Изобретение относится к области медицины, а именно к онкогинекологии, и может быть использовано для моделирования злокачественной опухоли тела матки в экспериментальной онкологии.
Интерес к проблеме опухолей тела матки связан с увеличением заболеваемости раком этой локализации. С 1970 по 1995гг. заболеваемость раком эндометрия увеличилась на 55%, занимая 1-ое место среди злокачественных опухолей женской половой сферы (Трапезников Н.Н., Аксель Е.М., 1999г.). По сводным данным FIGO, при лечении больных с уже установленным раком эндометрия только около 60% доживают до пятилетнего срока наблюдения, а не менее 30% умирают от рецидивов и метастазов (Бохман Я.В. и соавт., 1992г.). У 25% больных к моменту выявления опухоли имеются регионарные или отдаленные метастазы. Поэтому изучение особенностей метастазирования и реакции лимфатической системы при опухолях тела матки является актуальной задачей современной онкологии.
В литературе описаны модели опухолевого процесса тела матки, в основе которых лежит химический канцерогенез.
В исследованиях Чарквиани Л.И. (1964г.) крысам оперативным путем в маточные рожки вводились парафиновые палочки, содержащие 1 мг 9,10-диметил-1,2-бензантроцена. На 5-6 месяц после введения канцерогена в 98% случаев получали опухоли тела матки (цитируется по Багатурия Г.Д., 1978г.). Описанная выше модель обладает некоторыми недостатками.
В исследованиях Чарквиани Л.И. (цитируется по Багатурия Г.Д., 1978г.) использовалось локальное воздействие химического канцерогена. Известно, что перевиваемые опухоли животных являются более отдаленной моделью опухолей человека, чем спонтанные и индуцированные опухоли (Коноплев В.Н., 1960г.). С патогенетической точки зрения, в естественных условиях опухоли тела матки не развиваются под локальным воздействием химического канцерогена, кроме того, нельзя исключить реакцию регионарной лимфатической системы собственно на канцероген, что затрудняет оценку реакции лимфатического региона на локальный опухолевый процесс в матке. Обсуждаемая модель также длительна в воспроизведении и не позволяет контролировать время появления видимой опухоли, что затрудняет ее использование на практике. Результатом нашего исследования явилось создание модели опухоли тела матки для оценки реакции ее лимфатического региона на опухолевый процесс. Нами предлагается моделировать этот процесс путем введения злокачественной недифференцированной асцитной карциномы. За счет этого исключаются явления экзотоксикоза. Также появляется возможность контроля преимущественной локализации и скорости роста путем подбора места инъекции и количества опухолевых клеток. Преимуществом является скорость создания модели, а также возможность постановки массовых экспериментов. Кроме того, перевиваемые опухоли характеризуются относительным постоянством строения и биологических свойств (Караиванова М.Х.,1971г.; Васильева Г.С., 1982г.).
Предлагаемый способ моделирования опухоли тела матки состоит в следующем.
Непосредственно перед операцией подготавливают асцит. Мышь с асцитной карциномой Эрлиха умерщвляют под эфирным наркозом на 7 сутки роста опухоли. Переднюю брюшную стенку мыши обрабатывают антисептическим раствором. Производят рассечение кожи, подкожной клетчатки и мышц до слоя брюшины тупоконечными ножницами, предварительно заведя один конец под эти ткани через небольшой поперечный разрез кожи, который выполнен на 0,5-1 см выше лонного сочленения. Брюшину прокалывают инсулиновым шприцом. Потягиванием поршня шприца аспирируют асцит, предотвращая прилипание кишечника к игле путем уменьшения тяги за поршень и вращения шприца по продольной оси.
Аспирированный асцит в количестве 0,5 мл разводят в 5 мл 0,9% раствора NaCl в чашке Петри и тщательно перемешивают. Концентрацию клеток подсчитывают с помощью камеры Горяева по общепринятой методике. Концентрацию клеток доводят до 1,3-1,5•105 кл/мл разведением 0,9% раствором NaCl.
Белым беспородным мышам-самкам в условиях эфирного наркоза в асептических условиях (удаление шерсти и двукратная обработка дезинфицирующим раствором операционного поля) ножницами проводится лапаротомия. Длина разреза 1 см. Мочевой пузырь, как правило наполненный, выводится в рану и отклоняется кпереди. Осторожным потягиванием за дольки сальника в рану выводятся маточные рога. Правый маточный рог фиксируется мягким пинцетом. В стенку правого маточного рога с помощью инсулинового шприца вводят 0,05 мл полученного асцитного раствора. То есть в стенку маточного рога вводится асцитная карцинома Эрлиха в дозе 6,5-7,5•103 клеток. Концентрация клеток опухоли Эрлиха в 1 мл выведена опытным путем и должна считаться оптимальной, позволяя, с одной стороны, быть уверенным в том, что опухоль будет индуцирована на 7 сутки, а с другой, что это обеспечит необходимую продолжительность жизни экспериментальным животным. После этого рана трижды обрабатывается антисептическим раствором (фурациллин 1:5000). Матка с ее рогами, мочевой пузырь, доли сальника возвращаются в брюшную полость. Кетгутом 4/0 на атравматической игле тремя одиночными узловыми швами ушивается дефект брюшины. Таким же способом ушивается кожа, операционная рана обрабатывается 2% раствором Н2O2. Повязка на рану не накладывается в связи со сложностью ее фиксации и низким риском нагноения раны (выявлено на основании собственного опыта).
Наблюдение за развитием опухолевого процесса проводилось в течение 12 суток.
Через 7 суток с момента прививки макроскопически опухолевый узел определяется в области соединения тела и правого рога матки мышей, его размеры составляют 2•2,5 мм (фиг. 1).
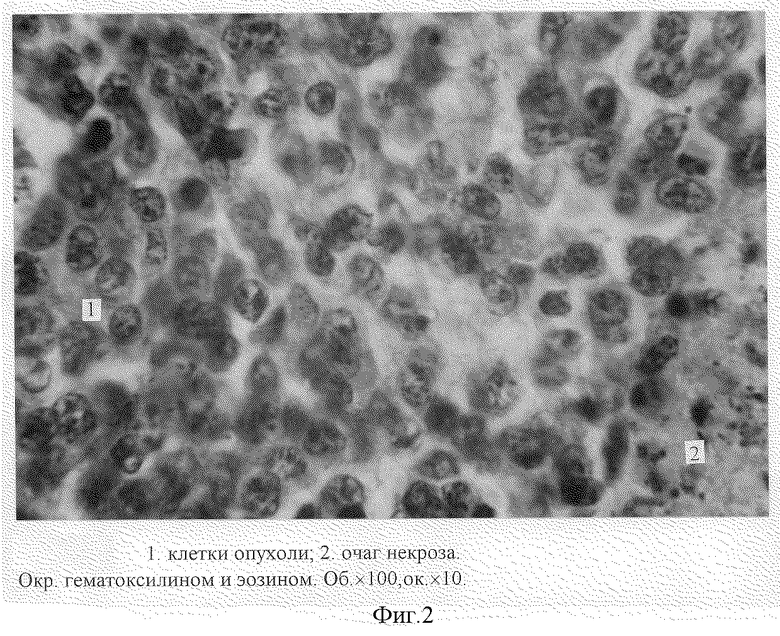
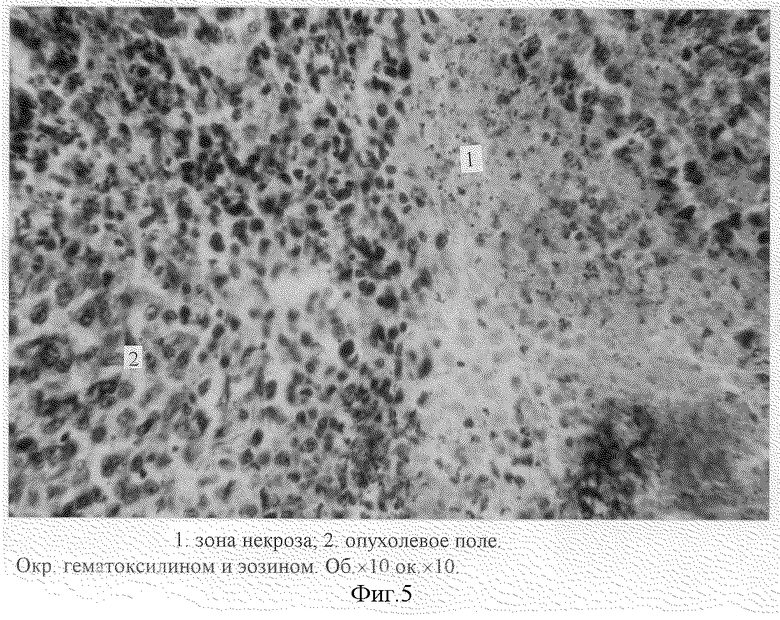
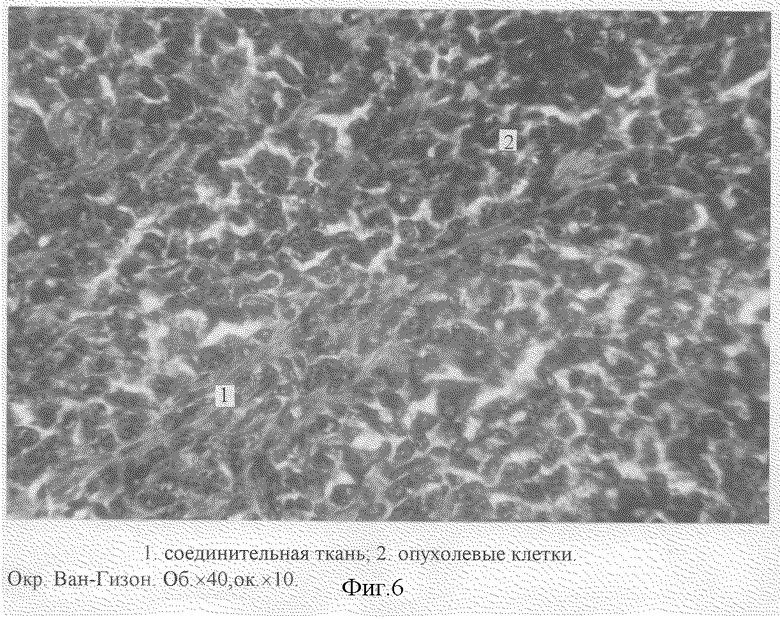
После умерщвления животных под эфирным наркозом по стандартной методике были изготовлены срединные продольные гистологические срезы с опухолевого узла, толщиной 5-7 мкм, окрашенные гематоксилин-эозином и по Ван-изон. Микроскопическое исследование гистологических препаратов опухоли (Об. 40•ок. 10, Об. 100•ок. 10) показало, что через 7 суток с момента прививки на ткань матки наблюдаются сплошные поля атипичных клеток опухоли (солидная форма), представляющие собой овальные клетки ("монотонность" опухолевых клеток) (фиг. 2). Клетки опухоли имеют крупные ядра с хорошо выраженными глыбками хроматина и малобазофильной цитоплазмой. Наблюдаются множественные митозы. Клеточный полиморфизм в опухолевой ткани нерезко выражен. В опухоли присутствует незначительное количество стромы (фиг. 6), центральные участки содержат очаги некроза (фиг. 5).
Через 12 суток с момента прививки макроскопически размеры опухоли составляют 5,0•5,0 мм, опухолевый узел занимает проксимальную часть правого рога матки и, зачастую, захватывает верхнюю 1/3 тела матки мышей.
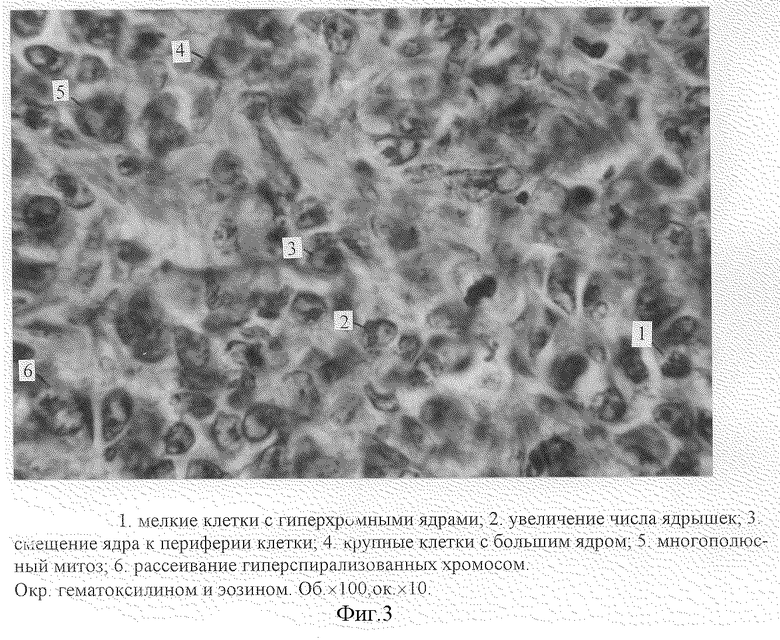
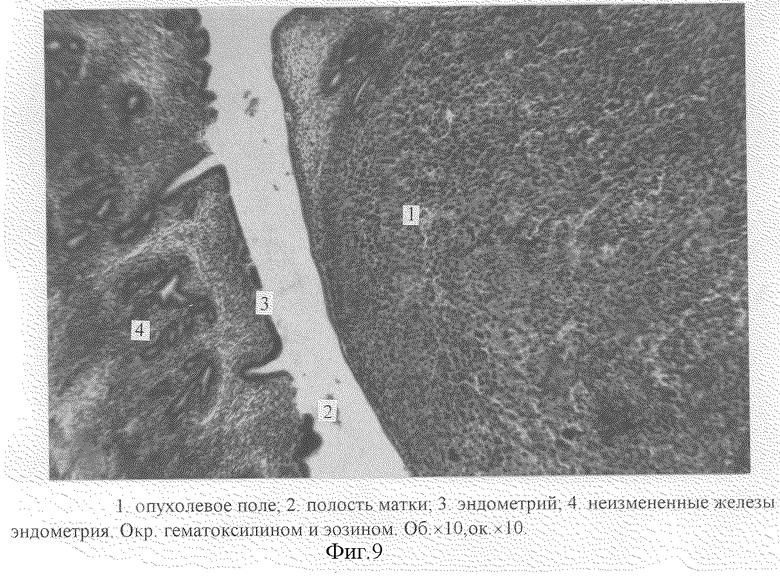
При микроскопическом исследовании гистологических срезов опухоли через 12 суток с момента прививки отмечается выраженный клеточный полиморфизм: мелкие клетки с гиперхромными ядрами (1. фиг. 3), увеличение числа ядрышек (2. фиг. 3), смещение ядра к периферии клетки (3. фиг. 2), крупные клетки с большим ядром (4. фиг. 4). Среди клеток опухоли встречаются клетки с патологическими митозами: многополюсный митоз (5. фиг. 3), рассеивание гиперспирализованных хромосом (6. фиг. 3). На фиг. 9 показано опухолевое поле на границе с полостью матки и неизменные железистые структуры на противоположной стороне полости.
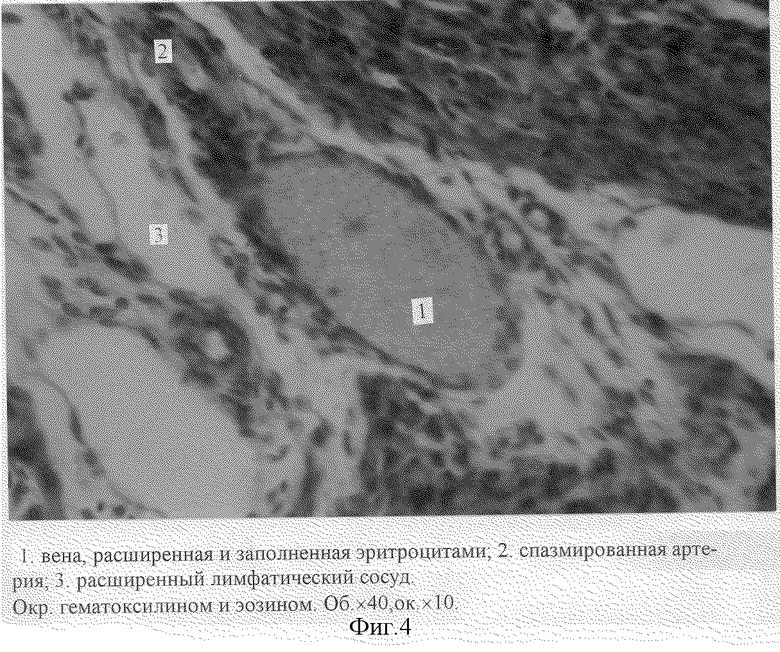
При микроскопическом исследовании гистологических препаратов опухоли по периферии опухолевого узла нами выявлены артерии различного калибра и дилятация вен матки, стаз крови. Обращает внимание резкое расширение лимфатических капилляров и сосудов (фиг. 4).
По стандартной методике (метод "полей") нами был произведен анализ ядерно-цитоплазматического и стромально-паренхиматозного соотношений в ткани опухоли. Для анализа клеток и тканей использовалась окулярная тест-система с 25 равноудаленными точками (Автандилов Г.Г., 1990г.).
Результаты исследований показали, что в динамике роста опухоли происходит увеличение ядерно-цитоплазматического и стромально-паренхиматозного соотношений. На 7 сутки ядерно-цитоплазматическое соотношение 1,380±0,02, на 12 сутки ядерно-цитоплазматическое соотношение 2,045±0,02, т.е. достоверно увеличивается на 67,48%; стромально-паренхиматозное соотношение на 7 сутки составляет 0,088±0,02, а на 12 сутки 0,181±0,02, т.е. достоверно увеличивается на 48,4%.
Полученные данные свидетельствуют о тенденции нарастания как клеточного, так и тканевого атипизма.
Через 14-15 суток с момента прививки макроскопически определяется распространение опухолевого процесса на левый маточный рог. Ткани стенки матки замещаются опухолевыми разрастаниями. Определяются множественные опухолевые узлы в рогах и теле матки (электронная фотография).
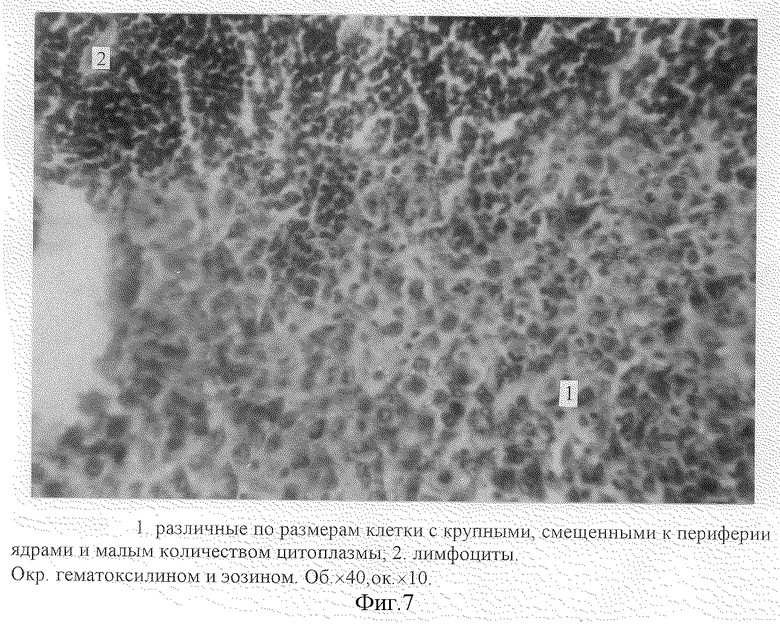
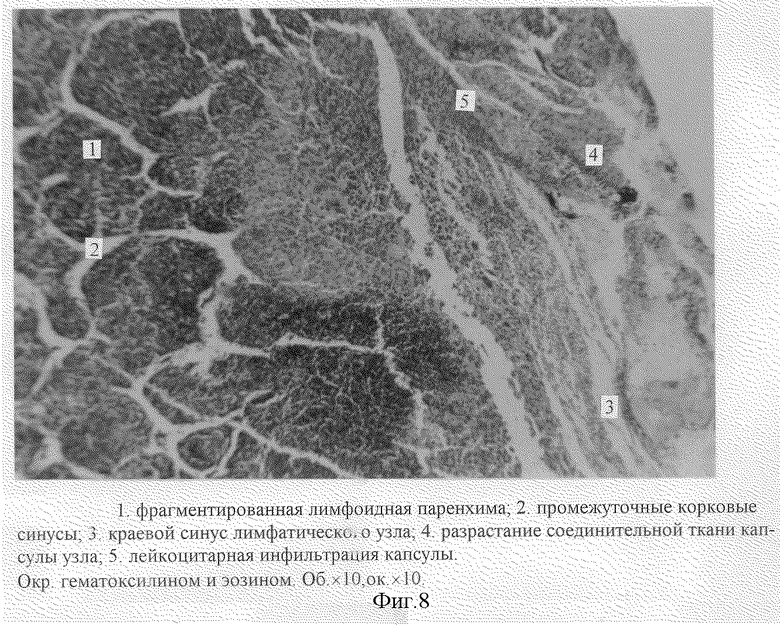
Помимо исследования опухолевого узла нами была изучена структурная организация регионарного лимфатического узла (правого подвздошного). Микроскопический анализ гистологических срезов лимфатического узла показал, что в 20% возможно появление метастаза, при этом структурная организация лимфоузла нарушается (изменяются корково-мозговое и паренхиматозно-стромальное соотношения). Через 12 суток при микроскопическом исследовании гистологических срезов регионарного лимфатического узла (правый подвздошный) выявлены скопления атипичных опухолевых клеток в корковом веществе лимфатического узла (различные по размерам клетки с крупными, смещенными к периферии ядрами и малым количеством цитоплазмы) (фиг. 7). По периферии опухолевого поля наблюдается некроз лимфоидной ткани паренхимы. Лимфоидная паренхима фрагментирована (1. фиг. 8), промежуточные корковые синусы расширены (2. фиг. 8). Краевой синус лимфатического узла увеличен в размерах (3. фиг. 8), отмечается разрастание соединительной ткани капсулы узла (4. фиг. 8) и ее лейкоцитарная инфильтрация (5. фиг. 8).
Анализ доступной литературы показал, что выявленные нами морфологические изменения в матке при прививке опухоли Эрлиха в количестве 6,5-7,5•103 клеток в большой степени соответствуют описанию солидного (недифференцированного) рака, описанного Бохманом Я.В. в 1972 г. (цитируется по Казаченко В.П. "Рак тела матки").
Литература
1. Багатурия Г.Д. "Лучевой патоморфоз индуцированного рака тела матки", Тбилиси, 1978 г.
2. Трапезников Н.Н., Аксель Е.М. "Злокачественные новообразования в России в 1997 г." (Статистический сборник), М., 1999 г.
3. Бохман Я. В. и соавт. "Гормонотерапия рака эндометрия". СПб.: "Гиппократ", 1992г.
4. Казаченко В.П. "Рак тела матки", М.: Медицина, 1983 г. с.114-117.
5. Хмельницкий О. П. "Патоморфологическая диагностика гинекологических заболеваний". СПб.: "Сотис", 1994г.
6. Струков А. И. , Серов В.В. "Патологическая анатомия", М.: Медицина, 1995 г.
7. Р.Зюсс, В.Кинцель, Дж.Д.Скрибнер "Рак: эксперименты и гипотезы", М.: "Мир", 1977 г.
8. Васильева Г.С. "Биология трансплантируемых опухолей". Алма-Ата, 1982 г.
9. Коноплев А.Е. Перевиваемые опухоли. В кн. "Модели и методы экспериментальной онкологии" - М., Медгиз, 1960. - С.144-237.
10. Караиванова М.Х. К методике первичного отбора противоопухолевых средств. // Вопросы онкологии. - 1971. - Т.17.-2. - С.62-66.
11. Автандилов Г.Г. "Медицинская морфометрия". - Москва, 1990. С.382.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ создания ортотопической модели рака эндометрия | 2024 |
|
RU2818464C1 |
| СПОСОБ МОДЕЛИРОВАНИЯ РАКА ЯИЧНИКА В ЭКСПЕРИМЕНТЕ У КРЫС | 2020 |
|
RU2743219C1 |
| Способ моделирования карциномы Герена в матке на фоне сахарного диабета | 2024 |
|
RU2833143C1 |
| СПОСОБ ПОЛУЧЕНИЯ МЕТАСТАЗОВ ПЕЧЕНИ В ЭКСПЕРИМЕНТЕ | 2013 |
|
RU2538243C1 |
| СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ ЗЛОКАЧЕСТВЕННЫХ АСЦИТНЫХ ОПУХОЛЕЙ | 2011 |
|
RU2464974C1 |
| Способ создания модели саркомы матки | 2024 |
|
RU2820404C1 |
| СПОСОБ ДИАГНОСТИКИ МЕТАСТАЗОВ В ЛИМФАТИЧЕСКИЕ УЗЛЫ МАЛОГО ТАЗА У БОЛЬНЫХ РЕЗЕКТАБЕЛЬНЫМ РАКОМ ШЕЙКИ МАТКИ | 2020 |
|
RU2750769C2 |
| Способ интраоперационной цитологической оценки статуса сигнального лимфатического узла у больных раком эндометрия 1 клинической стадии | 2023 |
|
RU2831695C1 |
| СПОСОБ ДИАГНОСТИКИ РАКА И ПОТЕНЦИАЛЬНОЙ УСТОЙЧИВОСТИ ЗЛОКАЧЕСТВЕННЫХ КЛЕТОК К ГИПОКСИИ | 2011 |
|
RU2463963C1 |
| СПОСОБ ДИФФЕРЕНЦИАЛЬНОЙ ДИАГНОСТИКИ ФИБРОАДЕНОМЫ И РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ | 1994 |
|
RU2092843C1 |
Изобретение относится к области медицины, а именно к онкогинекологии, и может быть использовано для моделирования злокачественной опухоли тела матки в экспериментальной онкологии. В маточный рог вводят индуктор опухолевого роста - асцитную карциному Эрлиха в дозе 6,5-7,5•103 клеток. Способ позволяет исключить явления экзотоксикоза, обеспечивает возможность контроля преимущественной локализации и скорости роста опухоли путем подбора места инъекции и количества опухолевых клеток. 9 ил.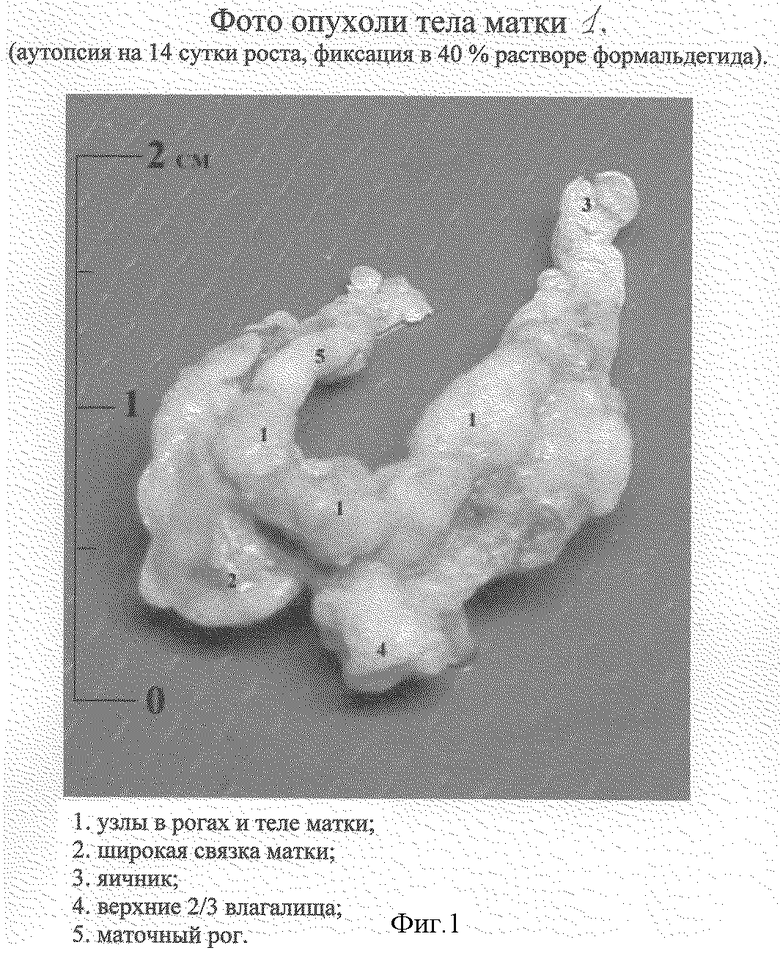
Способ моделирования опухоли тела матки, заключающийся во введении в маточный рог индуктора опухолевого роста, отличающийся тем, что в стенку маточного рога вводится асцитная карцинома Эрлиха в дозе 6,5-7,5·103 клеток.
| TESHIMA S | |||
| ET AL | |||
| Experimental yolk sac tumors in the rat // Hokkaido | |||
| Дверной замок, автоматически запирающийся на ригель, удерживаемый в крайних своих положениях помощью серии парных, симметрично расположенных цугальт | 1914 |
|
SU1979A1 |
| ncdi | |||
| nlm | |||
| nih | |||
| gov/entrez/query | |||
| fcgi? CMD, PubMed) | |||
| АСТАШОВ B.B | |||
| и др | |||
| Морфофункциональные изменения регионарных лимфатических узлов при моделировании опухолевого процесса | |||
| Проблемы экспериментальной, клинической и профилактической лимфологии | |||
| Материалы международного симпозиума | |||
| - Новосибирск, 2000, с.19-21 | |||
| СРЕДСТВО ДЛЯ РЕГУЛИРОВАНИЯ ЭНДОГЕННОЙ ПРОДУКЦИИ ЦИТОКИНОВ И ГЕМОПОЭТИЧЕСКИХ ФАКТОРОВ (ВАРИАНТЫ) И СПОСОБ ЕГО ИСПОЛЬЗОВАНИЯ | 1996 |
|
RU2153351C2 |
| ПРОТИВООПУХОЛЕВОЕ СРЕДСТВО | 1998 |
|
RU2145854C1 |
| Модели и методы экспериментальной онкологии | |||
| - М.: Медгиз, 1960, с.148-152. | |||
Авторы
Даты
2003-12-27—Публикация
2002-06-24—Подача