Предлагаемое изобретение относится к медицине и органической химии, а именно касается подавления опухолевого роста путем химиотерапии и применяющихся при этом химических соединений.
Новая стратегия в терапии опухолей предполагает использование оригинальных, нетрадиционных подходов. Одним из таких подходов является "бинарная" терапия опухолей, включающая два компонента, необходимых для получения терапевтического эффекта, каждый из которых в отдельности не проявляет антибластомного действия. К такому виду лечения относится фотодинамическая терапия, сочетающая применение фотосенсибилизатора с местным лазерным облучением. Данный метод противоопухолевой терапии основан на образовании при взаимодействии фотосенсибилизатора с лазерным излучением активных форм кислорода (АФК) и других свободнорадикальных частиц различного химического строения, которые и являются цитотоксическими агентами. Этот метод лечения проходит клиническую апробацию во всем мире [Чиссов В.И., Соколов В.В., Филоненко Е. В. и др. РОЖ, 1998, N 4, с. 4-12; Ma L.W., Moan J., Grahn M.F., Iani V. Proc SPIE, 1996, v. 2924, p. 219-223; Raymond Bonnett. Chemical Society Reviews, 1995, v. 24, p. 19-33].
Недостатком данного метода лечения злокачественных новообразований является необходимость активации фотосенсибилизатора светом для достижения клинического эффекта, что существенно ограничивает использование данного метода, не позволяя применять ФДТ для лечения глубоко распространенных злокачественных новообразований.
В ходе клинического изучения также были выявлены нежелательные фармакологические эффекты фотосенсибилизаторов. Это увеличение фоточувствительности кожи, которая проявляется в поражении эпителия и ее соединительно-тканного слоя (коллагенозы, склеротические изменения) и обусловлена тем, что препарат длительное время сохраняется в коже и в условиях естественной освещенности может переходить в активное состояние. Возможно также поражение конъюнктивы и сетчатки глаза.
Другим примером "бинарной" терапии может служить применение каталитической системы, состоящей из металлокомплекса Co или Fe с замещенными фталоцианинами и биогенного восстановителя [Патент РФ 2106146, Борисенкова С.А., Гиренко Е.Г., Калия О.Л. Российский химический журнал, том XXLII, N 5, 1998; Вольпин М.Е., Крайнева Н.Ю., Левитин И.Я и др. Российский химический журнал, том XXLII, N 5, 1998; Сыркин А.Б., Жукова О.С., Кикоть С.Б. и др. Российский химический журнал, том XXLII, N 5, 1998]. Этот вид "бинарной" терапии, в отличие от ФДТ, получил название "темновой" или каталитической терапии злокачественных новообразований. На сегодня выявлен комплекс - натриевая соль - окта - 4,5- карбоксифталоцианина кобальта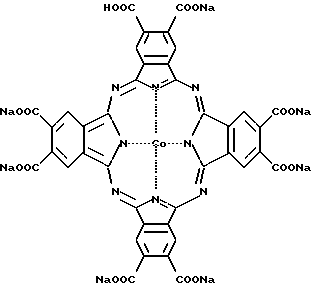
являющийся наиболее активным из всех испытанных комплексов Co и Fe с замещенными фталоцианинами, который в сочетании с биогенным восстановителем - аскорбиновой кислотой (АК) оказывает противоопухолевое действие. Этот металлокомплекс кобальта получил название "Терафтал" (ТФ) и испытывается в настоящее время в качестве лекарственного средства для лечения злокачественных новообразований в составе бинарной каталитической системы. Бинарная каталитическая система "ТФ + АК" оказывает выраженное противоопухолевое действие in vitro и in vivo [Сыркин А.Б., Жукова О.С., Кикоть С.Б. и др. Российский химический журнал, том XXLII, N 5, 1998].
Задачей предлагаемого изобретения было создание новых металлокомплексов кобальта с замещенными фталоцианинами, которые в сочетании с аскорбиновой кислотой оказывают выраженное противоопухолевое действие, эффективно уничтожая опухолевые клетки.
Для решения этой задачи были синтезированы эфиры окта-4,5-карбоновой кислоты фталоцианина кобальта формулы 1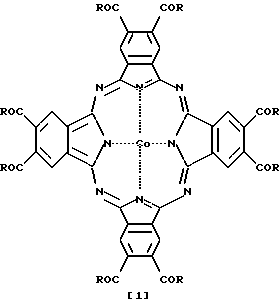
где R - CH3О[CH2CH2O]n или HO[CH2CH2O]n;
n = 3-7.
Синтез этих эфиров осуществляется путем взаимодействия окта-4,5-карбоксифталоцианина кобальта Co с метилполиэтиленгликолем или с тетраэтиленгликолем.
Для дальнейшего создания новых соединений, способных быть использованными для подавления опухолевого роста, были синтезированы комплексы включения эфиров формулы 1 (ЭТФ или ТЭТФ) с пропиленгликолевым эфиром β-циклодекстрина (ЦДОП), именуемые в дальнейшем (ЭТФ-К или ТЭТФ-К).
Эти комплексы включения получают растворением эфиров формулы 1 в воде, фильтрованием, добавлением к фильтрату ЦДОП, размешиванием, отгонкой воды и последующим высушиванием остатка.
Известен способ подавления опухолевого роста с использованием соли окта-4,5-карбоксифталоцианина Co и аскорбиновой кислоты [патент РФ 2106146]. Этот способ позволяет добиться ингибирования пролиферации опухолевых клеток человека in vitro, а также торможения роста опухоли и увеличения средней продолжительности жизни животных с перевивными злокачественными опухолями in vivo.
Задачей предлагаемого изобретения являлась разработка такого способа подавления опухолевого роста, который бы обеспечил более стойкое биологически значимое торможение опухоли и значительное увеличение средней продолжительности жизни животных с перевивными злокачественными опухолями. Для решения этой задачи был предложен способ подавления опухолевого роста с использованием комплекса кобальта с замещенными фталоцианинами и аскорбиновой кислоты, в котором в качестве комплекса используют вышеописанные соединения формулы 1 или их комплексы включения с пропиленгликолевым эфиром β-циклодекстрина.
Противоопухолевую эффективность предлагаемого способа оценивали как in vitro, так и in vivo. Методики оценки противоопухолевой эффективности приводятся ниже.
Методика 1.
Цитотоксическую активность in vitro оценивали по ингибированию роста опухолевых клеток в культуре. Использовали клетки эпидермоидной карциномы гортаноглотки человека (культура клеток Hep-2).
Клетки культивировали на среде Игла-МЕМ с добавлением 2 мМ L-глутамина и 8% эмбриональной телячьей сыворотки, при 37oC в увлажненной атмосфере, содержащей 5% диоксида углерода.
Клетки рассеивали в лунки 96-луночного микропланшета по 100 мкл в концентрации 70-80 тыс.кл./мл. Для оценки эффективности цитотоксического воздействия каталитической пары через 24 ч (к началу фазы логарифмического роста) в лунки вносили серийные разведения исследуемых эфиров и аскорбиновой кислоты.
В качестве препаратов сравнения использовали традиционный цитостатический препарат "Платидиам".
Через 24 ч инкубации клеток с препаратами оценивали число жизнеспособных клеток колориметрическим методом, используя МТТ-тест [Mossmann T.R. Rapid colorimetric for cellular growth and survival: application to proliferation and cytotoxity assays/ Journal of immunological methods, 65, 1983, p. 55-63] .
Уровень ингибирования роста культуры вычисляли по формуле:
ИР (%)=[(Пк-По)/Пк]•100%,
где ИР - ингибирование роста культуры, в процентах;
По и Пк - число жизнеспособных клеток, выраженное в единицах оптической плотности, соответственно, в опытных (с препаратами) и контрольных (без препаратов) пробах.
Биологически значимым эффектом считали ингибирование роста культуры на 50%.
Цитотоксическую активность in vitro исследуемых препаратов рассчитывали с использованием интегрального показателя цитотоксической активности ИК50, представляющего собой концентрацию цитотоксического агента, при которой наблюдается ингибирование роста культуры на 50%.
Методика 2.
Противоопухолевую активность in vivo оценивали на мышах с перевивными злокачественными опухолями. Использовали следующие перевивные злокачественные опухоли мышей - асцитную карциному Эрлиха (АКЭ), аденокарциному молочной железы Ca-755 (Ca- 755) и лимфоцитарную лейкемию P-388 (солидный вариант опухоли).
АКЭ прививали беспородным белым мышам самкам интраперитонеально по 0,1 мл асцитной жидкости, взятой у мыши донора на 7 день роста опухоли и разведенной 1:1 0,9% раствором хлорида натрия.
Ca-755 прививали мышам самкам линии C57В1/6 подкожно по 60 мг опухолевой ткани в 0,3 мл среды 199, взятой у мыши донора на 10 - 12 день роста опухоли.
P-388 прививали мышам гибридам F1 самкам подкожно по 0,1 мл асцитной жидкости, взятой у мыши донора на 7 день роста опухоли и разведенной 1:100, 9% раствором хлорида натрия.
Лечение животных с АКЭ и P-338 начинали через 24 - 48 ч, а животных с Ca-755 через 48 - 72 ч после инокуляции опухоли.
Контрольным животным с перевивными злокачественными опухолями вводили placebo (0,9% раствор хлорида натрия).
В качестве препарата сравнения использовали традиционный цитостатический препарат "Платидиам" (цисдихлордиаминоплатина, ДДП).
Дозы и режимы введения исследуемых препаратов подробно изложены в приводимых примерах.
Противоопухолевый эффект оценивали по средней продолжительности жизни (СПЖ), увеличению продолжительности жизни (УПЖ), вычисленному по формуле:
УПЖ-[(СПЖопыт - СПЖконтроль)/ СПЖконтроль]•100%
и торможению роста опухоли, вычисленному по формуле:
ТРО=[(РОконтроль-РОопыт)/РОконтроль]•100%.
Значимым биологическим эффектом считали увеличение продолжительности жизни животных на 25% и торможение роста опухоли на 50%. [Экспериментальная оценка противоопухолевых препаратов в СССР и США / под редакцией З.П.Софьиной, А.Б.Сыркина, А.Голдина, А.Кляйна, М., "Медицина", 1980].
Предлагаемое изобретение иллюстрируется нижеприведенными примерами.
Пример 1.
Синтез метилполиэтиленгликолевого эфира.
В автоклав загружают 280 г высушенного над оксидом алюминия и перегнанного метилкарбитола и 0,4 г эфирата трехфтористого бора, нагревают до температуры 100oC и постепенно добавляют 410 г окиси этилена. Затем автоклав охлаждают до комнатной температуры и реакционную смесь выгружают. Получают 630 г продукта, имеющего показатель преломления 1,4519 и плотность 1,076, представляющего собой смесь полимергомологов.
Синтез метилполиэтиленгликолевого эфира окта-4,5-карбоновой кислоты фталоцианина кобальта (ЭТФ). В колбу вместимостью 50 мл, снабженную мешалкой, термометром и насадкой Дина-Старка, помещают 3,8 г окта-4,5-карбокси фталоцианина кобальта, 16,6 г метилполиэтиленгликоля и 0,07 г ортофосфорной кислоты. Реакционную массу нагревают при перемешивании до температуры 160 -165oC, затем отбирают пробу и проверяют растворимость ее в воде. При положительном результате испытания пробы реакционную массу переносят в стакан, добавляют 200 мл толуола и перемешивают. Образующееся масло отделяют от раствора декантацией и промывают небольшим количеством гексана. Остаток растворяют в воде, раствор фильтруют, отгоняют воду и сушат в вакууме. Получают 7,9 г ЭТФ, представляющего собой вязкую однородную массу темно-синего цвета, медленно растворяющуюся в воде.
ИК спектр: νc=o 1710 см-1.
Электронный спектр (фосфорный буфер pH 7,4): полоса 1 - λ 325±2 нм, полоса 2 - λ 667±2 нм.
Пример 2.
В условиях примера 1 из 3,5 г окта-4,5-карбоксифталоцианина кобальта и 16,0 г метилполиэтиленгликолевого эфира с т. кип. 160 - 200oC/3-5 мм рт. ст. получают 7,1 г ЭТФ.
ИК спектр: νc=o 1710 см-1.
Электронный спектр (фосфорный буфер pH 7,4): полоса 1 - λ 325±2 нм, полоса 2 - λ 667±2 нм.
Пример 3.
В условиях примера 1 из 3,8 г окта-4,5-карбоксифталоцианина кобальта и 16,0 г тетраэтиленгликоля получают 6,3 г тетраэтиленгликолевого эфира окта-4,5-карбоксифталоцианина кобальта (ТЭТФ).
ИК спектр: νc=o 1710 см-1.
Электронный спектр (фосфорный буфер pH 7,4): полоса 1 - λ 325±2 нм, полоса 2 - λ 668±2 нм.
Пример 4.
Синтез комплекса включения ЭТФ с пропиленгликолевым эфиром β-циклодекстрина (ЦДОП)* - субстанции ЭТФ-К.
Субстанцию ЭТФ из примера 1 в количестве 7,9 г растворяют в подогретой до 50-60oC дистилированной воде, водный раствор фильтруют, отделяя не растворившийся осадок. К фильтрату добавляют 31,6 г ЦДОП и размешивают при температуре 60-70oC, затем воду отгоняют на роторе, остаток высушивают до постоянного веса в сушильном шкафу. Получают 37,8 г комплекса ЭТФ-К, представляющего собой синий кристаллический порошок, хорошо растворимый в воде. Выход 95,8%.
ИК спектр: νc=o 1710 см-1.
Электронный спектр (фосфорный буфер pH 7,4): полоса 1 - λ 326±2 нм, полоса 2 -  670±2 нм.
670±2 нм.
* - ЦДОП синтезирован в соответствии со способом, описанным в патенте США N 3459731.
Пример 5.
В условиях примера 4 из 7,1 г субстанции ЭТФ из примера 2 и 28,4 г ЦДОП получают 34,81 г комплекса ЭТФ-К.
ИК спектр: νc=o 1710 см-1.
Электронный спектр (фосфорный буфер pH 7,4): полоса 1 - λ 326±2 нм, полоса 2 - λ 670±2 нм.
Пример 6.
В условиях примера 4 из 6,3 г субстанции ТЭТФ из примера 3 и 25,2 г ЦДОП получают 29,5 г комплекса ТЭТФ-К.
ИК спектр: νc=o 1710 см-1
Электронный спектр (фосфорный буфер pH 7,4): полоса 1 - λ 326±2 нм, полоса 2 - λ 672±2 нм.
Пример 7.
Цитотоксическая активность различных субстанций эфира октакарбоксифталоцианина кобальта (СЭТФ) (ЭТФ, ЭТФ-К и ТЭТФ-К), взятых как индивидуально, так и в сочетании с аскорбиновой кислотой, в сравнении с цитотоксической активностью препарата "Платидиам" и бинарной каталитической системы "ТФ + АК" в отношении клеток эпидермоидной карциномы гортаноглотки человека (культура клеток Hep-2).
СЭТФ в культуральную среду вносили в концентрациях от 10 • 10-5 М до 3 • 10-6 М, а препарат "Платидиам" - от 2 •10-5 М до 2,6•10-6 М.
Аскорбиновую кислоту вносили в культуральную среду после СЭТФ с интервалом от 0 до 5 мин в концентрациях от 1•10-3 М до 6•10-4 М, используя молярное соотношение СЭТФ:АК - 1:20.
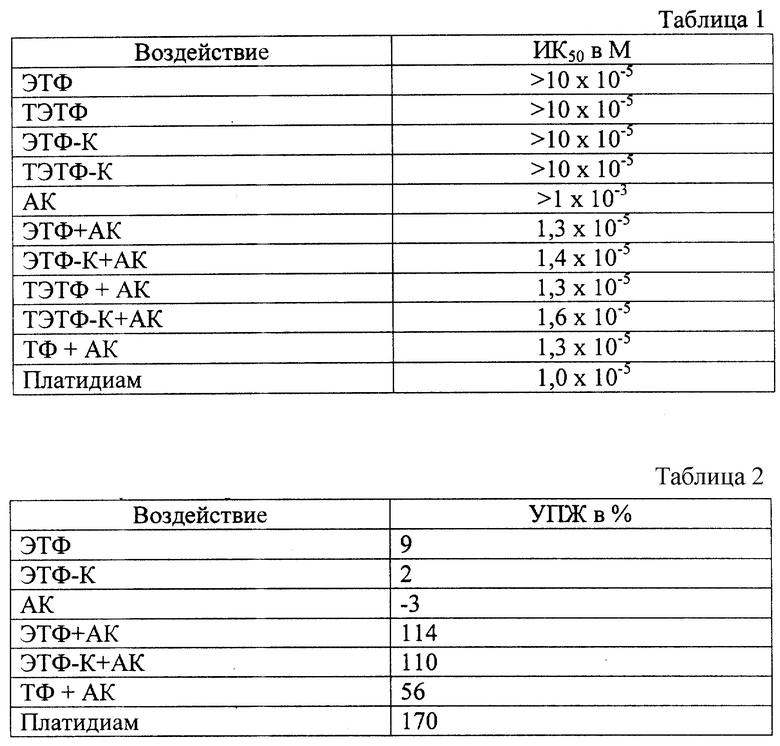
Результаты представлены в таблице 1.
Как видно из данных, представленных в таблице 1, индивидуально СЭТФ и аскорбиновая кислота не оказывают какого-либо цитотоксического действия, а бинарные каталитические системы "ЭТФ + АК", "ЭТФ-К+АК", "ТЭТФ + АК" и "ТЭТФ-К+АК" эффективно уничтожают опухолевые клетки. Цитотоксическая активность вышеуказанных бинарных каталитических систем сопоставима с таковой для традиционного противоопухолевого препарата "Платидиам" и бинарной каталитической системы "ТФ+АК" (табл.1).
Пример 8.
Влияние различных СЭТФ (ЭТФ, ЭТФ-К), взятых как индивидуально, так и в сочетании с аскорбиновой кислотой, препарата "Платидиам" и бинарной каталитической системы "ТФ+АК" на увеличение средней продолжительности жизни мышей с асцитной карциномой Эрлиха.
СЭТФ вводили однократно, внутрибрюшинно в дозе (по активному веществу) 250 мг/кг. Аскорбиновую кислоту вводили внутрибрюшинно сразу после введения СЭТФ в дозе 443 мг/кг (молярное соотношение субстанция:АК - 1:30). Бинарную каталитическую систему вводили по следующей схеме: ТФ (40 мг/кг), 1 ч + АК (88 мг/кг), молярное соотношение ТФ:АК -1:10.
Результаты представлены в таблице 2.
Как видно из данных, представленных в таблице 2, индивидуально ЭТФ, ЭТФ-К и АК не оказывают какого-либо влияния на среднюю продолжительность жизни мышей-опухоленосителей. Бинарные каталитические системы "ЭТФ+АК" и "ЭТФ-К+АК" оказывают противоопухолевое действие, выраженное в снижении темпов накопления опухолевого асцита и биологически значимом увеличении средней продолжительности жизни (УПЖ составило 110 - 114). Применение бинарной каталитической системы "ТФ+АК" приводит к увеличению средней продолжительности жизни мышей с АКЭ на 42%.
Пример N 9.
Влияние различных СЭТФ (ЭТФ и ЭТФ-К), взятых как индивидуально, так и в сочетании с аскорбиновой кислотой, препарата "Платидиам" и бинарной каталитической системы "ТФ+АК" на динамику роста опухоли у мышей с аденокарциномой молочной железы Ca-755.
СЭТФ вводили однократно, внутрибрюшинно в дозе (по активному веществу) 250 мг/кг. Аскорбиновую кислоту вводили внутрибрюшинно через 1 ч после введения СЭТФ в дозе 443 мг/кг (молярное соотношение субстанция:АК - 1:30). Бинарную каталитическую систему вводили по следующей схеме: ТФ (40 мг/кг), 1 ч + АК (88 мг/кг), молярное соотношение ТФ:АК - 1:10.
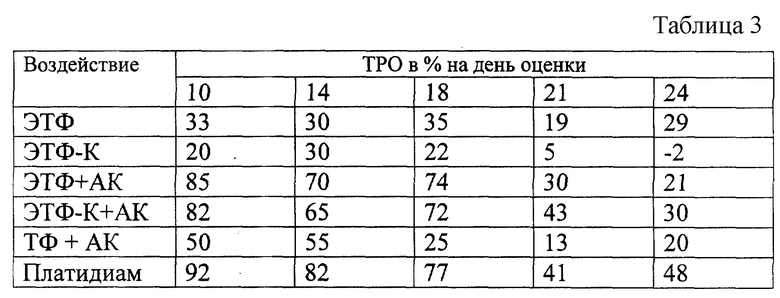
Результаты представлены в таблице 3.
Как видно из данных, представленных в таблице 3, индивидуально ЭТФ, ЭТФ-К не оказывают какого-либо влияния как на динамику роста опухоли, так и на выживаемость мышей- опухоленосителей.
Применение бинарных каталитических систем "ЭТФ+АК" и "ЭТФ-К+АК" приводит к стойкому (в течение 18 дней) биологически значимому торможению роста опухоли, где ТРО на 10 день составило 82-85%, а на 18 день - 72-74%. В то же время внутривенное введение бинарной каталитической системы "ТФ+АК" животным с Ca-755 приводит к торможению роста опухоли лишь на 55% (минимальный биологически значимый противоопухолевый эффект).
Пример N 10.
Влияние различных СЭТФ (ЭТФ и ЭТФ-К), взятых как индивидуально, так и в сочетании с аскорбиновой кислотой, препарата "Платидиам" и бинарной каталитической системы "ТФ+АК" на динамику роста опухоли у мышей с лимфоцитарной лейкемией Р-388.
СЭТФ вводили однократно, внутрибрюшинно в дозе (по активному веществу) 250 мг/кг. Аскорбиновую кислоту вводили внутрибрюшинно через 1 ч после введения СЭТФ в дозе 443 мг/кг (молярное соотношение субстанция:АК - 1:30). Бинарную каталитическую систему вводили по следующей схеме: ТФ (40 мг/кг), 1 ч + АК (88 мг/кг), молярное соотношение ТФ:АК - 1:10.
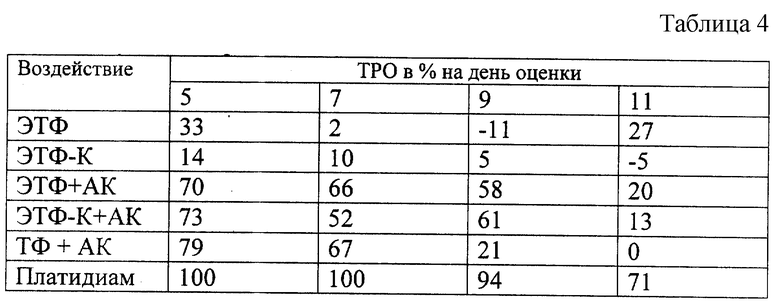
Результаты представлены в таблице 4.
Как видно из данных, представленных в таблице 4, индивидуально ЭТФ, ЭТФ-К не оказывают какого-либо влияния как на динамику роста опухоли, так и на выживаемость мышей- опухоленосителей.
Применение бинарных каталитических систем "ЭТФ+АК" и "ЭТФ-К+АК" приводит к стойкому (в течение 9 дней) биологически значимому торможению роста опухоли, где ТРО на 5 день составило 70-73%, а на 9 день - 58-61%. Внутривенное введение бинарной каталитической системы "ТФ+АК" животным с солидной формой лейкоза Р-388 приводит к биологически значимому торможению роста опухоли, наблюдаемому в течение 7 дней, где ТРО на 7 день роста опухоли составило 67%.
Таким образом, заявленные эфиры и их комплексы включения с пропиленгликолевым эфиром β-циклодекстрина в сочетании с аскорбиновой кислотой оказывают выраженное цитотоксическое действие в отношении опухолевых клеток человека (культура клеток Hep-2) in vitro, сопоставимое с таковым как для бинарной каталитической системы на основе аналога препарата "Терафтал", так и для традиционного противоопухолевого препарата "Платидиам", а в системе in vivo у животных с перевивными злокачественными опухолями различного генеза обеспечивают значительное стойкое торможение роста опухоли и увеличение средней продолжительности жизни животных- опухоленосителей.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОДАВЛЕНИЯ РОСТА ОПУХОЛЕЙ | 2007 |
|
RU2376999C2 |
| СПОСОБ ПОДАВЛЕНИЯ ОПУХОЛЕВОГО РОСТА | 2003 |
|
RU2255742C2 |
| СПОСОБ ПОДАВЛЕНИЯ ОПУХОЛЕВОГО РОСТА | 2012 |
|
RU2491930C1 |
| СРЕДСТВО ДЛЯ ПОДАВЛЕНИЯ ОПУХОЛЕВОГО РОСТА | 1995 |
|
RU2106146C1 |
| СПОСОБ СОЧЕТАННОГО КОНСЕРВАТИВНОГО ВОЗДЕЙСТВИЯ НА ЗЛОКАЧЕСТВЕННЫЕ ОПУХОЛИ | 2008 |
|
RU2392935C1 |
| СПОСОБ ЛЕЧЕНИЯ СПОНТАННЫХ ОПУХОЛЕЙ ДОМАШНИХ ЖИВОТНЫХ И УСТРОЙСТВО ДЛЯ ЛЕЧЕНИЯ | 2010 |
|
RU2454231C2 |
| СПОСОБ ПОДАВЛЕНИЯ ОПУХОЛЕВОГО РОСТА | 1996 |
|
RU2114623C1 |
| Способ получения наночастиц полистирольных ионообменников для доставки противоопухолевых препаратов | 2016 |
|
RU2635865C1 |
| СПОСОБ ПОДАВЛЕНИЯ ОПУХОЛЕВОГО РОСТА | 1999 |
|
RU2188054C2 |
| ОКТА-4,5-КАРБОКСИФТАЛОЦИАНИНЫ КАК ФОТОСЕНСИБИЛИЗАТОРЫ ДЛЯ ФОТОДИНАМИЧЕСКОЙ ТЕРАПИИ | 2000 |
|
RU2193563C2 |
Изобретение относится к органической химии, а также к медицине, а именно касается веществ, используемых в сочетании с аскорбиновой кислотой для терапии злокачественных новообразований (бинарная каталитическая "темновая" терапия злокачественных новообразований) и способа подавления опухолевого роста. Описываются эфиры окта-4,5-карбокси фталоцианина кобальта общей формулы I, где R-CH3O[CH2CH2O]n или HO[CH2CH2O]n, n = 3 - 7, а также их комплексы включения с пропиленгликолевым эфиром β-циклодекстрина, и способ подавления опухолевого роста с использованием этих соединений и биогенного восстановителя аскорбиновой кислоты. Применение предложенных соединений обеспечивает стойкое биологически значимое торможение роста опухоли и значительное увеличение средней продолжительности жизни мышей с перевивными злокачественными опухолями различного генеза. 3 с.п. ф-лы, 4 табл. 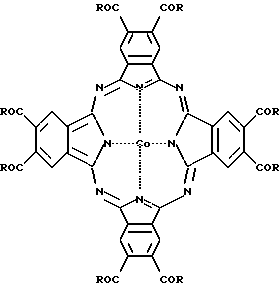
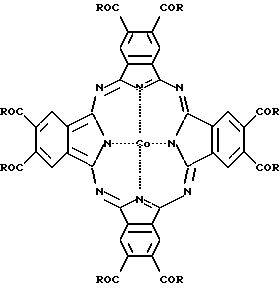
где R-CH3O[CH2CH2O]n или HO[CH2CH2O]n;
n = 3-7.
| Сыркин А.Б., Жукова О.С | |||
| и др | |||
| Терафтал-новый препарат для бинарной каталитической терапии злокачественных опухолей | |||
| - Российский химический журнал, т | |||
| XLII, N 5, с.140, 1998 | |||
| СРЕДСТВО ДЛЯ ПОДАВЛЕНИЯ ОПУХОЛЕВОГО РОСТА | 1995 |
|
RU2106146C1 |
| МЕТАЛЛОКОМПЛЕКСЫ ДИГАЛОГЕН-ДИ(ТРЕТ-БУТИЛ)-ЗАМЕЩЕННЫХ ФТАЛОЦИАНИНОВ | 1993 |
|
RU2093515C1 |
| ДИ(1,4-ДИТИАЦИКЛОГЕКСЕН)-ДИ(ТРЕТ.-БУТИЛБЕНЗО)ПОРФИРАЗИН И ЕГО МЕТАЛЛОКОМПЛЕКСЫ | 1994 |
|
RU2122547C1 |
| Бесколесный шариковый ход для железнодорожных вагонов | 1917 |
|
SU97A1 |
| Пожарный двухцилиндровый насос | 0 |
|
SU90A1 |
| Генератор задающих импульсов и пилообразного напряжения | 1973 |
|
SU496641A1 |
| Устройство защиты преобразователя с искусственной коммутацией от перенапряжений | 1975 |
|
SU536563A1 |
Авторы
Даты
2001-08-20—Публикация
2000-04-26—Подача