Область техники
Настоящее изобретение относится к микробиологической промышленности и, в частности, к способу получения гидроксилированных L-аминокислот с использованием бактерии, содержащей ДНК, кодирующую бактериальную диоксигеназу. Более конкретно и в частности, настоящее изобретение относится к способу получения гидроксилированного L-лейцина.
Описание предшествующего уровня техники
Гидроксилированные аминокислоты могут иметь большое практическое значение. Так, 4-гидроксиизолейцин проявляет инсулинотропную активность, что вызывает большой интерес, поскольку его стимулирующий эффект явно зависит от концентрации глюкозы в окружающей среде. Данный эффект был показан как на модели изолированных перфузионных поджелудочных желез крыс, так и в кусочках ткани поджелудочных желез человека (Sauvaire, Y. et al. Diabetes, 47:206-210, (1998)). Такая зависимость инсулинотропного эффекта от концентрации глюкозы не подтверждается в случае с сульфонилмочевиной (Drucker, D. J., Diabetes 47:159-169, (1998)), единственным инсулинотропным препаратом, используемым в настоящее время для лечения диабета типа II [не инсулинзависимого диабета (NIDD) или (NIDDM)], и, как следствие, гипогликемия остается основным нежелательным побочным эффектом лечения сульфонилмочевиной (Jackson, J., and Bessler, R. Drugs, 22:211-245; 295-320, (1981); Jennings, A. et al. Diabetes Care, 12:203-208, (1989)). Способы повышения толерантности организма к глюкозе известны (Am. J. Physiol. Endocrinol., Vol.287, E463-E471, 2004). Эта способность 4-гидроксиизолейцина ускорять метаболизм глюкозы и потенциальная возможность его применения в качестве лекарственного средства и компонента функционального питания были раскрыты в выложенной патентной заявке Японии No. Hei 6-157302 и в патентной заявке США US2007-000463A1.
4-гидрокси-L-изолейцин обнаружен до настоящего времени только в растениях и благодаря своему частичному инсулинотропному действию может рассматриваться как новое средство, усиливающее секрецию инсулина, с возможным применением для лечения диабета II типа, заболевания, характеризующегося нарушением секреции инсулина, связанным с развитием инсулиновой резистентности различной степени тяжести (Broca, С. et al., Am. J. Physiol. 277 (Endocrinol. Metab. 40): E617-E623, (1999)).
Метод окисления изолейцина кислородом воздуха в присутствии железа, аскорбиновой кислоты, α-кетоглутаровой кислоты и кислородзависимого изолейцина с использованием диоксигеназной активности экстракта пажитника греческого был предложен в качестве способа получения 4-гидрокси-L-изолейцина (Phytochemistry, Vol.44, No. 4, p.563-566, 1997). Однако этот способ не пригоден для промышленного получения 4-гидроксиизолейцина, так как активность фермента ингибируется субстратом при концентрациях изолейцина от 20 мМ и выше, к тому же фермент до сих пор не идентифицирован, его получают из экстрактов растений в небольших количествах, и он нестабилен.
К настоящему времени описан эффективный восьмистадийный способ синтеза оптически чистого (2S,3R,4S)-4-гидроксиизолейцина с общим выходом 39%. Ключевая стадия этого синтеза включает в себя биотрансформацию этил-2-метилацетоацетата в этил-(2S,3S)-2-метил-3-гидроксибутаноат с использованием Geotrichum candidum и асимметрического синтеза Штрекера (Wang, Q. et al., Eur. J. Org. Chem., 834-839 (2002)).
Также описан короткий шестистадийный ферментохимический способ синтеза (2S,3R,4S)-4-гидроксиизолейцина с общим контролем стереохимии, последней стадией которого является ферментативное разложение путем гидролиза производного N-фенилацетиллактона с использованием коммерчески доступной пенициллинацилазы G, иммобилизованной на Eupergit C(E-PAC) (Rolland-Fulcrand, V. et al., J. Org. Chem., 873-877 (2004)).
Однако в настоящее время отсутствуют сообщения о получении гидроксилированных L-аминокислот путем ферментативной конверсии исходных, негидроксилированных L-аминокислот с использованием диоксигеназы. В частности, в настоящее время нет данных, описывающих способы получения гидроксилированного L-лейцина из L-лейцина с помощью бактериальной диоксигеназы. Также, нет данных, сообщающих о получении гидроксилированных L-аминокислот, в частности гидроксилированного L-лейцина, с использованием бактерии, содержащей ДНК, кодирующую бактериальную диоксигеназу.
Описание изобретения
Целью настоящего изобретения является предоставление способа получения гидроксилированных L-аминокислот методом ферментативной конверсии L-аминокислот с использованием диоксигеназы. В частности, целью настоящего изобретения является предоставление способа получения гидроксилированного L-лейцина методом ферментативной конверсии L-лейцина в присутствии диоксигеназы, выделенной из бактерии.
Вышеуказанная цель была достигнута благодаря обнаружению того факта, что бактериальные диоксигеназы могут участвовать в образовании гидроксилированных L-аминокислот. В частности, диоксигеназы, например, из Bacillus, Gloeobacter, Gluconobacter, Methylobacillus и Nostoc могут участвовать в гидроксилировании L-лейцина с образованием его гидроксилированного производного.
Целью настоящего изобретения является предоставление способа получения гидроксилированной L-аминокислоты или ее соли, в частности гидроксилированного L-лейцина или его соли, методом ферментативной конверсии с использованием диоксигеназы, выделенной из бактерии, принадлежащей к группе, включающей роды Bacillus, Gloeobacter, Gluconobacter, Methylobacillus и Nostoc.
Также целью настоящего изобретения является предоставление описанного выше способа, отличающегося тем, что указанная диоксигеназа выбрана из группы, состоящей из диоксигеназ с аминокислотной последовательностью SEQ ID NO:6, SEQ ID NO:8, SEQ ID NO:22, SEQ ID NO:54, SEQ ID NO:62 или их вариантов
Также целью настоящего изобретения является предоставление способа получения гидроксилированного L-лейцина или его соли в среде в присутствии первой бактерии, обладающей активностью диоксигеназы, выделенной из второй бактерии, принадлежащей к группе, включающей роды Bacillus, Gloeobacter, Gluconobacter, Methylobacillus и Nostoc.
Также целью настоящего изобретения является предоставление описанного выше способа, отличающегося тем, что первая бактерия, обладающая активностью бактериальной диоксигеназы, выбрана из группы бактерий, включающей роды Agrobacterium, Anabaena, Bacillus, Bordetella, Burkholderia, Escherichia, Gloeobacter, Gluconobacter, Mesorhizobium, Methylobacillus, Nostoc, Pantoea, Photorhabdus, Pseudomonas, Psychromonas и Streptomyces.
Также целью настоящего изобретения является предоставление описанного выше способа, отличающегося тем, что первая бактерия, обладающая активностью бактериальной диоксигеназы, модифицирована таким образом, что активность бактериальной диоксигеназы повышена.
Также целью настоящего изобретения является предоставление описанного выше способа, отличающегося тем, что активность бактериальной диоксигеназы повышена путем усиления экспрессии гена, кодирующего бактериальную диоксигеназу.
Также целью настоящего изобретения является предоставление описанного выше способа, отличающегося тем, что экспрессия гена, кодирующего бактериальную диоксигеназу, усилена путем трансформации первой бактерии молекулой ДНК, кодирующей бактериальную диоксигеназу, способную конвертировать L-лейцин в гидроксилированный L-лейцин.
Также целью настоящего изобретения является предоставление описанного выше способа, отличающегося тем, что указанная бактериальная диоксигеназа выбрана из группы, состоящей из бактериальных диоксигеназ с аминокислотной последовательностью SEQ ID NO:6, SEQ ID NO:8, SEQ ID NO:22, SEQ ID NO:54, SEQ ID NO:62 или их вариантов.
Также целью настоящего изобретения является предоставление описанного выше способа, отличающегося тем, что указанная среда содержит L-лейцин или его соли.
Также целью настоящего изобретения является предоставление бактерии-продуцента гидроксилированного L-лейцина или его соли, трансформированной молекулой ДНК, кодирующей бактериальную диоксигеназу, способной конвертировать L-лейцин в гидроксилированный L-лейцин.
Также целью настоящего изобретения является предоставление описанной выше бактерии-продуцента, отличающейся тем, что указанная бактерия принадлежит к группе, включающей роды Agrobacterium, Anabaena, Bacillus, Bordetella, Burkholderia, Escherichia, Gloeobacter, Gluconobacter, Mesorhizobium, Methylobacillus, Nostoc, Pantoea, Photorhabdus, Pseudomonas, Psychromonas и Streptomyces.
Также целью настоящего изобретения является предоставление описанной выше бактерии-продуцента, отличающейся тем, что указанная бактериальная диоксигеназа выделена из другой бактерии, принадлежащей к группе, включающей роды Bacillus, Gloeobacter, Gluconobacter, Methylobacillus и Nostoc.
Также целью настоящего изобретения является предоставление описанной выше бактерии-продуцента, отличающейся тем, что указанная бактериальная диоксигеназа, кодируемая трансформирующей молекулой ДНК, выбрана из группы, состоящей из бактериальных диоксигеназ с аминокислотной последовательностью SEQ ID NO:6, SEQ ID NO:8, SEQ ID NO:22, SEQ ID NO:54, SEQ ID NO:62 или их вариантов.
Настоящее изобретение детально описано ниже.
КРАТКОЕ ОПИСАНИЕ РИСУНКОВ
На Фигуре 1 показаны результаты определения соединений Х (4'-HIL) и Y (4',4-DHIL). А, В, С - HPLC-анализ аминокислотного профиля в полученных культурах штаммов MG1655[pMW119], MG1655[pETAC-HilA-HilB] и MG1655[pETAC-HilA] соответственно. D - ТСХ анализ аминокислотного профиля в полученных культурах штаммов MG1655[pMW119] (2), MG1655[pETAC-HilA-HilB] (3) и MG1655 [рЕТАС-HilA] (4) соответственно. Дорожки 1 и 2 - стандарт Ile. S1, S2 - "системные" пики.
На Фигуре 2 показаны биосинтез и очистка соединения Х (4'-HIL).
На Фигуре 3 показаны биосинтез и очистка 4',4-DHIL.
На Фигуре 4 показан каскад гидроксилирования изолейцина, катализируемый HilA и HilB.
На Фигуре 5 показана очистка HilA и his6-tag-HilB. A - SDS-PAGE белковых фракций, полученных в процессе очистки: 1 - маркер молекулярной массы, 2 - неочищенный лизат клеток штамма MG1655[pETAC-HilA], 3 - несвязавшаяся с колонкой DEAE фракция, 4 - стадия осаждения аммонием, 5 - активная фракция, элюированная с SEC-колонки. В - SDS-PAGE полученного препарата his6-tag-HilB. Дорожки: 1 - белковый маркер с известными молекулярными массами; препарат белка 2, 3 - his6-tag-HilB (20 мкг и 40 мкг соответственно).
На Фигуре 6 показаны результаты определения субстратной специфичности his6-tag-HilB. Дорожки А1, А6, В1 и В6 - стандарты 4'-HIL, Ile, Met и Leu соответственно; А2, А7, В2 и В7 - полные реакционные смеси, содержащие 4'-HIL, Ile, Met и Leu соответственно. Реакционные смеси, содержащие все компоненты кроме Fe2+ (A3, А8, В3, В8), L-аскорбата (А4, А9, В4, В9) и α-кетоглутарата (А5, А10, В5, В10) соответственно.
На Фигуре 7 показаны результаты выравнивания по гомологии с 4-IDO Bacillus subtilis. Сокращения: mor-DO-B - гипотетический белок РЕ36_03361 из Moritella sp. PE36 [gi|149908332]; mme-DO-B - гипотетический белок GOS_1822161 [метагеном морских организмов, gi|142909932]; plu-DO-B - гипотетический белок plu1881 из Photorhabdus luminescens subsp. laumondu TT01 [gi|37525805]; sat-DO-B - консервативный гипотетический белок из Streptomyces atroolivaceus [gi|26541515]; sfr-DO-B - гипотетический белок из Streptomyces fradiae [gi|85813592]; gvi-DO-B - гипотетический белок gh-2602 из Gloeobacter violaceus PCC 7421 [gi|37522171]; avi-DO-B -гипотетический белок из Agrobacterium vitis [gi|110671820]; bpe-DO-B - гипотетический белок Bpet1371 из Bordetella petrii DSM 12804 [gi|163855678]; cvi-DO-B - гипотетический белок CV_3308 из Chromobacterium violaceum ATCC 12472 [gi|34498763]; vvu-DO-B - гипотетический белок VV2_1380 из Vibrio vulnificus CMCP6 [gi|27367746]; mfl-DO-B - гипотетический белок Mfla_2629 из Methylobacillus flagellatus KT [gi|91776977]; gau-DO-B - консервативный гипотетический белок из Caulobacter sp. K31 [gi|167645207]; gbe-DO-B - гипотетический белок GbCGDNIH1_2096 из Granulibacter bethesdensis [gi|114328760]; swi-DO-B - гипотетический белок Swit_3525 из Sphingomonas wittichii RW1 [gi|148556427]; gdi-DO-B - гипотетический белок GDI0791 из Gluconacetobacter diazotrophicus PA1 [gi|162146613]; gox-DO-B - гипотетический белок GOX1674 из Gluconobacter oxydans 621H [gi|58040106]; msi-DO-B - консервативный гипотетический белок из Methylocella silvestris [gi|172066227]. Консервативные остатки выделены синим цветом, идентичные - желтым цветом.
На Фигуре 8 показаны результаты выравнивания членов семейства диоксигеназ HilA. Сокращения: mlr-DO-А - гипотетический белок mlr5944 из Mesorhizobium loti MAFF303099 (GI:13474949); mlo-DO-А - гипотетический белок из Mesorhizobium loti (GI:20804088); plu-DO-A - гипотетический белок plu0160 из Photorhabdus luminescens subsp. laumondii TTO1 (GI:37524182); psyHilA - гипотетический белок PSPPH_3987 из Pseudomonas syringae (GI:20804088); paaHilA - белок HilA из Pantoea ananatis SC17; mme-DO-A - гипотетический белок GOS_9268270 из метагенома морских организмов (GI:135403471); bce-DO-A - предполагаемый сигнальный белок трансдукции из Bacillus cereus subsp. cytotoxis NVH 391-98 (GI:152974310); bha-DO-A - гипотетический белок ВН2933 из Bacillus halodurans C-125 (GI:15615495); ava-DO-A - гипотетический белок Ava_1614 из Anabaena variabilis ATCC 29413 (GI:75907836); ssc-DO-A - гипотетический белок SS1G_11624 из Sclerotinia sclerotiorum 1980 (GI:156042147); mgr-DO-A - гипотетический белок MGG_11067 из Magnaporthe grisea 70-15 (GI:39977483); met-DO-A - гипотетический белок GOS_9492232 из метагенома морских организмов (GI:135192580); pfl-DO-A - гипотетический белок PFL_1388 из Pseudomonas fluorescens Pf-5 (GI:70728768); bur-DO-A - предполагаемая пролил-4-диоксигеназа, α-субъединица из Burkholderia sp. (GI:78060434); bpe-DO-A - гипотетический белок Bpet1341 из Bordetella petrii DSM 12804 (GI:163855648); psh-DO-A - гипотетический белок PCNPT3_00501 из Psychromonas sp. CNPT3 (GI:90407605). Консервативные остатки выделены синим, идентичные - желтым.
На Фигуре 9 показана структура плазмид pSlo и рЕТ, содержащих синтезированный ген диоксигеназы (н-р HT-avi-DO-B).
На Фигуре 10 показаны результаты определения активности HT-bpe-DO-A. Белок гидроксилировал метионин (дорожки 1-5) и изолейцин (дорожки 6-10). Дорожки 3 и 8 - контрольные реакции без Fe2+. Реакции 1, 2 и 6, 7 проводили в HEPES буфере, а реакции 4, 5 и 9, 10 в 50 мМ Трис буфере рН 8. Каждую реакцию дублировали.
На Фигуре 11 показана новая треонин-4-диоксигеназная активность диоксигеназы из штамма Bordetella petrii DSM 12804. А. Новая треонин-4-диоксигеназная активность диоксигеназы из штамма Bordetella petrii DSM 12804. В. Результаты ТСХ-анализа реакционной смеси, содержащей 100 мМ Hepes pH7, 5 мМ треонина, 5 мМ α-кетоглутарата, очищенный HT-bpe-DO-B и 5 мМ Fe2+ (дорожка 1). В качестве контрольной реакции использовали ту же смесь без Fe2+.
На Фигуре 12 показаны результаты исследования субстратной специфичности gvi-DO-B в отношении некоторых аминокислот, включая Leu и Met. Полные реакционные смеси обозначены как «+». Контрольные реакционные смеси (без Fe2+) обозначены «-». Гидроксилированные лейцин и метионин обведены окружностью красного цвета.
На Фигуре 13 показана структура плазмиды pELAC-HT-mfl-DO-B.
На Фигуре 14 показана структура плазмиды pELAC-IDO(Lys, 23).
На Фигуре 15 показана схема биотрансформации Ile→4',4-DHIL.
На Фигуре 16 показаны результаты, касающиеся процесса биотрансформации Ile→4',4-DHIL. TCX проводили с использованием щелочного (А) и кислотного (В) проявителя. Дорожки: А1, А4, А7, В1, В2, В7 и В10 - начальные реакционные смеси, содержащие 100 мМ Ile; А2(В2), А3(В3) и А5(В5), А6(В6) - продублированные реакционные смеси А и С после 16 ч культивирования соответственно (в качестве ссылки см. Фиг.1); А8(В8), А9(В9) и А10(В11), А11(В12) - дублированные реакционные смеси В и D после 16 ч культивирования соответственно.
На Фигуре 17 показаны результаты очистки 4',4-DHIL с использованием DOWEX 50 W-X2. Показаны элюированные фракции (2-13), стандартные растворы глутамата (Glu) и стандартная смесь глутамата и 4-HIL (mix).
На Фигуре 18 показаны результаты частичной очистки hLeu. A - Хроматография 1, фракции 10-12 были объединены; В, С - Хроматография 2, фракции 10-14 были объединены. Старт - наносимый препарат.
На Фигуре 19 показаны результаты очистки hVal. Старт - культуральная жидкость после процесса биотрансформации; 1-6 - хроматографические фракции.
На Фигуре 20 показаны результаты очистки метионинсульфоксида. Старт - культуральная жидкость после биотрансформации; 1-12 - хроматографические фракции.
На Фигуре 21 показаны результаты, касающиеся гидроксилирования треонина с использованием неочищенного лизата клеток BL21(DE3)[pET-HT-bpe-DO-B]. Проявитель - ацетон:изопропанол:аммиак:H2O=25:25:6:4. Дорожки: 1(6), 2(7), 3(8), 4(9), 5(10) - реакции, содержащие 10 мМ, 20 мМ, 50 мМ, 70 мМ, 100 мМ Thr соответственно. (Для уравнивания количества применяемых аминокислот реакционные смеси разводили водой в 2 (20 мМ), 5 (50 мМ), 7 (70 мМ), 10 (100 мМ) раз.)
На Фигуре 22 показаны результаты очистки hThr, фракции 9-14 были объединены.
На Фигуре 23 показана стандартная ВЭЖХ-хроматограмма рацемической смеси L-метионинсульфоксида, подвергнутого дериватизации реагентом Marfey.
На Фигуре 24 показаны результаты ВЭЖХ продуктов реакции с использованием IDO после обработки реагентом Marfey.
НАИЛУЧШИЙ СПОСОБ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
1. Диоксигеназа настоящего изобретения.
Термин "диоксигеназы", как он употребляется в настоящем описании, относится к группе ферментов, катализирующих включение молекулы кислорода в состав молекулы органического субстрата. Диоксигеназы согласно настоящему изобретению имеют α-кетоглутарат-зависимую и Fe2+-зависимую активность. Термин "α-кетоглутарат-зависимая активность", как он употребляется в настоящем описании, относится к ферментативной активности катализа реакции, сопряженной с образованием сукцината из α-кетоглутарата. Термин "Fe2+-зависимая активность" означает, что каталитический центр фермента содержит ион Fe2+. Более конкретно, диоксигеназа согласно настоящему изобретению содержит в каталитическом центре ион Fe2+ и катализирует включение одного атома кислорода в молекулу субстрата, конкретно в молекулу L-аминокислоты, сопряженное с образованием сукцината из α-кетоглутарата с использованием другого атома кислорода.
Термин "гидроксилированная L-аминокислота", как он употребляется в настоящем описании, относится к L-аминокислоте, содержащей дополнительно одну гидроксильную группу или более как результат гидроксилирования с участием диоксигеназы. Согласно настоящему изобретению гидроксилированной L-аминокислотой может быть гидроксилированная L-аминокислота, однако предпочтительней гидроксилированный изолейцин, гидроксилированный метионин, гидроксилированный треонин, гидроксилированный лейцин или гидроксилированный валин. Например, изолейцин в результате реакции гидроксилирования может быть трансформирован в 4-гидроксиизолейцин, 4'-гидроксиизолейцин, 3-гидроксиизолейцин, 5-гидроксиизолейцин, 4,4'-дигидроксиизолейцин, 3,4-дигидроксиизолейцин и т.д.; валин может быть трансформирован в 3-гидроксивалин, 4-гидроксивалин, 4'-гидроксивалин, 3,4-дигидроксивалин или 3,4'-дигидроксивалин; треонин может быть трансформирован в 4-гидрокситреонин; лейцин может быть трансформирован в 3-гидроксилейцин, 4-гидроксилейцин, 5-гидроксилейцин, 5'- гидроксилейцин, 3,4-дигидроксиизолейцин, 5,5'-дигидроксиизолейцин и т.д.; метионин может быть трансформирован в 3-гидроксиметионин, 2-амино-4-(метилсульфокси)масляную кислоту.
Авторы настоящего изобретения обнаружили процесс каскадного гидроксилирования изолейцина с участием оксигеназ HilA и HilB. HilA катализирует трансформацию Ile (2S, 3R) в 4'-HIL (2S, 3R), а HilB катализирует трансформацию 4'-HIL (2S, 3R) в 4',4-DHIL (2S, 3R, 4S) и 4',4-DHIL (2S, 3R, 4R) (Фиг.4). Авторы настоящего изобретения клонировали, экспрессировали как his6-tag производные и очистили предполагаемые диоксигеназы из: Pantoea ananatis (HT-paa-HilA и HT-paa-HilB), Methylobacillus flagellatus KT (HT-mfl-DO-B), Gluconobacter oxydans 621H (HT-gox-DO-B), Agrobacterium vitis (HT-avi-DO-B); Bordetella petrii DSM 12804 (HT-bpe-DO-A и HT-bpe-DO-B); Streptomyces fradiae (HT-sfr-DO-В); метагеном морских организмов (НТ-mme-DO-B); Photorhabdus luminescens subsp. laumondu TTO1 (HT-plu-DO-B); Gloeobacter violaceus PCC7421 (HT-gvi-DO-B); Psychromonas sp. CNPT3 (HT-psh-DO-A); Mesorhizobium loti (HT-mlo-DO-A); Anabaena variabilis ATCC 29413 (HT-ava-DO-A); Burkholderia sp. (HT-bur-DO-A). Сконструирована библиотека из 15 диоксигеназ, принадлежащих к семействам HilA и HilB диоксигеназ.
ДНК, кодирующая диоксигеназу HT-paa-HilA (из Pantoea ananatis), представлена в Перечне последовательностей под номером SEQ ID No:1. Кроме того, аминокислотная последовательность HT-paa-HilA, кодируемой нуклеотидной последовательностью SEQ ID NO:1, представлена в Перечне последовательностей под номером SEQ ID No:2.
ДНК, кодирующая диоксигеназу HT-paa-HilB (из Pantoea ananatis), представлена в Перечне последовательностей под номером SEQ ID No:3. Кроме того, аминокислотная последовательность HT-paa-HilB, кодируемой нуклеотидной последовательностью SEQ ID NO:3, представлена в Перечне последовательностей под номером SEQ ID No:4.
ДНК, кодирующая диоксигеназу KT HT-mfl-DO-B (из Methylobacillus flagellatus), представлена в Перечне последовательностей под номером SEQ ID No:5. Кроме того, аминокислотная последовательность KT HT-mfl-DO-B, кодируемой нуклеотидной последовательностью SEQ ID NO:5, представлена в Перечне последовательностей под номером SEQ ID No:6.
ДНК, кодирующая диоксигеназу HT-gox-DO-B (из Gluconobacter oxydans 621H), представлена в Перечне последовательностей под номером SEQ ID No:7. Кроме того, аминокислотная последовательность HT-gox-DO-B, кодируемой нуклеотидной последовательностью SEQ ID NO:7, представлена в Перечне последовательностей под номером SEQ ID No:8.
ДНК, кодирующая диоксигеназу HT-avi-DO-B (из Agrobacterium vitis), представлена в Перечне последовательностей под номером SEQ ID No:9. Кроме того, аминокислотная последовательность HT-avi-DO-B, кодируемой нуклеотидной последовательностью SEQ ID NO:9, представлена в Перечне последовательностей под номером SEQ ID No:10.
ДНК, кодирующая диоксигеназу HT-bpe-DO-A (из Bordetella petrii DSM 12804), представлена в Перечне последовательностей под номером SEQ ID No:11. Кроме того, аминокислотная последовательность HT-bpe-DO-A, кодируемой нуклеотидной последовательностью SEQ ID NO:11, представлена в Перечне последовательностей под номером SEQ ID No:12.
ДНК, кодирующая диоксигеназу HT-bpe-DO-B (из Bordetella petrii DSM 12804), представлена в Перечне последовательностей под номером SEQ ID No:13. Кроме того, аминокислотная последовательность HT-bpe-DO-B, кодируемой нуклеотидной последовательностью SEQ ID NO:12, представлена в Перечне последовательностей под номером SEQ ID No:14.
ДНК, кодирующая диоксигеназу HT-sfr-DO-B (из Streptomyces fradiae), представлена в Перечне последовательностей под номером SEQ ID No:15. Кроме того, аминокислотная последовательность HT-sfr-DO-B, кодируемой нуклеотидной последовательностью SEQ ID NO:15, представлена в Перечне последовательностей под номером SEQ ID No:16.
ДНК, кодирующая диоксигеназу HT-mme-DO-B (из метагенома морских организмов), представлена в Перечне последовательностей под номером SEQ ID No:17. Кроме того, аминокислотная последовательность HT-mme-DO-B, кодируемой нуклеотидной последовательностью SEQ ID NO:17, представлена в Перечне последовательностей под номером SEQ ID No:18.
ДНК, кодирующая диоксигеназу HT-plu-DO-B (из Photorhabdus luminescens subsp. laumondii TT01), представлена в Перечне последовательностей под номером SEQ ID No:19. Кроме того, аминокислотная последовательность HT-plu-DO-B, кодируемой нуклеотидной последовательностью SEQ ID NO:19, представлена в Перечне последовательностей под номером SEQ ID No:20.
ДНК, кодирующая диоксигеназу T-gvi-DO-B (из Gloeobacter violaceus PCC7421), представлена в Перечне последовательностей под номером SEQ ID No:21. Кроме того, аминокислотная последовательность T-gvi-DO-B, кодируемой нуклеотидной последовательностью SEQ ID NO:21, представлена в Перечне последовательностей под номером SEQ ID No:22.
ДНК, кодирующая диоксигеназу HT-psh-DO-A (из Psychromonas sp. CNPT3), представлена в Перечне последовательностей под номером SEQ ID No:23. Кроме того, аминокислотная последовательность HT-psh-DO-A, кодируемой нуклеотидной последовательностью SEQ ID NO:23, представлена в Перечне последовательностей под номером SEQ ID No:24.
ДНК, кодирующая диоксигеназу HT-mlo-DO-A (из Mesorhizobium loti), представлена в Перечне последовательностей под номером SEQ ID No:25. Кроме того, аминокислотная последовательность HT-mlo-DO-A, кодируемой нуклеотидной последовательностью SEQ ID NO:25, представлена в Перечне последовательностей под номером SEQ ID No:26.
ДНК, кодирующая диоксигеназу T-ava-DO-A (из Anabaena variabilis ATCC 29413), представлена в Перечне последовательностей под номером SEQ ID No:27. Кроме того, аминокислотная последовательность T-ava-DO-A, кодируемой нуклеотидной последовательностью SEQ ID NO:27, представлена в Перечне последовательностей под номером SEQ ID No:28.
ДНК, кодирующая диоксигеназу HT-bur-DO-A (из Burkholderia sp.), представлена в Перечне последовательностей под номером SEQ ID No:29. Кроме того, аминокислотная последовательность HT-bur-DO-A, кодируемой нуклеотидной последовательностью SEQ ID NO:29, представлена в Перечне последовательностей под номером SEQ ID No:30.
ДНК, кодирующая диоксигеназу Ido (из Bacillus thuringiensis 2e2), представлена в Перечне последовательностей под номером SEQ ID No:53. Кроме того, аминокислотная последовательность Ido, кодируемой нуклеотидной последовательностью SEQ ID NO:53, представлена в Перечне последовательностей под номером SEQ ID No:54.
ДНК, кодирующая диоксигеназу Dox1 (из Pseudomonas syringae pv. phaseolicola 1448A), представлена в Перечне последовательностей под номером SEQ ID No:55. Кроме того, аминокислотная последовательность Dox1, кодируемой нуклеотидной последовательностью SEQ ID NO:55, представлена в Перечне последовательностей под номером SEQ ID No:56.
ДНК, кодирующая диоксигеназу Dox2 (из Pseudomonas syringae pv. phaseolicola 1448A), представлена в Перечне последовательностей под номером SEQ ID No:57. Кроме того, аминокислотная последовательность Dox2, кодируемой нуклеотидной последовательностью SEQ ID NO:57, представлена в Перечне последовательностей под номером SEQ ID No:58.
ДНК, кодирующая диоксигеназу Dox (из Burkholderia phytofirmans PsJN), представлена в Перечне последовательностей под номером SEQ ID No:59. Кроме того, аминокислотная последовательность Dox, кодируемой нуклеотидной последовательностью SEQ ID NO:59, представлена в Перечне последовательностей под номером SEQ ID No:60.
ДНК, кодирующая диоксигеназу Dox (из Nostoc punctiforme PCC 73102), представлена в Перечне последовательностей под номером SEQ ID No:61. Кроме того, аминокислотная последовательность Dox, кодируемой нуклеотидной последовательностью SEQ ID NO:61, представлена в Перечне последовательностей под номером SEQ ID No:62.
ДНК, кодирующая диоксигеназу Dox (из Burkholderia ambifaria AMMD), представлена в Перечне последовательностей под номером SEQ ID No:63. Кроме того, аминокислотная последовательность Dox, кодируемой нуклеотидной последовательностью SEQ ID NO:63, представлена в Перечне последовательностей под номером SEQ ID No:64.
ДНК, кодирующая диоксигеназу, принадлежащую к семейству диоксигеназ HilA или HilB, - не только ДНК, представленная в Перечне последовательностей под номером SEQ ID No:1, SEQ ID No:3, SEQ ID No:5, SEQ ID No:7, SEQ ID No:9, SEQ ID No:11, SEQ ID No:13, SEQ ID No:15, SEQ ID No:17, SEQ ID No:19, SEQ ID No:21, SEQ ID No:23, SEQ ID No:25, SEQ ID No:27, SEQ ID No:29, SEQ ID No:53, SEQ ID No:55, SEQ ID No:57, SEQ ID No:59, SEQ ID No:61 или SEQ ID No:63. Это связано с тем, что у представителей различных родов или штаммов бактерий, образующих диоксигеназы, принадлежащие к семейству диоксигеназ HilA или HilB, возможны некоторые вариации в нуклеотидных последовательностях.
ДНК согласно настоящему изобретению включает в себя не только выделенную из бактерии ДНК, кодирующую диоксигеназу, принадлежащую к семейству диоксигеназ HilA или HilB, но также и ДНК, кодирующую диоксигеназу, принадлежащую к семейству диоксигеназ HilA или HilB, в которую были искусственно введены мутации. Эта ДНК может быть выделена из хромосомы микроорганизма, синтезирующего диоксигеназу, принадлежащую к семейству диоксигеназ НПА или НПВ. ДНК настоящего изобретения должна кодировать диоксигеназу, способную катализировать реакцию гидроксилирования аминокислоты. Способы искусственного введения мутаций включают типичные способы введения сайт-специфических мутаций, описанные в Method, in Enzymol., 154 (1987).
ДНК согласно настоящему изобретению также включает в себя ДНК, гибридизующуюся в жестких условиях с ДНК, нуклеотидная последовательность которой комплементарна нуклеотидной последовательности SEQ ID No:1, SEQ ID No:3, SEQ ID No:5, SEQ ID No:7, SEQ ID No:9, SEQ ID No:11, SEQ ID No:13, SEQ ID No:15, SEQ ID No:17, SEQ ID No:19, SEQ ID No:21, SEQ ID No:23, SEQ ID No:25, SEQ ID No:27, SEQ ID No:29, SEQ ID No:53, SEQ ID No:55, SEQ ID No:57, SEQ ID No:59, SEQ ID No:61 или SEQ ID No:63, и кодирующую диоксигеназу, способную катализировать реакцию гидроксилирования аминокислоты. «Жесткие условия» включают такие условия, при которых специфические гибриды образуются, а неспецифические гибриды не образуются.
Хотя трудно точно численно выразить эти условия, в качестве примера, условия, при которых молекулы ДНК, имеющие более высокую гомологию, например предпочтительно не менее 70%, более предпочтительно не менее 80%, еще более предпочтительно не менее 90% и наиболее предпочтительно не менее 95%, гибридизуются, а молекулы ДНК, имеющие более низкую гомологию, не гибридизуются друг с другом, или такие условия, при которых гибридизация имеет место в типичных условиях отмывки, соответствующих методике гибридизации по Саузерну, таких как концентрация солей 0.1×SSC и 0.1% SDS при 37°С, предпочтительно 0.1×SSC и 0.1% SDS при 60°С и более предпочтительно 0.1×SSC и 0.1% SDS при 65°С. Длина зонда может быть выбрана в зависимости от условий гибридизации, обычно она варьирует от 100 до 1000 п.н. Кроме того, "активность диоксигеназы L-аминокислоты" может быть описана как активность, осуществляющая синтез гидроксилированной L-аминокислоты из L-аминокислоты. Однако, когда нуклеотидная последовательность гибридизуется в жестких условиях с ДНК, нуклеотидная последовательность которой комплементарна нуклеотидной последовательности SEQ ID No:1, SEQ ID No:3, SEQ ID No:5, SEQ ID No:7, SEQ ID No:9, SEQ ID No:11, SEQ ID No:13, SEQ ID No:15, SEQ ID No:17, SEQ ID No:19, SEQ ID No:21, SEQ ID No:23, SEQ ID No:25, SEQ ID No:27, SEQ ID No:29, SEQ ID No:53, SEQ ID No:55, SEQ ID No:57, SEQ ID No:59, SEQ ID No:61 или SEQ ID No:63, она предпочтительно сохраняет активность диоксигеназы L-аминокислоты на уровне 10% или более, предпочтительно 30% или более, более предпочтительно 50% или более и еще более предпочтительно 70% или более, от активности белка, имеющего аминокислотную последовательность, представленную в Перечне последовательностей под номером SEQ ID No:2, SEQ ID No:4, SEQ ID No:6, SEQ ID No:8, SEQ ID No:10, SEQ ID No:12, SEQ ID No:14, SEQ ID No:16, SEQ ID No:18, SEQ ID No:20, SEQ ID No:22, SEQ ID No:24, SEQ ID No:26, SEQ ID No:28, SEQ ID No:30, SEQ ID No:54, SEQ ID No:56, SEQ ID No:58, SEQ ID No:60, SEQ ID No:62 или SEQ ID No:64 соответственно, в условиях 37°С и рН 8.
Кроме того, ДНК согласно настоящему изобретению также включает в себя ДНК, кодирующую белок, в большой степени идентичный диоксигеназе L-аминокислоты, кодируемой ДНК с нуклеотидной последовательностью SEQ ID No:1, SEQ ID No:3, SEQ ID No:5, SEQ ID No:7, SEQ ID No:9, SEQ ID No:11, SEQ ID No:13, SEQ ID No:15, SEQ ID No:17, SEQ ID No:19, SEQ ID No:21, SEQ ID No:23, SEQ ID No:25, SEQ ID No:27, SEQ ID No:29, SEQ ID No:53, SEQ ID No:55, SEQ ID No:57, SEQ ID No:59, SEQ ID No:61 или SEQ ID No:63. А именно, следующие ДНК также включены в понятие ДНК согласно настоящему изобретению:
(a) ДНК с нуклеотидной последовательностью SEQ ID No:1, SEQ ID No:3, SEQ ID No:5, SEQ ID No:7, SEQ ID No:9, SEQ ID No:11, SEQ ID No:13, SEQ ID No:15, SEQ ID No:17, SEQ ID No:19, SEQ ID No:21, SEQ ID No:23, SEQ ID No:25, SEQ ID No:27, SEQ ID No:29, SEQ ID No:53, SEQ ID No:55, SEQ ID No:57, SEQ ID No:59, SEQ ID No:61 или SEQ ID No:63;
(b) ДНК, гибридизующаяся в жестких условиях с ДНК, нуклеотидная последовательность которой комплементарна нуклеотидной последовательности SEQ ID No:1, SEQ ID No:3, SEQ ID No:5, SEQ ID No:7, SEQ ID No:9, SEQ ID No:11, SEQ ID No:13, SEQ ID No:15, SEQ ID No:17, SEQ ID No:19, SEQ ID No:21, SEQ ID No:23, SEQ ID No:25, SEQ ID No:27, SEQ ID No:29, SEQ ID No:53, SEQ ID No:55, SEQ ID No:57, SEQ ID No:59, SEQ ID No:61 или SEQ ID No:63, и кодирующая белок, обладающий активностью диоксигеназы L-аминокислоты;
(c) ДНК, кодирующая белок с аминокислотной последовательностью SEQ ID No:2, SEQ ID No:4, SEQ ID No:6, SEQ ID No:8, SEQ ID No:10, SEQ ID No:12, SEQ ID No:14, SEQ ID No:16, SEQ ID No:18, SEQ ID No:20, SEQ ID No:22, SEQ ID No:24, SEQ ID No:26, SEQ ID No:28, SEQ ID No:30, SEQ ID No:54, SEQ ID No:56, SEQ ID No:58, SEQ ID No:60, SEQ ID No:62 или SEQ ID No:64;
(d) ДНК, кодирующая белок с аминокислотной последовательностью, содержащей замену, делецию, вставку, добавление или инверсию одного или нескольких аминокислотных остатков в аминокислотной последовательности SEQ ID No:2, SEQ ID No:4, SEQ ID No:6, SEQ ID No:8, SEQ ID No:10, SEQ ID No:12, SEQ ID No:14, SEQ ID No:16, SEQ ID No:18, SEQ ID No:20, SEQ ID No:22, SEQ ID No:24, SEQ ID No:26, SEQ ID No:28, SEQ ID No:30, SEQ ID No:54, SEQ ID No:56, SEQ ID No:58, SEQ ID No:60, SEQ ID No:62 или SEQ ID No:64, обладающий активностью диоксигеназы L-аминокислоты; и
(e) ДНК, кодирующая белок с аминокислотной последовательностью, которая имеет гомологию по крайней мере 70%, предпочтительно гомологию по крайней мере 80%, более предпочтительно гомологию по крайней мере 90% и еще более предпочтительно гомологию по крайней мере 95% с аминокислотной последовательностью SEQ ID No:2, SEQ ID No:4, SEQ ID No:6, SEQ ID No:8, SEQ ID No:10, SEQ ID No:12, SEQ ID No:14, SEQ ID No:16, SEQ ID No:18, SEQ ID No:20, SEQ ID No:22, SEQ ID No:24, SEQ ID No:26, SEQ ID No:28, SEQ ID No:30, SEQ ID No:54, SEQ ID No:56, SEQ ID No:58, SEQ ID No:60, SEQ ID No:62 или SEQ ID No:64, обладающий активностью диоксигеназы L-аминокислоты.
В рамках настоящего изобретения фраза «один или несколько» означает диапазон, вне которого стереоизомерия аминокислотных остатков белка или активность диоксигеназы L-аминокислоты изменяется незначительно и, в частности, соответствует значениям от 1 до 78, предпочтительно от 1 до 52, более предпочтительно от 1 до 26 и еще более предпочтительно от 1 до 13.
Замена, делеция, вставка, добавление или инверсия одного или нескольких аминокислотных остатков будут представлять собой консервативную мутацию или консервативные мутации при условии, что активность фермента при этом сохраняется. Примером консервативной мутации(ий) является консервативная замена(ы). Примеры консервативных замен включают замену Ala на Ser или Thr, замену Arg на Gln, His или Lys, замену Asn на Glu, Gln, Lys, His или Asp, замену Asp на Asn, Glu или Gln, замену Cys на Ser или Ala, замену Gln на Asn, Glu, Lys, His, Asp или Arg, замену Glu на Asn, Gln, Lys или Asp, замену Gly на Pro, замену His на Asn, Lys, Gln, Arg или Tyr, замену Ile на Leu, Met, Val или Phe, замену Leu на Ile, Met, Val или Phe, замену Lys на Asn, Glu, Gln, His или Arg, замену Met на Ile, Leu, Val или Phe, замену Phe на Trp, Tyr, Met, Ile или Leu, замену Ser на Thr или Ala, замену Thr на Ser или Ala, замену Trp на Phe или Tyr, замену Tyr на His, Phe или Trp и замену Val на Met, Ile или Leu.
Кроме того, "активность диоксигеназы L-аминокислоты" может быть описана как катализирующая реакцию гидроксилирования аминокислоты. Однако, когда аминокислотная последовательность SEQ ID No:2, SEQ ID No:4, SEQ ID No:6, SEQ ID No:8, SEQ ID No:10, SEQ ID No:12, SEQ ID No:14, SEQ ID No:16, SEQ ID No:18, SEQ ID No:20, SEQ ID No:22, SEQ ID No:24, SEQ ID No:26, SEQ ID No:28, SEQ ID No:30, SEQ ID No:54, SEQ ID No:56, SEQ ID No:58, SEQ ID No:60, SEQ ID No:62, SEQ ID No:64 содержит замену, делецию, вставку, добавление или инверсию одного или нескольких аминокислотных остатков, она предпочтительно сохраняет активность диоксигеназы L-аминокислоты на уровне 10% или более, предпочтительно 30% или более, более предпочтительно 50% или более и еще более предпочтительно 70% или более, по сравнению с белком с аминокислотной последовательностью SEQ ID No:2, SEQ ID No:4, SEQ ID No:6, SEQ ID No:8, SEQ ID No:10, SEQ ID No:12, SEQ ID No:14, SEQ ID No:16, SEQ ID No:18, SEQ ID No:20, SEQ ID No:22, SEQ ID No:24, SEQ ID No:26, SEQ ID No:28, SEQ ID No:30, SEQ ID No:54, SEQ ID No:56, SEQ ID No:58, SEQ ID No:60, SEQ ID No:62, SEQ ID No:64 в услових 30°С и рН 6.0. Активность диоксигеназы L-аминокислоты диоксигеназы настоящего изобретения может быть определена методом анализа образования гидроксилированной L-аминокислоты из L-аминокислоты с использованием высокоэффективной жидкой хроматографии (ВЭЖХ).
Кроме того, ДНК, гомологичная ДНК с последовательностью SEQ ID No:1, SEQ ID No:3, SEQ ID No:5, SEQ ID No:7, SEQ ID No:9, SEQ ID No:11, SEQ ID No:13, SEQ ID No:15, SEQ ID No:17, SEQ ID No:19, SEQ ID No:21, SEQ ID No:23, SEQ ID No:25, SEQ ID No:27, SEQ ID No:29, SEQ ID No:53, SEQ ID No:55, SEQ ID No:57, SEQ ID No:59, SEQ ID No:61, SEQ ID No:63, может быть использована в качестве гена, кодирующего диоксигеназу L-аминокислоты настоящего изобретения. Кодирует гомологичная ДНК диоксигеназу L-аминокислоты или нет, может быть подтверждено измерением активности диоксигеназы L-аминокислоты лизата клеток или лизата микроорганизма, в котором гомологичная ДНК сверхэкспрессированна.
ДНК, гомологичная ДНК с последовательностью SEQ ID No:1, SEQ ID No:3, SEQ ID No:5, SEQ ID No:7, SEQ ID No:9, SEQ ID No:11, SEQ ID No:13, SEQ ID No:15, SEQ ID No:17, SEQ ID No:19, SEQ ID No:21, SEQ ID No:23, SEQ ID No:25, SEQ ID No:27, SEQ ID No:29, SEQ ID No:53, SEQ ID No:55, SEQ ID No:57, SEQ ID No:59, SEQ ID No:61, SEQ ID No:63, также может быть получена из генома других видов бактерий, принадлежащих к родам Pantoea, Methylobacillus, Gluconobacter, Agrobacterium, Bordetella, Streptomyces, Photorhabdus, Gloeobacter, Psychromonas, Mesorhizobium, Anabaena, Burkholderia, или бактерий, геном которых описан в проекте метагенома морских организмов.
1. Бактерия согласно настоящему изобретению.
Термин «бактерия/микроорганизм», как он используется в настоящем описании, включает в себя синтезирующую фермент бактерию/микроорганизм, мутант и генетический рекомбинант такой бактерии/микроорганизма, в которых присутствует или увеличена активность целевого фермента и т.п.
Имеются сведения о довольно большом числе белков, обладающих α-кетоглутарат-зависимой ферментной активностью, таких как α-кетоглутарат-зависимые диоксигеназы. Примеры таковых включают диоксигеназы, используемые для получения полезных продуктов, такие как Pro диоксигеназа, трансформирующая L-Pro в гидрокси-Pro (APPLIED AND ENVIRONMENTAL MICROBIOLOGY, Sept. 1999, p.4028-4031), γ-бутиробетаиндиоксигеназа, конвертирующая γ-бутиробетаин в L-карнитин (WO2005/083089). Кроме этих диоксигеназ, имеются сведения о большом числе диоксигеназ. Например, в: Critical Reviews in Biochemistry and Molecular Biology, 39:21-68, 2004; NATURE CHEMICAL BIOLOGY, 4 NUMBER 3 MARCH: 152-156, 2008. Что касается описанных в обзорах α-кетоглутарат-зависимых диоксигеназ, бактерия модифицирована с целью ослабления экспрессии гена, кодирующего оксоглутаратдегидрогеназу (например, ΔsucAB, ΔsucA, ΔsucB), предпочтительно модифицирована с целью ослабления экспрессии генов, кодирующих оксоглутаратдегидрогеназу и изоцитратлиазу (например, (ΔsucAB, ΔsucA или ΔsucB) плюс ΔасеА), более предпочтительно модифицирована с целью ослабления экспрессии генов, кодирующих оксоглутаратдегидрогеназу, изоцитратлиазу и фосфатазу изоцитратдегидрогеназы (например, (ΔsucAB, ΔsucA или ΔsucB) плюс ΔaceAK), такая бактерия представлена штаммом Е.coli MG1655 (ΔsucAB, ΔaceAK), описанным в нижеприведенных Примерах, она рассматривается как основной хозяин для эффективного использования α-кетоглутарата, образующегося из источника углерода, такого как D-глюкоза, в α-кетоглутарат-зависимых ферментативных реакциях.
Настоящее изобретение будет описано со ссылкой в качестве примера на способ осуществления изобретения, в котором белок, обладающий α-кетоглутарат-зависимой ферментной активностью, - это белок, обладающий активностью диоксигеназы L-атаминокислоты, а продуктом катализируемой ферментом реакции является гидроксилированная L-аминокислота. Однако настоящее изобретение не ограничивается этим способом осуществления изобретения.
Термин "бактерия, принадлежащая к роду Escherichia" означает, что бактерия относится к роду Escherichia в соответствии с классификацией, известной специалисту в области микробиологии. В качестве примера микроорганизма, принадлежащего к роду Escherichia, использованного в настоящем изобретении, может быть упомянута бактерия Escherichia coli (Е.coli).
Круг бактерий, принадлежащих к роду Escherichia, которые могут быть использованы в настоящем изобретении, не ограничен каким-либо образом, однако, например, бактерии, описанные в книге Neidhardt, F.C. et al. (Escherichia coli and Salmonella typhimurium, American Society for Microbiology, Washington DC, 1208, Таблица 1), могут быть включены в число бактерий согласно настоящему изобретению.
Термин «бактерия, принадлежащая к роду Pantoea» означает, что бактерия относится к роду Pantoea в соответствии с классификацией, известной специалисту в области микробиологии. Недавно несколько видов Enterobacter agglomerans были классифицированы как Pantoea agglomerans, Pantoea ananatis, Pantoea stewartii или подобные им, на основе анализа нуклеотидной последовательности 16S рРНК и т.д. (International Journal of Systematic Bacteriology, July 1989, 39(3) p.337-345). Кроме того, некоторые бактерии, принадлежащие к роду Erwinia, были реклассифицированы как Pantoea ananatis или Pantoea stewartii (International Journal of Systematic Bacteriology, Jan. 1993, 43(1), p.162-173). Типичные штаммы бактерий Pantoea включают, но не ограничиваются ими, Pantoea ananatis, Pantoea stewartii, Pantoea agglomerans и Pantoea citrea. Конкретные примеры включают следующие штаммы: Pantoea ananatis AJ13355 (FERM BP-6614, Европейская патентная заявка №0952221), Pantoea ananatis AJ13356 (PERM BP-6615, Европейская патентная заявка №0952221), Pantoea ananatis AJ13601 (FERM BP-7207, Европейская патентная заявка №0952221). Для настоящего изобретения предпочтительно использование λ-Red устойчивого штамма Pantoea ananatis SC17(0) (VKPM В-9246, Российская патентная заявка 2006134574).
Термин «бактерия, принадлежащая к роду Bacillus" означает, что бактерия относится к роду Bacillus в соответствии с классификацией, известной специалисту в области микробиологии. Примеры использованных в настоящем изобретении бактерий, принадлежащих к роду Bacillus, включают, но не ограничиваются ими, Bacillus subtilis и Bacillus thuringiensis.
Термин «бактерия, принадлежащая к роду Pseudomonas» означает, что бактерия относится к роду Pseudomonas в соответствии с классификацией, известной специалисту в области микробиологии. Примеры использованных в настоящем изобретении бактерий, принадлежащих к роду Pseudomonas, включают, но не ограничиваются, Pseudomonas syringae.
Термин «бактерия, принадлежащая к роду Agrobacterium» означает, что бактерия относится к роду Agrobacterium в соответствии с классификацией, известной специалисту в области микробиологии. Примеры использованных в настоящем изобретении бактерий, принадлежащих к роду Agrobacterium, включают, но не ограничиваются, Agrobacterium vitis.
Термин «бактерия, принадлежащая к роду Bordetella" означает, что бактерия относится к роду Bordetella в соответствии с классификацией, известной специалисту в области микробиологии. Примеры использованных в настоящем изобретении бактерий, принадлежащих к роду Bordetella, включают, но не ограничиваются, Bordetella petrii.
Термин «бактерия, принадлежащая к роду Streptomyces» означает, что бактерия относится к роду Streptomyces в соответствии с классификацией, известной специалисту в области микробиологии. Примеры использованных в настоящем изобретении бактерий, принадлежащих к роду Streptomyces, включают, но не ограничиваются, Streptomyces fradiae.
Термин «бактерия, принадлежащая к роду Photorhabdus» означает, что бактерия относится к роду Photorhabdus в соответствии с классификацией, известной специалисту в области микробиологии. Примеры использованных в настоящем изобретении бактерий, принадлежащих к роду Photorhabdus, включают, но не ограничиваются, Photorhabdus luminescens.
Термин «бактерия, принадлежащая к роду Gloeobacter» означает, что бактерия относится к роду Gloeobacter в соответствии с классификацией, известной специалисту в области микробиологии. Примеры использованных в настоящем изобретении бактерий, принадлежащих к роду Gloeobacter, включают, но не ограничиваются, Gloeobacter violaceus.
Термин «бактерия, принадлежащая к роду Psychromonas» означает, что бактерия относится к роду Psychromonas в соответствии с классификацией, известной специалисту в области микробиологии. Термин «бактерия, принадлежащая к роду Mesorhizobium» означает, что бактерия относится к роду Mesorhizobium в соответствии с классификацией, известной специалисту в области микробиологии. Примеры использованных в настоящем изобретении бактерий, принадлежащих к роду Mesorhizobium, включают, но не ограничиваются, Mesorhizobium loti.
Термин «бактерия, принадлежащая к роду Anabaena» означает, что бактерия относится к роду Anabaena в соответствии с классификацией, известной специалисту в области микробиологии. Примеры использованных в настоящем изобретении бактерий, принадлежащих к роду Anabaena, включают, но не ограничиваются, Anabaena variabilis.
Термин «бактерия, принадлежащая к роду Burkholderia» означает, что бактерия относится к роду Burkholderia в соответствии с классификацией, известной специалисту в области микробиологии. Примеры использованных в настоящем изобретении бактерий, принадлежащих к роду Burkholderia, включают, но не ограничиваются, Burkholderia phytofirmans и Burkholderia ambifaria.
Термин «бактерия, принадлежащая к роду Methylobacillus» означает, что бактерия относится к роду Methylobacillus в соответствии с классификацией, известной специалисту в области микробиологии. Примеры использованных в настоящем изобретении бактерий, принадлежащих к роду Methylobacillus, включают, но не ограничиваются, Methylobacillus flagellatus.
Термин «бактерия, принадлежащая к роду Gluconobacter» означает, что бактерия относится к роду Gluconobacter в соответствии с классификацией, известной специалисту в области микробиологии. Примеры использованных в настоящем изобретении бактерий, принадлежащих к роду Gluconobacter, включают, но не ограничиваются, Gluconobacter oxydans.
Термин «бактерия, принадлежащая к роду Nostoc» означает, что бактерия относится к роду Nostoc в соответствии с классификацией, известной специалисту в области микробиологии. Примеры использованных в настоящем изобретении бактерий, принадлежащих к роду Nostoc, включают, но не ограничиваются, Nostoc punctiforme.
Термин «микроорганизм, принадлежащий к роду Corynebacterium» означает, что микроорганизм относится к роду Corynebacterium в соответствии с классификацией, известной специалисту в области микробиологии. Примеры использованных в настоящем изобретении бактерий, принадлежащих к роду Corynebacterium, включают, но не ограничиваются ими, Corynebacterium glutamicum.
Термин «микроорганизм, принадлежащий к роду Arthrobacter» означает, что микроорганизм относится к роду Arthrobacter в соответствии с классификацией, известной специалисту в области микробиологии. Примеры использованных в настоящем изобретении бактерий, принадлежащих к роду Arthrobacter, включают, но не ограничиваются ими, Arthrobacter simplex, Arthrobacter globiformis, Arthrobacter sulfureus, Arthrobacter viscosus.
Термин «микроорганизм, принадлежащий к роду Aspergillus» означает, что микроорганизм относится к роду Aspergillus в соответствии с классификацией, известной специалисту в области микробиологии.
Гомология между двумя аминокислотными последовательностями может быть определена с использованием известных методов, например компьютерной программы BLAST 2.0, которая считает три параметра: число аминокислот, идентичность и сходство.
"Трансформация бактерии ДНК, кодирующей белок" означает введение ДНК в бактерию, например, традиционными методами. Трансформация этой ДНК приведет к усилению экспрессии гена, кодирующего белок (белки) настоящего изобретения, и к увеличению активности белка в бактериальной клетке. Например, для Escherichia coli K-12 известен метод обработки реципиентных клеток хлоридом кальция с целью увеличения проницаемости клеток для ДНК (Mandel, Higa, J. Mol. Biol., 53, 159 (1970)).
Методы приготовления плазмидной ДНК, рестрикции и лигирования ДНК, трансформации, выбора нуклеотидов в качестве праймера и т.п. могут быть обычными методами, известными специалисту в этой области. Эти методы описаны, например, в Sambrook, J., Fritsch, E.F., Maniatis, Т., "Molecular Cloning: A Laboratory Manual, Second Edition", Cold Spring Harbor Laboratory Press (1989).
2. Способ согласно настоящему изобретению.
Способом согласно настоящему изобретению является способ получения продукта реакции, катализируемой белком, обладающим α-кетоглутарат-зависимой и Fe2+-зависимой ферментной активностью, путем выращивания бактерии согласно настоящему изобретению в питательной среде, содержащей субстрат для реакции, и выделения образовавшегося продукта из культуральной жидкости. Продукт включает соединения и в свободной форме, и в виде соли.
В зависимости от продукта и специфики используемого белка, обладающего α-кетоглутарат-зависимой и Fe2+-зависимой ферментной активностью, выбирается соответственный субстрат. Например, когда продукт-4'-HIL (2S, 3R) и белок обладает HilA диоксигеназной активностью, субстратом может быть Ile (2S, 3R).
Таким образом, способом настоящего изобретения может быть способ получения гидроксилированной L-аминокислоты, включающий получение указанной гидроксилированной L-аминокислоты в свободной форме и в виде ее соли путем выращивания бактерии согласно настоящему изобретению в питательной среде, содержащей L-аминокислоту, и выделения образовавшейся гидроксилированной L-аминокислоты из культуральной жидкости.
Питательная среда, используемая для выращивания, может быть как синтетической, так и натуральной, при условии, что указанная среда содержит источники углерода, азота, минеральные добавки и, если необходимо, соответствующее количество питательных добавок, необходимых для роста микроорганизмов. В качестве источника углерода используют этанол. В качестве источника азота могут использоваться различные неорганические соли аммония, такие как аммиак и сульфат аммония, другие соединения азота, такие как амины, природные источники азота, такие как пептон, гидролизат соевых бобов, ферментолизат микроорганизмов. В качестве минеральных добавок могут использоваться фосфат калия, сульфат магния, хлорид натрия, сульфат железа, сульфат марганца, хлорид кальция и подобные им соединения. В качестве витаминов могут использоваться тиамин, дрожжевой экстракт и т.п. Питательная среда настоящего изобретения содержала L-аминокислоту (20-40 г/л).
Выращивание осуществляется предпочтительно в аэробных условиях, таких как перемешивание культуральной жидкости на качалке, взбалтывание с аэрацией при температуре в пределах от 20 до 40°С, предпочтительно в пределах от 30 до 38°С. рН среды поддерживают в пределах от 5 до 9, предпочтительно от 6.5 до 7.2. рН среды может регулироваться аммиаком, карбонатом кальция, различными кислотами, основаниями и буферными растворами.
Примеры способов выделения и очистки могут включать способ, в котором гидроксилированная L-аминокислота контактирует с ионообменной смолой для адсорбции основных аминокислот с последующей элюцией и центрифугированием, и метод, в котором полученный продукт после элюции обесцвечивают и фильтруют с использованием активированного угля с последующей кристаллизацией для получения гидроксилированной L-аминокислоты.
Для различных гидроксилированных L-аминокислот в качестве продукта условия выращивания, выделения и очистки выбирают в зависимости от природы используемой бактерии и целевого продукта.
Примеры
Настоящее изобретение будет более подробно описано ниже со ссылкой на следующие не ограничивающие настоящее изобретение Примеры.
Пример 1. Характеристика диоксигеназ HilA и HilB из Pantoea ananatis.
1.1. Клонирование генов hilA и hilB из Р.ananatis SC17.
Для того чтобы сконструировать плазмиду рЕТ-HilA амплифицировали содержащий ген hilA фрагмент ДНК (935 п.н.) с использованием праймеров P1 (SEQ ID No:31) и P2 (SEQ ID No:32) и хромосомной ДНК из Р.ananatis SC17 в качестве матрицы. Полученный фрагмент обрабатывали рестриктазами XbaI и SacI и лигировали с плазмидой pET-ilvA (патентная заявка РФ 2006131211), предварительно обработанной теми же рестриктазами.
Для того чтобы сконструировать плазмиду рЕТ-HilA-HilB амплифицировали содержащий гены hilA и hilB фрагмент ДНК (1732 п.н.) с использованием праймеров Р1 (SEQ ID No:31) и Р3 (SEQ ID No:33) и хромосомной ДНК из Р.ananatis SC17 в качестве матрицы. Полученный фрагмент обрабатывали рестриктазами XbaI и SacI и лигировали с плазмидой pET-ilvA, предварительно обработанной теми же рестриктазами.
Для того чтобы сконструировать плазмиду pET-HilB амплифицировали содержащий ген hilB фрагмент ДНК (791 п.н.) с использованием праймеров Р4 (SEQ ID No:34) и Р3 (SEQ ID No:33) и хромосомной ДНК из Р.ananatis SC17 в качестве матрицы. Полученный фрагмент обрабатывали рестриктазами XbaI и SacI и лигировали с плазмидой pET-ilvA, предварительно обработанной теми же рестриктазами.
Для того чтобы сконструировать плазмиду рЕТ-НТ-HilB (таким же образом может быть синтезирована любая плазмида pET-HT-xxx-DOA(B)) амплифицировали фрагмент ДНК (796 п.н.) с использованием праймеров Р5 (SEQ ID No:35) и Р6 (SEQ ID No:36) и хромосомной ДНК из Р.ananatis SC17 в качестве матрицы. Полученный фрагмент обрабатывали рестриктазами NcoI и BamHI и лигировали с вектором рЕТ-15 (b+) (Novagen, Germany), предварительно обработанным теми же рестриктазами.
1.2. Биотрансформация Ile в 4'-гидроксиизолейцин (4'-HIL) и в 4,4'-дигидроксиизолейцин (4,4'-DHIL) с использованием штамма Е.coli, содержащего плазмиды рЕТ-HilA, pET-HilA-HilB.
Штамм Е.coli MG1655 (λattB-PL-brnQ) ΔsucAB::(λattB-Ptac)ΔaceAK::(λattB), представляющий собой штамм MG1655 (ΔsucAB, ΔaceAK, PL-brnQ), описанный в заявке WO 2009/082029, трансформировали плазмидами рЕТАС-HilA и pETAC-HilA-HilB, таким образом получили штаммы AG7030 и AG7029 соответственно. Штаммы AG7030 и AG7029 культивировали в пробирках с 2 мл среды [50 мМ KH2PO4 (рН 7 доводят KOH); 20 мМ NH4Cl; 2 мМ MgSO4; 1 мМ IPTG, Ile 3 г/л, ампициллин - 200 мг/л; 10% LB-среда; 1% глюкоза; мел - 1,25 г/100 мл] при 32°С в течение 48 часов. Полученную культуральную жидкость исследовали с использованием методов ТСХ и ВЭЖХ.
ВЭЖХ анализ проводили следующим образом. Аминокислоты определяли с использованием метода Accq-Tag (Waters). Синтез производных аминокислот и их разделение осуществляли в соответствии с рекомендациями производителя. Разделение проводили при 20°C с использованием комплекта для хроматографии Agilent 1100 с колонкой XBridge С18 (5) (150×2,1 мм; Waters).
Крупномасштабный биосинтез и частичную очистку 4'-HIL проводили следующим образом. Клетки штамма AG7030 культивировали в колбах объемом 750 мл с 50 мл LB среды при 37°С до достижения значения А540=1-1.3. Экспрессию HilA индуцировали путем добавления ИПТГ(1РТО) до конечной концентрации 1 мМ. Затем индуцированные клетки культивировали при 34°С в течение приблизительно 2.5 часов. Полученную "активную" биомассу собирали с использованием центрифугирования и ресуспендировали в 5 мл реакционного буфера (KH2PO4 50 мМ рН 7, рН доводят NaOH; 20 мМ NH4Cl, 2 мМ MgSO4, мел - 1.25 г/100 мл, 1 мМ IPTG, 100 мМ Ile, 100 мМ α-кетоглутарата). Полученную суспензию культивировали при 32°С в течение приблизительно 48 часов при сильном встряхивании. 4'-HIL очищали из культуральной жидкости с использованием ионообменной хроматографии на DOWEX 50 W-X2 (SO3H). Конечный препарат 4'-HIL получали лиофилизацией фракции 6 (Фиг.2).
Анализ очищенного соединения с использованием ЖХ (жидкая хроматография)-МС (масс-спектрометрия) и ЯМР (ядерный магнитный резонанс) показал, что продукт биотрансформации Ile при экспрессии HilA-4'-гидроксиизолейцин (4'-HIL) (Фиг.4).
Для индуцированной экспрессии HilA и HilB использована та же описанная выше схема с использованием штамма AG7029. Конечный препарат 4,4'-HIL получали лиофилизацией фракций 4, 5 (Фиг.3).
Анализ очищенного соединения ЖХ-МС и ЯМР показал, что продукт биотрансформации Не при экспрессии HilA и HilB - 4,4'-дигидроксиизолейцин (4,4'-DHIL) (Фиг.4).
4' HIL, 1Н NMR (в D2O) δ 0.97 (3Н, t, J=7.5Hz) <δ>, 1.36-1.43 (2H, m) <γ>, 2.05-2.15 (1H, m) <β>, 3.71 (1H, dd, J=11.6, 6.8Hz) <A1>, 3.81 (1H, dd, J=11.6, 4.2Hz), A2>, 3.94 (1H, d, J=2.8 Hz) <α>, ESI-MS (наблюдали) m/z=+148.2 [M+H], расчетная молекулярная масса 147.17.
4,4'-дигидроксилированный-L-изолейцин (4,4'-DHIL), 1H NMR (в D2O) δ 1.30 (3H, d, J=6.4Hz) <5>, 2.19-2.24 (1H, m) <β>, 3.73 (1H, dd, J=11.5, 7.6Hz) <A1>, 3.82 (1H, dd, J=11.5, 4.8Hz) <A1>, 3.99-4.06 (1H, m) <γ>, 4.07 (1H, d, J=2.7 Hz) <α>, ESI-MS (наблюдали) m/z=+164.1 [M+H], расчетная молекулярная масса 163.17.
Крупномасштабный биосинтез и частичную очистку 4,4'-дигидроксиизолейцина (DHIL) проводили следующим образом. Клетки штамма AG7029 культивировали в трех колбах объемом 750 мл со 100 мл LB среды при 37°С до достижения значения А550=1.3. Для индукции синтеза HilA и HilB добавляли IPTG до конечной концентрации 1 мМ. Затем индуцированные клетки культивировали при 34°С в течение приблизительно 2.5 часов. Клетки собирали и ресуспендировали в реакционном буфере RB-I (KH2PO4 50 мМ рН 7, доводили NaOH; 20 мМ NH4Cl, 2 мМ MgSO4, 100 мМ Ile, 150 мМ глюкозы) или в реакционном буфере RB-II (KH2PO4 50 мМ рН 7, доводили NaOH; 20 мМ (NH4)Cl, 2 мМ MgSO4, 100 мМ Ile, 150 мМ глицерина, 100 мМ α-кетоглутарата).
Полученные суспензии культивировали при 32°С в течение приблизительно 16 ч. Синтезированный 4',4-DHIL определяли с использованием ТСХ (схема и результаты эксперимента показаны на Фиг.15, Фиг.16).
Продублированные реакционные смеси В и D объединяли с приблизительно 10 мл полученного раствора 4',4-DHIL. 2 мл полученного раствора наносили на колонку DOWEX 50 W-X2 (16 × 0.8 см), уравновешенную 30 мкМ раствора аммиака. Использовали изократную элюцию таким же раствором аммиака при скорости элюции 1.5 мл/мин. Собрали двадцать фракций. 4',4-DHIL был элюирован во фракциях 7-11 (Фиг.17). Элюированный DHIL лиофилизировали и хранили до использования при -20°С. Описанную процедуру повторили 5 раз для очистки DHIL из 10 мл раствора. В общей сложности получили приблизительно 100 мг лиофилизированного порошка 4,4'-DHIL.
Крупномасштабный биосинтез и частичную очистку гидроксивалина (hVal) проводили следующим образом. Свежевыросшую на LB-агаре биомассу штамма TG1[pETAC-HilA] инокулировали в 1200 мл среды LB (6 × 200 мл) с добавлением Ар (100 мг/л) и культивировали при 37°С до достижения значения A555=1. Затем добавляли IPTG до конечной концентрации 1 мМ и продолжали культивирование при 30°С в течение 2 ч. Полученную после индукции биомассу собирали с использованием центрифугирования и ресуспендировали в 24 мл реакционного буфера, содержащего: 100 мМ HEPES рН 8, 10 мМ Fe2+, L-валин 100 мМ, α-кетоглутарат 100 мМ. Реакционную смесь инкубировали при 37°С в течение 15 ч при энергичном встяхивании. Частичную очистку hVal проводили, как описано ране для hLeu (Фиг.19). Дальнейшая очистка и характеристика свойств описана в Примере 11.
1.3. Определение специфической активности HilA и HilB (his6-tag-HilB) в неочищенном клеточном лизате.
Реакционная смесь (50 мкл) содержала 100 мМ HEPES (рН 7 доводят KOH), 5 мМ Ile, 10 мМ 2-кетоглутарата, 5 мМ аскорбата, 5 мМ FeSO4 и образец препарата белка (неочищенный клеточный лизат). Реакцию проводили при 34°С в течение 1 часа с энергичным встряхиванием. Полученную в результате реакционную смесь анализировали с использованием методов ТСХ и ВЭЖХ. Активности обоих ферментов, изолейцин-4'-диоксигеназы (4'-IDO) и 4'-гидроксиизолейцин-4-диоксигеназы (4',4-HIDO) определяли в неочищенных клеточных лизатах MG1655[pETAC-HilA] и MG1655[pETAC-HilA-HilB] соответственно.
Субстратную специфичность HilA и HilB (his6-tag-HilB) исследовали следующим образом. Реакционная смесь (50 мкл) содержала: 100 мМ Hepes pH 7.0, 5 мМ аминокислоты (проверяли Ile, Val, Leu, Ala, Gly, Asp, Asn, Glu, Gln, Pro, Phe, Trp, Met, Cys, Lys, Arg, Thr, Ser, His), 5 мМ 2-оксоглутарата, 5 мМ аскорбата, 5 мМ FeSO4 и препарат белка. Реакционную смесь инкубировали при 34°С в течение 1 часа при энергичном встряхивании. Гидроксилирование аминокислот определяли методом ТСХ.
1.4. Очистка белков HilA и his6-tag-HilB.
Очистку белка HilA проводили следующим образом. Клетки штамма TG1[pETAC-HilA], выросшие на чашках с LB-агаром, инокулировали в 1 л LB среды (5 × 200 мл в колбах на 750 мл) с добавлением ампициллина (100 мг/л) и выращивали при 34°С до достижения значения OD540=1. Затем индуцировали культуру путем добавления IPTG (1 мМ) и культивировали в течение приблизительно 2 часов. Затем клетки собирали и хранили до использования при -70°С.
Этап 1. Клетки размораживали и ресуспендировали в 40 мл буфера А (50 мМ Tris рН 7, 50 мМ NaCl, 1 мМ DTT, 1 мМ ЭДТА (EDTA)). Клетки разрушали двумя пассажами через клеточный дезинтегратор высокого давления (max P=2000 Psi) с последующим центрифугированием для удаления остатков разрушенных клеток (14000 g, 4°С, 20 мин).
Этап 2. 40 мл полученного на этапе 1 препарата белка наносили на DEAE-Sepharose колонку (1.6×25 см), уравновешенную буфером А. Собирали несвязавшуюся (вытекшую) фракцию.
Этап 3. Полученный на этапе 2 препарат белка осаждали путем добавления (NH4)2SO4 до 40% насыщения и затем ресуспендировали в 2 мл буфера А.
Этап 4. 1 мл полученного на этапе 3 препарата белка наносили на Superdex 200 HR 10/30А колонку, уравновешенную буфером А. Проводили изократную элюцию при скорости протока 0.5 мл мин-л. Собирали каждый 1 мл фракции. Активные фракции объединяли.
Белок paaHilA очищали (Фиг.5) и изучали его основные свойства. Очищенный белок - гомодимер с оптимальным рН 7-8 и имеет преимущественную субстратную специфичность к изолейцину и валину (побочная активность).
Очистку белка his6-tag-HilB проводили следующим образом. Клетки штамма BL21(DE3)[pET-HT-HilB] выращивали в LB среде (5×200 мл в колбах на 700 мл) при 37°С до достижения значения А540=1. Затем добавляли IPTG до конечной концентрации 1 мМ и культивирование продолжали в течение 2 часов. Индуцированные клетки собирали, ресуспендировали в 17 мл буфера His-tag1 (20 мМ NaH2PO4, 0.5M NaCl, 20 мМ имидазола, рН 7.4 доводили NaOH) и разрушали с использованием French-пресса. Остатки разрушенных клеток удаляли центрифугированием.
Полученный препарат белка (концентрация белка была около 4 мг/мл) наносили на 1 мл His-trap колонку (Amersham), уравновешенную буфером His-tag1. Элюцию проводили при скорости протока 1 мл/мин линейным градиентом 0.02-0.5 М имидазола в буфере His-tag1 (15 объемов колонки). Каждый 1 мл фракции собирали. Активные фракции объединяли.
Белок HilB очистили как his6-tag производное (Фиг.5) и изучили его основные свойства. Очищенный белок - гомодимер и имеет преимущественную субстратную специфичность к 4'-Ile, метионину и Ile (побочная активность) (Фиг.6).
Пример 2. Характеристика ферментов, принадлежащих к семействам HilA-диоксигеназы и HilB-диоксигеназы.
2.1. Анализ семейств HilA-диоксигеназы и HilB-диоксигеназы.
Проведен анализ бактериальных белков, принадлежащих к семействам диоксигеназ HilA и HilB. Ранее было установлено, что HilA и HilB имеют изолейцин-4'-диоксигеназную и 4'-гидроксиизолейцин-4-диоксигеназную активности соответственно (см. Пример 1). Был выявлен консервативный мотив (Asp-Xi-Arg-Xj-Arg-Xk-His-X1-Pro-X3-His-X2-Asp-X17-Gly-Xm-His-Xn-Arg; диоксигеназная триада выделена жирным шрифтом), который может использоваться для характеристики семейства HilB-диоксигеназы (Фиг.7) и обнаружен консервативный мотив (Tyr-Xi-His-X2-Asp-Xj-Gly-Xk-Gly-His; диоксигеназная триада выделена жирным шрифтом), который может считаться "маркером" семейства HilA-диоксигеназы (Фиг.8).
13 ферментов выбраны для клонирования и экспрессии в Е.coli (Таблица 1).
11 генов синтезировали с использованием SlonoGene™ (http://www.sloning.com/). Два гена из Methylobacillus flagellatus KT и Gluconobacter oxydans 621Н амплифицировали в ПЦР с использованием хромосомной ДНК в качестве матрицы (см. ниже). Последовательности генов представлены в Перечне последовательностей (соответствующие номера в Таблице 1).
Каждый фрагмент ДНК, содержащий соответствующий ген, клонировали в векторе рЕТ15-b(+). Все ферменты были экспрессированы и очищены. Все гены, кодирующие предполагаемые диоксигеназы (за исключением генов из Methylobacillus flagellatus KT и Gluconobacter oxydans 621Н) синтезировали с использованием технологии SloningTM и получили как набор pSlo.X плазмид (Фиг.9). Для конструирования pET-HT-xxx-DOA(B) плазмиды фрагмент XbaI-BamHI соответствующей pSlo.X плазмиды реклонировали в вектор pET15(b+)/XbaI-BamHI. Полученную плазмиду pET-HT-xxx-DOA(B) вводили в штамм BL21(DE3). Клетки штамма BL21 (DE3) [рЕТ-НТ HT-xxx-DOA(B)] выращивали в LB среде при 37°С до достижения значения А540≈1. Затем добавляли IPTG до конечной концентрации 1 мМ и продолжали культивирование в течение 2 часов. Индуцированные клетки собирали и до использования хранили при -70°С.
Очистку HT-xxx-DO-A(B) проводили следующим образом. Индуцированные клетки (собранные из 1 литра культуральной жидкости, см. предыдущий абзац) ресуспендировали в 4-5 мл буфера HT-I (20 мМ NaH2PO4, 0.5M NaCl, 20 мМ имидазола, рН 7.4 доводят NaOH) и разрушали с использованием French-пресса. Остатки разрушенных клеток удаляли центрифугированием. Полученный препарат белка наносили на 1 мл His-trap колонку (Amersham), уравновешенную буфером HT-I. Элюцию проводили при скорости протока 1 мл/мин линейным градиентом 0.02-0.5 М имидазола в буфере HT-I (15 объемов колонки). Каждый 1 мл фракции собирали. Активные фракции объединяли. Полученный препарат активного белка обессоливали с использованием колонки PD10 (Amersham), уравновешенной буфером IDO (50 мМ HEPES, 50 мМ NaCl, 1 мМ EDTA, глицерин 10% v/v). Аликвоты по 0.2 мл конечного препарата белка до использования хранили при -70°С.
Четыре белка (HT-paa-HilA, HT-sfr-DO-B, HT-mme-DO-B и HT-mlo-DO-A) при экспрессии с использованием рЕТ-системы были обнаружены в нерастворимой фракции общего клеточного белка (образовывали тельца включения).
Субстратную специфичность предполагаемой диоксигеназы исследовали следующим образом. Реакционная смесь (50 мкл) содержала: 50 мМ HEPES рН 8.0, 5 мМ аминокислоты (проверяли Ile, Val, Leu, Ala, Gly, Asp, Asn, Glu, Gln, Pro, Phe, Trp, Met, Cys, Lys, Arg, Thr, Ser, His, R(S)-β-фенилаланин), 5 мМ 2-оксоглутарата, 5 мМ FeSO4 и препарат белка. Инкубировали смесь при 34°С в течение 0.5-1 ч с энергичным встряхиванием. Гидроксилирование аминокислоты выявляли с использованием ТСХ. Исследование субстратной специфичности растворимых диоксигеназ показало, что ферменты, принадлежащие к семейству HilA, могут гидроксилировать L-метионин и L-изолейцин (Фиг.10), тогда как ферменты, принадлежащие к семейству HilB, гидроксилируют L-метионин, L-лейцин и L-треонин (Фиг.11, 12). Полученные данные сведены в Таблице 2.
2.2. Клонирование, экспрессия, очистка и определение активности предполагаемой диоксигеназы из Metylobacillus flagellatus KT (HT-mfl-DO-B).
Фрагмент ДНК размером 805 п.н. амплифицировали с использованием праймеров Р7 (SEQ ID NO:37), Р8 (SEQ ID NO:38) и хромосомной ДНК штамма Methylobacillus flagellatus KT в качестве матрицы. Полученный фрагмент обрабатывали рестриктазами NcoI и BamHI и лигировали с вектором рЕТ-15 (b+), предварительно обработанным теми же рестриктазами. Полученную плазмиду pET-HT-mfl-DO-B вводили в штамм Е.coli BL21 (DE3) (Novagen, Germany).
Экспрессию, очистку и определение активности диоксигеназы HT-mfl-DO-B проводили так же, как описано выше для HilA и HilB.
2.3. Предполагаемая диоксигеназа Gluconobacter oxydans 621Н (HT-gox-DO-B).
2.3.1. Клонирование, экспрессия, очистка и определение активности предполагаемой диоксигеназы из Gluconobacter oxydans 621Н (HT-gox-DO-B).
Фрагмент ДНК размером 802 п.н. амплифицировали с использованием праймеров Р9 (SEQ ID NO:39), Р10 (SEQ ID NO:40) и хромосомной ДНК штамма Gluconobacter oxydans 621Н в качестве матрицы. Полученный фрагмент обрабатывали рестриктазами NcoI и BamHI и лигировали с вектором рЕТ-15 (b+), предварительно обработанным теми же рестриктазами.
Экспрессию, очистку и определение активности диоксигеназы HT-mfl-DO-B проводили так же, как описано выше для HilA и HilB.
2.3.2. Крупномасштабный биосинтез и частичная очистка 4-гидроксилейцина (hLeu).
Свежевыросшую на LB-агаре биомассу штаммов BL21(DE3)[pET-HT-gox-DO-B] или BL21(DE3)[pET-HT-mfl-DO-B] инокулировали в 400 мл среды LB (2 × 200 мл) с добавлением Ар (100 мг/л) и культивировали при 37°С до достижения А555=1. Затем добавляли IPTG до конечной концентрации 1 мМ и продолжали культивирование в течение 2 ч. Выросшую после индукции биомассу собирали с использованием центрифугирования и ресуспендировали в 10 мл реакционного буфера (100 мМ Hepes pH 8, 100 мМ α-кетоглутарата, 100 мM Leu). Полученную реакционную смесь инкубировали в пробирках (5×2 мл) при 37°С в течение 15 ч. Культуральную жидкость объединили, пропустили через фильтр с размером пор 0.22 мкм и нанесли на колонку DOWEX 50 W-Х2 (32 × 1.6 см), уравновешенную 30 мкМ раствором аммиака. Изократную элюцию проводили с использованием такого же раствора аммиака при скорости элюции 1 мл/мин. Собирали фракции по 3 мл (Фиг.18). Фракции, содержащие hLeu, объединили, повторно нанесли на колонку DOWEX 50 W-X2, собрали и повторили процесс хроматографии. Фракции, содержащие hLeu, лиофилизировали.
2.4. Крупномасштабный биосинтез и частичная очистка метионинсульфоксида (sMet).
Свежевыросшую на LB-агаре биомассу штамма BL21(DE3)[pET-HT-avi-DO-B] инокулировали в 800 мл среды LB (4 × 200 мл) с добавлением Ар (100 мг/л) и культивировали при 37°С до достижения А555=1. Затем добавляли IPTG до конечной концентрации 1 мМ и продолжали культивирование в течение 2 ч. Выросшую после индукции биомассу собирали с использованием центрифугирования и ресуспендировали в реакционном буфере, содержащем: 100 мМ HEPES pH 7, 10 мМ Fe2+, Met/ α-кетоглутарат в концентрации 100 мМ. Реакционноую смесь инкубировали при 37°С в течение 15 ч с энергичным встряхиванием. Очистку метионинсульфоксида проводили, как описано выше для hLeu (Фиг.20).
2.5. Крупномасштабный биосинтез и частичная очистка гидрокситреонина (hThr).
Эксперимент 1.
Свежевыросшую на LB-агаре биомассу штамма BL21(DE3)[pET-HT-bpe-DO-B] инокулировали в 400 мл среды LB (2×200 мл) с добавлением Ар (100 мг/л) и культивировали при 37°С до достижения значения А555=1. Затем добавляли IPTG до конечной концентрации 1 мМ и продолжали культивирование в течение 2 ч. Выросшую после индукции биомассу собирали с использованием центрифугирования, ресуспендировали в 5 мл 50 мМ Hepes pH 7 и разрушали путем одного пропускания через фрэнч-пресс (1000 psi). Затем приготовили пять реакционных смесей (общий объем каждой смеси - 2 мл), содержащих: 1 мл лизата клеток, 10 мМ Fe2+, Thr (и α-кетоглутарат) в концетрации 10 мМ, 20 мМ, 50 мМ, 70 мМ, 100 мМ. Реакционные смеси инкубировали при 37°С в течение 15 ч с энергичным встряхиванием. Полученные реакционные смеси анализировали с использованием ТСХ (Фиг.21). Как можно видеть, только 10 и 20 мМ Thr полностью был гидроксилирован. При более высоких концентрациях Thr (и α-кетоглутарата) наблюдалась преципитация белка, препятствовавшая эффективному гидроксилированию Thr. Таким образом, оптимальная реакционная смесь содержала 20-25 мМ Thr.
Эксперимент 2 (Крупномасштабное гидроксилирование треонина).
Эксперимент 1 повторили 4 раза. Реакционная смесь содержала 25 мМ Thr, 25 мМ α-кетоглутарата, 100 мМ Hepes рН 7, 10 мМ Fe2+. Конечные реакционные смеси центрифугировали и содержащий гидрокситреонин супернатант до использования замораживали.
10 мл полученного в эксперименте 2 супернатанта (см. выше) пропустили через фильтр с размером пор 0.22 мкм и нанесли на колонку DOWEX 50 W-X2 (32×1.6 см), уравновешенную 30 мкМ раствором аммиака. Провели изократную элюцию таким же раствором аммиака при скорости элюции 1 мл/мин. Собирали фракции по 3 мл (Фиг.22). Фракции, содержащие hThr, объединили. Эту процедуру повторили четырежды. Полученные фракции объединили и лиофилизировали.
Пример 3. Применение штамма E.coli для синтеза новой (-ых) гидроксилированной (-ых) аминокислоты (-лот) с использованием процесса прямой биотрансформации.
3.1. Конструирование штамма 2Δ#.
Делеция ΔsucAB была выполнена в штамме 2Δ strain (MG1655 aceAK::λattL-Kn-λattR), как описано в WO 05/010175. Таким образом был сконструирован штамм 2Δ# strain (MG1655 sucAB::λattR-Cm-λattL-Ptac, aceAK:: λattL-Kn-λattR).
3.2. Биотрансформация Ile в 4HIL. Сравнение штаммов 2Δ и 2Δ#.
В эксперименте использовали питательную среду следующего состава: СМ7 - [(NH4)2SO4 - 5 г/л; KH2PO4 - 1.5 г/л; MgSO4 × 7H2O - 1 г/л; FeSO4×7H2O - 0,01 г/л; изолейцин - 26 г/л; глюкоза - 54 г/л; рН 7 доводят KOH].
Штаммы Е.coli 2Δ и 2Δ# трансформировали плазмидой pEL-IDO (pEL-IDO(Lys, 23). Плазмида была сконструирована следующим образом. Большую часть гена lad делегировали из плазмиды pELAC-IDO (Lys, 23) (Фиг.14) путем вырезания SphI-EcoRV фрагмента с использованием соответствующих рестриктаз с последующим дотированием оставшейся части плазмиды. Таким образом были получены штаммы 2Δ[pEL-IDO] и 2Δ#[pEL-IDO] соответственно.
Свежевыросшие на чашках с LB-агаром клетки штамма Е.coli 2Δ[pEL-IDO] и штамма Е.coli 2Δ#[pEL-IDO] инокулировали в 50 мл LB-среды с добавлением Ар (100 мг/л) в колбах на 750 мл и культивировали при 37°С в течение приблизительно 4 ч. Полученные культуры использовали в качестве инокулята в крупномасштабном процессе биотрансформации.
Крупномасштабный процесс биотрансформации проводили в ферментере Marubischi. Параметры культивирования были следующие: начальный объем культуры - 500 мл; перемешивание - 1200 об/мин; температура культивирования - 34°С; рН 7.0 поддерживали с использованием 2.5М NH4OH. Инокуляты штаммов 2Δ[pEL-IDO] и 2Δ#[pEL-IDO] добавляли к 450 мл среды СМ7 (конечный объем = 500 мл) и культивировали в течение 22 ч.
Полученные данные представлены в Таблице 3. Как следует из Таблицы 3, штамм 2Δ# имеет хорошие функциональные характеристики.
Пример 4. Клонирование генов диоксигеназы Bacillus thuringiensis 2е2, Pseudomonas syringae pv. phaseolicola 1448A, Burkholderia phytofirmans PsJN, Nostoc punctiforme PCC 73102 и Burkholderia ambifaria AMMD.
(1) Приготовление хромосомной ДНК
Для культивирования Bacillus thuringiensis 2e2 использовали среду LB (10 г/л триптона, 5 г/л дрожжевого экстракта, 10 г/л NaCl). Для культивирования Pseudomonas syringae pv. phaseolicola 1448A, использовали среду King's В (20 г/л пептона «Proteose» №3, 1% (v/v) глицерина, 1.5 г/л K2HPO4, 1.5 г/л MgSO4·7H2O, 50 мг/л рифампицина, рН 7.2). Для культивирования Burkholderia phytofirmans PsJN и Burkholderia ambifaria AMMD использовали среду TGY (5 г/л триптона, 1 г/л глюкозы и 3 г/л дрожжевого экстракта). Для культивирования Nostoc punctiforme PCC 73102 использовали среду «Blue-green nitrogen-fixing» (1.5 г/л NaNO3, 0.04 г/л K2HPO4, 0.075 г/л MgSO4·7H2O, 0.036 г/л CaCl2·2Н2О, 6.0 мг/л лимонной кислоты, 6.0 мг/л железоаммонийного цитрата, 1.0 мг/л EDTA, 0.02 г/л Na2CO3, 2.86 мг/л Н3ВО3, 1.81 мг/л MnCl2·4H2O, 0.222 мг/л ZnSO4·7H2O, 0.39 мг/л Na2MoO4·2H2O, 0.079 мг/л CuSO4·5H2O, 0.0494 мг/л Со(NO3)2·6H2O, рН 7.1).
В. thuringiensis 2e2, P. syringae pv. phaseolicola 1448A, В. phytofirmans PsJN и Burkholderia ambifaria АММВ культивировали в течение ночи при 28°С в 5 мл (посевная культура). N.punctiforme PCC 73102 культивировали в течение недели при 22°С в 5 мл при интенсивности света 2,000-3,000 люкс (посевная культура). Использовали 1.5 мл культуральной жидкости в качестве посевного материала, основную культуру выращивали в 50 мл соответствующей среды. После культивирования до логарифмической фазы роста клетки собирали из 50 мл культуральной жидкости с использованием центрифугирования (12000×g, 4°C, 15 мин). Из этих клеток выделяли ДНК с использованием стандартного метода.
Штамм Bacillus thuringiensis 2e2 был назван Bacillus thuringiensis AJ110584 и был депонирован в Национальном Институте Прогрессивной Промышленной Науки и Технологии, Международном Депозитарии Организмов для Целей Патентования, Централ 6, 1-1, Хигаши 1-Чоме, Тсукуба-ши, Ибараки-кен, 305-8566, Япония (National Institute of Advanced Industrial Science and Technology, International Patent Organism Depositary, Central 6, 1-1, Higashi 1-Chome, Tsukuba-shi, Ibaraki-ken, 305-8566, Japan), 27 сентября 2006 года и получил инвентарный номер FERM ВР-10688 согласно условиям Будапештского Договора.
(2) Получение генов диоксигеназ с использованием ПЦР
На основании информации относительно гена L-изолейциндиоксигеназы, ido, из В. thuringiensis 2e2 синтезировали праймеры Р11 (SEQ ID NO:41) и P12 (SEQ ID NO:42). С использованием полученных праймеров и хромосомной ДНК В. thuringiensis 2e2 в качестве матрицы провели ПЦР на PrimeSTAR (TaKaRa) при следующих условиях: 30 циклов по 10 сек при 98°С, 15 сек при 52°С и 1 мин при 72°С.
Полученный ПЦР-продукт использовали для электрофореза в агарозном геле, обнаружили, что продукт амплификации является фрагментом размером приблизительно 750 п.н. Фрагмент ДНК элюировали, обработали эндонуклеазами BamHI и HindIII и клонировали в векторе QE80 (Qiagen), обработанном теми же рестриктазами.
Что касается Р. syringae pv. phaseolicola 1448A, на основании опубликованной информации относительно геномной последовательности Р. syringae pv. phaseolicola 1448А (GenBank accession No. CP000058) синтезировали праймеры Р13 (SEQ ID NO:43), P14 (SEQ ID NO:44), P15 (SEQ ID NO:45) и Р16 (SEQ ID NO:46).
Что касается В. phytofirmans PsJN, на основании опубликованной информации относительно геномной последовательности В. phytofirmans PsJN (GenBank accession No. NC_010676 синтезировали праймеры Р17 (SEQ ID NO:47) и P18 (SEQ ID NO:48), ген диоксигеназы dox клонировали с использованием ПЦР, как описано выше.
Что касается N. punctiforme PCC 73102, на основании опубликованной информации относительно геномной последовательности N. punctiforme PCC 73102 (GenBank accession No. CP001037) синтезировали праймеры Р19 (SEQ ID NO:49) и Р20 (SEQ ID NO:50), ген диоксигеназы dox клонировали с использованием ПЦР, как описано выше.
Что касается В. ambifaria AMMD, на основании опубликованной информации относительно геномной последовательности В. ambifaria AMMD (GenBank accession No. NC_008392) синтезировали праймеры Р21 (SEQ ID NO:51) и Р22 (SEQ ID NO:52), ген диоксигеназы dox клонировали с использованием ПЦР, как описано выше.
Пример 5. Экспрессия генов диоксигеназы в Е.coli и получение HIL из Ile.
(1) Экспрессия генов диоксигеназы в Е.coli
Плазмиду с экспрессирующимися генами диоксигеназы из В. thuringiensis 2e2, Р. syringae pv. phaseolicola 1448А, В. phytofirmans PsJN, N. punctiforme PCC 73102 и В. ambifaria AMMD, сконструированную в Примере 4, вводили в Е.coli JM109 и полученные трансформанты выращивали со встряхиванием на LB среде с добавлением 50 мкг/мл ампициллина для получения посевной культуры. Культуральную жидкость посевной культуры вносили в 50 мл среды LB в количестве 1%, основное культивирование проводили при 37°С. Через 2 ч после начала культивирования добавляли IPTG до конечной концентрации 1 мМ и продолжали культивировать в течение 3 ч. После завершения культивирования клетки собирали, отмывали, суспендировали в 1 мл 20 мМ Tris-HCl (рН 7.6) и разрушали звуком (INSONATOR 201М, KUBOTA). Лизат центрифугировали при 15000 об/мин в течение 10 мин для получения супернатанта, который использовали в качестве неочищенного ферментного раствора.
(2) Очистка диоксигеназ
Хроматографию проводили с использованием системы AKTA FPLC (GE Healthcare) при 4°С. Полученный препарат белка добавляли к 5 мл HisTrap HP (GE Healthcare), уравновешенного буфером для связывания (20 мМ фосфата натрия, 0.5 М NaCl, 30 мМ имидазола, рН 7.4). Элюцию проводили при скорости протока 1 мл/мин линейным градиентом элюционного буфера в объеме 10 колонок (20 мМ фосфата натрия, 0.5 М NaCl, 500 мМ имидазола, рН 7.4). Собирали каждую фракцию по 1 мл. Активные фракции объединили и провели диализ против 20 мМ Tris-HCl (рН 7.6).
(3) Определение реактивности аминокислот с использованием очищенной диоксигеназы
С использованием очищенного ферментного раствора, приготовление которого описано в (2), измеряли активность превращения аминокислоты в гидроксиаминокислоту. Реакционная смесь имела состав, описанный ниже. Реакцию проводили при встряхивании (300 об/мин) при 25°С в течение 16 ч, затем полученный сукцинат определяли с использованием F-kit (Roche). Результаты определения представлены в Таблице 4.
(4) Идентификация аминокислот, образующихся в диоксигеназной реакции.
Продукты аминокислот в диоксигеназной реакции определяли с использованием жидкостной хроматографии - масс-спектрометрии (LC-MS) анализа. Производные амнокислот были получены с использованием метода AccQ-Tag (Waters). Производные аминокислот анализировали с использованием системы высокоэффективной жидкостной хроматографии (ВЭЖХ) и квадрупольного масс-спектрометра с ионизирующим электроспреем (ESI-MS). Колонку XBridge C18 (5 мкм, 2.1 × 150 мм; Waters) использовали для разделения при 40°С. Подвижная фаза была: 1 мМ аммонийацетатный буфер (элюент А) и метанол (элюент В), скорость потока элюента была 0.3 мл/мин. Градиенты элюента были 20-40% (v/v) В за 0-15 мин и 80% (v/v) В за 15.1-18 мин. Результаты определения представлены в Таблице 5.
Как показывают результаты, когда использовались штаммы, экспрессирующие ген диоксигеназы В. thuringiensis 2e2, P. syringae pv. phaseolicola 1448A, В. phytofirmans PsJN, N. punctiforme PCC 73102 или В. ambifaria AMMD, четко наблюдалась продукция гидроксиаминокислоты. Таким образом было подтверждено, что эти гены полезны для продукции гидроксиаминокислоты.
Пример 6. Получение гидроксилированного L-лейцина, гидроксилированного L-норлейцина и окисленного L-метионина с использованием IDO.
6-1. Экспрессия IDO в Е.coli AG6772.
Е.coli AG6772 (2Δ [pEL-IDO]) инокулировали в колбы Sakaguchi, содержащие 50 мл среды ТВ (дрожжевой экстракт 24 г/л, пептон 12 г/л, K2HPO4 9.4 г/л, KH2PO4 2.2 г/л, глицерин 4 мл/л) с добавлением 100 мкг/мл ампициллина и 0.1 мМ IPTG, и культивировали в течение 16 ч при 34°С. Культуральную жидкость центрифугировали при 8000 об/мин в течение 5 мин и полученные таким образом клетки использовали для реакций в дальнейшей работе.
6-2. Получение гидроксилированного L-Leu с использованием IDO.
Клетки Е.coli AG6772 собрали из 10 мл культуральной жидкости, как описано выше, и ресуспендировали в 2 мл реакционной среды, содержащей 100 мМ KPB (рН 7.0), 100 мМ L-Leu, 100 мМ α-кетоглутарата, 1 мМ аскорбата натрия, 10 мМ FeSO4·7H2O. Суспензию переносили в пробирку 10 объемом 10 мл и встряхивали при 34°С в течение 16 ч. Гидроксилирование аминокислоты наблюдали с использованием метода ТСХ (n-бутанол:уксусная кислота: вода = 2:1:1) с использованием нингидрина. Новое пятно наблюдали ниже L-Leu, что демонстрировало образование гидроксилированного L-Leu. Реакционную смесь центрифугировали при 8000 об/мин в течение 10 мин. Супернатант сгущали и использовали для хроматографии в силикагеле с использованием следующей системы растворителей (этилацетат:метанол: уксусная кислота: вода = 4:1:0.1:1). Элюированные фракции анализировали с использованием ТСХ, фракции, содержащие гидроксилированный L-Leu, собирали, сгущали, наносили на Amberlite 120 Н (объем - приблизительно 1 мл) и элюировали 1 н. NH4aq. Элюат собирали, сгущали и анализировали методами ЯМР и ESI-MS. Результаты показали, что очищенное соединение - 4-гидрокси-L-лейцин.
4-гидрокси-L-лейцин, 1Н NMR (в D2O) δ 1.33 (3Н, s) <δ1>, 1.34 (3Н, s) <δ2>, 1.93 (1Н, dd, J=15.3, 10.1 Hz) <β1>, 2.11 (1H, dd, J=15.3, 3.3 Hz) <β2>, 3.94 (1H, dd, J=10.1, 3.3 Hz) <α>, ESI-MS (наблюдавшийся) m/z=+148.1 [M+H], оценочная молекулярная масса 147.17.
6-3. Получение гидроксилированного L-норлейцина с использованием IDO.
Клетки Е.coli AG6772 собрали из 10 мл культуральной жидкости, как описано выше, и ресуспендировали в 2 мл реакционной среды, содержащей 100 мМ KPB (рН 7.0), 100 мМ L-норлейцина, 100 мМ α-кетоглутарата, 1 мМ аскорбата натрия, 10 мМ FeSO4·7H2O. Суспензию переносили в пробирку 10 объемом 10 мл и встряхивали при 34°С в течение 16 часов. Гидроксилирование аминокислоты наблюдали с использованием метода ТСХ (п-бутанол: уксусная кислота: вода = 2:1:1) с использованием нингидрина. Новое пятно наблюдали ниже L-норлейцина, что демонстрировало образование гидроксилированного L-норлейцина. Реакционную смесь центрифугировали при 8000 об/мин в течение 10 мин. Супернатант сгущали и использовали для хроматографии в силикагеле с использованием следующей системы растворителей (этилацетат:метанол: уксусная кислота: вода = 4:1:0.1:1). Элюированные фракции анализировали с использованием ТСХ, фракции, содержащие гидроксилированный L-норлейцин, собирали, сгущали, наносили на Amberlite 120 Н (объем - приблизительно 1 мл) и элюировали 1н. NH4aq. Элюат собирали, сгущали и анализировали методами ЯМР и ESI-MS. Результаты показали, что очищенное соединение - 4-гидрокси-L-норлейцин.
4-гидрокси-L-норлейцин, 1Н NMR (в D2O) δ 0.93 (3Н, t, J=7.5 Hz) <ε>, 1.45-1.60 (2Н, m) <δ>, 1.75 (1Н, ddd, J=15.0, 9.7, 9.0 Hz) <β1>, 2.16 (1H, ddd, J=15.0, 4.5, 3.0 Hz) <β2>, 3.79-3.86 (1H, m) <γ>, 3.82 (1H, dd, J=9.0, 4.5 Hz) <α>, ESI-MS (наблюдавшийся) m/z=+148.1 [M+H], оценочная молекулярная масса 147.17.
6-4. Получение L-метионинсульфоксида с использованием IDO.
Клетки Е.coli AG6772 собрали из 10 мл культуральной жидкости, как описано выше, и ресуспендировали в 2 мл реакционной среды, содержащей 100 мМ KPB (рН 7.0), 100 мМ L-норлейцина, 100 мМ α-кетоглутарата, 1 мМ аскорбата натрия, 10 мМ FeSO4·7H2O. Суспензию переносили в пробирку 10 объемом 10 мл и встряхивали при 34°С в течение 16 ч. Гидроксилирование аминокислоты наблюдали с использованием метода ТСХ (n-бутанол: уксусная кислота: вода = 2:1:1) с использованием нингидрина. Новое пятно наблюдали ниже L-Met, что демонстрировало образование окисленного или гидроксилированного L-Met. Реакционную смесь центрифугировали при 8000 об/мин в течение 10 мин. Супернатант сгущали и использовали для хроматографии в силикагеле с использованием следующей системы растворителей (этилацетат:метанол: уксусная кислота: вода = 4:1:0.1:1). Элюированные фракции анализировали с использованием ТСХ, фракции, содержащие гидроксилированный L-норлейцин, собирали, сгущали, наносили на Amberlite 120 Н (объем - приблизительно 1 мл) и элюировали 1 н. NH4aq. Элюат собирали, сгущали и анализировали методами ЯМР и ESI-MS. Результаты показали, что очищенное соединение является L-метионинсульфоксидом.
L-метионинсульфоксид, 1H NMR (в D2O) δ 2.31-2.36 (2H, m) <β>, 2.75 (3H, s) <ε>, 2.99-3.12 (2H, m) <γ>, 3.90 (1H, t, J=6.3) <α>, ESI-MS (наблюдавшийся) m/z=+166.1 [M+H], оценочная молекулярная масса 165.21.
Была установлена хиральность L-метионинсульфоксида, произведенного из L-Met L-изолейциндиоксигеназой штамма Bacillus thuringiensis 2e2. Реакцию окисления L-Met с использованием IDO проводили при 25°С в течение 2 часов с перемешиванием. Реакционная смесь содержала 20 мМ L-Met, 10 мМ аскорбата, 100 мМ α-кетоглутарата, 1 мМ FeSO4, 100 мМ KPB (рН 6.0), 20 мг/мл His-меченного IDO. Продукт ферментативной реакции подвергали дальнейшей дериватизации реагентом Marfey (1-флуоро-2,4-динитрофенил-5-L-аланинамид) согласно процедуре, описанной Joseph Т. Dever et al. (Drug Metabolism and Disposition 34, 2036-2043 (2006)), с последующим ВЭЖХ-анализом. Стандартная ВЭЖХ-хроматограмма рацемической смеси L-метионинсульфоксида, подвергнутого дериватизации реагентом Marfey, показана на Фиг.23. R-энантиомер и S-энантиомер могут быть разделены. Хроматограммы продуктов реакции с использованием IDO после обработки реагентом Marfey показаны на Фиг.24. В реакционной смеси был обнаружен только S-энантиомер L-метионинсульфоксида (примерно 19 мМ).
Пример 7. Определение L-Leu, гидроксилированного mfl-DO-B.
Исследование полученного гидроксилированного L-лейцина ЯМР и ESI-MS методами показало, что полученное очищенное соединение - 4-гидрокси-L-лейцин.
Пример 8. Определение L-Leu, гидроксилированного HT-gox-DO-B.
Исследование полученного гидроксилированного L-лейцина ЯМР и ESI-MS методами показало, что полученное очищенное соединение - 4-гидрокси-L-лейцин.
Пример 9. Определение L-Thr, гидроксилированного bpe-DO-B.
Полученный гидроксилированный L-Thr был далее очищен с использованием препаративной ТСХ (n-бутанол:уксусная кислота: вода = 2:1:1). Гидроксилированный L-Thr собрали, элюировали водой и лиофилизировали. Полученный ESI-MS (m/z=+166.1 [M+H], оценочная молекулярная масса 165.21) показал, что очищенное соединение - гидроксилированный L-Thr.
Пример 10. Определение L-Met, окисленного avi-DO-B.
Окисленный avi-DO-B L-Met был далее очищен с использованием препаративной ТСХ (n-бутанол:уксусная кислота: вода = 2:1:1). Окисленный L-Met собрали, элюировали водой и лиофилизировали. С помощью методов ЯМР и ESI-MS показано, что очищенное соединение является L-метионинсульфоксидом.
Пример 11. Определение L-Val, гидроксилированного HilA.
Гидроксилированный HilA L-Val был далее очищен с использованием препаративной ТСХ (n-бутанол:уксусная кислота: вода = 2:1:1). Гидроксилированный L-Val собрали, элюировали водой и лиофилизировали. С помощью методов ЯМР и ESI-MS показано, что очищенное соединение - 4-гидрокси-L-валин.
4-гидрокси-L-валин, 1Н ЯМР (в D2O) δ 0.92 (3Н, d, J=7.0 Hz) <A>, 2.22-2.33 (1H, m) <β>, 3.53-3.72 (3Н, m) <α,γ>, ESI-MS (наблюдавшийся) m/z=+134.1 [M+H], оценочная молекулярная масса 133.15.
Хотя указанное изобретение описано в деталях со ссылкой на Наилучший способ осуществления изобретения, для специалиста в указанной области техники очевидно, что могут быть совершены различные изменения и произведены эквивалентные замены, и такие изменения и замены не выходят за рамки настоящего изобретения. Каждому из упомянутых выше документов соответствует ссылка, и все цитируемые документы являются частью описания настоящего изобретения.
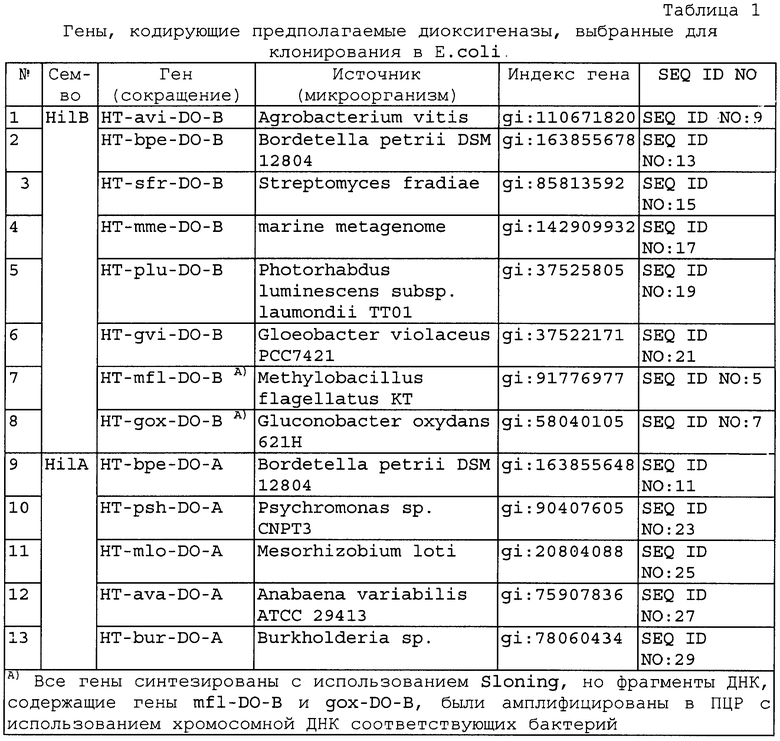
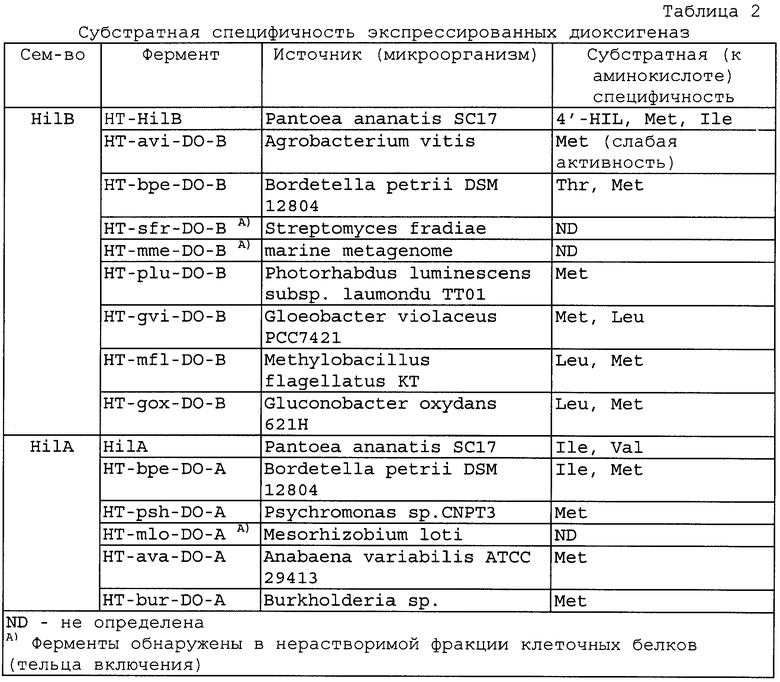


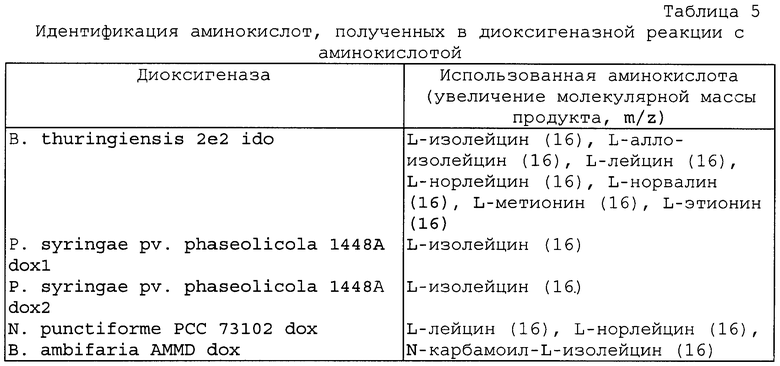
| название | год | авторы | номер документа |
|---|---|---|---|
| БАКТЕРИЯ - ПРОДУЦЕНТ ПРОДУКТА РЕАКЦИИ, КАТАЛИЗИРУЕМОЙ БЕЛКОМ, ОБЛАДАЮЩИМ АКТИВНОСТЬЮ 2-ОКСОГЛУТАРАТ-ЗАВИСИМОГО ФЕРМЕНТА, И СПОСОБ ПРОДУКЦИИ УКАЗАННОГО ПРОДУКТА | 2008 |
|
RU2444568C2 |
| СПОСОБ ПРОДУКЦИИ (2S,3R,4S)-4-ГИДРОКСИ-L-ИЗОЛЕЙЦИНА С ИСПОЛЬЗОВАНИЕМ БАКТЕРИИ, В КОТОРОЙ РАЗРУШЕНА АКТИВНОСТЬ 4-ГИДРОКСИ-L-ИЗОЛЕЙЦИНДЕГИДРОГЕНАЗЫ | 2007 |
|
RU2395578C2 |
| ДНК, КОДИРУЮЩАЯ ДИПЕПТИД-СИНТЕЗИРУЮЩИЙ ФЕРМЕНТ (ВАРИАНТЫ), БАКТЕРИЯ РОДА Escherichia И СПОСОБ ПОЛУЧЕНИЯ ДИПЕПТИДОВ С ЕЕ ИСПОЛЬЗОВАНИЕМ | 2013 |
|
RU2560980C2 |
| СПОСОБ КОНСТРУИРОВАНИЯ БАКТЕРИИ-ПРОДУЦЕНТА (2S,3R,4S)-4-ГИДРОКСИ-L-ИЗОЛЕЙЦИНА, БАКТЕРИЯ-ПРОДУЦЕНТ (2S,3R,4S)-4-ГИДРОКСИ-L-ИЗОЛЕЙЦИНА И СПОСОБ ПРОДУКЦИИ (2S,3R,4S)-ГИДРОКСИ-L-ИЗОЛЕЙЦИНА ИЛИ ЕГО СОЛИ | 2007 |
|
RU2395580C2 |
| СПОСОБ ПРОДУКЦИИ 2-АМИНО-3-МЕТИЛ-4-КЕТОПЕНТАНОАТА | 2007 |
|
RU2392323C2 |
| СПОСОБ ПОЛУЧЕНИЯ L-треонина С ИСПОЛЬЗОВАНИЕМ БАКТЕРИИ, ПРИНАДЛЕЖАЩЕЙ К РОДУ Escherichia | 2006 |
|
RU2351646C2 |
| СПОСОБ ПОЛУЧЕНИЯ L-АМИНОКИСЛОТ С ИСПОЛЬЗОВАНИЕМ БАКТЕРИИ СЕМЕЙСТВА ENTEROBACTERIACEAE | 2007 |
|
RU2364628C2 |
| СПОСОБ ПОЛУЧЕНИЯ L-АМИНОКИСЛОТЫ С ИСПОЛЬЗОВАНИЕМ БАКТЕРИИ СЕМЕЙСТВА Enterobacteriaceae, ОБЛАДАЮЩЕЙ ПОВЫШЕННОЙ ЭКСПРЕССИЕЙ ГЕНОВ КАСКАДА ОБРАЗОВАНИЯ ФЛАГЕЛЛ И КЛЕТОЧНОЙ ПОДВИЖНОСТИ | 2012 |
|
RU2508404C1 |
| СПОСОБ ПОЛУЧЕНИЯ L-ТРЕОНИНА С ИСПОЛЬЗОВАНИЕМ БАКТЕРИИ, ПРИНАДЛЕЖАЩЕЙ К РОДУ Escherichia, В КОТОРОЙ ИНАКТИВИРОВАН ГЕН yahN | 2007 |
|
RU2392322C2 |
| СПОСОБ ПОЛУЧЕНИЯ L-АМИНОКИСЛОТ С ИСПОЛЬЗОВАНИЕМ БАКТЕРИИ, ПРИНАДЛЕЖАЩЕЙ К РОДУ ESCHERICHIA | 2005 |
|
RU2311454C2 |

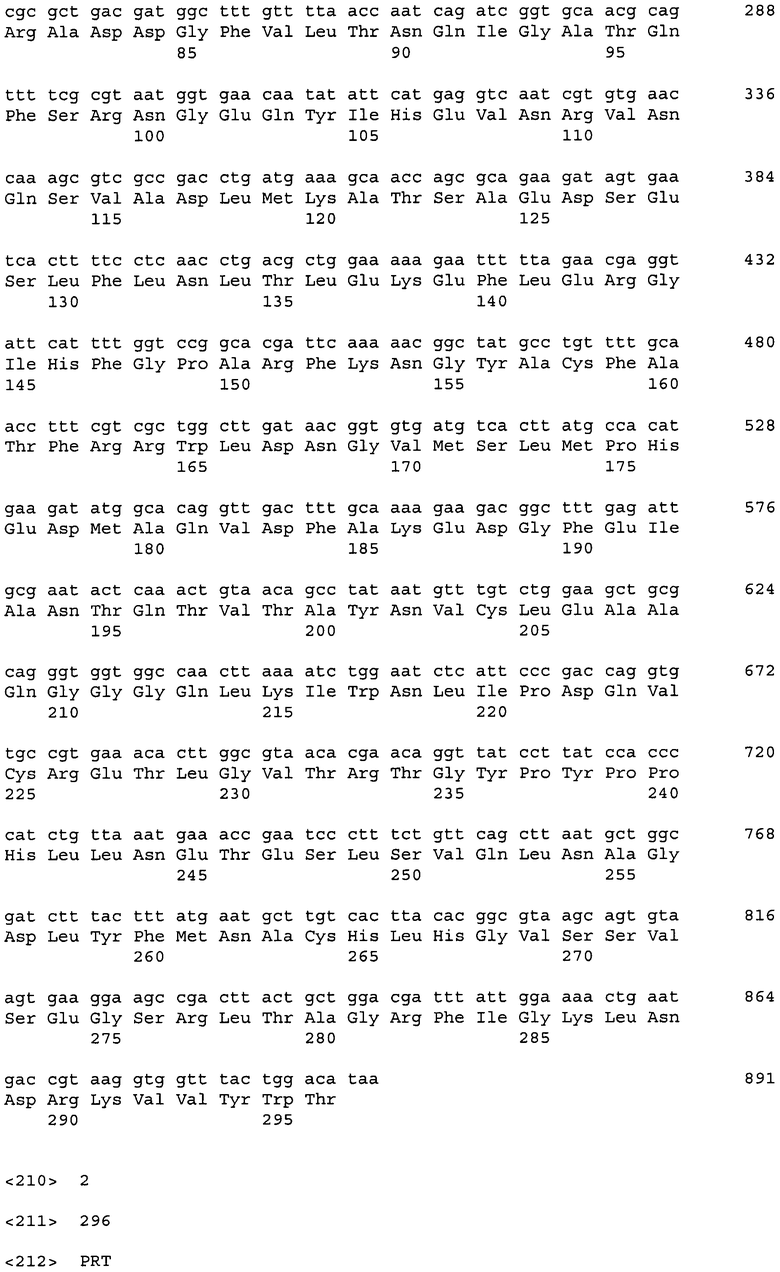







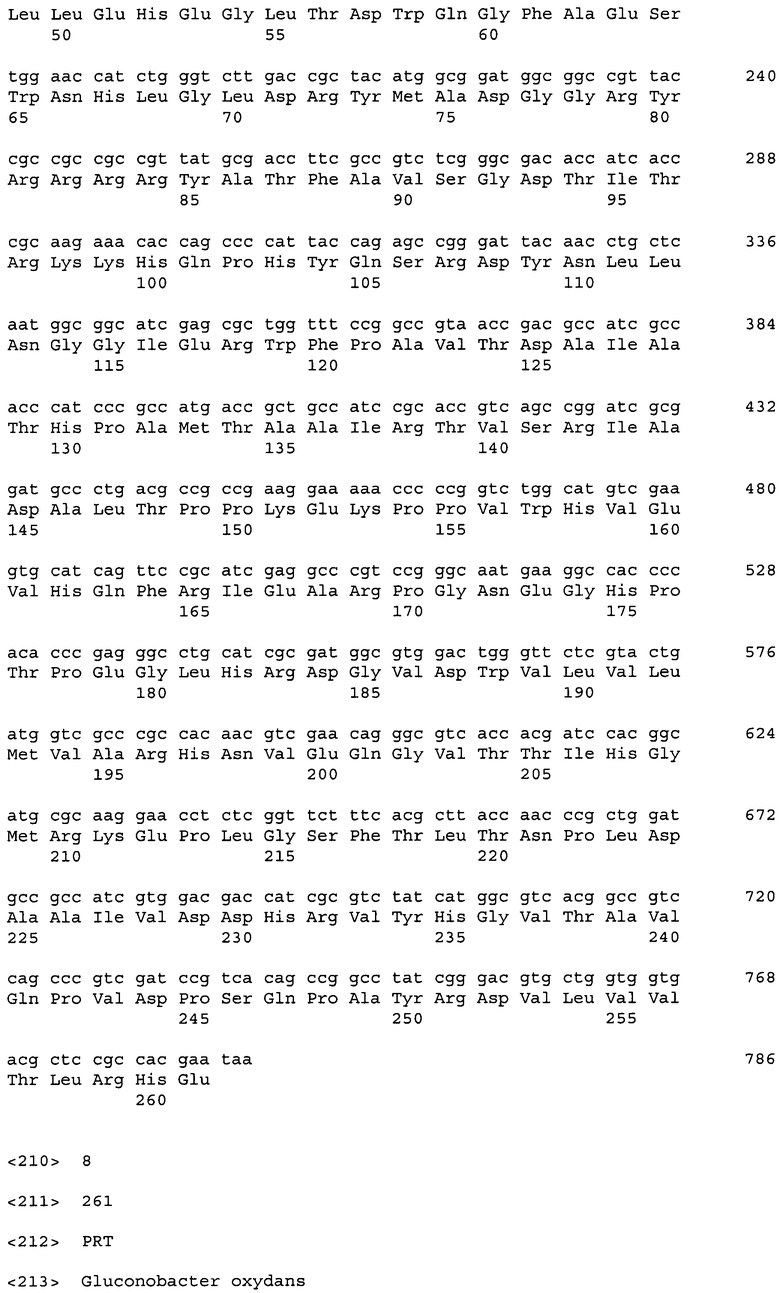




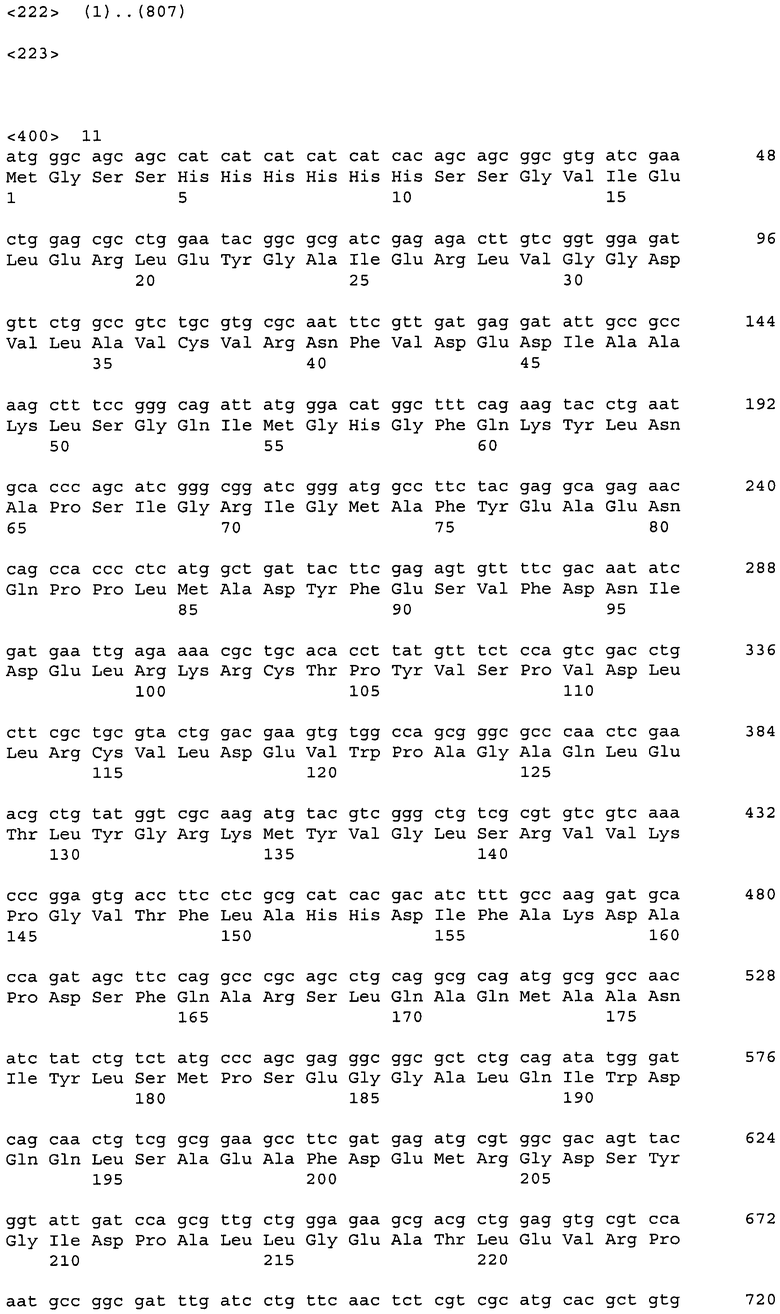









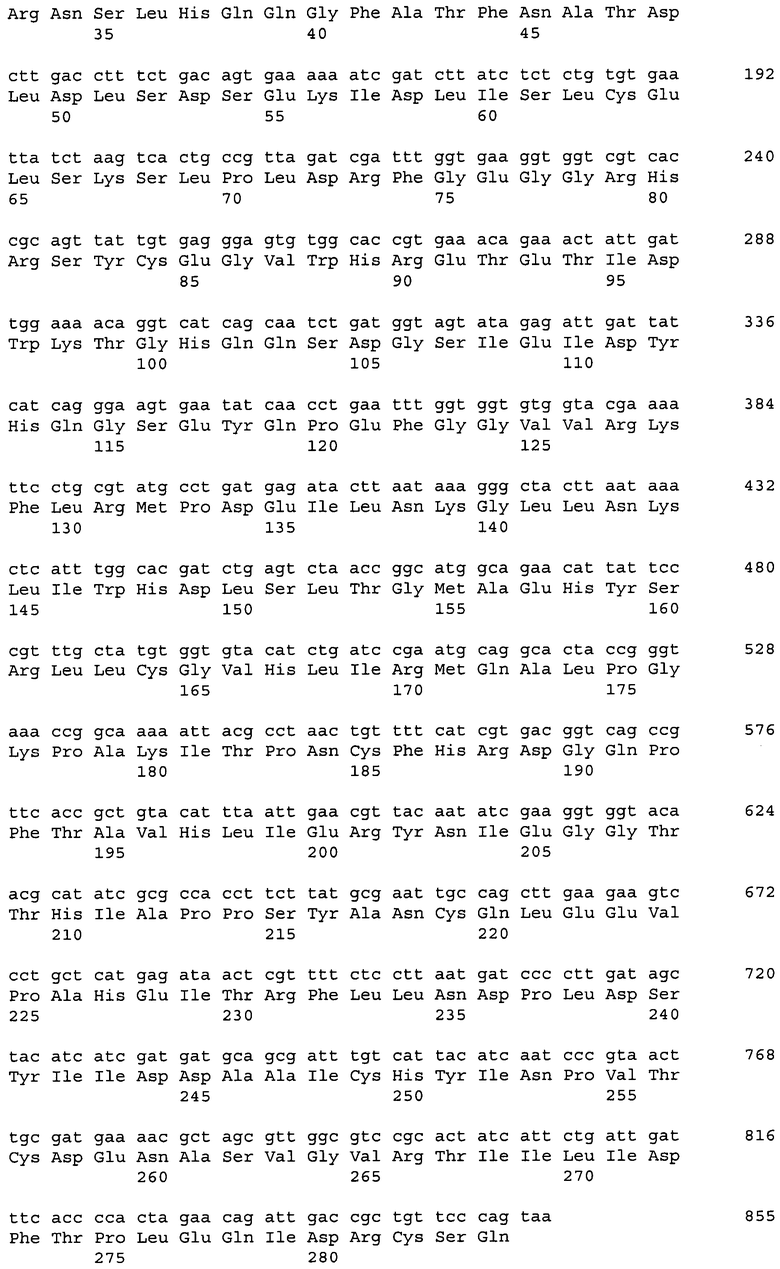










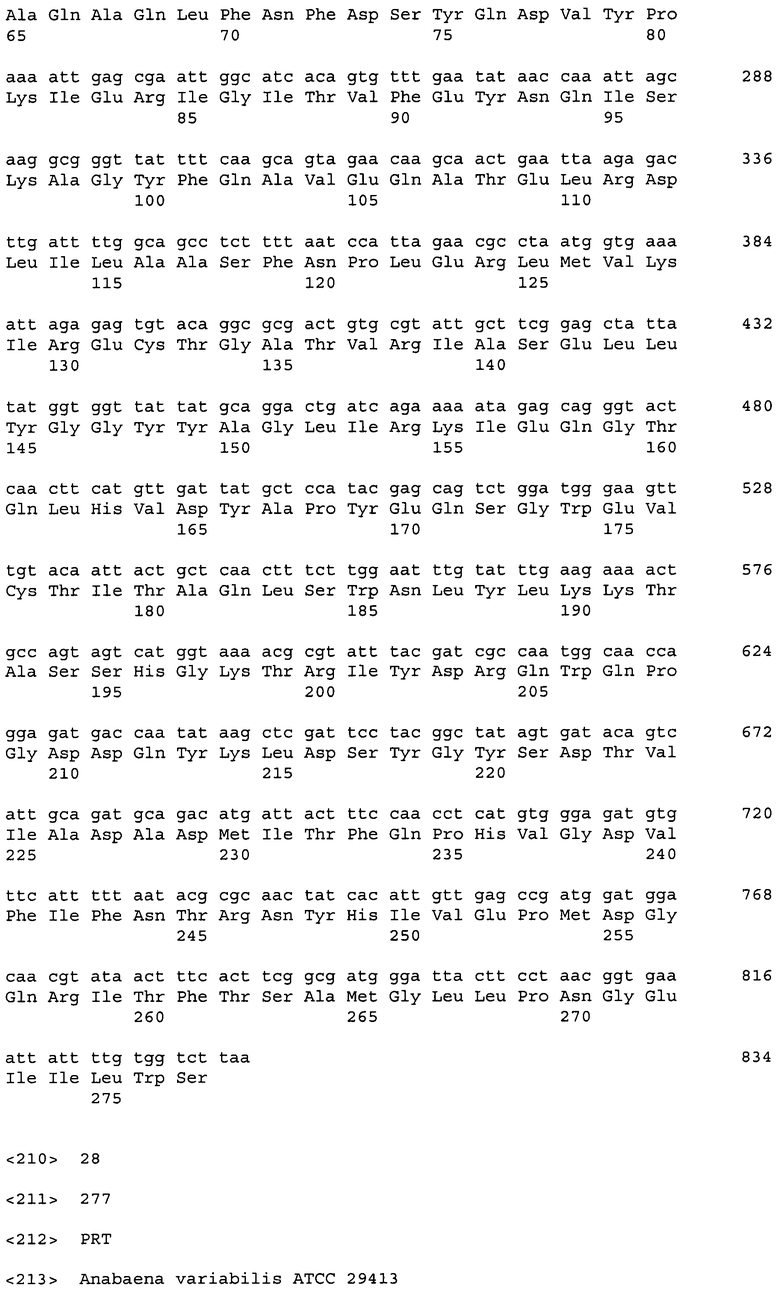
























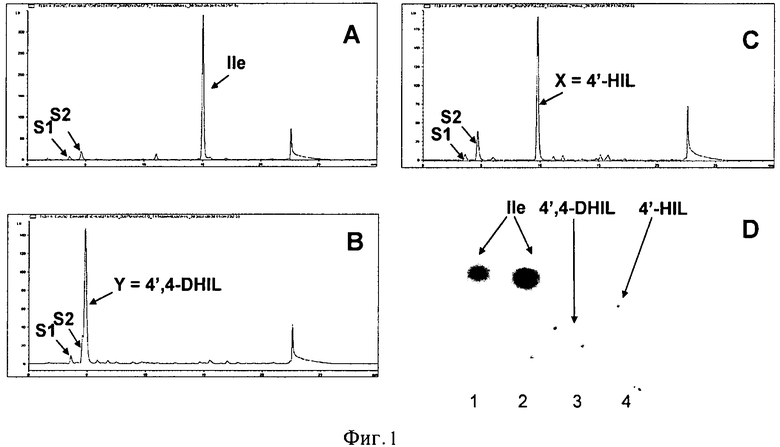
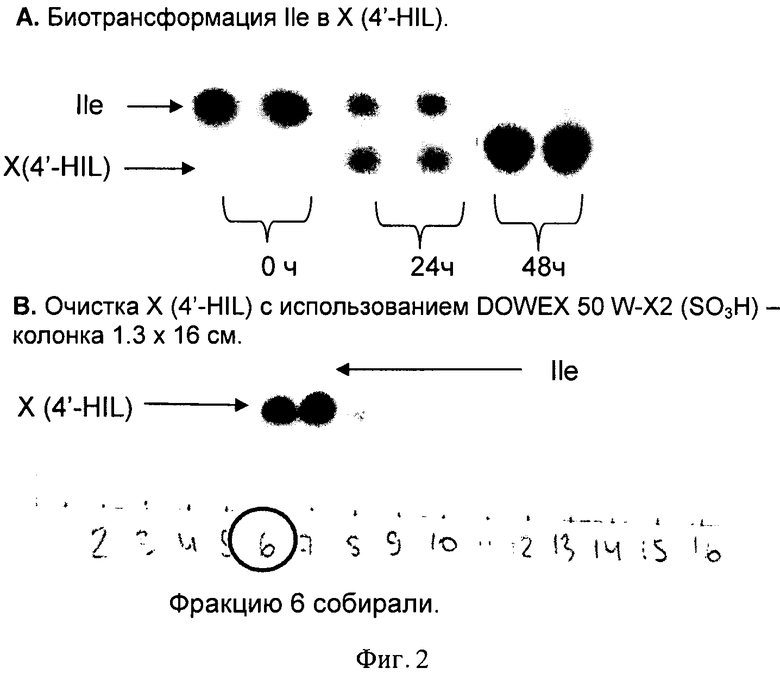
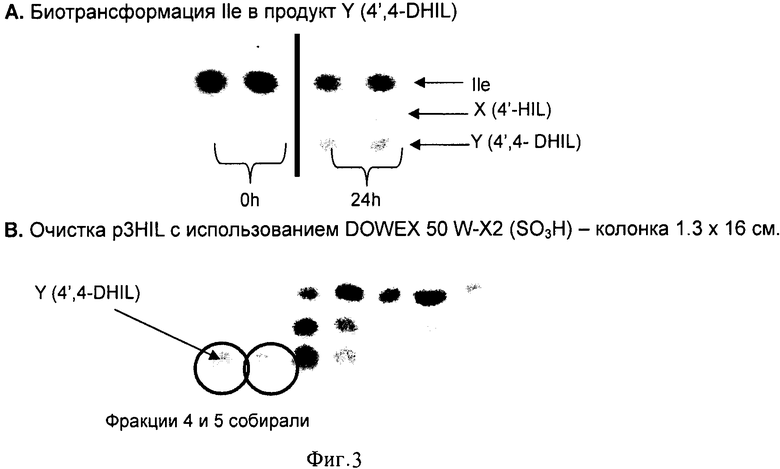
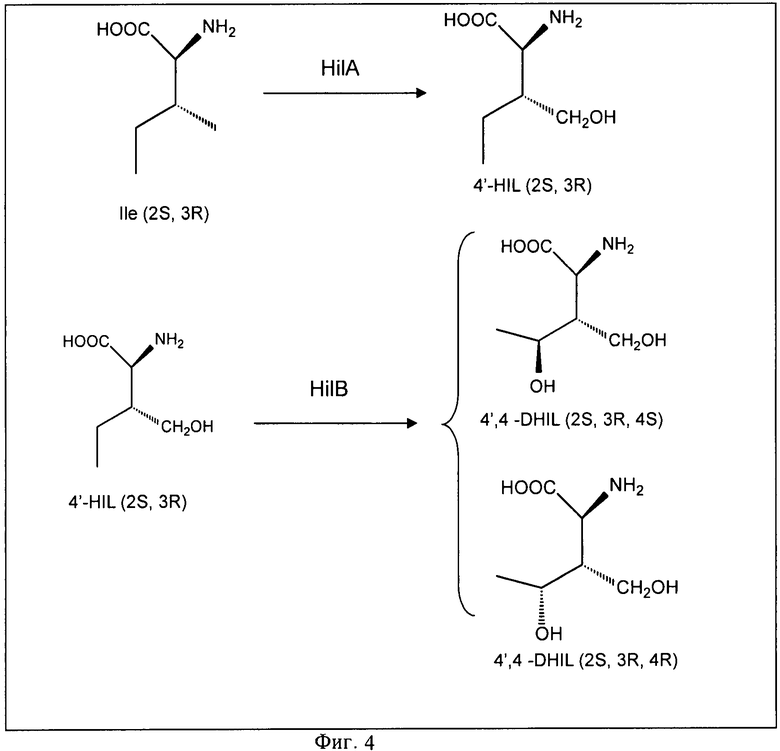
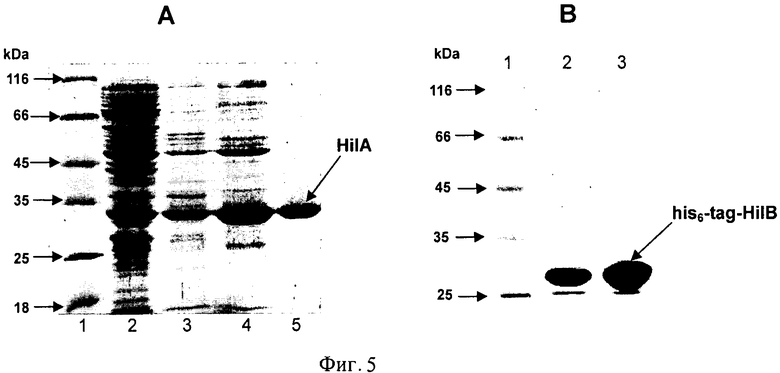



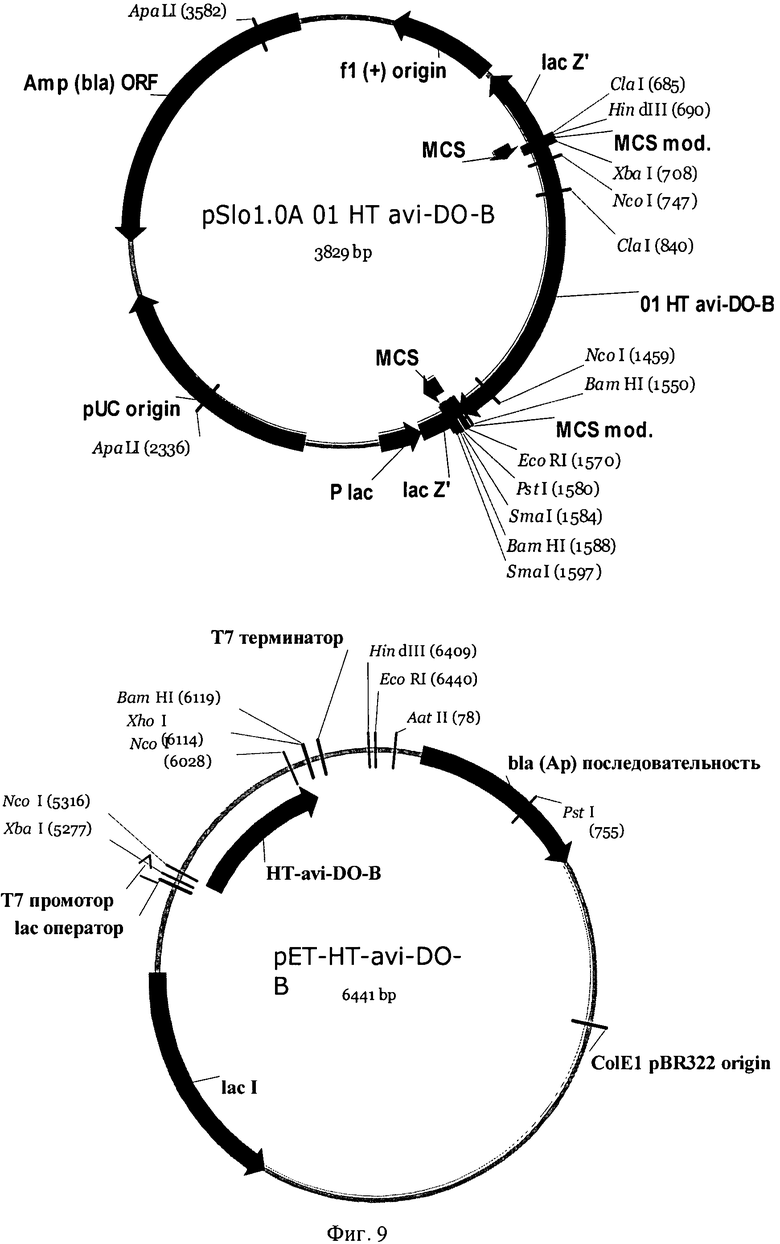
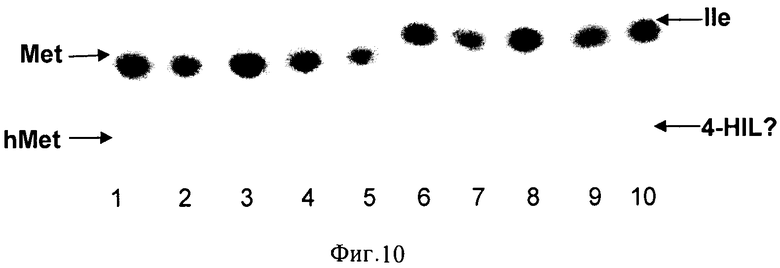
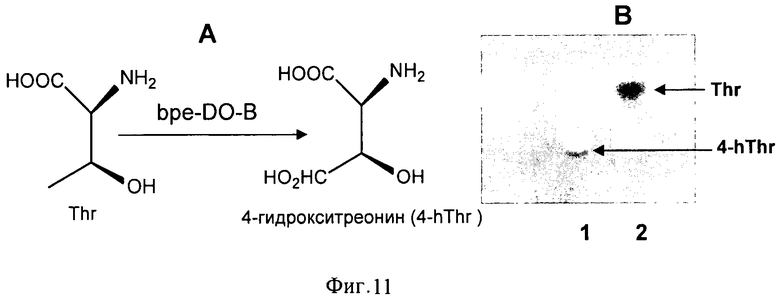
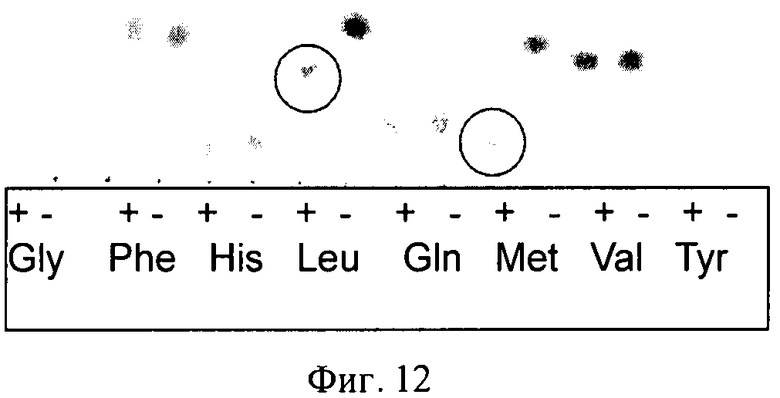
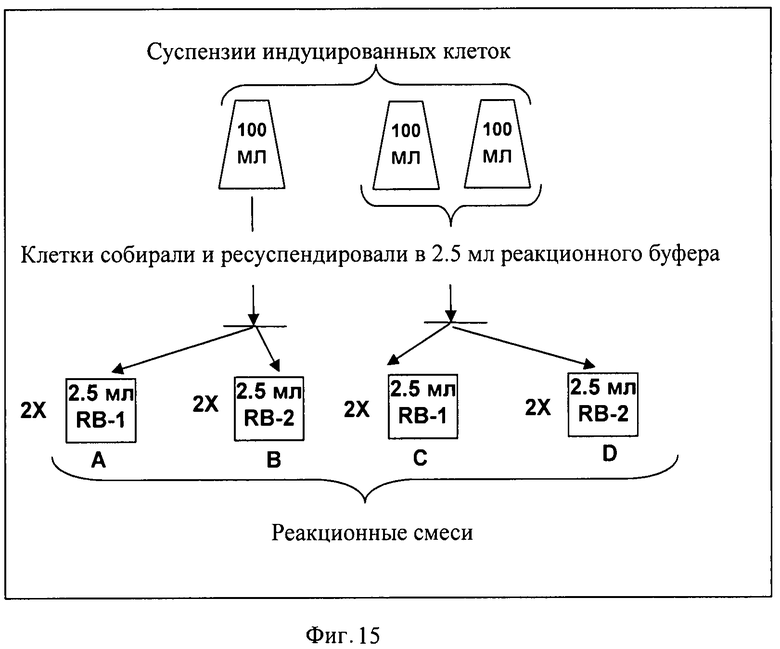
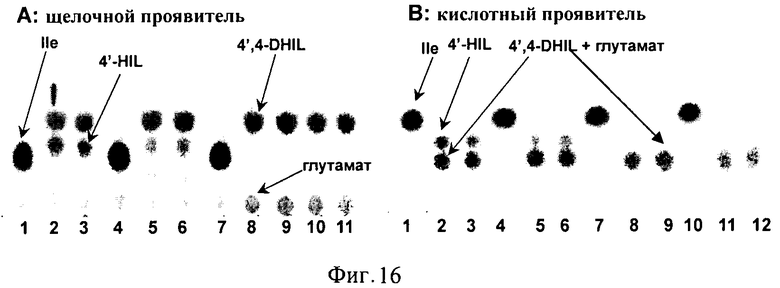
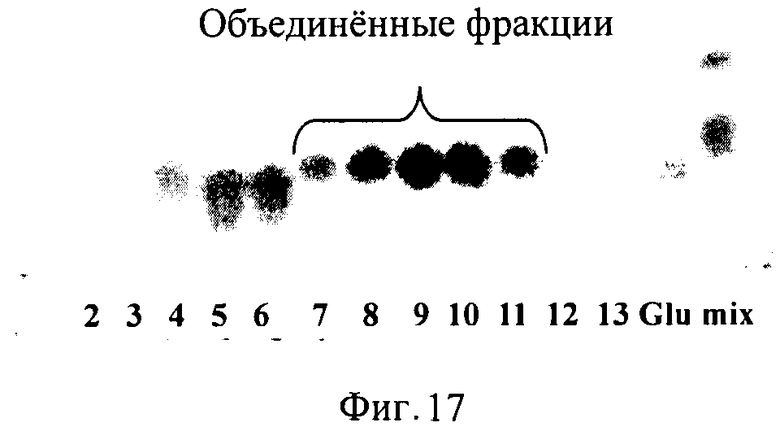

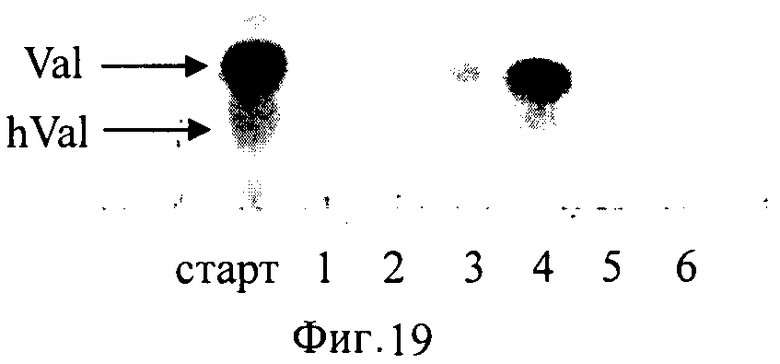
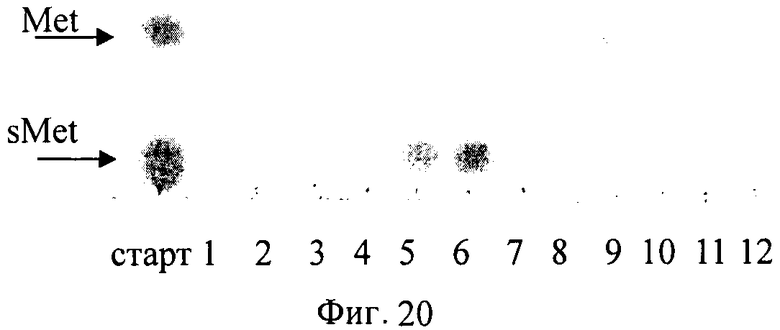
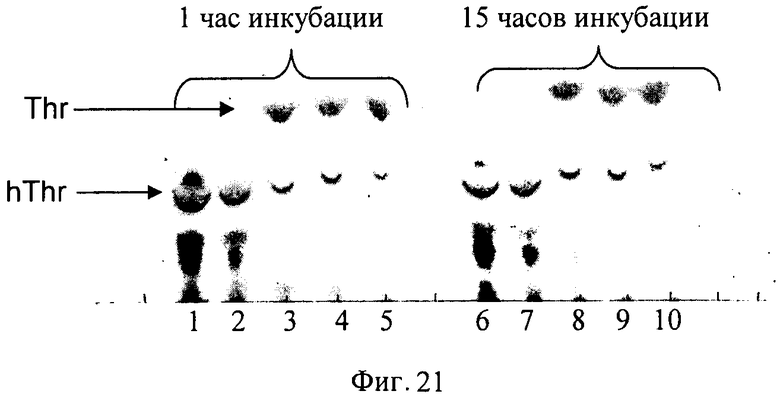
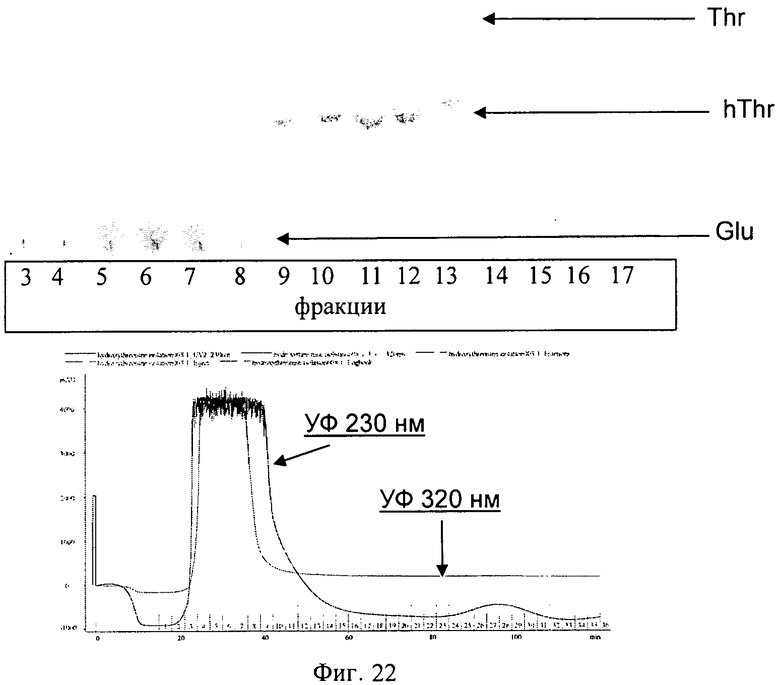
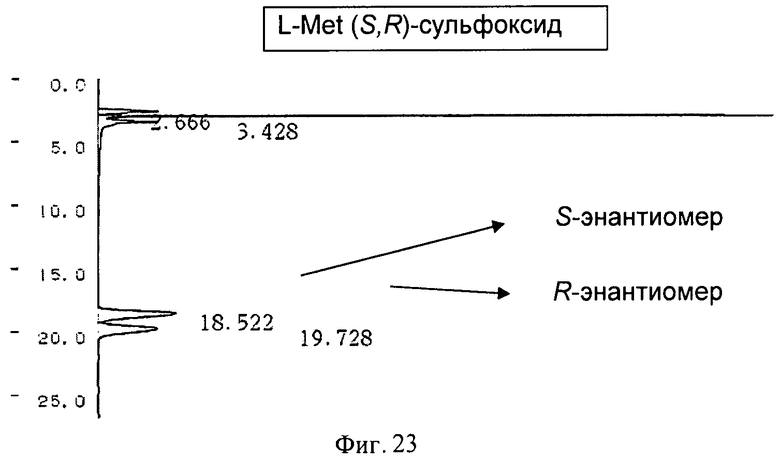
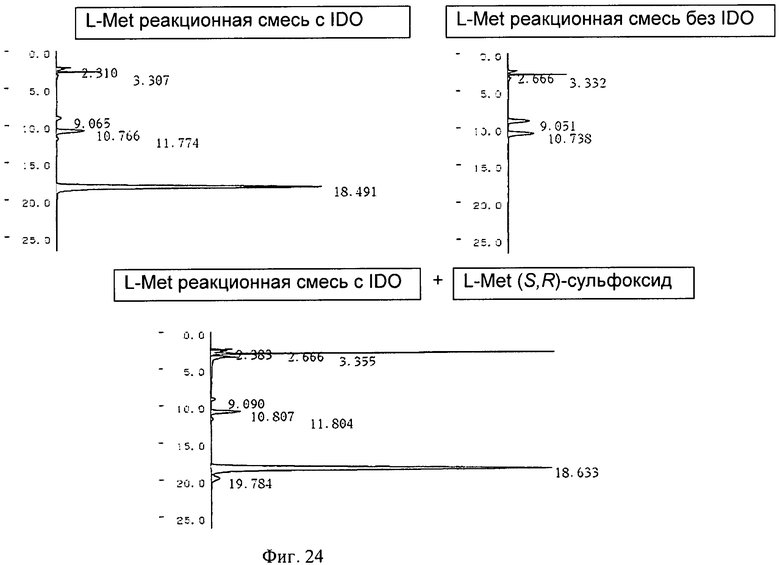
Изобретение относится к области биохимии. Представлен способ получения 4-гидрокси-L-лейцина или его соли методом ферментативной конверсии L-лейцина или его соли в присутствии бактериальной диоксигеназы, выбранной из группы, состоящей из диоксигеназ с аминокислотной последовательностью SEQ ID NO: 6, SEQ ID NO: 8, SEQ ID NO: 22, SEQ ID NO: 54, SEQ ID NO: 62 или их вариантов. Раскрыт способ получения 4-гидрокси-L-лейцина или его соли в содержащей L-лейцин или его соль среде в присутствии первой бактерии, трансформированной молекулой ДНК, кодирующей диоксигеназу, состоящей из диоксигеназ с аминокислотной последовательностью SEQ ID NO: 6, SEQ ID NO: 8, SEQ ID NO: 22, SEQ ID NO: 54, SEQ ID NO: 62 или их вариантов. Представлена бактерия-продуцент 4-гидрокси-L-лейцина или его соли, трансформированная молекулой ДНК, кодирующей бактериальную диоксигеназу, выбранную из группы, состоящей из диоксигеназ с аминокислотной последовательностью SEQ ID NO: 6, SEQ ID NO: 8, SEQ ID NO: 22, SEQ ID NO: 54, SEQ ID NO: 62 или их вариантов, в среде, содержащей L-лейцин или его соль. Изобретение позволяет получить 4-гидрокси-L-лейцин или его соль с высокой степенью эффективности. 3 н. и 6 з.п. ф-лы, 24 ил., 5 табл., 11 пр.
1. Способ получения 4-гидрокси-L-лейцина или его соли методом ферментативной конверсии L-лейцина или его соли в присутствии бактериальной диоксигеназы, выбранной из группы, состоящей из диоксигеназ с аминокислотной последовательностью SEQ ID NO: 6, SEQ ID NO: 8, SEQ ID NO: 22, SEQ ID NO: 54, SEQ ID.NO: 62 или их вариантов, содержащих делецию, вставку, добавление и/или замену одного или нескольких аминокислотных остатков и обладающих активностью диоксигеназы, способной конвертировать L-лейцин в 4-гидрокси-L-лейцин и представленной в SEQ ID NO: 6, SEQ ID NO: 8, SEQ ID NO: 22, SEQ ID NO: 54, SEQ ID NO: 62.
2. Способ получения 4-гидрокси-L-лейцина или его соли в содержащей L-лейцин или его соль среде в присутствии первой бактерии, трансформированной молекулой ДНК, кодирующей диоксигеназу, выделенную из второй бактерии и выбранную из группы, состоящей из диоксигеназ с аминокислотной последовательностью SEQ ID NO: 6, SEQ ID NO: 8, SEQ ID NO: 22, SEQ ID NO: 54, SEQ ID NO: 62 или их вариантов, содержащих делецию, вставку, добавление и/или замену одного или нескольких аминокислотных остатков и обладающих активностью диоксигеназы, способной конвертировать L-лейцин в 4-гидрокси-L-лейцин и представленной в SEQ ID NO: 6, SEQ ID NO: 8, SEQ ID NO: 22, SEQ ID NO: 54, SEQ ID NO: 62.
3. Способ по п.2, отличающийся тем, что первая бактерия, обладающая активностью бактериальной диоксигеназы, выбрана из группы бактерий, включающей роды Agrobacterium, Anabaena, Bacillus, Bordetella, Burkholderia, Escherichia, Gloeobacter, Gluconobacter, Mesorhizobium, Methylobacillus, Nostoc, Pantoea, Photorhabdus, Pseudomonas, Psychromonas и Streptomyces.
4. Способ по п.2, отличающийся тем, что первая бактерия, обладающая активностью бактериальной диоксигеназы, модифицирована таким образом, что активность бактериальной диоксигеназы повышена.
5. Способ по п.4, отличающийся тем, что активность бактериальной диоксигеназы повышена путем усиления экспрессии гена, кодирующего бактериальную диоксигеназу.
6. Способ по п.5, отличающийся тем, что экспрессия гена, кодирующего бактериальную диоксигеназу, усилена путем трансформации первой бактерии молекулой ДНК, кодирующей бактериальную диоксигеназу, способную конвертировать L-лейцин в 4-гидрокси-L-лейцин и выбранную из группы, состоящей из диоксигеназ с аминокислотной последовательностью SEQ ID NO: 6, SEQ ID NO: 8, SEQ ID NO: 22, SEQ ID NO: 54, SEQ ID NO: 62 или их вариантов, содержащих делецию, вставку, добавление и/или замену одного или нескольких аминокислотных остатков и обладающих активностью диоксигеназы, способной конвертировать L-лейцин в 4-гидрокси-L-лейцин и представленной в SEQ ID NO: 6, SEQ ID NO: 8, SEQ ID NO: 22, SEQ ID NO: 54, SEQ ID NO: 62.
7. Бактерия-продуцент 4-гидрокси-L-лейцина или его соли, трансформированная молекулой ДНК, кодирующей бактериальную диоксигеназу, выбранную из группы, состоящей из диоксигеназ с аминокислотной последовательностью SEQ ID NO: 6, SEQ ID NO: 8, SEQ ID NO: 22, SEQ ID NO: 54, SEQ ID NO: 62 или их вариантов, содержащих делецию, вставку, добавление и/или замену одного или нескольких аминокислотных остатков и обладающих активностью диоксигеназы, способной конвертировать L-лейцин в 4-гидрокси-L-лейцин и представленной в SEQ ID NO: 6, SEQ ID NO: 8, SEQ ID NO: 22, SEQ ID NO: 54, SEQ ID NO: 62, в среде, содержащей L-лейцин или его соль.
8. Бактерия по п.7, отличающаяся тем, что указанная бактерия принадлежит к группе, включающей роды Agrobacterium, Anabaena, Bacillus, Bordetella, Burkholderia, Escherichia, Gloeobacter, Gluconobacter, Mesorhizobium, Methylobacillus, Nostoc, Pantoea, Photorhabdus, Pseudomonas, Psychromonas и Streptomyces.
9. Бактерия по п.7, отличающаяся тем, что указанная бактериальная диоксигеназа выделена из другой бактерии и выбрана из группы, состоящей из диоксигеназ с аминокислотной последовательностью SEQ ID NO: 6, SEQ ID NO: 8, SEQ ID NO: 22, SEQ ID NO: 54, SEQ ID NO: 62 или их вариантов, содержащих делецию, вставку, добавление и/или замену одного или нескольких аминокислотных остатков и обладающих активностью диоксигеназы, способной конвертировать L-лейцин в 4-гидрокси-L-лейцин и представленной в SEQ ID NO: 6, SEQ ID NO: 8, SEQ ID NO: 22, SEQ ID NO: 54, SEQ ID NO: 62.
| WO 2008044614 A1, 17.04.2008 | |||
| HAEFELE С et al., Characterization of a dioxygenase from Trigonella foenum-graecum involved in 4-hydroxyisoleucine biosynthesis, Phytochemistry, 1997, 44(4), p.p.563-566 | |||
| JADOT J et al., Separation and characterization of a hydroxyleucine from Deutzia gracilis, Biochim Biophys Acta, 1961, 1;48, p.p.400-402 | |||
| ФИЛИППОВИЧ Ю.Б | |||
| Основы биохимии | |||
| - М.: Высшая школа, 1969, с.256-265. |
Авторы
Даты
2012-11-27—Публикация
2011-11-03—Подача