Область техники
Настоящее изобретение относится к микробиологической промышленности, и в частности к способу получения продукта реакции, катализируемой белком, обладающим активностью 2-оксоглутарат-зависимого фермента, такого как 4-гидрокси-L-изолейцин или его соль, с использованием бактерии, трансформированной фрагментом ДНК, содержащим ген, кодирующий белок, обладающий активностью 2-оксоглутарат-зависимого фермента, так же как и L-изолейциндиоксигеназной активностью. Данная бактерия также модифицирована для усиления экспрессии гена, кодирующего транспортер L-изолейцина, и обладает способностью к продукции (2S,3R,4S)-4-гидрокси-L-изолейцина.
Описание предшествующего уровня техники
4-Гидрокси-L-изолейцин является аминокислотой, которая может быть экстрагирована и очищена из семян пажитника греческого (Trigonella foenum-graecum L.leguminosae). Препарат 4-гидроксиизолейцина проявляет инсулинотропную активность, что вызывает большой интерес, поскольку этот стимулирующий эффект явно зависит от концентрации глюкозы в плазме. Этот эффект показан как на модели изолированных перфузионных поджелудочных желез крыс, так и в кусочках ткани поджелудочных желез человека (Sauvaire, Y. et al, Diabetes, 47: 206-210 (1998)). Такая зависимость инсулинотропного эффекта от концентрации глюкозы не подтверждается в случае с сульфонилмочевиной (Drucker, D.J., Diabetes 47: 159-169 (1998)), единственным инсулинотропным препаратом, используемым в настоящее время для лечения диабета типа II [не инсулинзависимого диабета (NIDD) или (NIDDM)], и, как следствие, гипогликемия остается основным нежелательным побочным эффектом лечения сульфонилмочевиной (Jackson, J., and Bessler, R. Drugs, 22: 211-245; 295-320 (1981); Jennings, A. et al. Diabetes Care, 12: 203-208 (1989)). Известно также свойство 4-гидроксиизолейцина повышать толерантность организма к глюкозе (Am. J. Physiol. Endocrinol., Vol.287, E463-E471, 2004). Способность 4-гидроксиизолейцина ускорять метаболизм глюкозы и потенциальная возможность его применения в качестве лекарственного средства и компонента функционального питания были раскрыты в выложенной патентной заявке Японии No. Hei 6-157302 и в патентной заявке США US 2007-000463 A1.
4-Гидрокси-L-изолейцин обнаружен только в растениях и благодаря его специфической инсулинотропной активности может рассматриваться в качестве нового стимулятора секреции с потенциальным применением для лечения диабета II типа, т.к. это заболевание характеризуется недостаточной секрецией инсулина, связанной с различной степенью устойчивости к инсулину (Broca, С. et al, Am. J. Physiol. 277 (Endocrinol. Metab. 40): E617-E623 (1999)).
Метод окисления изолейцина кислородом воздуха в присутствии железа, аскорбиновой кислоты и 2-оксоглутаровой кислоты с использованием диоксигеназной активности экстракта пажитника греческого был предложен в качестве способа получения 4-гидрокси-L-изолейцина (Phytochemistry, Vol.44, No.4, pp.563-566,1997). Однако этот способ не пригоден для промышленного получения 4-гидроксиизолейцина, так как активность фермента ингибируется субстратом при концентрациях изолейцина от 20 мМ и выше, к тому же фермент до сих пор не идентифицирован, его получают из экстрактов растений в небольших количествах и активность его быстро падает.
К настоящему времени описан эффективный способ синтеза оптически чистого (2S,3R,4S)-4-гидроксиизолейцина с общим выходом 39%, состоящий из восьми стадий. Ключевая стадия этого процесса синтеза включает в себя биотрансформацию этил-2-метилацетоацетата в этил-(2S,3S)-2-метил-3-гидроксибутаноат с помощью Geotrichum candidum и асимметрического синтеза Штрекера (Wang, Q. et al, Eur. J. Org. Chem., 834-839 (2002)).
Также описан короткий шестистадийный ферментохимический способ синтеза (2S,3R,4S)-4-гидроксиизолейцина с общим контролем стереохимии, последней стадией которого является ферментативное разложение путем гидролиза производного N-фенилацетиллактона с использованием коммерчески доступной пенциллинацилазы G, иммобилизованной на Eupergit C(E-PAC) (Rolland-Fulcrand, V. et al, J. Org. Chem., 873-877 (2004)).
Однако в настоящее время отсутствуют сообщения о продукции (2S,3R,4S)-4-гидрокси-L-изолейцина с использованием бактерии, трансформированной фрагментом ДНК, содержащим ген, кодирующий белок с L-изолейциндиоксигеназной активностью; при этом бактерия также модифицирована с целью усиления экспрессии гена, кодирующего транспортер L-изолейцина; и обладает способностью к продукции (2S,3R,4S)-4-гидрокси-L-изолейцина.
Кроме того, (2S,3R,4S)-4-гидрокси-L-изолейцин, являющийся продуктом реакции, катализируемой белком, обладающим активностью 2-оксоглутарат-зависимого фермента, а также важным промышленным продуктом, был известен. Однако не было сообщений об эффективных способах получения и других продуктов с помощью белков, обладающих активностью 2-оксоглутарат-зависимого фермента.
Описание изобретения
Аспектом данного изобретения является увеличение продукции продукта реакции, сопряженного с образованием сукцината из 2-оксоглутарата под действием белка, обладающего активностью 2-оксоглутарат-зависимого фермента. К такому продукту относятся соединения как в свободной форме, так и их соли. Другим аспектом настоящего изобретения является предоставление промышленного способа получения продукта, сопряженного с образованием сукцината из 2-оксоглутарата с помощью бактерии, имеющей активность 2-оксоглутарат-зависимого фермента. Эта бактерия была модифицирована таким образом, что экспрессии гена, кодирующего оксоглутаратдегидрогеназу, ослаблены, предпочтительно модифицирована таким образом, что экспрессии генов, кодирующих оксоглутаратдегидрогеназу и изоцитратлиазу, ослаблены, более предпочтительно модифицирована таким образом, что экспрессии генов, кодирующих оксоглутаратдегидрогеназу, изоцитратлиазу и фосфатазу изоцитратдедгидрогеназы, ослаблены.
Другим аспектом настоящего изобретения является предоставление способа получения 4-гидроксиизолейцина, включая как его свободную форму, так и его соли. Данное соединение может также упоминаться как "(2S,3R,4S)-4HIL". Другим аспектом настоящего изобретения является предоставление способа продукции (2S,3R,4S)-4-гидрокси-L-изолейцина или его соли путем прямого энзиматического гидроксилирования L-изолейцина с использованием бактерии с L-изолейциндиоксигеназной активностью. В этой бактерии также осуществляется сверхэкспрессия гена, кодирующего транспортер L-изолейцина, и бактерия способна к продукции (2S,3R,4S)-4-гидрокси-L-изолейцина.
Ранее из природного источника выделена бактерия с высоким уровнем L-изолейциндиоксигеназной активности и клонирован ген, кодирующий L-изолейциндиоксигеназу. Обнаружено, что L-изолейциндиоксигеназу можно использовать для синтеза (2S,3R,4S)-4-гидрокси-L-изолейцина.
Другой аспект настоящего изобретения включает предоставление способа для увеличения продукции (2S,3R,4S)-4-гидрокси-L-изолейцина с использованием бактерии с активностью L-изолейциндиоксигеназы. Вышеуказанная цель была достигнута обнаружением того факта, что бактерия с активностью L-изолейциндиоксигеназы продуцирует больше (2S,3R,4S)-4-гидрокси-L-изолейцина в случае, если бактерия модифицирована таким образом, что экспрессия гена, кодирующего транспортер L-изолейцина, усилена.
Целью настоящего изобретения является предоставление бактерии, трансформированной фрагментом ДНК, содержащим ген, кодирующий белок с L-активностью изолейциндиоксигеназы, отличающейся тем, что указанная бактерия модифицирована таким образом, что экспрессия гена, кодирующего транспортер L-изолейцина, усилена и указанная бактерия обладает способностью к продукции (2S,3R,4S)-4-гидрокси-L-изолейцина.
Также целью настоящего изобретения является предоставление описанной выше бактерии - продуцента (2S,3R,4S)-4HIL, при этом ген, кодирующий белок с L-изолейциндиогсигеназной активностью, выбран из группы, состоящей из:
(a) ДНК, включающей нуклеотидную последовательность, приведенную в Перечне последовательностей под номером 1 (SEQ ID No: 1);
(b) ДНК, гибридизующейся в жестких условиях с ДНК, включающей нуклеотидную последовательность, комплементарную нуклеотидной последовательности, приведенной в Перечне последовательностей под номером 1 (SEQ ID No: 1), при этом указанная ДНК кодирует белок с L-изолейциндиоксигеназной активностью;
(c) ДНК, включающей нуклеотидную последовательность, кодирующую белок, включающий аминокислотную последовательность, приведенную в Перечне последовательностей под номером 2 (SEQ ID No: 2);
(d) ДНК, включающей нуклеотидную последовательность, кодирующую белок, включающий аминокислотную последовательность, приведенную в Перечне последовательностей под номером 2 (SEQ ID No: 2), за исключением того, что указанная аминокислотная последовательность содержит замену, делецию, вставку, добавление или инверсию одного или нескольких аминокислотных остатков и при этом указанный белок имеет L-изолейциндиоксигеназную активность; и
(e) ДНК, включающей нуклеотидную последовательность, кодирующую белок, включающий аминокислотную последовательность, гомологичную по крайней мере на 98% аминокислотной последовательности, приведенной в Перечне последовательностей под номером 2 (SEQ ID No: 2), при этом указанный белок имеет L-изолейциндиоксигеназную активность.
Также целью настоящего изобретения является предоставление описанной выше бактерии - продуцента (2S,3R,4S)-4HIL, при этом бактерия модифицирована таким образом, что активность L-изолейциндиоксигеназы увеличена.
Также целью настоящего изобретения является предоставление описанной выше бактерии - продуцента (2S,3R,4S)-4HIL, при этом активность L-изолейциндиоксигеназы увеличена за счет усиления экспрессии гена, кодирующего L-изолейциндиоксигеназу.
Также целью настоящего изобретения является предоставление описанной выше бактерии - продуцента (2S,3R,4S)-4HIL, при этом экспрессия L-изолейциндиоксигеназы усилена путем модификации последовательности, контролирующей экспрессию гена, кодирующего L-изолейциндиоксигеназу, или путем увеличения числа копий гена, кодирующего L-изолейциндиоксигеназу.
Также целью настоящего изобретения является предоставление описанной выше бактерии - продуцента (2S,3R,4S)-4HIL, при этом геном, кодирующим транспортер L-изолейцина, является ген brnQ из Escherichia coli.
Также целью настоящего изобретения является предоставление описанной выше бактерии - продуцента (2S,3R,4S)-4HIL, при этом бактерия дополнительно модифицирована с целью ослабления экспрессии генов, кодирующих оксоглутаратдегидрогеназу, изоцитратлиазу и фосфатазу изоцитратдегидрогеназы.
Также целью настоящего изобретения является предоставление описанной выше бактерии, при этом указанная экспрессия ослаблена путем инактивации указанных генов.
Также целью настоящего изобретения является предоставление описанной выше бактерии, при этом бактерия дополнительно модифицирована с целью ослабления экспрессии гена, кодирующего аминотрансферазу аминокислот с разветвленной цепью.
Также целью настоящего изобретения является предоставление описанной выше бактерии, при этом указанная экспрессия ослаблена путем инактивации указанного гена.
Также целью настоящего изобретения является предоставление описанной выше бактерии, при этом бактерия принадлежит к роду, выбранному из группы, состоящей из Escherichia, Pseudomonas, Corynebacterium, Arthrobacter, Aspergillus и Bacillus.
Также целью настоящего изобретения является предоставление описанной выше бактерии, при этом бактерия выбрана из группы, состоящей из Escherichia coli, Arthrobacter simplex, Corynebacterium glutamicum, Arthrobacter globiformis, Arthrobacter sulfureus, Arthrobacter viscosus и Bacillus subtilis.
Также целью настоящего изобретения является предоставление способа продукции (2S,3R,4S)-4-гидрокси-L-изолейцина или его соли, включающего:
культивирование описанной выше бактерии - продуцента (2S,3R,4S)-4HIL в питательной среде, содержащей L-изолейцин; и
выделение (2S,3R,4S)-4-гидрокси-L-изолейцина.
Также целью настоящего изобретения является предоставление описанного выше способа, при этом питательная среда содержит источник углерода, выбранный из группы, состоящей из углевода и спирта.
Также целью настоящего изобретения является предоставление описанного выше способа, при этом указанным углеводом является глюкоза, а указанным спиртом - глицерин.
Другим аспектом настоящего изобретения является предоставление способа получения 4-гидрокси-L-пролина, включая как его свободную форму, так и его соли. Другим аспектом настоящего изобретения является предоставление способа продукции 4-гидрокси-L-пролина или его соли путем прямого ферментативного гидроксилирования L-пролина с использованием бактерии с L-пролингидроксилазной активностью.
Настоящее изобретение детально описано ниже.
КРАТКОЕ ОПИСАНИЕ РИСУНКОВ
На Фигуре 1 показано 'шунтирование' цикла трикарбоновых кислот в штамме MG1655 (ΔsucAB, ΔaceAK, PL-brnQ)_[pELAC-IDO(Lys, 23)] благодаря окислению изолейцина и α-кетоглутарата (2-оксоглутарата).
На Фигуре 2 показана схема рекомбинантной плазмиды pET-IlvA.
На Фигуре 3 показана схема рекомбинантной плазмиды pELAC-IDO(Lys, 23).
На Фигуре 4 показано конструирование штамма Е.coli MG1655(PL-brnQ).
На Фигуре 5 показан рост штаммов MG1655 и MG1655 (ΔsucAB, ΔaceAK, PL-brnQ) на синтетической среде М9, содержащей глюкозу или глицерин с добавлением или без добавления лизина, метионина и диаминопимелата (DAP-diaminopimelate). Штаммы выращивали на синтетической среде М9 с добавлением глюкозы или глицерина, а также лизина, метионина и диаминопимелата (DAP). Сокращения: Штаммы WT = MG1655; 2d = MG1655 (ΔsucAB, ΔaceAK, PL-brnQ); Среда: А = М9 + глюкоза; В = М9 + глюкоза + (Lys, Met, DAP); С = М9 + глицерин; D = М9 + глицерин + (Lys, Met, DAP).
На Фигуре 6 показан рост штаммов MG1655 [pELAC-IDO(Lys, 23)] и MG1655 (ΔsucAB, ΔaceAK, PL-brnQ) [pELAC-IDO(Lys, 23)] на синтетической среде М9 с добавлением или без добавления L-изолейцина. Сокращения: Штаммы 1 = MG1655[pELAC-IDO(Lys, 23)]; 2 = MG1655 (ΔsucAB, ΔaceAK, PL-brnQ) [pELAC-IDO(Lys, 23)]; Среда: G = М9 + глюкоза (137 мМ); GI = М9 + глюкоза (137 мМ) + L-изолейцин (137 мМ); Y = М9 + глицерин (136 мМ); YI = М9 + глицерин (136 мМ) + L-изолейцин (137 мМ).
НАИЛУЧШИЙ СПОСОБ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
1. Бактерия согласно настоящему изобретению
Термин "бактерия", как он употребляется в настоящем описании, включает бактерию, продуцирующую фермент, мутант и генетический рекомбинант такой бактерии, в которой имеется или увеличена целевая ферментативная активность, и т.п.
Термин «активность 2-оксоглутарат-зависимого фермента», как он употребляется в настоящем описании, обозначает ферментативную активность, способную катализировать реакцию образования сукцината из 2-оксоглутарата.
Многие белки имеют активность 2-оксоглутарат-зависимого фермента, так же как и 2-оксоглутарат-зависимые диоксигеназы, что сообщалось ранее. Следующие примеры, включающие диоксигеназы, способные к продукции нужных продуктов, таких как Pro гидроксилаза, превращающая L-Pro в гидрокси-Pro (APPLIED AND ENVIRONMENTAL MICROBIOLOGY, Sept. 1999, p.4028-4031), γ-бутиробетаин гидроксилаза, превращающая γ-бутиробетаин в L-карнитин (WO 2005/083089). Кроме того, это диоксигеназы, о многих из которых уже сообщалось. Например, ссылка на: Critical Reviews in Biochemistry and Molecular Biology, 39: 21-68, 2004, and NATURE CHEMICAL BIOLOGY, 4 NUMBER 3 MARCH: 152-156, 2008. Что касается 2-оксоглутарт-зависимых диоксигеназ, описанных в обзорах, бактерия была модифицирована таким образом, что экспрессия гена, кодирующего оксоглутаратдегидрогеназу (такой как ΔsucAB, ΔsucA, ΔsucB), ослаблена; предпочтительно модифицирована таким образом, что экспрессии генов, кодирующих оксоглутаратдегидрогеназу и изоцитратлиазу (такие как (ΔsucAB, ΔsucA, или ΔsucB) плюс ΔaceA), ослаблены; более предпочтительно модифицирована таким образом, что экспрессии генов, кодирующих оксоглутаратдегидрогеназу, изоцитратлиазу и фосфатазу изоцитратдегидрогеназы (такие как (ΔsucAB, ΔsucA или ΔsucB) плюс ΔaceAK), ослаблены, которые представлены в Е.coli штаммом MG1655 (ΔsucAB, ΔaceAK), которые описаны в нижеупомянутых примерах, являются подходящими клетками-хозяевами, эффективно использующими 2-оксоглутарат, продуцирующий на средах, содержащих углерод в виде D-глюкозы, в 2-оксоглутарат-зависимых ферментативных реакциях.
Настоящее изобретение будет описано со ссылкой на Примеры, в которых в качестве белка с активностью 2-оксоглутарт-зависимого фермента приводится белок с активностью L-изолейциндиоксигеназы и продуктом реакции, катализируемой указанным белком, является (2S,3R,4S)-4-гидрокси-L-изолейцин. Однако настоящее изобретение не ограничивается этими примерами.
В настоящем изобретении термин "(2S,3R,4S)-4-гидрокси-L-изолейцин", или "(2S,3R,4S)-4HIL", или "4HIL" относится к отдельному химическому соединению или к смеси соединений, содержащей (2S,3R,4S)-4-гидроксиизолейцин.
Термин "бактерия", как он употребляется в настоящем описании, включает фермент-образующую бактерию, мутант и генетический рекомбинант такой бактерии, в которой имеется или увеличена целевая ферментативная активность, и т.п.
Можно употреблять аббревиатуру L-изолейциндиоксигеназы - IDO (L-isoleucine dioxygenase).
В результате скрининга природных микроорганизмов обнаружена уникальная бактерия - штамм Bacillus thuringiensis 2-e-2, обладающий активностью, катализирующей реакцию, в которой (2S,3R,4S)-4HIL образуется непосредственно из L-изолейцина, как в свободной форме, так и в форме соли. Из микробных клеток после культивирования очистили L-изолейциндиоксигеназу, в сокращенном варианте она может называться IDO(Lys, 23).
Кроме того, определена N-концевая аминокислотная последовательность IDO(Lys, 23) очищенной диоксигеназы штамма Bacillus thuringiensis 2-e-2. Штамм Bacillus thuringiensis 2-e-2 был назван Bacillus thuringiensis AJ110584 и депонирован в соответствии с будапештским Договором в International Patent Organism Depositary, National Institute of Advanced Industrial Science and Technology (Central 6, 1-1-1 Higashi, Tsukuba, Ibaraki 305-8566, Japan) 27 сентября 2006 г. с инвентарным номером FERM ВР-10688.
ДНК, кодирующая IDO(Lys, 23), представлена в Перечне последовательностей под SEQ ID No: 1. Кроме того, аминокислотная последовательность IDO(Lys, 23), кодируемой нуклеотидной последовательностью SEQ ID NO: 1, представлена в Перечне последовательностей под SEQ ID No: 2. SEQ ID NO: 2 - аминокислотная последовательность IDO(Lys, 23), кодируемой нуклеотидной последовательностью SEQ ID NO: 1. IDO(Lys, 23) с последовательностью SEQ ID NO: 2 обладает L-изолейциндиоксигеназной активностью и катализирует реакцию, в которой (2S,3R,4S)-4HIL, выраженный следующей формулой (I), синтезируется непосредственно из одной молекулы L-изолейцина.
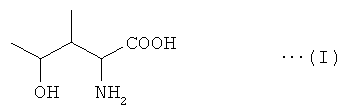
ДНК, кодирующая IDO, катализирующую реакцию, в которой (2S,3R,4S)-4HIL образуется из L-изолейцина, - не только ДНК, представленная в SEQ ID No: 1. Это связано с возможностью различий в нуклеотидных последовательностях среди видов и штаммов Bacillus, образующих IDO, катализирующую реакцию образования (2S,3R,4S)-4HIL из L-изолейцина.
ДНК настоящего изобретения включает не только выделенную ДНК, кодирующую IDO, но также и ДНК, кодирующую IDO, в которую искусственно введены мутации. Эта ДНК может быть выделена из хромосомы продуцирующего IDO микроорганизма. ДНК настоящего изобретения должна кодировать IDO, способную катализировать вышеуказанную реакцию. Методы искусственного введения мутаций включают обычно используемые методы введения сайт-специфических мутаций, описанные в Method. in Enzymol., 154 (1987).
ДНК, гибридизующаяся в жестких условиях с ДНК, имеющей нуклеотидную последовательность, комплементарную нуклеотидной последовательности SEQ ID No: 1, и кодирующая белок с активностью IDO, также включена в ДНК настоящего изобретения. В рамках настоящего изобретения «жесткие условия» означают такие условия, при которых специфические гибриды образуются тогда, как неспецифические гибриды не образуются. Хотя количественное описание этих условий является затруднительным, в качестве примера можно сослаться на условия, при которых молекулы ДНК, имеющие более высокую гомологию, предпочтительно не менее 70%, более предпочтительно не менее 80%, еще более предпочтительней не менее 90% и особенно предпочтительно не менее 95% или более, гибридизуются друг с другом, тогда как молекулы ДНК, имеющие более низкую гомологию, не гибридизуются друг с другом, или такие условия, при которых гибридизация имеет место при обычных условиях отмывки во время проведения гибридизации по Саузерну, которая проводится при концентрации солей, 0.1×SSC, 0.1% SDS при температуре 37°C, предпочтительно 0.1×SSC, 0.1% SDS при температуре 60°C и более предпочтительно 0.1×SSC, 0.1% SDS при температуре 65°C. Длина зонда может быть выбрана соответствующим образом, в зависимости от условий гибридизации и обычно варьирует от 100 п.о. до 1 тыс. п.о. Кроме того, "L-изолейциндиоксигеназная активность" может быть описана как активность, осуществляющая синтез (2S,3R,4S)-4HIL из L-изолейцина. Однако нуклеотидная последовательность, гибридизующаяся в жестких условиях с нуклеотидной последовательностью, комплементарной нуклеотидной последовательности SEQ ID No: 1, предпочтительно сохраняет L-изолейциндиоксигеназную активность на 10% или более, предпочтительно 30% или более, более предпочтительно 50% или более и еще более предпочтительно 70% или более, относительно белка с аминокислотной последовательностью SEQ ID No: 2 в условиях 37°C и рН 8.
Кроме того, ДНК, кодирующая белок, по существу идентичный IDO, кодируемой SEQ ID No: 1, также включена в ДНК настоящего изобретения. А именно следующие ДНК также включены в ДНК настоящего изобретения:
(а) ДНК с нуклеотидной последовательностью SEQ ID No: 1;
(b) ДНК, гибридизующаяся в жестких условиях с ДНК с нуклеотидной последовательностью, комплементарной нуклеотидной последовательности SEQ ID No: 1, и кодирующая белок с L-изолейциндиоксигеназной активностью;
(c) ДНК, кодирующая белок с аминокислотной последовательностью SEQ ID No: 2;
(d) ДНК, кодирующая белок с аминокислотной последовательностью, содержащей замену, делецию, вставку, добавление или инверсию одного или нескольких аминокислотных остатков в аминокислотной последовательности SEQ ID No: 2, обладающий L-изолейциндиоксигеназной активностью; и
(e) ДНК, кодирующая белок с аминокислотной последовательностью, гомологичной по крайней мере на 70%, предпочтительно по крайней мере на 80%, более предпочтительно по крайней мере на 90% и еще более предпочтительно по крайней мере на 95% аминокислотной последовательности SEQ ID NO: 2, обладающий L-изолейциндиоксигеназной активностью.
В рамках настоящего изобретения фраза «один или несколько» означает диапазон изменений, при котором третичная структура белка или активность L-изолейциндиоксигеназы изменяется незначительно и, в частности, соответствует значениям от 1 до 78, предпочтительно от 1 до 52, более предпочтительно от 1 до 26 и еще более предпочтительно от 1 до 13.
Замена, делеция, вставка, добавление или инверсия одного или нескольких аминокислотных остатков будут представлять собой консервативную мутацию или консервативные мутации при условии, что активность фермента при этом сохраняется. Примером консервативной мутации(ий) являет(ют)ся консервативная замена(ы). Примеры консервативных замен включают замену Ala на Ser или Thr, замену Arg на Gln, His или Lys, замену Asn на Glu, Gln, Lys, His или Asp, замену Asp на Asn, Glu или Gln, замену Cys на Ser или Ala, замену Gln на Asn, Glu, Lys, His, Asp или Arg, замену Glu на Asn, Gln, Lys или Asp, замену Gly на Pro, замену His на Asn, Lys, Gln, Arg или Tyr, замену Ile на Leu, Met, Val или Phe, замену Leu на Ile, Met, Val или Phe, замену Lys на Asn, Glu, Gln, His или Arg, замену Met на Ile, Leu, Val или Phe, замену Phe на Trp, Tyr, Met, Ile или Leu, замену Ser на Thr или Ala, замену Thr на Ser или Ala, замену Trp на Phe или Tyr, замену Tyr на His, Phe или Trp и замену Val на Met, Ile или Leu.
Кроме того, термин «L-изолейциндиоксигеназная активность» означает способность к продукции (2S,3R,4S)-4HIL из L-изолейцина, как описано выше. Однако в случае, когда аминокислотная последовательность содержит замену, делецию, вставку, добавление или инверсию одного или нескольких аминокислотных остатков в аминокислотной последовательности SEQ ID No: 2, L-изолейциндиоксигеназная активность сохраняется, по крайней мере, не менее чем на 10%, предпочтительно не менее чем на 30%, более предпочтительно не менее чем на 50% и еще более предпочтительней на 70% и более от активности белка, имеющего аминокислотную последовательность SEQ ID No: 2, в условиях поддержания температуры на уровне 30°C и рН 6. L-изолейциндиоксигеназная активность IDO согласно настоящему изобретению может быть измерена путем анализа образования (2S,3R,4S)-4HIL из L-изолейцина с помощью высокоэффективной жидкостной хроматографии (ВЭЖХ).
Кроме того, фрагмент ДНК, гомологичный фрагменту ДНК, показанному на SEQ ID NO: 1, может быть использован в качестве гена, кодирующего L-изолейциндиоксигеназу согласно настоящему изобретению. Тот факт, что гомологичный фрагмент ДНК кодирует или не кодирует L-изолейциндиоксигеназу, может быть подтвержден путем измерения L-изолейциндиоксигеназной активности в клеточном лизате или в клеточном лизате микроорганизма, в котором гомологичный фрагмент ДНК сверхэкспрессируется.
Фрагмент ДНК, гомологичный показанному на SEQ ID NO: 1, может быть также приготовлен из геномной ДНК других видов бактерий рода Bacillus, например из Bacillus cereus, Bacillus weihenstephanensis.
Термин "бактерия, принадлежащая к роду Escherichia" означает, что бактерия относится к роду Escherichia в соответствии с классификацией, известной специалисту в области микробиологии. В качестве примера микроорганизма, принадлежащего к роду Escherichia, использованного в настоящем изобретении, может быть упомянута бактерия Escherichia coli (E.coli).
Круг бактерий, принадлежащих к роду Escherichia, которые могут быть использованы в настоящем изобретении, не ограничен каким-либо образом, однако, например, бактерии, описанные в книге Neidhardt, F.C. et al. (Escherichia coli and Salmonella typhimurium, American Society for Microbiology, Washington D.C., 1208, Таблица 1), могут быть включены в число бактерий согласно настоящему изобретению.
Термин "бактерия, принадлежащая к роду Pseudomonas" означает, что данная бактерия классифицирована как принадлежащая к роду Pseudomonas согласно классификации, известной специалисту в области микробиологии.
Термин "бактерия, принадлежащая к роду Corynebacterium" означает, что данная бактерия классифицирована как принадлежащая к роду Corynebacterium согласно классификации, известной специалисту в области микробиологии. Примеры бактерии, принадлежащей к роду Corynebacterium, в качестве используемой в настоящем изобретении включают, но не ограничиваются, Corynebacterium glutamicum.
Термин "бактерия, принадлежащая к роду Arthrobacter" означает, что данная бактерия классифицирована как принадлежащая к роду Arthrobacter согласно классификации, известной специалисту в области микробиологии. Примеры бактерии, принадлежащей к роду Arthrobacter, в качестве используемой в настоящем изобретении включают, но не ограничиваются, Arthrobacter simplex, Arthrobacter globiformis, Arthrobacter sulfureus и Arthrobacter viscosus.
Термин "бактерия, принадлежащая к роду Aspergillus" означает, что данная бактерия классифицирована как принадлежащая к роду Aspergillus согласно классификации, известной специалисту в области микробиологии.
Термин "бактерия, принадлежащая к роду Bacillus" означает, что данная бактерия классифицирована как принадлежащая к роду Bacillus согласно классификации, известной специалисту в области микробиологии. Примеры бактерии, принадлежащей к роду Bacillus, в качестве используемой в настоящем изобретении включают, но не ограничиваются, Bacillus subtilis.
Ген brnQ E.coli (синонимы - ECK0395, b0401, hrbA) кодирует LIVCS транспортер аминокислот с разветвленной цепью BrnQ (синонимы - B0401, HrbA, LIV-II). Ген brnQ (нуклеотиды с 418815 по 420134; в последовательности с инвентарным номером NC_000913.2 в базе данных GenBank; gi: 16128105) расположен между генами phoR и proY на хромосоме штамма E.coli K-12. Нуклеотидная последовательность гена brnQ и аминокислотная последовательность белка BrnQ, кодируемого геном brnQ, приведены в Перечне последовательностей под номерами 3 (SEQ ID NO: 3) и 4 (SEQ ID NO: 4) соответственно.
Ген sucA E.coli (синонимы - ECK0714, lys, b0726, lys+met) кодирует субъединицу E1(0) компонента оксоглутаратдегидрогеназного комплекса - SucA (синонимы - B0726, Lys). Ген sucA (нуклеотиды с 757,929 по 760,730; в последовательности с инвентарным номером NC_000913.2 в базе данных GenBank; gi: 16128105) расположен между геном G6388, частично перекрываясь с ним, и геном sucB на хромосоме штамма E.coli K-12. Нуклеотидная последовательность гена sucA и аминокислотная последовательность белка SucA, кодируемого геном sucA, приведены в Перечне последовательностей под номерами 5 (SEQ ID NO: 5) и 6 (SEQ ID NO: 6) соответственно.
Ген sucB E.coli (синонимы - ECK0715, b0727) кодирует субъединицу Е2(0) компонента оксоглутаратдегидрогеназного комплекса - SucB (синоним B0727). Ген sucB (нуклеотиды с 760,745 по 761,962; в последовательности с инвентарным номером NC_000913.2 в базе данных GenBank; gi: 16128105) расположен между генами sucA и sucC на хромосоме штамма E.coli K-12. Нуклеотидная последовательность гена sucB и аминокислотная последовательность белка SucB, кодируемого геном sucB, приведены в Перечне последовательностей под номерами 7 (SEQ ID NO: 7) и 8 (SEQ ID NO: 8) соответственно.
Ген асеА Е.coli (синонимы - ECK4007, b4015, icI) кодирует субъединицу изоцитратлиазы - АсеА (синонимы B4015, IcI). Ген асеА (нуклеотиды с 4,215,132 по 4,216,436; в последовательности с инвентарным номером NC_000913.2 в базе данных GenBank; gi: 16128105) расположен между генами асеВ и aceK на хромосоме штамма Е.coli K-12. Нуклеотидная последовательность гена асеА и аминокислотная последовательность белка АсеА, кодируемого геном асеА, приведены в Перечне последовательностей под номерами 9 (SEQ ID NO: 9) и 10 (SEQ ID NO: 10) соответственно.
Ген aceK Е.coli (синонимы - ECK4008, b4016) кодирует субъединицу фосфатазы изоцитратдегидрогеназы - AceK (синоним В4016). Ген aceK (нуклеотиды с 4,216,619 по 4,218,355; в последовательности с инвентарным номером NC_000913.2 в базе данных GenBank; gi: 16128105) расположен между геном асеА и геном arpA, в противоположной ориентации, частично перекрываясь с ним, на хромосоме штамма Е.coli K-12. Нуклеотидная последовательность гена aceK и аминокислотная последовательность белка AceK, кодируемого геном aceK, приведены в Перечне последовательностей под номерами 11 (SEQ ID NO: 11) и 12 (SEQ ID NO: 12) соответственно.
Ген ilvE E.coli (синонимы - ECK3762, b3770) кодирует субъединицу аминотрансферазы аминокислот с разветвленной цепью - IlvE (синоним В3770). Ген ilvE (нуклеотиды с 3,950,507 по 3,951,436; в последовательности с инвентарным номером NC_000913.2 в базе данных GenBank; gi: 16128105) расположен между генами ilvM и ilvD на хромосоме штамма Е.coli K-12. Нуклеотидная последовательность гена ilvE и аминокислотная последовательность белка IlvE, кодируемого геном ilvE, приведены в Перечне последовательностей под номерами 13 (SEQ ID NO: 13) и 14 (SEQ ID NO: 14) соответственно.
Поскольку у представителей различных родов или штаммов семейства Enterobacteriaceae возможны некоторые вариации в нуклеотидных последовательностях, понятие гена brnQ с усиленной экспрессией или генов sucA, sucB, асеА, aceK, ilvE с ослабленной экспрессией не ограничивается генами, последовательности которых приведены в Перечне последовательностей под номерами SEQ ID No: 3, SEQ ID No: 5, SEQ ID No: 7, SEQ ID No: 9, SEQ ID No: 11 и SEQ ID No: 13, но также может включать и гены, гомологичные SEQ ID No: 3, SEQ ID No: 5, SEQ ID No: 7, SEQ ID No: 9, SEQ ID No: 11 и SEQ ID No: 13, кодирующие вариант белка BrnQ, SucA, SucB, АсеА, AceK и IlvE соответственно. Термин "вариант белка", используемый в настоящем изобретении, означает белок с изменениями в последовательности, будь то делеции, вставки, добавления или замены аминокислот, в котором сохраняется активность белка BrnQ/SucA/SucB/AceA/AceK/IlvE. Число изменений в варианте белка зависит от положения или типа аминокислотного остатка в третичной структуре белка. Оно может быть от 1 до 30, предпочтительно от 1 до 15, более предпочтительно от 1 до 5 в SEQ ID No: 4, SEQ ID No: 6, SEQ ID No: 8, SEQ ID No: 10, SEQ ID No: 12 и SEQ ID No: 14. Данные изменения в вариантах могут иметь место в областях, не критичных для функции белка. Данные изменения возможны потому, что некоторые аминокислоты имеют высокую гомологию друг другу, поэтому такие изменения не влияют на третичную структуру или активность. Следовательно, вариант белка, кодируемого геном brnQ/sucA/sucB/aceA/aceK/ilvE, может быть представлен белками с гомологией не менее 80%, предпочтительно не менее 90% и наиболее предпочтительно не менее 95%, по отношению к полной аминокислотной последовательности, приведенной в Перечне последовательностей под номером SEQ ID No: 4, SEQ ID No: 6, SEQ ID No: 8, SEQ ID No: 10, SEQ ID No: 12 и SEQ ID No: 14, при условии, что сохраняется активность белков BrnQ, SucA, SucB, AceA, AceK и IlvE (до инактивации гена sucA/sucB/aceA/aceK/ilvE).
Гомология между двумя аминокислотными последовательностями может быть определена с использованием известных методов, например компьютерной программы BLAST 2.0, которая считает три параметра: число аминокислот, идентичность и сходство.
Кроме того, гены brnQ, sucA, sucB, aceA, aceK, ilvE могут быть вариантом, который гибридизуется в жестких условиях с нуклеотидной последовательностью, приведенной в Перечне последовательностей под номером SEQ ID No: 3/SEQ ID No: 5/SEQ ID No: 7/SEQ ID No: 9/SEQ ID No: 11/SEQ ID No: 13, или с зондом, который может быть синтезирован на основе указанной нуклеотидной последовательности, при условии, что до инактивации он кодирует функциональный белок BrnQ/SucA/SucB/AceA/AceK/IlvE. «Жесткие условия» включают такие условия, при которых специфические гибриды, например гибриды с гомологией не менее 60%, предпочтительно не менее 70%, более предпочтительно не менее 80%, еще более предпочтительно не менее 90% и наиболее предпочтительно не менее 95%, образуются, а неспецифические гибриды, например гибриды с меньшей гомологией, чем указано выше, - не образуются. Практическим примером жестких условий является однократная отмывка, предпочтительно двух- или трехкратная, при концентрации солей 1×SSC, 0.1% SDS, предпочтительно 0.1×SSC, 0.1% SDS, при 60°C. Продолжительность отмывки зависит от типа используемой для блоттинга мембраны и, как правило, такова, как рекомендовано производителем. Например, рекомендуемая продолжительность отмывки для нейлоновой мембраны Hybond™ N+ (Amersham) при строгих условиях - 15 минут. Предпочтительна двух-, трехкратная отмывка. Длина зонда может быть выбрана в зависимости от условий гибридизации и обычно составляет около 100-1000 п.н.
Термин "усиленная экспрессия гена" или "сверхэкспрессия гена" означает, что экспрессия гена выше, чем в немодифицированном штамме, например в штамме дикого типа. Примеры таких модификаций включают увеличение числа копий гена на клетку, увеличение уровня экспрессии гена и т.д. Количество копий экспрессирующегося гена определяют, например, с использованием рестрикции хромосомной ДНК с последующим блоттингом по Саузерну с использованием зонда на основе последовательности гена, флуоресцентной гибридизацией in situ (FISH- fluorescence in situ hybridization) и т.п.
Уровень экспрессии гена можно определить с использованием различных известных методов, включая блоттинг по Нозерну, количественную RT-PCR, и т.п. Количество кодируемого геном белка можно определить с использованием известных методов, включая электрофорез в SDS-ПААГ с последующим иммуноблоттингом (Western блоттинг) и т.п. Кроме того, штаммы дикого типа, которые могут использоваться в качестве контрольных, включают, например, Escherichia coli K-12.
Термин «трансформация бактерии с помощью фрагмента ДНК, кодирующего белок» означает введение фрагмента ДНК в бактерию, например, традиционными методами. Трансформация этой ДНК приведет к усилению экспрессии гена, кодирующего белок согласно настоящему изобретению, и к увеличению активности белка в этой бактериальной клетке. Способы трансформации включают любые известные методы, которые к настоящему времени уже описаны. Например, может быть использован метод обработки реципиентных клеток хлоридом кальция таким образом, чтобы увеличить проницаемость клеток для ДНК. Этот метод был описан для штамма Escherichia coli K-12 (Mandel, M. and Higa, A., J. Mol. Biol., 53, 159 (1970)).
Методы сверхэкспрессии гена или усиления экспрессии гена включают увеличение числа копий гена. Введение гена в вектор, способный функционировать в бактерии семейства Enterobacteriaceae, увеличивает число копий гена. Преимущественно используют низкокопийные векторы. Примеры низкокопийных векторов включают, но не ограничиваются ими, pSC101, pMW118, pMW119 и т.п. Термин "низкокопийный вектор" используется для векторов, число копий которого в клетке достигает пяти.
Усиление экспрессии гена может также быть достигнуто путем введения множества копий гена в бактериальную хромосому, например, методом гомологичной рекомбинации, Mu интеграции и т.п. Например, один акт Mu интеграции позволяет ввести в бактериальную хромосому до 3 копий гена.
Увеличение числа копий гена также может быть достигнуто путем введения множества копий гена в хромосомную ДНК бактерии. Для введения множества копий гена в бактериальную хромосому выполняется гомологичная рекомбинация с использованием в качестве целевых последовательностей, присутствующих в хромосоме во множестве копий. Последовательности с множеством копий в хромосомной ДНК включают, но не ограничиваются ими, повторяющиеся ДНК или инвертированные повторы на концах транспонируемых элементов.
Усиление экспрессии гена также может быть достигнуто путем подстановки ДНК настоящего изобретения под контроль сильного промотора. Известно, что сильными промоторами являются, например, lac промотор, trp промотор, trc промотор, PR или PL промоторы фага λ. Использование сильного промотора можно сочетать с увеличением копий гена.
С другой стороны, действие промотора может быть усилено, например, введением в промотор мутации, ведущей к увеличению уровня транскрипции локализованного за промотором гена. Кроме того, известно, что замена нескольких нуклеотидов в области между сайтом связывания рибосомы (ribosome binding site - RBS) и стартовым кодоном, особенно в последовательности непосредственно перед стартовым кодоном, существенно влияет на транслируемость мРНК.
Кроме того, возможно ввести нуклеотидную замену в область промотора гена на бактериальной хромосоме, результатом чего является усиление функции промотора. Изменение последовательности, контролирующей экспрессию, можно осуществить, например, таким же способом, что и замена гена с использованием чувствительной к температуре плазмиды, как раскрыто в международной заявке WO 00/18935 и заявке Японии JP 1-215280 А.
Изобретатели настоящего изобретения предположили, что ослабление экспрессии генов sucA, sucB, aceA и асеK приведет к 'шунтированию' цикла трикарбоновых кислот в мутантных клетках благодаря одновременному окислению изолейцина и α-кетоглутарата (2-оксоглутарата). Это может привести к увеличенной продукции 4HIL. В то же время одновременное окисление изолейцина и α-кетоглутарата благодаря действию IDO будет являться фактором, необходимым и для роста бактерии, и для стабилизации плазмиды, содержащей ген, кодирующий IDO. Другими словами, процесс гидроксилирования изолейцина будет необходим для роста клеток. В этом случае биотрансформация изолейцина в 4-HIL может быть достигнута во время роста бактериальных клеток без добавления каких-либо антибиотиков. Этот подход был реализован путем конструирования штамма, дефицитного по сукцинил-КоА за счет делеции генов sucAB и aceAK (Фиг.1, Примеры 3-5).
Очевидно, что этот принцип может применяться к любым реакциям, сопряженным с образованием сукцината из 2-оксоглутарата. Также очевидно, что минимальное требование - это уменьшение экспрессии гена, кодирующего оксоглутаратдегидрогеназу (такого как ΔsucAB, ΔsucA, ΔsucB). Предпочтительно, чтобы бактерия была дополнительно модифицирована таким образом, что экспрессия гена, кодирующего изоцитратлиазу (такого как ΔасеА), была ослаблена. Еще более предпочтительно, чтобы бактерия была дополнительно модифицирована таким образом, чтобы экспрессия генов, кодирующих изоцитратлиазу и фосфатазу изоцитратдегидрогеназы (такого как ΔaceAK), была ослаблена.
При ослаблении экспрессии генов, кодирующих оксоглутаратдегидрогеназу, метаболизм 2-оксоглутарата в клетке подавляется и приток 2-оксоглутарата к 2-оксоглутарат-зависимому ферменту увеличивается. Сконструированная таким образом бактерия полностью приспособлена для проведения 2-оксоглутарат-зависимых ферментных реакций. Ослабление экспрессии генов, кодирующих оксоглутаратдегидрогеназу, увеличивает уровень 2-оксоглутарата, вследствие чего его поток на 2-оксоглутарат-зависимый фермент становится более эффективным. Оксоглутаратдегидрогеназа - это фермент, превращающий 2-оксоглутарат в сукцинил-СоА в цикле трикарбоновых кислот (ЦТК). Предпочтительно далее комбинировать ослабление экспрессии гена, кодирующего изоцитратлиазу, катализирующую превращение изоцитрата в сукцинат в глиоксилатном цикле, таким образом увеличивая в дальнейшем приток 2-оксоглутарата. В случае такой комбинации, пути от 2-оксоглутарата до сукцината в ЦТК и глиоксилатном циклах блокируются, вследствие чего в дальнейшем увеличивается приток 2-оксоглутарата к 2-оксоглутарат-зависимому ферменту. Еще более предпочтительна дальнейшая комбинация с ослаблением генов, кодирующих фосфатазу изоцитратдегидрогеназы, таким образом подавляется инактивация изоцитратдегидрогеназы, продуцирующая 2-оксоглутарат из изоцитрата.
Поскольку аминотрансфераза аминокислот с разветвленной цепью деаминирует 4HIL (Smirnov S.V. et al, FEMS Microbiol Lett.; 273(1): 70-7(2007)), изобретатели настоящего изобретения предположили, что ослабление экспрессии гена ilvE приведет к более высокому выходу 4HIL благодаря предотвращению деаминирования 4HIL.
Термин «бактерия модифицирована таким образом, что экспрессия гена ослаблена» означает, что указанная бактерия была модифицирована таким образом, что в результате модификации такая бактерия содержит пониженное количество белка по сравнению с немодифицированной бактерией или указанная бактерия не способна синтезировать белок. Термин «бактерия модифицирована таким образом, что экспрессия гена ослаблена» также означает, что указанная бактерия была модифицирована таким образом, что модифицированный ген кодирует мутантный белок со сниженной активностью.
Наличие или отсутствие гена yahN на хромосоме может быть определено хорошо известными методами, включая ПЦР, блоттинг по Саузерну и т.п.
Термин «инактивация гена» означает, что модифицированный ген кодирует полностью неактивный белок. Возможно также, что естественная экспрессия модифицированного участка ДНК невозможна из-за делении генов оперона, сдвига рамки считывания, введения миссенс/нонсенс мутации(-ий) или модификации примыкающих к гену областей, которые включают последовательности, контролирующие экспрессию гена, такие как промоторы, энхансеры, аттенуаторы, сайты связывания рибосомы и т.д.
Экспрессия гена может быть ослаблена введением мутаций в гены. Такой мутацией гена может быть замена одного или более оснований для аминокислотной замены в кодируемом геном белке («миссенс»-мутация), введение стоп-кодона («нонсенс»-мутация), делеция одного или более оснований для сдвига рамки считывания, вставка гена устойчивости к антибиотику или делеция гена или его части (J. Biol. Chem., 1997, 272 (13); 8611-8617, J. Antimicrobial Chemotherapy, 2000, 46: 793-79). Экспрессия гена yahN также может быть ослаблена за счет модификации экспрессии регуляторных последовательностей, таких как промотор, последовательность Shine-Dalgarno (SD) и т.д. (заявка РСТ WO 95/34672; Carrier, T.A. and Keasling, J.D., Biotechnol Prog 15, 58-64 (1999)).
Например, для введения мутаций путем генной рекомбинации могут применяться следующие методы. Конструируется мутантный ген, кодирующий мутантный белок со сниженной активностью, и бактерия для ее модификации трансформируется фрагментом ДНК, содержащим мутантный ген. Затем нативный ген на хромосоме замещается путем гомологичной рекомбинации мутантным геном, отбирается полученный штамм. Такое замещение гена с использованием гомологичной рекомбинации может быть проведено методом с использованием линейной ДНК, известным как "Red-зависимая интеграция" или "интеграция посредством Red-системы" (Datsenko, K.A., Wanner, B.L., Proc.Natl.Acad.Sci. USA, 97, 12, 6640-6645 (2000), заявка РСТ WO 2005/010175), или методом с использованием плазмиды, репликация которой чувствительна к температуре (патент США 6,303,383 или патентная заявка Японии JP 05-007491A). Далее, введение сайт-специфической мутации путем замещения гена с использованием вышеупомянутой гомологичной рекомбинации может также быть осуществлено с использованием плазмиды с пониженной способностью к репликации в клетке хозяина.
Экспрессия гена также может быть ослаблена вставкой транспозона или IS фактора в кодирующую область гена (патент США 5,175,107) или традиционными методами, такими как мутагенез с использованием УФ-излучения или обработка нитрозогуанидином (N-метил-N'-нитро-N-нитрозогуанидин).
Инактивация гена также может быть осуществлена такими традиционными методами, как мутагенез с использованием УФ-излучения или обработка нитрозогуанидином (N-метил-N'-нитро-N-нитрозогуанидин), сайт-специфический мутагенез, разрушение гена с использованием гомологичной рекомбинации или/и мутагенеза за счет вставки-делеции (Yu, D. et al., Proc. Natl. Acad. Sci. USA, 2000, 97:12: 5978-83 and Datsenko, K.A. and Wanner, B.L., Proc. Natl. Acad. Sci. USA, 2000, 97:12: 6640-45), также называемого "Red-зависимая интеграция".
Методы приготовления плазмидной ДНК, рестрикции и лигирования ДНК, трансформации, выбора нуклеотидов в качестве праймера и т.п. могут быть обычными методами, известными специалисту в этой области. Эти методы описаны, например, в Sambrook, J., Fritsch, E.F., and Maniatis, Т., "Molecular Cloning: A Laboratory Manual, Second Edition", Cold Spring Harbor Laboratory Press (1989).
2. Способ согласно настоящему изобретению
Способом согласно настоящему изобретению является способ продукции продукта реакции, катализируемой белком, обладающим активностью 2-оксоглутарат-зависимого фермента, путем выращивания бактерии согласно настоящему изобретению в питательной среде, содержащей субстрат реакции, и выделения полученного продукта из культуральной жидкости.
В зависимости от продукта и специфичности используемого белка, обладающего активностью 2-оксоглутарат-зависимого фермента, выбирается подходящий субстрат. Например, когда продуктом является (2S,3R,4S)-4-гидрокси-L-изолейцин и белок обладает L-изолейциндиоксигеназной активностью, субстратом может быть L-лейцин.
Таким образом, способом согласно настоящему изобретению может являться способ получения (2S,3R,4S)-4-гидрокси-L-изолейцина путем культивирования бактерии настоящего изобретения в питательной среде, содержащей L-изолейцин, и выделения образовавшегося (2S,3R,4S)-4-гидрокси-L-изолейцина из культуральной жидкости.
Питательная среда, используемая для выращивания, может быть как синтетической, так и натуральной, при условии, что указанная среда содержит источники углерода, азота, минеральные добавки и, если необходимо, соответствующее количество питательных добавок, необходимых для роста микроорганизмов. К источникам углерода относятся различные углеводы, такие как глюкоза и сахароза, а также различные органические кислоты. В зависимости от характера ассимиляции используемого микроорганизма, могут использоваться спирты, такие как этанол и глицерин. В качестве источника азота могут использоваться различные неорганические соли аммония, такие как аммиак и сульфат аммония, другие соединения азота, такие как амины, природные источники азота, такие как пептон, гидролизат соевых бобов, ферментолизат микроорганизмов. В качестве минеральных добавок могут использоваться фосфат калия, сульфат магния, хлорид натрия, сульфат железа, сульфат марганца, хлорид кальция и подобные им соединения. В качестве витаминов могут использоваться тиамин, дрожжевой экстракт и т.п. Питательная среда, использованная в настоящем изобретении, содержала L-изолейцин (20-40 г/л).
Выращивание осуществляется предпочтительно в аэробных условиях, таких как перемешивание культуральной жидкости на качалке, взбалтывание с аэрацией, при температуре в пределах от 20 до 40°C, предпочтительно в пределах от 30 до 38°C. рН среды поддерживают в пределах от 5 до 9, предпочтительно от 6.5 до 7.2. рН среды может регулироваться аммиаком, карбонатом кальция, различными кислотами, основаниями и буферными растворами.
Примеры методов выделения и очистки могут включать метод, при котором (2S,3R,4S)-4HIL связывается с ионообменной смолой для адсорбции основных аминокислот с последующей элюцией и кристаллизацией, и метод, при котором продукт, полученный после элюции, обесцвечивается и фильтруется через активированный уголь с последующей кристаллизацией для получения (2S,3R,4S)-4HIL.
В отношении продукта, отличного от (2S,3R,4S)-4-гидрокси-L-изолейцина, условия выращивания, методы разделения и очистки выбираются в соответствии с особенностями используемых бактерий и целевых продуктов.
Примеры
Настоящее изобретение будет более детально разъяснено ниже со ссылкой на Примеры, которыми не ограничивается настоящее изобретение.
Пример 1. Конструирование штаммов MG1655 [pELAC-IDO(Lys, 23)] и MG1655(PL-brnQ)[pELAC-IDO(Lys, 23)]
1.1. Конструирование плазмиды pMW119-IDO(Lys, 23)
Фрагмент ДНК хромосомы штамма Bacillus thuringiensis 2-e-2 длиной 0.8 т.п.н. амплифицировали с использованием олигонуклеотидов SVS 170 (SEQ ID No: 15) и SVS 169 (SEQ ID No: 16) в качестве праймеров и очищенной хромосомной ДНК в качестве матрицы. Схема проведения ПЦР была следующая: начальный цикл в течение 30 секунд при 94°C; 4 цикла: 40 секунд при 94°C; 30 секунд при 49°C; 40 секунд при 72°C; 35 циклов: 30 секунд при 94°C; 30 секунд при 54°C; 30 секунд при 72°C. Фрагмент ПЦР обрабатывали эндонуклеазами BamHI и SacI и затем лигировали в вектор pMW119, предварительно обработанный такими же рестриктазами.
1.2. Конструирование плазмиды pELAC-IDO (Lys, 23)
Фрагмент ДНК величиной 0.76 т.п.н. вырезали из плазмиды pMW119-IDO(Lys, 23) с использованием эндонуклеаз XbaI, SacI, затем клонировали в векторе pELAC-ilvA/XbaI-SacI (см. Справочный пример 1), в результате получили плазмиду pELAC-IDO (Lys, 23) (Фиг.3).
1.3. Конструирование штамма MG1655 (PL-brnQ)
Экспрессия транспортера Ile BrnQ была усилена в штамме MG1655 для усиления поступления Ile. Фрагмент ДНК величиной 1.9 т.п.н., содержащий маркер Cm и промотор PL, получили в ПЦР с использованием олигонуклеотидов SVS 179 (SEQ ID No: 17) и SVS 180 (SEQ ID No: 18) в качестве праймеров и ДНК штамма BW25113 cat-PL-yddG (EP 1449918 A1, патент РФ 2222596) в качестве матрицы. Условия проведения ПЦР были следующие: стадия денатурации в течение 3 мин при 95°C; профиль для первых двух циклов: 1 мин при 95°C, 30 с при 50°C, 40 с при 72°C; профиль для последних 25 циклов: 30 с при 95°C, 30 с при 54°C, 40 с при 72°C; конечная стадия: 5 мин при 72°C.
Полученный продукт ПЦР величиной 1.9 т.п.н. очищали в агарозном геле и использовали для электропорации в штамм Е.coli MG1655 (АТСС 700926), содержащий плазмиду pKD46 с чувствительным к температуре ориджином репликации. Плазмида pKD46 (Datsenko, K.A. and Wanner, B.L., Proc. Natl. Acad. Sci. USA, 2000, 97:12:6640-45) содержит фрагмент ДНК фага λ величиной 2,154 нуклеотида (нуклеотиды с 31088 по 33241, в последовательности с инвентарным номером J02459 в базе данных GenBank) и содержит гены системы Red-гомологичной рекомбинации фага λ (гены γ, β, exo) под контролем индуцируемого арабинозой промотора ParaB. Плазмида pKD46 необходима для интеграции продукта ПЦР в хромосому штамма MG1655.
Электрокомпетентные клетки получали следующим образом: клетки MG1655/pKD46 выращивали в течение ночи при 30°C в жидкой среде LB, содержащей ампициллин (100 мкг/мл), затем разбавляли 1:100 средой SOB (дрожжевой экстракт, 5 г/л; NaCl, 0.5 г/л; триптон, 20 г/л; KCl, 2.5 мМ; MgCl2, 10 мМ), содержащей ампициллин (100 мкг/мл) и L-арабинозу (10 мМ) (арабинозу используют для индукции плазмиды, содержащей гены Red системы), и выращивали при 30°C до достижения оптической плотности бактериальной культуры OD600≈0.6, затем делали клетки электрокомпетентными путем концентрирования в 100 раз и трехкратного отмывания ледяной деионизованной водой. Электропорацию проводили с использованием 70 мкл клеточной суспензии и ≈100 нг продукта ПЦР.
После электропорации клетки добавляли к 1 мл среды SOC (Sambrook et al, "Molecular Cloning A Laboratory Manual, Second Edition", Cold Spring Harbor Laboratory Press (1989)), инкубировали в течение 2,5 часов при 37°C, затем высевали на L-агар, содержащий 30 мкг/мл хлорамфеникола, и выращивали при 37°C для отбора CmR рекомбинантов. Затем для удаления плазмиды pKD46 проводили два пассажа на L-агаре с Cm при 42°C и полученные колонии тестировали на чувствительность к ампициллину.
Таким образом был сконструирован штамм Е.coli MG1655 (PL-brnQ) (Фиг.4).
1.4. Конструирование штаммов MG1655 [pELAC-IDO(Lys, 23)] и MG1655(PL-brnQ)[pELAC-IDO(Lys, 23)]
Клетки штаммов MG1655 и MG1655 (PL-brnQ) трансформировали плазмидой pELAC-IDO (Lys, 23). Полученные клоны отбирали на чашках с X-gal/IPTG-агаром (blue/white тест). Таким образом были получены штаммы MG1655 [pELAC-IDO(Lys, 23)] и MG1655(PL-brnQ)[pELAC-IDO(Lys, 23)] соответственно.
Пример 2. Продукция 4HIL штаммом E.coli MG1655(PL-brnQ)[pELAC-IDO(Lys, 23)]
Для оценки влияния усиленной экспрессии гена, кодирующего транспортер L-изолейцина, на продукцию 4HIL клетки штаммов MG1655 [pELAC-IDO(Lys, 23)] и MG1655(PL-brnQ)[pELAC-IDO(Lys, 23)] выращивали в среде LB с добавлением ампициллина (200 мкг/мл) и ИПТГ (1 мМ) при 37°C в течение 4-5 часов. Специфическую активность IDO определяли в неочищенном экстракте клеток каждого рекомбинантного штамма Е.coli следующим образом. Клетки из 5 мл культуры собирали центрифугированием при 4°C, ресуспендировали в 0.5 мл буфера А*(50 мМ TRIZMA, 5% глицерин, 1 мМ ЭДТА, 1 мМ ДТТ, рН 7 доводили HCl) и разрушали ультразвуком при 4°C. Реакционная смесь (50 мкл) содержала 50 мМ HEPES рН 7.0; 5 мМ Ilе; 0.5 мМ α-кетоглутарата; 5 мМ аскорбата; 5 мМ FeSO4 и аликвоту препарата белка. Реакционную смесь инкубировали при 34°C в течение 1 часа со встряхиванием. 4HIL определяли с использованием методов ТСХ или ВЭЖХ следующим образом. ТСХ анализ: на пластинки размером 10×15 см, покрытые тонким слоем силикагеля, наносили реакционный раствор и экспонировали в подвижной фазе следующего состава: пропан-2-ол:ацетон:аммиак:вода = 100:100:25:16, определяли 4HIL с использованием нингидринового реагента.
ВЭЖХ анализ: использовали хроматограф высокого давления (Waters, USA) со спектрофлуорометром серии 1100 (Agilent, USA). Выбранные диапазоны длин волн: длина волны возбуждения 250 нм, область длин волн эмиссии 320-560 нм. Разделение с помощью метода accq-tag осуществляли на колонке Nova-Pak™ C18 150×3,9 мм, 4 мкм (Waters, США) при +40°C. Объем пробы составлял 5 мкл. Образование производных аминокислот и их разделение осуществляли в соответствии с рекомендациями производителя Waters (Liu, H. et al, J. Chromatogr. A, 828, 383-395 (1998); Waters accq-tag chemistry package. Instruction manual. Millipore Corporation, pp.1-9 (1993)). Для получения производных аминокислот с 6-аминохинолил-N-гидроксисукцинимидилкарбаматом использовали набор Accq-FluorTM (Waters, США). Анализ с помощью метода accq-tag осуществляли с использованием концентрированного элюента Accq-tag Eluent A (Waters, США). Все растворы готовили с использованием воды Milli-Q, стандартные растворы хранили при +4°C. Результаты измерения активности IDO в неочищенном экстракте клеток штаммов - продуцентов IDO представлены в Таблице 1.
Клетки штаммов MG1655 [pELAC-IDO(Lys, 23)] и MG1655(PL-brnQ)[pELAC-IDO(Lys, 23)] собирали центрифугированием и ресуспендировали в объеме 2 мл (до значения OD540≈0.03-0.04) в среде MI30ch (50 мМ KH2PO4 (pH 7, доводится NaOH); 20 мМ NH4Cl, 2 мМ MgSO4, мел - 1,25 г/100 мл, 30 г/л Ile, 2 мМ FeSO4, 2 мМ аскорбата, ампициллин 200 мг/л) с добавлением L-изолейцина и кетоглутарата, глюкозы или глицерина в различных сочетаниях (см. Таблицу 2, Таблицу 3). Клетки культивировали приблизительно в течение 15 часов при 32°C с энергичным встряхиванием. Затем накопление 4HIL исследовали методом ВЭЖХ как описано выше. Результаты измерения 4HIL, образованного штаммами MG1655 [pELAC-IDO(Lys, 23)] и МG1655(PL-brnQ)[pELAC-IDO(Lys, 23)] в зависимости от добавления α-кетоглутарата, глюкозы и глицерина показаны в Таблице 2 (по крайней мере по 3 пробирочных ферментации). Результаты определения 4HIL, образованного штаммами MG1655 [pELAC-IDO(Lys, 23)] и MG1655(PL-brnQ)[pELAC-IDO(Lys, 23)] в зависимости от различных концентраций глицерина показаны в Таблице 3 (по крайней мере по 3 пробирочных ферментации). Как следует из Таблицы 2 и Таблицы 3, MG1655(PL-brnQ)[pELAC-IDO(Lys, 23)] накапливал большее количество 4HIL, чем MG1655 [pELAC-IDO(Lys, 23)].
Пример 3. Конструирование штамма MG1655 (ΔsucAB, ΔaceAK, PL-brnQ) [pELAC-IDO(Lys, 23)]
3.1. Конструирование штамма MG1655 (ΔsucAB)
Для делеции генов sucAB выполнили следующие манипуляции. Фрагмент ДНК величиной 1.8 т.п.н., содержащий маркер CmR и промотор Ptac, амплифицировали в ПЦР с использованием олигонуклеотидов SVS-192 (SEQ ID No: 19) и SVS-193 (SEQ ID No: 20) в качестве праймеров и хромосомной ДНК штамма MG1655(attR-Cm-attL-Ptac) (Katashkina J.I. et al., Molekularnaya biologiya (RU), v.39. No.5,1-10 (2005)) в качестве матрицы. Условия проведения ПЦР были следующие: стадия денатурации в течение 3 мин при 95°C; условия для двух первых циклов: 1 мин при 95°C, 30 с при 50°C, 40 с при 72°C; условия для последних 25 циклов: 30 с при 95°C, 30 с при 54°C, 40 с при 72°C; конечная стадия: 5 мин при 72°C.
Полученный продукт ПЦР величиной 1.8 т.п.н. очищали в агарозном геле и использовали для электропорации в штамм Е.coli MG1655, содержащий плазмиду pKD46 с чувствительной к температуре репликацией.
Электропорацию проводили как описано выше. Клетки после электропорации инкубировали в 1 мл среды SOC при 37°C в течение 2.5 часов и затем высевали на L-агар, содержащий хлорамфеникол (30 мкг/мл), и выращивали при 37°C для отбора CmR рекомбинантов. Затем, для удаления плазмиды pKD46, проводили два пассажа на L-агаре с Cm при 42°C и полученные колонии тестировали на чувствительность к ампициллину.
Таким образом был сконструирован штамм Е.coli MG1655(ΔsucAB).
3.2. Конструирование штамма MG1655 (ΔaceAK)
Для делеции генов aceAK выполнили следующие манипуляции. Фрагмент ДНК величиной 1.8 т.п.н., содержащий маркер KmR и промотор Ptac, амплифицировали в ПЦР с использованием олигонуклеотидов SVS-199 (SEQ ID No: 21) и SVS-200 (SEQ ID No: 22) в качестве праймеров и плазмидной ДНК pMW118-(λattL-Kmr-λattR) (см. Справочный пример 2) в качестве матрицы.
Условия для ПЦР были следующие: стадия денатурации в течение 3 мин при 95°C; условия для первых двух циклов: 1 мин при 95°C, 30 с при 50°C, 40 с при 72°C; условия для последних 25 циклов: 30 с при 95°C, 30 с при 54°C, 40 с при 72°C; конечная стадия: 5 мин при 72°C.
Полученный продукт ПЦР величиной 1.8 т.п.н. очищали в агарозном геле и использовали для электропорации в штамм Е.coli MG1655, содержащий плазмиду pKD46 с чувствительным к температуре ориджином репликации.
Электропорацию проводили как описано выше. Клетки после электропорации инкубировали в 1 мл среды SOC при 37°C в течение 2.5 часов и затем высевали на L-агар, содержащий канамицин (20 мкг/мл), и выращивали при 37°C для отбора KmR рекомбинантов. Затем, для удаления плазмиды pKD46, проводили два пассажа на L-агаре с Cm при 42°C и полученные колонии тестировали на чувствительность к ампициллину.
Таким образом был сконструирован штамм Е.coli MG1655 (ΔaceAK).
3.3. Конструирование штамма MG1655 (ΔsucAB, ΔaceAK, PL-brnQ)
Для удаления маркера устойчивости к хлорамфениколу из штамма MG1655 (PL-brnQ), клетки трансформировали плазмидой pMW118-int-xis (ApR) (WO 2005/010175). ApR клоны выращивали на чашках с LB агаром, содержащим 150 мг/л ампициллина, при 30°C. Несколько десятков ApR клонов отобрали и клонировали на чувствительность к хлорамфениколу. Плазмиду pMW118-int-xis удаляли из CmS клеток путем инкубирования на чашках с LB-агаром при 42°C. Полученный штамм использовали для дальнейшего конструирования.
Фрагменты ДНК из хромосомы штамма Е.coli MG1655(ΔsucAB) переносили в штамм, полученный после удаления маркера устойчивости к хлорамфениколу, из штамма MG1655 (PL-brnQ) методом Р1 трансдукции (Miller, J.H. Experiments in Molecular Genetics, Cold Spring Harbor Lab. Press, 1972, Plainview, NY). Таким образом был сконструирован штамм MG1655 (ΔsucAB, PL-brnQ). Фрагменты ДНК из хромосомы штамма Е.coli MG1655(ΔaceAK) переносили в штамм MG1655 (ΔsucAB, PL-brnQ). Таким образом был сконструирован штамм MG1655 (ΔsucAB, ΔaceAK, PL-brnQ).
Клетки штамма MG1655 (ΔsucAB, ΔaceAK, PL-brnQ) трансформировали плазмидой pELAC-IDO (Lys, 23). Полученные клоны отбирали на чашках с X-gal/IPTG агаром (blue/white тест). Таким образом был получен штамм MG1655 (ΔsucAB, ΔaceAK, PL-brnQ) [pELAC-IDO(Lys, 23)].
3.4. Исследование роста штаммов MG1655, MG1655 (ΔsucAB, ΔaceAK, PL-brnQ), MG1655 [pELAC-IDO(Lys, 23)] и MG1655 (ΔsucAB, ΔaceAK, PL-brnQ)[pELAC-IDO(Lys, 23)]
Штаммы MG1655 и MG1655 (ΔsucAB, ΔaceAK, PL-brnQ) выращивали на следующих питательных средах:
А - М9 соли + глюкоза (0.4%);
В - М9 соли + глюкоза (0.4%) + ДАП, Met, Lys (40 мг/л каждого);
С - М9 соли + глицерин (0.4%);
D - М9 соли + глицерин (0.4%) + ДАП, Met, Lys (40 мг/л каждого).
Штаммы культивировали в пробирках при 37°C и каждый час определяли оптическую плотность клеточной культуры (А555). Как можно видеть на Фигуре 5, штамм MG1655 (ΔsucAB, ΔaceAK, PL-brnQ) с дефицитом сукцинил-КоА не может расти на средах А или С. Только при добавлении лизина, метионина и диаминопимелата (ДАП) восстанавливался рост штамма.
Далее штаммы MG1655[pELAC-IDO(Lys, 23)] и MG1655 (ΔsucAB, ΔaceAK, PL-brnQ) [pELAC-IDO(Lys, 23)] выращивали на следующих средах:
G - М9 соли + глюкоза (137 мМ);
GI - М9 соли + глюкоза (137 мМ) + L-изолейцин (137 мМ);
Y - М9 соли + глицерин (136 мМ);
YI - М9 соли + глицерин (136 мМ) + L-изолейцин (137 мМ).
Каждая среда содержала ампициллин (100 мг/л). Штаммы культивировали в пробирках при 37°C и каждый час определяли оптическую плотность клеточной культуры (А555).
Экспрессия гена IDO восстанавливает рост штамма MG1655 (ΔsucAB, ΔaceAK, PL-brnQ) на синтетической среде М9 с добавлением L-изолейцина (Фиг.6). Это подтверждает идею авторов настоящего изобретения о том, что гидроксилирование изолейцина ведет к росту штамма.
Пример 4. Продукция 4HIL штаммом Е.coli MG1655 (ΔsucAB, ΔaceAK, PL-brnQ) [pELAC-IDO(Lys, 23)]
Для оценки влияния ослабления экспрессии генов, кодирующих оксоглутаратдегидрогеназу, изоцитратлиазу и фосфатазу изоцитратдегидрогеназы, клетки штаммов MG1655(PL-brnQ)[pELAC-IDO(Lys, 23)] и MG1655(ΔsucAB, ΔaceAK, PL-brnQ)[pELAC-IDO(Lys, 23)] выращивали в среде A [(NH4)2SO4 - 1,5 г/100 мл; KH2PO4 - 0,15 г/100 мл; MgSO4 - 0,1 г/100 мл (MgSO4·7H2O - 0,205 г/100 мл); Ile - 220 мМ; FeCl2 - 2 мМ, 1 мМ IPTG, мел - 2 г/100 мл] с добавлением глюкозы (300 мМ) или глицерина (500 мМ) при 32°C в течение 72 часов с энергичным встряхиванием. Затем исследовали накопление 4HIL с использованием ВЭЖХ как описано выше. Результаты измерения 4HIL, образованного штаммами MG1655(PL-brnQ)[pELAC-IDO(Lys, 23)] и MG1655(ΔsucAB, ΔaceAK, PL-brnQ)[pELAC-IDO(Lys, 23)], показаны в Таблице 4 (по крайней мере по 3 пробирочных ферментации). Как следует из Таблицы 4, MG1655(ΔsucAB, ΔaceAK, PL-brnQ)[pELAC-IDO(Lys, 23)] образовывал больше 4HIL, чем MG1655(PL-brnQ)[pELAC-IDO(Lys, 23)].
Пример 5. Продукция 4HIL штаммом E.coli MG1655 (ΔsucAB, ΔaceAK, PL-brnQ)*[pEL-IDO(Lys, 23)]
5.1. Конструирование плазмиды pEL-IDO(Lys, 23)
Вследствие присутствия гена lacI на плазмиде pELAC-IDO(Lys, 23), необходимо добавление ИПТГ для индукции экспрессии IDO во время процесса биотрансформации продукции 4-HIL. Во избежание такой IPTG-зависимости, большую часть гена lacI удалили из плазмиды pELAC-IDO(Lys, 23) (Фиг.1) путем вырезания фрагмента ДНК SphI-EcoRV с использованием соответствующих рестриктаз с последующим лигированием оставшейся части плазмиды. Таким образом была сконструирована плазмида pEL-IDO(Lys, 23).
5.2. Продукция 4HIL
MG1655 (ΔsucAB, ΔaceAK, PL-brnQ)* штамм получили путем последовательного вырезания маркеров устойчивости к Cm и Kn из штамма MG1655 (ΔsucAB, ΔaceAK, PL-brnQ) с использованием плазмиды pMW118-int-xis (ApR) (WO 2005/010175) как описано выше. Плазмиды pELAC-IDO(Lys, 23) и pEL-IDO(Lys, 23) вводили в полученный штамм. Таким образом были получены штаммы MG1655 (ΔsucAB, ΔaceAK, PL-brnQ)*[pELAC-IDO(Lys, 23)] и MG1655 (ΔsucAB, ΔaceAK, PL-brnQ)*[pEL-IDO(Lys, 23)].
Часть биомассы свежевыращенного на LB-агаре штамма MG1655 (ΔsucAB, ΔaceAK, PL-brnQ)*[pELAC-IDO(Lys, 23)] и MG1655 (ΔsucAB, ΔaceAK, PL-brnQ)*[pEL-IDO(Lys, 23)] инокулировали в 50 мл бульона LB с добавлением Ap (100 мг/л) и культивировали при 37°C в течение приблизительно 4 часов в колбах на 750 мл. Полученные клеточные культуры использовали в качестве посевного материала для биотрансформации, проведенной на ферментерах "Marubischi". Использовали следующие параметры культивирования: начальный объем культуры - 500 мл; встряхивание - 1200 об/мин; воздух - 1:1; температура культивирования - 34°C; рН 7.0 поддерживался с использованием 2.5М NH4OH.
Инокулят штамма MG1655 (ΔsucAB, ΔaceAK, PL-brnQ)*[pELAC-IDO] добавляли к 450 мл среды, содержащей (NH4)2SO4 - 5 г/л; KH2PO4 - 1.5 г/л; MgSO4 7H2O - 1 г/л; FeSO4 7Н2О - 0,01 г/л; изолейцин - 22-23 г/л (≈170 мМ); glucose - 50 г/л; 1 мМ ИПТГ (pH 7 доводят KOH, конечный объем = 500 мл), и культивировали в течение 20 часов.
Инокулят штамма MG1655 (ΔsucAB, ΔaceAK, PL-brnQ)*[pEL-IDO] добавляли к 450 мл вышеописанной среды без ИПТГ и культивировали приблизительно в течение 20 часов. Концентрации 4HIL и L-изолейцина определяли с использованием метода ВЭЖХ как описано выше. Как видно из Таблицы 5, использование плазмиды pEL-IDO позволяет избежать ИПТГ-зависимости.
Справочный пример 1. Конструирование плазмиды pELAC-ilvA
Плазмида pET-ilvA была сконструирована следующим образом. Фрагмент хромосомной ДНК штамма Е.coli MG1655 величиной 1.5 т.п.н. амплифицировали в ПЦР с использованием олигонуклеотидов IlvA-5 (SEQ ID NO: 23) и ilvA-3 (SEQ ID NO: 24) в качестве праймеров. Часть клеточной культуры штамма E.coli MG1655 с LB-агара использовали в качестве источника ДНК матрицы для процедуры ПЦР. Полученный в результате фрагмент ДНК содержал ген ilvA и был фланкирован сайтами рестрикции NdeI и BamHI. Фрагмент клонировали в векторе pET22b(+) (Novagen, Germany) между сайтами NdeI-BamHI. Таким образом была сконструирована рекомбинантная плазмида pET-ilvA (Фиг.2).
Плазмида pELAC-ilvA была сконструирована на основе pET-ilvA путем замены BglII-XbaI фрагмента, содержащего промотор Т7, фрагментом BglII-XbaI, содержащим промотор Plac (SEQ ID NO: 25).
Справочный пример 2. Конструирование плазмиды pMW118-(λattL-Kmr-λattR)
Плазмида pMW118-(λattL-Kmr-λattR) была сконструирована на основе плазмиды pMW118-attL-Tc-attR (WO 2005/010175) путем замены гена-маркера устойчивости к тетрациклину геном-маркером устойчивости к канамицину из плазмиды pUC4K (Vieira, J. and Messing, J., Gene, 19(3); 259-68 (1982)).
С этой целью большой фрагмент EcoRI - HindIII из плазмиды pMW118-attL-Tc-attR лидировали с двумя фрагментами плазмиды pUC4K: фрагментом HindIII - PstI (676 п.н.) и фрагментом - EcoRI - HindIII (585 п.н.).
Базовая плазмида pMW118-attL-Tc-attR была получена путем лигирования следующих четырех фрагментов:
1) фрагмент BglII-EcoRI (114 п.н.), содержащий attL (SEQ ID NO: 26), полученный амплификацией в ПЦР соответствующей области хромосомы Е.coli W3350 (содержащей λ профаг) с использованием олигонуклеотидов P3 и Р4 (SEQ ID NOS: 27 и 28) в качестве праймеров (эти праймеры содержали вспомогательные сайты узнавания для эндонуклеаз BglII и EcoRI);
2) фрагмент PstI-HindIII (182 п.н.), содержащий attR (SEQ ID NO: 29), полученный амплификацией в ПЦР соответствующей области хромосомы Е.coli W3350 (содержащей λ профаг) с использованием олигонуклеотидов Р5 и Р6 (SEQ ID NOS: 30 и 31) в качестве праймеров (эти праймеры содержали вспомогательные сайты узнавания для эндонуклеаз PstI и HindIII);
3) большой BglII-HindIII фрагмент (3916 п.н.) плазмиды pMW118-ter_rrnB. Плазмиду pMW118-ter_rrnB получили путем лигирования трех следующих фрагментов ДНК:
a) большой фрагмент ДНК (2359 п.н.), содержащий AatII-EcoRI фрагмент плазмиды pMW118, полученный следующим образом: pMW118 обработали рестриктазой EcoRI, обработали фрагментом Кленова ДНК-полимеразы I и затем обработали рестриктазой AatII;
b) малый AatII-BglII фрагмент (1194 п.н.) вектора pUC19, содержащий ген bla устойчивости к ампициллину (ApR), был получен амплификацией в ПЦР соответствующей области плазмиды pUC19 с использованием олигонуклеотидов Р7 и Р8 (SEQ ID NOS: 32 и 33) в качестве праймеров (эти праймеры содержали вспомогательные сайты узнавания для эндонуклеаз AatII и BglII);
c) малый BglII-PstIpol фрагмент (363 п.н.) терминатора транскрипции ter_rrnB был получен амплификацией в ПЦР соответствующей области хромосомы Е.coli MG1655 с использованием олигонуклеотидов Р9 и Р10 (SEQ ID NOS: 34 и 35) в качестве праймеров (эти праймеры содержали вспомогательные сайты узнавания для эндонуклеаз BglII и PstI);
4) малый EcoRI-PstI фрагмент (1388 bp) (SEQ ID NO: 36) плазмиды pML-Tc-ter_thrL, содержащий ген устойчивости к тетрациклину и терминатор транскрипции ter_thrL; плазмида pML-Tc-ter_thrL была получена в две стадии:
- плазмиду pML-ter_thrL получили путем обработки плазмиды pML-MCS (Mashko, S.V. et al., Biotekhnologiya (in Russian), 2001, no.5, 3-20) рестриктазами XbaI и BamHI с последующим лигированием большого фрагмента (3342 п.н.) с XbaI-BamHI фрагментом (68 п.н.), содержащим терминатор ter_thrL, полученным амплификацией в ПЦР соответствующей области хромосомы Е.coli MG1655 с использованием олигонуклеотидов Р11 и P12 (SEQ ID NOS: 37 и 38) в качестве праймеров (эти праймеры содержали вспомогательные сайты узнавания для эндонуклеаз XbaI и BamHI);
- плазмида pML-Tc-ter_thrL была получена путем обработки плазмиды pML-ter_thrL рестриктазами KpnI и XbaI с последующей обработкой фрагментом Кленова ДНК-полимеразы I и лигированием с малым EcoRI-Van91I фрагментом (1317 п.н.) плазмиды pBR322, содержащим ген устойчивости к тетрациклину (pBR322 обрабатывали рестриктазами EcoRI и Van91I и затем обрабатывали фрагментом Кленова ДНК-полимеразы I).
Пример 6. Получение гидроксипролина с использованием штамма Е.coli MG1655 (ΔsucAB, ΔaceAK, PL-brnQ)*
Синтез фрагмента ДНК, приведенного в Списке последовательностей под номером SEQ ID NO: 39, был поручен в фирме Invitrogen и этот фрагмент ДНК, кодирующий L-пролил-4-гидроксигеназу (PDO) из Dactylosporangium sp. c аминокислотной последовательностью SEQ ID NO: 40, был получен в виде плазмиды BlueHeron pUCminusMCS, в которую указанный фрагмент ДНК был лигирован. Что касается плазмиды, то в последовательность ДНК были введены последовательности узнавания для рестриктаз NdeI и HindIII, расположенные на 5'- и 3'-концах ДНК соответственно, и эту плазмиду обрабатывали рестриктазами NdeI и HindIII. Параллельно, вектор ptrp4 (Journal of Molecular Catalysis В: Enzymatic 32 (2005) 205-211) обрабатывали этими же рестриктазами NdeI и HindIII. Два полученных фрагмента, обработанных рестриктазами NdeI и HindIII, лидировали и полученную плазмиду вводили в штамм Е.coli JM109 с получением трансформанта JM109/ptrp4_PDO.
Плазмиду выделяли из полученных трансформантов и вводили в штаммы Е.coli MG1655 и MG1655 (ΔsucAB, ΔaceAK, PL-brnQ)* с получением трансформантов MG1655/ ptrp4_PDO и MG1655 (ΔsucAB, ΔaceAK, PL-brnQ)*/ptrp4_PDO соответственно.
Штаммы MG1655/ptrp4_PDO и MG1655 (ΔsucAB, ΔaceAK, PL-brnQ)*/ptrp4_PDO выращивали в питательной среде LB, содержащей 100 мг/л ампициллина, при 30°C в течение 24 часов и 300 мкл культуральной жидкости вносили в 3 мл среды LB, содержащей 100 мг/л ампициллина, и выращивали при 37°C в течение 6 часов. В пробирки, содержащие L-пролин и карбонат кальция с количестве, необходимом, чтобы их конечная концентрация была 10 г/л и 20 г/л соответственно, вносили полученную культуральную жидкость (0.3 мл) и питательную среду (2.7 мл) следующего состава:
питательная среда А (300 мл): D-глюкоза (20 г/л), MgSO4·7H2O (1 г/л);
питательная среда В (700 мл): сульфат аммония (5 г/л), KH2PO4 (1.5 г/л), аскорбат натрия (0.01 г/л), FeSO4 7H2O (0.1 г/л), рН доведен до 7.0 с помощью KOH.
Среды А и В автоклавировали раздельно при 120°C в течение 20 мин и смешивали после охлаждения.
Концентрации D-глюкозы (г/л) и 4-гидроксипролина (мМ) приведены в Таблице 6. Концентрацию D-глюкозы определяли на анализаторе глюкозы (SAKURA SI, Япония). Концентрацию 4-гидроксипролина определяли с помощью ВЭЖХ Sumichiral OA-5000 (Sumika Analysis Center, Япония) (состав подвижной фазы: 2 мМ водный раствор сульфата меди, температура колонки: 30°C, скорость потока: 1 мл/мин, детектор: УФ 254 нм).
В результате было показано, что штамм MG1655 (ΔsucAB, ΔaceAK, PL-brnQ)*/ptrp4_PDO способен утилизировать D-глюкозу в реакции по продукции гидроксипролина более эффективно, чем штамм MG1655/ptrp4_PDO.
Пример 7-1. Конструирование штамма Е.coli MG1655 (ΔsucA, ΔaceAK) и MG1655 (ΔsucB, ΔaceAK)
Для того чтобы проверить, является ли модификация PL-brnQ необходимой для эффективной утилизации D-глюкозы, проводили следующий эксперимент.
Для того чтобы получить штамм, дефицитный по 2-оксоглутаратдегидрогеназе (sucA и sucB), изоцитратлиазе (aceA) и киназе/фосфатазе изоцитратдегидрогеназы (aceK) без модификации PL-brnQ, делецию ΔaceAK вводили в штаммы Е.coli MG1655 ΔsucA (JW0715) и MG1655 ΔsucB (JW0716) из коллекции Keio Knockout Collection (http://ecoli.naist.jp) с получением штаммов MG1655 (ΔsucA, ΔaceAK) и MG1655 (ΔsucB, ΔaceAK). Дефицит одного из генов sucA и sucB приводил к дефициту активности 2-оксоглутаратдегидрогеназы.
Чтобы получить делецию гена aceAK, проводили следующие манипуляции. Фрагмент ДНК размером 1.6 т.п.о., содержащий маркер CmR, амплифицировали с помощью ПЦР с использованием праймеров SVS-199 (SEQ ID NO: 21) и SVS-200 (SEQ ID NO: 22) и плазмиды pMW118-(λattL-Cmr-λattR) (WO 2005/010175) в качестве матрицы. Условия ПЦР следующие: денатурация в течение 3 мин при 94°C; 30 циклов: 30 с при 94°C, 30 с при 50°C, 2 мин при 72°C.
Полученный продукт ПЦР размером 1.6 т.п.о. очищали в агарозном геле и использовали для электропорации штаммов Е.coli MG1655 (ΔsucA) и MG1655 (ΔsucB), содержащих плазмиду pKD46 (WO 2005/010175) с термочувствительным репликоном.
Электропорацию проводили как описано выше. После электропорации клетки инкубировали в 1 мл питательной среды SOC при 37°C в течение 1 часа, а затем помещали на чашку с L-агаром, содержащим хлорамфеникол (25 мкг/мл), и выращивали при 37°C для отбора CmR рекомбинантом. Затем проводили два пассажа на чашках с агаром, содержащим хлорамфеникол, при 42°C для удаления плазмиды pKD46 и полученные колонии проверяли на чувствительность к ампициллину.
Затем удалали CmR-маркер с использованием плазмиды pMW118-int-xis-ts (ApR) (WO 2005/010175) как описано выше.
Так были сконструированы штаммы Е.coli MG1655 (ΔsucA, ΔaceAK) и MG1655 (ΔsucB, ΔaceAK).
Пример 7-2. Получение 4HIL штаммами Е.coli MG1655[pEL-IDO(Lys, 23)], MG1655 (ΔsucA, ΔaceAK)[pEL-IDO(Lys, 23)] и MG1655 (ΔsucB, ΔaceAK)[pEL-IDO(Lys, 23)]
Плазмиду pEL-IDO(Lys, 23) вводили в каждый из штаммов MG1655, MG1655 (ΔsucA, ΔaceAK) и MG1655 (ΔsucAB, ΔaceAK) с получением трансформантов MG1655[pEL-IDO(Lys, 23)], MG1655 (ΔsucA, ΔaceAK)[pEL-IDO(Lys, 23)] и MG1655 (ΔsucB, ΔaceAK) [pEL-IDO(Lys, 23)].
Штаммы выращивали в питательной среде LB, содержащей 100 мг/л ампициллина, при 30°C в течение 24 часов и 300 мкл культуральной жидкости вносили в 3 мл среды LB, содержащей 100 мг/л ампициллина, и выращивали при 37°C в течение 6 часов.
В пробирки, содержащие L-изолейцин и карбонат кальция с количестве, необходимом чтобы их конечная концентрация была 10 г/л и 20 г/л соответственно, вносили полученную культуральную жидкость (0.3 мл) и питательную среду (2.7 мл) следующего состава:
питательная среда А (300 мл): D-глюкоза (20 г/л), MgSO4·7H2O (1 г/л);
питательная среда В (700 мл): сульфат аммония (5 г/л), KH2PO4 (1.5 г/л), аскорбат натрия (0.01 г/л), FeSO4 7H2O (0.1 г/л), рН доведен до 7.0 с помощью KOH.
Среды А и В автоклавировали раздельно при 120°C в течение 20 мин и смешивали после охлаждения.
Концентрации D-глюкозы (г/л) и 4-гидрокси-L-изолейцина (мМ) приведены в Таблице 7. Концентрацию D-глюкозы определяли на анализаторе глюкозы (SAKURA SI, Япония). Концентрацию 4-гидрокси-L-изолейцина определяли с помощью ВЭЖХ MCI GEL CRS10W (Mitsubishi Kagaku, Япония) (состав подвижной фазы: 2 мМ раствор сульфата меди в 5% МеОН, температура колонки: 30°C, скорость потока: 1 мл/мин, детектор: УФ 254 нм).
В результате было показано, что с использованием штаммов Е.coli MG1655 (ΔsucA, ΔaceAK)[pEL-IDO(Lys, 23)] и MG1655 (ΔsucB, ΔaceAK) [pEL-IDO(Lys, 23)] без модификации PL-brnQ D-глюкоза более эффективно утилизируется в реакции с изолейциндиоксигеназой в сравнении с MG1655[pEL-IDO(Lys, 23)].
Приведенные результаты подтверждают, что штаммы, дефицитные по генам ΔsucAB, ΔsucA, ΔsucB и ΔaceAK, такие как Е.coli MG1655 (ΔsucAB, ΔaceAK), MG1655 (ΔsucA, ΔaceAK) и MG1655 (ΔsucB, ΔaceAK), могут широко применяться для использования 2-оксоглутарат-зависимых ферментов.
Разъяснение последовательностей
1: Ген L-изолейциндиоксигеназы из штамма Bacillus thuringiensis 2-e-2
2: L-Изолейциндиоксигеназа из штамма Bacillus thuringiensis 2-e-2
3: Генн brnQ из Е.coli
4: Белок BrnQ из Е.coli
5: Ген sucA из Е.coli
6: Белок SucA из Е.coli
7: Ген sucB из Е.coli
8: Белок SucB из Е.coli
9: Ген асеА из E.coli
10: Белок АсеА из Е.coli
11: Ген aceK из E.coli
12: Белок AceK из E.coli
13: Ген ilvE из Е.coli
14: Белок IlvE из Е.coli
15: Праймер SVS 170
16: Праймер SVS 169
17: Праймер SVS 179
18: Праймер SVS 180
19: Праймер SVS 192
20: Праймер SVS 193
21: Праймер SVS 199
22: Праймер SVS 200
23: Праймер IlvA-5
24: Праймер ilvA-3
25: Фрагмент BglII-XbaI, содержащий промотор Plac
26: Фрагмент attL
27: Праймер P3
28: Праймер Р4
29: Фрагмент attR
30: Праймер Р5
31: Праймер Р6
32: Праймер Р7
33: Праймер Р8
34: Праймер Р9
35: Праймер Р10
36: Фрагмент pML-Tc-ter_thrL
37: Праймер Р11
38: Праймер Р12
39: Ген L-пролин-4-гидроксигеназы из Dactylosporangium sp.
40: L-Пролин-4-гидроксигеназа из Dactylosporangium sp.
Хотя указанное изобретение описано в деталях со ссылкой на Наилучший способ осуществления изобретения, для специалиста в указанной области техники очевидно, что могут быть совершены различные изменения и произведены эквивалентные замены, и такие изменения и замены не выходят за рамки настоящего изобретения.
Каждому из упомянутых выше документов соответствует ссылка, и все цитируемые документы являются частью описания настоящего изобретения.
Промышленная применимость
Согласно настоящему изобретению продукция (2S,3R,4S)-4-гидрокси-L-изолейцина может быть увеличена. Это соединение полезно в качестве компонента фармацевтических композиций с инсулинотропной активностью. Продукция (2S,3R,4S)-4-гидрокси-L-изолейцина увеличивается с использованием бактерии, трансформированной фрагментом ДНК, содержащим ген, кодирующий белок с L-изолейциндиоксигеназной активностью.
Дополнительный пример 1
С целью проверки достаточности делеции генов, кодирующих оксоглутаратдегидрогеназу, для продукции 4HIL, был сконструирован штамм Е.coli MG1655 (ΔsucAB, ΔaceAK). Для этого фрагменты ДНК из хромосомы штамма Е.coli MG1655 (ΔaceAK) (см. Пример 3.2) переносили в штамм MG1655 (ΔsucAB) (см. Пример 3.1) методом Р1 трансдукции (Miller, J.H. Experiments in Molecular Genetics, Cold Spring Harbor Lab. Press, 1972, Plainview, NY). Таким образом был сконструирован штамм MG1655 (ΔsucAB, ΔaceAK).
Плазмиду pEL-IDO вводили в штаммы Е.coli MG1655 (ΔsucAB), Е.coli MG1655 (ΔsucAB, ΔaceAK) и в штамм Е.coli MG1655 как описано выше. Таким образом были получены штаммы Е.coli MG1655 (ΔsucAB) [pEL-IDO], Е.coli MG1655 [pEL-IDO] и Е.coli MG1655 [pEL-IDO].
Полученные штаммы по отдельности культивировали в среде А следующего состава: [(NH4)2SO4 - 1,5 г/100 мл; KH2PO4 - 0,15 г/100 мл; MgSO4 - 0,1 г/100 мл (MgSO4·7H2O - 0,2 г/100 мл); Ile - 100 мМ; FeCl2 - 2 мМ, мел - 2 г/100 мл, Ар - 100 мкг/мл], с добавлением глюкозы (150 мМ). Часть клеточных культур, выросших на чашках с агаром, переносили в 2 мл среды А. Клетки культивировали в 50-мл пробирках при 32°С в течение 72 часов. Концентрации 4HIL и L-изолейцина определяли с использованием метода ВЭЖХ как описано выше. Результаты представлены в Таблице 8. Как видно из Табл.8, штамм E.coli MG1655 (ΔsucAB) [pEL-IDO] с инактивированными генами, кодирующими оксоглутаратдегидрогеназу, накапливает в 2,5 раза больше 4-HIL, чем контрольный штамм MG1655 [pEL-IDO], приблизительно такое же количество 4-HIL, как и штамм MG1655 ΔsucAB, ΔaceAK [pEL-IDO].
Дополнительный пример 2
2.1. Конструирование штамма Е.coli MG1655 (ΔsucAB, ΔaceAK, ΔilvE, PL-brnQ)*
Для делеции гена ilvE выполнили следующие манипуляции. Фрагмент ДНК величиной 1.8 т.п.н., содержащий маркер CmR и промотор Ptac, амплифицировали с помощью ПЦР с использованием олигонуклеотидов SVS_9 (SEQ ID NO: 41) и SVS_11 (SEQ ID NO: 42) в качестве праймеров и хромосомной ДНК штамма MG1655 (attR-Cm-attL-Ptac) (Katashkina J.I. et al., Molekularnaya biologiya (RU), v.39, No.5, 1-10 (2005)) в качестве матрицы. Условия проведения ПЦР были следующие: стадия денатурации в течение 3 мин при 95°С; условия для двух первых циклов: 1 мин при 95°С, 30 с при 50°С, 40 с при 72°С; условия для последних 25 циклов: 30 с при 95°С, 30 с при 54°С, 40 с при 72°С; конечная стадия: 5 мин при 72°С.
Полученный продукт ПЦР величиной 1.8 т.п.н. очищали в агарозном геле и использовали для электропорации в штамм Е.coli MG1655 (ΔsucAB, ΔaceAK, PL-brnQ)*, содержащий плазмиду pKD46 с чувствительной к температуре репликацией.
Электропорацию проводили как описано выше. Клетки после электропорации инкубировали в 1 мл среды SOC при 37°С в течение 2.5 часов и затем высевали на L-агар, содержащий хлорамфеникол (30 мкг/мл), и выращивали при 37°С для отбора CmR рекомбинантов. Затем, для удаления плазмиды pKD46, проводили два пассажа на L-агаре с Cm при 42°С и полученные колонии тестировали на чувствительность к ампициллину.
Таким образом был сконструирован штамм Е.coli MG1655 (ΔsucAB, ΔaceAK, ΔilvE, PL-brnQ)*.
2.2. Продукция 4HIL
Плазмиду pELAC-IDO (Lys, 23) вводили в полученный штамм Е.coli MG1655 (ΔsucAB, ΔaceAK, ΔilvE, PL-brnQ)* как описано выше. Таким образом был получен штамм Е.coli MG1655 (ΔsucAB, ΔaceAK, ΔilvE, PL-brnQ)* [pELAC-IDO (Lys, 23)].
Часть биомассы свежевыращенного на LB-агаре штамма MG1655 (ΔsucAB, ΔaceAK, ΔilvE, PL-brnQ)*[pELAC-IDO (Lys, 23)] и MG1655 (ΔsucAB, ΔaceAK, PL-brnQ)*[pEL-IDO (Lys, 23)] инокулировали в 50 мл бульона LB с добавлением Ар (100 мг/л) и культивировали при 37°С в течение приблизительно 4 часов в колбах на 750 мл. Полученные клеточные культуры использовали в качестве посевного материала для биотрансформации, проведенной на ферментерах "Marubischi". Использовали следующие параметры культивирования: начальный объем культуры - 500 мл; встряхивание - 1200 об/мин; воздух - 1:1; температура культивирования - 34°С; рН 7.0 поддерживался с использованием 2.5М NH4OH.
Инокуляты штаммов MG1655 (ΔsucAB, ΔaceAK, ΔilvE, PL-brnQ)*[pELAC-IDO (Lys, 23)] и MG1655 (ΔsucAB, ΔaceAK, PL-brnQ)*[pELAC-IDO] добавляли к 450 мл среды, содержащей (NH4)2SO4 - 5 г/л; KH2PO4 - 1.5 г/л; MgSO4·7H2O - 1 г/л; FeSO4·7H2O - 0,01 г/л; изолейцин - 22-23 г/л (=170 мМ); глюкоза - 50 г/л; 1 мМ ИПТГ (рН 7 доводят КОН, конечный объем = 500 мл), и культивировали по отдельности в течение 20 часов. Концентрации 4HIL и L-изолейцина определяли с использованием метода ВЭЖХ как описано выше. Результаты приведены в Таблице 9. Как видно из Таблицы 9, введение делеции гена ilvE в штамм Е.coli MG1655 (ΔsucAB, ΔaceAK) [pELAC-IDO (Lys, 23)] приводит к дополнительному увеличению продукции 4HIL.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ КОНСТРУИРОВАНИЯ БАКТЕРИИ-ПРОДУЦЕНТА (2S,3R,4S)-4-ГИДРОКСИ-L-ИЗОЛЕЙЦИНА, БАКТЕРИЯ-ПРОДУЦЕНТ (2S,3R,4S)-4-ГИДРОКСИ-L-ИЗОЛЕЙЦИНА И СПОСОБ ПРОДУКЦИИ (2S,3R,4S)-ГИДРОКСИ-L-ИЗОЛЕЙЦИНА ИЛИ ЕГО СОЛИ | 2007 |
|
RU2395580C2 |
| СПОСОБ ПРОДУКЦИИ 2-АМИНО-3-МЕТИЛ-4-КЕТОПЕНТАНОАТА | 2007 |
|
RU2392323C2 |
| СПОСОБ ПРОДУКЦИИ (2S,3R,4S)-4-ГИДРОКСИ-L-ИЗОЛЕЙЦИНА С ИСПОЛЬЗОВАНИЕМ БАКТЕРИИ, В КОТОРОЙ РАЗРУШЕНА АКТИВНОСТЬ 4-ГИДРОКСИ-L-ИЗОЛЕЙЦИНДЕГИДРОГЕНАЗЫ | 2007 |
|
RU2395578C2 |
| СПОСОБ ПОЛУЧЕНИЯ ГИДРОКСИЛИРОВАННОГО L-ЛЕЙЦИНА И БАКТЕРИЯ, ТРАНСФОРМИРОВАННАЯ ДНК, КОДИРУЮЩЕЙ ДИОКСИГЕНАЗУ | 2011 |
|
RU2468085C1 |
| СПОСОБ ПОЛУЧЕНИЯ L-треонина С ИСПОЛЬЗОВАНИЕМ БАКТЕРИИ, ПРИНАДЛЕЖАЩЕЙ К РОДУ Escherichia | 2006 |
|
RU2351646C2 |
| СПОСОБ ПРОДУКЦИИ 4-ГИДРОКСИ-L-ИЗОЛЕЙЦИНА | 2007 |
|
RU2402608C2 |
| МУТАНТНАЯ АЦЕТОЛАКТАТСИНТАЗА И СПОСОБ ПРОДУКЦИИ РАЗВЕТВЛЕННЫХ L-АМИНОКИСЛОТ | 2006 |
|
RU2355763C2 |
| СПОСОБ ПОЛУЧЕНИЯ L-АМИНОКИСЛОТ С ИСПОЛЬЗОВАНИЕМ БАКТЕРИЙ, ПРИНАДЛЕЖАЩИХ К РОДУ ESCHERICHIA | 2005 |
|
RU2304615C2 |
| СПОСОБ ПОЛУЧЕНИЯ L-АМИНОКИСЛОТ С ИСПОЛЬЗОВАНИЕМ БАКТЕРИИ СЕМЕЙСТВА ENTEROBACTERIACEAE | 2007 |
|
RU2364628C2 |
| СПОСОБ ПОЛУЧЕНИЯ L-АМИНОКИСЛОТ С ИСПОЛЬЗОВАНИЕМ БАКТЕРИИ, ПРИНАДЛЕЖАЩЕЙ К РОДУ ESCHERICHIA | 2005 |
|
RU2311454C2 |







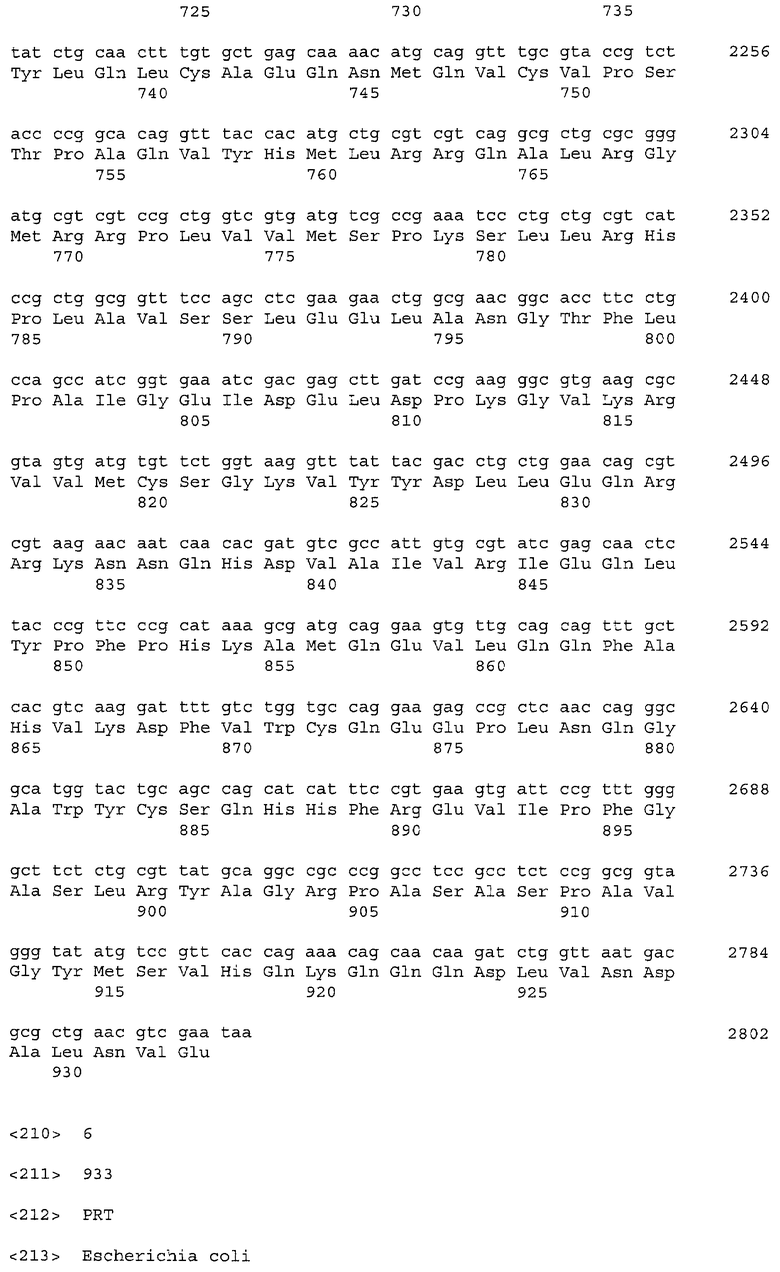




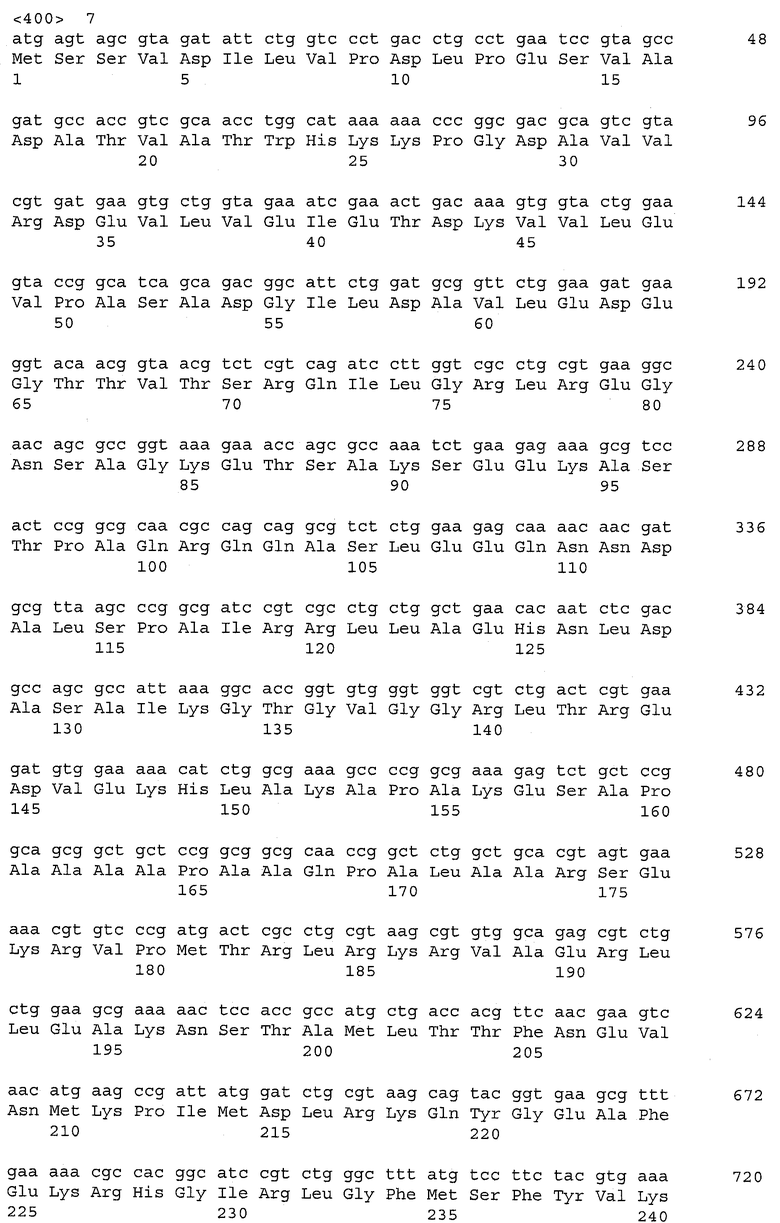
























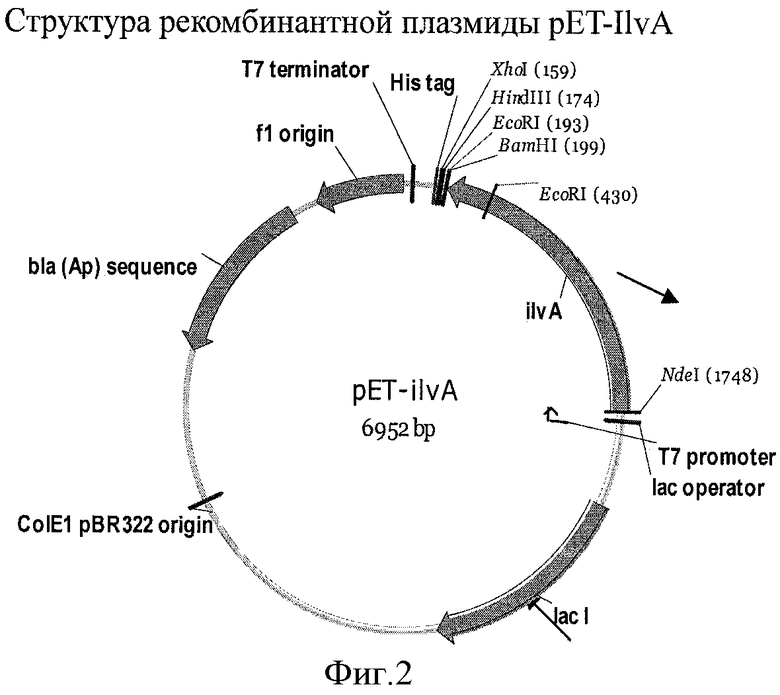
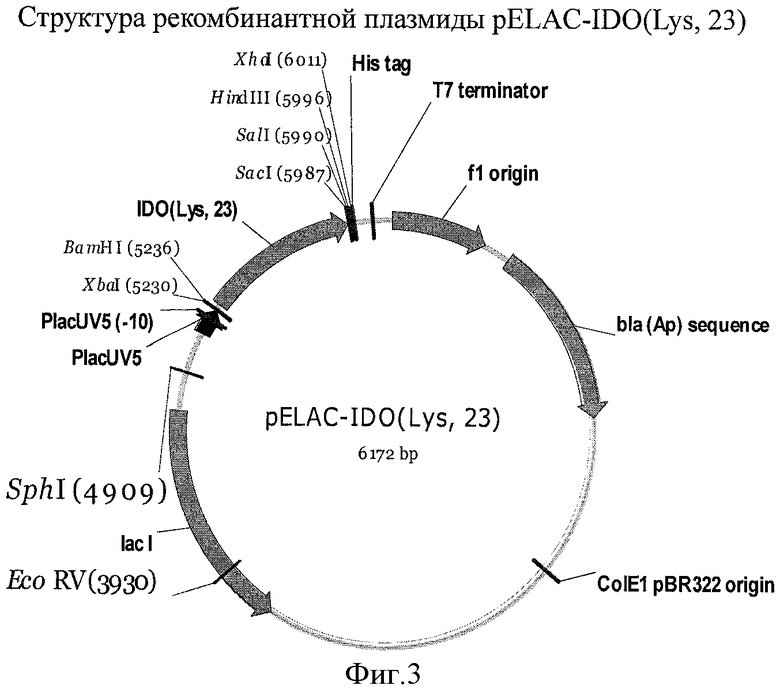
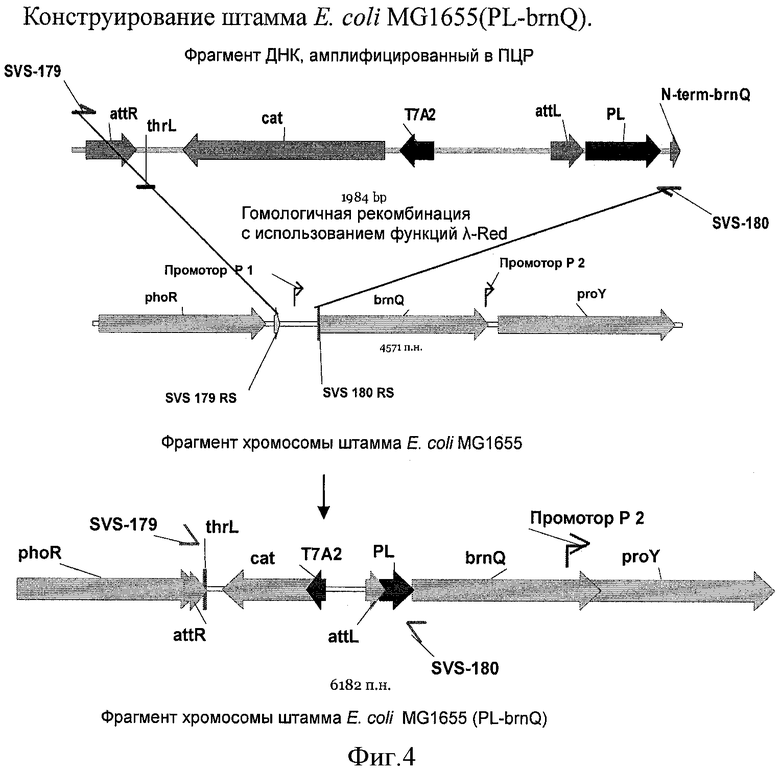
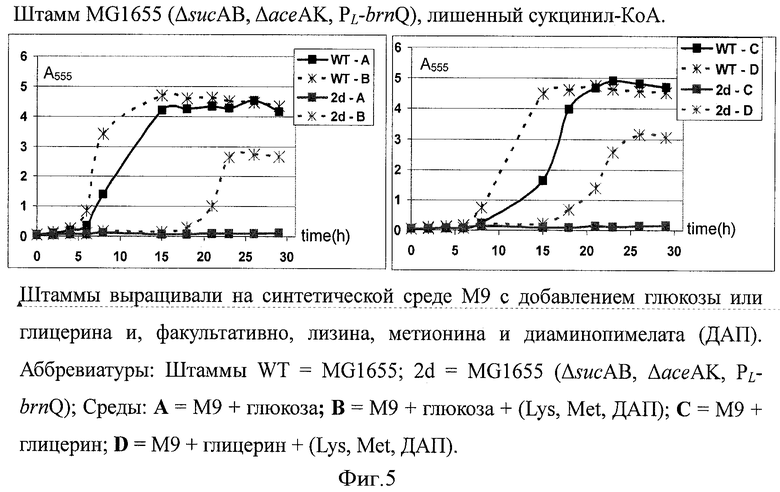
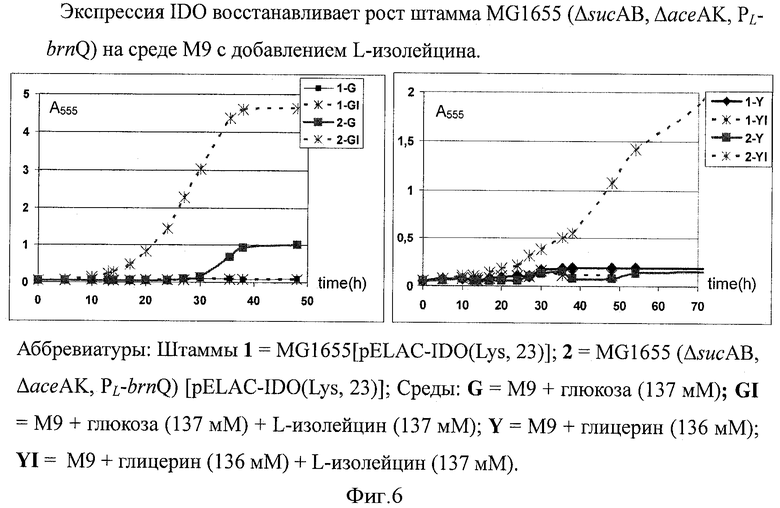
Изобретение относится к биотехнологии, в частности к способу получения продукта реакции, катализируемой белком, обладающим активностью 2-оксоглутарат-зависимого фермента, такого как (2S,3R,4S)-4-гидрокси-L-изолейцин или его соль и 4-гидрокси-L-пролин или его соль, с использованием бактерии, принадлежащей к роду, выбранному из группы, состоящей из Escherichia, Corynebacterium, Arthrobacter, Aspergillus и Bacillus, трансформированной фрагментом ДНК, содержащим ген, кодирующий белок, обладающий активностью 2-оксоглутарат-зависимого фермента, при этом указанная бактерия модифицирована таким образом, что: ген, кодирующий 2-оксоглутаратдегидрогеназу, инактивирован или ген, кодирующий 2-оксоглутаратдегидрогеназу, и ген, кодирующий аминотрансферазу аминокислот с разветвленной цепью, инактивированы. Изобретение позволяет получать (2S,3R,4S)-4-гидрокси-L-изолейцин или его соль и 4-гидрокси-L-пролин или его соль с высокой степенью эффективности. 4 н. и 10 з.п. ф-лы, 6 ил., 9 табл., 9 пр.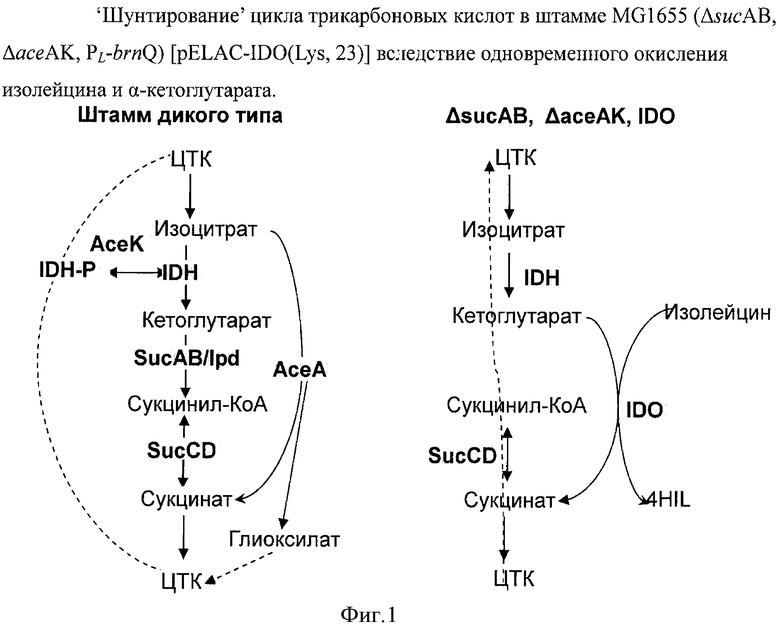
1. Бактерия, принадлежащая к роду, выбранному из группы, состоящей из Escherichia, Corynebacterium, Arthrobacter, Aspergillus и Bacillus, трансформированная фрагментом ДНК, содержащим ген, кодирующий белок, обладающий активностью 2-оксоглутарат-зависимого фермента, отличающаяся тем, что указанная бактерия модифицирована таким образом, что:
ген, кодирующий 2-оксоглутаратдегидрогеназу, инактивирован; или
ген, кодирующий 2-оксоглутаратдегидрогеназу, и ген, кодирующий аминотрансферазу аминокислот с разветвленной цепью, инактивированы,
и указанная бактерия обладает способностью к продукции продукта реакции, катализируемой указанным белком.
2. Бактерия по п.1, отличающаяся тем, что бактерия выбрана из группы, состоящей из Escherichia coli, Arthrobacter simplex, Corynebacterium glutamicum, Arthrobacter globiformis, Arthrobacter sulfureus, Arthrobacter viscosus и Bacillus subtilis.
3. Бактерия по п.1, отличающаяся тем, что указанный ген, кодирующий 2-оксоглутаратдегидрогеназу, инактивирован за счет делеции указанного гена в хромосоме бактерии.
4. Бактерия по п.1, отличающаяся тем, что указанный ген, кодирующий аминотрансферазу аминокислот с разветвленной цепью, инактивирован за счет делеции указанного гена в хромосоме бактерии.
5. Способ получения продукта реакции, катализируемой белком, обладающим активностью 2-оксоглутарат-зависимого фермента, включающий:
выращивание бактерии по любому из пп.1-4 в питательной среде, содержащей субстрат указанной реакции; и
выделение указанного продукта из культуральной жидкости.
6. Бактерия по п.1, отличающаяся тем, что указанный белок обладает активностью L-изолейциндиоксигеназы, а указанным продуктом является (2S,3R,4S)-4-гидрокси-L-изолейцин.
7. Бактерия по п.1, отличающаяся тем, что указанная бактерия модифицирована таким образом, что в ней усилена экспрессия гена, кодирующего транспортер L-изолейцина.
8. Бактерия по п.6, отличающаяся тем, что ген, кодирующий белок с активностью L-изолейциндиоксигеназы, выбран из группы, состоящей из:
(a) ДНК, включающей нуклеотидную последовательность, приведенную в Перечне последовательностей под номером 1 (SEQ ID NO: 1);
(b) ДНК, гибридизующейся в жестких условиях с ДНК, включающей нуклеотидную последовательность, комплементарную нуклеотидной последовательности, приведенной в Перечне последовательностей под номером 1 (SEQ ID NO: 1), при этом указанная ДНК кодирует белок с активностью L-изолейциндиоксигеназы;
(c) ДНК, включающей нуклеотидную последовательность, кодирующую белок, включающий аминокислотную последовательность, приведенную в Перечне последовательностей под номером 2 (SEQ ID NO: 2);
(d) ДНК, включающей нуклеотидную последовательность, кодирующую белок, включающий аминокислотную последовательность, приведенную в Перечне последовательностей под номером 2 (SEQ ID NO: 2), за исключением того, что указанная аминокислотная последовательность содержит замену, делецию, вставку, добавление или инверсию одного или нескольких аминокислотных остатков, и при этом указанный белок проявляет активность L-изолейциндиоксигеназы; и
(е) ДНК, включающей нуклеотидную последовательность, кодирующую белок, включающий аминокислотную последовательность, гомологичную по крайней мере на 98% аминокислотной последовательности, приведенной в Перечне последовательностей под номером 2 (SEQ ID NO: 2), при этом указанный белок проявляет активность L-изолейциндиоксигеназы.
9. Бактерия по п.7, отличающаяся тем, что геном, кодирующим транспортер L-изолейцина, является ген brnQ из Escherichia coli.
10. Способ получения (2S,3R,4S)-4-гидрокси-L-изолейцина или его соли, включающий:
выращивание бактерии по любому из пп.6-9 в питательной среде, содержащей L-изолейцин; и
выделение (2S,3R,4S)-4-гидрокси-L-изолейцина из культуральной жидкости.
11. Способ по п.10, отличающийся тем, что питательная среда содержит источник углерода, выбранный из группы, состоящей из углевода и спирта.
12. Способ по п.11, отличающийся тем, что указанным углеводом является глюкоза, а указанным спиртом является глицерин.
13. Бактерия по п.1, отличающаяся тем, что указанный белок обладает активностью L-пролингидроксилазы, а указанным продуктом является 4-гидрокси-L-пролин.
14. Способ получения 4-гидрокси-L-пролина или его соли включающий:
выращивание бактерии по п.13 в питательной среде, содержащей L-пролин; и
выделение 4-гидрокси-L-пролина из культуральной жидкости.
| WO 2008044614 A1, 17.04.2008 | |||
| WO 1993004181 A1, 04.03.1993 | |||
| US 20070043240 A1, 22.02.2007 | |||
| US 2003219880 A1, 27.11.2003 | |||
| RU 2006106311 A, 20.09.2007. |
Авторы
Даты
2012-03-10—Публикация
2008-12-22—Подача