Область техники
Настоящее изобретение относится к микробиологической промышленности и, в частности, к ранее неизвестной дегидрогеназе и способу получения 2-амино-3-метил-4-кетопентаноата или его соли.
Описание предшествующего уровня техники
Поиск микроорганизмов, вырабатывающих вещества, ингибирующие стимулируемый витамином B12 рост Escherichia coli штамма (Davis 113-3) привел к отбору штамма Bacillus cereus, обладающего такой способностью. 2-амино-4-кето-3-метилпентановая кислота была выделена как смесь диастереомеров при ферментации В. cereus 439 и, как обнаружено, является антиметаболитом витамина B12 в системе биоанализа, основанной на использовании штамма Е.coli (Davis 113-3), для роста которого требуется витамин B12. Подобная смесь диастереомеров с биоактивностью была синтезирована при конденсации 2-бром-3-бутанона с натрийдиэтилацетамидомалонатом с последующим гидролизом 6 н. HCl и очисткой методом ионообменной хроматографии. Эффект ингибирования роста антиметаболитами аннулировали витамин B12, L-метионин, L-изолейцин, L-лейцин, L-валин и D-аланин (Perlman D. et al, Bioorganic Chemistry, 6(3), 263-71(1977)).
4-гидрокси-L-изолейцин является аминокислотой, которую можно выделить и очистить из семян пажитника (Trigonella foenum-graecum L. legummosae). 4-гидрокси-L-изолейцин проявляет инсулинотропную активность, представляющую большой интерес, поскольку его стимулирующий эффект четко зависит от концентрации глюкозы в среде, как показано и на выделенной перфузионной поджелудочной железе крыс, и на островках поджелудочной железы человека (Sauvaire, Y. et al, Diabetes, 47: 206-210, (1998)). Такая глюкозная зависимость не подтверждена на сульфонилмочевине (Drucker, D. J., Diabetes 47: 159-169, (1998)), единственном инсулинотропном препарате, используемом в настоящее время для лечения диабета II типа [или диабета, независимого от инсулина-non-insulin-dependent diabetes (NIDD) mellitus (NIDDM)], и в результате гипогликемия является распространенным нежелательным побочным эффектом при лечении сульфонилмочевиной (Jackson, J., and Bessler, R. Drugs, 22: 211-245; 295-320, (1981); Jennings, A. et al. Diabetes Care, 12: 203-208, (1989)). Повышение глюкозной толерантности также известно (Am. J. Physiol. Endocrinol., Vol.287, E463-E471, 2004). Сообщено об этом повышении активности глюкометаболизма и его потенциальном применении в фармацевтике и здоровом питании (выложенная патентная заявка Японии No. Hei 6-157302, заявка США US 2007-000463A1).
Однако в настоящее время отсутствуют сообщения о клонировании какой-либо 4-гидрокси-L-изолейциндегидрогеназы и продукции 2-амино-3-метил-4-кетопентаноата из L-изолейцина с использованием L-изолейциндиоксигеназы и 4-гидрокси-L-изолейциндегидрогеназы.
Описание изобретения
Целью настоящего изобретения является продукция 2-амино-3-метил-4-кетопентаноата (используемое обозначение включает в себя как свободную форму, так и его соли, может использоваться аббревиатура "АМКР"(от 2-amino-3-methyl-4-ketopentanoate), в дальнейшем обозначает то же самое), предоставить способ производства АМКР из L-изолейцина с использованием L-изолейциндиоксигеназы (IDO, L-isoleucine dioxygenase) и 4-гидрокси-L-изолейциндегидрогеназы (HIDH, 4-hydroxy-L-isoleucine dehydrogenase) или бактерии, обладающей активностью L-изолейциндиоксигеназы и активностью 4-гидрокси-L-изолейциндегидрогеназы. А именно, цели настоящего изобретения включают предоставление новой 4-гидрокси-L-изолейциндегидрогеназы и ДНК, кодирующей 4-гидрокси-L-изолейциндегидрогеназу, и способ продукции АМКР из L-изолейцина с использованием L-изолейциндиоксигеназы и 4-гидрокси-L-изолейциндегидрогеназы. Вышеуказанные цели были достигнуты путем обнаружения новой 4-гидрокси-L-изолейциндегидрогеназы настоящего изобретения.
Более детально настоящее изобретение описано ниже.
Целью настоящего изобретения является предоставление ДНК, выбранной из группы, состоящей из:
(a) ДНК, включающая нуклеотидную последовательность SEQ ID No:5;
(b) ДНК, гибридизующаяся в жестких условиях с ДНК, имеющей нуклеотидную последовательность, комплементарную нуклеотидной последовательности SEQ ID No:5, и кодирующая белок, обладающий 4-гидрокси-L-изолейциндегидрогеназной активностью;
(c) ДНК, кодирующая белок, включающий аминокислотную последовательность SEQ ID No:6;
(d) ДНК, кодирующая белок с аминокислотной последовательностью, включающей замену, делению, вставку, добавление или инверсию одного или нескольких аминокислотных остатков в аминокислотной последовательности SEQ ID No:6, и обладающий 4-гидрокси-L-изолейциндегидрогеназной активностью; и
(e) ДНК, кодирующая белок с аминокислотной последовательностью, по крайней мере на 70% гомологичной аминокислотной последовательности SEQ ID NO:6, и обладающий 4-гидрокси-L-изолейциндегидрогеназной активностью.
Также целью настоящего изобретения является предоставление рекомбинантной ДНК, полученной лигированием вышеописанной ДНК с векторной ДНК. Также целью настоящего изобретения является предоставление клетки, трансформированной вышеописанной рекомбинантной ДНК.
Также целью настоящего изобретения является предоставление способа получения белка, обладающего 4-гидрокси-L-изолейциндегидрогеназной активностью, включающего: культивирование вышеописанной клетки в питательной среде и накопление белка, обладающего 4-гидрокси-L-изолейциндегидрогеназной активностью, в питательной среде или/и клетке.
Также целью настоящего изобретения является предоставление белка, выбранного из группы, состоящей из:
(f) белок, аминокислотная последовательность которого включает последовательность SEQ ID No:6;
(g) белок с аминокислотной последовательностью, содержащей замену, делецию, вставку, добавление или инверсию одного или нескольких аминокислотных остатков в аминокислотной последовательности SEQ ID No:6, и обладающий 4-гидрокси-L-изолейциндегидрогеназной активностью; и
(h) белок с аминокислотной последовательностью, по крайней мере на 70% гомологичной аминокислотной последовательности SEQ ID NO:6, и обладающий 4-гидрокси-L-изолейциндегидрогеназной активностью.
Также целью настоящего изобретения является предоставление способа продукции 2-амино-3-метил-4-кетопентаноата или его соли, включающего стадии:
реакции L-изолейцина в водном растворе в присутствии L-изолейциндиоксигеназы и по крайней мере одной 4-гидрокси-L-изолейциндегидрогеназы, выбранной из группы, состоящей из:
(f) белок, аминокислотная последовательность которого включает последовательность SEQ ID No:6;
(g) белок с аминокислотной последовательностью, содержащей замену, делецию, вставку, добавление или инверсию одного или нескольких аминокислотных остатков в аминокислотной последовательности SEQ ID No:6, и обладающий 4-гидрокси-L-изолейциндегидрогеназной активностью; и
(h) белок с аминокислотной последовательностью, по крайней мере на 70% гомологичной аминокислотной последовательности SEQ ID NO:6, и обладающий 4-гидрокси-L-изолейциндегидрогеназной активностью;
выделение синтезированного 2-амино-3-метил-4-кетопентаноата.
Также целью настоящего изобретения является предоставление способа продукции 2-амино-3-метил-4-кетопентаноата или его соли, включающего стадии:
реакции L-изолейцина в водном растворе в присутствии бактерии, содержащей L-изолейциндиоксигеназу и по крайней мере одну 4-гидрокси-L-изолейциндегидрогеназу, выбранную из группы, состоящей из:
(f) белок, аминокислотная последовательность которого включает последовательность SEQ ID No:6;
(g) белок с аминокислотной последовательностью, содержащей замену, делецию, вставку, добавление или инверсию одного или нескольких аминокислотных остатков в аминокислотной последовательности SEQ ID No:6, и обладающий 4-гидрокси-L-изолейциндегидрогеназной активностью; и
(h) белок с аминокислотной последовательностью, по крайней мере на 70% гомологичной аминокислотной последовательности SEQ ID NO:6, и обладающий 4-гидрокси-L-изолейциндегидрогеназной активностью;
выделения синтезированного 2-амино-3-метил-4-кетопентаноата.
Также целью настоящего изобретения является предоставление вышеописанного способа, отличающегося тем, что бактерия модифицирована с целью увеличения активности 4-гидрокси-L-изолейциндегидрогеназы.
Также целью настоящего изобретения является предоставление вышеописанного способа, отличающегося тем, что бактерия модифицирована с целью увеличения активности L-изолейциндиоксигеназы и 4-гидрокси-L-изолейциндегидрогеназы.
Также целью настоящего изобретения является предоставление вышеописанного способа, отличающегося тем, что активность белка увеличена путем усиления экспрессии гена, кодирующего указанный белок.
Также целью настоящего изобретения является предоставление вышеописанного способа, отличающегося тем, что экспрессия гена усилена путем модификации последовательности, контролирующей экспрессию гена, кодирующего белок, или увеличения числа копий гена, кодирующего белок.
Также целью настоящего изобретения является предоставление вышеописанного способа, отличающегося тем, что бактерия принадлежит к роду Escherichia, Pseudomonas, Corynebacterium, Arthrobacter, Aspergillus или Bacillus.
Также целью настоящего изобретения является предоставление вышеописанного способа, отличающегося тем, что бактерия принадлежит к Escherichia coli, Arthrobacter simplex, Corynebacterium glutamicum, Arthrobactor globiformis, Arthrobactor sulfureus, Arthrobactor viscosus или Bacillus subtilis.
Также целью настоящего изобретения является предоставление вышеописанного способа, отличающегося тем, что бактерия - бактериальная культура, клетки, обработанные клетки или клеточный лизат.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На Фиг.1 показан предполагаемый путь синтеза АМКР в Bacillus thuringiensis.
На Фиг.2 показаны: А - Согласование трансляции IDO (RBTH_06809) с трансляцией HIDH (RBTH_06810) с использованием "ATGA" трансляционного сопряжения; В - Структура сконструированной рекомбинантной плазмиды, содержащей IDO-HIDH оперон.
На Фиг.3 показан результат выравнивания аминокислотных последовательностей HIDH Bacillus thuringiensis serovar israelensis ATCC 35646 (ZP_00738909), короткоцепочечной дегидрогеназы/редуктазы SDR Bacillus weihenstephanensis KBAB4 (ZP_01182591), 3-оксоацил-[ацил-переносящий белок]-редуктазы Bacillus cereus ATCC 14579 (NP_830848), гипотетического белка GOS_9257808 [метагеном морского вида] (ЕВН46681) и 3-оксоацил-[ацил-переносящий белок]-редуктазы Pseudomonas syringae pv. phaseolicola 1448A(YP_276118).
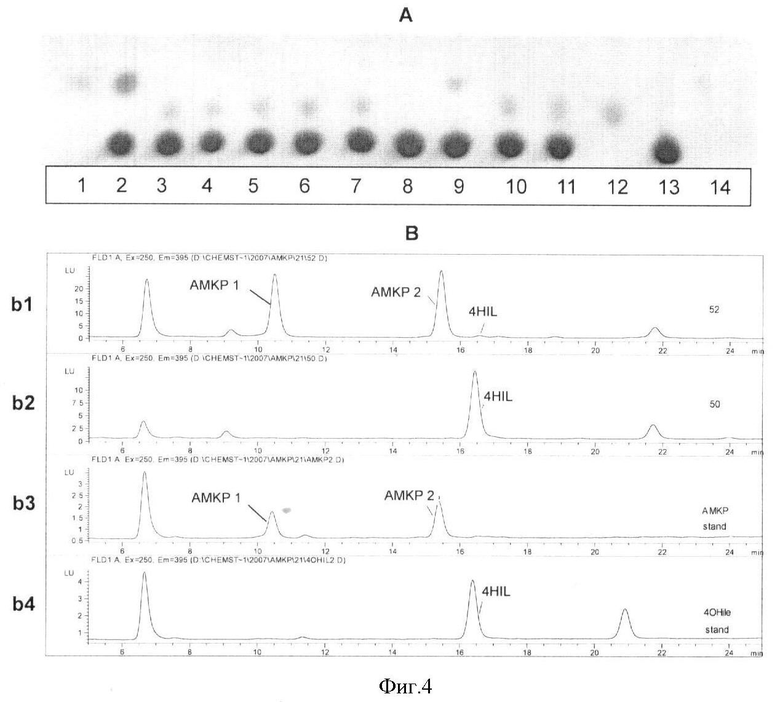
На Фиг.4 показана биоконверсия изолейцина в АМКР с использованием штама Е.coli, обладающего активностями IDO и HIDH. А - ТСХ анализ продукции АМКР. Дорожки: 1, 14 - стандартный 4HIL; 12 - стандартный АМКР; 13 - стандартный Ile; 2 - культуральная жидкость штамма TG1 [pMW119-IDO (2-е-2)]; 3-7 - культуральная жидкость штаммов TG1 [pMW119-IDO-HIDH (2-е-2)] (пять независимых клонов); 8 - культуральная жидкость штамма TG1 [pMW119]; 9- культуральная жидкость штамма TG1 [pMW119-IDO(VKPM В-197)]; 10-11 - культуральная жидкость штаммов TG1 [pMW119-IDO-HIDH (VKPM В-197)] (два независимых клона). В - ВЭЖХ анализ продукции АМКР. b1 - культуральная жидкость штамма TG1 [pMW119-IDO-HIDH (2-е-2)]; b2 - культуральная жидкость штамма TG1 [pMW119-IDO (2-е-2)]; b3 - стандартный АМКР; b4 - стандартный 4HIL.
ПОДРОБНОЕ ОПИСАНИЕ НАИЛУЧШЕГО СПОСОБА ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
В настоящем изобретении "2-амино-3-метил-4-кетопентаноат" или "АМКР" относится к отдельному(ым) химическому(им) соединению(ям) (2S,3S)-2-амино-3-метил-4-кетопентаноату или/и (2S,3R)-2-амино-3-метил-4-кетопентаноату или смеси, содержащей (2S,3S)-2-амино-3-метил-4-кетопентаноат или/и (2S,3R)-2-амино-3-метил-4-кетопентаноат.
В настоящем изобретении термин "(2S,3R,4S)-4-гидрокси-L-изолейцин" или "(2S,3R,4S)-4HIL" относится к отдельному химическому соединению или смеси, содержащей (2S,3R,4S)-4-гидроксиизолейцин.
Термин "бактерия", как он используется в настоящем описании, включает образующую фермент бактерию, мутант и генетический рекомбинант такой бактерии, в которой существует или увеличена целевая ферментативная активность, и т.п.
Авторы настоящего изобретения получили АМКР как побочный продукт при продукции (2S,3R,4S)-4HIL. Основываясь на экспериментальных данных, изобретатели предположили предполагаемый путь синтеза АМКР (Фиг.1). Он включает гидроксилирование изолейцина L-изолейциндиоксигеназой (IDO) и последующее окисление полученного (2S,3R,4S)-4HIL специфической 4-гидроксиизолейциндегидро-геназой (HIDH). Анализ генома Bacillus thuringiensis показал, что трансляция гена IDO (RBTH_06809) сопряжена с трансляцией следующего за ним гена RBTH_06810 (Фиг.2). Обычно такая "синхронизация " используется для эквимолярного синтеза ферментов, катализирующих последовательные реакции. Более того, RBTH_06810 кодирует гомолог 3-оксоацил-[ацил-переносящий белок] редуктазы (дегидрогеназы). Поэтому предположили, что этот ген кодирует HIDH.
Далее предоставляется детальное описание [I] L-изолейциндиоксигеназы, [II] 4-гидрокси-L-изолейциндегидрогеназы, [III] способа получения 2-амино-3-метил-4-кетопентаноата из L-изолейцина с использованием L-изолейциндиоксигеназы и 4-гидрокси-L-изолейциндегидрогеназы настоящего изобретения со ссылкой на соответствующие рисунки.
[I] L-изолейциндиоксигеназа
Согласно исследованиям, проведенным изобретателями настоящего изобретения, было подтверждено, что бактериальные штаммы рода Bacillus содержат L-изолейциндиоксигеназу, обладающую способностью образовывать (2S,3R,4S)-4HIL. L-изолейциндиоксигеназа из микробных клеток в дальнейшем обозначается как аббревиатура IDO.
(1) ДНК, кодирующая L-изолейциндиоксигеназу
ДНК, кодирующая IDO штамма Bacillus thuringiensis 2-e-2 (FERM BP-10688) настоящего изобретения показана в Перечне последовательностей под номером SEQ ID No:1. Кроме того, аминокислотная последовательность IDO, кодируемой нуклеотидной последовательностью SEQ ID NO:1, показана в SEQ ID No:2. SEQ ID NO:2 - аминокислотная последовательность IDO, кодируемой нуклеотидной последовательностью SEQ ID NO:1. IDO с последовательностью SEQ ID NO:2 обладает L-изолейциндиоксигеназной активностью и катализирует реакцию, в которой (2S,3R,4S)-4HIL образуется в результате прямого синтеза из одной молекулы L-изолейцина.
ДНК, кодирующая IDO штамма Bacillus thuringiensis (serovar israelensis) (ATCC 35646) настоящего изобретения, которая идентифицируется, как упомянуто в разделе Примеры, показана в Перечне последовательностей под номером SEQ ID No:3. Кроме того, аминокислотная последовательность IDO, кодируемой нуклеотидной последовательностью SEQ ID NO:3, показана в SEQ ID No:4. SEQ ID NO:4 - аминокислотная последовательность IDO, кодируемой нуклеотидной последовательностью SEQ ID NO:3. IDO с последовательностью SEQ ID NO:4 обладает L-изолейциндиоксигеназной активностью и катализирует реакцию, в которой (2S,3R,4S)-4HIL образуется в результате прямого синтеза из одной молекулы L-изолейцина.
ДНК, кодирующая IDO, катализирующую реакцию, в которой (2S,3R,4S)-4HIL образуется из L-изолейцина, - не только ДНК, показанные в SEQ ID No:1 и SEQ ID No:3. Это связано с различиями в нуклеотидных последовательностях, наблюдающихся для каждого вида и штамма среди видов Bacillus, которые образуют IDO, катализирующую реакцию образования (2S,3R,4S)-4HIL из L-изолейцина.
ДНК настоящего изобретения не только включает выделенные ДНК, кодирующие IDO, но ДНК, в которых в ДНК, кодирующей IDO, выделенной из хромосомной ДНК IDO-продуцирующих микроорганизмов, искусственно введены мутации, также включены в ДНК настоящего изобретения при условии, что ДНК кодирует IDO с активностью, катализирующей указанную реакцию. Методы для искусственного введения мутаций включают обычно используемые методы, такие как метод для введения сайт-специфических мутаций, описанных в Method, in Enzymol., 154 (1987).
ДНК, гибридизующаяся в жестких условиях с ДНК с нуклеотидной последовательностью, комплементарной нуклеотидной последовательности SEQ ID No:1 или SEQ ID No:3, кодирующая белок, обладающий активностью IDO, также включена в ДНК настоящего изобретения. Как используется здесь, термин "жесткие условия" означает такие условия, при которых специфические гибриды образуются, тогда как неспецифические гибриды не образуются. Хотя количественное описание этих условий является затруднительным, в качестве примера можно сослаться на условия, при которых молекулы ДНК, имеющие более высокую гомологию, предпочтительно не менее 70%, более предпочтительно не менее 80%, еще более предпочтительно не менее 90% и особенно предпочтительно не менее 95% или более, гибридизуются друг с другом, тогда как молекулы ДНК, имеющие более низкую гомологию, не гибридизуются друг с другом, или такие условия, при которых гибридизация имеет место при обычных условиях отмывки во время проведения гибридизации по Саузерну, которая проводится при концентрации солей, 0.1×SSC, 0.1% SDS при температуре 37°С, предпочтительно 0.1×SSC, 0.1% SDS при температуре 60°С, и более предпочтительно 0.1×SSC, 0.1% SDS при температуре 65°С. Длина зонда может быть выбрана соответствующим образом в зависимости от условий гибридизации и обычно варьирует от 100 п.о. до 1 тыс. п.о. Кроме того, определения "L-изолейциндиоксигеназная активность" может быть достаточно для активности, которая синтезирует (2S,3R,4S)-4HIL из L-изолейцина. Однако в случае, если нуклеотидная последовательность гибридизуется в жестких условиях с нуклеотидной последовательностью, комплементарной нуклеотидной последовательности SEQ ID No:1 или SEQ ID No:3, она предпочтительно сохраняет L-изолейциндиоксигеназную активность величиной 10% или более, предпочтительно 30% или более, более предпочтительно 50% или более, и еще более предпочтительно 70% или более, относительно белка с аминокислотной последовательностью SEQ ID No:2 или SEQ ID No:4 в условиях 37°С и pH 8.
L-изолейциндиоксигеназная активность IDO может быть определена путем анализа образования (2S,3R,4S)-4HIL из L-изолейцина с использованием высокоэффективной жидкостной хроматографии (ВЭЖХ) (см. Примеры 3 и 4).
Кроме того, ДНК, кодирующая белок, по существу идентичный IDO, кодируемой ДНК SEQ ID No:1 и SEQ ID No:3, также включена в ДНК настоящего изобретения. А именно, следующие ДНК также включены в настоящее изобретение:
(a) ДНК, включающая нуклеотидную последовательность SEQ ID No:1 или SEQ ID No:3;
(b) ДНК, гибридизующаяся в жестких условиях с ДНК с нуклеотидной последовательностью, комплементарной нуклеотидной последовательности SEQ ID No:1 или SEQ ID No:3, и кодирующая белок, обладающий L-изолейциндиоксигеназной активностью;
(c) ДНК, кодирующая белок, включающий аминокислотную последовательность SEQ ID No:2 или SEQ ID No:4;
(d) ДНК, кодирующая белок с аминокислотной последовательностью, которая содержит замену, делецию, вставку, добавление или инверсию одной или нескольких аминокислот в последовательности SEQ ID No:2 или SEQ ID No:4, и обладающий L-изолейциндиоксигеназной активностью; и
(е) ДНК, кодирующая белок с аминокислотной последовательностью, гомологичной по крайней мере на 70%, предпочтительно гомологичной по крайней мере на 80%, более предпочтительно гомологичной по крайней мере на 90% и еще более предпочтительно гомологичной по крайней мере на 95% аминокислотной последовательности SEQ ID NO:2 или SEQ ID No:4, и обладающий L-изолейциндиоксигеназной активностью.
Здесь "один или несколько" означает диапазон, вне которого стереоизомерия аминокислотных остатков белка или активность L-изолейциндиоксигеназы изменяется незначительно и, в частности, соответствует значениям от 1 до 20, предпочтительно от 1 до 15, более предпочтительно от 1 до 10 и еще более предпочтительно от 1 до 5.
Замена, делеция, вставка, добавление или инверсия одного или нескольких аминокислотных остатков будут представлять собой консервативную(ые) мутацию(и) при условии, что активность фермента при этом сохраняется. Примером консервативной мутации(ий) является(ются) консервативная(ые) замена(ы). Примеры консервативных замен включают замену Ala на Ser или Thr, замену Arg на Gln, His или Lys, замену Asn на Glu, Gln, Lys, His или Asp, замену Asp на Asn, Glu или Gln, замену Cys на Ser или Ala, замену Gln на Asn, Glu, Lys, His, Asp или Arg, замену Glu на Asn, Gln, Lys или Asp, замену Gly на Pro, замену His на Asn, Lys, Gln, Arg или Tyr, замену Ilе на Leu, Met, Val или Phe, замену Leu на Ile, Met, Val или Phe, замену Lys на Asn, Glu, Gln, His или Arg, замену Met на Ile, Leu, Val или Phe, замену Phe на Trp, Tyr, Met, Ile или Leu, замену Ser на Thr или Ala, замену Thr на Ser или Ala, замену Trp на Phe или Tyr, замену Tyr на His, Phe или Trp и замену Val на Met, He или Leu.
(2) Способ получения L-изолейциндиоксигеназы
Предоставляется описание способа получения IDO настоящего изобретения. Существует два способа получения IDO настоящего изобретения. Они состоят из (i) способа культивирования IDO-продуцирующего микроорганизма для образования и накопления IDO, и (ii) способа конструирования трансформанта для образования IDO с использованием технологии рекомбинантной ДНК и культивирования трансформантов для накопления IDO.
Оба способа могут быть осуществлены таким же образом, как описано ниже в [II] (3).
[II] 4-гидрокси-L-изолейциндегидрогеназа
Согласно исследованиям изобретателей настоящего изобретения, было подтверждено, что бактериальные штаммы содержат 4-гидрокси-L-изолейциндегидрогеназу, обладающую способностью образовывать (2S,3S)-2-амино-3-метил-4-кетопентаноат или/и (2S,3R)-2-амино-3-метил-4-кетопентаноат из (2S,3R,4S)-4HIL, образованного из L-изолейцина благодаря активности IDO в бактерии, принадлежащей к роду Bacillus. 4-гидрокси-L-изолейциндегидрогеназа из микробных клеток в дальнейшем обозначается как аббревиатура HIDH.
ДНК, кодирующая HIDH штамма Bacillus thuringiensis serovar israelensis (ATCC 35646)
(http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?db=genome&cmd=Retrieve&dopt=Overview&list_uids=5343) показана в Перечне последовательностей под номером SEQ ID No:5. Кроме того, аминокислотная последовательность HIDH, кодируемой нуклеотидной последовательностью SEQ ID NO:5, показана в SEQ ID No:6. SEQ ID NO:6 - аминокислотная последовательность HIDH, кодируемой нуклеотидной последовательностью SEQ ID NO:5. HIDH с последовательностью SEQ ID NO:6 обладает 4-гидрокси-L-изолейциндегидрогеназной активностью и катализирует реакцию, в которой АМКР образуется в результате прямого синтеза из (2S,3R,4S)-4HIL.
Далее предоставляется детальное описание (1) ДНК, кодирующей 4-гидрокси-L-изолейциндегидрогеназу, (2) свойства 4-гидрокси-L-изолейциндегидрогеназы и (3) способа получения 4-гидрокси-L-изолейциндегидрогеназы в указанном порядке.
(1) ДНК, кодирующая 4-гидрокси-L-изолейциндегидрогеназу
Ген HIDH настоящего изобретения, имеющий нуклеотидную последовательность SEQ ID No:5, был выделен из хромосомной ДНК штамма Bacillus thuringiensis (serovar israelensis) (ATCC 35646), полученного во Всероссийской Коллекции Промышленных Микроорганизмов (ВКПМ) и хранящегося под инвентарным номером VKPM В-197, как описано в разделе Примеры. Амнокислотная последовательность HIDH, кодируемой нуклеотидной последовательностью SEQ ID NO:5, показанная в SEQ ID No:6, демонстрирует высокую степень гомологии с аминокислотной последовательностью (Фиг.3) 3-оксоацил-[ацил-переносящий белок] редуктазы Bacillus thuringiensis serovar israelensis (ATCC 35646), короткоцепочечной дегидрогеназы/редуктазы SDR Bacillus weihenstephanensis KBAB4, 3-оксоацил-[ацил-переносящий белок] редуктазы Bacillus cereus (ATCC 14579), гипотетического белка GOS_9257808 метагенома морского вида 3-оксоацил-[ацил-переносящий белок] редуктазы Pseudomonas syringae pv. phaseolicola 1448A.
Фрагмент ДНК, кодирующий IDO, может быть получен в ПЦР с использованием предназначенных для этого праймеров, сконструированных на основе последовательности штамма Bacillus thuringiensis (serovar israelensis) (ATCC 35646).
Процедура ПЦР описана в публикациях, таких как White, T.J. et al., Trends Genet. 5, 185 (1989). Метод выделения хромосомной ДНК так же, как метод выделения необходимых молекул ДНК из библиотеки генов с использованием молекул ДНК в качестве зондов, описан в публикациях, таких как Molecular Cloning, 3rd edition, Cold Spring Harbor Laboratory Press (2001).
Метод определения нуклеотидной последовательности изолированной ДНК, кодирующей HIDH, описан в Practical Guide to Molecular Cloning, John Wiley & Sons, Inc. (1985). Кроме того, нуклеотидная последовательность может быть определена с помощью ДНК-Секвенатора, предлагаемого фирмой Applied Biosystems (США). Нуклеотидная последовательность, кодирующая HIDH штамма Bacillus thuringiensis (serovar israelensis) ATCC 35646 (VKPM В-197), показана в SEQ ID No:5.
ДНК, кодирующая HIDH, катализирующий реакцию, в которой АМКР образуется из (2S,3R,4S)-4HIL, не только ДНК, показанная в SEQ ID No:5. Это связано с различиями в нуклеотидных последовательностях, наблюдающихся для каждого вида и штамма среди видов Bacillus, которые образуют HIDH, катализирующую реакцию образования АМКР из (2S,3R,4S)-4HIL.
ДНК настоящего изобретения включает не только выделенную ДНК, кодирующую HIDH, но ДНК, в которой в ДНК, кодирующую HIDH, выделенную из хромосомной ДНК HIDH-продуцирующего микроорганизма, искусственно введены мутации, также включена в ДНК настоящего изобретения, при условии что она кодирует HIDH, катализирующую указанную реакцию. Методы для искусственного введения мутаций включают обычно используемые методы, такие как метод для введения сайт-специфических мутаций, описанных в Method, in Enzymol., 154 (1987).
ДНК, гибридизующаяся в жестких условиях с ДНК с нуклеотидной последовательностью, комплементарной нуклеотидной последовательности SEQ ID No:5, кодирующая белок, обладающий активностью HIDH, также включена в ДНК настоящего изобретения. Кроме того, определения "4-гидрокси-L-изолейциндегидрогеназная активность" может быть достаточно для активности, которая синтезирует АМКР из (2S,3R,4S)-4HIL. Однако в случае, если нуклеотидная последовательность гибридизуется в жестких условиях с нуклеотидной последовательностью, комплементарной нуклеотидной последовательности SEQ ID No:5, она предпочтительно сохраняет 4-гидрокси-L-изолейциндегидрогеназную активность величиной 10% или более, предпочтительно 30% или более, более предпочтительно 50% или более и еще более предпочтительно 70% или более, относительно белка с аминокислотной последовательностью SEQ ID No:6 в условиях 37°С и pH 8.
4-гидрокси-L-изолейциндегидрогеназная активность HIDH может быть определена путем анализа образования АМКР из (2S,3R,4S)-4HIL с использованием высокоэффективной жидкостной хроматографии (ВЭЖХ) (см. Примеры 3 и 4).
Кроме того, ДНК, кодирующая белок, по существу идентичный HIDH, кодируемой ДНК SEQ ID No:5, также включен в ДНК настоящего изобретения. А именно, следующие ДНК также включены в настоящее изобретение:
(a) ДНК, включающая нуклеотидную последовательность SEQ ID No:5;
(b) ДНК, гибридизующаяся в жестких условиях с ДНК с нуклеотидной последовательностью, комплементарной нуклеотидной последовательности SEQ ID No:5 и кодирующая белок, обладающий 4-гидрокси-L-изолейциндегидрогеназной активностью;
(c) ДНК, кодирующая белок, включающий аминокислотную последовательность SEQ ID No:6;
(d) ДНК, кодирующая белок с аминокислотной последовательностью, которая содержит замену, делецию, вставку, добавление или инверсию одной или нескольких аминокислот в последовательности SEQ ID No:6, и обладающий 4-гидрокси-L-изолейциндегидрогеназной активностью; и
(e) ДНК, кодирующая белок с аминокислотной последовательностью, гомологичной по крайней мере на 70%, предпочтительно гомологичной по крайней мере на 80%, более предпочтительно гомологичной по крайней мере на 90% и еще более предпочтительно гомологичной по крайней мере на 95% аминокислотной последовательности SEQ ID NO:6, и обладающий 4-гидрокси-L-изолейциндегидрогеназной активностью.
Здесь "один или несколько" означает диапазон, вне которого стереоизомерия аминокислотных остатков белка или активность 4-гидрокси-L-изолейциндегидрогеназы изменяется незначительно и, в частности, соответствует значениям от 1 до 78, предпочтительно от 1 до 52, более предпочтительно от 1 до 26 и еще более предпочтительно от 1 до 13.
Замена, делеция, вставка, добавление или инверсия одного или нескольких аминокислотных остатков будут представлять собой консервативную(ые) мутацию(и) при условии, что активность фермента при этом сохраняется. Примером консервативной мутации(ий) является консервативная замена(ы). Примеры консервативных замен включают замену Ala на Ser или Thr, замену Arg на Gln, His или Lys, замену Asn на Glu, Gln, Lys, His или Asp, замену Asp на Asn, Glu или Gln, замену Cys на Ser или Ala, замену Gln на Asn, Glu, Lys, His, Asp или Arg, замену Glu на Asn, Gln, Lys или Asp, замену Gly на Pro, замену His на Asn, Lys, Gln, Arg или Tyr, замену Ile на Leu, Met, Val или Phe, замену Leu на Ile, Met, Val или Phe, замену Lys на Asn, Glu, Gln, His или Arg, замену Met на Ile, Leu, Val или Phe, замену Phe на Trp, Tyr, Met, He или Leu, замену Ser на Thr или Ala, замену Thr на Ser или Ala, замену Trp на Phe или Tyr, замену Tyr на His, Phe или Trp и замену Val на Met, He или Leu.
Кроме того, термин "4-гидрокси-L-изолейциндегидрогеназа" относится к активности, которая обеспечивает синтез АМКР из (2S,3R,4S)-4HIL, как описано выше. Однако в случае, если аминокислотная последовательность содержит замену, делецию, вставку, добавление или инверсию одного или нескольких аминокислотных остатков в последовательности SEQ ID No:6, она предпочтительно сохраняет 4-гидрокси-L-изолейциндегидрогеназную активность в размере 10% или более, предпочтительно 30% или более, более предпочтительно 50% или более и еще более предпочтительно 70% или более относительно белка с аминокислотной последовательностью SEQ ID No:6 в условиях 30°С и pH 7.0. 4-гидрокси-L-изолейциндегидрогеназная активность HIDH настоящего изобретения может быть определена анализом образования АМКР из (2S,3R,4S)-4HIL с использованием высокоэффективной жидкостной хроматографии (ВЭЖХ).
Кроме того, ДНК, гомологичная SEQ ID NO:5, может использоваться в качестве гена, кодирующего 4-гидрокси-L-изолейциндегидрогеназу настоящего изобретения. Кодирует ли гомологичная ДНК 4-гидрокси-L-изолейциндегидрогеназу может быть подтверждено определением 4-гидрокси-L-изолейциндегидрогеназы в лизате клеток или в лизате клеток микроорганизма, в котором сверхэкспрессируется гомологичная ДНК.
ДНК, гомологичная SEQ ID NO:5, также может быть получена из генома других видов Bacillus, например. Bacillus cereus. Bacillus weihenstephanensis как кодирующая 4-гидрокси-L-изолейциндегидрогеназу настоящего изобретения. Результат выравнивания аминокислотных последовательностей Bacillus cereus. Bacillus thuringiensis, Bacillus weihenstephanensis показан на Фиг.3.
(2) Свойства HIDH
Далее предоставляется описание свойств очищенной 4-гидрокси-L-изолейциндегидрогеназы из штамма Bacillus thuringiensis (serovar israelensis) ATCC 35646 (VKPMB-197) (HIDH).
HIDH настоящего изобретения имеет аминокислотную последовательность SEQ ID No:6, что четко определено выделением и анализом гена. Однако настоящее изобретение включает белок с аминокислотной последовательностью, содержащей замену, делецию, вставку, добавление или инверсию одного или нескольких аминокислотных остатков в SEQ ID No:6, который также имеет 4-гидрокси-L-изолейциндегидрогеназную активность. А именно, HIDH настоящего изобретения включает следующие белки:
(f) белок, включающий аминокислотную последовательность SEQ ID No:6;
(g) белок с аминокислотной последовательностью, содержащей замену, делецию, вставку, добавление или инверсию одной или нескольких аминокислот в последовательности SEQ ID No:6, и обладающий 4-гидрокси-L-изолейциндегидрогеназной активностью; и
(h) белок, имеющий по крайней мере 70% гомологии, предпочтительно по крайней мере 80% гомологии, более предпочтительно по крайней мере 90% гомологии и еще более предпочтительно по крайней мере 95% гомологии с аминокислотной последовательностью SEQ ID NO:6, и обладающий 4-гидрокси-L-изолейциндегидрогеназной активностью.
Здесь определения "несколько" и "4-гидрокси-L-изолейциндегидрогеназа" такие же, как определено в секции (1), ДНК, кодирующая 4-гидрокси-L-изолейциндегидрогеназу.
HIDH настоящего изобретения катализирует реакцию синтеза АМКР из (2S,3R,4S)-4HIL путем ферментативной реакции дегидрогенирования.
4-гидрокси-L-изолейциндегидрогеназная активность HIDH настоящего изобретения может быть определена путем анализа образования АМКР из (2S,3R,4S)-4HIL с использованием высокоэффективной жидкостной хроматографии (ВЭЖХ).
HIDH штамма Bacillus thuringiensis (serovar israelensis) ATCC 35646 (VKPM В-197) имеет аминокислотную последовательность SEQ ID NO:6.
(3) Способ получения 4-гидрокси-L-изолейциндегидрогеназы
Далее предоставляется описание способа получения HIDH настоящего изобретения. Существует два способа получения HIDH настоящего изобретения. Они состоят из (i) способа культивирования HIDH-продуцирующего микроорганизма для образования и накапливания HIDH, и (ii) способа получения трансформанта для образования HIDH с использованием техники рекомбинантных ДНК и культивирования трансформанта для накапливания HIDH.
(i) Способ образования и накапливания HIDH путем микробного культивирования
Примеры микроорганизмов, служащих источником получения HIDH в процессе образования и накопления HIDH при культивировании HIDH-продуцирующих микроорганизмов, включают микроорганизмы, принадлежащие к родам Escherichia, Pseudomonas, Corynebacterium, Arthrobacter, Aspergillus или Bacillus.
В настоящем изобретении может использоваться любой микроорганизм, принадлежащий к роду Bacillus, Escherichia, Corynebacterium, Arthrobacter, Aspergillus, Pseudomonas, Granulibacter, Methylobacillus, Granulibacter, Acidiphilium, Agrobacterium, Gluconobacter, Caulobacter, Stigmatella, Myxococcus, Polaromonas, Caulobacter, Polaromonas, Sphingomonas, Acidovorax, Mycobacterium, Azotobacter, Vibrio, Polynucleobacter, Streptomyces при условии, что он образует HIDH, катализирующий реакцию синтеза АМКР из (2S,3R,4S)-4HIL, и предпочтительно микроорганизмы включают штамм Bacillus thuringiensis (serovar israelensis) ATCC 35646 (VKPM В-197) и штамм Bacillus thuringiensis 2-е-2. Среди них особенно предпочтителен штамм Bacillus thuringiensis 2-e-2.
Хотя микроорганизм, служащий источником получения HIDH, может быть культивирован в любой форме, такой как культивирование на жидких и плотных средах, для культивирования в промышленных масштабах предпочтителен метод культивирования с интенсивным аэрированием путем перемешивания. В качестве питательных элементов питательной среды могут использоваться источники углерода, источники азота, неорганические кислоты и другие питательные элементы, обычно используемые при культивировании микроорганизмов. Все источники питательных веществ могут использоваться до тех пор, пока штамм микроорганизма их утилизирует.
Культивирование проводится в аэробных условиях при встряхивании, глубоком вентилировании путем перемешивания и т.п. Температура культивирования может быть в пределах значений, при которых растут микроорганизмы и образуется HIDH. Таким образом, хотя условия не жесткие, температура культивирования обычно от 10 до 50°С и предпочтительно от 15 до 42°С. Время культивирования варьируется в соответствии с другими условиями культивирования. Например, микроорганизмы могут культивироваться до достижения максимального уровня продукции HIDH, это обычно составляет от 5 часов до 7 дней, предпочтительно от 10 часов до 96 часов.
После культивирования микробные клетки отделяются центрифугированием (например, при 10,000×g в течение 10 минут). Так как HIDH в основном находится в клетках, HIDH солюбилизируют путем разрушения или лизиса микробных клеток. Для разрушения микробных клеток может использоваться разрушение ультразвуком, разрушение с использованием French press или разрушение с использованием стеклянных шариков. Для лизиса клеток выбирается метод с использованием лизоцима яичного белка, обработка пептидазой или подходящая комбинация методов.
Когда HIDH из HIDH-продуцирующего организма очищают, хотя HIDH очищают с использованием растворяющего фермент раствора для исходного материала, если остаются неразрушенные или нелизированные остатки, для очистки предпочтительно повторное центрифугирование раствора и удаление осадка.
Для очистки HIDH можно использовать все широко используемые методы очистки обычных ферментов, примеры которых включают осаждение сульфатом аммония, гель-фильтрацию, ионообменную хроматографию, гидрофобную хроматографию и гидроксиапатитовую хроматографию. В результате может быть получена HIDH - содержащая фракция с более высокой специфической активностью.
(ii) Способ продукции с использованием технологии рекомбинантной ДНК
Далее предоставляется описание способа получения HIDH с использованием технологии рекомбинантной ДНК. Существует множество известных примеров получения полезных белков, таких как ферменты и физиологически активные вещества, с использованием технологии рекомбинантной ДНК, и технология рекомбинантной ДНК делает возможным получение в большом количестве полезных белков, в природе присутствующих только в очень малых количествах.
Сначала готовится ДНК, кодирующая HIDH настоящего изобретения.
Затем приготовленную ДНК лигируют с векторной ДНК для получения рекомбинантной ДНК и клетки трансформируют рекомбинантной ДНК для получения трансформантов. Затем трансформанты культивируют в питательной среде для образования HIDH и его накопления в среде или/и клетках.
Затем процесс переходит в стадию, на которой получают очищенный HIDH путем выделения и очистки фермента.
Требуемый АМКР можно получить в большом количестве с использованием очищенной HIDH или среды или/и клеток, в которой/ых накоплена HIDH.
ДНК, которая лигирована с векторной ДНК, может обеспечить экспрессию HIDH настоящего изобретения.
Здесь примеры генов HIDH, лигированных в векторную ДНК, включают ДНК, ранее описанную в [II].
В случае крупномасштабного производства белка с использованием технологии рекомбинантной ДНК в качестве трансформируемых клеток могут использоваться клетки, такие как бактериальные клетки, клетки Actinomyces, клетки дрожжей, клетки плесневых грибов, клетки растений и клетки животных. Примеры бактериальных клеток, для которых разработаны системы хозяин-вектор, включают виды Escherichia, виды Pseudomonas, виды Corynebacterium, виды Arthrobacter, виды Aspergillus и виды Bacillus, и предпочтительно используются Escherichia coli или Corynebacterium glutamicum. Это объясняется тем, что существует множество сведений относительно технологий для производства большого количества белка с использованием бактерии Escherichia coli, Corynebacterium glutamicum или Bacillus. Далее предоставляется описание процесса получения L-изолейциндиоксигеназы с использованием трансформированной Е.coli. Следующий способ для Е.coli может также быть применен к бактерии Corynebacterium glutamicum или Bacillus.
В качестве промотора для экспрессии ДНК, кодирующей HIDH, можно использовать промотор, обычно используемый для продукции гетерологичного белка в E.coli, примеры которого включают сильные промоторы, такие как промоторТ7, trp промотор, lac промотор, tac промотор и PL промотор.
Для продукции HIDH в виде телец включения гибридного белка ген, кодирующий еще один белок, предпочтительно гидрофильный пептид, лигируют с геном гибридного белка перед или после гена HIDH. Ген, кодирующий еще один белок, может быть геном, увеличивающим количество накопленного гибридного белка и увеличивающим растворимость гибридного белка после стадий денатурации и регенерации, примеры кандидатов включают ген 10 Т7, ген β-галактозидазы, ген дегидрофолатредуктазы, ген интерферона-γ, ген интерлейкина-2 и ген прохимозина.
При лигировании этих генов с геном, кодирующим HIDH, необходимо, чтобы их рамки считывания совпадали. Гены можно либо лигировать в пригодный сайт рестрикции либо использовать синтетическую ДНК с соответствующей последовательностью.
Для увеличения продукции предпочтительно присоединить терминирующую транскрипцию последовательность в виде терминатора за геном гибридного белка. Примеры такого терминатора включают терминатор Т7, терминатор фага fd, терминатор Т4, терминатор гена устойчивости к тетрациклину и терминатор гена trpA E.coli.
В качестве вектора, используемого для введения гена, кодирующего HIDH или гибридный белок HIDH с другим белком, в E.coli, предпочтительны многокопийные векторы, примеры которых включают плазмиды с точкой начала репликации из Col E1, такие как плазмиды pUC, плазмиды pBR322 или их производные. "Производное" здесь относится к плазмидам, подвергнутым изменениям путем замены, делеции, вставки, добавления или инверсии. Упоминаемые здесь изменения включают изменения, вызванные мутагенной обработкой с использованием мутагенов или УФ облучения, или спонтанной мутацией, или случайной мутацией.
Предпочтительно, чтобы в векторе имелся маркер, такой как ген устойчивости к ампициллину для селекции трансформантов. Примеры таких плазмид включают коммерческие векторы экспрессии с сильным промотором (такие как pUC (Takara), pPROK (Clontech) и pKK233-2 (Clontech)).
Число копий гена можно увеличить путем вставки гена в многокопийный вектор с последующим введением вектора в микроорганизм. Векторы, которые можно использовать, включают плазмидные векторы E.coli, такие как pMW118, pBR322, pUC19, pBluescript KS+, pACYC177, pACYC184, pAYC32, pMW119, pET22b, челночные векторы E.coli - В. subtilis, такие как pHY300PLK, pGK-12, pLF14, pLF22 и т.п., фаговые векторы, такие как 11059, 1BF101, M13mp9, Mu фаг (Japanese Patent Application Laid-Open No. 2-109985), и т.п., и транспозоны (Berg, D.E. and Berg, C.M., Bio/Technol., 1,417 (1983)), такие как Mu, Tn10, Tn5 и т.п.
Рекомбинантная ДНК получается при лигировании фрагмента ДНК, в котором промотор, ген, кодирующий HIDH или гибридный белок, состоящий из HIDH и другого белка, и терминатор лигированы в указанном порядке, с векторной ДНК.
При трансформации E.coli с использованием рекомбинантной ДНК и последующем культивировании E.coli экспрессируется и продуцируется HIDH или гибридный белок HIDH с другим белком. Для трансформации можно использовать штамм, обычно используемый для экспрессии гетерологичных генов, особенно предпочтительны штамм E.coli JM109(DE3) и штамм E.coli JM109. Метод трансформации и метод отбора трансформантов описаны, например, в Molecular Cloning, 3rd edition. Cold Spring Harbor Laboratory Press (2001).
В случае экспрессии гибридного белка HIDH можно вырезать с использованием рестрикционной протеазы, такой как фактор коагуляции крови Ха или калликреин, который узнает последовательность, не существующую в HIDH в качестве последовательности узнавания.
Возможно также увеличить число копий гена путем введения гена в хромосому в результате гомологичной рекомбинации с использованием плазмиды и т.п. Примеры клеток и систем экспрессии в этом случае могут включать сообщение Shaw P.C. et al. о методе рекомбинантной экспрессии в Arthrobacter sp. (J Gen Micobiol. 134 (1988) p.903-911), сообщение Sandu C. et al. о методе рекомбинантной экспрессии в Arthrobacter nicotinovorans (Appl Environ Microbiol. 71(2005) p8920-8924) и сообщение Morikawa, M. et al. о методе рекомбинантной экспрессии в Arthrobacter sp. (Appl Microbiol Biotechnol., 42 (1994), р.300-303). Также существует несколько сообщений о разработке системы экспрессии для коринеформных бактерий, также используемых для видов Arthrobacter (Sandu C. et al.).
Когда источником гена HIDH является бактерия, принадлежащая к роду Bacillus, HIDH может экспрессироваться и продуцироваться с использованием бактерий рода Escherichia, Pseudomonas, Corynebacterium, Arthrobacter, Aspergillus или Bacillus в качестве бактерии-хозяина в одном предпочтительном методе.
В качестве среды для продукции можно использовать среду, обычно используемую для культивирования E.coli, примеры которой включают среду М9-казаминовая кислота и среда LB. Кроме того, условия культивирования и индукции продукции можно выбрать в соответствии с типом маркера и промотора используемого вектора и типом используемого микроорганизма-хозяина.
Для выделения HIDH или гибридного белка HIDH с другим белком можно использовать следующий способ. Если HIDH или его гибридный белок растворен в микробной клетке, его можно использовать в форме неочищенного ферментного раствора после получения микробных клеток и разрушения или лизиса полученных клеток. Кроме того, HIDH или его гибридный белок можно также использовать после очистки путем осаждения, фильтрации, хроматографии на колонке или другой технологии по мере необходимости. В этом случае также можно использовать метод очистки с использованием антител к HIDH или его гибридному белку.
Когда образуется белковое тельце включения, его растворяют денатуратом. Хотя его можно растворять вместе с белком микробной клетки, учитывая последующую процедуру очистки, предпочтительно выделить тельце включения и затем растворить его. Для выделения тельца включения из микробной клетки можно использовать метод, известный специалисту в данной области. Например, тельце включения можно выделить путем разрушения микробной клетки с последующим разделением с использованием центрифугирования. Примеры растворяющих белковые тельца включения денатуратов включают гидрохлорид гуанидина (н-р, 6 М, pH 5-8) и мочевину (н-р, 8 М).
Белковое тельце включения может быть восстановлено в виде активного белка путем удаления этих денатуратов с использованием такой обработки, как диализ. Для диализа можно использовать такие диализные растворы, как Tris-HCl буфер или фосфатный буфер, с возможной концентрацией 20 мМ - 0.5 М, с возможным значением pH 5-8.
Концентрацию белка в процессе стадии регенерации предпочтительно поддерживать на уровне 500 мкг/мл или менее. Для предотвращения образования сшивок внутри регенерированного HIDH значение температуры диализа предпочтительно 5°С или ниже. Кроме того, также можно ожидать, что активность восстанавливают другие методы, используемые для удаления денатурирующего реагента в дополнение к вышеупомянутому диализу, такие как разведение и ультрафильтрация.
[III] Метод получения 2-амино-3-метил-4-кетопентаноата из L-изолейцина
Метод получения АМКР настоящего изобретения включает две стадии, представленные следующими реакциями:
L-isoleucine+α-ketoglutarate+O2→4HIL+succinate+CO2
4HIL+NAD+→AMKP+NADH+Н+
отличающийся тем, что первая реакция осуществляется в присутствии L-изолейцина в качестве молекулы-акцептора одного или нескольких атомов кислорода, α-кетоглутарата в качестве молекулы-акцептора еще одного атома кислорода, одной молекулы кислорода в качестве донора двух атомов кислорода и IDO, катализирующей реакцию, а вторая реакция осуществляется в присутствии 4HIL в качестве молекулы-донора двух атомов водорода, NAD+ в качестве молекулы-акцептора атома водорода и HIDH, катализирующей реакцию.
Для продукции АМКР из L-изолейцина требуется экспрессия как IDO, так и HIDH. Следовательно, если в бактерии имеется IDO, необходимо дополнительно экспрессировать HIDH; если в бактерии имеется HIDH, необходимо дополнительно экспрессировать IDO; если в бактерии нет ни IDO, ни HIDH, необходимо экспрессировать и IDO, и HIDH; если в бактерии имеются и IDO, и HIDH, может быть желательным увеличить экспрессию IDO или/и HIDH для продукции АМКР из L- изолейцина.
В настоящем изобретении "энзиматическое гидроксилирование" означает реакцию гидроксилирования, которую осуществляет фермент IDO. Особенно предпочтительна бактериальная IDO.
Не существует особых ограничений на IDO, катализирующую реакцию, и можно использовать любой белок, способный катализировать реакцию гидроксилирования L-изолейцина в присутствии α-кетоглутарата и кислорода.
В настоящем изобретении "энзиматическое дегидрогенизирование" означает реакцию дегидрогенизирования, которая выполняется ферментом HIDH. Особенно предпочтительна бактериальная HIDH.
Не существует особых ограничений на HIDH, катализирующую реакцию, и можно использовать любой белок, способный катализировать реакцию дегидрогенизирования 4HIL в присутствии NAD+ и кислорода.
Предпочтительным примером таких IDO и HIDH являются IDO и HIDH, описанные в разделе [I], описывающем IDO, и [II], описывающем HIDH. В способе настоящего изобретения IDO и HIDH могут использоваться в любой форме, такой как бактерия (включая бактериальную культуру, бактериальные клетки или обработанные клетки), очищенный фермент или неочищенный фермент, если она содержит вышеупомянутые IDO и HIDH, катализирующие реакции вышеупомянутого АМКР. При использовании бактерии в качестве источника IDO или/и HIDH, и (1) бактерия, которая по природе продуцирует IDO или/и HIDH, такая как микроорганизмы, принадлежащие к роду Bacillus, и (2) рекомбинантный микроорганизм, трансформированный рекомбинантной ДНК, как описано в разделах [I] и [II], пригодны для накапливания IDO и HIDH при культивировании таких микроорганизмов.
Последовательность белка, использованная для характеристики IDO, классифицирована как L-изолейциндиоксигеназа (SEQ ID NO:2, SEQ ID NO:4).
Последовательность белка, использованная для характеристики HIDH, классифицирована как 4-гидрокси-L-изолейциндегидрогеназа (SEQ ID NO:6).
Неаннотированные гены, кодирующие IDO/HIDH других микроорганизмов, могут быть определены по гомологии с известными генами IDO/HIDH с последующим определением активности белков, кодируемых этими генами.
Гомология между двумя аминокислотными последовательностями может быть определена с использованием известных методов, например компьютерной программы BLAST 2.0, которая определяет три параметра: количество аминокислот, их идентичность и сходство.
Следовательно, фрагменты ДНК штамма Bacillus thuringiensis strain 2-e-2 и штамма Bacillus thuringiensis (serovar israelensis; ATCC 35646), кодирующие полноразмерную IDO, и фрагменты ДНК штамма Bacillus thuringiensis (serovar israelensis) ATCC 35646 (VKPM B-197), кодирующие полноразмерную HIDH, можно получить в ПЦР (полимеразная цепная реакция; см. White, T.J. et al., Trends Genet., 5, 185 (1989)) с использованием праймеров, сконструированных на основе фрагмента с известными аминокислотной и нуклеотидной последовательностями. Фрагменты ДНК, кодирующие IDO и HIDH других микроорганизмов, могут быть получены сходным образом.
Так как в последовательностях ДНК могут существовать некоторые различия между бактериальными штаммами, вышеописанные фрагменты, кодирующие IDO и HIDH, не ограничиваются последовательностями, показанными в (SEQ ID NO:1 и SEQ ID NO:3) и (SEQ ID NO:5), но также могут включать нуклеотидные последовательности, сходные с последовательностями, показанными в (SEQ ID NO:1 и SEQ ID NO:3) и (SEQ ID NO:5). Следовательно, варианты белков, кодируемые вышеописанными генами, могут иметь сходство не менее 80%, предпочтительно не менее 90%, наиболее предпочтительно не менее 95%, с полной аминокислотной последовательностью, показанной в (SEQ ID NO:2 и SEQ ID NO:4) и (SEQ ID NO:6), при условии, что такие белки катализируют указанные реакции.
Кроме того, вышеописанные фрагменты ДНК могут быть представлены вариантами, которые гибридизуются в жестких условиях с нуклеотидными последовательностями, показанными в (SEQ ID NO:1 и SEQ ID NO:3) и (SEQ ID NO:5), или с зондами, приготовленными на основе этих нуклеотидных последовательностей, при условии, что они кодируют функциональные белки. Используемый здесь термин "жесткие условия" тот же, что вышеупомянутый в разделе [I].
Примеры форм обработанных бактериальных клеток, используемых в настоящем изобретении, включают высушенную бактериальную массу, бактериальную массу, полученную в результате замораживания-высушивания, препараты, полученные в результате обработки сурфактантами или органическими растворителями, препараты, полученные в результате обработки ферментом, препараты, полученные в результате воздействия ультразвуком, механического перемалывания, воздействия растворителями, белковые фракции бактериальной массы, иммобилизованные препараты бактериальной массы и обработанную бактериальную массу.
IDO и HIDH можно приготовить отдельно, как описано выше, и добавить в реакционную смесь. Бактерию (клетку-хозяина), экспрессирующую ДНК, кодирующую IDO и HIDH, можно приготовить путем трансфекции экспрессионного вектора, функционально содержащего ДНК, кодирующую IDO и HIDH, в способной экспрессироваться форме в клетку-хозяина с теми активностями. Кроме того, предпочтительно в качестве хозяина использовать клетки с активностями IDO и HIDH, увеличенными путем усиления экспрессии генов, кодирующих IDO и HIDH.
Фраза "усиление экспрессии гена" означает, что экспрессия гена выше, чем в немодифицированном штамме, например в штамме дикого типа. Примеры таких модификаций включают увеличение числа копий экспрессируемого(ых) гена(ов) на клетку, увеличение уровня экспрессии гена(ов) и т.д. Количество числа копий экспрессируемого гена измеряют, например, путем рестрикции хромосомной ДНК с последующим Саузерн-блоттингом с использованием зонда, приготовленного на основе последовательности гена, флуоресцентной гибридизации in situ (FISH) и т.п. Уровень экспресии гена можно измерить различными известными методами, включая Нозерн-блоттинг, количественную ПЦР в реальном времени и т.п. Количество белка, кодируемого геном, можно определить известными методами, включая электрофорез в SDS-ПААГ с последующим иммуноблоттингом (Вестерн-блоттинг) и т.п..
"Трансформация бактерии ДНК, кодирующей белок" означает введение ДНК в бактерию, например, традиционными методами. В результате трансформации этой ДНК увеличится экспрессия гена, кодирующего белок настоящего изобретения, и увеличится активность белка в бактериальных клетках. Методы трансформации включают любые известные упомянутые ранее методы. Например, метод обработки реципиентных клеток хлоридом кальция для увеличения проницаемости клеток для ДНК описан для Escherichia coli K-12 (Mandel, M. and Higa, A., J. Mol. Biol., 53, 159 (1970)) и может быть использован.
Методы усиления экспрессии гена включают увеличение числа копий гена. Введение гена в вектор, способный функционировать в бактерии настоящего изобретения, увеличивает число копий гена. Для этого предпочтительно использовать многокопийные векторы. В качестве примера многокопийных векторов можно привести pBR322, pMW119, puC19, pET22b и т.п.
Усиление экспрессии гена может также быть достигнуто путем введения множества копий гена в бактериальную хромосому с использованием, например, гомологичной рекомбинации, Мu интеграции и т.п.. Например, один акт Mu интеграции позволяет ввести в бактериальную хромосому до 3 копий гена.
Увеличение числа копий гена также может быть достигнуто путем введения множества копий гена в хромосомную ДНК бактерии. Для введения множества копий гена в бактериальную хромосому выполняют гомологичную рекомбинацию с использованием последовательности, существующей во множестве копий, в качестве мишеней в хромосомной ДНК. Последовательности с множеством копий в хромосомной ДНК включают, но не ограничиваются ими, повторяющуюся ДНК, или инвертированные повторы на концах транспозонных элементов. Также, как раскрыто в патенте США No. 5,595,889, возможно включить ген в транспозон, что позволит перенести его для введения множества копий гена в хромосомную ДНК.
Усиление экспрессии гена также может быть достигнуто путем помещения ДНК настоящего изобретения под контроль сильного промотора. Например, известны такие сильные промоторы, как Ptac промотор, lac промотор, trp промотор, trc промотор, PR или PL промотор фага лямбда. Использование сильного промотора можно комбинировать с увеличением копий гена.
С другой стороны, действие промотора может быть усилено, например, путем введения в промотор мутации с целью увеличения уровня транскрипции гена, локализованного за промотором. Кроме того, известно, что замена нескольких нуклеотидов в промежутке между сайтом связывания рибосомы (RBS) и стартовым кодоном, особенно непосредственно перед стартовым кодоном, серьезно влияет на транслируемость мРНК. Например, обнаружен 20-кратный разброс в уровнях экспрессии в зависимости от природы трех нуклеотидов, предшествующих стартовому кодону (Gold et al., Annu. Rev. Microbiol., 35, 365-403, 1981; Hui et al., EMBO J., 3, 623-629, 1984). Предварительно было показано, что мутация rhtA23 представляет собой замену G на А в положении -1 относительно стартового ATG кодона (ABSTRACTS of 17th International Congress of Biochemistry and Molecular Biology in conjugation with 1997 Annual Meeting of the American Society for Biochemistry and Molecular Biology, San Francisco, California August 24-29, 1997, abstract No. 457).
Кроме того, также возможно ввести нуклеотидную замену в области промотора гена на бактериальной хромосоме, ведущую к усилению функции промотора. Изменение последовательности, контролирующей экспрессию, можно осуществить, например, тем же способом, что и замещение гена с использованием плазмиды, экспрессия которой чувствительна к температуре, как раскрыто в заявке РСТ WO 00/18935 и выложенной патентной заявке Японии No. 1-215280.
Способы приготовления плазмидной ДНК включают, но не ограничиваются ими, рестрикцию и лигирование ДНК, трансформацию, выбор олигонуклеотида для использования в качестве праймера и т.п. или другие методы, известные специалисту в данной области. Эти методы описаны, например, в "Molecular Cloning A Laboratory Manual, Third Edition", Cold Spring Harbor Laboratory Press (2001).
При продукции АМКР из L-изолейцина с использованием (IDO и HIDH) - продуцирующей бактерии или бактериальных клеток, трансформированных рекомбинантной ДНК, субстрат можно добавлять непосредственно в среду при культивировании или можно использовать бактериальные клетки или отмытые бактериальные клетки, отделенные от культуральной жидкости. Кроме того, обработанные бактериальные клетки, разрушенные или лизированные, можно использовать непосредственно, либо IDO и HIDH можно выделить из обработанных бактериальных клеток и использовать как раствор неочищенного фермента, либо использовать очищенный фермент. А именно, если они в виде фракции с IDO и HIDH, их можно использовать в процессе продукции АМКР настоящего изобретения.
Для осуществления реакции гидроксилирования с использованием IDO и реакции дегидрогенизирования с использованием HIDH для продукции АМКР из L-изолейцина, реакционная смесь, содержащая L-изолейцин, α-кетоглутарат и белки или (IDO и HIDH)-содержащие композиции, катализирующие реакцию, поддерживают при подходящей температуре от 20 до 50°С в покое, при встряхивании или помешивании в течение от 30 минут до 5 дней при pH 5-12.
Кислород попадает в реакцию из воздуха в результате перемешивания в фиксированном режиме в процессе культивирования.
Образующийся в реакционной смеси АМКР можно либо выделить или очистить в соответствии с известными методами, либо использовать дальше, особенно, когда реакция осуществляется с рекомбинантными микроорганизмами, экспрессирующими IDO и HIDH.
Примеры методов выделения и очистки могут включать метод, в котором АМКР контактирует с ионообменной смолой для адсорбции основных аминокислот с последующей элюцией и кристаллизацией, и метод, в котором продукт, полученный после элюции, обесцвечивают и фильтруют через активированный уголь с последующей кристаллизацией для получения АМКР.
Примеры
Настоящее изобретение будет более подробно описано ниже со ссылкой на следующие не ограничивающие настоящее изобретение Примеры.
Пример 1. Клонирование генов IDO-HIDH штамма Bacillus thuringiensis 2-e-2 (FERM ВР-10688) и штамма Bacillus thurinsiensis (serovar israelensis) ATCC 35646 (VKPM В-197).
Фрагмент ДНК, содержащий гены IDO-HIDH и фланкированный сайтами узнавания рестриктаз BamHI и SacI, получили в ПЦР с использованием праймеров P1(SVS 170) (SEQ ID NO:7) и Р2(SVS 171) SEQ ID NO:8) и хромосомной ДНК штамма Bacillus thuringiensis 2-e-2 strain (FERM ВР-10688) в качестве матрицы. Использовали следующий температурный профиль для ПЦР: 1 мин при 95°С, 30 с при 50°С, 40 с при 72°С; профиль для последующих 25 циклов: 30 с при 95°С, 30 с при 54°С, 40 с при 72°С; и заключительная полимеризация: 5 мин при 72°С.
Полученный ПЦР-продукт длиной 1.5 т.п.н. (Фиг.1), очищенный в агарозном геле, был обработан рестриктазами BamHI и SacI и затем лигирован в вектор pMW119, предварительно обработанный теми же рестриктазами. Таким образом была получена плазмида pMW119-IDO-HIDH (2-e-2).
Другой фрагмент ДНК, содержащий гены IDO-HIDH и фланкированный сайтами рестриктаз BamHI и SacI, получили в ПЦР с использованием праймеров P1(SVS 170) (SEQ ID NO:7) и P3(SVS 169) (SEQ ID NO:9) и хромосомной ДНК штамма Bacillus thuringiensis (serovar israelensis) ATCC 35646 (VKPM B-197) в качестве матрицы. Температурные условия для ПЦР были такие, как описано выше.
Полученный ПЦР-продукт длиной 1.5 т.п.н., очищенный в агарозном геле, был обработан рестриктазами BamHI и SacI и затем лигирован в вектор pMW119, предварительно обработанный теми же рестриктазами. Таким образом была получена плазмида pMW119-IDO-HIDH (VKPM B-197).
Штамм Е.coli TG1 трансформировали плазмидой pMW119-IDO-HIDH (2-e-2). Таким образом сконструировали штамм - продуцент IDO/HIDH Е. coli TG1 [pMW119-IDO-HIDH (2-e-2)].
Штамм Е.coli TG1 трансформировали плазмидой pMW119-IDO-HIDH (VKPM В-197). Таким образом сконструировали штамм - продуцент Е.coli TG1[pMW119-IDO-HIDH (VKPM В-197)].
Пример 2. Клонирование гена IDO штамма Bacillus thuringiensis 2-e-2 (FERM ВР-10688) и штамма Bacillus thurinsiensis (serovar israelensis) ATCC 35646 (VKPM В-197).
Фрагмент ДНК, содержащий ген IDO и фланкированный сайтами рестриктаз BamHI и SacI, получили в ПЦР с использованием праймеров P1(SVS 170) (SEQ ID NO:7) и Р3(SVS 169) (SEQ ID NO:9) и хромосомной ДНК штамма Bacillus thuringiensis 2-e-2 (FERM BP-10688) в качестве матрицы. Условия для ПЦР были следующие: стадия денатурации в течение 3 мин при 95°С; профиль для двух первых циклов: начальная стадия в течение 30 секунд при 94°С; 4 цикла в течение 40 секунд при 94°С; 30 секунд при 49°С; 40 секунд при 72°С; 35 циклов в течение 30 секунд при 94°С; 30 секунд при 54°С; 30 секунд при 72°С. Полученный ПЦР-продукт длиной 0.8 т.п.н., очищенный в агарозном геле, был обработан рестриктазами BamHI и SacI и затем лигирован в вектор pMW119, предварительно обработанный теми же рестриктазами. Таким образом была получена плазмида pMW119-IDO (2-e-2).
Другой фрагмент ДНК, содержащий ген IDO и фланкированный сайтами рестриктаз BamHI и SacI, получили в ПЦР с использованием праймеров P1 (SVS 170) (SEQ ID NO:7) и P3 (SVS 169) (SEQ ID NO:9) и хромосомной ДНК штамма Bacillus thuringiensis (serovar israelensis) ATCC 35646 (VKPM В-197) в качестве матрицы. Температурные условия для ПЦР были такие, как описано выше.
Полученный ПЦР-продукт длиной 0.8 т.п.н., очищенный в агарозном геле, был обработан рестриктазами BamHI и SacI и затем лигирован в вектор pMW119, предварительно обработанный теми же рестриктазами. Таким образом была получена плазмида pMW119-IDO (VKPM В-197).
Штамм Е.coli TG1 трансформировали плазмидой pMW119-IDO (2-e-2). Таким образом сконструировали штамм - продуцент IDO Е.coli TG1 [pMW119-IDO (2-e-2)].
Штамм Е.coli TG1 трансформировали плазмидой pMW119-IDO (VKPM В-197). Таким образом сконструировали штамм-продуцент IDO Е.coli TG1 [pMW119-IDO (VKPM В-197)].
Пример 3. Биоконверсия изолейцина в 4HIL и АМКР с использованием штаммов-продуцента IDO и продуцента IDO/HIDH.
Клетки штаммов Е.coli TG1 [pMW119], TG1 [pMW119-IDO (2-e-2)], TG1 [pMW119-IDO (VKPM В-197)], TG1 [pMW119-IDO-HIDH (2-e-2)] и TG1 [pMW119-IDO-HIDH (VKPM В-197)] инокулировали в 2 мл среды MI50 и культивировали в пробирках при 32°C с энергичным встряхиванием в течение 72 ч. После культивирования определяли концентрации АМКР и 4HIL в культуральной жидкости с использованием методов ТСХ и ВЭЖХ. Для ТСХ использовали пластины размером 10×15 см, покрытые 0,11 мм слоем силикагеля Сорбфил, не содержащего флуоресцентный индикатор (Акционерное Общество Сорбполимер, Краснодар, Россия). Пластинки Сорбфил экспонировали в подвижной фазе следующего состава: пропан-2-ол: этилацетат: 25% водного аммиака: вода = 40:40:7:16 (v/v). Раствор (2%) нингидрина в ацетоне использовали для визуализации. Результаты ТСХ и ВЭЖХ представлены на Фиг.4 и в Таблице 1. Как видно на Фиг.4 и в Таблице 1, штаммы TG1 [pMW119-IDO (2-е-2)] и TG1 [pMW119-IDO (VKPM В-197)] накапливали 4HIL; штаммы TG1 [pMW119-IDO-HIDH (2-е-2)] и TG1 [pMW119-IDO-HIDH (VKPM В-197)] накапливали АМКР. Эти данные подтверждают, что экспрессия IDO ведет к синтезу 4HIL из L-изолейцина, тогда как экспрессия IDO-HIDH ведет к синтезу преимущественно АМКР из L-изолейцина.
Состав среды MI50 был следующим (г/л):
СаСО3 стерилизовали сухим жаром при 180°C в течение 2 часов. Значение pH доводили до 7.0 с использованием NaOH.
Пример 4. Определение накопленных АМКР 4-HIL методом ВЭЖХ
ВЭЖХ анализ: использовали хроматограф высокого давления (Waters, USA) со спектрофлуорометром серии 1100 (Agilent, USA). Выбранные диапазоны длин волн: длина волны возбуждения 250 нм, область длин волн эмиссии 320-560 нм. Разделение с помощью метода accq-tag осуществляли на колонке Nova-Pak™ С18 150×3,9 мм, 4 мкм (Waters, США) при +40°С. Объем пробы составлял 5 мкл. Образование производных аминокислот и их разделение осуществляли в соответствии с рекомендациями производителя Waters (Liu, H. et al, J. Chromatogr. A, 828, 383-395 (1998); Waters accq-tag chemistry package. Instruction manual. Millipore Corporation, pp.1-9 (1993)). Для получения производных аминокислот с 6-аминохинолил-N-гидроксисукцинимидилкарбаматом использовали набор Accq-FluorTM (Waters, США). Анализ с помощью метода accq-tag осуществляли с использованием концентрированного элюента Accq-tag Eluent A (Waters, США). Все растворы готовили с использованием воды Milli-Q, стандартные растворы хранили при +4°С.
Хотя указанное изобретение описано в деталях со ссылкой на наилучший способ осуществления изобретения, для специалиста в указанной области техники очевидно, что могут быть совершены различные изменения и произведены эквивалентные замены, и такие изменения и замены не выходят за рамки настоящего изобретения.
Каждому из упомянутых выше документов соответствует ссылка, и все цитируемые документы являются частью описания настоящего изобретения.
Таблица. Биоконверсия L-изолейцина в АМКР с использованием штаммов Е.coli, обладающих активностями IDO и HIDH.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПРОДУКЦИИ (2S,3R,4S)-4-ГИДРОКСИ-L-ИЗОЛЕЙЦИНА С ИСПОЛЬЗОВАНИЕМ БАКТЕРИИ, В КОТОРОЙ РАЗРУШЕНА АКТИВНОСТЬ 4-ГИДРОКСИ-L-ИЗОЛЕЙЦИНДЕГИДРОГЕНАЗЫ | 2007 |
|
RU2395578C2 |
| СПОСОБ КОНСТРУИРОВАНИЯ БАКТЕРИИ-ПРОДУЦЕНТА (2S,3R,4S)-4-ГИДРОКСИ-L-ИЗОЛЕЙЦИНА, БАКТЕРИЯ-ПРОДУЦЕНТ (2S,3R,4S)-4-ГИДРОКСИ-L-ИЗОЛЕЙЦИНА И СПОСОБ ПРОДУКЦИИ (2S,3R,4S)-ГИДРОКСИ-L-ИЗОЛЕЙЦИНА ИЛИ ЕГО СОЛИ | 2007 |
|
RU2395580C2 |
| БАКТЕРИЯ - ПРОДУЦЕНТ ПРОДУКТА РЕАКЦИИ, КАТАЛИЗИРУЕМОЙ БЕЛКОМ, ОБЛАДАЮЩИМ АКТИВНОСТЬЮ 2-ОКСОГЛУТАРАТ-ЗАВИСИМОГО ФЕРМЕНТА, И СПОСОБ ПРОДУКЦИИ УКАЗАННОГО ПРОДУКТА | 2008 |
|
RU2444568C2 |
| СПОСОБ ПОЛУЧЕНИЯ ГИДРОКСИЛИРОВАННОГО L-ЛЕЙЦИНА И БАКТЕРИЯ, ТРАНСФОРМИРОВАННАЯ ДНК, КОДИРУЮЩЕЙ ДИОКСИГЕНАЗУ | 2011 |
|
RU2468085C1 |
| СПОСОБ ПРОДУКЦИИ 4-ГИДРОКСИ-L-ИЗОЛЕЙЦИНА | 2007 |
|
RU2402608C2 |
| СПОСОБ ПРОДУКЦИИ ПУРИНОВЫХ НУКЛЕОЗИДОВ И НУКЛЕОТИДОВ МЕТОДОМ ФЕРМЕНТАЦИИ С ИСПОЛЬЗОВАНИЕМ БАКТЕРИЙ, ПРИНАДЛЕЖАЩИХ К РОДУ Escherichia ИЛИ Bacillus | 2006 |
|
RU2365622C2 |
| СПОСОБ ПОЛУЧЕНИЯ L-треонина С ИСПОЛЬЗОВАНИЕМ БАКТЕРИИ, ПРИНАДЛЕЖАЩЕЙ К РОДУ Escherichia | 2006 |
|
RU2351646C2 |
| СПОСОБ ПОЛУЧЕНИЯ L-АМИНОКИСЛОТЫ МЕТОДОМ ФЕРМЕНТАЦИИ, ШТАММ БАКТЕРИИ ESCHERICHIA COLI - ПРОДУЦЕНТ L-АМИНОКИСЛОТЫ (ВАРИАНТЫ) | 1999 |
|
RU2207376C2 |
| НОВАЯ АЛЬДОЛАЗА, ДНК, КОДИРУЮЩАЯ АЛЬДОЛАЗУ, КЛЕТКИ, ТРАНСФОРМИРОВАННЫЕ ДНК, СПОСОБ ПОЛУЧЕНИЯ АЛЬДОЛАЗЫ И СПОСОБ ПОЛУЧЕНИЯ 4-ГИДРОКСИ-L-ИЗОЛЕЙЦИНА (ВАРИАНТЫ) | 2006 |
|
RU2338784C2 |
| ПРЕФЕНАТДЕГИДРАТАЗА-ХОРИЗМАТМУТАЗА И ФРАГМЕНТ ДНК, КОДИРУЮЩИЙ ПРЕФЕНАТДЕГИДРАТАЗУ-ХОРИЗМАТМУТАЗУ, ИЗ БАКТЕРИИ Methylophilus methylotrophus | 2003 |
|
RU2250261C1 |

Изобретение относится к биотехнологии и представляет собой способ продукции 2-амино-3-метил-4-кетопентаноата или его соли, включающий следующие стадии: реакции L-изолейцина в водном растворе в присутствии L-изолейциндиоксигеназы и по крайней мере одной 4-гидрокси-L-изолейциндегидрогеназы, выбранной из группы, состоящей из белка, аминокислотная последовательность которого включает последовательность SEQ ID No:6; белка с аминокислотной последовательностью, содержащей замену, делецию, вставку, добавление или инверсию одного или нескольких аминокислотных остатков в аминокислотной последовательности SEQ ID No:6, и обладающего 4-гидрокси-L-изолейциндегидрогеназной активностью; и белка с аминокислотной последовательностью, по крайней мере на 70% гомологичной аминокислотной последовательности SEQ ID No:6, и обладающего 4-гидрокси-L-изолейциндегидрогеназной активностью; выделение синтезированного 2-амино-3-метил-4-кетопентаноата. Изобретение позволяет получать 2-амино-3-метил-4-кетопентаноат или его соль с высокой степенью эффективности. 2 н. и 7 з.п. ф-лы, 4 ил, 1 табл.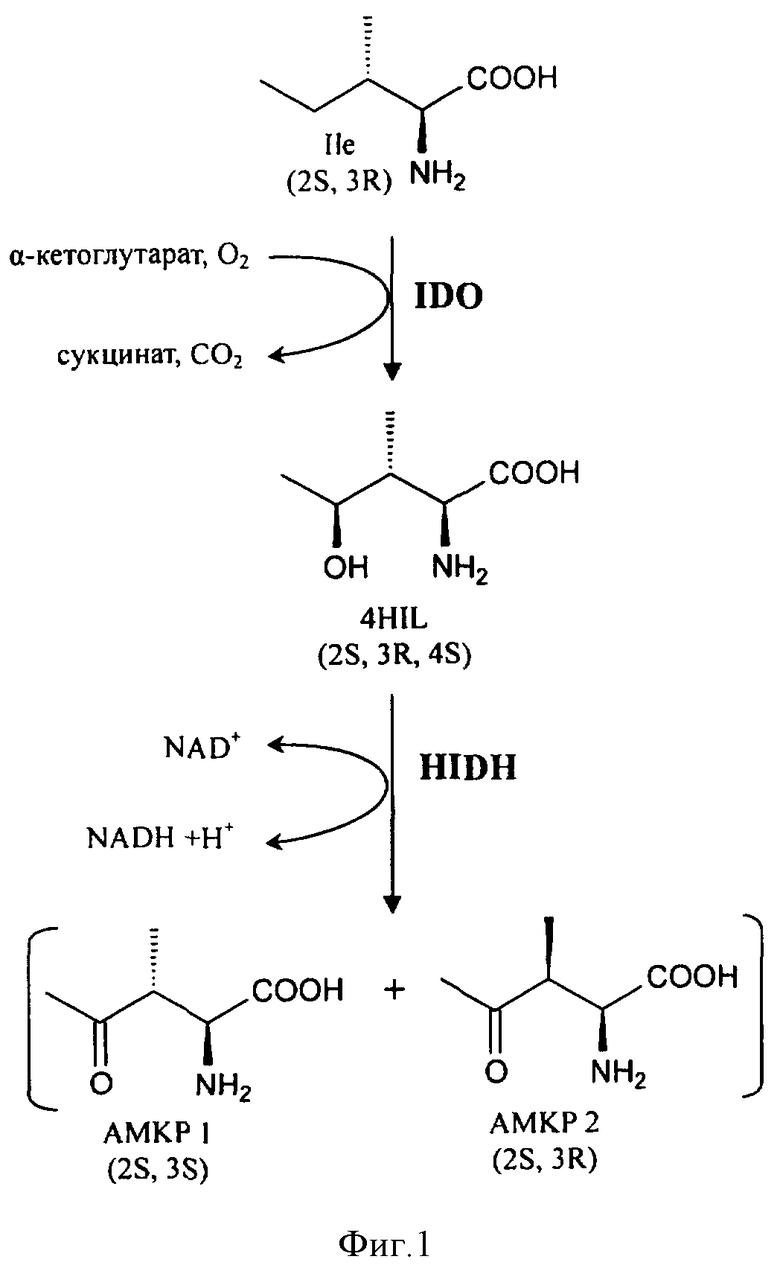
1. Способ продукции 2-амино-3-метил-4-кетопентаноата или его соли, включающий стадии:
реакции L-изолейцина в водном растворе в присутствии L-изолейциндиоксигеназы и по крайней мере одной 4-гидрокси-L-изолейциндегидрогеназы, выбранной из группы, состоящей из:
(f) белок, аминокислотная последовательность которого включает последовательность SEQ ID No:6;
(g) белок с аминокислотной последовательностью, содержащей замену, делецию, вставку, добавление или инверсию одного или нескольких аминокислотных остатков в аминокислотной последовательности SEQ ID No:6, и обладающий 4-гидрокси-L-изолейциндегидрогеназной активностью; и
(h) белок с аминокислотной последовательностью, по крайней мере на 70% гомологичной аминокислотной последовательности SEQ ID No:6, и обладающий 4-гидрокси-L-изолейциндегидрогеназной активностью;
выделение синтезированного 2-амино-3-метил-4-кетопентаноата.
2. Способ продукции 2-амино-3-метил-4-кетопентаноата или его соли, включающий стадии:
реакции L-изолейцина в водном растворе в присутствии бактерии, содержащей L-изолейциндиоксигеназу и по крайней мере одну 4-гидрокси-L-изолейциндегидрогеназу, выбранную из группы, состоящей из:
(f) белок, аминокислотная последовательность которого включает последовательность SEQ ID No:6;
(g) белок с аминокислотной последовательностью, содержащей замену, делецию, вставку, добавление или инверсию одного или нескольких аминокислотных остатков в аминокислотной последовательности SEQ ID No:6, и обладающий 4-гидрокси-L-изолейциндегидрогеназной активностью; и
(h) белок с аминокислотной последовательностью, по крайней мере на 70% гомологичной аминокислотной последовательности SEQ ID No:6, и обладающий 4-гидрокси-L-изолейциндегидрогеназной активностью;
выделения синтезированного 2-амино-3-метил-4-кетопентаноата.
3. Способ по п.2, отличающийся тем, что бактерия модифицирована таким образом, что активность 4-гидрокси-L-изолейциндегидрогеназы увеличена.
4. Способ по п.2, отличающийся тем, что бактерия модифицирована таким образом, что активности L-изолейциндиоксигеназы и 4-гидрокси-L-изолейциндегидрогеназы увеличены.
5. Способ по п.4, отличающийся тем, что активность белка увеличена путем усиления экспрессии гена, кодирующего указанный белок.
6. Способ по п.5, отличающийся тем, что экспрессия гена усилена путем модификации последовательности, контролирующей экспрессию гена, кодирующего белок, или увеличения числа копий гена, кодирующего белок.
7. Способ по любому из пп.2-6, отличающийся тем, что бактерия принадлежит к роду Escherichia, Pseudomonas, Corynebacterium, Arthrobacter, Aspergillus или Bacillus.
8. Способ по п.6, отличающийся тем, что бактерия принадлежит к Escherichia coli, Arthrobacter simplex, Corynebacterium glutamicum, Arthrobactor globiformis, Arthrobactor sulfureus, Arthrobactor viscosus или Bacillus subtilis.
9. Способ по п.2, отличающийся тем, что бактерией являются бактериальная культура, клетки, обработанные клетки или клеточный лизат.
| Устройство для резки ленточного упаковочного материала на заготовки | 1978 |
|
SU738909A2 |
| SAUIVAIRE Y et al | |||
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| Diabetes | |||
| Способ и аппарат для получения гидразобензола или его гомологов | 1922 |
|
SU1998A1 |
| RU 2006109216, 10.10.2007. | |||
Авторы
Даты
2010-06-20—Публикация
2007-11-07—Подача