Изобретение относится к биотехнологии. Конкретно к способу экспансии CD34+гематопоэтических клеток.
Гемопоэтические стволовые клетки (ГСК) - первичные мультипотентные клетки, способные к самовоспроизведению, а также к дифференцировке и созреванию во все ростки кроветворения. Они располагаются в костном мозге (клетки костного мозга), печени плода, во фракции мононуклеаров циркулирующей крови (стволовые клетки периферической крови) и в пуповинной крови (стволовые клетки пуповинной крови).
Размеры и плотность ГСК из различных источников подобны мононуклеарным клеткам цельной крови. ГСК распознаются по их колониеобразующей способности in vitro и по поверхностным антигенным маркерам. Мембранный маркер CD34 общепринят для успешного выделения/очищения ГСК и повсеместно используется как показатель при контроле качества приготовления.
ГСК - короткоживущие в культуральной среде in vitro; криоконсервирование (ниже -120°С) позволяет хранить ГСК длительный период времени. Способность увеличивать число ГСК in vivo или in vitro обеспечит новые возможности для лечения, но было трудно достигнуть амплификации ГСК. Понимание механизмов самообновления ГСК сделало амплификацию ГСК важной клинической целью. Авторами разработаны протоколы дифференцировки ЭСК в ГСК и протоколы экспансии ГСК.
Пуповинная кровь является одним из источников гемопоэтических стволовых клеток (ГСК). Однако объем получаемого при родах материала недостаточен для обеспечения лечебной дозы ГСК в терапии взрослых пациентов. Кроме того, скорость достижения минимальной численности гранулоцитов крови (500/мл), достоверно предотвращающей летальность от инфекционных осложнений, при использовании пуповинной крови составляет около трех недель. В этой связи в настоящий момент остро стоит проблема разработки приемлемых и доступных методов экспансии ГСК пуповинной крови in vitro. Это позволит сократить продолжительность периода «острого иммунодефицита» и расширить показания для применения клеток пуповинной крови в терапии взрослых пациентов за счет значительного увеличения количества гемопоэтических предшественников при культивировании.
В журнале Nature Medicine I. Delaney C et al [1] опубликованы результаты начального этапа первого в мировой практике клинического исследования, в котором сообщается об успешной трансплантации гемопоэтических клеток пуповинной крови, которые предварительно были подвергнуты экспансии in vitro лигандами Notch, для лечения гемобластозов. В работе авторы проанализировали эффекты активации рецептора Notch на сроки и численность экспансии клеток пуповинной крови ex vivo, a также на скорость восстановления пула гранулоцитов крови после трансплантации культуры пациентам с острым лейкозом. Ген Notch, открытый Т.Н. Morgan (1917), кодирует трансмембранный рецептор, активация которого (например, лигандом Deltal) приводит к высвобождению внутриклеточного домена, дислокации его в ядро клетки с последующим изменением экспрессии генов, ответственных за пролиферацию и дифференцировку ГСК [1]. Это практически единственная публикация об успешной экспансии CD34+ гематопоэтических клеток.
Разработка протокола экспансии CD34+ гематопоэтических клеток
В качестве модельной системы были выбраны стволовые клетки пуповинной крови. Мононуклеарную фракцию выделяли методом центрифугирования в фиколл-верографине, после чего проводили обогащение CD34+ фракции методом иммуномагнитной сепарации на колонках Myltenyi biotec. Полученную фракцию анализировали иммуноцитохимическими методами и методом проточной цитофлуориметрии. После двойной очистки чистота CD34+ популяции составляла около 90%.
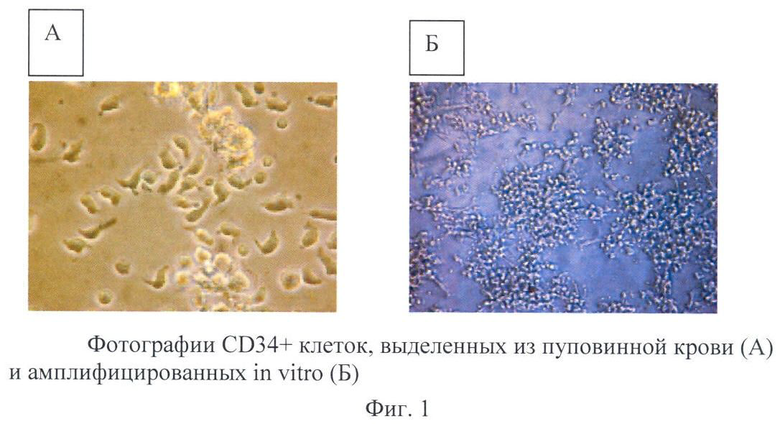
Обогащенную CD34+ клетками фракцию пуповинной крови культивировали в бессывороточной среде ExVivo 15 с ростовыми факторами SCF (50 нг/мл, IL-3 (20 нг/мл), IL-6 (20 Ед/мл), SCF (50 нг/мл), Flt-3/ (100 нг/мл). При использовании двустадийного способа культивирования сначала в суспензии, а затем на подложке, из клеток ОР9 удалось увеличить количество CD34+ клеток в 5 раз в течение 12 дней. (Фиг.1). Установлено, что сокультивирование с клетками ОР9 способствует ускорению пролиферации гемопоэтических стволовых клеток и поддержанию ранних гемопоэтических клеток-предшественников в недифференцированном состоянии.
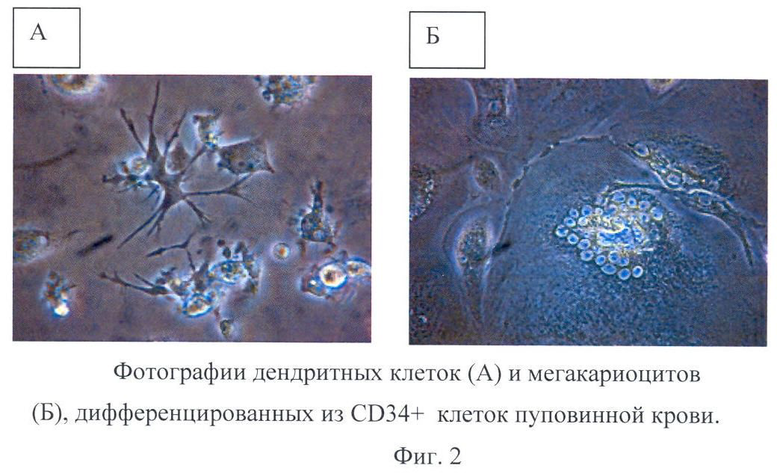
Часть CD34+ клеток с помощью набора цитокинов GMCSF, GCSF, ТРО, ЕРО и других были дифференцированы в ядерные эритроциты и лимфоциты крови и остеокласты (костные макрофаги кроветворного происхождения) - то есть в клетки эритрогидного, лимфоидного и миелоидного ряда (Фиг.2, 3).
CD34+ клетки, выделенные методом иммуномагнитной сепарации из пуповинной крови, аспиратов костного мозга, периферической крови помещаются в концентрации 1X105/мл в среду, имеющую следующий состав:
Среда StemXVivo Serum-Free HSC (R&D Systems), содержащая 100 нг/мл CSF, 100 нг/мл FLT-3, 50 нг/мл ТРО, 20 нг/мл IL-3 (рекомбинантные, человека, Peprotech), X-Vivo 15 (Cambrex), содержащую IL-3 30 нг/мл, SCF 50 нг/мл, IGF 10 нг/мл, FLT3L 50 нг/мл, GMCSF- 3 нг/мл, IL-7- 5 нг/мл, SCDF 10 нг/мл. Клетки культивируются при 37°С, 5% СО2 в течение 14 дней. Половина среды заменяется на свежую каждые три дня. Через 14 дней число CD34+ клеток должно увеличиться минимум в 30 раз.
Помимо вышеописанного эффекта (увеличение количества CD34+ клеток в 5 раз в течение 12 дней или в 30 раз через 14 дней) также было установлено, что ГСК, подвергшиеся экспансии описанным способом, после дифференцировки не проявляют опухолевого фенотипа и могут быть использованы для целей регенеративной медицины.
Была проведена проверка способности гематопоэтических клеток, дифференцированных из ЭСК, вызывать опухоль при введении внутривенно и внутрибрюшинно иммунодефицитным животным.
Всего в эксперименте была использована 21 мышь линии Nu/Nu.
Части мышей клетки вводили подкожно, а части - внутрибрюшинно. Введение клеток человека производилось в день начала эксперимента (0 день). Вели наблюдение в течение максимум 10 недель. Первые признаки роста ЭСК человека под кожей мышей обнаружили на 6-й неделе эксперимента. В процессе проведения эксперимента три мыши были выведены из эксперимента раньше запланированного срока и проанализированы на 7-, 8- и 10-й неделе после инъекции соответственно. На 10-й неделе все животные были выведены из эксперимента и умерщвлены путем эвтаназии в СO2 для гистологического и иммуногистохимического анализа полученных новообразований. Образовавшиеся опухоли вырезали, фиксировали в фиксаторе Буэна и приготовляли парафиновые срезы. Срезы окрашивали гематоксилином - эозином и проводили гистологический анализ тканей.
Как показали гистологические исследования, ГСК ни в одном из экспериментов при разном способе их введения иммунодефицитным мышам не привели к образованию опухолеподобных структур или других новообразований. Напротив, недифференцированные ЭСК, введенные под кожу, образовывали тератомоподобные структуры с соответствующей гистологией. Тем не менее, не было обнаружено ни в одном случае миграции клеток, дифференцированных из ЭСК, вне сайта введения.
Таким образом, были разработаны условия получения и культивирования ЭСК, при которых отсутствуют компоненты среды животного происхождения, минимизировано изменение кариотипа, разрабатываются протоколы дифференцировки ЭСК и ГСК в клетки гематопоэтического ряда, которые не проявляли бы опухолевого фенотипа и могли быть использованы для целей регенеративной медицины.
Список литературы:
1. Delaney С et al: "Notch-mediated expansion of human cord blood progenitor cells capable of rapid myeloid reconstitution", Nat Med. 2010 Feb; 16(2):232-6. Epub 2010 Jan 17.

Изобретение относится к области биохимии. Представлен способ экспансии CD34+ клеток, включающий комбинированное культивирование суспензия - подложка в бессывороточной среде ExVivo 15 с ростовыми факторами SCF 50 нг/мл, IL-3 20 нг/мл, IL-6 20 нг/мл, Flt-3 100 нг/мл, при этом в качестве подложки используются клетки ОР9, а культивирование осуществляют при 37°С, 5% CO2 в течение 12 дней и способ экспансии CD34+ клеток, включающий культивирование в среде следующего состава: среда StemXVivo Serum-Free HSC, содержащая 100 нг/мл CSF, 100 нг/мл FLT-3, 50 нг/мл ТРО, 20 нг/мл IL-3, X-Vivo 15, содержащая 30 нг/мл IL-3, 50 нг/мл SCF, 10 нг/мл IGF, 50 нг/мл FLT3L, 3 нг/мл GMCSF, 5 нг/мл IL-7, 10 нг/мл SCDF, при этом культивирование осуществляют при 37°С, 5% СО2 в течение 14 дней, и половина среды заменяется на свежую каждые три дня. Изобретение позволяет увеличить количество CD34+ клеток в 5 раз в течение 12 дней или в 30 раз в течение 14 дней, при этом после дифференцировки данные клетки не проявляют опухолевого фенотипа. 2 н.п. ф-лы, 3 ил.
1. Способ экспансии CD34+ клеток, включающий комбинированное культивирование суспензия - подложка в бессывороточной среде ExVivo 15 с ростовыми факторами SCF 50 нг/мл, IL-3 20 нг/мл, IL-6 20 нг/мл, Flt-3 100 нг/мл, при этом в качестве подложки используются клетки ОР9, а культивирование осуществляют при 37°С, 5% СO2 в течение 12 дней.
2. Способ экспансии CD34+ клеток, включающий культивирование в среде StemXVivo Serum-Free HSC, содержащей 100 нг/мл CSF, 100 нг/мл FLT-3, 50 нг/мл ТРО, 20 нг/мл IL-3, X-Vivo 15, содержащей 30 нг/мл IL-3, 50 нг/мл SCF, 10 нг/мл IGF, 50 нг/мл FLT3L, 3 нг/мл GMCSF, 5 нг/мл IL-7, 10 нг/мл SCDF, при этом культивирование осуществляют при 37°С, 5% СО2 в течение 14 дней, и половина среды заменяется на свежую каждые три дня.
| ПИТАТЕЛЬНАЯ СРЕДА ДЛЯ КУЛЬТИВИРОВАНИЯ КЛЕТОЧНОЙ КУЛЬТУРЫ Atragene speciosa Weinm | 2009 |
|
RU2422515C1 |
| VERHASSELT В | |||
| et al., Thymic Repopulation by CD34+ Human Cord Blood Cells After Expansion in Stroma-Free Culture, Blood, 1999, v.94, pp.3644-3652 | |||
| LI N | |||
| et al., Human mesenchymal stem cells improve ex vivo expansion of adult human CD34(+) peripheral blood progenitor cells and decrease their allostimulatory capacity, Exp | |||
Авторы
Даты
2012-12-10—Публикация
2011-12-19—Подача