Изобретение относится к теплофизическим измерениям и может быть использовано при проведении физико-химического анализа адсорбирующих материалов, разработке технологий их производства и контроле технологических процессов при их эксплуатации.
Одна из основных стадий любого адсорбционного процесса - десорбция поглощенных веществ - может быть осуществлена различными способами: путем повышения температуры слоя адсорбента, снижением давления в системе, вакуумированием адсорбента, отдувкой в токе газа-носителя и т.д. Практически во всех случаях необходимым условием успешного осуществления стадии десорбции является наличие минимального температурного уровня, обеспечивающего быстрое удаление адсорбата. Адсорбирующие материалы на основе микропористых адсорбентов (цеолиты, активные угли, силикагели и др.) отличаются трудностью удаления из них адсорбата. Для эффективного проведения десорбции из данных адсорбирующих материалов необходимы более высокие, чем обычно, температуры, что повышает требования к правильному выбору температурного режима процесса. Ошибки в выборе оптимальных температур десорбции приводят к уменьшению адсорбционной емкости адсорбента либо за счет неполноты десорбции (если температура процесса слишком низка), либо вследствие разрушения структуры адсорбирующего материала (если температура процесса слишком высока), что крайне нежелательно при многоцикловой эксплуатации адсорбентов в промышленных производствах. Для установления оптимального температурного режима стадии десорбции из любого адсорбирующего материала необходимо тщательное определение основных кинетических параметров данного процесса, в первую очередь энергии активации десорбции. Однако теоретические аспекты стадии десорбции разработаны гораздо слабее теории статики, кинетики и динамики адсорбции.
Известен способ определения энергии активации процесса десорбции, по которому энергию активации десорбции определяют расчетным путем по формуле (1) [Кельцев Н.В. Основы адсорбционной техники. - М.: Химия. 1976. 511 с.]

где Q - теплота адсорбции; Еа - энергия активации процесса адсорбции.
Данный способ позволяет определять энергию активации процесса десорбции химически не связанного с сорбентом сорбата. Поэтому предварительно определяют теплоту адсорбции и энергию активации процесса адсорбции.
Теплоту адсорбции Q определяют путем прямых измерений калориметрическим, хроматографическим или изостерическим методами, а энергию активации адсорбции определяют на основании математической обработки кинетических кривых процесса адсорбции, зарегистрированных методом сорбционных весов при постоянном давлении паров сорбата в вакууме. При этом энергию активации процесса адсорбции Еа вычисляют на основании расчетов коэффициентов диффузии при двух температурах (в достаточно узком температурном интервале принимается допущение о равенстве энергий активации процессов адсорбции при данных температурах, чего в общем случае может и не быть) по формуле (2)
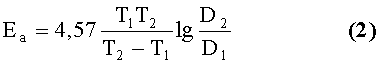
где Т - температура, D - коэффициент диффузии [Д.П.Тимофеев, И.Т.Ерашко. Кинетика сорбции паров воды на цеолитах типа А. // Изв. АН СССР. ОХН. 1961. №7. С.1192-1197].
Уравнение (2) вытекает из уравнения температурной зависимости коэффициента активированной диффузии (3)

где Еа - энергия активации; D0 - предэкспотенциальный множитель; R - универсальная газовая постоянная; T - температура.
Коэффициенты диффузии D вычисляют по уравнению (4) диффузии для цилиндра конечных размеров
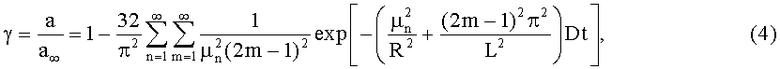
где γ - относительная величина адсорбции; a - величина адсорбции к моменту времени t; a∞ - равновесная величина адсорбции (t→∞); µn - корни функции Бесселя I0(µn); D - коэффициент диффузии, R и L - радиус и длина цилиндра; n=1, 2, 3,… и m=1, 2, 3, …
Данное уравнение после принятия ряда допущений и проведения преобразований для адсорбента, имеющего форму цилиндра с длиной, равной диаметру, примет вид (5)

где t0,5 - время достижения относительной величины адсорбции значения γ=0,5; R - универсальная газовая постоянная.
Уравнение (4) справедливо для случая, когда коэффициент диффузии D является постоянным (D=const), чего в общем случае может и не быть. Поэтому расчет коэффициентов диффузии проводят в относительно узких интервалах величин адсорбции.
Следует отметить, что данный метод определения энергии активации процесса адсорбциии Ea достаточно трудоемок и сложен и, кроме того, при его реализации делается ряд допущений, правомерных далеко не во всех случаях (например, специалистам, работающим в области сорбционной техники хорошо известно, что калориметрический, хроматографический или изостерический методы определения теплоты адсорбции либо довольно длительны и сложны в аппаратурном оформлении (калориметрический метод), либо приемлемы не для всех случаев адсорбционных процессов (хроматографический и изостерический методы) [Кельцев Н.В. Основы адсорбционной техники. - М.: Химия. 1976. 511 с.], а подавляющее большинство используемых адсорбентов не являются цилиндрами с длиной, равной диаметру и др.).
Перечисленные выше факты позволяют утверждать о недостаточно высокой достоверности и точности расчета энергии активации процесса десорбции на основании определения теплоты и энергии активации процесса адсорбции.
Известен способ определения энергии активации топохимических реакций (дегидратации моногидрата пероксида лития состава Li2О2·Н2О), протекающих с изменением массы, основанный на математической обработке дериватографических измерений, выполненных в неизотермическом режиме в условиях линейно повышающейся температуры [Ю.А.Ферапонтов, С.Б.Путин, Л.Л.Ферапонтова и др. Изучение кинетики топохимических процессов в неизотермическом режиме дериватографическим методом. // Вестник ТГТУ. 2009. Т. 15. №4. С.826-835]. В способе определения энергии активации процесса дегидратации кристаллогидратов осуществляют нагревание образцов, регистрацию интегрального изменения массы образца от температуры и времени, определение температуры экстремума процесса дегидратации, построение графика зависимости в координатах 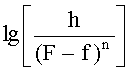 от
от 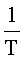 и расчет энергии активации процесса дегидратации. Расчет энергии активации процесса дегидратации осуществляют по формуле
и расчет энергии активации процесса дегидратации. Расчет энергии активации процесса дегидратации осуществляют по формуле
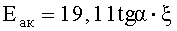
где tgα - тангенс углового коэффициента прямой, построенной в координатах 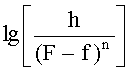 от
от 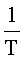
ξ - отношение масштабов по оси абсцисс к масштабам по оси ординат;
h - отклонение кривой интегрального изменения массы образца от нулевой линии;
F - площадь под кривой интегрального изменения массы образца, ограниченная нулевой линией;
f - площадь под кривой интегрального изменения массы образца в любой момент времени;
Т - абсолютная температура;
n - порядок реакции.
При этом порядок реакции n определяется по формуле
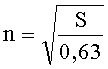
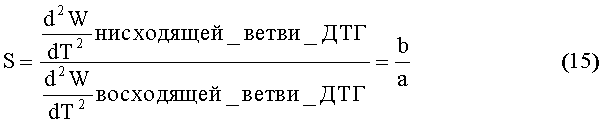
где S - асимметрия кривой интегрального изменения массы образца от времени, определяемая как отношение отрезков а и b, образованных проекциями восходящей и нисходящей ветвей кривой интегрального изменения массы образца от времени на нулевую линию по уравнению
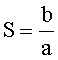
Масса образца кристаллогидрата составляет 74-80 мг, скорость нагрева образца составляет 5-10 град/мин, а все измерения проводят деривато-графическим методом в неизотермических условиях в температурном интервале от 91 до 146°С.
Данный способ определения энергии активации процесса дегидратации позволяет получать достаточно точные результаты для топохимических процессов, к которым относятся процессы дегидратации кристаллогидратов - соединений имеющих в своем составе химически связанную воду, т.е. истинных дальтонидов (индивидуальных химических соединений). Однако при определении энергии активации процесса десорбции сорбата микропористыми адсорбентами (после стадии сорбции относящихся к классу бертоллидов, т.е. соединений переменного состава) возможны значительные погрешности полученных результатов вследствие влияния таких факторов, как теплопроводность среды проведения эксперимента, теплопроводность сорбента и сорбата, конвекция тепла десорбатом, выделяющимся на стадии десорбции из твердой фазы и др., на которые, в свою очередь, влияют дисперсность изучаемого образца, масса навески для исследований, температура проведения измерений дериватографическим методом. В итоге снижается достоверность и точность определения энергии активации процесса десорбции сорбата микропористыми адсорбентами.
Задачей изобретения является повышении достоверности и точности определения энергии активации процесса десорбции.
Задача решается тем, что в способе определения энергии активации процесса десорбции, включающем нагревание образцов адсорбентов, регистрацию интегрального изменения массы образца от температуры и времени дериватографическим методом в неизотермических условиях, определение температуры экстремума процесса десорбции, построение графика зависимости в координатах 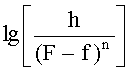 от
от 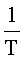 , расчет энергии активации процесса десорбции, осуществляемый по формуле
, расчет энергии активации процесса десорбции, осуществляемый по формуле
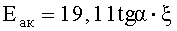
где tgα - тангенс углового коэффициента прямой, построенной в координатах 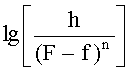 от
от 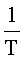
ξ - отношение масштабов по оси абсцисс к масштабам по оси ординат;
h - отклонение кривой интегрального изменения массы образца от нулевой линии;
F - площадь под кривой интегрального изменения массы образца, ограниченная нулевой линией;
f - площадь под кривой интегрального изменения массы образца в любой момент времени;
T - абсолютная температура;
n - порядок реакции,
для нагрева используют навеску адсорбента массой 20-100 мг с дисперсностью адсорбента 3-7 мкм, предварительно насыщенного сорбатом, а нагрев осуществляют в температурном интервале 50-400°С.
Основанием для осуществления изобретения являются следующие предпосылки.
Процесс десорбции молекул сорбата из бидисперсных (первичная и вторичная пористость) адсорбентов, каковыми являются все формованные цеолиты, силикагели, активные угли и многие другие адсорбенты включает следующие стадии:
- отрыв молекул сорбата от активных центров поверхности сорбента;
- диффузию молекул в первичной пористой структуре;
- диффузию молекул во вторичной пористой структуре;
- испарение с наружной поверхности адсорбента;
- удаление десорбата из газовой фазы [Кельцев Н.В., Афанасьев Ю.М., Шумяцкий Ю.И. Метод относительного расчета кинетических кривых десорбции углеводородов в вакууме. // ЖФХ. 1968. Т.42. №6. С.1480-1483].
Если принять ряд допущений, обоснованных в работе авторов [Кельцев Н.В., Афанасьев Ю.М., Шумяцкий Ю.И. Метод относительного расчета кинетических кривых десорбции углеводородов в вакууме. // ЖФХ. 1968. Т.42. №6. С.1480-1483] и корректно выбрать на их основании условия проведения измерений (в первую очередь дисперсность адсорбента, оказывающую значительное влияние на диффузию молекул сорбата во вторичной пористой структуре и испарение с наружной поверхности адсорбента), то основными факторами, определяющими механизм процесса десорбции, является отрыв молекул сорбата от поверхности адсорбента и диффузия в первичной пористой структуре адсорбента, а остаточная адсорбция после удаления сорбата из объема адсорбционных полостей происходит мономолекулярным слоем на дискретных центрах однородных поверхностей в отсутствие взаимодействия между адсорбированными молекулами (т.е. в соответствие с теорией Ленгмюра), и процесс десорбции можно рассматривать как типичную топохимическую реакцию. При этом процесс десорбции можно схематически представить следующей квазихимической реакцией (6):

Скорость гетерогенного процесса, сопровождающегося образованием одного газообразного продукта, удаляемого из зоны реакции, описывается следующим кинетическим уравнением (7) [Киперман С.Л. Введение в кинетику гетерогенных каталитических реакций. М.: Наука. 1964. 608 с.]:
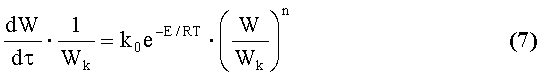
где Wk - потеря массы изучаемого образца; W - потеря массы изучаемого образца к моменту времени τ; k0 - предэкспотенциальный множитель; Е - энергия активации топохимического процесса; n - порядок реакции; T - абсолютная температура; R - универсальная газовая постоянная.
Для условий линейного программированного нагрева, когда 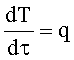 уравнение (7) может быть представлено в виде (8):
уравнение (7) может быть представлено в виде (8):
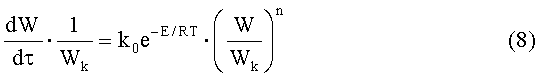
где q - скорость нагрева изучаемого образца.
Дериватографы позволяют с высокой точностью одновременно фиксировать как интегральное изменение массы изучаемого образца в процессе нагрева (кривая ТГ), так и интегральное изменение массы образца от времени (кривая ДТГ). В этом случае величина 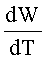 будет пропорциональна отклонению кривой ДТГ от нулевой линии h, т.е.
будет пропорциональна отклонению кривой ДТГ от нулевой линии h, т.е.

Если
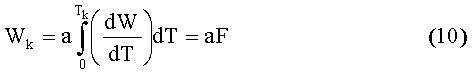
то
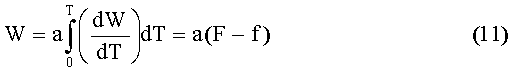
где α, a - коэффициенты пересчета; F - площадь под кривой ДТГ, ограниченная нулевой линией; f - площадь под кривой ДТГ в любой момент времени.
Для конкретных условий эксперимента величины α, a, F являются константами, т.е. уравнение (8) с учетом уравнений (9-11) может быть записано в виде (12):
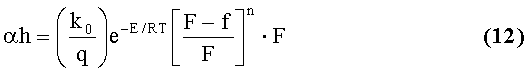
Преобразовав уравнение (12), получим уравнение (13)
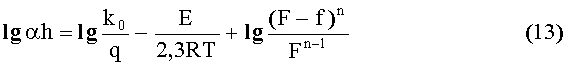
или
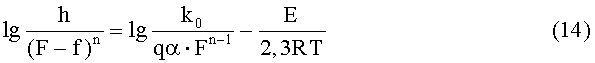
Зависимость в координатах 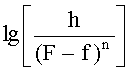 от
от 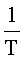 при правильно определенном порядке реакции описывается уравнением прямой, угловой коэффициент которой пропорционален энергии активации процесса десорбции.
при правильно определенном порядке реакции описывается уравнением прямой, угловой коэффициент которой пропорционален энергии активации процесса десорбции.
Порядок реакции определяют по простому и надежному способу, предложенному Киссинджером [H.E.Kissinger. // Analyt. Chem. 1957. V.29. P.1702], основанному на нахождении температуры максимума изучаемого эффекта и асимметрии кривой ДТГ. Асимметрия кривой ДТГ, определяемая по уравнению (15) и вычисленная как отношение отрезков а и b, образованных проекциями восходящей и нисходящей ветвей кривой ДТГ на нулевую линию
связана с порядком реакции n следующей зависимостью (16)

В работе [V.М.Padmanabhan, S.С.Saraiya, А.К.Sundaram. // J. Inorg. and Nucl. Chem. 1960. V.12. P.356.] показано, что предэкспотенциальный множитель k0 для топохимических процессов может быть достаточно легко определен из формулы (17)

где Ts - температура экстремума процесса десорбции на кривой ДТГ.
Способ осуществляется следующим образом.
Предварительно обработанные водяным паром до стадии насыщения образцы кристаллического цеолита NaX (адсорбирующего материала, десорбция которого наиболее детально исследована и описана в научной литературе) массой 20-100 мг и дисперсностью 3-7 мкм помещают в корундовый тигель и нагревают. Выбранные масса образца и его дисперсность обеспечивают необходимую для равномерного прогрева навески образца в ходе измерений теплопроводность сорбента и сорбата, конвекцию тепла десорбатом, выделяющимся на стадии десорбции из твердой фазы и исключают наличие на термограммах эффектов, отвечающих переходу из неравновесного состояния в равновесное и способных повлиять на корректность полученных результатов. Измерение температуры осуществляют платино-платинородиевой термопарой, помещенной в объем образца и проградуированной по общепринятым реперным точкам. Регистрацию интегрального изменения массы образца от температуры и времени и определение температуры экстремума процесса десорбции (термогравиметрический и дифференциальный термический анализ) проводят в неизотермических условиях на дериватографе, например исследовательском комплексе TAG-24 фирмы "Setaram" (Франция). Температуру регистрируют с точностью до 0,01°С, изменения массы образцов фиксируют с точностью до 0,01 мг. Измерения проводят на воздухе при атмосферном давлении в температурном интервале от 50 до 400°С со скоростью нагрева 5÷10 градусов в минуту. При этом регистрируют интегральные изменения массы образца от температуры (кривая ТГ) и от времени (кривая ДТГ), а также определяют температуру экстремума на кривой интегрального изменения массы образца от температуры Ts.
Выбор условий проведения термического анализа обусловлен тем, что именно при данных условиях происходит термическая десорбция сорбата из цеолита NaX. Указанная скорость нагрева обеспечивает тождество температур по всему объему изучаемых образцов при проведении эксперимента. При скорости нагрева образцов меньше 5 град/мин и выше 10 град/мин наблюдается существенное отклонение кривой изменения температуры Т от прямой линии, приводящее к значительной погрешности при проведении расчетов кинетических параметров изучаемого процесса. Данный экспериментальный факт объясняется нарушением равенства температур внешних и внутренних слоев навески изучаемых образцов, вызванным недостаточной теплопроводностью адсорбирующих материалов.
На основании математической обработки полученных данных строят график зависимости в координатах 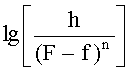 от
от 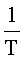
Расчет энергии активации процесса десорбции осуществляют по формуле 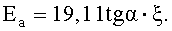
В таблице представлены данные, характеризующие условия реализации изобретения и основные кинетические параметры процесса десорбции, полученные на основании проведения математической обработки экспериментальных данных.
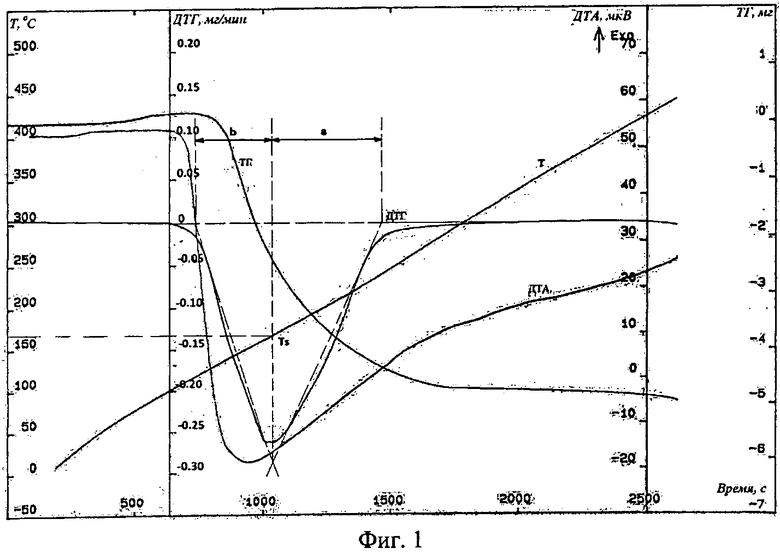
На Фиг.1, как пример, представлены результаты термического анализа образца №1 из таблицы (во избежание загромождения текста описания практически тождественными материалами приводятся результаты термического анализа только данного образца) и обозначены величины, необходимые для расчета основных кинетических параметров процесса десорбции по данным термического анализа. В ходе практической реализации способа определении энергии активации процесса десорбции было установлено, что процесс десорбции водяного пара начинается при температуре 91,2±1,4°С, проходит через максимум при 172,2±1,3°С и заканчивается при 277,7±1,6°С (первый эндотермический эффект на кривых ДТА и ДТГ). При этом наблюдается уменьшение массы образца адсорбирующего материала на 26,1±0,2% (сорбционная емкость образцов составляет ~26,3% весовых), что свидетельствует о практически полной десорбции образцов адсорбирующих материалов в условиях эксперимента. Наличие на кривых ДТА в температурном интервале от 80°С до 280°С только одного эндотермического эффекта свидетельствует о том, что в процессе десорбции энергия затрачивается только на одну стадию - отрыв молекул адсорбата от поверхности адсорбента.
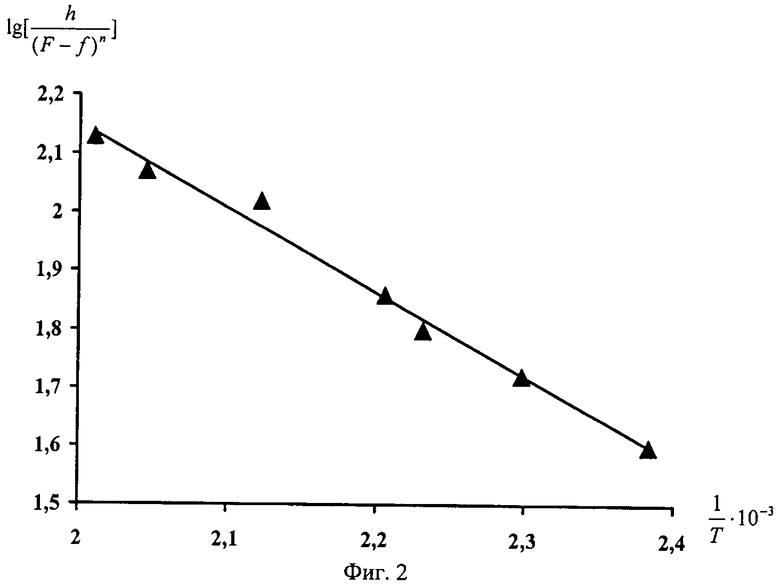
Из асимметрии кривых ДТГ по формуле (16) был определен порядок процесса десорбции, равный 1,01±0,03. Для всех образцов на основании определения значений температур по кривым ТГ и проведенных расчетов величин h, F и f по кривым ДТГ были построены зависимости, в координатах 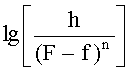 от
от 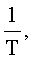 имеющие практически идентичный характер. На Фиг.2 проиллюстрирована данная зависимость для образца №2 из таблицы.
имеющие практически идентичный характер. На Фиг.2 проиллюстрирована данная зависимость для образца №2 из таблицы.
Зависимость 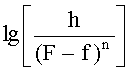 от
от 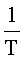 близка к линейной на протяжении всего рассматриваемого температурного интервала, что так же свидетельствует о правильно рассчитанном порядке реакции. Из приведенных графических данных энергия активации изучаемого процесса определялась по формуле
близка к линейной на протяжении всего рассматриваемого температурного интервала, что так же свидетельствует о правильно рассчитанном порядке реакции. Из приведенных графических данных энергия активации изучаемого процесса определялась по формуле
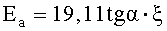
Предэкспотенциальный множитель для описания кинетики процесса десорбции по уравнению (8), определялся по уравнению (17) с учетом полученного значения энергии активации десорбции и скорости нагрева навески образца адсорбирующего материала.
Способ определения энергии активации процесса десорбции позволяет повысить достоверность и точность измерения требуемых параметров при их последующей математической обработке.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ФОРМОВАННОГО СОРБЕНТА | 2010 |
|
RU2446876C1 |
| СПОСОБ ПОЛУЧЕНИЯ АДСОРБИРУЮЩЕГО ЭЛЕМЕНТА | 2012 |
|
RU2524608C2 |
| СПОСОБ ПОЛУЧЕНИЯ ГИБКИХ КОМПОЗИЦИОННЫХ СОРБЦИОННО-АКТИВНЫХ МАТЕРИАЛОВ | 2013 |
|
RU2543167C2 |
| АНОД ФТОРНОГО СРЕДНЕТЕМПЕРАТУРНОГО ЭЛЕКТРОЛИЗЕРА | 1996 |
|
RU2118995C1 |
| СПОСОБ ПОЛУЧЕНИЯ КОКСОВЫХ ПЛАСТИН ДЛЯ ФТОРНЫХ ЭЛЕКТРОЛИЗЕРОВ | 1997 |
|
RU2136785C1 |
| АДСОРБЕР | 2013 |
|
RU2547115C2 |
| СПОСОБ ПОЛУЧЕНИЯ ГИБКИХ КОМПОЗИЦИОННЫХ СОРБЦИОННО-АКТИВНЫХ МАТЕРИАЛОВ | 2011 |
|
RU2481154C1 |
| СПОСОБ ПОЛУЧЕНИЯ ГИБКИХ АДСОРБИРУЮЩИХ ИЗДЕЛИЙ | 2011 |
|
RU2475301C2 |
| Адсорбирующие материалы и способы их применения | 2015 |
|
RU2705340C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ФРАКЦИОННОГО СОСТАВА ВЛАГИ В МАТЕРИАЛАХ | 2005 |
|
RU2296974C1 |
Изобретение относится к теплофизическим измерениям и может быть использовано при проведении физико-химического анализа адсорбирующих материалов, разработке технологий их производства и контроле технологических процессов при их эксплуатации. Способ определения энергии активации процесса десорбции включает нагревание образцов адсорбентов, регистрацию интегрального изменения массы образца от температуры и времени дериватографическим методом в неизотермических условиях, определение температуры экстремума процесса десорбции, построение графика зависимости в координатах 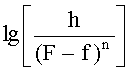 от
от 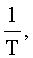 расчет энергии активации процесса десорбции, осуществляемый по формуле
расчет энергии активации процесса десорбции, осуществляемый по формуле
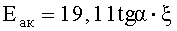
где tgα - тангенс углового коэффициента прямой, построенной в координатах 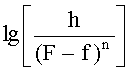 от
от 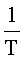
ξ - отношение масштабов по оси абсцисс к масштабам по оси ординат;
h - отклонение кривой интегрального изменения массы образца от нулевой линии;
F - площадь под кривой интегрального изменения массы образца, ограниченная нулевой линией;
f - площадь под кривой интегрального изменения массы образца в любой момент времени;
Т - абсолютная температура;
n - порядок реакции, для нагрева используют навеску адсорбента массой 20-100 мг, дисперсностью адсорбента 3-7 мкм, предварительно насыщенного сорбатом, а нагрев осуществляют в температурном интервале 50÷400°С. Технический результат - повышение достоверности и точности определения энергии активации процесса десорбции. 1 табл. 2 ил.
Способ определения энергии активации процесса десорбции, включающий нагревание образцов адсорбентов, регистрацию интегрального изменения массы образца от температуры и времени дериватографическим методом в неизотермических условиях, определение температуры экстремума процесса десорбции, построение графика зависимости в координатах 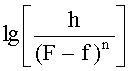 от
от 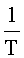 , расчет энергии активации процесса десорбции, осуществляемый по формуле
, расчет энергии активации процесса десорбции, осуществляемый по формуле
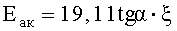 ,
,
где tgα - тангенс углового коэффициента прямой, построенной в координатах 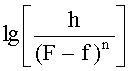 от
от 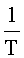 ;
;
ξ - отношение масштабов по оси абсцисс к масштабам по оси ординат;
h - отклонение кривой интегрального изменения массы образца от нулевой линии;
F - площадь под кривой интегрального изменения массы образца, ограниченная нулевой линией;
f - площадь под кривой интегрального изменения массы образца в любой момент времени;
Т - абсолютная температура;
n - порядок реакции,
отличающийся тем, что для нагрева используют навеску адсорбента массой 20-100 мг, дисперсностью адсорбента 3-7 мкм, предварительно насыщенного сорбатом, а нагрев осуществляют в температурном интервале 50÷400°С.
| Ферапонтов Ю.А., Путин С.Б., Ферапонтов Л.Л | |||
| и др | |||
| Изучение кинетики топохимических процессов в неизотермическом режиме дериватографическим методом | |||
| - Вестник ТГТУ, 2009, т | |||
| Прибор для нагревания перетягиваемых бандажей подвижного состава | 1917 |
|
SU15A1 |
| Химия | |||
| Фролов В.В | |||
| Учебное пособие | |||
| - М.: Высш | |||
| школа, 1986, с.51 | |||
Авторы
Даты
2012-12-10—Публикация
2011-09-02—Подача