Область техники
Настоящее изобретение было сделано при поддержке Корейского института по продвижению технология в соответствии с Грантом 1415118385 с 1 ноября 2011 по 1 октября 2014 года и управлении рабочей группы поддержки международного сотрудничества КИАТ, называемой Работы по международному сотрудничеству для развития технологий и платформы открытия инновационных эпитопов на основе технологий глобальной разработки новых лекарств на основе антител, проводимой AbClon, Inc.
Эта заявка претендует на приоритет корейской патентной заявки № 10-2013-0055912, поданной 16 мая 2013 года, в Корейском бюро интеллектуальной собственности, раскрытие которой включено в настоящий документ посредством ссылки.
Настоящее изобретение относится к антителам к HER2 (рецептор 2 эпидермального фактора роста человека) для предупреждения или лечения связанных с HER2 заболеваний, особенно злокачественных новообразований.
Предпосылки изобретения
Ген HER2/neu(ErbB2) кодирует 185 кДа трансмембранный гликопротеин, который является одним из членов семейства EGFR (рецептор эпидермального фактора роста). Белок HER2 состоит из внеклеточного домена из 620 аминокислотных остатков, 20 трансмембранных доменов из 23 аминокислотных остатков и внутриклеточного домена, обладающего тирозинкиназной активностью, состоящего из 490 аминокислотных остатков (Akiyama T, et al., Science, 232(4758): 1644-1646(1986)).
Кроме того, HER2-антитела с различными характеристиками представлены в ряде работ: Tagliabue et al., Int. J. Cancer 47:933-937 (1991); McKenzie et al., 25 Oncogene 4:543-548 (1989); Maier et al., Cancer Res. 51:5361-5369 (1991); Bacus et al., Molecular Carcinogenesis 3:350-362 (1990); Stancovski et al., PNAS (USA) 88:8691-8695 (1991); Bacus et al., Cancer Research 52:2580-2589 (1992); Xu et al., Int. J. Cancer 53:401-408 (1993); WO94/00136; Kasprzyk et al., Cancer Research 52:2771-2776 (1992); Hancock et al., Cancer Research. 51:4575-4580 (1991); 30 Shawver et al, Cancer Res. 54:1367-1373 (1994); Arteaga et al., Cancer Res. 54:3758-3765 (1994); Harwerth et al., J. Biol. Chem. 267:15160-15167 (1992); U.S. Pat. № 5783186; Kao et al., U.S. Publ. № 2009/0285837 (2009); Ross et al., The Oncologist 8:307-325 (2003) and Klapper et al., Oncogene 14:2099-2109 (1997).
Среди HER2-антител, трастузумаб как самое коммерчески успешное антитело (продается как Herceptin™, патент США № 5821337) интенсивно изучали: Sapino A., et al., Annals of Oncology (2007) 18:1963-1968; Bussolati, G, et al., British Journal of Cancer (2005) 92, 1261-1267; and Glazyrin A, et al., J Histology & Cytochemistry (2007) 55(1):25-33.
Хотя трастузумаб был коммерчески успешным, это антитело, скорее всего, показывает терапевтическую эффективность лишь у 15% пациентов со злокачественной опухолью молочной железы, сверхэкспрессирующей HER2. Поэтому предпринимались попытки улучшить прогноз онкологических пациентов, которые не реагировали или слабо реагировали на трастузумаб при комбинированной терапии, в контексте повышения степени или спектра эффективности трастузумаба.
Например, публикация патентной заявки США № 2011-0086004 раскрывает комбинированную противоопухолевую терапию с трастузумабом и IL-21. Публикация патентной заявки США № 2012-0107270 описывает трастузумаб в комбинации с тенасцин-С направленным антителом, конъюгированным с IL-2.
Публикация патентной заявки США № 2005-0101618 раскрывает противоопухолевую терапию с трастузумабом и лигандом erbB2. Европейская публикация патентной заявки № 2134364 раскрывает ингибирование пролиферации раковых клеток при помощи трастузумаба в комбинации с ингибиторами теломеразы. WO 2008/031531 описывает, что трастузумаб в комбинации с пертузумаб может подавлять раковые метастазы.
В продолжение этой заявки даются ссылки на различные патенты и публикации, и цитаты приводятся в скобках. Раскрытие этих патентов и публикаций в своей сущности настоящим включено посредством ссылки в данную заявку для более полного описания данного изобретения и состояния рассматриваемой области техники, к которой данное изобретение относится.
Технологические вопросы, подлежащие решению
Авторы настоящего изобретения предприняли интенсивные исследования для разработки антител, способных к предупреждению или лечению связанных с HER2 заболеваний, особенно злокачественных опухолей (в частности, рак молочной железы и рак желудка). В частности, авторы настоящего изобретения предприняли интенсивные исследования для разработки антител, способных в комбинации с трастузумабом преодолевать ограничения в противоопухолевой эффективности, связанные с лечением трастузумабом в качестве единственного средства. В результате, авторы настоящего изобретения разработали новые антитела, обладающие значительной противоопухолевой эффективностью per se и гораздо более высокой эффективностью в сочетании с трастузумабом для профилактики или лечения злокачественных опухолей (особенно рака молочной железы и рака желудка, и в частности, HER2-экспрессирующего рака молочной железы и рака желудка). Соответственно, предметом данного изобретения является предоставление антитела к рецептору эпидермального фактора роста 2 (HER2) человека или его антигенсвязывающего фрагмента.
Еще одним предметом данного изобретения является получение молекулы нуклеиновой кислоты, кодирующей настоящее HER2-антитело или его антигенсвязывающий фрагмент.
Еще одним предметом настоящего изобретения является получение рекомбинантного вектора, несущего молекулу нуклеиновой кислоты.
Еще одним предметом настоящего изобретения является получение клетки-хозяина, трансфицированной с помощью рекомбинантного вектора.
Еще одним предметом настоящего изобретения является получение фармацевтической композиции для предупреждения или лечения рака.
Еще одним предметом настоящего изобретения является получение фармацевтической композиция для индуцирования апоптоза.
Другие предметы и преимущества настоящего изобретения станут очевидными из подробного последующего описания, приведенного в сочетании с прилагаемыми пунктами формулы изобретения и чертежами.
Подробное описание этого изобретения
В первом аспекте настоящего изобретения, предоставлено антитело к рецептору эпидермального фактора роста 2 (HER2) человека или его антигенсвязывающий фрагмент, включающее:
(а) вариабельную область тяжелой цепи, содержащую определяющую комплементарность область (CDR)H1 SEQ ID NO:1, CDRH2 SEQ ID NO:2 и CDRH3, представленную следующей формулой 1; и
(b) вариабельную область легкой цепи:
X1-X2-X3-X4-X5-X6-X7-Phe-Asp-Tyr (1),
в которой X1 представляет His, Asn, Ser или Ala; X2 представляет Leu, Phe, Tyr, His, Met, Trp, Asn, Ile или Ala; X3 представляет Gly или Cys; X4 представляет Gly или Ser; Х5 представляет Thr, Met или Ala; Х6 представляет Ala, Ser, Gly или Thr; и Х7 представляет Ser, Ala, Cys или Thr.
Авторы настоящего изобретения предприняли интенсивные исследования, чтобы разработать антитела, способные к предупреждению или лечению связанных с HER2 заболеваний, особенно злокачественных опухолей (в частности, рака молочной железы и рака желудка). В частности, в настоящее время изобретатели предприняли интенсивные исследования, чтобы разработать антитела, в комбинации с трастузумабом способные преодолевать ограничения в противоопухолевой эффективности, связанные с трастузумабом при лечении в качестве единственного средства. В результате, авторы настоящего изобретения разработали новые антитела, обладающие значительной противоопухолевой эффективностью сами по себе, и гораздо более высокой эффективностью в сочетании с трастузумабом для профилактики или лечения злокачественных опухолей (особенно рака молочной железы и рака желудка, и в частности, HER2-экспрессирующих рака молочной железы и рака желудка).
Антитело по данному изобретению обладает специфической способностью связывания с HER2. В частности, настоящее антитело связывается с эпитопом на HER2, отличающимся от эпитопа, с которым связывается трастузумаб.
Используемый в настоящем документе термин "трастузумаб" относится к антителу, раскрытому в патенте США № 5821337.
Антитело по изобретению оказывает цитотоксические эффекты или эффекты ингибирования пролиферации в отношении различных HER2-экспрессирующих раковых клеток. Различие между терминами "цитотоксичность" и "ингибирование пролиферации" в связи с раковыми клетками предполагается, и эти термины используются взаимозаменяемо в данном документе.
Используемый в настоящем документе термин "антитело" относится к HER2-специфическим антителам, в том числе к целому антителу, а также к любому антигенсвязывающему фрагменту антитела.
Целое антитело включает две полноразмерных легких цепи и две полноразмерных тяжелых цепи, и каждая легкая цепь связана с тяжелой цепью посредством дисульфидной связи. Константная область тяжелой цепи включает пять различных изотипов (γ, μ, α, δ и ε), которые подразделяются на подгруппы γ1, γ2, γ3, γ4, α1 и α2. Константная область легкой цепи включает два различных изотипа (κ и λ) (Cellular and Molecular Immunology, Wonsiewicz, M. J., Ed., Chapter 45, pp.41-50, W. B. Saunders Co. Philadelphia, PA(1991); Nisonoff, A., Introduction to Molecular Immunology, 2nd Ed., Chapter 4, pp.45-65, sinauer Associates, Inc., Sunderland, MA (1984)).
Антигенсвязывающий фрагмент относится к любому фрагменту антитела, способному связывать антиген, включая Fab, F(ab'), F(ab')2, Fv и так далее. Fab имеет один антигенсвязывающий участок, который состоит из вариабельных доменов тяжелой цепи и легкой цепи антитела, константного домена легкой цепи и первого константного домена (CH1) тяжелой цепи. Fab' отличается от Fab в том смысле, что существует шарнирная область, содержащая один или более остатков цистеина в С-концевой части CH1-домена тяжелой цепи. Антитело F(ab')2 получают путем формирования дисульфидных связей между остатками цистеина шарнирной области Fab'. Fv представляет собой минимальный фрагмент антитела, состоящий из вариабельных областей тяжелой цепи и легкой цепи, и рекомбинантная технология подготовки Fv-фрагмента раскрыта в РСТ WO 88/10649, WO 88/106630, WO 88/07085, WO 88/07086 и WO 88/09344. В двуцепочечном, вариабельные области тяжелой цепи и легкой цепи связаны нековалентной связью, а в одноцепочечных Fv, вариабельные области тяжелой цепи и легкой цепи, как правило, связаны посредством ковалентной связи через пептидный линкер или напрямую связаны друг с другом по C-концу, образуя димер, такой как двуцепочечный Fv. Такие фрагменты антител могут быть получены при использовании протеолитических ферментов (например, целое антитело переваривается папаином для получения Fab-фрагментов, и обработка пепсином приводит к продуцированию F(ab')2 фрагментов), и могут быть подготовлены при помощи способов генетической рекомбинации.
В соответствии с вариантом осуществления изобретения антитело по настоящему изобретению включает Fab-антитела и целые антитела. Кроме того, константную область тяжелой цепи выбирают из изотипов, состоящих из (γ, μ, α, δ и ε. Предпочтительно, константная область тяжелой цепи включает изотипы γ1, γ3 и γ4, наиболее предпочтительно изотип γ1. Константная область легкой цепи может быть κ и λ изотипа, предпочтительно, изотипа κ. Поэтому предпочтительным вариантом осуществления настоящего антитела является антитело Fab или IgGl, содержащее легкую цепь κ и тяжелую цепь γ1.
Термин "тяжелая цепь", используемый в настоящем документе, относится как к полноразмерной тяжелой цепи, так и к ее части, которая включает вариабельный домен (VH), содержащий аминокислотную последовательность последовательности вариабельной области для специфического связывания с антигеном, и три константных домена (CH1, CH2 и CH3). Термин "легкая цепь", используемый в настоящем документе, относится как к полноразмерной легкой цепи, так и к ее части, которая включает вариабельный домен (VL), содержащий аминокислотную последовательность последовательности вариабельной области для специфического связывания антигена, и константный домен (CL).
Используемый в настоящем документе термин "CDR (определяющая комплементарность область)" относится к аминокислотной последовательности гипервариабельных областей тяжелых и легких цепей иммуноглобулинов (Kabat et al, Sequences of Proteins of Immunological Interest, 4th Ed., U.S. Department of Health and Human Services, National Institutes of Health (1987)). Каждая из тяжелых и легких цепей содержит три CDR (тяжелая цепь (CDRH1, CDRH2 и CDRH3) и легкая цепь (CDRL1, CDRL2 и CDRL3)). CDR предоставляет контактирующие остатки, играющие важную роль в связывании антитела с антигеном или эпитопом.
В настоящем антителе, CDRH3 представлен формулой 1.
В формуле 1, X1 представляет His, Asn, Ser или Ala; конкретно His, Asn или Ser; более конкретно, His или Asn; еще более конкретно, His.
В формуле 1, X2 представляет Leu, Phe, Tyr, His, Met, Trp, Asn, Ile или Ala; конкретно Leu, Phe, Tyr, His, Met, Trp, Asn или Ile; более конкретно, Leu, Phe или Tyr; еще более конкретно, Leu.
В формуле 1, X3 представляет Gly или Cys; в частности, Gly.
В формуле 1, X4 представляет Gly или Ser; в частности, Gly.
В формуле 1, Х5 представляет Thr, Met или Ala; в частности, Thr.
В формуле 1, Х6 представляет Ala, Ser, Gly или Thr; в частности, Ala.
В формуле 1, Х7 представляет Ser, Ala, Cys или Thr; в частности, Ser.
В соответствии с вариантом осуществления X1 представляет His, Asn или Ser; X2 представляет Leu, Phe или Tyr; X3 представляет Gly; X4 представляет Gly; X5 представляет Thr, Met или Ala; X6 представляет Ala, Ser, Gly или Thr; и X7 представляет Ser, Ala, Cys или Thr.
Более конкретно, X1 представляет His, Asn или Ser; X2 представляет Leu, Phe или Tyr; X3 представляет Gly; X4 представляет Gly; X5 представляет Thr; Х6 представляет Ala и X7 представляет Ser.
Еще более конкретно, CDRH3 содержит аминокислотную последовательность, выбранную из группы SEQ ID NO:3, 27-28, 32 и 39-86; еще гораздо более конкретно, CDRH3 содержит аминокислотную последовательность SEQ ID NO:3, 43, 64, 67, 71, 76, 83, 25 84 или 85; наиболее конкретно, SEQ ID NO:3.
В соответствии с вариантом осуществления вариабельная область легкой цепи содержит CDRL1 SEQ ID NO:4, CDRL2 SEQ ID NO:5 и CDRL3, представленную следующей формулой 2:
Y1-Y2-Y3-Y4-Y5-Y6-Pro-Trp-Thr (2)
в которой Y1 представляет Gln, Asp или Ala; Y2 представляет Gln, Asn, Glu или Ala; Y3 представляет Leu, Met, Asn, He, Ser, Thr, Ala или Lys; Y4 представляет Tyr, Ala, Ser, Arg, Val, Gly, Met или Phe; Y5 представляет Ser, Phe, Tyr, Arg, He, Gly, Lys, Asn, Val или Ala; и Y6 представляет Thr, Ser, Val, Ile, Ala, Gly, Asn, Glu, Phe или Leu.
В формуле 2, Y1 представляет Gln, Asp или Ala; конкретно Gln или Asp; более конкретно, Gln.
В формуле 2, Y2 представляет Gln, Asn, Glu или Ala; конкретно Gln, Asn или Glu; более конкретно, Gln.
В формуле 2, Y3 представляет Leu, Met, Asn, He, Ser, Thr, Ala или Lys; конкретно Leu, Met, Asn, He, Ser или Thr; более конкретно, Leu, Met, Asn or He; еще более конкретно, Leu или Met; наиболее конкретно, Leu.
В формуле 2, Y4 представляет Tyr, Ala, Ser, Arg, Val, Gly, Met или Phe; конкретно Tyr или Ala.
В формуле 2, Y5 представляет Ser, Phe, Tyr, Arg, Ile, Gly, Lys, Asn, Val или Ala; конкретно Ser, Phe, Tyr, Arg или Ile; более конкретно, Ser, Phe или Tyr.
В формуле 2, Y6 представляет Thr, Ser, Val, Ile, Ala, Gly, Asn, Glu, Phe или Leu; конкретно Thr, Ser, Val, Ile, Ala, Gly или Asn; более конкретно, Thr, Ser или Ala.
В соответствии с вариантом осуществления Y1 представляет Gln или Asp; Y2 представляет Gln; Y3 представляет Leu, Met, Asn, Ile, Ser или Thr; Y4 представляет Tyr, Ala, Ser, Arg, Val, Gly, Met или Phe; Y5 представляет Ser, Phe, Tyr, Arg или Ile; и Y6 представляет Thr, Ser, Val, Ile, Ala, Gly или Asn.
Более конкретно, CDRL3 содержит аминокислотную последовательность SEQ ID NO:6, 33-38 или 87-245; еще более конкретно, CDRL3 содержит аминокислотную последовательность SEQ ID NO:6, 88, 109, 131, 155, 156, 157, 178, 218, 220, 222 или 239; наиболее конкретно, SEQ ID NO:6, 88 (hz1E11-3), 218 (hz1E11-133) или 239 (hz1E11-154).
В соответствии с вариантом осуществления вариабельная область тяжелой цепи содержит аминокислотную последовательность SEQ ID NO:8 (1E11) или 24 (hz1E11).
В соответствии с вариантом осуществления вариабельная область легкой цепи включает последовательность аминокислот SEQ ID NO:10 (1E11), 26 (hz1E11), 247 (hz1E11-3), 249 (hz1E11-133) или 251 (hz1E11-154).
Как продемонстрировано в примерах, хотя антитело по настоящему изобретению специфически связывается с суб-доменом 4 среди внеклеточных доменов HER2, настоящее антитело связывается с эпитопом на суб-домене 4, отличным от эпитопа для трастузумаба.
Настоящее HER2-антитело или его антигенсвязывающий фрагмент включает варианты аминокислотных последовательностей, изложенные в прилагаемом списке последовательностей, при условии, что они способны специфически узнавать HER2. Например, аминокислотные последовательности антител могут быть изменены с целью улучшения аффинности связывания и/или других биологических характеристик антител. Например, такие изменения включают делецию, вставку и/или замену аминокислотных остатков антител.
Такие аминокислотные вариации могут быть предоставлены на основании относительного сходства боковых цепей аминокислот, например, гидрофобности, гидрофильности, заряда и размера. Из анализа размера, формы и типа боковых цепей аминокислот, может быть ясно, что каждый из остатков аргинина, лизина и гистидина является остатком, имеющим положительный заряд; аланин, глицин и серин имеют одинаковый размер; фенилаланин, триптофан и тирозин имеют сходную форму. Соответственно, исходя из этих важных факторов, аргинин, лизин и гистидин; аланин, глицин и серин; и фенилаланин, триптофан и тирозин могут рассматриваться биологически в качестве функциональных эквивалентов.
Для введения вариаций, можно рассматривать индекс гидрофобности аминокислот. На основе гидрофобности и заряда, в индекс гидрофобности придается каждой аминокислоте: изолейцин (+4,5); валин (+4,2); лейцин (+3,8); фенилаланин (+2,8); цистеин (+2,5); метионин (+1,9); аланин (+1,8); глицин (-0,4); треонин (-0,7); серин (-0,8); триптофан (-0,9); тирозин (-1,3); пролин (-1,6); гистидин (-3,2); глутаминовая кислота (-3,5); глутамин (-3,5); аспарагиновая кислота (-3,5); аспарагин (-3,5); лизин (-3,9) и аргинин (-4,5).
Для обеспечения интерактивной биологической функции белков, индекс гидрофобности аминокислота очень важен. Любому специалисту в рассматриваемой области техники известно, что варианты могут обладать сходной биологической активностью, только где белки заменяются аминокислотами, имеющими сходный индекс гидрофобности. В случае, где вариации вводятся на основе индекса гидрофобности, замещение предпочтительно выполняют между аминокислотными остатками, имеющими разницу в значении индекса гидрофобности не более +2, более предпочтительно, в пределах ±1, намного более предпочтительно, в пределах ±0,5.
Специалистам в рассматриваемой области техники также очевидно, что замены аминокислот другими аминокислотами, имеющими аналогичные значения гидрофильности, может привести к созданию вариантов, обладающих биологически эквивалентными активностями. Как раскрыто в патенте США № 4554101, каждому аминокислотному остатку придаются следующие значения гидрофильности: аргинин (+3,0); лизин (+3,0); аспарагиновая кислота (+3,0±1); глутаминовая кислота (+3,0±1); серин (+0,3); аспарагин (+0,2); глутамин (+0,2); глицин (0); треонин (-0,4); пролин (-0,5±1); аланин (-0,5); гистидина (-0,5); цистеин (-1,0); метионин (-1,3); валин (-1,5); лейцин (-1,8); изолейцин (-1,8); тирозин (-2,3); фенилаланин (-2,5); триптофан (-3,4).
В случаях, где вариации предназначены для введения на основе значения гидрофильности, замену предпочтительно выполняют между аминокислотными остатками, имеющими разницу в значении гидрофильности не более чем ±2, более предпочтительно, в пределах ±1, намного более предпочтительно, в пределах ±0,5.
Изменение аминокислотных остатков без существенного ущерба для активности белка хорошо известны специалистам в данной области техники (H. Neurath, R.L. Hill, The Proteins, Academic Press, New York, 1979). Такое изменение аминокислоты включает замены Ala/Ser, Val/Ile, Asp/Glu, Thr/Ser, Ala/Gly, Ala/Thr, Ser/Asn, Ala/Val, Ser/Gly, Thr/Phe, Ala/Pro, Lys/Arg, Asp/Asn, Leu/Ile, Leu/Val, Ala/Glu и Asp/Gly, в качестве неограничивающих примеров ими.
Учитывая вышеупомянутые вариации, имеющие биологически эквивалентные активности, можно было бы понять, что либо антитело по настоящему изобретению, либо нуклеиновая кислота, кодирующая его, содержит в существенной степени идентичные последовательности с последовательностями, изложенными в прилагаемом списке последовательностей. «В значительной степени идентичные последовательности» относится к таким, которые показывают, предпочтительно, по меньшей мере, 61%, более предпочтительно, по меньшей мере, 70%, еще более предпочтительно, по меньшей мере, 80%, наиболее предпочтительно, по меньшей мере, 90% сходства нуклеотидных последовательностей с последовательностями из прилагаемого списка последовательностей, определяемого с помощью одного из традиционно используемых алгоритмов сравнения последовательностей. Способы выравнивания последовательностей для сравнения хорошо известны в данной области техники. Различные программы и алгоритмы выравнивания описаны в: Smith and Waterman, Adv. Appl. Math. 2:482(1981); Needleman and Wunsch, J. Mol. Bio. 48:443(1970); Pearson and Lipman, Methods in Mol. Biol. 24:307-31(1988); Higgins and Sharp, Gene 73:237-44(1988); Higgins and Sharp, CABIOS 5:151-3(1989); Corpet et al., Nuc. Acids Res. 16:10881-90(1988); Huang et al., Comp. Appl. BioSci. 8:155-65(1992); and Pearson et al., Meth. Mol. Biol. 24:307-31(1994). NCBI Basic Local Alignment Search Tool (BLAST) (Altschul et al., J. Mol. Biol. 215:403-10(1990)) можно получить из нескольких источников, включая Национальный центр биологической информации (NBCI, Bethesda, Мэриленд) и в Интернете, для использования в связи с программами для анализа последовательностей blastp, blasm, blastx, tblastn и tblastx. Ее можно получить по адресу http://www.ncbi.nlm.nih.gov/BLAST/. Описание того, как определить идентичность последовательности с помощью этой программы, доступно по адресу http://www.ncbi.nlm.nih.gov/BI-AST/blast help.html.
Антитело по настоящему изобретению включает, в качестве неограничивающих примеров, моноклональное антитело, поливалентное антитело, антитело человека, гуманизированное антитело, химерное антитело, одноцепочечные Fvs (scFV), одноцепочечное антитело, Fab-фрагмент, F(ab')-фрагмент, дисульфид-связанные Fvs (sdFV) и анти-антиидиотипическое (anti-Id) антитело и их эпитоп-связывающий фрагмент.
CDR-последовательности настоящих антител демонстрируют низкое сходство с CDR-последовательностями известных антител, указывая, что CDR-последовательности являются уникальными. Например, антитела, раскрытые в патентах США № 7329737 и 7993646, которые обладают наибольшим сходством с настоящим антителом в поиск BLAST (http://www.ncbi.nlm.nih.gov/BLAST/), показывают сходство менее 50% с CDR-последовательностью антитела 1E11, материнского антитела, и кроме того, связываются с hK-1, отличаясь от мишени настоящих антител.
Соответственно, аминокислотные последовательности настоящих антител могут быть признаны новыми и уникальными.
В другом аспекте настоящего изобретения предоставлена молекула нуклеиновой кислоты, кодирующая настоящее антитело или его антигенсвязывающий фрагмент.
Используемый в настоящем документе термин "молекула нуклеиновой кислоты" относится к молекуле ДНК (гДНК и кДНК) или РНК, и основные нуклеотиды молекулы нуклеиновой кислоты также включают аналоги с модифицированным сахаром или основанием, а также природные нуклеотиды (Scheit, Nucleotide Analogs, John Wiley, New York (1980); Uhlman and Peyman, Chemical Reviews, 90:543-584 (1990)). Последовательность настоящей молекулы нуклеиновой кислоты, кодирующей вариабельные области тяжелой и легкой цепи, может быть изменена. Такая модификация включает добавление, удаление или неконсервативную или консервативную замену нуклеотида.
В соответствии с вариантом осуществления молекула нуклеиновой кислоты, кодирующая вариабельную область тяжелой цепи, содержит нуклеотидную последовательность SEQ ID NO:7 или 23.
В соответствии с вариантом осуществления молекула нуклеиновой кислоты, кодирующая вариабельную область легкой цепи, содержит нуклеотидную последовательность SEQ ID NO:9, 25, 246, 248 или 250.
Молекула нуклеиновой кислоты, кодирующая настоящее HER2-антитело, также включает нуклеотидную последовательность, обладающую существенной гомологией с вышеуказанной нуклеотидной последовательностью. Существенная гомология означает нуклеотидную последовательность, обладающую гомологией, по меньшей мере, 80%, более предпочтительно, 90% и наиболее предпочтительно, 95% путем анализа выравнивания последовательностей с использованием максимального выравнивания между нуклеотидной последовательностью данного изобретения и другими случайными последовательностями и алгоритма, обычно известных специалистам в данной области техники.
Еще в одном аспекте данного изобретения предоставлен рекомбинантный вектор, включающий настоящую молекулу нуклеиновой кислоты, описанную выше.
Используемый в настоящем документе термин "вектор" представляет собой инструмент для экспрессии целевого гена в клетке-хозяине, в том числе плазмидный вектор; козмидный вектор; и вирусный вектор, такой как вектор на основе бактериофага, аденовирусный вектор, ретровирусный вектор и вектор на основе адено-ассоциированного вируса.
В соответствии с вариантом осуществления молекулы нуклеиновой кислоты, кодирующие вариабельные области легкой и тяжелой цепей, функционально связаны с промотором. Используемый в настоящем документе термин "функционально связанный" относится к функциональной связи между последовательностью нуклеиновой кислоты, контролирующей экспрессию (например, промотор, сигнальная последовательность или множество сайтов связывания транскрипционных факторов), и второй последовательностью нуклеиновой кислоты, отличающийся тем, что экспрессия контрольной последовательности влияет на транскрипцию и/или трансляцию нуклеиновой кислоты, соответствующей второй последовательности. Рекомбинантные векторы по настоящему изобретению можно конструировать различными способами, известными специалистам в данной области техники, и их практические способы описаны в Sambrook et al., Molecular Cloning, A Laboratory Manual, Cold Spring Harbor Laboratory Press (2001), который в данном документе включен посредством ссылки.
Как правило, вектор по этому изобретению может быть сконструирован как вектор для клонирования или экспрессии. Кроме того, вектор по данному изобретению может быть сконструирован с использованием прокариотической или эукариотической клетки в качестве клетки-хозяина.
Например, если вектор экспрессии конструируется для эукариотической клетки-хозяина, можно использовать промотор, полученный из генома клеток млекопитающих (например, промотор металлотионеина, промотор р-актина, промотор гемоглобина человека и промотором мышечного креатина человека) или вирусов млекопитающих (например, аденовирусный поздний промотор; промотор 7.5K вируса коровьей оспы, промотор SV40, промотор цитомегаловируса, tk-промотор вируса простого герпеса, промотор вируса опухоли молочной железы мыши (MMTV), LTR-промотор ВИЧ, промотор вируса молони, промотор вируса Эпштейна-Барра (EBV) и промотор вируса саркомы Рауса (RSV)). Вектор обычно содержит последовательность полиаденилирования в качестве терминатора транскрипции.
Вектор по настоящему изобретению может быть слит с другими последовательностями для очистки экспрессируемых антител. Например, последовательность для слияния включает глутатион-S-трансферазу (Pharmacia, США), мальтоза-связывающий белок (NEB, США), FLAG (IBI, США) и 6x His (гексагистидин; Quiagen, США) и так далее. Поскольку белок, экспрессируемый вектором по настоящему изобретению, представляет собой антитело, экспрессированное антитело может быть также очищать при помощи колонки с протеином А простым способом без дополнительных последовательностей для очистки.
Вектор экспрессии по настоящему изобретению включает ген устойчивости к антибиотикам, известный специалистам в рассматриваемой области в качестве селективного маркера, например, гены устойчивости к ампициллину, гентамицину, карбенициллину, левомицетину, стрептомицину, канамицину, генетицину, неомицину и тетрациклину.
В дополнительном аспекте настоящего изобретения предоставлена клетка-хозяин, трансформированная описанным выше рекомбинантным вектором.
Клетки хозяина, в которых настоящий вектор стабильно и успешно клонируется и экспрессируется, также используют любые, известные специалистам в данной области техники, например, подходящая эукариотическая клетка-хозяин, включая клетку COS7 (клетка почки обезьяны), клетка NSO, SP2/0, клетку CHO (яичник китайского хомяка), W138, клетку ВНК (почка детеныша хомяка), MDCK, миеломную клеточную линию, клетку HuT 78 и клетку HEK-293, но без ограничения этим.
В другом аспекте настоящего изобретения предоставлена фармацевтическая композиция для профилактики или лечения рака, содержащая: (а) фармацевтически эффективное количество настоящего антитела к HER2 или его антигенсвязывающего фрагмента; и (b) фармацевтически приемлемый носитель.
Поскольку настоящая фармацевтическая композиция содержит в HER2-антитело по настоящему изобретению или его антигенсвязывающий фрагмент в качестве активного ингредиента, общие для них описания опущены во избежание неоправданной избыточности, ведущей к сложности данной спецификации.
Как описано в примерах, HER2-антитело по настоящему изобретению в комбинации с трастузумабом убивает раковые клетки (в частности, клетки рака молочной железы, в частности, HER2-экспрессирующие клетки рака молочной железы) с существенно увеличенной цитотоксичностью и поэтому очень эффективно в терапии рака (особенно, рака молочной железы и рака желудка, в частности, HER2-экспрессирующий рак молочной железы и рак желудка). В соответствии с вариантом осуществления фармацевтическая композиция дополнительно содержит трастузумаб.
Злокачественная опухоль, предназначенная для профилактики или лечения настоящей композицией, включает различные виды злокачественных опухолей, известных любому специалисту в рассматриваемой области техники, например, рак молочной железы, рак яичника, рак желудка, рак легкого, рак печени, рак бронха, рак носоглотки, рак гортани, рак поджелудочной железы, рак мочевого пузыря, колоректальный рак, рак толстой кишки, рак шейки матки, рак мозга, рак предстательной железы, рак кости, рак головы и шеи, рак кожи, рак щитовидной железы, рак паращитовидной железы или рак мочеточника.
Конкретно, злокачественная опухоль, предназначенная для профилактики или лечения композицией, представляет собой HER2-экспрессирующую злокачественную опухоль, более конкретно, HER2-экспрессирующую злокачественную опухоль молочной железы или злокачественную опухоль желудка.
Еще в одном аспекте настоящего изобретения предоставляется фармацевтическая композиция для индуцирования апоптоза, содержащая: (а) фармацевтически эффективное количество настоящего антитела к HER2 или его антигенсвязывающего фрагмента; и (b) фармацевтически приемлемый носитель.
В соответствии с вариантом осуществления фармацевтическая композиция индуцирует апоптоз для профилактики или лечения гиперпролиферативного заболевания; при этом гиперпролиферативное заболевание представляет собой злокачественную опухоль, гиперплазию, келоидн, синдром Кушинга, первичный альдостеронизм, эритроплакию, истинную полицитемию, лейкоплакию, гиперпластический рубец, красный плоский лишай, лентигиноз, артериосклероз, атеросклероз, рестеноз или стеноз.
Фармацевтически приемлемым носитель может быть обычным для рецептуры, включая лактозу, декстрозу, сахарозу, сорбит, маннит, крахмал, пахотный каучук, фосфат калия, аргинат, желатин, силикат калия, микрокристаллическую целлюлозу, поливинилпирролидон, целлюлозу, воду, сиропы, метилцеллюлозу, метилгидроксибензоат, пропилгидроксибензоат, тальк, стеарат магния и минеральные масла, но не ограничивается этим. Фармацевтическая композиция в соответствии с настоящим изобретением может дополнительно включать смазывающее средство, увлажнитель, подслащивающее средство, вкусовое средство, эмульгатор, суспендирующее средство и консервант. Подробности фармацевтически приемлемых носителей и составов можно найти в Remington's Pharmaceutical Sciences (19th ed., 1995), который включен в настоящий документ посредством ссылки.
Фармацевтическую композицию в соответствии с настоящим изобретением можно вводить парентерально, например, путем внутривенного, подкожного, внутримышечного, внутрибрюшинного, местного, назального, легочного или ректального введения.
Подходящая доза фармацевтической композиции по настоящему изобретению может варьировать в зависимости от способов фармацевтического состава, способов введения, возраста пациента, массы тела, пола, тяжести заболевания, диеты, времени введения, способа введения, скорости экскреции и чувствительность к фармацевтической композиции. Предпочтительно, фармацевтическую композицию по настоящему изобретению вводят при суточной дозе 0,0001-100 мг/кг (массы тела). Термин "фармацевтически эффективное количество" относится к количеству, пригодному для профилактики или лечения рака.
В соответствии с общепринятыми методиками, известными специалистам в данной области техники, фармацевтическая композиция может быть составлена с фармацевтически приемлемым носителем и/или наполнителем, с предоставлением в конце нескольких форм, включая порционную форму и многодозовую форму. Состав может представлять собой масляную или водную среду, ресуспензию или эмульсию, экстракт, порошок, суппозиторий, гранулу, таблетку или капсулы и дополнительно содержать диспергатор или стабилизатор.
Антитело по настоящему изобретению можно использовать для диагностики с HER2-экспрессирующих сопутствующих расстройств, заболеваний или состояний.
В дополнительном аспекте настоящего изобретения предоставляется набор для диагностики связанных с HER2-экспрессией расстройств, заболеваний или состояний, включающий настоящее антитело к HER2 или его антигенсвязывающий фрагмент.
Связанное с HER2-экспрессией расстройство, заболевание или состояние представляет собой, в частности, злокачественную опухоль, например, рак молочной железы, рак яичников, рак желудка, рак легких, рак печени, рак бронха, рак носоглотки, рак гортани, рак поджелудочной железы, рак мочевого пузыря, колоректальный рак, рак толстой кишки, рак шейки матки, рак мозга, рак предстательной железы, рак кости, рак головы и шеи, рак кожи, рак щитовидной железы, рак паращитовидной железы или рак мочеточника. В частности, диагностический набор по настоящему изобретению используется для диагностики HER2-экспрессирующей злокачественной опухоли, более конкретно, HER2-экспрессирующей злокачественной опухоли молочной железы или злокачественной опухоли желудка.
Антитело по настоящему изобретению можно использовать для анализа реакции на лекарственное средство настоящего антитела в организме пациента.
В другом аспекте настоящего изобретения предоставлен набор для анализа реакции на лекарственное средство, содержащий настоящее антитело.
Набор для анализа по настоящему изобретению используется для оценки отзывчивости организма пациента на настоящее антитело. Например, если раковые клетки, полученные от пациента, инкубируют с антителом по данному изобретению, и выясняется, что антитело связывается с клетками, пациент определяется как имеющий лекарственную отзывчивость на настоящее антитело.
Поскольку настоящий набор содержит антитела, они могут быть изготовлены для иммунологического анализа или иммуноокрашивания. Формат иммунологического анализа или иммуноокрашивания включает, в качестве неограничивающих примеров, радиоиммунологический анализ, радиоиммунопреципитацию, иммуноферментный анализ (ELISA), захват-ELISA, анализ ингибирования или конкуренции, сэндвич-анализ, проточную цитометрию, иммунофлюоресцентное окрашивание и иммуноафинную очистку, но не ограничивается этим. Процедуры иммунологического анализа или иммуноокрашивания можно найти в Enzyme Immunoassay, E. T. Maggio, ed., CRC Press, Boca Raton, Florida, 1980; Gaastra, W., Enzvme-linked immunosorbent assay (ELISA), in Methods in Molecular Biology, Vol.1, Walker, J.M. ed., Humana Press, NJ, 1984; и Ed Harlow and David Lane, Using Antibodies, A Laboratory Manual, Cold Spring Harbor 15 Laboratory Press, 1999, включенные в настоящий документ путем ссылки.
Например, в соответствии с радиоиммунологическим способом, меченое радиоизотопом (например, С14, I125, P32 и S35) антитело может быть использовано для определения HER2 на поверхности раковых клеток. В соответствии со способом ELISA, конкретный пример настоящего способа может включать стадии: (I) покрытие поверхности твердой подложки биообразцом для анализа; и (II) инкубация биообразца с HER2-антителом по данному изобретению в качестве первичного антитела; (III) инкубация получаемой в результате стадии (II) с вторичным антителом, конъюгированным ферментом; и (IV) определение активности фермента.
Твердые подложки могут представлять собой углеводородные полимеры (например, полистирол и полипропилен), стекло, металлы или гели. Наиболее предпочтительно, чтобы твердый субстрат представлял собой микротитрационный планшет.
Фермент, конъюгированный с вторичным антителом, включает фермент, катализирующий колориметрические, флуоресцентные, люминесцентные или инфракрасные реакции, например, щелочная фосфатаза, β-галактозидаза, пероксидаза хрена, люцифераза и цитохром P450. При использовании щелочной фосфатазы, бромхлориндолилфосфат (BCIP) и нитросиний тетразолий (NBT), нафтол-AS-B1-фосфат и ECF (усиленная хемифлуоресценция) могут быть использованы в качестве субстрата; в случае использования пероксидазы хрена, хлорнафтол, аминоэтилкарбазол, диаминобензидин, D-люциферин, люцигенин (бис-N-метилакридиниумнитрат), бензиловый эфир резоруфина, люминол, реагента Amplex красный (10-ацетил-3,7-дигидроксифеноксазин, Pierce), HYR (р-фенилендиамин-HCl и пирокатехин), TMB (3,3,5,5-тетраметилбензидин), ABTS (2,2-азин-ди[3-этилбензтиазолинсульфонат]), o-фенилендиамин (OPD) и нафтол/пиронин, глюкозооксидаза и t-NBT (нитросиний тетразолий) и m-PMS (фензаинметосульфат) могут быть использованы в качестве субстрата.
В соответствии со способом захват-ELISA, конкретный пример настоящего способа может включать стадии: (а) покрытие поверхности твердой подложки HER2-антителом в качестве захватывающего антитела; (II) инкубация захватывающего антитела с биообразцом для анализа; (III) инкубация полученного в результате на стадии (II) с HER2-антителом, конъюгированным с меткой, генерирующей детектируемый сигнал, в качестве детектирующего антитела; и (IV) определение сигнала, получаемого от метки.
Детектирующее антитело имеет метку, генерирующую детектируемый сигнал. Метка включает, в качестве неограничивающих примеров, химическую (например, биотин), ферментную (например, щелочная фосфатаза, β-галактозидаза, пероксидаза хрена и цитохром Р450), радиоактивную (например, С14, I125, P32 и S35), флуоресцентную (например, флуоресцеин), люминесцентную, хемилюминесцентную и FRET (флуоресцентный резонансный перенос энергии) метку. Различные метки и способы маркировки антител можно найти в Ed Harlow and 10 David Lane, Using Antibodies, A Laboratory Manual, Cold Spring Harbor Laboratory Press, 1999.
Измерение ферментативной активности или сигнала в ELISA и захват-ELISA может осуществляться при помощи различные процессы, хорошо известны в данной области техники. При использовании биотина в качестве метки, детекцию можно выполнять с использованием стрептавидина. При использовании люциферазы составляет детекцию можно выполнять с использованием люциферина.
Биообразец, применимый к настоящему набору, включает, в качестве неограничивающих примеров, клетки, ткани, экстракты, полученные из тканей, лизат или очищенный продукт, кровь, плазму, сыворотку, лимфу и асцитическую жидкость.
Антитело по настоящему изобретению можно использовать для визуализации in vivo или in vitro. В другом аспекте настоящего изобретения, предоставлена композиция для визуализации, содержащая антитело по настоящему изобретению и сигнал-генерирующая метка, конъюгированная с антителом.
Сигнал-генерирующая метка включает, в качестве неограничивающих примеров, контрастное вещество Т1 (например, хелатное соединение Gd), контрастное вещество Т2 (например, суперпарамагнитные материалы (например, магнетит, Fe304, γ-Fe203, марганцевый феррит, феррит кобальта и феррит никеля)), радиоизотоп (например, 11C, 15О, 13N, P32, S35, 44Sc, 45Ti, 118I, 136La, I98T1, 200T1, 205Bi и 206Bi), флуоресцентные материалы (например, флуоресцеин, фикоэритрин, родамин, лиссамин, Cy3 и Су5), хемилюминесцентный материалы, магнитные частицы, массовые метки и электронно-плотные частицы.
Хотя антитело настоящему изобретению само по себе полезно в терапии рака, оно может быть представлено в виде ADC (конъюгата антитела и препарата) путем конъюгирования с другим препаратом, потому что антитела способно нацеливаться на HER2-экспрессирующие клетки.
Таким образом, в другом аспекте настоящего изобретения, предоставлен ADC (конъюгат антитела и препарата), содержащий антитело по настоящему изобретению и препарат, конъюгированный с антителом.
Препарат, конъюгированный с антителом, включает, в качестве неограничивающих примеров, химические вещества, радионуклиды, иммуннотерапевтические средства, цитокины, хемокины, токсины, биологические средства и ингибиторы ферментов, специфические противоопухолевые препараты, как следует: ацивицин, акларубицин, акодазол, акронин, адозелезин, аланозин, алдеслейкин, аллопуринол натрия, алтретамин, аминоглютетимид, амонафид, амплиген, амсакрин, андрогены, ангуидин, афидиколин глицинат, асалей, аспарагиназа, 5-азацитидин, азатиоприн, бацилла Кальметта-Герена (БЦЖ), антифол Бейкера, бета-2'-дезокситиогуанозин, бисантрен HCl, блеомицинсульфат, бусульфан, бутионинсульфоксимин, BWA773U82, BW 502U83/HCl, BW 7U85 мезилат, церацемид, карбетимер, карбоплатин, кармустин, хлорамбуцил, хлорхиноксалинсульфонамид, хлорозотоцин, хромомицин А3, цисплатин, кладрибин, кортикостероиды, Corynebacterium parvum, СРТ-11, криснатол, циклоцитидин, циклофосфамид, цитарабин, цитембена, дабис малеат, дакарбазин, дактиномицин, даунорубицин HCl, диазауридин, дексразоксан, диангидрогалактион, диазиквон, дибромодулцитол, дидемнин В, диэтилдитиокарбамат, дигликоальдегид, дигидро-5-азацитидин, доксорубицин, эхиномицин, дедатрексат, эделфосин, эфлорнитин, раствор Эллиота, элсамитруцин, эпирубицин, эсорубицин, эстрамустинфосфат, эстрогены, этанидазол, этиофос, этопозид, фадразол, фазарабин, фенретинид, филграстим, финастерид, флавон уксусной кислоты, флоксуридин, флударабинфосфат, 5-фторурацил, Флуозол™, флутамид, галлия нитрат, гемцитабин, гозерелинацетат, гепсульфам, гексаметилендиизоцианат бисацетамид, гомохаррингтонин, гидразин сульфат, 4-гидроксиандростенедион, гидрозимочевина, идарубицин HCl, ифосфамид, 4-ипомеанол, ипроплатин, изотретиноин, лейковорин кальция, ацетат лейпролида, левамизол, липосомальный даунорубицин, липосомный инкапсулированный доксорубицин, ломустин, лонидамин, майтанзин, гидрохлорид мехлорэтамин, мелфалан, меногарил, мербарон, 6-меркаптопурин, месна, извлеченный метанолом остаток бациллы Кальметта-Герена, метотрексат, N-метилформамид, мифепристон, митогуазон, митомицин-C, митотан, митоксантрона гидрохлорид, моноцитарно/макрофагальный колониестимулирующий фактор, набилон, нафоксидин, неокарзиностатин, октреотида ацетат, ормаплатин, оксалиплатин, паклитаксел, пала, пентостатин, пиперазиндион, пипоброман, пирарубицин, пиритрексим, пироксантрон гидрохлорид, PIXY-321, пликамицин, порфимер натрия, преднимустин, прокарбазин, прогестины, пиразофурин, разоксан, сарграмостим, семустин, спирогерманиум, спиромустин, стрептонигрин, стрептозоцин, сулофенур, сурамин натрия, тамоксифен, таксотер, тегафур, тенипозид, терефталамидин, тероксирон, тиогуанин, тиотэф, инъекция тимидина, тиазофурин, топотекан, торемифен, третиноин, трифлуоперазин гидрохлорид, трифлуридин, триметрексат, TNF (фактор некроза опухоли), урацилиприт, винбластина сульфат, винкристина сульфат, виндезин, винорелбин, винзолидин, Йоши 864, зорубицин, цитозин арабинозид, этопозид, мелфалан, таксотер и таксол.
Следствия этого изобретения
Особенности и преимущества настоящего изобретения обобщены, как следует:
(a) Антитело по изобретению связывается специфически с HER2, сверхэкспрессированным в раковых клетках (в частности, клетки рака молочной железы и желудка), специфически с эпитопом на HER2, отличающимся от эпитопа для трастузумаба.
(b) CDC-последовательности настоящих антител проявляют низкое сходство с CDC-последовательностями известных HER2-антител, указывая, что CDC-последовательности являются уникальными.
(с) Антитела по настоящему изобретению в комбинации с трастузумабом убивают раковые клетки с существенно увеличенной цитотоксичностью и поэтому очень эффективна в терапии рака (особенно, рака молочной железы и рака желудка).
(d) Не желая быть связанными теорией, улучшение эффективности в комбинированной терапии свидетельствовало бы, что антитела по настоящему изобретению связываются с эпитопом на HER2, отличным от эпитопа для трастузумаба, и ингибируют HER2 совместно с трастузумабом.
(е) Антитела по настоящему изобретению, способные индуцировать апоптоз, можно применять для профилактики или лечения гиперпролиферативных заболеваний.
(f) Настоящее изобретение также может быть полезно для диагностики рака, анализа реакции на лекарственный препарат, визуализации и ADC (конъюгат антитела с препаратом), а также для терапии рака.
Краткое описание чертежей
Фиг. 1 показывает генетические карты вектора pcDNA3.3-IgG Heavy и вектора pOptiVEC-IgG Kappa.
Фигуры 2А и 2B представляют собой графики, соответственно показывающие ингибирующее пролиферацию действие однократной обработки антителом 1E11 и комбинированной терапии антитела 1E11 и трастузумаба в отношении злокачественной клеточной линии NCI-N87 и злокачественной клеточной линии ВТ-474. TRA, PER и hIgG, соответственно, указывают трастузумаб, пертузумаб и IgG человека (отрицательный контроль).
Фигуры 3А и 3B показывают, что антитело 1E11 связывается с доменом суб-домена HER2, который отличается от домена связывания трастузумаба. Фигуры 3А и 3В, соответственно, показывают результаты SPR-анализа и ELISA-анализа.
Фиг. 4А показывает результат ELISA-анализа по проверке того, связывается ли антитело 1E11 специфически с HER2 среди белков ErbB-семейства, к которому относится HER2. Цетуксимаб (СЕТ) был использован в качестве контрольного антитела против белка EGFR.
Фиг. 4В показывает результат ELISA-анализа по проверке того, связывается ли антитело 1E11 специфически с HER2, отличным от HER2 человека.
Фиг. 5А показывает результат анализа процента раковых клеток, в которых произошел апоптоз, после обработки клеток NCI-N87 антителом 1E11 или трастузумабом отдельно или в комбинации.
Фиг. 5В показывает результат анализа процента раковых клеток, в которых произошел апоптоз, после обработки клеток ВТ-474 антителом 1E11 или трастузумабом отдельно или в комбинации.
Фиг. 5С показывает результат анализов жизнеспособности клеток за 24 часа и 48 часов после обработки клеток NCI-N87 антителом 1E11 или трастузумабом отдельно или в комбинации. Контрольная группа показывает жизнеспособность клеток, обработанных только PBS, сольвентом для антител.
Фиг. 5D показывает результат анализа активности каспазы-3/7 через 24 часа после обработки клеток NCI-N87 антителом 1E11 или трастузумабом отдельно или в их комбинации. Контрольная группа показывает жизнеспособность клеток, обработанных только PBS, сольвентом для антител.
Фиг. 6А показывает результат вестерн-блот-анализа, иллюстрирующий снижение в HER2 понижающей сигнализации путем обработки антителом 1E11 или трастузумабом отдельно или в их комбинации.
Фиг. 6В представляет собой график, показывающий ингибирующее действие на гетеродимеризация-индуцированную клеточную пролиферацию путем обработки антителом 1E11 или трастузумабом отдельно или в их комбинации. Отрицательный контроль (Negative Ctrl) показывает жизнеспособность клеток, не обработанных ни лигандами, ни антителами, и положительный контроль (Positive Ctrl) показывает жизнеспособность клеток, обработанных только лигандами без обработки антителами.
Фиг. 7А через 7С показывает ингибирующее действие на рост опухолевых клеток в животной модели ксенотрансплантата NCI-N87 при лечении антителом 1E11 или трастузумабом отдельно или в их комбинации. Фиг. 7А показывает график, иллюстрирующий изменения объема опухоли. Фиг. 7В показывает график, иллюстрирующий изменение массы опухоли, а фиг. 7С показывает изображение, иллюстрирующее результат окрашивания опухолевых тканей. Контрольное антитело представляет собой паливизумаб.
Фиг. 8А и 8В представляют собой графики, показывающие соответственно ингибирующее действие на пролиферацию злокачественной линии клеток NCI-N87 и злокачественной линии клеток ОЕ-19 при однократной обработке антителом hz1E11, которое является гуманизированным антителом, и комбинированной обработке антителом hz1E11 и трастузумабом.
Фиг. 9 показывает ингибирующее действие на рост опухолевых клеток в животной модели ксенотрансплантата NCI-N87 при лечении антителом hz1E11 или трастузумабом отдельно или в их комбинации. Контрольное антитело представляет собой паливизумаб.
Фиг. 10A и 10В соответственно показывают результаты сканирования аланина CDRH3 и CDRL3 антитела hz1E11.
Фигуры с 11А по 11F представляют собой графики, показывающие ингибирующее действие на пролиферацию злокачественных линий клеток NCI-N87, ОЕ-19 и BT-474 при однократной обработке антителами hz1E11-3, hz1E11-133 и hz1E11-154, которые являются гуманизированными антителами с улучшенной афинностью, и комбинированной обработке этого с трастузумабом.
Настоящее изобретение теперь будет описано более подробно на примерах. Для специалистов в рассматриваемой области техники должно быть очевидным, что эти примеры предназначены для того, чтобы более конкретно иллюстрировать, а не для ограничения объема настоящего изобретения, как изложено в прилагаемых пунктах Формулы изобретения, или примерами.
ПРИМЕРЫ
ПРИМЕР 1
Разработка HER2-антител
Для подготовки антител, внеклеточный домен (ECD) белка HER2 получали с использованием животных клеток, и затем использовали его в качестве антигена. ДНК, в которой шарнирная область IgG1 человека и Fc-часть (СН2-СН3) были связаны с С-концом ECD, клонировали с помощью рестрикционных ферментом HindIII и BamHI. Затем, клонированный вектор транзиентно трансфицировали в клетку FreeStyleTM 293F (Invitrogen, кат. № R790-07) с использованием полиэтиленимина (Polyscience Inc., кат. № 23966), и гибридный белок HER2-ECD Fc очищали из культуры клеток с помощью смолы Protein-A Ceramic HyperD F (PALL, кат. № 20078-028). Очищенный белок количественно оценивали с помощью Protein assay dye (Bio-Rad, кат. № 500-0006), разгоняли в SDS-PAGE, и его концентрацию и чистоту подтверждали с помощью окрашивания Кумасси. 100 пг очищенного белкового антигена смешивали с адъювантом Фрейнда (Sigma, кат. № F5506), и затем вводили внутрибрюшинно в мышей BALB/с (DBL Co., Ltd., Корея). Через две недели, 100 пг антигена разводили в PBS и снова вводили, и через три дня после этого, извлекали селезенку мышей и оттуда выделяли лимфоциты. Выделенные лимфоциты смешивали с миеломной клеточной линией SP2/0-Agl4 (ATCC, кат. № CRL-1581) в соотношении 5:1, и сливали с использованием ПЭГ-1500 (Roche, кат. № 783641). Слитые клетки культивировали в среде, содержащей добавку HAT (Sigma, кат. № H0262), и слитые клетки (гибридомные) выборочно перебирали и культивировали.
Полученные таким образом гибридомные клетки проверяли с помощью ELISA-анализа, чтобы определить, являются ли они клетками, продуцирующими антитела, которые связываются с антигенами. HER2-ECD-Fc или ChromPure IgG человека (hIgG, Jackson Immunoresearch Lab. Inc., кат. № 009-000-003) иммобилизовали при комнатной температуре в 96-луночном планшете Costar (Corning, кат. № 3590) при концентрации 1 пг/мл в течение 1 часа. Полученное в результате промывали 3 раза в TBS-T (0,05% Тритон Х-100) и затем блокировали при комнатной температуре в 300 мкл TBS-T/SM (2% обезжиренное молоко) в течение 30 минут. Блокированный планшет промывали 3 раза и добавляли гибридомный культуральный бульон, и давали возможность антителам связаться при 37°C в течение 1 часа. После промывки полученного 3 раза, анти-мышиный IgG-HRP (Pierce, кат. № 31439) в качестве вторичного антитела разводили в TBS-Т/SM в соотношении 1:5000 и давали возможность связываться с этим при 37°C в течение 1 часа. После промывки полученного 3 раза, TMB (SurModics, кат. № TMBC-1000-01) добавляли к этому и давали возможность проявиться цвету при комнатной температуре в течение 5 минут и добавляли 1н серную кислоту (DukSan, кат. № 254), чтобы остановить развитие цвета. Абсорбцию измеряли при 450 нм при помощи Victor X3 (PerkinElmer, кат. № 2030-0030), и отобрали антитела, которые специфически связывались с HER2-ECD-Fc.
Поскольку HER2 представляет собой белок, экспрессируемый на поверхности клетки, было исследовано, связываются ли разработанные антитела с HER2-сверхэкспрессирующими клетками, с помощью клеточных тест ELISA. HER2-сверхэкспрессирующую линию клеток рака яичника, SKOV-3 (Korean Cell Line Bank (KCLB), кат. № 30077) раскапывали в 96-луночные планшеты для культивирования клеток Costar (Corning, кат. № 3595) в концентрации 10000 клеток/лунку и культивировали в течение 24 часов. На следующий день, после удаления надосадочной жидкости культуры клеток, полученный осадок промывали в PBS 3 раза, добавляли гибридомный культуральный бульон, и культивировали далее при 37°C в течение 2 часов. После промывки полученного 3 раза в ТБС-Т, к этому добавляли козьи антимышиные IgG-HRP в качестве вторичного антитела, разведенные в PBS/FBS (3% FBS) в соотношении 1:5000, и обрабатывали при комнатной температуре в течение 1 часа. После промывки полученного 3 раза в ТБС-Т, была предоставлена возможность проявиться цвету с использованием TMB. Был отобран 61 клон, показывающий оптическую плотность выше, чем культура клеток SP2/0 в качестве отрицательного контроля.
ПРИМЕР 2
Сравнение ингибирующих воздействий разработанных антител в отношении роста клеток рака молочной железы
В целях выполнения теста на жизнеспособность клеток для подтверждения ингибирующего действия в отношении пролиферации клеток рака молочной железы, антитела из гибридомного культурального бульона очищали. Гибридому культивировали в культуральной среде, содержащей 3% ЭТС, и антитела в виде IgG очищали с помощью протеин А-смолы. Очищенные антитела количественно оценивали при помощи BCA assay (Pierce, кат. № 23227), разгоняли в SDS-PAGE, и их концентрация и чистота были подтверждены с помощью окрашивания Кумасси.
Анализ жизнеспособности клеток проводили с помощью одинарного лечения или комбинированного лечения вместе с трастузумабом в отношении ВТ-474, репрезентативной клеточной линии рака молочной железы, и клеточной линии NCI-N87, репрезентативной клеточной линии рака желудка, где HER2 сверхэкспрессируется. Для комбинированного лечения, была использована смесь разработанных антител и трастузумаба, смешанных в соотношении 1:1 (массовое соотношение). В 96-луночный планшет раскапывали клетки BT-474 (ATCC, кат. № НТВ-20, 10000 клеток/лунку) и NCI-N87 (ATCC, кат. № CRL-5822, 10 000 клеток/лунку) и культивировали в течение 24 часов. Очищенные антитела были соответственно обработаны, чтобы иметь концентрацию 5 мкг/мл, и клеточные линии BT-474 и NCI-N87 культивировали далее в течение 4 дней. Для анализа жизнеспособности клеток, CCK-8 (Dojindo, кат. № CK-04-13) добавляли в конечной концентрации 10%, обрабатывали при 37°C в течение 3 часов, и определяли их плотности. Относительную жизнеспособность рассчитывали относительно оптической плотности лунки, не обработанной антителом, который был принят за 100% уровень жизнеспособности. На основании вышеизложенного, было выбрано антитело 1E11.
ПРИМЕР 3
Анализ последовательности антитела
Для проведения анализа последовательности антител была сконструирована фаговая библиотека Fab-антител с помощью соответствующей гибридомной РНК, и трехступенчатый пэннинг проводили для получения фага, который связывается с HER2-ECD-Fc (Phage display: a laboratory manual, Carlos Barbas III, et al., Cold Spring Harbor Laboratory Press). После культивирования гибридомы, РНК выделяли с использованием SV Total RNA Isolation System (Promega, кат. № Z3100), и кДНК синтезировали с нее. Используя известный набор праймеров (см. Phage display: a laboratory manual, Carlos Barbas III, et al., Cold Spring Harbor Laboratory Press), вариабельную область антитела амплифицировали, клонировали в вектор pComb3X (Barbas laboratory, The Scripps Research Institute), используя рестриктазу SfiI, после лигирования с Ck and CHI человека, а затем трансформировали в бактерию ER2537 (New England Biolabs, кат. № 801-N). Трансформированные бактерии были трансфицированы фагом-помощником VCSM13 (Stratagene, кат. № 200251) для получения фага, и клон, который связывается с HER2-ECD-Fc, был получен с использованием иммунопробирки, в которой HER2-ECD-Fc был иммобилизован.
Среди колоний для каждого из антител, антитела, которые связываются с HER2-ECD-Fc, были подтверждены с помощью ELISA-анализа. Колонии трансформированных бактерий культивировали при 37°С до оптической плотности 0,5 при 600 нм, и обрабатывали ИПТГ в конечной концентрации 1 мМ, давали возможность и экспрессировали антитела в виде Fab во время культивирования в течение ночи при 30°С. После культивирования 5 мл, клетки собирали центрифугированием, суспендировали в 0,4 мл 1X TES (50 мМ Трис, 1 мМ ЭДТА, 20% (об./об.) сахарозы, рН 8,0), и выдерживали при 4°C в течение 10 минут. После добавления 0,6 мл 0,2 × TES к этому, полученное в результате обрабатывали при 4°C в течение 30 минут, центрифугировали и отбирали надосадочную жидкость. После промывки 96-луночного планшета с уменьшенным объемом лунки от Costar (Corning Inc., кат. № 3690), которые были покрыты HER2-ECD-Fc в концентрации 1 пг/мл, 3 раза в TBS-T, блокировали с TBS-T/SM (3% обезжиренное сухое обезжиренное молоко, 0,05% Тритон Х-100) при комнатной температуре в течение 1 часа. Культуральный бульон или периплазматический экстракт (периплазма) для каждой колонии обрабатывали путем разбавления его в соотношении 1:3 с использованием TBS-T/SM, и давали возможность связываться при комнатной температуре в течение 1 часа. После промывки 3 раза, анти-HA-HRP (Roche, кат. № 120-138-190-01) в качестве вторичного антитела разводили в соотношении 1:5000, давали возможность связываться при комнатной температуре в течение 1 часа, промывали 3 раза, и давали возможность проявиться цвету, используя TMB.
Большинство колоний в бульоне культуры клеток или периплазматическом экстракте имели оптическую плотность 0,2 или выше, и последовательности антител анализировали в отношении этих клонов. Анализ последовательности выявил, что колонии, полученные от одной гибридомы, как было показано, имеют одну и ту же последовательность. Аминокислотные последовательности определяющей комплементарность области (CDR) антитела 1E11 обобщены в таблице 1 ниже.
Аминокислотные последовательности определяющей комплементарность области (CDR) антитела 1E11
Пример 4
Конструирование и продуцирование химерных антител
Химерные антитела конструировали, чтобы подготовить антитела по настоящему изобретению в форме, более поддающейся воздействию лекарственных средств.
Вариабельную область мышиных антител, для которых анализ нуклеотидной последовательности был завершен, амплифицировали и присоединяли к константным областям Сκ и СН человека, и часть тяжелой цепи ТА-клонировали при помощи вектора pcDNA3.3-TOPO (Invitrogen, кат. № K8300-01), в то время как часть легкой цепи ТА-клонировали при помощи вектора pOptiVEC-TOPO (Invitrogen, кат. № 12744-017). Праймеры, использованные для амплификации, приведены в таблицах 2 и 3 ниже. Прямые праймеры встраивали c сайтом рестрикции ClaI, а обратные праймеры добавляли c сайтом рестрикции NheI для тяжелой цепи и с сайтом рестрикции BsiWI для легкой цепи, соответственно. Кроме того, прямые праймеры в вариабельной области добавляли с сигнальной последовательностью так, чтобы химерные антитела могли секретироваться в бульон культуры клеток. Нуклеотидные последовательности и аминокислотные последовательности Сκ и СН, используемые в настоящем изобретении, описаны в SEQ ID NO:11-14.
Реакцию ПЦР (30 сек при 95°С; 30 сек при 58°С, 30 сек при 72°С) повторно выполняли за 35 циклов, используя праймеры и ДНК-полимеразу GoTaq (Promega, кат. № M3005), описанные выше. Каждый из амплифицированных ПЦР-продуктов вариабельных областей и константных областей после разгона в 1% агарозном геле, очищали с помощью набора для гель-экстракции Qiaquick (QIAGEN, кат. № 20 28706). Для соединения вариабельных областей и константных областей, ПЦР-продукты вариабельных областей и константных областей смешивали в равном количестве, и ПЦР с перекрывающимися праймерами проводили с использованием прямых праймеров для вариабельных областей и обратных праймеров для константных областей для получения генных продуктов, и продукты очищали таким же образом, как описано выше. ПЦР с перекрывающимися праймерами (30 сек при 95°С; 30 сек при 58°С, 45 сек при 72°C) повторно выполняли за 35 циклов, используя праймеры и ДНК-полимеразу GoTaq (Promega, кат. № M3005). Амплифицированные генные продукты ТА-клонировали в вектор pcDNA3.3-TOPO (Invitrogen, кат. # K8300-01) для части тяжелой цепи, и ТА-клонировали в вектор pOptiVEC-TOPO (Invitrogen, кат. № 12744-017) для части легкой цепи, в соответствии с инструкцией производителя.
Праймеры для амплификации вариабельных областей
GCTCTGGGTTCCAGGTTCCACGTGGGATATTCAGATG
GCTCTGGGTTCCAGGTTCCACGTGGGAGGTGAAGCT
Праймеры для амплификации константных областей
В приведенных выше таблицах, жирным шрифтом указаны сайты рестрикции для рестрикционных ферментов, тогда как сплошной линией подчеркнуты сигнальные последовательности.
Карты окончательно сконструированных вектора pcDNA3.3-IgG Heavy и вектора pOptiVEC-IgG Kappa проиллюстрированы на фиг.1.
Затем, клонированные векторы транзиентно трансфицировали в животные клетки FreeStyleTM 293F (Invitrogen, кат. № R790-07) с использованием полиэтиленимина (Polyscience Inc., кат. № 23966), и химерные антитела очищали из бульона культуры клеток с использованием смолы Protein-A Ceramic HyperD F (PALL, кат. № 20078-028). Очищенные химерные антитела количественно определяли при помощи BCA (Pierce, кат. № 23227), разгоняли в SDS-PAGE, и их концентрацию и чистоту подтверждали с помощью окрашивания Кумасси.
ПРИМЕР 5
Сравнение ингибирующего воздействия разработанных антител в отношении роста злокачественной опухоли молочной железы и злокачественной опухоли желудка
В целях подтверждения противоопухолевого воздействия разработанных антител в соответствии с их концентрацией, проводили тест на жизнеспособность клеток в отношении раковых клеточные линий, сверхэкспрессирующих HER2, таких как BT-474 (клеточная линия рака молочной железы) и NCI-N87 (клеточная линия рака желудка). ВТ-474 (10000 клеток/лунку) и NCI-N87 (10000 клеток/лунку) в объеме 70 мкл раскапывали в 96-луночный планшет, и иммобилизовали этим при культивировании в течение 24 часов. На следующий день, 30 мкл антител добавляли к культивируемым клеткам. Конечная концентрация антител для обработки составляла максимум 20 пг/мл для каждого антитела и последовательно разводили в соотношении 1:4, и анализ проводили в 5 различных концентрациях. При обработке в комбинации с трастузумабом, соотношение между разработанным антителом и трастузумабом устанавливали как соотношение 1:1 (например, на фиг. 2A и 2B, когда количество введения составляло 1 пг/мл, вводили 1 пг/мл TRA и 1 пг/мл 1E11). После обработки антителами, клетки BT-474 и NCI-N87 культивировали в течение 4 дополнительных дней, добавляли ССК-8 до конечной концентрации 10% и обрабатывали при температуре 37°C в течение 3 часов. Затем, для обработанных клеток определяли оптическую плотность при 450 нм, используя Victor X-3. Оптическую плотность клеток, не обработанных с помощью антител, принимали за 100%, и рассчитывали их относительную жизнеспособность (фиг. 2А и 2В).
Разработанное антитело 1El1 показали ингибирующее действие в отношении пролиферации клеточных линий NCI-N87 (фиг. 2А) и BT-474 (фиг. 2В), которые были отзывчивы на трастузумаб. Кроме того, комбинированная обработка антителом 1E11 и трастузумабом показало более высокую ингибирующую активностью в отношении раковых клеток, чем при лечении только трастузумабом в отношении пролиферации клеточных линий NCI-N87 и BT-474. Интересно, что комбинированная обработка антителом 1E11 и трастузумабом показало более высокую ингибирующую активность в отношении раковых клеток, чем комбинированная обработка трастузумабом и пертузумабом в отношении клеточной линии NCI-N87 (фиг. 2А).
ПРИМЕР 6
Подтверждение синергетического эффекта разработанных антител при обработке в комбинации с трастузумабом
Для того, чтобы убедиться в том, являлся ли противоопухолевый эффект комбинированной обработки разработанным антителом 1E11 и трастузумабом в отношении рака желудка синергетическим эффектом, клетки NCI-N87 обрабатывали антителом 1E11 или трастузумабом по отдельности или их комбинации, противоопухолевые эффекты были проанализированы (фиг. 2А). Противоопухолевый эффект в зависимости от концентрации анализировали при помощи программы CalcuSyn (Biosoft), используя способ Чоу и Талалая (Chou et al., Adv. Enzyme. Regul. 22:27-55(1984)), которая анализирует влияние комбинированного введения, по меньшей мере, двух препаратов (таблица 4). Когда два препарата вводят в комбинации, они становятся либо агонистическими, аддитивными или синергическими. Взаимное воздействие лекарственных веществ можно проанализировать с помощью способа Чу & Талалая в плане комбинационного индекса (CI). Значение CI, равное 1 или выше указывает на агонистический эффект, в то время как значение CI, равное 1, и 1 или меньше указывают на аддитивный эффект, и синергетический эффект, соответственно.
В приведенной выше таблице, ЭД50, ED75 и ED90 указывает на эффективные дозы, которые демонстрируют эффекты в 50%, 75% и 90% популяций, соответственно. "r" обозначает линейный коэффициент корреляции в графике срединного значения.
Как видно из фиг. 2А и таблицы 4, значение CI двух препаратов трастузумаба и клонов 1E11 во время их комбинированной обработки было ниже 0,1, и, следовательно, было подтверждено, что два антитела обладают синергетическим эффектом при введении в комбинации.
ПРИМЕР 7
Сравнение эпитопов для разработанных антител и трастузумаба
Известно, что трастузумаб, антитело к HER2, связывается с доменом-4 из четырех доменов HER2 ECD. Чтобы убедиться в том, перекрываются ли эпитопы на HER2 для разработанных антител с таковыми для трастузумаба, проводили эпитопный биннинг с помощью поверхностного плазмонного резонанса (SPR) с использованием Biacore 3000 (GE Healthcare). Около 1000 RU (группа реагирования) трастузумаба был иммобилизовано на сенсорном чипе CM5 (GE Healthcare, кат. № BR-1000-12) с помощью способа аминного связывания, используя ECD/NHS. Белку HER2-ECD-His в концентрации 320 нМ дали возможность связаться с сенсорным чипом, с которым трастузумаб был иммобилизован, с помощью буфера HBS-P (10 мМ HEPES, 150 мМ NaCl, 1 мМ ЭДТА, 0,005% Твин-20, рН 7,4) в течение 4 минут, и после этого пустой буфер пропускали через чип в течение 5 минут для стабилизации связывания между трастузумабом HER2-ECD. Затем, вторичным антителам в концентрации 1 мкг/мл давали возможность связываться с этим в течение 4 минут, и буферу давали возможность пропускаться через чип. Во всех экспериментах скорость потока была установлена на уровне 50 мкл/мин. Если вторично связанные антитела также связываются с белком HER2-ECD, с которым связан трастузумаб, они представляют собой антитела, которые не имеют общего эпитопа с эпитопом для трастузумаба.
Как видно из фиг.3А, hIgG, который использовали в качестве вторичного антитела, не связывается с HER2 и поэтому не было никакого дополнительного связывания, и поскольку трастузумаб имеет тот же эпитоп, он не связывался в дальнейшем. В отличие от этого, антитело 1Е11 дополнительно связывалось с HER2-ECD, который был связан с трастузумаб, и таким образом, было подтверждено, что оно имеет эпитоп, который отличается от такового для трастузумаба.
Для того, чтобы подтвердить область домена, с которой связываются клоны 1E11, четыре суб-домена (домены 1-4), которые образуют внеклеточный домен белка HER2, были индивидуально продуцированы с использованием животных клеток, в которых шарнирная область и FC область IgG1 человека были связаны, и очищали с помощью белка-А. Связывание клонов 1E11, трастузумаба, пертузумаба было подтверждено при помощи анализа ELISA в отношении полученных таким образом рекомбинантных белков. Как можно видеть на фиг. 3В, клоны 1E11, как было показано, связываются с субдоменом 4, как и в случае с трастузумабом.
На основании вышеизложенных результатов было подтверждено, что клоны 1E11 связываются с субдоменом 4 ECD белка HER2, но они связываются с эпитопом, который отличается от такового для трастузумаба (фиг. 3).
ПРИМЕР 8
Специфичность разработанного антитела к HER2
Связываются ли разработанные антитела 1E11 специфически с HER2 среди белков ErbB-семейства, к которому HER2 принадлежит, и связываются ли они с HER2 видов, отличных от человека, было подтверждено с помощью ELISA-анализа. Для того чтобы подтвердить, связываются ли разработанные антитела 1E11 специфически с HER2 среди белков ErbB-семейства, внеклеточные домены EGFR, HER2, HER3 и HER4, которые относятся к ErbB-семейству, были исследованы с помощью ELISA-анализа. Внеклеточные домены EGFR (EGFR-ECD-Fc) были продуцированы тем же способом, что и для HER2-ECD-Fc, а HER3 (R&D Systems, #348-RB-050) и HER4 (R&D Systems, #1131-ER-050) были приобретены. Чтобы убедиться в том, что разработанные антитела проявляют межвидовые перекрестные реакции с белками HER2 разных видов, были использованы внеклеточные домены HER2 человека, макака-резус, яванского макака, мыши и крысы и подтверждены с помощью ELISA-анализа. Внеклеточный домен яванского макака был произведен таким же образом, что и HER2-ECD-Fc человека, а внеклеточный домен HER2 макака-резус (Sino Biological Inc., #90020-K08H), внеклеточный домен HER2 мыши (Sino Biological Inc., #50714-M08H) и внеклеточный домен HER2 крысы (Sino Biological Inc., #80079-08H) были приобретены.
Как видно на фиг. 4A и 4B, было подтверждено, что разработанные антитела 1E11 специфически связываются с HER2 среди белков семейства ErbB человека, и межвидово перекрестно реагируют с белками HER2 макака-резуса и яванского макака.
ПРИМЕР 9
Анализ HER2-антител на апоптоз
Мы проанализировали способности HER2-антитела индуцировать апоптоз для выяснения основного молекулярного механизма противоопухолевого воздействия антитела 1E11, вводимого совместно с трастузумабом. Для исследования способностей индукцировать апоптоза, клетки NCI-N87 и BT-474 обрабатывали 10 пг/мл антитела 1E11, трастузумаба или их комбинации в течение 48 ч (10 пг/мл 1E11 и 10 пг/мл трастузумаба для комбинированного введения). После обработки антителом клетки снимали трипсином, и 500000 клеток были проанализированы с использованием набора ApoScreen Annexin V Apoptosis (SouthernBiotech, #10010-02) при помощи жидкостной цитометрии (Cytomics FC500, Beckman Coulter Inc.) (фиг. 5a и 5b).
Для измерения активности каспазы-3 и каспазы-7, играющих ключевую роль в апоптозе, противоопухолевые эффективности антитела 1Е11, трастузумаба или их комбинации анализировали в течение времени обработки. Клетки NCI-N87 обрабатывали 10 пг/мл антител. После 24 ч и 48 ч обработки, анализ жизнеспособности клеток проводили с использованием Caspase-Glo (Promega, #G7571) (фиг.5С). Показано, что жизнеспособность клеток резко снизилась после 24 ч лечения. Основываясь на таких результатах, активности каспазы-3/7 измеряли после 24 ч обработки. Клетки NCI-N87 обрабатывали 10 мкг/мл антител в течение 24 часов. Тест Caspase-Glo 3/7 (Promega, #G809) использовался для измерения активности каспазы-3/7 (фиг. 5d).
Как представлено на фиг. 5А и 5B, было показано, что антитело 1E11 само по себе проявляет апоптотическую активность в отношении HER2-сверхэкспрессирующего рака желудка (клетки NCI-N87) и молочной железы (клетки BT-474), которая отлична от трастузумаба. Апоптотическая активность антитела 1E11 дополнительно увеличивалась при комбинированной обработке с трастузумабом. Увеличенную апоптотическую активность комбинированной обработки 1E11 и трастузумабом анализировали на предмет того, происходит ли это из-за увеличения активности каспазы-3/7, играющей решающую роль в апоптозе (фиг. 5d).
ПРИМЕР 10
Ингибирование HER2-клеточной сигнализации антителами
Для выяснения противоопухолевого механизма 1E11 в комбинации с трастузумабом в отношении HER2-сверхэкспрессирующего рака желудка и рака молочной железы, мы анализировали HER2-сигнальные активности на клетках. Клетки NCI-N87 обрабатывали 10 мкг/мл антител в течение 24 часов. Затем клетки лизировали в растворе для клеточного лизиса [50 мМ Трис, рН 7,4, 150 мМ NaCl, 1% NP-40, 0,1% додецилсульфата натрия, 1 мМ фторида натрия, 1 мМ Na3V04, 1 мМ PMSF и коктейль ингибиторов протеаз (Sigma)] для получения клеточных лизатов. Клеточный лизат подвергали Вестерн-блот анализу. Антитела HER2 (#4290), pHER2 (#2243), pHER3 (#4791), EGFR (#4267), pEGFR (#3777), АКТ (#4691), рАКТ (#4060), ERK (#4695) и pERK (#4370) были приобретены у Cell Signaling Technology. Антитело HER3 (sc-285) был куплено у Santa Cruz Biotechnology и антитело GAPDH (AbC-1001) в качестве контроля нагрузки было приобретено у AbClon. Конъюгированные с пероксидазой хрена антитела против мыши (AbC-5001) и против крысы (AbC-5003) также были куплены у AbClon. Полосы визуализировали с помощью AbSignal (AbClon, АВС-3001).
Мы также исследовали, ингибирует ли комбинированная обработка 1Е11 и трастузумабом гетеродимеризацию между HER2 и EGFR или HER3 в качестве белка ErbB-семейства. Клетки NCI-N87 обрабатывали EGF для индукции гетеродимеризацию между HER2 и EGFR, и обрабатывали HRG для индукции гетеродимеризации между HER2 и HER3. Клетки NCI-N87 распределяли на аликвоты в клеточной среде с добавлением 0,1% FBR, и культивировали в течение 24 часов. Затем клетки обрабатывали 10 мкг/мл антител в течение 1 ч, а затем при 200 нг/мл EGF (R&D Systems, #236-EG-200) или HRG (R&D Systems, #377-HB/CF). Три дня спустя, проверяли жизнеспособность клеток.
Как показано на фиг. 6а, комбинированная обработка 1E11 и трастузумабом способствует снижению уровня белка HER2. При снижении уровня белка HER2, фосфорилированный белок HER2 также снижается. Мы наблюдали пониженный уровень фосфорилирования HER3 и EGFR без изменения уровня общего белка. Такие результаты показывают, что комбинированная обработка 1E11 и трастузумабом способна контролировать активность HER2, HER3 и EGFR. При помощи таких контролей активности, активность АКТ и ERK, известных понижающих активность HER2 факторов, также были изменены без изменения уровня общего белка.
Показано, что комбинированная обработка 1E11 и трастузумабом приводила к снижению пролиферации клеток путем гетеродимеризации между HER2 и EGFR (или HER3) (фиг. 6b). Пролиферация клеток NCI-N87 при помощи EGF, способного индуцировать гетеродимеризацию между HER2 и EGFR, и HRG, способного индуцировать гетеродимеризацию между HER2 и HER3, уменьшалась при комбинированной обработке 1Е11 и трастузумабом до уровня, аналогичном уровню для пертузумаба, для блокирования связывания HER2 с другими рецепторами.
Эти результаты свидетельствуют, что клеточная сигнализация через гетеродимеризацию между HER2 и EGFR (или HER3) подавлялась комбинированной обработкой 1Е11 и трастузумабом.
ПРИМЕР 11
Противоопухолевые эффективности антител в животных моделях
Противоопухолевые эффективности антитела 1E11 оценивали с использованием животных моделей. Бестимусным голым самкам мышей (Daehan Biolink, Корея) вводили подкожно 5×106 клеток NCI-N87 для подготовки ксенотрансплантатной модели. Опухоли давали возможность расти до примерно 200 мм3 в размере, и мышей рандомизировали на четыре группы. Животные из всех четырех групп получали два раза в неделю внутрибрюшинное введение 10 мг/кг паливизумаба (в качестве изотипического контроля трастузумаба (Medlmmune LLC.)), 1E11, трастузумаб и комбинацию 1E11 и трастузумаба, соответственно. Для комбинированного введения, каждое антитело вводили в дозе 10 мг/кг. Объемы опухолей измеряли с течением времени. На 22 день, животных забивали и выделяли опухоли. Объемы опухолей рассчитывали, используя формулу (L*W*W)/2, где "L" означает больший диаметр опухоли и "W" представляет собой наименьший диаметр опухоли. Выделенные опухоли взвешивали и подготавливали для иммуногистохимического анализа. Ткани опухолевых ксенотрансплантатов готовили как срезы фиксированных в формалине и залитых в парафин образцов. Их исследовали при помощи окрашивания гематоксилином (DAKO, #CS700) и эозином (DAKO, #CS701) (H&E) и окрашиванием на белок HER2 с использованием HER2-антитела (Cell Signaling Technology, #4290).
1E11 само по себе ингибировало рост опухоли до степени, сходной с таковой для трастузумаба (фиг. 7а). 1E11 демонстрировало резко увеличенную противоопухолевую активность в комбинации с трастузумабом, по сравнению с лечением каждым антителом по отдельности. Противоопухолевая активность также была подтверждена путем анализа опухолевой массы, экстрагированной после экспериментов (фиг. 7b). Снижение HER2-экспрессирующих клеток при комбинированном лечении 1E11 и трастузумабом наблюдалось при иммуногистохимическом окрашивании (фиг. 7с), которое сопоставимо с результатами Вестерн-блоттинга (фиг. 6а). Эти результаты указывают на то, что 1E11 в комбинации с трастузумабом значительно ингибирует рост опухоли по сравнению с лечением антителом самим по себе, что обусловлено подавлением экспрессии белка HER2.
ПРИМЕР 12
Разработка гуманизированных антител и подтверждение их эффектов
Гуманизированные антитела химерных антител 1E11, разработанных в примере 4, были разработаны с использованием способа CDR-прививки. Что касается человеческих антител для получения CDR разработанных антител, гены V и J генов антител зародышевой линии человека с высокой степенью гомологии нуклеотидной последовательности были отобраны с помощью IMGT/V-QUEST (Brochet, X. et al, Nucl Acids Res. 36:503-508(2008)). В качестве V-гена и J-гена тяжелой цепи были выбраны ген IGHV3-48*03 и гена IGHJ4*01, соответственно, и их гомология последовательности составляла 85,07% и 87,23%, соответственно. Кроме того, в качестве V-гена и J-гена легкой цепи были выбраны ген IGKV 1-39*01 и ген IGKJ1*01, соответственно, и их гомология последовательности составляла 81,36% и 81,08%, соответственно. Принимая во внимание сообщение, что прививка CDR только уменьшает афинность, Н49 по нумерации Кабат тяжелой цепи, соответствующий зоне Вернье, который может влиять на всю структуру антитела, был заменен на аланин вместо серина, который находится в гене зародышевой линии человека. Разработанное гуманизированное антитело hz1E11 продуцировали в виде IgG при помощи клеточной линии FreeStyleTM 293F. Аминокислотные последовательности вариабельной области тяжелой цепи и вариабельной области легкой цепи разработанного hz1E11 представлены в SEQ ID NOs:24 и 26, соответственно.
Афинность hz1E11, разработанного из 1E11 гуманизированного антитела, к HER2 измеряли способом анализа поверхностного плазмонного резонанса (SPR). Все эксперименты выполнялись с использованием Biacore 3000. Сначала, козьи антитела к человеческому IgG были иммобилизованы в концентрации 1000 RU c сенсорным чипом CM5 обломок датчика способом аминного соединения. Трастузумаб, пертузумаб и hz1E11 разводили, соответственно, до 2,84 мкМ, 5,68 мкМ, и 7,1 мкМ с помощью HBS-P буфера. Перед связыванием с белком HER2-ECD-His, каждое антитело связывали со скоростью 50 мкл/мин в течение 180 секунд, и давали буферу возможность протекать через чип для целей стабилизации. Затем, белку HER2-ECD-His была предоставлена возможность связывания в концентрации 640 нМ, 320 нМ, 160 нМ, 80 нМ, 40 нМ, 20 нМ и 0 нм в течение 4 минуты, и давали буферу возможность протекать через чип в течение 15 минут. Сенсорный чип повторно использовали, давая возможность 10 мМ глицин-HCl (рН 1,5) буферу протекать через чип. Все данные сенсограммы анализировали с помощью модели взаимодействия 1:1 с использованием программного обеспечения BIAevaluation. Афинности антител приведены в таблице 5 ниже. Афинности трастузумаба и пертузумаба составляли 1,94 и 1,89 нМ и нМ, соответственно, тогда как афинность разработанного антитела 1E11 составляла 16,0 нМ. Афинность антитела, гуманизированного из 1E11, составила 10,4 нМ, демонстрируя почти полное отсутствие разницы с существующим антителом 1E11.
Противоопухолевый эффект hz1E11, разработанного гуманизированного антитела 1Е11, подтверждали на человеческих клеточных линиях рака желудка NCI-N87 и ОЕ-19, которые сверхэкспрессируют HER2 (фиг. 8). Однократная обработка hz1E11 клеток NCI-N87 показала снижение частоты выживания при раке аналогично таковой при обработке трастузумабом, в то время как комбинированная обработка hz1E11 и трастузумабом показала достоверно более выраженное снижение частоты выживания при раке по сравнению с обработкой каким-либо одним из антител (фиг. 8А). Кроме того, комбинированная обработка hz1E11 и трастузумабом ОЕ-19, другой клеточной линии человеческого рака желудка, показали более выраженное снижение частоты выживания при раке по сравнению с обработкой каким-либо одним из антител (фиг. 8В). Кроме того, комбинированная обработка hz1E11 и трастузумабом показала немного более высокий ингибирующий эффект, чем комбинированная обработка 1E11 и трастузумабом (фиг. 2А) в отношении пролиферации раковых клеток (фиг. 8А). Комбинированная обработка hz1E11 и трастузумабом показала более высокий ингибиторный эффект на клеточных линиях NCI-N87 и ОЕ-19, чем при комбинированной обработке трастузумабом и пертузумабом в отношении пролиферации раковых клеток.
Вышеизложенные результаты указывают на то, что hz1E11, разработанное из 1E11 гуманизированные антитело имеет равную способность к связыванию и немного улучшенный противоопухолевый эффект по сравнению с обычным 1E11.
Противоопухолевый эффект комбинированного лечения hz1E11, разработанным из 1E11 гуманизированным антителом, наряду с трастузумабом был подтвержден на модели ксенотрансплантатов с помощью NCI-N87. Мышам, имеющим злокачественную опухоль, образованную посредством NCI-N87-трансплантации, внутрибрюшинно вводили два раза в неделю разработанное антитело и изотипическую контрольную группу трастузумаба, hz1E11, трастузумаб и комбинацию hz1E11 и трастузумаб, соответственно. Изотипическую контрольную группу и трастузумаб вводили в дозе 10 мг/кг. В случае комбинированного лечения, hz1E11 и трастузумаба смешивали в соотношении 1:1 и вводили в дозе 1 мг/кг, 2,5 мг/кг, 5 мг/кг и 10 мг/кг на основе каждого антитела. Комбинированное лечение hz1E11 и трастузумабом показало снижение злокачественного роста зависимым от дозы образом (фиг.9). Противоопухолевый эффект, наблюдаемый при введении 10 мг/кг трастузумаба, также отмечался при введении 1 мг/кг hzlE11 или трастузумаба. Введение hz1E11 и трастузумаба в дозе более 5 мг/кг, как было показано, не только подавляет злокачественный рост, но и уменьшает уже сформированную злокачественную опухоль.
ПРИМЕР 13
Подтверждение области связывания разработанных антител
Для того, чтобы подтвердить область разработанных антител, важную для связывания с антигенами, проводили аланин-сканирующий анализ, который проверяет способность к связыванию путем изменения аминокислот, соответствующих CDR3 тяжелой цепи и легкой цепи на аланин. Гистидин (Н), лейцин (L), глицин (G), глицин (G), треонин (Т) и серин (S) среди области CDR3 тяжелой цепи, что соответствуют 95, 96, 97, 98, 99 и 100 в соответствии с нумерацией Кабату, и глутамин (Q), глутамин (Q), лейцин (L), тирозина (T), серин (S) и треонина (Т) среди области CDR3 легкой цепи, что соответствует 89, 90, 91, 92, 93 и 94 нумерации по Кабату, были изменены на аланин с помощью набора для направленного мутагенеза QuikChange Site-directed Mutagenesis kit (Stratagene, #200518). Среди CDR3 тяжелой цепи, А100 был исключен из анализа, поскольку в разработанное антитело имело аланин. После экспрессии каждого модифицированного антитела в бактериях, его экспрессию подтверждали с помощью дот-блота после получения из этого периплазматического экстракта, и связывающую способность анализировали в отношении HER2-ECD с помощью теста ELISA (см.: фиг. 10).
Как видно из таблицы 6 и фиг. 10А и 10В, модифицированные антитела были экспрессированы на сходном уровне, в то время как G98A тяжелой цепи показала полную потерю его связывающей способности, и G97A тяжелой цепи показала заметное снижение его способности к связыванию. Изменения в других областях не оказывают какого-либо заметного влияния на связывание антигенантитело.
Пример 14
Повышение афинностей разработанных антител
В целях повышения афинностей разработанных антител, была разработана библиотека рандомизированных CDR3 легкой цепи и тяжелой цепи. F, D и Y среди CDR3 тяжелой цепи, которые соответствуют F100b, D101 и Y102, аминокислотным номерам в соответствии с нумерацией Кабат, и Р, W и T среди CDR3 легкой цепи, которые соответствуют Р95, W96 и T97 в соответствии с нумерацией Кабат, были исключены из рандомизации, поскольку они представляют собой обычно обнаруживаемые аминокислоты в человеческих антителах. Была разработана фаговая библиотека антител с 20 рандомизированными аминокислотами CDR3-аминокислот тяжелой цепи и легкой цепи эксклюзивами аминокислот, описанных в вышеуказанной технологии (Phage display: a laboratory manual, Carlos Barbas III, et al., Cold Spring Harbor Laboratory Press). В частности, праймеры, использованные выше, относятся к области, соответствующей CDR3 тяжелой цепи и легкой цепи, и были синтезированы так, что аденин (а), цитозин (C), гуанин (G) и тимин (Т) были смешаны в равной пропорции, для встраивания случайным образом в первое и второе положения кодона соответствующей аминокислоты, предназначенную для рандомизации, и гуанин (G) или цитозин (C) смешивали в равном соотношении, для встраивания в третье положение.
Для отбора клонов с увеличенными афинностями из разработанной библиотеки, белок HER2-ECD-His биотинилировали с использованием EZ-Link Sulfo-NHS-LC-Biotinylation kit (Thermo Scientific, #21435) и использовали в качестве антигенов для отбора антител. Разработанной фаговой библиотеке антител и белку биотин-HER2-ECD-His давали возможность связывания при комнатной температуре в течение 2 часов, и фаги, связанные с антигенами, отделяли с использованием 50 мкл Dynabeads М-270 Streptavidin (Invitrogen, #653.06). Вышеуказанный процесс отбора проводили 4 раза, и колонии, которые экспрессировали антитела, которые связываются с HER2-ECD среди отобранных таким образом колоний, были отобраны при помощи теста ELISA с использованием периплазматических экстрактов, и последовательности антител, экспрессированных в выбранных колониях, были подтверждены при помощи нуклеотидного анализа. Аминокислотные последовательности CDR3 тяжелой цепи и легкой цепи антител, которые связываются с HER2-ECD, суммированы в таблицах 7 и 8 ниже. Число 1 в каждой таблице представляет аминокислотную последовательность CDR3 тяжелой цепи и легкой цепи hz1E11.
Последовательности CDRH3-мутантов, отобранных в процессе улучшения аффинности
Последовательности CDRH3-мутантов, отобранных в процессе улучшения аффинности
Для отбора клонов с улучшенным значением Кофф среди отобранных клонов, клоны анализировали с помощью Biacore 3000 (GE Healthcare). Белок HER2-ECD-His иммобилизовали с СМ5 сенсорным чипом способом аминного соединения с использованием ECD/NHS. После экспрессирования антител в каждом клоне с использованием ИПТГ, из них получали периплазматический экстракт и давали возможность связываться с HER2-ECD-His. Значение Кофф для каждого антитела анализировали с помощью программного обеспечения BIAevaluation. На основании вышеизложенного, были выбраны антитела с улучшенным значением Кофф (см. таблицу 9а). Таблица 9а раскрывает типичные примеры клонов, показывая аналогичные или улучшенные значения Кофф по сравнению с исходным антителом hz1E11, среди клонов, разработанных авторами настоящего изобретения.
Как видно из таблицы 9а, различные CDRH3, представленные общей формулой 1, и CDRL3, представленные общей формулой 2, по настоящему изобретению показывают аналогичные или улучшенные значения Кофф по сравнению с CDRH3 и CDRL3 исходного антитела, hz1E11.
Среди рандомизированных последовательностей CDR3 легкой цепи, эксперименты проводили с использованием hz1E11-3, hz1E11-133 и hz1E11-154.
Вариабельные области тяжелой цепи hz1E11-3, hz1E11-133 и hz1E11-154 были теми же, что и у hz1E11, и аминокислотная последовательность вариабельных областей легкой цепи описаны в SEQ ID NO:247, 249 и 251, соответственно.
В целях подтверждения увеличения афинности выбранных 3 видов антител, антитела продуцировали в форме IgG. Козье антитело к IgG человека (Invitrogen, #H10500) в концентрации 2000 RU иммобилизовали на СМ5 сенсорный чип способом ECD/NHS. Затем, антителам давали связаться при скорости 50 мкл/мин в течение 5 минут, и давали буферу возможность протекать через чип в течение 5 минут в целях стабилизации. Концентрации антител, используемых для связывания антител, составляли 0,4 мкг/мл для трастузумаба (TRA), 0,8 мкг/мл для пертузумаба (PER) и 1 мкг/мл для hz1E11 и выбранных антител. После стабилизации антител, белку HER2-ECD-His в концентрации 640 нМ, 320 нМ, 160 нМ, 80 нМ, 40 нМ, 20 нМ и 0 нМ давали связаться при скорости 50 мкл/мин в течение 4 минут, и давали буферу возможность протекать через чип в течение 15 минут для отделения. После анализа каждой из концентраций, их восстанавливали при помощи 10 нМ глицин (рН 1,5) и проводили последующие анализы. Афинности антител анализировали с помощью программного обеспечения BIAevaluation. Результаты анализа обобщены в таблице 9b.
В вышеприведенной таблице 9b, ka, kd, Rmax и KD, соответственно, показывают константу скорости ассоциации, константу скорости диссоциации, максимальную емкость связывания и равновесную константу диссоциации.
Как видно из таблицы 9b, hz1E11-133 и hz1E11-154 показали 8,4-кратное снижение значения Кофф, т.е. значений kd, по сравнению с hz1E11, в то время как они показали небольшое увеличение в значении kon, т.е. значение ka. Убедительно, в отношении конечной афинности, hz1E11-133 показал 1,5 нМ и hz1E11-154 показал 1,1 нМ, которые представляли собой 15-кратное улучшение и 20-кратное улучшение по сравнению с hz1E11.
ПРИМЕР 15
Подтверждение противоопухолевых эффектов антител с улучшенными афинностями
Противоопухолевые эффекты антител с улучшенными афинностями были подтверждены в отношении HER2-сверхэкспрессирующего рака желудка и рака молочной железы. Анализировали частоты выживания злокачественных клеток, когда NCI-N87 и ОЕ-19, HER2-сверхэкспрессирующие клеточные линии рака желудка, ВТ-474, HER2-сверхэкспрессирующую клеточную линию рака молочной железы подвергали однократной обработке каждым антителом отдельно или комплексной обработке вместе с трастузумабом, в соответствии с концентрацией.
Как видно из фиг. 11А-11F, антитела hz1E11-3, hz1E11-133 и hz1E11-154 с улучшенными афинностями показали улучшенные эффекты при обработке по отдельности и при комбинированной обработке, по сравнению с hz1E11.
Описав предпочтительные варианты осуществления настоящего изобретения, следует понимать, что их варианты и модификаций, находящиеся в пределах сущности изобретения, могут стать очевидными специалистам в этой области техники, а объем настоящего изобретения определяется прилагаемыми пунктами формулы изобретения и их эквивалентами.
| название | год | авторы | номер документа |
|---|---|---|---|
| САЙТ-СПЕЦИФИЧЕСКИЕ КОНЪЮГАТЫ АНТИТЕЛА К HER2 И ЛЕКАРСТВЕННОГО СРЕДСТВА | 2016 |
|
RU2745565C2 |
| АНТИ-НЕR2 АНТИТЕЛО И ЕГО КОНЪЮГАТ | 2014 |
|
RU2656161C1 |
| БИСПЕЦИФИЧЕСКИЕ СВЯЗЫВАЮЩИЕ МОЛЕКУЛЫ, СПОСОБНЫЕ СВЯЗЫВАТЬ CD137 И ОПУХОЛЕВЫЕ АНТИГЕНЫ, И ВАРИАНТЫ ИХ ПРИМЕНЕНИЯ | 2018 |
|
RU2805648C2 |
| БИСПЕЦИФИЧЕСКИЕ АНТИТЕЛА ПРОТИВ CEACAM5 И CD3 | 2020 |
|
RU2827106C1 |
| Биспецифическое антитело анти-HER2/анти-4-1BB и его применение | 2020 |
|
RU2831838C2 |
| АНТИТЕЛО ПРОТИВ КЛАУДИНА 18.2 И ЕГО КОНЪЮГАТ АНТИТЕЛО-ЛЕКАРСТВЕННОЕ СРЕДСТВО | 2022 |
|
RU2814164C2 |
| БИСПЕЦИФИЧЕСКОЕ АНТИТЕЛО И ЕГО ПРИМЕНЕНИЕ | 2021 |
|
RU2839153C2 |
| НОВЫЕ АНТИ-CLDN18.2 АНТИТЕЛА | 2020 |
|
RU2830887C2 |
| Антитела против TIGIT и их применение | 2019 |
|
RU2750705C1 |
| КОНЪЮГАТ ЛИГАНД - ЦИТОТОКСИЧЕСКОЕ ЛЕКАРСТВЕННОЕ СРЕДСТВО, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ЕГО ПРИМЕНЕНИЯ | 2015 |
|
RU2685728C2 |




























































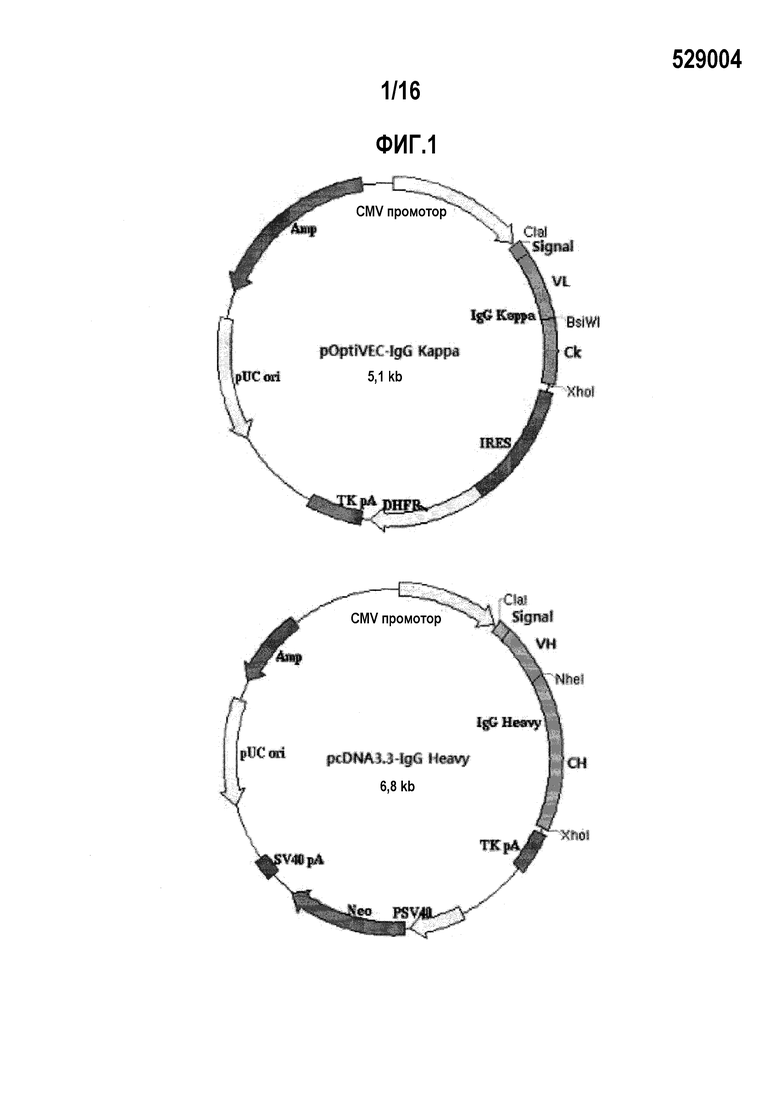
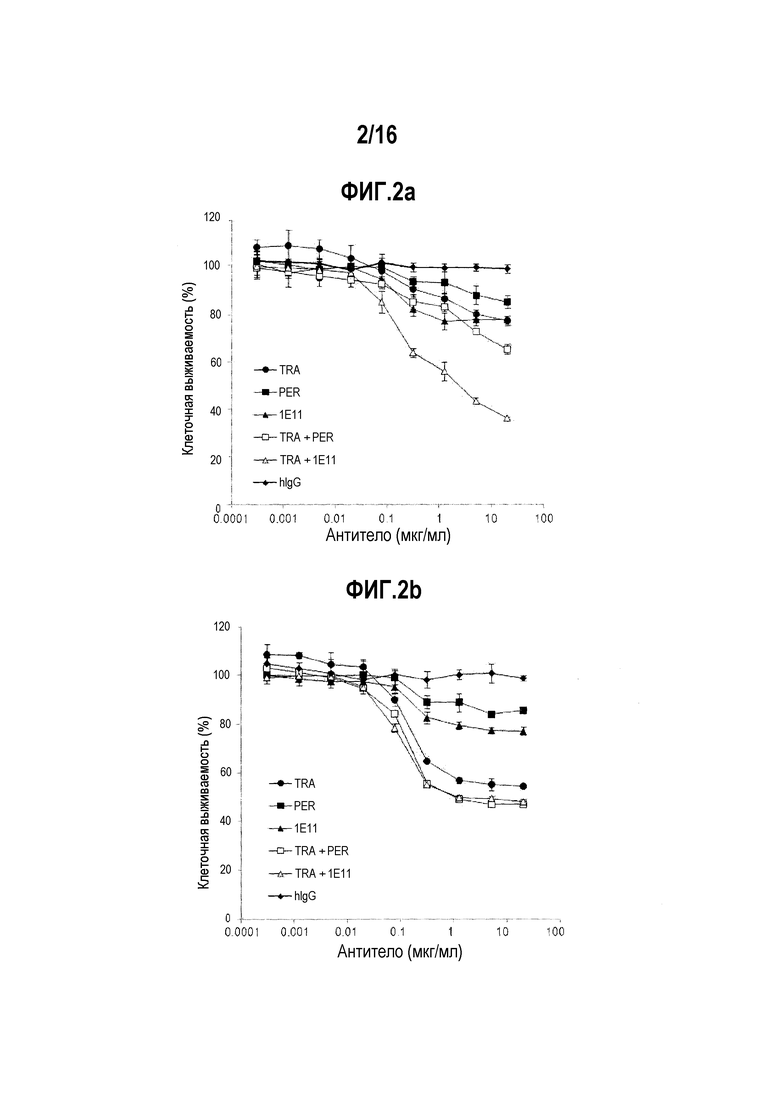
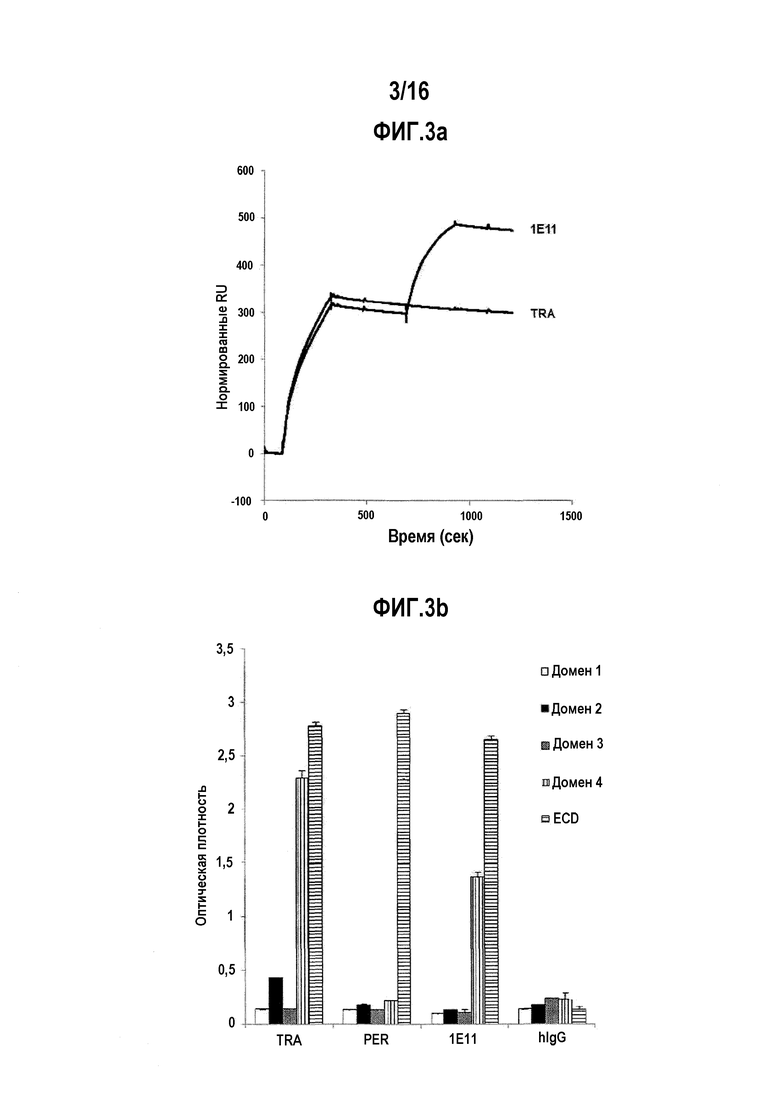
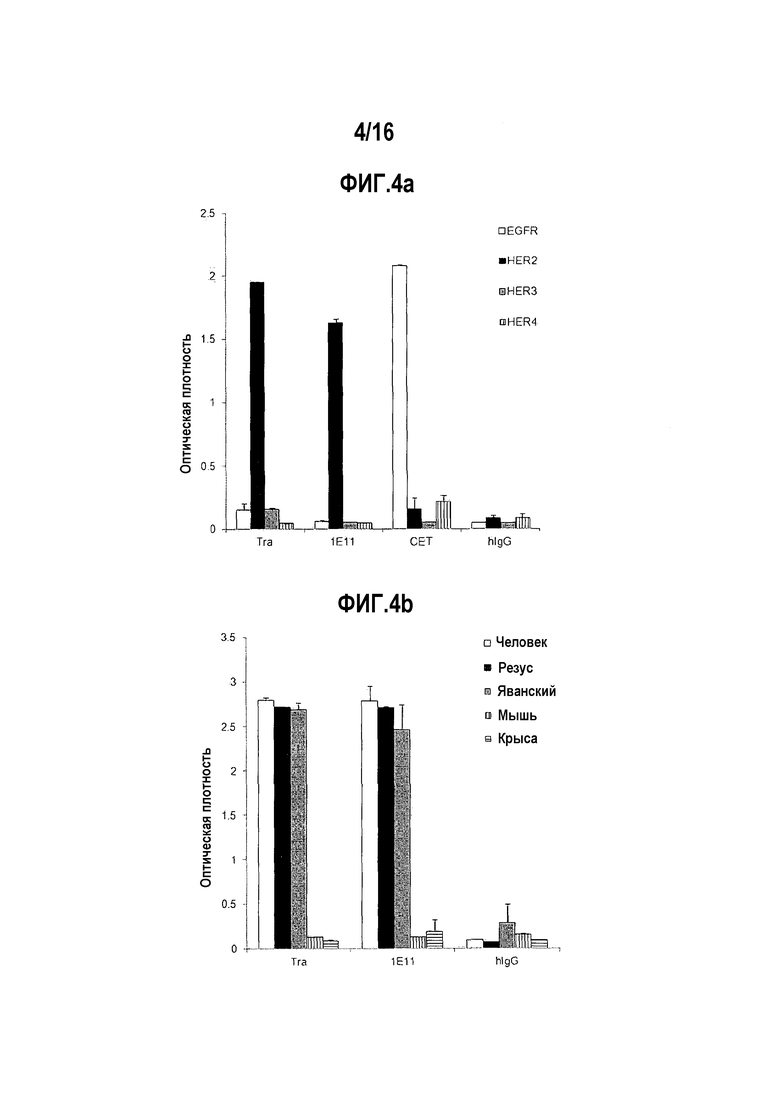
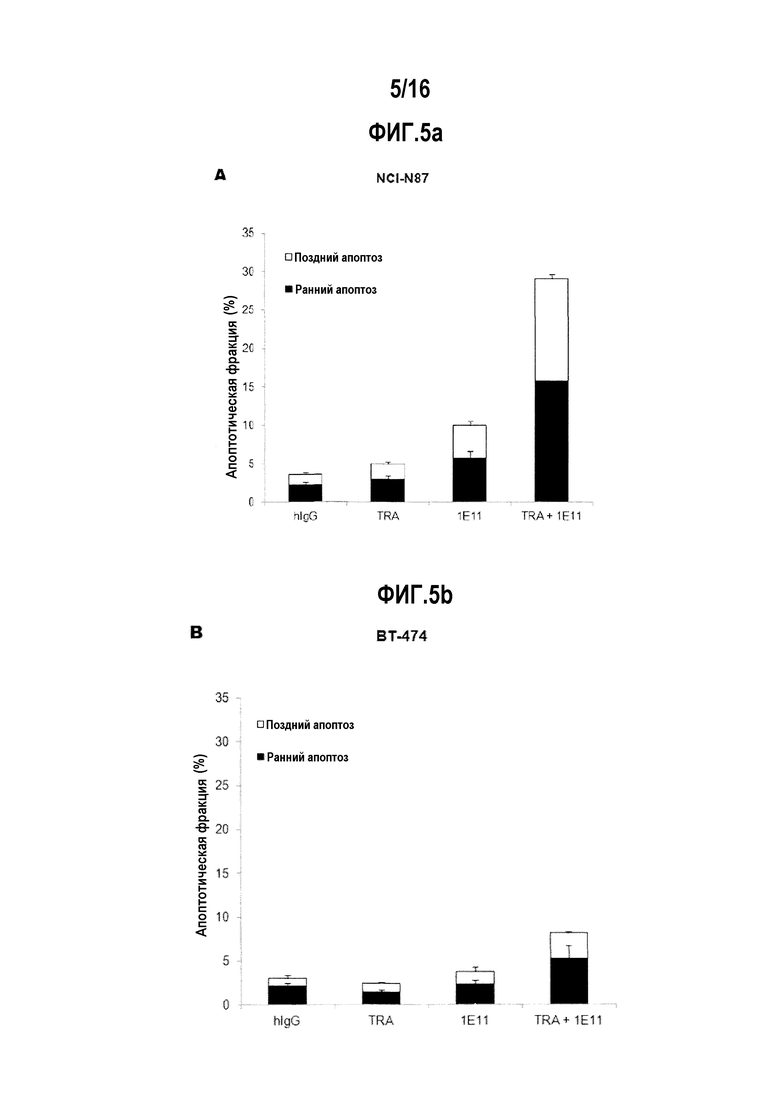
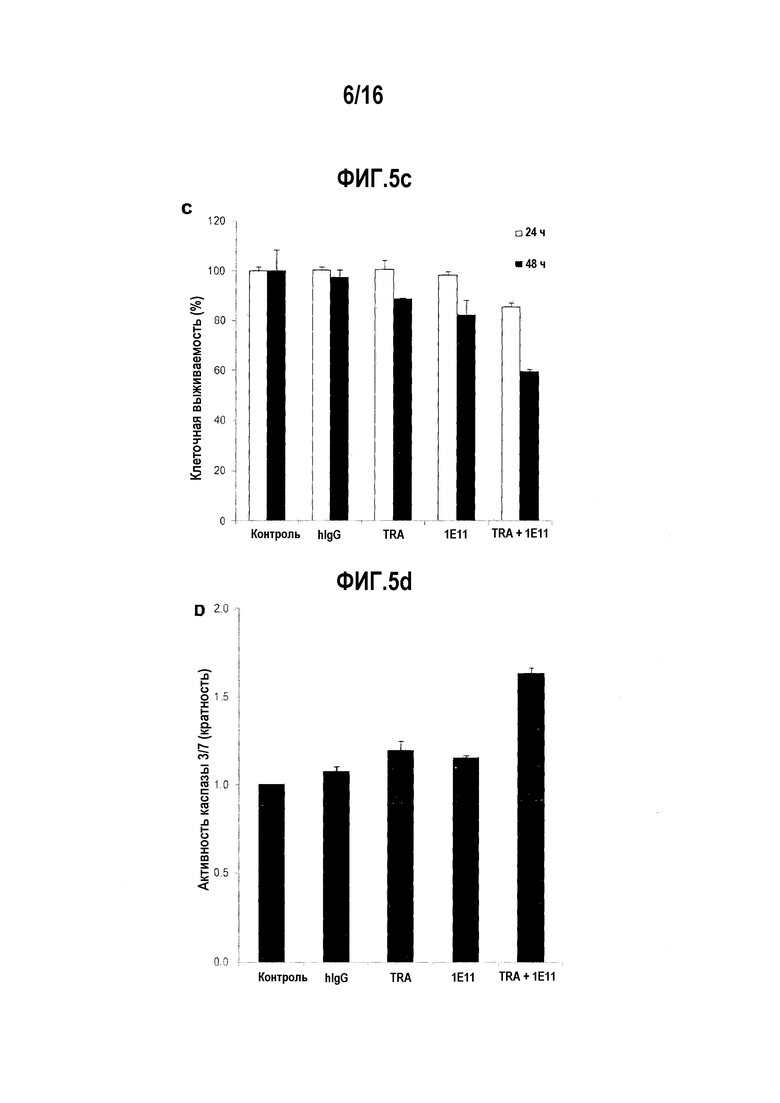
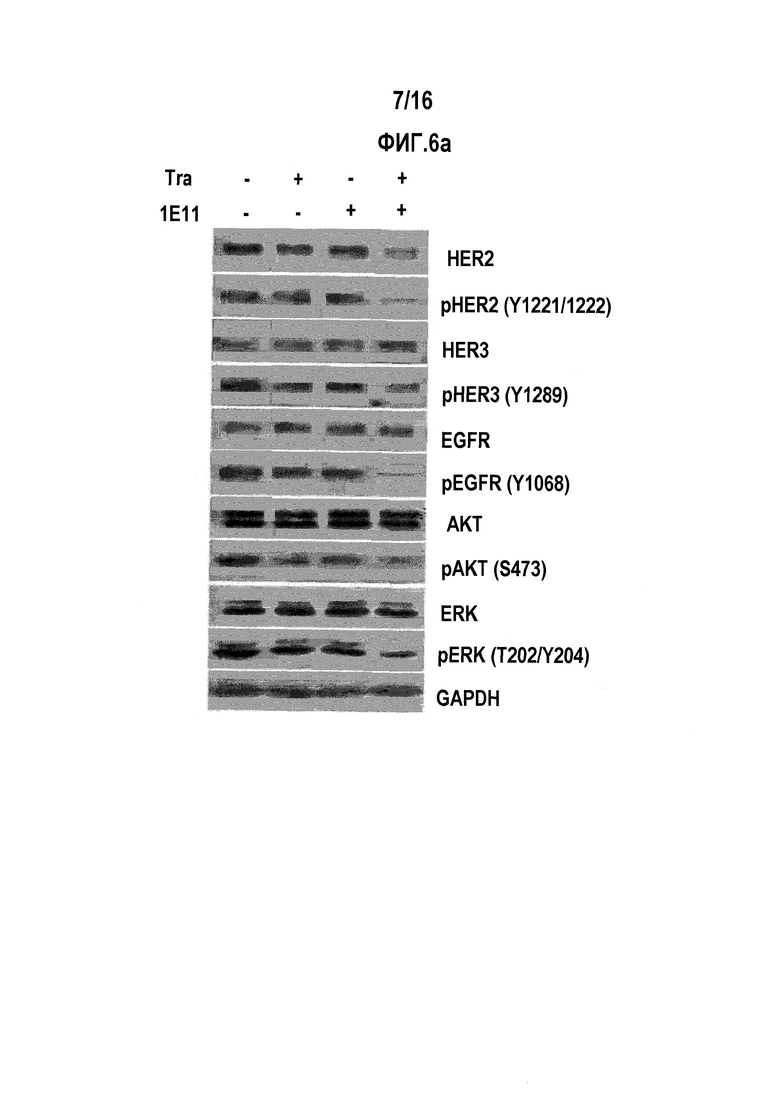
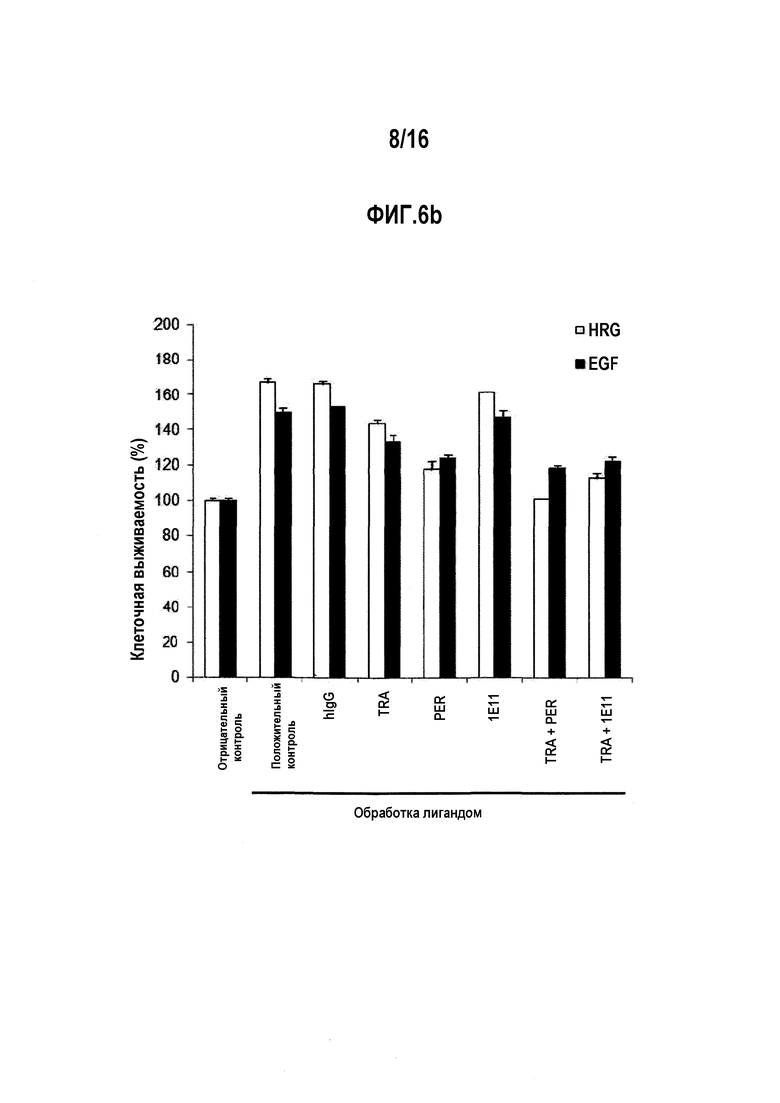
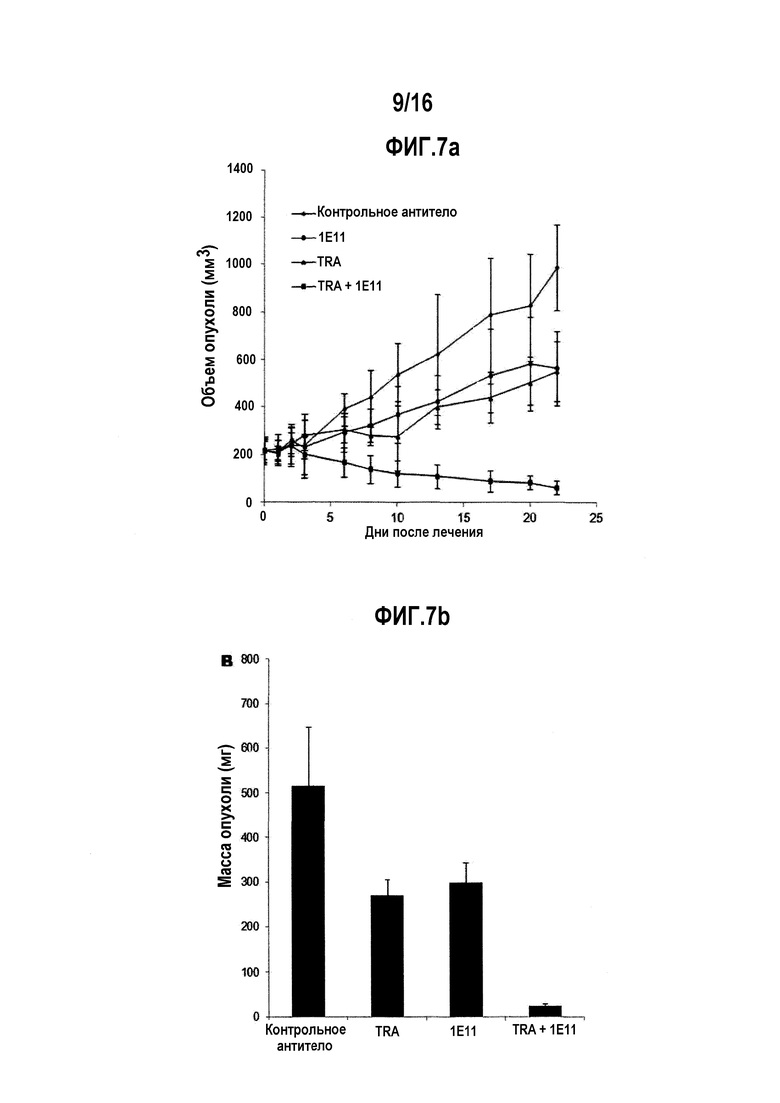
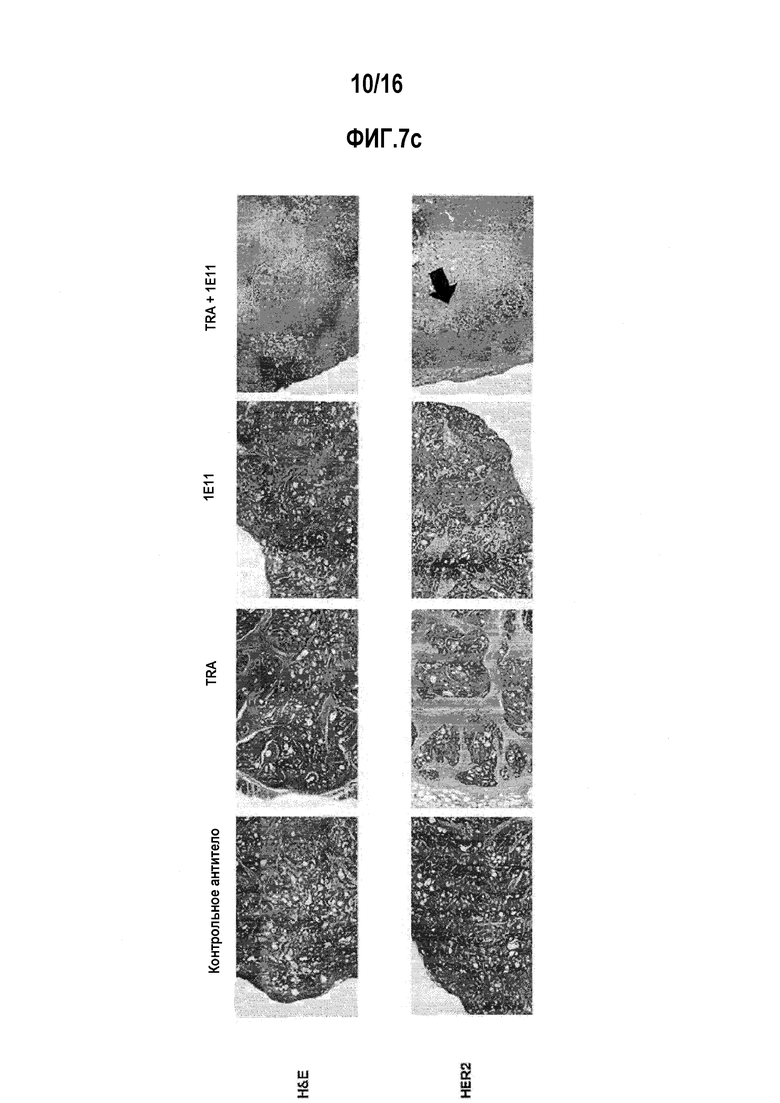
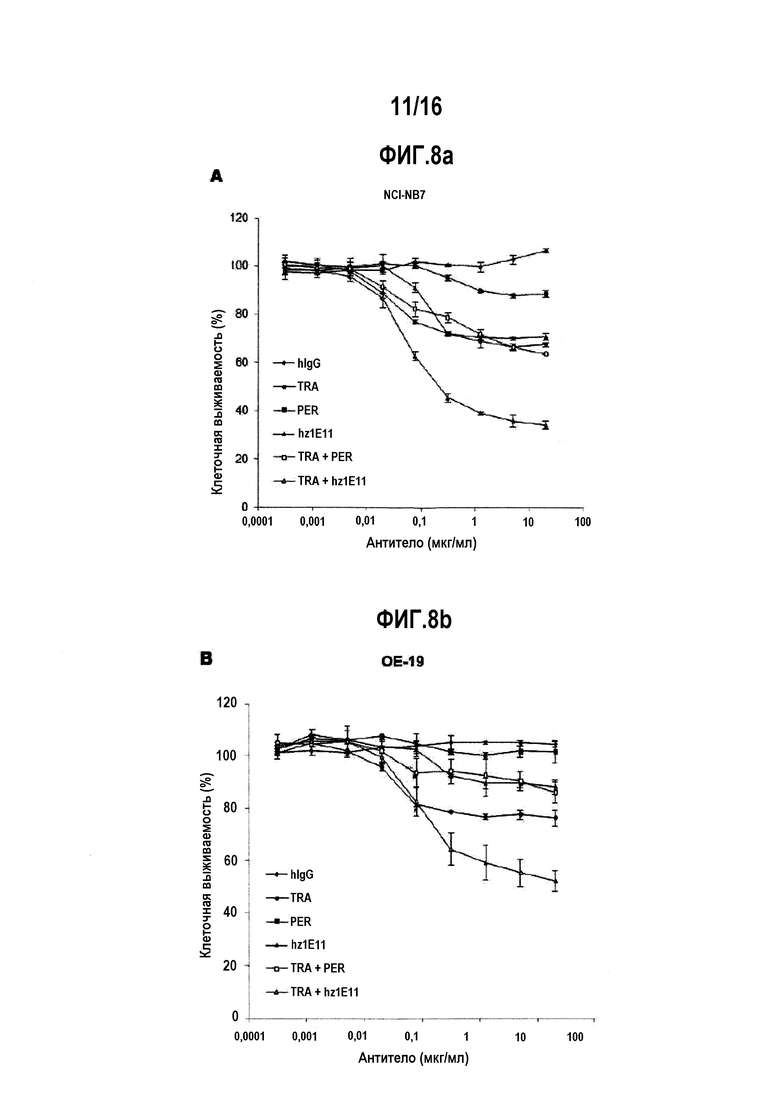
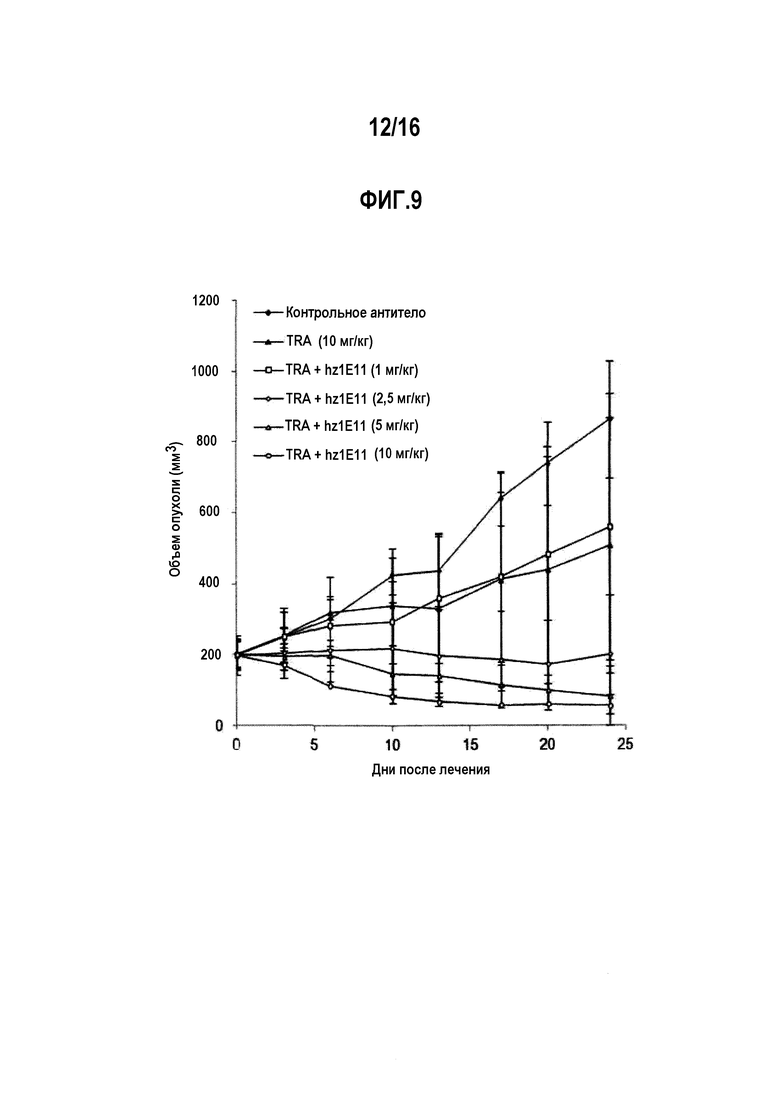

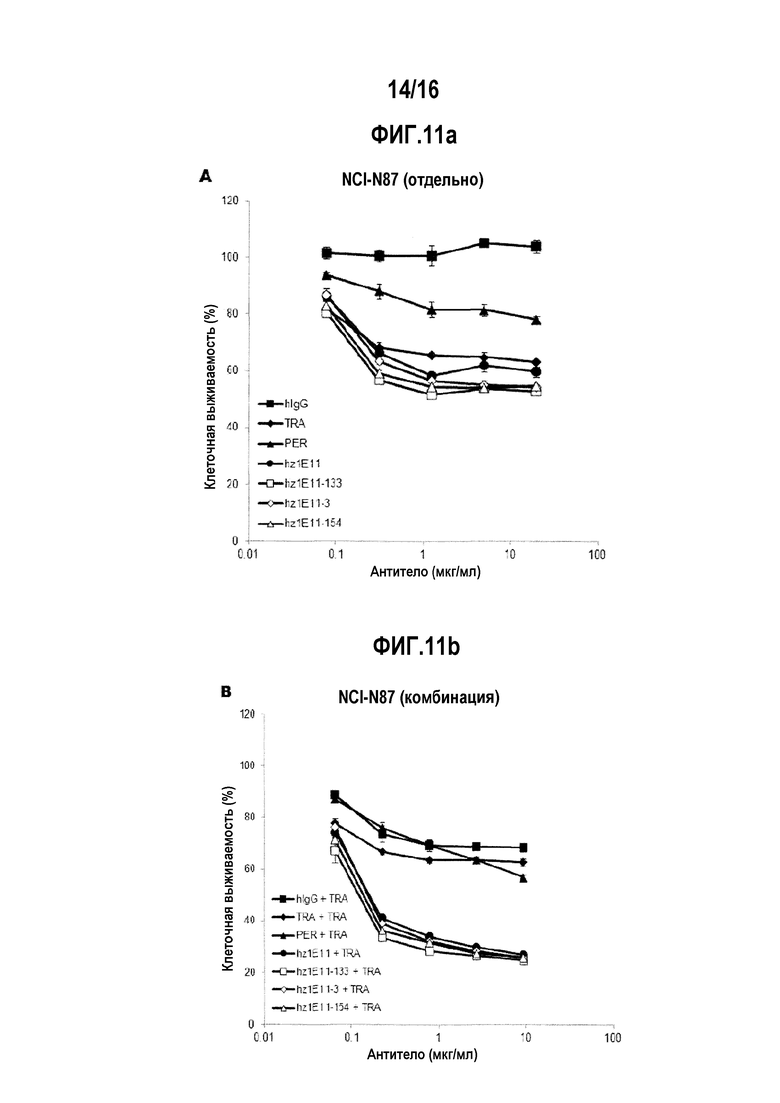
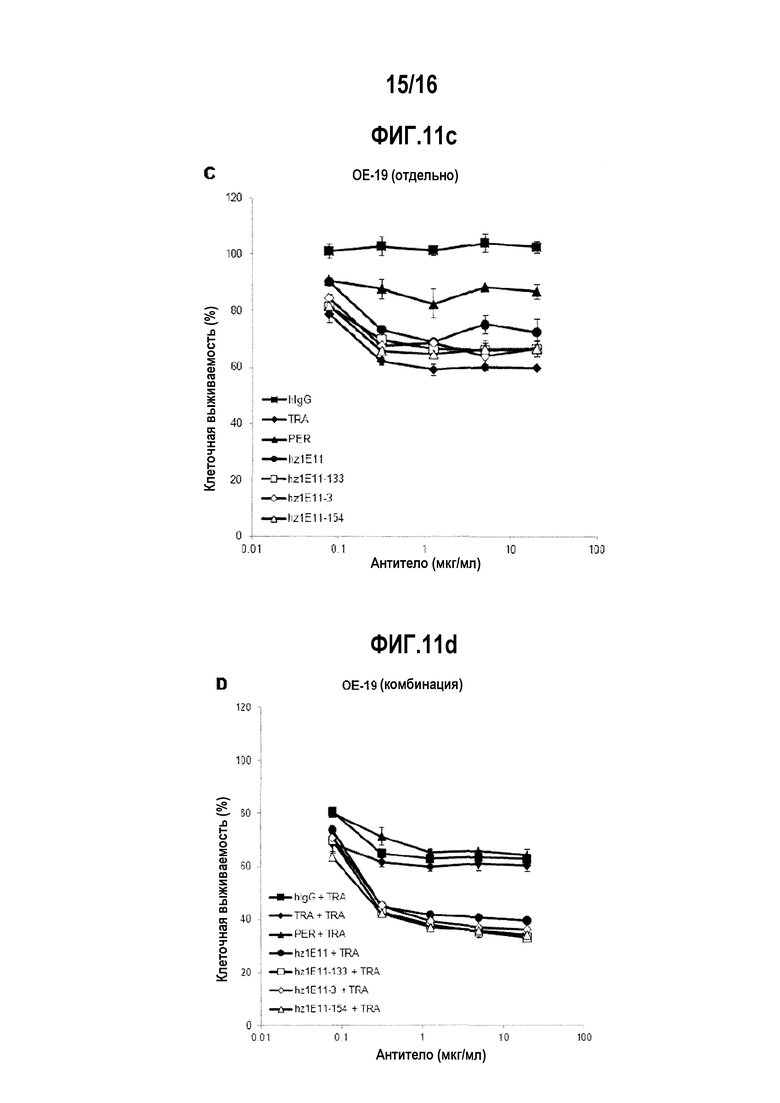

Изобретение относится к области биохимии. Предложено антитело к рецептору эпидермального фактора роста 2 (HER2) человека, а также включающие указанное антитело фармацевтические композиции, предназначенные для профилактики и лечения злокачественной опухоли и для индуцирования апоптоза. Кроме того, предложен набор для диагностики злокачественной опухоли, включающий указанное антитело. Изобретение позволяет уничтожать раковые клетки с существенно увеличенной цитотоксичностью при применении указанного антитела в комбинации с трастузумабом и может быть использовано в терапии рака. 4 н. и 7 з.п. ф-лы, 27 ил., 10 табл., 15 пр.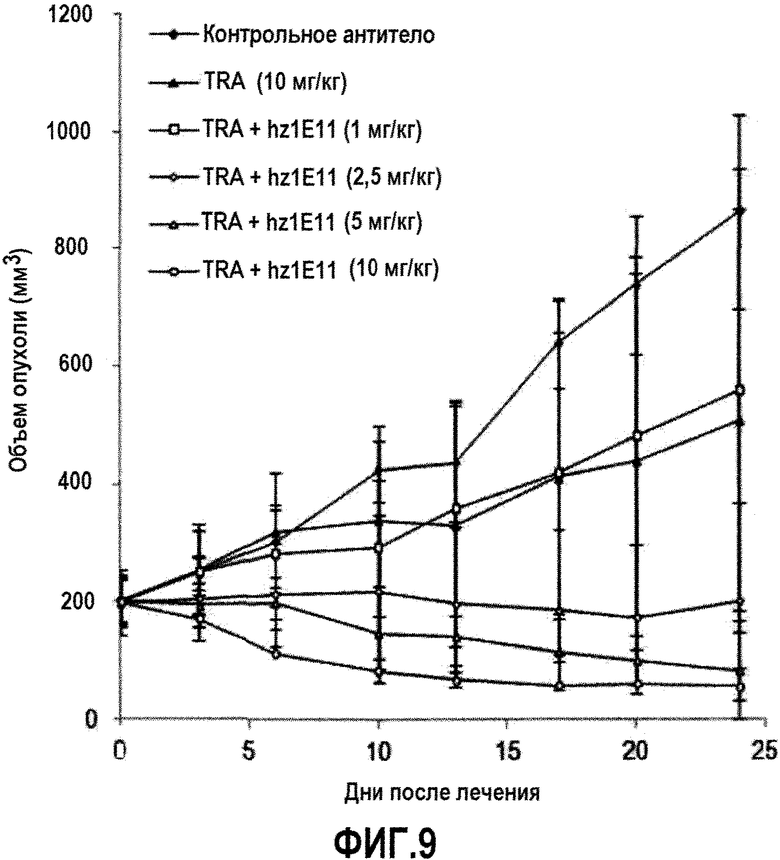
1. Антитело к рецептору эпидермального фактора роста 2 (HER2) человека или его антигенсвязывающий фрагмент, включающее:
(i) вариабельную область тяжелой цепи, содержащую определяющую комплементарность область (CDR)H1 SEQ ID NO: 1, CDRH2 SEQ ID NO: 2 и CDRH3 SEQ ID NO: 3, и вариабельную область легкой цепи, содержащую CDRL1 SEQ ID NO: 4, CDRL2 SEQ ID NO: 5 и CDRL3 SEQ ID NO: 6;
(ii) вариабельную область тяжелой цепи, содержащую CDRH1 SEQ ID NO: 1, CDRH2 SEQ ID NO: 2 и CDRH3 SEQ ID NO: 3, и вариабельную область легкой цепи, содержащую CDRL1 SEQ ID NO: 4, CDRL2 SEQ ID NO: 5 и CDRL3 SEQ ID NO: 218;
(iii) вариабельную область тяжелой цепи, содержащую CDRH1 SEQ ID NO: 1, CDRH2 SEQ ID NO: 2 и CDRH3 SEQ ID NO: 3, и вариабельную область легкой цепи, содержащую CDRL1 SEQ ID NO: 4, CDRL2 SEQ ID NO: 5 и CDRL3 SEQ ID NO: 239;
(iv) вариабельную область тяжелой цепи, содержащую CDRH1 SEQ ID NO: 1, CDRH2 SEQ ID NO: 2 и CDRH3 SEQ ID NO: 3, и вариабельную область легкой цепи, содержащую CDRL1 SEQ ID NO: 4, CDRL2 SEQ ID NO: 5 и CDRL3 SEQ ID NO: 88;
(v) вариабельную область тяжелой цепи, содержащую CDRH1 SEQ ID NO: 1, CDRH2 SEQ ID NO: 2 и CDRH3 SEQ ID NO: 76, и вариабельную область легкой цепи, содержащую CDRL1 SEQ ID NO: 4, CDRL2 SEQ ID NO: 5 и CDRL3 SEQ ID NO: 6;
(vi) вариабельную область тяжелой цепи, содержащую CDRH1 SEQ ID NO: 1, CDRH2 SEQ ID NO: 2 и CDRH3 SEQ ID NO: 43, и вариабельную область легкой цепи, содержащую CDRL1 SEQ ID NO: 4, CDRL2 SEQ ID NO: 5 и CDRL3 SEQ ID NO: 6;
(vii) вариабельную область тяжелой цепи, содержащую CDRH1 SEQ ID NO: 1, CDRH2 SEQ ID NO: 2 и CDRH3 SEQ ID NO: 84, и вариабельную область легкой цепи, содержащую CDRL1 SEQ ID NO: 4, CDRL2 SEQ ID NO: 5 и CDRL3 SEQ ID NO: 6;
(viii) вариабельную область тяжелой цепи, содержащую CDRH1 SEQ ID NO: 1, CDRH2 SEQ ID NO: 2 и CDRH3 SEQ ID NO: 85, и вариабельную область легкой цепи, содержащую CDRL1 SEQ ID NO: 4, CDRL2 SEQ ID NO: 5 и CDRL3 SEQ ID NO: 6;
(ix) вариабельную область тяжелой цепи, содержащую CDRH1 SEQ ID NO: 1, CDRH2 SEQ ID NO: 2 и CDRH3 SEQ ID NO: 76, и вариабельную область легкой цепи, содержащую CDRL1 SEQ ID NO: 4, CDRL2 SEQ ID NO: 5 и CDRL3 SEQ ID NO: 222;
(x) вариабельную область тяжелой цепи, содержащую CDRH1 SEQ ID NO: 1, CDRH2 SEQ ID NO: 2 и CDRH3 SEQ ID NO: 67, и вариабельную область легкой цепи, содержащую CDRL1 SEQ ID NO: 4, CDRL2 SEQ ID NO: 5 и CDRL3 SEQ ID NO: 156;
(xi) вариабельную область тяжелой цепи, содержащую CDRH1 SEQ ID NO: 1, CDRH2 SEQ ID NO: 2 и CDRH3 SEQ ID NO: 3, и вариабельную область легкой цепи, содержащую CDRL1 SEQ ID NO: 4, CDRL2 SEQ ID NO: 5 и CDRL3 SEQ ID NO: 109;
(xii) вариабельную область тяжелой цепи, содержащую CDRH1 SEQ ID NO: 1, CDRH2 SEQ ID NO: 2 и CDRH3 SEQ ID NO: 76, и вариабельную область легкой цепи, содержащую CDRL1 SEQ ID NO: 4, CDRL2 SEQ ID NO: 5 и CDRL3 SEQ ID NO: 157;
(xiii) вариабельную область тяжелой цепи, содержащую CDRH1 SEQ ID NO: 1, CDRH2 SEQ ID NO: 2 и CDRH3 SEQ ID NO: 67, и вариабельную область легкой цепи, содержащую CDRL1 SEQ ID NO: 4, CDRL2 SEQ ID NO: 5 и CDRL3 SEQ ID NO: 154;
(xiv) вариабельную область тяжелой цепи, содержащую CDRH1 SEQ ID NO: 1, CDRH2 SEQ ID NO: 2 и CDRH3 SEQ ID NO: 3, и вариабельную область легкой цепи, содержащую CDRL1 SEQ ID NO: 4, CDRL2 SEQ ID NO: 5 и CDRL3 SEQ ID NO: 220;
(xv) вариабельную область тяжелой цепи, содержащую CDRH1 SEQ ID NO: 1, CDRH2 SEQ ID NO: 2 и CDRH3 SEQ ID NO: 64, и вариабельную область легкой цепи, содержащую CDRL1 SEQ ID NO: 4, CDRL2 SEQ ID NO: 5 и CDRL3 SEQ ID NO: 178;
(xvi) вариабельную область тяжелой цепи, содержащую CDRH1 SEQ ID NO: 1, CDRH2 SEQ ID NO: 2 и CDRH3 SEQ ID NO: 64, и вариабельную область легкой цепи, содержащую CDRL1 SEQ ID NO: 4, CDRL2 SEQ ID NO: 5 и CDRL3 SEQ ID NO: 6;
(xvii) вариабельную область тяжелой цепи, содержащую CDRH1 SEQ ID NO: 1, CDRH2 SEQ ID NO: 2 и CDRH3 SEQ ID NO: 71, и вариабельную область легкой цепи, содержащую CDRL1 SEQ ID NO: 4, CDRL2 SEQ ID NO: 5 и CDRL3 SEQ ID NO: 155;
(xviii) вариабельную область тяжелой цепи, содержащую CDRH1 SEQ ID NO: 1, CDRH2 SEQ ID NO: 2 и CDRH3 SEQ ID NO: 3, и вариабельную область легкой цепи, содержащую CDRL1 SEQ ID NO: 4, CDRL2 SEQ ID NO: 5 и CDRL3 SEQ ID NO: 131;
(xix) вариабельную область тяжелой цепи, содержащую CDRH1 SEQ ID NO: 1, CDRH2 SEQ ID NO: 2 и CDRH3 SEQ ID NO: 71, и вариабельную область легкой цепи, содержащую CDRL1 SEQ ID NO: 4, CDRL2 SEQ ID NO: 5 и CDRL3 SEQ ID NO: 6; или
(xx) вариабельную область тяжелой цепи, содержащую CDRH1 SEQ ID NO: 1, CDRH2 SEQ ID NO: 2 и CDRH3 SEQ ID NO: 83, и вариабельную область легкой цепи, содержащую CDRL1 SEQ ID NO: 4, CDRL2 SEQ ID NO: 5 и CDRL3 SEQ ID NO: 6.
2. Антитело или его антигенсвязывающий фрагмент по п.1, в котором вариабельная область тяжелой цепи включает последовательность аминокислот SEQ ID NO:8 или 24.
3. Антитело или его антигенсвязывающий фрагмент по п.1, в котором вариабельная область легкой цепи включает последовательность аминокислот SEQ ID NO:10, 26, 247, 249 или 251.
4. Фармацевтическая композиция для профилактики или лечения злокачественной опухоли, включающая: (а) фармацевтически эффективное количество антитела к HER2 или его антигенсвязывающего фрагмента по любому из пп.1-3; и (b) фармацевтически приемлемый носитель.
5. Фармацевтическая композиция по п.4, в которой композиция дополнительно содержит трастузумаб.
6. Фармацевтическая композиция по п.4, в которой злокачественная опухоль представляет собой рак молочной железы, рак яичника, рак желудка, рак легкого, рак печени, рак бронха, рак носоглотки, рак гортани, рак поджелудочной железы, рак мочевого пузыря, колоректальный рак, рак толстой кишки, рак шейки матки, рак мозга, рак предстательной железы, рак кости, рак головы и шеи, рак кожи, рак щитовидной железы, рак паращитовидной железы или рак мочеточника.
7. Фармацевтическая композиция по п.6, в которой злокачественная опухоль представляет собой рак молочной железы или рак желудка.
8. Фармацевтическая композиция для индуцирования апоптоза, включающая: (а) фармацевтически эффективное количество антитела к HER2 или его антигенсвязывающего фрагмента по любому из пп.1-3; и (b) фармацевтически приемлемый носитель.
9. Фармацевтическая композиция по п.8, в которой фармацевтическая композиция индуцирует апоптоз для профилактики или лечения гиперпролиферативных заболеваний; при этом гиперпролиферативное заболевание представляет собой злокачественную опухоль, гиперплазию, келоид, синдром Кушинга, первичный альдостеронизм, эритроплакию, истинную полицитемию, лейкоплакию, гиперпластический рубец, красный плоский лишай, лентигиноз, артериосклероз, атеросклероз, рестеноз или стеноз.
10. Набор для диагностики злокачественной опухоли, включающий (a) антитело к HER2 или его антигенсвязывающий фрагмент по любому из пп.1-3; и (b) биообразец.
11. Набор для диагностики злокачественной опухоли по п.10, где биообразцом являются клетки, ткани, экстракты, полученные из тканей, лизат, очищенный продукт, кровь, плазма, сыворотка, лимфа или асцитическая жидкость.
| WO 2011103700 A1, 01.09.2011 | |||
| US 2011117097 A1, 19.05.2011 | |||
| LEWIS PHILLIPS G.D | |||
| et al.,Targeting HER2-Positive Breast Cancer with Trastuzumab-DM1, an Antibody-Cytotoxic Drug Conjugate, CANCER RESEARCH, 2008, vol.68, no.22, pp.9280 - 9290 | |||
| ЯРИЛИН А.А., Основы иммунологии: Учебник | |||
| - М.: Медицина, 1999, 608с. |
Авторы
Даты
2017-08-14—Публикация
2014-05-14—Подача