Область техники
Настоящее изобретение относится к микробиологической промышленности, в частности к способу получения L-аминокислоты с использованием бактерии семейства Enterobacteriaceae, содержащей мутантную аденилатциклазу.
Описание предшествующего уровня техники
Традиционно L-аминокислоты в промышленном масштабе могут быть получены методом ферментации с использованием штаммов микроорганизмов, полученных из природных источников, или их мутантов, специально модифицированных для того, чтобы увеличить продукцию L-аминокислот.
Описано множество методов увеличения продукции L-аминокислот, включая трансформацию микроорганизмов рекомбинантной ДНК (см., например, патент США 4,278,765). Другие методы увеличения продукции включают повышение активности ферментов, вовлеченных в биосинтез аминокислот, и/или уменьшение чувствительности целевого фермента к ингибированию по типу обратной связи продуцируемой L-аминокислотой (см., например, международную заявку WO 95/16042 или патенты США 4,346,170; 5,661,012 и 6,040,160).
Было показано, что мутанты Е.coli K-12, дефицитные по аденилатциклазе (Cya) и катаболитному белку-активатору (Crp) растут на минимальной глюкозной среде медленнее, чем их родительские штаммы. Скорость их роста заметно снижалась при повышенном значении рН - между 6 и 7.8. Было показано, что такая чувствительность к значению рН является прямым следствием мутации cya, поскольку мутация устойчивости к повышенному рН также восстанавливала способность к ферментации различных сахаров. Протонзависимый транспорт пролина и глутамата также снижался и был чувствителен к рН в cya-мутантах. Значение активности мембраносвязанной АТФазы было нормальным. Скорость поглощения клетками кислорода хотя и была снижена, но была не чувствительна к рН (Ahmad D, Newman ЕВ. J Bacteriol.; 170(8):3443-7(1988)).
Обнаружено, что дефицитные по аденилатциклазе (cya) мутанты Е.coli K-12 устойчивы к фосмидомицину, специфическому ингибитору не мевалонатного пути, как к фосфомицину. Мутанты Е.coli по glpT были устойчивы к фосфомицину, так же как и к фосмидомицину. Этот факт доказывает, что фосмидомицин траспортировался внутрь через глицерол-3-фосфатный транспортер, GlpT. Анализ с использованием микрочипов ДНК показал, что транскрипция glpT и других генов, имеющих отношение к утилизации глицерина, в значительной степени зависит от присутствия цАМФ (Sakamoto Y, et. al., Biosci Biotechnol Biochem.; 67(9):2030-3(2003)).
В настоящее время нет сообщений, описывающих использование бактерии, содержащей мутантную аденилатциклазу, для получения L-аминокислот.
Описание изобретения
Цели настоящего изобретения включают повышение продуктивности штаммов-продуцентов L-аминокислоты и предоставление способа получения неароматической или ароматической L-аминокислот с использованием этих штаммов.
Вышеупомянутые цели были достигнуты путем установления того факта, что мутация в аденилатциклазе может привести к повышению продукции L-аминокислот, таких как L-треонин, L-лизин, L-цистеин, L-метионин, L-лейцин, L-изолейцин, L-валин, L-гистидин, L-глицин, L-серин, L-аланин, L-аспарагин, L-аспарагиновая кислота, L-глутамин, L-глутаминовая кислота, L-пролин, L-аргинин, L-фенилаланин, L-тирозин и L-триптофан.
Настоящее изобретение предоставляет бактерию семейства Enterobacteriaceae, обладающую способностью к повышенной продукции аминокислот, таких как L-треонин, L-лизин, L-цистеин, L-метионин, L-лейцин, L-изолейцин, L-валин, L-гистидин, L-глицин, L-серин, L-аланин, L-аспарагин, L-аспарагиновая кислота, L-глутамин, L-глутаминовая кислота, L-пролин, L-аргинин, L-фенилаланин, L-тирозин и L-триптофан.
Целью настоящего изобретения является предоставление мутантной аденилатциклазы, выбранной из группы, состоящей из:
(A) белка, в котором L-лизин в положении, соответствующем положению 432 в SEQ ID NO:2, замещен другим аминокислотным остатком; и
(B) варианта белка (А), обладающего аденилатциклазной активностью.
Также целью настоящего изобретения является предоставление упомянутой мутантной аденилатциклазы, отличающейся тем, что L-лизин в положении, соответствующем положению 432 в SEQ ID NO:2, замещен L-глутамином.
Также целью настоящего изобретения является предоставление ДНК, кодирующей упомянутую мутантную аденилатциклазу.
Также целью настоящего изобретения является предоставление бактерии семейства Enterobacteriaceae, содержащей упомянутую ДНК.
Также целью настоящего изобретения является предоставление упомянутой бактерии, отличающейся тем, что указанная бактерия способна к продукции L-аминокислот.
Также целью настоящего изобретения является предоставление упомянутой бактерии, отличающейся тем, что указанная бактерия принадлежит к роду Escherichia.
Также целью настоящего изобретения является предоставление упомянутой бактерии, отличающейся тем, что указанная бактерия - Escherichia coli.
Также целью настоящего изобретения является предоставление способа получения L-аминокислоты, включающего выращивание упомянутой бактерии в питательной среде, содержащей в качестве единственного источника углерода этанол или глицерин, и выделение указанной L-аминокислоты из культуральной жидкости.
Также целью настоящего изобретения является предоставление упомянутого способа, отличающегося тем, что указанная L-аминокислота выбрана из группы, состоящей из ароматической L-аминокислоты и неароматической L-аминокислоты.
Также целью настоящего изобретения является предоставление упомянутого способа, отличающегося тем, что указанная ароматическая L-аминокислота выбрана из группы, состоящей из L-фенилаланина, L-тирозина и L-триптофана.
Также целью настоящего изобретения является предоставление упомянутого способа, отличающегося тем, что указанная неароматическая L-аминокислота выбрана из группы, состоящей из L-греонина, L-лизина, L-цистеина, L-метионина, L-лейцина, L-изолейцина, L-валина, L-гистидина, L-глицина, L-серина, L-аланина, L-аспарагина, L-аспартата, L-глутамина, L-глутаминовой кислоты, L-пролина и L-аргинина.
Более детально настоящее изобретение описано ниже.
Наилучший способ осуществления настоящего изобретения
1. Мутантная аденилатциклаза и кодирующий ее фрагмент ДНК согласно настоящему изобретению.
Ген cyaA (синонимы: ECK3800, b3806) кодирует белок Cya, аденилатциклазу (синоним В3806). Ген cyaA (нуклеотиды с 3,989,176 по 3,991,722; в последовательности с инвентарным номером NC_000913.2 в базе данных GenBank; gi; 49175990) расположен между геном hemC, ориентированным в противоположном направлении, и геном cyaY, ориентированным в противоположном направлении, на хромосоме Е.coli штамма K-12. Нуклеотидная последовательность гена cyaA и аминокислотная последовательность белка Cya, кодируемого геном cyaA, приведены в Перечне последовательностей под номерами SEQ ID NO:1 и SEQ ID NO:2, соответственно.
Фраза "активность аденилатциклазы" означает активность, катализирующую синтез циклической АМФ (сАМР) путем внутримолекулярного переноса аденилильной группы АТФ на 3'-гидроксигруппу с высвобождением пирофосфата. Активность аденилатциклазы может быть определена, например, с использованием метода, описанного Yang J.K. and Epstein W. (J Biol Chem.; 258(6):3750-8(1983)).
Аденилатциклаза с заменой аминокислотного остатка, соответствующего положению 432 в SEQ ID NO:2, может быть упомянута как "мутантная аденилатциклаза", ДНК, кодирующая мутантную аденилатциклазу, может быть упомянута как "мутантный ген cyaA" или "мутантный ген аденилатциклазы", а аденилатциклаза без замены может быть упомянута как "аденилатциклаза дикого типа".
Согласно настоящему изобретению, "остаток L-аминокислоты, соответствующий положению 432" означает аминокислотный остаток, соответствующий аминокислотному остатку в положении 432 в аминокислотной последовательности SEQ ID NO:2.
Положение аминокислотного остатка может меняться. Например, если в N-концевой области имеет место вставка аминокислотного остатка, аминокислотный остаток, изначально локализованный в положении 432, оказывается в положении 433. В таком случае аминокислотный остаток, соответствующий изначальному положению 432, обозначается как аминокислотый остаток в положении 432 согласно настоящему изобретению.
Для определения остатка L-аминокислоты, соответствующего мутации 432 аденилатциклазы, необходимо сделать выравнивание аминокислотной последовательности аденилатциклазы из Е.coli и аминокислотной последовательности аденилатциклазы из представляющей интерес бактерии и определить L-аминокислоту, соответствующую номеру 432 в аденилатциклазе из представляющей интерес бактерии.
Поскольку у представителей различных родов и штаммов семейства Enterobacteriaceae возможны некоторые вариации в нуклеотидных последовательностях, понятие гена суаА не ограничивается геном, последовательность которого приведена в Перечне последовательностей под номером SEQ ID No:1, но также может включать и гомологичные ему гены. Следовательно, вариант белка, кодируемый геном суаА, может иметь гомологию не менее 80%, предпочтительно не менее 90%, и наиболее предпочтительно не менее 95%, с полной аминокислотной последовательностью SEQ ID NO:2 при условии сохранения активности белка Cya. Термин "вариант белка", используемый в настоящем изобретении, означает белок с изменениями в последовательности, будь то делеции, вставки, добавления или замены аминокислот. Число изменений в варианте белка зависит от положения или типа аминокислотного остатка в третичной структуре белка. Оно может быть от 1 до 30, предпочтительно от 1 до 15, более предпочтительно от 1 до 5 в SEQ ID NO:2. Данные изменения в вариантах могут иметь место в областях, не критичных для третичной структуры белка. Данные изменения возможны потому, что некоторые аминокислоты имеют высокую гомологию друг другу, поэтому такие изменения не влияют на третичную структуру.
Гомология между двумя аминокислотами последовательностями может быть определена с использованием известных методов, например, компьютерной программы BLAST 2.0, которая считает три параметра: число аминокислот, идентичность и сходство.
Замена, делеция, вставка или добавление одного или нескольких аминокислотных остатков должны быть консервативными мутациями, при которых сохраняется активность белка. Типичной консервативной мутацией является консервативная замена. Примеры консервативной замены включают: замену Ala на Ser или Thr, замену Arg на Gln, His или Lys, замену Asn на Glu, Gln, Lys, His или Asp, замену Asp на Asn, Glu или Gln, замену Cys на Ser или Ala, замену Gln на Asn, Glu, Lys, His, Asp или Arg, замену Glu на Asn, Gln, Lys или Asp, замену Gly на Pro, замену His на Asn, Lys, Gln, Arg или Tyr, замену Ile на Leu, Met, Val или Phe, замену Leu на Ile, Met, Val или Phe, замену Lys на Asn, Glu, Gln, His или Arg, замену Met на Ile, Leu, Val или Phe, замену Phe на Trp, Tyr, Met, Ile или Leu, замену Ser на Thr или Ala, замену Thr на Ser или Ala, замену Trp на Phe или Tyr, замену Tyr на His, Phe или Trp, и замену Val на Met, Ile или Leu.
Поэтому ген cyaA может быть вариантом, который гибридизуется в жестких условиях с нуклеотидной последовательностью, приведенной в Перечне последовательностей под номером SEQ ID NO:1, или с зондом, который может быть синтезирован на основе указанной нуклеотидной последовательности. «Жесткие условия» включают такие условия, при которых специфические гибриды, например, гибриды с гомологией не менее 80%, предпочтительно не менее 90%, более предпочтительно не менее 95%, еще более предпочтительно не менее 97%, и наиболее предпочтительно не менее 98%, образуются, а неспецифические гибриды, например, гибриды с меньшей гомологией, чем указано выше, - не образуются. Практическим примером жестких условий является однократная отмывка, предпочтительно двух- или трехкратная, при концентрации солей 1×SSC, 0.1% SDS, предпочтительно 0.1×SSC, 0.1% SDS, при 60°С. Продолжительность отмывки зависит от типа используемой для блоттинга мембраны и, как правило, такова, как рекомендовано производителем. Например, рекомендуемая продолжительность отмывки для нейлоновой мембраны Hybond™ N+ (Amersham) при строгих условиях - 15 минут. Предпочтительна двухтрехкратная отмывка. Длина зонда может быть выбрана в зависимости от условий гибридизации, обычно она составляет от 100 п.н. до 1 т.п.н.
Методы приготовления плазмидной ДНК, рестрикции и лигирования ДНК, трансформации, выбора нуклеотидов в качестве праймера и т.п. могут быть обычными методами, известными специалисту в этой области. Эти методы описаны, например, в Sambrook, J., Fritsch, E.F., and Maniatis, Т., "Molecular Cloning: A Laboratory Manual, Second Edition", Cold Spring Harbor Laboratory Press (1989).
1. Бактерия согласно настоящему изобретению
Бактерия согласно настоящему изобретению - это бактерия-продуцент L-аминокислоты семейства Enterobacteriaceae, содержащая мутантную аденилатциклазу.
Бактерия согласно настоящему изобретению может быть получена путем введения в клетку бактерии фрагмента ДНК, кодирующего мутантную аденилатциклазу согласно настоящему изобретению.
Согласно настоящему изобретению, «бактерия-продуцент L-аминокислоты» означает бактерию, обладающую способностью к продукции и выделению L-аминокислоты в питательную среду, когда указанная бактерия выращивается в указанной питательной среде.
Используемый здесь термин «бактерия-продуцент L-аминокислоты» также означает бактерию, которая способна к продукции L-аминокислоты и вызывает накопление L-аминокислоты в ферментационной среде в количествах, больших по сравнению с природным или родительским штаммом Е.coli, таким как штамм Е.coli K-12, и предпочтительно означает, что указанный микроорганизм способен накапливать в среде целевую L-аминокислоту в количестве не менее чем 0.5 г/л, более предпочтительно, не менее чем 1.0 г/л. Термин «L-аминокислота» включает в себя. Градации, L-аргинин, L-аспарагин, L-аспарагиновую кислоту, L-цистеин, L-глутаминовую кислоту, L-глутамин, L-глицин, L-гистидин, L-изолейцин, L-лейцин, L-лизин, L-метионин, L-фенилаланин, L-пролин, L-серин, L-треонин, L-триптофан, L-тирозин и L-валин.
Термин «ароматическая L-аминокислота» включает в себя L-фенилаланин, L-тирозин и L-триптофан. Термин «неароматическая L-аминокислота» включает в себя L-треонин, L-лизин, L-цистеин, L-метионин, L-лейцин, L-изолейцин, L-валин, L-гистидин, L-глицин, L-серин, L-аланин, L-аспарагин, L-аспартат, L-глутамин, L-глутаминовую кислоту, L-пролин и L-аргинин. Наиболее предпочтительны L-треонин, L-лизин, L-цистеин, L-лейцин, L-гистидин, L-глутаминовая кислота, L-фенилаланин, L-триптофан, L-пролин и L-аргинин.
Семейство Enterobacteriaceae включает в себя бактерии, принадлежащие к родам Escherichia, Enterobacter, Erwinia, Klebsiella, Pantoea, Photorhabdus, Providencia, Salmonella, Serratia, Shigella, Morganella, Yersinia и т.д. Более конкретно, могут быть использованы бактерии, классифицируемые как принадлежащие к семейству Enterobacteriaceae в соответствии с таксономией, используемой в базе данных NCBI (National Center for Biotechnology Information) (http://www.ncbi.nlm.nih.gov/htbinpost/Taxonomy/wgetorg?mode=Tree&id=1236&lvl=3&keep=1&srchmode=1&unlock). Предпочтительна бактерия, принадлежащая к роду Escherichia или Pantoea.
Термин "бактерия, принадлежащая к роду Escherichia" означает, что бактерия относится к роду Escherichia в соответствии с классификацией, известной специалисту в области микробиологии. В качестве примера микроорганизма, принадлежащего к роду Escherichia, использованного в настоящем изобретении, может быть упомянута бактерия Escherichia coli (E.coli).
Круг бактерий, принадлежащих к роду Escherichia, которые могут быть использованы в настоящем изобретении, не ограничен каким-либо образом, однако, например, бактерии, описанные в книге Neidhardt, F.C. et al. (Escherichia coli and Salmonella typhimurium,. American Society for Microbiology, Washington D.C., 1208, Таблица 1), могут быть включены в число бактерий согласно настоящему изобретению.
Термин «бактерия, принадлежащая к роду Pantoea» означает, что бактерия относится к роду Pantoea в соответствии с классификацией, известной специалисту в области микробиологии. Недавно несколько видов Enterobacter agglomerans были классифицированы как Pantoea agglomerans, Pantoea ananatis, Pantoea stewartii или подобные им, на основе анализа нуклеотидной последовательности 16S рРНК и т.д. (Int. J. Syst. Bacteriol., 43, 162-173 (1993)).
Бактерия-продуцент L-аминокислоты
В качестве бактерии согласно настоящему изобретению, имеющей мутацию в гене cyaA, может использоваться бактерия, способная к продукции ароматической или неароматической L-аминокислоты.
Бактерия согласно настоящему изобретению может быть получена путем введения мутации в гене cyaA в бактерию, уже обладающую способностью к продукции L-аминокислот. С другой стороны, бактерия согласно настоящему изобретению может быть получена путем придания способности к продукции L-аминокислот бактерии, в которой уже имеется мутация в гене cyaA.
Предпочтительно, чтобы в бактерии настоящего изобретения была увеличена способность к ассимиляции глицерина или этанола.
Для увеличения способности к ассимиляции глицерина в бактерии может быть ослаблена экспрессия гена glpR (EP 1715056) или усилена экспрессия генов метаболизма глицерина (EP 1715055 А), таких как glpA, glpB, glpC, glpD, glpE, glpF, glpG, glpK, glpQ, glpT, glpX, tpiA, gldA, dhaK, dhaL, dhaM, dhaR, fsa и talC. Предпочтительно может быть усилена экспрессия гена, кодирующего мутантную глицеринкиназу, устойчивую к ингибированию фруктозо-1,6-бифосфатом (Pettigrew, D. W., Liu, W. Z., Holmes, С., Meadow, N. D., and Roseman, S., J. Bacteriol. 178, 10, 2846-52 (1996), Honisch, C. et. al., Genome Reseasch, 14: 2495-2502 (2004), WO 2008/081959 и WO 2008/107277). Кроме того, могут быть увеличены активность глицериндегидрогеназы и активность дигидроксиацетонкиназы (WO 2008/102861).
Для увеличения ассимилируемости этанола в бактерии модифицировали ген, кодирующий алкогольдегидрогеназу (adhE) с целью экспрессии под контролем ненативного промотора, функционирующего в аэробных условиях культивирования (WO 2008/010565).
В настоящем изобретении бактериальный штамм, используемый для получения L-аминокислоты, модифицирован таким образом, что экспрессия гена adhE контролируется ненативным промотором, например, промотором, который не контролирует экспрессию гена adhE в штамме дикого типа. Такая модификация может быть достигнута путем замещения нативного промотора гена adhE на хромосоме ненативным промотором, функционирующим в аэробных условиях культивирования, так чтобы ген adhE gene оказался функционально связанным с этим ненативным промотором. В качестве ненативного промотора, функционирующего в аэробных условиях культивирования, может быть использован любой промотор который может обеспечить экспрессию гена adhE на уровне, выше определенного, в аэробных условиях культивирования. Что касается уровня белка AdhE в настоящем изобретении, активность алкогольдегидрогеназы в экстракте свободных клеток, определенная методом Clark and Cronan (J. Bacteriol. 141 177-183 (1980)), должна быть 1.5 Ед или выше, предпочтительно 5 Ед или выше, и более предпочтительно 10. 5 Ед или выше (на мг белка). Аэробные условия культивирования могут быть такими, какие обычно используются для культивирования бактерий, когда поступление кислорода достигается такими способами как встряхивание, аэрация и перемешивание. Конкретно может использоваться любой промотор, о котором известно, что он обеспечивает экспрессию гена в аэробных условиях культивирования. Например, могут использоваться промоторы генов, вовлеченных в гликолиз, пентозофосфатный путь, цикл трикарбоновых кислот, пути биосинтеза аминокислот и т.д.. Кроме того, известны как сильные промоторы, функционирующие в аэробных условиях культивирования, следующие: Ptac промотор, lac промотор, trp промотор, trc промотор, PR или PL промоторы фага λ, их и предпочтительно использовать.
Алкогольдегидрогеназа дикого типа может быть подвержена катализируемому металлами окислению. Хотя такая алкогольдегидрогеназа дикого типа и может использоваться, в настоящем изобретении предпочтительно использовать мутантную алкогольдегидрогеназу, устойчивую к аэробной инактивации. Фраза "мутантная алкогольдегидрогеназа, устойчивая к аэробной инактивации" означает, что мутантная алкогольдегидрогеназа в аэробных условиях сохраняет свою активность или активность снижается в меньшей степени по сравнению с алкогольдегидрогеназой дикого типа. В качестве примера мутантной алкогольдегидрогеназы, устойчивой к аэробной инактивации, можно использовать следующие:
a) белок, в котором глутаминовая кислота в положении, соответствующем положению 568 в ADH из Е.coli, замещена другим аминокислотным остатком, таким как лизин (WO2008/010565).
b) белок, в котором глутаминовая кислота в положении, соответствующем положению 560 в ADH из Е.coli, замещена другим аминокислотным остатком, таким как лизин.
c) белок, в котором фенилаланин в положении, соответствующем положению 566 в ADH из Е.coli, замещен другим аминокислотным остатком, таким как валин.
d) белок, в котором остаток глутаминовой кислоты, остаток метионина, остаток тирозина, остаток изолейцина и остаток аланина в положениях, соответствующих положениям 22, 236, 461, 554 и 786, соответственно, в ADH из Е.coli, замещены другими аминокислотными остатками, например, остатком глицина, остатком валина, остатком цистеина, остатком серина и остатком валина, соответственно;
e) их комбинация.
Бактерия-продуцент L-треонина
Примеры родительского штамма для получения бактерии-продуцента L-треонина согласно настоящему изобретению, включают, но не ограничиваются штаммами, принадлежащими к роду Escherichia, такими как штамм Е.coli TDH-6/pVIC40 (ВКПМ В-3996) (патенты США 5175107 и 5705371), штамм Е.coli NRRL-21593 (патент США 5939307), штамм Е.coli FERM ВР-3756 (патент США 5474918), штаммы Е.coli FERM ВР-3519 и FERM ВР-3520 (патент США 5376538), штамм Е.coli MG442 (Гусятинер и др., Генетика, 14, 947-956 (1978)), штаммы Е.coli VL643 и VL2055 (Европейская патентная заявка ЕР 1149911 А) и подобными им.
Штамм TDH-6 является дефицитным по гену thrC, способен ассимилировать сахарозу и содержит ген ilvA с мутацией типа "leaky". Указанный штамм содержит мутацию в гене rhtA, которая обуславливает устойчивость к высоким концентрациям треонина и гомосерина. Штамм В-3996 содержит плазмиду pVIC40, которая была получена путем введения в вектор, производный от вектора RSF1010, оперона thrA*BC, включающего мутантный ген thrA, кодирующий аспартокиназа-гомосериндегидрогеназу I, у которой существенно снижена чувствительность к ингибированию треонином по типу обратной связи. Штамм В-3996 был депонирован 19 ноября 1987 года во Всесоюзном научном центре антибиотиков (РФ, 117105 Москва, Нагатинская ул., 3-А) с инвентарным номером РИА 1867. Указанный штамм также был депонирован во Всероссийской коллекции промышленных микроорганизмов (ВКПМ) (РФ, 117545 Москва, 1-й Дорожный проезд, 1) 7 апреля 1987 г. с инвентарным номером В-3996.
В качестве родительского штамма для получения бактерии-продуцента L-треонина согласно настоящему изобретению также может быть использован штамм Е.coli ВКПМ В-5318 (Европейская заявка 0593792 В). Штамм В-5318 является прототрофным относительно изолейцина, и чувствительный к температуре С1 репрессор фага λ и PR-промотор замещает регуляторную область в треониновом опероне на плазмиде pVIC40. Штамм ВКПМ В-5318 депонирован во Всероссийской коллекции промышленных микроорганизмов (ВКПМ) (РФ, 117545 Москва, 1-й Дорожный проезд, 1) 3 мая 1990 г. с инвентарным номером В-5318.
Предпочтительно, чтобы бактерия согласно настоящему изобретению была далее модифицирована таким образом, чтобы иметь повышенную экспрессию одного или нескольких следующих генов:
- мутантного гена thrA, кодирующего аспартокиназа-гомосериндегидрогеназу I, устойчивую к ингибированию треонином по типу обратной связи;
- гена thrB, кодирующего гомосеринкиназу;
- гена thrC, кодирующего треонинсинтазу;
- гена rhtA, предположительно кодирующего трансмембранный белок;
- гена asd, кодирующего аспартат-β-семиальдегиддегидрогеназу, и
- гена aspC, кодирующего аспартатаминотрансферазу (аспартаттрансаминазу).
Нуклеотидная последовательность гена thrA, кодирующего аспартокиназа-гомосериндегидрогеназу I из Escherichia coli, известна (номера нуклеотидов с 337 по 2799 в последовательности с инвентарным номером NC_000913.2 в базе данных GenBank, gi: 49175990). Ген thrA расположен на хромосоме штамма Е.coli K-12 между генами thrL и thrB. Нуклеотидная последовательность гена thrB, кодирующего гомосеринкиназу из Escherichia coli, известна (номера нуклеотидов с 2801 по 3733 в последовательности с инвентарным номером NC_000913.2 в базе данных GenBank, gi: 49175990). Ген thrB расположен на хромосоме штамма Е.coli K-12 между генами thrA и thrC. Нуклеотидная последовательность гена thrC, кодирующего треонинсинтазу из Escherichia coli, известна (номера нуклеотидов с 3734 по 5020 в последовательности с инвентарным номером NC_000913.2 в базе данных GenBank, gi: 49175990). Ген thrC расположен на хромосоме штамма Е.coli K-12 между геном thrB и открытой рамкой считывания уааХ. Все три указанных гена функционируют как один треониновый оперон. Для усиления экспрессии треонинового оперона желательно удалить из оперона область аттенюатора, который влияет на транскрипцию (заявка РСТ WO2005/049808, заявка РСТ WO2003/097839).
Мутантный ген thrA, кодирующий аспартокиназу-гомосериндегидрогеназу I, устойчивую к ингибированию треонином по типу обратной связи, так же как и гены thrB и thrC, может быть получен в виде единого оперона из хорошо известной плазмиды pVIC40, которая представлена в штамме-продуценте Е.coli ВКПМ В-3996. Плазмида pVIC40 подробно описана в патенте США 5705371.
Ген rhtA расположен на 18 минуте хромосомы Е.coli около оперона glnHPQ, который кодирует компоненты транспортной системы глутамина, ген rhtA идентичен ORF1 (ген ybiF, номера нуклеотидов с 764 по 1651 в последовательности с инвентарным номером ААА218541 в базе данных GenBank, gi:440181), расположен между генами рехВ и ompX. Участок ДНК, экспрессирующийся с образованием белка, кодируемого рамкой считывания ORF1, был назван геном rhtA (rht: resistance to homoserine and threonine). Также было показано, что мутация rhtA23 представляет собой замену А-на-G в положении -1 по отношению к старт кодону ATG (тезисы 17th International Congress of Biochemistry and Molecular Biology, тезисы 1997 Annual Meeting of the American Society for Biochemistry and Molecular Biology, San Francisco, California August 24-29, 1997, abstract No. 457; Европейская заявка ЕР 1013765 A).
Нуклеотидная последовательность гена asd из E.coli известна (номера нуклеотидов с 3572511 по 3571408 в последовательности с инвентарным номером NC_000913.1 в базе данных GenBank, gi: 16131307) и может быть получена с помощью ПЦР (полимеразная цепная реакция; ссылка на White, T.J. et al., Trends Genet., 5, 185 (1989)) с использованием праймеров, синтезированных на основе нуклеотидной последовательности указанного гена. Гены asd из других микроорганизмов могут быть получены сходным образом.
Также нуклеотидная последовательность гена aspC из Е.coli известна (номера нуклеотидов с 983742 по 984932 в последовательности с инвентарным номером NC_000913.1 в базе данных GenBank, gi:16128895) и может быть получена с помощью ПЦР. Гены aspC из других микроорганизмов могут быть получены сходным образом.
Бактерия-продуцент L-лизина
Примеры бактерий-продуцентов L-лизина, принадлежащих к роду Escherichia, включают мутанты, обладающие устойчивостью к аналогу L-лизина. Аналог L-лизина ингибирует рост бактерий, принадлежащих к роду Escherichia, но это ингибирование полностью или частично снимается, когда в среде также присутствует L-лизин. Примеры аналога L-лизина включают, но не ограничиваются оксализином, лизингидроксаматом, S-(2-аминоэтил)-L-цистеином (АЕС), γ-метиллизном, α-хлорокапролактамом и так далее. Мутанты, обладающие устойчивостью к указанным аналогам лизина могут быть получены путем обработки бактерий, принадлежащих к роду Escherichia, традиционными мутагенами. Конкретные примеры бактериальных штаммов, используемых для получения L-лизина, включают штамм Escherichia coli AJ11442 (FERM BP-1543, NRRL В-12185; смотри патент США 4346170) и штамм Escherichia coli VL611. В этих микроорганизмах аспартокиназа устойчива к ингибированию L-лизином по принципу обратной связи.
Штамм WC196 может быть использован в качестве бактерии-продуцента L-лизина Escherichia coli. Данный бактериальный штамм был получен путем селекции фенотипа устойчивости к АЕС у штамма W3110, производного от штамма Escherichia coli K-12. Полученный штамм был назван Escherichia coli AJ13069 и был депонирован в Национальном Институте Биологических Наук и Человеческих Технологий, Агенство Промышленной Науки и Технологии, Министерство Международной Торговли и Промышленности (National Institute of Bioscience and Human-Technology, Agency of Industrial Science and Technology, Ministry of International Trade and Industry), в настоящее время называющийся Национальный Институт Прогрессивной Промышленной Науки и Технологии, Международный Депозитарий Организмов для Целей Патентования, Централ 6, 1-1, Хигаши 1-Чоме, Тсукуба-ши, Ибараки-кен, 305-8566, Япония (National Institute of Advanced Industrial Science and Technology, International Patent Organism Depositary, Central 6, 1-1, Higashi 1-Chome, Tsukuba-shi, Ibaraki-ken, 305-8566, Japan), 6 декабря 1994 года и получил инвентарный номер FERM Р-14690. Затем было произведено международное депонирование этого штамма согласно условиям Будапештского Договора 29 сентября 1995 года, и штамм получил инвентарный номер FERM BP-5252 (патент США 5827698).
Примеры родительских штаммов для получения бактерий, продуцирующих L-лизин, согласно настоящему изобретению, также включают штаммы, в которых усилена экспрессия одного или нескольких генов, кодирующих ферменты биосинтеза L-лизина. Примеры ферментов, вовлеченных в биосинтез L-лизина, включают, но не ограничиваются ими, дигидродипиколинатсинтазу (dapA), аспартокиназу (lysC), дигидродипиколинатредуктазу (dapB), диаминопимелатдекарбоксилазу (lysA), диаминопимелатдегидрогеназу (ddh) (патент США. 6,040,160), фосфоенолпируваткарбоксилазу (ррс), аспартатсемиальдегиддегидрогеназу (asd), никотинамидадениндинуклеотидтрансгидрогеназу (pntAB) и аспартазу (aspA) (европейская заявка ЕР 1253195 А). Кроме того, родительские штаммы могут иметь повышенный уровень экспрессии гена, вовлеченного в процесс дыхания (cyo) (европейская заявка ЕР 1170376 А), гена, кодирующего никотинамиднуклеотидтрансгидрогеназу (pntAB) (патент США 5,830,716), гена ybjE (заявка РСТ WO2005/073390), или комбинации этих генов.
Примеры родительских штаммов для получения бактерий, продуцирующих L-лизин, согласно настоящему изобретению, также включают штаммы, в которых снижена или отсутствует активность ферментов, которые катализируют реакции образования отличных от L-лизина соединений, ответвляющихся от основного пути биосинтеза L-лизина. Примеры ферментов, которые катализируют реакции образования отличных от L-лизина соединений, ответвляющихся от основного пути биосинтеза L-лизина, включают гомосериндегидрогеназу, лизиндекарбоксилазу (патент США 5,827,698) и малатдегидрогеназу (заявка РСТ WO2005/010175).
Бактерия-продуцент L-цистеина
Примеры родительских штаммов, используемых для получения бактерии-продуцента L-цистеина согласно настоящему изобретению, включают в себя, но не ограничиваются штаммами, принадлежащими к роду Escherichia, такими как штамм Е.coli JM 15, трансформированный различными аллелями гена cysE, кодирующими устойчивые к ингибирбтванию по типу обратной связи серинацетилтрансферазы (патент США 6218168, патентная заявка РФ 2003121601); штамм Е.coli W3110, содержащий сверхэкспрессированные гены, кодирующие белок, способный к секреции соединений, токсичных для клетки (патент США 5972663); штаммы Е.coli, содержащие цистеиндесульфогидразу со сниженной активностью (патент Японии JP11155571A2); штамм Е.coli W3110 с повышенной активностью позитивного транскрипционного регулятора цистеинового регулона, кодируемого геном cysB (международная заявка РСТ WO 0127307 А1) и подобные им.
Бактерия-продуцент L-лейцина
Примеры родительских штаммов, используемых для получения бактерии-продуцента L-лейцина согласно настоящему изобретению, включают в себя, но не ограничиваются штаммами, принадлежащими к роду Escherichia, такими как штаммы Е.coli, устойчивые к аналогам лейцина, включающих, например, β-2-тиенилаланин, 3-гидроксилейцин, 4-азалейцин и 5,5,5-трифлуоролейцин (выложенные патентные заявки Японии 62-34397 и 8-70879), штаммы Е.coli, полученные с помощью генно-инженерных методов, описанных в заявке РСТ 96/06926; Е.coli штамм Н-9068 (JP8-70879A), и подобные им.
Бактерия согласно настоящему изобретению может быть улучшена путем усиления экспрессии одного или нескольких генов, вовлеченных в биосинтез L-лейцина. Примеры таких генов включают в себя гены оперона leuABCD, и предпочтительно представлены мутантным геном leuA, кодирующим изопропилмалатсинтазу со снятым ингибированием L-лейцином по типу обратной связи (патент США 6403342). Кроме того, бактерия согласно настоящему изобретению может быть улучшена путем усиления экспрессии одного или нескольких генов, кодирующих белки, которые экспортируют L-аминокислоту из бактериальной клетки. Примеры таких генов включают в себя гены b2682 и b2683 (гены ygaZH) (европейская заявка ЕР 1239041 А2).
Бактерия-продуцент L-гистидина
Примеры родительских штаммов, используемых для получения бактерии-продуцента L-гистидина согласно настоящему изобретению, включают в себя, но не ограничиваются бактериями-продуцентами L-гистидина, принадлежащими к роду Escherichia, такими как штамм Е.coli 24 (ВКПМ В-5945, патент РФ 2003677); штамм Е.coli 80 (ВКПМ В-7270, патент РФ 2119536); штаммы Е.coli NRRL В-12116 - В12121 (патент США 4388405); штаммы Е.coli Н-9342 (FERM ВР-6675) и Н-9343 (PERM ВР- 6676) (патент США 6344347); штамм Е.coli H-9341 (PERM BP-6674) (Европейский патент 1085087); штамм Е.coli AI80/pFM201 (патент США 6258554) и подобными им.
Примеры родительских штаммов для получения бактерий, продуцирующих L-гистидин, согласно настоящему изобретению, также включают штаммы, в которых усилена экспрессия одного или нескольких генов, кодирующих ферменты биосинтеза L-гистидина. Примеры таких генов включают гены, кодирующие АТФ-фосфорибозилтрансферазу (hisG), фосфорибозил-АМФ-циклогидролазу (hisI), фосфорибозил-АТФ- фосфогидролазу (hisIE), фосфорибозилформимино-5-аминоимидазолкарбоксамидриботидизомеразу (hisA), амидотрансферазу (hisH), гистидинолфосфатаминотрансферазу (hisC), гистидинолфосфатазу (hisB), гистидинолдегидрогеназу (hisD) и т.д.
Известно, что гены, кодирующие ферменты биосинтеза L-гистидина (hisG, hisBHAFI), ингибируются L-гистидином, поэтому способность к продукции L-гистидина также может быть значительно усилена введением мутации, придающей устойчивость к ингибированию по типу обратной связи, в ген АТФ-фосфорибозидтрансферазы (hisG) (патенты РФ. 2003677 и 2119536).
Специфические примеры штаммов, обладающих способностью к продукции L-гистидина, включают Е.coli FERM-P 5038 и 5048, в которые был введен вектор, содержащий ДНК, кодирующую фермент биосинтеза L-гистидина (заявка Японии 56-005099 А), штаммы E.coli, в которые введен ген rht, для экспорта аминокислоты (европейская заявка ЕР 1016710 А), штамм Е.coli 80, которому придана устойчивость к сульфагуанидину, DL-1,2,4-триазол-3-аланину и стрептомицину (ВКПМ В-7270, патент РФ. 2119536), и т.д.
Бактерия-продуцент L-глутаминовой кислоты
Примеры родительских штаммов, используемых для получения бактерии-продуцента L-глутаминовой кислоты согласно настоящему изобретению, включают в себя, но не ограничиваются штаммами, принадлежащими к роду Escherichia, такими как штамм Е.coli VL334 thrC+ (Европейский патент ЕР 1172433). Штамм Е.coli VL334 (ВКПМ В-1641) является ауксотрофом по L-изолейцину и L-треонину с мутациями в генах thrC и ilvA (патент США 4278765). В этот штамм была перенесена природная аллель гена thrC методом общей трансдукции с использованием бактериофага Р1, выращенного на клетках природного штамма Е.coli K12 (ВКПМ В-7). В результате был получен штамм, ауксотроф по L-изолейцину, VL334thrC+ (ВКПМ В-8961), который обладает способностью к продукции L-глутаминовой кислоты.
Примеры родительских штаммов, используемых для получения бактерии-продуцента L-глутаминовой кислоты, согласно настоящему изобретению, включают в себя, но не ограничиваются ими, штаммы, в которых усилена экспрессия одного или нескольких генов, кодирующих ферменты биосинтеза L-глутаминовой кислоты. Примеры таких ферментов включают глутаматдегидрогеназу (gdh), глутаминсинтетазу (glnA), глутаматсинтетазу (gltAB), изоцитратдегидрогеназу (icdA), аконитатгидратазу (acnA, acnB), цитратсинтазу (gltA), фосфоенолпируваткарбоксилазу (ррс), пируватдегидрогеназу (aceEF, lpdA), пируваткиназу (pykA, pykF), фосфоенолпируватсинтазу (ppsA), енолазу (eno), фосфоглицеромутазу (pgmA, pgmI), фосфоглицераткиназу (pgk), глицеральдегид-3-фосфатдегидрогеназу (gapA), триозофосфатизомеразу (tpiA), фруктозобифосфатальдолазу (fbp), фосфофруктокиназу (pfkA, pfkB) и глюкозофосфатизомеразу (pgi).
Примеры штаммов, модифицированных таким образом, что усилена экспрессия гена цитратсинтетазы, гена фосфоенолпируваткарбоксилазы и/или гена глутаматдегидрогеназы, включают описанные в европейских заявках ЕР1078989А, ЕР955368А и ЕР952221А.
Примеры штаммов, модифицированных таким образом, что ослаблена экспрессия гена цитратсинтетазы и/или гена фосфоенолпируваткарбоксилазы и/или недостаточна активность α-кетоглутаратдегидрогеназы, включают описанные в европейских заявках ЕР1078989А, ЕР955368А и ЕР952221А.
Примеры родительских штаммов для получения продуцирующих L-глутаминовую кислоту бактерий, согласно настоящему исследованию, также включают штаммы, в которых снижена или отсутствует активность ферментов, которые катализируют синтез отличных от L-глутаминовой кислоты соединений, ответвляющихся от основного пути биосинтеза L-глутаминовой кислоты. Примеры таких ферментов включают изоцитратлиазу, α-кетоглутаратдегидрогеназу, фосфотрансацетилазу, ацетаткиназу, синтазу ацетогидроксикислот, ацетолактатсинтазу, форматацетилтрансферазу, лактатдегидрогеназу и глутаматдекарбоксилазу. Бактерии, принадлежащие к роду Escherichia, лишенные активности α-кетоглутаратдегидрогеназы или обладающие сниженной активностью α-кетоглутаратдегидрогеназы и способы их получения описаны в патентах США 5,378,616 и 5,573,945. Конкретно, примеры таких штаммов включают в себя следующие штаммы:
E.coli W3110sucA::KmR
Е.coli AJ12624 (FERM ВР-3853)
Е.coli AJ12628(PERM BP-3854)
E.coli AJ12949 (FERM BP-4881)
E.coli W3110sucA::KmR - это штамм, полученный в результате разрушения гена α-кетоглутаратдегидрогеназы (далее называемого "ген sucA") в штамме E.coli W3110. У этого штамма активность α-кетоглутаратдегидрогеназы отсутствует полностью.
Другие примеры бактерии-продуцента L-глутаминовой кислоты включают в себя бактерии, принадлежащие к роду Escherichia и обладающие устойчивостью к антиметаболитам аспарагиновой кислоты и дефицитные по активности α-кетоглутаратдегидрогеназы, например, штамм AJ13199 (FERM BP-5807) (патент США 5,908,768), или штамм FERM P-12379, дополнительно обладающий низкой активностью по расщеплению L-глутаминовой кислоты (патент США 5,393,671); штамм E.coli AJ13138 (FERM BP-5565) (патент США 6,110,714) и подобные им.
Примеры бактерии-продуцента L-глутаминовой кислоты включают в себя мутантные штаммы, принадлежащие к роду Pantoea, которые лишены активности α-кетоглутаратдегидрогеназы или имеют сниженную активность α-кетоглутаратдегидрогеназы, и могут быть получены описанным выше способом. Примерами таких штаммов являются штамм Pantoea ananatis AJ13356 (патент США 6,331,419), штамм Pantoea ananatis AJ13356, депонированный в Национальном Институте Биологических Наук и Человеческих Технологий, Агенство Промышленной Науки и Технологии, Министерство Международной Торговли и Промышленности (National Institute of Bioscience and Human-Technology, Agency of Industrial Science and Technology, Ministry of International Trade and Industry) (в настоящее время называющийся Национальный Институт Прогрессивной Промышленной Науки и Технологии, Международный Депозитарий Организмов для Целей Патентования, Централ 6, 1-1, Хигаши 1-Чоме, Тсукуба-ши, Ибараки-кен, 305-8566, Япония - National Institute of Advanced Industrial Science and Technology, International Patent Organism Depositary, Central 6, 1-1, Higashi 1-Chome, Tsukuba-shi, Ibaraki-ken, 305-8566, Japan) 19 февраля, 1998 и получивший инвентарный номер FERM Р-16645. Затем было произведено международное депонирование этого штамма согласно условиям Будапештского Договора от 11 января 1999 г., и штамм получил инвентарный номер FERM BP-6615. Штамм Pantoea ananatis AJ13356 не имеет α-KGDH активности в результате разрушения гена αKGDH-E1 субъединицы (sucA). Вышеупомянутый штамм при выделении был идентифицирован как Enterobacter agglomerans и депонирован как штамм Enterobacter agglomerans AJ13356. Тем не менее, позднее он был классифицирован как Pantoea ananatis на основе нуклеотидной последовательности 16S рРНК и других доказательств. Несмотря на то, что штамм AJ13356, был депонирован в указанный выше депозитарий как Enterobacter agglomerans, для целей данного описания он будет упоминаться как Pantoea ananatis.
Бактерия-продуцент L-фенилаланина
Примеры родительских штаммов, используемых для получения бактерии-продуцента L-фенилаланина согласно настоящему изобретению, включают в себя, но не ограничиваются штаммами, принадлежащими к роду Escherichia, такими как штамм AJ12739 (tyrA::Tn10, tyrR) (ВКМП В-8197); штамм HW1089 (АТСС-55371), содержащий ген pheA34 (патент США 5354672); мутантный штамм MWEC101-b (KR8903681); штаммы NRRL B-12141, NRRL B-12145, NRRL В-12146 и NRRL В-12147 (патент США 4407952) и подобные им. Также в качестве родительских штаммов могут быть использованы бактерии, принадлежащие к роду Escherichia, - продуценты L-фенилаланина, такие как штамм E.coli K-12[W3110(tyrA)/pPHAB] (FERM ВР-3566), штамм E.coli K-12[W3110(tyrA)/pPHAD] (PERM ВР-12659), штамм E.coli К-12[W3110(tyrA)/pPHATerm] (PERM BP-12662) и штамм E.coli K-12[W3110(tyrA)/pBR-aroG4, pACMAB], названный как AJ12604 (PERM BP-3579) (Европейский патент ЕР488424 В1). Кроме того, также могут быть использованы бактерии-продуценты L-фенилаланина, принадлежащие к роду Escherichia с повышенной активностью белков, кодируемых геном yedA или геном yddG (патентные заявки США 2003/0148473 А1 и 2003/0157667 А1).
Бактерия-продуцент L-триптофана
Примеры родительских штаммов, используемых для получения бактерии-продуцента L-триптофана согласно настоящему изобретению, включают в себя, но не ограничиваются бактериями-продуцентами L-триптофана, принадлежащими к роду Escherichia, такими как штаммы Е.coli JP4735/pMU3028 (DSM10122) и JP6015/pMU91 (DSM10123), лишенные активности триптофанил-тРНК синтетазы, кодируемой мутантным геном trpS (патент США 5756345); штамм Е.coli SV164 (pGH5), содержащий аллель serA, кодирующий фосфоглицератдегидрогеназу, не ингибируемую серином по типу обратной связи и аллель trpE, кодирующий антранилатсинтазу, не ингибируемую триптофаном по типу обратной связи (патент США 6180373); штаммы Е.coli AGX17 (pGX44) (NRRL В-12263) и AGX6(pGX50)aroP (NRRL В-12264), в которых отсутствует активность триптофаназы (патент США 4371614); штамм Е.coli AGX17/pGX50, pACKG4-pps, в котором усилена способность к синтезу фосфоенолпирувата (заявка РСТ WO9708333, патент США 6319696), и подобные им. Также могут быть использованы бактерии-продуценты L-триптофана принадлежащие к роду Escherichia, в которых увеличена активность белка, кодируемого геном yedA или геном yddG (заявки на патент США 2003/0148473 А1 и 2003/0157667 А1).
Примеры родительских штаммов, используемых для получения бактерии-продуцента L-триптофана, согласно настоящему изобретению, также включают в себя штаммы, в которых увеличена активность одного или нескольких ферментов, выбранных из группы, состоящей из антранилатсинтазы, фосфоглицератдегидрогеназы, и триптофансинтазы. И антранилатсинтаза, и фосфоглицератдегидрогеназа подвержены ингибированию L-триптофаном и L-серином по типу обратной связи, так что в эти ферменты могут быть введены мутации, снижающие чувствительность к ингибированию по типу обратной связи. Специфические примеры штаммов с такой мутацией включают Е.coli SV164, антранилатсинтаза которой не чувствительна к ингибированию по типу обратной связи, и штамм-трансформант, полученный введением в Е.coli SV164 плазмиды pGH5 (заявка РСТ WO 94/08031), которая содержит мутантный ген serA, кодирующий фосфоглицератдегидрогеназу, которая не чувствительна к ингибированию по типу обратной связи.
Примеры родительских штаммов, используемых для получения бактерии-продуцента L-триптофана, согласно настоящему изобретению, также включают в себя штаммы, в которые введен триптофановый оперон, содержащий ген, кодирующий антранилатсинтазу, которая не чувствительна к ингибированию по типу обратной связи (заявка Японии 57-71397 А, заявка Японии 62-244382 А, патент США 4,371,614). Кроме того, способность к продукции L-триптофана может быть придана путем усиления экспрессии гена (из триптофанового оперона), кодирующего триптофансинтазу (trpBA). Триптофансинтаза состоит из двух субъединиц α и β, которые кодируются trpA и trpB соответственно. Кроме того, способность к продукции L-триптофана может быть увеличена усилением экспрессии оперона изоцитратлиазы-малатсинтазы (заявка РСТ WO2005/103275).
Бактерия-продуцент L-пролина
Примеры бактерий-продуцентов L-пролина, используемых в качестве родительского штамма согласно настоящему изобретению, включают в себя, но не ограничиваются штаммами, принадлежащими к роду Escherichia, такими как штамм Е.coli 702ilvA (ВКПМ В-8012), дефицитного по гену ilvA и способного к продукции L-пролина (Европейский патент ЕР 1172433). Бактерия согласно настоящему изобретению может быть улучшена путем усиления экспрессии одного или нескольких генов, вовлеченных в биосинтез L-пролина. Предпочтительно, примеры таких генов для бактерий-продуцентов L-пролина, включают ген proB, кодирующий глутаматкиназу с десенсибилизированной регуляцией L-пролином по типу обратной связи (патент Германии 3127361). Кроме того, бактерия согласно настоящему изобретению может быть улучшена путем усиления экспрессии одного или нескольких генов, кодирующих белки, экскретирующие L-аминокислоту из бактериальной клетки. Примерами таких генов являются гены b2682 и b2683 (ygaZH гены) (Европейская патентная заявка ЕР1239041А2).
Примеры бактерий, принадлежащих к роду Escherichia и обладающих способностью к продукции L-пролина, включают следующие штаммы Е.coli: NRRL В-12403 и NRRL В-12404 (патент Великобритании GB 2075056), ВКПМ В-8012 (патентная заявка РФ 2000124295), плазмидные мутанты, описанные в патенте Германии DE 3127361, плазмидные мутанты, описанные у Bloom F.R. et al (The 15th Miami winter symposium, 1983, p.34), и подобные им.
Бактерия-продуцент L-аргинина
Примеры родительских штаммов, используемых для получения бактерии-продуцента L-аргинина согласно настоящему изобретению, включают в себя, но не ограничиваются штаммами, принадлежащими к роду Escherichia, такими как штамм Е.coli 237 (ВКПМ В-7925) (патентная заявка США 2002/058315 A1) и его производные, содержащие мутантную N-ацетилглутаматсинтазу (патентная заявка РФ 2001112869), штамм Е.coli 382 (ВКПМ В-7926) (Европейская патентная заявка ЕР 1170358А1), штамм-продуцент аргинина, в который введен ген argA, кодирующий N-ацетилглутаматсинтетазу (Европейская патентная заявка ЕР1170361А1), и подобные им.
Примеры родительских штаммов, используемых для получения бактерии-продуцента L-аргинина, согласно настоящему изобретению, также включают в себя штаммы, в которых усилена экспрессия одного или нескольких генов, кодирующих ферменты биосинтеза L-аргинина. Примеры ферментов биосинтеза L-аргинина. включают N-ацетилглутамилфосфатредуктазу (argC), орнитинацетилтрансферазу (argJ), N-ацетилглутаматкиназу (argB), ацетилорнитинтрансаминазу (argD), орнитинкарбамоилтрансферазу (argF), синтетазу аргининсукциниловой кислоты (argG), лиазу аргининсукциниловой кислоты (argH), и карбамоилфосфатсинтетазу(carAB).
Бактерия-продуцент L-валина
Примеры родительских штаммов, используемых для получения бактерии-продуцента L-валина, согласно настоящему изобретению, включают в себя, но не ограничиваются ими, штаммы, модифицированные с целью сверхэкспрессии оперона ilvGMEDA (патент США 5998178). Желательно удалить область оперона ilvGMEDA, которая необходима для ослабления экспрессии, с тем, чтобы экспрессия оперона не ослаблялась образующимся L-валином. Далее, желательно разрушить в опероне ген ilvA с тем чтобы снизить активность треониндеаминазы.
Примеры родительских штаммов, используемых для получения бактерии-продуцента L-валина, согласно настоящему изобретению, также включают в себя мутантные штаммы, имеющие мутацию аминоацил-тРНК-синтетазы (патент США 5658766). Например, может использоваться штамм Е.coli VL1970, который имеет мутацию в гене ileS, кодирующем изолейцин-тРНК-синтетазу. Штамм Е.coli VL1970 депонирован в Российской Национальной Коллекции Промышленных Микроорганизмов (ВКПМ) (Россия, 117545 Москва, 1-й Дорожный проезд, 1) 24 июня 1988 г. с инвентарным номером ВКПМ В-4411.
Далее, в качестве родительских штаммов также могут использоваться мутантные штаммы, для роста которых требуется липоевая кислота, и/или с недостаточным количеством H+-АТФазы (заявка РСТ WO96/06926).
Бактерия-продуцент L-изолейцина
Примеры родительских штаммов, используемых для получения бактерии-продуцента L-изолейцина, согласно настоящему изобретению, включают в себя, но не ограничиваются ими, мутантные штаммы с устойчивостью к 6-диметиламинопурину (заявка Японии 5-304969А), мутантные штаммы с устойчивость к аналогу изолейцина, такому как тиаизолейцин и гидроксамат изолейцина, и мутантные штаммы, дополнительно имеющие устойчивость к DL-этионину и/или гидроксамату аргинина (заявка Японии 5-130882А). Кроме того, в качестве родительских штаммов также могут использоваться рекомбинантные штаммы, трансформированные генами, кодирующими белки, вовлеченные в биосинтез L-изолейцина, такие как треониндеаминаза и ацетогидроксатсинтаза (заявка Японии 2-458А, патент Франции 0356739 и патент США 5998178).
2. Способ согласно настоящему изобретению.
Способом согласно настоящему изобретению является способ получения L-аминокислоты, включающий стадии выращивания бактерии согласно настоящему изобретению в питательной среде с целью продукции и накопления L-аминокислоты в питательной среде, и выделения L-аминокислоты из культуральной жидкости.
В способе настоящего изобретения в качестве источника углерода в ферментационной среде могут использоваться глицерин и/или этанол.
"Глицерин" подразумевает вещество с номенклатурным названием пропан-1,2,3-триол. Сырой глицерин подразумевает полученный промышленным способом глицерин, содержащий также примеси. Сырой глицерин получают путем гидролиза жиров и масел водой при высокой температуре и при высоком давлении, или с использованием реакции этерификации для получения биодизельного топлива. Биодизельное топливо включает метиловые эфиры алифатической кислоты, полученные трансэтерификацией из жиров и масел и метанола. Сырой глицерин получают как побочный продукт данной реакции (Fukuda, H., Kondo, A., and Noda, H., 2001, J, Biosci. Bioeng., 92, 405-416). В процессе получения биодизельного топлива во многих случаях для трансэтерификации используют метод щелочного катализа, а для нейтрализации добавляют кислоты. Поэтому сырой глицерин получается 70-95% чистоты (по весу) и содержит также воду и примеси. Сырой глицерин, полученный в процессе получения биодизельного топлива, содержит кроме воды остаточный метанол, соли щелочных металлов, таких как Na, поскольку NaOH используют в качестве катализатора, и кислоту, такую как H2SO4, используемую для нейтрализации щелочи. Хотя это зависит от производителя и способов получения, количество этих солей и метанола может достигать нескольких процентов. Сырой глицерин преимущественно содержит ионы из щелочи и кислоты для нейтрализации, такие как ионы натрия, ионы калия, хлорид-ионы и сульфат-ионы в количестве 2-7%, предпочтительно 3-6%, более предпочтительно 4-5.8%, в пересчете на весовые проценты сырого глицерина. Хотя метанол может отсутствовать, в основном он присутствует в количестве 0.01% и менее.
Сырой глицерин может кроме того содержать следовые количества металлов, органических кислот, фосфора, алифатических кислот и т.д. Примеры органических кислот включают муравьиную кислоту, уксусную кислоту и т.д., и хотя они могут отсутствовать, преимущественно они присутствуют в количестве 0.01% и менее. Предпочтительно присутствие следовых количеств металлов, требуемых для роста микроорганизмов, например, магния, железа, кальция, марганца, меди, цинка и т.д. Магний, железо и кальций преимущественно присутствуют в количестве 0.00001-0.1%, предпочтительно 0.0005-0.1%, более предпочтительно 0.004-0.05%, еще более предпочтительно 0.007-0.01%, в пересчете на весовые проценты сырого глицерина. Марганец, медь и цинк преимущественно присутствуют в количестве 0.000005-0.01%, предпочтительно 0.000007-0.005%, более предпочтительно 0.00001-0.001%, в пересчете на весовые проценты сырого глицерина.
Степень чистоты сырого глицерина может быть 10% или выше, предпочтительно 50% или выше, более предпочтительно 70% или выше, особенно предпочтительно 80% или выше. При условии что количество примесей в вышеупомянутых пределах, степень чистоты глицерина может быть 90% или выше.
Предпочтительно использование сырого глицерина, полученного при производстве биодизельного топлива. Кроме того, предпочтительно использование сырого глицерина, который обеспечивает лучшую продукцию L-аминокислоты, чем при использовании того же количества реактива глицерина. Лучшая продукция L-аминокислоты, чем при использовании того же количества реактива глицерина означает увеличение количества получаемой кислоты на 5% и более, предпочтительно на 10% и более, более предпочтительно на 20% и более, по сравнению с продукцией при использовании в качестве источника углерода реактива глицерина. "Реактив глицерина" означает глицерин, продаваемый в качестве реактива или имеющий степень чистоты, эквивалентную степени чистоты глицерина, продаваемого в качестве реактива. Преимущественно глицерин имеет степень чистоты 99% по весу и выше, особенно предпочтителен чистый глицерин. Выражение "реактив глицерина в таком же количестве, как сырой глицерин" означает, что реактив глицерина- такого же веса, как сырой глицерин за исключением воды, в том случае если глицерин содержит воду.
Сырой глицерин может быть разбавлен растворителем, таким как вода. В таком случае вышеупомянутое описание относительно глицерина и примесей может быть применимо к сырому глицерину до разбавления. То есть, когда используют раствор сырого глицерина и когда количество растворителя снижено и составляет до 30% по весу и менее, 20% по весу и менее, более предпочтительно 10% по весу и менее, если содержание глицерина и примесей - внутри вышеупомянутых пределов, этот сырой глицерин соответствует понятию "сырой глицерин" настоящего изобретения.
Этанол - моноспирт с молекулярной формулой C2H5OH и может использоваться как самостоятельно, так представлять собой смесь в среде, такую как этанол, получаемый в среде при этанольной ферментации и т.д.
Этанол может присутствовать в среде в любой концентрации при условии, что выбранная бактерия может ассимилировать его в качестве источника углерода. Когда он используется в качестве единственного источника углерода в среде, он присутствует в количестве 20% (по соотношению веса к объему - w/v) и менее, более предпочтительно 10% w/v и менее, еще более предпочтительно 2% w/v и менее. Кроме того, этанол может присутствовать в среде в любой концентрации при условии, что выбранная бактерия может ассимилировать его в качестве источника углерода. Когда он используется в качестве единственного источника углерода в среде, он присутствует в количестве 0.001% w/v и более, предпочтительно 0.05% w/v и более, более предпочтительно 0.1% w/v и более.
Что касается питательной среды, когда этанол используется в качестве единственного источника углерода, предпочтительно его присутствие в среде в количестве 10% w/v и менее, более предпочтительно 5% w/v и менее, еще более предпочтительно 1% w/v и менее.
Хотя концентрацию этанола можно определять различными методами, наиболее удобный и общепринятый - ферментативный метод (Swift R., 2003, Addiction, 98:73-80). Концентрация алифатической кислоты может быть определена известными методами, такими как газовая хроматография и ВЭЖХ (TrAC Trends Anal. Chem., 2002, 21:686-697; Lin J.T., Snyder L.R., and McKeon, T.A., 1998, J. Chromatogr. A., 808:43-49).
Кроме того, среда может содержать смесь этанола. Концентрации этанола, добавляемого в среду, могут быть любыми при условии, что выбранная бактерия может ассимилировать их в качестве источника углерода. Однако когда смесь этанола используется в качестве единственного источника углерода в среде, предпочтительно ее присутствие в количестве 20% w/v и менее, более предпочтительно 10% w/v и менее, еще более предпочтительно 2% w/v и менее, в выражении общей концентрации. Кроме того, смесь этанола может присутствовать в среде в любой концентрации при условии, что бактерия может ассимилировать ее в качестве источника углерода. Однако когда смесь этанола используется в качестве единственного источника углерода в среде, желательно ее содержание в среде в количестве 0.001% w/v и более, предпочтительно 0.05% w/v и более, более предпочтительно 0.1% w/v и более, в выражении общей концентрации этанола.
Кроме этанола и глицерина в среде могут содержаться также другие источники углерода, например, углеводы, такие как глюкоза, фруктоза, сахароза, лактоза, галактоза, меласса, гидролизат крахмала, спирты, такие как глицерин, и органические кислоты, такие как фумаровая кислота, лимонная кислота и янтарная кислота. Особенно предпочтительны глюкоза, сахароза, фруктоза и глицерин. В качестве глицерина также может быть использован сырой глицерин, получаемый при производстве биодизельного топлива. Источник углерода может быть одним видом вещества или смесью двух и более видов веществ. Когда используются другие источники углерода, доля этанола, алифатической кислоты или смеси этанола и глицерина в источнике углерода предпочтительно должна составлять 10% по весу и более, более предпочтительно 30% по весу и более, еще более предпочтительно 50% по весу и более.
Согласно настоящему изобретению выращивание, выделение и очистка L-аминокислоты из культуральной или подобной ей жидкости могут быть осуществлены способом, подобным традиционным способам ферментации, в которых аминокислота продуцируется с использованием бактерии.
Питательная среда, используемая для выращивания, может быть как синтетической, так и натуральной, при условии, что указанная среда содержит источники углерода, азота, минеральные добавки и, если необходимо, соответствующее количество питательных добавок, необходимых для роста микроорганизмов. В качестве источника углерода используют этанол и глицерин. В качестве источника азота могут использоваться различные неорганические соли аммония, такие как аммиак и сульфат аммония, другие соединения азота, такие как амины, природные источники азота, такие как пептон, гидролизат соевых бобов, ферментолизат микроорганизмов. В качестве минеральных добавок могут использоваться фосфат калия, сульфат магния, хлорид натрия, сульфат железа, сульфат марганца, хлорид кальция и подобные им соединения. В качестве витаминов могут использоваться тиамин, дрожжевой экстракт и т.п.
Выращивание осуществляется предпочтительно в аэробных условиях, таких как перемешивание культуральной жидкости на качалке, взбалтывание с аэрацией, при температуре в пределах от 20 до 40°С, предпочтительно в пределах от 30 до 38°С. рН среды поддерживают в пределах от 5 до 9, предпочтительно от 6.5 до 7.2. рН среды может регулироваться аммиаком, карбонатом кальция, различными кислотами, основаниями и буферными растворами. Обычно, выращивание в течение от 1 до 5 дней приводит к накоплению целевой L-аминокислоты в культуральной среде.
После выращивания твердые остатки, такие как клетки, могут быть удалены из культуральной жидкости методом центрифугирования или фильтрацией через мембрану, а затем L-аминокислота может быть выделена и очищена методами ионообменной хроматографии, концентрирования и/или кристаллизации.
Примеры
Настоящее изобретение будет более подробно описано ниже со ссылкой на следующие не ограничивающие настоящее изобретение Примеры.
Пример 1. Конструирование штамма. E.coli MG1655 cyaAK432QPLtac-adhE*.
Для получения штамма Е.coli, способного более эффективно утилизировать этанол, был использован метод отбора в соответствии с методикой адаптивной эволюции, описанной Fong S. et al (http://www.genome.org/cgi/doi/10.1101/gr.3832305). Культуру штамма MG1655 PL-tacadhE* (WO 2008010565) в течение продолжительного времени поддерживали в экспоненциальной фазе роста путем ежедневных пассажей на свежую минимальную среду (М9) с добавлением 2% (v/v) этанола. Каждые 100 часов эксперимента отбирали пробы культуры и определяли скорость роста в такой же среде. К 700 ч эксперимента больше не наблюдалось увеличения скорости роста. Суспензию клеток этой "fitness" культуры высевалина чашки с LB для получения индивидуальных колоний. Определили скорость роста семи независимых клонов. Показано, что все эти клоны и "fitness" культура имеют одинаковую скорость роста на этаноле. Один из этих клонов, Fit73, был выбран для дальнейших исследований.
С использованием сравнительного анализа последовательностей генома (NimbleGen) выбранного клона Fit73 "fitness" штамма обнаружили 16 мутаций: 3 синонимичных и 13 несинонимичных. Одна из несинонимичных мутаций обнаружена в гене суаА: A→G в положении 1294. В результате данной мутации остаток лизина в положении 432 аденилатциклазы замещается глутамином.
Затем данный штамм маркировали устойчивостью к хлорамфениколу (CmR) после гена cyaAK432Q следующим образом. Фрагмент ДНК, содержащий маркер устойчивости к хлорамфениколу (CmR), кодируемый геном cat, интегрировали в хромосому штамма Fit73 после гена cyaAK432Q с использованием метода, описанного Datsenko K.A. and Wanner B.L. (Proc. Natl. Acad. Sci. USA, 2000, 97, 6640-6645), называемым "Red-опосредованная интеграция" и/или "Red-зависимая интеграция".
Фрагмент ДНК, содержащий маркер CmR, кодируемый геном cat, получили в ПЦР с использованием в качестве матрицы плазмиды pMW118-attL-Cm-attR (WO 05/010175) и праймеров P1 (SEQ ID NO:3) и P2 (SEQ ID NO:4). ПЦР проводили с использованием амплификатора "Gene Amp PCR System 2700" (Applied Biosystems). Реакционная смесь (общий объем - 50 мкл) состояла из 5 мкл 10х ПЦР-буфера с 25 мМ MgCl2 ("Fermentas", Lithuania), no 200 мкМ каждого dNTP, no 25 пкМ каждого используемого праймера и 1 Ед Taq-полимеразы ("Fermentas", Lithuania). Для ПЦР амплификации в реакционную смесь в качестве матрицы добавляли приблизительно 5 нг плазмидной ДНК. Использовали следующие температурные условия для ПЦР: денатурация при 95°С в течение 5 мин; последующие 25 циклов: денатурация 30 сек при 95°С, отжиг 30 сек при 55°С, элонгация 40 сек при 72°С; и заключительная полимеризация: 5 мин при 72°С. Затем амплифицированный фрагмент ДНК очищали с использованием электрофореза в агарозном геле, экстрагировали с использованием "GenElute Spin Columns" ("Sigma", USA) и осаждали этанолом.
Полученный фрагмент ДНК использовали для электропорации и Red-зависимой интеграции в бактериальную хромосому выбранного "fitness" штамма Е.coli Fit73.
Клетки штамма Fit73 выращивали в течение ночи при 30°С в жидкой среде LB, содержащей ампициллин (100 мкг/мл), затем разводили в 100 раз средой SOB (дрожжевой экстракт, 5 г/л; NaCl, 0.5 г/л; триптон, 20 г/л; KCl, 2.5 мМ; MgCl2, 10 мМ) содержащей ампициллин (100 мкг/мл) и L-арабинозу (10 мМ) (арабинозу используют для индукции плазмиды, содержащей гены Red системы) и выращивали при 30°С до достижения значения оптической плотности бактериальной культуры OD600=0.4-0.7. Выросшие клетки из 10 мл бактериальной культуры трижды отмывали ледяной деионизированной водой, после чего суспендировали в 100 мкл воды. 10 мкл раствора фрагмента ДНК (100 нг) в деионизованной воде добавляли к суспензии клеток. Электропорацию проводили с использованием электропоратора "Bio-Rad" (USA) (No. 165-2098, version 2-89) согласно инструкции производителя. Клетки после шока добавляли к 1 мл среды SOC (Sambrook et al, "Molecular Cloning A Laboratory Manual, Second Edition", Cold Spring Harbor Laboratory Press (1989)), инкубировали в течение 2 часов при 37°С, затем высевали на чашки с L-агаром, содержащим 25 мкг/мл хлорамфеникола. Выросшие в течение 24 часов колонии тестировали на присутствие маркера CmR после гена cyaAK432Q методом ПЦР с использованием праймеров Р3 (SEQ ID NO:5) и Р4 (SEQ ID NO:6). Для этого свежевыросшую колонию суспендировали в 20 мкл воды и затем 1 мкл полученной суспензии использовали для ПЦР. µl of obtained suspension was used for PCR. Использовали следующие температурные условия для ПЦР: денатурация при 95°С в течение 5 мин; последующие 30 циклов: денатурация 30 сек при 95°С, отжиг 30 сек при 55°С, элонгация 30 сек при 72°С; и заключительная полимеризация: 5 мин при 72°С. Клетки нескольких протестированных CmR колоний содержали требуемый фрагмент ДНК 2076 п.н., что подтверждает присутствие маркера CmR после гена cyaAK432Q. Один из полученных штаммов излечили от термочувствительной плазмиды pKD46 путем культивирования при 37°С.
С использованием Р1 трансдукции cyaA*-cat фрагмент из полученного штамма ввели в штамм MG1655 PL-tacadhE* (WO2008010565). Протестировали рост полученного штамма на среде М9 с добавлением 2% этанола. Было показано, что мутация cyaAK432Q оказывает большое влияние на рост: мутантный ген суаА* улучшал рост штамма MG1655 PL-tacadhE* до приблизительно 50% от роста штамма Fit73.
Таким образом был получен штамм, содержащий мутантный ген cyaAK432Q. Штамм был назван MG1655 cyaAK432Q PLtac-adhE*.
Пример 2. Влияние мутации гена суаА на продукцию L-треонина.
Для оценки влияния мутации K432Q гена суаА на продукцию треонина был сконструирован штамм Е.coli MG1655Δtdh, rhtA*, cyaAK432Q PL-tacadhE* путем переноса фрагмента ДНК хромосомы штамма Е.coli MG1655 cyaAK432Q PLtac-adhE* в штамм E.coli MG1655 Δtdh rhtA* PLtac-adhE* (WO2008010565) методом Р1 трансдукции. Затем штаммы Е.coli MG1655Δtdh, rhtA*, PL-tacadhE* и MG1655Δtdh, rhtA*, cyaAK432Q PL-tacadhE* трансформировали плазмидой pVIC40 (плазмида pVIC40 подробно описана в патенте США 5,705,371). Таким образом были сконструированы штаммы- продуценты треонина MG1655Δtdh, rhtA*, PL-tacadhE*/ pVIC40 и MG1655Δtdh, rhtA*, cyaAK432Q PL-tacadhE*/pVIC40.
Штаммы E.coli MG1655Δtdh, rhtA*, PL-tacadhE*/ pVIC40 и MG1655Δtdh, rhtA*, cyaAK432Q PL-tacadhE*/ pVIC40 культивировали при 37°С в течение 18 ч в питательной среде и по 0.1 мл каждой из полученных культур инокулировали в 2 мл ферментационной среды в пробирках 20×200 мм и культивировали при 32°С в течение 48 ч на роторной качалке. После культивирования количество накопленного в среде L-треонина определяли с помощью бумажной хроматографии с использованием подвижной фазы следующего состава: бутанол: уксусная кислота: вода=4:1:1 (v/v). Для визуализации использовали раствор (2%) нингидрина в ацетоне. Пятно, содержащее L-треонин, вырезали; L-треонин элюировали 0.5% водным раствором CdCl2, после чего оценивали количество L-треонина спектрофотометрическим методом при длине волны 540 нм. Результаты 8 независимых пробирочных ферментаций приведены в Таблице 1.
Как следует из Таблицы 1, штамм MG1655Δtdh, rhtA*, cyaAK432Q PL-tacadhE*/ pVIC40 накапливал большее количество L-треонина по сравнению со штаммом MG1655Δtdh, rhtA*, PL-tacadhE*/ pVIC40 как на среде, содержащей этанол, так и на среде, содержащей глицерин.
Состав среды для ферментации (г/л):
K2HPO4 и СаСО3 стерилизовали по отдельности. Значение рН доводили до 7.0.
Пример 3. Влияние мутации гена суаА на продукцию L-лизина.
Для оценки влияния мутации K432Q гена суаА на продукцию L-лизина сначала ДНК-фрагменты хромосомы описанного выше штамма Е.coli MG1655::PL-tacadhE* (US2009203090 (А1) могут быть перенесены в штамм-продуцент L-лизина Е.coli WC196 (pCABD2) с помощью P1-трансдукции (Miller, J.H. (1972) Experiments in Molecular Genetics, Cold Spring Harbor Lab. Press, Plainview, NY) с целью получения штамма WC196 PL-tacadhE* (pCABD2). В составе плазмиды pCABD2 имеются ген dapA, кодирующий дигидродипиколинатсинтазу с мутацией, снимающей ингибирование L-лизином по типу обратной связи, ген lysC, кодирующий аспартокиназу III с мутацией, снимающей ингибирование L-лизином по типу обратной связи, ген, dapB, кодирующий дигидродипиколинатредуктазу, и ген ddh, кодирующий диаминопимелатдегидрогеназу (US Patent 6,040,160).
Затем штамм Е.coli WC196 PL-tacadhE* cat-cyaAK432Q (pCABD2) может быть получен путем переноса фрагментов ДНК из хромосомы штамма Е.coli MG1655 cyaAK432Q PLtac-adhE* в штамм Е.coli WC196 PL-tacadhE* (pCABD2) с помощью Р1 трансдукции.
Штаммы Е.coli, WC196 PL-tacadhE* cat- cyaAK432Q (pCABD2) и WC196 PL-tacadhE* (pCABD2), могут быть выращены в L-среде, содержащей 20 мг/л стрептомицина, при 37°С; и 0.3 мл полученных культур может быть внесено в 20 мл ферментационной среды, содержащей необходимые антибиотики, в колбы объемом 500 мл. Культивирование может проводиться при 37°С в течение 16 часов с использованием возвратно-поступательной качалки со скоростью перемешивания 115 об/мин. После выращивания количество L-лизина и остаточной глюкозы в среде может быть измерено известным способом (Biotech-analyzer AS210, производитель- Sakura Seiki Co.). Затем, для каждого из штаммов может быть рассчитан выход L-лизина в пересчете на потребленный этанол.
Может быть использована ферментационная среда следующего состава (г/л):
рН доводят до 7.0 с помощью KOH, и среду автоклавируют при 115°С в течение 10 мин. Этанол и MgSO4 7Н2О стерилизуют отдельно. Также добавляют СаСО3 до концентрации 30 г/л, предварительно простерилизованного сухим жаром при 180°С в течение 2 часов.
Пример 4. Влияние мутации гена суаА на продукцию L-гистидина.
Для оценки влияния мутации K432Q гена суаА на продукцию L-гистидина ДНК-фрагменты хромосомы описанного выше штамма Е.coli MG1655::PL-tacadhE* (US 2009203090 (А1) могут быть перенесены в штамм-продуцент L-гистидина Е.coli 80 с помощью P1-трансдукции (Miller, J.H. (1972) Experiments in Molecular Genetics, Cold Spring Harbor Lab. Press, Plainview, NY) с целью получения штамма 80 PL-tacadhE*. Штамм 80 описан в патенте РФ 2119536 и депонирован во Всероссийской коллекции промышленных микроорганизмов (Россия, 117545 Москва, 1-й Дорожный проезд, 1) 15 октября 1999 г. с инвентарным номером ВКПМ В-7270, затем 12 июля 2004 г. было произведено международное депонирование этого штамма согласно условиям Будапештского Договора.
Затем штамм Е.coli 80 PL-tacadhE* cat-cyaAK432Q может быть получен путем переноса фрагментов ДНК из хромосомы штамма Е.coli MG1655 cyaAK432Q PLtac-adhE* в штамм Е.coli 80 PL-tacadhE* с помощью Р1 трансдукции.
Штаммы E.coli 80 PL-tacadhE* cat-cyaAK432Q и 80 PL-tacadhE* могут быть выращены на L-бульоне при 29°С в течение 6 часов. Затем по 0.1 мл полученных культур может быть внесено в 2 мл ферментационной среды в пробирки размером 20×200 мм, и культуры могут быть выращены при 29°С в течение 65 часов на роторной качалке (350 об/мин). После выращивания количество накопленного в среде гистидина может быть определено с помощью бумажной хроматографии. Может быть использована подвижная фаза следующего состава: п-бутанол - уксусная кислота - вода=4:1:1 (v/v). Раствор нингидрина (0.5%) в ацетоне может быть использован для визуализации.
Состав ферментационной среды (рН 6.0) (г/л):
Этанол, пролин, бетаин и СаСО3 стерилизуют отдельно. рН доводят до 6.0 перед стерилизацией.
Пример 5. Влияние мутации гена cyaA на продукцию L-лейцина.
Для оценки влияния мутации K432Q гена суаА на продукцию L-лейцина ДНК-фрагменты хромосомы описанного выше штамма Е.coli MG1655::PL-tacadhE* (US2009203090 (А1) могут быть перенесены в штамм-продуцент L-лейцина Е.coli NS1391 с помощью P1-трансдукции (Miller, J.H. (1972) Experiments in Molecular Genetics, Cold Spring Harbor Lab. Press, Plainview, NY) с целью получения штамма NS1391 PL-tacadhE*.
Затем штамм Е.coli NS1391 PL-tacadhE* cyaAK432Q может быть получен путем переноса фрагментов ДНК из хромосомы штамма Е.coli MG1655 Δtdh rhtA* cyaAK432Q PLtac-adhE* в штамм Е.coli NS1391 PL-tacadhE* с помощью Р1 трансдукции.
Штаммы Е.coli NS1391 PL-tacadhE* cyaAK432Q и NS1391 PL-tacadhE* могут быть выращены в течение 18-24 часов при температуре 37°С на чашках с L-агаром. Для получения посевной культуры указанные штаммы могут быть выращены на роторной качалке (250 об/мин) при 32°С в течение 18 часов в пробирках размером 20×200 мм, содержащих 2 мл L-бульона с 4% сахарозы. Затем в ферментационную среду может быть внесено по 0.21 мл (10%) посевного материала. Ферментацию можно проводить в 2 мл минимальной ферментационной среды в пробирках размером 20×200 мм. Клетки могут быть выращены в течение 48-72 часов при 32°C с перемешиванием (250 об/мин). Количество L-лейцина может быть измерено с помощью бумажной хроматографии (состав подвижной фазы: бутанол - уксусная кислота - вода=4:1:1).
Состав ферментационной среды (рН 7.2) (г/л):
Этанол и мел стерилизуют отдельно.
Пример 6. Влияние мутации гена суаА на продукцию L-фенилаланина.
Для оценки влияния мутации K432Q гена суаА на продукцию L- фенилаланина ДНК-фрагменты хромосомы описанного выше штамма Е.coli MG1655::PL-tacadhE* (US2009203090 (А1) могут быть перенесены в штамм-продуцент L-фенилаланина Е.coli AJ12739 с помощью P1-трансдукции (Miller, J.H. (1972) Experiments in Molecular Genetics, Cold Spring Harbor Lab. Press, Plainview, NY) с целью получения штамма AJ12739 PL-tacadhE*. Штамм AJ12739 депонирован во Всероссийской коллекции промышленных микроорганизмов (ВКПМ) (Россия, 117545 Москва, 1-й Дорожный проезд, 1) 6 ноября 2001 года с инвентарным номером ВКПМ В-8197, затем 23 августа 2002 г. было произведено международное депонирование этого штамма согласно условиям Будапештского Договора.
Затем штамм Е.coli AJ12739 PL-tacadhE* cyaAK432Q может быть получен путем переноса фрагментов ДНК из хромосомы штамма Е.coli MG1655 cyaAK32Q PLtac-adhE* в штамм Е.coli AJ12739 PL-tacadhE* с помощью Р1-трансдукции.
Штаммы Е.coli AJ12739 PL-tacadhE* cat-cyaAK432Q и AJ12739 PL-tacadhE* могут быть выращены при 37°С в течение 18 часов в питательном бульоне, 0.3 мл полученных культур может быть внесено в 3 мл ферментационной среды в пробирки размером 20×200 мм, и культуры могут быть выращены при 37°С в течение 48 часов на роторной качалке. По окончании ферментации количество накопленного в среде фенилаланина может быть определено с помощью тонкослойной хроматографии (TLC). Для этой цели могут быть использованы TLC-пластинки размером 10×15 см, покрытые 0.11 мм-слоем силикагеля Сорбфил без флуоресцентного индикатора (Акционерное Общество Сорбполимер, Краснодар, Россия). Пластинки Сорбфил могут быть экспонированы в подвижной фазе следующего состава: пропан-2-ол: этилацетат: 25% водного аммиака: вода=40:40:7:16 (v/v). Раствор (2%) нингидрина в ацетоне может быть использован для визуализации.
Состав ферментационной среды (г/л):
Этанол и сульфат магния стерилизуют отдельно. СаСО3 стерилизуют сухим жаром при 180°С в течение 2 часов. рН доводят до 7.0.
Пример 7. Влияние мутации гена cyaA на продукцию L-аргинина. Для оценки влияния мутации K432Q гена суаА на продукцию L-аргинина ДНК-фрагменты хромосомы описанного выше штамма Е.coli MG1655::PL-tacadhE* (US2009203090 (A1) могут быть перенесены в штамм-продуцент L-аргинина Е.coli 382 с помощью Р1-трансдукции (Miller, J.H. (1972) Experiments in Molecular Genetics, Cold Spring Harbor Lab. Press, Plainview, NY) с целью получения штамма 382 PL-tacadhE*. Штамм 382 депонирован во Всероссийской коллекции промышленных микроорганизмов (ВКПМ) (Россия, 117545 Москва, 1-й Дорожный проезд, 1) 10 апреля 2000 года с инвентарным номером ВКПМ В-7926, затем 18 мая 2001 г. было произведено международное депонирование этого штамма согласно условиям Будапештского Договора.
Затем штамм Е.coli 382 PL-tacadhE* cyaAK432Q может быть получен путем переноса фрагментов ДНК из хромосомы штамма MG1655 cyaAK432Qcat PLtac-adhE* в штамм Е.coli 382 PL-tacadhE* с помощью Р1-трансдукции.
Штаммы Е.coli 382 PL-tacadhE* cat-cyaAK432Q и 382 PL-tacadhE* могут быть выращены с перемешиванием при 37°С в течение 18 часов в 3 мл питательного бульона, по 0.3 мл полученных культур может быть внесено в 3 мл ферментационной среды в пробирки размером 20×200 мм, и культуры могут быть выращены при 32°С в течение 48 часов на роторной качалке.
После выращивания количество накопленного в среде L-аргинина может быть определено с помощью бумажной хроматографии, при этом может быть использован следующий состав подвижной фазы: бутанол: уксусная кислота: вода=4:1:1 (v/v). Раствор нингидрина (2%) в ацетоне может быть использован для визуализации. Пятно, содержащее L-аргинин, может быть вырезано; L-аргинин может быть элюирован 0.5% водным раствором CdCl2, после чего количество L-аргинина может быть определено спектрофотометрическим методом при длине волны 540 нм.
Состав ферментационной среды (г/л):
MgSO4·7H2O, этанол и СаСО3 стерилизуют отдельно.
Пример 8. Влияние мутации гена суаА на продукцию L-триптофана.
Для оценки влияния мутации K432Q гена суаА на продукцию L-триптофана ДНК-фрагменты хромосомы описанного выше штамма Е.coli MG1655::PL-tacadhE* (US2009203090 (А1) могут быть перенесены в штамм-продуцент L-триптофана Е.coli SV164 (pGH5) с помощью P1-трансдукции (Miller, J.H. (1972) Experiments in Molecular Genetics, Cold Spring Harbor Lab. Press, Plainview, NY) с целью получения штамма SV164 Pl-tacadhE*(pGH5). Штамм SV164 содержит аллель trpE, кодирующий антранилатсинтазу, не подверженную ингиброванию триптофаном по типу обратной связи. Плазмида pGH5 содержит мутантный ген serA, кодирующий фосфоглицератдегидрогеназу, не подверженную ингиброванию серином по типу обратной связи. Штамм SV164 (pGH5) подробно описан в патенте США 6180373.
Затем штамм Е.coli SV164 PL-tacadhE* cyaAK432Q (pGH5) может быть получен путем переноса фрагментов ДНК из хромосомы штамма MG1655 cyaAK432Qcat PLtac-adhE* в штамм Е.coli SV164 PL-tacadhE* (pGH5) с помощью Р1-трансдукции.
Штаммы Е.coli SV164 PL-tacadhE* cat-cyaAK432Q (pGH5) и SV164 PL-tacadhE* (pGH5) могут быть выращены с перемешиванием при 37°С в течение 18 часов в 3 мл питательного бульона с добавлением тетрациклина (маркера плазмиды pGH5, 20 мг/л). По 0.3 мл полученных культур может быть внесено в 3 мл ферментационной среды, содержащей тетрациклин (20 мг/л), в пробирках размером 20×200 мм, и культуры могут быть выращены при 37°С в течение 48 часов на роторной качалке при 250 об/мин. После выращивания количество накопленного в среде триптофана может быть определено с помощью TLC, как описано в Примере 6.
Компоненты ферментационной среды представлены в Таблице 3; группы компонентов А, В, С, D, Е, F и Н стерилизуют отдельно, как и показано в Таблице 3, чтобы избежать нежелательных взаимодействий во время стерилизации.
Пример 9. Влияние мутации гена суаА на продукцию L-глутаминовой кислоты.
Для оценки влияния мутации K432Q гена суаА на продукцию L-глутаминовой кислоты ДНК-фрагменты хромосомы описанного выше штамма Е.coli MG1655::PL-tacadhE* (US2009203090 (А1) могут быть перенесены в штамм-продуцент L-глутаминовой кислоты Е.coli VL334thrC+ (Европейский Патент 1172433) с помощью Р1-трансдукции (Miller, J.H; (1972) Experiments in Molecular Genetics, Cold Spring Harbor Lab. Press, Plainview, NY) с целью получения штамма VL334thrC+ PL-tacadhE*. Штамм VL334thrC+ депонирован во Всероссийской коллекции промышленных микроорганизмов (Россия, 117545 Москва, 1-й Дорожный проезд, 1) 6 декабря 2004 г. с инвентарным номером ВКПМ В-8961, затем 8 декабря 2004 г. было произведено международное депонирование этого штамма согласно условиям Будапештского Договора.
Затем штамм Е.coli VL334thrC+ PL-tacadhE* cyaAK432Q может быть получен путем переноса фрагментов ДНК из хромосомы штамма MG1655 cyaAK432Qcat PLtac-adhE* в штамм Е.coli VL334thrC+ PL-tacadhE* с помощью Р1-трансдукции.
Штаммы Е.coli VL334thrC+ PL-tacadhE* cyaAK432Q и VL334thrC+ PL-tacadhE* могут быть выращены при 37°С со встряхиванием в течение 18 ч в 3 мл питательной среды. По 0.3 мл полученных культур могут быть инокулированы в 3 мл ферментационной среды в пробирках 20×200 мм и могут быть выращены при 37°С в течение 48 ч на роторной качалке при 250 об/мин.
Состав ферментационной среды (рН 7.2) (г/л):
Этанол и СаСО3 стерилизуют отдельно.
Пример 10. Влияние мутации гена суаА на продукцию L-валина.
Для оценки влияния мутации K432Q гена суаА на продукцию L-валина сначала был сконструирован штамм-продуцент L-валина Е.coli H-81 PL-tacadhE* путем переноса фрагментов ДНК хромосомы штамма Е.coli MG1655::PL-tacadhE* (патентная заявка США 2009203090 А1) в штамм - продуцент валина Е.coli H-81 с помощью Р1 трансдукции (Miller, J.H. Experiments in Molecular Genetics, Cold Spring Harbor Lab. Press, 1972, Plainview, NY). Затем штамм Е.coli H-81 PL-tacadhE* cyaAK432Q был получен путем переноса фрагментов ДНК хромосомы штамма Е.coli MG1655 cyaAK432Qcat PLtac-adhE* в штамм Е.coli H-81 PL-tacadhE* с помощью Р1 трансдукции.
Штаммы H-81 PL-tacadhE* cyaAK32Q и H-81 PL-tacadhE* культивировали при 37°С в течение 18 ч в питательной среде и по 0.1 мл каждой из полученных культур инокулировали в 2 мл ферментационной среды в пробирках 20×200 мм и культивировали при 32°С в течение 72 ч на роторной качалке. После культивирования в течение 24 часов в ферментационной среде, содержащей этанол, и в течение 18 часов в ферментационной среде, содержащей глицерин, определяли количество накопленного L-валина с использованием метода ТСХ, как описано в Примере 6. Результаты 8 независимых пробирочных ферментации приведены в Таблице 2.
Как следует из Таблицы 2, штамм H-81 PL-tacadhE* cyaAK432Q накапливал большее количество L-валина по сравнению со штаммом H-81 PL-tacadhE* как на среде, содержащей этанол, так и на среде, содержащей глицерин.
Состав среды для ферментации (г/л):
СаСО3 стерилизовали сухим жаром при 180°С в течение 2 ч. Значение рН доводили до 7.0.
Хотя указанное изобретение описано в деталях со ссылкой на Наилучший способ осуществления изобретения, для специалиста в указанной области техники очевидно, что могут быть совершены различные изменения и произведены эквивалентные замены, и такие изменения и замены не выходят за рамки настоящего изобретения.
Каждому из упомянутых выше документов соответствует ссылка, и все цитируемые документы являются частью описания настоящего изобретения.
рН раствора А доводят до значения 7.1 при помощи NH4OH.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ L-АМИНОКИСЛОТ С ИСПОЛЬЗОВАНИЕМ БАКТЕРИИ СЕМЕЙСТВА ENTEROBACTERIACEAE | 2007 |
|
RU2364628C2 |
| СПОСОБ ПОЛУЧЕНИЯ L-АМИНОКИСЛОТ С ИСПОЛЬЗОВАНИЕМ БАКТЕРИЙ, ПРИНАДЛЕЖАЩИХ К РОДУ ESCHERICHIA | 2005 |
|
RU2304615C2 |
| СПОСОБ ПОЛУЧЕНИЯ L-треонина С ИСПОЛЬЗОВАНИЕМ БАКТЕРИИ, ПРИНАДЛЕЖАЩЕЙ К РОДУ Escherichia | 2006 |
|
RU2351646C2 |
| СПОСОБ ПОЛУЧЕНИЯ L-АМИНОКИСЛОТ С ИСПОЛЬЗОВАНИЕМ БАКТЕРИИ СЕМЕЙСТВА Enterobacteriaceae | 2010 |
|
RU2497943C2 |
| СПОСОБ ПОЛУЧЕНИЯ L-АРГИНИНА С ИСПОЛЬЗОВАНИЕМ БАКТЕРИИ, ПРИНАДЛЕЖАЩЕЙ К РОДУ Escherichia, В КОТОРОЙ ИНАКТИВИРОВАН ОПЕРОН relBE | 2005 |
|
RU2313574C2 |
| СПОСОБ ПОЛУЧЕНИЯ L-АМИНОКИСЛОТЫ С ИСПОЛЬЗОВАНИЕМ БАКТЕРИИ СЕМЕЙСТВА Enterobacteriaceae | 2010 |
|
RU2501856C2 |
| СПОСОБ ПОЛУЧЕНИЯ НЕАРОМАТИЧЕСКИХ L-АМИНОКИСЛОТ С ИСПОЛЬЗОВАНИЕМ БАКТЕРИИ, ПРИНАДЛЕЖАЩЕЙ К РОДУ ESCHERICHIA, В КОТОРОЙ ИНАКТИВИРОВАН ГЕН csrA | 2005 |
|
RU2311453C2 |
| СПОСОБ ПОЛУЧЕНИЯ L-ТРЕОНИНА С ИСПОЛЬЗОВАНИЕМ БАКТЕРИИ, ПРИНАДЛЕЖАЩЕЙ К РОДУ Escherichia, В КОТОРОЙ ИНАКТИВИРОВАН ГЕН yrbG | 2006 |
|
RU2330881C2 |
| СПОСОБ ПОЛУЧЕНИЯ L-ТРЕОНИНА ИЛИ L-АРГИНИНА С ИСПОЛЬЗОВАНИЕМ БАКТЕРИИ, ПРИНАДЛЕЖАЩЕЙ К РОДУ Escherichia, В КОТОРОЙ ИНАКТИВИРОВАН ГЕН bisC | 2006 |
|
RU2337958C2 |
| СПОСОБ ПОЛУЧЕНИЯ L-АМИНОКИСЛОТ С ИСПОЛЬЗОВАНИЕМ БАКТЕРИИ, ПРИНАДЛЕЖАЩЕЙ К РОДУ Escherichia, В КОТОРОЙ ИНАКТИВИРОВАН ГЕН leuO | 2006 |
|
RU2312894C1 |

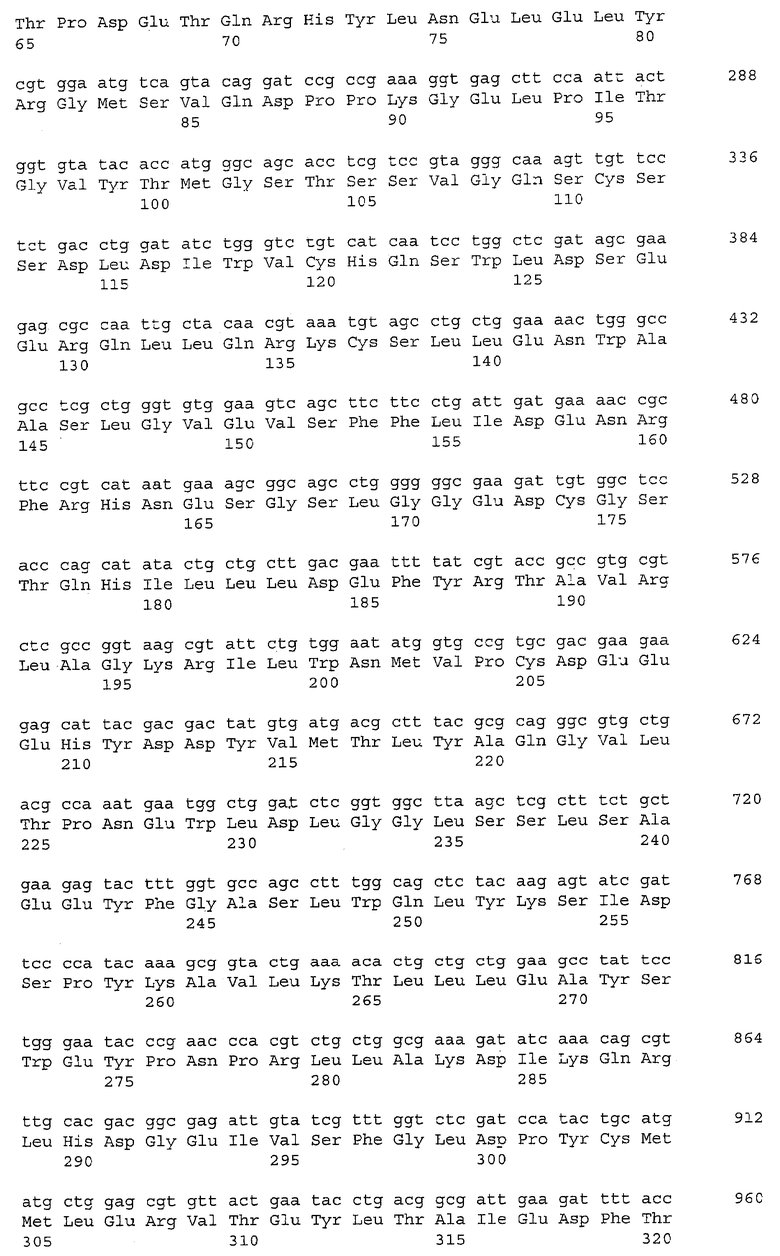

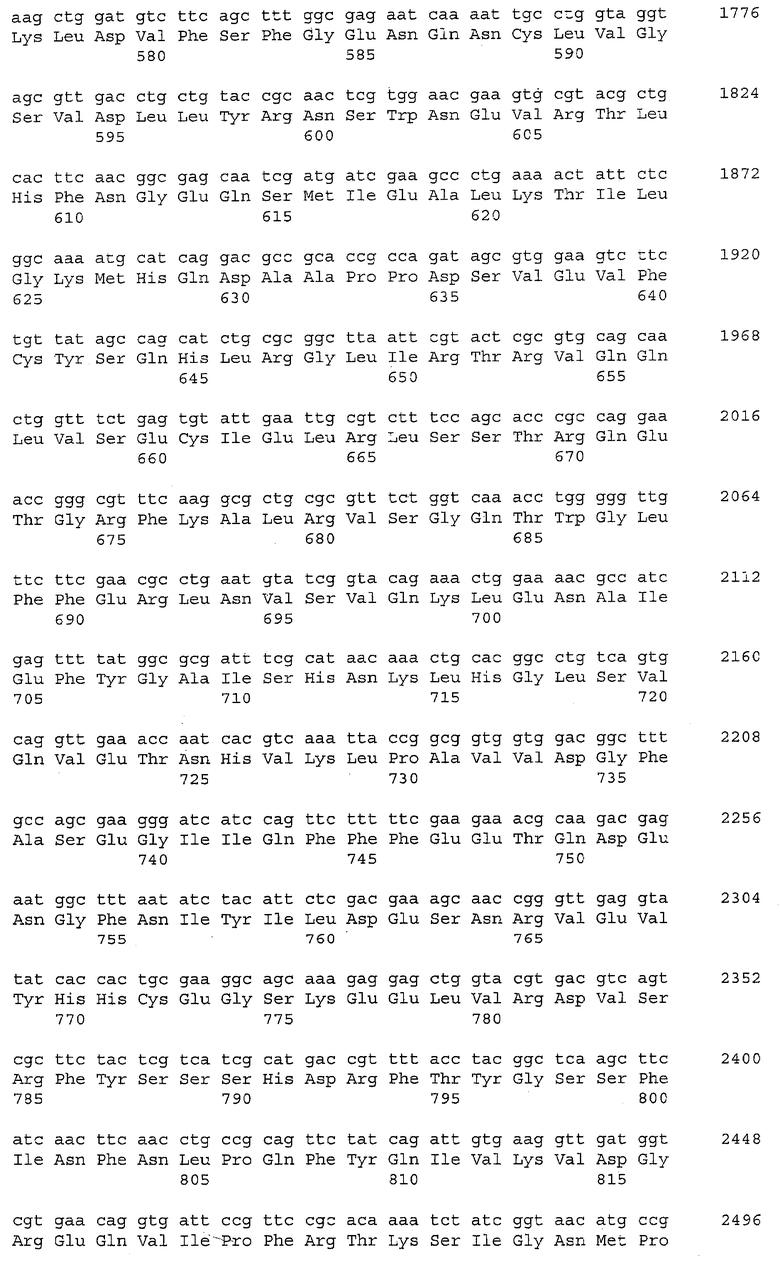





Изобретение относится к области биохимии. Представлена мутантная аденилатциклаза, имеющая аминокислотную последовательность, представленную как SEQ ID NO:2, в котором остаток L-лизина в положении, соответствующем положению 432 в SEQ ID NO:2, замещен на остаток L-глутамина, и вариант мутантной аденилатциклазы, имеющей аминокислотную последовательность, представленную как SEQ ID NO:2, в котором остаток L-лизина в положении, соответствующем положению 432 в SEQ ID NO:2, замещен на остаток L-глутамина, содержащего делецию, вставку, добавление и/или замену одного или нескольких аминокислотных остатков и обладающего активностью аденилатциклазы в соответствии с последовательностью, представленной в SEQ ID NO:2. Представлена ДНК, кодирующая мутантную аденилатциклазу. Преставлена бактерия семейства Enterobacteriaceae, содержащая ДНК, кодирующую мутантную аденилатциклазу, - продуцент протеиногенной L-аминокислоты. Раскрыт способ получения протеиногенной L-аминокислоты, включающий выращивание бактерии в питательной среде, содержащей в качестве основного источника углерода этанол и/или глицерин, и выделение указанной L-аминокислоты из культуральной жидкости. Изобретение позволяет получать L-аминокислоту с высокой степенью эффективности. 4 н. и 6 з.п. ф-лы, 3 табл., 10 пр.
1. Мутантная аденилатциклаза, выбранная из группы, состоящей из:
(A) белка, имеющего аминокислотную последовательность, представленную как SEQ ID NO:2, в котором остаток L-лизина в положении, соответствующем положению 432 в SEQ ID NO:2, замещен на остаток L-глутамина; и
(B) варианта белка, имеющего аминокислотную последовательность, представленную как SEQ ID NO:2, в котором остаток L-лизина в положении, соответствующем положению 432 в SEQ ID NO:2, замещен на остаток L-глутамина, содержащего делецию, вставку, добавление и/или замену одного или нескольких аминокислотных остатков и обладающего активностью аденилатциклазы в соответствии с последовательностью, представленной в SEQ ID NO:2.
2. ДНК, кодирующая мутантную аденилатциклазу по п.1.
3. Бактерия семейства Enterobacteriaceae, содержащая ДНК по п.2, - продуцент протеиногенной L-аминокислоты, выбранной из группы, состоящей из L-треонина, L-лизина, L-цистеина, L-метионина, L-лейцина, L-изолейцина, L-валина, L-гистидина, глицина, L-серина, L-аланина, L-аспарагина, L-аспарагиновой кислоты, L-глутамина, L-глутаминовой кислоты, L-пролина, L-аргинина, L-фенилаланина, L-тирозина и L-триптофана.
4. Бактерия по п.3, отличающаяся тем, что указанная бактерия принадлежит к роду Escherichia.
5. Бактерия по п.4, отличающаяся тем, что указанная бактерия принадлежит к виду Escherichia coli.
6. Способ получения протеиногенной L-аминокислоты, выбранной из группы, состоящей из L-треонина, L-лизина, L-цистеина, L-метионина, L-лейцина, L-изолейцина, L-валина, L-гистидина, глицина, L-серина, L-аланина, L-аспарагина, L-аспарагиновой кислоты, L-глутамина, L-глутаминовой кислоты, L-пролина, L-аргинина, L-фенилаланина, L-тирозина и L-триптофана, включающий выращивание бактерии по любому из пп.3-5 в питательной среде, содержащей в качестве основного источника углерода этанол и/или глицерин, и выделение указанной L-аминокислоты из культуральной жидкости.
7. Способ по п.6, отличающийся тем, что указанная протеиногенная L-аминокислота выбрана из группы, состоящей из ароматической L-аминокислоты и неароматической L-аминокислоты.
8. Способ по п.7, отличающийся тем, что указанная ароматическая L-аминокислота выбрана из группы, состоящей из L-фенилаланина, L-тирозина и L-триптофана.
9. Способ по п.7, отличающийся тем, что указанная неароматическая L-аминокислота выбрана из группы, состоящей из L-треонина, L-лизина, L-цистеина, L-метионина, L-лейцина, L-изолейцина, L-валина, L-гистидина, глицина, L-серина, L-аланина, L-аспарагина, L-аспарагиновой кислоты, L-глутамина, L-глутаминовой кислоты, L-пролина и L-аргинина.
10. Способ по любому из пп.6 или 7, отличающийся тем, что указанная протеиногенная L-аминокислота выбрана из группы, состоящей из L-фенилаланина, L-треонина и L-валина.
| СПОСОБ ПОЛУЧЕНИЯ L-АМИНОКИСЛОТ, ШТАММ Escherichia coli - ПРОДУЦЕНТ L-АМИНОКИСЛОТЫ (ВАРИАНТЫ) | 2001 |
|
RU2215785C2 |
| US 6403358 В1, 11.06.2002 | |||
| US 2006160192 A1, 20.07.2006 | |||
| МОДИФИЦИРОВАННАЯ АДЕНИЛАТЦИКЛАЗА BORDETELLA, СОДЕРЖАЩАЯ ДОМЕН ВЗАИМОДЕЙСТВИЯ CD11B/СD18 ИЛИ ЛИШЕННАЯ ДОМЕНА ВЗАИМОДЕЙСТВИЯ CD11b/CD18, И ЕЕ ПРИМЕНЕНИЕ | 2004 |
|
RU2421241C2 |
Авторы
Даты
2013-01-10—Публикация
2010-02-18—Подача