Изобретение относится к биологически активным веществам для приготовления лекарственных средств, используемых в терапии тяжелых заболеваний человека, вызванных гиперпродукцией фактора некроза опухолей (ФНО) и может быть использовано в биотехнологии, в частности в генетической инженерии, фармацевтической промышленности.
ФНО является одним из ключевых цитокинов, играющих центральную роль в регуляции защитных реакций организма, - способствует инфильтрации очага воспаления лейкоцитами, повышает уровень продукции молекул адгезии, активирует макрофаги, увеличивает проницаемость сосудов, способствует активации антигенпредставляющих клеток и др [1, 2]. Ввиду широкого спектра биологических эффектов, обусловленных связыванием ФНО с соответствующими рецепторами, нарушение уровня продукции данного цитокина может приводить к развитию патологических состояний, сопровождающихся хроническими воспалительными и/или аутоиммунными реакциями. Важным клиническим аспектом изучения ФНО является специфическое ингибирование его биологической активности при целом ряде заболеваний, включая широкий спектр инфекций и аутоиммунных патологий [3]. К таким патологиям относят ревматоидный артрит, псориаз, септический шок и ряд других [4, 5]. При вышеперечисленных заболеваниях в сыворотке крови и пораженных тканях пациентов наблюдается высокий уровень ФНО (наряду с другими воспалительными цитокинами, хемокинами и ростовыми факторами). Для терапии заболеваний, основные патологические процессы которых обусловлены гиперпродукцией ФНО, применяются и создаются биологические препараты, блокирующие ФНО на уровне транскрипции, трансляции, процессинга, а также препараты, блокирующие взаимодействия ФНО с их рецепторами и передачу сигнала [3, 6]. На настоящий момент в клинической практике применяются препараты, способные с высокой афинностью связывать ФНО, - это препарат, созданный на основе клеточного рецептора ФНО - Etanercept и препараты на основе моноклональных анти-ФНО антител - Infliximab, Adalimumab [7, 8].
Infliximab - препарат, представляющий собой химерные моноклональные антитела, состоящие из константного участка легкой цепи человеческого IgG1 и вариабельного участка мышиных антител [9]. Это довольно высокоспецифичный препарат, что уменьшает его побочные действия на другие биологические пути, однако наличие вариабельного фрагмента мышиных антител может вызывать иммунный ответ на препарат при введении его больному [10].
Adalimumab - препарат, представляющий собой моноклональные анти-ФНО антитела IgG1 человека. Он специфически связывает ФНО, тем самым блокирует взаимодействие ФНО с его клеточными рецепторами [8], в исследованиях in vitro индуцирует клеточный лизис и апоптоз [11].
Etanercept - белковый препарат, который состоит из двух экстраклеточных доменов человеческого рецептора ФНО p75, связанных с Fc-фрагментом IgG1 человека [3]. Наличие Fc-фрагмента IgG1 увеличивает время циркуляции молекулы, обеспечивая пролонгирование действия [8].
Все три вышеперечисленных анти-ФНО препарата со сравнимой эффективностью связывают растворимую форму ФНО и это связывание высокоаффинное. Однако данные препараты проявляют различную терапевтическую эффективность при лечении одних и тех же заболеваний. Так, Etanercept эффективен при лечении ревматоидного артрита и псориаза, Infliximab и Adalimumab - при болезни Крона и язвенном колите. Кроме того, различия в эффективности препаратов обусловлены различиями биологических активностей анти-ФНО белков: Etanercept - единственный из анти-ФНО препаратов, способный связывать и нейтрализовывать лимфотоксин [12, 13]. Infliximab и Adalimumab, в отличие от Etanercept, способны фиксировать комплемент и, следовательно, приводить к лизису клеток, экспрессирующих мембраносвязанный ФНО [12]. Отличия в фармакокинетике и в распределении лекарственных средств между тканями организма также могут объяснять различную терапевтическую эффективность препаратов при лечении одних и тех же заболеваний [7]. Таким образом, несмотря на применяемые терапевтические средства, связывающие ФНО, существует необходимость расширения, спектра таких средств, обусловленная еще и тем, что в течение терапии может теряться чувствительность к одному анти-ФНО препарату, и в этом случае встает вопрос о назначении пациенту другого препарата. Проблема создания новых терапевтических средств, направленных на лечение заболеваний, связанных с гиперпродукцией ФНО, остается актуальной на настоящий момент.
Ранее в экспериментах in vitro на культуре клеток мышиных фибробластов L-929 нами (авторами) было показано, что ФНО-связывающие белки ортопоксвирусов эффективно нейтрализуют цитопатическое действие ФНО различных видов позвоночных. В отношении нейтрализации цитотоксического действия ФНО человека наиболее выраженный эффект наблюдался для ФНО-связывающего белка вируса натуральной оспы (CrmB ВНО) [14]. Также были проведены исследования по определению терапевтической эффективности белка CrmB ВНО на мышиной модели липополисахарид (ЛПС) - индуцированного эндотоксического шока. В результате данного исследования было выявлено, что введение рекомбинантного белка CrmB ВНО мышам с эндотоксическим шоком приводило к отчетливому снижению гистопатологических изменений внутренних органов по сравнению с животными, не получавшими этого белка. При введении рекомбинантного белка CrmB ВНО интактным мышам не наблюдалось каких-либо изменений в поведении животных, их внешнем виде и в гистологическом строении внутренних органов в сравнении с мышами контрольной группы. Это свидетельствует об отсутствии токсического действия белка при использованной схемы введения препарата [15, 16].
Таким образом, полученные нами (авторами) данные в экспериментах in vivo и in vitro позволяют рассматривать белок CrmB ВНО, как основу для создания терапевтических средств, направленных на лечение заболеваний, вызванных гиперпродукцией ФНО. Однако в ходе дальнейших исследований было показано, что белок CrmB ВНО обладает способностью к олигомеризации. При гель-фильтрации полноразмерного CrmB ВНО было установлено, что биологическая активность, нейтрализующая in vitro цитотоксическое действие ФНО человека и ФНО мыши на культуре клеток мышиных фибробластов L-929, ассоциируется с фракциями свободного объема (более 500 кДа), что соответствует молекулярной массе олигомерного комплека [17]. Кроме того, Alejo с соавторами было установлено, что за связывание с ФНО ответственен только N-концевой домен белка (ФНО-связывающий домен), в то время как С-концевой участок белка (SECRET-домен) ответственен за связывание с хемокинами, причем эти два домена являются структурно обособленными [18]. Поэтому нами было решено создать укороченный вариант белка CrmB ВНО, а именно белок CrmB, у которого удален SECRET-домен, не влияющий на способность белка связывать ФНО. Таким образом, возможно, удастся оптимизировать структуру вирусного белка с целью уменьшения терапевтической дозы потенциального препарата и снижения его иммуногенности за счет уменьшения молекулярной массы белка и возможной потерей способности к олигомеризации. Такой делеционный вариант - белок CrmB ВНО с делетированным SECRET-доменом, вероятно, является более перспективной белком-основой для создания терапевтических средств, направленных на лечение заболеваний, вызванных гиперпродукцией ФНО, нежели целевой CrmB ВНО.
Авторами получена продукция белка CrmB ВНО с делетированным SECRET-доменом в прокариотической и эукариотической системах экспрессии.
Наиболее близким техническим решением (прототипом) является рекомбинантная плазмидная ДНК pFastBac-G2R-IgG (патент РФ №2376375, МПК C12N15/62, опубл. 20.12.2009 г.) [19] для обеспечения экспрессии растворимого химерного белка, состоящего из белка вируса натуральной оспы, связывающего фактор некроза опухолей, и фрагмента тяжелой цепи иммуноглобулина G человека размером 6444 п.н. и молекулярной массой 4,18 мДа, содержащая в соответствии с физической картой плазмиды:
- ПЦР-фрагмент генома вируса натуральной оспы штамма India-67 длиной 1068 п.н., кодирующий ФНО-связывающий белок без стоп-кодона, полученный с использованием праймеров
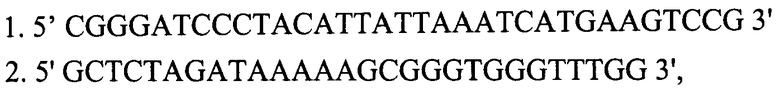
фланкированный сайтами узнавания эндонуклеаз рестрикции BamHI и XbaI;
- фрагмент генома человека длиной 699 п.н., кодирующий фрагмент тяжелой цепи IgG1 человека с 117 по 329 а.к., полученный из плазмиды pBluescript-IgG1 после гидролиза эндонуклеазами рестрикции XbaI и HindIII;
- BamHI - HindIII фрагмент векторной плазмиды pFastBac, размером 4677 п.н., включающий бакуловирусный промотор pPolh, мини-Tn7-транспазон и сигнал для полиаденилирования вируса SV-40, обеспечивающий сайт-специфическую транспозицию ДНК химерного гена G2R-IgG в геном бакуловируса;
- генетические маркеры:
- ген α-лактамазы, определяющий устойчивость к ампициллину;
- ген аминогликозидтрансферазы, определяющий устойчивость к
гентамицину;
- уникальные сайты рестрикции: BamHI (4033), HindIII (5806).
С помощью рекомбинантной плазмидной ДНК pFastBac-G2R-IgG получен штамм рекомбинантного бакуловируса BvG2RIgG, депонированный в Коллекции микроорганизмов ФГУН ГНЦ ВБ «Вектор» Роспотребнадзора под номером V-354, - продуцент растворимого химерного белка, состоящего из белка вируса натуральной оспы, связывающего фактор некроза опухолей, и фрагмента тяжелой цепи иммуноглобулина G человека.
Однако в отличие от патента-аналога (прототипа) рекомбинантного штамма бакуловируса BVG2RIgG [19], полученный (заявляемый) рекомбинантный штамм бакуловируса BV/G2R-dSECRET при заражении клеток насекомых Sf-21 обеспечивает продукцию белка CrmB вируса натуральной оспы с делетированным SECRET-доменом, который способен связывать ФНО, но не связывает хемокины. При изучении полученного белка было показано, что удаление SECRET-домена не приводит к утрате биологических свойств по связыванию ФНО in vivo и in vitro, а также не снижает эффективность этого связывания, поэтому данный белок может быть взят за основу терапевтических средств, направленных на лечение заболеваний, вызванных гиперпродукцией ФНО. Таким образом, заявляемый рекомбинантный бакуловирус BV/G2R-dSECRET, обеспечивающий продукцию белка CrmB вируса натуральной оспы с делетированным SECRET-доменом в культуре клеток насекомых Sf-21, расширяет диапазон биологически активных веществ (белков), которые могут использоваться для создания ФНО-блокаторов.
Техническим результатом настоящего изобретения является расширение спектра биологически активных белковых веществ, предназначенных для получения лекарственных средств нового поколения и используемых при лечении заболеваний человека, связанных с гиперпродукцией ФНО.
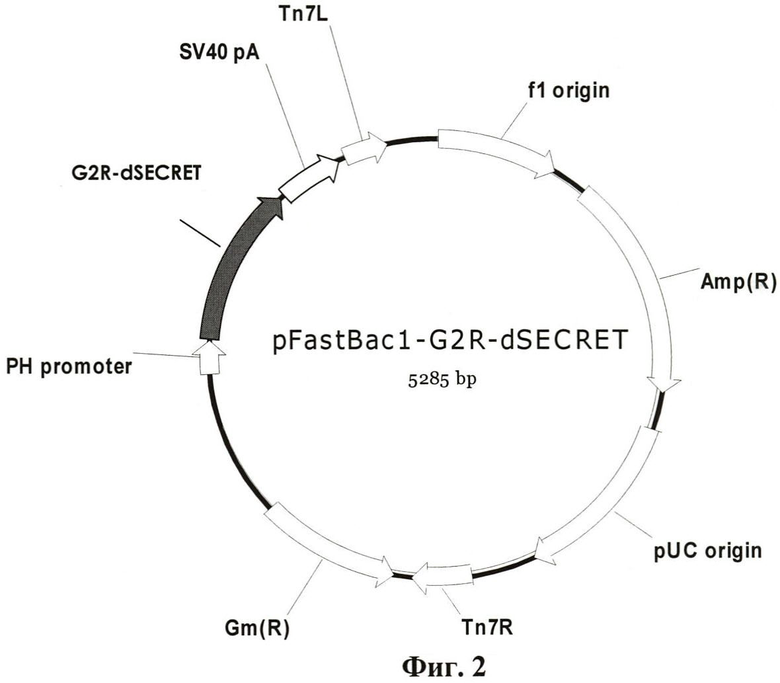
Указанный технический результат достигается путем создания рекомбинантной плазмидной ДНК pFastBac1-G2R-dSECRET размером 5285 п.н. и молекулярной массой 3,43 мДа, несущей фрагмент генома вируса натуральной оспы штамма India-1967, кодирующий ФНО-связывающий домен белка CrmB, содержащая:
- ПЦР-фрагмент генома вируса натуральной оспы штамма India-67 длиной 525 п.н., кодирующий ФНО-связывающий домен белка CrmB ВНО (штамм India-1967), полученный с помощью праймеров
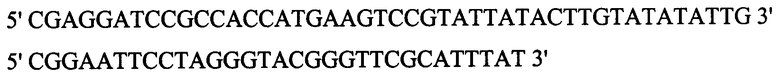
фланкированный сайтами узнавания эндонуклеаз рестрикции EcoRI и BamHI;
- EcoRI - BamHI фрагмент векторной плазмиды pFastBac1, размером 4760 п.н., включающий бакуловирусный промотор pPolh, мини-Tn7-транспазон и сигнал для полиаденилирования вируса SV-40.
Указанный технический результат достигается также получением нового штамма рекомбинантного бакуловируса Bv/G2R-dSECRET, полученный с помощью рекомбинантной плазмидной ДНК pFastBac1-G2R-dSECRET по п.1, депонированный в коллекции микроорганизмов ФГУН ГНЦ ВБ «Вектор» Роспотребнадзора под номером V-537 - продуцент ФНО-связывающего домена белка CrmB ВНО (штамм India-1967).
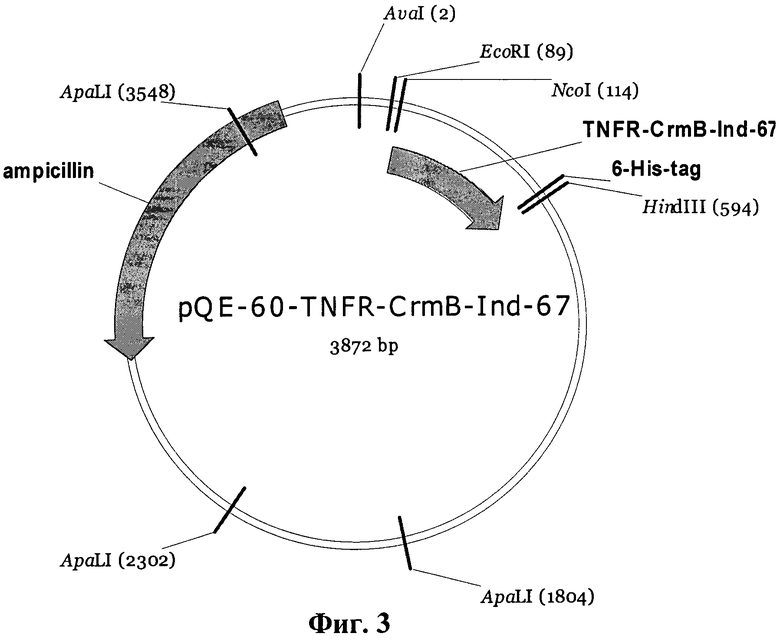
Указанный технический результат достигается также получением рекомбинантной плазмидной ДНК pQE-60-TNFR-CrmB-Ind-67 размером 3872 п.н. и молекулярной массой 2,5 мДа, депонированной в коллекции микроорганизмов ФГУН ГНЦ ВБ «Вектор» Роспотребнадзора под номером P-48 и несущей фрагмент генома вируса натуральной оспы штамма India-1967, кодирующий ФНО-связывающий домен белка CrmB, содержащая:
- ПЦР-фрагмент генома вируса натуральной оспы штамма India-67 длиной 453 п.н., кодирующий ФНО-связывающий домен белка CrmB ВНО (штамм India-1967), полученный с помощью праймеров
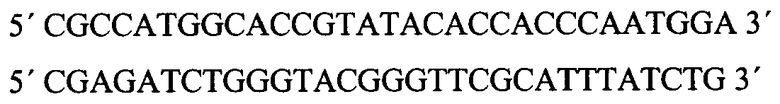
фланкированный сайтами узнавания эндонуклеаз рестрикции NcoI и BglII;
- NcoI - BglII фрагмент векторной плазмиды pFastBac1, размером 3419 п.н., включающий ген β-лактамазы, определяющий устойчивость к ампициллину, область начала (ориджин) репликации ColEI. Указанная рекомбинантная плазмидная ДНК pQE-60-TNFR-CrmB-Ind-67 предназначена для трансформации в клетках штамма E.coli SG13009[pRep4] - продуцента ФНО-связывающего домена белка CrmB ВНО.
При заражении полученным рекомбинантным бакуловирусом клеток насекомых линии Sf-21 наблюдается продукция укороченного варианта ФНО-связывающего белка CrmB ВНО.
В клетках E.coli SG13009[pRep4], трансформированных заявляемой плазмидой pQE-60-TNFR-CrmB-Ind-67, также наблюдается продукция укороченного варианта ФНО-связывающего белка CrmB ВНО.
В качестве плазмидного вектора, обеспечивающего сайт-специфическую транспозицию целевого фрагмента ДНК для получения рекомбинантного бакуловируса , используют плазмиду pFastBac1 [21]. Плазмида pFastBac1 содержит следующие элементы:
• детерминанты устойчивости к гентамицину и ампицилллину
• полилинкер для встройки целевого гена
• промотор гена полиэдрина, под контроль которого встраивается целевая последовательность гена для экспрессии белков в клетках насекомых
• сигнал для полиаденилирования вируса SV-40
• Tn7R и Tn7L - участки, по которым происходит транспозиция
Сайт-специфическая транспозиция происходит между плазмидой pFastBac1-G2R-dSECRET и бакуловирусной бакмидой bMON14272 [21], содержащей следующие генно-инженерные элементы:
• низкокопийный мини-F репликон
• ген устойчивости к канамицину
• участок интеграции транспозона Tn7
• последовательность, кодирующую α-донорный пептид β-галактозидазы E.coli, и обеспечивающую α-комплементацию при размножении в штамме E.coli DH10Bac в присутствии хромогенного субстрата X-gal и индуктора ИПТГ
Выбранная бакуловирусная система экспрессии обеспечивает высокий уровень синтеза целевого продукта и его правильную посттрансляционную модификацию по сравнению с другими системами экспрессии.
Сущность изобретения заключается в том, что фрагмент ДНК, содержащий ген ФНО-связывающего домена белка CrmB ВНО, с дополнительно введенными стоп кодоном и последовательностью Козак [20], получают в результате проведения ПЦР, используя праймеры:
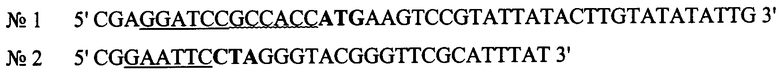
В структуре олигонуклеотидного праймера №1 содержится последовательность для гидролиза эндонуклеазой рестрикции BamHI (выделена подчеркиванием) и последовательность Козак [20] (выделена волнистой линией). Инициирующий триплет отображен жирным шрифтом.
В структуре олигонуклеотидного праймера №2 содержится последовательность для гидролиза эндонуклеазой рестрикции EcoRI (выделена подчеркиванием) и терминирующий кодон (отображен жирным шрифтом).
Далее рекомбинантную плазмиду pFastBac1, содержащую в своей структуре последовательность, кодирующую CrmB ВНО с делетированным SECRET доменом, получают путем клонирования соответствующего фрагмента вирусного генома в плазмиду интеграции pFastBac1 по сайтам эндонуклеаз рестрикции BamHI и EcoRI. Анализ выделенной плазмидной ДНК на наличие в ее структуре клонируемого фрагмента устанавливают путем гидролиза выделенной ДНК эндонуклеазами рестрикции BamHI и EcoRI, первичную структуру встроенной последовательности ДНК подтверждают секвенированием.
Затем путем сайт-специфической транспозиции в бактериальных клетках E.coli штамма DH10Bac образуется рекомбинантная бакмида, которую используют для трансфекции клеток насекомых Sf-21, в результате продуцируется рекомбинантный вирус Bv/G2R-dSECRET, обуславливающий экспрессию гена, кодирующего белок CrmB с удаленным SECRET-доменом. Нуклеотидная последовательность встроенного фрагмента приведена на фиг. 1.
Штамм характеризуется следующими признаками:
Морфологические признаки. Штамм обладает свойствами типичного представителя бакуловирусов, но в отличие от векторного вируса на среде с Х-Gal бляшки, формируемые рекомбинантным бакуловирусом, имеют фенотип Lac-.
Физиолого-биохимические характеристики и культуральные свойства штамма. ДНК рекомбинантного бакуловируса имеет длину около 140000 п.н. Наличие в его геноме целевой вставки длиной 525 п.н. подтверждено с помощью метода ПЦР. При размножении рекомбинантного бакуловируса на культуре клеток насекомых Sf-21 его титр не отличается от титра, получаемого при размножении вируса, не содержащего в своем геноме чужеродных фрагментов ДНК.
Основным отличием штамма является его способность опосредовать продукцию ФНО-связывающего белка CrmB ВНО с удаленным SECRET-доменом при инфицировании им культуры клеток насекомых Sf-21.
Полученный штамм рекомбинантного бакуловируса Bv/G2R-dSECRET депонирован в коллекции микроорганизмов ФГУН ГНЦ ВБ «Вектор» Роспотребнадзора за номером V-537.
Кроме того, техническая задача изобретения достигается путем создания рекомбинантной плазмиды pQE-60-TNFR-CrmB-Ind-67. В клетках E.coli штамма SG13009 [pRep4], трансформированных плазмидой pQE-60-TNFR-CrmB-Ind-67, наблюдается продукция укороченного варианта ФНО-связывающего белка CrmB ВНО.
Рекомбинантная плазмида pQE-60-TNFR-CrmB-Ind-67 была получена стандартными генно-инженерными методами, имеет размер 3872 п.н., молекулярную массу 2,5 мДа, состоит из:
• фрагмента геномной ДНК ВНО (штамм India-67) длиной 453 п.н., кодирующий ФНО-связывающий домен белка CrmB ВНО. Фрагмент встроен в ОРТ вектора pQE-60 (по сайтам эндонуклеаз рестрикции NcoI-BglII), таким образом, что в процессе трансляции на С-конце белка синтезируются дополнительные 6 аминокислотных остатков (гистидинов);
• векторной плазмиды pQE-60 [22] длиной 3419 п.н., обеспечивающей экспрессию гена, кодирующего ФНО-связывающий домен белка CrmB ВНО в клетках E.coli.
Фрагмент генома ВНО, используемый при создании рекомбинантной плазмиды, получали с помощью ПЦР. В качестве матрицы для проведения ПЦР использовали гибридную плазмиду, содержащую фрагмент ДНК ВНО штамма India-1967. Олигонуклеотидные праймеры для амплификации необходимого фрагмента ДНК вируса натуральной оспы имеют следующую структуру:
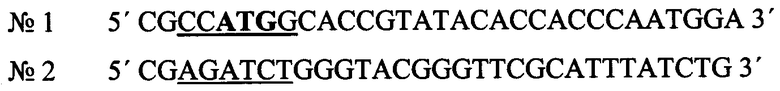
В структуре олигонуклеотидного праймера №1 содержится последовательность для гидролиза эндонуклеазой рестрикции NcoI (выделена подчеркиванием), жирным выделен инициирующий кодон.
В структуре олигонуклеотидного праймера №2 содержится последовательность для гидролиза эндонуклеазой рестрикции BglII (выделена подчеркиванием).
В качестве плазмидного вектора используют плазмиду pQE-60 [22]. Плазмида pQE-60 содержит следующие элементы:
• детерминанта устойчивости к ампициллину;
• полилинкер для встройки целевого гена;
• мотив, кодирующий 6 гистидинов;
• область начала репликации ColEI;
• промотор фага T5/элемент lac-оператора.
Сущность изобретения заключается в том, что фрагмент ДНК, содержащий ген ФНО-связывающего домена белка CrmB ВНО, получают в результате проведения ПЦР. Далее рекомбинантную плазмиду pQE-60, содержащую в своей структуре последовательность, кодирующую CrmB ВНО с делетированным SECRET доменом, получают путем клонирования соответствующего фрагмента вирусного генома в плазмиду pQE-60 по сайтам эндонуклеаз рестрикции NcoI и BglII. Анализ выделенной плазмидной ДНК на наличие в ее структуре клонируемого фрагмента устанавливают путем гидролиза выделенной ДНК эндонуклеазами рестрикции NcoI и BglII, первичную последовательность рекомбинантной плазмидной ДНК подтверждают секвенированием.
Основным отличием рекомбинантной плазмиды является ее способность опосредовать продукцию ФНО-связывающего белка CrmB ВНО с удаленным SECRET-доменом при трансформации клеток E.coli SG13009 [pRep4].
Полученная рекомбинантная плазмида pQE-60-TNFR-CrmB-Ind-67 депонирована в коллекции микроорганизмов ФГУН ГНЦ ВБ «Вектор» Роспотребнадзора под номером P-48.
Изобретение иллюстрируется следующими фигурами графических изображений: Фиг. 1 - нуклеотидная последовательность фрагмента гена G2R ВНО (штамм India-1967), кодирующего белок CrmB ВНО с делетированным SECRET-доменом, и расположение специфических праймеров (показаны жирным шрифтом) на матрице; Фиг. 2. - физическая карта рекомбинантной плазмидной ДНК pFastBac1-G2R-dSECRET; Фиг. 3 - физическая карта рекомбинантной плазмидной ДНК pQE-60-TNFR-CrmB-Ind-67.
Для лучшего понимания сущности изобретения ниже приведены примеры его осуществления.
Пример 1. Амплификация фрагмента генома вируса натуральной оспы, кодирующего белок CrmB с делетированным SECRET-доменом.
Реакцию амплификации проводят в пробирках типа «Eppendorf» на амплификаторе производства фирмы «Applied BioSystem», модели «GeneAmp PCR System 9700» в объеме 50 мкл. Реакционная смесь содержит 20 мМ Tris-HCl (pH 8.4), 50 мМ KCl, 1.5 мМ MgCl2, 0.2 мМ dTTP, 0.2 мМ dGTP, 0.2 мМ dATP, 0.2 мМ dCTP, 10 пмол каждого олигонуклеотидного праймера, 1.25 единиц активности Taq-ДНК-полимеразы («Invitrogen», США), 2-10 нг матричной ДНК. Амплификацию ведут в течение 30 циклов по следующей схеме:
Наличие амплифицированного продукта определяют с помощью электрофореза в 1.5 % агарозном геле.
Пример 2. Конструирование рекомбинантной плазмиды интеграции pFastBac1-G2R-dSECRET.
Рекомбинантную плазмиду pFastBac1, содержащую нуклеотидную последовательность, кодирующую CrmB ВНО с делетированным SECRET доменом (pFastBac1-G2R-dSECRET), получают путем клонирования соответствующего фрагмента вирусного генома в плазмиду интеграции pFastBac1 по сайтам эндонуклеаз рестрикции BamHI и EcoRI. Для этого гидролизуют плазмиду pFastBac1 эндонуклеазами рестрикции BamHI и EcoRI. Реакционная смесь содержит 5-8 мкг плазмидной ДНК, 1-2 единиц активности эндонуклеазы рестрикции, однократный буфер, оптимальный для используемой эндонуклеазы рестрикции. Реакцию проводят при температуре 37°С в течение 1.5-2 часов. Такие же манипуляции проводят с амплифицированным фрагментом вирусного генома, кодирующий белок CrmB вируса натуральной оспы с делетированным SECRET-доменом (гидролизуют эндонуклеазами рестрикции BamHI и EcoRI). Далее полученные гидролизованные фрагменты ДНК электрофоретически разделяют в 1.5% агарозном геле и затем элюируют ДНК из геля набором фирмы «Qiagen». Проводят реакцию лигирования. Реакционная смесь содержит 0.2 мкг вектора, гидролизованного эндонуклеазами рестрикции, 0.2 мкг амплифицированного фрагмента (предварительно гидролизованного соответствующими эндонуклеазами рестрикции), 5 единиц активности ДНК-лигазы фага Т4 («Invitrogen», США), однократный буфер для ДНК-лигазы фага T4. Реакцию проводят при температуре 22°С 5 часов. Полученной лигазной смесью трансформируют компетентные клетки E.coli XL2-blue. Для этого компетентные клетки размораживают во льду, добавляют смесь после лигирования, аккуратно перемешивают и инкубируют 30 мин во льду, после чего проводят инкубацию при температуре 42°С 2 мин и переносят пробирки в лед на 5 мин. Клетки высевают при помощи шпателя Дригальского на чашку Петри с селективной агаризованной средой, содержащей 100 мкг/мл ампициллина. После 12-часовой инкубации пересевают индивидуальные колонии в среду LB и инкубируют при 37°С до стационарной фазы роста. Рекомбинантную плазмидную ДНК выделяют по стандартной методике и анализируют с помощью эндонуклеаз рестрикции BamHI, EcoRI. Затем проводят анализ фрагментов ДНК, встроенных в структуру плазмиды pFastBac1, на наличие нуклеотидных замен. Определение нуклеотидной последовательности проводят на автоматическом секвенаторе 310 Genetic analyzer («PE BioSystems», США) с использованием реагента «BigDye-v.3.1» («PE BioSystems», США). На фиг. 1 представлены праймеры, которые использовались при создании рекомбинантной плазмидной ДНК pFastBac1-G2R-dSECRET. Сайты узнавания эндонуклеаз рестрикции BamHI, EcoRI показаны подчеркиванием. Инициирующий кодон указан на матричной ДНК жирным шрифтом.
Полученную таким образом целевую плазмиду обозначают pFastBac1-G2R-dSECRET. На фиг. 2 представлена физическая карта рекомбинантной плазмидной ДНК pFastBac1-G2R-dSECRET. За первый нуклеотид плазмиды принимается нуклеотид A межцистронной области фага f1; Tn7L, Tn7R- участки, по которым происходит транспозиция in vivo сегмента плазмидной ДНК; SV40polyA - сайт полиаденилирования вируса SV40; G2R-dSECRET - схематическое изображение нуклеотидной последовательности, кодирующей белок CrmB ВНО с делетированным SECRET-доменом; PH - промотор полиэдрина; ori - сайт инициации репликации; Ap(R), Gm(R) - гены, определяющие устойчивость к ампициллину и гентамицину, соответственно.
Пример 3. Получение рекомбинантной бакмиды bMON14272-G2R-dSECRET.
Компетентные клетки E.coli штамма DH10Bac трансформируют рекомбинантной плазмидой pFastBac1-G2R-dSECRET. Для этого к 100 мкл компетентных клеток E.coli добавляют 1 нг плазмиды pFastBac1-G2R-dSECRET. Полученную смесь инкубируют во льду в течение 30 мин, затем при 42°С в течение 45 сек с последующим охлаждением во льду в течение 2 мин. Реакционную смесь разводят 1:10 LB-бульоном и инкубируют при интенсивной аэрации при 37°С в течение 4 часов. Далее при помощи шпателя Дригальского клетки высевают на плотную селективную среду, содержащую 50 мкг/мл канамицина, 7 мкг/мл гентамицина, 10 мкг/мл тетрациклина, 40 мкг/мл ИПТГ, 100 мкг/мл Bluo-gal, инкубируют при температуре 37°С 24 часа. После чего отбирают индивидуальную белую колонию E.coli и для подтверждения ее фенотипа пересевают колонию на агаризованную среду (с добавлением всех компонентов, описанных выше) методом истощающего штриха. Клетки инкубируют при температуре 37°С 24 часа. Далее индивидуальную белую колонию пересевают в 2 мл L-бульона и инкубируют при температуре 37°С 24 часа. Выделяют бакмидную ДНК. Для этого культуру переносят в 1.5 мл пробирки, осаждают клетки центрифугированием при 14000×g, 1 мин. Далее супернатант удаляют, осадок ресуспендируют в 0.3 мл раствора 1 для выделения плазмидной ДНК, добавляют 0.3 мл раствора 2 для выделения плазмидной ДНК, мягко перемешивают, инкубируют 5 мин при комнатной температуре. После чего добавляют 0.3 мл раствора 3 для выделения плазмидной ДНК, инкубируют во льду 10 мин. Центрифугируют при 14000×g 10 мин. Отбирают супернатант и переносят в чистые пробирки, к супернатанту добавляют 0.8 мл изопропилового спирта, перемешивают и помещают пробирки в лед на 5 мин. Центрифугируют при 14000×g, 15 мин. Супернатант удаляют, а осадок промывают два раза 70 % этиловым спиртом, высушивают при комнатной температуре 15-20 мин и разводят ДНК в 40 мкл буфера TE. Наличие в геноме бакмиды интегрированного фрагмента ДНК подтверждают с помощью ПЦР, используя при этом специфичные для бакмидной ДНК праймеры. Полученную таким образом бакмидную ДНК bMON14272-G2R-dSECRET используют в дальнейшем для трансфекции клеток насекомых Sf-21.
Пример 4. Трансфекция клеток Sf-21 бакмидной ДНК bMON14272-G2R-dSECRET.
Засевают клетки Sf-21 в лунки шестилуночного планшета из расчета 2×106 клеток на лунку. На следующий день готовят в стерильных условиях два раствора: раствор А - 5 мкл вирусной бакмидной ДНК bMON14272-G2R-dSECRET смешивают со 100 мкл среды Грейса, не содержащей антибиотик; раствор Б - 6 мкл катионного липидного реагента CellFECTIN («LifeTecnologies», США). Далее полученные два раствора смешивают и инкубируют при комнатной температуре 45 мин. Удаляют из лунок планшета среду и промывают монослой клеток средой Грейса, не содержащей антибиотик, 2 раза. Затем к соединенным растворам А и Б добавляют 800 мкл среды Грейса, и полученную смесь наносят на монослой клеток. Инкубируют клетки в течение 15-18 часов при 28°С. После чего добавляют по 2 мл среды Грейса с 10 % эмбриональной сывороткой коров. Инкубируют клетки при 28°С 2-5 суток. Проводят три цикла замораживания - оттаивания для получения лизатов клеток. Лизаты клеток расфасовывают в пробирки. Хранят полученный таким образом рекомбинантный бакуловирус Bv/G2R-dSECRET при -20°С и используют для дальнейшего заражения клеток Sf-21.
Пример 5. Заражение клеток Sf-21 рекомбинантным бакуловирусом
Bv/G2R-dSECRET и определение его титра.
Засевают клетки Sf-21 на пластиковый культуральный матрац площадью 175 см2 в 50 мл среды Грейса, содержащей 10% эмбриональной сыворотки коров и гентамицин (концентрация антибиотика 80 мкг/мл) и инкубируют при 28°С до получения монослоя клеток. Далее удаляют среду, а на монослой наносят 200 мкл лизата клеток, полученного после трансфекции, и инкубируют 30 мин при периодическом покачивании. После чего добавляют 15 мл среды Грейса, содержащей 10% эмбриональной сыворотки коров. Инкубируют клетки при 28°С 2-5 суток. Далее клетки ресуспендируют (интенсивным пипетированием), центрифугируют 5 мин при 5000×g и осветленный супернатант расфасовывают в стерильные пробирки. Далее определяют титр вируса Bv/G2R-dSECRET следующим образом. В каждую лунку шестилуночного планшета наносят по 2 мл суспензии клеток Sf-21 в среде Грейса (с 10% эмбриональной сывороткой коров), содержащей около 5×106 кл/мл. Клетки инкубируют до образования монослоя при 28°С. Готовят разведения вируса (1 : 10, 1 : 102, …, 1 : 107) в 1 мл среды Грейса. Далее удаляют среду из лунок планшета и наносят по 1 мл вируса, разведенного в среде Грейса. Инкубируют 1 час при комнатной температуре. Готовят 2% легкоплавкую агарозу («Sigma», США), плавят ее и смешивают в соотношении 1 : 1 с 2-кратной средой Грейса (с 20% эмбриональной сывороткой коров). Полученную смесь охлаждают в термостате до 37°С и добавляют по 2 мл на лунку, предварительно удалив из лунок среду, содержащую вирус. Инкубируют 1 час при комнатной температуре - до застывания агарозы, далее проводят инкубацию при 28°С и влажности воздуха 98% 4 суток. Плавят 2% легкоплавкую агарозу, смешивают ее с 2-кратной средой Грейса (содержащей 20% эмбриональную сыворотку коров) в соотношении 1 : 1 и добавляют 1/100 объема 1% раствора нейтрального красного. Наносят на лунку по 1 мл полученной смеси и инкубируют при 28°С и влажности воздуха 98%, 12 часов. Подсчитывают количество бляшкообразующих единиц. Титр составляет 107 БОЕ/мл. Суспензию рекомбинантного вируса Bv/G2R-dSECRET хранят при -20°С.
Пример 6. Анализ экспрессии рекомбинантного ФНО-связывающего белка CrmB с делетированным SECRET-доменом вируса натуральной оспы в клетках насекомых линии Sf-21.
Продукцию рекомбинантного ФНО-связывающего белка CrmB вируса натуральной оспы с делетированным SECRET-доменом (CrmB ВНО dSECRET) в клетках насекомых линии Sf-21 оптимизируют, варьируя множественность заражения и продолжительность инфекции. Для этого клетки Sf-21 в лунках 24-луночного планшета заражают рекомбинантным вирусом Bv/G2R-dSECRET с множественностью заражения 0.01, 0.1, 3 и 7 БОЕ/мл и инкубируют при температуре 28°С. На 1-е, 2-е, …, 6-е сутки после заражения вирусом снимают контрольные точки, удаляя содержимое лунок. Затем методами дот-блот и Вестерн-блот-анализа устанавливают оптимальные продолжительность инкубации и множественность заражения, при которых наблюдается наибольший выход белка, что достигается при множественности заражения 0.1 БОЕ/мл и продолжительности инкубации с вирусным материалом 5 суток.
Пример 7. Очистка рекомбинантного ФНО-связывающего белка CrmB вируса натуральной оспы с делетированным SECRET-доменом.
Целевой белок выделяют из культуральной среды клеток Sf21 методом аффинной хроматографии. Для этого синтезируют аффинный сорбент на основе поперечно-сшитой агарозной матрицы - сефарозы CL-6B с иммобилизованным рекомбинантным ФНО. К 2 мл сефарозы CL-6B добавляли 20 мл 0.1 М раствора периодата натрия и инкубируют при 16°С в течение 16 ч. Активированный гель промывают водой и добавляют 1 мг мышиного ФНО в 50 мМ натрий-карбонатном буфере, рН 8.5. После 20 ч инкубации при 6°С в раствор добавляют 20 мг боргидрида натрия, перемешивая 2 ч. После этого сорбент последовательно промывают водой, 0.2 М раствором глицин-НС1, рН 2.5 и уравновешивают буфером PBS (10 мМ калий-фосфат, рН 7.0, 150 мМ NaCl). Содержание ФНО составляет 0.4 ± 0.1 мг/мл геля. Для очистки растворимого рекомбинантного ФНО-связывающего белка вируса натуральной оспы с делетированным SECRET-доменом используют культуральную жидкость клеток Sf21, зараженных рекомбинантным бакуловирусом Bv/G2R-dSECRET, клеточный дебрис удаляют низкоскоростным центрифугированием. Для уменьшения объема раствора белок предварительно осаждают сульфатом аммония (50% насыщения). После растворения осадка и диализа раствор наносят на аффинную колонку со скоростью протока жидкости 1 объем колонки в час. Сорбент отмывают буфером, содержащим 0.2 М NaCl, и элюцию проводят 0.2 М раствором глицин-НС1, рН 2.5, нейтрализуя раствор в собираемых фракциях 1 М раствором Трис-НС1, рН 8.8. Выход гомогенного белка составяет 4-6 мг из 1 л культуральной жидкости инфицированных клеток.
Пример 8. Определение биологической активности ФНО-связывающего белка CrmB вируса натуральной оспы с делетированным SECRET-доменом in vitro.
Биологическую активность ФНО-связывающего белка CrmB вируса натуральной оспы с делетированным SECRET-доменом определяют по его способности ингибировать цитотоксическое действие ФНО человека и мыши на культуре клеток фибробластов мыши L-929. Для этого засевают клетки L-929 в среде DMEM с 10% эмбриональной сывороткой коров в лунки 96-луночного планшета и инкубируют в СО2-инкубаторе (концентрация СО2 5%) при 37°С до формирования клетками монослоя. Размораживают клетки Sf-21, трансфицированные рекомбинантными бакуловирусами, и готовят серию разведений (1 : 1; 1 : 2; 1 : 4; 1 : 8; …; 1 : 1024) объемом по 100 мкл каждое разведение в среде DMEM с 2% эмбриональной сывороткой коров, в каждое разведение добавляют ФНО (1.5 нг/мл) и актиномицин D (1 мкг/мл), наносят на лунки планшета (при проведении экспериментов используют концентрации ФНО, которые, по данным предварительно проведенного определения их цитотоксичности, соответствуют шестикратной дозе, обеспечивающей 50% цитопатическое действие). Планшеты инкубируют при 37°С в СО2-инкубаторе (концентрация СО2 составляла 5%). Через 18 часов количество живых клеток определяют окрашиванием красителем нейтральный красный. Измеряют оптическую плотность на приборе Microplate Reader ELX808 («BIO-TEK INSTRUMENTS , INC», США). Результаты выражают в процентном отношении выживших клеток относительно количества клеток в необработанных ФНО контрольных пробах. Каждая проба берется в трех повторах, и среднее значение процента выживаемости высчитывается по формуле:
(ODФНО + CrmB - ODФНО)/(ODL-929 - ODФНО) × 100 %,
где ОDФНО - фоновое значение OD в лунках планшета, содержащих клетки L-929 и ФНО;
ОDФНО + CrmB - ODФНО в лунках планшета, содержащих клетки L-929, ФНО и ФНО-связывающие белки;
ODL-929 - ODФНО в лунках планшета, содержащих клетки L-929.
По данным ингибирования цитотоксического действия ФНО человека и мыши на культуре клеток фибробластов мыши L-929 50% гибель клеток наблюдается при добавлении 40-100 нг/мл ФНО-связывающего белка CrmB вируса натуральной оспы с делетированным SECRET-доменом, что сопоставимо с данными для полноразмерного белка CrmB ВНО.
Пример 9. Определение биологической активности ФНО-связывающего белка CrmB вируса натуральной оспы с делетированным SECRET-доменом in vivo.
Биологическую активность ФНО-связывающего белка CrmB вируса натуральной оспы с делетированным SECRET-доменом in vivo определяют на мышиной модели ЛПС-индуцированного эндотоксического шока. Для этого используют самцов мышей линии BALB/с, 4-недельного возраста, из питомника лабораторных животных ФГУН ГНЦ ВБ «Вектор», Россия. Опыты на животных проводят после недельной адаптации, в соответствии с Протоколом, утвержденным Биоэтическим комитетом ФГУН ГНЦ ВБ «Вектор». Формируют 8 групп животных по 6-8 мышей в каждой группе для визуального наблюдения и изучения выживаемости. Первая группа (контрольная) - животные, которым дважды (с интервалом в 16 часов) вводится 1% бычий сывороточный альбумин. Вторая группа (контрольная) - животные, которым дважды (с интервалом в 16 часов) вводится в 100 мкл PBS 10 мкг/мышь ФНО-связывающего белка CrmB вируса натуральной оспы с делетированным SECRET-доменом. Третья группа (контрольная) - животные, которым дважды (с интервалом в 16 часов) вводится в 100 мкл PBS 10 мкг/мышь ФНО-связывающего белка CrmB вируса натуральной оспы. Четвертая группа (контрольная) - животные, которым вводят сенсибилизирующую (250 мкг/мышь) и, через 16 ч, разрешающую дозы бактериального ЛПС (300 мкг/мышь) в 100 мкл PBS. Пятая группа (экспериментальная) - животные, которым вводят сенсибилизирующую дозу ЛПС, через 16 ч вводят 0.2 мкг/мышь белка CrmB вируса натуральной оспы с делетированным SECRET-доменом, по прошествии 0.5 часов после введения белка вводят разрешающую дозу ЛПС. Шестая группа (экспериментальная) - животные, которым вводят сенсибилизирующую дозу ЛПС, через 16 ч вводят 2 мкг/мышь белка CrmB вируса натуральной оспы с делетированным SECRET-доменом, по прошествии 0.5 часов после введения белка вводят разрешающую дозу ЛПС. Седьмая группа (экспериментальная) - животные, которым вводят сенсибилизирующую дозу ЛПС, через 16 ч вводят 0.2 мкг/мышь белка CrmB вируса натуральной оспы, по прошествии 0.5 часов после введения белка вводят разрешающую дозу ЛПС. Восьмая группа (экспериментальная) - животные, которым вводят сенсибилизирующую дозу ЛПС, через 16 ч вводят 2 мкг/мышь белка CrmB вируса натуральной оспы, по прошествии 0.5 часов после введения белка вводят разрешающую дозу ЛПС. Все инъекции проводились внутрибрюшинно. Наблюдение за животными и учет гибели проводят в течение 72 ч. Мыши, получившие инъекции ЛПС (группа 4), становились вялыми и малоподвижными, с взъерошенной и влажной шерстью. В течение 72 ч наблюдения смертность животных составила 90%. Эти изменения соответствуют таковым, описанным в литературе при развитии экспериментального эндотоксического шока у мышей. В контрольных группах 1-3 не было зафиксировано ни одного случая падежа, поведение и внешний вид животных не изменялись по сравнению с интактными животными. При введении рекомбинантных белков (ФНО-связывающего белка CrmB вируса натуральной оспы с делетированным SECRET-доменом и ФНО-связывающего белка CrmB вируса натуральной оспы) выживаемость животных увеличилась до уровня 40-60%. Достоверных отличий при использовании ФНО-связывающего белка CrmB вируса натуральной оспы или его усеченного варианта с делетированным SECRET доменом не выявлено.
Пример 10. Конструирование рекомбинантной плазмиды
pQE-60-TNFR-CrmB-Ind-67.
Рекомбинантную плазмиду pQE-60-TNFR-CrmB-Ind-67, кодирующую ФНО-связывающий домен белка CrmB вируса натуральной оспы (pQE-60-TNFR-CrmB-Ind-67) получают путем клонирования соответствующего фрагмента вирусного генома в вектор pQE-60 («Qiagen», Германия) по сайтам эндонуклеаз рестрикции NcoI и BglII. Для этого гидролизуют плазмиду pQE-60 эндонуклеазой рестрикции NcoI. Реакционная смесь содержит 5 мкг плазмидной ДНК, 1 единицу активности эндонуклеазы рестрикции NcoI, однократный буфер для эндонуклезы рестрикции NcoI. Реакции проводят при температуре 37°С, 1 час. Далее к смеси добавляют 1/10 CH3COOK (pH 5.5) и 2 объема этилового спирта, инкубируют при -20°С в течение 30 мин. Центрифугируют при 14000×g, 10 мин, удаляют супернатант, добавляют к осадку 70% этиловый спирт и центифугируют при 14000×g, 5 мин. Снова удаляют супернатант и растворяют осадок ДНК в смеси, содержащей эндонуклеазу рестрикции BglII и однократный буфер, оптимальный для проявления ферментативной активности эндонуклеазы рестрикции BglII. Реакции проводят в течение 1 часа при температуре 37°С. Аналогичные манипуляции проводят с амплифицированным фрагментом вирусного генома, кодирующий ФНО-связывающий домен белка CrmB (гидролизуют эндонуклеазами рестрикции BglII и NcoI). Далее полученные гидролизованные фрагменты ДНК электрофоретически разделяют в 1.5% агарозном геле и затем элюируют ДНК из геля набором фирмы «Qiagen» (Германия) согласно протоколу фирмы производителя. Затем проводят реакцию лигирования. Реакционная смесь содержит 0.2 мкг вектора, гидролизованного эндонуклеазами рестрикции, 0.2 мкг амплифицированного фрагмента (предварительно гидролизованного соответствующими эндонуклеазами рестрикции), 5 единиц активности ДНК-лигазы фага Т4 («СибЭнзим», Россия), однократный буфер для ДНК-лигазы фага T4. Реакцию проводят при температуре 16°С, 4 часа. Полученной лигазной смесью трансформируют компетентные клетки E.coli XL2-blue. Для этого компетентные клетки размораживают во льду, добавляют смесь после лигирования, аккуратно перемешивают и инкубируют 30 мин во льду, после чего проводят инкубацию при температуре 42°С, 2 мин и переносят пробирки в лед на 5 мин. При помощи шпателя Дригальского высевают клетки на питательную агаризованную среду, содержащую ампициллин (100 мкг/мл). Инкубируют при температуре 37°С 12 часов до появления индивидуальных колоний. Далее засевают ночную культуру: индивидуальную колонию при помощи стерильной вольфрамовой петли переносят в 3 мл L-бульона и инкубируют при эффективной аэрации и температуре 37°С, 12 часов. Производят выделение рекомбинантной плазмидной ДНК по стандартной методике и анализируют с помощью эндонуклеаз рестрикции NcoI, BglII. Затем проводят анализ фрагментов ДНК, встроенных в структуру плазмиды pQE-60, на наличие нуклеотидных замен. Определение нуклеотидной последовательности проводят на автоматическом секвенаторе 310 Genetic analyzer («PE BioSystems», США) с использованием реагента «BigDye-v.3.1» («PE BioSystems», США). Полученную таким образом целевую плазмиду обозначают pQE-60-TNFR-CrmB-Ind-67. На фиг. 3 приведена физическая карта рекомбинантной плазмидной ДНК pQE-60-TNFR-CrmB-Ind-67. За первый нуклеотид плазмиды принимается нуклеотид С, расположенный внутри сайта узнавания эндонуклеазы рестрикции XhoI. TNFR-CrmB-Ind-67 - схематическое изображение нуклеотидной последовательности, кодирующей белок CrmB ВНО с делетированным SECRET-доменом, 6His-tag - последовательность, кодирующая мотив из шести гистидинов, ampicillin - ген, экспрессия которого обуславливает устойчивость к ампициллину.
Пример 11. Экспрессия гена, кодирующего ФНО-связывающий домен белка CrmB вируса натуральной оспы, в клетках E.coli.
Для экспрессии гена, кодирующего ФНО-связывающий домен белка CrmB вируса натуральной оспы, в прокариотических организмах используют штамм E.coli SG13009[pRep4]. Трансформируют компетентные клетки E.coli SG13009[pRep4]. Для этого размораживают компетентные клетки во льду, затем добавляют 1 мкл раствора, содержащего плазмидную ДНК с концентрацией 0.5 мкг/мл, аккуратно перемешивают и инкубируют 30 мин во льду, затем пробирки выдерживают при температуре 42°С, 2 мин и переносят в лед на 5 мин. Клетки высевали при помощи шпателя Дригальского на чашку Петри с агаризованной средой, содержащей ампициллин (100 мкг/мл), и инкубируют при температуре 37°С 12 часов до появления индивидуальных колоний. Далее засевают ночную культуру: индивидуальную колонию при помощи стерильной вольфрамовой петли переносили в 3 мл L-бульона и инкубируют при эффективной аэрации и температуре 37°С, 12 часов, после чего 2 мл культуральной жидкости добавляют к 100 мл L-бульона. Суспензию клеток инкубируют при эффективной аэрации и температуре 37°С до OD550 = 0.7. К культуральной жидкости добавляют 0.1 М изопропил-β-D-тиогалактозид до концентрации 0.001 М. Инкубацию проводят при эффективной аэрации и температуре 37°С, 5 часов. Клетки осаждают центрифугированием при 3000 об/мин (центрифуга J2-21, ротор JA-20) 15 мин. Супернатант тщательно удаляют. Биомассу клеток ресуспендируют в буфере B (на 1 г биомассы приходится 5 мл буфера B (0.1 М NaH2PO4, 0.01 М Tris-Cl, 8 М мочевина)). Суспензию обрабатывают ультразвуком 5 мин (10 раз по 30 сек с перерывом 15-20 сек во льду при частоте 40 кГц). Центрифугируют суспензию при 9300×g, 3 мин (при температуре 4°С). Отбирают супернатант и смешивают его с Ni-NTI-агарозой (на 1 мл агарозы приходится 4 мл супернатанта). Смесь в течение 1 часа периодически перемешивают. Переносят смесь на колонку. На колонку наносят промывочный буфер (0.05 М NaH2PO4, 0.3 М NaCl, 0.02 М имидазол, pH 8.0). Проводят элюцию белка элюирующим буфером (0.05 М NaH2PO4, 0.3 М NaCl, 0.25 М имидазол, pH 8.0). Далее кипятят диализный мешок в дистилированной воде 30 мин, после чего переносят в него пробы после элюции и помещают мешок в однократный фосфатный буфер на 12 часов при температуре 4°С.
Пример 12. Определение биологической активности ФНО-связывающего белка CrmB вируса натуральной оспы с делетированным SECRET-доменом (полученного в прокариотической системе экспрессии) in vitro.
Биологическую активность ФНО-связывающего белка CrmB вируса натуральной оспы с делетированным SECRET-доменом, полученного в прокариотической системе экспрессии определяют способом, изложенным в примере 8.
При исследовании ингибирования цитотоксического действия ФНО мыши на культуре клеток фибробластов мыши L-929 были получены данные, сопоставимые с таковыми для рекомбинантного ФНО-связывающего белка CrmB с делетированным SECRET-доменом вируса натуральной оспы, продуцированного в клетках насекомых линии Sf-21.
Таким образом, получен рекомбинантный бакуловирус Bv/G2R-dSECRET, продуцирующий секретируемый ФНО-связывающий белок CrmB вируса натуральной оспы (штамма India-1967) с делетированным SECRET-доменом в клетках насекомых Sf-21. Кроме того, получена рекомбинантная плазмида pQE-60-TNFR-CrmB-Ind-67, обеспечивающая продукцию ФНО-связывающего белка CrmB вируса натуральной оспы с делетированным SECRET-доменом при трансформации данной плазмидой клеток E.coli штамма SG13009[pRep4].




Изобретение относится к области биотехнологии, генетической инженерии и фармацевтической промышленности. Предложены две рекомбинантные плазмидные ДНК pFastBac1-G2R-dSECRET и pQE-60-TNFR-CrmB-Ind-67, кодирующие ФНО-связывающий домен белка CrmB. Указанная рекомбинантная плазмидная ДНК pQE-60-TNFR-CrmB-Ind-67 предназначена для трансформации в клетках штамма E.coli SG13009[pRep4] - продуцента ФНО-связывающего домена белка CrmB ВНО. Предложенная группа изобретений предназначена для приготовления лекарственных средств, используемых в терапии тяжелых заболеваний человека, вызванных гиперпродукцией фактора некроза опухолей (ФНО), и может быть использована в медицине. 3 н.п. ф-лы, 3 ил., 12 пр.
1. Рекомбинантная плазмидная ДНК pFastBac1-G2R-dSECRET размером 5285 п.н. и молекулярной массой 3,43 мДа, несущая фрагмент генома вируса натуральной оспы штамма India-1967, кодирующий ФНО-связывающий домен белка CrmB, обеспечивающий ингибирование цитопатического действия ФНО-человека, содержащая в соответствии с физической картой плазмиды, приведенной на фиг.2:
- ПЦР-фрагмент генома вируса натуральной оспы штамма India-67 длиной 525 п.н., кодирующий ФНО-связывающий домен белка CrmB BHO (штамм India-1967), полученный с помощью праймеров
5' CGAGGATCCGCCACCATGAAGTCCGTATTATACTTGTATATATTG 3'
5' CGGAATTCCTAGGGTACGGGTTCGCATTTAT 3'
фланкированный сайтами узнавания эндонуклеаз рестрикции EcoRI и BamHI;
- EcoRI - BamHI фрагмент векторной плазмиды pFastBac1, размером 4760 п.н., включающий бакуловирусный промотор pPolh, мини-Tn7-транспазон и сигнал для полиаденилирования вируса SV-40.
2. Штамм рекомбинантного бакуловируса Bv/G2R-dSECRET, полученный с помощью рекомбинантной плазмидной ДНК pFastBac1-G2R-dSECRET по п.1, депонированный в коллекции микроорганизмов ФГУН ГНЦ ВБ «Вектор» Роспотребнадзора под номером V-537 - продуцент ФНО-связывающего домена белка CrmB BHO (штамм India-1967).
3. Рекомбинантная плазмидная ДНК pQE-60-TNFR-CrmB-Ind-67 размером 3872 п.н. и молекулярной массой 2,5 мДа, депонированная в коллекции микроорганизмов ФГУН ГНЦ ВБ «Вектор» Роспотребнадзора под номером Р-48 и несущая фрагмент генома вируса натуральной оспы штамма India-1967, кодирующий ФНО-связывающий домен белка CrmB, обеспечивающий ингибирование цитопатического действия ФНО-человека, содержащая в соответствии с физической картой плазмиды, приведенной на фиг.3:
- ПЦР-фрагмент генома вируса натуральной оспы штамма India-67 длиной 453 п.н., кодирующий ФНО-связывающий домен белка CrmB BHO (штамм India-1967), полученный с помощью праймеров
5' CGCCATGGCACCGTATACACCACCCAATGGA 3'
5' CGAGATCTGGGTACGGGTTCGCATTTATCTG 3'
фланкированный сайтами узнавания эндонуклеаз рестрикции NcoI и BglII;
- NcoI - BglII фрагмент векторной плазмиды pFastBac1, размером 3419 п.н., включающий ген в-лактамазы, определяющий устойчивость к ампициллину, область начала репликации ColEI.
| РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК pFastBac-G2R-IgG, СОДЕРЖАЩАЯ ФРАГМЕНТ ГЕНОМА ВИРУСА НАТУРАЛЬНОЙ ОСПЫ, КОДИРУЮЩИЙ ФАКТОР НЕКРОЗА ОПУХОЛЕЙ СВЯЗЫВАЮЩИЙ БЕЛОК, И ФРАГМЕНТ ГЕНОМА ЧЕЛОВЕКА, КОДИРУЮЩИЙ УЧАСТОК ТЯЖЕЛОЙ ЦЕПИ ИММУНОГЛОБУЛИНА G, И ШТАММ БАКУЛОВИРУСА BvG2RIgG, ПРОДУЦИРУЮЩИЙ РАСТВОРИМЫЙ ХИМЕРНЫЙ БЕЛОК, СОСТОЯЩИЙ ИЗ БЕЛКА ВИРУСА НАТУРАЛЬНОЙ ОСПЫ, СВЯЗЫВАЮЩЕГО ФАКТОР НЕКРОЗА ОПУХОЛЕЙ, И ФРАГМЕНТА ТЯЖЕЛОЙ ЦЕПИ ИММУНОГЛОБУЛИНА G ЧЕЛОВЕКА | 2008 |
|
RU2376375C2 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК PFASTBAC-G2R, СОДЕРЖАЩАЯ ФРАГМЕНТ ГЕНОМА ВИРУСА НАТУРАЛЬНОЙ ОСПЫ, КОДИРУЮЩИЙ БЕЛОК-АНАЛОГ РЕЦЕПТОРА ФАКТОРА НЕКРОЗА ОПУХОЛЕЙ, И ШТАММ БАКУЛОВИРУСА BTRI67, ПРОДУЦИРУЮЩИЙ РАСТВОРИМЫЙ РЕЦЕПТОР ФАКТОРА НЕКРОЗА ОПУХОЛЕЙ ВИРУСА НАТУРАЛЬНОЙ ОСПЫ | 2002 |
|
RU2241754C2 |
| US 20090104178 A1, 23.04.2009. | |||
Авторы
Даты
2013-01-10—Публикация
2011-05-10—Подача