Изобретение относится к биотехнологии, в частности к генетической инженерии, и может найти применение как лекарственное средство нового поколения для борьбы с тяжелыми заболеваниями человека, связанными с гиперпродукцией фактора некроза опухолей (ФНО).
Фактор некроза опухолей является одним из ключевых цитокинов воспалительного ответа, он модулирует иммунные реакции организма, играет важную роль в регуляции жизнеспособности клеток [1]. Однако гиперпродукция ФНО приводит к ряду заболеваний человека, таких как болезнь Крона, ревматоидный артрит (РА), псориаз, псориатический артрит, сердечная недостаточность и других [2]. Тяжелой патологией, обусловленной высоким уровнем ФНО и часто завершающейся летальным исходом, является эндотоксический шок [2, 3]. В настоящее время препараты с анти-ФНО действием можно отнести к четырем различным группам в соответствии с тем, на каком этапе они блокируют ФНО: на стадии транскрипции, трансляции, процессинга (протеолитического отщепления мембраносвязанной формы цитокина) или блокируют взаимодействие ФНО с их рецепторами и передачу сигнала [2]. Анти-ФНО препараты, применяющиеся в клинической практике и проходящие клинические испытания, приведены в таблице.
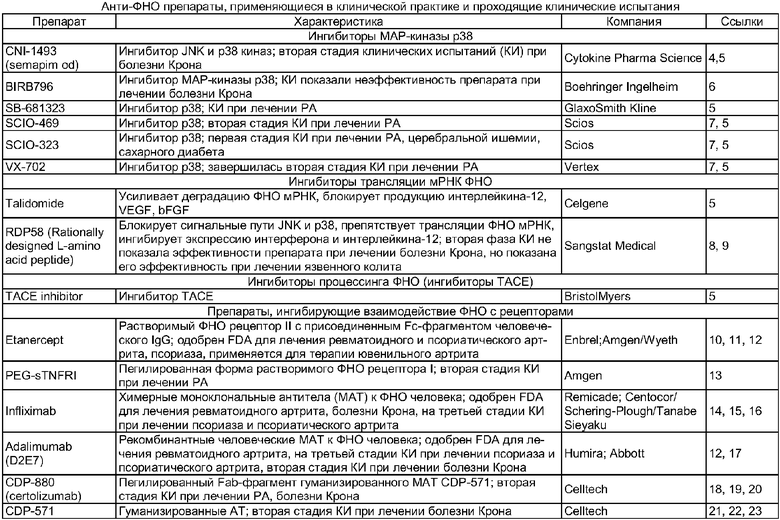
Как видно, одним из направлений разработки терапевтических средств для коррекции этих иммунопатологий является создание препаратов, связывающих данный цитокин. Такими препаратами могут быть моноклональные антитела (МАТ) и растворимые клеточные рецепторы, связывающие ФНО. Растворимые рекомбинантные клеточные рецепторы ФНО ранее синтезировали в мономерной форме, и, несмотря на эффективное ингибирование цитотоксического действия ФНО in vitro, они практически не оказывали протективного действия in vivo на модели эндотоксического шока [24]. Добавление Fc-фрагментов иммуноглобулина G (IgG) к лиганд-связывающим доменам рецепторов ФНО первого (р55) [25] и второго (р75) [24] типов привело к их синтезу в виде ковалентно связанных димеров. Такие химерные молекулы в 1000 раз более эффективно ингибировали in vitro цитотоксическое действие ФНО, чем их прототипные варианты, и в значительной степени повышали выживаемость животных в модели эндотоксического шока [24, 25]. Препарат Etanercept, представляющий собой химерную молекулу внеклеточного домена белка р75 с Fc-фрагментом IgGl человека, в настоящее время используется для терапии некоторых заболеваний человека [2].
Создание химерных молекул с фрагментом тяжелой цепи IgG получило широкое распространение. Данный класс химерных белков, включающий в себя цитокины, рецепторы цитокинов, комплементсвязывающие белки, ферменты, молекулы адгезии, насчитывает более 50 членов, представляющих собой ковалентно-связанные димеры, напоминающие молекулы иммуноглобулинов. Такие молекулы отличаются от своих прототипных аналогов значительным увеличением авидности и времени полужизни [26].
Наиболее близким аналогом (прототипом) является ФНО-связывающие белки ортопоксвирусов, которые эффективно ингибируют цитопатическое действие ФНО на культуре клеток мышиных фибробластов L929 [27]. Для клеточных рецепторов ФНО было показано, что химерные с IgG человека белки оказываются гораздо более эффективными антагонистами ФНО in vitro и in vivo.
Однако эффективных средств для борьбы с тяжелыми заболеваниями человека, связанными с гиперпродукцией фактора некроза опухолей (ФНО), явно недостаточно.
Техническим результатом настоящего изобретения является расширение спектра средств нового поколения, предназначенных для лечения заболеваний человека, связанных с гиперпродукцией фактора некроза опухолей путем добавления Fc-фрагмента IgGl человека к ФНО-связывающему белку ВНО.
Технический результат достигается путем конструирования рекомбинантной плазмидной ДНК pFastBac-G2R-IgG, содержащей фрагмент генома вируса натуральной оспы, кодирующей аминокислотную последовательность ФНО-связывающего белка без терминирующего кодона, и фрагмент генома человека, кодирующего фрагмент тяжелой цепи IgGl человека с 117 по 329 (нумерация для Fc-фрагмента, кодируемого геном AF237583(GenBank)) и создания с ее использованием нового рекомбинантного штамма бакуловируса - продуцента растворимого химерного белка, состоящего из белка вируса натуральной оспы, связывающего фактор некроза опухолей, и фрагмента тяжелой цепи иммуноглобулина G человека.
Целевая плазмида pFastBac-G2R-IgG (фиг.1) имеет размер 6444 п.н. и молекулярную массу 4,18 мДа и состоит из:
- фрагмента генома вируса натуральной оспы штамма India-67 длиной 1068 п.н., кодирующего ФНО-связывающий белок;
- фрагмента генома человека длиной 699 п.н., кодирующего фрагмент тяжелой цепи IgGl человека с 117 по 329 а.к.;
- векторной плазмиды pFastBacl [28], длиной 4677 п.н., обеспечивающей сайт-специфическую транспозицию целевого фрагмента ДНК в геном бакуловируса.
Рекомбинантный штамм бакуловируса, полученный в результате сайт-специфической транспозиции целевого фрагмента ДНК из донорной плазмиды pFastBac-G2R-IgG в бакуловирусный вектор (бакмиду), находящийся в E.coli [28], после заражения им клеток насекомых Sf21 продуцирует растворимый химерный белок, состоящий из белка вируса натуральной оспы, связывающего фактор некроза опухолей, и фрагмента тяжелой цепи иммуноглобулина G человека.
В качестве фрагмента генома вируса натуральной оспы используют фрагмент ДНК длиной 1068 п.н., полученный с помощью полимеразной цепной реакции. Матрицей для амплификации служит ДНК вируса натуральной оспы штамма India-1967. Олигонуклеотидные праймеры для амплификации ФНО-связывающего белка вируса натуральной оспы имеют следующую структуру:
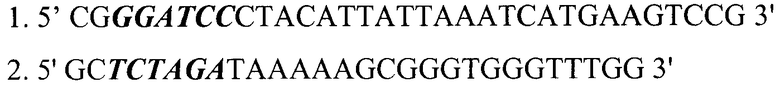
В структуру праймеров 1 и 2 заложены сайты узнавания эндонуклеаз рестрикции ВаmHI и XbaI, соответственно (выделены в последовательности праймеров жирным курсивом).
В качестве фрагмента генома человека используют фрагмент ДНК длиной 699 п.н., выделенный из плазмиды pBluescript-IgG1 после гидролиза эндонуклеазами рестрикции XbaI и HindIII.
В качестве плазмидного вектора, обеспечивающего сайт-специфическую транспозицию целевого фрагмента ДНК в бакмиду pMON14272 [28], используют плазмиду pFastBacl [28], содержащую бакуловирусный специфический промотор pPolh для экспрессии белков в клетках насекомых, мини-Tn7-транспазон, гены устойчивости к ампициллину и гентамицину, полилинкер для клонирования целевых генов и сигнал для полиаденилирования вируса SV-40. Бакмида pMON14272 содержит низкокопийный мини-F репликон, ген устойчивости к канамицину и фрагмент ДНК, кодирующий α-донорный пептид β-галактозидазы E.coli и обеспечивает α-комплементацию при размножении в штамме E.coli DH10Bac™ в присутствии хромогенного субстрата X-gal и индуктора IPTG.
Выбранная бакуловирусная система экспрессии обеспечивает высокий уровень синтеза целевого продукта и его правильную посттрансляционную модификацию по сравнению с другими системами экспрессии.
Сущность настоящего изобретения заключается в том, что фрагмент ДНК, содержащий ген фактор некроза опухолей связывающего белка G2R вируса натуральной оспы штамма India-1967 без стоп-кодона, получается с помощью ПЦР из вирусного генома; фрагмент ДНК, содержащий фрагмент гена IgG1 с 117 по 329 а.к. человека, выделяется из плазмиды pBluescript-IgG1 после гидролиза эндонуклеазами рестрикции XbaI и HindIII; затем полученные фрагменты ДНК клонируются в донорной плазмиде pFastBacl и путем сайт-специфической транспозиции в бактериальных клетках образуется рекомбинантная бакмида, которая используется для трансфекции клеток насекомых, в результате чего генерируется рекомбинантный вирус BvG2RIgG, экспрессирующий указанный химерный ген. Нуклеотидная последовательность встроенного фрагмента приведена на фиг.2.
Штамм характеризуется следующими признаками:
Морфологические признаки. Штамм обладает свойствами типичного представителя бакуловирусов, но в отличие от векторного вируса на среде с XGa1 бляшки, формируемые рекомбинантным бакуловирусом, имеют фенотип Lac-.
Физиолого-биохимические характеристики и культуральные свойства штамма. ДНК рекомбинантного бакуловируса имеет длину около 140000 п.н. Наличие в его геноме целевой вставки длиной 1767 п.н. подтверждено с помощью метода ПЦР. При размножении рекомбинантного бакуловируса на культуре клеток насекомых Spodoptera frugiperda (Sf21) его титр не отличается от титра, получаемого при размножении вируса, не содержащего в своем геноме чужеродных фрагментов ДНК.
Основным отличием штамма является его способность синтезировать химерный ФНО-связывающий белок ВНО с ковалентно-связанным с ним фрагментом тяжелой цепи IgG человека при инфицировании им культуры клеток насекомых Sf21.
Полученный штамм рекомбинантного бакуловируса BvG2RIgG депонирован в коллекции микроорганизмов Государственного научного центра вирусологии и биотехнологии «Вектор» за номером V-354 от 06.10.06.
Изобретение иллюстрируется следующими чертежами:
Фиг.1. Физическая карта плазмиды pFastBac-G2R-IgG. За первый нуклеотид плазмиды принимается нуклеотид А межцистронной области фага f1; Tn7L, Tn7R-фрагменты транспозона Tn7; SV40polyA - сайт полиаденилирования вируса SV40; G2R-IgG - химерный ген, состоящий из гена фактора некроза опухолей связывающего белка ВНО штамма India-67 без терминирующего кодона и фрагмента гена тяжелой цепи IgG1 человека с 117 по 329 а.к.; pPolh - промотор полиэдрина; Ori - сайт инициации репликации; Apr, Gmr - маркеры устойчивости к ампициллину и гентамицину, соответственно.
Фиг.2. Нуклеотидная последовательность гена G2R ВНО (штамм India-1967) и фрагмента гена тяжелой цепи IgG1 человека, соответствующего кодирующей последовательности с 117 по 329 а.к., и расположение специфических праймеров (показаны жирным шрифтом) на матрице. Сайты эндонуклеаз рестрикции Xbal, Hindlll, ВаmHI, используемые при конструировании плазмиды интеграции pFastBac-G2R-IgG, показаны жирным курсивом. Инициирующий кодон и стоп-кодоны выделены жирным шрифтом и подчеркиванием, сайты рестрикции - жирным курсивом.
Фиг.3. Электрофоретический анализ в 1% агарозе ПЦР-фрагментов, содержащих химерный ген фактор некроза опухолей связывающего белка ВНО с фрагментом гена тяжелой цепи IgG1 человека, соответствующего кодирующей последовательности с 117 по 329 а.к., амплифицированных с помощью специфических праймеров с плазмиды pFastBac-G2R-IgG (дорожки 2, 3) и с бакмиды bMON14272-G2R-IgG (дорожки 4, 5). Дорожка 1 - маркеры длин «bp 100» («СибЭнзим», Россия), дорожка 6 - отрицательный контроль (нерекомбинантная бакмида).
Для лучшего понимания сущности изобретения ниже следуют примеры его осуществления.
Пример 1. Способ амплификации фрагмента ДНК, содержащего ген ФНО-связывающего белка ВНО.
Реакцию амплификации проводят в пробирках Eppendorf в объеме 50 мкл в амплификаторах с горячей крышкой. Реакционная смесь содержит 10 мМ Tris-HCl рН 8.8, 50 мМ KCl, 2.5 мМ MgCl2, 0.1% Tween 20, 0.2 мМ dATP, 0.2 мМ dCTP, 0.2 мМ dGTP, 0.2 мМ dTTP, олигонуклеотидные праймеры в количестве 10 пмоль каждого, 2 ед.а. Tth-полимеразы, 2-10 нг ДНК-матрицы.
Наличие амплифицированного продукта проверяют с помощью электрофореза в 1% агарозном геле.
Пример 2. Конструирование рекомбинантной плазмидной ДНК pFastBac-G2R-IgG.
5-10 мкг плазмиды pFastBac [28] гидролизуют эндонуклеазами рестрикции BamHI и HindIII; 1-5 мкг амплифицированного продукта, соответствующего гену G2R ВНО без терминирующего кодона, гидролизуют эндонуклеазами рестрикции BamHI и XbaI; плазмиду pBluescript-IgG1 гидролизуют эндонуклеазами рестрикции XbaI и HindIII в стандартных условиях. Полученные фрагменты выделяют электрофорезом в 1% агарозном геле с последующей элюцией. 0.2 мкг вектора и по 0.6 мкг фрагментов лигируют в стандартных условиях и полученной лигазной смесью трансформируют компетентные клетки E.coli штамма XL-blue. Клеточные Apr-клоны выращивают при 37°С в LB среде, содержащей 100 мкг/мл ампициллина, до стационарной фазы. Рекомбинантную плазмидную ДНК выделяют по стандартной методике и анализируют с помощью эндонуклеаз рестрикции BamHI, XbaI и HindIII. Из клонов, содержащих встроенный фрагмент, выделяют плазмидную ДНК, структуру которой в районе встройки подтверждают определением нулеотидной последовательности методом терминации синтезируемой цепи на автоматическом секвенаторе ABM PRISM™ 310 (Perkin Elmer, США). Полученную таким образом целевую плазмиду обозначают pFastBac-G2R-IgG.
Пример 3. Получение бакмиды pMON14272-G2R-IgG.
К 100 мкл компетентных клеток E.coli штамма DH10Bac™ добавляют 1 нг плазмиды pFastBac-G2R-IgG. Полученную смесь инкубируют во льду в течение 30 мин, затем при 42°С в течение 45 сек с последующим охлаждением во льду в течение 2 мин. Реакционную смесь разводят 1:10 LB-бульоном и подращивают на качалке при интенсивной аэрации при 37°С в течение четырех часов. Далее клетки высевают на селективную среду - LB-агар, содержащий 100 мкг/мл X-ga1, 40 мкг/мл IPTG, 50 мкг/мл канамицина, 7 мкг/мл гентамицина, 10 мкг/мл тетрациклина, и инкубируют в термостате при 37°С в течение суток. Клоны с фенотипом Lac- засевают в пробирки с 5 мл LB-бульона, содержащего 50 мкг/мл канамицина, 7 мкг/мл гентамицина, 10 мкг/мл тетрациклина, и выращивают при интенсивной аэрации при 37°С до стационарной фазы. Культуру переносят в 1.5 мл пробирки Eppendorf, осаждают клетки центрифугированием в течение 40 сек при 14000 g, удаляют среду. Процедуру добавления культуры, осаждения и удаления среды повторяют еще два раза. Осадок ресуспендируют в 0.3 мл раствора 1 (10 мМ ЭДТА, 15 мМ Tris-HCl pH 8.0, 100 мкг/мл РНКазы), добавляют 0.3 мл раствора 2 (0.2 М NaOH, 1% SDS) и инкубируют при комнатной температуре 5 мин. К смеси медленно добавляют 0.3 мл раствора 3 (3 М КАс рН 5.2). Инкубируют во льду 10 мин. Центрифугируют при 14000 g в течение 10 мин. Супернатант переносят в чистую пробирку, добавляют 0.8 мл изопропанола, перемешивают и охлаждают при -20°С 5 мин, затем осаждают при 14000 g 15 мин. Осадок промывают два раза этанолом, высушивают, растворяют в 40 мкл буфера ТЕ. Наличие в геноме бакмиды интегрированного фрагмента ДНК подтверждают с помощью ПЦР. Полученную бакмидную ДНК pMON14272-G2R-IgG используют для трансфекции клеток насекомых линии Sf21.
Пример 4. Трансфекция клеток насекомых Sf21 рекомбинантной бакмидной ДНК pMON14272-G2R-IgG и получение рекомбинантного вируса.
Клетки Sf21 засевают в лунки 6-ти луночного планшета из расчета, чтобы на следующий день был монослой (2×106 клеток/лунку). На следующий день готовят два раствора: 10 мкл вирусной ДНК + 100 мкл среды Грейса и 6 мкл реактива CellFECTIN фирмы LifeTechnologies (США) + 100 мкл среды Грейса. Растворы смешивают, инкубируют при комнатной температуре 25 мин. В это время промывают монослой клеток два раза средой Грейса. К клеткам добавляют по 0.8 мл/лунку среды Грейса и 200 мкл приготовленного раствора. Инкубируют клетки при 28°С в течение 5 ч. После этого отбирают среду и добавляют к клеткам по 2 мл среды Грейса с 10% эмбриональной сывороткой коров (ЭСК) (ООО «БиолоТ», Россия). Клетки инкубируют при 28°С в течение 2-5 суток. Далее клетки ресуспендируют (интенсивным пипетированием), центрифугируют 5 мин при 5000 g и осветленный супернатант расфасовывают в стерильные пробирки. Титр вируса определяют следующим образом. К монослою клеток Sf21 добавляют 200 мкл разведения вируса и проводят адсорбцию в течение 60 мин при комнатной температуре. Далее готовят 2% легкоплавкую агарозу («Sigma», США) и смешивают ее в расплавленном виде со средой Грейса с 10% ЭСК в соотношении 1:1. Полученную среду охлаждают в термостате до 37°С и добавляют по 2 мл на лунку, а после застывания добавляют по 2 мл на лунку среды Грейса с 10% ЭСК. Инкубируют в термостате при 28°С 5 суток. Далее добавляют по 2 мл на лунку краситель нейтральный красный, разведенный в среде Грейса с 10% ЭСК, в соотношении 1:20. Инкубируют при 28°С в течение суток. Титр определяют путем подсчета окрашенных бляшек. Последний составляет 107 БОЕ/мл. Суспензию рекомбинантного вируса хранят при -20°С.
Пример 5. Заражение клеток насекомых Sf21 рекомбинантным вирусом.
200 мкл размороженного вирусного материала с титром 107 наносят на монослой клеток насекомых Sf21 в матрасе для культивирования объемом 25 мл. Инкубируют 30 мин при комнатной температуре. После инкубации добавляют 2 мл среды Грейса с 10% ЭСК. Инкубируют при 28°С в течение 2-3 суток. Далее клетки ресуспендируют интенсивным пипетированием и центрифугируют 5 мин при 5000 g.
Пример 6. Очистка рекомбинантного химерного белка.
Целевой белок выделяют из культуральной среды клеток Sf21 методом аффинной хроматографии. Для этого синтезируют аффинный сорбент на основе поперечно-сшитой агарозной матрицы - сефарозы CL-6B с иммобилизованным белком А. К 2 мл сефарозы CL-6B добавляли 20 мл 0,1 М раствора периодата натрия и инкубируют при 16°С в течение 16 ч. Активированный гель промывают водой и добавляют 1 мг высокоочищенного препарата белка А в 50 мМ натрий-карбонатном буфере, рН 8,5. После 20 ч инкубации при 6°С в раствор добавляют 20 мг боргидрида натрия, перемешивая 2 ч. После этого сорбент последовательно промывают водой, 0,2 М раствором глицин-НСl, рН 2,5 и уравновешивают буфером PBS (10 мМ калий-фосфат, рН 7,0, 150 мМ NaCl). Содержание белка А составляет 0,4±0,1 мг/мл геля. Для очистки растворимого химерного фактор некроза опухолей связывающего белка вируса натуральной оспы с фрагментом тяжелой цепи иммуноглобулина G человека используют культуральную жидкость клеток Sf21, зараженных рекомбинантными бакуловирусами, клеточный дебрис удаляют низкоскоростным центрифугированием. Для уменьшения объема раствора белки предварительно осаждают сульфатом аммония (50% насыщения). После растворения осадка и диализа раствор наносят на аффинную колонку со скоростью протока жидкости 1 объем колонки в час. Сорбент отмывают буфером, содержащим 0,2 М NaCl, и элюцию проводят 0,2 М раствором глицин-HCl, рН 2,5, нейтрализуя раствор в собираемых фракциях 1 М раствором Трис-HCl, рН 8,8. Выход гомогенного белка составляет 4-6 мг из 1 л культуральной жидкости инфицированных клеток.
Пример 7. Определение биологической активности продукта экспрессии химерного гена G2R-IgG in vitro.
Биологическую активность химерного ФНО-связывающего белка ВНО с фрагментом тяжелой цепи IgG человека определяли по его способности ингибировать цитотоксическое действие ФНО человека и мыши на культуре клеток фибробластов мыши L929.
Клетки L929 культивировали в среде DMEM с добавлением 10% фетальной бычьей сыворотки, стрептомицина (50 мкг/мл) и пенициллина (50 единиц/мл) при 37°С в СО2-инкубаторе (концентрация СО2 составляла 5%) до формирования клеточного монослоя на 75-85% поверхности лунок 96-луночного планшета.
При достижении необходимой плотности клеток ростовую среду заменяли на DMEM с 2% фетальной бычьей сывороткой и актиномицином D (1 мкг/мл), содержащую 100 нг/мл химерного ФНО-связывающего белка ВНО с фрагментом тяжелой цепи IgG человека и последовательные двукратные разведения и препараты ФНО (2 нг/мл).
Планшеты инкубировали при 37°С в СО2-инкубаторе (концентрация СО2 составляла 5%).
Через 18 часов количество живых клеток определяли окрашиванием красителем нейтральный красный [29]. Измерение оптической плотности (ОП) проводили на приборе Microplate Reader ELX808 («BIO-ТЕК INSTRUMENTS, INC», США). Результаты выражали в процентном отношении выживших клеток относительно количества клеток в необработанных ФНО контрольных пробах. Каждая проба бралась в трех повторах, и среднее значение процента выживаемости высчитывали по формуле:
(ОПФНО + ФНО-связывающий белок-ОПФНО)/(ОПклетки-ОПФНО)×100%,
где ОПФНО - фоновое значение ОП в лунках планшета, содержащих клетки L929 + ФНО; ОПФНО + ФНО-связывающий белок - ОП в лунках планшета, содержащих клетки L929+ФНО+ФНО-связывающий белок; ОПклетки - ОП в лунках планшета, содержащих клетки L929.
По данным ингибирования цитотоксического действия ФНО человека и мыши на культуре клеток фибробластов мыши L929 50% гибель клеток достигается при добавлении 40-100 нг/мл химерного ФНО-связывающего белка ВНО с фрагментом тяжелой цепи IgG человека.
Пример 8. Определение биологической активности продукта экспрессии химерного гена G2R-IgG in vivo.
Биологическую активность химерного варианта ФНО-связывающего белка ВНО изучают in vivo на модели ЛПС-индуцированного эндотоксического шока. В работе используют самцов мышей линии BALB/c, возраст 3-4 недели, из питомника лабораторных животных ГНЦ ВБ «Вектор», Россия. Опыты на животных проводят после двухнедельной адаптации, в соответствии с Протоколом, утвержденным Биоэтическим комитетом ГНЦ ВБ «Вектор». Группы по 8-10 мышей формируют для визуального наблюдения и изучения выживаемости. Контрольным животным дважды, через 16 ч, вводят внутрибрюшинно по 100 мкл PBS с 1% BSA либо с 10 мкг/мышь изучаемого рекомбинантного белка. Для контроля индукции эндотоксического шока животным вводят внутрибрюшинно сенсибилизирующую (150 мкг/мышь) и, через 16 ч, разрешающую дозы ЛПС (250 мкг/мышь) в 100 мкл PBS. Всем животным экспериментальных групп вводят ЛПС по такой же схеме, как и для контрольной группы. Рекомбинантный химерный ФНО-связывающий белок ВНО с фрагментом тяжелой цепи IgG человека вводят мышам внутрибрюшинно за 30 мин до введения разрешающей дозы ЛПС в дозах 0,4 и 4 мкг/мышь. Наблюдение за животными и учет гибели проводят в течение 72 ч.
Мыши, получившие инъекции бактериального ЛПС, становились вялыми и малоподвижными, с взъерошенной и влажной шерстью. В течение 72 ч наблюдения смертность животных составила 80-100%. Эти изменения, а также выявляемая гистологическая картина внутренних органов экспериментальных животных [30] соответствуют таковым, описанным в литературе при развитии экспериментального эндотоксического шока у мышей [31, 32, 33]. В отрицательных контрольных группах не было зафиксировано ни одного случая падежа, поведение и внешний вид животных не изменялись по сравнению с интактными животными. Как было показано ранее [30], в сыворотках крови контрольных животных, получавших ЛПС, в течение 1 ч после индукции шока концентрация ФНО резко возрастала, затем постепенно снижалась и достигала уровня контрольных образцов к 24 ч наблюдения. Полученные результаты свидетельствуют, что используемая экспериментальная модель развития эндотоксического шока сопровождается резким ростом продукции ФНО.
При введении рекомбинантного химерного ФНО-связывающего белка ВНО с фрагментом тяжелой цепи IgG человека (0,4 или 4 мкг/мышь) выживаемость животных увеличилась до уровня до 56+7,2% и 70+9,7%, соответственно. Как видно, химерный ФНО-связывающий белок ВНО с фрагментом тяжелой цепи IgG человека обусловливал достоверный терапевтический эффект.
Таким образом, получен рекомбинантный бакуловирус BvG2RIgG, обеспечивающий экспрессию химерного гена ФНО-связывающего белка ВНО штамма India-1967 с фрагментом тяжелой цепи IgG человека в клетках насекомых линии Sf21.
Полученный штамм может быть использован для разработки терапевтического препарата нового поколения для борьбы с заболеваниями человека, связанными с гиперпродукцией фактора некроза опухолей.





Изобретение относится к области биотехнологии, конкретно к получению белка, связывающего фактор некроза опухолей (ФНО), и может быть использовано в медицине. Создают штамм-продуцент бакуловируса BvG2RIgG с помощью рекомбинантной плазмидной ДНК pFastBac-G2R-IgG размером 6444 п.н. и молекулярной массой 4,18 мДа, несущей фрагмент генома вируса натуральной оспы штамма India-1967, кодирующий белок, связывающий ФНО, и фрагмент генома человека, кодирующий фрагмент тяжелой цепи иммуноглобулина G человека. Полученный штамм продуцирует растворимый химерный белок, состоящий из белка вируса натуральной оспы, связывающего ФНО, и фрагмента тяжелой цепи иммуноглобулина G человека. Изобретение позволяет расширить спектр препаратов нового поколения, предназначенных для лечения заболеваний человека, связанных с гиперпродукцией фактора некроза опухолей. 2 н.п. ф-лы, 3 ил., 1 табл.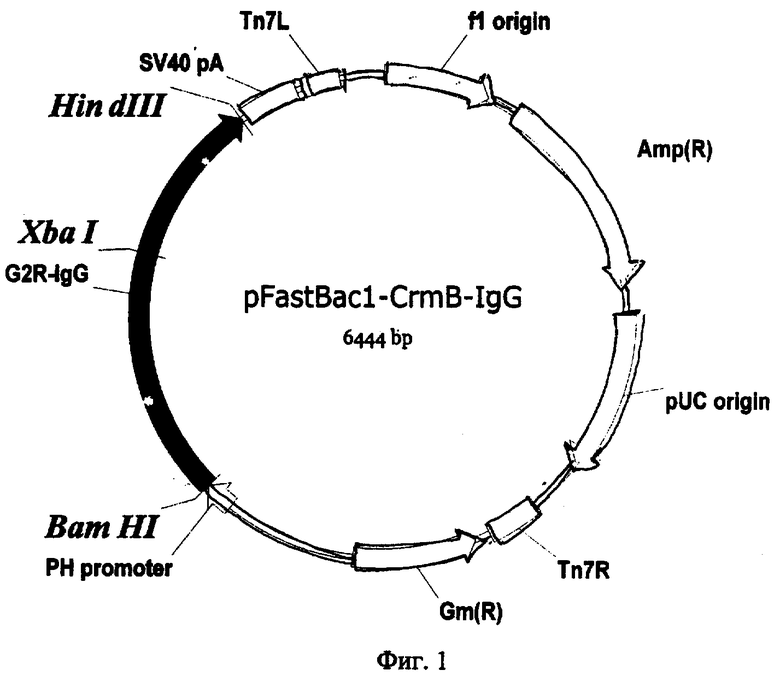
1. Рекомбинантная плазмидная ДНК pFastBac-G2R-IgG для обеспечения экспрессии растворимого химерного белка, состоящего из белка вируса натуральной оспы, связывающего фактор некроза опухолей, и фрагмента тяжелой цепи иммуноглобулина G человека, размером 6444 п.н. и молекулярной массой 4,18 мДа, содержащая в соответствии с физической картой плазмиды, приведенной на фиг.1:
ПЦР-фрагмент генома вируса натуральной оспы штамма India-67 длиной 1068 п.н., кодирующий ФНО-связывающий белок без стоп-кодона, полученный с использованием праймеров
1. 5′ CGGGATCCCTACATTATTAAATCATGAAGTCCG 3′
2. 5′ GCTCTAGATAAAAAGCGGGTGGGTTTGG 3′, фланкированный сайтами узнавания эндонуклеаз рестрикции ВаmHI и XbaI;
фрагмент генома человека длинной 699 п.н., кодирующий фрагмент тяжелой цепи IgGl человека с 117 по 329 а.к., полученный из плазмиды pBluescript-IgGl после гидролиза эндонуклеазами рестрикции XbaI и HindIII;
BamHI-HindIII фрагмент векторной плазмиды pFastBac, размером 4677 п.н., включающий бакуловирусный промотор pPolh, мини-Тn7-транспазон и сигнал для полиаденилирования вируса SV-40, обеспечивающий сайт-специфическую транспозицию ДНК химерного гена G2R-IgG в геном бакуловируса;
генетические маркеры:
ген α-лактамазы, определяющий устойчивость к ампициллину;
ген аминогликозидтрансферазы, определяющий устойчивость к гентамицину;
уникальные сайты рестрикции: ВаmHI (4033), HindIII (5806).
2. Штамм рекомбинантного бакуловируса BvG2RIgG, полученный с помощью рекомбинантной плазмидной ДНК pFastBac-G2R-IgG по п.1, депонированный в Коллекции микроорганизмов ФГУН ГНЦ ВБ «Вектор» Роспотребнадзора под номером V-354, - продуцент растворимого химерного белка, состоящего из белка вируса натуральной оспы, связывающего фактор некроза опухолей, и фрагмента тяжелой цепи иммуноглобулина G человека.
| ГИЛЕВА И.П | |||
| и др., Экспрессия генов TNF-связывающих белков ортопоксвирусов в клетках насекомых и изучение свойств рекомбинантных белков, Молекуляр | |||
| биология, 2005, Т.39, №2, с.245-254 | |||
| ГИЛЕВА И.П | |||
| и др., Изучение действия TNF-связывающего белка вируса натуральной оспы на развитие ЛПС-индуцированного эндотоксического шока, Цитокины и |
Авторы
Даты
2009-12-20—Публикация
2008-02-18—Подача