Изобретение относится к биотехнологии, белковой и генной инженерии и представляет собой иммунную комбинаторную фагмидную библиотеку одноцепочечных антител человека, сконструированную in vitro на основе генов, кодирующих вариабельные домены иммуноглобулинов людей, вакцинированных вирусом осповакцины; отобранную из этой библиотеки рекомбинантную фагмидную ДНК pHEN-2A8, содержащую полученный генно-инженерными методами искусственный ген одноцепочечного антитела человека под контролем промотора лактозного оперона, обеспечивающий в клетках E.coli синтез одноцепочечного антитела человека в составе химерного белка с оболочечным белком р3 бактериофага М13, способного нейтрализовать ортопоксвирусы, а также одноцепочечное антитело человека 2А8, экспонированное на поверхности нитчатого бактериофага М13 в составе оболочечного белка р3, способное нейтрализовать вирус осповакцины и вирус оспы коров.
Род Orthopoxvirus включает в себя сложные ДНК-содержащие вирусы, реплицирующиеся в цитоплазме клеток позвоночных и беспозвоночных. К ортопоксвирусам относят вирусы натуральной оспы и оспы обезьян, являющиеся возбудителями тяжелого генерализованного заболевания человека и приматов, вирусы оспы коров и осповакцины, способные вызывать у людей локальные повреждения, а также ряд других вирусов (вирусы эктромелии, оспы верблюдов и др.), патогенных для млекопитающих [1]. Следует отметить, что у людей с ослабленным иммунным статусом вирусы осповакцины и оспы коров могут стать причиной тяжелых заболеваний или даже генерализованной инфекции.
С использованием вируса осповакцины к концу 70-х годов прошлого века в рамках глобальной программы ВОЗ была осуществлена ликвидация натуральной оспы. В связи с прекращением естественной трансмиссии вируса натуральной оспы тогда же была прекращена массовая вакцинация вирусом осповакцины. Однако, несмотря на ликвидацию натуральной оспы, существуют причины, по которым ортопоксвирусы продолжают оставаться источником биологической опасности для людей, причем стихийному или преднамеренному распространению натуральной оспы или оспы обезьян может способствовать то, что в настоящее время большинство населения не имеет иммунитета к этим вирусам. Кроме того, возобновление массовых вакцинаций вирусом осповакцины в США подтвердило неизбежность возникновения поствакцинальных осложнений в ряде случаев, тем более что большая часть вакцинированных взрослых людей не были привиты осповакциной в детстве.
Ряд поствакцинальных осложнений, а также заболеваний, возникающих у людей с ослабленной иммунной системой при инфицировании вирусом оспы коров, можно предупредить применением человеческого вакцинного иммуноглобулина [1], но этот препарат дорог и малодоступен, кроме того, использование препаратов, полученных из человеческой крови, всегда сопровождается известным биологическим риском. Альтернативу вакцинному иммуноглобулину могли бы составить моноклональные антитела (МКА) человека, специфичные к ортопоксвирусам. Однако, с помощью традиционной гибридомной технологии получить стабильные клеточные линии с высоким уровнем продукции МКА человека крайне трудно.
Одним из современных способов получения МКА человека является селекция их вариабельных доменов из комбинаторных фаговых библиотек одноцепочечных антител человека с последующим объединением их с константными доменами иммуноглобулинов человека. К настоящему времени таким способом сконструированы полноразмерные антитела человека против ряда антигенов, включая и вирусные агенты [2, 3].
Комбинаторная библиотека антител представляет собой коллекцию бактерофагов, каждый из которых экспонирует на своей поверхности уникальное одноцепочечное антитело в составе оболочечного фагового белка [4]. Чаще всего комбинаторные библиотеки конструируют на основе нитчатых бактериофагов Escherichia coli - М13, fd. Технология фагового дисплея позволяет конструировать библиотеки одноцепочечных антител с огромным молекулярным разнообразием от 104 до 109 различных антител. Физическая сцепленность антитела и кодирующего его генетического материала дает возможность быстрого анализа антигенспецифических молекул, позволяя отбирать антитела, специфичные к целевому антигену [5].
Один из способов конструирования фаговых библиотек - случайное объединение in vitro вариабельных доменов тяжелых цепей с вариабельными доменами легких цепей (Vh и Vl, соответственно), гены которых получены на основе мРНК из мононуклеарных клеток крови людей. При этом если человек перенес вирусное заболевание или его иммунизировали соответствующей вакциной, то сконструированная на основе его Vh- и Vl-генов библиотека антител будет заведомо содержать антитела против целевого вирусного агента и вероятность отбора вируснейтрализующих или протективных антител резко повысится. Поэтому для получения терапевтических антител против ортопоксвируса, включая вирус натуральной оспы, на первом этапе необходимо сконструировать комбинаторную фагмидную библиотеку одноцепочечных антител человека, на основе Vh- и Vl-генов лимфоцитов людей, иммунизированных вирусом осповакцины.
Ранее в США была создана фаговая библиотека Fab-фрагментов антител на основе генов иммуноглобулинов человека, вакцинированного вирусом осповакцины [6]. Однако необходимым условием наличия антигенсвязывающих свойств Fab-фрагментов является конформационно правильное взаимодействие VhCh и VlCl цепей, формирующих Fab-домены, что не всегда происходит при их синтезе в клетках Е.coli. Более стабильными являются одноцепочечные антитела (scFv - single chain antibody fragments), состоящие из вариабельных доменов тяжелой и легкой цепей иммуноглобулинов, объединенных гибким пептидным линкером (Gly4Ser)n [7]. Иммунная библиотека одноцепочечных антител человека против ортопоксвирусов не описана.
Технической задачей изобретения является создание комбинаторной фагмидной библиотеки одноцепочечных антител человека, на основе генов, кодирующих вариабельные домены иммуноглобулинов людей, иммунизированных вирусом осповакцины, и получение с помощью фагового дисплея одноцепочечного антитела человека, экспонированного на поверхности бактериофага М13К07 в составе оболочечного белка р3 и способного осуществлять нейтрализацию инфекционности ортопоксвирусов.
Поставленные цели достигаются синтезом фрагментов кДНК, кодирующих вариабельные домены иммуноглобулинов, на основе мРНК, выделенной из лимфоцитов людей, иммунизированных вирусом осповакцины; объединением фрагментов кДНК, кодирующих вариабельные домены тяжелых и легких цепей, в ДНК-последовательности, кодирующие одноцепочечные антитела человека; встраиванием полученных генов (ДНК-последовательностей), кодирующих одноцепочечные антитела, в фагмиду pHEN2 и трансформацией результирующими фагмидами клеток Е.coli TG1; отбором из полученной фагмидной коллекции рекомбинантной фагмидной ДНК, содержащей уникальный ген одноцепочечного антитела человека, способного нейтрализовать ортопоксвирусы; получением одноцепочечного антитела человека, экспонированного на поверхности бактериофага М13К07 в составе оболочечного белка р3 и способного осуществлять нейтрализацию инфекционности ортопоксвирусов.
Олигонуклеотидные праймеры, используемые для конструирования комбинаторной фаговой библиотеки одноцепочечных антител человека [8]:
1. HuJH1-2FOR 5'TGAGGAGACGGTGACCAGGGTGCC;
2. HuJH3FOR 5'TGAAGAGACGGTGACCATTGTCCC;
3. HuJH4-5FOR 5'TGAGGAGACGGTGACCAGGGTTCC;
4. HuJH6FOR 5'TGAGGAGACGGTGACCGTGGTCCC;
5. HuVH1aBACK 5'CAGGTGCAGCTGGTGCAGTCTGG;
6. HuVH3aBACK 5'GAGGTGCAGCTGGTGGAGTCTGG;
7. HuVH5aBACK 5'GAGGTGCAGCTGTTGCAGTCTGC;
8. HuJk1FOR 5'ACGTTTGATTTCCACCTTGGTCCC;
9. HuJk2FOR 5'ACGTTTGATCTCCAGCTTGGTCCC;
10. HuJk3FOR 5'ACGTTTGATATCCACTTTGGTCCC;
11. HuJk4FOR 5'ACGTTTGATCTCCACCTTGGTCCC;
12. HuJk5FOR 5'ACGTTTAATCTCCAGTCGTGTCCC;
13. HuJλFOR 5'ACCTAGGACGGTGACCTTGGTCCC;
14. HuJλ2-3 FOR 5'ACCTAGGACGGTCAGCTTGGTCCC;
15. HuJλ4-5FOR 5'ACCTAAAACGGTGAGCTGGGTCCC;
16. HuVk1aBACK 5'GACATCCAGATGACCCAGTCTCC;
17. HuVk2aBACK 5'GATGTTGTGATGACTCAGTCTCC;
18. HuVk3aBACK 5'GAAATTGTGTTGACGCAGTCTCC;
19. HuJλlBACK 5'CAGTCTGTGTTGACGCAGCCGCC;
20. HuJλ2BACK 5' CAGTCTGCCCTGACTCAGCCTGC;
21. HuJλ3aBACK 5' TCCTATGTGCTGACTCAGCCACC;
22. HuJλ3bBACK 5'TCTTCTGAGCTGACTCAGGACCC;
23. RhuJH1 5'GCACCCTGGTCACCGTCTCCTCAGGTGGCGGTGGCTCT;
24. RhuJH3 5'GGACAATGGTCACCGTCTCTTCAGGTGGCGGTGGCTCT;
25. RhuJH4-5 5'GAACCCTGGTCACCGTCTCCTCAGGTGGCGGTGGCTCT;
26. RhuJH6 5'GGACCACGGTCACCGTCTCCTCAGGTGGCGGTGGCTCT;
27. HuVH1aBACKSfi 5'GTCCTCGCAACTGCGGCCCAGCCGGCCATGGCC CAGGTGCAGCTGGTGCAGTCTGG;
28. HuVH3aBACKSfi 5'GTCCTCGCAACTGCGGCCCAGCCGGCCATGGCC CAGGTGCAGCTGGTGGAGTCTGG;
29. HuVH5aBACKSfi 5'GTCCTCGCAACTGCGGCCCAGCCGGCCATGGCC CAGGTGCAGCTGTTGCAGTCTGC;
30. RhuVklaB 5'GGAGACTGGGTCATCTGGATGTCAGATCCGCCGCCACCCGA;
31. RhuVk2aB 5'GGAGACTGAGTCATCACAACATCAGATCCGCCGCCACCCGA;
32. RhuVk3aB 5'GGAGACTGCGTCAACACAATTTCAGATCCGCCGCCACCCGA;
33. RhuVlB1 5'GGCGGCTGCGTCAACACAGACTGAGATCCGCCGCCACCCGA;
34. RhuVlB2 5'GCAGGCTGAGTCAGAGCAGACTGAGATCCGCCGCCACCCGA;
35. RhuVlB3a 5'GGTGGCTGAGTCACCACATAGGAAGATCCGCCGCCACCCGA;
36. RhuVlB3b 5'GGGTCCTGAGTCAGCTCAGAAGAAGATCCGCCGCCACCCGA;
37. HuJk1FORNot 5'GAGTCATTCTCGACTTGCGGCCGCACGTTTGATTTCCACCTTGGTCCC;
38. HuJk2FORNot 5'GAGTCATTCTCGACTTGCGGCCGCACGTTTGATCTCCA GCTTGGTCCC;
39. HuJk3FORNot 5'GAGTCATTCTCGACTTGCGGCCGCACGTTTGATATCCA CTTTGGTCCC;
40. HuJk4FORNot 5'GAGTCATTCTCGACTTGCGGCCGCACGTTTGATCTCCA CCTTGGTCCC;
41. НuJk5FORNot 5'GAGTCATTCTCGACTTGCGGCCGCACGTTTAATCTCCA GTCGTGTCCC;
42. HuJl1FORNot 5' GAGTCATTCTCGACTTGCGGCCGCACCTAGGACGGTGACCTTGGTCCC;
43. НuJl2-3FORNot 5'GAGTCATTCTCGACTTGCGGCCGCACCTAGGACGGTCAGCTTGGTCCC;
44. НuJl4-5FORNot 5'GAGTCATTCTCGACTTGCGGCCGCACCTAAAACGGTGAGCTGGGTCCC.
На первом этапе выделяют лимфоциты из крови четырех доноров, иммунизированных вирусом осповакцины. Для каждого донора после вакцинации проводят мониторинг титра антител против вируса осповакцины методом иммуноферментного анализа. Чтобы повысить вероятность отбора специфических антител в конструируемой библиотеке, кровь для последующего выделения клеток берут при достижении максимальных значений титра антител против вируса осповакцины в сыворотке.
Кровь в количестве 100 мл сразу же смешивают с антикоагулянтом и разбавляют равным объемом фосфатно-солевого буфера (PBS). Лимфоциты периферической крови выделяют путем центрифугирования в градиенте плотности фикол-триомбраст. Для этого полученный раствор крови наслаивают на раствор фикола-триомбраста в объемном соотношении 3:1 и затем центрифугируют при 1500 g в течение 30 мин. Мононуклеарные клетки, находящиеся в интерфазе, собирают и промывают несколько раз стерильным PBS. Для дальнейшего выделения РНК, клетки лизируют в растворе 4 М гуанидинизотиоцианата.
Далее выделяют суммарную РНК с использованием реагента TRIzol по стандартной методике. Полученную РНК используют как матрицу для синтеза первой цепи кДНК в реакции обратной транскрипции с использованием фермента M-MuLV обратной транскриптазы. В качестве праймеров используют олиго-dT и статистические гексаолигонуклеотиды.
Для синтеза второй цепи в качестве праймеров используют специфические олигонуклеотиды. Выбор олигонуклеотидов для амплификации фрагментов ДНК, кодирующих вариабельные домены тяжелых и легких цепей иммуноглобулинов, обусловлен первичной структурой этих доменов. Они ограничены по краям консервативными FR1 участками и J-сегментами, которые высоко консервативны в 3'-области. При этом каждому семейству иммуноглобулинов характерны свои консервативные последовательности FR1 участков и 3'-концевых фрагментов J-сегментов. Соответствующие им олигонуклеотиды могут быть использованы в качестве праймеров для амплификации кДНК В-лимфоцитов.
Для амплификации вариабельных доменов тяжелых цепей иммуноглобулинов используют праймеры 1-4, комплементарные последовательностям мРНК, кодирующим J-сегменты тяжелых цепей иммуноглобулинов, а также праймеры 5-7, соответствующие последовательностям мРНК, кодирующим FR1- районы тяжелых цепей иммуноглобулинов. Для амплификации вариабельных доменов легких цепей (каппа и ламбда) используют праймеры 8-15, комплементарные последовательностям мРНК, кодирующим J-сегменты легких цепей иммуноглобулинов, а также праймеры 16-22, соответствующие последовательностям мРНК, кодирующим FR1- районы легких цепей иммуноглобулинов. Такие наборы олигонуклеотидов позволяют амплифицировать вариабельные домены генов иммуноглобулинов, наиболее широко представленных в организме.
Амплификацию вариабельных фрагментов осуществляют в полимеразной цепной реакции (ПЦР) с использованием Taq- и Vent- ДНК-полимераз при температуре отжига праймеров 55°С.
На втором этапе с помощью нуклеотидной последовательности, кодирующей гибкий пептидный линкер Ser(Gly4Ser)2AlaArgGlySerGly4Ser, проводят объединение вариабельных фрагментов тяжелых и легких цепей иммуноглобулинов человека, в ДНК-последовательности, кодирующие одноцепочечные антитела человека (фиг.1). При этом используют олигонуклеотид, кодирующий обратную линкерную последовательность linkApaLI: 5' AGATCCGCCGCCACCCGAACCCGGTGCACTGCCGCCACCACCAGAGCCACCGCCACCTGA и содержащий сайт для эндонуклеазы рестрикции ApaLI (выделен жирным шрифтом).
Объединение проводят в несколько этапов. Сначала с помощью ПЦР олигонуклеотид linkApaLI достраивают последовательностями 23-26, кодирующими 3'-концы вариабельных доменов тяжелых цепей иммуноглобулинов. Затем полученный достроенный линкер с помощью ПЦР объединяют с тяжелыми цепями, используя праймеры 27-29, содержащие сайт рестрикции SfiI с 5'-конца.
В случае легких цепей, линкер linkApaLI, достроенный олигонуклеотидами 23-26, удлиняют последовательностями, комплементарными 5'-концам вариабельных доменов легких цепей. Для этого используют праймеры 30-36. Затем достроенный с обоих концов линкер объединяют с легкими цепями, используя праймеры 23-26 и праймеры 37-44, содержащие сайт рестрикции NotI.
Полученные фрагменты ДНК амплифицируют, очищают электрофрезом в 1,5% агарозном геле и обрабатывают эндонуклеазой рестрикции ApaLI. Подготовленные таким образом фрагменты ДНК, кодирующие вариабельные домены тяжелых и легких цепей, объединяют в реакции лигирования с использованием ДНК-лигазы фага Т4. Полученные фрагменты ДНК, кодирующие одноцепочечные антитела человека длинной около 800 п.н., амплифицируют с использованием праймеров 27-29 и 37-44, содержащих сайты рестрикции SfiI и NotI соответственно.
На третьем этапе полученные гены, кодирующие одноцепочечные антитела человека, встраивают в векторную фагмиду pHEN2 (MRC, Великобритания). Эта фагмида может реплицироваться как обычная плазмида, а благодаря наличию ori фага М13К07 и в случае котрансфекции клеток Е.coli фагом-помощником М13К07, может упаковываться в фаговые частицы. Между последовательностями, кодирующими встраиваемое одноцепочечное антитело и белок pIII бактериофага М13К07, находится стоп-кодон TAG, который в supE штаммах Е.coli транслируется как остаток глутаминовой кислоты, поэтому фагмида pHEN2 обеспечивает в supE штаммах Е.coli довольно высокий уровень экспрессии генов одноцепочечных антител в составе химерного белка с оболочечным белком pIII бактериофага М13К07. При комплементации в отсутствие фага-помощника одна копия рекомбинантного белка будет включаться в состав фаговой частицы, что не сказывается на инфекционности последней. Кроме того, при трансформации несупрессорных штаммов Е.coli данная фагмида позволяет получать секретируемые антитела в виде индивидульных молекул, без оболочечного белка.
Фрагменты ДНК, кодирующие одноцепочечные антитела, и ДНК фагмиды pHEN2 обрабатывают эндонуклеазами рестрикции SfiI и NotI и объединяют в реакции лигирования с помощью ДНК-лигазы фага Т4. В результате получается коллекция фагмидных ДНК, каждая из которых содержит под контролем промотора лактозного оперона уникальный ген одноцепочечного антитела человека в составе химерного белка с оболочечным белком pIII бактериофага М13К07.
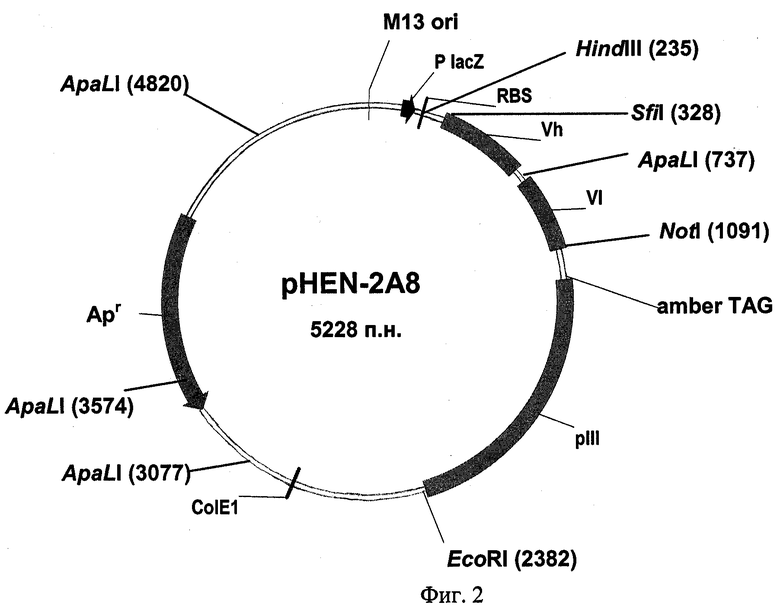
Полученная из описанной фагмидной коллекции рекомбинантная фагмидная ДНК pHEN-2A8, содержащая уникальный ген одноцепочечного антитела человека, способного нейтрализовать ортопоксвирусы (вирус осповакцины и вирус оспы коров), характеризуется следующими признаками:
- имеет молекулярную массу 3,46 МДа и размер 5258 п.о.;
- уникальные сайты узнавания эндонуклеазами рестрикции, имеющие следующие координаты: HindIII-235, SfiI-328, NotI-1091, EcoRI-2382.
- содержит полученный генно-инженерными методами искусственный ген одноцепочечного антитела человека, обеспечивающий под контролем промотора лактозного оперона в клетках E.coli синтез одноцепочечного антитела человека в составе химерного белка с оболочечным белком р3 фага М13К07, способного нейтрализовать ортопоксвирусы;
состоит из следующих элементов:
- SfiI/NotI - векторного фрагмента фагмиды pHEN2 (MRC, Великобритания) размером 4495 п.о., содержащего промотор Lac - оперона E.coli, ori E.coli, ori фага М 13, супрессируемый стоп-кодон TAG, фрагмент гена белка pIII фага М 13, ген β-лактамазы (bla);
- SfiI/NotI - фрагмента размером 763 п.о., включающего искусственный ген одноцепочечного антитела человека, способного нейтрализовать ортопоксвирусы, в котором вариабельный домен тяжелой цепи соединен с вариабельным доменом легкой цепи иммуноглобулина человека с помощью ДНК последовательности, кодирующей гибкий пептидный линкер Ser(Gly4Ser)2AlaArgGlySerGly4Ser, и имеющего нуклеотидную последовательность, представленную на фиг.6;
содержит:
- промотор Lac - оперона Е.coli;
- генетический маркер: ген β-лактамазы (bla), определяющий устойчивость трансформированных фагмидой pHEN-2A8 клеток бактерий к ампициллину;
- уникальные сайты узнавания эндонуклеазами рестрикции, имеющие следующие координаты: HindIII-235, SfiI-328, NotI-1091, EcoRI-2382.
Схема фагмиды pHEN-2A8 приведена на фиг.2.
Полученной коллекцией фагмид трансформируют клетки супрессорного штамма E.coli TG1 с использованием электропоратора BIORAD Gene Pulser™. Трансформированные клетки высевают на агаризованную среду 2×YT, содержащую 100 мкг/мл ампициллина и 1.5% глюкозы, и растят при 30°С в течение ночи. Выросшие клетки собирают и хранят в среде 2×YT, содержащей 30% глицерин, при -70°С. Полученная популяция клеток является целевой библиотекой одноцепочечных антител человека.
Для получения антител против ортопоксвирусов, например вируса осповакцины, проводят аффинное обогащение библиотеки специфическими клонами с использованием вируса осповакцины в качестве антигена с последующим отбором индивидуальных клонов, способных продуцировать бактериофаги, экспонирующие на своей поверхности одноцепочечные антитела человека против вируса осповакцины.
Для этого аликвоту трансформированных клеток размораживают, растят до среднелогарифмической фазы и инфицируют фагом-помощником М13К07, при этом получают популяцию нитчатых бактериофагов, каждый из которых экспонирует на своей поверхности уникальное одноцепочечное антитело человека в виде химерного белка с оболочечным белком pIII фага М13К07.
Аффинное обогащение библиотеки проводят в ходе трех последовательных раундов. Для проведения раунда обогащения в лунках полистиролового планшета сорбируют вирус осповакцины (штамм Elstree) в концентрации 100 мкг/мл. По окончании сорбции места неспецифического связывания насыщают 5%-ным раствором сухого обезжиренного молока, после чего в каждую лунку добавляют аликвоту (1011 БОЕ) библиотеки в виде коллекции нитчатых бактериофагов. Неспецифически связавшиеся фаговые частицы удаляют при промывке, а фаги, несущие на своей поверхности одноцепочечные антитела, способные связываться с вирусом осповакцины, элюируют раствором антигена и раствором триэтиламина. Полученными элюатами инфицируют культуру клеток Е.coli TG1 в стадии экспоненциального роста для амплификации элюированных фаговых антител.
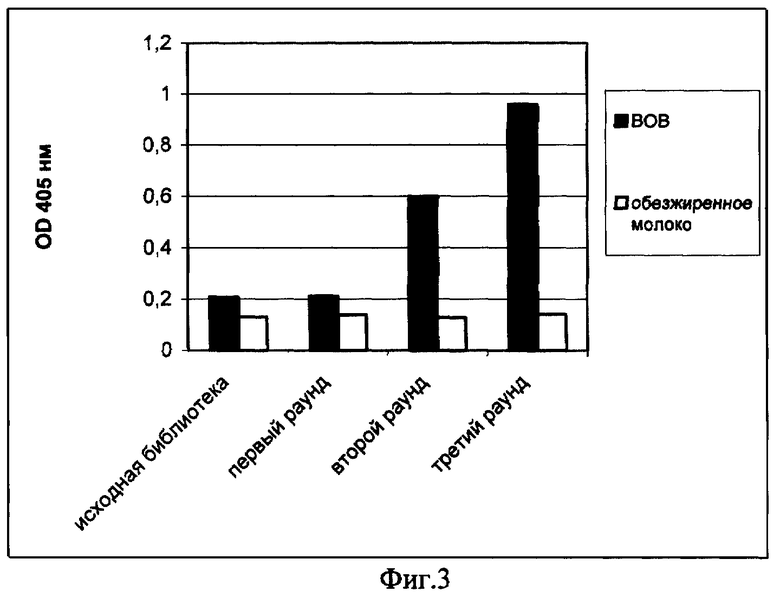
Второй и третий раунды аффинного обогащения проводят аналогично. При этом концентрации вируса осповакцины уменьшают до 50 и 20 мкг/мл соответственно. Степень обогащения библиотеки антителами, специфическими к вирусу осповакцины, проверяют с использованием непрямого твердофазного иммуноферментного анализа (ТИФА) по способности популяций фаговых антител, полученных в результате каждого раунда аффинного обогащения, связывать вирус осповакцины (фиг.3). При этом фаговые антитела выделяют, как описано в Примере 6. В качестве отрицательного контроля используют связывание популяций фаговых антител с сухим обезжиренным молоком.
Далее, из популяции фаговых антител, обогащенной против вируса осповакцины, проводят отбор моноклональных фаговых антител, специфически связывающих вирус осповакцины, с помощью ТИФА. Вирус осповакцины сорбируют на 96-луночные иммунологические планшеты («Медполимер», Россия) в концентрации 3 мкг/мл. Места неспецифического связывания блокируют раствором 3%-ного бычьего сывороточного альбумина (БСА, «Sigma», США) в фосфатном буфере, рН 7.2. Затем в лунки вносят выделенные как описано в Примере 6 фаговые антитела, разведенные PBS буфером, содержащим 0,1% Твин, и инкубируют 1 час при 37°С. После промывки в лунки вносят поликлональные анти-М13 мышиные антитела в разведении 1:2000, а затем антивидовой конъюгат щелочной фосфатазы («Sigma», США) в разведении 1:4000. В качестве хромогена используют паранитрофенилфосфат. Контролем неспецифического связывания служит связывание вируса с фагом-помощником М13К07, не несущим фрагментов антител на своей поверхности. В качестве отрицательного контроля используют связывание фаговых антител с БСА. Клоны, продемонстрировавшие сигнал, значение которого в 3 и более раз превышает контроль неспецифического связывания и отрицательный контроль, отбирают как положительные.
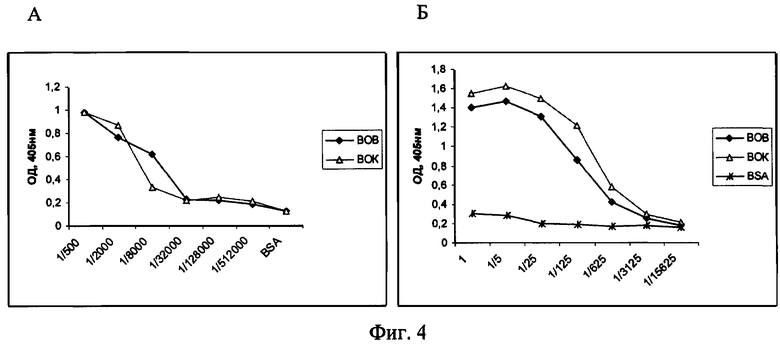
Отобранные фаговые антитела, выделяют и исследуют с помощью ТИФА при последовательном разведении антигена или антитела. При этом в качестве антигенов для более полной характеристики исследуемых антител можно использовать помимо вируса осповакцины, другие ортопоксвирусы, например вирус оспы коров (фиг.4).
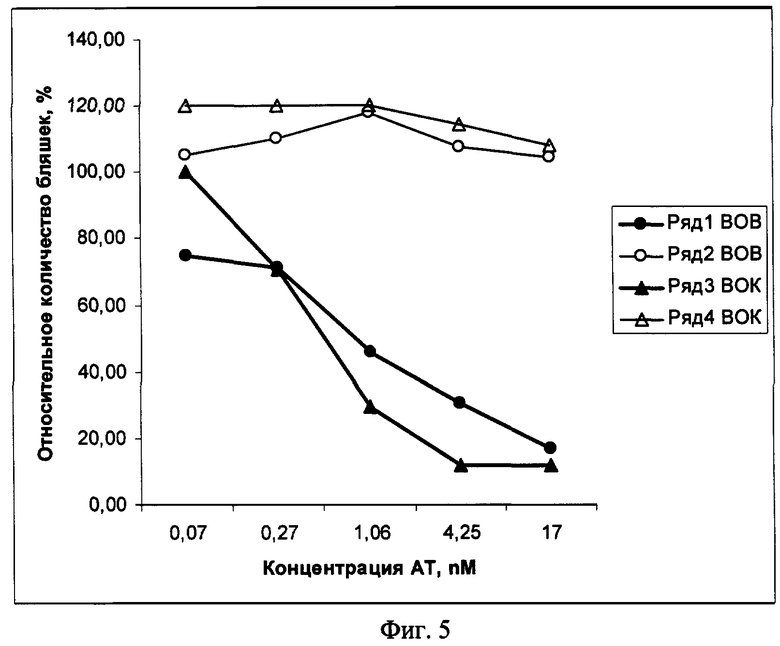
Стандартный анализ вируснейтрализующей активности проводят для всех фаговых антител, специфически связывающих вирус осповакцины. В ходе этого анализа проверяют способность ингибировать образование бляшек вирусами осповакцины и оспы коров на монослое клеток Vero E6. В качестве отрицательного контроля используют бактериофаг-помощник М13К07, не несущий на своей поверхности одноцепочечного антитела. Способность нейтрализовать вирусную инфекционность оценивают по титру нейтрализации, который определяется как разведение фаговых антител, демонстрирующее уменьшение количества вирусных бляшек не менее чем на 50% (фиг.5).
Далее проводят определение нуклеотидных последовательностей генов, кодирующих одноцепочечные антитела, нейтрализующие вирусную инфекционность. Для амплификации Vh и Vl фрагментов в качестве матрицы используют фагмидные ДНК, выделенные методом щелочного лизиса [9], и олигонуклеотидные праймеры: LMB 5'-CAGGAAACAGTCATGAC, pHEN-SEQ 5'-CTATGGGGCCCCATTCA. Амплификацию осуществляют методом ПЦР с использованием Taq и Vent ДНК-полимераз при температуре отжига праймеров LMB и pHEN-SEQ 55°С.
Определение нуклеотидных последовательностей очищенных Vh и Vl фрагментов проводят в обоих направлениях с использованием автоматического секвенатора CEQ™ 2000XL DNA Analysis System ("Beckman") и наборов "F"CEQ DTCS Kit. Нуклеотидные и выведенные аминокислотные последовательности анализируют с использованием баз данных IgBLAST и V-base. На фиг.6 представлена нуклеотидная последовательность уникального гена одноцепочечного антитела человека, обладающего вируснейтрализующей активностью в отношении вируса осповакцины и вируса оспы коров, а также аминокислотная последовательность этого рекомбинантного антитела 2А8.
Сущность изобретения заключается в следующем:
- сконструирована иммунная комбинаторная фаговая библиотека одноцепочечных антител человека на основе генов, кодирующих вариабельные домены иммуноглобулинов людей, вакцинированных вирусом осповакцины;
- из полученной иммунной фаговой библиотеки отобрана фагмидная ДНК pHEN-2A8, содержащая уникальный ген одноцепочечного антитела человека, способного нейтрализовать ортопоксвирусы (вирус осповакцины и вирус оспы коров);
- выделено фаговое одноцепочечное антитело 2А8, экспонированное на поверхности нитчатого бактериофага М13К07 в составе оболочечного белка р3, способное нейтрализовать ортопоксвирусы (вирус осповакцины и вирус оспы коров).
Изобретение иллюстрируется следующими фигурами:
Фиг.1. Схема конструирования фрагментов ДНК, кодирующих одноцепочечные антитела человека. На схеме показаны: гены вариабельных доменов тяжелых (Vh) и легких (Vl) цепей иммуноглобулинов; сайты для эндонуклеаз рестрикции ApaLI, SfiI, и NotI; места отжига праймеров LinkApaLI, 23-26, 27-29, 30-36, 37-44.
Фиг.2. Схема фагмиды pHEN-2A8, содержащей ген одноцепочечного антитела 2А8. Указаны сайты для эндонуклеаз рестрикции HindIII, SfiI, ApaLI, NotI и EcoRI; промотор лактозного оперона Р lac Z; место посадки рибосом RBS; гены вариабельных доменов тяжелых (Vh) и легких (Vl) цепей иммуноглобулинов, супрессируемый стоп кодон amber TAG; фрагмент гена белка pIII; ori репликации ColE1; ori фага М13; ген ампициллиновой устойчивости Арr.
Фиг.3. Связывание популяций фаговых антител после раундов селекции с вирусом осповакцины (ВОВ).
Фиг.4. Связывание фагового одноцепочечного антитела 2А8 с различными ортопоксвирусами при последовательных разведениях антигенов (А) и антитела (Б). Обозначения: ВОВ - вирус осповакцины, ВОК - вирус оспы коров.
Фиг.5. Нейтрализация инфекционности вирусов осповакцины и оспы коров фаговым одноцепочечным антителом 2А8 (ряд 1, 3) и фагом-помощником М13К07 (ряд 2, 4). Обозначения: BOB - вирус осповакцины, ВОК - вирус оспы коров.
Фиг.6. Нуклеотидная и соответствующая ей аминокислотная последовательность одноцепочечного антитела человека 2А8.
Для лучшего понимания сущности изобретения ниже следуют примеры его конкретного выполнения.
Пример 1. Выделение мононуклеарных клеток из периферической крови доноров, иммунизированных вирусом осповакцины.
В процессе отбора кровь сразу же смешивают с антикоагулянтом, а затем разбавляют равным объемом PBS. Лимфоциты из периферической крови выделяют путем центрифугирования в градиенте плотности фикол-триомбраст, приготовленном при смешивании 9%-ного раствора фикола и 32,8%-ного раствора триомбраста в объемном соотношении 24 к 10 соответственно. Плотность полученного раствора составляет 1,077 г/см. Далее раствор крови наслаивают на раствор фикола-триомбраста в объемном соотношении 3:1 и затем центрифугируют при 1500 g в течение 30 мин. Мононуклеарные клетки, находящиеся в интерфазе, собирают и промывают несколько раз стерильным PBS. Осадок клеток лизируют в растворе следующего состава: 4М гуанидинизотиоцианат, 50 мМ Tris-HCl, рН 7,6, 10 мМ ЭДТА, 2% лаурилсаркозилат натрия, 1% β-меркаптоэтанол.
Пример 2. Выделение РНК из лизата лимфоцитов периферической крови и синтез кДНК.
Суммарную РНК выделяют из лизата клеток с помощью реагента TRIzol (Sigma, США). Для этого к 200 мкл лизированного клеточного осадка добавляют 1 мл TRIzol и перемешивают в течение 30 мин при 30°С. Затем к лизату добавляют 100 мкл хлороформа, интенсивно встряхивают и инкубируют при -40°С 20 мин. После чего суспензию центрифугируют 5 мин при 10000 g, 4°С. Водную фазу переносят в чистую пробирку с 5 мкл 10% декстрана, не захватывая интерфазу. В эту же пробирку добавляют 600 мкл изопропанола, перемешивают и оставляют на 30 мин при -20°С. После этого смесь центрифугируют 30 мин при 12000 g, отбирают водную фазу, смешивают ее с 400 мкл холодного 70% этанола и центрифугируют 5 мин при 12000 g, 4°C. Удалив из пробирки супернатант, осадок подсушивают, растворяют в 30 мкл воды и используют в качестве матрицы для синтеза кДНК.
Синтез кДНК ведут в объеме 25 мкл. Для этого 3-5 мкг РНК смешивают с необходимым количеством DEPC-обработанной воды, добавляют 800 нг рэндомизированных гексаолигонуклеотидов и столько же олиго-dT. Полученную смесь инкубируют 10 мин при 65°С, затем переносят на лед, и добавляют 0,5 мкл РНКзина, 0,8 мкл 25 мМ dNTP и 2,5 мкл десятикратного буфера для обратной транскрипции, содержащего 50 мМ Tris-HCl pH 8,3, 3 мМ MgCl2, 75 мМ KCl, 10 мМ DTT. Смесь инкубируют 3-5 мин при 25°С, добавляют 200 единиц обратной транскриптазы M-MuLV и выдерживают еще 5 мин при 25°С, а затем 5 мин при 37°С, 60 мин при 42°С и 10 мин при 70°С. После этого реакционную смесь охлаждают на льду, разбавляют до 80 мкл и перед дальнейшим использованием хранят при -70°С.
Пример 3. Синтез фрагментов ДНК, кодирующих вариабельные домены тяжелых и легких цепей иммуноглобулинов человека.
Синтез фрагментов ДНК, кодирующих вариабельные домены иммуноглобулинов, проводят с использованием праймеров 1-4 и 5-7 в случае тяжелых цепей, и 8-15 и 16-22 в случае легких цепей (последовательности праймеров приведены выше). Реакционная смесь объемом 100 мкл содержит по 15 pmol указанных праймеров, 0,01% BSA, 2,5 мМ MgCl2, смесь dNTP (по 0,25 мМ каждого), 20 мМ Tris-HCl pH 8,8, 10 мМ KCl,10 мМ (NH4)2SO4, 2 мМ MgCl2, 0,1% Triton X-100, 5 мкл разбавленного раствора кДНК и по 1 ед. акт. ДНК-полимераз Taq и Vent. Всего проводят 25 циклов ПЦР по схеме: 94°С/1 мин, 55°С/35 сек, 72°С/50 сек. Продукты амплификации анализируют в 1,5% агарозном геле. В случае Vh цепей полосу размером около 340 п.о., а в случае Vl цепей полосу размером около 325 п.о. вырезают и экстрагируют из геля.
Пример 4. Объединение фрагментов кДНК, кодирующих вариабельные домены тяжелых и легких цепей иммуноглобулинов человека, в гены одноцепочечных антител.
а) Достройка линкерной последовательности фрагментами ДНК, кодирующими N-концы Vh-доменов иммуноглобулинов.
Реакционная смесь для ПЦР объемом 50 мкл содержит по 15 pmol праймеров 23-26 и 15 pmol праймера linkApaLI, 0,01% BSA, 2,5 мМ MgCl2, смесь dNTP (no 0,25 мМ каждого), 20 мМ Tris-HCl рН 8,8, 10 мМ KCl, 10 мМ (NH4)2SO4, 2 мМ MgCl2, 0,1% Triton X-100 и по 1 ед. акт. ДНК-полимераз Taq и Vent. Всего проводят 5 циклов по схеме: 94°С/1 мин, 56°С/30 сек, 72°С/50 сек, затем еще 20 циклов по схеме 94°С/1 мин, 68°С/20 сек, 72°С/60 сек. Продукт амплификации размером около 100 п.о. вырезают и экстрагируют из 1,5% агарозного геля.
б) Объединение фрагментов ДНК, кодирующих Vh-домены, с линкерной последовательностью.
Реакционная смесь объемом 25 мкл содержит по 100 ng фрагментов ДНК, кодирующих Vh-домены, и достроенного линкера, 0,01% BSA, 2,5 мМ MgCl2, смесь dNTP (по 0,25 мМ каждого), 20 мМ Tris-HCl рН 8,8, 10 мМ KCl, 10 mM (NH4)2SO4, 2 мМ MgCl2, 0,1% Triton X-100 и по 0,5 ед. акт. ДНК-полимераз Taq и Vent. Всего проводят 15 циклов ПЦР по схеме: 94°С/1 мин, 57°С/2 мин, 72°С/1 мин.
в) Амплификация фрагментов ДНК, кодирующих Vh-домены с линкером, с введением сайта для эндонуклеазы рестрикции SfiI, необходимого для дальнейшего клонирования.
Реакционная смесь для ПЦР объемом 50 мкл содержит по 15 pmol праймеров 27-29 и 15 pmol праймера linkApaLI, смесь dNTP (по 0,25 мМ каждого), 20 мМ Tris-HCl рН 8,8, 10 мМ KCl, 10 мМ (NH4)2SO4, 2 мМ MgCl2, 0,1% Triton X-100 и по 1 ед. акт. ДНК-полимераз Taq и Vent. В нагретую до 94°С реакционную смесь добавляют 5 мкл из ПЦР-смеси, в которой объединяют Vh-домен и линкер. Всего проводят 5 циклов по схеме: 94°С/1 мин, 57°С/30 сек, 72°С/55 сек, а затем еще 15 циклов по схеме: 94°С/1 мин, 68°С/20 сек, 72°С/50 сек. Продукт амплификации анализируют в 1,5% агарозном геле. Фрагмент размером около 460 п.о. вырезают и экстрагируют из геля.
г) Достройка линкерной последовательности фрагментами ДНК, кодирующими N-концы Vl-доменов иммуноглобулинов.
Линкер, достроенный ранее фрагментами ДНК, кодирующими С-концы Vh-доменов, удлиняют последовательностями, кодирующими N-концы Vl-доменов иммуноглобулинов, методом ПЦР. Для этого используют праймеры 23-26 и 30-36. Реакционная смесь объемом 50 мкл содержит по 15 pmol указанных праймеров, смесь dNTP (по 0,25 мМ каждого), 20 мМ Tris-HCl рН 8,8, 10 мМ KCl, 10 мМ (NH4)2SO4, 2 мМ MgCl2, 0,1% Triton X-100 и по 1 ед. акт. ДНК-полимераз Taq и Vent. Всего проводят 5 циклов ПЦР по схеме: 94°С/1 мин, 56°С/30 сек, 72°С/50 сек, а затем еще 20 циклов по схеме 94°С/1 мин, 68°С/20 сек, 72°С/60 сек. Продукт амплификации размером около 100 п.о. вырезают и экстрагируют из 1,5% агарозного геля.
д) Объединение фрагментов ДНК, кодирующих Vl-домены, с удлиненной линкерной последовательностью.
Реакционная смесь для ПЦР объемом 25 мкл содержит по 100 ng Vl цепей и линкера, 0,01% BSA, 2,5 мМ MgCl2, смесь dNTP (по 0,25 мМ каждого), 20 мМ Tris-HCl рН 8,8, 10 мМ KCl, 10 мМ (NH4)2SO4, 2 мМ MgCl2, 0,1% Triton Х-100 и по 0,5 ед. акт. ДНК-полимераз Taq и Vent. Всего проводят 15 циклов по схеме: 94°С/1 мин, 57°С/2 мин, 72°С/1 мин.
е) Амплификация фрагментов ДНК, кодирующих Vl-домены с линкером, с введением сайта для эндонуклеазы рестрикции NotI, необходимого для дальнейшего клонирования.
Амплификацию фрагмента ДНК, кодирующего Vl с линкером, проводят, используя праймеры 23-26 и праймеры 37-44. Реакционная смесь для ПЦР объемом 50 мкл содержит по 15 pmol указанных праймеров, смесь dNTP (no 0,25 мМ каждого), 20 мМ Tris-HCl рН 8,8,10 мМ KCl, 10 мМ (NH4)2SO4, 2 мМ MgCl2, 0,1% Triton X-100 и по 1 ед. акт. ДНК-полимераз Taq и Vent. В нагретую до 94°С реакционную смесь добавляют 5 мкл ПЦР-смеси, содержащей фрагменты ДНК, кодирующие Vl-домены, объединенные с удлиненной линкерной последовательностью. Всего проводят 5 циклов по схеме: 94°С/1 мин, 57°С/30 сек, 72°С/55 сек, а затем еще 15 циклов по схеме: 94°С/1 мин, 68°С/20 сек, 72°С/50 сек. Продукт амплификации анализируют в 1,5% агарозном геле. Фрагмент размером около 450 п.о. вырезают и экстрагируют из геля.
ж) Объединение ДНК-конструкций "Vh-линкер" и "Vl-линкер" в единые ДНК-последовательности, кодирующие одноцепочечные антитела.
По 0,5 мкг объединенных с линкером фрагментов Vh и Vl обрабатывают эндонуклеазой рестрикции ApaLI в течение 1 часа при 37°С. По окончании рестрикции смесь прогревают 10 мин при 70°С и добавляют ЭДТА до 15 мМ. Затем ДНК-фрагменты очищают с использованием силикагеля. Для этого к рестрикционной смеси добавляют 3-4 объема буфера, содержащего 6 М гуанидинизотиоцинат, 150 мМ NaAc pH 5,5 и 0,5% Triton X-100. Затем к полученному раствору добавляют изопропанол (из расчета 0,5-1 объем от исходного объема рестрикционной смеси) и 10-15 мкл силикагеля (SiO2 предварительно замачивают в 1-2 М HCl на несколько часов, затем отмывают водой до нейтрального pH, причем, соотношение объема осадка SiO2 к водной фазе составляет примерно 2:1). Полученную смесь инкубируют 10 мин при комнатной температуре при покачивании, затем центрифугируют 30 сек при 11 тыс.g. Супернатант удаляют, а осадок дважды промывают буфером, содержащим 80% этанол, 10 мМ Tris HCl pH 7,6 и 1 мМ ЭДТА, затем центрифугируют 30 сек при 11 тыс g. После удаления супернатанта, осадок сушат и добавляют элюирующий буфер, содержащий 10 мМ Tris HCl pH 8,8. Полученную смесь инкубируют 5-10 мин при 42°С, помешивая каждые две минуты, затем центрифугируют 5 мин при 12 тыс. g и супернатант, содержащий ДНК, отбирают, не захватывая осадок.
Очищенные таким образом ДНК-фрагменты объединяют с использованием реакции лигирования в объеме 40 мкл с помощью ДНК-лигазы фага Т4 в стандартных условиях. Затем полученные фрагменты ДНК, кодирующие 27-29 и 37-44. Реакционная смесь для ПЦР содержит по 15 pmol указанных праймеров смесь dNTP (по 0,25 мМ каждого), 20 мМ Tris-HCl pH 8,8, 10 мМ KCl, 10 мМ (NH4)2SO4, 2 мМ MgCl2, 0,1% Triton X-100 и по 1 ед. акт. ДНК-полимераз Taq и Vent. В нагретую до 94°С смесь для ПЦР добавляют 3 мкл лигазной смеси и проводят 20 циклов ПЦР по схеме: 94°С/1 мин, 56°С/30 сек, 72°С/1 мин 10 сек. Продукт амплификации анализируют в 1,5% агарозном геле, фрагмент размером около 800 п.о. вырезают и экстрагируют из геля.
Пример 5. Клонирование генов, кодирующих одноцепочечные антитела человека, в фагмиду pHEN2.
Полученный набор фрагментов ДНК, кодирующий одноцепочечные антитела, а также 10 мкг ДНК фагмиды pHEN2 обрабатывают эндонуклеазами рестрикции SfiI и NotI, после чего их очищают с использованием силикагеля, как описано в Примере 4 (ж).
Обработанные указанными эндонуклеазами рестрикции фрагменты ДНК, кодирующие одноцепочечные антитела, и ДНК фагмиды pHEN2 объединяют в реакции лигирования в соотношении 100 нг к 200 нг соответственно. Всего проводят 4 таких реакции в стандартных условиях с использованием ДНК-лигазы фага Т4, каждая реакция проводится в объеме 25 мкл.
По 5 мкл лигазной смеси используют для трансформации компетентных клеток супрессорного штамма E.coli TG1 с использованием электропоратора BIORAD Gene Pulser (BIORAD, США). Всего проводят 20 электропораций. Трансформированные клетки высевают на агаризованную среду 2×YT, содержащую 100 мкг/мл ампициллина и 1.5% глюкозы и растят при 30°С в течение ночи. Выросшие клетки собирают и хранят в среде 2×YT, содержащей 30% глицерин, при -70°С. Полученная популяция клеток, каждая из которых содержит уникальную фагмиду, является клеточным вариантом иммунной фагмидной библиотеки одноцепочечных антител человека.
Для определения количества независимых трансформантов высевают десятикратные разведения аликвоты суспензии трансформированных клеток. Суммарное количество независимых трансформантов составляет 3·107, что является расчетным титром библиотеки.
Для проверки качества библиотеки фагмидные ДНК 50 клонов, анализируют на наличие вставок, кодирующих одноцепочечные антитела. 48 из 50 фагмидных ДНК содержат вставки, следовательно, не менее 95% клонов библиотеки содержат фрагмент ДНК, кодирующий одноцепочечное антитело (критерий оценки χ2).
Из нескольких клонов выделяют фагмидную ДНК методом щелочного лизиса [7]. Структуры ДНК результирующих фагмид анализируют эндонуклеазами рестрикции HindIII, SfiI, ApaLI, NotI и EcoRI.
Пример 6. Получение популяции нитчатых бактериофагов, каждый из которых экспонирует на своей поверхности уникальное одноцепочечное антитело человека в виде химерного белка с оболочечным белком р3 фага М13К07.
Аликвоту клеточного варианта полученной библиотеки одноцепочечных антител человека, содержащую около 1010 клонов (25 мкл) инокулируют в 50 мл среды 2×YT, содержащей 100 мкг/мл ампициллина и 1% глюкозу, и растят при постоянном перемешивании при 37°С до OD600=0.5. После этого полученную культуру инфицируют фагом-помощником М13К07 (Pharmacia Biotech, Швеция), добавляя его в соотношении 1:20 (количество бактериальных клеток: количество фаговых частиц), и инкубируют 30 мин при 37°С. Затем 20 мл культуры осаждают центрифугированием в течение 10 мин при 3300 g. Осадок ресуспендируют в 10 мл 2×YT, содержащей 100 мкг/мл ампициллина и 25 мкг/мл канамицина, и переносят суспензию в 200 мл 2×YT, содержащей 100 мкг/мл ампициллина и 25 мкг/мл канамицина. Культуру инкубируют ночь при постоянном перемешивании при 30°С. На следующий день клетки Е.coli осаждают центрифугированием 10800 g, 10 мин в центрифуге "Beckman J2-21", к супернатанту добавляют 1/5 объема раствора PEG/NaCl (20% ПЭГ6000 и 2,5 М NaCl), хорошо перемешивают и в течение 1 ч инкубируют на льду. После этого суспензию центрифугируют при 10800 g 30 мин. Полученный осадок растворяют в 40 мл фосфатно-солевого буфера рН 7,2 (PBS), и добавляют 8 мл раствора PEG/NaCl, инкубируют во льду не менее 20 мин и проводят осаждение бактериофагов в центрифуге "Beckman J2-21" при 3300 g 30 минут. Супернатант вместе с остатками PEG/NaCl тщательно удаляют, а осадок ресуспендируют в 2 мл стерильного PBS. Для удаления остатков бактериальных клеток фаговую суспензию центрифугируют при 3300 g 10 мин. Выход фаговых частиц составляет приблизительно 1012-1013 бляшкообразующих единиц (БОЕ).
Пример 7. Аффинное обогащение полученной библиотеки фаговыми антителами, специфичными к вирусу осповакцины.
Аффинное обогащение библиотеки проводят в ходе трех последовательных раундов. Для проведения первого раунда селекции в лунках 96-луночного планшета («Медполимер», Россия) сорбируют вирус осповакцины в концентрации 100 мкг/мл в PBS и инкубируют в течение ночи при комнатной температуре. На следующий день после удаления антигена лунки трижды промывают PBS и места неспецифического связывания насыщают 5% раствором сухого обезжиренного молока в буфере PBS в течение 2 ч при 37°С. Кроме того, 5% раствор сухого обезжиренного молока сорбируют в дополнительные лунки в качестве отрицательного контроля. После этого лунки трижды промывают PBS и в каждую лунку добавляют 1011 БОЕ фаговой библиотеки в 100 мкл раствора PBS с 0,1% Твин-20. Планшеты инкубируют 1,5 часа при постоянном перемешивании при 37°С, после чего лунки планшета промывают 20 раз раствором PBS с 0,1% Твин-20, а затем 20 раз PBS.
Элюцию связавшихся бактериофагов проводят с помощью антигена. Для этого в лунки добавляют по 100 мкл суспензии вируса осповакцины в PBS в концентрации 100 мкг/мл и инкубируют 30 минут при 37°С при перемешивании. Для дополнительной элюции фагов в лунки добавляют по 100 мкл 100 мМ триэтиламина, 2-3 минуты непрерывно перемешивают и элюированные фаги переносят в 350 мкл 1М трис-HCl, рН 7,4.
Для получения фагового репертуара культуру клеток Е.coli TG1 в стадии экспоненциального роста (по 10 мл для каждого элюата) инфицируют полученными фаговыми элюатами (по 400 мкл), инкубируют 30 мин при 37°С, затем центрифугируют 10 мин при 3000 g. Осадки ресуспендируют в 1 мл 2×YT и высевают на чашки с агаризованной средой 2×YT, содержащей 100 мкг/мл ампициллина и 1% глюкозу. Чашки инкубируют ночь при 30°С. Выросшие клетки собирают и хранят в среде 2×YT, содержащей 30% глицерин, при -70°С.
Амплификацию отобранных после первого раунда бактериофагов проводят как описано в Примере 6, используя объединенные глицериновые стоки с обеих элюций.
Второй и третий раунды аффинного обогащения проводят аналогично. При этом концентрации вируса осповакцины уменьшают до 50 и 20 мкг/мл соответственно.
Степень обогащения библиотеки антителами, специфичеными к вирусу осповакцины, проверяют с использованием непрямого ТИФА по способности популяций фаговых антител, полученных в результате каждого раунда аффинного обогащения, связывать вирус осповакцины (фиг.3). Для этого вирус осповакцины сорбируют на 96-луночные иммунологические планшеты («Медполимер», Россия) в количестве 300 нг на лунку. Места неспецифического связывания блокируют раствором 3%-ного БСА («Sigma», США) в фосфатном буфере, рН 7.2. Затем в лунки вносят фаговые антитела, выделенные как описано в Примере 6, разведенные PBS буфером, содержащим 0,1% Твин, и инкубируют 1 час при 37°С. После промывки в лунки вносят анти-М13 мышиную сыворотку в разведении 1:2000, а затем антивидовой конъюгат щелочной фосфатазы («Sigma», США) в разведении 1:4000. В качестве хромогена используют паранитрофенилфосфат. В качестве отрицательного контроля используют связывание фаговых антител с обезжиренным молоком. Результаты приведены на фиг.3.
Пример 8. Отбор клонов, способных продуцировать антитела, связывающие вирус осповакцины.
Для получения моноклональных фаговых антител отдельные колонии E.coli TG1 из обогащенной против вируса осповакцины библиотеки пересевают с агаризованной среды в жидкую среду 2×YT, содержащую 100 мкг/мл ампициллина и 1%-ную глюкозу, и растят до плотности, равной 0,5 при OD600. Затем клетки инфицируют фагом-помощником М13К07, осаждают центрифугированием 3300 g, 10 мин и ресуспендируют клеточный осадок в среде, содержащей 100 мкг/мл ампициллина и 50 мкг/мл канамицина. Клетки культивируют при 30°С при перемешивании в течение ночи и затем осаждают центрифугированием 10800 g, 10 мин.
Супернатант, содержащий фаговые антитела, исследуют на способность связываться с вирусом осповакцины методом ТИФА. Вирус осповакцины сорбируют в лунки 96-луночных иммунологических планшетов («Медполимер», Россия) в концентрации 3 мкг/мл. Места неспецифического связывания блокируют раствором 3%-ного БСА («Sigma», США) в фосфатном буфере, рН 7.2. Затем в лунки вносят супернатанты, разведенные PBS буфером, содержащим 0,1% Твин, в объемном соотношении 1:1 и инкубируют 1 час при 37°С. После промывки в лунки вносят анти-М13К07 мышиную сыворотку в разведении 1:2000, а затем антивидовой конъюгат щелочной фосфатазы («Sigma», США) в разведении 1:4000. В качестве хромогена используют паранитрофенилфосфат. Контролем неспецифического связывания служит связывание вируса с фагом-помощником М13К07, не несущим фрагментов антител на своей поверхности. В качестве отрицательного контроля используют связывание фаговых антител с БСА. Результаты приведены на фиг.4
В дальнейшем из супернатантов, продемонстрировавших сигнал, значение которого в 3 и более раз превышает контроль неспецифического связывания и отрицательный контроль, выделяют фаговые антитела с помощью преципитации раствором PEG/NaCl и последующего центрифугирования, как описано в Примере 6.
Пример 9. Твердофазный иммуноферментный анализ связывания фагового антитела 2А8 с вирусом осповакцины и вирусом оспы коров.
а) ТИФА при последовательном разведении антигена.
Последовательные разведения вируса осповакцины и вируса оспы коров, начиная с 300 нг на лунку, с шагом 1:5 сорбируют в лунки 96-луночных иммунологических планшетов («Медполимер», Россия). Места неспецифического связывания блокируют раствором 3%-ного БСА («Sigma», США) в фосфатном буфере, рН 7.2. Затем в лунки вносят фаговые частицы, несущие на своей поверхности антитело 2А8, в количестве 1010 БОЕ на лунку в PBS буфере, содержащим и 0,1% Твин, и инкубируют 1 час при 37°С. После промывки в лунки вносят поликлональные анти-М13К07 антитела кролика в разведении 1:12000, а затем антивидовой конъюгат щелочной фосфатазы («Sigma», США) в разведении 1:4000. В качестве хромогена используют паранитрофенилфосфат.
б) ТИФА при последовательном разведении антитела.
Вирус осповакцины и вирус оспы коров сорбируют в лунки 96-луночных иммунологических планшетов («Медполимер», Россия) в концентрации 300 нг на лунку. Места неспецифического связывания блокируют раствором 3%-ного БСА («Sigma», США) в фосфатном буфере, рН 7.2. Затем в лунки вносят последовательные разведения фагового антитела 2А8 в PBS буфере (шаг 1:5), начиная с 1010 БОЕ на лунку, содержащем 0,1% Твин, и инкубируют 1 час при 37°С. После промывки в лунки вносят анти-М13К07 мышиную сыворотку в разведении 1:2000, а затем антивидовой конъюгат щелочной фосфатазы («Sigma», США) в разведении 1:4000. В качестве хромогена используют паранитрофенилфосфат. В качестве отрицательного контроля используют связывание фаговых антител с БСА.
Результаты экспериментов приведены на фиг.4
Пример 10. Исследование вируснейтрализующей активности фагового антитела 2А8.
Суспензию вирусов разводят до уровня примерно 50 БОЕ на лунку и смешивают с равным объемом фаговых антител соответствующего разведения. Антитела последовательно разводят в PBS буфере с шагом 1:5 начиная с концентрации 1012 фаговых частиц. Смеси инкубируют при 37°С в течение 1 часа. Аликвоты из каждой смеси наносят на монослой клеток линии Vero E6 в 24-луночные планшеты при 37°С на 1 час, затем смывают. Затем лунки покрывают средой MEM, содержащей 2% FBS и 0.24% агарозу. Жизнеспособные клетки окрашивают через 3-4 дня после инфицирования, визуализируя бляшки. В качестве отрицательного контроля используется бактериофаг-помощник М13К07, не несущий на своей поверхности одноцепочечного антитела. Титр нейтрализации определяют как разведение фаговых антител, при котором происходит 50%-ное уменьшение количества бляшек.
Результаты приведены на фиг.5
Источники информации
1. Fenner F., Wittek R., Dumbel K. The Orthopoxviruses. San Diego, New York, Berkeley, Boston, London, Sydney, Tokyo, Toronto: Academic Press, Inc. 1989.
2. O'Connell D, Becerril B, Roy-Burman A, Daws M, Marks JD. Phage versus phagemid libraries for generation of human monoclonal antibodies. J Mol Biol. 2002. 321(1):49-56.
3. A A den Broeder, LAB Joosten, Т Saxne, D Heinegard, H Fenner, A M M Miltenburg, W L H Frasa, L J van Tits, W A Buurman, P L С M van Riel, L В A van de Putte and P Barrera. Long term anti-tumour necrosis factor omionotherapy in rheumatoid arthritis: effect on radiological course and prognostic value of markers of cartilage turnover and endothelial activation. Annals of the Rheumatic Diseases. 2002, 61:311-318
4. Hoogenboom H.R. and Winter G. By-passing immunization: Human antibodies from synthetic repertoires of germline VH gene segments rearranged in vitro// J. Mol. Biol. - 1992. - Vol.227. - P.381-388.
5. Патент США №6265169, кл. С 12 Q 1/68, опубл. 2001 г.
6. С.Schmaijohn, Y.Cul, S.Kerby, D.Pennok, K.Spik.// Virology, 1999, v.258, p.189-200.
7. Huston J.S., Mudgett-Hunter M., Nai M.S., McCartney J., Warren F., Haber E., Opperman H. Protein engineering of single-chain Fv analogs and fusion proneins.// Meth. Enzymology. 1990. v.203. p.46-89.
8. Kay B.K., Winter J., MacCafferty, J., Phage display of peptides and proteins: a laboratory manual.// antibodies: filamentous phage displaying antibody variable domains.// Academic Press, Inc. 1996.
9. Bimboim H.C. and Doly J. A rapid aikalin extraction procedure for screening recombinant plasmid DNA.// Nucl. Acids Res. 1979. v.7. p.1513-1523.

Изобретение относится к биотехнологии и белковой инженерии. Библиотека представляет собой клетки E.coli TG1, каждая из которых содержит рекомбинантную фагмидную ДНК, обеспечивающую биосинтез нитчатых бактериофагов, экспонирующих на своей поверхности уникальное одноцепочечное антитело человека. Также предложена рекомбинантная фагмидная ДНК pHEN-2A8, содержащая искусственный ген одноцепочечного антитела человека под контролем промотора лактозного оперона, обеспечивающий в клетках E.coli синтез одноцепочечного антитела человека в составе химерного белка с оболочечным белком pIII бактериофага М13. Кроме того, предложен способ получения искусственного одноцепочечного антитела человека 2А8 с помощью такой фагмидной ДНК. Изобретение может быть использовано в медицине. 3 н.п. ф-лы, 6 ил.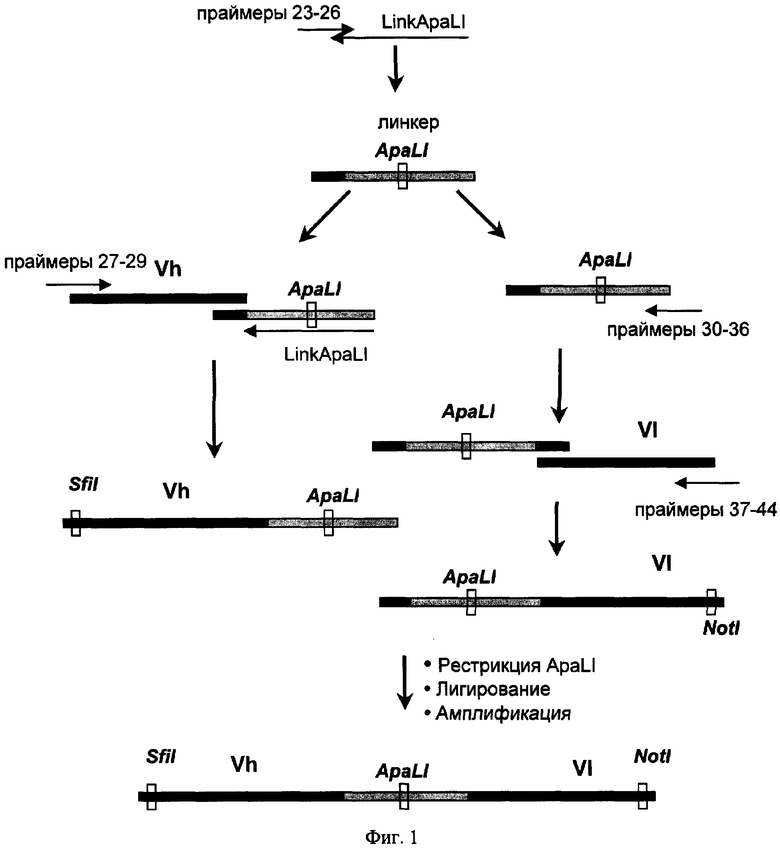
имеет молекулярную массу 3,46 МДа и размер 5258 п.н.;
содержит полученный генно-инженерными методами искусственный ген одноцепочечного антитела человека, обеспечивающий под контролем промотора лактозного оперона в клетках E.coli синтез одноцепочечного антитела человека в составе химерного белка с оболочечным белком р3 фага М13К07, способного нейтрализовать вирус осповакцины и вирус оспы коров;
состоит из следующих элементов:
SfiI/NotI - векторного фрагмента фагмиды pHEN2 (MRC, Великобритания) размером 4495 п.о., содержащего промотор Lac - оперона E.coli, ori E.coli, ori фага М 13, супрессируемый стоп-кодон TAG, фрагмент гена белка pIII фага М 13, ген β-лактамазы (bla);
SfiI/NotI - фрагмента размером 763 п.о., включающего искусственный ген одноцепочечного антитела человека, способного нейтрализовать вирус осповакцины и вирус оспы коров, в котором вариабельный домен тяжелой цепи соединен с вариабельным доменом легкой цепи иммуноглобулина человека с помощью ДНК последовательности, кодирующей гибкий пептидный линкер Ser(Gly4Ser)2AlaArgGlySerGly4Ser, и имеющего нуклеотидную последовательность, представленную на фиг.6;
содержит
промотор Lac-оперона E.coli;
генетический маркер: ген β-лактамазы (bla), определяющий устойчивость трансформированных фагмидой pHEN-2A8 клеток бактерий к ампициллину;
уникальные сайты узнавания эндонуклеазами рестрикции, имеющие следующие координаты: HindIII-235, SfiI-328, NotI-1091, EcoRI-2382.
| SCHMALJOHN С | |||
| et al., "Production and characterization of human monoclonal antibody Fab fragments to vaccinia virus from a phage-display combinatorial library", Virology | |||
| Металлический водоудерживающий щит висячей системы | 1922 |
|
SU1999A1 |
| KAY B.K | |||
| et al., "Phage display of peptides and proteins: a laboratory manual | |||
| // antibodes: filamentous phage displaying antibody variable domains.", Academic Press, Inc, 1996. | |||
Авторы
Даты
2007-12-10—Публикация
2005-08-15—Подача