Настоящее изобретение относится к новым производным 4-диметиламиномасляной кислоты, способу их получения и фармацевтическим композициям, содержащим указанные соединения, а также к применению этих соединений для получения лекарственных средств.
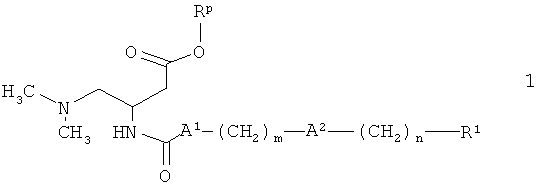
Более подробно настоящее изобретение относится к соединениям формулы
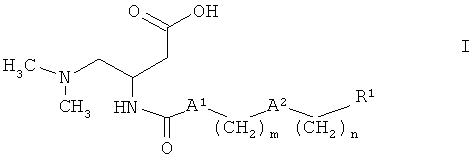
где
А1 обозначает NH или связь,
А2 выбран из группы, включающей связь, О, O(СН2)2O, S, SO2, CF2 и NR2, где R2 обозначает водород или (низш.)алкил,
m выбран из 2, 3, 4, 5, 6, 7, 8, 9, 10 и 11,
n выбран из 0, 1, 2, 3, 4 и 5,
R1 обозначает арил, который выбран из фенила и нафтила, причем указанный арил является незамещенным или замещенным одной, двумя, тремя, четырьмя или пятью группами, выбранными из группы, включающей (низш.)алкил, галоген, галоген (низш.)алкил, (низш.)алкоксигруппу и фенил, или
гетероарил, который выбран из пиридила, тиенила и тиазолила, причем указанный гетероарил является незамещенным или замещенным одной, двумя или тремя группами, выбранными из группы, включающей (низш.)алкил, галоген, галоген (низш.)алкил, (низш.)алкоксигруппу и фенил,
и к их фармацевтически приемлемым солям.
Повышенный уровень свободных жирных кислот (FFA) в плазме вызывает острую и долговременную периферическую и печеночную инсулинорезистентность. Повышенный уровень FFA в плазме и более интенсивное окисление FFA связаны с диабетом типа 2. Гипергликемия после воздержания от приема пищи в течение ночи является основным маркером и важным диагностическим критерием диабета, а с избыточным глюконеогенезом связано развитие гипергликемии после всасывания у пациентов, страдающих от диабета. Высокий уровень свободных жирных кислот (FFA) приводит к увеличению интенсивности β-окисления в митохондриях в печени, что приводит к повышению концентрации ацетил-СоА. При этом обеспечивается возрастание энергии (АТР) и восстанавливающей способности (NADH) для глюконеогенеза. Повышенный уровень ацетил-СоА также индуцирует глюконеогенез за счет аллостерической активации пируваткарбоксилазы. При этом снижение избыточного β-окисления в печени, которое в основном имеет важное значение для индукции эффективного глюконеогенеза, должно приводить к снижению гипогликемии натощак у пациентов, страдающих от диабета. Окисление в митохондриях длинноцепочечных FFA требует участия двух мембраносвязанных карнитинзависимых пальмитоилтрансфераз (СРТ). СРТ1, фермент, расположенный на внешней мембране митохондрии, катализирует образование длинноцепочечных ацилкарнитинов. Изоформы печеночного (L-СРТ1) и мышечного (М-СРТ1) кодируются двумя различными генами и ингибируются при действии малонил-СоА. N-концевой домен L-CPT1 придает низкую чувствительность к малонил-СоА. СРТ2, фермент, расположенный на внутренней мембране митохондрии, превращает длинноцепочечные ацилкарнитины в длинноцепочечные сложные эфиры ацил-СоА. Длинноцепочечные ацил-СоА затем в процессе β-оксиления превращаются в ацетил-СоА, что активирует пируваткарбоксилазу и глюконеогенез. Согласно описанному выше механизму действия, фармацевтически активные соединения, подавляющие транспорт длинноцепочечных FFA путем ингибирования СРТ, снижают интенсивность β-оксиления в печени, соответственно, подавляют глюконеогенез и таким образом предотвращают гипергликемию.
Настоящее изобретение относится к новым соединениям, ингибирующим активность карнитинпальмитоилтрансферазы (СРТ) и, прежде всего/предпочтительно, активность СРТ2. Соединения по настоящему изобретению можно использовать в качестве фармацевтически активных агентов для профилактики и/или лечения заболеваний, которые модулируются ингибиторами СРТ, прежде всего/предпочтительно ингибиторами СРТ2, прежде всего, заболеваний, связанных с гипергликемией и/или нарушенной толерантностью к глюкозе. Указанные заболевания включают, например, диабет и связанные с ним заболевания, инсулиннезависимый сахарный диабет (диабет типа II), ожирение, гипертензию, синдром резистентности к инсулину, метаболический синдром, гиперлипидемию, гиперхолестеринемию, жировой гепатоз, атеросклероз, застойную сердечную недостаточность и почечную недостаточность.
Новые соединения по настоящему изобретению обладают преимуществами по сравнению с известными соединениями, так как они особенно или предпочтительно ингибируют активность СРТ2. Таким образом, следует ожидать, что указанные соединения обладают повышенной терапевтической эффективностью по сравнению с соединениями, известными в данной области техники.
Если не указано иное, для иллюстрации настоящего изобретения используют следующие определения.
В данном контексте термин «(низш.)» обозначает группу, содержащую от одного до семи, предпочтительно от одного до четырех атомов углерода.
Термин «галоген» обозначает фтор, хлор, бром и иод, предпочтительно фтор, хлор и бром.
Термин «алкил», отдельно или в комбинации с другими группами, обозначает одновалентный насыщенный алифатический углеводородный радикал с прямой или разветвленной цепью, содержащий от одного до двадцати атомов углерода, предпочтительно от одного до шестнадцати атомов, более предпочтительно от одного до десяти атомов углерода. Термин «C1-С10алкил» обозначает одновалентный насыщенный алифатический углеводородный радикал с прямой или разветвленной цепью, содержащий от одного до десяти атомов углерода, например, такой как метил, этил, н-пропил, изопропил, н-бутил, втор-бутил, трет-бутил, пентил, 1,1,3,3-тетраметилбутил и т.п. Группы (низш.)алкил, описанные ниже, также относятся к предпочтительным алкильным группам.
Термин «(низш.)алкил» или «С1-С7алкил» отдельно или в комбинации с другими группами обозначает одновалентный алкильный радикал с прямой или разветвленной цепью, содержащий от одного до семи атомов углерода, предпочтительно от одного до четырех атомов углерода. Примеры указанных радикалов включают такие группы, как метил, этил, н-пропил, изопропил, н-бутил, втор-бутил, трет-бутил и т.п.
Термин «галоген(низш.)алкил» или «галогенС1-С7алкил» обозначает (низш.)алкильные группы, как описано выше, в которых по крайней мере один атом водорода в составе (низш.)алкила заменен на атом галогена, предпочтительно фтор или хлор, наиболее предпочтительно фтор. Предпочтительные галоген(низш.)алкильные группы включают трифторметил, дифторметил, трифторэтил, 2,2-дифторэтил, фторметил и хлорметил, наиболее предпочтительно, трифторметил.
Термин «алкокси» или «(низш.)алкокси» обозначает группу R'-O-, где R' обозначает (низш.)алкил, а термин (низш.)алкил определен выше. Примеры (низш.)алкоксигрупп включают метоксигруппу, этоксигруппу, н-пропоксигруппу, изопропоксигруппу, н-бутоксигруппу, изобутоксигруппу, втор-бутоксигруппу и трет-бутоксигруппу, предпочтительно метоксигруппу и этоксигруппу, наиболее предпочтительно метоксигруппу.
Соединения формулы (I) могут образовывать фармацевтически приемлемые соли. Соединения формулы (I) могут образовывать соли оснований. Примеры указанных солей включают соли щелочных металлов, щелочно-земельных металлов и аммония, например, такие как соли Na, K, Ca и триметиламмония. Соединения формулы I, кроме того, могут образовывать фармацевтически приемлемые кислотно-аддитивные соли. Примеры указанных фармацевтически приемлемых солей включают соли соединений формулы (I) и физиологически совместимых минеральных кислот, таких как соляная кислота, серная кислота или фосфорная кислота, или соли органических кислот, таких как метансульфоновая кислота, пара-толуолсульфоновая кислота, уксусная кислота, молочная кислота, лимонная кислота, фумаровая кислота, малеиновая кислота, винная кислота, янтарная кислота или салициловая кислота. Термин «фармацевтически приемлемые соли» обозначает все указанные соли.
Более подробно настоящее изобретение относится к соединениям формулы

где
А1 обозначает NH или связь,
А2 выбран из группы, включающей связь, О, O(СН2)2O, S, SO2, CF2 и NR2, где R2 обозначает водород или (низш.)алкил,
m выбран из 2, 3, 4, 5, 6, 7, 8, 9, 10 и 11,
n выбран из 0, 1, 2, 3, 4 и 5,
R1 обозначает арил, который выбран из фенила и нафтила, причем указанный арил является незамещенным или замещенным одной, двумя, тремя, четырьмя или пятью группами, выбранными из группы, включающей (низш.)алкил, галоген, галоген(низш.)алкил, (низш.)алкоксигруппу и фенил, или
гетероарил, который выбран из пиридила, тиенила и тиазолила, причем указанный гетероарил является незамещенным или замещенным одной, двумя или тремя группами, выбранными из группы, включающей (низш.)алкил, галоген, галоген(низш.)алкил, (низш.)алкоксигруппу и фенил,
и к их фармацевтически приемлемым солям.
Прежде всего, предпочтительными являются индивидуальные соединения формулы I и фармацевтически приемлемые соли, особенно предпочтительных соединений формулы I.
Предпочтительными являются соединения формулы I по настоящему изобретению, где А1 обозначает связь.
Кроме того, предпочтительными являются соединения формулы I по настоящему изобретению, где А2 выбран из группы, включающей простую связь, О, O(СН2)2O, S, SO2 и NR2, где R2 обозначает водород или (низш.)алкил.
Более предпочтительно А2 выбран из группы, включающей связь, О и O(СН2)2O.
Группа более предпочтительных соединений формулы I включает соединения формулы I, в которых А2 обозначает О или O(СН2)2O, прежде всего предпочтительными являются соединения формулы I, в которых А2 обозначает О (кислород).
Другая группа предпочтительных соединений формулы I включает соединения, в которых А2 обозначает связь.
Предпочтительными являются соединения формулы I по настоящему изобретению, в которых m выбран из 6, 7, 8, 9, 10 и 11.
Более предпочтительными являются соединения формулы I по настоящему изобретению, где n выбран из 0, 1, 2 и 3, еще более предпочтительными являются соединения, в которых n равен из 0 или 1, и наиболее предпочтительными являются соединения, в которых n равен 1.
Наиболее предпочтительными являются соединения формулы I, в которых сумма m+n выбрана из 8, 9 и 10.
Группа предпочтительных соединений формулы (I) по настоящему изобретению включает соединения, в которых R1 обозначает арил, выбранный из фенила и нафтила, причем указанный арил является незамещенным или замещенным одной, двумя, тремя, четырьмя или пятью группами, выбранными из группы, включающей (низш.)алкил, галоген, галоген(низш.)алкил, (низш.)алкоксигруппу и фенил.
Прежде всего предпочтительными являются соединения формулы I по настоящему изобретению, где R1 обозначает фенил, замещенный одной, двумя, тремя, четырьмя или пятью заместителями, выбранными из группы, включающей (низш.)алкил, галоген, галоген(низш.)алкил, (низш.)алкоксигруппу и фенил. Более предпочтительны соединения формулы I, в которых R1 обозначает фенил, замещенный одной, двумя, тремя, четырьмя или пятью группами, выбранными из группы, включающей (низш.)алкил, галоген, галоген(низш.)алкил, (низш.)алкоксигруппу и фенил, при условии что по крайней мере один заместитель обозначает галоген или галоген(низш.)алкил. Особенно предпочтительно, когда R обозначает фенил, замещенный одной, двумя, тремя, четырьмя или пятью группами, выбранными из группы, включающей галоген или галоген(низш.)алкил.
Другая группа предпочтительных соединений формулы I по настоящему изобретению включает соединения, в которых R1 обозначает гетероарил, который выбран из группы, включающей пиридил, тиенил и тиазолил, причем указанный гетероарил является незамещенным или замещенным одной, двумя или тремя группами, выбранными из группы, включающей (низш.)алкил, галоген, галоген(низш.)алкил, (низш.)алкоксигруппу и фенил.
Особенно предпочтительными являются соединения формулы I по настоящему изобретению, где R1 обозначает гетероарил, который выбран из группы, включающей пиридил, тиенил и тиазолил.
Кроме того, наиболее предпочтительными являются соединения формулы I с (R)-конфигурацией, т.е. соединения формулы
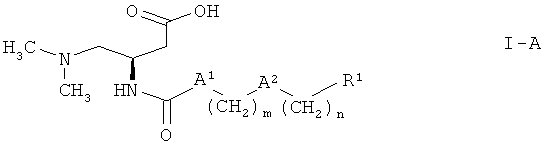
Предпочтительными соединениями формулы I являются соединения, выбранные из группы, включающей
(R)-3-[8-(3,4-дифторбензилокси)октаноиламино]-4-диметиламиномасляную кислоту,
(R)-3-[8-(2,5-дифторбензилокси)октаноиламино]-4-диметиламиномасляную кислоту,
(R)-3-[8-(2,4-дифторбензилокси)октаноиламино]-4-диметиламиномасляную кислоту,
(R)-4-диметиламино-3-[8-(2,3,4-трифторбензилокси)октаноиламино]масляную кислоту,
(R)-4-диметиламино-3-(8-пентафторфенилметоксиоктаноиламино)масляную кислоту,
(R)-4-диметиламино-3-[8-(4-трифторметибензилокси)октаноиламино]масляную кислоту,
(К)-4-диметиламино-3-[8-(3-фтор-4-трифторметилбензилокси)октаноиламино]масляную кислоту,
(R)-4-диметиламино-3-[8-(4-метоксибензилокси)октаноиламино]масляную кислоту,
(R)-3-[8-(бифенил-4-илметокси)октаноиламино]-4-диметиламиномасляную кислоту,
(R)-4-диметиламино-3-[8-(2-фтор-4-трифторметилбензилокси)октаноиламино]масляную кислоту,
(R)-4-диметиламино-3-[8-(2,3,5,6-тетрафтор-4-метоксибензилокси)октаноиламино]масляную кислоту,
(R)-4-диметиламино-3-[8-(нафталин-1-илметокси)октаноиламино]масляную кислоту,
(R)-4-диметиламино-3-[8-(2-фторбензилокси)октаноиламино]масляную кислоту,
(R)-4-диметиламино-3-[8-(3-фторбензилокси)октаноиламино]масляную кислоту,
(R)-4-диметиламино-3-[8-(4-фторбензилокси)октаноиламино]масляную кислоту,
(R)-3-[8-(2,3-дифторбензилокси)октаноиламино]-4-диметиламиномасляную кислоту,
(R)-3-(8-бензилоксиоктаноиламино)-4-диметиламиномасляную кислоту,
(R)-4-диметиламино-3-[9-(2-фторфенокси)нонаноиламино]масляную кислоту,
(R)-4-диметиламино-3-[9-(3-фторфенокси)нонаноиламино]масляную кислоту,
(R)-4-диметиламино-3-[9-(4-фторфенокси)нонаноиламино]масляную кислоту,
(R)-3-[9-(2,3-дифторфенокси)нонаноиламино]-4-диметиламиномасляную кислоту,
(R)-3-[9-(2,4-дифторфенокси)нонаноиламино]-4-диметиламиномасляную кислоту,
(R)-3-[9-(3,4-дифторфенокси)нонаноиламино]-4-диметиламиномасляную кислоту,
(R)-4-диметиламино-3-[9-(2,3,4-трифторфенокси)нонаноиламино]масляную кислоту,
(R)-3-[9-(бифенил-4-илокси)нонаноиламино]-4-диметиламиномасляную кислоту,
(R)-3-[9-(3,4-диметоксифенокси)нонаноиламино]-4-диметиламиномасляную кислоту,
(R)-4-диметиламино-3-[9-(4-трифторметилфенокси)нонаноиламино]масляную кислоту,
(R)-4-диметиламино-3-[9-(4-метоксифенокси)нонаноиламино]масляную кислоту,
(R)-4-диметиламино-3-[9-(нафталин-1-илокси)нонаноиламино]масляную кислоту,
(R)-4-диметиламино-3-(11-феноксиундеканоиламино)масляную кислоту,
(R)-4-диметиламино-3-(9-феноксинонаноиламино)масляную кислоту,
(R)-4-диметиламино-3-(10-фенилдеканоиламино)масляную кислоту,
(S)-4-диметиламино-3-(10-фенилдеканоиламино)масляную кислоту,
(R)-4-диметиламино-3-[10-(4-фторфенил)деканоиламино]масляную кислоту,
(R)-4-диметиламино-3-[10-(2-фторфенил)деканоиламино]масляную кислоту,
(R)-4-диметиламино-3-[10-(2,5-диметилфенил)деканоиламино]масляную кислоту,
(R)-4-диметиламино-3-[10-(2,6-диметилфенил)деканоиламино]масляную кислоту,
(R)-4-диметиламино-3-[10-(4-метоксифенил)деканоиламино]масляную кислоту,
(R)-4-диметиламино-3-(10-нафталин-1-илдеканоиламино)масляную кислоту,
(R)-4-диметиламино-3-[10-(4-трифторметилфенил)деканоиламино]масляную кислоту,
(R)-4-диметиламино-3-[10-(3-фторфенил)деканоиламино]масляную кислоту,
(R)-3-[10-(2,3-дифторфенил)деканоиламино]-4-диметиламиномасляную кислоту,
(R)-4-диметиламино-3-(10-тиофен-3-илдеканоиламино)масляную кислоту,
(R)-4-диметиламино-3-(10-тиазол-5-илдеканоиламино)масляную кислоту,
(R)-4-диметиламино-3-(6-фенилгексаноиламино)масляную кислоту,
(R)-4-диметиламино-3-(7-фенилгептаноиламино)масляную кислоту,
(R)-4-диметиламино-3-(8-фенилоктаноиламино)масляную кислоту,
(R)-4-диметиламино-3-(9-фенилнонаноиламино)масляную кислоту,
(R)-4-диметиламино-3-(9-пиридин-3-илнонаноиламино)масляную кислоту,
(R)-4-диметиламино-3-(11-фенилундеканоиламино)масляную кислоту,
(R)-4-диметиламино-3-(12-фенилдодеканоиламино)масляную кислоту,
(R)-4-диметиламино-3-[4-(5-фенилпентилокси)бутириламино]масляную кислоту,
(R)-4-диметиламино-3-[6-(3-фенилпропокси)гексаноиламино]масляную кислоту,
(R)-4-диметиламино-3-(9-фенетилоксинонаноиламино)масляную кислоту,
(R)-4-диметиламино-3-[8-(3-фенилпропокси)октаноиламино]масляную кислоту,
(R)-4-диметиламино-3-[8-(2-феноксиэтокси)октаноиламино]масляную кислоту,
(R)-3-(10-бензилоксидеканоиламино)-4-диметиламиномасляную кислоту,
(R)-4-диметиламино-3-[7-(2-фенилэтансульфонил)гептаноиламино]масляную кислоту,
(R)-4-диметиламино-3-(8-(фенилметансульфонил)октаноиламино)масляную кислоту,
(R)-3-(9-бензолсульфонилнонаноиламино)-4-диметиламиномасляную кислоту,
(R)-3-{7-[2-(2,3-дифторфенил)этокси]гептаноиламино}-4-диметиламиномасляную кислоту,
(R)-3-{3-[6-(2,3-дифторбензилокси)гексил]уреидо}-4-диметиламиномасляную кислоту,
(R)-4-диметиламино-3-[3-(9-фенилнонил)уреидо]масляную кислоту,
(R)-4-диметиламино-3-[9-(метилфенетиламино)нонаноиламино]масляную кислоту,
(R)-4-диметиламино-3-(9-фенетиламинононаноиламино)масляную кислоту,
(R)-4-диметиламино-3-[9-(метилфениламино)нонаноиламино]масляную кислоту и их фармацевтически приемлемые соли.
Особенно предпочтительными соединениями формулы I по настоящему изобретению являются соединения, выбранные из группы, включающей:
(R)-4-диметиламино-3-[8-(4-трифторметилбензилокси)октаноиламино]масляную кислоту,
(R)-3-[8-(бифенил-4-илметокси)октаноиламино]-4-диметиламиномасляную кислоту,
(R)-4-диметиламино-3-[9-(3-фторфенокси)нонаноиламино]масляную кислоту,
(R)-4-диметиламино-3-[9-(4-фторфенокси)нонаноиламино]масляную кислоту,
(R)-3-[9-(3,4-дифторфенокси)нонаноиламино]-4-диметиламиномасляную кислоту,
(R)-4-диметиламино-3-[9-(2,3,4-трифторфенокси)нонаноиламино]масляную кислоту,
(R)-4-диметиламино-3-[9-(нафталин-1-илокси)нонаноиламино]масляную кислоту,
(R)-4-диметиламино-3-(10-фенилдеканоиламино)масляную кислоту,
(R)-4-диметиламино-3-[10-(2-фторфенил)деканоиламино]масляную кислоту,
(R)-4-диметиламино-3-(10-нафталин-1-илдеканоиламино)масляную кислоту,
(R)-4-диметиламино-3-[10-(4-трифторметилфенил)деканоиламино]масляную кислоту,
(R)-3-[10-(2,3-дифторфенил)деканоиламино]-4-диметиламиномасляную кислоту,
(R)-4-диметиламино-3-(10-тиофен-3-илдеканоиламино)масляную кислоту,
(R)-4-диметиламино-3-(9-фенетилоксинонаноиламино)масляную кислоту,
(R)-4-диметиламино-3-[8-(2-феноксиэтокси)октаноиламино]масляную кислоту и их фармацевтически приемлемые соли.
Особенно предпочтительным является соединение формулы I, которое представляет собой (R)-4-диметиламино-3-(10-фенилдеканоиламино)масляную кислоту.
Специалисту в данной области техники представляется очевидным, что соединения общей формулы I по настоящему изобретению можно модифицировать по функциональным группам, получая при этом производные, которые, в свою очередь, могут превращаться в исходное соединение in vivo.
Настоящее изобретение также относится к способу получения соединений формулы I, определенных выше, включающему
а) конденсацию амина формулы
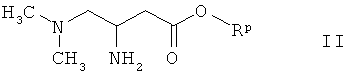
где Rp обозначает метил, этил или бензил, с карбоновой кислотой формулы
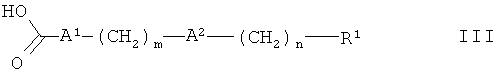
где А1 обозначает связь, а А2, m, n и R1 определены в данном контексте выше,
в присутствии основания и конденсирующего агента, с получением соединения формулы
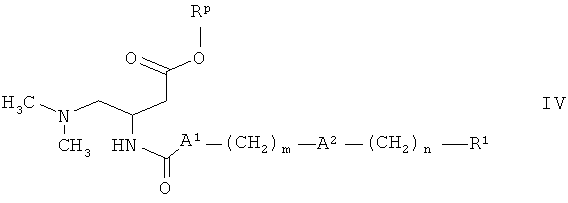
и превращение соединения формулы IV в соединение формулы I, где А1 обозначает связь, при гидролизе сложного эфира или гидрировании, или
б) конденсацию амина формулы
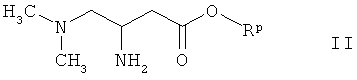
где Rp означает метил, этил или бензил, с изоцианатом формулы
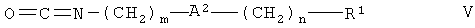
где А2, m, n и R1 определены в данном контексте выше,
в присутствии основания, с получением соединения формулы
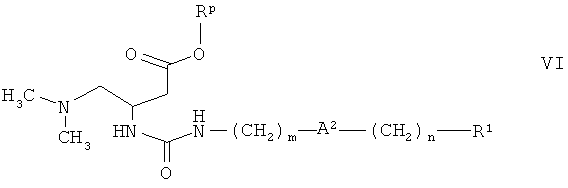
и превращение соединения формулы VI в соединение формулы I, где А1 обозначает NH, при гидролизе сложного эфира или гидрировании или
в) конденсацию амина формулы
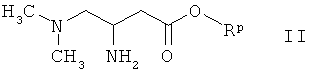
где Rp означает бензил, с карбоновой кислотой формулы
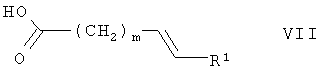
где m и R1 определены выше в данном контексте,
в присутствии основания и конденсирующего агента, с получением соединения формулы
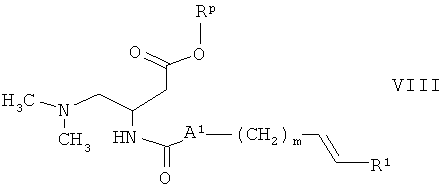
и превращение соединения формулы VIII в соединение формулы I, где А2 обозначает связь, а n равен 2, при гидрировании.
Гидролиз сложного эфира обозначает катализируемый основанием гидролиз с использованием реагентов, таких как гидроксид лития, натрия, калия, в растворителях, таких как вода, метанол, этанол, тетрагидрофуран или в их смеси, при температуре от 0°С до 100°С. Гидрирование обычно проводят при давлении водорода от 1 до 10 бар в присутствии пригодного катализатора, такого как палладий на активированном угле, в растворителе, таком как метанол или этанол, при температуре от 0°С до 50°С, но гидрирование также обозначает восстановление двойной связи в присутствии триэтилсилана и трифторуксусной кислоты в инертном растворителе, таком как толуол или дихлорметан, с последующим гидролизом сложного эфира, как описано в данном контексте выше.
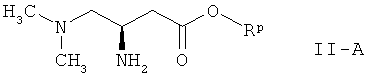
Поскольку соединения формулы I с (R)-конфигурацией являются предпочтительными, в способе по настоящему изобретению предпочтительно используют 3-амино-4-диметиламинобутират формулы
Настоящее изобретение также относится к соединениям формулы I, как описано выше, полученным способом, как описано выше.
Более подробно соединения формулы I получают из соответствующих сложных эфиров 1 (Rp обозначает метил, этил, бензил) по известным методикам. Прежде всего, предпочтительными являются соединения формулы 1, где Rp обозначает бензил, которые можно превратить в соединение формулы I при гидрировании при давлении 1-10 бар в присутствии пригодного катализатора, например палладия на активированном угле, в таком растворителе, как метанол или этанол, при температуре от 0 до 50°С. В другом варианте сложный эфир 1 можно превратить в соединение формулы I при гидролизе, катализируемом основанием, в присутствии таких реагентов, как гидроксид лития, натрия, калия, в таких растворителях, как вода, метанол, этанол, тетрагидрофуран или их смеси, при температуре от 0°С до 100°С.
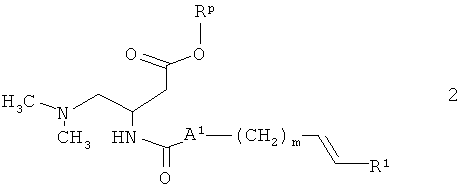
В другом варианте соединения формулы I, где А обозначает связь, а n равен 2, можно получать из сложного эфира 2 (в случае, если Rp обозначает бензил) при гидрировании, как описано выше, при этом двойная связь, которая в соответствии с используемой методикой является соседней с группой R1 (см. ниже), также восстанавливается. В случае, если Rp обозначает метил, этил или бензил, превращение соединения 2 в соединение формулы I можно также проводить в две стадии, как описано ниже. На первой стадии упомянутая выше двойная связь восстанавливается в присутствии триэтилсилана и трифторуксусной кислоты в инертном растворителе, таком как толуол или дихлорметан. На второй стадии сложноэфирную группу гидролизуют в присутствии таких реагентов, как гидроксид лития, натрия или калия, в таких растворителя, как вода, метанол, этанол, тетрагидрофуран или их смеси, при температуре от 0°С до 100°С.
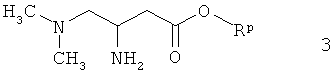
Соединения формулы I, где А1 обозначает NH, можно получать из 3-амин-4-диметиламинобутирата 3
и изоцианата 4
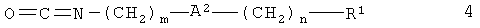
Реакцию предпочтительно проводят в апротонном растворителе, таком как дихлорметан или тетрагидрофуран, необязательно в присутствии основания, например, триэтиламина или 4-метилморфолина.
Соединения формулы 1, где А1 обозначает связь, получают из 3-амино-4-диметиламинобутирата 3 и карбоновой кислоты 5.
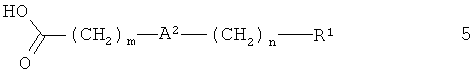
Реакцию проводят в условиях, известных специалистам в данной области. Указанные реакции можно проводить, например, при смешивании карбоновой кислоты 5 с амином 3 в апротонных растворителях, таких как дихлорметан, тетрагидрофуран, N,N-диметилформамид, N-метилпирролидинон и их смеси при температуре от 0°С до 60°С в присутствии или отсутствии основания, такого как триэтиламин или N,N-диизопропилэтиламин, и конденсирующего агента. Пригодные конденсирующие агенты включают, например, O-(7-бензотриазол-1-ил)-N,N,N',N'-тетраметилуронийтетрафторборат (TBTU), O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилуронийгексафторфосфат (HATU), N,N'-дициклогексилкарбодиимид, гидрохлорид 1-(3-диметиламинопропил)-3-этилкарбодиимида, O-(бензотриазол-1-ил)-N,N,N',N'-тетраметилуронийгексафторфосфат, бром-трис-пирролидинофосфонийгексафторфосфат или другие известные специалистам в данной области соединения.
В другом варианте указанные реакции можно проводить в две стадии, включающие сначала образование ацилгалогенида 5, а затем конденсацию с амином 3 в присутствии основания. Обычно используемые для получения ацилхлорида реагенты включают тионилхлорид, пентахлорид фосфора, оксалилхлорид или цианурхлорид, а реакцию обычно проводят в отсутствие растворителя или в присутствии апротонного растворителя, такого как дихлорметан, толуол или ацетон. Необязательно добавляют основание, например, пиридин, триэтиламин, N,N-диизопропилэтиламин или 4-метилморфолин. Полученный ацилхлорид выделяют или непосредственно вводят в реакцию с амином 3 в апротонном растворителе, таком как дихлорметан, тетрагидрофуран или ацетон в присутствии основания. Обычно в качестве основания используют триэтиламин, 4-метилморфолин, пиридин, N,N-диизопропилэтиламин или диметиламинопиридин или их смеси.
В другом варианте указанные реакции проводят в две стадии, включающие сначала образование смешанного ангидрида 5, полученного по реакции с реагентом, таким как этилхлорформиат, изобутилхлорформиат или уксусный ангидрид, а затем реакцию с амином 3, как описано выше.
Соединения формулы 2 получают из 3-амино-4-диметиламинобутирата 3 и карбоновой кислоты 6, аналогично тому, как описано для соединения 1.
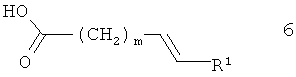
Синтез 3-амино-4-диметиламинобутирата 3 показан на схеме 1, исходным соединением является коммерческий N-защищенный моноэфир аспарагиновой кислоты 7. Rp обозначает метил, этил или бензил, предпочтительно бензил.
Схема 1
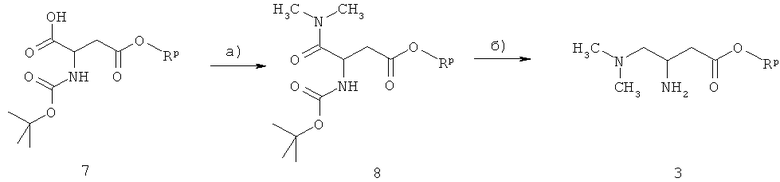
На стадии а) на схеме 1 карбоновая кислоту 7 взаимодействует с диметиламином, при этом получают N,N-диметиламид 8, при этом используют реагенты и способы, описанные для реакции карбоновой кислоты 5 с амином 3. На стадии б) на схеме 1 N,N-диметиламин 8 превращают в диметиламин 3 при восстановлении и последующем удалении трет-бутоксикарбонильной защитной группы. Предпочтительные реагенты для восстановления включают комплекс боран-тетрагидрофуран или комплекс боран-диметилсульфид в апротонном растворителе, таком как тетрагидрофуран при температуре от -20°С до 80°С. Удаление трет-бутоксикарбонильной группы проводят в кислотной среде в присутствии соляной кислоты или серной кислоты, в таких растворителях, как этанол, метанол, вода или их смеси, при температуре от 0°С до 20°С.
Изоцианат 4 получают из карбоновой кислоты 5, как показано на схеме 2. Реакцию проводят, используя известные в данной области техники способы, например, перегруппировку Курциуса. Обычно реакцию начинают с превращения соединения 5 в его ацилгалогенид. Обычно для получения ацилхлорида используют тионилхлорид, пентахлорид фосфора, оксалилхлорид, этилхлорформиат, изобутилхлорформиат или цианурхлорид, реакцию обычно проводят в отсутствие растворителя или в апротонном растворителе, таком как дихлорметан или толуол. Необязательно добавляют основание, например, пиридин, триэтиламин, диизопропилэтиламин или 4-метилморфолин. Полученный ацилхлорид можно выделить или его непосредственно вводят в реакцию с азидом натрия, при этом получают ацилазид соединения 5, которое не выделяют, а нагревают при >60°С, при этом происходит его перегруппировка с образованием изоцианата 4 и с выделением газообразного азота.
Схема 2
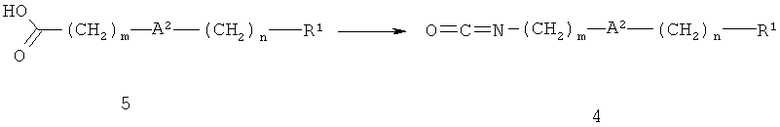
В другом варианте превращение соединения 5 в соединение 4 можно проводить в одну стадию с использованием дифенилфосфорилазида в качестве источника азида, необязательно в присутствии основания, например триэтиламина, при температуре от 0°С до 110°С, предпочтительно в толуоле.
Карбоновая кислота 5 является коммерческим продуктом или ее получают, как показано на схемах 3-10.
Если R1 обозначает описанную выше группу, А2 обозначает О, O(СН2)2O, S или SO2, то карбоновую кислоту 5 получают, как показано на схеме 3, где Х обозначает уходящую группу, такую как бром, йод или метансульфонилокси, а PG обозначает необязательную защитную группу, например, тетрагидрофуран-2-ил.
Схема 3
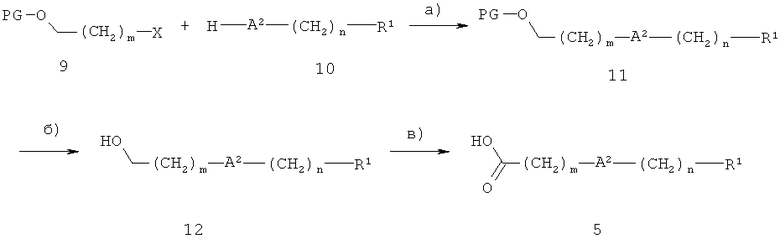
На стадии а) на схеме 3 соединение 10 алкилируют с использованием необязательно защищенных ω-галоген- или ω-сульфонилоксиспиртов 9, при этом получают соединение 11. Реакцию проводят в таком растворителе, как этанол, ацетонитрил или N,N-диметилформамид, в присутствии основания, например, карбоната калия, гидроксида натрия, трет-бутилата калия или гидрида натрия, при температуре от 0°С до 100°С.
На необязательной стадии б) (в случае, когда PG≠H), защитную группу в соединении 11 удаляют, при этом получают спирт 12. В случае, если PG обозначает тетрагидрофуран-2-ил, указанную реакцию проводят с использованием кислотного катализатора, такого как соляная кислоту, толуол-4-сульфокислоту или толуол-4-сульфонат пиридиния, в таком растворителе, как вода, метанол или этанол, при температуре от 0°С до 100°С.
На стадии в) на схеме 3 спирт 12 окисляют до карбоновой кислоты 5. Обычно используемые реагенты и условия окисления спирта 12 включают дихромат пиридиния, оксид хрома (VI) или перманганат калия. В качестве соединения 12 для окисления до соединения 5 можно также использовать спирт 12, где А обозначает связь.
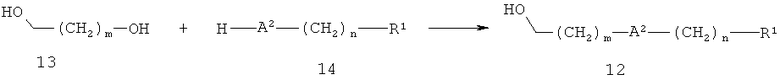
В другом варианте спирт 12 можно получать, как показано на схеме 4. А2 обозначает кислород, серу или SO2, a R1, m и n определены выше. В указанном способе диол 13 и соединение 14 взаимодействуют в условиях реакции Мицунобу с использованием фосфина, например, трифенилфосфина, и диэфира азодикарбоновой кислоты, например, диэтилазодикарбоксилата или диизопропилазодикарбоксилата, в таких растворителях, как тетрагидрофуран, дихлорметан или толуол, при температуре от 0°С до 50°С, при этом получают соединение 12.
Схема 4
В другом варианте спирт 12 можно получить, как показано на схеме 5. В данном случае А2 обозначает О, S или SO2, R1, m и n определены выше, а Х обозначает уходящую группу, такую как бром, иод или метансульфонилокси. Таким образом, соединение 15 алкилируют с использованием галогенида или сульфоната 16. Реакцию проводят в таком растворителе, как этанол, ацетонитрил или N,N-диметилформамид, в присутствии основания, например, карбоната калия, гидроксида натрия трет-бутилата калия или гидрида натрия, при тмпературе от 0°С до 100°С.
Схема 5
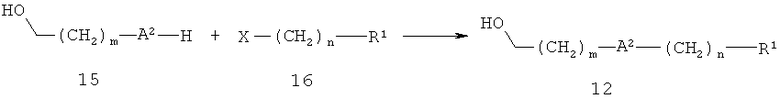
Кислоту 5 также можно получить, как показано на схеме 6. В этом случае А2 обозначает О, S или SO2, R1, m и n определены выше, Х обозначает уходящую группу, такую как бром, иод или метансульфонилоксигруппа. Алкилирование карбоновой кислоты 17 с использованием галогенида или сульфоната 16 проводят аналогично тому, как описано выше, с использованием производных 16 и 17 (схема 5).
Схема 6
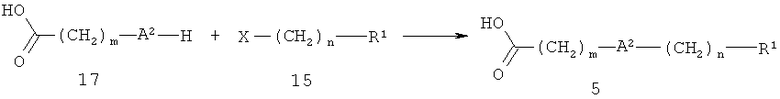
Кислота 5, в которой А2 обозначает N(R2), представляет собой соединение формулы 18. Соединение формулы 18 можно получать, как показано на схеме 7. R1, R2, m и n определены выше.
Схема 7
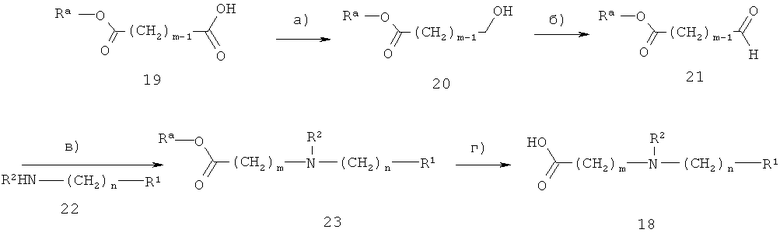
На стадии а) на схеме 7 моноэфир дикарбоновой кислоты 19 восстанавливают с образованием ω-гидроксиэфира 20 с использованием известных реагентов, например, комплекса боран-тетрагидрофуран, в таком растворителе, как тетрагидрофуран, при температуре от 0°С до 50°С.
На стадии б) на схеме 7 гидроксигруппу в соединении 20 окисляют до формильной группы, при этом получают соединение 21. Пригодными реагентами являются, например, гипохлорит натрия, в присутствии бромида калия, 2,2,6,6-тетраметилпиридин-1-оксила и гидрокарбоната натрия, в двухфазной смеси воды и дихлорметана при приблизительно 0°С. В другом варианте применяют реагенты на основе диметилсульфоксида, например, диметилсульфоксид-оксалилхлорид или диметилсульфоксид-трифторуксусный ангидрид в таком растворителе, как дихлорметан при температуре ниже 0°С, обычно при -78°С.
На стадии в) на схеме 7 альдегид 21 взаимодействует с амином 22 в присутствии восстанавливающего агента, при этом получают аминоэфир 23. Обычно используют такие реагенты, как боргидрид натрия (необязательно в присутствии изопропоксида титана (IV)), цианоборгидрид натрия или триацетоксиборгидрид натрия, в таких растворителях, как метанол, уксусная кислоту, тетрагидрофуран, 1,2-дихлорэтан или их смеси, при температуре от 0°С до 100°С.
На стадии г) на схеме 7 аминоэфир 23 превращают в кислоту 18 в условиях щелочного гидролиза с использованием таких реагентов, как гидроксид лития, гидроксид натрия, гидроксид калия в таких растворителях, как вода, метанол, этанол, тетрагидрофуран или их смеси, при температуре от 0°С до 100°С.
В другом варианте аминоэфир 23 получают, как показано на схеме 8. R1, R2 и m определены выше, Ra обозначает (низш.)алкил, например, метил или этил.
Схема 8
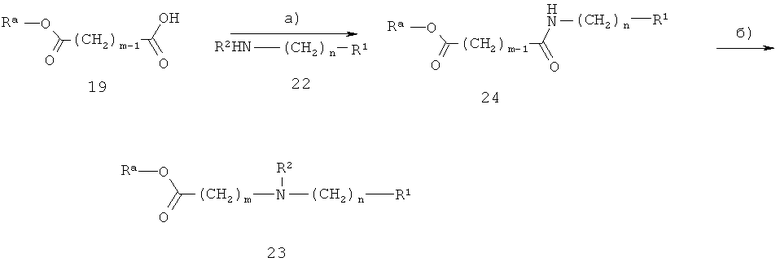
На стадии а) на схеме 8 амид 24 получают из кислоты 19 при обработке амином 22 с использованием реагентов и способов, описанных для реакции карбоновой кислоты 5 с амином 3.
На стадии б) на схеме 8 аминоэфир 23 получают при восстановлении амида 24 с использованием таких реагентов, как диборан, комплекс боран-диметилсульфид или комплекс боран-тетрагидрофуран в таких растворителях, как тетрагидрофуран, при температуре от 0°С до 100°С.
Ненасыщенные кислоты общей формулы 6 получают, как показано на схеме 9. R1 и m определены выше, Ra обозначает (низш.)алкил, например, метил или этил.
Схема 9
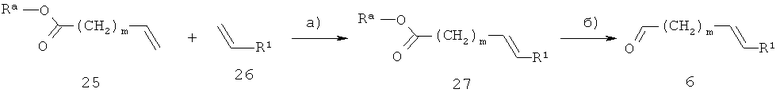
На стадии а) на схеме 9 ненасыщенный эфир 25 взаимодействует с производным стирола 26 по реакции перекрестного обмена алкенов, при этом получают соединение 27. Указанную реакцию проводят в инертном растворителе, таком как дихлорметан или толуол, обязательно в присутствии пригодного катализатора, например, дихлор(1,3-димезитил-4,5-дигидроимидазол-2-илиден)(фенилметилен)(трициклогексилфосфин)рутения, при температуре от 20°С до 100°С.
На стадии б) на схеме 9 сложный эфир 27 превращают в кислоту 6 в условиях катализируемого основанием гидролиза, аналогично тому, как показано на схеме 7, стадия г).
В другом варианте ненасыщенные кислоты формулы 6 можно получать, как показано на схеме 10. R1 и m определены выше.
Схема 10
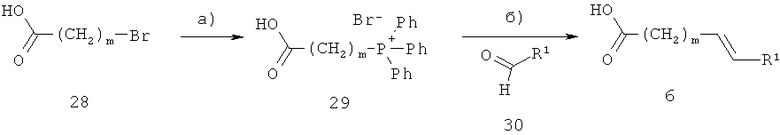
На стадии а) на схеме 10, ω-бромкислота 28 взаимодействует с трифенилфосфином, при этом получают соль фосфония 29. Указанную реакцию проводят в инертном растворителе, таком как толуол, при температуре от 20°С до 110°С.
На стадии б) на схеме 10 соль фосфония 29 взаимодействует с альдегидом 30, при этом получают соединение 6. Указанную реакцию проводят в присутствии основания, такого как гидрид натрия, н-бутиллитий или трет-бутилат калия, в таком растворителе, как диэтиловый эфир или тетрагидрофуран, при температуре от -20°С до 50°С.
Как описано выше, было установлено, что новые соединения формулы I по настоящему изобретению ингибируют активность карнитинпальмитолил трансферазы 2 (СРТ2). Таким образом, соединения по настоящему изобретению можно использовать для лечения и/или профилактики заболеваний, модулируемых ингибиторами СРТ2, особенно заболеваний, связанных с гипергликемией и/или нарушенной толерантностью к глюкозе. Указанные заболевания включают, например диабет и связанные с ним заболевания, инсулиннезависимый сахарный диабет, ожирение, гипертензия, синдром резистентности к инсулину, метаболический синдром, гиперлипидемию, гиперхолестеринемию, жировой гепатоз, атеросклероз, застойную сердечную недостаточность и почечную недостаточность.
Настоящее изобретение также относится к фармацевтическим композициям, включающим соединение формулы I, как описано выше, и фармацевтически приемлемый носитель и/или адъюавант.
Настоящее изобретение также включает соединения формулы I, как описано выше, для применения в качестве терапевтически активных веществ, предназначенных, прежде всего, в качестве терапевтически активных соединений для лечения и/или профилактики заболеваний, модулируемых ингибиторами СРТ2, особенно для применения в качестве терапевтически активных веществ, предназначенных для лечения и/или профилактики гипергликемии, нарушенной толерантности к глюкозе, диабета и связанных с ним заболеваний, инсулиннезависимого сахарного диабета, ожирения, гипертензии, синдрома резистентости к инсулину, метаболического синдрома, гиперлипидемии, гиперхолестеринемии, жирового гепатоза, атеросклероза, застойной сердечной недостаточности и почечной недостаточности.
В другом предпочтительном варианте настоящего изобретения предлагается способ терапевтического и/или профилактического лечения заболеваний, модулируемых ингибиторами СРТ2, особенно для терапевтического и/или профилактического лечения гипергликемии, нарушенной толерантности к глюкозе, диабета и связанных с ним заболеваний, инсулиннезависимого сахарного диабета, ожирения, гипертензии, синдрома резистентности к инсулину, метаболического синдрома, гиперлипидемии, гиперхолестеринемии, жирового гепатоза, атеросклероза, застойной сердечной недостаточности и почечной недостаточности, который включает введение соединения формулы I, как описано выше, человеку или животному.
Настоящее изобретение также относится к применению соединений формулы I, как описано выше, для получения лекарственных средств, предназначенных для терапевтического и/или профилактического лечения заболеваний, которые модулируются ингибиторами СРТ2, особенно для терапевтического и/или профилактического лечения гиперлипидемии, нарушенной толерантности к глюкозе, диабета и связанных с ним заболеваний, инсулиннезависимого сахарного диабета, ожирения, гипертензии, синдрома резистентности к инсулину, метаболического синдрома, гиперлипидемии, гиперхолестеринемии, жирового гепатоза, атеросклероза, застойной сердечной недостаточности и почечной недостаточности. Указанные лекарственные средства содержат соединения формулы I, как описано выше.
Наиболее предпочтительной является профилактика и/или лечение гиперлипидемии и инсулиннезависимого сахарного диабета.
Активность соединений по настоящему изобретению оценивали следующими методами анализа. Информацию о проведенных анализах можно найти в следующих статьях: Jackson и др., Biochem. J., 341, сс.483-489 (1999) и Jackson и др., J. Biol Chem., 275, сс.19560-19566 (2000).
кДНК СРТ2 - человека и крысы и СРТ1 из печени, а также мышечную кДНК СРТ1 субклонировали в векторах pGAPZB или pGAPZA, соответственно. Указанные плазмиды использовали для трансформации Р. pastoris, штамм Х-33, методом электропорации после получения электрокомпетентных клеток. Выбирали клоны с высокой копийностью при необходимости с использованием реагента Zeocin (0,5 или 1 мг/мл). Культуры для измерения активности инкубировали в течение 16 ч в среде YPD (1% экстракт дрожжей, 2% пептон, 2% глюкоза). Неочищенные экстракты клеток получали при разрушении клеток стеклянными шариками или в гомогенизаторе френч-пресс, в зависимости от размеров ферментера. После центрифугирования не содержащие клеток экстракты ресуспендировали в буферном растворе для разрушения клеток (50 мМ Трис, pH 7,4, 100 мМ KCl, 1 мМ ЭДТУ) в присутствии смеси ингибиторов протеаз, а затем разделяли на аликвотные части и замораживали при -20°С.
Активность СРТ измеряли спектрофотометрически с использованием 5,5'-дитио-бис-(2-нитробензойной кислоты) (ДТНБ), так называемого реагента Эллмана. HS-KoA высвобождается при образовании ацилкарнитина из карнитина (500 мкМ) и пальмитоил-КоА (80 мкМ) и восстанавливает ДТНБ (300 мкМ) с образованием 5-меркапто-2-нитробензойной кислоты, которая поглощает при 410 нм, молярный коэффициент экстинции составляет 13600 М-1 см-1. Буферный раствор для анализа содержит 120 мМ KCl, 25 мМ трис, pH 7,4, 1 мМ ЭДТУ. Указанный анализ использовали для оценки активности ингибиторов СРТ, особенно/предпочтительно СРТ2-селективных ингибиторов по сравнению с изоформами СРТ1 печени и мышц.
Соединения формулы I предпочтительно характеризуются значением IC50 (СРТ2) менее 10 мкМ, предпочтительно от 1 нМ до 10 мкМ, более предпочтительно от 1 нМ до 1 мкМ. В приведенной таблице показаны данные для некоторых соединений, полученные в примерах.
Соединения формулы I и/или их фармацевтически приемлемые соли можно использовать в качестве лекарственных средств, например в форме фармацевтических композиций для энтерального, парентального или местного введения. Указанные композиции можно вводить, например перорально, например в форме таблеток, таблеток с покрытием, драже, твердых или мягких желатиновых капсул, растворов, эмульсий или суспензий, например в форме суппозиториев, парентерально, например в форме растворов для инъекций, суспензий для инъекций или вливаний, или местно, например в форме мазей, кремов или масел. Предпочтительным является пероральное введение.
Получение фармацевтических композиций можно осуществлять способом, известным специалисту в данной области, при переработке описанных соединений формулы I и/или их фармацевтически приемлемых солей, необязательно в комбинации с другими терапевтически ценными соединениями, в галеновые препараты в смеси с приемлемыми нетоксичными, инертными, терапевтически совместимыми твердыми или жидкими носителями и при необходимости стандартными фармацевтическими адъювантами.
Пригодными носителями являются как неорганические, так и органические материалы. Так, например, лактозу, кукурузный крахмал или их производные, тальк, стеариновую кислоту или ее соли можно использовать в качестве носителей для таблеток, таблеток с покрытием, драже и твердых желатиновых капсул. Пригодными носителями для мягких желатиновых капсул являются, например, растительные масла, воски, жиры и полутвердые и жидкие полиолы (в зависимости от природы активного ингредиента носитель не требуется в случае мягких желатиновых капсул). Пригодные носители для получения растворов и сиропов включают, например, воду, полиолы, сахарозу, инвертный сахар и т.п. Пригодные носители для растворов для инъекций включают, например, воду, спирты, полиолы, глицерин и растительные масла. Пригодные носители для суппозиториев включают, например, природные или отвержденные масла, воски, жиры и полужидкие или жидкие полиолы. Пригодные носители для местных композиций включают глицериды, полусинтетические или синтетические глицериды, гидрированные масла, жидкие воски, вазелиновое масло, жидкие жирные спирты, стерины, полиэтиленгликоли и производные целлюлозы.
В качестве фармацевтических адъювантов можно использовать стандартные стабилизаторы, консерванты, смачивающие и эмульгирующие агенты, улучшающие консистенцию агенты, улучшающие вкус агенты, соли для регулировки осмотического давления, буферные вещества, солюбилизирующие агенты, красители, маскирующие вкус агенты и антиоксиданты.
Дозировки соединений формулы I могут изменяться в зависимости от заболевания, подлежащего лечению, возраста и индивидуального состояния пациента, а также способа введения, и их подбирают согласно индивидуальным требованиям в каждом конкретном случае. Для взрослых пациентов суточная доза составляет от 1 до 2000 мг, прежде всего, приблизительно от 1 до 500 мг. В зависимости от тяжести заболевания и точного фармакокинетического профиля, соединение можно вводить в виде одной или нескольких суточных доз, например, от 1 до 3 суточных доз.
Фармацевтические композиции содержат от приблизительно 1 до 500 мг, предпочтительно от 1 до 200 мг соединения формулы I.
Приведенные ниже примеры представлены для иллюстрации настоящего изобретения и никоим образом не ограничивают объем настоящего изобретения.
Примеры
Сокращения
ЖХВР - жидкостная хроматография высокого давления, m/e - отношение массы к заряду на масс-спектре (МС).
Пример 1
(R)-3-[8-(3,4-Дифторбензилокси)октаноиламино]-4-диметиламиномасляная кислота
Стадия 1
Раствор 1,8-октандиола (300 мг, 2,05 ммоля) в тетрагидрофуране/N,N-диметилформамиде 2:1 (3 мл) добавляли по каплям при 0°С в суспензию гидрида натрия (60% дисперсия в минеральном масле, 90 мг, 2,3 ммоля) в N,N-диметилформамиде (1,5 мл), затем через 2 ч добавляли 3,4-дифторбензилбромид (445 мг, 2,15 ммоля). Через 4 ч реакционную смесь распределяли между водой и этилацетатом. Органический слой промывали солевым раствором, сушили над сульфатом натрия, фильтровали и упаривали. После проведения хроматографии (SiO2, элюент: градиент гептан/этилацетат) получали 8-(3,4-дифторбензилокси)октан-1-ол (258 мг, 46%) в виде бесцветного масла, m/e 273,3 ([М+Н]+).
Стадия 2
Дихромат пиридиния (1,23 г, 3,27 ммоля) добавляли при 0°С в раствор 8-(3,4-дифторбензилокси)октан-1-ола (254 мг, 0,93 ммоля) в N,N-диметилформамиде (2 мл). Реакционную смесь выдерживали при КТ в течение 16 ч, затем смесь распределяли между водой и этилацетатом. Органический слой промывали солевым раствором, сушили над сульфатом натрия, фильтровали и упаривали. После проведения хроматографии (SiO2, элюент: градиент гептан-этилацетат/муравьиная кислота, 100:1) получали 8-(3,4-дифторбензилокси)октановую кислоту (выход 162 мг, 61%), в виде бесцветного масла, m/e 285,1 ([М-Н]-).
Стадия 3
Раствор 8-(3,4-дифторбензилокси)октановой кислоты (153 мг, 0,53 ммоля), N,N-диизопропилэтиламина (414 мг, 3,21 ммоля) и O-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилуронийгексафторфосфата (244 мг, 0,64 ммоля) в N,N-диметилформамиде перемешивали в течение 1 ч при КТ, затем добавляли раствор дигидрохлорида бензилового эфира (R)-3-амино-4-диметиламиномасляной кислоты (198 мг, 0,64 ммоля) в N,N-диметилформамиде (1 мл). Реакционную смесь перемешивали в течение 16 ч при КТ, затем упаривали. После проведения хроматографии (SiO2, элюент: градиент дихлорметан-дихлорметан/метанол/25% води. раствор аммиака, 110:10:1) получали бензиловый эфир (R)-3-[8-(3,4-дифторбензилокси)октаноиламино]-4-диметиламиномасляной кислоты (136 мг, 50%) в виде светло-желтого масла, m/e 505,4 ([M+H]+).
Стадия 4
Раствор бензилового эфира (R)-3-[8-(3,4-дифторбензилокси)октаноиламино]-4-диметиламиномасляной кислоты (125 мг, 0,25 ммоля) гидрировали при атмосферном давлении в присутствии палладия (10% на активированном угле, 30 мг). Через 30 мин катализатор отделяли фильтрованием и фильтрат концентрировали и сушили, при этом получали (R)-3-[8-(3,4-дифторбензилокси)октаноиламино]-4-диметиламино масляную кислоту (96 мг, 89%) в виде светло-желтого масла, m/e 413,2 ([М-Н]-.
Получение дигидрохлорида бензилового эфира (R)-3-амино-4-диметиламиномасляной кислоты
а) Триэтиламин (2,8 мл, 20,0 ммоля) добавляли при 0°С в раствор 4-бензилового эфира Boc-D-аспарагиновой кислоты (5,00 г, 15,0 ммоля) в дихлорметане, а затем по каплям добавляли этилхлорформиат (1,91 мл, 20,0 ммоля). Реакционную смесь перемешивали в течение 1 ч при 0°С, затем по каплям добавляли раствор гидрохлорида диметиламина (2,65 г, 32,0 ммоля) и триэтиламина (4,53 мл, 32,0 ммоля) в дихлорметане (100 мл). Реакционую смесь инкубировали при КТ в течение 16 ч, затем промывали солевым раствором и концентрировали. После проведения хроматографии (SiO2, элюент: градиент гептан/этилацетат) получали бензиловый эфир (R)-3-трет-бутоксикарбониламино-N,N-диметилсукцинамовой кислоты (3,77 г, 70%) в виде бесцветного масла, m/e 351,4 ([М+Н]+).
б) Комплекс боран-диметилсульфид (1,57 мл, 3,14 ммоля) добавляли по каплям при 0°С в раствор бензилового эфира (R)-3-трет-бутоксикарбониламино-N,N-диметилсукцинамовой кислоты (500 мг, 1,43 ммоля). Реакционную смесь нагревали до КТ, а затем кипятили с обратным холодильником в течение 3 ч, охлаждали до 0°С и по каплям добавляли 6 М водный раствор соляной кислоты (0,68 мл, 4,1 ммоля). Реакционную смесь нагревали до КТ и концентрировали в вакууме. Остаточную воду упаривали в виде азеотропной смеси с толуолом и смесь концентрировали в высоком вакууме, при этом получали дигидрохлорид бензилового эфира (R)-3-амино-4-диметиламиномасляной кислоты (384 мг, 87%) в виде твердого вещества белого цвета, m/e 237,4 ([М+Н]+).
Пример 2
(R)-3-[8-(2,5-Дифторбензилокси)октаноиламино]-4-диметиламиномасляная кислота
Указанное в заголовке соединение, m/e 413,3 ([М-Н]-), получали аналогично тому, как описано в примере 1, стадии 1-4. 1,8-Октандиол алкилировали на стадии 1 в присутствии 2,5-дифторбензилбромида, при этом получали 8-(2,5-дифторбензилокси)октан-1-ол, который окисляли на стадии 2, при этом получали 8-(2,5-дифторбензилокси)октановую кислоту. Указанное соединение конденсировали на стадии 3 с дигидрохлоридом бензилового эфира (R)-3-амино-4-диметиламиномасляной кислоты, при этом получали бензиловый эфир (R)-3-[8-(2,5-дифторбензилокси)октаноиламино]-4-диметиламиномасляной кислоты, который гидрировали на стадии 4.
Пример 3
(R)-3-[8-(2,4-Дифторбензилокси)октаноиламино]-4-диметиламиномасляная кислота
Указанное в заголовке соединение, m/e 413,1 ([М-Н]-), получали аналогично тому, как описано в примере 1, стадии 1-4. 1,8-Октандиол алкилировали на стадии 1 в присутствии 2,4-дифторбензилбромида, при этом получали 8-(2,4-дифторбензилокси)октан-1-ол, который окисляли на стадии 2, при этом получали 8-(2,4-дифторбензилокси)октановую кислоту. Указанное соединение конденсировали на стадии 3 с дигидрохлоридом бензилового эфира (R)-3-амино-4-диметиламиномасляной кислоты, при этом получали бензиловый эфир (R)-3-[8-(2,4-дифторбензилокси)октаноиламино]-4-диметиламиномасляной кислоты, который гидрировали на стадии 4.
Пример 4
(R)-4-Диметиламино-3-[8-(2,3,4-трифторбензилокси)октаноиламино]масляная кислота
Указанное в заголовке соединение, m/e 432,5 ([М+Н]+), получали аналогично тому, как описано в примере 1, стадии 1-4. 1,8-Октандиол алкилировали на стадии 1 в присутствии 2,3,4-трифторбензилбромида, при этом получали 8-(2,3,4-трифторбензилокси)октан-1-ол, который окисляли на стадии 2, при этом получали 8-(2,3,4-трифторбензилокси)октановую кислоту. Полученное соединение на стадии 3 конденсировали с дигидрохлоридом бензилового эфира (R)-3-амино-4-диметиламиномасляной кислоты, при этом получали бензиловый эфир (R)-3-[8-(2,3,4-трифторбензилокси)октаноиламино]-4-диметиламиномасляной кислоты, который гидрировали на стадии 4.
Пример 5
(R)-4-Диметиламино-3-(8-пентафторфенилметоксиоктаноиламино)масляная кислота
Указанное в заголовке соединение, m/e 467,5 ([М-Н]-), получали аналогично тому, как описано в примере 1, стадии 1-4. 1,8-Октандиол алкилировали на стадии 1 в присутствии пентафторбензил бромида, при этом получали 8-(пентафторбензилокси)октан-1-ол, который окисляли на стадии 2, при этом получали 8-(пентафторбензилокси)октановую кислоту. Указанное соединение конденсировали на стадии 3 с дигидрохлоридом бензилового эфира (R)-3-амино-4-диметиламиномасляной кислоты, при этом получали бензиловый эфир (R)-3-[8-(пентафторбензилокси)октаноиламино]-4-диметиламиномасляной кислоты, который гидрировали на стадии 4.
Пример 6
(R)-4-Диметиламино-3-[8-(4-трифторметилбензилокси)октаноиламино]масляная кислота
Указанное в заголовке соединение, m/e 445,6 ([М-Н]-), получали аналогично тому, как описано в примере 1, стадии 1-4. 1,8-Октандиол алкилировали на стадии 1 в присутствии 4-трифторметилбензилбромида, при этом получали 8-(4-трифторметилбензилокси)октан-1-ол, который окисляли на стадии 2, при этом получали 8-(4-трифторметилбензилокси)октановую кислоту. Указанное соединение конденсировали на стадии 3 с дигидрохлоридом бензилового эфира (R)-3-амино-4-диметиламиномасляной кислоты, при этом получали бензиловый эфир (R)-3-[8-(4-трифторметилбензилокси)октаноиламино]-4-диметиламиномасляной кислоты, который гидрировали на стадии 4.
Пример 7
(R)-4-Диметиламино-3-[8-(3-фтор-4-трифторметилбензилокси)октаноиламино]масляная кислота
Указанное в заголовке соединение, m/e 463,5 ([М-Н]-), получали аналогично тому, как описано в примере 1, стадии 1-4. 1,8-Октандиол алкилировали на стадии 1 в присутствии 3-фтор-4-трифторметилбензилбромида, при этом получали 8-(3-фтор-4-трифторметилбензилокси)октан-1-ол, который окисляли на стадии 2, при этом получали 8-(3-фтор-4-трифторметилбензилокси)октановую кислоту. Указанное соединение конденсировали на стадии 3 с дигидрохлоридом бензилового эфира (R)-3-амино-4-диметиламиномасляной кислоты, при этом получали бензиловый эфир (R)-3-[8-(3-фтор-4-трифторметилбензилокси)октаноиламино]-4-диметиламиномасляной кислоты, который гидрировали на стадии 4.
Пример 8
(R)-4-Диметиламино-3-[8-(4-метоксибензилокси)октаноиламино]масляная кислота
Указанное в заголовке соединение, m/e 407,6 ([М-Н]-), получали аналогично тому, как описано в примере 1, стадии 1-4. 1,8-Октандиол алкилировали на стадии 1 в присутствии 4-метоксибензилбромида, при этом получали 8-(4-метоксибензилокси)октан-1-ол, который окисляли на стадии 2, при этом получали 8-(4-метоксибензилокси)октановую кислоту. Указанное соединение конденсировали на стадии 3 с дигидрохлоридом бензилового эфира (R)-3-амино-4-диметиламиномасляной кислоты, при этом получали бензиловый эфир (R)-3-[8-(4-метоксибензилокси)октаноиламино]-4-диметиламиномасляной кислоты, который гидрировали на стадии 4.
Пример 9
(R)-3-[8-(Бифенил-4-илметокси)октаноиламино]-4-диметиламиномасляная кислота
Указанное в заголовке соединение, m/e 455,3 ([М+Н]+), получали аналогично тому, как описано в примере 1, стадии 1-4. 1,8-Октандиол алкилировали на стадии 1 в присутствии 4-(бромметил)бифенила, при этом получали 8-(бифенил-4-илметокси)октан-1-ол, который окисляли на стадии 2, при этом получали 8-(бифенил-4-илметокси)октановую кислоту. Указанное соединение конденсировали на стадии 3 с дигидрохлоридом бензилового эфира (R)-3-амино-4-диметиламиномасляной кислоты, при этом получали бензиловый эфир (R)-3-[8-(бифенил-4-илметокси)октаноиламино]-4-диметиламиномасляной кислоты, который гидрировали на стадии 4.
Пример 10
(R)-4-Диметиламино-3-[8-(2-фтор-4-трифторметилбензилокси)октаноиламино]масляная кислота
Указанное в заголовке соединение, m/e 463,1 ([М-Н]-), получали аналогично тому, как описано в примере 1, стадии 1-4. 1,8-Октандиол алкилировали на стадии 1 в присутствии 2-фтор-4-трифторметилбензилбромида, при этом получали 8-(2-фтор-4-трифторметилбензилокси)октан-1-ол, который окисляли на стадии 2, при этом получали 8-(2-фтор-4-трифторметилбензилокси)октановую кислоту. Указанное соединение конденсировали на стадии 3 с дигидрохлоридом бензилового эфира (R)-3-амино-4-диметиламиномасляной кислоты, при этом получали бензиловый эфир (R)-3-[8-(2-фтор-4-трифторметилбензилокси)октаноиламино]-4-диметиламиномасляной кислоты, который гидрировали на стадии 4.
Пример 11
(R)-4-Диметиламино-3-[8-(2,3,5,6-тетрафтор-4-метоксибензилокси)октаноиламино]масляная кислота
Указанное в заголовке соединение, m/e 479,4 ([М-Н]-), получали аналогично тому, как описано в примере 1, стадии 1-4. 1,8-Октандиол алкилировали на стадии 1 в присутствии 2,3,5,6-тетрафтор-4-метоксибензилбромида, при этом получали 8-(2,3,5,6-тетрафтор-4-метоксибензилокси)октан-1-ол, который окисляли на стадии 2, при этом получали 8-(2,3,5,6-тетрафтор-4-метоксибензилокси)октановую кислоту. Указанное соединение конденсировали на стадии 3 с дигидрохлоридом бензилового эфира (R)-3-амино-4-диметиламиномасляной кислоты, при этом получали бензиловый эфир (R)-3-[8-(2,3,5,6-тетрафтор-4-метоксибензилокси)октаноиламино]-4-диметиламиномасляной кислоты, который гидрировали на стадии 4.
Пример 12
(R)-4-Диметиламино-3-[8-(нафталин-1-илметокси)октаноиламино]масляная кислота
Указанное в заголовке соединение, m/e 427,1 ([М-Н]-), получали аналогично тому, как описано в примере 1, стадии 1-4. 1,8-Октандиол алкилировали на стадии 1 в присутствии 1-бромметилнафталина, при этом получали 8-(нафталин-1-илметокси)октан-1-ол, который окисляли на стадии 2, при этом получали 8-(нафталин-1-илметокси)октановую кислоту. Указанное соединение конденсировали на стадии 3 с дигидрохлоридом бензилового эфира (R)-3-амино-4-диметиламиномасляной кислоты, при этом получали бензиловый эфир (R)-3-[8-(нафталин-1-илметокси)октаноиламино]-4-диметиламиномасляной кислоты, который гидрировали на стадии 4.
Пример 13
(R)-4-Диметиламино-3-[8-(2-фторбензилокси)октаноиламино]масляная кислота
Указанное в заголовке соединение, m/e 397,4 ([М+Н]+), получали аналогично тому, как описано в примере 1, стадии 1-4. 1,8-Октандиол алкилировали на стадии 1 в присутствии 2-фторбензилбромида, при этом получали 8-(2-фторбензилокси)октан-1-ол, который окисляли на стадии 2, при этом получали 8-(2-фторбензилокси)октановую кислоту. Указанное соединение конденсировали на стадии 3 с дигидрохлоридом бензилового эфира (R)-3-амино-4-диметиламиномасляной кислоты, при этом получали бензиловый эфир (R)-3-[8-(2-фторбензилокси)октаноиламино]-4-диметиламиномасляной кислоты, который гидрировали на стадии 4.
Пример 14
(R)-4-Диметиламино-3-[8-(3-фторбензилокси)октаноиламино]масляная кислота
Указанное в заголовке соединение, m/e 397,4 ([М+Н]+), получали аналогично тому, как описано в примере 1, стадии 1-4. 1,8-Октандиол алкилировали на стадии 1 в присутствии 3-фторбензилбромида, при этом получали 8-(3-фторбензилокси)октан-1-ол, который окисляли на стадии 2, при этом получали 8-(3-фторбензилокси)октановую кислоту. Указанное соединение конденсировали на стадии 3 с дигидрохлоридом бензилового эфира (R)-3-амино-4-диметиламиномасляной кислоты, при этом получали бензиловый эфир (R)-3-[8-(3-фторбензилокси)октаноиламино]-4-диметиламиномасляной кислоты, который гидрировали на стадии 4.
Пример 15
(R)-4-Диметиламино-3-[8-(4-фторбензилокси)октаноиламино]масляная кислота
Указанное в заголовке соединение, m/e 397,4 ([М+Н]+), получали аналогично тому, как описано в примере 1, стадии 1-4. 1,8-Октандиол алкилировали на стадии 1 в присутствии 4-фторбензилбромида, при этом получали 8-(4-фторбензилокси)октан-1-ол, который окисляли на стадии 2, при этом получали 8-(4-фторбензилокси)октановую кислоту. Указанное соединение конденсировали на стадии 3 с дигидрохлоридом бензилового эфира (R)-3-амино-4-диметиламиномасляной кислоты, при этом получали бензиловый эфир (R)-3-[8-(4-фторбензилокси)октаноиламино]-4-диметиламиномасляной кислоты, который гидрировали на стадии 4.
Пример 16
(R)-3-[8-(2,3-Дифторбензилокси)октаноиламино]-4-диметиламиномасляная кислота
Указанное в заголовке соединение, m/e 415,5 ([М+Н]+), получали аналогично тому, как описано в примере 1, стадии 1-4. 1,8-Октандиол алкилировали на стадии 1 в присутствии 2,3-дифторбензилбромида, при этом получали 8-(2,3-дифторбензилокси)октан-1-ол, который окисляли на стадии 2, при этом получали 8-(2,3-дифторбензилокси)октановую кислоту. Указанное соединение конденсировали на стадии 3 с дигидрохлоридом бензилового эфира (R)-3-амино-4-диметиламиномасляной кислоты, при этом получали бензиловый эфир (R)-3-[8-(2,3-дифторбензилокси)октаноиламино]-4-диметиламиномасляной кислоты, который гидрировали на стадии 4.
Пример 17
(R)-3-(8-Бензилоксиоктаноиламино)-4-диметиламиномасляная кислота
Указанное в заголовке соединение, m/e 377, ([М-Н]-),]+), получали аналогично тому, как описано в примере 1, стадии 1-4. 1,8-Октандиол алкилировали на стадии 1 в присутствии бензилбромида, при этом получали 8-бензилоксиоктан-1-ол, который окисляли на стадии 2, при этом получали 8-бензилоктановую кислоту. Указанное соединение конденсировали на стадии 3 с дигидрохлоридом бензилового эфира (R)-3-амино-4-диметиламиномасляной кислоты, при этом получали бензиловый эфир (R)-3-[8-бензилокси)октаноиламино]-4-диметиламиномасляной кислоты, который гидрировали на стадии 4.
Пример 18
(R)-4-Диметиламино-3-[9-(2-фторфенокси)нонаноиламино]масляная кислота
Стадия 1
Карбонат калия (2,59 г, 18,7 ммоля) и 9-бром-1-нонанол (1,39 г, 6,24 ммоля) добавляли при КТ в раствор 2-фторфенола (700 мг, 6,24 ммоля) в N,N-диметилформамиде (20 мл), затем через 40 ч нерастворенный материал отделяли фильтрованием. Фильтрат упаривали и остаток переносили в дихлорметан, промывали 1 М водным раствором гидроксида натрия, сушили над сульфатом натрия, фильтровали и упаривали, при этом получали 9-(2-фторфенокси)нонан-1-ол (1,7 г), который использовали без дополнительной очистки на следующей стадии.
Стадия 2
9-(2-Фторфенокси)нонан-1-ол окисляли аналогично тому, как описано в примере 1, стадия 2, при этом получали 9-(2-фторфенокси)нонановую кислоту.
Стадия 3
После амидоконденсации 9-(2-фторфенокси)нонановой кислоты с дигидрохлоридом бензилового эфира (R)-3-амино-4-диметиламиномасляной кислоты аналогично тому, как описано в примере 1, стадия 3, получали бензиловый эфир (R)-4-диметиламино-3-[9-(2-фторфенокси)нонаноиламино]масляной кислоты.
Стадия 4
После гидрирования бензилового эфира (R)-4-диметиламино-3-[9-(2-фторфенокси)нонаноиламино]масляной кислоты аналогично тому, как описано в примере 1, стадия 4, получали (R)-4-диметиламино-3-[9-(2-фторфенокси)нонаноиламино]масляную кислоту в виде твердого вещества белого цвета, m/e 395,5 ([М-Н]-).
Пример 19
(R)-4-Диметиламино-3-[9-(3-фторфенокси)нонаноиламино] масляная кислота
Указанное в заголовке соединение, m/e 397,4 ([М+Н]+), получали аналогично тому, как описано в примере 18, стадии 1-4. 3-Фторфенол алкилировали на стадии 1 в присутствии 9-бром-1-нонанола, при этом получали 9-(3-фторфенокси)нонан-1-ол, который окисляли на стадии 2, при этом получали 9-(3-фторфенокси)нонановую кислоту. Указанное соединение конденсировали на стадии 3 с дигидрохлоридом бензилового эфира (R)-3-амино-4-диметиламиномасляной кислоты, при этом получали бензиловый эфир (R)-4-диметиламино-3-[9-(3-фторфенокси)нонаноиламино]масляной кислоты, который гидрировали на стадии 4.
Пример 20
(R)-4-Диметиламино-3-[9-(4-фторфенокси)нонаноиламино]масляная кислота
Указанное в заголовке соединение, m/e 395,5 ([М-Н]-), получали аналогично тому, как описано в примере 18, стадии 1-4. 4-Фторфенол алкилировали на стадии 1 в присутствии 9-бром-1-нонанола, при этом получали 9-(4-фторфенокси)нонан-1-ол, который окисляли на стадии 2, при этом получали 9-(4-фторфенокси)нонановую кислоту. Указанное соединение конденсировали на стадии 3 с дигидрохлоридом бензилового эфира (R)-3-амино-4-диметиламиномасляной кислоты, при этом получали бензиловый эфир (R)-4-диметиламино-3-[9-(4-фторфенокси)нонаноиламино]масляной кислоты, который гидрировали на стадии 4.
Пример 21
(R)-3-[9-(2,3-Дифторфенокси)нонаноиламино]-4-диметиламиномасляная кислота
Указанное в заголовке соединение, m/e 415,5 ([М+Н]+), получали аналогично тому, как описано в примере 18, стадии 1-4. 2,3-Дифторфенол алкилировали на стадии 1 в присутствии 9-бром-1-нонанола, при этом получали 9-(2,3-дифторфенокси)нонан-1-ол, который окисляли на стадии 2, при этом получали 9-(2,3-дифторфенокси)нонановую кислоту. Указанное соединение конденсировали на стадии 3 с дигидрохлоридом бензилового эфира (R)-3-амино-4-диметиламиномасляной кислоты, при этом получали бензиловый эфир (R)-4-диметиламино-3-[9-(2,3-дифторфенокси)нонаноиламино]масляной кислоты, который гидрировали на стадии 4.
Пример 22
(R)-3-[9-(2,4-Дифторфенокси)нонаноиламино]-4-диметиламиномасляная кислота
Указанное в заголовке соединение, m/e 413,6 ([М-Н]-), получали аналогично тому, как описано в примере 18, стадии 1-4. 2,4-Дифторфенол алкилировали на стадии 1 в присутствии 9-бром-1-нонанола, при этом получали 9-(2,4-дифторфенокси)нонан-1-ол, который окисляли на стадии 2, при этом получали 9-(2,4-дифторфенокси)нонановую кислоту. Указанное соединение конденсировали на стадии 3 с дигидрохлоридом бензилового эфира (R)-3-амино-4-диметиламиномасляной кислоты, при этом получали бензиловый эфир (R)-4-диметиламино-3-[9-(2,4-дифторфенокси)нонаноиламино] масляной кислоты, который гидрировали на стадии 4.
Пример 23
(R)-3-[9-(3,4-Дифторфенокси)нонаноиламино]-4-диметиламиномасляная кислота
Указанное в заголовке соединение, m/e 413,6 ([М-Н]-), получали аналогично тому, как описано в примере 18, стадии 1-4. 3,4-Дифторфенол алкилировали на стадии 1 в присутствии 9-бром-1-нонанола, при этом получали 9-(3,4-дифторфенокси)нонан-1-ол, который окисляли на стадии 2, при этом получали 9-(3,4-дифторфенокси)нонановую кислоту. Указанное соединение конденсировали на стадии 3 с дигидрохлоридом бензилового эфира (R)-3-амино-4-диметиламиномасляной кислоты, при этом получали бензиловый эфир (R)-4-диметиламино-3-[9-(3,4-дифторфенокси)нонаноиламино]масляной кислоты, который гидрировали на стадии 4.
Пример 24
(R)-4-Диметиламино-3-[9-(2,3,4-трифторфенокси)нонаноиламино]масляная кислота
Указанное в заголовке соединение, m/e 433,5 ([М+Н]+), получали аналогично тому, как описано в примере 18, стадии 1-4. 2,3,4-Трифторфенол алкилировали на стадии 1 в присутствии 9-бром-1-нонанола, при этом получали 9-(2,3,4-трифторфенокси)нонан-1-ол, который окисляли на стадии 2, при этом получали 9-(2,3,4-трифторфенокси)нонановую кислоту. Указанное соединение конденсировали на стадии 3 с дигидрохлоридом бензилового эфира (R)-3-амино-4-диметиалминомасляной кислоты, при этом получали бензиловый эфир (R)-4-диметиламино-3-[9-(2,3,4-трифторфенокси)нонаноиламино]масляной кислоты, который гидрировали на стадии 4.
Пример 25
(R)-3-[9-(Бифенил-4-илокси)нонаноиламино]-4-диметиламиномасляная кислота
Указанное в заголовке соединение, m/e 455,3 ([М+Н]+), получали аналогично тому, как описано в примере 18, стадии 1-4. Бифенил-4-ол алкилировали на стадии 1 в присутствии 9-бром-1-нонанола, при этом получали 9-(бифенил-4-илокси)нонан-1-ол, который окисляли на стадии 2, при этом получали 9-(бифенил-4-илокси)нонановую кислоту. Указанное соединение конденсировали на стадии 3 с дигидрохлоридом бензилового эфира (R)-3-амино-4-диметиламиномасляной кислоты, при этом получали бензиловый эфир (R)-4-диметиламино-3-[9-(бифенил-4-илокси)нонаноиламино]масляной кислоты, который гидрировали на стадии 4.
Пример 26
(R)-3-[9-(3,4-Диметоксифенокси)нонаноиламино]-4-диметиламино масляная кислота
Указанное в заголовке соединение, m/e 439,4 ([М+Н]+), получали аналогично тому, как описано в примере 18, стадии 1-4. 3,4-Диметоксифенол алкилировали на стадии 1 в присутствии 9-бром-1-нонанола, при этом получали 9-(3,4-диметоксифенокси)нонан-1-ол, который окисляли на стадии 2, при этом получали 9-(3,4-диметоксифенокси)нонановую кислоту. Указанное соединение конденсировали на стадии 3 с дигидрохлоридом бензилового эфира (R)-3-амино-4-диметиламиномасляной кислоты, при этом получали бензиловый эфир (R)-4-диметиламино-3-[9-(3,4-диметоксифенокси)нонаноиламино]масляной кислоты, который гидрировали на стадии 4.
Пример 27
(R)-4-Диметиламино-3-[9-(4-трифторметилфенокси)нонаноиламино]масляная кислота
Указанное в заголовке соединение, m/e 447,4 ([М+Н]+), получали аналогично тому, как описано в примере 18, стадии 1-4. 4-Трифторметилфенол алкилировали на стадии 1 в присутствии 9-бром-1-нонанола, при этом получали 9-(4-трифторметилфенокси)нонан-1-ол, который окисляли на стадии 2, при этом получали 9-(4-трифторметилфенокси)нонановую кислоту. Указанное соединение конденсировали на стадии 3 с дигидрохлоридом бензилового эфира (R)-3-амино-4-диметиламиномасляной кислоты, при этом получали бензиловый эфир (R)-4-диметиламино-3-[9-(4-трифторметилфенокси)нонаноиламино]масляной кислоты, который гидрировали на стадии 4.
Пример 28
(R)-4-Диметиламино-3-[9-(4-метоксифенокси)нонаноиламино]масляная кислота
Указанное в заголовке соединение, m/e 409,5 ([М+Н]+), получали аналогично тому, как описано в примере 18, стадии 1-4. 4-Метоксифенол алкилировали на стадии 1 в присутствии 9-бром-1-нонанола, при этом получали 9-(4-метоксифенокси)нонан-1-ол, который окисляли на стадии 2, при этом получали 9-(4-метоксифенокси)нонановую кислоту. Указанное соединение конденсировали на стадии 3 с дигидрохлоридом бензилового эфира (R)-3-амино-4-диметиламиномасляной кислоты, при этом получали бензиловый эфир (R)-4-диметиламино-3-[9-(4-метоксифенокси)нонаноиламино]масляной кислоты, который гидрировали на стадии 4.
Пример 29
(R)-4-Диметиламино-3-[9-(нафталин-1-илокси)нонаноиламино]масляная кислота
Указанное в заголовке соединение, m/e 429,5 ([М+Н]+), получали аналогично тому, как описано в примере 18, стадии 1-4. Нафталин-1-ол алкилировали на стадии 1 в присутствии 9-бром-1-нонанола, при этом получали 9-(нафталин-1-илокси)нонан-1-ол, который окисляли на стадии 2, при этом получали 9-(нафталин-1-илокси)нонановую кислоту. Указанное соединение конденсировали на стадии 3 с дигидрохлоридом бензилового эфира (R)-3-амино-4-диметиламиномасляной кислоты, при этом получали бензиловый эфира (R)-4-диметиламино-3-[9-(нафталин-1-илокси)нонаноиламино]масляной кислоты, который гидрировали на стадии 4.
Пример 30
(R)-4-Диметиламино-3-(11-феноксиундеканоиламино)масляная кислота
Указанное в заголовке соединение, m/e 405,7 ([М-Н]-), получали аналогично тому, как описано в примере 18, стадии 1-4. Фенол алкилировали на стадии 1 в присутствии 11-бром-1-ундеканола, при этом получали 11-феноксиундекан-1-ол, который окисляли на стадии 2, при этом получали 11-феноксиундекановую кислоту. Указанное соединение конденсировали на стадии 3 с дигидрохлоридом бензилового эфира (R)-3-амино-4-диметиламиномасляной кислоты, при этом получали бензиловый эфир (R)-4-диметиламино-3-[11-феноксиундеканоиламино]масляной кислоты, который гидрировали на стадии 4.
Пример 31
(R)-4-Диметиламино-3-(9-феноксинонаноиламино)масляная кислота
Указанное в заголовке соединение, m/e 379,4 ([М+Н]+), получали аналогично тому, как описано в примере 18, стадии 1-4. Фенол алкилировали на стадии 1 в присутствии 9-бром-1-нонанола, при этом получали 9-феноксинонан-1-ол, который окисляли на стадии 2, при этом получали 9-феноксинонановую кислоту. Указанное соединение конденсировали на стадии 3 с дигидрохлоридом бензилового эфира (R)-3-амино-4-диметиламиномасляной кислоты, при этом получали бензиловый эфир (R)-4-диметиламино-3-[9-феноксинонаноиламино]масляной кислоты, который гидрировали на стадии 4.
Пример 32
(R)-4-Диметиламино-3-(10-фенилдеканоиламино)масляная кислота
Указанное в заголовке соединение, m/e 377,3 ([М+Н]+), получали аналогично тому, как описано в примере 1, стадии 3 и 4. Коммерческую 10-фенилдекановую кислоту конденсировали на стадии 3 с дигидрохлоридом бензилового эфира (R)-3-амино-4-диметиламиномасляной кислоты, при этом получали бензиловый эфир (R)-4-диметиламино-3-(10-фенилдеканоиламино)масляной кислоты, который гидрировали на стадии 4.
Пример 33
(S)-4-Диметиламино-3-(10-фенилдеканоиламино)масляная кислота
Указанное в заголовке соединение, m/e 377,5 ([М+Н]+), получали аналогично тому, как описано в примере 1, стадии 3 и 4. Коммерческую 10-фенилдекановую кислоту конденсировали на стадии 3 с дигидрохлоридом бензилового эфира (S)-3-амино-4-диметиламиномасляной кислоты, при этом получали бензиловый эфир (S)-4-диметиламино-3-(10-фенилдеканоиламино)масляной кислоты, который гидрировали на стадии 4.
Дигидрохлорид бензилового эфира (S)-3-амино-4-диметиламиномасляной кислоты получали аналогично тому, как описано для дигидрохлорида бензилового эфира (R)-3-амино-4-диметиламиномасляной кислоты (пример 1) из 4-бензилового эфира Boc-L-аспарагиновой кислоты.
Пример 34
(R)-4-Диметиламино-3-[10-(4-фторфенил)деканоиламино]масляная кислота
Стадия 1
В раствор 9-бромнонановой кислоты (7,00 г, 29,5 ммоля) в толуоле (10 мл) добавляли трифенилфосфин (7,74 г, 29,5 ммоля). Раствор герметично закрывали в атмосфере азота в пробирке для высокого давления и нагревали при 110°С в течение 18 ч. После завершения реакции наблюдали образование двух фаз. Верхний слой толуола отделяли от неочищенного продукта декантацией и продукт промывали толуолом. При этом получали бромид (8-карбоксиоктил)трифенилфосфония (14,9 г) в виде полутвердого вещества белого цвета, которое использовали на следующей стадии без дополнительной очистки, m/e 419,3 ([М+Н]+).
Стадия 2
Гидрид натрия (60% дисперсия в минеральном масле, 0,65 г, 16 ммолей) порциями при КТ добавляли в перемешиваемый раствор бромида (8-карбоксиоктил)трифенилфосфония (2,8 г, 5,6 ммоля) в тетрагидрофуране (30 мл) при КТ, затем через 1 ч в смесь порциями добавляли 4-фторбензальдегид (700 мг, 5,64 ммоля) и раствор перемешивали в течение 2 сут при КТ. После завершения реакции добавляли воду (10 мл) и раствор подкисляли до pH 3 конц. соляной кислотой. Продукт экстрагировали этилацетатом, органический слой сушили над сульфатом магния, фильтровали и упаривали. После проведения хроматографии (SiO2, элюент: гептан/этилацетат, 4:1) получали 10-(4-фторфенил)дец-9-еновую кислоту (280 мг, 19%) в виде бесцветного масла.
Стадия 3
Раствор 10-(4-фторфенил)дец-9-еновой кислоты (230 мг, 0,87 ммоля), оксалилхлорида (0,11 мл, 1,3 ммоля) и N,N-диметилформамид (одна капля) в дихлорметане (3 мл) перемешивали при КТ в течение 2 ч, затем летучие соединения удаляли при перегонке, при этом получали 10-(4-фторфенил)дец-9-еноилхлорид. Указанное соединение снова растворяли в дихлорметане, затем по каплям добавляли N,N-диизопропилэтиламин (140 мг, 1,04 ммоля), затем дигидрохлорид бензилового эфира (R)-3-амино-4-диметиламиномасляной кислоты. Реакционную смесь перемешивали при КТ в течение 16 ч и промывали водой. Органический слой упаривали и остаток очищали препаративной ЖХВР, при этом получали бензиловый эфир (R)-4-диметиламино-3-[10-(4-фторфенил)дец-9-еноиламино]масляной кислоты (100 мг, 24%), m/e 483,4 ([M+H]+).
Стадия 4
После гидрирования бензилового эфира (R)-4-диметиламино-3-[10-(4-фторфенил)дец-9-еноиламино]масляной кислоты аналогично тому, как описано в примере 1, стадия 4, получали (R)-4-диметиламино-3-[10-(4-фторфенил)деканоиламино]масляную кислоту, m/e 395,2 ([М+Н]+).
Пример 35
(R)-4-Диметиламино-3-[10-(2-фторфенил)деканоиламино]масляная кислота
Стадия 1
В раствор этилового эфира 9-декановой кислоты (Tetrahedron, 59, 7973 (2003), 500 мг, 2,53 ммоля) и 2-фторстирола (617 мг, 5,05 ммоля) в дихлорметане (12,5 мл) добавляли дихлор(1,3-димезитил-4,5-дигидроимидазол-2-илиден)(фенилметилен)(трициклогексилфосфин)рутений (107 мг, 0,13 ммол). Смесь продували азотом и герметично закрывали в пробирке для высокого давления, затем нагревали при 40°С в течение 18 ч. После охлаждения и упаривания растворителя продукт очищали хроматографией (SiO2, элюент: гептан/дихлорметан, 3:1), при этом получали этиловый эфир 10-(2-фторфенил)дец-9-еновой кислоты (420 мг, 57%).
Стадия 2
В раствор этилового эфира 10-(2-фторфенил)дец-9-еновой кислоты (420 мг, 1,44 ммоля) в тетрагидрофуране (2 мл) добавляли 2 М водный раствор гидроксида лития (2 мл, 4 ммоля). Реакционную смесь перемешивали при КТ в течение 16 ч, затем распределяли между 1 М водным раствором соляной кислоты и этилацетатом. Органический слой сушили над сульфатом магния, фильтровали и упаривали, при этом получали 10-(2-фторфенил)дец-9-еновую кислоту (250 мг, 66%).
Стадия 3
Аналогично тому, как описано в примере 34, стадия 3, 10-(2-фторфенил)дец-9-еновую кислоту превращали в 10-(2-фторфенил)дец-9-еноилхлорид, который затем вводили в реакцию с дигидрохлоридом бензилового эфира (R)-3-амино-4-диметиламиномасляной кислоты, при этом получали бензиловый эфир (R)-4-диметиламино-3-[10-(2-фторфенил)дец-9-еноиламино]масляной кислоты.
Стадия 4
После гидрирования бензилового эфира (R)-4-диметиламино-3-[10-(2-фторфенил)дец-9-еноиламино]масляной кислоты аналогично тому, как описано в примере 1, стадия 4, получали (R)-4-диметиламино-3-[10-(2-фторфенил)деканоиламино]масляную кислоту, m/e 395,2 ([М+Н]+).
Пример 36
(R)-4-Диметиламино-3-[10-(2,5-диметилфенил)деканоиламино]масляная кислота
Указанное в заголовке соединение, m/e 405,4 ([М+Н]+), получали аналогично тому, как описано в примере 35, стадии 1-4. Этиловый эфир 9-деценовой кислоты вводили в реакцию на стадии 1 с 2,5-диметилстиролом, при этом получали этиловый эфир 10-(2,5-диметилфенил)дец-9-еновой кислоты, который гидролизовали на стадии 2, при этом получали 10-(2,5-диметилфенил)дец-9-еновую кислоту. На стадии 3 указанное соединение превращали в 10-(2,5-диметилфенил)дец-9-еноилхлорид, который затем вводили в реакцию с дигидрохлоридом бензилового эфира (R)-3-амино-4-диметиламиномасляной кислоты, при этом получали бензиловый эфир (R)-4-диметиламино-3-[10-(2,5-диметилфенил)дец-9-еноиламино]масляной кислоты, который гидрировали на стадии 4.
Пример 37
(R)-4-Диметиламино-3-[10-(2,6-диметилфенил)деканоиламино]масляная кислота
Указанное в заголовке соединение, m/e 405,3 ([М+Н]+), получали аналогично тому, как описано в примере 34, стадии 2-4. 2,6-Диметилбензальдегид вводили в реакцию на стадии 2 с бромидом (8-карбоксиоктил)трифенилфосфония, при этом получали 10-(2,6-диметилфенил)дец-9-еновую кислоту. На стадии 3 указанное соединение превращали в 10-(2,6-диметилфенил)дец-9-еноилхлорид, который затем вводили в реакцию с дигидрохлоридом бензилового эфира (R)-3-амино-4-диметиламиномасляной кислоты, при этом получали бензиловый эфир (R)-4-диметиламино-3-[10-(2,6-диметилфенил)дец-9-еноиламино]масляной кислоты, который гидрировали на стадии 4.
Пример 38
(R)-4-Диметиламино-3-[10-(4-метоксифенил)деканоиламино]масляная кислота
Указанное в заголовке соединение, m/e 407,3 ([М+Н]+), получали аналогично тому, как описано в примере 35, стадии 1-4. Этиловый эфир 9-деценовой кислоты вводили в реакцию на стадии 1 с 4-метоксистиролом, при этом получали этиловый эфир 10-(4-метоксифенил)дец-9-еновой кислоты, который гидрировали на стадии 2, при этом получали 10-(4-метоксифенил)дец-9-еновую кислоту. На стадии 3 указанное соединение превращали в 10-(4-метоксифенил)дец-9-еноилхлорид, который затем вводили в реакцию с дигидрохлоридом бензилового эфира (R)-3-амино-4-диметиламиномасляной кислоты, при этом получали бензиловый эфир (R)-4-диметиламино-3-[10-(4-метоксифенил)дец-9-еноиламино]масляной кислоты, который гидрировали на стадии 4.
Пример 39
(R)-4-Диметиламино-3-(10-нафталин-1-илдеканоиламино)масляная кислота
Указанное в заголовке соединение, m/e 427,4 ([М+Н]+), получали аналогично тому, как описано в примере 35, стадии 1-4. Этиловый эфир 9-деценовой кислоты вводили в реакцию на стадии 1 с 1-винилнафталином, при этом получали этиловый эфир 10-(нафталин-1-ил)дец-9-еновой кислоты, который гидрировали на стадии 2, при этом получали 10-(нафталин-1-ил)дец-9-еновую кислоту. На стадии 3 указанное соединение превращали в 10-(нафталин-1-ил)дец-9-еноилхлорид, который затем вводили в реакцию с дигидрохлоридом бензилового эфира (R)-3-амино-4-диметиламиномасляной кислоты, при этом получали бензиловый эфир (R)-4-диметиламино-3-[10-(нафталин-1-ил)дец-9-еноиламино]масляной кислоты, который гидрировали на стадии 4.
Пример 40
(R)-4-Диметиламино-3-[10-(4-трифторметилфенил)деканоиламино]масляная кислота
Указанное в заголовке соединение, m/e 445,1 ([М+Н]+), получали аналогично тому, как описано в примере 35, стадии 1-4. Этиловый эфир 9-деценовой кислоты вводили в реакцию на стадии 1 с 4-трифторметилстиролом, при этом получали этиловый эфир 10-(4-трифторметилфенил)дец-9-еновой кислоты, который гидролизовали на стадии 2, при этом получали 10-(4-трифторметилфенил)дец-9-еновую кислоту. На стадии 3 указанное соединение превращали в 10-(4-трифторметилфенил)дец-9-еноилхлорид, который затем вводили в реакцию с дигидрохлоридом бензилового эфира (R)-3-амино-4-диметиламиномасляной кислоты, при этом получали бензиловый эфир (R)-4-диметиламино-3-[10-(4-трифторметилфенил)дец-9-еноиламино]масляной кислоты, который гидрировали на стадии 4.
Пример 41
(R)-4-Диметиламино-3-[10-(3-фторфенил)деканоиламино]масляная кислота
Указанное в заголовке соединение, m/e 395,3 ([М+Н]+), получали аналогично тому, как описано в примере 35, стадии 1-4. Этиловый эфир 9-деценовой кислоты вводили в реакцию на стадии 1 с 3-фторстиролом, при этом получали этиловый эфир 10-(3-фторфенил)дец-9-еновой кислоты, который гидролизовали на стадии 2, при этом получали 10-(3-фторфенил)дец-9-еновую кислоту. На стадии 3 указанное соединение превращали в 10-(3-фторфенил)дец-9-еноилхлорид, который затем вводили в реакцию с дигидрохлоридом бензилового эфира (R)-3-амино-4-диметиламиномасляной кислоты, при этом получали бензиловый эфир (R)-4-диметиламино-3-[10-(3-фторфенил)дец-9-еноиламино]масляной кислоты, который гидрировали на стадии 4.
Пример 42
(R)-3-[10-(2,3-Дифторфенил)деканоиламино1-4-диметиламиномасляная кислота
Указанное в заголовке соединение, m/e 413,3 ([М+Н]+), получали аналогично тому, как описано в примере 34, стадии 2-4. 2,3-Дифторбензальдегид вводили в реакцию на стадии 2 с бромидом (8-карбоксиоктил)трифенилфосфония, при этом получали 10-(2,3-дифторфенил)дец-9-еновую кислоту. На стадии 3 указанное соединение превращали в 10-(2,3-дифторфенил)дец-9-еноилхлорид, который затем вводили в реакцию с дигидрохлоридом бензилового эфира (R)-3-амино-4-диметиламиномасляной кислоты, при этом получали бензиловый эфир (R)-4-диметиламино-3-[10-(2,3-дифторфенил)дец-9-еноиламино]масляной кислоты, который гидрировали на стадии 4.
Пример 43
(R)-4-Диметиламино-3-(10-тиофен-3-илдеканоиламино)масляная кислота
Стадия 1
После взаимодействия 3-тиофенкарбоксальдегида с бромидом (8-карбоксиоктил)трифенилфосфония, аналогично тому, как описано в примере 34, стадия 2, получали 10-(тиофен-3-ил)дец-9-еновую кислоту.
Стадия 2
Аналогично тому, как описано в примере 34, стадия 3, 10-(тиофен-3-ил)дец-9-еновую кислоту превращали в 10-(тиофен-3-ил)дец-9-еноилхлорид, который затем вводили в реакцию с дигидрохлоридом бензилового эфира (R)-3-амино-4-диметиламиномасляной кислоты, при этом получали бензиловый эфир (R)-4-диметиламино-3-[10-(тиофен-3-ил)дец-9-еноиламино]масляной кислоты.
Стадия 3
Триэтилсилан (0,23 мл, 1,43 ммоля) и трифторуксусную кислоту (0,21 мл, 2,9 ммоля) добавляли в раствор бензилового эфира 4-диметиламино-3-(10-тиофен-3-илдец-9-еноиламино)масляной кислоты (67 мг, 0,14 ммоля) в толуоле (8 мл). Реакционную смесь перемешивали при КТ в течение 12 ч, затем раствор выливали в холодный насыщенный водный раствор бикарбоната натрия. Водную фазу отделяли и дважды экстрагировали дихлорметаном. Объединенные органические фазы сушили над сульфатом магния, фильтровали и концентрировали в вакууме, при этом получали бензиловый эфир 4-диметиламино-3-(10-тиофен-3-илдеканоиламино)масляной кислоты (74 мг), m/e=473,3 ([M+H]+).
Стадия 4
После гидролиза бензилового эфира 4-диметиламино-3-(10-тиофен-3-илдеканоиламино)масляной кислоты, аналогично тому, как описано в примере 35, стадия 2, получали (R)-4-диметиламино-3-(10-тиофен-3-илдеканоиламино)масляную кислоту, m/e 383,1 ([М+Н]+).
Пример 44
(R)-4-Диметиламино-3-(10-тиазол-5-илдеканоиламино)масляная кислота
Указанное в заголовке соединение, m/e 384,3 ([М+Н]+), получали аналогично тому, как описано в примере 43, стадии 1-4. Тиазол-5-карбоксальдегид вводили в реакцию на стадии 1 с бромидом (8-карбоксиоктил)трифенилфосфония, при этом получали 10-(тиазол-5-ил)дец-9-еновую кислоту. На стадии 2 указанное соединение превращали в 10-(тиазол-5-ил)дец-9-еноилхлорид, который затем вводили в реакцию с дигидрохлоридом бензилового эфира (R)-3-амино-4-диметиламиномасляной кислоты, при этом получали бензиловый эфир (R)-4-диметиламино-3-[10-(2,3-дифторфенил)дец-9-еноиламино]масляной кислоты. На стадии 3 при взаимодействии бензилового эфира (R)-4-диметиламино-3-[10-(2,3-дифторфенил)дец-9-еноиламино]масляной кислоты с триэтилсиланом-трифторуксусной кислотой получали бензиловый эфир 4-диметиламино-3-(10-тиазол-5-илдеканоиламино)масляной кислоты, который гидрировали на стадии 4.
Пример 45
(R)-4-Диметиламино-3-(6-фенилгексаноиламино)масляная кислота
Указанное в заголовке соединение, m/e 321,3 ([М+Н]+), получали аналогично тому, как описано в примере 1, стадии 3 и 4. Коммерческую 6-фенилгексановую кислоту конденсировали на стадии 3 с дигидрохлоридом бензилового эфира (R)-3-амино-4-диметиламиномасляной кислоты, при этом получали бензиловый эфир (R)-4-диметиламино-3-(6-фенилгексаноиламино)масляной кислоты, который гидрировали на стадии 4.
Пример 46
(R)-4-Диметиламино-3-(7-фенилгептаноиламино)масляная кислота
Указанное в заголовке соединение, m/e 335, ([М+Н]+), получали аналогично тому, как описано в примере 1, стадии 3 и 4. Коммерческую 7-фенилгептановую кислоту конденсировали на стадии 3 с дигидрохлоридом бензилового эфира (R)-3-амино-4-диметиламиномасляной кислоты, при этом получали бензиловый эфир (R)-4-диметиламино-3-(7-фенилгептаноиламино)масляной кислоты, который гидрировали на стадии 4.
Пример 47
(R)-4-Диметиламино-3-(8-фенилоктаноиламино)масляная кислота
Указанное в заголовке соединение, m/e 347,4 ([М-Н]-), получали аналогично тому, как описано в примере 1, стадии 3 и 4. Коммерческую 8-фенилоктановую кислоту конденсировали на стадии 3 с дигидрохлоридом бензилового эфира (R)-3-амино-4-диметиламиномасляной кислоты, при этом получали бензиловый эфир (R)-4-диметиламино-3-(8-фенилоктаноиламино)масляной кислоты, который гидрировали на стадии 4.
Пример 48
(R)-4-Диметиламино-3-(9-фенилнонаноиламино)масляная кислота
Указанное в заголовке соединение, m/e 361,5 ([М-Н]-), получали аналогично тому, как описано в примере 1, стадии 3 и 4. Коммерческую 9-фенилнонановую кислоту конденсировали на стадии 3 с дигидрохлоридом бензилового эфира (R)-3-амино-4-диметиламиномасляной кислоты, при этом получали бензиловый эфир (R)-4-диметиламино-3-(9-фенилнонаноиламино)масляной кислоты, который гидрировали на стадии 4.
Пример 49
(R)-4-Диметиламино-3-(9-пиридин-3-илнонаноиламино)масляная кислота
Указанное в заголовке соединение, m/e 362,3 ([М-Н]-), получали аналогично тому, как описано в примере 1, стадии 3 и 4. 3-Пиридиннонановую кислоту (US No. 4632925) конденсировали на стадии 3 с дигидрохлоридом бензилового эфира (R)-3-амино-4-диметиламиномасляной кислоты, при этом получали бензиловый эфир (R)-4-диметиламино-3-(9-пиридин-3-илнонаноиламино)масляной кислоты, который гидрировали на стадии 4.
Пример 50
(R)-4-Диметиламино-3-(11-фенилундеканоиламино)масляная кислота
Указанное в заголовке соединение, m/e 391,5 ([М+Н]+), получали аналогично тому, как описано в примере 1, стадии 3 и 4. Коммерческую 11-фенилундекановую кислоту конденсировали на стадии 3 с дигидрохлоридом бензилового эфира (R)-3-амино-4-диметиламиномасляной кислоты, при этом получали бензиловый эфир (R)-4-диметиламино-3-(11-фенилундеканоиламино)масляной кислоты, который гидрировали на стадии 4.
Пример 51
(R)-4-Диметиламино-3-(12-фенилдодеканоиламино)масляная кислота
Указанное в заголовке соединение, m/e 403,6 ([М-Н]-), получали аналогично тому, как описано в примере 1, стадии 3 и 4. Коммерческую 12-фенилдодекановую кислоту конденсировали на стадии 3 с дигидрохлоридом бензилового эфира (R)-3-амино-4-диметиламиномасляной кислоты, при этом получали бензиловый эфир (R)-4-диметиламино-3-(12-фенилдодеканоиламино)масляной кислоты, который гидрировали на стадии 4.
Пример 52
(R)-4-Диметиламино-3-[4-(5-фенилпентилокси)бутириламино]масляная кислота
Стадия 1
Гидрид натрия (60% дисперсия в минеральном масле, 228 мг, 5,7 ммоля) добавляли в раствор 4-гидроксибутирата натрия (600 мг, 4,76 ммоля) в N,N-диметилформамиде (5 мл). Реакционную смесь нагревали при 60°С в течение 1 ч, затем добавляли (5-бромпентил)бензол (1,15 г, 5,08 ммоля) и через 3 недели добавляли 1 М водный раствор соляной кислоты, реакционную смесь упаривали. После проведения хроматографии (SiO2, элюент: градиент гептан/этилацетат) получали 4-(5-фенилпентилокси)масляную кислоту (32 мг, 3%) в виде бесцветного масла.
Стадия 2
После амидоконденсации 4-(5-фенилпентилокси)масляной кислоты с дигидрохлоридом бензилового эфира (R)-3-амино-4-диметиламиномасляной кислоты аналогично тому, как описано в примере 1, стадия 3, получали бензиловый эфир (R)-4-диметиламино-3-[4-(5-фенилпентилокси)бутириламино]масляной кислоты.
Стадия 3
После гидрирования бензилового эфира (R)-4-диметиламино-3-[4-(5-фенилпентилокси)бутириламино]масляной кислоты аналогично тому, как описано в примере 1, стадия 4, получали (R)-4-диметиламино-3-[9-(2-фторфенокси)нонаноиламино]масляную кислоту в виде твердого вещества белого цвета, m/e 379,5 ([М+Н]+).
Пример 53
(R)-4-Диметиламино-3-[6-(3-фенилпропокси)гексаноиламино]масляная кислота
Указанное в заголовке соединение, m/e 379,4 ([М+Н]+), получали аналогично тому, как описано в примере 1, стадии 1-4. 1,6-Гександиол алкилировали на стадии 1 в присутствии 1-бром-3-фенилпропана, при этом получали 6-(3-фенилпропокси)гексан-1-ол, который окисляли на стадии 2, при этом получали 6-(3-фенилпропокси)гексановую кислоту. Указанное соединение конденсировали на стадии 3 с дигидрохлоридом бензилового эфира (R)-3-амино-4-диметиламиномасляной кислоты, при этом получали бензиловый эфир (R)-4-диметиламино-3-[6-(3-фенилпропокси)гексаноиламино]масляной кислоты, который гидрировали на стадии 4.
Пример 54
(R)-4-Диметиламино-3-(9-фенетилоксинонаноиламино)масляная кислота
Стадия 1
Раствор 9-бром-1-нонанола (2,00 г, 8,96 ммоля), 3,4-дигидро-2Н-пирана (792 мг, 9,41 ммоля) и пиридинийтолуол-4-сульфоната (1,08 г, 4,30 ммоля) в дихлорметане (34 мл) перемешивали при КТ в течение 16 ч, затем промывали 2 М водным раствором карбоната натрия и солевым раствором, сушили над сульфатом магния, фильтровали и упаривали. После проведения хроматографии (SiO2, элюент: градиент гептан/этилацетат) получали 2-(9-бромнонилокси)тетрагидропиран (2,45 г, 89%) в виде бесцветного масла, m/e 324,1 ([М+NH4]+).
Стадия 2
Гидрид натрия (60% дисперсия в минеральном масле, 264 мг, 6,6 ммоля) добавляли при 0°С в раствор 2-фенилэтанола (807 мг, 6,61 ммоля) в тетрагидрофуране (8,6 мл) и N,N-диметилформамиде (3,4 мл), затем через 1 ч по каплям добавляли раствор 2-(9-бромнонилокси)тетрагидропирана (2,44 г, 7,93 ммоля) в N,N-диметилформамиде (1,5 мл). Раствор выдерживали при КТ в течение 16 ч, затем распределяли между водой и этилацетатом. Органический слой промывали солевым раствором, сушили над сульфатом натрия, фильтровали и упаривали. После проведения хроматографии (SiO2, элюент: градиент гептан/этилацетат) получали 2-(9-фенетилоксинонилокси)тетрагидропиран (898 мг, 39%) в виде бесцветного масла, m/e 366,2 ([M+NH4]+).
Стадия 3
Раствор 2-(9-фенетилоксинонилокси)тетрагидропирана (890 мг, 2,55 ммоля) в смеси уксусная кислота/тетрагидрофуран/вода, 4:2:1 (23 мл) перемешивали при 45°С в течение 4 ч. После упаривания остаток очищали хроматографией (SiO2, элюент: градиент гептан/этилацетат), при этом получали 9-фенетилоксинонан-1-ол (513 мг, 76%) в виде бесцветного масла, m/e 265,3 ([М+Н]+).
Стадия 4
После окисления 9-фенетилоксинонан-1-ола аналогично тому, как описано в примере 1, стадия 2, получали 9-фенетилоксинонановую кислоту в виде твердого вещества белого цвета, m/e 277,4 ([М-Н]-).
Стадия 5
После амидоконденсации 9-фенетилоксинонановой кислоты с дигидрохлоридом бензилового эфира (R)-3-амино-4-диметиламиномасляной кислоты аналогично тому, как описано в примере 1, стадия 3, при этом получали бензиловый эфир (R)-4-диметиламино-3-(9-фенетилоксинонаноиламино)масляной кислоты в виде масла светло-желтого цвета, m/e 497,5 ([М+Н]+).
Стадия 6
После гидрирования бензилового эфира (R)-4-диметиламино-3-(9-фенетилоксинонаноиламино)масляной кислоты аналогично тому, как описано в примере 1, стадия 4, получали (R)-4-диметиламино-3-[9-(2-фторфенокси)нонаноиламино]масляную кислоту в виде твердого вещества белого цвета, m/e 405,6 ([М-Н]-).
Пример 55
(R)-4-Диметиламино-3-[8-(3-фенилпропокси)октаноиламино]масляная кислота
Указанное в заголовке соединение, m/e 405,7 ([М-Н]-), получали аналогично тому, как описано в примере 54, стадии 1-6. 8-Бром-1-октанол защищали на стадии 1, при этом получали 2-(8-бромоктилокси)тетрагидропиран, который вводили в реакцию на стадии 2 с 3-феноксипропанолом, при этом получали 2-(8-(3-фенилпропокси)октилокси)тетрагидропиран, из которого после удаления защитной группы на стадии 3 получали 8-(3-фенилпропокси)октан-1-ол. Указанное соединение окисляли на стадии 4, при этом получали 8-(3-фенилпропокси)октановую кислоту, которую конденсировали на стадии 5 с дигидрохлоридом бензилового эфира (R)-3-амино-4-диметиламиномасляной кислоты, при этом получали бензиловый эфир (R)-4-диметиламино-3-[8-(3-фенилпропокси)октаноиламино]масляной кислоты, который гидрировали на стадии 6.
Пример 56
(R)-4-Диметиламино-3-[8-(2-феноксиэтокси)октаноиламино]масляная кислота
Указанное в заголовке соединение, m/e 407,6 ([М-Н]-), получали аналогично тому, как описано в примере 54, стадии 1-6. 8-Бром-1-октанол защищали на стадии 1, при этом получали 2-(8-бромоктилокси)тетрагидропиран, который вводили в реакцию на стадии 2 с 2-феноксиэтанолом, при этом получали 2-(8-(2-феноксиэтокси)октилокси)тетрагидропиран, из которого после удаления защитной группы на стадии 3 получали 8-(2-феноксиэтокси)октан-1-ол. Указанное соединение окисляли на стадии 4, при этом получали 8-(2-феноксиэтокси)октановую кислоту, которую конденсировали на стадии 5 с дигидрохлоридом бензилового эфира (R)-3-амино-4-диметиламиномасляной кислоты, при этом получали бензиловый эфир (R)-4-диметиламино-3-[8-(2-феноксиэтокси)октаноиламино]масляной кислоты, который гидрировали на стадии 6.
Пример 57
(R)-3-(10-Бензилоксидеканоиламино)-4-диметиламиномасляная кислота
Указанное в заголовке соединение, m/e 405,6 ([М-Н]-), получали аналогично тому, как описано в примере 1, стадии 1-4. 1,10-Декандиол алкилировали на стадии в присутствии 1 бензилбромида, при этом получали 10-бензилоксидекан-1-ол, который окисляли на стадии 2, при этом получали 10-бензилоксидекановую кислоту. Указанное соединение конденсировали на стадии 3 с дигидрохлоридом бензилового эфира (R)-3-амино-4-диметиламиномасляной кислоты, при этом получали бензиловый эфир (R)-3-(10-бензилоксидеканоиламино)-4-диметиламиномасляной кислоты, который гидрировали на стадии 4.
Пример 58
(R)-4-Диметиламино-3-[7-(2-фенилэтансульфонил)гептаноиламино]масляная кислота
Стадия 1
2-Фенилэтантиол алкилировали в присутствии 7-бром-1-гептанола, аналогично тому, как описано в примере 18, стадия 1, при этом получали 7-фенетилсульфанилгептан-1-ол.
Стадия 2
Oxone® (3,3 г, 5,5 ммоля) добавляли в раствор 7-фенетилсульфанилгептан-1-ола (930 мг, 3,68 ммоля) в метаноле (40 мл), затем через 16 ч нерастворенный материал отделяли фильтрованием и фильтрат упаривали, при этом получали 7-(2-фенилэтансульфонил)гептан-1-ол (1,6 г), который использовали на следующей стадии без дополнительной очистки.
Стадия 3
После окисления 7-(2-фенилэтансульфонил)гептан-1-ола, аналогично тому, как описано в примере 1, стадия 2, получали 7-(2-фенилэтансульфонил)гептановую кислоту.
Стадия 4
После амидоконденсации 7-(2-фенилэтансульфонил)гептановой кислоты с дигидрохлоридом бензилового эфира (R)-3-амино-4-диметиламиномасляной кислоты аналогично тому, как описано в примере 1, стадия 3, получали бензиловый эфир (R)-4-диметиламино-3-[7-(2-фенилэтансульфонил)гептаноиламино]масляной кислоты.
Стадия 5
После гидрирования бензилового эфира (R)-4-диметиалмино-3-[7-(2-фенилэтансульфонил)гептаноиламино]масляной кислоты аналогично тому, как описано в примере 1, стадия 4, получали (R)-4-диметиламино-3-[7-(2-фенилэтансульфонил)гептаноиламино]масляную кислоту в виде твердого вещества белого цвета, m/e 427,3 ([М+Н]+).
Пример 59
(R)-4-Диметиламино-3-(8-(фенилметансульфонил)октаноиламино)масляная кислота
Указанное в заголовке соединение, m/e 427,4 ([М+Н]+), получали аналогично тому, как описано в примере 59, стадии 1-5. Фенилметантиол алкилировали на стадии 1 в присутствии 8-бром-1-октанола, при этом получали 8-бензилсульфанилоктан-1-ол, который окисляли на стадии 2, при этом получали 8-фенилметансульфонилоктан-1-ол. Указанное соединение окисляли на стадии 3, при этом получали 8-фенилметансульфонилоктановую кислоту, которую конденсировали на стадии 4 с дигидрохлоридом бензилового эфира (R)-3-амино-4-диметиламиномасляной кислоты, при этом получали бензиловый эфир (R)-4-диметиламино-3-(8-(фенилметансульфонил)октаноиламино)масляной кислоты, который гидрировали на стадии 5.
Пример 60
(R)-3-(9-Бензолсульфонилнонаноиламино)-4-диметиламиномасляная кислота
Указанное в заголовке соединение, m/e 427,5 ([М+Н]+), получали аналогично тому, как описано в примере 18, стадии 1-4. Натриевую соль бензолсульфиновой кислоты алкилировали на стадии 1 в присутствии 9-бром-1-нонанола, при этом получали 9-бензолсульфонилнонан-1-ол, который окисляли на стадии 2, при этом получали 9-бензолсульфонилнонановую кислоту. Указанное соединение конденсировали на стадии 3 с дигидрохлоридом бензилового эфира (R)-3-амино-4-диметиламиномасляной кислоты, при этом получали бензиловый эфир (R)-3-(9-бензолсульфонилнонаноиламино)-4-диметиламиномасляной кислоты, который гидрировали на стадии 4.
Пример 61
(R)-3-{7-[2-(2,3-Дифторфенил)этокси]гептаноиламино}-4-диметиламиномасляная кислота
Указанное в заголовке соединение, m/e 413,5 ([М-Н]-), получали аналогично тому, как описано в примере 54, стадии 1-6. 7-Бром-1-гептанол защищали на стадии 1, при этом получали 2-(7-бромгептилокси)тетрагидропиран, который вводили в реакцию на стадии 2 с 2-(2,3-дифторфенокси)этанолом, при этом получали 2-(7-[2-(2,3-дифторфенил)этокси]гептилокси)тетрагидропиран, из которого после удаления защитной группы на стадии 3 получали 7-[2-(2,3-дифторфенил)этокси]гептан-1-ол. Указанное соединение окисляли на стадии 4, при этом получали 7-[2-(2,3-дифторфенил)этокси]гептановую кислоту, которую конденсировали на стадии 5 с дигидрохлоридом бензилового эфира (R)-3-амино-4-диметиламиномасляной кислоты, при этом получали бензиловый эфир (R)-3-{7-[2-(2,3-дифторфенил)этокси]гептаноиламино}-4-диметиламиномасляной кислоты, который гидрировали на стадии 6.
Пример 62
(R)-3-{3-[6-(2,3-Дифторбензилокси)гексил]уреидо}-4-диметиламиномасляная кислота
Стадия 1
Этилхлорформиат (414 мг, 3,82 ммоля) добавляли при 0°С в раствор 7-[2-(2,3-дифторфенил)этокси]гептановой кислоты (800 мг, 2,94 ммоля) и триэтиламина (387 мг, 3,82 ммоля) в дихлорметане (15 мл), затем через 2 ч летучие соединения удаляли при перегонке, при этом получали 7-[2-(2,3-дифторфенил)этокси]гептаноил хлорид (855 мг). Указанное соединение снова растворяли в ацетоне (2 мл) и обрабатывали при 0°С раствором азида натрия (268 мг, 4,12 ммоля) в воде (4 мл) при интенсивном перемешивании. Реакционную смесь перемешивали в течение еще 1 ч при 10°С, затем распределяли между толуолом и водой. Органический слой отделяли и нагревали при 65°С в течение 90 мин, затем концентрировали в вакууме, при этом получали [6-(2,3-дифторбензилокси)гексил]изоцианат (486 мг, 61%) в виде масла желтого цвета.
Стадия 2
Раствор [6-(2,3-дифторбензилокси)гексил]изоцианата (224 мг, 0,83 ммоля) в дихлорметане (1 мл) добавляли при 0°С в суспензию дигидрохлорида бензилового эфира (R)-3-амино-4-диметиламиномасляной кислоты (255 мг, 0,83 ммоля) в дихлорметане (4 мл), затем по каплям в течение 25 мин добавляли раствор триэтиламина (167 мг, 1,65 ммоля) в дихлорметане (1 мл). Реакционную смесь выдерживали при <5°С в течение 1 ч, затем нагревали до комнатной температуры в течение 1 ч. Нерастворимые соединения отделяли фильтрованием и фильтрат упаривали. Остаток очищали с помощью ЖХВР, при этом получали бензиловый эфир (R)-3-{3-[6-(2,3-дифторбензилокси)гексил]уреидо}-4-диметиламиномасляной кислоты (56 мг, 13%) в виде бесцветного масла.
Стадия 3
После гидрирования бензилового эфира (R)-3-{3-[6-(2,3-дифторбензилокси)гексил]уреидо}-4-диметиламиномасляной кислоты аналогично тому, как описано в примере 1, стадия 4, получали (R)-3-{3-[6-(2,3-дифторбензилокси)гексил]уреидо}-4-диметиламиномасляную кислоту в виде бесцветного масла, m/e 414,4 ([М+Н]+).
Пример 63
(R)-4-Диметиламино-3-[3-(9-фенилнонил)уреидо]масляная кислота
Указанное а заголовке соединение, m/e 392,4 ([М+Н]+), получали аналогично тому, как описано в примере 62, стадии 1-3. 10-Фенилдекановую кислоту на стадии 1 превращали в 9-фенилнонилизоцианат. Указанное соединение конденсировали на стадии 2 с дигидрохлоридом бензилового эфира (R)-3-амино-4-диметиламиномасляной кислоты, при этом получали бензиловый эфир (R)-4-диметиламино-3-[3-(9-фенилнонил)уреидо]масляной кислоты, который гидрировали на стадии 3.
Пример 64
(R)-4-Диметиламино-3-[9-(метилфенетиламино)нонаноиламино]масляная кислота
Стадия 1
В раствор метилового эфира 9-оксононановой кислоты (J. Org. Chem., 72, с.9471 (2007), 303 мг, 1,63 ммоля) и N-метил-2-фенилэтиламина (220 мг, 1,63 ммоля) в метаноле (10 мл) добавляли при КТ концентрированную серную кислоту (5 капель), затем через 40 ч раствор кипятили с обратным холодильником в течение 2 ч. После охлаждения добавляли боргидрид натрия (123 мг, 3,25 ммоля), затем через 1 ч реакционную смесь распределяли между водой и дихлорметаном. Органический слой сушили над сульфатом натрия, фильтровали и упаривали, при этом получали метиловый эфир 9-(метилфенетиламино)нонановой кислоты в виде жидкости светло-желтого цвета.
Стадия 2
Метиловый эфир 9-(метилфенетиламино)нонановой кислоты гидролизовали аналогично тому, как описано в примере 35, стадия 2, при этом получали 9-(метилфенетиламино)нонановую кислоту.
Стадия 3
После амидоконденсации 9-(метилфенетиламино)нонановой кислоты с дигидрохлоридом бензилового эфира (R)-3-амино-4-диметиламиномасляной кислоты аналогично тому, как описано в примере 1, стадия 3, получали бензиловый эфир (R)-4-диметиламино-3-[9-(метилфенетиламино)нонаноиламино]масляной кислоты.
Стадия 4
После гидрирования бензилового эфира (R)-4-диметиламино-3-[9-(метилфенетиламино)нонаноиламино]масляной кислоты аналогично тому, как описано в примере 1, стадия 4, получали (R)-4-диметиламино-3-[9-(метилфенетиламино)нонаноиламино]масляную кислоту в виде бесцветной жидкости, m/e 420,3 ([М+Н]+).
Пример 65
(R)-4-Диметиламино-3-(9-фенетиламинононаноиламино)масляная кислота
Указанное в заголовке соединение, m/e 406,6 ([М+Н]+), получали аналогично тому, как описано в примере 64, стадии 1-4. Метиловый эфир 9-оксононановой кислоты вводили в реакцию на стадии 1 с N-бензил-2-фенилэтиламином, при этом получали метиловый эфир 9-(бензилфенетиламино)нонановой кислоты, который гидролизовали на стадии 2, при этом получали 9-(бензилфенетиламино)нонановую кислоту. Указанное соединение конденсировали на стадии 3 с дигидрохлоридом бензилового эфира (R)-3-амино-4-диметиламиномасляной кислоты, при этом получали бензиловый эфир (R)-3-[9-(бензилфенетиламино)нонаноиламино]-4-диметиламиномасляной кислоты, который гидрировали на стадии 4.
Пример 66
(R)-4-Диметиламино-3-[9-(метилфениламино)нонаноиламино]масляная кислота
Стадия 1
Монометиловый эфир азелаиновой кислоты конденсировали с N-метиланилином аналогично тому, как описано в примере 1, стадия 3, при этом получали метиловый эфир 8-(метилфенилкарбамоил)октановой кислоты.
Стади 2
Комплекс боран-тетрагидрофуран (1М в тетрагидрофуране, 3,09 мл, 3,09 ммоля) добавляли при 0°С в раствор метилового эфира 8-(метилфенилкарбамоил)октановой кислоты (300 мг, 1,03 ммоля) в тетрагидрофуране (20 мл). Реакционную смесь перемешивали при КТ в течение ночи, затем добавляли еще одну порцию комплекса боран-тетрагидрофуран (2,1 мл, 2,1 ммоля) и реакционную смесь перемешивали при КТ в течение 3,5 ч. Добавляли метанол (60 мл), затем концентрированную серную кислоту. Реакционную смесь кипятили с обратным холодильником при 80°С в течение 2 ч. После охлаждения до КТ добавляли насыщенный раствор карбоната натрия и реакционную смесь экстрагировали 3 раза дихлорметаном. Объединенные органические слои сушили над сульфатом натрия, фильтровали и растворитель удаляли в вакууме. Неочищенный продукт очищали хроматографией (SiO2, элюент: градиент гептан/этилацетат), при этом получали метиловый эфир 9-(метилфениламино)нонановой кислоты (89 мг, 31%).
Стадия 3
Метиловый эфир 9-(метилфениламино)нонановой кислоты гидролизовали аналогично тому, как описано в примере 35, стадия 2, при этом получали 9-(метилфениламино)нонановую кислоту.
Стадия 4
После амидоконденсации 9-(метилфениламино)нонановой кислоты с дигидрохлоридом бензилового эфира (R)-3-амино-4-диметиламиномасляной кислоты аналогично тому, как описано в примере 1, стадия 3, получали бензиловый эфир (R)-4-диметиламино-3-[9-(метилфениламино)нонаноиламино]масляной кислоты.
Стадия 5
После гидрирования бензилового эфира (R)-4-диметиламино-3-[9-(метилфениламино)нонаноиламино]масляной кислоты аналогично тому, как описано в примере 1, стадия 4, получали (R)-4-диметиламино-3-[9-(метилфенетиламино)нонаноиламино]масляную кислоту в виде твердого вещества белого цвета, m/e 392,3 ([М+Н]+).
Пример А
Таблетки с пленочным покрытием, содержащие следующие ингредиенты, получали по стандартной методике:
Активный ингредиент просеивали и смешивали с микрокристаллической целлюлозой, смесь гранулировали с раствором поливинилпирролидона в воде. Гранулят смешивали с натриевой солью гликолята крахмала и стеаратом магния, затем прессовали в ядра массой 120 или 350 мг, соответственно. На ядра наносили покрытия с использованием водного раствора/суспензии описанного выше пленочного покрытия.
Пример Б
Капсулы, содержащие следующие ингредиенты, получали по стандартной методике:
Компоненты просеивали, смешивали и полученной смесью заполняли капсулы размера 2.
Пример В
Получали растворы для инъекции следующего состава:
Активный ингредиент растворяли в смеси полиэтиленгликоля 400 и воды для инъекций (часть от общего количества). pH доводили до значения 5,0 уксусной кислотой. Объем доводили до 1,0 мл, добавляя остальное количество воды. Раствор фильтровали, заполняли им флаконы и стерилизовали.
Пример Г
Мягкие желатиновые капсулы, содержащие следующие ингредиенты, получали по стандартной методике:
Содержимое капсулы
Желатиновая капсула
Содержимое капсулы
Активный ингредиент растворяли в теплом расплаве остальных ингредиентов и полученной смесью заполняли мягкие желатиновые капсулы пригодного размера. Заполненные желатиновые капсулы обрабатывали по стандартной методике.
Пример Д
Пакетики, содержащие следующие ингредиенты, получали по стандартной методике:
Активный ингредиент смешивали с лактозой, микрокристаллической целлюлозой и натриевой солью карбоксиметилцеллюлозы и смесь гранулировали в смеси поливинилпирролидона с водой. Гранулят смешивали со стеаратом магния и ароматизаторами, полученной смесью заполняли пакетики.
| название | год | авторы | номер документа |
|---|---|---|---|
| 4-ТРИМЕТИЛАММОНИОБУТИРАТЫ В КАЧЕСТВЕ ИНГИБИТОРОВ СРТ2 | 2009 |
|
RU2502727C2 |
| ДВАЖДЫ АЦИЛИРОВАННЫЕ ПРОИЗВОДНЫЕ GLP-1 | 2010 |
|
RU2559540C2 |
| НОВЫЕ БИЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ В КАЧЕСТВЕ ДВОЙНЫХ ИНГИБИТОРОВ АУТОТАКСИНА (ATX)/КАРБОАНГИДРАЗЫ (CA) | 2016 |
|
RU2725138C2 |
| ПРОИЗВОДНЫЕ ТЕТРАГИДРОПИРАНА ПРОТИВ НЕВРОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ | 2011 |
|
RU2554344C2 |
| АРОИЛАМИНО- И ГЕТЕРОАРОИЛАМИНО-ЗАМЕЩЕННЫЕ ПИПЕРИДИНЫ В КАЧЕСТВЕ ИНГИБИТОРОВ GLYT-1 | 2010 |
|
RU2517701C2 |
| ПИРИМИДИНОВЫЕ ПРОИЗВОДНЫЕ, ОБЛАДАЮЩИЕ АКТИВНОСТЬЮ В ОТНОШЕНИИ МСН | 2005 |
|
RU2373197C2 |
| НОВОЕ ТРИЦИКЛИЧЕСКОЕ ПРОИЗВОДНОЕ ИЛИ ЕГО ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ, СПОСОБ ИХ ПОЛУЧЕНИЯ И СОДЕРЖАЩАЯ ИХ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 2009 |
|
RU2470934C1 |
| ЦИКЛИЧЕСКИЕ АЗАИНДОЛ-3-КАРБОКСАМИДЫ, ИХ ПОЛУЧЕНИЕ И ПРИМЕНЕНИЕ В КАЧЕСТВЕ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ | 2009 |
|
RU2487874C2 |
| СОЕДИНЕНИЯ ДЛЯ ЛЕЧЕНИЯ МЕТАБОЛИЧЕСКИХ ЗАБОЛЕВАНИЙ | 2008 |
|
RU2502723C2 |
| СОЕДИНЕНИЯ ДЛЯ ЛЕЧЕНИЯ МЕТАБОЛИЧЕСКИХ ЗАБОЛЕВАНИЙ | 2002 |
|
RU2341513C2 |
Предложены новые производные 4-диметиламиномасляной кислоты формулы (I) (и их фармацевтически приемлемые соли), где значения А1, А2, R1, m и n определены в формуле изобретения, ингибирующие активность карнитинпальмитоилтрансферазы (СРТ), а конкретнее СРТ2. Указанные соединения являются активным началом фармацевтических композиций, обладающих ингибирующей активностью по отношению к СРТ2. 2 н. и 14 з.п. ф-лы, 71 пр., 1 табл.

1. Соединения формулы

где А1 обозначает NH или связь,
А2 выбран из группы, включающей связь, О, O(CH2)2O, CF2;
m выбран из 6, 7, 8, 9, 10 и 11,
n выбран из 0, 1, 2 и 3,
R1 обозначает арил, который выбран из фенила и нафтила, причем указанный арил является незамещенным или замещенным одной, двумя, тремя, четырьмя или пятью группами, выбранными из группы, включающей C1-7-алкил, галоген, галоген-С1-7-алкил, С1-7-алкоксигруппу и фенил, или
гетероарил, который выбран из группы, состоящей из пиридила, тиенила и тиазолила, причем указанный гетероарил является незамещенным, и их фармацевтически приемлемые соли.
2. Соединения формулы I по п.1, где A1 обозначает связь.
3. Соединения формулы I по п.1, где А2 выбран из группы, включающей связь, О и O(СН2)2O.
4. Соединения формулы I по п.1, где А2 обозначает О или O(CH2)2O.
5. Соединения формулы I по п.1, где А2 обозначает связь.
6. Соединения формулы I по п.1, где n равен 0 или 1.
7. Соединения формулы I по п.1, где R1 обозначает арил, который выбран из фенила и нафтила, причем указанный арил является незамещенным или замещенным одной, двумя, тремя, четырьмя или пятью группами, выбранными из группы, включающей C1-7-алкил, галоген, галоген-С1-7-алкил, C1-7-алкоксигруппу и фенил.
8. Соединения формулы I по п.1, где R1 обозначает фенил, замещенный одной, двумя, тремя, четырьмя или пятью группами, выбранными из группы, включающей С1-7-алкил, галоген, галоген-С1-7-алкил, C1-7-алкоксигруппу и фенил, при условии что по крайней мере один из заместителей обозначает галоген или галоген-С1-7-алкил.
9. Соединения формулы I по п.1, где R1 обозначает гетероарил, который выбран из группы, состоящей из пиридила, тиенила и тиазолила, причем указанный гетероарил является незамещенным.
10. Соединения формулы I по п.1 формулы
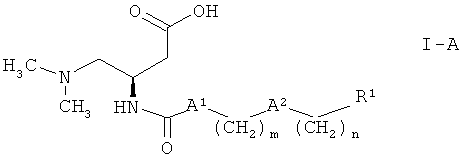 .
.
11. Соединения формулы I по п.1, выбранные из группы, включающей следующие соединения:
(R)-3-[8-(3,4-дифторбензилокси)октаноиламино]-4-диметиламиномасляная кислота,
(R)-3-[8-(2,5-дифторбензилокси)октаноиламино]-4-диметиламиномасляная кислота,
(R)-3-[8-(2,4-дифторбензилокси)октаноиламино]-4-диметиламиномасляная кислота,
(R)-4-диметиламино-3-[8-(2,3,4-трифторбензилокси)октаноиламино]масляная кислота,
(R)-4-диметиламино-3-(8-пентафторфенилметоксиоктаноиламино)масляная кислота,
(R)-4-диметиламино-3-[8-(4-трифторметилбензилокси)октаноиламино]масляная кислота,
(R)-4-диметиламино-3-[8-(3-фтор-4-трифторметилбензилокси)октаноиламино]масляная кислота,
(R)-4-диметиламино-3-[8-(4-метоксибензилокси)октаноиламино]масляная кислота,
(R)-3-[8-(бифенил-4-илметокси)октаноиламино]-4-диметиламиномасляная кислота,
(R)-4-диметиламино-3-[8-(2-фтор-4-трифторметилбензилокси)октаноиламино]масляная кислота,
(R)-4-диметиламино-3-[8-(2,3,5,6-тетрафтор-4-метоксибензилокси)октаноиламино]масляная кислота,
(R)-4-диметиламино-3-[8-(нафталин-1-илметокси)октаноиламино]масляная кислота,
(R)-4-диметиламино-3-[8-(2-фторбензилокси)октаноиламино]масляная кислота,
(R)-4-диметиламино-3-[8-(3-фторбензилокси)октаноиламино]масляная кислота,
(R)-4-диметиламино-3-[8-(4-фторбензилокси)октаноиламино]масляная кислота,
(R)-3-[8-(2,3-дифторбензилокси)октаноиламино]-4-диметиламиномасляная кислота,
(R)-3-(8-бензилоксиоктаноиламино)-4-диметиламиномасляная кислота,
(R)-4-диметиламино-3-[9-(2-фторфенокси)нонаноиламино]масляная кислота,
(R)-4-диметиламино-3-[9-(3-фторфенокси)нонаноиламино]масляная кислота,
(R)-4-диметиламино-3-[9-(4-фторфенокси)нонаноиламино]масляная кислота,
(R)-3-[9-(2,3-дифторфенокси)нонаноиламино]-4-диметиламиномасляная кислота,
(R)-3-[9-(2,4-дифторфенокси)нонаноиламино]-4-диметиламиномасляная кислота,
(R)-3-[9-(3,4-дифторфенокси)нонаноиламино]-4-диметиламиномасляная кислота,
(R)-4-диметиламино-3-[9-(2,3,4-трифторфенокси)нонаноиламино]масляная кислота,
(R)-3-[9-(бифенил-4-илокси)нонаноиламино]-4-диметиламиномасляная кислота,
(R)-3-[9-(3,4-диметоксифенокси)нонаноиламино]-4-диметиламино масляная кислота,
(R)-4-диметиламино-3-[9-(4-трифторметилфенокси)нонаноиламино]масляная кислота,
(R)-4-диметиламино-3-[9-(4-метоксифенокси)нонаноиламино]масляная кислота,
(R)-4-диметиламино-3-[9-(нафталин-1-илокси)нонаноиламино]масляная кислота,
(R)-4-диметиламино-3-(11-феноксиундеканоиламино)масляная кислота,
(R)-4-диметиламино-3-(9-феноксинонаноиламино)масляная кислота,
(R)-4-диметиламино-3-(10-фенилдеканоиламино)масляная кислота,
(S)-4-диметиламино-3-(10-фенилдеканоиламино)масляная кислота,
(R)-4-диметиламино-3-[10-(4-фторфенил)деканоиламино]масляная кислота,
(R)-4-диметиламино-3-[10-(2-фторфенил)деканоиламино]масляная кислота,
(R)-4-диметиламино-3-[10-(2,5-диметилфенил)деканоиламино]масляная кислота,
(R)-4-диметиламино-3-[10-(2,6-диметилфенил)деканоиламино]масляная кислота,
(R)-4-диметиламино-3-[10-(4-метоксифенил)деканоиламино]масляная кислота,
(R)-4-диметиламино-3-(10-нафталин-1-илдеканоиламино)масляная кислота,
(R)-4-диметиламино-3-[10-(4-трифторметилфенил)деканоиламино]масляная кислота,
(R)-4-диметиламино-3-[10-(3-фторфенил)деканоиламино]масляная кислота,
(R)-3-[10-(2,3-дифторфенил)деканоиламино]-4-диметиламиномасляная кислота,
(R)-4-диметиламино-3-(10-тиофен-3-илдеканоиламино)масляная кислота,
(R)-4-диметиламино-3-(10-тиазол-5-илдеканоиламино)масляная кислота,
(R)-4-диметиламино-3-(6-фенилгексаноиламино)масляная кислота,
(R)-4-диметиламино-3-(7-фенилгептаноиламино)масляная кислота,
(R)-4-диметиламино-3-(8-фенилоктаноиламино)масляная кислота,
(R)-4-диметиламино-3-(9-фенилнонаноиламино)масляная кислота,
(R)-4-диметиламино-3-(9-пиридин-3-илнонаноиламино)масляная кислота,
(R)-4-диметиламино-3-(11-фенилундеканоиламино)масляная кислота,
(R)-4-диметиламино-3-(12-фенилдодеканоиламино)масляная кислота,
(R)-4-диметиламино-3-[4-(5-фенилпентилокси)бутириламино]масляная кислота,
(R)-4-диметиламино-3-[6-(3-фенилпропокси)гексаноиламино]масляная кислота,
(R)-4-диметиламино-3-(9-фенетилоксинонаноиламино)масляная кислота,
(R)-4-диметиламино-3-[8-(3-фенилпропокси)октаноиламино]масляная кислота,
(R)-4-диметиламино-3-[8-(2-феноксиэтокси)октаноиламино]масляная кислота,
(R)-3-(10-бензилоксидеканоиламино)-4-диметиламиномасляная кислота,
(R)-4-диметиламино-3-[7-(2-фенилэтансульфонил)гептаноиламино] масляная кислота,
(R)-4-диметиламино-3-(8-(фенилметансульфонил)октаноиламино)масляная кислота,
(R)-3-(9-бензолсульфонилнонаноиламино)-4-диметиламиномасляная кислота,
(R)-3-{7-[2-(2,3-дифторфенил)этокси]гептаноиламино}-4-диметиламино масляная кислота,
(R)-3-{3-[6-(2,3-дифторбензилокси)гексил]уреидо}-4-диметиламино масляная кислота,
(R)-4-диметиламино-3-[3-(9-фенилнонил)уреидо]масляная кислота, (R)-4-диметиламино-3-[9-(метилфенетиламино)нонаноиламино]масляная кислота,
(R)-4-диметиламино-3-(9-фенетиламинононаноиламино)масляная кислота,
(R)-4-диметиламино-3-[9-(метилфениламино)нонаноиламино]масляная кислота, и их фармацевтически приемлемые соли.
12. Соединения формулы I по п.1, выбранные из группы, включающей следующие соединения:
(R)-4-диметиламино-3-[8-(4-трифторметилбензилокси)октаноиламино]масляная кислота,
(R)-3-[8-(бифенил-4-илметокси)октаноиламино]-4-диметил аминомасляная кислота,
(R)-4-диметиламино-3-[9-(3-фторфенокси)нонаноиламино]масляная кислота,
(R)-4-диметиламино-3-[9-(4-фторфенокси)нонаноиламино]масляная кислота,
(R)-3-[9-(3,4-дифторфенокси)нонаноиламино]-4-диметиламиномасляная кислота,
(R)-4-диметиламино-3-[9-(2,3,4-трифторфенокси)нонаноиламино]масляная кислота,
(R)-4-диметиламино-3-[9-(нафталин-1-илокси)нонаноиламино]масляная кислота,
(R)-4-диметиламино-3-(10-фенилдеканоиламино)масляная кислота,
(R)-4-диметиламино-3-[10-(2-фторфенил)деканоиламино]масляная кислота,
(R)-4-диметиламино-3-(10-нафталин-1-илдеканоиламино)масляная кислота,
(R)-4-диметиламино-3-[10-(4-трифторметилфенил)деканоиламино]масляная кислота,
(R)-3-[10-(2,3-дифторфенил)деканоиламино]-4-диметиламиномасляная кислота,
(R)-4-диметиламино-3-(10-тиофен-3-илдеканоиламино)масляная кислота,
(R)-4-диметиламино-3-(9-фенетилоксинонаноиламино)масляная кислота,
(R)-4-диметиламино-3-[8-(2-феноксиэтокси)октаноиламино]масляная кислота,
и их фармацевтически приемлемые соли.
13. Соединение формулы I по п.1, которое представляет собой (R)-4-диметиламино-3-(10-фенилдеканоиламино)масляную кислоту.
14. Фармацевтические композиции, обладающие ингибирующей активностью по отношению к СРТ2, содержащие соединение формулы I по п.1 и фармацевтически приемлемый носитель и/или адьювант.
15. Соединения формулы I по п.1, обладающие ингибирующей активностью по отношению к СРТ2, для применения в качестве терапевтически активных веществ.
16. Соединения формулы I по п.1 для применения в качестве терапевтически активных веществ, предназначенных для лечения или профилактики заболеваний, модулируемых ингибиторами СРТ2.
| Прибор, замыкающий сигнальную цепь при повышении температуры | 1918 |
|
SU99A1 |
| ОМЕГА-АМИНОАЛКИЛАМИДЫ R-2-АРИЛПРОПИОНОВЫХ КИСЛОТ В КАЧЕСТВЕ ИНГИБИТОРОВ ХЕМОТАКСИСА ПОЛИМОРФНОЯДЕРНЫХ И ОДНОЯДЕРНЫХ КЛЕТОК, СПОСОБ ИХ ПОЛУЧЕНИЯ И ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ИХ ОСНОВЕ | 2002 |
|
RU2272024C2 |
| ФЕНИЛСОДЕРЖАЩИЕ N-АЦИЛЬНЫЕ ПРОИЗВОДНЫЕ АМИНОВ, СПОСОБ ИХ ПОЛУЧЕНИЯ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ПРОТИВОВОСПАЛИТЕЛЬНЫХ И АНАЛЬГЕТИЧЕСКИХ СРЕДСТВ | 2005 |
|
RU2309144C2 |
| EA 200701868 A1, 28.02.2008. | |||
Авторы
Даты
2013-02-10—Публикация
2009-04-20—Подача