Область, к которой относится изобретение
Настоящее изобретение относится к фармацевтическим применениям ланоста-8,24-диен-3-олов, семейства тетрациклических терпенолов, в качестве противовоспалительных, антиканцерогенных и/или анальгетических средств посредством ингибирования определенных ферментов, активность которых связана с пролиферацией определенных типов рака.
В следующем контексте часто будет упоминаться соединение эуфол, член семейства ланоста-8,24-диен-3-олов, и следует понимать, что это делается просто для облегчения ссылки, и ни одно другое соединение ланоста-8,24-диен-3-ола не исключается по этой причине из изобретения.
Предпосылки изобретения
Рак представляет собой название, присвоенное группе из более чем 100 заболеваний, которые имеют общие признаки, заключающиеся в дезорганизованном росте клеток, которые внедряются в ткани и органы и которые могут распространяться в другие области организма, что известно как метастазирование.
Различные типы рака соответствуют различным типам клеток организма. Например, существуют несколько типов рака кожи, поскольку кожа сформирована более чем одним типом клеток. Если рак начинается в эпителиальных тканях, таких как кожа или слизистая оболочка, то он называется карциномой. Если он начинается в конъюнктивальных тканях, таких как костная, мышечная или хрящевая ткань, то он называется саркомой. Другие характеристики, которые отличают один вид рака от другого, представляют собой скорость размножения клеток и их способность внедряться в другие ткани и органы, поблизости или вдали от участка их происхождения.
Протеинкиназы типа C (PKC) включают группу белковых киназ, функция и регуляция которых являются высоко консервативными. Киназы также называются фосфотрансферазами, и они фосфорилируют остатки серина и треонина из их субстратов и регулируют активность различных клеток, включая экспрессию генов, митоз, движение клеток, метаболизм и запрограммированную гибель клеток (апоптоз). PKC подвергаются фосфорилированию перед активацией, такой как процесс, происходящий во время перемещения ее цитозоля в плазматическую мембрану. Их активация и перемещение цитозоля в плазматическую мембрану происходят в ответ на транзиторное увеличение диацилглицерина (DAG), или на экзогенные агенты, известные как сложные форболовые эфиры, обычно присутствующие в растениях.
Семейство PKC включает 12 изоформ, разделенных на три подкатегории: обычную (cPKC, кальцийзависимую, и активируемую DAG и фосфатидилсерином), оригинальную (nPKC, кальцийнезависимую, но активируемую DAG и фосфатидилсерином) и атипичную (aPKC, кальцийнезависимую и активируемую фосфатидилсерином, но не DAG). Внутри одной клетки изоформы проявляют различия их распределения перед и после транслокации в клеточную мембрану, и данные литературы свидетельствуют о том, что функция каждой изоформы, связанной с определенной клеткой, может придаваться различиями субклеточной локализации PKC в цитоплазматических компартментах мембраны и ядра.
В последние годы несколько исследований показали связь между нарушением активации PKC и развитием патологических процессов, включая ревматоидный артрит, рассеянный склероз, колит и различные типы рака. Гипотеза о вовлечении PKC при раке в последнее время привлекла большое внимание, в частности, на основании данных о том, что эти ферменты представляют собой субстрат для естественных промотеров опухолей, сложных форболовых эфиров. Повышенная или сниженная активация протеинкиназ серина-треонина, включая PKC, или транскрипционных факторов, модулированная ими, может привести к дезорганизованному росту клеток, включая раковый процесс. В этом смысле, многие исследования показали, что после активации PKC возникает увеличение фосфорилирования транскрипционных факторов, среди которых имеются ядерный фактор Каппа B (NF-κB) и активаторный белок 1 (AP-I), которые в свою очередь модулируют экспрессию нескольких белков, важных для прогрессирования опухолей, включая циклооксигеназу-2 (COX-2). Таким образом, активация или блокада таких внутриклеточных путей, натуральные соединения могут вмешиваться в рост и пролиферацию патологических клеток.
Сложные форболовые эфиры получают из тетрациклических дитерпенов и представляются ограниченными семействами растений Euphorbiaceae и Thymelaceae. Такие соединения часто исследуются ввиду их особенного стимулирующего индукцию опухолей и провоспалительного действия. Молекулярные механизмы, которые регулируют стимулирующее индукцию опухолей действие сложных форболовых эфиров, отличаются от механизмов, которые запускают воспалительную активность. Представляется, что стимулирующее индукцию опухолей действие связано с их способностью замещать DAG при активации PKC, а также с их способностью стимулировать синтез РНК и ДНК белков, проявляя поведение митогенных агентов и стимулируя клеточный рост. Что касается провоспалительной активности, то сложные форболовые эфиры, мобилизуя фосфолипиды, освобождают арахидоновую кислоту и вызывают секрецию простагландинов, приводя к воспалительной реакции тканей. Местное нанесение сложных форболовых эфиров, в частности, TPA (тетрадеканоилфорбол-13-ацетат), внесло вклад в понимание молекулярных механизмов, связанных с воспалительными процессами и раком.
Некоторые ингибиторы PKC тестировались для лечения рака на различных фазах преклинических испытаний. Один из них представляет собой энзастаурин (LY317615), который проявляет важную активность при пероральном введении и эффективность на различных моделях рака in vitro и in vivo (Journal of Investigative Dermatology (2006) 126, 1641- 1647; Cancer Res (2005) 65:7462-7469; MoI Cancer Ther. (2006) 5:1783-1789).
Основной проблемой при противовоспалительном лечении заболеваний NSAID (нестероидными противовоспалительными лекарственными препаратами) и стероидными лекарственными препаратами (кортикоидами) являются побочные эффекты, вызванные ими, и их неполная эффективность. Наиболее часто отмечаемыми побочными эффектами являются: головная боль, боль в желудке, рвота, диарея, гастропатии, такие как язвенные поражения желудка и 12-перстной кишки. Кортикоиды могут вызвать повышение артериального давления, астению и миопатию, пептические язвы, петехии, эритему, угри, хроническую головню боль, гирсутизм, подавление роста у детей (при длительном лечении), аменорею, катаракту и глаукому, повышенный аппетит и прибавку массы тела, тошноту. NSAID, селективные модуляторы COX-2, также могут повысить риски тяжелых тромботических сердечно-сосудистых явлений, коронарного тромбоза и инсультов.
Что касается эффективного лечения рака, то трудность заключается в установлении различия между злокачественными и нормальными клетками организма. Они имеют одинаковое происхождение и очень похожи, что приводит к отсутствию распознавания роли иммунной системы при существующей угрозе развития рака. До настоящего времени, рак лечили путем хирургического вмешательства, химиотерапии, лучевой терапии и иммунотерапии (терапии моноклональными антителами). Выбор лечения зависит от локализации, степени опухоли и фазы заболевания, а также от общего состояния пациента. Полное удаление опухоли без повреждения остального организма является основной целью лечения, которая может иногда достигаться хирургическим вмешательством, но склонность заболевания к внедрению в прилегающие ткани или распространению на отдаленные участки (метастазированию) часто ограничивает его эффективность. Эффективность химиотерапии часто ограничивается токсичностью для других клеток организма, тогда как лучевая терапия может повредить здоровую ткань. При иммунотерапии, в раковых клетках развиваются механизмы избегания иммунологических реакций, феномен, известный как устойчивость к лечению.
Краткое описание чертежей
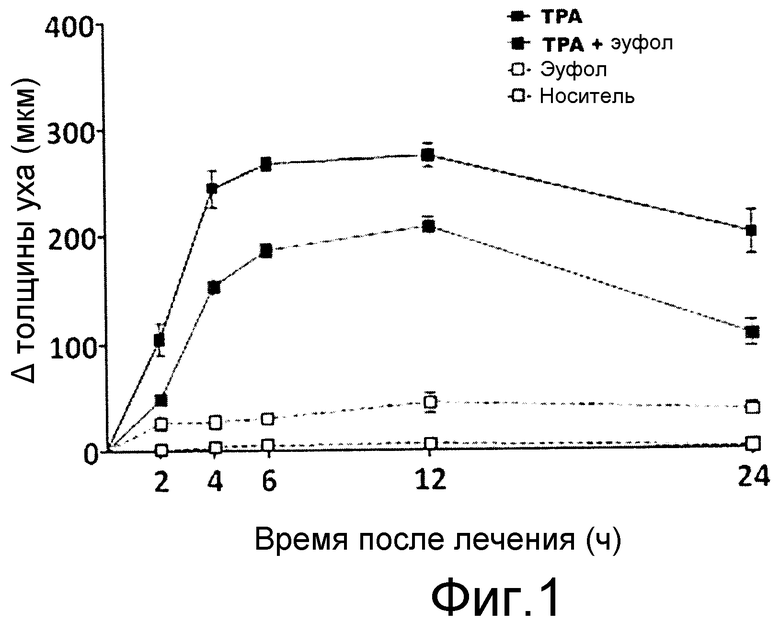
На фиг. 1 показано различие толщины ушей до и после нанесения тестированных соединений с течением времени.
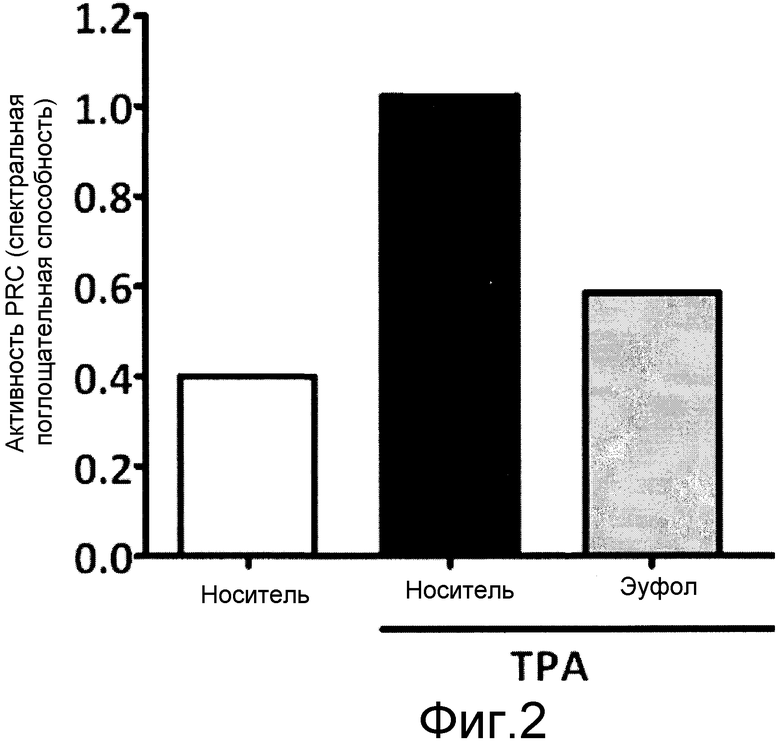
На фиг. 2 показана спектральная поглощательная способность трех тестированных соединений. Белый столбик: положительный контроль, а именно TPA (тетрадеканоилфорбол-13-ацетат), 2,5 мкг/ухо, в носителе, содержащем смесь 3:1 ацетона:этанола; четный столбик: отрицательный контроль, а именно носитель, который представляет собой смесь 3:1 ацетона:этанола; и серый столбик: смесь 100 мкг эуфола и 2,5 мкг TPA, на ухо, в носителе, содержащем смесь 3:1 ацетона:этанола.
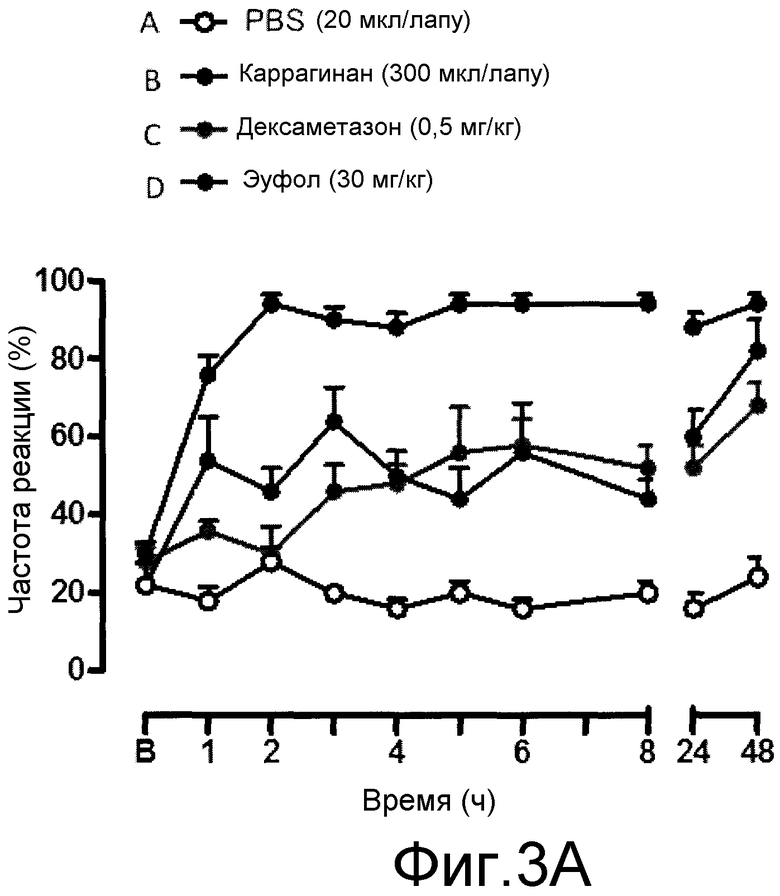
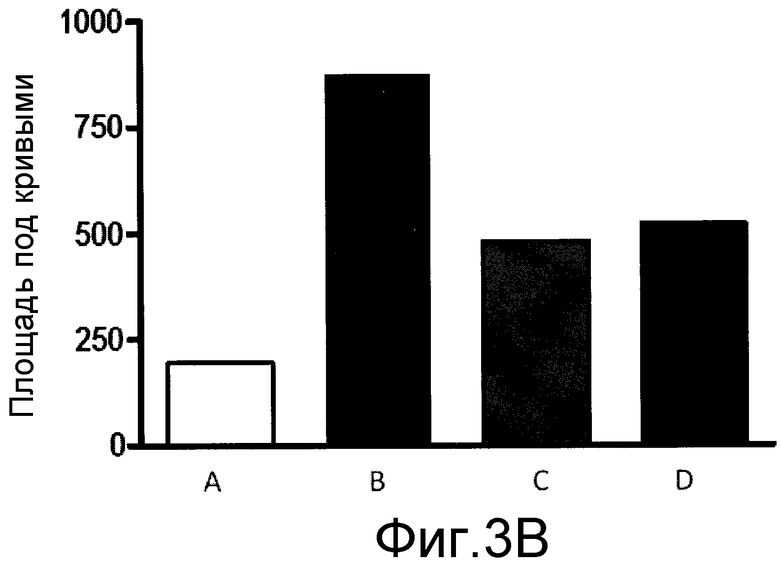
На фиг. 3A и 3B, причем фиг. 3A представляет собой динамику во времени частоты реакции, а фиг. 3B представляет площадь под кривой, показанной на фиг. 3A, для каждого тестированного соединения, что позволяет сравнивать их в процентах.
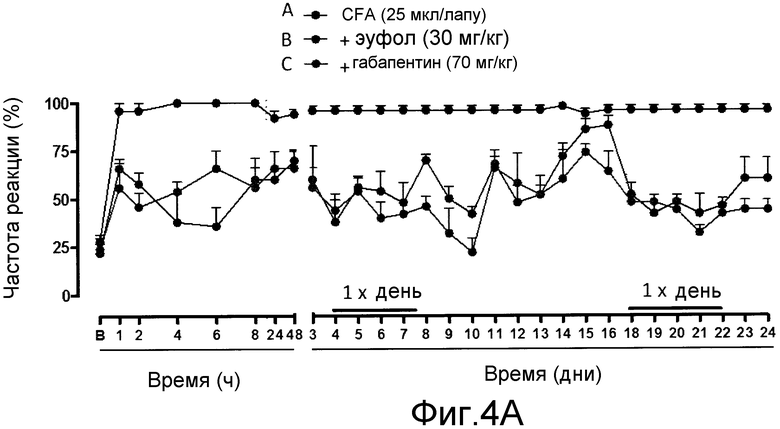
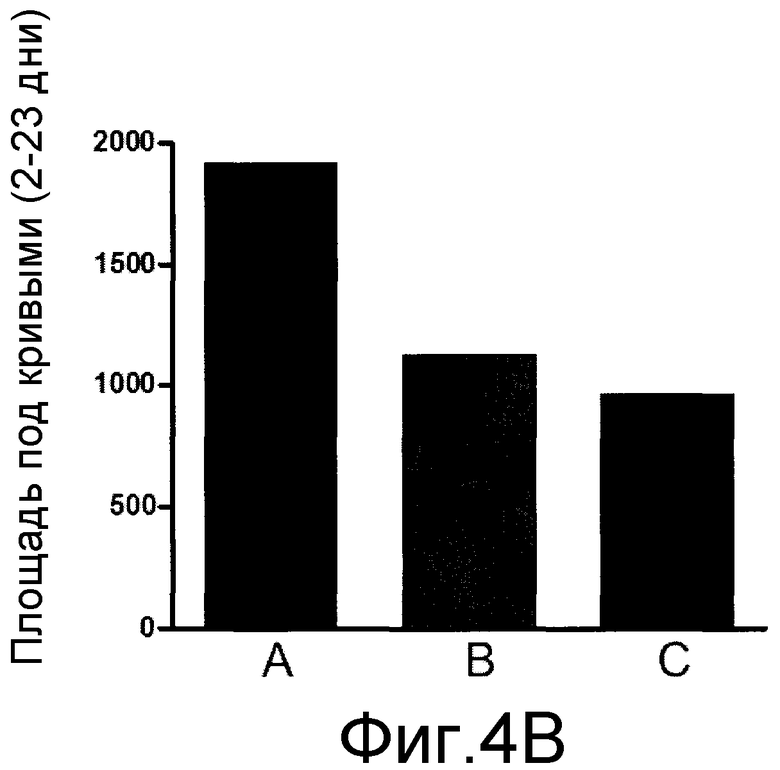
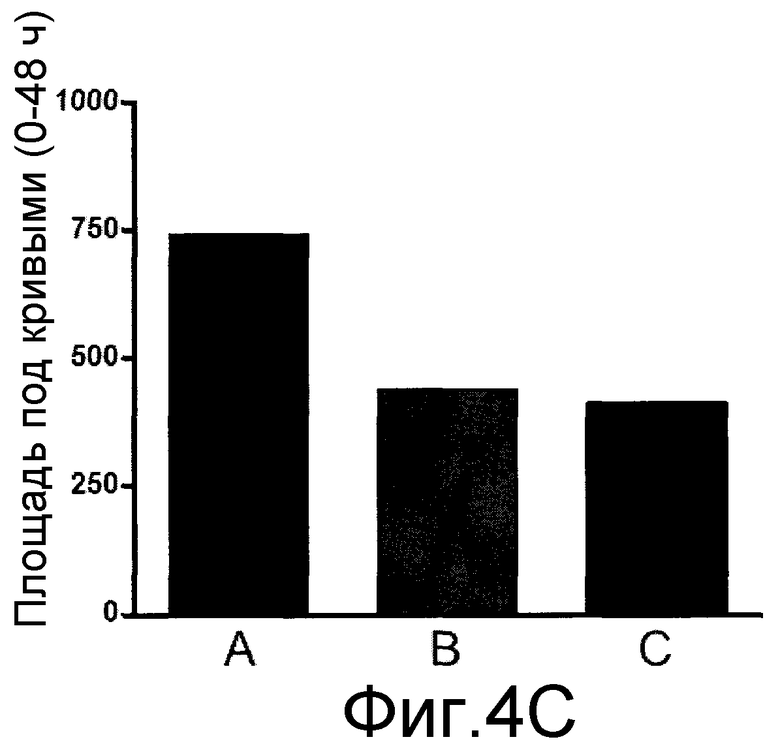
На фиг. 4A, 4B и 4C, причем фиг. 4A представляет собой динамику во времени частоты реакции, а фиг. 4B и 4C представляют площадь под кривыми, показанными на фиг. 4A, для каждого тестированного соединения, что позволяет сравнивать их.
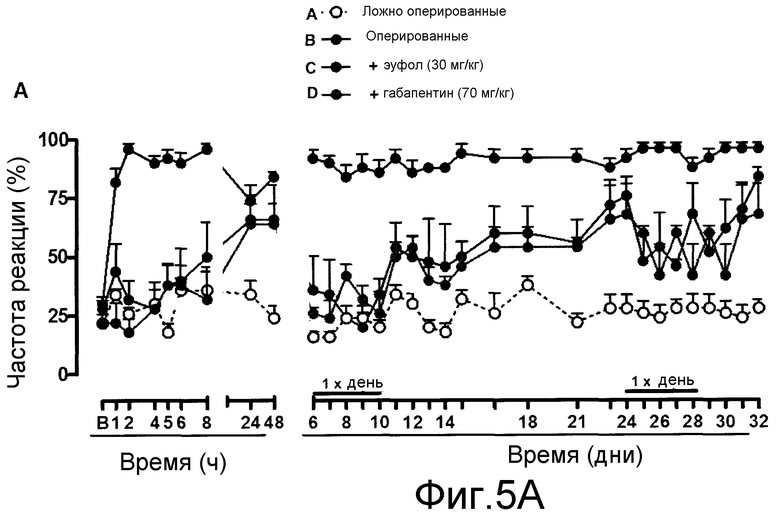
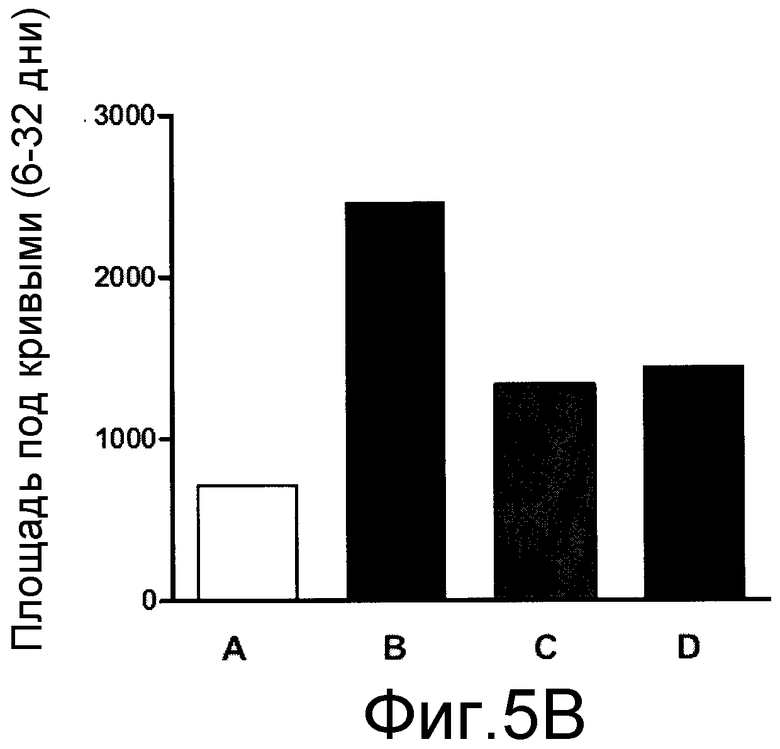
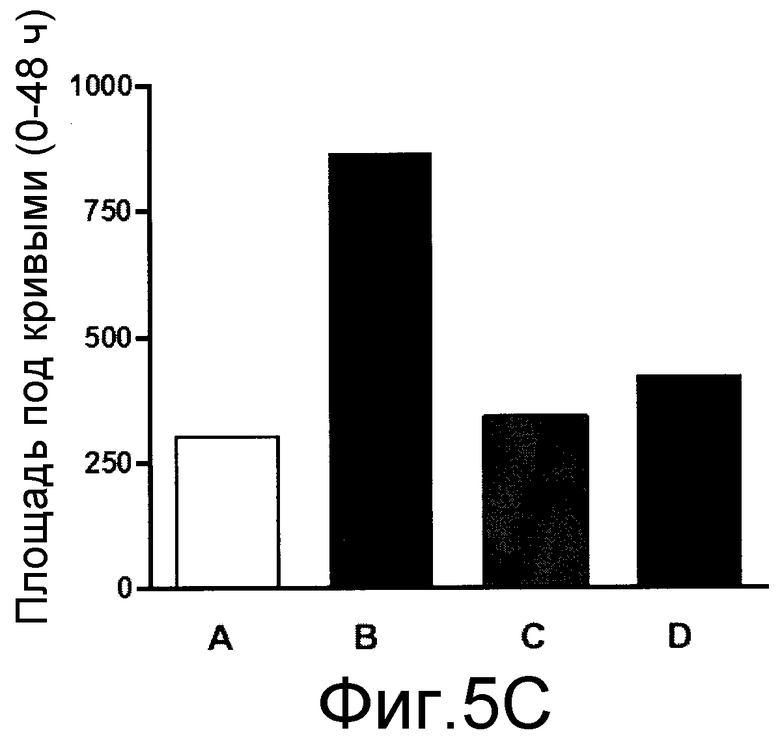
На фиг. 5A, 5B и 5C, причем фиг. 5A представляет собой динамику во времени частоты реакции, а фиг. 5B и 5C представляют площадь под кривыми, показанными на фиг. 5A, для каждого тестированного соединения, что позволяет сравнивать их.
Детальное описание изобретения
С учетом предшествующего уровня техники, настоящее изобретение относится к применению ланоста-8,24-диен-3-олов для ингибирования ферментов, активность которых связана с пролиферацией раковых клеток, в частности, PKC. Поэтому изобретение также относится к ланоста-8,24-диен-3-олам для применения при эффективном лечении опухолей, воспаления и/или боли, в значительной степени без недостатков, известных до настоящего времени.
Адекватными ланоста-8,24-диен-3-олами являются эуфол, тирукаллол и ланостерин, их изомеры, производные (в частности ацетаты), сольваты или гидраты, без исключения любых других. Ланоста-8,24-диен-3-олы могут быть получены, например, из растений Euphorbiaceae plants, или химическим синтезом, причем путь получения не имеет решающего значения для изобретения.
Поэтому в первом аспекте изобретение относится к применению ланоста-8,24-диен-3-олов для получения фармацевтических композиций, которые ингибируют повышенную или сниженную активацию протеинкиназ серина-треонина, или транскрипционные факторы, модулируемые ими. Химические соединения по изобретению ингибируют активацию таких киназ, в частности, PKC (протеинкиназ C), активность которых, как известно, связана с клетками рака. Также, в частности, транскрипционные факторы, модулируемые указанными киназами, содержат ядерный фактор Каппа B (NF-κB) и/или активаторный белок 1 (AP-I).
Ланоста-8,24-диен-3-олы по изобретению, а также композиции, содержащие их, могут быть введены субъекту, нуждающемуся в лечении, любым адекватным путем, энтеральным или парентеральным, включая переоральное, местное, трансдермальное, подкожное, внутрибрюшинное, внутривенное, ингаляционное, через слизистые оболочки, внутримышечное, интрапульмональное, вагинальное, ректальное, внутриглазное и сублингвальное применение. Особенно адекватными путями введения в настоящем изобретении являются местный и системный (инфильтрационный, пероральный, ингаляционный путем распыления, трансдермальный). Ланоста-8,24-диен-3-олы по изобретению могут содержаться в композициях медленного или контролируемого высвобождения. Известные адъюванты и эксципиенты могут использоваться в таких композициях - ссылку на фармацевтические формы введения, которые могут применяться для композиций, связанных с изобретением, можно найти в публикации Remington's Pharmaceutical Sciences, Mack Publishing, 1965-1990.
Без исключения любых других соединений семейства, подходящими ланоста-8,24-диен-3-олами являются один или более из эуфола (RN 514-47-6), тирукаллола (RN 514-46-5) и ланестерина (RN 79-63-0), конкретнее, эуфола.
В другом аспекте, изобретение относится к применению ланоста-8,24-диен-3-олов или содержащих их композиций для получения фармацевтических композиций для лечения опухолей, и/или воспаления, и/или боли (ноцицептивных реакций).
Композиции по изобретению могут вводиться пациентам в виде твердых форм, жидких или полужидких форм, таблеток, капсул, пилюль, порошков, гранул, суспензий, эмульсий, дисперсий и любой другой известной фармацевтически приемлемой формы. Композиции могут содержать другие активные средства, например, антибиотики, в зависимости от желательного эффекта. Для перорального введения в виде таблеток или капсул (и мягких капсул, и твердых капсул), ланоста-8,24-диен-3-олы могут комбинироваться с фармацевтически приемлемыми инертными носителями, такими как лактоза, крахмал, сахароза, глюкоза, метилцеллюлоза, стеарат магния, дикальций фосфат, фосфат кальция, маннит, сорбит и аналогичные вещества; для перорального введения в жидкой форме, ланоста-8,24-диен-3-олы могут комбинироваться с этанолом, глицерином, водой и аналогичными веществами. При желании или необходимости, к смеси могут добавляться агломерирующие агенты, смазывающие агенты, разрыхлители, красящие и ароматизирующие агенты. Обычными агломерирующими агентами являются глюкоза, [бета]-лактоза, кукурузные подсластители, натуральные или синтетические смолы, такие как гуммиарабик, трагакант или альгинат натрия, карбоксиметилцеллюлоза, полиэтиленгликоль, воск и аналогичные вещества. Смазывающие вещества включают олеат натрия, стеарат натрия, стеарат магния, бензоат натрия, ацетат натрия, хлорид натрия. Разрыхлители включают крахмал, метилцеллюлозу, агар, бентонит, ксантановую смолу и аналогичные вещества.
Композиции по изобретению могут также вводиться в виде липосом или соединенными с растворимыми полимерами в качестве носителей.
Жидкие лекарственные формы для перорального введения могут содержать красящие агенты и подсластители для увеличения приемлемости для пациентов. Приемлемыми носителями для водных лекарственных форм являются вода, соответствующее масло, солевой раствор, водная декстроза, другие сахарные растворы и гликоли, такие как пропиленгликоль или полиэтиленгликоли, фосфатный буфер.
В еще одном аспекте, изобретение относится к способу медицинского лечения соматического состояния млекопитающих, связанного с нарушенной активацией протеинкиназ серина-треонина, конкретнее, PKC, когда они влияют на внешние проявления или присутствие воспаления, и/или рака, и/или боли, причем указанный способ включает введение указанному млекопитающему фармакологически эффективного количества ланоста-8,24-диен-3-ола для лечения указанного состояния в фармакологически приемлемом носителе или эксципиенте.
Примеры
Хотя следующие примеры представляют собой конкретные варианты осуществления изобретения, они ни коим образом не ограничивают его, кроме того, что выражено в представленной ниже формуле изобретения.
Во всех следующих примерах, самцов мышей весом 20-30 г держали в вентилируемых фильтруемых воздухом клетках с регулируемой температурой (22±2°C) и влажностью (50-60%), при циклах 12 ч света/12 ч темноты, со свободным доступом к воде и пище. Животные оставались в лаборатории в течение адаптационного периода, по меньшей мере, 1 час перед фармакологическими тестами, проводимыми между 8:00 и 17:00 ч.
Во всех следующих примерах, проводили статистические анализы с использованием программного обеспечения Graph Pad Prism® 5.0.
Пример 1
Раздражающее действие определенных химических соединений характеризовали сравнением результатов местной обработки мышиных ушей следующими составами:
- положительный контроль, а именно TPA (тетрадеканоилфорбол-13-ацетат), 2,5 мкг/ухо, в носителе, содержащем смесь 3:1 ацетона:этанола;
- отрицательный контроль, а именно носитель, который представляет собой смесь 3:1 ацетона:этанола;
- эуфол, 100 мкг/ухо, соединение по изобретению, в носителе, содержащем смесь 3:1 ацетона:этанола;
- смесь 100 мкг эуфола и 2,5 мкг TPA, на ухо в носителе, содержащем смесь 3:1 ацетона:этанола.
Группам по 5 мышей на внутреннюю поверхность ушей местно наносили представленные выше композиции. Толщину ушей до и после воздействия тестируемых композиций измеряли с использованием микрометра, и реакции выражали в мкм. На фиг. 1 показано различие между толщиной ушей перед и после нанесения тестируемых соединений в динамике.
Результаты показаны на фиг. 1.
Как видно, ингибирующий эффект, полученный эуфолом, был значимым даже до 24 часов после обработки, указывая на его выраженное фармакокинетическое воздействие на воспаление.
Пример 2
В настоящем примере оценивали воздействие соединений по изобретению на активность PKC в отношении кожи мышей. Животные получали следующие композиции по 100 мкг/ухо:
- положительный контроль, а именно TPA (тетрадеканоилфорбол-13-ацетат), 2,5 мкг/ухо, в носителе, содержащем смесь 3:1 ацетона:этанола;
- отрицательный контроль, а именно носитель, который представляет собой смесь 3:1 ацетона:этанола;
- смесь 100 мкг эуфола и 2,5 мкг TPA на ухо в носителе, содержащем смесь 3:1 ацетона:этанола.
Группам по 5 мышей на внутреннюю поверхность ушей местно наносили представленные выше композиции. Активность PKC до и после воздействия тестируемых соединений измеряли, используя ELISA (иммуноферментный анализ). На фиг. 2 показана спектральная поглощательная способность трех тестируемых соединений, указанных выше.
Как видно, TPA содействует значительному увеличению активности PKC в отношении группы, получавшей обработку носителем, тогда как обработка эуфолом значительно снижает возрастание активности PKC, вызванное TPA.
Примеры 3, 4 и 5 - Ноцицепция
Пороги ноцицепции при механическом воздействии оценивали в виде частоты реакции одергивания лапы после десяти наложений нити фон Фрея (VHF, Stoelting, Chicago, USA). Животных по отдельности помещали в прозрачные акриловые отсеки размером 9×7×11 см на приподнятую платформу из проволочной сетки для обеспечения возможности доступа к подошвенной поверхности лап. Нить фон Фрея накладывали на правую заднюю лапу, соблюдая следующие критерии: (1) наложение перпендикулярно подошвенной поверхности при давлении, достаточном для сгибания нити, с тем, чтобы обеспечить общее давление; (2) оценку у животных проводили, когда все четыре лапы помещались на проволочную сетку; (3) реакцию в виде одергивания лапы учитывали, когда животное полностью удаляло лапу с проволочной сетки; (4) каждое животное подвергали воздействию 10 последовательных стимулов при длительности каждого стимула 1 с; (5) одергивание каждой лапы учитывали как 10% реакции при 190 одергиваниях, соответствующих 100% реакции.
Пример 3 - Ноцицепция вследствие воспаления, вызванного каррагинаном
Для индукции боли, связанной с воспалением, каждому животному в подошву лапы инъецировали 20 мкл каррагинана (300 мкг/лапу) в правую заднюю лапу. Животных, получавших лечение 0,9% (20 мкл/лапу) раствором PBS (солевым раствором с фосфатным буфером), использовали в качестве контроля. Указанная дозировка каррагинана вызывала отек, болевое ощущение и значительное увеличение размера лапы, в которую производили инъекцию.
Животных лечили пероральным введением эуфола (30 мкг/кг) за один час до инъекции каррагинана. Животных, получавших лечение подкожными инъекциями 0,5 мг/кг дексаметазона за 4 часа до инъекции каррагинана, использовали в качестве положительного контроля. Снижение болевой чувствительности оценивали ежечасно в течение 8 часов с помощью давления силой 0,6 г нитью фон Фрея, а также через 24 и 48 часов после инъекции каррагинана.
Результаты показаны на фиг. 3A и 3B, причем фиг. 3A представляет собой график частоты реакции в динамике во времени. А фиг. 3B представляет площадь под кривой, показанной на фиг. 3A, для каждого из тестированных соединений, что позволяет их сравнение в процентах.
Как видно на этих чертежах, однократное лечение эуфолом значительно снижало повышенное болевое ощущение при механической стимуляции вследствие воспаления, вызванного каррагинаном. Эуфол снижал болевую реакцию, аналогичную контрольной группе, получавшей лечение дексаметазоном.
Пример 4 - Стойкая ноцицепция, связанная с воспалением, вызванная CFA (полным адъювантом Фрейнда)
Животным внутрибрюшинно инъецировали 25 мкл CFA, дозой, которая вызывает повышенное болевое ощущение и увеличение размера лапы, в которую производится инъекция (Neuropharmacology, 41:1006-1012, 2001; Anesth Analg., 101:1763-1769, 2005).
Животные получали лечение пероральным введением 30 мг/кг эуфола или 70 мг/кг габапентина (положительный контроль) за 1 час до инъекции CFA. Повышенную ноцицепцию при механическом раздражении измеряли посредством стимуляции давлением силой 0,6 г нитью фон Фрея через интервалы времени 1, 2, 4, 6, 8, 24 и 48 часов после инъекции CFA, и до восстановления ноцицептивной реакции. После этого - на 3-й день - начинали постоянное лечение для оценки длительного лечения эуфолом. Для этого животным ежедневно перорально вводили 30 мг/кг эуфола в течение 5 дней, и повышенную ноцицепцию оценивали один раз в день, через 4 часа после первого введения. Повышенную ноцицепцию при механическом раздражении оценивали до возврата реакции на болевую стимуляцию. После этого опять начинали лечение один раз в день в течение 5 дней для оценки развития устойчивости к соединению, и повышенное восприятие боли оценивали до возврата ноцицептивной реакции.
Результаты показаны на фиг. 4A, 4B и 4C, причем фиг. 4A представляет собой график частоты реакции в динамике во времени, а фиг. 4B и 4C представляют площадь под кривыми, показанными на фиг. 4A, для каждого тестируемого соединения, что обеспечивает возможность их сравнения в процентах.
Как видно на фиг. 4A и 4B, однократное лечение эуфолом значительно снижало вызванное CFA повышенное болевое восприятие при механическом раздражении, что было близко к эффекту, полученному габапентином.
Когда эуфол вводили один раз в день в течение 5 дней, наблюдалось ингибирование ноцицептивной реакции, вызванной CFA, в течение 6 последующих дней лечения. Повышенная ноцицепция при механическом раздражении снова снижалась при начале длительного лечения, как видно по кривым, полученным с 3-го по 24-й день после инъекции CFA. Аналогичное ингибирование наблюдалось при длительном лечении габапентином.
Пример 5 - Невропатическая боль, вызванная частичной перевязкой седалищного нерва
Используемая в данном примере процедура была аналогична той, которая описана для крыс (Pain, 43:205-218, 1990), modified for mice ((Pain, 76:215-222, 1998), и стандартизирована Bortolanza et al. {Eur J Pharmacol, 453:203-208, 2002). Мышей наркотизировали 7% хлоралгидратом (0,6% мл/кг в подошву лапы). Затем седалищный нерв обнажали в верхней части бедра около разветвления седалищного нерва на 3 ветви, и 1/3-1/2 дистальной части перевязывали шовной нитью № 8. В группе ложной операции, седалищный нерв обнажали без перевязки. На 4-й день после операции одну группу животных лечили пероральным введением 30 мг/кг эуфола, а другую группу лечили пероральным введением 70 мг/кг габапентина в качестве положительного контроля. В заданные точки времени после лечения (1, 2, 4, 6, 8, 24 и 48 часов) оценивали механический порог посредством стимуляции нитью фон Фрея 0,6. Для оценки эффекта длительного лечения, животным ежедневно вводили эуфол, с 6-го дня в течение 5 дней, и механическую повышенную болевую чувствительность оценивали один раз в день, через 4 ч после первого введения до возвращения ноцицептивной реакции, аналогичной контрольной группе. После этого, протокол продолжительного лечения повторяли для оценки возможного развития устойчивости к соединению.
Результаты представлены на фиг. 5A, 5B и 5C, причем фиг. 5A представляет собой график частоты реакции в динамике во времени, а фиг. 5B и 5C представляют площадь под кривыми, показанными на фиг. 5A, для каждого тестируемого соединения, что обеспечивает возможность их сравнения в процентах.
Как видно на фиг. 5A и 5B, однократное лечение эуфолом или габапентином в значительной степени ингибировало механическую ноцицептивную реакцию, вызванную частичной перевязкой седалищного нерва.
Аналогичным образом, продолжительное лечение эуфолом или габапентином один раз в день в значительной степени снижало механическую ноцицептивную реакцию, вызванную частичной перевязкой седалищного нерва с возвратом к ноцицептивной реакции на 10-й день лечения.
С помощью положений и примеров, представленных в настоящем описании, специалист в данной области может воспроизвести изобретение эквивалентными путями с использованием таких же функций для получения аналогичных результатов без отхода от объема изобретения, определенного прилагаемой формулой изобретения.
Настоящее изобретение относится к химико-фармацевтической промышленности и представляет собой применение ланоста-8,24-диен-3-олов для получения фармацевтических композиций, которые ингибируют повышенную активацию протеинкиназ серина-треонина, или транскрипционных факторов, модулируемых ими. Изобретение обеспечивает применение ланоста-8,24-диен-3-олов в качестве противовоспалительных, противоопухолевых, анальгетических средств, действующих посредством ингибирования ферментов, активность которых связана с пролиферацией определенных типов рака. 3 н. и 12 з.п. ф-лы, 5 пр., 10 ил.
1. Применение ланоста-8,24-диен-3-олов для получения фармацевтических композиций, которые ингибируют повышенную активацию протеинкиназ серина-треонина, или транскрипционных факторов, модулируемых ими.
2. Применение по п.1, где протеинкиназы представляют собой протеинкиназы С.
3. Применение по п.1, где указанные транскрипционные факторы представляют собой ядерный фактор Каппа В (NF-кВ) и/или активаторный белок 1 (АР-I).
4. Применение по п.1, где указанные ланоста-8,24-диен-3-олы представляют собой один или более из эуфола, тирукаллола и ланостерина, их изомеры, ацетаты, сольваты или гидраты.
5. Применение по п.4, где производное указанных ланоста-8,24-диен-3-олов представляет собой ацетат.
6. Применение по п.1, где ланоста-8,24-диен-3-ол представляет собой эуфол.
7. Средство для лечения опухолей, воспаления и/или боли, связанных с нарушенной активацией протеинкиназ серина-треонина, или транскрипционных факторов, модулируемых ими, представляющее собой ланоста-8,24-диен-3-ол.
8. Средство по п.7 для лечения опухолей.
9. Средство по п.7 для лечения воспаления.
10. Средство по п.7 для лечения боли.
11. Способ медицинского лечения состояния, связанного с нарушенной активацией протеинкиназ серина-треонина, конкретнее, РКС у млекопитающих, где указанный способ включает введение указанному млекопитающему фармакологически эффективного количества ланоста-8,24-диен-3-ола в фармакологически приемлемом носителе или эксципиенте для лечения опухолей, воспаления и/или боли.
12. Способ по п.11, где указанные состояния влияют на внешний вид или присутствие воспаления, и/или рака, и/или боли.
13. Способ по п.11, где медицинское лечение относится к опухолям.
14. Способ по п.11, где медицинское лечение относится к воспалению.
15. Способ по п.11, где медицинское лечение относится к боли.
| WO 2006007676 А1, 26.01.2006 | |||
| HJ Mackay and CJ Twelves | |||
| Protein kinase C: a target for anticancer drugs? // Endocrine-Related Cancer | |||
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
| Способ и приспособление для нагревания хлебопекарных камер | 1923 |
|
SU2003A1 |
| P.J.BARNES, M.KARIN | |||
| NUCLEAR FACTOR-kB - A PIVOTAL TRANSCRIPTION FACTOR IN CHRONIC INFLAMMATORY DISEASES // The New England Journal of Medicine | |||
| - Vol.336, No.15, p.1066-1071 | |||
| - | |||
Авторы
Даты
2013-02-27—Публикация
2008-08-05—Подача