ОБЛАСТЬ ТЕХНИКИ
Изобретение относится к биосовместимой композиции, которая включает микрочастицы альгиновой кислоты или ее солей и активный ингредиент. Более конкретно настоящее изобретение относится к микрочастицам, предназначенным для инкапсулирования активного ингредиента, которые предполагается вводить внутривенно нуждающемуся в этом пациенту. Для этих частиц характерно сочетание размера, необходимого для увеличения времени полужизни или срока существования активного ингредиента в крови, с низким поглощением в печени и быстрым клеточным клиренсом при внутривенном введении. Активный ингредиент композиции по настоящему изобретению может являться пептидом, белком или гормоном, человеческого или животного происхождения, естественной, рекомбинантной или трансгенной природы. В число примеров активных ингредиентов в композициях по настоящему изобретению входят факторы свертывания крови, например, фактор VIII, фактор IX или фактор VIIa.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Увеличение времени полужизни терапевтически активного ингредиента в крови позволяет добиться определенных преимуществ, в т.ч. для достижения желаемого терапевтического эффекта необходимо меньшее количество введений. Это уменьшение количества введений является особенно важным в случае лекарств, предназначенных для парентерального введения, в наибольшей степени для лекарств, предназначенных для внутривенного введения, и особенно для лекарств, вводимых в течение долгого времени, например лекарств, применяемых при лечении хронических расстройств.
В настоящее время существует тенденция так долго, как только возможно, вводить активные ингредиенты путями, которые не требуют проникновения в вену, поскольку в случае применения этого способа пациент испытывает затруднения и неудобства. Однако существует ряд активных ингредиентов, для которых в настоящее время нет альтернативы внутривенному введению. В это число входят активные ингредиенты, содержащие молекулы значительного размера и сложности, например биологические или биотехнологические продукты, которые включают белки и гормоны.
Одним из примеров хронического терапевтического состояния, при котором необходимо постоянное внутривенное введение сложных активных ингредиентов, является гемофилия. Гемофилия представляет собой наследственное заболевание, характеризующееся появлением внутренних и внешних кровотечений, вследствие общего или частичного дефицита белков, имеющих отношение к свертыванию крови. Гемофилия A характеризуется дефицитом фактора свертывания крови VIII, который препятствует нормальной генерации тромбина, что в итоге мешает крови нормально свертываться. В случае гемофилии B дефицит фактора IX вызывает сходное клиническое состояние.
Первая терапевтическая возможность лечения гемофилии заключается в замене отсутствующего белка (FVIII или FIX) с помощью введения терапевтического концентрата, содержащего этот фактор. Другая терапевтическая возможность добиться правильного гемостаза при гемофилии заключается во введении FVIIa, который обладает способностью генерировать тромбин в отсутствии FVIII или FIX. Однако такой способ лечения обычно ограничен теми случаями, когда лечение с помощью FVIII или FIX является проблематичным или доказана его неэффективность, как, например, у пациентов, у которых возникал ингибиторный иммунологический ответ на эти активные ингредиенты. На сегодняшний момент ни один из этих продуктов не удалось ввести каким-либо иным способом за исключением внутривенного, с учетом их структурной сложности и невысокой способности проникать через эпителий.
Вследствие этого пациентам, страдающим гемофилией, необходимы внутривенные введения, повторяющиеся с определенной частотой, определяемой временем полужизни активного ингредиента в плазме. В случае FVIII время полужизни составляет примерно 12 часов. Это подразумевает, согласно фармакопейной статье Всемирной Федерации Гемофилии (Casper, CK, Hereditary Plasma Clotting Factor Disorders and Their Management 5th ed. WFH, Sam Schulman Ed., 2008), что для основного профилактического режима, т.е. для профилактики кровотечения у детей без суставных поражений, применяется доза примерно 20 Ед/кг каждые 48 часов, достаточная для поддержания уровня FVIII в плазме выше 1% от нормального значения. Как правило, такое лечение превращает тяжелую гемофилию в гемофилию незначительной или умеренной степени. В случае FIX время полужизни составляет примерно 26 часов, и поэтому для первичной профилактики могут вводиться дозы примерно 40 Ед/кг дважды в неделю с целью поддержания минимального уровня, равного 1%.
Следует принять во внимание, что профилактика, начиная с раннего возраста (примерно с одного года или в начале ползания), является стандартом лечения, необходимым для того, чтобы избежать поражения суставов в случае тяжелой гемофилии.
Таким образом, гемофилия является наглядным примером случая, когда увеличение времени полужизни активного ингредиента могло бы обеспечить значительное улучшение качества жизни пациента, поскольку оно могло бы уменьшить число внутривенных введений, которые особенно трудно переносятся детьми в раннем возрасте.
Другими примерами продолжительного лечения с помощью внутривенного введения препаратов является, например, применение иммуноглобулинов (IgG) при первичном иммунодефиците и применение антитромбина III (AT) и альфа-1 антитрипсина (AAT) в случае наследственного дефицита.
Существуют многочисленные технологические подходы, нацеленные на увеличение времени полужизни в плазме активных ингредиентов указанных типов. Одним из наиболее изученных подходов является получение производных белков и совместимых полимеров, как, например, полиэтиленгликоля (ПЭГ). Эта методика заключается в проведении химических реакций с целью ковалентного присоединения цепей ПЭГ к аминокислотам белка. Было подтверждено, что эта методика применима в случае гормонов и пептидных цепей небольшого размера, например интерферона, поскольку для соединений этого типа основным механизмом их выведения из организма является почечный клиренс, который легко регулируется простым увеличением размеров молекулы (Bailon Pascal et al, Bioconjugate Chem. 2001, 12, 195-202). Однако по-прежнему необходимо выяснить, может ли этот способ применяться в случае более сложных активных ингредиентов, поскольку он основан на внешней модификации структуры белка, подвергаемого обработке. Кроме того, ковалентные связи с белком этого типа значительно снижают биологическую активность обрабатываемого гормона или белка.
Другой альтернативой для изменения времени полужизни является добавление или модификация остатков сахаров, которые присутствуют в природных белках или гормонах (Perlman Signe et al., The Journal of Clinical Endocrinology & Metabolism 88 (7): 3227-3235, 2003). Эта методика требует изменения белка, вызывающего модификацию его распознавания рецепторами, которые принимают участие в его разрушении. Однако риски, присущие такому изменению, являются очевидными, с учетом высокого иммуногенного потенциала гликозильных остатков, присутствующих в белках.
Третьей возможностью является получение химерных белков, в которых активная последовательность представляющего интерес белка, экспрессируется вместе с последовательностью белков плазмы, имеющих значительное время полужизни, как, например, альбумина или фрагментов иммуноглобулинов (Dennis, Marks S. et al, The Journal of Biological Chemistry vol.277, №38, Issue of September 20, pp. 35035-35043, 2002). Однако основным недостатком этой методики, помимо ожидаемой иммуногенности, связанной с действием на пациента белков, отсутствующих в природе, является потеря эффективности белка при столь глубокой модификации его структуры.
Другой исследованной возможностью увеличения времени полужизни сложных активных ингредиентов является введение этих продуктов в состав липосом, стабилизированных ПЭГ. Эта методика основана на сродстве активного ингредиента к ПЭГ, которое делает возможным обратимую ассоциацию между белком и липосомами. Эта временная ассоциация должна обеспечить увеличение времени полужизни активного белкового ингредиента, поскольку липосомы, стабилизированные ПЭГ, циркулируют в организме в течение долгого времени. Однако эту гипотезу не удалось подтвердить на практике, поскольку было доказано, что эта система является неэффективной для увеличения времени полужизни FVIII у пациентов с гемофилией (Powell J.S. et al, Journal of Thrombosis and Haemostasis, 6: 277-283, 2007).
На сегодняшний день среди описанных выше систем не существует ни одной, которая способна значительно изменить время полужизни, за исключением тех случаев, когда введение структурных модификаций и изменений делает их применение для лечения патологий человека невозможным или очень затруднительным.
Широко изучалось регулируемое высвобождение терапевтических средств, инкапсулированных в биоразрушаемых полимерных микросферах. Микроинкапсулирование ингредиента в биоразрушаемых полимерах позволяет добиться того, чтобы высвобождение лекарственного средства стало регулируемым. В последнее время этот подход был применен в составах с регулируемым высвобождением для подкожного введения на основе производных молочной и гликолевой кислот. Эти составы с успехом применялись для инкапсулирования широкого круга активных ингредиентов, включая, в числе прочего, цитостатики, противовоспалительные средства, пептиды и гормоны (Tamilvanan S. et al, PDA Journal of Pharmaceutical Science and Technology, vol.62, No 2, March-April 2008 pp.125-154).
Pankaj (патент США № 5417982) описывает применение микросфер из молочной и гликолевой кислоты для достижения регулируемого высвобождения гормонов при пероральном введении. Хотя Pankaj описывает возможность получения пригодного для инъекции продукта, очень маловероятно, что составы по этому изобретению можно вводить внутривенно с учетом требований этого способа введения, и в любом случае в изобретении не предусмотрено применения альгинатов для этой цели.
Sivadas (Sivadas Neeraj et al., International Journal of Pharmaceutics 358 (2008) pp. 159-167) описывает применение различных полимеров, включая гидроксипропилцеллюлозу, хитозан, гиалуроновую кислоту, желатин, овальбумин и гликолевую полимолочную кислоту в качестве носителей для инкапсулирования белков с целью их введения путем ингаляции.
Одним из недостатков применения производных молочной и гликолевой кислот является необходимость получения препаратов в присутствии органических растворителей, некоторые из которых известны своей токсичностью, например поливинилового спирта, который не позволяет сохранить биологическую активность сложных активных ингредиентов, таких как белки и гормоны.
Применение этих полимеров приводит также к получению частиц с высокой гидрофильностью, которые, как обсуждается ниже, быстро перестают циркулировать в организме за счет механизмов поглощения клетками. Еще одним недостатком является локальное образование сильнокислой среды вокруг частицы во время ее растворения и, следовательно, в то время, когда высвобождается активный ингредиент. Это происходит из-за того, что полимер распадается на молочную кислоту и гликолевую кислоту, что создает избыточно кислую среду вокруг частицы при растворении. Это именно та кислая среда, которая может повредить чувствительные активные ингредиенты и особенно те из них, которые имеют сложную аминокислотную структуру с неустойчивой биологической активностью.
Альгинаты находят многочисленные применения в пищевой и фармацевтической промышленности и, в основном, в химической промышленности. Широкий круг применений определяется их гидроколлоидными свойствами, т.е. их способностью гидратироваться в воде с образованием вязких растворов, дисперсий или гелей. Эта особенность придает альгинатам уникальные свойства в качестве загущающих средств, стабилизирующих средств, гелеобразующих средств и пленкообразователей.
Одной из областей, где свойства альгинатов находят широкое применение, является инкапсулирование активных ингредиентов, в частности, для улучшения их растворимости или с целью содействия введению лекарственных препаратов (Tønnesen, Hanne Hjorth et al, Drug Development and Industrial Pharmacy, 28(6), 621-630 (2002)) различными путями. В число этих путей входит пероральное введение с учетом мукоадгезивных свойств альгинатов. Также был исследован подкожный путь введения. Однако опыт внутривенного введения отсутствовал в силу жестких ограничений, характерных для этого пути введения.
Например, Benchabane (Benchabane, Samir et al, Journal of Microencapsulation, September 2007; 24(6): pp.565-576) описал применение альгинатов при производстве микрокапсул альбумина путем «распыления-высушивания» для перорального введения. В аналогичном случае Coppi (Coppi, Gilberto et al, 2001, Drug Development and Industrial Pharmacy, 27(5) pp.393-400) продемонстрировал образование микросфер, сшитых кальцием и хитозаном, для перорального введения белков. В обоих случаях альгинат действует в качестве средства защиты белков от протеолитического разложения, которое происходит естественным путем во время переваривания в желудке.
Далее Mladenovska (Mladenovska, K., International Journal of Pharmaceutics 342 (2007) pp.124-136) описала получение микрочастиц альгината/хитозана для введения в ободочную кишку.
Sivadas (Sivadas Neeraj et al., International Journal of Pharmaceutics 358 (2008) pp. 159-167) также упоминает о применении альгинатов в качестве носителя для инкапсулирования белков с целью их введения путем ингаляции.
Помимо непосредственного введения активных ингредиентов альгинаты были также предложены в качестве носителей для введения сложных терапевтических форм. Например, в заявке на патент WO 2006/028996 A2 описано применение альгината и эмульсана для транспорта детоксифицирующих средств для бактериальных токсинов.
Другим примером является применение альгината в инкапсулировании мультивезикулярных липосом (Dai, Chuanyun, et al, Colloids and Surfaces B: Biointerfaces 47 (2006) pp. 205-210) или живых клеток (European Patent publication number 2 159 523). В этом случае цель введения живых клеток заключалась в их применении в регенеративной медицине или генной терапии (WO 2007/046719 A2; Peirone, Michael et al, J. Biomed. Mater. Res. 42, pp.587-596, 1998; Garcia-Martin, Carmen et al, The Journal of Gene Medicine, J Gene Med 2002; 4 pp.215-223). Любопытно отметить, что Garcia-Martin (Garcia-Martin, Carmen et al, The Journal of Gene Medicine, J Gene Med 2002; 4 pp.215-223) описал возможное применение введения генетически модифицированных живых клеток для лечения гемофилии A, приводя пример медицинской актуальности проблемы. В этом случае микрокапсулы из альгинатов, которые содержат живые клетки, имплантируют интраперитонеально с помощью введения катетера. В этом случае как объект лечения, так и способ введения - не внутривенные, и они очень далеки от настоящего изобретения.
В противоположность обширному опыту применения полимеров для инкапсулирования сложных активных ингредиентов, например белков, отсутствуют источники, в которых решены проблемы, связанные с внутривенным введением этих продуктов. Как описано у Wong и соавторов (Wong, Joseph et al, Advanced Drug Delivery Reviews 60 (2008) pp. 939-954) существуют только три одобренных продукта для внутривенного введения, в которых применяется суспензия частиц. Ни один из этих продуктов не содержит в своем составе альгинатов. Во всех этих случаях не предполагалось увеличение времени полужизни, а цель заключалась в улучшении растворимости продукта.
Сложность эффективного внутривенного введения микрочастиц может заключаться в: (a) основных характеристиках продукта, таких как размер и распределение частиц, отсутствие органических растворителей, а также гомогенность, вязкость и возможность введения суспензии с помощью шприца, где под возможностью введения с помощью шприца подразумевается легкость всасывания и впрыскивания продукта; (b) технических аспектах производства и выпуска в промышленном масштабе, таких как однородность доз, нежелательная кристаллизация солей в случае продуктов, полученных осаждением из растворителя, стерильность и апирогенность продукта; и (c) биологических аспектах, таких как непредусмотренное изменение фармакокинетического и фармакодинамического профиля, изменение биораспределения, бионакопления полимера, активации фагоцитов, токсичности и эффектов эмболизации или активации комплемента.
В этой связи одной из наиболее значительных проблем в разработке этих продуктов является их быстрое выведение системой мононуклеарных фагоцитов (MPS), ранее именуемой ретикулоэндотелиальной системой (RES), которая включает все клетки, образовавшиеся из предшественников моноцитов в костном мозге, моноцитов периферической крови и макрофагов или гистоцитов различных органов и тканей. Среди последних, вследствие их важности для удаления микрочастиц в плазме, следует упомянуть клетки Купфера печени и макрофаги, распределенные в селезенке и костном мозге (Passirane, Catherine et al, Pharmaceutical Research, Vol.15, No 7, 1998 pp.1046-1050).
Широко описан тот факт, что после внутривенного введения нано- или микрочастиц, они быстро опсонизируются белками плазмы. Эти белки, абсорбированные на их поверхности, вызывают распознавание и захват клетками MPS (Passirane, Catherine et al, Pharmaceutical Recearch, vol 15, No 7, 1998, pp. 1046-1050).
Аналогичный эффект наблюдали в случае липосом (Ishida, Tatsuhiro et al., Journal of Controlled Release 126 (2008) pp.162-165), для которых было описано явление, известное как ускоренное очищение крови (ABC). В обоих случаях - как для полимерных микрочастиц, так и для липосом - явление опсонизации также непосредственно относится к активации комплементарной системы (Ishida, Tatsuhiro et al., Journal of Controlled Release 126 (2008) pp.162-165; Koide, Hiroyuki et al, International Journal of Pharmaceutics 362 (2008) pp.197-200).
На практике это явление фагоцитоза препятствует разработке лекарственных средств с увеличенным временем полужизни на основе внутривенно вводимых микрочастиц, поскольку увеличение размеров, связанных с инкапсулированием, не только не увеличивает это время, но в отдельных случаях вызывает ускоренное разрушение. Очевидно, что это явление можно наблюдать только при экспериментах in vivo, которые включают исследование фармакокинетики у животных.
Многократно зафиксирована связь между выведением за счет фагоцитоза и размером частиц. Champion (Champion, JA, Pharm Res. 2008 Aug; 25(8): 1815-21. Epub 2008 Mar 29) конкретно описал зависимость между фагоцитозом, которому подвергаются полимерные частицы, и их размером, причем максимальный эффект наблюдался в диапазоне 2-3 мкм. Другими параметрами, которые определяют захват микрочастиц MPS in vivo, является гидрофобность частиц и их дзета-потенциал (Z-потенциал) (Szycher, Michael, High Performance Biomaterials: A Comprehensive Guide to Medical and Pharmaceutical Applications, published by CRC Press, 1991 ISB 0877627754, 9780877627753, 812 pages).
Z-потенциал является свойством частиц. Конкретно дисперсные частицы стремятся приобрести электрический заряд за счет адсорбции ионов из внешней среды или за счет ионизации функциональных групп на их собственной поверхности. Одним из следствий этого является образование в среде, окружающей отрицательно заряженную дисперсную частицу, слоя противоионов, именуемого слоем Штерна, и расположенного вплотную к ней. Диффузный слой, образующийся на указанном слое Штерна, характеризуется наличием подвижных зарядов (обоих знаков), которые будут нейтрализовать заряд частицы как функцию расстояния до нее. Z-потенциалом именуется величина разности потенциалов, между слоем противоионов и точкой электрокинетической нейтральности.
Значения Z-потенциалов являются ключевыми для стабильности большинства дисперсных систем, поскольку они регулируют степень отталкивания между дисперсными частицами одноименного заряда, препятствуя слишком тесному сближению указанных частиц друг с другом и преобладанию сил притяжения между частицами, вызванного явлением коалесценции. Что касается Z-потенциала, было обнаружено (Szycher, Michael, High Performance Biomaterials: A Comprehensive Guide to Medical and Pharmaceutical Applications, published by CRC Press, 1991 ISB 0877627754, 9780877627753, 812 pages), что небольшой отрицательный Z-потенциал, близкий к 0, уменьшает фагоцитоз.
Кроме того, гидрофобность также содействует опсонизации и захвату частиц. Это представляет особый интерес, т.к. частицы, полученные из полимолочной и гликолевой кислот являются, например, весьма гидрофобными.
Одним из подходов, приводящих к увеличению времени полужизни микрочастиц и липосом в плазме, стало введение на поверхность указанных частиц заряженных полимеров, способных изменять заряд поверхности и образовывать гидрофильный поверхностный слой для защиты частиц от опсонизации и фагоцитоза. В рамках этого подхода находится применение полиэтиленгликоля (ПЭГ) (Ishida, Tatsuhiro et al., Journal of Controlled Release 126 (2008) 162-165; Owens III, Donald E et al, International Journal of Pharmaceutics, volume 307, Issue 1, 3 January 2006, pages 93-102) или гепарина (Passirane, Catherine et al, Pharmaceutical Recearch, vol 15, No 7, 1998, pp. 1046-1050).
Этот подход усложняет и затрудняет разработку фармацевтических продуктов из-за повышения сложности системы. Кроме того, как обсуждалось выше, было доказано, что применение ПЭГ-липосом является неэффективным для увеличения времени полужизни сложных белков, например, FVIII (Powell J.S. et al., 2007, Journal of Thrombosis and Haemostasis, 6: pp 277-283).
В случае микрочастиц для получения продукта, пригодного для внутривенного введения, было бы необходимо иметь гидрофильные частицы с подходящей комбинацией размера и Z-потенциала.
Terrence (European Patent Publication Number: 2286040, European Application Number: 00973477.3) описал применение полимеров в качестве системы введения, способной увеличить время полужизни инкапсулированных активных ингредиентов. С этой целью в указанном изобретении требуется применение: (1) первого водорастворимого полимера; (2) как минимум одного анионного полисахарида в качестве первого комплексообразующего агента и (3) катиона двухвалентного металла в качестве второго комплексообразующего агента. Как было обнаружено, упомянутое изобретение является технически сложным и трудно применимым на практике. В противоположность этому в настоящем изобретении регулируемое высвобождение активного ингредиента достигается с помощью более простых микрочастиц, в которые входит единственный полимер, обладающий всеми свойствами, необходимыми для его применения. Кроме того, препараты по изобретению Terrence не подходят для внутривенного применения по размеру частиц, и в изобретении не объяснено и не показано, как избежать клеточного фагоцитоза.
Альгинаты, в отличие от других полимеров на основе PLA или PLGA, являются гидрофильными. Было показано, что частицы по настоящему изобретению имеют небольшой отрицательный Z-потенциал, достаточный для предупреждения агрегации частиц, но достаточно нейтральный для обеспечения низкого профиля опсонизации.
Максимальные размеры частиц, приемлемых для внутривенного введения, составляют около 5 мкм. На это указывает наличие зарегистрированных лекарственных препаратов, в которых применяется альбумин, помеченных «для ультразвуковой диагностики» (Optison, спецификация 28) со средним размером частиц 3,0-4,5 мкм.
Альгинаты являются биосовместимыми и широко применяются для перорального введения у людей с учетом их широкого применения в пищевой промышленности. В случае внутривенной инъекции в форме недисперсного полимера он удаляется в бифазной форме с периодом полужизни от 4 до 22 часов (Hagen, A et al, European Journal of Pharmaceutical Sciences, Volume 4, Supplement 1, September 1996, pp. 100-100 (1)) без наблюдаемых нежелательных эффектов. Альгинаты удаляются с мочой.
Кроме того, альгинаты являются водорастворимыми полимерами, и это способствует их совместимости со сложными белками, поскольку вода является для них природным растворителем.
Настоящее изобретение относится к композиции, включающей микрочастицы альгиновой кислоты или ее фармацевтически приемлемых солей, с помощью которой достигаются регулируемое высвобождение и увеличение времени полужизни внутривенно вводимых активных ингредиентов, в результате чего достигаются низкая частота применения и более стабильные уровни активного ингредиента в крови, что потенциально уменьшает максимумы и минимумы, типичные для концентрации активного ингредиента, которые возникают в результате его периодической инфузии.
В настоящем изобретении описаны гидрофильные микрочастицы альгината, которые обладают сочетанием размеров, подходящих для внутривенного введения, и физико-химических характеристик, подходящих для предотвращения быстрого фагоцитоза микрочастиц, что делает возможным регулируемое высвобождение сложных активных ингредиентов.
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Альгиновая кислота и ее соли (альгинат аммония, альгинат кальция, альгинат калия, альгинат натрия и альгинат пропиленгликоля) входят в число наиболее исследованных и часто применяемых полимеров при инкапсулировании активных ингредиентов, благодаря их физико-химическим и биохимическим свойствам. Они являются полисахаридами природного происхождения, получаемыми в промышленности из водорослей или бактерий.
Альгинаты являются солями альгиновой кислоты, т.е. линейными полисахаридами, полученными из двух мономерных единиц, а именно β-(1-4)-D-маннуроновой (M) кислоты и α-(1-4)-L-гулуроновой (G) кислоты. Они сгруппированы в блоки, образующие большое разнообразие последовательностей, причем наиболее обычными являются G, M и MG.
В присутствии многовалентных катионов, например кальция (Ca++), возникают прочные связи между соседними G-блоками, образующие протяженную пространственную решетку альгинатов. Ионы кальция играют роль мостиков между группами гулуроновой кислоты с отрицательным зарядом. В некоторых составах альгинаты часто присутствуют совместно с другими полисахаридами, например хитозаном. Хитозан представляет собой линейный полисахарид, состоящий из звеньев β-(1-4) D-глюкозамина (деацетилированная единица) и N-ацетил-D-глюкозамина (ацетилированная единица), случайно распределенных в цепях.
В других составах на основе альгинатов в качестве вещества, несущего заряд, может применяться альбумин, предпочтительно стерильный и апирогенный человеческий альбумин, который может также действовать в качестве защитного средства активного ингредиента в способе производства или в качестве стабилизатора во время долговременного хранения продукта.
Активный ингредиент, высвобождение которого в плазму предполагается модифицировать, может являться сложным и лабильным активным ингредиентом. Более конкретно, активный ингредиент отличается проявлением биологической активности. Эта биологическая активность может проявляться в форме ферментной активности, транспорта, молекулярного взаимодействия или связывания с лигандом. В обоих случаях это было бы проблемой активных ингредиентов, являющихся лабильными или чувствительными к энергетическим условиям производства в том числе при повышенной температуре, давлении и/или в неполярных растворителях, поскольку незначительные структурные изменения могут вести к необратимой потере биологической активности.
В качестве примеров активных ингредиентов, обладающих биологической активностью, могут быть упомянуты человеческие пептидные гормоны, например мелатонин, серотонин, тироксин, эпинефрин, норэпинефрин, дофамин, адренокортикотропный гормон, ангиотензиноген и ангиотензин, вазопрессин, атриопептин, кальцитонин, эритропоэтин, фолликулостимулирующий гормон, глюкагон, человеческий хорионический гонадотропин, человеческий плацентарный лактоген, гормон роста, ингибин, инсулин, инсулиноподобный фактор роста (или соматомедин), лютеинизирующий гормон, меланоцит-стимулирующий гормон, окситоцин, пролактин, тромбопоэтин, нейропептид Y, гистамин, а также их производные.
Другими примерами могут являться биологически активные белки, такие как, в числе прочих, альбумин, альфа 1-антитрипсин, альфа-1 кислый гликопротеин, альфа-2-макроглобулин, антитромбин, гаптоглобин, церулоплазмин, липопротеины, трансферрин, плазминоген, фибриноген, комплементарные белки, факторы свертывания и иммуноглобулины.
Тот факт, что упомянутые активные ингредиенты являются биологически активными, делает их особенно чувствительными к возможной потере функциональности в результате минимальных нарушений структуры. Эти нарушения структуры могут быть связаны с температурой, давлением, полярностью среды, осмоляльностью, присутствием кислорода, интенсивным перемешиванием и т.д.
В этом отношении фактор свертывания крови VIII выделяется из числа перечисленных активных ингредиентов своей чрезвычайной лабильностью. Благодаря его сложной структуре, очень сложно должным образом стабилизировать биологическую активность FVIII, особенно в очищенной форме. Например, Parti R и соавторы (Haemophillia 2000; 6: 513-522) указали, что биологическая активность FVIII даже в лиофилизованной форме находится под угрозой при температурах выше 40°C. Эта нестабильность наиболее очевидна, когда FVIII находится в растворе, где даже при 25°C наблюдаются признаки нестабильности. Что касается фактора IX и фактора VIIa, также известна их чувствительность к внешним факторам, таким как температура.
При этом следует заметить, что заявленный в изобретении способ производства дает возможность получать терапевтические препараты, в которых сохраняется биологическая активность FVIII. Это означает, что способ по настоящему изобретению применим к активным ингредиентам, демонстрирующим биологическую активность, которые с трудом поддаются стабилизации, и, следовательно, что настоящее изобретение применимо к таким лабильным ингредиентам, как FVIII. Разумеется, настоящее изобретение применимо к ингредиентам, которые являются более стабильными, чем FVIII. В итоге факторы свертывания являются показательными примерами активных ингредиентов, в отношении которых можно добиться эффекта от применения составов, описанных в настоящем изобретении.
Таким образом, в число активных ингредиентов по настоящему изобретению, заключенных в полимерные микросферы, могут входить пептиды, белки или гормоны, демонстрирующие биологическую активность. Предпочтительно активный ингредиент является фактором свертывания крови, и более предпочтительно, активный ингредиент представляет собой фактор VIII, фактор фон Виллебранда, комплекс, образованный фактором VIII и фактором фон Виллебранда, фактор IX или фактор VIIa.
Указанные ингредиенты могут быть человеческого, животного, рекомбинантного или трансгенного происхождения. В последних случаях синтетические молекулы могут являться копиями природных молекул или же могут быть намеренно изменены.
Получение композиций
Микроинкапсулирование представляет собой процесс покрытия молекул, твердых частиц или жидких капелек материалами иной природы для получения частиц микронного размера. Продукты, получаемые по этому технологическому процессу, именуют микрочастицами, микрокапсулами или микросферами.
Существует несколько методик микроинкапсулирования:
- микроинкапсулирование химическими способами:
полимеризация на границе раздела фаз,
- микроинкапсулирование физико-химическими способами:
выпаривание растворителя,
коацервация,
гелеобразование,
хелатообразование,
образование пузырьков,
- микроинкапсулирование механическими способами:
экструзия,
совместная экструзия,
распылительная сушка,
охлаждение распылением.
Методикой, выбранной для получения микрочастиц, описанных в настоящем изобретении, является распылительная сушка, описанная у Erdinc B.I. [Erdinc B.I. (2007) Micro/nanoencapsulation of proteins with alginate/chitosan matrix by spray drying, Degree Thesis, Queen's University, Kingston, Canada]. Эта методика получения характеризуется наличием одной стадии, и микрочастицы получаются в качестве конечного продукта.
Способ получения биосовместимой композиции по настоящему изобретению, предназначенной для внутривенного введения, которая включает микрочастицы альгиновой кислоты или ее солей для достижения регулируемого высвобождения активного ингредиента, характеризуется наличием следующих стадий:
- распыление, при котором раствор/суспензию/эмульсию, содержащую активный ингредиент и полимер, прокачивают через распылительную головку и диспергируют в форме капелек;
- высушивания в сушильной камере, где горячий воздух способствует испарению растворителя из капелек; и
- собирания инкапсулированного продукта.
Этот способ реализуют при температуре от 140 до 180°C при скорости подачи воздуха от 35 до 40 м3/ч, скорости подачи в распылительную головку от 3,5 до 5 мл/мин и давлении от 4 до 6 фунтов/кв.дюйм.
В этих условиях имеется возможность получения частиц с размером, меньшим или равным 5 мкм, предпочтительно от 1 до 4,5 мкм, и сохранения активности активного ингредиента. Кроме того, средний размер частиц может быть улучшен путем необязательной гомогенизации эмульсии перед стадией распыления. Эту дополнительную стадию гомогенизации проводят под давлением, например, от 1500 до 2000 фунтов/кв.дюйм.
Инкапсулирование активных ингредиентов с помощью распылительной сушки является непрерывным процессом, в котором раствор или эмульсию подвергают дегидратации, возмещая твердое вещество, образованное микрочастицами в завершении процесса.
С этой целью жидкость, содержащую активный ингредиент, механически подают с заданной скоростью потока на распылительную насадку или вращающийся диск, с помощью которых ее распыляют на огромное количество очень мелких капель. Размер капель в значительной степени определяется давлением газа, который вызывает распыление жидкости. Процесс проводят в закрытой камере, в которой регулируемый поток газа, который обычно является воздухом, непрерывно циркулирует при заданной скорости подачи и регулируемой температуре.
В результате распыления значительно увеличивается поверхность контакта жидкости с воздухом, поэтому при соприкосновении с потоком высушивающего воздуха имеет место быстрое испарение жидкого растворителя, обычно воды. Это быстрое испарение вызывает внутреннее охлаждение каждой капельки, поскольку для изменения фазового состояния необходимо тепло. Таким путем можно осуществить быстрое высушивание при минимальном термическом воздействии на активный ингредиент. После завершения процесса продукт собирают в твердой форме.
Описание композиции
Полученные микрочастицы характеризуют определением их среднего размера, Z-потенциала и биологической активности. Размер частиц определяют с помощью прибора Beckman Coulter LS 13320 по дифракции лазерных лучей.
Поскольку микрочастицы предназначены для внутривенного введения, необходимо, чтобы их размер был меньше или равен 5 мкм, предпочтительно от 1 до 4,5 мкм, поскольку более крупный размер частиц мог бы вызвать образование тромбов.
Z-потенциал, который определяют с помощью прибора Malvern Zetasizer, является одним из основных параметров, определяющих взаимодействие частиц в суспензии. Он определяется природой поверхности частиц и дисперсионной средой. В данном случае оптимальными величинами являются значения, превышающие -30 мВ, поскольку они гарантируют отталкивание между частицами и отсутствие агрегатов. Было показано, что микрочастицы с Z-потенциалом, близким к 0, предпочтительно от -30 мВ до 0, имеют низкое поглощение в печени и уровни клеточного клиренса (Szycher, Michael, High Performance Biomaterials: A Comprehensive Guide to Medical and Pharmaceutical Applications, published by CRC Press, 1991 ISB 0877627754, 9780877627753, 812 pages).
Применение композиции
Фармацевтические формы с модифицированным или регулируемым высвобождением представляют собой формы, разработанные с целью изменения скорости и/или места высвобождения активного вещества или веществ, по сравнению с фармацевтической формой с обычным высвобождением, введенной тем же путем.
В настоящем изобретении было установлено, что инкапсулирование активных ингредиентов, проявляющих биологическую активность, например белков, и более конкретно факторов свертывания, делает возможным регулируемое высвобождение в модели высвобождения in vivo. Фактор VIII отличается исключительной чувствительностью к внешним факторам в силу сложности своей структуры. Фактически даже заморозка FVIII в плазме человека, т.е. в его природной среде, вызывает частичную потерю биологической активности (Bravo, M.I. et al, Pharmeuropa Scientific Notes, 2006-1 pp.1-5).
Поэтому когда описанные в настоящем изобретении микрочастицы, содержащие человеческий FVIII, помещали в проточную кювету в среду, аналогичную человеческой плазме, наблюдалась задержка при высвобождении FVIII в среду, по сравнению с неинкапсулированным продуктом.
Аналогично внутривенное введение кроликам FVIII-содержащих микрочастиц по настоящему изобретению приводит к устойчивому и значительному увеличению времени полужизни FVIII в плазме по сравнению с обычным продуктом. Кроме того, у животных не наблюдается нежелательных эффектов, которые могли бы указывать на токсическое действие, связанное с описываемыми составами.
Фармакокинетические данные in vivo являются очень важными, поскольку они несомненно подтверждают, что эффект опсонизации и ускоренного захвата MPS относятся именно к составу по настоящему изобретению.
Настоящее изобретение может применяться при лечении различных патологий, требующих внутривенного введения сложных ингредиентов, которые могут включать, например, кровотечения и нарушения свертывания крови, гормональные расстройства и т.д. В этих случаях может быть достигнуто значительное увеличение периода полужизни, что, например, в случае FVIII могло бы сократить количество введений препарата для поддержания основного профилактического режима, например обеспечить еженедельное введение.
Возможный недостаток, связанный с применением гидрофильных полимеров, может заключаться в частичном растворении микрочастиц в период между суспендированием продукта в водном носителе, например стерильной апирогенной воде для инъекций, и временем внутривенной инфузии. Недостаток такого типа может быть преодолен, например, применением частично неполярных биосовместимых растворителей, таких как, в числе прочих, этанол, пропиленгликоль, полиэтиленгликоль, диметилсульфоксид, N-метил-2-пирролидон, гликофурол, изопропилиден-глицерин, глицеринформаль или ацетон (Mottu F et al. Journal of Pharmaceutical Science & Technology 2000 Vol. 54, No6, 456-469), в качестве носителей при ресуспендировании и введении микрочастиц, описанных в настоящем изобретении.
Микрочастицы по настоящему изобретению могут быть получены, например, в форме дегидратированного или лиофилизированного продукта, упакованного в вакууме или инертной атмосфере, что позволяет добиться долговременной стабильности в условиях меняющихся температур, например, от 2 до 40°C. Сохраненный таким способом продукт можно вводить внутривенно после восстановления с применением растворителя, который может представлять собой воду для инъекций или солевой раствор или же смесь водного солевого раствора с различным содержанием, например, от 0,5 до 50% биосовместимых растворителей, таких как, в числе прочих, например, этанол, пропиленгликоль, полиэтиленгликоль, диметилсульфокисд, N-метил-2-пирролидон, гликофурол, изопропилиденглицерин, глицеринформаль или ацетон.
Преимущества перед техникой известного уровня
В настоящем изобретении описано получение гидрофильных микрочастиц альгинатов, которые обладают комбинацией размеров, подходящих для внутривенной инфузии, и физико-химических характеристик, подходящих для предотвращения их быстрого фагоцитоза, что делает возможным увеличение времени полужизни активных ингредиентов сложной структуры.
Альгинаты являются биосовместимыми, выводятся с мочой и не связаны с какими-либо известными токсическими эффектами. Благодаря этим свойствам, составы по настоящему изобретению подходят для введения белков и активных ингредиентов сложной структуры.
Настоящее изобретение способно преодолеть все недостатки, которые делали неосуществимым внутривенное введение препаратов с регулируемым высвобождением, уменьшая тем самым количество введений, необходимых для лечения с применением активных ингредиентов для внутривенного введения, не подвергшихся изменениям. В этой связи следует отметить, что настоящее изобретение не требует каких-либо модификаций активного ингредиента, в части аминокислотной последовательности, гликозилирования или введения синтетических производных.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
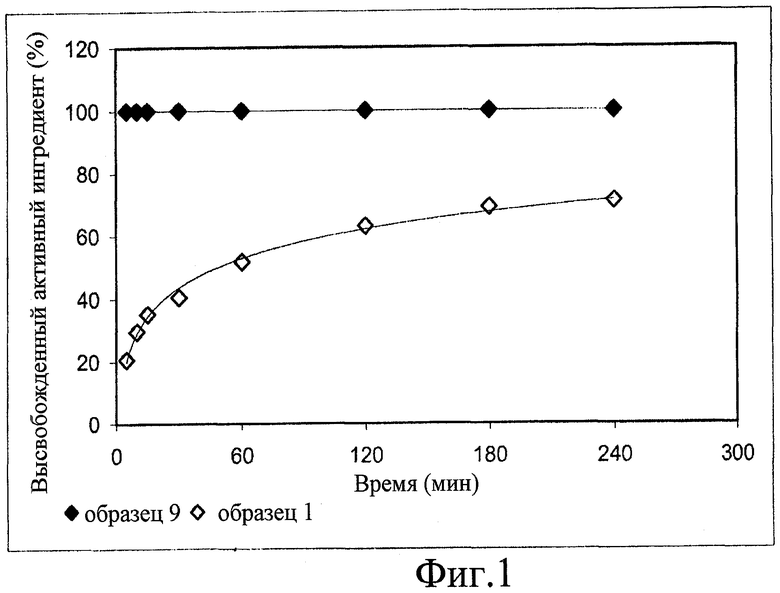
Фиг.1 представляет собой сравнительный график результатов тестов по высвобождению in vitro для образца 9 и образца 1.
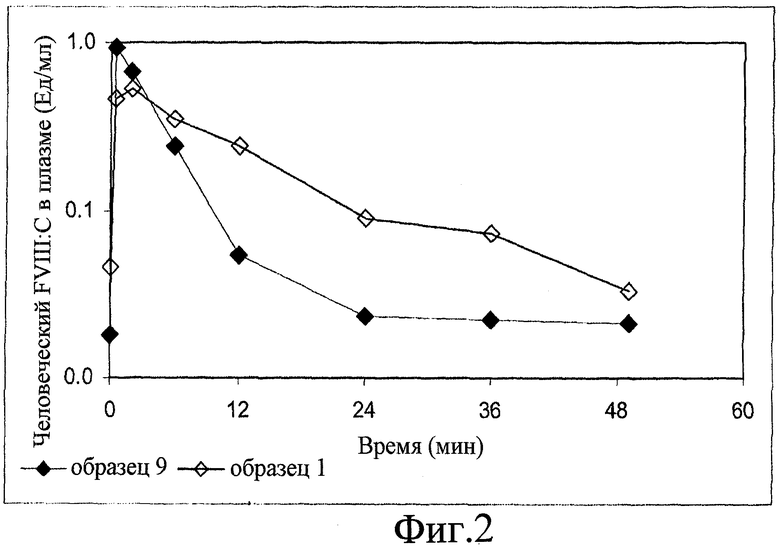
На фиг.2 показана фармакокинетика человеческого FVIII:C в плазме кролика после введения неинкапсулированного FVIII и после введения композиции по настоящему изобретению.
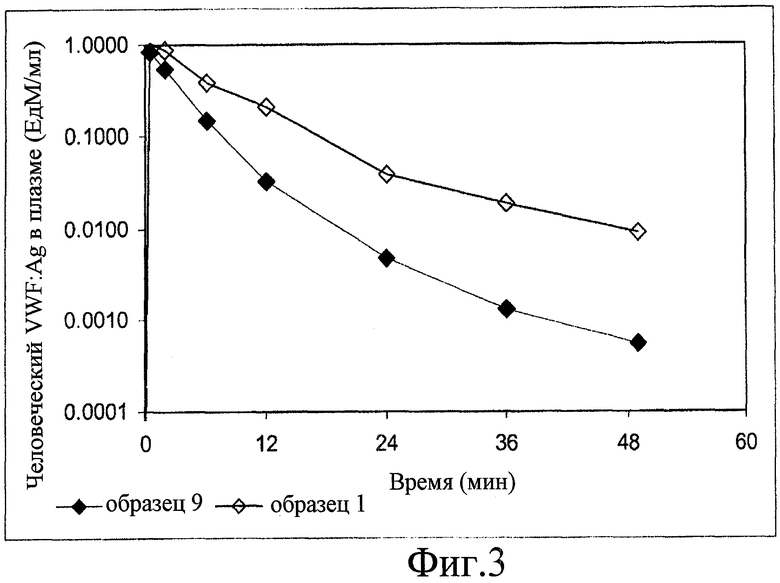
На фиг.3 показана фармакокинетика человеческого VWF:Ag в плазме кролика после введения неинкапсулированного FVIII и после введения композиции по настоящему изобретению.
Пример 1
Получение микрочастиц
Способ распылительной сушки применяли для получения микрочастиц альгинатов, как описано у Erdinc B.I. [Erdinc B.I. (2007) Micro/nanoencapsulation of proteins with alginate/chitosan matrix by spray drying, Degree Thesis, Queen's University, Kingston, Canada]. В основном микрочастицы получали с помощью образования эмульсии, включавшей полимер и выбранный активный ингредиент.
Агрегат Büchi MiniSpray Dryer B-290 применяли для распыления образцов при следующих условиях: температура распыления 140-180°C, скорость подачи воздуха 35-40 м3/ч, скорость подачи распыляемого вещества: 3,5-5 мл/мин и давление 4-6 фунтов/кв.дюйм.
Пример 2
Характеристики микрочастиц
В таблицах 1, 2 и 3 приведены вещества, применяемые в производстве микрочастиц и их характеристики, включая размер, Z-потенциал и выход. Способ производства и примененные условия соответствовали описанным в примере 1.
FVIII
FVIII
FVIII
Соотношение активность FVIII/антиген FVIII дает представление о доле активного белка в данном образце. Таким образом, если сравнить соотношение активность/антиген в исходном образце с активностью, полученной для инкапсулированного образца, можно рассчитать долю активного ингредиента, которая сохраняет функциональную активность после микроинкапсулирования. В данном примере было обнаружено, что выход процесса инкапсулирования по активности составлял 57,6, 33,9 и 35,7% для образцов 1, 2 и 3 соответственно.
FIX
FIX
FIX
В данном случае было обнаружено, что выход по активности при инкапсулировании в образцах 4, 5 и 6 составлял 100% во всех указанных образцах.
rFVIII
rFVIIa
В случае белков рекомбинантного происхождения выход по активности при инкапсулировании составлял 25% и 71% для образцов 7 и 8 соответственно.
Во всех образцах размер частиц определяли с помощью прибора Beckman Coulter LS13320 по дифракции лазерных лучей, и Z-потенциал измеряли прибором Malvern Zetasizer.
Биологическую активность FVIII определяли путем анализа свертывания дефицитной плазмы или оценивая генерацию FXa при хромогенезе. В случае FVIIa и FIX биологическую активность определяли, оценивая время свертывания (время частично активированного тромбопластина) плазмы, лишенной FVII и FIX, соответственно. Концентрацию белка определяли способом иммунологического детектирования с помощью иммуноферментного твердофазного анализа (ELISA), используя специфичные антитела против FVII:Ag, FIX:Ag или FVII:Ag соответственно.
Соотношения активность/антиген, которые показывают долю активного белка, рассчитывали, получая частное от деления активности на число антигенных единиц к специфически активному ингредиенту в образце. Расчет выхода по соотношению активность/антиген производят путем определения процентного изменения соотношений активность/антиген в исходном образце и конечном инкапсулированном продукте.
Как можно видеть во всех случаях, средний размер частиц меньше или равен 5 мкм, и Z-потенциал является отрицательным. Кроме того, данные по соотношению активность/Ag показывают, что во время получения инкапсулированного продукта биологическая активность сохранялась.
Различные таблицы показывают, что описанная в изобретении система регулируемого высвобождения подходит для различных активных ингредиентов.
Пример 3
In vitro тест на высвобождение
Тест на регулируемое высвобождение с использованием проточной кюветы осуществляли на приборе Sotax CE1 в замкнутом контуре для оценки высвобождения активного ингредиента.
Тест проводили при температуре 37°C при скорости потока 7-25 мл/мин, используя в качестве растворяющей среды имидазольный буфер с pH 7,3, содержащий 1% человеческий альбумин. В различные моменты времени отбирали образцы для анализа (5 минут, 10 минут, 15 минут, 30 минут, 60 минут, 120 минут, 180 минут и 240 минут). Отобранный образец заменяли равным объемом свежей среды для восполнения уменьшения объема.
Биологическую активность FVIII определяли с помощью анализа свертывания дефицитной плазмы или оценивая генерацию FXa при хромогенезе. В случае FVIIa и FIX, биологическую активность определяли измерением времени свертывания (время частично активированного тромбопластина) плазмы, лишенной FVII и FIX, соответственно. Концентрацию белка определяли способом иммунологического детектирования с помощью иммуноферментного твердофазного анализа (ELISA), используя специфичные антитела против FVII:Ag, FIX:Ag или FVII:Ag соответственно.
После завершения тестирования были получены следующие результаты:
Из приведенных данных можно видеть, что введение активного ингредиента в микрочастицы по настоящему изобретению изменяет кинетику высвобождения по сравнению с не инкапсулированным продуктом.
Пример 4
Фармакокинетика фактора VIII у животных
Для оценки свойств композиции по высвобождению активного ингредиента in vivo, проводили фармакокинетический тест на кроликах. С этой целью трем самкам новозеландского белого кролика внутривенно вводили дозу 50 IU/кг человеческого FVIII из образца 9 (не инкапсулированного). Аналогично другим трем самкам новозеландского белого кролика внутривенно вводили дозу 50 IU/кг инкапсулированного FVIII из образца 1, полученного, как описано в примере 1, с характеристиками, указанными в примере 2. В различные моменты времени отбирали образцы плазмы и подвергали их анализу для определения наличия человеческого FVIII:C, как указано в таблице 6. Определение содержания человеческого FVIII осуществляли по хромогенезу после селективного иммунологического захвата молекул человеческого FVIII. Такая методика позволяла отличать активность введенного человеческого FVIII от активности кроличьего FVIII.
образец 9
образец 1
Из приведенных в таблице результатов можно видеть, что композиция по настоящему изобретению задерживает высвобождение активных ингредиентов в плазму. Кроме того, эти результаты показывают, что не существует клеточных механизмов (в печени, селезенке или при действии макрофагов), которые быстро удаляют микрочастицы из циркуляции в организме, несмотря на их размеры.
Анализ приведенных данных с использованием подходящего для этой цели программного обеспечения (WinNonlin 5.2) позволил вычислить фармакокинетические константы, приведенные в таблице 7.
образец 9
(инкапсулированный)
образец 1
Пример 5
Фармакокинетика фактора фон Виллебранда у животных
При получении как образца 9 (неинкапсулированный FVIII), так и образца 1 (инкапсулированный FVIII) фактор FVIII выделяли из плазмы, и он содержал значительное количество фактора фон Виллебранда (VWF). Это означает, что инкапсулирование VWF происходило одновременно с инкапсулированием FVIII. Поэтому была возможность исследовать их поведение независимо друг от друга. Для этого осуществляли независимый анализ фармакокинетики VWF, измеряя содержание человеческого VWF антигена (VWF:Ag) в плазме кроликов. Результаты показаны в таблице 8.
образец 9
образец 1
Из приведенных в таблице результатов можно видеть, что композиция по настоящему изобретению задерживает высвобождение активных ингредиентов в плазму. Кроме того, эти результаты показывают, что не существует клеточных механизмов (в печени, селезенке или за счет действия макрофагов), которые быстро удаляют микрочастицы из циркуляции в организме, несмотря на их размеры.
Анализ приведенных данных с использованием подходящего для этой цели программного обеспечения (WinNonlin 5.2) позволил вычислить фармакокинетические константы, приведенные в таблице 9.
образец 9
(инкапсулированный)
образец 1
Как можно видеть из данных таблицы, инкапсулирование активного ингредиента, в данном случае VWF, значительно увеличивает время полужизни.
Хотя настоящее изобретение было описано на примере предпочтительных вариантов осуществления, их не следует рассматривать как ограничение объема изобретения, который будет определен расширительным толкованием следующей далее формулы изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| ФАРМАЦЕВТИЧЕСКИЕ СОСТАВЫ ПЕГИЛИРОВАННЫХ ЛИПОСОМ И ФАКТОРОВ СВЕРТЫВАНИЯ КРОВИ | 2015 |
|
RU2737291C2 |
| КОНЪЮГИРОВАННЫЕ МОЛЕКУЛЫ ФАКТОРА VIII | 2009 |
|
RU2573587C2 |
| КОМБИНИРОВАННОЕ ПРИМЕНЕНИЕ ПОЛИПЕПТИДОВ ФАКТОРА VII И ПОЛИПЕПТИДОВ ФАКТОРА VIII | 2002 |
|
RU2311923C2 |
| СПОСОБ ПОЛУЧЕНИЯ ПОРОШКА, СОДЕРЖАЩЕГО БЕЛОК, ПРЕДСТАВЛЯЮЩИЙ СОБОЙ ФАКТОР СВЕРТЫВАНИЯ КРОВИ ЧЕЛОВЕКА, И ПОЛИМЕР НА ОСНОВЕ МОЛОЧНОЙ КИСЛОТЫ | 2016 |
|
RU2702740C2 |
| Химерный улучшенный рекомбинантный фактор VIII | 2015 |
|
RU2647769C2 |
| СПОСОБ ОТДЕЛЕНИЯ ФАКТОРА VIII ОТ ПРОДУКТОВ КРОВИ | 2017 |
|
RU2734783C2 |
| МОДИФИЦИРОВАННЫЙ ФАКТОР ВИЛЛЕБРАНДА С УДЛИНЕННЫМ ПОЛУПЕРИОДОМ СУЩЕСТВОВАНИЯ IN VIVO, ЕГО ПРИМЕНЕНИЯ И СПОСОБЫ ПОЛУЧЕНИЯ | 2009 |
|
RU2528855C2 |
| РЕКОМБИНАНТНАЯ МОЛЕКУЛА ДНК, КОДИРУЮЩАЯ МОДИФИЦИРОВАННЫЙ СВИНОЙ ФАКТОР VIII (POL 1212), ЭКСПРЕССИРУЮЩИЕ ВЕКТОРЫ, МОДИФИЦИРОВАННЫЙ СВИНОЙ ФАКТОР VIII, ТЕРАПЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СПОСОБЫ ПОЛУЧЕНИЯ БЕЛКА МОДИФИЦИРОВАННОГО СВИНОГО ФАКТОРА VIII (ВАРИАНТЫ) И ЛИНИИ КЛЕТОК (ВАРИАНТЫ) | 2001 |
|
RU2285724C2 |
| САЙТ-НАПРАВЛЕННАЯ МОДИФИКАЦИЯ FVIII | 2005 |
|
RU2423380C2 |
| УЛУЧШЕНИЕ КЛИНИЧЕСКИХ ПАРАМЕТРОВ ПОСРЕДСТВОМ ЭКСПРЕССИИ ФАКТОРА VIII | 2019 |
|
RU2799048C2 |
Группа изобретений относится к медицине, в частности к композиции на основе биосовместимых микрочастиц альгиновой кислоты, предназначенных для регулируемого высвобождения активных ингредиентов при внутривенном введении, а также к способу получения и ее применения. Композиция включает микрочастицы альгиновой кислоты по размеру меньше или равные 5 мкм, имеющие отрицательный Z-потенциал, а активный ингредиент представляет собой фактор свертывания крови. Группа изобретений обеспечивает сочетание размера, достаточного для увеличения времени полужизни или срока существования активного ингредиента в крови, с низким поглощением в печени и быстрым клеточным клиренсом при внутривенном введении. 3 н. и 20 з.п. ф-лы, 5 пр., 9 табл., 3 ил.
1. Биосовместимая композиция для внутривенного введения, включающая микрочастицы альгиновой кислоты или ее солей, предназначенная для регулируемого высвобождения активного ингредиента, отличающаяся тем, что эти микрочастицы по размеру меньше или равны 5 мкм и имеют отрицательный Z-потенциал, где активный ингредиент представляет собой фактор свертывания крови.
2. Композиция по п.1, отличающаяся тем, что размер микрочастиц составляет от 1 до 4,5 мкм.
3. Композиция по п.1, отличающаяся тем, что Z-потенциал составляет от - 70 до 0, но не включая 0.
4. Композиция по п.1, отличающаяся тем, что активный ингредиент представляет собой фактор VIII.
5. Композиция по п.1, отличающаяся тем, что активный ингредиент представляет собой VWF.
6. Композиция по п.1, отличающаяся тем, что активный ингредиент представляет собой комплекс, образованный FVIII и VWF.
7. Композиция по п.1, отличающаяся тем, что активный ингредиент представляет собой фактор IX.
8. Композиция по п.1, отличающаяся тем, что активный ингредиент представляет собой фактор VIIa.
9. Способ получения биосовместимой композиции для внутривенного введения, включающей микрочастицы альгиновой кислоты или ее солей и предназначенной для регулируемого высвобождения активного ингредиента по любому из пп.1-8, характеризующийся тем, что он включает стадии:
- распыления, при котором раствор/суспензию/эмульсию, содержащую активный ингредиент и полимер, прокачивают через распылительную головку и диспергируют в форме капель,
- высушивания в сушильной камере, где горячий воздух способствует испарению растворителя из капелек; и
- сбора инкапсулированного продукта;
причем этот способ реализуют при температуре 140-180°С при скорости подачи воздуха от 35 до 40 м3/ч, скорости подачи в распылительную головку от 3,5 до 5 мл/мин и давлении от 4 до 6 фунтов/кв.дюйм.
10. Способ по п.9, характеризующийся тем, что перед стадией распыления дополнительно осуществляют необязательную стадию гомогенизации эмульсии.
11. Способ по п.9, характеризующийся тем, что дополнительную стадию гомогенизации осуществляют при давлении 1500-2000 фунтов/кв.дюйм.
12. Способ по п.9, характеризующийся тем, что размер полученных микрочастиц составляет от 1 до 4,5 мкм.
13. Способ по п.9, характеризующийся тем, что Z-потенциал полученных микрочастиц составляет от -70 до 0, но не включая 0.
14. Способ по п.9, характеризующийся тем, что активный ингредиент представляет собой пептид, белок или гормон.
15. Способ по п.14, характеризующийся тем, что активный ингредиент может иметь человеческое, животное, рекомбинантное или трансгенное происхождение.
16. Способ по п.14, характеризующийся тем, что активный ингредиент демонстрирует неустойчивую биологическую активность.
17. Способ по п.14, характеризующийся тем, что активный ингредиент представляет собой фактор свертывания крови.
18. Способ по п.14, характеризующийся тем, что активный ингредиент представляет собой фактор VIII.
19. Способ по п.14, характеризующийся тем, что активный ингредиент представляет собой VWF.
20. Способ по п.14, характеризующийся тем, что активный ингредиент представляет собой комплекс, образованный FVIII и VWF.
21. Способ по п.14, характеризующийся тем, что активный ингредиент представляет собой фактор IX.
22. Способ по п.14, характеризующийся тем, что активный ингредиент представляет собой фактор VIIa.
23. Применение биосовместимой композиции по любому из пп.1-8 для лечения расстройств, связанных с кровотечениями, нарушением свертывания крови, и гормональных заболеваний.
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ (ВАРИАНТЫ), ПРЕПАРАТ И СПОСОБ ЛЕЧЕНИЯ СОСТОЯНИЯ, ПОДДАЮЩЕГОСЯ ВОЗДЕЙСТВИЮ АНАЛОГА LHRH, ШПРИЦ | 1997 |
|
RU2202371C2 |
| СПОСОБ ПОЛУЧЕНИЯ ЛИПОСОМ | 1994 |
|
RU2071765C1 |
| МИКРОЧАСТИЦЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 1997 |
|
RU2201214C2 |
| US 2005181067 А1, 18.08.2005 | |||
| WO 2008143812 A3, 27.11.2008. | |||
Авторы
Даты
2013-02-27—Публикация
2009-12-22—Подача