Область техники
Настоящее изобретение относится к новому соединению или его фармакологически приемлемой соли или фармацевтической композиции, содержащей соединение или соль в качестве активного ингредиента, обладающего эффектом ингибирования активности mTOR-киназы.
Уровень техники
Мишенью рапамицина у млекопитающих (mTOR) является серин/треонинкиназа с молекулярной массой 289 кДа, обозначаемая как мишень рапамицина, макролидного антимикробного средства.
mTOR (также называемый FRAP, RAPT1 или RAFT1) экспрессирован почти во всех органах и тканях и вовлечен в PI3K-Akt сигнальную систему. mTOR образует комплексы mTORC1 и mTORC2 вместе с адапторными белками, такими как raptor и rictor соответственно, и передает внеклеточные сигналы. mTORC1 активирует трансляцию белков, связанных со злокачественной опухолью (таких как циклин D1, myc и HIF-1α), фосфорилируя свою мишень, такую как S6K и 4ЕВР-1, в последующих стадиях сигнального пути. В то же время предполагается, что mTORC2 активирует сигналы выживания клеток злокачественной опухоли, фосфорилируя свою мишень в последующих стадиях сигнального пути Ser473 Akt.
Клинически наблюдали также усиление mTOR сигнальной системы в различных типах злокачественных опухолей, включая злокачественную опухоль почек, остеосаркому, злокачественную опухоль легкого, злокачественную опухоль яичников, злокачественную опухоль предстательной железы, злокачественную опухоль молочной железы, злокачественную опухоль толстой кишки и злокачественную опухоль печени.
Рапамицин, ингибитор mTOR, внутриклеточно связывается с FKBP12 (FK-506 связывающий белок) и образует комплекс. Затем комплекс рапамицин/FKBP12 связывается с mTOR; активность mTOR-киназы, как предполагается, ингибируется этим связыванием, и соответственно, также ингибируются белковый синтез и клеточная пролиферация. Кроме того, сообщалось, что рапамицин обладает противоопухолевым эффектом у пациентов с опухолью. На данный момент были выполнены клинические испытания ингибиторов mTOR, включая CCI-779, производного рапамицина.
Как описано выше, считается, что mTOR является эффективной молекулярной мишенью для лечения злокачественной опухоли и что соединения, обладающие эффектом ингибирования активности mTOR-киназы (в дальнейшем именуемая иногда как активность ингибирования mTOR), могут быть фармакологически полезными в лечении злокачественной опухоли, в частности для лечения злокачественной опухоли с усиленной mTOR передачей сигнала, например злокачественной опухоли с LKB мутациями или TSC2 мутациями, или злокачественной опухоли с активированным PTEN (непатентные ссылки 1-3).
Известно, что соединения, такие как производные пиридопиримидина и производные имидазопиразина, ингибируют активность mTOR.
Перечень ссылок
Ссылка на патенты
Ссылка на патент 1: WO 2007/051493
Ссылка на патент 2: WO 2008/023161
Ссылка на патент 3: WO 2008/051493
Непатентные ссылки
Непатентная ссылка 1: Science, vol. 307, no. 18, 1098-1101, 2005
Непатентная ссылка 2: Nature, vol. 441, no. 25, 424-430, 2006
Непатентная ссылка 3: Drug Discovery Today, vol. 12, no. 3/4, 112-124, 2007
Сущность изобретения
Техническая задача
В результате проведения интенсивных исследований, в отношении соединений, обладающих mTOR ингибирующей активностью, авторы настоящего изобретения обнаружили, что соединение, представленное формулой (I) в соответствии с настоящим изобретением, эффективно ингибирует активность mTOR-киназы с превосходным эффектом ингибирования клеточной пролиферации. Таким образом, авторы изобретения осуществили настоящее изобретение.
Соответственно, целью настоящего изобретения является получение соединения или его фармакологически приемлемой соли, обладающей превосходной mTOR ингибирующей активностью.
Другой целью настоящего изобретения является получение фармацевтической композиции или mTOR ингибитора, в частности противоопухолевого агента, содержащего вышеуказанное соединение или его фармакологически приемлемую соль в качестве активного ингредиента.
Средства решения задачи
Конкретно, настоящее изобретение относится к:
(1) соединению, представленному следующей формулой (I):
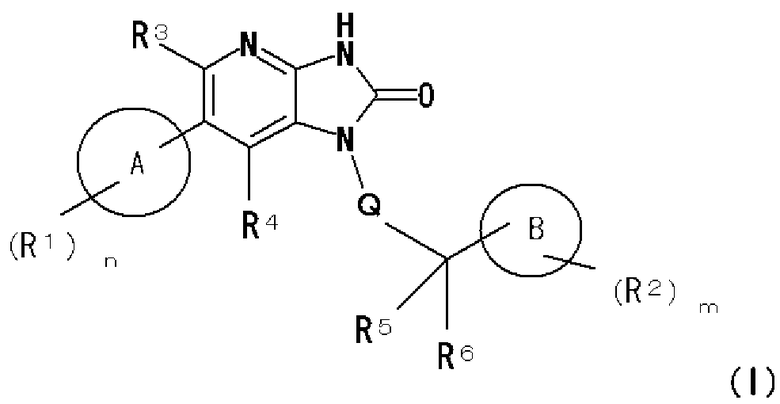
где в общей формуле (I)
A представляет собой 8-10-членную частично насыщенную или ароматическую конденсированную бициклическую азот-содержащую гетероциклическую группу, содержащую 1-3 атома азота,
A может иметь в качестве заместителей одинаковые или различные R1 с числом n,
R1 представляет собой заместитель, выбранный из группы, состоящей из: гидрокси группы, атома галогена, циано группы, оксо группы, C1-4 алкильной группы (где C1-4 алкильная группа может быть замещена одной или двумя одинаковыми или различными двумя C1-4 алкокси группами или -NR7aR7b), C1-4 алкокси группы, галоген-C1-4 алкильной группы, -NR7aR7b, -C(O)R8 и -C(O)NR9aR9b,
n равно любому целому числу от 0 до 3,
R7a, R7b, R9a и R9b являются одинаковыми или различными и представляют собой каждый атом водорода или C1-4 алкильную группу (где C1-4 алкильная группа может быть замещена 1 или 2 гидрокси группами),
R8 представляет собой атом водорода, гидрокси группу, C1-4 алкильную группу или C1-4 алкокси группу,
B представляет собой 3-7-членную насыщенную или частично насыщенную моноциклическую углеводородную группу и может содержать 1 или 2 атома кислорода, атома серы, атома азота, сульфинильные группы и/или сульфонильные группы в качестве заместителей кольца,
B может иметь в качестве заместителей одинаковые или различные R2 с числом m,
R2 представляет собой заместитель, представленный на атоме углерода или атоме азота, образующем B,
R2 представляет собой заместитель, выбранный из группы, состоящей из: гидрокси группы, атома галогена, циано группы, оксо группы, C1-4 алкильной группы (где C1-4 алкильная группа может быть замещена 1 или 2 C1-4 алкокси группами), C1-4 алкокси группы, галоген-C1-4 алкильной группы, C1-4 алкилсульфонильной группы, C1-4 алкилкарбонильной группы и -NR10aR10b, когда R2 представляет собой заместитель, представленный на атоме углерода, образующем B, и R2 представляет собой заместитель, выбранный из группы, состоящей из гидрокси группы, C1-4 алкильной группы (где C1-4 алкильная группа может быть замещена 1 или 2 C1-4 алкокси группами), C1-4 алкокси группы, галоген-C1-4 алкильной группы, C1-4 алкилсульфонильной группы, C1-4 алкилкарбонильной группы и -NR10aR10b, когда R2 представляет собой заместитель, представленный на атоме азота, образующем B,
R10a и R10b являются одинаковыми или различными и представляют собой каждый атом водорода или C1-4 алкильную группу,
m равно любому целому числу от 0 до 3,
Q представляет собой связь или C1-4 алкиленовую группу,
R3 и R4 являются одинаковыми или различными и представляют собой каждый атом водорода, атом галогена, C1-4 алкильную группу, галоген-C1-4 алкильную группу или циано группу, и
R5 и R6 являются одинаковыми или различными и представляют собой каждый атом водорода, атом галогена или C1-4 алкильную группу, или R5 и R6 вместе могут образовывать оксо группу, или вместе с атомом углерода, с которым R5 и R6 связаны, могут образовывать C3-8 циклоалкильную группу,
или его фармакологически приемлемой соли;
(2) соединению или его фармакологически приемлемой соли в соответствии с описанным выше пунктом (1), где A представляет собой конденсированную бициклическую азот-содержащую гетероциклическую группу, содержащую от 1 до 3 атомов азота, в которой:
(a) кольцо, непосредственно связанное с имидазопиридиновым кольцом, представляет собой частично насыщенное или ароматическое 6-членное кольцо, содержащее от 0 до 2 атомов азота, и
(b) кольцо, не связанное непосредственно с имидазопиридиновым кольцом, представляет собой частично насыщенное или ароматическое 5-членное кольцо, содержащее 1 или 2 атома азота;
(3) соединению или его фармакологически приемлемой соли в соответствии с описанным выше пунктом (1), где A представляет собой индолильную группу, изоиндолильную группу, индазолильную группу, пирролопиридильную группу, пиразолопиридильную группу, имидазопиридильную группу, пирролопиридазинильную группу, пиразолопиридазинильную группу, имидазопиридазинильную группу, пирролопиримидинильную группу, пиразолопиримидинильную группу, имидазопиримидинильную группу, пирролопиразинильную группу, пиразолопиразинильную группу или имидазопиразинильную группу;
(4) соединению или его фармакологически приемлемой соли в соответствии с любым из описанных выше пунктов (1)-(3), где R1 представляет собой заместитель, тождественно или иным образом выбранный из группы, состоящей из: атома фтора, атома хлора, циано группы, метильной группы, этильной группы, изопропильной группы, метокси группы, этокси группы, трифторметильной группы, метоксиметильной группы, этоксиметильной группы, амино группы, метиламино группы, диметиламино группы, метилэтиламино группы, пропиламино группы, (2-гидроксиэтил)(метил)амино группы, формильной группы, ацетильной группы, этилкарбонильной группы, этоксикарбонильной группы, карбоксильной группы, карбамоильной группы и метилкарбамоильной группы, и n равно любому целому числу от 0 до 2;
(5) соединению или его фармакологически приемлемой соли в соответствии с любым из описанных выше пунктов (1)-(4), где R3 представляет собой атом водорода, атом фтора, атом хлора, циано группу или метильную группу и R4 представляет собой атом водорода;
(6) соединению или его фармакологически приемлемой соли в соответствии с любым из вышеописанных пунктов (1)-(5), где Q представляет собой связь или метиленовую группу;
(7) соединению или его фармакологически приемлемой соли в соответствии с любым из вышеописанных пунктов (1)-(6), где R5 и R6 являются одинаковыми или различными и представляют собой каждый атом водорода, атом галогена или C1-4 алкильную группу;
(8) соединению или его фармакологически приемлемой соли в соответствии с любым из вышеописанных пунктов (1)-(7), где B представляет собой C3-7 циклоалкильную группу, тетрагидрофурильную группу, дигидропиранильную группу, тетрагидропиранильную группу, диоксанильную группу, пиперидильную группу, пиперазинильную группу или 1,1-диоксидотетрагидротиопиранильную группу;
(9) соединению или его фармакологически приемлемой соли в соответствии с любым из вышеописанных пунктов (1)-(8), где R2 представляет собой гидрокси группу, атом галогена, циано группу, оксо группу, C1-4 алкильную группу, C1-4 алкокси-C1-4 алкильную группу, C1-4 алкокси группу, C1-4 алкилсульфонильную группу или C1-4 алкилкарбонильную группу, когда R2 представляет собой заместитель, представленный на атоме углерода, образующий B, R2 представляет собой C1-4 алкильную группу, C1-4 алкилсульфонильную группу или C1-4 алкилкарбонильную группу, когда R2 представляет собой заместитель, представленный на атоме азота, образующий B, и m равно любому целому числу от 0 до 2;
(10) соединению в соответствии с описанным выше пунктом (1), где соединение представляет собой любое соединение, выбранное из:
1-[(2S)-1,4-диоксан-2-илметил]-6-(1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидроимидазо[4,5-b]пиридин-2-она,
1-[(2S)-1,4-диоксан-2-илметил]-6-(4-метил-1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидроимидазо[4,5-b]пиридин-2-она,
6-(3,4-диметил-1H-пирроло[2,3-b]пиридин-5-ил)-1-[(2S)-1,4-диоксан-2-илметил]-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-она,
6-(3-хлор-4-метил-1H-пирроло[2,3-b]пиридин-5-ил)-1-[(2S)-1,4-диоксан-2-илметил]-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-она,
1-[(2S)-1,4-диоксан-2-илметил]-6-(3-фтор-4-метил-1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-она,
2,6-ангидро-1,3,5-тридеокси-4-O-метил-1-[6-(4-метил-1H-пирроло[2,3-b]пиридин-5-ил)-2-оксо-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил]-L-трео-гекситола,
2,6-ангидро-1,3,4-тридеокси-5-O-метил-1-[6-(4-метил-1H-пирроло[2,3-b]пиридин-5-ил)-2-оксо-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил]-L-трео-гекситола,
2,6-ангидро-1,3,4-тридеокси-1-[6-(3,4-диметил-1H-пирроло[2,3-b]пиридин-5-ил)-2-оксо-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил]-5-O-метил-L-трео-гекситола,
2,6-ангидро-1-[6-(3-хлор-4-метил-1H-пирроло[2,3-b]пиридин-5-ил)-2-оксо-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил]-1,3,4-тридеокси-5-O-метил-L-трео-гекситола,
2,6-ангидро-1,3,5-тридеокси-1-[6-(3,4-диметил-1H-пирроло[2,3-b]пиридин-5-ил)-2-оксо-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил]-4-O-метил-L-трео-гекситола и
2,6-ангидро-1-[6-(3-хлор-4-метил-1H-пирроло[2,3-b]пиридин-5-ил)-2-оксо-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил]-1,3,5-тридеокси-4-O-метил-L-трео-гекситола;
(11) 1-[(2S)-1,4-диоксан-2-илметил]-6-(1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидроимидазо[4,5-b]пиридин-2-ону;
(12) 1-[(2S)-1,4-диоксан-2-илметил]-6-(4-метил-1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидроимидазо[4,5-b]пиридин-2-ону;
(13) 6-(3,4-диметил-1H-пирроло[2,3-b]пиридин-5-ил)-1-[(2S)-1,4-диоксан-2-илметил]-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-ону;
(14) 6-(3-хлор-4-метил-1H-пирроло[2,3-b]пиридин-5-ил)-1-[(2S)-1,4-диоксан-2-илметил]-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-ону;
(15) 1-[(2S)-1,4-диоксан-2-илметил]-6-(3-фтор-4-метил-1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-ону;
(16) 2,6-ангидро-1,3,5-тридеокси-4-O-метил-1-[6-(4-метил-1H-пирроло[2,3-b]пиридин-5-ил)-2-оксо-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил]-L-трео-гекситолу;
(17) 2,6-ангидро-1,3,4-тридеокси-5-O-метил-1-[6-(4-метил-1H-пирроло[2,3-b]пиридин-5-ил)-2-оксо-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил]-L-трео-гекситолу;
(18) 2,6-ангидро-1,3,4-тридеокси-1-[6-(3,4-диметил-1H-пирроло[2,3-b]пиридин-5-ил)-2-оксо-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил]-5-O-метил-L-трео-гекситолу;
(19) 2,6-ангидро-1-[6-(3-хлор-4-метил-1H-пирроло[2,3-b]пиридин-5-ил)-2-оксо-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил]-1,3,4-тридеокси-5-O-метил-L-трео-гекситолу;
(20) 2,6-ангидро-1,3,5-тридеокси-1-[6-(3,4-диметил-1H-пирроло[2,3-b]пиридин-5-ил)-2-оксо-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил]-4-O-метил-L-трео-гекситолу;
(21) 2,6-ангидро-1-[6-(3-хлор-4-метил-1H-пирроло[2,3-b]пиридин-5-ил)-2-оксо-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил]-1,3,5-тридеокси-4-O-метил-L-трео-гекситолу;
(22) фармакологически приемлемой соли соединения в соответствии с любым из вышеописанных пунктов (10)-(21);
(23) фармацевтической композиции, содержащей соединение или его фармакологически приемлемую соль в соответствии с любым из вышеописанных пунктов (1)-(21) в качестве активного ингредиента;
(24) противоопухолевому агенту, содержащему соединение или его фармакологически приемлемую соль в соответствии с любым из вышеописанных пунктов (1)-(21) в качестве активного ингредиента;
(25) ингибитору mTOR, содержащему соединение или его фармакологически приемлемую соль в соответствии с любым из вышеописанных пунктов (1)-(21) в качестве активного ингредиента; и
(26) противоопухолевому агенту в соответствии с описанным выше пунктом (24), где опухолью является лейкоз, лимфома, множественная миелома, опухоль головного мозга, злокачественная опухоль головы и шеи, злокачественная опухоль пищевода, злокачественная опухоль желудка, апендикулярная злокачественная опухоль, злокачественная опухоль толстой кишки, злокачественная опухоль анального канала, злокачественная опухоль желчного пузыря, злокачественная опухоль желчных протоков, злокачественная опухоль поджелудочной железы, стромальная опухоль желудочно-кишечного тракта, злокачественная опухоль легкого, злокачественная опухоль печени, мезотелиома, злокачественная опухоль щитовидной железы, злокачественная опухоль почек, злокачественная опухоль предстательной железы, нейроэндокринная опухоль, меланома, злокачественная опухоль молочной железы, злокачественная опухоль эндометрия, злокачественная опухоль шейки матки, злокачественная опухоль яичников, остеосаркома, саркома мягких тканей, саркома Капоши, миосаркома, злокачественная опухоль почек, злокачественная опухоль мочевого пузыря и/или злокачественная опухоль яичек.
Настоящее изобретение также относится к способу профилактики, лечения или предотвращения рецидива опухоли, включающему введение теплокровному животному (предпочтительно человеку) соединения или его фармакологически приемлемой соли в соответствии с любым из описанных выше пунктов, выбранных из (1)-(21), фармацевтической композиции в соответствии с представленным выше пунктом (23), ингибитора mTOR в соответствии с представленным выше пунктом (25) или противоопухолевого агента в соответствии с представленными выше пунктами (24) или (26).
Настоящее изобретение далее относится к:
(27) соединению, представленному следующей формулой (II):
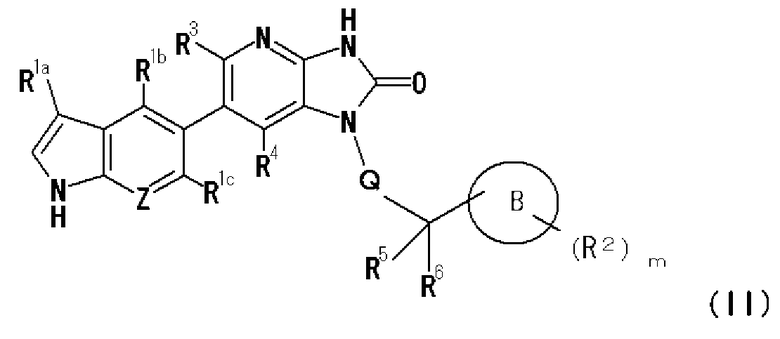
где в общей формуле (II)
R1a, R1b и R1c являются одинаковыми или различными и представляют собой каждый заместитель, выбранный из группы, состоящей из атома водорода, гидрокси группы, атома галогена, циано группы, C1-4 алкильной группы (где C1-4 алкильная группа может быть замещена одной или двумя одинаковыми или различными C1-4 алкокси группами или -NR7aR7b), C1-4 алкокси группы, галоген-C1-4 алкильной группы, -NR7aR7b, -C(O)R8 и -C(O)NR9aR9b,
Z представляет собой C-R1d или атом азота,
R1d представляет собой атом водорода, атом галогена или C1-4 алкильную группу,
R7a, R7b, R9a и R9b являются одинаковыми или различными и представляют собой каждый атом водорода или C1-4 алкильную группу (где C1-4 алкильная группа может быть замещена 1 или 2 гидрокси группами),
R8 представляет собой атом водорода, гидрокси группу, C1-4 алкильную группу или C1-4 алкокси группу,
B представляет собой 3-7-членную насыщенную или частично насыщенную моноциклическую углеводородную группу и может содержать 1 или 2 атома кислорода, атомы серы, атомы азота, сульфинильные группы и/или сульфонильные группы в качестве составляющих кольца,
B может иметь в качестве заместителей одинаковые или различные R2 в количестве m,
R2 представляет собой заместитель, представленный на атоме углерода или атоме азота, образующем B,
R2 представляет собой заместитель, выбранный из группы, состоящей из гидрокси группы, атома галогена, циано группы, оксо группы, C1-4 алкильной группы (где C1-4 алкильная группа может быть замещена 1 или 2 C1-4 алкокси группами), C1-4 алкокси группы, галоген-C1-4 алкильной группы, C1-4 алкилсульфонильной группы, C1-4 алкилкарбонильной группы и -NR10aR10b, когда R2 представляет собой заместитель, представленный на атоме углерода, образующем B, и R2 представляет собой заместитель, выбранный из группы, состоящей из гидрокси группы, C1-4 алкильной группы (где C1-4 алкильная группа может быть замещена 1 или 2 C1-4 алкокси группами), C1-4 алкокси группы, галоген-C1-4 алкильной группы, C1-4 алкилсульфонильной группы, C1-4 алкилкарбонильной группы и -NR10aR10b, когда R2 представляет собой заместитель, представленный на атоме азота, образующем B,
R10a и R10b являются одинаковыми или различными и представляют собой каждый атом водорода или C1-4 алкильную группу,
m равно любому целому числу от 0 до 3,
Q представляет собой связь или C1-4 алкиленовую группу,
R3 и R4 являются одинаковыми или различными и представляют собой каждый атом водорода, атом галогена, C1-4 алкильную группу, галоген-C1-4 алкильную группу или циано группу, и
R5 и R6 являются одинаковыми или различными и представляют собой каждый атом водорода, атом галогена или C1-4 алкильную группу, или R5 и R6 вместе могут образовывать оксо группу или вместе с атомом углерода, с которым R5 и R6 связаны, могут образовывать C3-8 циклоалкильную группу,
или его фармакологически приемлемой соли;
(28) соединению или его фармакологически приемлемой соли в соответствии с описанным выше пунктом (27), где R1a, R1b и R1c являются одинаковыми или различными и представляют собой каждый атом водорода, атом галогена, C1-4 алкильную группу или C1-4 алкокси группу;
(29) соединению или его фармакологически приемлемой соли в соответствии с описанным выше пунктом (27) или (28), где R3 представляет собой атом водорода, атом фтора, атом хлора, циано группу или метильную группу и R4 представляет собой атом водорода;
(30) соединению или его фармакологически приемлемой соли в соответствии с любым из вышеописанных пунктов (27)-(29), где Q представляет собой связь или метиленовую группу;
(31) соединению или его фармакологически приемлемой соли в соответствии с любым из вышеописанных пунктов (27)-(30), где R5 и R6 являются одинаковыми или различными и представляют собой каждый атом водорода, атом галогена или C1-4 алкильную группу;
(32) соединению или его фармакологически приемлемой соли в соответствии с любым из вышеописанных пунктов (27)-(31), где B представляет собой C3-7 циклоалкильную группу, тетрагидрофурильную группу, дигидропиранильную группу, тетрагидропиранильную группу, диоксанильную группу, пиперидильную группу, пиперазинильную группу или 1,1-диоксидотетрагидротиопиранильную группу;
(33) соединению или его фармакологически приемлемой соли в соответствии с любым из вышеописанных пунктов (27)-(32), где R2 представляет собой гидрокси группу, атом галогена, циано группу, оксо группу, C1-4 алкильную группу, C1-4 алкокси-C1-4 алкильную группу, C1-4 алкокси группу, C1-4 алкилсульфонильную группу или C1-4 алкилкарбонильную группу, когда R2 представляет собой заместитель, представленный на атоме углерода, образующего B, R2 представляет собой C1-4 алкильную группу, C1-4 алкилсульфонильную группу или C1-4 алкилкарбонильную группу, когда R2 представляет собой заместитель, представленный на атоме азота, образующем B, и m равно любому целому числу от 0 до 2;
(34) фармацевтической композиции, содержащей соединение или его фармакологически приемлемую соль в соответствии с любым из вышеописанных пунктов (27)-(33) в качестве активного ингредиента;
(35) противоопухолевому агенту, содержащему соединение или его фармакологически приемлемую соль в соответствии с любым из вышеописанных пунктов (27)-(33) в качестве активного ингредиента;
(36) ингибитору mTOR, содержащему соединение или его фармакологически приемлемую соль в соответствии с любым из вышеописанных пунктов (27)-(33) в качестве активного ингредиента; и
(37) противоопухолевому агенту в соответствии с вышеуказанным пунктом (35), где опухолью является лейкоз, лимфома, множественная миелома, опухоль головного мозга, злокачественная опухоль головы и шеи, злокачественная опухоль пищевода, злокачественная опухоль желудка, апендикулярная злокачественная опухоль, злокачественная опухоль толстой кишки, злокачественная опухоль анального канала, злокачественная опухоль желчного пузыря, злокачественная опухоль желчных протоков, злокачественная опухоль поджелудочной железы, стромальная опухоль желудочно-кишечного тракта, злокачественная опухоль легкого, злокачественная опухоль печени, мезотелиома, злокачественная опухоль щитовидной железы, злокачественная опухоль почек, злокачественная опухоль предстательной железы, нейроэндокринная опухоль, меланома, злокачественная опухоль молочной железы, злокачественная опухоль эндометрия, злокачественная опухоль шейки матки, злокачественная опухоль яичников, остеосаркома, саркома мягких тканей, саркома Капоши, миосаркома, злокачественная опухоль почек, злокачественная опухоль мочевого пузыря и/или злокачественная опухоль яичек.
Настоящее изобретение также относится к способу профилактики, лечения или предотвращения рецидива опухоли, включающему введение теплокровному животному (предпочтительно человеку) соединения или его фармакологически приемлемой соли в соответствии с любым вышеописанным пунктом, выбранным из (27)-(33), фармацевтической композиции в соответствии с вышеописанным пунктом (34), ингибитора mTOR в соответствии с вышеописанным пунктом (36) или противоопухолевого агента в соответствии с вышеописанными пунктами (35) или (37).
Благоприятные эффекты изобретения
Соединение или его фармакологически приемлемая соль, имеющая формулу (I) в соответствии с настоящим изобретением, обладает сильной ингибирующей активностью в отношении mTOR и ингибирует клеточную пролиферацию. Кроме того, в животной модели с трансплантированной опухолью соединение или соль ингибирует фосфорилирование S6 и Akt в ткани опухоли и обладает превосходным противоопухолевым эффектом. Таким образом, соединение или его фармакологически приемлемую соль в соответствии с настоящим изобретением, или фармацевтическую композицию, содержащую соединение или его фармакологически приемлемую соль в соответствии с настоящим изобретением в качестве активного ингредиента, применяют в качестве противоопухолевого средства, в частности средства для лечения опухолей, таких как злокачественное заболевание кровеносной системы, например лейкоз, лимфома или множественная миелома, опухоль головного мозга, злокачественная опухоль головы и шеи, злокачественная опухоль пищевода, злокачественная опухоль желудка, апендикулярная злокачественная опухоль, злокачественная опухоль толстой кишки, злокачественная опухоль анального канала, злокачественная опухоль желчного пузыря, злокачественная опухоль желчных протоков, злокачественная опухоль поджелудочной железы, стромальная опухоль желудочно-кишечного тракта, злокачественная опухоль легкого, злокачественная опухоль печени, мезотелиома, злокачественная опухоль щитовидной железы, злокачественная опухоль почек, злокачественная опухоль предстательной железы, нейроэндокринная опухоль, меланома, злокачественная опухоль молочной железы, злокачественная опухоль эндометрия, злокачественная опухоль шейки матки, злокачественная опухоль яичников, остеосаркома, саркома мягких тканей, саркома Капоши, миосаркома, злокачественная опухоль почек, злокачественная опухоль мочевого пузыря и/или злокачественная опухоль яичек. Соединение, или соль, или фармацевтическая композиция является эффективной в качестве средства для лечения опухолей с мутациями генов, вовлеченных в сигнальные пути, включающие mTOR, например опухолей с LKB мутациями или TSC2 мутациями, или опухолей с неактивированной PTEN, в числе вышеуказанных опухолей.
Описание вариантов осуществления
Используемый здесь термин "C1-4 алкильная группа" представляет собой линейную или разветвленную алкильную группу, имеющую от 1 до 4 атомов углерода. Примеры группы включают метильную группу, этильную группу, пропильную группу, изопропильную группу, бутильную группу, изобутильную группу, втор-бутильную группу и трет-бутильную группу. "C3-8 циклоалкильная группа" представляет собой алициклическую углеводородную группу, имеющую от 3 до 8 атомов углерода, и "C3-7 циклоалкильная группа" представляет собой алициклическую углеводородную группу, имеющую от 3 до 7 атомов углерода. Примеры таких групп включают циклопропильную группу, циклобутильную группу, циклопентильную группу и циклогексильную группу соответственно. Примеры "атома галогена" включают атом фтора, атом хлора, атом брома и атом йода. "Галоген-C1-4 алкильная группа" представляет собой группу, в которой вышеуказанная C1-4 алкильная группа замещена одинаковыми или различными 1-3 вышеуказанными атомами галогена. Примеры группы включают фторметильную группу, дифторметильную группу, трифторметильную группу, хлорметильную группу, дихлорметильную группу, трихлорметильную группу, 2-фторэтильную группу, 1,2-дифторэтильную группу, 2-трифторэтильную группу, 2-хлорэтильную группу, 1,2-дихлорэтильную группу, 1,1,2-трихлорэтильную группу, 1,2,2-трихлорэтильную группу и 2,2,2-трихлорэтильную группу. "C1-4 алкокси группа" представляет собой группу, образованную вышеуказанной "C1-4 алкильной группой" и атомом кислорода. Примеры группы включают метокси группу, этокси группу, пропокси группу и изопропокси группу. "C1-4 алкилкарбонильная группа" представляет собой группу, образованную вышеуказанной "C1-4 алкильной группой" и карбонильной группой. Примеры группы включают ацетильную группу, этилкарбонильную группу и пропилкарбонильную группу. "C1-4 алкилсульфонильная группа" представляет собой группу, в которой вышеуказанная C1-4 алкильная группа замещена или представляет собой сульфонильную группу. Примеры группы включают метилсульфонильную группу, этилсульфонильную группу, пропилсульфонильную группу и изопропилсульфонильную группу. "C1-4 алкиленовая группа" представляет собой линейную или разветвленную алкиленовую группу, имеющую от 1 до 4 атомов углерода. Примеры группы включают метиленовую группу, этиленовую группу, пропиленовую группу и метилметиленовую группу.
Используемый здесь термин "8-10-членная частично насыщенная или ароматическая конденсированная бициклическая азот-содержащая гетероциклическая группа" в определении A представляет собой 8-10-членное бициклическое ароматическое кольцо, содержащее от 1 до 3 атомов азота, которые могут быть частично насыщенными. Два моноцикла, образующие бициклическую азот-содержащую гетероциклическую группу, тождественно или по-разному выбраны из 5-членных или 6-членных колец. Примеры таких конденсированных бициклических азот-содержащих гетероциклических групп включают индолизинильную группу, изоиндолильную группу, индолильную группу, индолинильную группу, индазолильную группу, пирролопиридильную группу, пиразолопиридильную группу, имидазопиридильную группу, пиразолопиримидинильную группу, пуринильную группу, хинолизинильную группу, изохинолильную группу, хинолильную группу и нафтидинильную группу.
"3-7-Членная моноциклическая насыщенная или частично насыщенная циклическая углеводородная группа" в определении B относится к 3-7-членной насыщенной или частично насыщенной циклической углеводородной группе, которая может содержать одинаковые или различные 1 или 2 атома азота, атома кислорода, атома серы, сульфоксидные группы и/или сульфонильные группы в качестве составляющих кольца. Примеры таких циклических углеводородных групп включают C3-7 циклоалкильные группы, такие как циклопропильная группа, циклобутильная группа, циклопентильная группа или циклогексильная группа, пирролидинильная группа, имидазолидинильная группа, пиразолидинильная группа, пиперидильная группа, пиперазинильная группа, морфолинильная группа, дигидрофурильная группа, тетрагидрофурильная группа, дигидропиранильная группа, тетрагидропиранильная группа, диоксанильная группа, тетрагидротиенильная группа, 1-оксидотетрагидротиопиранильная группа и 1,1-диоксидотетрагидротиопиранильная группа.
Заместители и части структуры в общей формуле (I) будут описаны далее ниже.
A представляет собой 8-10-членную частично насыщенную или ароматическую конденсированную бициклическую азот-содержащую гетероциклическую группу, содержащую от 1 до 3 атомов азота. Предпочтительно кольцо, непосредственно связанное с имидазопиридиновым кольцом из числа двух колец, образующих A, представляет собой частично насыщенное или ароматическое 6-членное кольцо, содержащее от 0 до 2 атомов азота, и кольцо, не непосредственно связанное с имидазопиридиновым кольцом, представляет собой частично насыщенное или ароматическое 5-членное кольцо, содржащее 1 или 2 атома азота. A может иметь атом азота на конденсированном участке.
Более конкретно, A представляет собой индолильную группу, изоиндолильную группу, индазолильную группу, пирролопиридильную группу, пиразолопиридильную группу, имидазопиридильную группу, пирролопиридазинильную группу, пиразолопиридазинильную группу, имидазопиридазинильную группу, пирролопиримидинильную группу, пиразолопиримидинильную группу, имидазопиримидинильную группу, пирролопиразинильную группу, пиразолопиразинильную группу или имидазопиразинильную группу, например. A представляет собой предпочтительно индолильную группу, индазолильную группу, пирролопиридильную группу, пиразолопиридильную группу, имидазопиридильную группу, пирролопиридазинильную группу, пиразолопиримидинильную группу или пирролопиразинильную группу. A представляет собой предпочтительно 1H-индол-5-ильную группу, 1H-индол-2-ильную группу, 1H-индазол-5-ильную группу, 1H-пирроло[2,3-b]пиридин-5-ильную группу, 2,3-дигидро-1H-пирроло[2,3-b]пиридин-5-ильную группу, 1H-пирроло[3,2-b]пиридин-5-ильную группу, 1H-пирроло[3,2-b]пиридин-6-ильную группу, 1H-пирроло[2,3-c]пиридин-5-ильную группу, 1H-пиразоло[3,4-b]пиридин-5-ильную группу, 3H-имидазо[4,5-b]пиридин-6-ильную группу, 7H-пирроло[2,3-c]пиридазин-3-ильную группу, пиразоло[1,5-a]пиримидин-6-ильную группу или 5H-пирроло[2,3-b]пиразин-2-ильную группу. A представляет собой особенно предпочтительно 1H-индол-5-ильную группу или 1H-пирроло[2,3-b]пиридин-5-ильную группу.
В общей формуле (I) -(R1)n показывает, что A замещен одинаковыми или различными R1 в количестве n. A предпочтительно замещен R1 на атоме углерода, образующем A.
R1 представляет собой заместитель, выбранный из группы, состоящей из: гидрокси группы, атома галогена, циано группы, оксо группы, C1-4 алкильной группы (где C1-4 алкильная группа может быть замещена одной или двумя одинаковыми или различными C1-4 алкокси группами или -NR7aR7b), C1-4 алкокси группы, галоген-C1-4 алкильной группы, -NR7aR7b, -C(O)R8 и -C(O)NR9aR9b.
R7a, R7b, R9a и R9b являются одинаковыми или различными и представляют собой каждый атом водорода или C1-4 алкильную группу (где C1-4 алкильная группа может быть замещена 1 или 2 гидрокси группами). Предпочтительно R7a, R7b, R9a и R9b являются одинаковыми или различными и представляют собой каждый атом водорода, метильную группу, этильную группу, гидроксиметильную группу или гидроксиэтильную группу. Более предпочтительно R7a, R7b, R9a и R9b являются одинаковыми или различными и представляют собой каждый атом водорода, метильную группу или гидроксиэтильную группу.
R8 представляет собой атом водорода, гидрокси группу, C1-4 алкильную группу или C1-4 алкокси группу, предпочтительно атом водорода, гидрокси группу или C1-4 алкокси группу, и более предпочтительно гидрокси группу, метокси группу или этокси группу.
R1 представляет собой предпочтительно заместитель, тождественно или иным образом выбранный из группы, состоящей из атома фтора, атома хлора, циано группы, метильной группы, этильной группы, изопропильной группы, метокси группы, этокси группы, трифторметильной группы, метоксиметильной группы, этоксиметильной группы, амино группы, метиламино группы, диметиламино группы, метилэтиламино группы, пропиламино группы, (2-гидроксиэтил)(метил)амино группы, формильной группы, ацетильной группы, этилкарбонильной группы, этоксикарбонильной группы, карбоксильной группы, карбамоильной группы и метилкарбамоильной группы. R1 представляет собой предпочтительно заместитель, тождественно или иным образом выбранный из группы, состоящей из атома фтора, атома хлора и метильной группы.
n равно любому целому числу от 0 до 3, более предпочтительно любому целому числу от 0 до 2.
Часть структуры, представленная следующей формулой (III):
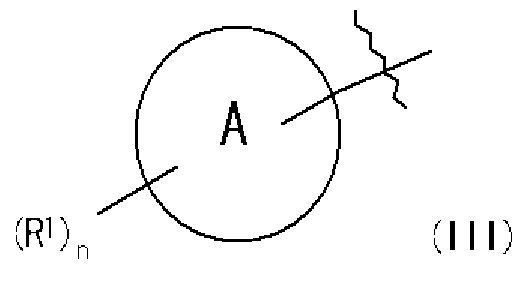
представляет собой предпочтительно 1H-индол-5-ильную группу, 4-фтор-1H-индол-5-ильную группу, 6-фтор-1H-индол-5-ильную группу, 7-фтор-1H-индол-5-ильную группу, 7-фтор-3-метил-1H-индол-5-ильную группу, 7-фтор-4-метил-1H-индол-5-ильную группу, 3,4-диметил-7-фтор-1H-индол-5-ильную группу, 1H-индазол-5-ильную группу, 1H-пирроло[2,3-b]пиридин-5-ильную группу, 3-хлор-1H-пирроло[2,3-b]пиридин-5-ильную группу, 4-хлор-1H-пирроло[2,3-b]пиридин-5-ильную группу, 6-хлор-1H-пирроло[2,3-b]пиридин-5-ильную группу, 3-фтор-1H-пирроло[2,3-b]пиридин-5-ильную группу, 4-фтор-1H-пирроло[2,3-b]пиридин-5-ильную группу, 6-фтор-1H-пирроло[2,3-b]пиридин-5-ильную группу, 3-метил-1H-пирроло[2,3-b]пиридин-5-ильную группу, 4-метил-1H-пирроло[2,3-b]пиридин-5-ильную группу, 6-метил-1H-пирроло[2,3-b]пиридин-5-ильную группу, 3,4-диметил-1H-пирроло[2,3-b]пиридин-5-ильную группу, 3-хлор-4-метил-1H-пирроло[2,3-b]пиридин-5-ильную группу, 3-фтор-4-метил-1H-пирроло[2,3-b]пиридин-5-ильную группу, 3-метокси-1H-пирроло[2,3-b]пиридин-5-ильную группу, 3-трифторметил-1H-пирроло[2,3-b]пиридин-5-ильную группу, 4-трифторметил-1H-пирроло[2,3-b]пиридин-5-ильную группу, 3-амино-1H-пирроло[2,3-b]пиридин-5-ильную группу, 4-амино-1H-пирроло[2,3-b]пиридин-5-ильную группу, 1H-пирроло[3,2-b]пиридин-5-ильную группу, пиразоло[1,5-a]пиримидин-6-ильную группу, 1H-пиразоло[3,4-b]пиридин-5-ильную группу, 5H-пирроло[2,3-b]пиразин-2-ильную группу, 7H-пирроло[2,3-c]пиридазин-3-ильную группу или 2-оксо-2,3-дигидро-1H-пирроло[2,3-b]пиридин-5-ильную группу.
Часть структуры представляет собой предпочтительно 1H-пирроло[2,3-b]пиридин-5-ильную группу, 3-хлор-1H-пирроло[2,3-b]пиридин-5-ильную группу, 4-хлор-1H-пирроло[2,3-b]пиридин-5-ильную группу, 3-фтор-1H-пирроло[2,3-b]пиридин-5-ильную группу, 4-фтор-1H-пирроло[2,3-b]пиридин-5-ильную группу, 3-метил-1H-пирроло[2,3-b]пиридин-5-ильную группу, 4-метил-1H-пирроло[2,3-b]пиридин-5-ильную группу, 3,4-диметил-1H-пирроло[2,3-b]пиридин-5-ильную группу, 3-фтор-4-метил-1H-пирроло[2,3-b]пиридин-5-ильную группу или 3-хлор-4-метил-1H-пирроло[2,3-b]пиридин-5-ильную группу.
B представляет собой 3-7-членную моноциклическую насыщенную или частично насыщенную циклическую углеводородную группу и в качестве составляющих кольца может содержать 1 или 2 атома кислорода, атома серы, атома азота, сульфинильные группы и/или сульфонильные группы. B также включает стереоизомерные структуры, если такие структуры имеются.
Более конкретно, B представляет собой, например, C3-7 циклоалкильную группу, фурильную группу, пиранильную группу, диоксанильную группу, пиперидильную группу, пиперазинильную группу, тиопиранильную группу, 1-оксидотиопиранильную группу или 1,1-диоксидотиопиранильную группу. B представляет собой предпочтительно C3-7 циклоалкильную группу, тетрагидрофурильную группу, дигидропиранильную группу, тетрагидропиранильную группу, диоксанильную группу, пиперидильную группу, пиперазинильную группу или 1,1-диоксидотетрагидротиопиранильную группу. B представляет собой предпочтительно циклопропильную группу, циклогексильную группу, тетрагидрофуран-3-ильную группу, 3,6-дигидро-2H-пиран-4-ильную группу, 5,6-дигидро-2H-пиран-3-ильную группу, тетрагидро-2H-пиран-2-ильную группу, тетрагидро-2H-пиран-3-ильную группу, тетрагидро-2H-пиран-4-ильную группу, пиперидин-4-ильную группу, пиперазин-1-ильную группу, морфолин-3-ильную группу, морфолин-4-ильную группу, 1,1-диоксидотетрагидро-2H-тиопиран-4-ильную группу или 1,4-диоксан-2-ильную группу. B представляет собой особенно предпочтительно циклогексильную группу, тетрагидро-2H-пиран-2-ильную группу, тетрагидро-2H-пиран-3-ильную группу, тетрагидро-2H-пиран-4-ильную группу, 5,6-дигидро-2H-пиран-3-ильную группу или 1,4-диоксан-2-ильную группу.
В общей формуле (I) -(R2)m показывает, что B замещен одинаковыми или различными R2 в количестве m. Структура, в которой B замещен R2, также включает стереоизомерные структуры, если такие структуры имеются.
R2 представляет собой заместитель, представленный на атоме углерода или атоме азота, образующем B. Когда B замещен R2 на атоме углерода, B может быть замещен одинаковыми или различными двумя R2 на атоме углерода.
R2 представляет собой заместитель, выбранный из группы, состоящей из гидрокси группы, атома галогена, циано группы, оксо группы, C1-4 алкильной группы (где C1-4 алкильная группа может быть замещена 1 или 2 C1-4 алкокси группами), C1-4 алкокси группы, галоген-C1-4 алкильной группы, C1-4 алкилсульфонильной группы, C1-4 алкилкарбонильной группы и -NR10aR10b, когда R2 представляет собой заместитель, представленный на атоме углерода, образующем B. R10a и R10b являются одинаковыми или различными и представляют собой каждый атом водорода или C1-4 алкильную группу. Предпочтительно R10a и R10b являются одинаковыми или различными и представляют собой каждый атом водорода, метильную группу или этильную группу. Более предпочтительно R10a и R10b представляют собой оба атомы водорода.
R2, в случае когда он является заместителем на атоме углерода, образующем B, представляет собой предпочтительно гидрокси группу, атом галогена, циано группу, оксо группу, C1-4 алкильную группу, C1-4 алкокси-C1-4 алкильную группу, C1-4 алкокси группу, C1-4 алкилсульфонильную группу или C1-4 алкилкарбонильную группу. R2 представляет собой предпочтительно гидрокси группу, атом фтора, атом хлора, циано группу, оксо группу, метильную группу, этильную группу, метоксиметильную группу, метокси группу, этокси группу, метилсульфонильную группу, этилсульфонильную группу или ацетильную группу. R2 представляет собой особенно предпочтительно гидрокси группу, атом фтора, циано группу, метильную группу, метоксиметильную группу или метокси группу.
R2 представляет собой заместитель, выбранный из группы, состоящей из гидрокси группы, C1-4 алкильной группы (где C1-4 алкильная группа может быть замещена 1 или 2 C1-4 алкокси группами), C1-4 алкокси группы, галоген-C1-4 алкильной группы, C1-4 алкилсульфонильной группы, C1-4 алкилкарбонильной группы и -NR10aR10b, когда R2 представляет собой заместитель, представленный на атоме азота, образующем B. R10a и R10b являются такими, как описано выше.
R2, в случае когда он является заместителем на атоме азота, образующем B, представляет собой предпочтительно C1-4 алкильную группу, C1-4 алкилсульфонильную группу или C1-4 алкилкарбонильную группу. R2 представляет собой предпочтительно метильную группу, метилсульфонильную группу или ацетильную группу.
m равно любому целому числу от 0 до 3, предпочтительно равно любому целому числу от 0 до 2 и более предпочтительно 0 или 1.
Часть структуры, содержащая B, представленная следующей формулой (IV):
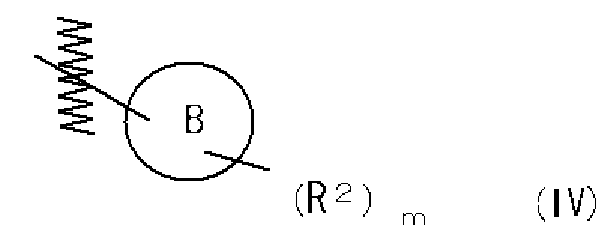
также включает стереоизомерные структуры, которые могут существовать.
Часть структуры, представленная формулой (IV), представляет собой предпочтительно циклопропильную группу, циклогексильную группу, 4-гидроксициклогексильную группу, 3-метоксициклогексильную группу, 4-метоксициклогексильную группу, 4,4-дифторциклогексильную группу, тетрагидрофуран-3-ильную группу, 4-гидрокситетрагидрофуран-3-ильную группу, 4-метокситетрагидрофуран-3-ильную группу, тетрагидро-2H-пиран-2-ильную группу, тетрагидро-2H-пиран-3-ильную группу, тетрагидро-2H-пиран-4-ильную группу, 4-гидрокситетрагидро-2H-пиран-2-ильную группу, 5-гидрокситетрагидро-2H-пиран-2-ильную группу, 5-гидрокситетрагидро-2H-пиран-3-ильную группу, 4-цианотетрагидро-2H-пиран-4-ильную группу, 3-фтортетрагидро-2H-пиран-3-ильную группу, 4-фтортетрагидро-2H-пиран-4-ильную группу, 3-метилтетрагидро-2H-пиран-3-ильную группу, 4-метилтетрагидро-2H-пиран-4-ильную группу, 2,2-диметилтетрагидро-2H-пиран-4-ильную группу, 2,6-диметилтетрагидро-2H-пиран-4-ильную группу, 3-метокситетрагидро-2H-пиран-3-ильную группу, 4-метокситетрагидро-2H-пиран-2-ильную группу, 4-метокситетрагидро-2H-пиран-4-ильную группу, 5-метокситетрагидро-2H-пиран-2-ильную группу, 5-метокситетрагидро-2H-пиран-3-ильную группу, 4-оксотетрагидро-2H-пиран-3-ильную группу, 3,6-дигидро-2H-пиран-4-ильную группу, 5,6-дигидро-2H-пиран-3-ильную группу, 1,4-диоксан-2-ильную группу, 5-метоксиметил-1,4-диоксан-2-ильную группу, 6-метоксиметил-1,4-диоксан-2-ильную группу, пиперидин-4-ильную группу, 1-метилпиперидин-4-ильную группу, 1-(метилсульфонил)пиперидин-4-ильную группу, пиперазин-1-ильную группу, 4-метилпиперазин-1-ильную группу, 4-ацетилпиперазин-1-ильную группу, 4-(метилсульфонил)пиперазин-1-ильную группу, морфолин-4-ильную группу, морфолин-3-ильную группу, 3-метилморфолин-4-ильную группу, 2,6-диметилморфолин-4-ильную группу, 5-оксоморфолин-2-ильную группу, 4-метил-5-оксо-морфолин-4-ильную группу или 1,1-диоксидотетрагидро-2H-тиопиран-4-ильную группу.
Часть структуры представляет собой предпочтительно циклогексильную группу, 4-гидроксициклогексильную группу, 3-метоксициклогексильную группу, 4-метоксициклогексильную группу, 4,4-дифторциклогексильную группу, тетрагидро-2H-пиран-2-ильную группу, тетрагидро-2H-пиран-3-ильную группу, тетрагидро-2H-пиран-4-ильную группу, 4-гидрокситетрагидро-2H-пиран-2-ильную группу, 5-гидрокситетрагидро-2H-пиран-2-ильную группу, 5-гидрокситетрагидро-2H-пиран-3-ильную группу, 4-цианотетрагидро-2H-пиран-4-ильную группу, 3-фтортетрагидро-2H-пиран-3-ильную группу, 4-фтортетрагидро-2H-пиран-4-ильную группу, 3-метилтетрагидро-2H-пиран-3-ильную группу, 4-метилтетрагидро-2H-пиран-4-ильную группу, 2,2-диметилтетрагидро-2H-пиран-4-ильную группу, 2,6-диметилтетрагидро-2H-пиран-4-ильную группу, 3-метокситетрагидро-2H-пиран-3-ильную группу, 4-метокситетрагидро-2H-пиран-2-ильную группу, 4-метокситетрагидро-2H-пиран-4-ильную группу, 5-метокситетрагидро-2H-пиран-2-ильную группу, 5-метокситетрагидро-2H-пиран-3-ильную группу, 4-оксотетрагидро-2H-пиран-3-ильную группу, 3,6-дигидро-2H-пиран-4-ильную группу, 5,6-дигидро-2H-пиран-3-ильную группу, 1,4-диоксан-2-ильную группу, 5-метоксиметил-1,4-диоксан-2-ильную группу или 6-метоксиметил-1,4-диоксан-2-ильную группу.
R3 и R4 являются одинаковыми или различными и представляют собой каждый атом водорода, атом галогена, C1-4 алкильную группу, галоген-C1-4 алкильную группу или циано группу. Предпочтительно R3 представляет собой атом водорода, атом фтора, атом хлора, циано группу или метильную группу, и R4 представляет собой атом водорода. Более предпочтительно R3 представляет собой атом водорода или метильную группу, и R4 представляет собой атом водорода.
R5 и R6 являются одинаковыми или различными и представляют собой каждый атом водорода, атом галогена или C1-4 алкильную группу, или R5 и R6 вместе могут образовывать оксо группу или вместе с атомом углерода, с которым R5 и R6 связаны, могут образовывать C3-8 циклоалкильную группу. Предпочтительно R5 и R6 являются одинаковыми или различными и представляют собой каждый атом водорода, атом галогена или C1-4 алкильную группу. Более предпочтительно R5 представляет собой атом водорода, атом фтора или метильную группу, и R6 представляет собой атом водорода или атом фтора. Особенно предпочтительно R5 представляет собой атом водорода, атом фтора или метильную группу, и R6 представляет собой атом водорода.
Q представляет собой связь или C1-4 алкиленовую группу, более предпочтительно связь, метиленовую группу или этиленовую группу и особенно предпочтительно связь или метиленовую группу.
Часть структуры, содержащая Q, R5, R6 и B, которая представлена следующей формулой (V):
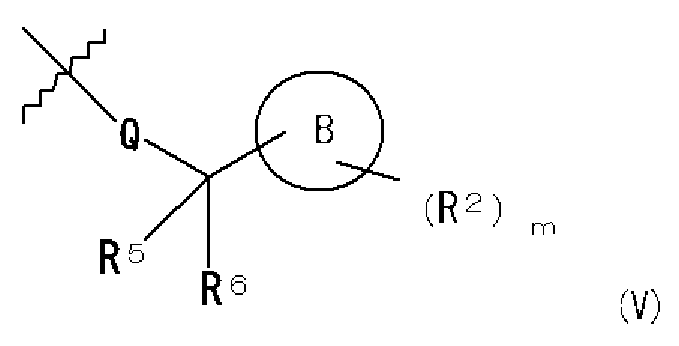
также включает стереоизомерные структуры, которые могут присутствовать.
Часть структуры, представленная формулой (V), представляет собой предпочтительно циклогексилметильную группу, 4-гидроксициклогексилметильную группу, 3-метоксициклогексилметильную группу, 4-метоксициклогексилметильную группу, 4,4-дифторциклогексилметильную группу, тетрагидро-2H-пиран-2-илметильную группу, тетрагидро-2H-пиран-3-илметильную группу, тетрагидро-2H-пиран-4-илметильную группу, 2-(тетрагидро-2H-пиран-4-ил)этильную группу, 2-фтор-2-(тетрагидро-2H-пиран-4-ил)этильную группу, 2-(тетрагидро-2H-пиран-4-ил)пропильную группу, тетрагидро-2H-пиран-3-илметильную группу, 4-гидрокситетрагидро-2H-пиран-2-илметильную группу, 5-гидрокситетрагидро-2H-пиран-2-илметильную группу, 5-гидрокситетрагидро-2H-пиран-3-илметильную группу, 4-цианотетрагидро-2H-пиран-4-илметильную группу, 3-фтортетрагидро-2H-пиран-3-илметильную группу, 4-фтортетрагидро-2H-пиран-4-илметильную группу, 3-метилтетрагидро-2H-пиран-3-илметильную группу, 4-метилтетрагидро-2H-пиран-4-илметильную группу, 2,2-диметилтетрагидро-2H-пиран-4-илметильную группу, 2,6-диметилтетрагидро-2H-пиран-4-илметильную группу, 3-метокситетрагидро-2H-пиран-3-илметильную группу, 4-метокситетрагидро-2H-пиран-2-илметильную группу, 4-метокситетрагидро-2H-пиран-4-илметильную группу, 5-метокситетрагидро-2H-пиран-2-илметильную группу, 5-метокситетрагидро-2H-пиран-3-илметильную группу, 4-оксотетрагидро-2H-пиран-3-илметильную группу, 3,6-дигидро-2H-пиран-4-илметильную группу, 2-(3,6-дигидро-2H-пиран-4-ил)этильную группу, 5,6-дигидро-2H-пиран-3-илметильную группу, 2-(5,6-дигидро-2H-пиран-3-ил)этильную группу, 1,4-диоксан-2-илметильную группу, 5-метоксиметил-1,4-диоксан-2-илметильную группу или 6-метоксиметил-1,4-диоксан-2-илметильную группу.
В общей формуле (I) в предпочтительных сочетаниях частей структуры, представленных формулами (III) и (V), когда часть структуры, представленная формулой (III), представляет собой 1H-индол-5-ильную группу, 4-фтор-1H-индол-5-ильную группу, 6-фтор-1H-индол-5-ильную группу, 7-фтор-1H-индол-5-ильную группу, 7-фтор-3-метил-1H-индол-5-ильную группу, 7-фтор-4-метил-1H-индол-5-ильную группу, 3,4-диметил-7-фтор-1H-индол-5-ильную группу, 1H-индазол-5-ильную группу, 1H-пирроло[2,3-b]пиридин-5-ильную группу, 3-хлор-1H-пирроло[2,3-b]пиридин-5-ильную группу, 4-хлор-1H-пирроло[2,3-b]пиридин-5-ильную группу, 6-хлор-1H-пирроло[2,3-b]пиридин-5-ильную группу, 3-фтор-1H-пирроло[2,3-b]пиридин-5-ильную группу, 4-фтор-1H-пирроло[2,3-b]пиридин-5-ильную группу, 6-фтор-1H-пирроло[2,3-b]пиридин-5-ильную группу, 3-метил-1H-пирроло[2,3-b]пиридин-5-ильную группу, 4-метил-1H-пирроло[2,3-b]пиридин-5-ильную группу, 6-метил-1H-пирроло[2,3-b]пиридин-5-ильную группу, 3,4-диметил-1H-пирроло[2,3-b]пиридин-5-ильную группу, 3-хлор-4-метил-1H-пирроло[2,3-b]пиридин-5-ильную группу, 3-фтор-4-метил-1H-пирроло[2,3-b]пиридин-5-ильную группу, 3-метокси-1H-пирроло[2,3-b]пиридин-5-ильную группу, 3-трифторметил-1H-пирроло[2,3-b]пиридин-5-ильную группу, 4-трифторметил-1H-пирроло[2,3-b]пиридин-5-ильную группу, 3-амино-1H-пирроло[2,3-b]пиридин-5-ильную группу, 4-амино-1H-пирроло[2,3-b]пиридин-5-ильную группу, 1H-пирроло[3,2-b]пиридин-5-ильную группу, пиразоло[1,5-a]пиримидин-6-ильную группу, 1H-пиразоло[3,4-b]пиридин-5-ильную группу, 5H-пирроло[2,3-b]пиразин-2-ильную группу, 7H-пирроло[2,3-c]пиридазин-3-ильную группу или 2-оксо-2,3-дигидро-1H-пирроло[2,3-b]пиридин-5-ильную группу, часть структуры, представленная формулой (V), представляет собой циклогексилметильную группу, 4-гидроксициклогексилметильную группу, 3-метоксициклогексилметильную группу, 4-метоксициклогексилметильную группу, 4,4-дифторциклогексилметильную группу, тетрагидро-2H-пиран-4-илметильную группу, тетрагидро-2H-пиран-4-илметильную группу, 2-(тетрагидро-2H-пиран-4-ил)этильную группу, 2-фтор-2-(тетрагидро-2H-пиран-4-ил)этильную группу, 2-(тетрагидро-2H-пиран-4-ил)пропильную группу, тетрагидро-2H-пиран-3-илметильную группу, 4-гидрокситетрагидро-2H-пиран-2-илметильную группу, 5-гидрокситетрагидро-2H-пиран-2-илметильную группу, 5-гидрокситетрагидро-2H-пиран-3-илметильную группу, 4-цианотетрагидро-2H-пиран-4-илметильную группу, 3-фтортетрагидро-2H-пиран-3-илметильную группу, 4-фтортетрагидро-2H-пиран-4-илметильную группу, 3-метилтетрагидро-2H-пиран-3-илметильную группу, 4-метилтетрагидро-2H-пиран-4-илметильную группу, 2,2-диметилтетрагидро-2H-пиран-4-илметильную группу, 2,6-диметилтетрагидро-2H-пиран-4-илметильную группу, 3-метокситетрагидро-2H-пиран-3-илметильную группу, 4-метокситетрагидро-2H-пиран-2-илметильную группу, 4-метокситетрагидро-2H-пиран-4-илметильную группу, 5-метокситетрагидро-2H-пиран-2-илметильную группу, 5-метокситетрагидро-2H-пиран-3-илметильную группу, 4-оксотетрагидро-2H-пиран-3-илметильную группу, 3,6-дигидро-2H-пиран-4-илметильную группу, 2-(3,6-дигидро-2H-пиран-4-ил)этильную группу, 5,6-дигидро-2H-пиран-3-илметильную группу, 2-(5,6-дигидро-2H-пиран-3-ил)этильную группу, 1,4-диоксан-2-илметильную группу, 5-метоксиметил-1,4-диоксан-2-илметильную группу или 6-метоксиметил-1,4-диоксан-2-илметильную группу.
Следующая общая формула (II) может быть представлена в качестве другого предпочтительного варианта осуществления соединения, представленного общей формулой (I), в соответствии с настоящим изобретением.

Здесь, в общей формуле (II), B, Q, R2, R3, R4, R5, R6 и m являются такими, как описано выше. Формулы (IV) и (V), представляющие каждая часть структуры, содержащую B в общей формуле (II), также являются такими, как описано выше.
В общей формуле (II) Z представляет собой C-R1d или атом азота. R1d представляет собой атом водорода, атом галогена или C1-4 алкильную группу и предпочтительно атом водорода, атом фтора или метильную группу.
R1a, R1b и R1c являются одинаковыми или различными и представляют собой каждый заместитель, выбранный из группы, состоящей из атома водорода, гидрокси группы, атома галогена, циано группы, C1-4 алкильной группы (где C1-4 алкильная группа может быть замещена одной или двумя одинаковыми или различными C1-4 алкокси группами или -NR7aR7b), C1-4 алкокси группы, галоген-C1-4 алкильной группы, -NR7aR7b, -C(O)R8 и -C(O)NR9aR9b. R7a, R7b, R8, R9a и R9b являются такими, как описано выше. Предпочтительно R1a, R1b и R1c являются одинаковыми или различными и представляют собой каждый атом водорода, атом галогена, C1-4 алкильную группу или C1-4 алкокси группу и более предпочтительно атом водорода, атом фтора, атом хлора, метильную группу или метокси группу. В конкретном предпочтительном сочетании R1a, R1b и R1c, R1a и R1b являются одинаковыми или различными и представляют собой каждый атом водорода, атом фтора, атом хлора или метильную группу, и R1c представляет собой атом водорода или атом фтора.
Предпочтительные примеры соединения, представленного общей формулой (I) или (II), в соответствии с настоящим изобретением включают 6-(1H-пирроло[2,3-b]пиридин-5-ил)-1-(тетрагидро-2H-пиран-4-илметил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он, 6-(7-фтор-1H-индол-5-ил)-1-(тетрагидро-2H-пиран-4-илметил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он, 6-(4-метил-1H-пирроло[2,3-b]пиридин-5-ил)-1-(тетрагидро-2H-пиран-4-илметил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он, 6-(3-метил-1H-пирроло[2,3-b]пиридин-5-ил)-1-(тетрагидро-2H-пиран-4-илметил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он, 1-[(2S)-1,4-диоксан-2-илметил]-6-(1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидроимидазо[4,5-b]пиридин-2-он, 6-(3-хлор-1H-пирроло[2,3-b]пиридин-5-ил)-1-[(2S)-1,4-диоксан-2-илметил]-1,3-дигидроимидазо[4,5-b]пиридин-2-он, 1-[(2S)-1,4-диоксан-2-илметил]-6-(4-метил-1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидроимидазо[4,5-b]пиридин-2-он, 1-[(2S)-1,4-диоксан-2-илметил]-6-(3-метил-1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидроимидазо[4,5-b]пиридин-2-он, 6-(3-хлор-1H-пирроло[2,3-b]пиридин-5-ил)-1-[(2S)-1,4-диоксан-2-илметил]-5-метил-1,3-дигидроимидазо[4,5-b]пиридин-2-он, 1-[(2S)-1,4-диоксан-2-илметил]-5-метил-6-(3-метил-1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидроимидазо[4,5-b]пиридин-2-он, 6-(3,4-диметил-1H-пирроло[2,3-b]пиридин-5-ил)-1-[(2S)-1,4-диоксан-2-илметил]-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он, 6-(3-хлор-4-метил-1H-пирроло[2,3-b]пиридин-5-ил)-1-[(2S)-1,4-диоксан-2-илметил]-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он, 1-[(2S)-1,4-диоксан-2-илметил]-6-(3-фтор-4-метил-1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он, 2,6-ангидро-1,3,4-тридеокси-5-O-метил-1-[2-оксо-6-(1H-пирроло[2,3-b]пиридин-5-ил)-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил]-L-трео-гекситол, 2,6-ангидро-1,3,5-тридеокси-4-O-метил-1-[2-оксо-6-(1H-пирроло[2,3-b]пиридин-5-ил)-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил]-L-трео-гекситол, 2,6-ангидро-1,3,5-тридеокси-4-O-метил-1-[6-(4-метил-1H-пирроло[2,3-b]пиридин-5-ил)-2-оксо-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил]-L-трео-гекситол, 2,6-ангидро-1,3,4-тридеокси-1-[6-(4-метил-1H-пирроло[2,3-b]пиридин-5-ил)-2-оксо-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил]-L-трео-гекситол, 2,6-ангидро-1,3,4-тридеокси-1-[6-(3,4-диметил-1H-пирроло[2,3-b]пиридин-5-ил)-2-оксо-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил]-L-трео-гекситол, 2,6-ангидро-1-[6-(3-хлор-4-метил-1H-пирроло[2,3-b]пиридин-5-ил)-2-оксо-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил]-1,3,4-тридеокси-L-трео-гекситол, 2,6-ангидро-1,3,4-тридеокси-5-O-метил-1-[6-(4-метил-1H-пирроло[2,3-b]пиридин-5-ил)-2-оксо-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил]-L-трео-гекситол, 2,6-ангидро-1,3,4-тридеокси-1-[6-(3,4-диметил-1H-пирроло[2,3-b]пиридин-5-ил)-2-оксо-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил]-5-O-метил-L-трео-гекситол, 2,6-ангидро-1-[6-(3-хлор-4-метил-1H-пирроло[2,3-b]пиридин-5-ил)-2-оксо-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил]-1,3,4-тридеокси-5-O-метил-L-трео-гекситол, 2,6-ангидро-1,3,4-тридеокси-1-[5-метил-2-оксо-6-(1H-пирроло[2,3-b]пиридин-5-ил)-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил]-L-трео-гекситол, 2,6-ангидро-1,3,5-тридеокси-1-[6-(3,4-диметил-1H-пирроло[2,3-b]пиридин-5-ил)-2-оксо-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил]-L-трео-гекситол, 2,6-ангидро-1,3,5-тридеокси-1-[6-(3,4-диметил-1H-пирроло[2,3-b]пиридин-5-ил)-2-оксо-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил]-4-O-метил-L-трео-гекситол и 2,6-ангидро-1-[6-(3-хлор-4-метил-1H-пирроло[2,3-b]пиридин-5-ил)-2-оксо-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил]-1,3,5-тридеокси-4-O-метил-L-трео-гекситол.
Более предпочтительные примеры соединения включают 1-[(2S)-1,4-диоксан-2-илметил]-6-(1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидроимидазо[4,5-b]пиридин-2-он, 1-[(2S)-1,4-диоксан-2-илметил]-6-(4-метил-1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидроимидазо[4,5-b]пиридин-2-он, 6-(3,4-диметил-1H-пирроло[2,3-b]пиридин-5-ил)-1-[(2S)-1,4-диоксан-2-илметил]-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он, 6-(3-хлор-4-метил-1H-пирроло[2,3-b]пиридин-5-ил)-1-[(2S)-1,4-диоксан-2-илметил]-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он, 1-[(2S)-1,4-диоксан-2-илметил]-6-(3-фтор-4-метил-1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он, 2,6-ангидро-1,3,5-тридеокси-4-O-метил-1-[6-(4-метил-1H-пирроло[2,3-b]пиридин-5-ил)-2-оксо-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил]-L-трео-гекситол, 2,6-ангидро-1,3,4-тридеокси-5-O-метил-1-[6-(4-метил-1H-пирроло[2,3-b]пиридин-5-ил)-2-оксо-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил]-L-трео-гекситол, 2,6-ангидро-1,3,4-тридеокси-1-[6-(3,4-диметил-1H-пирроло[2,3-b]пиридин-5-ил)-2-оксо-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил]-5-O-метил-L-трео-гекситол, 2,6-ангидро-1-[6-(3-хлор-4-метил-1H-пирроло[2,3-b]пиридин-5-ил)-2-оксо-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил]-1,3,4-тридеокси-5-O-метил-L-трео-гекситол, 2,6-ангидро-1,3,5-тридеокси-1-[6-(3,4-диметил-1H-пирроло[2,3-b]пиридин-5-ил)-2-оксо-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил]-4-O-метил-L-трео-гекситол и 2,6-ангидро-1-[6-(3-хлор-4-метил-1H-пирроло[2,3-b]пиридин-5-ил)-2-оксо-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил]-1,3,5-тридеокси-4-O-метил-L-трео-гекситол.
В настоящем изобретении фраза "его фармакологически приемлемая соль" относится к соли, которая может быть получена преобразованием соединения, имеющего формулу (I), в соответствии с настоящим изобретением, которое имеет основной заместитель или содержит атом азота в A и/или B, в соль общепринятым способом по желанию.
Примеры таких солей включают соли неорганических кислот, таких как гидрохлориды, гидробромиды, сульфаты, нитраты и фосфаты; соли карбоновых кислот, такие как ацетаты, фумараты, малеаты, оксалаты, малонаты, сукцинаты, цитраты и малаты; соли сульфоновых кислот, такие как метансульфонаты, этансульфонаты, бензолсульфонаты и толуолсульфонаты; и соли аминокислот, такие как глутаматы и аспартаты.
Соединение или его фармакологически приемлемая соль, имеющие формулу (I) в соответствии с настоящим изобретением, могут абсорбировать влагу, абсорбировать воду или образовывать гидрат при оставлении на воздухе или при перекристаллизации; такие гидраты также включены в настоящее изобретение.
Соединение или его фармакологически приемлемая соль, имеющие формулу (I) в соответствии с настоящим изобретением, могут образовывать сольват при взаимодействии с растворителем или при перекристаллизации; такие сольваты также включены в настоящее изобретение.
Кроме того, соединение или его фармакологически приемлемая соль, имеющие формулу (I) в соответствии с настоящим изобретением, могут существовать в виде стереоизомеров; все изомеры соединения и соли и смеси этих изомеров включены в настоящее изобретение.
Настоящее изобретение также включает соединения, меченные различными радиоизотопами или нерадиоактивными изотопами.
Соединение, имеющее формулу (I) в соответствии с настоящим изобретением, может быть легко получено методом, описанным в частях Способ 1-3 далее. Соединение может также быть получено без выполнения представленных на схемах стадий введения и удаления защитной группы.
(Способ 1)
Соединение, представленное показанной ниже формулой (I), может быть получено в соответствии со следующей реакционной схемой, например.
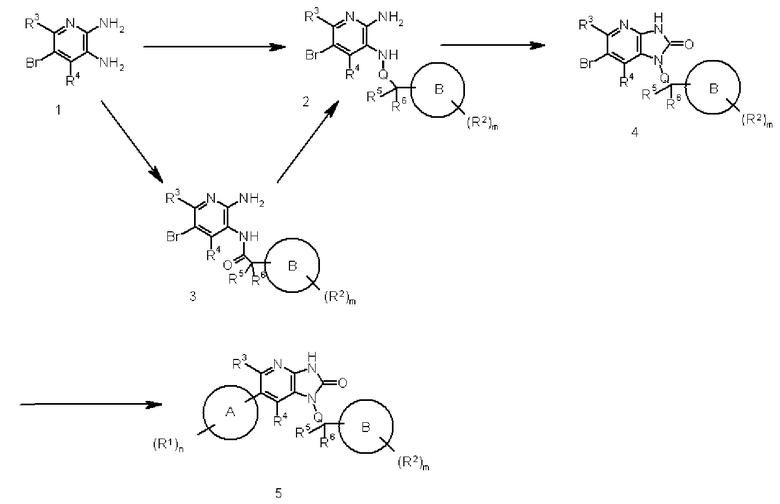
На этой схеме R1, R2, R3, R4, R5, R6 Q, A, B, m и n являются такими, как описано выше.
Каждая стадия в Способе 1 будет показана ниже.
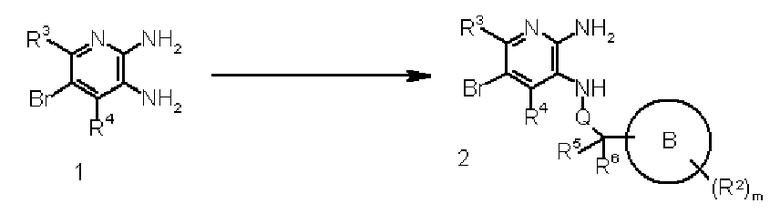
Соединение 1 преобразовывают в соединение 2 путем реакции восстановительного аминирования соединения 1 с карбонильным соединением, используя известный в органической химии метод. Взаимодействие осуществляют обрабатывая соединение 1 и карбонильное соединение цианоборгидридом натрия, боргидридом натрия или триацетоксиборгидридом натрия в подходящем растворителе, не оказывающем отрицательного воздействия на реакцию (таком как метанол, дихлорметан или уксусная кислота), при от -20°C до 100°C, предпочтительно от 0°C до 50°C, в присутствии подходящей кислоты (такой как уксусная кислота, соляная кислота или трифторуксусная кислота), например. Карбонильное соединение может быть использовано в количестве, превышающем 1 моль, предпочтительно от 1 до 5 молей, на моль соединения 1. Продолжительность реакции изменяется в пределах от 5 минут до 150 часов, обычно от 15 минут до 100 часов.
Соединение 2 может также быть получено путем реакции алкилирования соединения 1, используя известный в органической химии метод. Взаимодействие выполняют обрабатывая соединение 1 соединением алкилгалида, соединением метансульфонилоксиалкила или подобным соединением в подходящем растворителе, не оказывающем отрицательного воздействия на реакцию (таком как N,N-диметилформамид, диметилсульфоксид, 1,4-диоксан или ацетонитрил), или в растворителе, состоящем из их смеси, при температуре от 0°C до 300°C, предпочтительно от значения комнатной температуры до 150°C, в присутствии органического или неорганического основания (такого как карбонат калия, трет-бутоксид калия или триэтиламин) с добавлением подходящего вещества (такого как хлорид триэтилбензиламмония), например. Соединение алкилгалида, соединение метансульфонилоксиалкила или подобное соединение может быть использовано в количестве, превышающем 1 моль, предпочтительно от 1 до 5 моль, на моль соединения 1. Продолжительность реакции изменяется в пределах от 1 минуты до 72 часов, обычно от 5 минут до 48 часов.
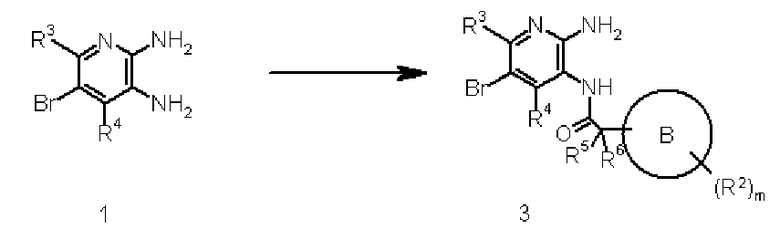
Соединение 1 преобразовывают в соединение 3 путем реакции амидирования соединения 1 с карбонильным соединением, используя известный в органической химии метод. Реакцию осуществляют взаимодействием соединения 1 с соединением карбоновой кислоты в подходящем растворителе, не оказывающем отрицательного воздействия на реакцию (таком как бензол, толуол, диэтиловый эфир, дихлорметан, тетрагидрофуран или N,N-диметилформамид), или в растворителе, состоящем из их смеси, при температуре от -30°C до температуры кипения растворителя, используемого для реакции, предпочтительно от 0°C до 50°C, в присутствии подходящего конденсирующего агента, такого как N,N-дициклогексилкарбодиимид, 1-этил-3-(3-диметиламинопропил)карбодиимид или диэтилцианофосфат. Конденсирующий агент может быть использован в количестве, превышающем 1 моль, предпочтительно от 1 до 5 моль, на моль соединения 1. Взаимодействие при необходимости может также быть выполнено добавлением основания (такого как триэтиламин, диизопропилэтиламин, N-метилморфолин или 4-диметиламинопиридин). Количество используемого основания может соответствовать каталитическому или быть избыточным. Продолжительность реакции составляет от 10 минут до 72 часов, обычно от 30 минут до 24 часов. Взаимодействие может также быть выполнено взаимодействием соединения 1 с соединением галида карбоновой кислоты в подходящем растворителе, не оказывающем отрицательного воздействия на взаимодействие (таком как бензол, толуол, диэтиловый эфир, дихлорметан, тетрагидрофуран или дихлорметан), или в растворителе, состоящем из их смеси, при температуре от -30°C до температуры кипения растворителя, используемого для реакции, предпочтительно от 0°C до 100°C, в присутствии подходящего основания (такого как триэтиламин, диизопропилэтиламин, N-метилморфолин или 4-диметиламинопиридин). Основание может быть использовано в каталитическом количестве или в избыточном количестве. Продолжительность реакции находится в пределах от 10 минут до 72 часов, обычно от 30 минут до 24 часов. Альтернативно, взаимодействие может быть выполнено взаимодействием соединения 1 с соединением карбоновой кислоты в кислотном растворителе (таком как полифосфорная кислота) при температуре от 0°C до температуры кипения растворителя, используемого для реакции, предпочтительно от 10°C до 120°C. Продолжительность реакции составляет от 10 минут до 72 часов, обычно от 30 минут до 24 часов.
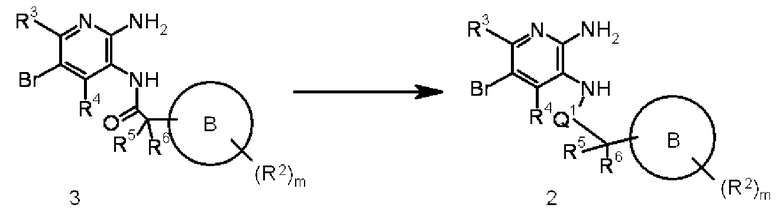
На этой схеме Q1 представляет метиленовую группу. Соединение 3 преобразовывают в соединение 2 путем реакции восстановления соединения 3, используя метод, известный в области органической химии. Взаимодействие выполняют обработкой соединения 3 подходящим восстанавливающим агентом (таким как алюмогидрид лития, диборан, боргидрид лития, комплекс боран-тетрагидрофуран или комплекс боран-диметилсульфид) в подходящем растворителе, не оказывающем отрицательного воздействия на реакцию (таком как дихлорметан, тетрагидрофуран, дихлорметан или толуол), или в растворителе, состоящем из их смеси, при температуре от -78°C до температуры кипения, используемой в реакции, предпочтительно от 0°C до 100°C, например. Восстанавливающий агент может быть использован в количестве, превышающем 1 моль, предпочтительно от 1 до 5 моль, на моль соединения 3. Взаимодействие выполняют добавлением кислоты Льюиса (такой как хлорид олова или комплекс трифторборан-простой эфир) при необходимости. Продолжительность реакции составляет от 1 минуты до 60 часов, обычно от 5 минут до 24 часов.
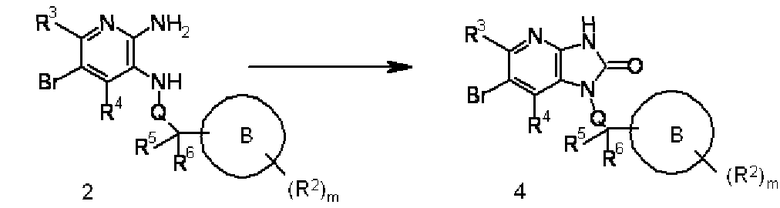
Соединение 2 преобразовывают в соединение 4 введением карбонильной группы в соединение 2, используя известный в области органической химии метод. Взаимодействие выполняют обработкой соединения 2 1,1'-карбонилдиимидазолом, карбонатом N,N'-дисукцинимидила, трифосгеном или подобным веществом в подходящем растворителе, не оказывающем отрицательного воздействия на реакцию (таком как 1,4-диоксан, тетрагидрофуран или дихлорметан), или в растворителе, состоящем из их смеси, при температуре от -10°C до температуры кипения растворителя, используемого для реакции, предпочтительно от 0°C до 100°C, например. 1,1'-Карбонилдиимидазол, карбонат N,N'-дисукцинимидила, трифосген или тому подобное может быть использовано в количестве, превышающем 1 моль, предпочтительно 1-5 моль, на моль соединения 2. Продолжительность реакции составляет от 5 минут до 60 часов, обычно от 1 до 24 часов.
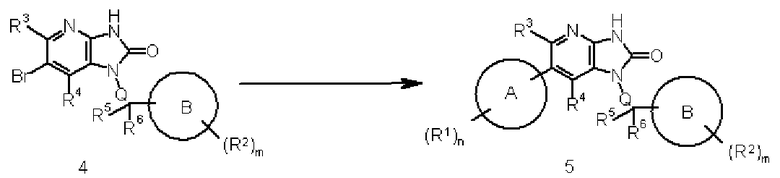
Соединение 4 преобразовывают в соединение 5 реакцией сочетания соединения 4 с соединением, образующим часть структуры, содержащей A, которая представлена указанной выше формулой (III), используя известный в области органической химии метод. Взаимодействие выполняют обработкой соединения 4 в присутствии подходящей органобороновой кислоты, органобороната, оловоорганического, цинкорганического или магнийорганического соединения и подходящего катализатора на основе металла с переходной валентностью (такого как соединение палладия), с добавлением органического или неорганического основания (такого как бикарбонат натрия, трикалий фосфат или диизопропилэтиламин), лиганда (такого как трифенилфосфин) и известной промотирующей реакции добавки (такой как хлорид лития или йодид меди), при необходимости, например.
Указанную выше реакцию сочетания осуществляют, используя подходящий растворитель, не оказывающий отрицательного воздействия на реакцию (такой как N,N-диметилформамид, тетрагидрофуран, толуол, 1,4-диоксан или вода), или растворитель, состоящий из их смеси, при температуре реакции в пределах от 0°C до 300°C, предпочтительно от комнатной температуры до 200°C. Указанную выше реакцию также осуществляют обработкой в герметически закрытом сосуде или в условиях микроволнового излучения. Органобороновая кислота или подобное вещество и основание могут быть использованы в количестве, превышающем 1 моль, предпочтительно от 1 до 5 моль, на моль соединения 3. Продолжительность реакции изменяется в пределах от 1 минуты до 60 часов, обычно от 5 минут до 24 часов.
(Способ 2)
Соединение, представленное формулой (I), которая показана ниже, может быть, например, получено в соответствии с описанной далее реакционной схемой.
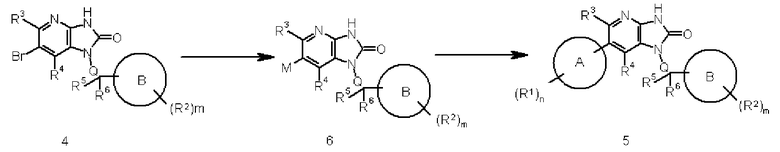
В этой схеме R1, R2, R3, R4, R5, R6, Q, A, B, m и n являются такими, как описано выше, и M представляет собой алкилолово, борат или тому подобное.
Каждая стадия в способе 2 будет показана ниже.
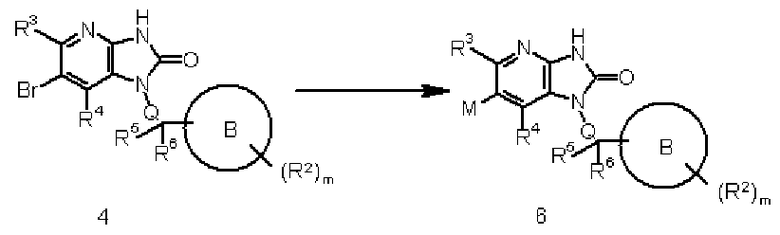
Соединение 4 преобразовывают в соединение 6 с помощью реакции обмена галоген-металл в соединении 4, используя известный в области органической химии метод. Взаимодействие осуществляют, например, обработкой соединения 4 в присутствии подходящего соединения дибороната или алкилдиолова и подходящего катализатора на основе переходного металла (такого как соединение палладия), с добавлением органического или неорганического основания (такого как ацетат калия, карбонат натрия или диизопропилэтиламин), лиганда (такого как трифенилфосфин) и известной реакционной промотирующей добавки (такой как хлорид лития или йодид меди) при необходимости.
Указанную выше реакцию осуществляют, используя подходящий растворитель, не оказывающий отрицательного воздействия на реакцию (такой как N,N-диметилформамид, тетрагидрофуран, толуол, 1,4-диоксан или вода), или растворитель, состоящий из их смеси, при температуре реакции в пределах от 0°C до 300°C, предпочтительно от комнатной температуры до 200°C. Указанную выше реакцию также осуществляют обработкой в герметически закрытом сосуде или в условиях микроволнового излучения. Диборонат или подобное вещество и основание могут быть использованы в количестве, превышающем 1 моль, предпочтительно от 1 до 5 моль, на моль соединения 4. Продолжительность реакции составляет от 1 минуты до 60 часов, обычно от 5 минут до 24 часов.
Взаимодействие также осуществляют обработкой соединения 4 основанием, таким как н-бутиллитий, втор-бутиллитий или трет-бутиллитий в количестве, превышающем 1 моль, предпочтительно от 1 до 1,5 моль, в подходящем растворителе, не оказывающем отрицательного воздействия на реакцию (таком как бензол, толуол, диэтиловый эфир или тетрагидрофуран), или в растворителе, состоящем из их смеси, при температуре от -100°C до 50°C, предпочтительно от -85°C до 10°C, и с последующим взаимодействием с металлогалидом, таким как хлорид трибутилолова, триалкилборат или тому подобное. Продолжительность реакции составляет от 1 минуты до 24 часов, обычно от 10 минут до 8 часов.
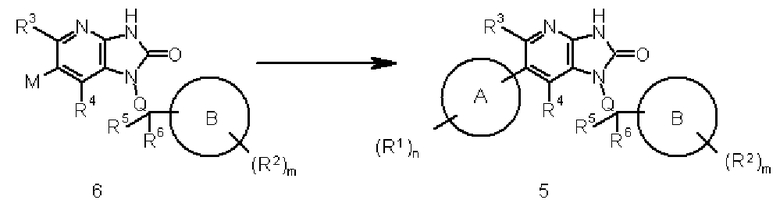
Соединение 6 преобразовывают в соединение 5 реакцией сочетания соединения 6 с соединением, образующим часть структуры, содержащей A, которое представлено формулой (III), используя известный в области органической химии метод. Взаимодействие осуществляют обработкой соединение 6 в присутствии подходящего органогалогенного соединения и подходящего катализатора на основе переходного металла (такого как соединение палладия) с добавлением, например, органического или неорганического основания (такого как бикарбонат натрия, трикалий фосфат или диизопропилэтиламин), лиганда (такого как трифенилфосфин) и известной промотирующей реакцию добавки (такой как хлорид лития или йодид меди), при необходимости.
Указанную выше реакцию сочетания осуществляют, используя подходящий растворитель, не оказывающий отрицательного воздействия на реакцию (такой как N,N-диметилформамид, тетрагидрофуран, толуол, 1,4-диоксан или вода), или растворитель, состоящий из их смеси, при температуре реакции от 0°C до 300°C, предпочтительно от комнатной температуры до 200°C. Указанную выше реакцию осуществляют обработкой в герметически закрытом сосуде или в условиях микроволнового излучения. Органобороновую кислоту или тому подобное и основание используют в количестве, превышающем 1 моль, предпочтительно от 1 до 5 моль, на моль соединения 3. Продолжительность реакции составляет от 1 минуты до 60 часов, предпочтительно от 5 минут до 24 часов.
(Способ 3)
Соединение, представленное формулой (I), показанной ниже, может быть получено, например, в соответствии со следующей реакционной схемой.
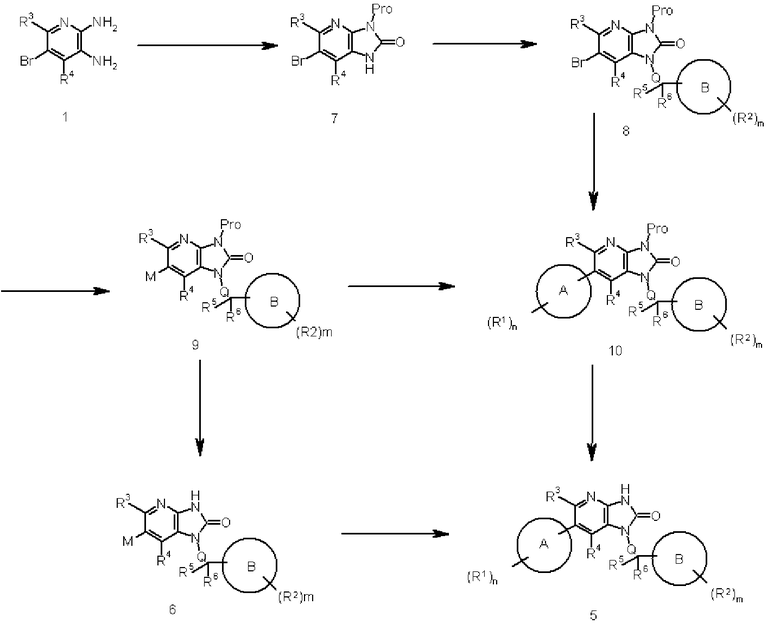
На этой схеме R1, R2, R3, R4, R5, R6, Q, A, B, m и n являются такими, как описано выше, и Pro представляет собой защитную группу.
Каждая стадия в способе 3 будет показана ниже.
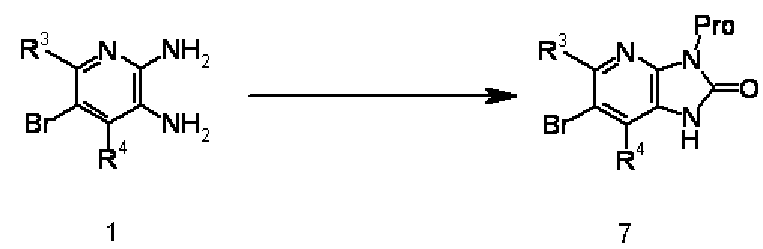
Соединение 1 преобразовывают в соединение 7 введением защитной группы (такой как циклогексеновая группа, триметилсилилэтоксиметильная группа, триметилсилилэтильная группа или цианоэтильная группа) в соответствующем положении соединения 1, используя известный в области органической химии метод. Например, когда Pro представляет собой циклогексеновую группу, взаимодействие осуществляют обработкой соединения 1 этил 2-циклогексанонкарбоксилатом в подходящем растворителе, не оказывающем отрицательного воздействия на реакцию (таком как толуол, бензол или ксилен), при нагревании с обратным холодильником. Этил 2-циклогексанонкарбоксилат используют в количестве, превышающем 1 моль, предпочтительно от 1 до 5 моль, на моль соединения 1. Продолжительность реакции составляет от 5 минут до 150 часов, предпочтительно от 60 минут до 100 часов.
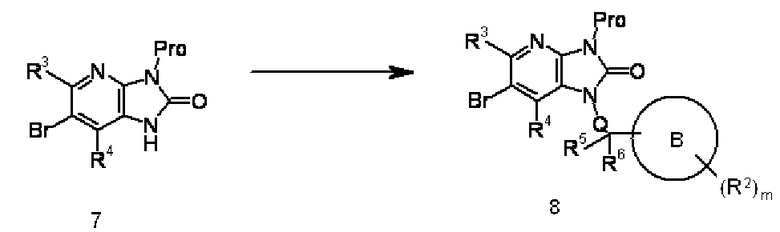
Соединение 7 может быть преобразовано в соединение 8 в соответствии с процедурой проведения реакции алкилирования, показанной в способе 1. Реакцию также осуществляют реакцией Митсунобу соединения 7, используя известный в области органической химии метод. Реакцию осуществляют взаимодействием соединения 7 с соединением спирта в подходящем растворителе, не оказывающем отрицательного воздействия на реакцию (таком как бензол, толуол, диэтиловый эфир, дихлорметан или тетрагидрофуран), или в растворителе, состоящем из их смеси, при температуре от -30°C до температуры кипения растворителя, используемого для реакции, предпочтительно от 0°C до 50°C, в присутствии цианометилентрибутилфосфорана или трифенилфосфина и подходящего реагента реакции Митсунобу, такого как диэтилазодикарбоксилат или диизопропилазодикарбоксилат. Трифенилфосфин и реагент реакции Митсунобу используют в количестве, превышающем 1 моль, предпочтительно от 1 до 5 моль, на моль соединения 7. Продолжительность реакции составляет от 10 минут до 72 часов, предпочтительно от 30 минут до 24 часов.
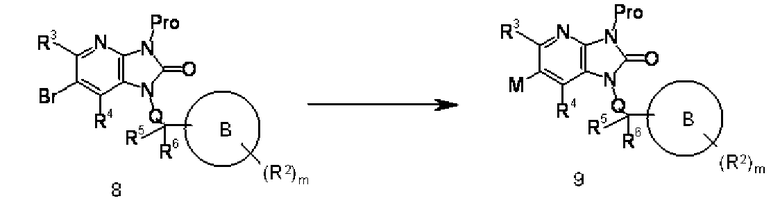
Соединение 8 может быть преобразовано в соединение 9 в соответствии с процедурой проведения реакции обмена галоген-металл, показанной в способе 2.
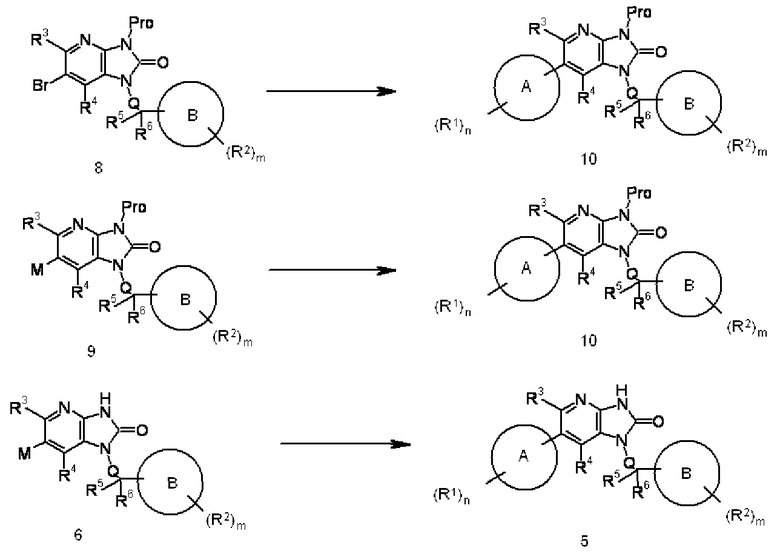
Соединение 8 может быть преобразовано в Соединение 10 в соответствии с процедурой проведения реакции сочетания, показанной в способе 1. Соединение 9 может быть преобразовано в соединение 10 и соединение 6 может быть преобразовано в соединение 5 в соответствии с процедурой проведения реакции сочетания, показанной в способе 2.
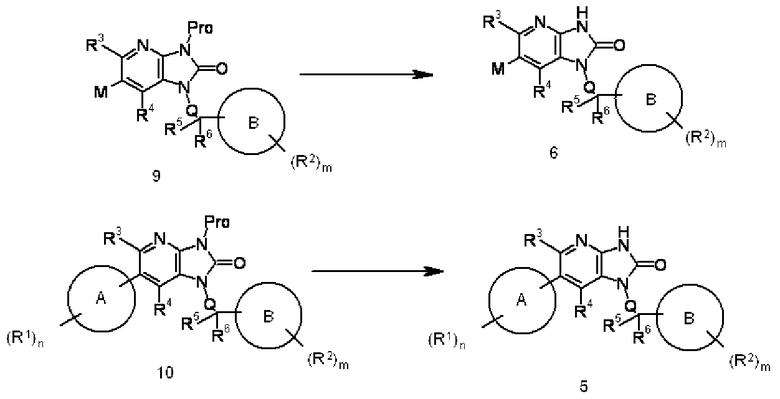
Соединение 9 преобразовывают в соединение 6 и соединение 10 преобразовывают в соединение 5 с помощью реакции удаления защитной группы в соединении 9 или 10, используя известный в области органической химии метод. Например, когда Pro представляет собой циклогексеновую группу, взаимодействие осуществляют обработкой соединения 9 или 10 подходящей кислотой (такой как серная кислота, соляная кислота или трифторуксусная кислота) в подходящем растворителе, не оказывающем отрицательного воздействия на реакцию (таком как этанол, метанол, пропанол или вода), или в растворителе, состоящем из их смеси, при температуре реакции от 0°C до 200°C, предпочтительно от комнатной температуры до 150°C. Кислоту используют в количестве, превышающем 1 моль на моль соединения 9 или 10. Продолжительность реакции составляет от 1 минуты до 500 часов, предпочтительно от 5 минут до 200 часов.
Соединение, имеющее формулу (I) в соответствии с настоящим изобретением, может также быть получено, используя промежуточное соединение, описанное в WO 2008/051493.
Соединение или его фармакологически приемлемая соль, имеющая формулу (I) в соответствии с настоящим изобретением, используемое в качестве вышеуказанного терапевтического средства или профилактического средства, может быть введено перорально в виде таблеток, капсул, гранул, порошка или сиропа или введено парентерально в виде инъекции или суппозитория, например, самостоятельно или в смеси с подходящим фармакологически приемлемым эксципиентом, разбавителем или тому подобным.
Эти лекарственные средства получают хорошо известными способами, используя добавки, такие как эксципиенты (примеры которых включают органические эксципиенты, такие как производные сахара, такие как лактоза, сахароза, глюкоза, маннит и сорбит; производные крахмала, такие как кукурузный крахмал, картофельный крахмал, α-крахмал и декстрин; производные целлюлозы, такие как кристаллическая целлюлоза; гуммиарабик; декстран; и пуллулан; и неорганические эксципиенты, такие как силикатные производные, такие как легкий кремниевый ангидрид, преобразованный силикат алюминия, силикат кальция и алюминометасиликат магния; фосфаты, такие как гидрофосфат кальция; карбонаты, такие как карбонат кальция; и сульфаты, такие как сульфат кальция), лубриканты (примеры которых включают стеариновую кислоту и соли, образованные металлами и стеариновой кислотой, такие как стеарат кальция и стеарат магния; тальк; коллоидный диоксид кремния; воски, такие как вигум и спермацет; борная кислота; адипиновая кислота; сульфаты, такие как сульфат натрия; гликоль; фумаровая кислота; бензоат натрия; DL-лейцин; натриевые соли жирной кислоты; лаурилсульфаты, такие как лаурилсульфат натрия и лаурилсульфат магния; кремниевые кислоты, такие как кремниевый ангидрид и гидрат кремниевой кислоты; и вышеуказанные производные крахмала), связующие вещества (примеры которых включают гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу, поливинилпирролидон, макрогол и соединения, аналогичные вышеуказанным эксципиентам), дезинтегрирующие вещества (примеры которых включают производные целлюлозы, такие как низкозамещенная гидроксипропилцеллюлоза, карбоксиметилцеллюлоза, кальций карбоксиметилцеллюлоза и поперечно-сшитая натрий карбоксиметилцеллюлоза; и химически модифицированные крахмалы, такие как карбоксиметил-крахмал, карбоксиметил-крахмал натрия и поперечно-сшитый поливинилпирродидон), стабилизаторы (примеры которых включают парагидроксибензоаты, такие как метилпарабен и пропилпарабен; спирты, такие как хлорбутанол, бензиловый спирт и фенилэтиловый спирт; бензалконий хлорид; фенолы, такие как фенол и крезол; тимеросал; дегидроуксусная кислота; и сорбиновая кислота), модификаторы вкуса (примеры которых включают обычно используемые подсластители, подкислители и ароматизаторы) и разбавители.
Доза соединения по настоящему изобретению может значительно изменяться в зависимости от различных условий, таких как активность вещества и симптомов, возраст и вес тела пациента (теплокровного животного, в частности человека). Для перорального введения однократная доза соединения желательно находится в пределах от минимальной, равной 0,01 мг на кг веса тела, до максимальной, равной 5000 мг на кг веса тела, или для внутривенного введения однократная доза соединения находится в пределах от минимальной, равной 0,001 мг на кг веса тела, до максимальной, равной 5000 мг на кг веса тела, принимаемая от одного до нескольких раз в день в зависимости от симптомов заболевания. Доза предпочтительно находится в пределах от 0,1 мг на кг веса тела до 100 мг на кг веса тела в день.
ПРИМЕРЫ
Настоящее изобретение будет описано более поднобно с помощью следующих примеров, примеров получения и примеров исследований; однако эти примеры являются только иллюстративными и могут быть изменены без выхода за рамки объема настоящего изобретения.
(Пример 1)
1-(Циклопропилметил)-6-(1H-индол-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
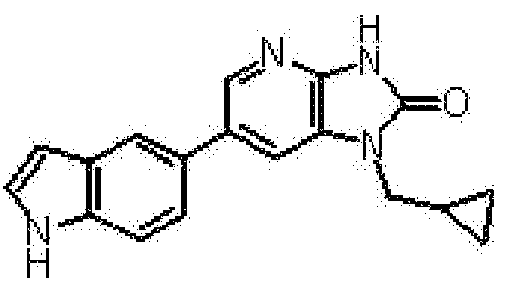
Стадия 1
5-Бром-N3-(циклопропилметил)пиридин-2,3-диамин
В раствор 2,3-диамино-5-бромпиридина (1000 мг) в дихлорметане (25 мл) при комнатной температуре добавляли уксусную кислоту (304 мкл) и циклопропанкарбальдегид (406 мкл), затем перемешивали в течение 1 часа. К реакционному раствору при охлаждении льдом добавляли тетрагидроборат натрия (604 мг) и смесь перемешивали с нагреванием до комнатной температуры в течение 22 часов. Реакционный раствор экстрагировали добавлением насыщенного водного раствора бикарбоната натрия и дихлорметана. Полученный органический слой промывали насыщенным солевым раствором и сушили над безводным сульфатом натрия. Растворитель упаривали при пониженном давлении. Полученный остаток очищали колоночной флеш-хроматографией с получением указанного в заголовке соединения (286 мг).
MS (ESI) m/z: 243 (M+H)+.
1H-ЯМР (CDCl3) δ: 0,24-0,30 (2H, м), 0,57-0,64 (2H, м), 1,06-1,19 (1H, м), 2,86-2,93 (2H, м), 3,38 (1H, ушир. с), 4,16 (2H, ушир. с), 6,84 (1H, д, J=1,8 Гц), 7,62 (1H, д, J=1,8 Гц).
Стадия 2
6-Бром-1-(циклопропилметил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
В раствор соединения, полученного на описанной выше стадии 1 (280 мг), в тетрагидрофуране (11 мл) добавляли 1,1'-карбонилбис-1H-имидазол (281 мг) и смесь нагревали с обратным холодильником в течение 8 часов. После охлаждения до комнатной температуры растворитель упаривали при пониженном давлении. Полученный остаток кристаллизовали добавлением дихлорметана и гексана. Это вещество собирали фильтрованием, промывали гексаном и затем сушили при пониженном давлении с получением указанного в заголовке соединения (273 мг).
MS (ESI) m/z: 268 (M+H)+.
1H-ЯМР (CDCl3) δ: 0,40-0,47 (2H, м), 0,58-0,64 (2H, м), 1,14-1,26 (1H, м), 3,73 (2H, д, J=7,3 Гц), 7,38 (1H, д, J=1,8 Гц), 8,10 (1H, д, J=1,8 Гц), 9,08 (1H, ушир. с).
Стадия 3
1-(Циклопропилметил)-6-(1H-индол-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
К смешанному раствору соединения, полученного на вышеописанной стадии 2 (41 мг), в смеси 1,4-диоксан-дистиллированная вода (1,6 мл - 0,4 мл) добавляли карбонат калия (63 мг), 5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-индол (37 мг) и тетракистрифенилфосфин палладий (18 мг) и смесь нагревали с обратным холодильником при 170°C в течение 30 минут, используя микроволновой реактор. Реакционный раствор охлаждали до комнатной температуры и разделяли добавлением этилацетата и дистиллированной воды. Полученный органический слой промывали насыщенным солевым раствором и сушили над безводным сульфатом натрия. Растворитель упаривали при пониженном давлении. Полученный остаток очищали тонкослойной хроматографией (элюируя смесью дихлорметан-метанол) с получением указанного в заголовке соединения (37 мг).
HRMS (ESI) [(M+H)+] вычислено: C18H17N4O 305,14024; найдено: 305,14092.
1H-ЯМР (ДМСО-d6) δ: 0,34-0,52 (4H, м), 1,21-1,32 (1H, м), 3,78 (2H, д, J=6,9 Гц), 6,46-6,51 (1H, м), 7,37-7,44 (2H, м), 7,48 (1H, д, J=8,3 Гц), 7,84 (2H, дд, J=9,4, 1,8 Гц), 8,20 (1H, д, J=1,8 Гц), 11,16 (1H, ушир. с), 11,52 (1H, ушир. с).
(Пример 2)
6-(1H-Индол-5-ил)-1-(тетрагидро-2H-пиран-4-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
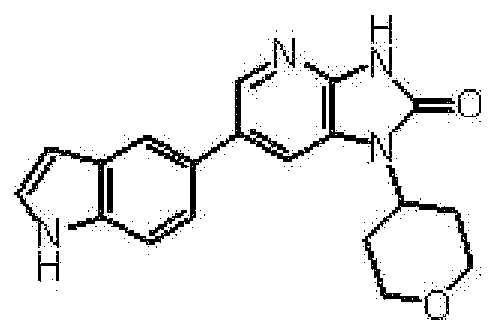
Стадия 1
5-Бром-N3-(тетрагидро-2H-пиран-4-ил)пиридин-2,3-диамин
2,3-Диамино-5-бромпиридин (1,0 г) и тетрагидро-4-пиран-4-он (0,69 г) растворяли в уксусной кислоте (20 мл). После перемешивания при комнатной температуре в течение некоторого времени добавляли тетрагидроборат натрия (0,6 г) и смесь перемешивали при комнатной температуре в течение 16 часов. Реакционный раствор концентрировали, разбавляли этилацетатом, промывали насыщенным водным раствором бикарбоната натрия и насыщенным солевым раствором и сушили над безводным сульфатом натрия. Растворитель упаривали при пониженном давлении. Полученный остаток очищали колоночной флеш-хроматографией (элюируя смесью этилацетат-гексан) с получением указанного в заголовке соединения (254 мг).
MS (ESI) m/z: 272 (M+H)+.
1H-ЯМР (CDCl3) δ: 1,50-1,54 (2H, м), 2,01-2,04 (2H, м), 3,15-3,18 (1H, м), 3,40-3,43 (1H, м), 3,52-3,55 (2H, м), 4,01-4,04 (2H, м), 4,12-4,13 (2H, м), 6,90 (1H, д, J=2,2 Гц), 7,64 (1H, д, J=2,2 Гц).
Стадия 2
6-Бром-1-(тетрагидро-2H-пиран-4-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (167 мг) получали способом, аналогичным применяемому на стадии 2 примера 1, используя соединение, полученное на вышеуказанной стадии 1 (287 мг).
MS (ESI) m/z: 298 (M+H)+.
1H-ЯМР (CDCl3) δ: 1,80-1,83 (2H, м), 2,31-2,38 (2H, м), 3,54-3,57 (2H, м), 4,14-4,17 (2H, м), 4,58-4,62 (1H, м), 7,55 (1H, д, J=2,0 Гц), 8,11 (1H, д, J=2,0 Гц), 9,51 (1H, ушир. с).
Стадия 3
6-(1H-Индол-5-ил)-1-(тетрагидро-2H-пиран-4-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (10 мг) получали способом, аналогичным применяемому на стадии 3 примера 1, используя соединение, полученное на вышеуказанной стадии 2 (48 мг).
HRMS (ESI) [(M+H)+] вычислено: C19H19N4O2 335,15080; найдено: 335,15316.
1H-ЯМР (ДМСО-d6) δ: 1,66-1,76 (2H, м), 2,36-2,49 (2H, м), 3,49 (2H, т, J=11,0 Гц), 4,00 (2H, дд, J=11,0, 4,1 Гц), 4,45-4,56 (1H, м), 6,47-6,52 (1H, м), 7,37-7,44 (2H, м), 7,48 (1H, д, J=8,3 Гц), 7,81 (1H, д, J=1,8 Гц), 7,84-7,88 (1H, м), 8,19 (1H, д, J=1,8 Гц), 11,15 (1H, ушир. с), 11,55 (1H, ушир. с).
(Пример 3)
6-(1H-Индол-5-ил)-1-[2-(тетрагидро-2H-пиран-4-ил)этил]-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
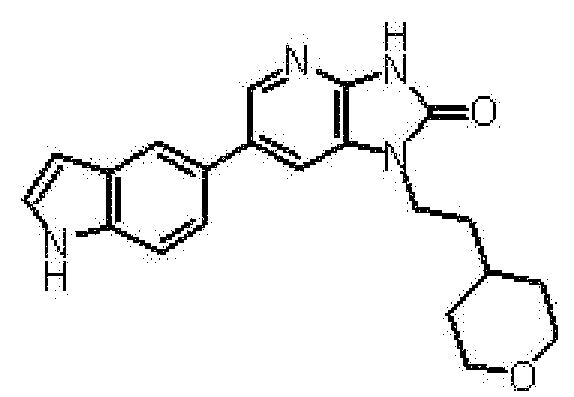
Стадия 1
5-Бром-N3-[2-(тетрагидро-2H-пиран-4-ил)этил]пиридин-2,3-диамин
Указанное в заголовке соединение (445 мг) получали способом, аналогичным применяемому на стадии 1 примера 2, используя 2,3-диамино-5-бромпиридин (1,0 г) и тетрагидро-2H-пиран-4-илацетальдегид (0,89 г).
MS (ESI) m/z: 300 (M+H)+.
Стадия 2
6-Бром-1-(тетрагидро-2H-пиран-4-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (707 мг) получали способом, аналогичным применяемому на стадии 2 примера 1, используя соединение, полученное на вышеуказанной стадии 1 (966 мг).
MS (ESI) m/z: 326 (M+H)+.
1H-ЯМР (CDCl3) δ: 1,32-1,71 (7H, м), 3,35-3,41 (2H, м), 3,89-3,91 (2H, м), 3,98-4,01 (2H, м), 7,30 (1H, д, J=2,0 Гц), 8,12 (1H, д, J=2,0 Гц), 10,32 (1H, ушир. с).
Стадия 3
6-(1H-Индол-5-ил)-1-[2-(тетрагидро-2H-пиран-4-ил)этил]-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (16 мг) получали способом, аналогичным применяемому на стадии 3 примера 1, используя соединение, полученное на вышеуказанной стадии 2 (61 мг).
HRMS (ESI) [(M+H)+] вычислено: C21H23N4O2 363,18210; найдено: 363,18482.
1H-ЯМР (ДМСО-d6) δ: 1,12-1,29 (2H, м), 1,45-1,73 (5H, м), 3,19-3,31 (2H, м), 3,76-3,96 (4H, м), 6,47-6,51 (1H, м), 7,38-7,43 (2H, м), 7,48 (1H, д, J=8,7 Гц), 7,74 (1H, д, J=1,8 Гц), 7,84 (1H, с), 8,19 (1H, д, J=1,8 Гц), 11,16 (1H, ушир. с), 11,51 (1H, ушир. с).
(Пример 4)
6-(1H-Индол-5-ил)-1-(тетрагидро-2H-пиран-4-илметил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
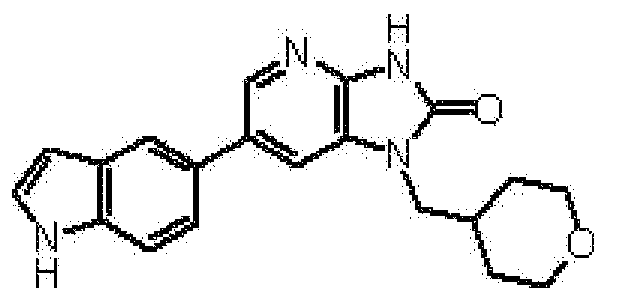
Стадия 1
6-Бром-1-(тетрагидро-2H-пиран-4-илметил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (809 мг) получали в виде бесцветного аморфного твердого вещества способом, аналогичным применяемому на стадии 2 примера 1, используя 5-бром-N3-(тетрагидро-2H-пиран-4-илметил)пиридин-2,3-диамин, полученный способом, описанным в WO 2006/126081 (830 мг).
MS (FAB) m/z: 311M+.
1H-ЯМР (CDCl3) δ: 1,39-1,51 (2H, м), 1,55-1,67 (3H, м), 2,05-2,17 (1H, м), 3,36 (2H, т, J=11,5 Гц), 3,73 (2H, д, J=7,2 Гц), 3,99 (2H, дд, J=11,5, 3,2 Гц), 7,31 (1H, д, J=1,7 Гц), 8,12 (1H, д, J=1,7 Гц), 10,01 (1H, ушир. с).
Стадия 2
6-(1H-Индол-5-ил)-1-(тетрагидро-2H-пиран-4-илметил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Соединение, полученное на описанной выше стадии 1 (50 мг), суспендировали в 1,4-диоксане (2 мл) и добавляли 5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-индол (39 мг), карбонат натрия (17 мг), бромид тетрабутиламмония (5 мг), тетракистрифенилфосфин палладий (18 мг) и воду (1 мл). Смесь нагревали с перемешиванием в атмосфере азота при 85°C в течение ночи. Реакционный раствор охлаждали до комнатной температуры и разделяли добавлением этилацетата и воды. Органический слой сушили над безводным сульфатом натрия и потом растворитель упаривали при пониженном давлении. Остаток очищали тонкослойной хроматографией с силикагелем (элюируя смесью хлороформ-метанол) с получением указанного в заголовке соединения (36 мг) в виде бесцветного аморфного твердого вещества.
HRMS (ESI) [(M+H)+] вычислено: C20H21N4O2 349,16645; найдено: 349,16738.
(Пример 5)
6-Хинолин-3-ил-1-(тетрагидро-2H-пиран-4-илметил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
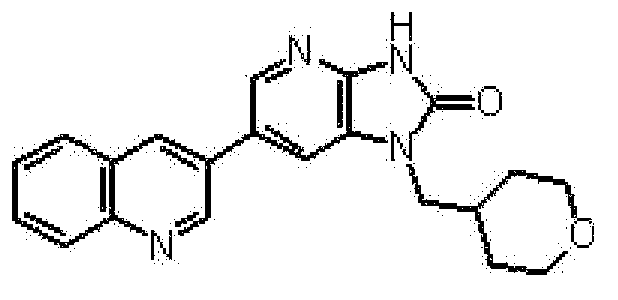
Указанное в заголовке соединение (34 мг) получали способом, аналогичным применяемому на стадии 3 примера 1, используя соединение, полученное на стадии 1 примера 4 (46 мг).
HRMS (ESI) [(M+H)+] вычислено: C21H21N4O2 361,16645; найдено: 361,16530.
1H-ЯМР (ДМСО-d6) δ: 1,26-1,41 (2H, м), 1,47-1,57 (2H, м), 2,05-2,20 (1H, м), 3,19-3,30 (2H, м), 3,76-3,87 (4H, м), 7,63-7,71 (1H, м), 7,75-7,81 (1H, м), 8,03-8,12 (3H, м), 8,45 (1H, д, J=1,8 Гц), 8,69 (1H, д, J=2,3 Гц), 9,31 (1H, д, J=2,3 Гц), 11,75 (1H, ушир. с).
(Пример 6)
1-(Циклогексилметил)-6-(1H-индол-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
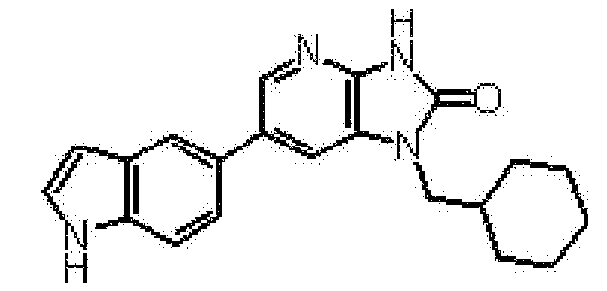
Стадия 1
5-Бром-N3-(циклогексилметил)пиридин-2,3-диамин
Указанное в заголовке соединение (263 мг) получали способом, аналогичным применяемому на стадии 1 примера 1, используя 2,3-диамино-5-бромпиридин (1,0 г) и циклогексанкарбальдегид (591 мг).
MS (ESI) m/z: 284 (M+H)+.
1H-ЯМР (CDCl3) δ: 0,95-1,08 (2H, м), 1,16-1,35 (4H, м), 1,67-1,88 (4H, м), 2,89 (2H, д, J=6,9 Гц), 4,11 (1H, ушир. с), 5,51 (2H, ушир. с), 7,13 (1H, д, J=1,8 Гц), 7,91 (1H, д, J=1,8 Гц).
Стадия 2
6-Бром-1-(циклогексилметил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (116 мг) получали способом, аналогичным применяемому на стадии 2 примера 1, используя соединение, полученное на вышеуказанной стадии 1 (260 мг).
1H-ЯМР (CDCl3) δ: 0,96-1,11 (2H, м), 1,14-1,35 (4H, м), 1,64-1,88 (4H, м), 3,65 (2H, д, J=7,3 Гц), 4,15 (1H, ушир. с), 7,29 (1H, д, J=1,8 Гц), 8,07 (1H, д, J=1,8 Гц).
Стадия 3
1-(Циклогексилметил)-6-(1H-индол-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (23 мг) получали способом, аналогичным применяемому на стадии 3 примера 1, используя соединение, полученное на вышеуказанной стадии 2 (47 мг).
HRMS (ESI) [(M+H)+] вычислено: C21H23N4O 347,18719; найдено: 347,18864.
1H-ЯМР (ДМСО-d6) δ: 0,96-1,25 (6H, м), 1,55-1,71 (4H, м), 1,77-1,90 (1H, м), 3,71 (2H, д, J=7,3 Гц), 6,47-6,51 (1H, м), 7,37-7,43 (2H, м), 7,48 (1H, д, J=8,3 Гц), 7,76 (1H, д, J=1,8 Гц), 7,84 (1H, д, J=1,8 Гц), 8,18 (1H, д, J=1,8 Гц), 11,16 (1H, ушир. с), 11,50 (1H, ушир. с).
(Пример 7)
6-(1H-Индол-5-ил)-5-метил-1-(тетрагидро-2H-пиран-4-илметил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
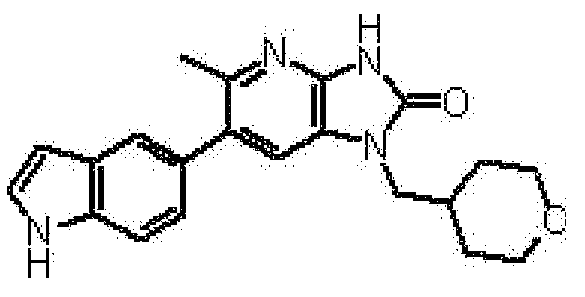
Стадия 1
5-Бром-6-метил-3-нитропиридин-2-амин
В раствор 6-амино-3-бром-2-метилпиридина (7,2 г) в концентрированной серной кислоте (39 мл) при охлаждении льдом в течение 30 минут добавляли по каплям азотную кислоту (2,9 мл) и смесь перемешивали при такой же температуре в течение одного часа. После дополнительного перемешивания при комнатной температуре в течение одного часа реакционный раствор выливали в ледяную воду. Добавляли 50% водный раствор гидроксида натрия и полученный осадок собирали фильтрованием, промывали дистиллированной водой и затем сушили при пониженном давлении с получением указанного в заголовке соединения (9,0 г).
1H-ЯМР (CDCl3) δ: 2,57 (3H, с), 8,51 (1H, с).
Стадия 2
5-Бром-6-метилпиридин-2,3-диамин
Дистиллированню воду (9 мл) и железный порошок (21,6 г) добавляли в раствор соединения, полученного на описанной выше стадии 1 (8,9 мг), в этаноле (36 мл). Дополнительно добавляли концентрированную соляную кислоту (0,4 мл) и смесь нагревали с обратным холодильником в течение одного часа. Потом добавляли железный порошок (21,6 г) и смесь нагревали с обратным холодильником в течение одного часа. Реакционный раствор охлаждали до комнатной температуры, фильтровали через целит 545 и промывали этанолом. Фильтрат концентрировали при пониженном давлении с получением указанного в заголовке соединения (5,5 г).
1H-ЯМР (CDCl3) δ: 2,42 (3H, с), 3,22 (2H, ушир. с), 4,20 (2H, ушир. с), 7,03 (1H, с).
Стадия 3
5-Бром-6-метил-N3-(тетрагидро-2H-пиран-4-илметил)пиридин-2,3-диамин
Указанное в заголовке соединение (619 мг) получали способом, аналогичным применяемому на стадии 1 примера 1, используя соединение, полученное на вышеуказанной стадии 2 (1500 мг), и тетрагидро-2H-пиран-4-карбальдегид (915 мг).
1H-ЯМР (CDCl3) δ: 1,33-1,47 (2H, м), 1,68-1,77 (2H, м), 1,79-1,92 (1H, м), 2,42 (3H, с), 2,95 (2H, д, J=6,9 Гц), 3,07 (1H, ушир. с), 3,37-3,46 (2H, м), 3,97-4,05 (2H, м), 4,11 (2H, ушир. с), 6,91 (1H, с).
Стадия 4
6-Бром-5-метил-1-(тетрагидро-2H-пиран-4-илметил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (462 мг) получали способом, аналогичным применяемому на стадии 2 примера 1, используя соединение, полученное на вышеуказанной стадии 3 (618 мг).
1H-ЯМР (CDCl3) δ: 1,37-1,50 (2H, м), 1,55-1,63 (2H, м), 2,03-2,18 (1H, м), 2,65 (3H, с), 3,31-3,41 (2H, м), 3,70 (2H, д, J=7,3 Гц), 4,02-3,94 (2H, м), 7,32 (1H, с).
Стадия 5
6-(1H-Индол-5-ил)-5-метил-1-(тетрагидро-2H-пиран-4-илметил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (33 мг) получали способом, аналогичным применяемому на стадии 3 примера 1, используя соединение, полученное на вышеуказанной стадии 4 (60 мг).
HRMS (ESI) [(M+H)+] вычислено: C21H23N4O2 363,18210; найдено: 363,18238.
1H-ЯМР (ДМСО-d6) δ: 1,18-1,33 (2H, м), 1,42-1,52 (2H, м), 1,94-2,08 (1H, м), 2,37 (3H, с), 3,15-3,26 (2H, м), 3,66-3,72 (2H, м), 3,76-3,84 (2H, м), 6,47 (1H, ушир. с), 7,09 (1H, д, J=8,7 Гц), 7,37-7,41 (2H, м), 7,46 (1H, д, J=8,3 Гц), 7,51 (1H, с), 11,16 (1H, ушир. с), 11,40 (1H, ушир. с).
(Пример 8)
6-(1H-Индол-5-ил)-7-метил-1-(тетрагидро-2H-пиран-4-илметил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
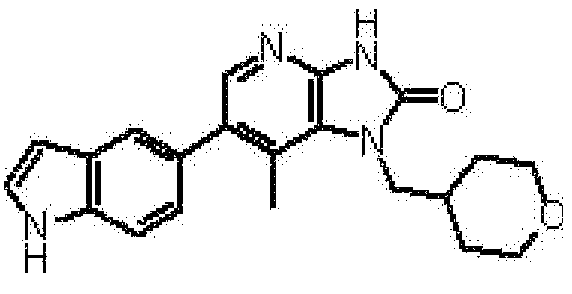
Стадия 1
5-Бром-4-метил-3-нитропиридин-2-амин
В раствор 5-бром-4-метилпиридин-2-амина (2,0 г) в концентрированной серной кислоте (8,7 мл) при 55°C в течение 30 минут добавляли по каплям азотную кислоту (0,7 мл) и смесь перемешивали при такой же температуре в течение 3 часов. После дополнительного перемешивания при комнатной температуре в течение 2 часов реакционный раствор выливали в ледяную воду. Добавляли 50% водный раствор гидроксида натрия и полученный осадок собирали фильтрованием, промывали дистиллированной водой и затем сушили при пониженном давлении с получением указанного в заголовке соединения (2,5 г).
MS (ESI) m/z: 268 (M+H)+.
1H-ЯМР (CDCl3) δ: 2,54 (3H, с), 5,83 (2H, ушир. с), 8,29 (1H, с).
Стадия 2
5-Бром-4-метилпиридин-2,3-диамин
В раствор соединения, полученного на описанной выше стадии 1 (1354 мг), в этаноле (20 мл) добавляли дистиллированную воду (4 мл) и железный порошок (3260 мг). Далее добавляли концентрированную соляную кислоту (2,0 мл) и смесь нагревали с обратным холодильником в течение одного часа. Реакционный раствор охлаждали до комнатной температуры и потом доводили до pH 9 добавлением 1н. водного раствора гидроксида натрия. Смешанный раствор фильтровали через целит 545 и промывали этанолом. Фильтрат концентрировали при пониженном давлении с получением указанного в заголовке соединения (934 мг).
1H-ЯМР (CDCl3) δ: 2,28 (3H, с), 3,39 (2H, ушир. с), 4,10 (2H, ушир. с), 7,77 (1H, с).
Стадия 3
5-Бром-4-метил-N3-(тетрагидро-2H-пиран-4-илметил)пиридин-2,3-диамин
Указанное в заголовке соединение (390 мг) получали способом, аналогичным применяемому на стадии 1 примера 1, используя соединение, полученное на вышеуказанной стадии 2 (1410 мг), и тетрагидро-2H-пиран-4-карбальдегид (860 мг).
1H-ЯМР (CDCl3) δ: 1,32-1,50 (2H, м), 1,71-1,81 (3H, м), 2,32 (3H, с), 2,73-2,79 (2H, м), 3,38-3,48 (2H, м), 3,98-4,06 (2H, м), 4,72 (2H, ушир. с), 7,89 (1H, д, J=4,1 Гц).
Стадия 4
6-Бром-7-метил-1-(тетрагидро-2H-пиран-4-илметил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (190 мг) получали способом, аналогичным применяемому на стадии 2 примера 1, используя соединение, полученное на вышеуказанной стадии 3 (288 мг).
MS (ESI) m/z: 326 (M+H)+.
1H-ЯМР (CDCl3) δ: 1,45-1,57 (4H, м), 1,89-2,04 (1H, м), 2,60 (3H, с), 3,29-3,39 (2H, м), 3,93-4,03 (4H, м), 8,15 (1H, с), 8,77 (1H, ушир. с).
Стадия 5
6-(1H-Индол-5-ил)-7-метил-1-(тетрагидро-2H-пиран-4-илметил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (33 мг) получали способом, аналогичным применяемому на стадии 3 примера 1, используя соединение, полученное на вышеуказанной стадии 4 (92 мг).
HRMS (ESI) [(M+H)+] вычислено: C21H23N4O2 363,18210; найдено: 363,18512.
1H-ЯМР (ДМСО-d6) δ: 1,21-1,37 (2H, м), 1,45-1,54 (2H, м), 1,91-2,07 (1H, м), 2,39 (3H, с), 3,21-3,33 (2H, м), 3,78-3,92 (4H, м), 6,44-6,49 (1H, м), 7,04 (1H, дд, J=8,3, 1,4 Гц), 7,38-7,42 (1H, м), 7,43-7,49 (2H, м), 7,77 (1H, с), 11,19 (1H, ушир. с), 11,53 (1H, ушир. с).
(Пример 9)
6-(1H-Индол-5-ил)-1-{[1-(метансульфонил)пиперидин-4-ил]метил}-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
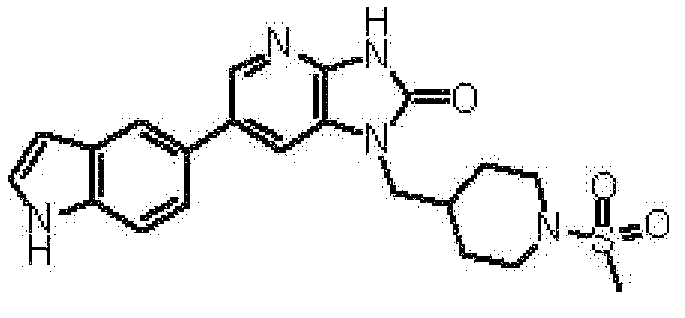
Стадия 1
1-(Метансульфонил)пипиридин-4-карбальдегид
[1-(Метансульфонил)пиперидин-4-ил]метанол, полученный способом, описанным в US 2002/895374 (1,00 г), растворяли в дихлорметане (20 мл). Добавляли реагент Десс-Мартина (2,19 г) и смесь перемешивали при комнатной температуре в течение одного часа. К реакционному раствору добавляли водный раствор тиосульфата натрия и насыщенный водный раствор бикарбоната натрия, затем экстрагировали хлороформом. Органический слой сушили над безводным сульфатом натрия и потом растворитель упаривали при пониженном давлении с получением указанного в заголовке соединения (1,04 г).
Стадия 2
5-Бром-N3-{[1-(метансульфонил)пиперидин-4-ил]метил}пиридин-2,3-диамин
Указанное в заголовке соединение (92 мг) получали способом, аналогичным применяемому на стадии 1 примера 2, используя 2,3-диамино-5-бромпиридин (0,75 г) и соединение, полученное на описанной выше стадии 1 (0,99 г).
MS (ESI) m/z: 363 (M+H)+.
Стадия 3
6-Бром-1-{[1-(метансульфонил)пиперидин-4-ил]метил}-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (59 мг) получали способом, аналогичным применяемому на стадии 2 примера 1, используя соединение, полученное на вышеуказанной стадии 2 (92 мг).
MS (ESI) m/z: 389 (M+H)+.
Стадия 4
6-(1H-Индол-5-ил)-1-{[1-(метансульфонил)пиперидин-4-ил]метил}-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (1,6 мг) получали способом, аналогичным применяемому на стадии 2 примера 4, используя соединение, полученное на вышеуказанной стадии 3 (28 мг).
HRMS (ESI) [(M+H)+] вычислено: C22H24N5O3S 426,15998; найдено: 426,16272.
(Пример 10)
6-Хинолин-6-ил-1-(тетрагидро-2H-пиран-4-илметил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (54 мг) получали способом, аналогичным применяемому на стадии 3 примера 1, используя соединение, полученное на стадии 1 примера 4 (60 мг), и 5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)хинолин (54 мг).
HRMS (ESI) [(M+H)+] вычислено: C21H21N4O2 361,16645; найдено: 361,16722.
1H-ЯМР (ДМСО-d6) δ: 1,22-1,40 (2H, м), 1,46-1,56 (2H, м), 2,03-2,18 (1H, м), 3,18-3,30 (2H, м), 3,75-3,86 (4H, м), 7,53-7,61 (1H, м), 8,01 (1H, д, J=1,8 Гц), 8,07-8,18 (2H, м), 8,31 (1H, д, J=1,8 Гц), 8,37-8,45 (2H, м), 8,87-8,93 (1H, м), 11,69 (1H, ушир. с).
(Пример 11)
6-Изохинолин-4-ил-1-(тетрагидро-2H-пиран-4-илметил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (40 мг) получали способом, аналогичным применяемому на стадии 3 примера 1, используя соединение, полученное на стадии 1 примера 4 (60 мг), и изохинолин-4-илборную кислоту (37 мг).
HRMS (ESI) [(M+H)+] вычислено: C21H21N4O2 361,16645; найдено: 361,16727.
1H-ЯМР (ДМСО-d6) δ: 1,19-1,34 (2H, м), 1,44-1,53 (2H, м), 1,95-2,12 (1H, м), 3,15-3,27 (2H, м), 3,70-3,85 (4H, м), 7,71-7,84 (3H, м), 7,86-7,92 (1H, м), 8,04 (1H, д, J=1,8 Гц), 8,23 (1H, д, J=8,3 Гц), 8,49 (1H, с), 9,36 (1H, с), 11,76 (1H, ушир. с).
(Пример 12)
6-Хинолин-4-ил-1-(тетрагидро-2H-пиран-4-илметил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (6 мг) получали способом, аналогичным применяемому на стадии 3 примера 1, используя соединение, полученное на стадии 1 примера 4 (60 мг), и хинолин-4-илборную кислоту (37 мг).
HRMS (ESI) [(M+H)+] вычислено: C21H21N4O2 361,16645; найдено: 361,16471.
1H-ЯМР (ДМСО-d6) δ: 1,21-1,36 (2H, м), 1,43-1,55 (2H, м), 1,95-2,12 (1H, м), 3,17-3,27 (2H, м), 3,72-3,87 (4H, м), 7,54 (1H, д, J=4,6 Гц), 7,60-7,66 (1H, м), 7,78-7,85 (2H, м), 7,94 (1H, д, J=8,3 Гц), 8,08 (1H, с), 8,13 (1H, д, J=8,7 Гц), 8,97 (1H, д, J=4,6 Гц), 11,80 (1H, ушир. с).
(Пример 13)
6-Хинолин-5-ил-1-(тетрагидро-2H-пиран-4-илметил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
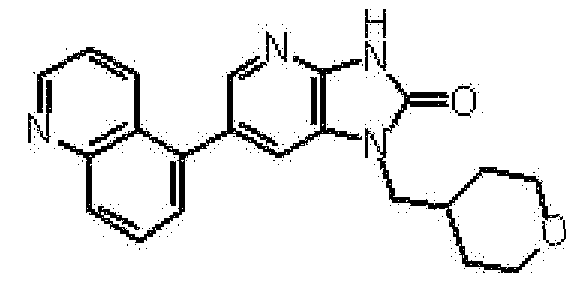
Указанное в заголовке соединение (45 мг) получали способом, аналогичным применяемому на стадии 3 примера 1, используя соединение, полученное на стадии 1 примера 4 (60 мг), и хинолин-5-илборную кислоту (37 мг).
HRMS (ESI) [(M+H)+] вычислено: C21H21N4O2 361,16645; найдено: 361,16582.
1H-ЯМР (ДМСО-d6) δ: 1,20-1,35 (2H, м), 1,44-1,55 (2H, м), 1,97-2,11 (1H, м), 3,16-3,27 (2H, м), 3,70-3,86 (4H, м), 7,55 (1H, дд, J=8,7, 4,1 Гц), 7,60-7,64 (1H, м), 7,73 (1H, с), 7,82-7,89 (1H, м), 8,01 (1H, д, J=1,8 Гц), 8,09 (1H, д, J=8,3 Гц), 8,24 (1H, д, J=8,3 Гц), 8,95 (1H, дд, J=4,1, 1,4 Гц), 11,74 (1H, ушир. с).
(Пример 14)
6-(1H-Индазол-5-ил)-1-(тетрагидро-2H-пиран-4-илметил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
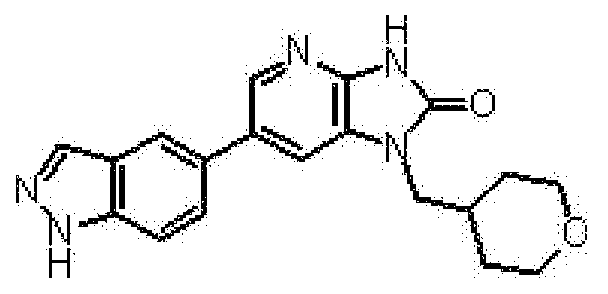
Стадия 1
5-(4,4,5,5-Тетраметил-1,3,2-диоксаборолан-2-ил)-1H-индазол
5-Бром-1H-индазол (1,00 г) растворяли в N,N-диметилформамиде (20 мл) и добавляли бис(пинаколато)диборон (3,87 г), ацетат калия (2,49 г) и комплекс [1,1'-бис(дифенилфосфино)ферроцен]палладий(II) хлорид-дихлорметан (0,12 г). Смесь перемешивали с нагреванием в атмосфере азота при 100°C в течение ночи. Реакционный раствор охлаждали до комнатной температуры и потом концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (элюируя смесью этилацетат-гексан) с получением указанного в заголовке соединения (1,99 г).
MS (ESI) m/z: 245 (M+H)+.
Стадия 2
6-(1H-Индазол-5-ил)-1-(тетрагидро-2H-пиран-4-илметил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (9 мг) получали способом, аналогичным применяемому на стадии 3 примера 1, используя соединение, полученное на стадии 1 примера 4 (60 мг), и 5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-индазол, полученный на вышеуказанной стадии 1 (49 мг).
HRMS (ESI) [(M+H)+] вычислено: C19H20N5O2 350,16170; найдено: 350,16170.
1H-ЯМР (ДМСО-d6) δ: 1,21-1,39 (2H, м), 1,45-1,56 (2H, м), 2,02-2,17 (1H, м), 3,19-3,30 (2H, м), 3,73-3,88 (4H, м), 7,64 (1H, д, J=8,7 Гц), 7,70 (1H, дд, J=8,7, 1,4 Гц), 7,87 (1H, д, J=1,8 Гц), 8,06 (1H, с), 8,14 (1H, с), 8,23 (1H, д, J=1,8 Гц), 11,58 (1H, ушир. с).
(Пример 15)
6-(1H-Пирроло[2,3-b]пиридин-5-ил)-1-(тетрагидро-2H-пиран-4-илметил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
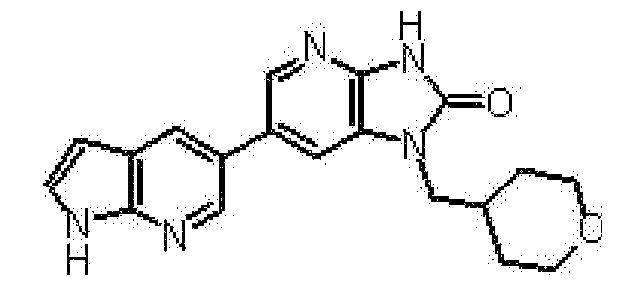
Указанное в заголовке соединение (45 мг) получали способом, аналогичным применяемому на стадии 2 примера 4, используя соединение, полученное на стадии 1 примера 4 (75 мг), и 5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пирроло[2,3-b]пиридин (59 мг).
HRMS (ESI) [(M+H)+] вычислено: C19H20N5O2 350,16170; найдено: 350,16275.
1H-ЯМР (ДМСО-d6) δ: 1,25-1,38 (2H, м), 1,51 (2H, д, J=11,7 Гц), 2,10 (1H, ушир. с), 3,24 (2H, т, J=11,7 Гц), 3,74-3,86 (4H, м), 6,49-6,53 (1H, м), 7,50-7,54 (1H, м), 7,91 (1H, д, J=2,0 Гц), 8,22-8,26 (2H, м), 8,55 (1H, д, J=2,0 Гц), 11,59 (1H, с), 11,74 (1H, с).
(Пример 16)
6-(6-Метил-1H-пирроло[2,3-b]пиридин-5-ил)-1-(тетрагидро-2H-пиран-4-илметил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
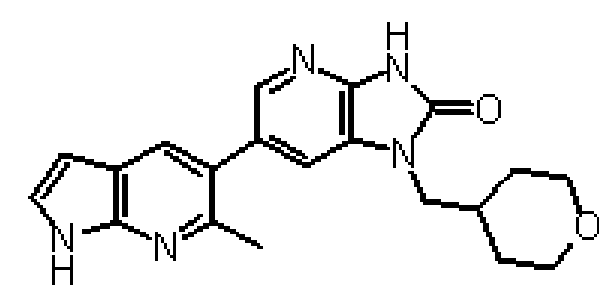
Указанное в заголовке соединение (44 мг) получали способом, аналогичным применяемому на стадии 3 примера 1, используя соединение, полученное на стадии 1 примера 4 (110 мг), и трет-бутил 6-метил-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пирроло[2,3-b]пиридин-1-карбоксилат, полученный способом, описанным в WO 2007/135398 (151 мг).
HRMS (ESI) [(M+H)+] вычислено: C20H22N5O2 364,17735; найдено: 364,17844.
1H-ЯМР (ДМСО-d6) δ: 1,17-1,35 (2H, м), 1,44-1,54 (2H, м), 1,95-2,11 (1H, м), 2,48 (3H, с), 3,15-3,30 (2H, м), 3,70-3,86 (4H, м), 6,40-6,44 (1H, м), 7,39-7,44 (1H, м), 7,62-7,66 (2H, м), 7,79 (1H, с), 7,90 (1H, д, J=1,8 Гц), 11,61 (1H, ушир. с), 11,54 (1H, ушир. с).
(Пример 17)
5-Метил-6-(1H-пирроло[2,3-b]пиридин-5-ил)-1-(тетрагидро-2H-пиран-4-илметил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
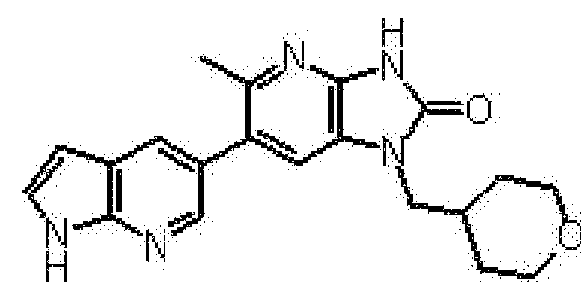
Указанное в заголовке соединение (47 мг) получали способом, аналогичным применяемому на стадии 3 примера 1, используя соединение, полученное на стадии 4 примера 7 (80 мг), и 5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пирроло[2,3-b]пиридин (66 мг).
HRMS (ESI) [(M+H)+] вычислено: C20H22N5O2 364,17735; найдено: 364,17731.
1H-ЯМР (ДМСО-d6) δ: 1,19-1,33 (2H, м), 1,41-1,51 (2H, м), 1,95-2,10 (1H, м), 2,38 (3H, с), 3,16-3,33 (2H, м), 3,66-3,84 (4H, м), 6,47-6,52 (1H, м), 7,47 (1H, с), 7,51-7,55 (1H, м), 7,96 (1H, д, J=1,8 Гц), 8,21 (1H, д, J=1,8 Гц), 11,48 (1H, ушир. с), 11,74 (1H, ушир. с).
(Пример 18)
7-Метил-6-(1H-пирроло[2,3-b]пиридин-5-ил)-1-(тетрагидро-2H-пиран-4-илметил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
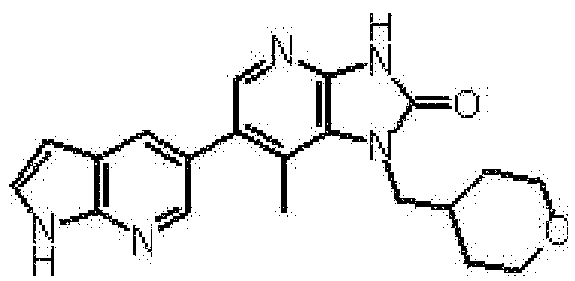
Указанное в заголовке соединение (64 мг) получали способом, аналогичным применяемому на стадии 3 примера 1, используя соединение, полученное на стадии 4 примера 8 (88 мг), и 5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пирроло[2,3-b]пиридин (72 мг).
HRMS (ESI) [(M+H)+] вычислено: C20H22N5O2 364,17735; найдено: 364,17698.
1H-ЯМР (ДМСО-d6) δ: 1,22-1,37 (2H, м), 1,43-1,54 (2H, м), 1,92-2,07 (1H, м), 2,39 (3H, с), 3,26-3,43 (2H, м), 3,78-3,94 (4H, м), 6,47-6,52 (1H, м), 7,51-7,57 (1H, м), 7,80 (1H, с), 7,93 (1H, д, J=1,8 Гц), 8,17 (1H, д, J=1,8 Гц), 11,61 (1H, ушир. с), 11,76 (1H, ушир. с).
(Пример 19)
6-(1H-Пирроло[2,3-b]пиридин-5-ил)-1-(тетрагидро-2H-пиран-4-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
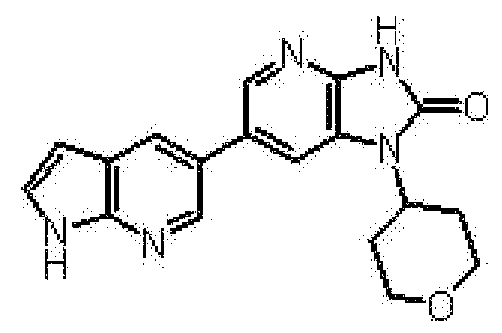
Указанное в заголовке соединение (46 мг) получали способом, аналогичным применяемому на стадии 3 примера 1, используя соединение, полученное на стадии 2 примера 2 (61 мг), и 5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пирроло[2,3-b]пиридин (55 мг).
HRMS (ESI) [(M+H)+] вычислено: C18H18N5O2 336,14605; найдено: 336,14456.
1H-ЯМР (ДМСО-d6) δ: 1,66-1,75 (2H, м), 2,39-2,49 (2H, м), 3,42-3,53 (2H, м), 3,96-4,05 (2H, м), 4,44-4,57 (1H, м), 6,48-6,53 (1H, м), 7,50-7,55 (1H, м), 7,91 (1H, д, J=1,8 Гц), 8,23 (1H, д, J=1,8 Гц), 8,27 (1H, д, J=1,8 Гц), 8,55 (1H, д, J=1,8 Гц), 11,62 (1H, ушир. с), 11,74 (1H, ушир. с).
(Пример 20)
6-(1H-Пирроло[2,3-b]пиридин-5-ил)-1-[2-(тетрагидро-2H-пиран-4-ил)этил]-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
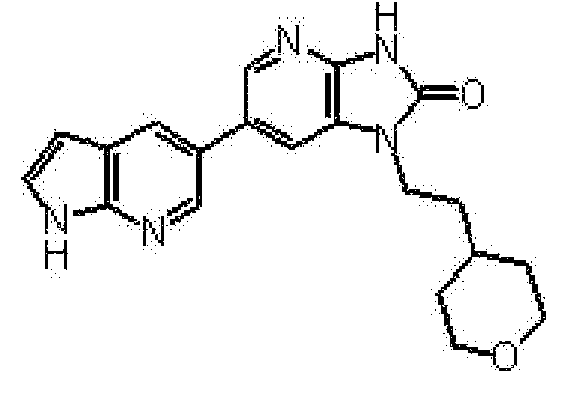
Указанное в заголовке соединение (36 мг) получали способом, аналогичным применяемому на стадии 3 примера 1, используя соединение, полученное на стадии 2 примера 3 (60 мг), и 5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пирроло[2,3-b]пиридин (49 мг).
HRMS (ESI) [(M+H)+] вычислено: C20H22N5O2 364,17735; найдено: 364,17712.
1H-ЯМР (ДМСО-d6) δ: 1,12-1,27 (2H, м), 1,42-1,56 (1H, м), 1,58-1,71 (4H, м), 3,25-3,35 (1H, м), 3,76-3,84 (2H, м), 3,86-3,94 (2H, м), 6,48-6,52 (1H, м), 7,49-7,52 (1H, м), 7,81 (1H, д, J=2,3 Гц), 8,20-8,25 (2H, м), 8,52 (1H, д, J=2,3 Гц), 11,57 (1H, ушир. с), 11,70 (1H, ушир. с).
(Пример 21)
1-(Циклопропилметил)-6-(1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
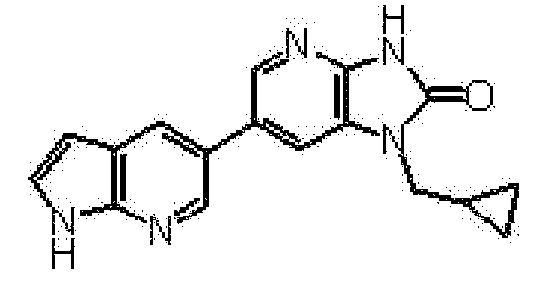
Указанное в заголовке соединение (51 мг) получали способом, аналогичным применяемому на стадии 3 примера 1, используя соединение, полученное на стадии 2 примера 1 (60 мг), и 5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пирроло[2,3-b]пиридин (60 мг).
HRMS (ESI) [(M+H)+] вычислено: C17H16N5O 306,13548; найдено: 306,13866.
1H-ЯМР (ДМСО-d6) δ: 0,39-0,54 (4H, м), 1,23-1,36 (1H, м), 3,79 (2H, д, J=6,9 Гц), 6,50-6,55 (1H, м), 7,51-7,56 (1H, м), 7,93 (1H, д, J=1,8 Гц), 8,25-8,28 (2H, м), 8,56 (1H, д, J=1,8 Гц), 11,61 (1H, ушир. с), 11,75 (1H, ушир. с).
(Пример 22)
1-(Тетрагидро-2H-пиран-4-илметил)-1,3-дигидро-2H,3'H-6,6'-биимидазо[4,5-b]пиридин-2-он
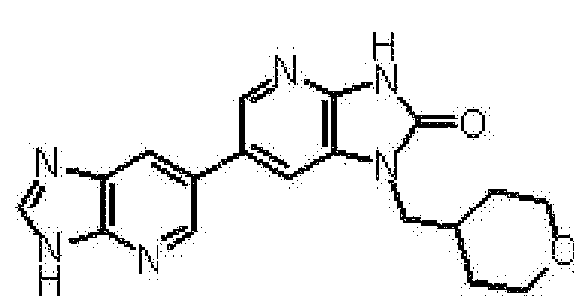
В раствор соединения, полученного на стадии 1 примера 5 (75 мг), в N,N-диметилформамиде (2,5 мл) добавляли бис(трифенилфосфин)палладий(II) дихлорид (17 мг) и 6-(триметилстаннил)-3H-имидазо[4,5-b]пиридин, полученный способом, описанным в WO 2008/051493 (75 мг), и смесь перемешивали при 110°C в течение 2 часов. Растворитель реакционной смеси упаривали при пониженном давлении. Полученный остаток очищали с помощью ВЭЖХ с получением указанного в заголовке соединения (6 мг).
HRMS (ESI) [(M+H)+] вычислено: C18H19N6O2 351,15695; найдено: 351,15798.
1H-ЯМР (ДМСО-d6) δ: 1,21-1,36 (2H, м), 1,45-1,54 (2H, м), 3,17-3,27 (2H, м), 3,72-3,86 (4H, м), 6,56-6,61 (1H, м), 7,95 (1H, д, J=1,7 Гц), 8,27 (2H, д, J=1,7 Гц), 8,30 (1H, ушир. с), 8,47 (1H, с), 8,69 (1H, д, J=2,3 Гц).
(Пример 23)
6-(1H-Индол-2-ил)-1-(тетрагидро-2H-пиран-4-илметил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
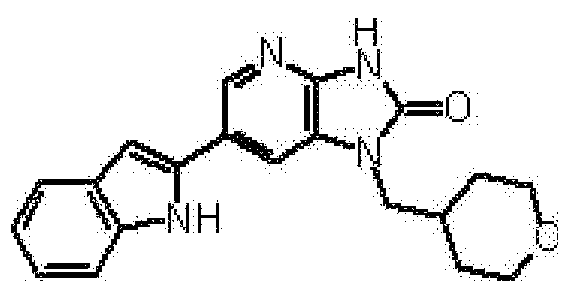
Указанное в заголовке соединение (23 мг) получали способом, аналогичным применяемому на стадии 3 примера 1, используя соединение, полученное на стадии 1 примера 4 (60 мг), и [1-(трет-бутоксикарбонил)-1H-индол-2-ил]борную кислоту (55 мг).
HRMS (ESI) [(M+H)+] вычислено: C20H21N4O2 349,16645; найдено: 349,16844.
1H-ЯМР (ДМСО-d6) δ: 1,26-1,38 (2H, м), 1,47-1,55 (2H, м), 2,03-2,15 (1H, м), 3,17-3,29 (2H, м), 3,73 (2H, д, J=7,4 Гц), 3,79-3,87 (2H, м), 6,94 (1H, д, J=1,7 Гц), 6,97-7,01 (1H, м), 7,05-7,11 (1H, м), 7,37-7,42 (1H, м), 7,51 (1H, д, J=7,4 Гц), 7,93 (1H, д, J=1,7 Гц), 8,44 (1H, д, J=1,7 Гц), 11,50 (1H, ушир. с).
(Пример 24)
6-(1H-Пирроло[2,3-b]пиридин-5-ил)-1-[1-(тетрагидро-2H-пиран-4-ил)этил]-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
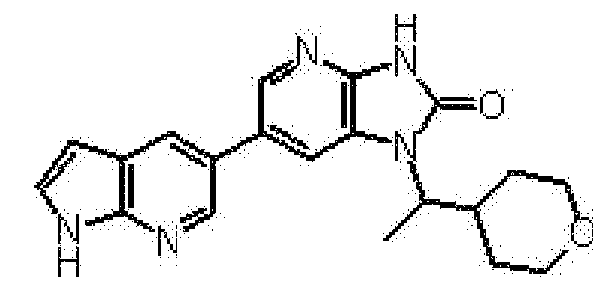
Стадия 1
5-Бром-N3-[1-(тетрагидро-2H-пиран-4-ил)этил]пиридин-2,3-диамин
2,3-Диамино-5-бромпиридин (1,07 г) и 1-(тетрагидро-2H-пиран-4-ил)этанон (0,80 г) растворяли в метаноле (20 мл) и добавляли уксусную кислоту (0,98 мл). После перемешивания при комнатной температуре в течение некоторого времени добавляли цианоборгидрид натрия (1,08 г) и смесь перемешивали при комнатной температуре в течение 20 часов. К реакционному раствору добавляли насыщенный водный раствор бикарбоната натрия, затем экстрагировали этилацетатом. Далее органический слой сушили над безводным сульфатом натрия. Растворитель упаривали при пониженном давлении. Полученный остаток очищали колоночной флеш-хроматографией (элюируя смесью этилацетат-гексан) с получением указанного в заголовке соединения (334 мг).
MS (ESI) m/z: 300 (M+H)+.
Стадия 2
6-Бром-1-[1-(тетрагидро-2H-пиран-4-ил)этил]-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (345 мг) получали способом, аналогичным применяемому на стадии 2 примера 1, используя соединение, полученное на вышеуказанной стадии 1 (344 мг).
MS (ESI) m/z: 326 (M+H)+.
1H-ЯМР (CDCl3) δ: 1,27-1,31 (1H, м), 1,52 (3H, д, J=7,1 Гц), 1,77-1,81 (1H, м), 2,16-2,19 (1H, м), 3,29-3,31 (1H, м), 3,40-3,43 (1H, м), 3,90-3,92 (1H, м), 4,04-4,06 (1H, м), 4,15-4,17 (1H, м), 7,39 (1H, д, J=2,0 Гц), 8,10 (1H, д, J=2,0 Гц), 9,35 (1H, с).
Стадия 3
6-(1H-Пирроло[2,3-b]пиридин-5-ил)-1-[1-(тетрагидро-2H-пиран-4-ил)этил]-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (33 мг) получали способом, аналогичным применяемому на стадии 3 примера 1, используя соединение, полученное на вышеуказанной стадии 2 (60 мг), и 5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пирроло[2,3-b]пиридин (49 мг).
HRMS (ESI) [(M+H)+] вычислено: C20H22N5O2 364,17735; найдено: 364,17814.
1H-ЯМР (ДМСО-d6) δ: 1,11-1,20 (2H, м), 1,24-1,37 (1H, м), 1,49 (3H, д, J=6,9 Гц), 1,72-1,82 (1H, м), 2,26-2,40 (1H, м), 3,09-3,21 (1H, м), 3,28-3,33 (1H, м), 3,71-3,79 (1H, м), 3,86-3,95 (1H, м), 4,11-4,22 (1H, м), 6,49-6,53 (1H, м), 7,50-7,54 (1H, м), 7,90 (1H, д, J=1,8 Гц), 8,24 (2H, дд, J=11,9, 1,8 Гц), 8,54 (1H, д, J=2,3 Гц), 11,58 (1H, ушир. с), 11,73 (1H, ушир. с).
(Пример 25)
1-[(4-Метилтетрагидро-2H-пиран-4-ил)метил]-6-(1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
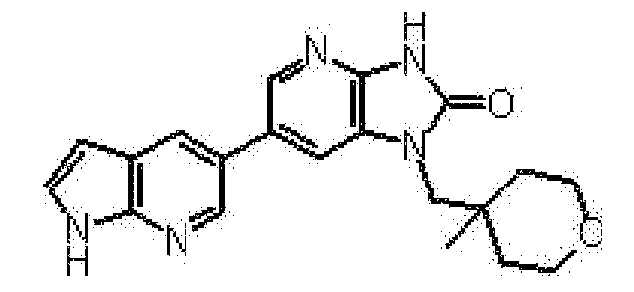
Стадия 1
4-Метилтетрагидро-2H-пиран-4-карбальдегид
(4-Метилтетрагидро-2H-пиран-4-ил)метанол, полученный способом, описанным в EP 1431285 (1,02 г), растворяли в дихлорметане (20 мл). Добавляли диметилсульфоксид (5,01 мл), триэтиламин (5,46 мл) и комплекс триоксид серы-пиридин (3,74 г) и смесь перемешивали при комнатной температуре в течение одного часа. К реакционному раствору добавляли насыщенный водный раствор хлорида аммония, затем экстрагировали хлороформом. Органический слой промывали 1 н. соляной кислотой, насыщенным водным раствором бикарбоната натрия и насыщенным солевым раствором и сушили над безводным сульфатом натрия. Растворитель упаривали при пониженном давлении с получением указанного в заголовке соединения (647 мг).
Стадия 2
5-Бром-N3-[(4-метилтетрагидро-2H-пиран-4-ил)метил]пиридин-2,3-диамин
Указанное в заголовке соединение (574 мг) получали способом, аналогичным применяемому на стадии 1 примера 24, используя 2,3-диамино-5-бромпиридин (0,85 г) и соединение, полученное на описанной выше стадии 1 (0,64 г).
MS (ESI) m/z: 300 (M+H)+.
Стадия 3
6-Бром-1-[(4-метилтетрагидро-2H-пиран-4-ил)метил]-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (636 мг) получали способом, аналогичным применяемому на стадии 2 примера 1, используя соединение, полученное на вышеуказанной стадии 2 (574 мг).
MS (ESI) m/z: 326 (M+H)+.
1H-ЯМР (CDCl3) δ: 1,14 (3H, с), 1,36-1,39 (2H, м), 1,68-1,75 (2H, м), 3,61-3,65 (2H, м), 3,83-3,86 (2H, м), 4,04 (2H, с), 7,32 (1H, д, J=2,0 Гц), 8,10 (1H, д, J=2,0 Гц), 9,35 (1H, с).
Стадия 4
1-[(4-Метилтетрагидро-2H-пиран-4-ил)метил]-6-(1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (36 мг) получали способом, аналогичным применяемому на стадии 3 примера 1, используя соединение, полученное на вышеуказанной стадии 3 (60 мг), и 5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пирроло[2,3-b]пиридин (49 мг).
HRMS (ESI) [(M+H)+] вычислено: C20H22N5O2 364,17735; найдено: 364,17621.
1H-ЯМР (ДМСО-d6) δ: 1,07 (3H, с), 1,26-1,35 (2H, м), 1,57-1,70 (2H, м), 3,46-3,56 (2H, м), 3,66-3,80 (4H, м), 6,48-6,54 (1H, м), 7,50-7,55 (1H, м), 7,88 (1H, с), 8,20-8,26 (2H, м), 8,53 (1H, с), 11,62 (1H, ушир. с), 11,74 (1H, ушир. с).
(Пример 26)
1-{[1-(Метансульфонил)пиперидин-4-ил]метил}-6-(1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
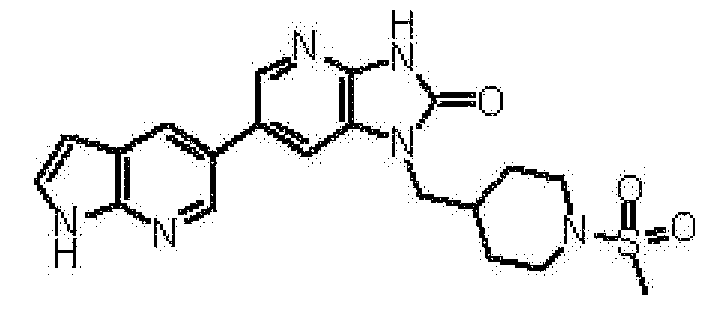
Указанное в заголовке соединение (4,3 мг) получали способом, аналогичным применяемому на стадии 2 примера 4, используя соединение, полученное на стадии 3 примера 9 (28 мг), и 5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пирроло[2,3-b]пиридин (21 мг).
HRMS (ESI) [(M+H)+] вычислено: C22H23N6O3S 427,15523; найдено: 427,15738.
(Пример 27)
6-(4-Фтор-1H-индол-5-ил)-1-(тетрагидро-2H-пиран-4-илметил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
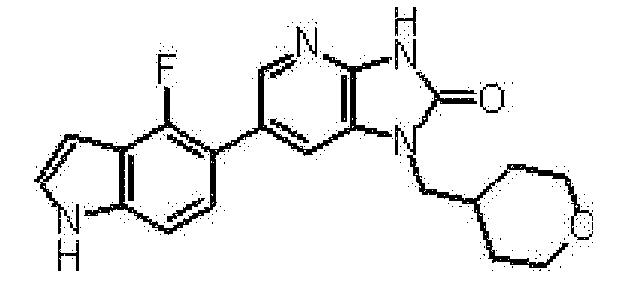
Стадия 1
4-Фтор-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-индол
5-Бром-4-фтор-1H-индол, полученный способом, описанным в Eur. J. Org. Chem. 2956-2969, 2006 (793 мг), растворяли в N,N-диметилформамиде (30 мл) и добавляли бис(пинаколато)диборон (1,88 г), ацетат калия (1,82 г) и комплекс [1,1'-бис(дифенилфосфино)ферроцен]палладий(II) хлорид-дихлорметан (151 мг). Смесь перемешивали с нагреванием в атмосфере азота при 100°C в течение ночи. Реакционный раствор охлаждали до комнатной температуры и потом концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (элюируя смесью этилацетат-гексан). Полученное бесцветное масло в виде суспензии промывали гексаном с получением указанного в заголовке соединения (481 мг) в виде бесцветного твердого вещества.
MS (EI) m/z: 261 M+.
1H-ЯМР (CDCl3) δ: 1,38 (12H, с), 6,65-6,68 (1H, м), 7,14-7,17 (1H, м), 7,18 (1H, с), 7,51 (1H, дд, J=8,3, 5,5 Гц), 8,27 (1H, ушир. с).
Стадия 2
6-(4-Фтор-1H-индол-5-ил)-1-(тетрагидро-2H-пиран-4-илметил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (35 мг) получали в виде бесцветного аморфного твердого вещества способом, аналогичным применяемому на стадии 2 примера 4, используя соединение, полученное на стадии 1 примера 4 (50 мг), и соединение, полученное на описанной выше стадии 1 (46 мг).
HRMS (ESI) [(M+H)+] вычислено: C20H20FN4O2 367,15703; найдено: 367,15767.
1H-ЯМР (ДМСО-d6) δ: 1,24-1,35 (2H, м), 1,50 (2H, д, J=11,7 Гц), 2,00-2,11 (1H, м), 3,23 (2H, т, J=11,7 Гц), 3,75 (2H, д, J=6,9 Гц), 3,82 (2H, дд, J=11,7, 2,8 Гц), 6,54-6,56 (1H, м), 7,22 (1H, т, J=8,0 Гц), 7,34 (1H, д, J=8,0 Гц), 7,44 (1H, т, J=2,8 Гц), 7,71 (1H, с), 8,07 (1H, т, J=1,6 Гц), 11,48 (1H, с), 11,61 (1H, с).
(Пример 28)
6-(6-Фтор-1H-индол-5-ил)-1-(тетрагидро-2H-пиран-4-илметил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
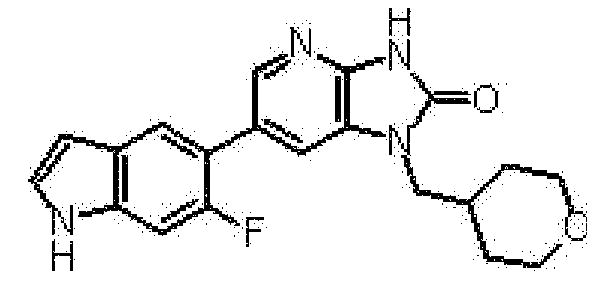
Стадия 1
6-Фтор-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-индол
Указанное в заголовке соединение (867 мг) получали в виде бесцветного твердого вещества способом, аналогичным применяемому на стадии 1 примера 27, используя 5-бром-6-фтор-1H-индол, полученный способом, описанным в Eur. J. Org. Chem. 2956-2969, 2006 (1,22 г).
MS (EI) m/z: 261 M+.
1H-ЯМР (CDCl3) δ: 1,38 (12H, с), 6,53 (1H, с), 7,04 (1H, д, J=10,1 Гц), 7,17 (1H, т, J=2,6 Гц), 8,04 (1H, д, J=5,5 Гц), 8,17 (1H, ушир. с).
MS (ESI) m/z: 262 (M+H)+.
Стадия 2
6-(6-Фтор-1H-индол-5-ил)-1-(тетрагидро-2H-пиран-4-илметил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (35 мг) получали в виде бесцветного аморфного твердого вещества способом, аналогичным применяемому на стадии 2 примера 4, используя соединение, полученное на стадии 1 примера 4 (50 мг), и 6-фтор-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-индол, полученный на вышеуказанной стадии 1 (46 мг).
HRMS (ESI) [(M+H)+] вычислено: C20H20FN4O2 367,15703; найдено: 367,15850.
1H-ЯМР (ДМСО-d6) δ: 1,22-1,35 (2H, м), 1,49 (2H, д, J=11,5 Гц), 2,04 (1H, ушир. с), 3,21 (2H, т, J=11,5 Гц), 3,74 (2H, д, J=7,3 Гц), 3,81 (2H, д, J=11,5 Гц), 6,48 (1H, с), 7,29 (1H, д, J=11,5 Гц), 7,38 (1H, т, J=2,8 Гц), 7,65 (1H, д, J=8,3 Гц), 7,68 (1H, с), 8,04 (1H, с), 11,21 (1H, с), 11,60 (1H, с).
(Пример 29)
6-(7-Фтор-1H-индол-5-ил)-1-(тетрагидро-2H-пиран-4-илметил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
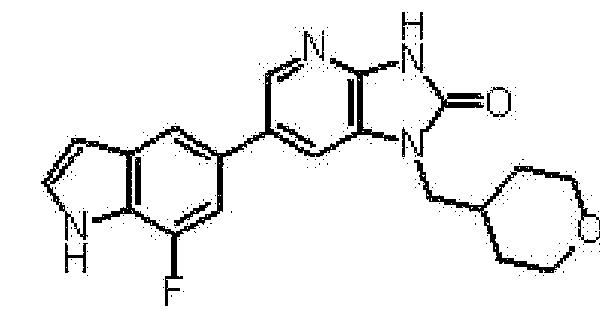
Стадия 1
7-Фтор-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-индол
Указанное в заголовке соединение (189 мг) получали в виде твердого вещества белого цвета способом, аналогичным применяемому на стадии 1 примера 27, используя 5-бром-7-фтор-1H-индол, полученный способом, описанным в Eur. J. Org. Chem. 2956-2969, 2006 (0,596 г).
MS (EI) m/z: 261 M+.
1H-ЯМР (CDCl3) δ: 1,38 (12H, с), 6,53 (1H, с), 7,04 (1H, д, J=10,1 Гц), 7,17 (1H, т, J=2,6 Гц), 8,04 (1H, д, J=5,5 Гц), 8,17 (1H, ушир. с).
Стадия 2
6-(7-Фтор-1H-индол-5-ил)-1-(тетрагидро-2H-пиран-4-илметил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (41 мг) получали в виде бесцветного аморфного твердого вещества способом, аналогичным применяемому на стадии 2 примера 4, используя соединение, полученное на стадии 1 примера 4 (50 мг), и соединение, полученное на описанной выше стадии 1 (48 мг).
HRMS (ESI) [(M+H)+] вычислено: C20H20FN4O2 367,15703; найдено: 367,15743.
1H-ЯМР (ДМСО-d6) δ: 1,26-1,39 (2H, м), 1,51 (2H, д, J=11,7 Гц), 2,10 (1H, ушир. с), 3,24 (2H, т, J=11,7 Гц), 3,78 (2H, д, J=7,2 Гц), 3,83 (2H, д, J=11,7 Гц), 6,59 (1H, с), 7,32 (1H, д, J=12,7 Гц), 7,46 (1H, т, J=2,4 Гц), 7,72 (1H, с), 7,87 (1H, д, J=1,5 Гц), 8,24 (1H, д, J=1,5 Гц), 11,56 (1H, с), 11,67 (1H, с).
(Пример 30)
6-(2-Оксо-2,3-дигидро-1H-пирроло[2,3-b]пиридин-5-ил)-1-(тетрагидро-2H-пиран-4-илметил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
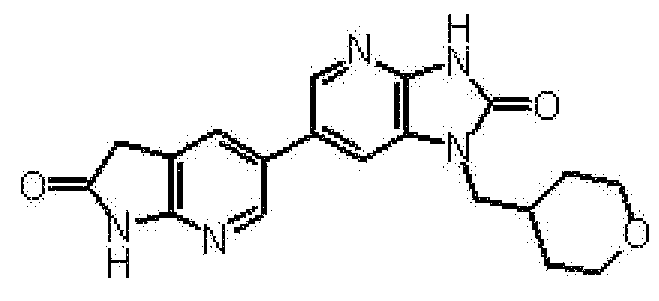
Стадия 1
5-(4,4,5,5-Тетраметил-1,3,2-диоксаборолан-2-ил)-1,3-дигидро-2H-пирроло[2,3-b]пиридин-2-он
Указанное в заголовке соединение (39 мг) получали в виде бесцветного твердого вещества способом, аналогичным применяемому на стадии 1 примера 27, используя 5-бром-1,3-дигидро-2H-пирроло[2,3-b]пиридин-2-он, полученный способом, описанным в J. Am. Chem. Soc. 14426, 2006 (300 мг).
MS (EI) m/z: 260 M+.
1H-ЯМР (CDCl3) δ: 1,35 (12H, с), 3,55 (2H, с), 7,84 (1H, д, J=1,4 Гц), 8,53-8,55 (1H, м), 8,67 (1H, ушир. с).
Стадия 2
6-(2-Оксо-2,3-дигидро-1H-пирроло[2,3-b]пиридин-5-ил)-1-(тетрагидро-2H-пиран-4-илметил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (22 мг) получали в виде бесцветного аморфного твердого вещества способом, аналогичным применяемому на стадии 2 примера 4, используя соединение, полученное на стадии 1 примера 4 (38 мг), и соединение, полученное на описанной выше стадии 1 (33 мг).
HRMS (ESI) [(M+H)+] вычислено: C19H20N5O3 366,15661; найдено: 366,15792.
1H-ЯМР (ДМСО-d6) δ: 1,25-1,38 (2H, м), 1,49 (2H, д, J=11,7 Гц), 2,02-2,14 (1H, м), 3,23 (2H, т, J=11,7 Гц), 3,63 (2H, с), 3,75 (2H, д, J=7,2 Гц), 3,82 (2H, д, J=11,7 Гц), 7,84 (1H, д, J=1,7 Гц), 7,92 (1H, с), 8,19 (1H, д, J=1,7 Гц), 8,40 (1H, д, J=1,7 Гц), 11,09 (1H, с), 11,62 (1H, с).
(Пример 31)
1-(5,6-Дигидро-2H-пиран-3-илметил)-6-(1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
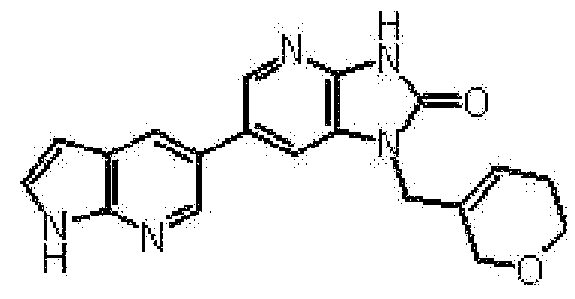
Стадия 1
5-Бром-N3-(5,6-дигидро-2H-пиран-3-илметил)пиридин-2,3-диамин
Указанное в заголовке соединение (434 мг) получали способом, аналогичным применяемому на стадии 1 примера 24, используя 2,3-диамино-5-бромпиридин (0,85 г) и 5,6-дигидро-2H-пиран-3-карбальдегид, полученный способом, описанным в US 4532337 (0,58 г).
MS (ESI) m/z: 284 (M+H)+.
Стадия 2
6-Бром-1-(5,6-дигидро-2H-пиран-3-илметил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (290 мг) получали способом, аналогичным применяемому на стадии 2 примера 1, используя соединение, полученное на вышеуказанной стадии 1 (434 мг).
MS (ESI) m/z: 310 (M+H)+.
1H-ЯМР (CDCl3) δ: 2,18-2,19 (2H, м), 3,75 (2H, т, J=5,5 Гц), 4,06-4,06 (2H, м), 4,34-4,37 (2H, м), 5,84-5,85 (1H, м), 7,30 (1H, д, J=2,0 Гц), 8,11 (1H, д, J=2,0 Гц), 9,12-9,15 (1H, м).
Стадия 3
1-(5,6-Дигидро-2H-пиран-3-илметил)-6-(1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (33 мг) получали способом, аналогичным применяемому на стадии 3 примера 1, используя соединение, полученное на вышеуказанной стадии 2 (60 мг), и 5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пирроло[2,3-b]пиридин (47 мг).
HRMS (ESI) [(M+H)+] вычислено: C19H18N5O2 348,14605; найдено: 348,14610.
1H-ЯМР (ДМСО-d6) δ: 1,97-2,08 (2H, м), 3,58-3,64 (2H, м), 4,00 (2H, д, J=1,8 Гц), 4,40 (2H, с), 5,77 (1H, с), 6,48-6,53 (1H, м), 7,50-7,55 (1H, м), 7,77 (1H, д, J=1,8 Гц), 8,20-8,27 (2H, м), 8,49-8,53 (1H, м), 11,66 (1H, ушир. с), 11,74 (1H, ушир. с).
(Пример 32)
6-(1H-Пирроло[2,3-b]пиридин-5-ил)-1-(тетрагидро-2H-пиран-3-илметил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
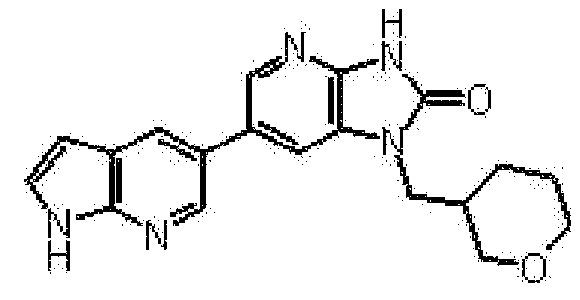
Стадия 1
5-Бром-N3-(тетрагидро-2H-пиран-3-илметил)пиридин-2,3-диамин
Указанное в заголовке соединение (743 мг) получали способом, аналогичным применяемому на стадии 1 примера 27, используя 2,3-диамино-5-бромпиридин (2,00 г) и тетрагидро-2H-пиран-3-карбальдегид, полученный способом, описанным в US 5071863 (1,34 г).
MS (ESI) m/z: 286 (M+H)+.
Стадия 2
6-Бром-1-(тетрагидро-2H-пиран-4-илметил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (741 мг) получали способом, аналогичным применяемому на стадии 2 примера 1, используя соединение, полученное на вышеуказанной стадии 1 (743 мг).
MS (ESI) m/z: 312 (M+H)+.
1H-ЯМР (CDCl3) δ: 1,42-1,43 (1H, м), 1,58-1,61 (1H, м), 1,71-1,72 (1H, м), 1,80-1,83 (1H, м), 2,16-2,17 (1H, м), 3,33 (1H, дд, J=11,5, 8,3 Гц), 3,50-3,56 (1H, м), 3,77-3,80 (4H, м), 7,12 (1H, д, J=0,7 Гц), 7,34 (1H, д, J=2,0 Гц), 8,11 (1H, д, J=2,0 Гц).
Стадия 3
6-(1H-Пирроло[2,3-b]пиридин-5-ил)-1-(тетрагидро-2H-пиран-3-илметил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (33 мг) получали способом, аналогичным применяемому на стадии 3 примера 1, используя соединение, полученное на вышеуказанной стадии 2 (60 мг), и 5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пирроло[2,3-b]пиридин (47 мг).
HRMS (ESI) [(M+H)+] вычислено: C19H20N5O2 350,16330; найдено: 350,16330.
1H-ЯМР (ДМСО-d6): 1,24-1,37 (1H, м), 1,38-1,51 (1H, м), 1,58-1,67 (1H, м), 1,68-1,78 (1H, м), 2,04-2,17 (1H, м), 3,19-3,28 (2H, м), 3,65-3,81 (4H, м), 6,48-6,54 (1H, м), 7,50-7,55 (1H, м), 7,88 (1H, д, J=1,8 Гц), 8,24 (2H, д, J=1,8 Гц), 8,54 (1H, д, J=2,3 Гц), 11,60 (1H, ушир. с), 11,74 (1H, ушир. с).
(Пример 33)
6-(7-Фтор-1H-индол-5-ил)-1-(2-морфолин-4-илэтил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
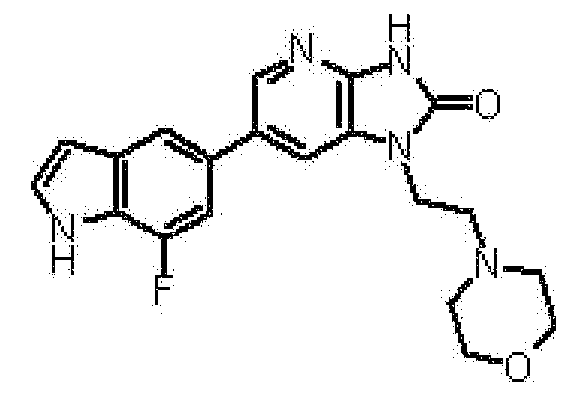
Стадия 1
N-(2-Амино-5-бромпиридин-3-ил)-2-морфолин-4-илацетамид
2,3-Диамино-5-бромпиридин (2,00 г) и гидрохлорид морфолин-4-илуксусной кислоты, полученный способом, описанным в US 6352993 (1,34 г), растворяли в ацетонитриле (15 мл). Добавляли 1-этил-3-(3-диметиламинопропил)карбодиимид гидрохлорид (1,22 г), 1-гидроксибензотриазол (0,98 г) и N-метилморфолин (1,29 мл) и смесь перемешивали при комнатной температуре в течение ночи. Реакционный раствор разбавляли хлороформом и промывали насыщенным солевым раствором. Органический слой сушили над безводным сульфатом натрия и далее растворитель упаривали при пониженном давлении. Полученное твердое вещество промывали диэтиловым эфиром с получением указанного в заголовке соединения (1,40 г) в виде твердого вещества светло-желтого цвета.
MS (ESI) m/z: 315 (M+H)+.
1H-ЯМР (ДМСО-d6) δ: 2,52 (4H, т, J=4,6 Гц), 3,62 (4H, т, J=4,6 Гц), 6,01 (2H, с), 7,84 (1H, д, J=2,2 Гц), 7,87 (1H, д, J=2,2 Гц), 9,20 (1H, с).
Стадия 2
5-Бром-N3-(2-морфолин-4-илэтил)пиридин-2,3-диамин
Алюмогидрид лития (120 мг) суспендировали в тетрагидрофуране (10 м). Раствор соединения, полученного на описанной выше стадии 1 (500 мг), в тетрагидрофуране (3 мл) медленно добавляли по каплям с перемешиванием при 0°C, затем перемешивали в течение одного часа. Добавляли алюмогидрид лития (120 мг) и смесь перемешивали при комнатной температуре в течение 2,5 часов и далее нагревали с обратным холодильником в течение одного часа. Реакционный раствор оставляли охлаждаться до комнатной температуры и затем добавляли воду (0,3 мл), 15% водный раствор гидроксида натрия (0,3 мл) и воду (0,6 мл). Осажденное нерастворимое вещество отфильтровывали через целит. Фильтрат концентрировали с получением указанного в заголовке соединения (397 мг).
MS (ESI) m/z: 301 (M+H)+.
Стадия 3
6-Бром-1-(2-морфолин-4-илэтил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (79 мг) получали способом, аналогичным применяемому на стадии 2 примера 1, используя соединение, полученное на вышеуказанной стадии 2 (397 мг).
MS (ESI) m/z: 327 (M+H)+.
Стадия 4
6-(7-Фтор-1H-индол-5-ил)-1-(2-морфолин-4-илэтил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (2,8 мг) получали в виде бесцветного аморфного твердого вещества способом, аналогичным применяемому на стадии 2 примера 4, используя соединение, полученное на вышеуказанной стадии 3 (79 мг), и соединение, полученное на стадии 1 примера 29 (54 мг).
HRMS (ESI) [(M+H)+] вычислено: C20H21FN5O2 382,16793; найдено: 382,16871.
(Пример 34)
6-(4-Хлор-1H-пирроло[2,3-b]пиридин-5-ил)-1-(тетрагидро-2H-пиран-4-илметил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
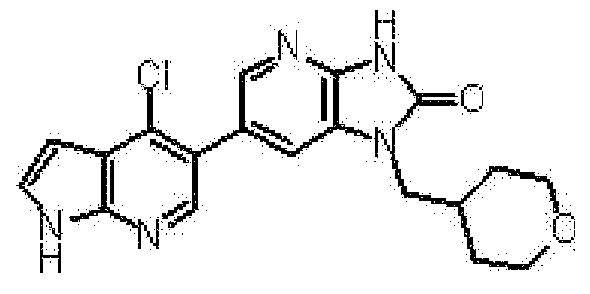
Указанное в заголовке соединение (26 мг) получали способом, аналогичным применяемому на стадии 3 примера 1, используя соединение, полученное на стадии 1 примера 4 (60 мг), и [4-хлор-1-(триизопропилсилил)-1H-пирроло[2,3-b]пиридин-5-ил]борную кислоту, полученную способом, описанным в Tetrahedron Lett. (45), 2317-2319, 2004 (75 мг).
HRMS (ESI) [(M+H)+] вычислено: C19H19Cl1N5O2; найдено: 384,12663.
1H-ЯМР (ДМСО-d6) δ: 1,20-1,37 (2H, м), 1,46-1,54 (2H, м), 1,99-2,15 (1H, м), 3,19-3,28 (2H, м), 3,70-3,87 (4H, м), 6,55-6,59 (1H, м), 7,64-7,68 (1H, м), 7,72 (1H, д, J=1,7 Гц), 8,01 (1H, д, J=1,7 Гц), 8,26-8,26 (1H, м), 11,69 (1H, ушир. с), 12,13 (1H, ушир. с).
(Пример 35)
6-(3-Хлор-1H-пирроло[2,3-b]пиридин-5-ил)-1-(тетрагидро-2H-пиран-4-илметил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
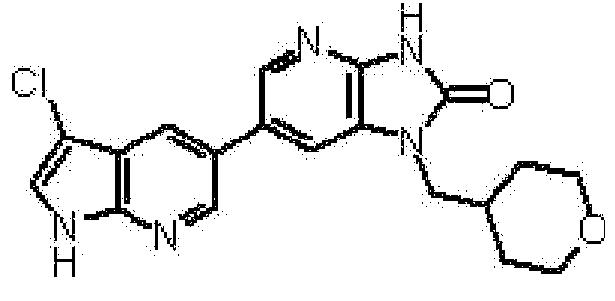
Стадия 1
трет-Бутил 5-бром-3-хлор-1H-пирроло[2,3-b]пиридин-1-карбоксилат
5-Бром-3-хлор-1H-пирроло[2,3-b]пиридин (235 мг) растворяли в дихлорметане (5 мл). Добавляли дитретбутил дикарбонат (248 мг) и N,N-диметиламинопиридин (1,2 мг) и смесь перемешивали при комнатной температуре в течение ночи. Реакционный раствор концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (элюируя смесью этилацетат-гексан) с получением указанного в заголовке соединения (297 мг).
MS (ESI) m/z: 331 (M+H)+.
1H-ЯМР (CDCl3) δ: 1,67 (9H, с), 7,65 (1H, с), 8,05 (1H, д, J=2,2 Гц), 8,58 (1H, д, J=2,2 Гц).
Стадия 2
6-Бром-3-циклогекс-1-ен-1-ил-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
2,3-Диамино-5-бромпиридин (50 г) и этиловый эфир 2-циклогексанонкарбоновой кислоты (63,5 мл) нагревали с обратным холодильником в ксилене (2000 мл) в течение 64 часов. Реакционный раствор охлаждали до комнатной температуры и осажденные кристаллы собирали фильтрованием. Полученные сырые кристаллы перекристаллизовывали из толуола с получением указанного в заголовке соединения (30 г).
MS (ESI) m/z: 294 (M+H)+.
1H-ЯМР (ДМСО-d6) δ: 1,61-1,64 (2H, м), 1,72-1,75 (2H, м), 2,19-2,21 (2H, м), 2,31-2,32 (2H, м), 5,89-5,90 (1H, м), 7,50 (1H, д, J=2,0 Гц), 8,02 (1H, д, J=2,0 Гц), 11,34 (1H, с).
Стадия 3
6-Бром-3-циклогекс-1-ен-1-ил-1-(тетрагидро-2H-пиран-4-илметил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Соединение, полученное на описанной выше стадии 2 (1 г), тетрагидро-2H-пиран-4-илметанол (0,43 г) и трифенилфосфин (1,1 г) растворяли в тетрагидрофуране (30 мл). По каплям в атмосфере азота добавляли диизопропилазодикарбоксилат (0,74 мл) и потом смесь перемешивали при комнатной температуре в течение 30 минут. Реакционный раствор концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (элюируя смесью этилацетат-гексан) с получением указанного в заголовке соединения (0,89 г).
MS (ESI) m/z: 392 (M+H)+.
1H-ЯМР (CDCl3) δ: 1,44-1,49 (2H, м), 1,61-1,62 (2H, м), 1,73-1,77 (2H, м), 1,85-1,88 (2H, м), 2,10-2,12 (1H, м), 2,30-2,32 (2H, м), 2,39-2,44 (2H, м), 3,35-3,38 (2H, м), 3,73 (2H, д, J=7,3 Гц), 3,97-4,00 (2H, м), 6,00-6,02 (1H, м), 7,28 (1H, д, J=2,0 Гц), 8,09 (1H, д, J=2,0 Гц).
Стадия 4
3-Циклогекс-1-ен-1-ил-1-(тетрагидро-2H-пиран-4-илметил)-6-(4,4,5,5-тетраметил-1,3,2-диоксаборан-2-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Бис(пинаколато)диборон (925 мг), ацетат калия (715 мг) и комплекс [1,1'-бис(дифенилфосфино)ферроцен]палладий(II) хлорид-дихлорметан (93 мг) добавляли в раствор соединения, полученного на вышеописанной стадии 3 (893 мг) в N,N-диметилформамиде (20 мл), и смесь нагревали с перемешиванием в атмосфере азота при 80°C в течение 6,5 часов. Реакционный раствор охлаждали до комнатной температуры, разбавляли этилацетатом и промывали насыщенным солевым раствором. Органический слой сушили и потом концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (элюируя смесью этилацетат-гексан) с получением указанного в заголовке соединения (723 мг).
MS (ESI) m/z: 440 (M+H)+.
1H-ЯМР (CDCl3) δ: 1,36 (12H, с), 1,45-1,48 (2H, м), 1,58-1,61 (2H, м), 1,75-1,77 (2H, м), 1,84-1,89 (2H, м), 2,12-2,14 (1H, м), 2,31-2,32 (2H, м), 2,43-2,43 (2H, м), 3,33-3,39 (2H, м), 3,77 (2H, д, J=7,3 Гц), 3,96-3,99 (2H, м), 6,00-6,02 (1H, м), 7,48 (1H, д, J=1,2 Гц), 8,45 (1H, д, J=1,2 Гц).
Стадия 5
6-(3-Хлор-1H-пирроло[2,3-b]пиридин-5-ил)-3-циклогекс-1-ен-1-ил-1-(тетрагидро-2H-пиран-4-илметил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (60 мг) получали способом, аналогичным применяемому на стадии 3 примера 1, используя соединение, полученное на вышеуказанной стадии 4 (120 мг), и соединение, полученное на описанной выше стадии 1 (95 мг).
MS (ESI) m/z: 464 (M+H)+.
1H-ЯМР (CDCl3) δ: 1,45-1,56 (2H, м), 1,62-1,69 (2H, м), 1,75-1,81 (2H, м), 1,87-1,92 (2H, м), 2,13-2,24 (1H, м), 2,31-2,38 (2H, м), 2,46-2,53 (2H, м), 3,33-3,41 (2H, м), 3,84 (2H, д, J=7,4 Гц), 3,95-4,02 (2H, м), 6,06-6,10 (1H, м), 7,37 (2H, д, J=1,7 Гц), 8,07 (1H, д, J=1,7 Гц), 8,29 (1H, д, J=2,3 Гц), 8,54 (1H, д, J=2,3 Гц), 8,94 (1H, ушир. с).
Стадия 6
6-(3-Хлор-1H-пирроло[2,3-b]пиридин-5-ил)-1-(тетрагидро-2H-пиран-4-илметил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
В раствор соединения, полученного на описанной выше стадии 5 (58 мг), в этаноле (5 мл) добавляли дистиллированную воду (1,5 мл) и добавляли при охлаждении льдом концентрированную серную кислоту (1,5 мл). Реакционный раствор перемешивали при 70°C в течение 89 часов. После охлаждения до комнатной температуры реакционный раствор выливали в насыщенный водный раствор бикарбоната натрия и ненужное вещество отфильтровывали. Полученный фильтрат разделяли добавлением этилацетата и дистиллированной воды. Полученный органический слой промывали насыщенным солевым раствором и сушили над безводным сульфатом натрия. Растворитель упаривали при пониженном давлении. Полученный остаток кристаллизовали из растворителя, состоящего из смеси дихлорметана и гексана, и суспендировали добавлением небольшого количества этилацетата, затем перемешивали в течение ночи. Твердый комопонент собирали из смешанного раствора фильтрованием и сушили с получением указанного в заголовке соединения (17 мг).
MS (ESI) m/z: 384 (M+H)+.
HRMS (ESI) [(M+H)+] вычислено: C19H19ClN5O2 384,12273; найдено: 384,12365.
1H-ЯМР (ДМСО-d6) δ: 1,27-1,38 (2H, м), 1,46-1,55 (2H, м), 2,03-2,17 (1H, м), 3,19-3,28 (2H, м), 3,79 (2H, д, J=7,4 Гц), 3,80-3,86 (2H, м), 7,74 (1H, д, J=2,9 Гц), 7,97 (1H, д, J=1,7 Гц), 8,18 (1H, д, J=1,7 Гц), 8,28 (1H, д, J=1,7 Гц), 8,65 (1H, д, J=2,3 Гц), 11,63 (1H, ушир. с), 12,09 (1H, ушир. с).
(Пример 36)
6-(4-Метил-1H-пирроло[2,3-b]пиридин-5-ил)-1-(тетрагидро-2H-пиран-4-илметил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
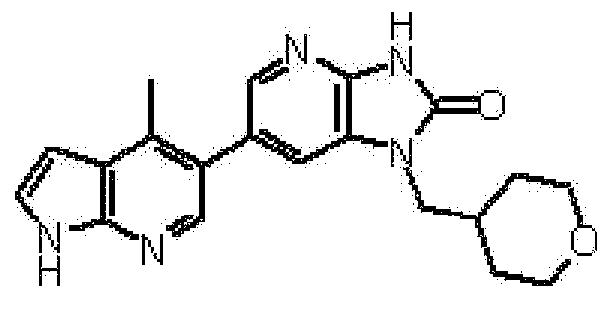
Стадия 1
5-Бром-3-йод-4-метилпиридин-2-амин
5-Бром-4-метилпиридин-2-амин (3,1 г) растворяли в уксусной кислоте (20 мл). Добавляли N-йодсукцинимид (3,8 г) и трифторуксусную кислоту (0,2 мл) и смесь перемешивали при комнатной температуре в течение 2,5 часов. Реакционный раствор выливали в ледяную воду и нейтрализовали 28% водным раствором аммиака. Затем осажденное твердое вещество собирали фильтрованием, промывали водой и сушили с получением указанного в заголовке соединения (4,9 г).
MS (ESI) m/z: 313 (M+H)+.
1H-ЯМР (ДМСО-d6) δ: 2,59 (3H, с), 5,01 (1H, ушир. с), 8,02 (1H, с).
Стадия 2
5-Бром-4-метил-3-[(триметилсилил)этинил]метилпиридин-2-амин
Соединение, полученное на описанной выше стадии 1 (3,0 г), растворяли в тетрагидрофуране (12 мл) и добавляли триэтиламин (60 мл) и йодид меди (0,04 г). Атмосферу заменяли на атмосферу азота. Далее добавляли триметилсилилацетилен (1,1 г) и бис(трифенилфосфин)палладий(II) дихлорид (0,1 г) и смесь перемешивали при комнатной температуре в течение ночи. Реакционный раствор распределяли между этилацетатом и водой и органический слой промывали насыщенным солевым раствором. Органический слой сушили и потом концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (элюируя смесью этилацетат-гексан) с получением указанного в заголовке соединения (2,5 г).
MS (ESI) m/z: 283 (M+H)+.
1H-ЯМР (CDCl3) δ: 0,28 (9H, с), 2,44 (3H, с), 4,99 (1H, ушир. с), 8,04 (1H, с).
Стадия 3
5-Бром-4-метил-1H-пирроло[2,3-b]пиридин
Раствор соединения, полученного на описанной выше стадии 2 (14,0 г), в N-метилпирролидоне (200 мл) медленно добавляли по каплям в раствор трет-бутоксида калия (11,6 г) в N-метилпирролидоне (300 мл) при 80°C и потом смесь перемешивали при 80°C в течение 30 минут. Реакционный раствор охлаждали до комнатной температуры, разбавляли этилацетатом и промывали водой. Органический слой сушили и затем концентрировали при пониженном давлении. Осажденное твердое вещество собирали фильтрованием с помощью смеси диэтиловый эфир-гексан с получением указанного в заголовке соединения (8,6 г).
MS (ESI) m/z: 211 (M+H)+.
1H-ЯМР (CDCl3) δ: 2,62 (3H, с), 6,50-6,54 (1H, м), 7,29-7,32 (1H, м), 8,35 (1H, с) 9,36 (1H, ушир. с).
Стадия 4
трет-Бутил 5-бром-4-метил-1H-пирроло[2,3-b]пиридин-1-карбоксилат
Указанное в заголовке соединение (339 мг) получали способом, аналогичным применяемому на стадии 1 примера 35, используя соединение, полученное на вышеуказанной стадии 3 (276 мг).
MS (ESI) m/z: 311 (M+H)+.
1H-ЯМР (CDCl3) δ: 1,67 (9H, с), 2,58 (3H, с), 6,53 (1H, д, J=4,0 Гц), 7,61 (1H, д, J=4,0 Гц), 8,52 (1H, с).
Стадия 5
3-Циклогекс-1-ен-1-ил-6-(4-метил-1H-пирроло[2,3-b]пиридин-5-ил)-1-(тетрагидро-2H-пиран-4-илметил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (136 мг) получали способом, аналогичным применяемому на стадии 3 примера 1, используя соединение, полученное на стадии 4 примера 35 (179 мг), и соединение, полученное на описанной выше стадии 4 (126 мг).
MS (ESI) m/z: 444 (M+H)+.
Стадия 6
6-(4-Метил-1H-пирроло[2,3-b]пиридин-5-ил)-1-(тетрагидро-2H-пиран-4-илметил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (54 мг) получали способом, аналогичным применяемому на стадии 6 примера 35, используя соединение, полученное на вышеуказанной стадии 5 (136 мг).
MS (ESI) m/z: 364 (M+H)+.
HRMS (ESI) [(M+H)+] вычислено: C20H22N5O2 364,17735; найдено: 364,17525.
1H-ЯМР (ДМСО-d6) δ: 1,27-1,32 (2H, м), 1,50 (2H, д, J=11,5 Гц), 2,03-2,05 (1H, м), 2,47 (3H, с), 3,21-3,24 (2H, м), 3,70-3,75 (2H, м), 3,79-3,84 (2H, м), 6,56-6,58 (1H, м), 7,47-7,49 (1H, м), 7,63 (1H, с), 7,91 (1H, д, J=1,7 Гц), 8,10 (1H, с), 11,62 (1H, ушир. с), 11,66 (1H, ушир. с).
(Пример 37)
6-(3-Метил-1H-пирроло[2,3-b]пиридин-5-ил)-1-(тетрагидро-2H-пиран-4-илметил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
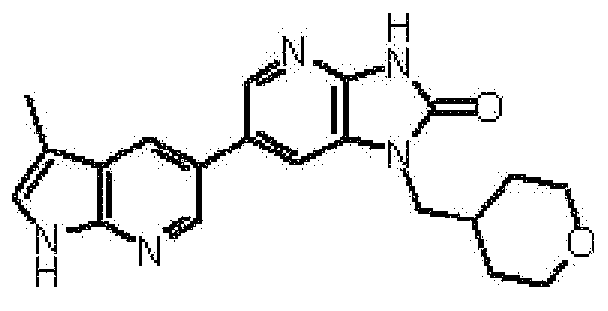
Стадия 1
5-[3-Циклогекс-1-ен-1-ил-2-оксо-1-(тетрагидро-2H-пиран-4-илметил)-2,3-дигидро-2H-имидазо[4,5-b]пиридин-6-ил]-1H-пирроло[2,3-b]пиридин-3-карбальдегид
Указанное в заголовке соединение (173 мг) получали способом, аналогичным применяемому на стадии 3 примера 1, используя соединение, полученное на стадии 4 примера 35 (296 мг), и 5-бром-1H-пирроло[2,3-b]пиридин-3-карбальдегид, полученный способом, описанным в WO 2004/101565 (159 мг).
MS (ESI) m/z: 458 (M+H)+.
1H-ЯМР (CDCl3) δ: 1,26-1,41 (2H, м), 1,48-1,57 (2H, м), 1,62-1,71 (2H, м), 1,73-1,82 (2H, м), 2,05-2,18 (1H, м), 2,20-2,28 (2H, м), 2,36-2,44 (2H, м), 3,19-3,29 (2H, м), 3,79-3,88 (4H, м), 5,94-6,00 (1H, м), 7,77-7,83 (1H, м), 8,04 (1H, д, J=2,3 Гц), 8,29 (1H, д, J=2,3 Гц), 8,55 (1H, с), 8,63 (1H, д, J=2,3 Гц), 8,69 (1H, д, J=2,3 Гц), 9,97 (1H, с).
Стадия 2
3-Циклогекс-1-ен-1-ил-6-(3-метил-1H-пирроло[2,3-b]пиридин-5-ил)-1-(тетрагидро-2H-пиран-4-илметил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Соединение, полученное на описанной выше стадии 1 (120 мг), растворяли в метаноле (4 мл). Добавляли диметиламин гидрохлорид (43 мг) и ацетат натрия (34 мг) и смесь перемешивали при комнатной температуре в течение 1,5 часов. Дополнительно добавляли цианоборгидрид натрия (46 мг) и смесь перемешивали при комнатной температуре в течение ночи. Реакционный раствор разбавляли этилацетатом и промывали насыщенным солевым раствором. Органический слой сушили и потом концентрировали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (элюируя смесью метанол-хлороформ) с получением указанного в заголовке соединения (50 мг).
MS (ESI) m/z: 444 (M+H)+.
1H-ЯМР (CDCl3) δ: 1,46-1,56 (2H, м), 1,65 (2H, д, J=13,2 Гц), 1,75-1,80 (2H, м), 1,88-1,93 (2H, м), 2,15-2,22 (1H, м), 2,33-2,36 (2H, м), 2,39 (3H, д, J=1,1 Гц), 2,49-2,52 (2H, м), 3,35-3,39 (2H, м), 3,85 (2H, д, J=6,9 Гц), 3,97-4,01 (2H, м), 6,08-6,09 (1H, м), 7,17-7,18 (1H, м), 7,38 (1H, д, J=1,7 Гц), 8,00 (1H, д, J=2,3 Гц), 8,30 (1H, д, J=2,3 Гц), 8,47 (1H, д, J=2,3 Гц), 9,36 (1H, с).
Стадия 3
6-(3-Метил-1H-пирроло[2,3-b]пиридин-5-ил)-1-(тетрагидро-2H-пиран-4-илметил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (26 мг) получали способом, аналогичным применяемому на стадии 6 примера 35, используя соединение, полученное на вышеуказанной стадии 2 (50 мг).
MS (ESI) m/z: 364 (M+H)+.
HRMS (ESI) [M+H]+ вычислено: C20H22N5O2 364,17735; найдено: 364,17567.
1H-ЯМР (ДМСО-d6) δ: 1,27-1,35 (2H, м), 1,47-1,51 (2H, м), 2,07-2,11 (1H, м), 2,31 (3H, с), 3,23 (2H, т, J=10,9 Гц), 3,77 (2H, д, J=7,4 Гц), 3,79-3,83 (2H, м), 7,27 (1H, с), 7,90 (1H, д, J=1,7 Гц), 8,17 (1H, д, J=1,7 Гц), 8,24 (1H, д, J=1,7 Гц), 8,49-8,51 (1H, м), 11,37 (1H, с), 11,58 (1H, с).
(Пример 38)
1-(1,4-Диоксан-2-илметил)-6-(1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
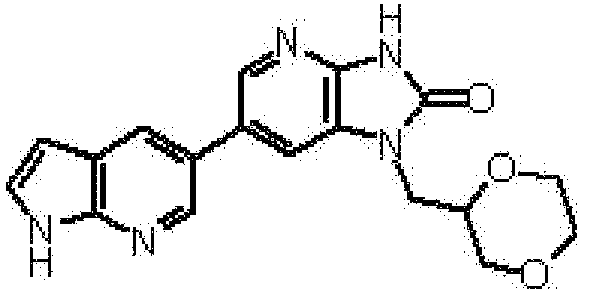
Стадия 1
6-Бром-3-циклогекс-1-ен-1-ил-1-(1,4-диоксан-2-илметил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (312 мг) получали способом, применяемым на стадии 3 примера 35, используя соединение, полученное на стадии 2 примера 35 (280 мг), и 1,4-диоксан-2-илметанол, полученный способом, описанным в Bioorg. Med. Chem. 15, 2667-2679 (2007) (135 мг).
MS (APCI) m/z: 394 [M+H]+.
1H-ЯМР (CDCl3) δ: 1,73-1,76 (2H, м), 1,84-1,88 (2H, м), 2,30-2,31 (2H, м), 2,41-2,43 (2H, м), 3,35-3,93 (9H, м), 6,02 (1H, м), 7,49 (1H, д, J=2,3 Гц), 8,09 (1H, д, J=2,3 Гц).
Стадия 2
3-Циклогекс-1-ен-1-ил-1-(1,4-диоксан-2-илметил)-6-(1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (47 мг) получали способом, аналогичным применяемому на стадии 3 примера 1, используя соединение, полученное на вышеуказанной стадии 1 (122 мг), и 5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пирроло[2,3-b]пиридин (83 мг).
MS (APCI) m/z: 432 [M+H]+ .
Стадия 3
1-(1,4-Диоксан-2-илметил)-6-(1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (32 мг) получали способом, аналогичным применяемому на стадии 6 примера 35, используя соединение, полученное на вышеуказанной стадии 2 (47 мг).
HRMS (ESI) [M+H]+ вычислено: C18H17N5O3 352,14096; найдено: 352,14017.
1H-ЯМР (ДМСО-d6) δ: 3,29-4,01 (9H, м), 6,51-6,52 (1H, м), 7,52-7,54 (1H, м), 7,84-7,85 (1H, м), 8,22-8,25 (2H, м), 8,53 (1H, д, J=2,3 Гц), 11,62 (1H, с), 11,74 (1H, с).
(Пример 39)
1-[(2R)-1,4-Диоксан-2-илметил]-6-(1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
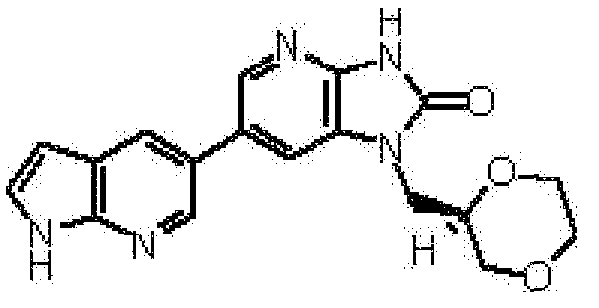
Стадия 1
6-Бром-3-циклогекс-1-ен-1-ил-1-[(2R)-1,4-диоксан-2-илметил]-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (602 мг) получали способом, применяемым на стадии 3 примера 35, используя соединение, полученное на стадии 2 примера 35 (300 мг), и (2R)-1,4-диоксан-2-илметанол, полученный способом, описанным в Bioorg. Med. Chem. 15, 2667-2679 (2007) (169 мг).
MS (ESI) m/z: 394 (M+H)+.
1H-ЯМР (CDCl3) δ: 1,73-1,76 (2H, м), 1,84-1,88 (2H, м), 2,30-2,31 (2H, м), 2,41-2,43 (2H, м), 3,37 (1H, м), 3,56-3,60 (1H, м), 3,66-3,73 (2H, м), 3,78-3,83 (2H, м), 3,86-3,94 (3H, м), 6,00-6,03 (1H, м), 7,49 (1H, д, J=2,3 Гц), 8,09 (1H, д, J=2,3 Гц).
Стадия 2
3-Циклогекс-1-ен-1-ил-1-[(2R)-1,4-диоксан-2-илметил]-6-(1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (91 мг) получали способом, аналогичным применяемому на стадии 3 примера 1, используя соединение, полученное на вышеуказанной стадии 1 (180 мг), и 5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пирроло[2,3-b]пиридин (69 мг).
MS (ESI) m/z: 432 (M+H)+.
1H-ЯМР (CDCl3) δ: 1,75-1,80 (2H, м), 1,88-1,93 (2H, м), 2,32-2,36 (2H, м), 2,49-2,52 (2H, м), 3,41-3,45 (1H, м), 3,57-3,60 (1H, м), 3,68-3,74 (2H, м), 3,77-3,80 (1H, м), 3,90-4,02 (4H, м), 6,08-6,09 (1H, м), 6,60 (1H, дд, J=3,4, 1,7 Гц), 7,41 (1H, дд, J=3,4, 2,3 Гц), 7,58 (1H, д, J=1,7 Гц), 8,09 (1H, д, J=1,7 Гц), 8,30 (1H, д, J=2,3 Гц), 8,50 (1H, д, J=1,7 Гц), 9,63 (1H, ушир. с).
Стадия 3
1-[(2R)-1,4-Диоксан-2-илметил]-6-(1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (31 мг) получали способом, аналогичным применяемому на стадии 6 примера 35, используя соединение, полученное на вышеуказанной стадии 2 (91 мг).
MS (ESI) m/z: 352 (M+H)+.
HRMS (ESI) [M+H]+ вычислено: C18H18N5O3 352,14096; найдено: 352,13790.
1H-ЯМР (ДМСО-d6) δ: 3,29-4,01 (9H, м), 6,51-6,52 (1H, м), 7,52-7,54 (1H, м), 7,84-7,85 (1H, м), 8,22-8,25 (2H, м), 8,53 (1H, д, J=2,3 Гц), 11,62 (1H, с), 11,74 (1H, с).
(Пример 40)
1-[(2S)-1,4-Диоксан-2-илметил]-6-(1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
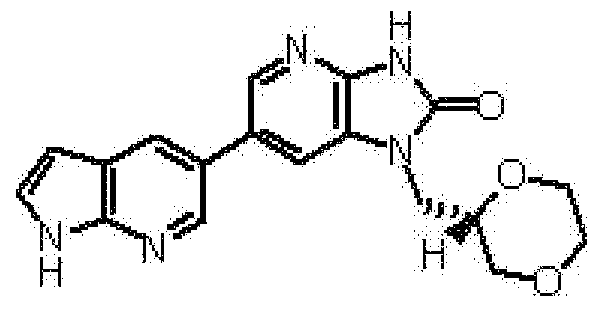
Стадия 1
6-Бром-3-циклогекс-1-ен-1-ил-1-[(2S)-1,4-диоксан-2-илметил]-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (593 мг) получали способом, применяемым на стадии 3 примера 35, используя соединение, полученное на стадии 2 примера 35 (300 мг), и (2S)-1,4-диоксан-2-илметанол, полученный способом, описанным в Bioorg. Med. Chem. 15, 2667-2679 (2007) (169 мг).
MS (ESI) m/z: 394 (M+H)+.
1H-ЯМР (CDCl3) δ: 1,73-1,76 (2H, м), 1,84-1,88 (2H, м), 2,30-2,31 (2H, м), 2,41-2,43 (2H, м), 3,37 (1H, м), 3,56-3,60 (1H, м), 3,66-3,73 (2H, м), 3,78-3,83 (2H, м), 3,86-3,94 (3H, м), 6,00-6,03 (1H, м), 7,49 (1H, д, J=2,3 Гц), 8,09 (1H, д, J=2,3 Гц).
Стадия 2
3-Циклогекс-1-ен-1-ил-1-[(2S)-1,4-диоксан-2-илметил]-6-(1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (89 мг) получали способом, аналогичным применяемому на стадии 3 примера 1, используя соединение, полученное на вышеуказанной стадии 1 (180 мг), и 5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пирроло[2,3-b]пиридин (69 мг).
MS (ESI) m/z: 432 (M+H)+.
Стадия 3
1-[(2S)-1,4-Диоксан-2-илметил]-6-(1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (32 мг) получали способом, аналогичным применяемому на стадии 6 примера 35, используя соединение, полученное на вышеуказанной стадии 2 (89 мг).
MS (ESI) m/z: 352 (M+H)+.
HRMS (ESI) [M+H]+ вычислено: C18H18N5O3 352,14096; найдено: 352,14104.
1H-ЯМР (ДМСО-d6) δ: 3,29-4,01 (9H, м), 6,51-6,52 (1H, м), 7,52-7,54 (1H, м), 7,84-7,85 (1H, м), 8,22-8,25 (2H, м), 8,53 (1H, д, J=2,3 Гц), 11,62 (1H, с), 11,74 (1H, с).
(Пример 41)
6-(3-Хлор-1H-пирроло[2,3-b]пиридин-5-ил)-1-[(2S)-1,4-диоксан-2-илметил]-1,3-дигидроимидазо[4,5-b]пиридин-2-он
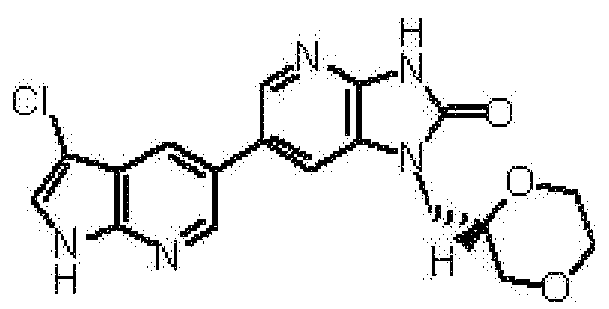
Стадия 1
3-Циклогекс-1-ен-1-ил-1-[(2S)-1,4-диоксан-2-илметил]-6-(4,4,5,5-тетраметил-1,3,2-диоксаборан-2-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (240 мг) получали способом, аналогичным применяемому на стадии 4 примера 35, используя соединение, полученное на стадии 1 примера 40 (353 мг).
MS (ESI) m/z: 442 (M+H)+.
1H-ЯМР (CDCl3) δ: 1,36 (12H, с), 1,74-1,76 (2H, м), 1,86-1,89 (2H, м), 2,31-2,32 (2H, м), 2,43-2,45 (2H, м), 3,43 (1H, дд, J=11,5, 9,6 Гц), 3,62 (1H, дд, J=11,5, 2,7 Гц), 3,68-3,70 (2H, м), 3,78-3,87 (2H, м), 3,89-3,90 (2H, м), 3,95-3,97 (1H, м), 6,01-6,03 (1H, м), 7,61 (1H, д, J=1,2 Гц), 8,45 (1H, д, J=1,2 Гц).
Стадия 2
6-(3-Хлор-1H-пирроло[2,3-b]пиридин-5-ил)3-циклогекс-1-ен-1-ил-1-[(2S)-1,4-диоксан-2-илметил]-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (122 мг) получали способом, аналогичным применяемому на стадии 3 примера 1, используя соединение, полученное на вышеуказанной стадии 1 (240 мг), и соединение, полученное на стадии 1 примера 35 (198 мг).
MS (ESI) m/z: 466 (M+H)+.
Стадия 3
6-(3-Хлор-1H-пирроло[2,3-b]пиридин-5-ил)-1-[(2S)-1,4-диоксан-2-илметил]-1,3-дигидроимидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (54 мг) получали способом, аналогичным применяемому на стадии 6 примера 35, используя соединение, полученное на вышеуказанной стадии 2 (122 мг).
MS (ESI) m/z: 386 (M+H)+.
HRMS (ESI) [M+H]+ вычислено: C18H17ClN5O3 386,10199; найдено: 386,10009.
1H-ЯМР (ДМСО-d6) δ: 3,33-4,02 (9H, м), 7,74-7,76 (1H, м), 7,91 (1H, д, J=1,7 Гц), 8,18 (1H, д, J=1,7 Гц), 8,29 (1H, д, J=2,3 Гц), 8,64 (1H, д, J=2,3 Гц), 11,66 (1H, с), 12,10 (1H, ушир. с).
(Пример 42)
1-[(2S)-1,4-Диоксан-2-илметил]-6-(4-метил-1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидроимидазо[4,5-b]пиридин-2-он
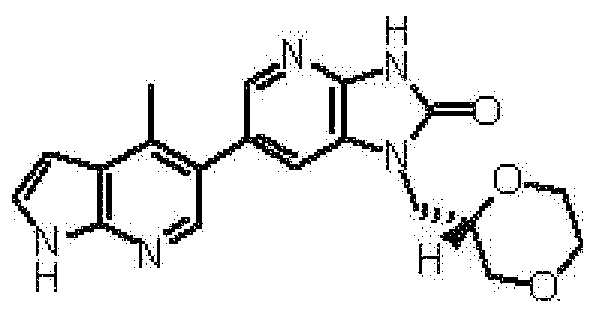
Стадия 1
3-Циклогекс-1-ен-1-ил-1-[(2S)-1,4-диоксан-2-илметил]-6-(4-метил-1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (41 мг) получали способом, аналогичным применяемому на стадии 3 примера 1, используя соединение, полученное на стадии 1 примера 41 (153 мг), и соединение, полученное на стадии 4 примера 36 (108 мг).
MS (ESI) m/z: 446 (M+H)+.
Стадия 2
1-[(2S)-1,4-Диоксан-2-илметил]-6-(4-метил-1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидроимидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (20 мг) получали способом, аналогичным применяемому на стадии 6 примера 35, используя соединение, полученное на вышеуказанной стадии 2 (41 мг).
MS (ESI) m/z: 366 (M+H)+.
HRMS (ESI) [M+H]+ вычислено: C19H20N5O3 366,15661; найдено: 366,15640.
1H-ЯМР (ДМСО-d6) δ: 2,47 (3H, с), 3,33-3,95 (9H, м), 6,56-6,58 (1H, м), 7,47-7,50 (1H, м), 7,56 (1H, с), 7,92-7,93 (1H, м), 8,09 (1H, с), 11,64-11,67 (2H, м).
(Пример 43)
1-[(2S)-1,4-Диоксан-2-илметил]-6-(3-метил-1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидроимидазо[4,5-b]пиридин-2-он
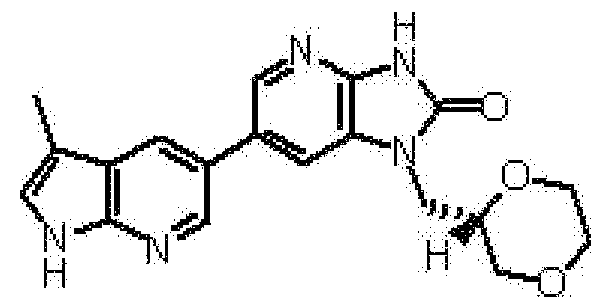
Стадия 1
5-[3-Циклогекс-1-ен-1-ил-1-[(2S)-1,4-диоксан-2-илметил]-2-оксо-2,3-дигидро-2H-имидазо[4,5-b]пиридин-6-ил]-1H-пирроло[2,3-b]пиридин-3-карбальдегид
Указанное в заголовке соединение (41 мг) получали способом, аналогичным применяемому на стадии 3 примера 1, используя соединение, полученное на стадии 1 примера 41 (190 мг), и 5-бром-1H-пирроло[2,3-b]пиридин-3-карбальдегид, полученный способом, описанным в WO 2004/101565 (97 мг).
MS (ESI) m/z: 460 (M+H)+.
Стадия 2
3-Циклогекс-1-ен-1-ил-1-[(2S)-1,4-диоксан-2-илметил]-6-(3-метил-1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (27 мг) получали способом, аналогичным применяемому на стадии 2 примера 37, используя соединение, полученное на вышеуказанной стадии 1 (41 мг).
MS (ESI) m/z: 446 (M+H)+.
Стадия 3
1-[(2S)-1,4-Диоксан-2-илметил]-6-(3-метил-1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидроимидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (26 мг) получали способом, аналогичным применяемому на стадии 6 примера 35, используя соединение, полученное на вышеуказанной стадии 2 (49 мг).
MS (ESI) m/z: 366 (M+H)+.
HRMS (ESI) [M+H]+ вычислено: C19H20N5O3 366,15661; найдено: 366,15790.
1H-ЯМР (ДМСО-d6) δ: 2,32 (3H, с), 3,33-4,04 (9H, м), 7,28 (1H, с), 7,85 (1H, д, J=1,2 Гц), 8,17-8,18 (1H, м), 8,26 (1H, д, J=1,2 Гц), 8,50-8,50 (1H, м), 11,38 (1H, ушир. с), 11,61 (1H, ушир. с).
(Пример 44)
1-[(2S)-1,4-Диоксан-2-илметил]-5-метил-6-(1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидроимидазо[4,5-b]пиридин-2-он
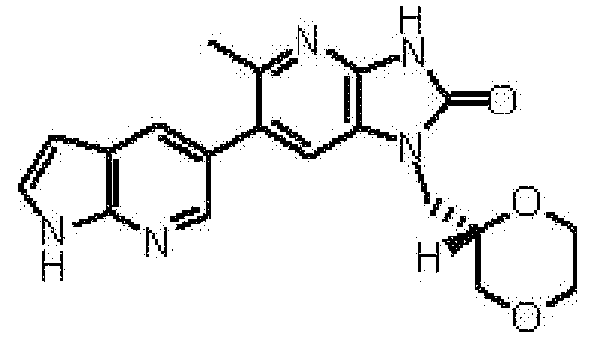
Стадия 1
6-Бром-3-циклогекс-1-ен-1-ил-5-метил-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (0,64 г) получали способом, аналогичным применяемому на стадии 2 примера 35, используя соединение, полученное на стадии 2 примера 7 (1,0 г).
MS (ESI) m/z: 410 (M+H)+.
Стадия 2
6-Бром-3-циклогекс-1-ен-1-ил-1-[(2S)-1,4-диоксан-2-илметил]-5-метил-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
В раствор соединения, полученного на описанной выше стадии 1 (640 мг), в тетрагидрофуране (20 мл) добавляли (2S)-1,4-диоксан-2-илметанол (319 мг) и трифенилфосфин (817 мг). После этого по каплям при 0°C добавляли раствор ди-2-метоксиэтил азодикарбоксилата (730 мг) в тетрагидрофуране (5 мл) и смесь перемешивали в течение 11 часов при постепенном нагревании до комнатной температуры. Реакционный раствор разбавляли диэтиловым эфиром, промывали водой и насыщенным солевым раствором в данном порядке и сушили над безводным сульфатом натрия. Растворитель упаривали при пониженном давлении. Полученный остаток очищали хроматографией на колонке с силикагелем (элюируя смесью этилацетат-гексан) с получением указанного в заголовке соединения (480 мг).
MS (ESI) m/z: 308 (M+H)+.
1H-ЯМР (CDCl3) δ: 1,72-1,76 (2H, м), 1,83-1,88 (2H, м), 2,28-2,32 (2H, м), 2,43-2,46 (2H, м), 2,60 (3H, с), 3,36 (1H, дд, J=11,5, 9,7 Гц), 3,54-3,60 (1H, м), 3,66-3,71 (2H, м), 3,77-3,81 (2H, м), 3,85-3,92 (3H, м), 5,99-6,01 (1H, м), 7,47 (1H, с).
Стадия 3
3-Циклогекс-1-ен-1-ил-1-[(2S)-1,4-диоксан-2-илметил]-5-метил-6-(1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (180 мг) получали способом, аналогичным применяемому на стадии 3 примера 1, используя соединение, полученное на вышеуказанной стадии 2 (150 мг), и 5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пирроло[2,3-b]пиридин (107 мг).
MS (ESI) m/z: 446 (M+H)+.
1H-ЯМР (CDCl3) δ: 1,75-1,79 (2H, м), 1,87-1,93 (2H, м), 2,31-2,35 (2H, м), 2,48 (3H, с), 2,52-2,55 (2H, м), 3,39 (1H, дд, J=11,5, 9,7 Гц), 3,55-3,76 (4H, м), 3,83-3,95 (4H, м), 6,06-6,08 (1H, м), 6,57 (1H, дд, J=3,7, 2,0 Гц), 7,24 (1H, с), 7,39-7,39 (1H, м), 7,89 (1H, д, J=1,2 Гц), 8,27 (1H, д, J=1,7 Гц), 8,97 (1H, с).
Стадия 4
1-[(2S)-1,4-Диоксан-2-илметил]-5-метил-6-(1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидроимидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (75 мг) получали способом, аналогичным применяемому на стадии 6 примера 35, используя соединение, полученное на вышеуказанной стадии 3 (180 мг).
MS (ESI) m/z: 366 (M+H)+.
1H-ЯМР (ДМСО-d6) δ: 2,38 (3H, с), 3,28-3,30 (1H, м), 3,40-3,52 (2H, м), 3,59 (1H, д, J=10,5 Гц), 3,68-3,80 (3H, м), 3,82-3,93 (2H, м), 6,49 (1H, дд, J=3,4, 1,7 Гц), 7,41 (1H, с), 7,53-7,53 (1H, м), 7,95 (1H, д, J=2,0 Гц), 8,21 (1H, д, J=2,2 Гц), 11,49 (1H, ушир. с), 11,74 (1H, ушир. с).
(Пример 45)
1-[(2S)-1,4-Диоксан-2-илметил]-5-метил-6-(4-метил-1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидроимидазо[4,5-b]пиридин-2-он
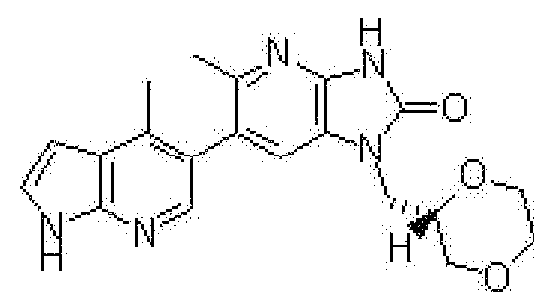
Стадия 1
3-Циклогекс-1-ен-1-ил-1-[(2S)-1,4-диоксан-2-илметил]-5-метил-6-(4,4,5,5-тетраметил-1,3,2-диоксаборан-2-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (433 мг) получали способом, аналогичным применяемому на стадии 4 примера 35, используя соединение, полученное на стадии 2 примера 44 (470 мг).
MS (ESI) m/z: 456 (M+H)+.
1H-ЯМР (CDCl3) δ: 1,36 (6H, с), 1,58 (6H, с), 1,71-1,76 (2H, м), 1,83-1,88 (2H, м), 1,93 (6H, с), 2,28-2,31 (2H, м), 2,45-2,49 (2H, м), 2,72 (3H, с), 3,43 (1H, дд, J=12,0, 9,7 Гц), 3,58-3,63 (1H, м), 3,67-3,72 (2H, м), 3,78-3,97 (5H, м), 4,07-4,09 (2H, м), 6,00-6,02 (1H, м), 7,58 (1H, с).
Стадия 2
3-Циклогекс-1-ен-1-ил-1-[(2S)-1,4-диоксан-2-илметил]-5-метил-6-(4-метил-1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (74 мг) получали способом, аналогичным применяемому на стадии 3 примера 1, используя соединение, полученное на вышеуказанной стадии 1 (130 мг), и соединение, полученное на стадии 4 примера 36 (106 мг).
MS (ESI) m/z: 460 (M+H)+.
Стадия 3
1-[(2S)-1,4-Диоксан-2-илметил]-5-метил-6-(4-метил-1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидроимидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (13 мг) получали способом, аналогичным применяемому на стадии 6 примера 35, используя соединение, полученное на вышеуказанной стадии 2 (70 мг).
MS (ESI) m/z: 380 (M+H)+.
1H-ЯМР (ДМСО-d6) δ: 2,15-2,15 (3H, м), 2,25-2,26 (3H, м), 3,39-3,51 (3H, м), 3,56-3,61 (1H, м), 3,67-3,91 (5H, м), 6,55-6,56 (1H, м), 7,29-7,30 (1H, м), 7,47-7,48 (1H, м), 7,95-7,97 (1H, м), 11,50-11,52 (1H, м), 11,64-11,66 (1H, м).
(Пример 46)
6-(3-Хлор-1H-пирроло[2,3-b]пиридин-5-ил)-1-[(2S)-1,4-диоксан-2-илметил]-5-метил-1,3-дигидроимидазо[4,5-b]пиридин-2-он
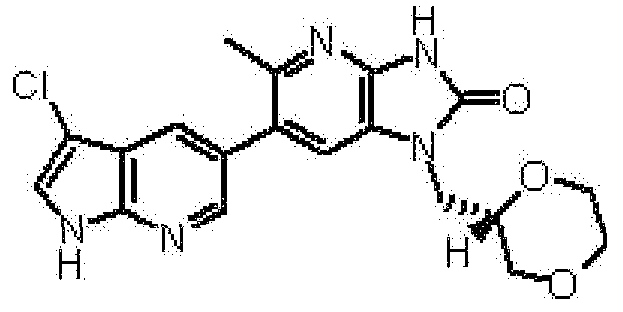
Стадия 1
6-(3-Хлор-1H-пирроло[2,3-b]пиридин-5-ил)-3-циклогекс-1-ен-1-ил-1-[(2S)-1,4-диоксан-2-илметил]-5-метил-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (35 мг) получали способом, аналогичным применяемому на стадии 3 примера 1, используя соединение, полученное на стадии 1 примера 45 (130 мг), и соединение, полученное на стадии 1 примера 35 (113 мг).
MS (ESI) m/z: 480 (M+H)+.
Стадия 2
6-(3-Хлор-1H-пирроло[2,3-b]пиридин-5-ил)-1-[(2S)-1,4-диоксан-2-илметил]-5-метил-1,3-дигидроимидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (17 мг) получали способом, аналогичным применяемому на стадии 6 примера 35, используя соединение, полученное на вышеуказанной стадии 1 (35 мг).
MS (ESI) m/z: 400 (M+H)+.
1H-ЯМР (ДМСО-d6) δ: 2,38 (3H, с), 3,27-3,31 (1H, м), 3,41-3,52 (2H, м), 3,59 (1H, д, J=10,9 Гц), 3,68-3,80 (3H, м), 3,84-3,88 (1H, м), 3,89-3,94 (1H, м), 7,45 (1H, с), 7,76 (1H, д, J=2,9 Гц), 7,90 (1H, д, J=1,7 Гц), 8,32 (1H, д, J=2,3 Гц), 11,53 (1H, с), 12,11 (1H, с).
(Пример 47)
1-[(2S)-1,4-Диоксан-2-илметил]-5-метил-6-(3-метил-1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидроимидазо[4,5-b]пиридин-2-он
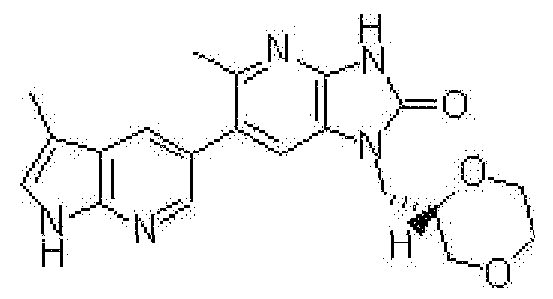
Стадия 1
трет-Бутил 5-бром-3-метил-1H-пирроло[2,3-b]пиридин-1-карбоксилат
Указанное в заголовке соединение (385 мг) получали способом, аналогичным применяемому на стадии 1 примера 35, используя 5-бром-3-метил-1H-пирроло[2,3-b]пиридин, полученный способом, описанным в WO 2009/016460 (365 мг).
MS (ESI) m/z: 311 (M+H)+.
1H-ЯМР (CDCl3) δ: 1,66 (9H, с), 2,23 (3H, д, J=1,5 Гц), 7,41-7,41 (1H, м), 7,94 (1H, д, J=2,2 Гц), 8,51 (1H, д, J=2,2 Гц).
Стадия 2
3-Циклогекс-1-ен-1-ил-1-[(2S)-1,4-диоксан-2-илметил]-5-метил-6-(3-метил-1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (105 мг) получали способом, аналогичным применяемому на стадии 2 примера 4, используя соединение, полученное на стадии 1 примера 45 (160 мг), и соединение, полученное на описанной выше стадии 1 (100 мг).
MS (ESI) m/z: 460 (M+H)+.
1H-ЯМР (CDCl3) δ: 1,75-1,79 (2H, м), 1,87-1,92 (2H, м), 2,32-2,34 (2H, м), 2,35 (3H, д, J=1,15 Гц), 2,47 (3H, с), 2,52-2,55 (2H, м), 3,39 (1H, дд, J=11,5, 9,7 Гц), 3,55 (1H, тд, J=11,7, 2,9 Гц), 3,65-3,70 (2H, м), 3,72-3,76 (1H, м), 3,84-3,94 (4H, м), 6,06-6,08 (1H, м), 7,14 (1H, с), 7,24 (1H, с), 7,81 (1H, д, J=2,3 Гц), 8,24 (1H, д, J=2,3 Гц), 8,59 (1H, ушир. с).
Стадия 3
1-[(2S)-1,4-Диоксан-2-илметил]-5-метил-6-(3-метил-1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидроимидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (42 мг) получали способом, аналогичным применяемому на стадии 6 примера 35, используя соединение, полученное на вышеуказанной стадии 2 (103 мг).
MS (ESI) m/z: 380 (M+H)+.
1H-ЯМР (ДМСО-d6) δ: 2,28 (3H, с), 2,38 (3H, с), 3,27-3,31 (1H, м), 3,40-3,52 (2H, м), 3,59 (1H, д, J=10,9 Гц), 3,68-3,93 (5H, м), 7,29 (1H, с), 7,41 (1H, с), 7,89 (1H, д, J=2,3 Гц), 8,18 (1H, д, J=1,7 Гц), 11,39 (1H, с), 11,49 (1H, с).
(Пример 48)
1-[2-(3,6-Дигидро-2H-пиран-4-ил)этил]-6-(1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
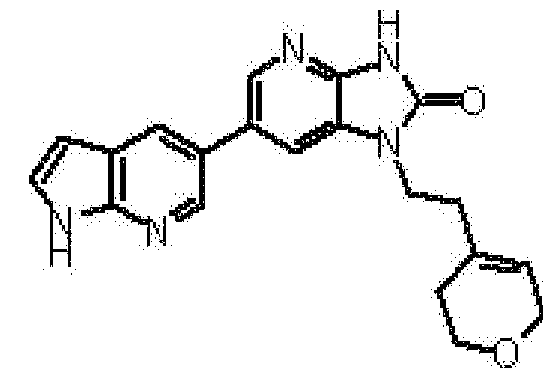
Стадия 1
Этил тетрагидро-4H-пиран-4-илиденацетат
Этил 3,6-дигидро-2H-пиран-4-илацетат
В диметоксиэтане (150 мл) суспендировали 55% гидрид натрия (2,6 г). В течение пяти минут по каплям в атмосфере азота при охлаждении льдом добавляли этилдиэтилфосфоноацетат (9,6 мл) и смесь перемешивали при такой же температуре в течение 45 минут. Добавляли по каплям раствор тетрагидро-4H-пиран-4-она (4,0 г) в диметоксиэтане (10 мл) в течение пяти минут. Смесь перемешивали при комнатной температуре в течение 10 минут и потом нагревали с обратным холодильником в течение одного часа. Реакционный раствор выливали в воду, затем экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором и потом сушили над безводным сульфатом натрия и растворитель упаривали. Остаток очищали хроматографией на колонке с силикагелем (элюируя смесью этилацетат-гексан) с получением указанных в заголовке соединений, этилтетрагидро-4H-пиран-4-илиденацетата (1,7 г) и этил 3,6-дигидро-2H-пиран-4-илацетата (2,2 г), оба в виде бесцветного масла.
Этил тетрагидро-4H-пиран-4-илиденацетат
1H-ЯМР (CDCl3) δ: 1,28 (3H, т, J=7,1 Гц), 2,30-2,35 (2H, м), 2,98-3,03 (2H, м), 3,74 (2H, т, J=5,6 Гц), 3,77 (2H, т, J=5,6 Гц), 4,16 (2H, кв, J=7,1 Гц), 5,68 (1H, с).
Этил 3,6-дигидро-2H-пиран-4-илацетат
1H-ЯМР (CDCl3) δ: 1,27 (3H, т, J=7,1 Гц), 2,12-2,19 (2H, м), 3,01 (2H, с), 3,80 (2H, т, J=5,5 Гц), 4,11-4,19 (4H, м), 5,58-5,62 (1H, м).
Стадия 2
2-(3,6-Дигидро-2H-пиран-4-ил)этанол
Указанное в заголовке соединение (1,6 г) получали в виде бесцветного масла способом, аналогичным применяемому на стадии 2 примера 33, используя этил 3,6-дигидро-2H-пиран-4-илацетат, полученный на вышеуказанной стадии 1.
1H-ЯМР (CDCl3) δ: 1,55 (1H, ушир. с), 2,06-2,12 (2H, м), 2,28 (2H, т, J=6,2 Гц), 3,72 (2H, т, J=6,3 Гц), 3,80 (2H, т, J=5,5 Гц), 4,11-4,15 (2H, м), 5,53-5,57 (1H, м).
Стадия 3
6-Бром-3-циклогекс-1-ен-1-ил-1-[2-(3,6-дигидро-2H-пиран-4-ил)этил]-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (705 мг) получали в виде смеси способом, аналогичным применяемому на стадии 3 примера 35, используя соединение, полученное на стадии 2 примера 35 (280 мг), и соединение, полученное на описанной выше стадии 2 (146 мг).
1H-ЯМР (CDCl3) δ: 1,70-1,78 (2H, м), 1,81-1,90 (2H, м), 2,11-2,18 (2H, м), 2,26-2,33 (2H, м), 2,36-2,45 (4H, м), 3,78 (2H, т, J=5,5 Гц), 3,97 (2H, т, J=7,2 Гц), 4,00-4,04 (2H, м), 5,37 (1H, с), 5,96-6,00 (1H, м), 7,30 (1H, д, J=2,0 Гц), 8,09 (1H, д, J=2,0 Гц).
Стадия 4
6-Бром-1-[2-(3,6-дигидро-2H-пиран-4-ил)этил]-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (192 мг) получали в виде бесцветного порошка способом, аналогичным применяемому на стадии 6 примера 35, используя соединение, полученное на вышеуказанной стадии 3 (705 мг).
1H-ЯМР (CDCl3) δ: 2,13-2,19 (2H, м), 2,42 (2H, т, J=7,0 Гц), 3,78 (2H, т, J=5,4 Гц), 3,95 (2H, т, J=7,3 Гц), 4,02-4,06 (2H, м), 5,39-5,43 (1H, м), 7,31 (1H, д, J=1,8 Гц), 8,10 (1H, д, J=1,8 Гц), 8,95 (1H, ушир. с).
Стадия 5
1-[2-(3,6-Дигидро-2H-пиран-4-ил)этил]-6-(1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (55 мг) получали способом, аналогичным применяемому на стадии 3 примера 1, используя соединение, полученное на вышеуказанной стадии 4 (100 мг), и 5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пирроло[2,3-b]пиридин (90 мг).
MS (ESI) m/z: 362 (M+H)+.
HRMS (ESI) [M+H]+ вычислено: C20H19N5O2 362,16170; найдено: 362,16021.
1H-ЯМР (ДМСО-d6) δ: 2,07-2,14 (2H, м), 2,36-2,42 (2H, м), 3,63 (2H, т, J=5,7 Гц), 3,86-3,90 (2H, м), 3,99 (2H, т, J=6,6 Гц), 5,35-5,38 (1H, м), 6,49-6,52 (1H, м), 7,51-7,54 (1H, м), 7,86 (1H, д, J=1,2 Гц), 8,22-8,26 (2H, м), 8,55 (1H, д, J=2,0 Гц), 11,56 (1H, ушир. с), 11,72 (1H, ушир. с).
(Пример 49)
1-[2-(3,6-Дигидро-2H-пиран-4-ил)этил]-6-(1H-индол-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
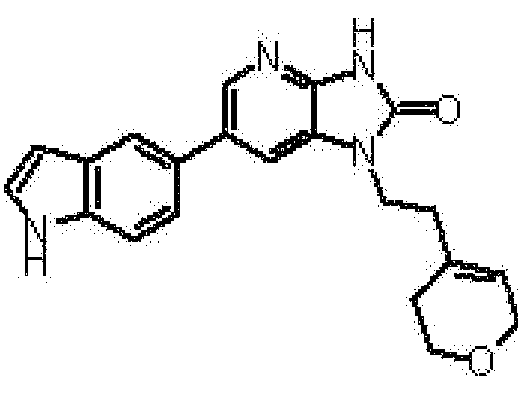
Указанное в заголовке соединение (42 мг) получали способом, аналогичным применяемому на стадии 3 примера 1, используя соединение, полученное на стадии 4 примера 48 (92 мг), и 5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-индол (33 мг).
MS (ESI) m/z: 361 (M+H)+.
HRMS (ESI) [M+H]+ вычислено: C20H20N4O2 361,16645; найдено: 361,16597.
1H-ЯМР (ДМСО-d6) δ: 2,07-2,14 (2H, м), 2,35-2,41 (2H, м), 3,63 (2H, т, J=5,4 Гц), 3,85-3,90 (2H, м), 3,99 (2H, т, J=7,0 Гц), 5,34-5,38 (1H, м), 6,47-6,50 (1H, м), 7,37-7,44 (2H, м), 7,48 (1H, д, J=8,5 Гц), 7,76-7,78 (1H, м), 7,84-7,86 (1H, м), 8,19 (1H, д, J=1,7 Гц), 11,14 (1H, ушир. с), 11,49 (1H, ушир. с).
(Пример 50)
6-(1H-Пирроло[2,3-b]пиридин-5-ил)-1-[2-(тетрагидро-2H-пиран-4-ил)пропил]-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
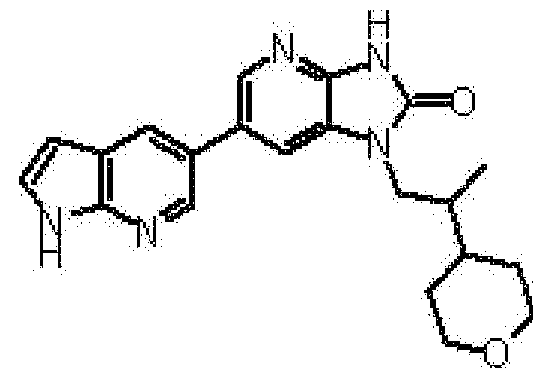
Стадия 1
Этил 2-(тетрагидро-2H-пиран-4-ил)пропаноат
Диизопропиламин (2,8 г) растворяли в тетрагидрофуране (20 мл). По каплям в атмосфере азота при охлаждении льдом добавляли раствор н-бутиллития в гексане (2,64 н., 11 мл) и смесь перемешивали при такой же температуре в течение 15 минут. Реакционный раствор охлаждали до -78°C. По каплям добавляли раствор этил 2-(тетрагидро-2H-пиран-4-ил)ацетата (4,0 г) в тетрагидрофуране (15 мл) и смесь перемешивали при такой же температуре в течение 15 минут. Затем добавляли по каплям метилйодид (2,2 мл). Смесь перемешивали при такой же температуре в течение 10 минут и потом нагревали до комнатной температуры и перемешивали в течение 3 часов. При охлаждении льдом добавляли 1 н. водный раствор соляной кислоты, затем экстрагировали этилацетатом. Органический слой промывали насыщенным водным раствором бикарбоната натрия и насыщенным солевым раствором и потом сушили над безводным сульфатом натрия и растворитель упаривали. Остаток очищали хроматографией на колонке с силикагелем (элюируя смесью этилацетат-гексан) с получением указанного в заголовке соединения (4,0 г) в виде бесцветного масла.
1H-ЯМР (CDCl3) δ: 1,13 (3H, д, J=6,8 Гц), 1,26 (3H, т, J=7,2 Гц), 1,30-1,46 (2H, м), 1,47-1,55 (1H, м), 1,58-1,66 (1H, м), 1,72-1,84 (1H, м), 2,21-2,30 (1H, м), 3,37 (2H, тт, J=11,8, 2,9 Гц), 3,92-4,03 (2H, м), 4,14 (2H, кв, J=7,2 Гц).
Стадия 2
2-(Тетрагидро-2H-пиран-4-ил)пропан-1-ол
Указанное в заголовке соединение (1,4 г) получали в виде бесцветного масла способом, аналогичным применяемому на стадии 2 примера 33, используя соединение, полученное на вышеуказанной стадии 1 (1,8 г).
1H-ЯМР (CDCl3) δ: 0,93 (3H, д, J=6,8 Гц), 1,20-1,72 (7H, м), 3,33-3,45 (2H, м), 3,49-3,58 (1H, м), 3,59-3,69 (1H, м), 3,95-4,07 (2H, м).
Стадия 3
6-Бром-3-циклогекс-1-ен-1-ил-1-[2-(тетрагидро-2H-пиран-4-ил)пропил]-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (255 мг) получали в виде смеси способом, аналогичным применяемому на стадии 3 примера 35, используя соединение, полученное на стадии 2 примера 35 (200 мг), и соединение, полученное на описанной выше стадии 2 (147 мг).
1H-ЯМР (CDCl3) δ: 0,91 (3H, д, J=6,8 Гц), 1,43-1,60 (3H, м), 1,63-1,78 (4H, м), 1,81-1,90 (2H, м), 1,90-1,98 (1H, м), 2,26-2,34 (2H, м), 2,36-2,44 (2H, м), 3,31-3,42 (2H, м), 3,63 (1H, дд, J=14,1, 8,9 Гц), 3,89 (1H, дд, J=14,1, 6,1 Гц), 3,96-4,06 (2H, м), 5,97-6,03 (1H, м), 7,25 (1H, д, J=2,0 Гц), 8,10 (1H, д, J=2,0 Гц).
Стадия 4
6-Бром-1-[2-(тетрагидро-2H-пиран-4-ил)пропил]-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (73 мг) получали в виде бесцветного твердого вещества способом, аналогичным применяемому на стадии 6 примера 35, используя соединение, полученное на вышеуказанной стадии 3 (255 мг).
1H-ЯМР (CDCl3) δ: 0,90 (3H, д, J=6,8 Гц), 1,48-1,59 (3H, м), 1,63-1,70 (1H, м), 1,88-1,99 (2H, м), 3,33-3,42 (3H, м), 3,63 (1H, дд, J=14,0, 8,9 Гц), 3,85 (1H, дд, J=13,3, 5,7 Гц), 3,97-4,07 (2H, м), 7,23-7,26 (1H, м), 8,06-8,09 (1H, м).
Стадия 5
6-(1H-Пирроло[2,3-b]пиридин-5-ил)-1-[2-(тетрагидро-2H-пиран-4-ил)пропил]-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (45 мг) получали в виде бесцветного твердого вещества способом, аналогичным применяемому на стадии 3 примера 1, используя соединение, полученное на вышеуказанной стадии 4 (73 мг), и 5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пирроло[2,3-b]пиридин (63 мг).
MS (ESI) m/z: 378 (M+H)+.
HRMS (ESI) [M+H]+ вычислено: C21H23N5O2 378,19300; найдено: 378,19239.
1H-ЯМР (ДМСО-d6) δ: 0,81 (3H, д, J=6,6 Гц), 1,22-1,58 (4H, м), 1,61-1,70 (1H, м), 1,94-2,05 (1H, м), 3,19-3,30 (2H, м), 3,66-3,76 (1H, м), 3,82-3,94 (3H, м), 6,50-6,53 (1H, м), 7,50-7,54 (1H, м), 7,81 (1H, с), 8,22-8,25 (2H, м), 8,53 (1H, д, J=1,7 Гц), 11,60 (1H, ушир. с), 11,73 (1H, ушир. с).
(Пример 51)
1-[2-Фтор-2-(тетрагидро-2H-пиран-4-ил)этил]-6-(1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
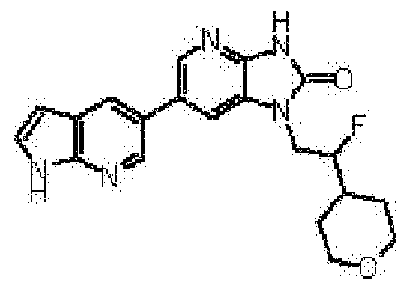
Стадия 1
Этил фтор(тетрагидро-2H-пиран-4-ил)ацетат
Этил 2-(тетрагидро-2H-пиран-4-ил)ацетат (2,0 г) растворяли в тетрагидрофуране (20 мл). Раствор бис(триметилсилил)амида лития в тетрагидрофуране (1,0 M, 17 мл) добавляли по каплям в атмосфере азота при охлаждении льдом и смесь перемешивали при такой же температуре в течение 15 минут. Затем добавляли раствор N-фторбензолсульфонимида (7,3 г) в тетрагидрофуране (20 мл) и смесь перемешивали при такой же температуре в течение 3 часов. При охлаждении льдом добавляли насыщенный водный раствор хлорида аммония и воду, потом экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором и потом сушили над безводным сульфатом натрия и растворитель упаривали. К остатку добавляли смесь хлороформ-диэтиловый эфир и нерастворимое вещество удаляли фильтрованием. После этого растворитель упаривали и остаток очищали хроматографией на колонке с силикагелем (элюируя смесью этилацетат-гексан и хлороформом) с получением указанного в заголовке соединения, содержащего нерастворимое вещество (0,9 г) в виде светло-оранжевого масла.
MS (ESI) m/z: 191 (M+H)+.
Стадия 2
2-Фтор(тетрагидро-2H-пиран-4-ил)этанол
Указанное в заголовке соединение (0,4 г) получали в виде бесцветного масла способом, аналогичным применяемому на стадии 2 примера 33, используя соединение, полученное на вышеуказанной стадии 1 (0,9 г).
1H-ЯМР (CDCl3) δ: 1,42-1,66 (3H, м), 1,74-2,05 (3H, м), 3,35-3,44 (2H, м), 3,68-3,88 (2H, м), 3,95-4,05 (2H, м), 4,21-4,28 (0,5H, м), 4,34-4,39 (0,5H, м).
Стадия 3
6-Бром-3-циклогекс-1-ен-1-ил-1-[2-фтор-2-(тетрагидро-2H-пиран-4-ил)этил]-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (196 мг) получали в виде смеси способом, аналогичным применяемому на стадии 3 примера 35, используя соединение, полученное на стадии 2 примера 35 (200 мг), и соединение, полученное на описанной выше стадии 2 (151 мг).
1H-ЯМР (CDCl3) δ: 1,48-1,61 (2H, м), 1,70-1,95 (7H, м), 2,28-2,34 (2H, м), 2,39-2,44 (2H, м), 3,35-3,45 (2H, м), 3,92-4,06 (3H, м), 4,17 (1H, ддд, J=29,4, 15,2, 2,2 Гц), 4,49 (0,5H, тд, J=7,2, 2,2 Гц), 4,61 (0,5H, тд, J=7,2, 2,2 Гц), 5,99-6,03 (1H, м), 7,43-7,45 (1H, м), 8,11 (1H, д, J=2,0 Гц).
Стадия 4
6-Бром-1-[2-фтор-2-(тетрагидро-2H-пиран-4-ил)этил]-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (145 мг) получали в виде светло-желтого аморфного вещества способом, аналогичным применяемому на стадии 6 примера 35, используя соединение, полученное на вышеуказанной стадии 3 (196 мг).
1H-ЯМР (CDCl3-CD3OD (10:1)) δ: 1,23-1,34 (2H, м), 1,49-1,62 (2H, м), 1,70-1,96 (2H, м), 3,35-3,47 (2H, м), 3,91-4,19 (4H, м), 4,42-4,50 (0,5H, м), 4,53-4,62 (0,5H, м), 7,30 (1H, д, J=2,0 Гц), 7,93 (1H, д, J=2,0 Гц).
Стадия 5
1-[2-Фтор-2-(тетрагидро-2H-пиран-4-ил)этил]-6-(1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (27 мг) получали в виде бесцветного твердого вещества способом, аналогичным применяемому на стадии 3 примера 1, используя соединение, полученное на вышеуказанной стадии 4 (71 мг), и 5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пирроло[2,3-b]пиридин (60 мг).
MS (ESI) m/z: 382 (M+H)+.
HRMS (ESI) [M+H]+ вычислено: C20H20FN5O2 382,16793; найдено: 382,16778.
1H-ЯМР (ДМСО-d6) δ: 0,81 (3H, д, J=6,6 Гц), 1,22-1,58 (4H, м), 1,61-1,70 (1H, м), 1,94-2,05 (1H, м), 3,19-3,30 (2H, м), 3,66-3,76 (1H, м), 3,82-3,94 (3H, м), 6,50-6,53 (1H, м), 7,50-7,54 (1H, м), 7,81 (1H, с), 8,22-8,25 (2H, м), 8,53 (1H, д, J=1,7 Гц), 11,60 (1H, ушир. с), 11,73 (1H, ушир. с).
(Пример 52)
1-{2-[цис-2,6-Диметилморфолин-4-ил]этил}-6-(1H-индол-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
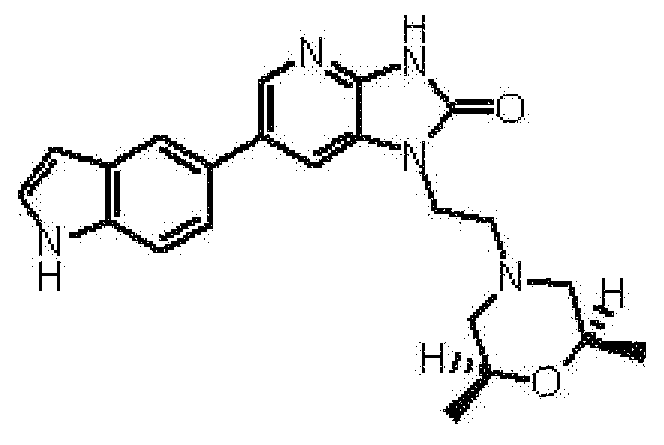
Стадия 1
Этил [цис-2,6-диметилморфолин-4-ил]ацетат
цис-2,6-Диметилморфолин (2,0 г) растворяли в ацетонитриле (70 мл). Добавляли этилбромацетат (2,5 мл) и карбонат калия (3,1 г) и смесь нагревали с перемешиванием при 60°C в течение 12 часов. Растворитель упаривали и потом к остатку добавляли этилацетат. Органический слой промывали насыщенным солевым раствором и потом сушили над безводным сульфатом натрия и растворитель упаривали. Остаток очищали хроматографией на колонке с силикагелем (элюируя смесью этилацетат-гексан) с получением указанного в заголовке соединения (2,9 г) в виде бесцветного масла.
1H-ЯМР (CDCl3) δ: 1,16 (6H, д, J=6,1 Гц), 1,28 (3H, т, J=7,1 Гц), 1,93 (2H, т, J=10,6 Гц), 2,76-2,83 (2H, м), 3,18 (2H, с), 3,71-3,81 (2H, м), 4,19 (2H, кв, J=7,1 Гц).
Стадия 2
2-[цис-2,6-Диметилморфолин-4-ил]этанол
Указанное в заголовке соединение (2,3 г) получали в виде бесцветного масла способом, аналогичным применяемому на стадии 2 примера 33, используя соединение, полученное на вышеуказанной стадии 1 (2,9 г).
1H-ЯМР (CDCl3) δ: 1,16 (6H, д, J=6,3 Гц), 1,80-1,88 (2H, м), 2,52 (2H, т, J=5,5 Гц), 2,70-2,76 (2H, м), 2,71 (1H, ушир. с), 3,62 (2H, т, J=5,5 Гц), 3,63-3,72 (2H, м).
Стадия 3
6-Бром-3-циклогекс-1-ен-1-ил-1-{2-[цис-2,6-диметилморфолин-4-ил]этил}-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (248 мг) получали способом, аналогичным применяемому на стадии 3 примера 35, используя соединение, полученное на стадии 2 примера 35 (280 мг), и соединение, полученное на описанной выше стадии 2 (182 мг).
1H-ЯМР (CDCl3) δ: 1,15 (6H, д, J=6,3 Гц), 1,70-1,91 (6H, м), 2,27-2,34 (2H, м), 2,37-2,44 (2H, м), 2,64 (2H, т, J=6,5 Гц), 2,77 (2H, д, J=10,5 Гц), 3,55-3,65 (2H, м), 3,96 (2H, т, J=6,5 Гц), 5,97-6,02 (1H, м), 7,37 (1H, д, J=2,0 Гц), 8,08 (1H, д, J=2,0 Гц).
Стадия 4
6-Бром-1-{2-[цис-2,6-диметилморфолин-4-ил]этил}-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (165 мг) получали в виде бесцветного аморфного вещества способом, аналогичным применяемому на стадии 6 примера 35, используя соединение, полученное на вышеуказанной стадии 3 (249 мг).
1H-ЯМР (CDCl3) δ: 1,16 (6H, д, J=6,3 Гц), 1,85 (2H, т, J=10,6 Гц), 2,67 (2H, т, J=6,3 Гц), 2,82 (2H, д, J=10,5 Гц), 3,58-3,68 (2H, м), 3,97 (2H, т, J=6,3 Гц), 7,39 (1H, д, J=1,8 Гц), 8,08 (1H, д, J=1,8 Гц), 10,53 (1H, ушир. с).
Стадия 5
1-{2-[цис-2,6-Диметилморфолин-4-ил]этил}-6-(1H-индол-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (33 мг) получали в виде бесцветного твердого вещества способом, аналогичным применяемому на стадии 3 примера 1, используя соединение, полученное на вышеуказанной стадии 4 (100 мг), и 5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-индол (96 мг).
MS (ESI) m/z: 392 (M+H)+.
HRMS (ESI) [M+H]+ вычислено: C22H25N5O2 392,20865; найдено: 392,20833.
1H-ЯМР (CDCl3) δ: 1,15 (6H, д, J=6,1 Гц), 1,85 (3H, т, J=10,7 Гц), 2,72 (2H, т, J=6,6 Гц), 2,86 (2H, д, J=10,5 Гц), 3,60-3,71 (2H, м), 4,06 (2H, т, J=6,6 Гц), 6,60-6,64 (1H, м), 7,29 (1H, т, J=2,7 Гц), 7,35-7,40 (1H, м), 7,45-7,51 (2H, м), 7,79 (1H, д, J=1,2 Гц), 8,30 (1H, д, J=1,2 Гц), 8,39 (1H, ушир. с).
(Пример 53)
1-{2-[цис-2,6-Диметилморфолин-4-ил]этил}-6-(1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
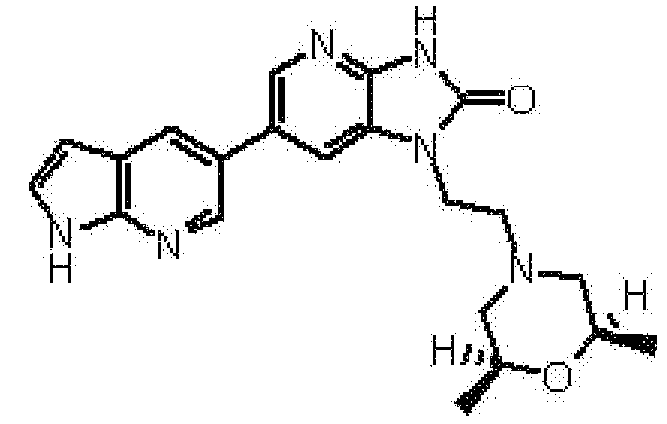
Указанное в заголовке соединение (53 мг) получали в виде бесцветного твердого вещества способом, аналогичным применяемому на стадии 3 примера 1, используя соединение, полученное на стадии 4 примера 52 (65 мг), и 5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пирроло[2,3-b]пиридин (54 мг).
MS (ESI) m/z: 393 (M+H)+.
HRMS (ESI) [M+H]+ вычислено: C21H24N6O2 393,20390; найдено: 393,20452.
1H-ЯМР (ДМСО-d6) δ: 1,02 (6H, д, J=6,3 Гц), 1,66 (2H, т, J=10,5 Гц), 2,60 (2H, т, J=6,1 Гц), 2,88 (2H, д, J=11,0 Гц), 3,38-3,47 (2H, м), 3,96-4,03 (2H, м), 6,48-6,52 (1H, м), 7,51-7,55 (1H, м), 7,86 (1H, с), 8,23-8,26 (2H, м), 8,54 (1H, д, J=1,5 Гц), 11,56 (1H, ушир. с), 11,73 (1H, ушир. с).
(Пример 54)
1-{2-[(3S)-3-Метилморфолин-4-ил]этил}-6-(1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
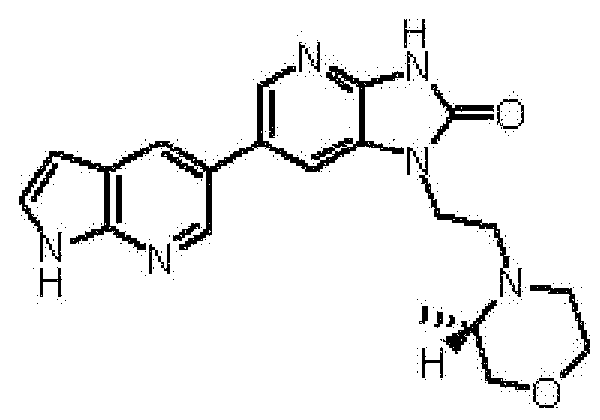
Стадия 1
Этил [(3S)-3-метилморфолин-4-ил]ацетат
Указанное в заголовке соединение (1,6 г) получали в виде бесцветного масла способом, аналогичным применяемому на стадии 1 примера 52, используя (3S)-3-метилморфолин (1,0 г).
1H-ЯМР (CDCl3) δ: 0,98 (3H, д, J=6,3 Гц), 1,28 (3H, т, J=7,1 Гц), 2,65-2,74 (2H, м), 2,77 (1H, дт, J=11,7, 2,2 Гц), 3,23-3,27 (1H, м), 3,27 (1H, д, J=16,3 Гц), 3,43 (1H, д, J=16,3 Гц), 3,64-3,72 (2H, м), 3,77-3,83 (1H, м), 4,19 (2H, кв, J=7,2 Гц).
Стадия 2
2-[(3S)-3-Метилморфолин-4-ил]этанол
Указанное в заголовке соединение (1,3 г) получали в виде бесцветного масла способом, аналогичным применяемому на стадии 2 примера 33, используя соединение, полученное на вышеуказанной стадии 1 (1,6 г).
1H-ЯМР (CDCl3) δ: 1,00 (3H, д, J=6,1 Гц), 2,25-2,38 (2H, м), 2,49-2,59 (1H, м), 2,73 (1H, ушир. с), 2,78-2,85 (1H, м), 2,93-3,02 (1H, м), 3,28 (1H, дд, J=11,1, 8,4 Гц), 3,49-3,58 (1H, м), 3,61-3,73 (3H, м), 3,75-3,82 (1H, м).
Стадия 3
6-Бром-3-циклогекс-1-ен-1-ил-1-{2-[(3S)-3-метилморфолин-4-ил]этил}-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (443 мг) получали способом, аналогичным применяемому на стадии 3 примера 35, используя соединение, полученное на стадии 2 примера 35 (400 мг), и соединение, полученное на описанной выше стадии 2 (296 мг).
1H-ЯМР (CDCl3) δ: 0,85 (3H, д, J=6,3 Гц), 1,71-1,78 (2H, м), 1,83-1,90 (2H, м), 2,27-2,34 (2H, м), 2,37-2,54 (5H, м), 2,85 (1H, дт, J=11,5, 2,9 Гц), 3,01-3,16 (2H, м), 3,55-3,64 (2H, м), 3,78 (1H, дт, J=11,0, 2,7 Гц), 3,87-3,98 (2H, м), 5,97-6,02 (1H, м), 7,38 (1H, д, J=2,0 Гц), 8,08 (1H, д, J=2,0 Гц).
Стадия 4
6-Бром-1-{2-[(3S)-3-метилморфолин-4-ил]этил}-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (364 мг) получали в виде светло-желтого аморфного вещества способом, аналогичным применяемому на стадии 6 примера 35, используя соединение, полученное на вышеуказанной стадии 3 (443 мг).
1H-ЯМР (CDCl3) δ: 0,84 (3H, д, J=6,3 Гц), 2,39-2,52 (3H, м), 2,77-2,86 (1H, м), 2,95-3,08 (1H, м), 3,08-3,17 (1H, м), 3,53-3,64 (2H, м), 3,71-3,80 (1H, м), 3,81-3,94 (2H, м), 7,34-7,41 (1H, м), 8,01-8,08 (1H, м).
Стадия 5
1-{2-[(3S)-3-Метилморфолин-4-ил]этил}-6-(1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (78 мг) получали в виде бесцветного твердого вещества способом, аналогичным применяемому на стадии 3 примера 1, используя соединение, полученное на вышеуказанной стадии 4 (147 мг), и 5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пирроло[2,3-b]пиридин (126 мг).
MS (ESI) m/z: 379 (M+H)+.
HRMS (ESI) [M+H]+ вычислено: C20H22N6O2 379,18825; найдено: 379,18744.
1H-ЯМР (ДМСО-d6) δ: 0,75 (3H, д, J=6,1 Гц), 2,27-2,47 (2H, м), 2,87-2,96 (2H, м), 3,02-3,12 (1H, м), 3,34-3,42 (1H, м), 3,49 (2H, дд, J=11,0, 2,8 Гц), 3,61-3,68 (1H, м), 3,86-3,96 (1H, м), 3,97-4,08 (1H, м), 6,49-6,53 (1H, м), 7,53 (1H, т, J=2,9 Гц), 7,86-7,88 (1H, м), 8,22-8,25 (2H, м), 8,54 (1H, д, J=2,0 Гц), 11,56 (1H, ушир. с), 11,73 (1H, ушир. с).
(Пример 55)
1-(2-Морфолин-4-илэтил)-6-(1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
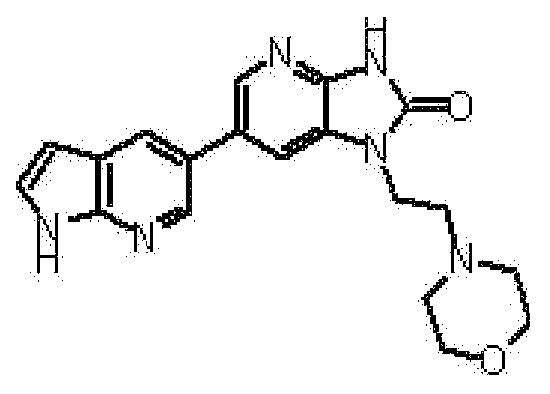
Стадия 1
6-Бром-3-циклогекс-1-ен-1-ил-1-(2-морфолин-4-илэтил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (340 мг) получали способом, аналогичным применяемому на стадии 3 примера 35, используя соединение, полученное на стадии 2 примера 35 (300 мг), и N-(2-гидроксиэтил)морфолин (201 мг).
1H-ЯМР (CDCl3) δ: 1,71-1,78 (2H, м), 1,83-1,90 (2H, м), 2,27-2,34 (2H, м), 2,39-2,45 (2H, м), 2,53 (4H, т, J=4,6 Гц), 2,68 (2H, т, J=6,4 Гц), 3,67 (4H, т, J=4,6 Гц), 3,97 (2H, т, J=6,4 Гц), 5,99-6,02 (1H, м), 7,39 (1H, д, J=2,0 Гц), 8,08 (1H, д, J=2,0 Гц).
Стадия 2
3-Циклогекс-1-ен-1-ил-1-(2-морфолин-4-илэтил)-6-(1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (308 мг) получали в виде светло-желтого аморфного вещества способом, аналогичным применяемому на стадии 3 примера 1, используя соединение, полученное на вышеуказанной стадии 1 (325 мг), и 5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пирроло[2,3-b]пиридин (234 мг).
1H-ЯМР (CDCl3) δ: 1,74-1,82 (2H, м), 1,86-1,95 (2H, м), 2,31-2,38 (2H, м), 2,47-2,53 (2H, м), 2,53-2,59 (4H, м), 2,75 (2H, т, J=6,6 Гц), 3,65-3,70 (4H, м), 4,08 (2H, т, J=6,6 Гц), 6,05-6,09 (1H, м), 6,59 (1H, дд, J=3,7, 2,0 Гц), 7,38-7,41 (1H, м), 7,43 (1H, д, J=2,0 Гц), 8,07 (1H, д, J=1,7 Гц), 8,28 (1H, д, J=2,0 Гц), 8,49 (1H, д, J=2,2 Гц), 9,09 (1H, с).
Стадия 3
1-(2-Морфолин-4-илэтил)-6-(1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (143 мг) получали в виде бесцветного твердого вещества способом, аналогичным применяемому на стадии 6 примера 35, используя соединение, полученное на вышеуказанной стадии 2 (308 мг).
MS (ESI) m/z: 365 (M+H)+.
HRMS (ESI) [M+H]+ вычислено: C19H20N6O2 365,17260; найдено: 365,17207.
1H-ЯМР (ДМСО-d6) δ: 2,44-2,49 (4H, м), 2,63 (2H, т, J=6,3 Гц), 3,48-3,53 (4H, м), 4,00 (2H, т, J=6,2 Гц), 6,51 (1H, д, J=3,4 Гц), 7,51-7,54 (1H, м), 7,87 (1H, с), 8,22-8,25 (2H, м), 8,54 (1H, д, J=2,0 Гц), 11,57 (1H, ушир. с), 11,73 (1H, ушир. с).
(Пример 56)
1-[(1-Метилпиперидин-4-ил)метил]-6-(1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Стадия 1
6-Бром-3-циклогекс-1-ен-1-ил-1-[(1-метилпиперидин-4-ил)метил]-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (126 мг) получали способом, аналогичным применяемому на стадии 3 примера 35, используя соединение, полученное на стадии 2 примера 35 (200 мг), и (1-метилпиперидин-4-ил)метанол (132 мг).
1H-ЯМР (CDCl3) δ: 1,36-1,50 (2H, м), 1,63-1,96 (9H, м), 2,26-2,34 (2H, м), 2,27 (3H, с), 2,38-2,44 (2H, м), 2,82-2,90 (2H, м), 3,73 (2H, д, J=7,1 Гц), 5,97-6,03 (1H, м), 7,25-7,28 (1H, м), 8,08 (1H, д, J=2,0 Гц).
Стадия 2
3-Циклогекс-1-ен-1-ил-1-[(1-метилпиперидин-4-ил)метил]-6-(1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (132 мг) получали в виде светло-желтого аморфного вещества способом, аналогичным применяемому на стадии 3 примера 1, используя соединение, полученное на вышеуказанной стадии 1 (126 мг), и 5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пирроло[2,3-b]пиридин (91 мг).
1H-ЯМР (CDCl3) δ: 1,40-1,55 (2H, м), 1,69-1,81 (4H, м), 1,84-1,95 (6H, м), 2,25 (3H, с), 2,29-2,38 (2H, м), 2,45-2,52 (2H, м), 2,80-2,89 (2H, м), 3,83 (2H, д, J=6,8 Гц), 6,04-6,09 (1H, м), 6,57-6,61 (1H, м), 7,35 (1H, д, J=1,7 Гц), 7,36-7,40 (1H, м), 8,06 (1H, д, J=2,1 Гц), 8,28 (1H, д, J=2,1 Гц), 8,49 (1H, д, J=2,1 Гц), 8,91 (1H, ушир. с).
Стадия 3
1-[(1-Метилпиперидин-4-ил)метил]-6-(1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (50 мг) получали в виде бесцветного твердого вещества способом, аналогичным применяемому на стадии 6 примера 35, используя соединение, полученное на вышеуказанной стадии 2 (132 мг).
MS (ESI) m/z: 363 (M+H)+.
HRMS (ESI) [M+H]+ вычислено: C20H22N6O 363,19333; найдено: 363,19277.
1H-ЯМР (ДМСО-d6) δ: 1,22-1,39 (2H, м), 1,52-1,62 (2H, м), 1,75-1,91 (3H, м), 2,15 (3H, с), 2,77 (2H, д, J=10,0 Гц), 3,76 (2H, д, J=7,1 Гц), 6,49-6,54 (1H, м), 7,51-7,55 (1H, м), 7,87-7,91 (1H, м), 8,22-8,26 (2H, м), 8,53-8,56 (1H, м), 11,58 (1H, ушир. с), 11,73 (1H, ушир. с).
(Пример 57)
1-[2-Пиперазин-1-илэтил]-6-(1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
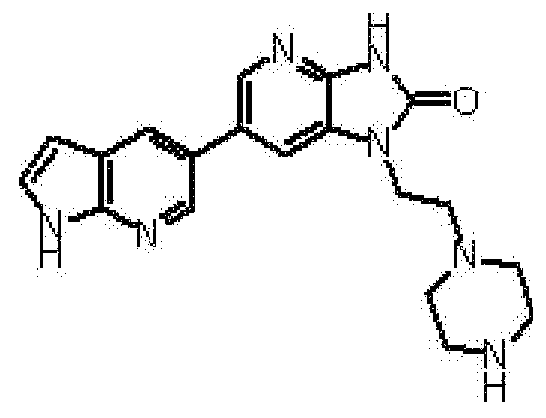
Стадия 1
1-[2-(4-Ацетилпиперазин-1-ил)этил]-6-бром-3-циклогекс-1-ен-1-ил-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (174 мг) получали способом, аналогичным применяемому на стадии 3 примера 35, используя соединение, полученное на стадии 2 примера 35 (200 мг), и 2-(4-ацетилпиперазин-1-ил)этанол (176 мг).
1H-ЯМР (CDCl3) δ: 1,70-1,78 (2H, м), 1,82-1,90 (2H, м), 2,08 (3H, с), 2,27-2,34 (2H, м), 2,37-2,44 (2H, м), 2,49 (2H, т, J=4,9 Гц), 2,53 (2H, т, J=4,9 Гц), 2,70 (2H, т, J=6,3 Гц), 3,41 (2H, т, J=5,0 Гц), 3,57 (2H, т, J=5,0 Гц), 3,98 (2H, т, J=6,3 Гц), 5,98-6,02 (1H, м), 7,35 (1H, д, J=2,0 Гц), 8,09 (1H, д, J=2,0 Гц).
Стадия 2
1-[2-(4-Ацетилпиперазин-1-ил)этил]-3-циклогекс-1-ен-1-ил-6-(1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (156 мг) получали в виде светло-желтого аморфного вещества способом, аналогичным применяемому на стадии 3 примера 1, используя соединение, полученное на вышеуказанной стадии 1 (174 мг), и 5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пирроло[2,3-b]пиридин (114 мг).
1H-ЯМР (CDCl3) δ: 1,73-1,82 (2H, м), 1,82-1,94 (2H, м), 2,07 (3H, с), 2,30-2,38 (2H, м), 2,45-2,60 (6H, м), 2,77 (2H, т, J=6,5 Гц), 3,42 (2H, т, J=4,9 Гц), 3,58 (2H, т, J=4,9 Гц), 4,09 (2H, т, J=6,5 Гц), 6,04-6,10 (1H, м), 6,59 (1H, дд, J=3,5, 1,8 Гц), 7,40-7,44 (2H, м), 8,08 (1H, д, J=2,0 Гц), 8,30 (1H, д, J=2,0 Гц), 8,50 (1H, д, J=2,0 Гц), 10,04 (1H, ушир. с).
Стадия 3
1-[2-Пиперазин-1-илэтил]-6-(1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (34 мг) получали в виде бесцветного твердого вещества способом, аналогичным применяемому на стадии 6 примера 35, используя соединение, полученное на вышеуказанной стадии 2 (156 мг).
MS (ESI) m/z: 364 (M+H)+.
HRMS (ESI) [M+H]+ вычислено: C21H23N7O2 364,18858; найдено: 364,18800.
1H-ЯМР (ДМСО-d6) δ: 2,34-2,45 (4H, м), 2,55-2,67 (6H, м), 3,93-4,02 (2H, м), 6,49-6,53 (1H, м), 7,50-7,56 (1H, м), 7,82-7,87 (1H, м), 8,21-8,26 (2H, м), 8,52-8,57 (1H, м), 11,73 (1H, ушир. с).
(Пример 58)
1-[2-(4-Метилпиперазин-1-ил)этил]-6-(1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
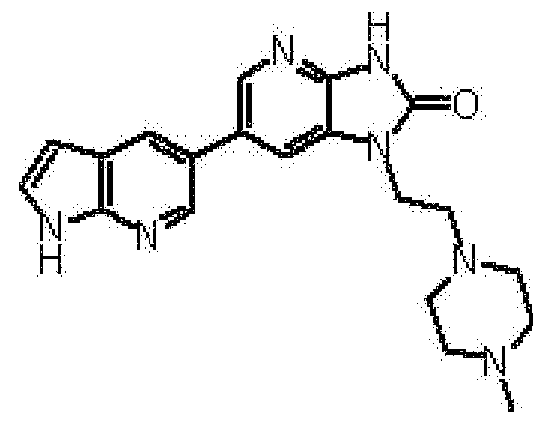
Стадия 1
6-Бром-3-циклогекс-1-ен-1-ил-1-[2-(4-метилпиперазин-1-ил)этил]-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (177 мг) получали способом, аналогичным применяемому на стадии 3 примера 35, используя соединение, полученное на стадии 2 примера 35 (200 мг), и 2-(4-метилпиперазин-1-ил)этанол (147 мг).
1H-ЯМР (CDCl3) δ: 1,70-1,79 (2H, м), 1,81-1,91 (2H, м), 2,25-2,34 (2H, м), 2,28 (3H, с), 2,36-2,48 (6H, м), 2,50-2,62 (4H, м), 2,67 (2H, т, J=6,4 Гц), 3,96 (2H, т, J=6,4 Гц), 5,98-6,02 (1H, м), 7,42 (1H, д, J=2,0 Гц), 8,08 (1H, д, J=2,0 Гц).
Стадия 2
3-Циклогекс-1-ен-1-ил-1-[2-(4-метилпиперазин-1-ил)этил]-6-(1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (173 мг) получали в виде светло-желтого аморфного вещества способом, аналогичным применяемому на стадии 3 примера 1, используя соединение, полученное на вышеуказанной стадии 1 (177 мг), и 5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пирроло[2,3-b]пиридин (123 мг).
1H-ЯМР (CDCl3) δ: 1,72-1,81 (2H, м), 1,86-1,94 (2H, м), 2,27 (3H, с), 2,30-2,38 (2H, м), 2,38-2,70 (10H, м), 2,76 (2H, т, J=6,8 Гц), 4,07 (2H, т, J=6,8 Гц), 6,05-6,09 (1H, м), 6,59 (1H, дд, J=3,4, 2,0 Гц), 7,38-7,42 (1H, м), 7,47 (1H, д, J=2,0 Гц), 8,08 (1H, д, J=2,0 Гц), 8,28 (1H, д, J=1,7 Гц), 8,50 (1H, д, J=2,2 Гц), 9,37 (1H, ушир. с).
Стадия 3
1-[2-(4-Метилпиперазин-1-ил)этил]-6-(1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (74 мг) получали в виде бесцветного твердого вещества способом, аналогичным применяемому на стадии 6 примера 35, используя соединение, полученное на вышеуказанной стадии 2 (173 мг).
MS (ESI) m/z: 378 (M+H)+.
HRMS (ESI) [M+H]+ вычислено: C20H23N7O 378,20290; найдено: 378,20325.
1H-ЯМР (ДМСО-d6) δ: 2,10 (3H, с), 2,17-2,35 (4H, м), 2,62 (2H, т, J=6,2 Гц), 3,28-3,30 (4H, м), 3,97 (2H, т, J=6,2 Гц), 6,49-6,52 (1H, м), 7,51-7,54 (1H, м), 7,85-7,87 (1H, м), 8,23 (2H, дд, J=5,7, 1,8 Гц), 8,54 (1H, д, J=2,0 Гц), 11,55 (1H, ушир. с), 11,73 (1H, ушир. с).
(Пример 59)
1-[2-(4-Ацетилпиперазин-1-ил)этил]-6-(1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
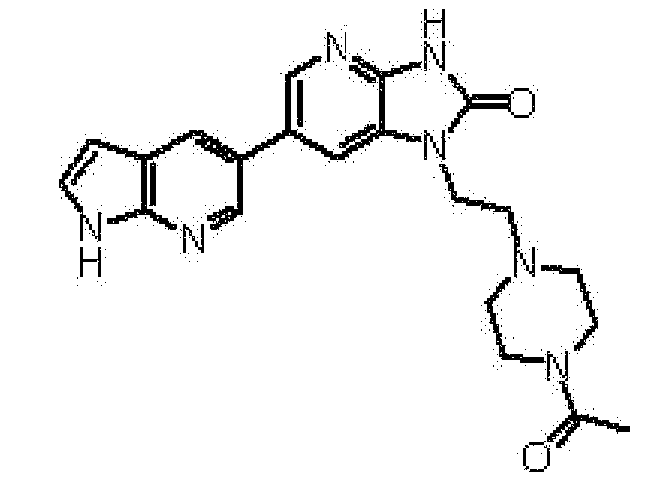
Стадия 1
Трет-бутил 4-[2-(6-бром-3-циклогекс-1-ен-1-ил-2-оксо-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил)-этил]пиперазин-1-карбоксилат
Указанное в заголовке соединение (551 мг) получали способом, аналогичным применяемому на стадии 3 примера 35, используя соединение, полученное на стадии 2 примера 35 (400 мг), и трет-бутил 4-(2-гидроксиэтил)пиперазин-1-карбоксилат (468 мг).
1H-ЯМР (CDCl3) δ: 1,45 (9H, с), 1,70-1,78 (2H, м), 1,82-1,90 (2H, м), 2,27-2,34 (2H, м), 2,38-2,44 (2H, м), 2,44-2,50 (4H, м), 2,68 (2H, т, J=6,5 Гц), 3,36-3,41 (4H, м), 3,97 (2H, т, J=6,5 Гц), 5,98-6,02 (1H, м), 7,37 (1H, д, J=2,0 Гц), 8,08 (1H, д, J=2,0 Гц).
Стадия 2
6-Бром-1-(2-пиперазин-4-илэтил]-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (249 мг) получали в виде бесцветного аморфного вещества способом, аналогичным применяемому на стадии 6 примера 35, используя соединение, полученное на вышеуказанной стадии 1 (551 мг).
1H-ЯМР (CDCl3) δ: 2,49-2,57 (4H, м), 2,68 (2H, т, J=6,2 Гц), 2,88 (4H, т, J=4,9 Гц), 3,95 (2H, т, J=6,2 Гц), 7,41 (1H, д, J=2,0 Гц), 8,04 (1H, д, J=2,0 Гц).
Стадия 3
1-[2-(4-Ацетилпиперазин-1-ил)этил]-6-бром-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Соединение, полученное на описанной выше стадии 2 (100 мг), растворяли в хлороформе (10 мл). Добавляли по каплям при охлаждении льдом триэтиламин (0,128 мл) и ацетил хлорид (0,026 мл) и смесь перемешивали при такой же температуре в течение 30 минут и потом перемешивали при комнатной температуре в течение 1,5 часов. Реакционный раствор концентрировали и остаток очищали хроматографией на колонке с силикагелем (элюируя смесью метанол-хлороформ) с получением указанного в заголовке соединения (114 мг) в виде бесцветного твердого вещества.
1H-ЯМР (CDCl3) δ: 2,08 (3H, с), 2,52 (2H, т, J=5,1 Гц), 2,57 (2H, т, J=5,0 Гц), 2,72 (2H, т, J=6,2 Гц), 3,44 (2H, т, J=4,8 Гц), 3,60 (2H, т, J=5,0 Гц), 3,98 (2H, т, J=6,2 Гц), 7,37 (1H, д, J=2,0 Гц), 8,08 (1H, д, J=2,0 Гц), 10,70 (1H, ушир. с).
Стадия 4
1-[2-(4-Ацетилпиперазин-1-ил)этил]-6-(1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (38 мг) получали в виде бесцветного твердого вещества способом, аналогичным применяемому на стадии 3 примера 1, используя соединение, полученное на вышеуказанной стадии 3 (114 мг), и 5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пирроло[2,3-b]пиридин (91 мг).
MS (ESI) m/z: 406 (M+H)+.
HRMS (ESI) [M+H]+ вычислено: C21H23N7O2 406,19915; найдено: 406,19850.
1H-ЯМР (ДМСО-d6) δ: 1,96 (3H, с), 2,38-2,50 (4H, м), 2,63-2,71 (2H, м), 3,32-3,38 (4H, м), 3,97-4,05 (2H, м), 6,49-6,53 (1H, м), 7,51-7,55 (1H, м), 7,85-7,90 (1H, м), 8,22-8,27 (2H, м), 8,53-8,57 (1H, м), 11,57 (1H, ушир. с), 11,73 (1H, ушир. с).
(Пример 60)
1-{2-[4-(Метилсульфонил)пиперазин-1-ил]этил}-6-(1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
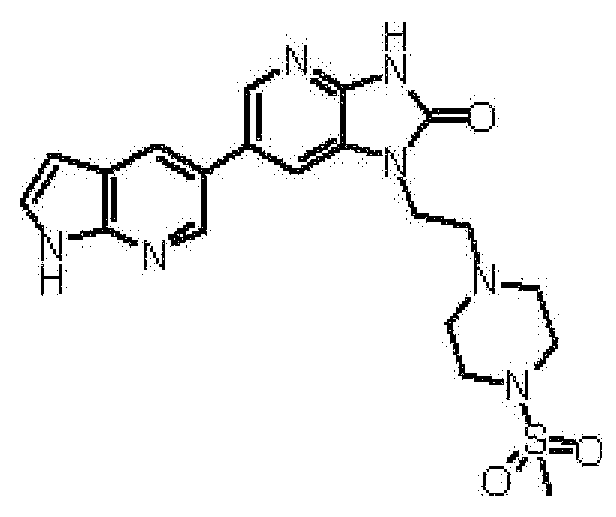
Стадия 1
6-Бром-1-{2-[4-(метилсульфонил)пиперазин-1-ил]этил}-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Соединение, полученное на стадии 2 примера 59 (100 мг), растворяли в хлороформе (10 мл). Добавляли по каплям при охлаждении льдом триэтиламин (0,128 мл) и метансульфонилхлорид (0,036 мл) и смесь перемешивали при такой же температуре в течение 10 минут и потом перемешивали при комнатной температуре в течение 1,5 часов. Реакционный раствор концентрировали и остаток очищали хроматографией на колонке с силикагелем (элюируя смесью метанол-хлороформ) с получением указанного в заголовке соединения (82 мг) в виде бесцветного твердого вещества.
1H-ЯМР (CD3OD) δ: 2,63 (4H, т, J=4,9 Гц), 2,74 (2H, т, J=6,1 Гц), 2,80 (3H, с), 3,15 (4H, т, J=4,9 Гц), 4,02 (2H, т, J=6,1 Гц), 7,71-7,73 (1H, м), 7,88 (1H, ушир. с), 8,02 (1H, д, J=2,0 Гц).
Стадия 2
1-{2-[4-(Метилсульфонил)пиперазин-1-ил]этил}-6-(1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (68 мг) получали в виде бесцветного твердого вещества способом, аналогичным применяемому на стадии 3 примера 1, используя соединение, полученное на вышеуказанной стадии 1 (82 мг), и 5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пирроло[2,3-b]пиридин (59 мг).
MS (ESI) m/z: 442 (M+H)+.
HRMS (ESI) [M+H]+ вычислено: C20H23N7O3S 442,16613; найдено: 442,16415.
1H-ЯМР (ДМСО-d6) δ: 2,55-2,62 (4H, м), 2,68-2,75 (2H, м), 2,80 (3H, с), 3,00-3,07 (4H, м), 3,97-4,04 (2H, м), 6,49-6,53 (1H, м), 7,53 (1H, т, J=2,7 Гц), 7,86-7,90 (1H, м), 8,22-8,26 (2H, м), 8,54-8,56 (1H, м), 11,57 (1H, ушир. с), 11,73 (1H, ушир. с).
(Пример 61)
1-{[транс-4-Гидрокситетрагидрофуран-3-ил]метил}-3-циклогекс-1-ен-1-ил-6-(1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
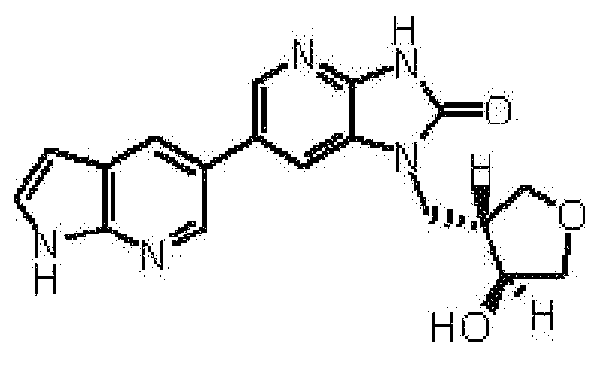
и его энантиомер
Стадия 1
Метил 4-оксотетрагидрофуран-3-карбоксилат
55% Гидрид натрия (1,9 г) суспендировали в тетрагидрофуране (30 мл) и в течение 10 минут добавляли по каплям раствор метилгликолята (3,6 г) в тетрагидрофуране (10 мл). После перемешивания при комнатной температуре в течение 30 минут, растворитель упаривали с получением бесцветного твердого вещества. Это вещество суспендировали в диметилсульфоксиде (20 мл) и добавляли метилакрилат (4,3 мл) при охлаждении льдом. Смесь перемешивали при такой же температуре в течение 15 минут и потом перемешивали при комнатной температуре в течение 45 минут. Реакционный раствор выливали в 5% водный раствор серной кислоты (50 мл), затем экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором и потом сушили над безводным сульфатом натрия и растворитель упаривали. Остаток очищали хроматографией на колонке с силикагелем (элюируя смесью этилацетат-гексан) с получением указанного в заголовке соединения (3,0 г) в виде бесцветного твердого вещества.
1H-ЯМР (CDCl3) δ: 3,54 (1H, т, J=8,3 Гц), 3,79 (3H, с), 3,97 (1H, д, J=17,1 Гц), 4,05 (1H, д, J=17,1 Гц), 4,43-4,54 (2H, м).
Стадия 2
Метил 4-гидрокситетрагидрофуран-3-карбоксилат
Соединение, полученное на описанной выше стадии 1 (1,6 г), растворяли в метаноле (150 мл). При охлаждении льдом добавляли боргидрид натрия (0,6 г) и смесь перемешивали при такой же температуре в течение 2 часов. К реакционному раствору добавляли воду, затем экстрагировали хлороформом. Органический слой промывали насыщенным солевым раствором и потом сушили над безводным сульфатом натрия и растворитель упаривали с получением указанного в заголовке соединения (1,3 г).
Стадия 3
Метил транс-4-{[трет-бутил(диметил)силил]окси}тетрагидрофуран-3-карбоксилат
Метил цис-4-{[трет-бутил(диметил)силил]окси}тетрагидрофуран-3-карбоксилат
Соединение, полученное на описанной выше стадии 2 (1,3 г), растворяли в N,N-диметилформамиде (10 мл). Добавляли имидазол (1,2 г) и трет-бутилдиметилсилил хлорид (1,7 г) и смесь перемешивали при комнатной температуре в течение 17 часов. Добавляли воду, затем экстрагировали этилацетатом. Органический слой промывали водой и насыщенным солевым раствором и потом сушили над безводным сульфатом натрия и растворитель упаривали. Остаток разделяли и очищали хроматографией на колонке с силикагелем (элюируя смесью этилацетат-гексан) с получением указанных в заголовке соединений, соответственно транс-изомера (0,6 г) и цис-изомера (1,4 г), в виде бесцветных масел.
транс-изомер
1H-ЯМР (CDCl3) δ: 0,07 (3H, с), 0,08 (3H, с), 0,88 (9H, с), 2,95-3,01 (1H, м), 3,62 (1H, дд, J=9,0, 3,7 Гц), 3,72 (3H, с), 3,91-4,00 (2H, м), 4,14 (1H, т, J=8,3 Гц), 4,63-4,68 (1H, м).
цис-изомер
1H-ЯМР (CDCl3) δ: 0,05 (3H, с), 0,06 (3H, с), 0,86 (9H, с), 3,07-3,15 (1H, м), 3,70 (3H, с), 3,72 (1H, д, J=2,4 Гц), 3,94 (1H, дд, J=9,4, 4,3 Гц), 4,01 (1H, т, J=8,3 Гц), 4,20 (1H, т, J=9,0 Гц), 4,59-4,64 (1H, м).
Стадия 4
[Транс-4-{[трет-бутил(диметил)силил]окси}тетрагидрофуран-3-ил]метанол
Указанное в заголовке соединение (0,16 г) получали в виде бесцветного масла способом, аналогичным применяемому на стадии 2 примера 33, используя соединение, полученное на вышеуказанной стадии 3 (0,59 г).
1H-ЯМР (CDCl3) δ: 0,07 (3H, с), 0,08 (3H, с), 0,89 (9H, с), 1,77 (1H, ушир. с), 2,24-2,35 (1H, м), 3,54-3,69 (4H, м), 3,93 (1H, дд, J=9,1, 5,2 Гц), 4,03 (1H, дд, J=8,8, 6,8 Гц), 4,21-4,27 (1H, м).
Стадия 5
6-Бром-1-{[транс-4-{[трет-бутил(диметил)силил]окси}тетрагидрофуран-3-ил]метил}-3-циклогекс-1-ен-1-ил-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (229 мг) получали способом, аналогичным применяемому на стадии 3 примера 35, используя соединение, полученное на стадии 2 примера 35 (200 мг), и соединение, полученное на описанной выше стадии 4 (160 мг).
1H-ЯМР (CDCl3) δ: -0,10 (3H, с), -0,06 (3H, с), 0,80 (9H, с), 1,71-1,79 (2H, м), 1,83-1,91 (2H, м), 2,28-2,34 (2H, м), 2,38-2,45 (2H, м), 2,57-2,66 (1H, м), 3,60-3,71 (3H, м), 3,92 (1H, дд, J=14,4, 9,0 Гц), 4,01 (1H, дд, J=9,3, 6,1 Гц), 4,13 (1H, дд, J=9,3, 5,1 Гц), 4,20-4,24 (1H, м), 5,98-6,01 (1H, м), 7,32 (1H, д, J=2,0 Гц), 8,11 (1H, д, J=2,0 Гц).
Стадия 6
1-{[транс-4-{[трет-Бутил(диметил)силил]окси}тетрагидрофуран-3-ил]метил}-3-циклогекс-1-ен-1-ил-6-(1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (191 мг) получали в виде светло-желтого аморфного вещества способом, аналогичным применяемому на стадии 3 примера 1, используя соединение, полученное на вышеуказанной стадии 5 (229 мг), и 5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пирроло[2,3-b]пиридин (165 мг).
1H-ЯМР (CDCl3) δ: -0,09 (3H, с), -0,06 (3H, с), 0,78 (9H, с), 1,74-1,82 (2H, м), 1,86-1,95 (2H, м), 2,31-2,38 (2H, м), 2,46-2,54 (2H, м), 2,67-2,76 (1H, м), 3,65 (1H, дд, J=9,3, 2,9 Гц), 3,73-3,82 (2H, м), 3,98-4,08 (2H, м), 4,17 (1H, дд, J=9,3, 5,1 Гц), 4,26-4,30 (1H, м), 6,05-6,10 (1H, м), 6,60 (1H, дд, J=3,4, 2,0 Гц), 7,42 (1H, д, J=1,7 Гц), 7,44-7,47 (1H, м), 8,09 (1H, д, J=2,0 Гц), 8,33 (1H, д, J=1,7 Гц), 8,51 (1H, д, J=2,0 Гц), 10,48 (1H, ушир. с).
Стадия 7
1-{[транс-4-Гидрокситетрагидрофуран-3-ил]метил}-3-циклогекс-1-ен-1-ил-6-(1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (61 мг) получали в виде светло-коричневого порошка способом, аналогичным применяемому на стадии 6 примера 35, используя соединение, полученное на вышеуказанной стадии 6 (191 мг).
MS (ESI) m/z: 352 (M+H)+.
HRMS (ESI) [M+H]+ вычислено: C18H17N5O3 352,14096; найдено: 352,14065.
1H-ЯМР (ДМСО-d6) δ: 3,44-3,50 (1H, м), 3,55 (1H, дд, J=8,7, 3,8 Гц), 3,69-3,97 (5H, м), 4,05-4,13 (1H, м), 4,94-4,99 (1H, м), 6,51 (1H, д, J=2,7 Гц), 7,52 (1H, д, J=2,9 Гц), 7,80-7,87 (1H, м), 8,22-8,25 (2H, м), 8,54 (1H, д, J=2,0 Гц), 11,73 (1H, ушир. с).
(Пример 62)
1-{[цис-4-Гидрокситетрагидрофуран-3-ил]метил}-3-циклогекс-1-ен-1-ил-6-(1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
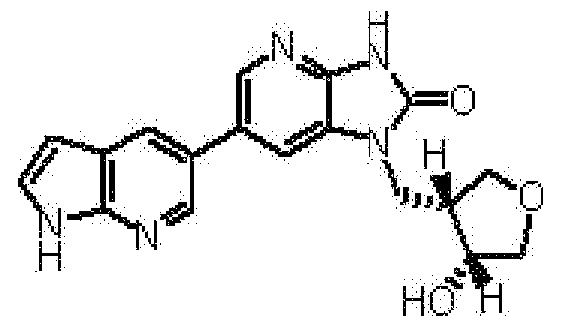
и его энантиомер
Стадия 1
цис-4-(Гидроксиметил)тетрагидрофуран-3-ол
Указанное в заголовке соединение (0,17 г) получали в виде бесцветного масла способом, аналогичным применяемому на стадии 2 примера 33, используя соединение, полученное на стадии 3 примера 61 (0,42 г).
1H-ЯМР (CDCl3) δ: 2,37-2,47 (1H, м), 3,61-3,95 (7H, м), 4,21 (1H, ушир. с), 4,45-4,50 (1H, м).
Стадия 2
цис-4-({[трет-Бутил(дифенил)силил]окси}метил)тетрагидрофуран-3-ил]метил}тетрагидрофуран-3-ол
Соединение, полученное на описанной выше стадии 1 (0,39 г), растворяли в дихлорметане (20 мл). При охлаждении льдом добавляли триэтиламин (0,92 мл), диметиламинопиридин (0,04 г) и трет-бутилдифенилсилилхлорид (1,02 мл) и смесь перемешивали при комнатной температуре в течение 65 часов. К реакционному раствору добавляли воду, затем экстрагировали хлороформом. Органический слой промывали насыщенным солевым раствором и потом сушили над безводным сульфатом натрия и растворитель упаривали. Остаток очищали хроматографией на колонке с силикагелем (элюируя смесью этилацетат-гексан) с получением указанного в заголовке соединения (1,0 г) в виде бесцветного масла.
1H-ЯМР (CDCl3) δ: 1,07 (9H, с), 2,37-2,48 (1H, м), 2,85-2,93 (1H, м), 3,67 (1H, т, J=8,8 Гц), 3,77-3,86 (2H, м), 3,86-3,94 (3H, м), 4,46-4,52 (1H, м), 7,36-7,47 (6H, м), 7,64-7,69 (4H, м).
Стадия 3
трет-Бутил(дифенил){[цис-4-(тетра-2H-пиран-2-илокси)тетрагидрофуран-3-ил]метокси}силан
Соединение, полученное на описанной выше стадии 2 (149 мг), растворяли в дихлорметане (10 мл). Добавляли 3,4-дигидро-2H-пиран (0,11 мл) и p-толуолсульфоновую кислоту (14 мг) и смесь перемешивали при комнатной температуре в течение 21 часов. К реакционному раствору добавляли насыщенный водный раствор бикарбоната натрия, затем экстрагировали хлороформом. Органический слой промывали насыщенным солевым раствором и потом сушили над безводным сульфатом натрия и растворитель упаривали. Остаток очищали хроматографией на колонке с силикагелем (элюируя смесью этилацетат-гексан) с получением указанного в заголовке соединения (126 мг) в виде бесцветного масла.
1H-ЯМР (CDCl3) δ: 1,05 (9H, с), 1,34-1,81 (6H, м), 2,43-2,61 (1H, м), 3,36-3,51 (1H, м), 3,56-4,10 (7H, м), 4,33-4,46 (1H, м), 4,62-4,68 (1H, м), 7,34-7,46 (6H, м), 7,62-7,70 (4H, м).
Стадия 4
[цис-4-(Тетра-2H-пиран-2-илокси)тетрагидрофуран-3-ил]метанол
Соединение, полученное на описанной выше стадии 3 (126 мг), растворяли в тетрагидрофуране (5 мл). Добавляли флуорид тетрабутиламмония (1,0 M раствор в тетрагидрофуран) (0,32 мл) и смесь перемешивали при комнатной температуре в течение одного часа. К реакционному раствору добавляли насыщенный водный раствор бикарбоната натрия, затем экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором и потом сушили над безводным сульфатом натрия и растворитель упаривали. Остаток очищали хроматографией на колонке с силикагелем (элюируя смесью метанол-хлороформ) с получением указанного в заголовке соединения (49 мг) в виде бесцветного масла.
1H-ЯМР (CDCl3) δ: 1,49-1,66 (4H, м), 1,70-1,87 (2H, м), 2,43-2,62 (1,5H, м), 3,48-3,58 (1,5H, м), 3,59-4,01 (7H, м), 4,36-4,43 (0,5H, м), 4,45-4,54 (1H, м), 4,70-4,74 (0,5H, м).
Стадия 5
6-Бром-3-циклогекс-1-ен-1-ил-1-{[цис-4-(тетра-2H-пиран-2-илокси)тетрагидрофуран-3-ил]метил}-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (91 мг) получали способом, аналогичным применяемому на стадии 3 примера 35, используя соединение, полученное на стадии 2 примера 35 (71 мг), и соединение, полученное на описанной выше стадии 4 (49 мг).
1H-ЯМР (CDCl3) δ: 1,46-1,95 (10H, м), 2,26-2,38 (2H, м), 2,36-2,49 (2H, м), 2,76-2,89 (1H, м), 3,42-3,56 (1H, м), 3,74-4,16 (6H, м), 4,24-4,33 (0,5H, м), 4,45-4,50 (0,5H, м), 4,52-4,58 (0,5H, м), 4,64 (0,5H, дд, J=4,9, 2,7 Гц), 5,98-6,05 (1H, м), 7,36 (0,5H, д, J=2,0 Гц), 7,46 (0,5H, д, J=2,0 Гц), 7,56 (0,5H, д, J=2,0 Гц), 8,06-8,10 (1H, м), 8,11 (0,5H, д, J=2,0 Гц).
Стадия 6
3-Циклогекс-1-ен-1-ил-1-{[цис-4-(тетра-2H-пиран-2-илокси)тетрагидрофуран-3-ил]метил}-6-(1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (82 мг) получали в виде светло-желтого масла способом, аналогичным применяемому на стадии 3 примера 1, используя соединение, полученное на вышеуказанной стадии 5 (91 мг), и 5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пирроло[2,3-b]пиридин (69 мг).
1H-ЯМР (CDCl3) δ: 1,30-1,66 (4H, м), 1,67-1,84 (4H, м), 1,86-1,95 (2H, м), 2,30-2,38 (2H, м), 2,46-2,54 (2H, м), 2,84-2,96 (1H, м), 3,39-3,55 (1H, м), 3,70-3,78 (0,5H, м), 3,79-4,08 (5,0H, м), 4,11-4,39 (2H, м), 4,51-4,56 (0,5H, м), 4,56-4,60 (0,5H, м), 4,65-4,69 (0,5H, м), 6,06-6,10 (1H, м), 6,58-6,61 (1H, м), 7,41-7,45 (1,5H, м), 7,57 (0,5H, д, J=2,0 Гц), 8,07-8,12 (1H, м), 8,30 (1H, т, J=2,2 Гц), 8,49-8,55 (1H, м), 9,83-9,92 (1H, м).
Стадия 7
1-{[цис-4-Гидрокситетрагидрофуран-3-ил]метил}-3-циклогекс-1-ен-1-ил-6-(1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (22 мг) получали в виде светло-коричневого порошка способом, аналогичным применяемому на стадии 6 примера 35, используя соединение, полученное на вышеуказанной стадии 6 (82 мг).
MS (ESI) m/z: 352 (M+H)+.
HRMS (ESI) [M+H]+ вычислено: C18H17N5O3 352,14096; найдено: 352,14081.
1H-ЯМР (ДМСО-d6) δ: 2,53-2,64 (1H, м), 3,56-3,66 (2H, м), 3,73-3,81 (2H, м), 3,94-4,06 (2H, м), 4,15-4,21 (1H, м), 5,17-5,27 (1H, м), 6,51 (1H, д, J=3,4 Гц), 7,50-7,54 (1H, м), 7,86-7,89 (1H, м), 8,24 (2H, д, J=2,0 Гц), 8,54 (1H, д, J=2,0 Гц), 11,66 (1H, ушир. с), 11,73 (1H, ушир. с).
(Пример 63)
1-{[цис-4-Метокситетрагидрофуран-3-ил]метил}-3-циклогекс-1-ен-1-ил-6-(1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
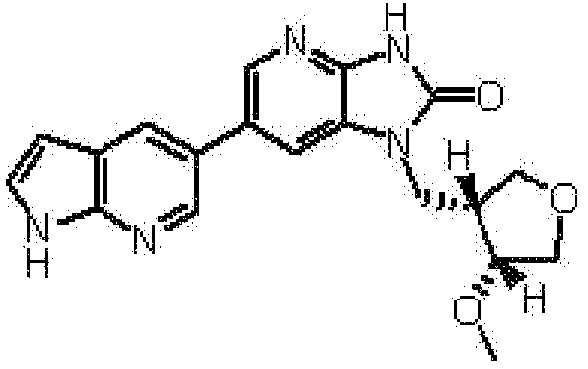
и его энантиомер
Стадия 1
трет-Бутил{[цис-4-метокситетрагидрофуран-3-ил]метокси}дифенилсилан
Цис-4-({[трет-бутил(дифенил)силил]окси}метил)тетрагидрофуран-3-ил]метил}тетрагидрофуран-3-ол, полученный на стадии 2 примера 62 (0,93 г), растворяли в тетрагидрофуране (30 мл). В атмосфере азота при 0°C добавляли 55% гидрид натрия (228 мг) и смесь перемешивали при такой же температуре в течение пяти минут и потом перемешивали при комнатной температуре в течение 30 минут. Добавляли метилйодид (1,62 мл) и смесь перемешивали при комнатной температуре в течение 15 часов. Добавляли воду при охлаждении льдом и потом тетрагидрофуран отгоняли. Остаток экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором и потом сушили над безводным сульфатом натрия и растворитель упаривали. Остаток очищали хроматографией на колонке с силикагелем (элюируя смесью этилацетат-гексан) с получением указанного в заголовке соединения (0,91 г) в виде бесцветного твердого вещества.
1H-ЯМР (CDCl3) δ: 1,05 (9H, с), 2,47-2,58 (1H, м), 3,27 (3H, с), 3,59-3,65 (1H, м), 3,72 (1H, дд, J=10,0, 7,3 Гц), 3,79 (1H, дд, J=10,0, 4,2 Гц), 3,88-3,99 (4H, м), 7,34-7,45 (6H, м), 7,64-7,71 (4H, м).
Стадия 2
[цис-4-Метокситетрагидрофуран-3-ил]метанол
Указанное в заголовке соединение (171 мг) получали в виде бесцветного масла способом, аналогичным применяемому на стадии 4 примера 11, используя соединение, полученное на вышеуказанной стадии 1 (0,91 г).
1H-ЯМР (CDCl3) δ: 2,42-2,54 (1H, м), 2,75 (1H, ушир. с), 3,37 (3H, с), 3,76-3,96 (6H, м), 4,01-4,09 (1H, м).
Стадия 3
6-Бром-3-циклогекс-1-ен-1-ил-1-{[цис-4-метокситетрагидрофуран-3-ил]метил}-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (334 мг) получали способом, аналогичным применяемому на стадии 3 примера 35, используя соединение, полученное на стадии 2 примера 35 (250 мг), и соединение, полученное на описанной выше стадии 2 (169 мг).
1H-ЯМР (CDCl3) δ: 1,68-1,79 (2H, м), 1,83-1,91 (2H, м), 2,27-2,35 (2H, м), 2,38-2,46 (2H, м), 2,78-2,89 (1H, м), 3,31 (3H, с), 3,65-3,78 (3H, м), 3,91-4,07 (4H, м), 5,99-6,04 (1H, м), 7,47 (1H, д, J=1,2 Гц), 8,09 (1H, т, J=1,0 Гц).
Стадия 4
3-Циклогекс-1-ен-1-ил-1-{[цис-4-метокситетрагидрофуран-3-ил]метил}-6-(1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (246 мг) получали в виде светло-оранжевого аморфного вещества способом, аналогичным применяемому на стадии 3 примера 1, используя соединение, полученное на вышеуказанной стадии 3 (334 мг), и 5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пирроло[2,3-b]пиридин (240 мг).
1H-ЯМР (CDCl3) δ: 1,73-1,81 (2H, м), 1,86-1,94 (2H, м), 2,30-2,38 (2H, м), 2,48-2,54 (2H, м), 2,89-3,00 (1H, м), 3,29 (3H, с), 3,73-3,81 (2H, м), 3,81-3,86 (1H, м), 3,98-4,07 (3H, м), 4,18 (1H, дд, J=14,3, 7,9 Гц), 6,07-6,11 (1H, м), 6,60 (1H, дд, J=3,5, 1,8 Гц), 7,43-7,47 (1H, м), 7,55 (1H, д, J=2,0 Гц), 8,12 (1H, д, J=2,0 Гц), 8,32 (1H, д, J=2,0 Гц), 8,54 (1H, д, J=2,2 Гц), 10,58 (1H, ушир. с).
Стадия 5
1-{[цис-4-Метокситетрагидрофуран-3-ил]метил}-3-циклогекс-1-ен-1-ил-6-(1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (50 мг) получали в виде бесцветного порошка способом, аналогичным применяемому на стадии 6 примера 35, используя соединение, полученное на вышеуказанной стадии 4 (246 мг).
MS (ESI) m/z: 366 (M+H)+.
HRMS (ESI) [M+H]+ вычислено: C19H19N5O3 366,15661; найдено: 366,15583.
1H-ЯМР (ДМСО-d6) δ: 2,73-2,85 (1H, м), 3,23 (3H, с), 3,58 (1H, т, J=8,9 Гц), 3,67 (1H, дд, J=9,6, 3,5 Гц), 3,76 (1H, т, J=7,8 Гц), 3,83-3,91 (2H, м), 3,97 (1H, дд, J=14,0, 8,4 Гц), 4,07 (1H, дд, J=14,5, 6,5 Гц), 6,51 (1H, д, J=3,4 Гц), 7,52 (1H, т, J=2,7 Гц), 7,81-7,84 (1H, м), 8,22-8,26 (2H, м), 8,55 (1H, д, J=2,0 Гц), 11,60 (1H, ушир. с), 11,73 (1H, ушир. с).
(Пример 64)
1-{[транс-4-Метокситетрагидрофуран-3-ил]метил}-6-(1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
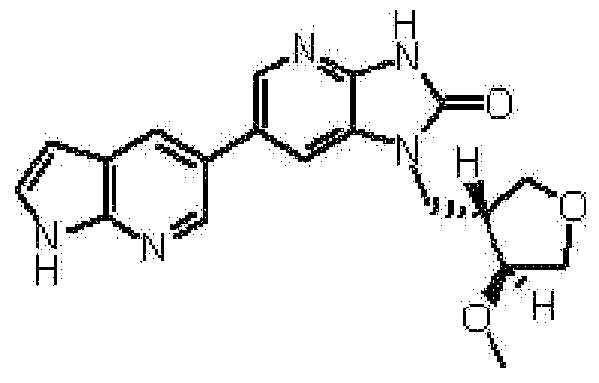
и его энантиомер
Стадия 1
транс-4-(Гидроксиметил)тетрагидрофуран-3-ол
Указанное в заголовке соединение (0,30 г) получали в виде бесцветного масла способом, аналогичным применяемому на стадии 2 примера 33, используя соединение, полученное на стадии 3 примера 61 (0,89 г).
1H-ЯМР (CDCl3) δ: 1,66-1,72 (1H, м), 2,31-2,42 (1H, м), 3,55-3,74 (4H, м), 3,87 (1H, т, J=5,6 Гц), 3,94 (1H, дд, J=9,8, 5,1 Гц), 4,09 (1H, дд, J=8,8, 7,3 Гц), 4,33 (1H, ушир. с).
Стадия 2
Транс-4-({[трет-бутил(дифенил)силил]окси}метил)тетрагидрофуран-3-ил]метил}тетрагидрофуран-3-ол
Указанное в заголовке соединение (0,39 г) получали в виде бесцветного масла способом, аналогичным применяемому на стадии 2 примера 62, используя соединение, полученное на вышеуказанной стадии 1 (0,30 г).
1H-ЯМР (CDCl3) δ: 1,06 (9H, с), 2,19 (1H, ушир. с), 2,34-2,43 (1H, м), 3,55-3,63 (2H, м), 3,64-3,70 (2H, м), 3,82 (1H, дд, J=9,6, 5,0 Гц), 4,04 (1H, дд, J=8,8, 7,6 Гц), 4,27-4,33 (1H, м), 7,36-7,46 (6H, м), 7,62-7,68 (4H, м).
Стадия 3
трет-Бутил{[транс-4-метокситетрагидрофуран-3-ил]метокси}дифенилсилан
Указанное в заголовке соединение (0,35 г) получали в виде бесцветного масла способом, аналогичным применяемому на стадии 1 примера 63, используя соединение, полученное на вышеуказанной стадии 2 (0,39 г).
1H-ЯМР (CDCl3) δ: 1,06 (9H, с), 2,40-2,50 (1H, м), 3,29 (3H, с), 3,52-3,67 (3H, м), 3,73-3,84 (3H, м), 3,97 (1H, дд, J=8,9, 7,0 Гц), 7,34-7,47 (6H, м), 7,60-7,68 (4H, м).
Стадия 4
[транс-4-Метокситетрагидрофуран-3-ил]метанол
Указанное в заголовке соединение (0,075 г) получали в виде бесцветного масла способом, аналогичным применяемому на стадии 4 примера 62, используя соединение, полученное на вышеуказанной стадии 3 (0,35 г).
1H-ЯМР (CDCl3) δ: 1,25 (1H, ушир. с), 2,38-2,47 (1H, м), 3,34 (3H, с), 3,59-3,67 (3H, м), 3,78 (1H, дд, J=9,8, 2,7 Гц), 3,81-3,85 (1H, м), 3,91 (1H, дд, J=9,5, 5,1 Гц), 4,00 (1H, дд, J=9,0, 6,8 Гц).
Стадия 5
6-Бром-3-циклогекс-1-ен-1-ил-1-{[транс-4-метокситетрагидрофуран-3-ил]метил}-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (118 мг) получали способом, аналогичным применяемому на стадии 3 примера 35, используя соединение, полученное на стадии 2 примера 35 (166 мг), и [транс-4-метокситетрагидрофуран-3-ил]метанол, полученный на вышеуказанной стадии 4 (75 мг).
1H-ЯМР (CDCl3) δ: 1,70-1,79 (2H, м), 1,82-1,91 (2H, м), 2,28-2,34 (2H, м), 2,37-2,45 (2H, м), 2,68-2,78 (1H, м), 3,21 (3H, с), 3,62-3,75 (2H, м), 3,78 (1H, дд, J=9,9, 3,1 Гц), 3,81-3,85 (1H, м), 3,91-4,00 (2H, м), 4,09 (1H, дд, J=9,9, 5,2 Гц), 5,98-6,03 (1H, м), 7,35 (1H, д, J=2,0 Гц), 8,12 (1H, д, J=2,0 Гц).
Стадия 6
3-Циклогекс-1-ен-1-ил-1-{[транс-4-метокситетрагидрофуран-3-ил]метил}-6-(1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (102 мг) получали в виде светло-желтого твердого вещества способом, аналогичным применяемому на стадии 3 примера 1, используя соединение, полученное на вышеуказанной стадии 5 (119 мг), и 5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пирроло[2,3-b]пиридин (197 мг).
1H-ЯМР (CDCl3) δ: 1,73-1,82 (2H, м), 1,87-1,95 (2H, м), 2,31-2,38 (2H, м), 2,46-2,53 (2H, м), 2,79-2,87 (1H, м), 3,22 (3H, с), 3,72 (1H, дд, J=9,0, 3,7 Гц), 3,77-3,86 (2H, м), 3,87-3,92 (1H, м), 3,97-4,09 (2H, м), 4,12 (1H, дд, J=10,0, 5,1 Гц), 6,06-6,10 (1H, м), 6,60 (1H, дд, J=3,5, 1,8 Гц), 7,41-7,44 (2H, м), 8,09 (1H, д, J=2,0 Гц), 8,32 (1H, д, J=2,0 Гц), 8,51 (1H, д, J=2,0 Гц), 9,84 (1H, ушир. с).
Стадия 7
1-{[транс-4-Метокситетрагидрофуран-3-ил]метил}-6-(1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (26 мг) получали в виде светло-оранжевого порошка способом, аналогичным применяемому на стадии 6 примера 35, используя соединение, полученное на вышеуказанной стадии 6 (102 мг).
MS (ESI) m/z: 366 (M+H)+.
HRMS (ESI) [M+H]+ вычислено: C19H19N5O3 366,15661; найдено: 366,15599.
1H-ЯМР (ДМСО-d6) δ: 2,70-2,79 (1H, м), 3,03 (3H, с), 3,54 (1H, дд, J=9,0, 4,2 Гц), 3,66 (1H, дд, J=9,8, 2,2 Гц), 3,79-3,95 (5H, м), 6,51 (1H, дд, J=3,4, 1,7 Гц), 7,51-7,54 (1H, м), 7,96 (1H, д, J=2,0 Гц), 8,24-8,28 (2H, м), 8,56 (1H, д, J=2,2 Гц), 11,67 (1H, ушир. с), 11,74 (1H, ушир. с).
(Пример 65)
1-{[цис-5-Гидрокситетрагидро-2H-пиран-3-ил]метил}-6-(1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
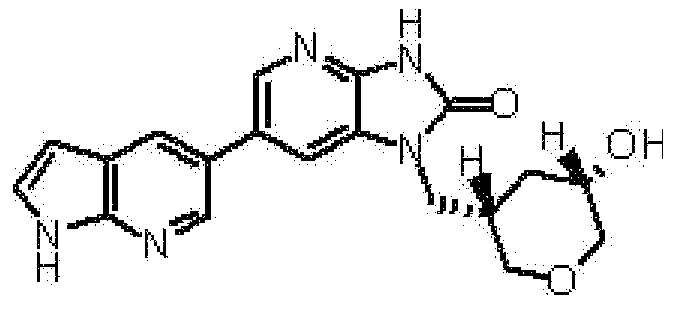
и его энантиомер
Стадия 1
Метил 4-анилино-2,5-дигидрофуран-3-карбоксилат
Соединение, полученное на стадии 1 примера 61 (1,0 г), растворяли в толуоле (20 мл). Добавляли анилин (0,76 мл) и p-толуолсульфоновую кислоту (0,011 г) и смесь нагревали с обратным холодильником при дегидратации в течение 17 часов. После охлаждения растворитель упаривали. Остаток очищали хроматографией на колонке с силикагелем (элюируя смесью этилацетат-гексан) с получением указанного в заголовке соединения (1,2 г) в виде твердого вещества светло-желтого цвета.
1H-ЯМР (CDCl3) δ: 3,76 (3H, с), 4,80 (2H, т, J=3,2 Гц), 4,95 (2H, т, J=3,2 Гц), 6,93 (2H, д, J=8,3 Гц), 7,08 (1H, т, J=7,3 Гц), 7,30 (2H, т, J=7,9 Гц), 9,10 (1H, ушир. с).
Стадия 2
Метил (4Z)-3-(йодметил)-4-(фенилимино)тетрагидрофуран-3-карбоксилат
Трет-бутоксид калия (5,2 г) суспендировали в бензоле (40 мл). Добавляли раствор соединения, полученного на описанной выше стадии 1 (8,5 г), и 18-краун-6 (12,3 г) в бензоле (40 мл) в атмосфере азота и смесь перемешивали при комнатной температуре в течение 30 минут. Затем добавляли дийодметан (9,4 мл) и смесь перемешивали при комнатной температуре в течение 24 часов. Реакционный раствор разбавляли этилацетатом, промывали 5% водным раствором тиосульфата натрия и насыщенным солевым раствором и потом сушили над безводным сульфатом натрия и растворитель упаривали. Остаток очищали хроматографией на колонке с силикагелем (элюируя смесью этилацетат-гексан) с получением указанного в заголовке соединения (3,5 г) в виде твердого вещества светло-желтого цвета.
1H-ЯМР (CDCl3) δ: 3,61 (1H, д, J=10,1 Гц), 3,79 (1H, д, J=10,1 Гц), 3,85 (3H, с), 4,17 (1H, д, J=9,9 Гц), 4,19 (1H, д, J=16,0 Гц), 4,28 (1H, д, J=16,0 Гц), 4,60 (1H, д, J=9,9 Гц), 6,78-6,83 (2H, м), 7,11-7,16 (1H, м), 7,29-7,35 (2H, м).
Стадия 3
Метил 5-оксотетрагидро-2H-пиран-3-карбоксилат
Соединение, полученное на описанной выше стадии 2 (3,5 г), растворяли в бензоле (300 мл). Добавляли по каплям раствор гидрида три-н-бутилолова (3,9 мл) и азобисизобутиронитрил (0,3 г) в бензоле (300 мл) при нагревании с обратным холодильником в атмосфере азота в течение 6 часов. Затем смесь нагревали с обратным холодильником в течение 2 часов. После охлаждения растворитель упаривали. Остаток разбавляли хлороформом, промывали 10% водным раствором флуорида калия и насыщенным солевым раствором и потом сушили над безводным сульфатом натрия и растворитель упаривали. Остаток очищали хроматографией на колонке с силикагелем (элюируя смесью этилацетат-гексан) с получением указанного в заголовке соединения (1,3 г) в виде светло-желтого масла.
1H-ЯМР (CDCl3) δ: 2,69 (1H, дд, J=17,0, 6,2 Гц), 2,84 (1H, дд, J=17,1, 7,3 Гц), 3,14-3,23 (1H, м), 3,75 (3H, с), 4,00 (1H, дд, J=11,7, 6,6 Гц), 4,04 (2H, с), 4,08 (1H, дд, J=11,7, 4,4 Гц).
Стадия 4
Метил цис-5-{[трет-бутил(диметил)силил]окси}тетрагидро-2H-пиран-3-карбоксилат
Метил транс-5-{[трет-бутил(диметил)силил]окси}тетрагидро-2H-пиран-3-карбоксилат
Соединение, полученное на описанной выше стадии 3 (1,6 г), растворяли в метаноле (100 мл). Добавляли при охлаждении льдом боргидрид натрия (0,5 г) и смесь перемешивали при такой же температуре в течение 3 часов. К реакционному раствору добавляли воду, затем нейтрализовали уксусной кислотой. Метанол отгоняли. К оставшемуся раствору добавляли хлорид натрия и потом экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором и потом сушили над безводным сульфатом натрия и растворитель упаривали. Остаток очищали хроматографией на колонке с силикагелем (элюируя смесью метанол-хлороформ) с получением сырого спирта (1,5 г).
Оба указанных в заголовке соединения, цис-изомер (2,1 г) и транс-изомер (0,18 г), получали в виде бесцветных масел способом, аналогичным применяемому на стадии 3 примера 61, используя полученный сырой спирт (1,5 г).
цис-изомер
1H-ЯМР (CDCl3) δ: 0,06 (3H, с), 0,07 (3H, с), 0,88 (9H, с), 1,54-1,66 (1H, м), 2,24-2,35 (1H, м), 2,64-2,76 (1H, м), 3,02 (1H, т, J=10,4 Гц), 3,32 (1H, т, J=11,1 Гц), 3,64-3,77 (1H, м), 3,66 (3H, с), 3,80-3,90 (1H, м), 4,01-4,10 (1H, м).
транс-изомер
1H-ЯМР (CDCl3) δ: 0,08 (3H, с), 0,08 (3H, с), 0,90 (9H, с), 1,76-1,85 (1H, м), 2,06-2,15 (1H, м), 2,87-2,95 (1H, м), 3,41 (1H, дд, J=11,2, 5,9 Гц), 3,59-3,65 (1H, м), 3,70 (3H, с), 3,77-3,86 (2H, м), 3,87-3,94 (1H, м).
Стадия 5
Цис-5-{[трет-бутил(диметил)силил]окси}тетрагидро-2H-пиран-3-карбоновая кислота
Метил цис-5-{[трет-бутил(диметил)силил]окси}тетрагидро-2H-пиран-3-карбоксилат, полученный на вышеуказанной стадии 4 (300 мг), растворяли в метаноле (15 мл). Добавляли 1 н. водный раствор гидроксида натрия (3,2 мл) и смесь перемешивали при комнатной температуре в течение 24 часов. Метанол отгоняли и потом к остатку добавляли 1 н. водный раствор соляной кислоты (3,2 мл), потом экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором и потом сушили над безводным сульфатом натрия и растворитель упаривали с получением указанного в заголовке соединения (267 мг) в виде бесцветного твердого вещества.
1H-ЯМР (CDCl3) δ: 0,07 (6H, д, J=3,9 Гц), 0,88 (9H, с), 1,61-1,72 (1H, м), 2,24-2,33 (1H, м), 2,66-2,76 (1H, м), 3,10 (1H, дд, J=10,9, 9,2 Гц), 3,42 (1H, т, J=10,7 Гц), 3,68-3,78 (1H, м), 3,79-3,86 (1H, м), 4,03 (1H, ддд, J=11,4, 4,3, 1,2 Гц), 10,52 (1H, ушир. с).
Стадия 6
[цис-5-{[трет-Бутил(диметил)силил]окси}тетрагидро-2H-пиран-3-ил]метанол
Соединение, полученное на описанной выше стадии 5 (267 мг), растворяли в тетрагидрофуране (10 мл). При охлаждении льдом добавляли триэтиламин (0,214 мл) и этилхлороформат (0,118 мл). Смесь перемешивали при такой же температуре в течение 30 минут и потом осадок удаляли фильтрованием. К фильтрату при охлаждении льдом добавляли по каплям раствор боргидрида натрия (77,7 мг) в воде (2 мл) и далее смесь перемешивали при комнатной температуре в течение 22 часов. Тетрагидрофуран отгоняли и затем к остатку добавляли насыщенный водный раствор бикарбоната натрия, потом экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором и далее сушили над безводным сульфатом натрия и растворитель упаривали. Остаток очищали хроматографией на колонке с силикагелем (элюируя смесью метанол-хлороформ) с получением указанного в заголовке соединения (251 мг) в виде бесцветного масла.
1H-ЯМР (CDCl3) δ: 0,07 (6H, д, J=3,2 Гц), 0,88 (9H, с), 1,13-1,27 (1H, м), 1,84-1,95 (1H, м), 1,95-2,05 (1H, м), 3,00-3,15 (2H, м), 3,45-3,55 (2H, м), 3,67-3,76 (1H, м), 3,79-3,85 (1H, м), 3,90-3,96 (1H, м).
Стадия 7
6-Бром-1-{[цис-5-{[трет-бутил(диметил)силил]окси}тетрагидро-2H-пиран-3-ил]метил}-3-циклогекс-1-ен-1-ил-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (405 мг) получали способом, аналогичным применяемому на стадии 3 примера 35, используя соединение, полученное на стадии 2 примера 35 (200 мг), и соединение, полученное на описанной выше стадии 6 (251 мг).
1H-ЯМР (CDCl3) δ: 0,07 (6H, д, J=1,0 Гц), 0,88 (9H, с), 1,51-1,53 (1H, м), 1,70-1,78 (2H, м), 1,82-1,91 (2H, м), 1,99-2,07 (1H, м), 2,17-2,27 (1H, м), 2,27-2,34 (2H, м), 2,38-2,44 (2H, м), 3,11-3,21 (2H, м), 3,65-3,93 (5H, м), 5,98-6,02 (1H, м), 7,31 (1H, д, J=2,0 Гц), 8,10 (1H, д, J=2,0 Гц).
Стадия 8
1-{[Цис-5-{[трет-бутил(диметил)силил]окси}тетрагидро-2H-пиран-3-ил]метил}-3-циклогекс-1-ен-1-ил-6-(1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (204 мг) получали в виде светло-желтого масла способом, аналогичным применяемому на стадии 3 примера 1, используя соединение, полученное на вышеуказанной стадии 7 (405 мг), и 5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пирроло[2,3-b]пиридин (204 мг).
1H-ЯМР (CDCl3) δ: 0,06 (6H, д, J=2,4 Гц), 0,88 (9H, с), 1,34-1,47 (1H, м), 1,73-1,82 (2H, м), 1,86-1,94 (2H, м), 2,05-2,13 (1H, м), 2,25-2,38 (3H, м), 2,46-2,53 (2H, м), 3,15 (1H, дд, J=10,7, 8,5 Гц), 3,24 (1H, дд, J=11,2, 9,5 Гц), 3,70-3,85 (4H, м), 3,99 (1H, дд, J=14,4, 9,0 Гц), 6,06-6,10 (1H, м), 6,60 (1H, дд, J=3,5, 1,8 Гц), 7,41 (1H, д, J=2,0 Гц), 7,42-7,46 (1H, м), 8,09 (1H, д, J=2,0 Гц), 8,31 (1H, д, J=1,7 Гц), 8,52 (1H, д, J=2,2 Гц), 10,18 (1H, ушир. с).
Стадия 9
1-{[цис-5-Гидрокситетрагидро-2H-пиран-3-ил]метил}-6-(1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (10 мг) получали в виде бесцветного твердого вещества способом, аналогичным применяемому на стадии 6 примера 35, используя соединение, полученное на вышеуказанной стадии 8 (204 мг).
MS (ESI) m/z: 366 (M+H)+.
HRMS (ESI) [M+H]+ вычислено: C19H19N5O3 366,15661; найдено: 366,15645.
1H-ЯМР (CD3OD) δ: 1,25-1,36 (1H, м), 2,07-2,16 (1H, м), 2,22-2,35 (1H, м), 3,08 (1H, т, J=10,0 Гц), 3,22 (1H, т, J=10,6 Гц), 3,58-3,68 (1H, м), 3,77-3,92 (3H, м), 3,96 (1H, дд, J=14,5, 7,7 Гц), 6,58 (1H, д, J=3,4 Гц), 7,46 (1H, д, J=3,4 Гц), 7,82 (1H, д, J=1,7 Гц), 8,24 (1H, д, J=1,7 Гц), 8,27 (1H, д, J=2,0 Гц), 8,46 (1H, д, J=2,0 Гц).
(Пример 66)
1-{[транс-5-Гидрокситетрагидро-2H-пиран-3-ил]метил}-6-(1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
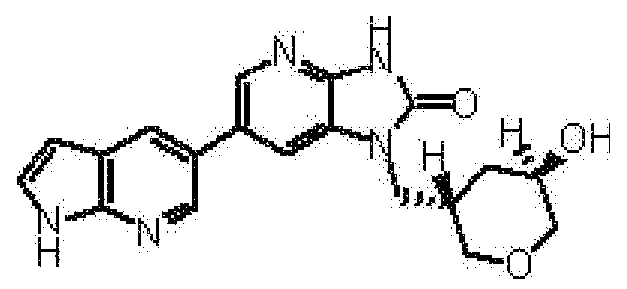
и его энантиомер
Стадия 1
Транс-5-{[трет-бутил(диметил)силил]окси}тетрагидро-2H-пиран-3-карбоновая кислота
Указанное в заголовке соединение (165 мг) получали в виде бесцветного масла способом, аналогичным применяемому на стадии 5 примера 65, используя метил транс-5-{[трет-бутил(диметил)силил]окси}тетрагидро-2H-пиран-3-карбоксилат (184 мг), полученный на стадии 4 примера 65.
1H-ЯМР (CDCl3) δ: 0,08 (6H, д, J=3,2 Гц), 0,90 (9H, с), 1,79-1,87 (1H, м), 2,07-2,16 (1H, м), 2,91-2,99 (1H, м), 3,41 (1H, дд, J=11,4, 5,7 Гц), 3,65 (1H, дд, J=11,2, 2,7 Гц), 3,79-3,96 (3H, м).
Стадия 2
[Транс-5-{[трет-бутил(диметил)силил]окси}тетрагидро-2H-пиран-3-ил]метанол
Указанное в заголовке соединение (154 мг) получали способом, аналогичным применяемому на стадии 6 примера 65, используя соединение, полученное на вышеуказанной стадии 1 (165 мг).
1H-ЯМР (CDCl3) δ: 0,06 (6H, с), 0,89 (9H, с), 1,68 (2H, т, J=5,7 Гц), 2,07-2,20 (1H, м), 2,38 (1H, ушир. с), 3,42 (1H, дд, J=11,4, 5,7 Гц), 3,47-3,55 (1H, м), 3,57-3,64 (3H, м), 3,77 (1H, дд, J=11,4, 3,5 Гц), 3,80-3,88 (1H, м).
Стадия 3
6-Бром-1-{[транс-5-{[трет-бутил(диметил)силил]окси}тетрагидро-2H-пиран-3-ил]метил}-3-циклогекс-1-ен-1-ил-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (167 мг) получали способом, аналогичным применяемому на стадии 3 примера 35, используя соединение, полученное на стадии 2 примера 35 (183 мг), и соединение, полученное на описанной выше стадии 2 (154 мг).
1H-ЯМР (CDCl3) δ: 0,03 (6H, д, J=11,7 Гц), 0,85 (9H, с), 1,64-1,70 (2H, м), 1,70-1,78 (2H, м), 1,82-1,90 (2H, м), 2,27-2,34 (2H, м), 2,37-2,43 (2H, м), 2,45-2,55 (1H, м), 3,42 (2H, тд, J=10,9, 6,2 Гц), 3,64-3,73 (2H, м), 3,78 (1H, дд, J=14,3, 8,2 Гц), 3,87 (1H, дд, J=14,2, 7,3 Гц), 3,89-3,97 (1H, м), 5,97-6,02 (1H, м), 7,32 (1H, д, J=2,0 Гц), 8,09 (1H, д, J=2,0 Гц).
Стадия 4
1-{[Транс-5-{[трет-бутил(диметил)силил]окси}тетрагидро-2H-пиран-3-ил]метил}-3-циклогекс-1-ен-1-ил-6-(1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (138 мг) получали в виде светло-желтого масла способом, аналогичным применяемому на стадии 3 примера 1, используя соединение, полученное на вышеуказанной стадии 3 (167 мг), и 5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пирроло[2,3-b]пиридин (117 мг).
1H-ЯМР (CDCl3) δ: 0,01 (6H, д, J=11,5 Гц), 0,82 (9H, с), 1,67-1,81 (4H, м), 1,85-1,94 (2H, м), 2,30-2,37 (2H, м), 2,46-2,53 (2H, м), 2,55-2,66 (1H, м), 3,40-3,53 (2H, м), 3,66-3,78 (2H, м), 3,84-4,01 (3H, м), 6,05-6,10 (1H, м), 6,58-6,60 (1H, м), 7,43 (1H, д, J=1,7 Гц), 7,44-7,47 (1H, м), 8,09 (1H, д, J=2,0 Гц), 8,31 (1H, д, J=1,7 Гц), 8,51 (1H, д, J=2,0 Гц), 10,76 (1H, ушир. с).
Стадия 5
1-{[транс-5-Гидрокситетрагидро-2H-пиран-3-ил]метил}-6-(1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (50 мг) получали в виде светлокоричневого порошка способом, аналогичным применяемому на стадии 6 примера 35, используя соединение, полученное на вышеуказанной стадии 4 (138 мг).
MS (ESI) m/z: 366 (M+H)+.
HRMS (ESI) [M+H]+ вычислено: C19H19N5O3 366,15661; найдено: 366,15579.
1H-ЯМР (ДМСО-d6) δ: 1,07-1,13 (1H, м), 1,50-1,62 (2H, м), 3,51 (2H, дд, J=11,5, 2,4 Гц), 3,59 (2H, дд, J=11,2, 2,9 Гц), 3,69-3,79 (3H, м), 4,65 (1H, ушир. с), 6,50 (1H, д, J=3,4 Гц), 7,51 (1H, д, J=3,4 Гц), 7,67-7,72 (1H, м), 8,16-8,19 (1H, м), 8,21 (1H, д, J=2,2 Гц), 8,52 (1H, д, J=2,2 Гц), 11,71 (1H, ушир. с).
(Пример 67)
1-{[цис-5-Метокситетрагидро-2H-пиран-3-ил]метил}-6-(1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
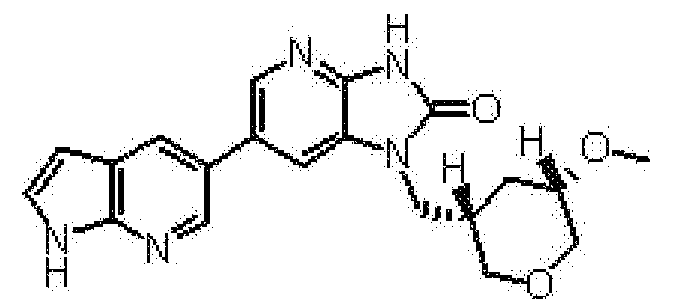
и его энантиомер
Стадия 1
Трет-бутил(диметил)({цис-5-[(тетрагидро-2H-пиран-2-илокси)метил]тетрагидро-2H-пиран-3-ил}окси)силан
Указанное в заголовке соединение (222 мг) получали в виде бесцветного масла способом, аналогичным применяемому на стадии 3 примера 62, используя соединение, полученное на стадии 6 примера 65 (180 мг).
1H-ЯМР (CDCl3) δ: 0,06 (12H, д, J=3,4 Гц), 0,88 (18H, с), 1,13-1,29 (2H, м), 1,46-1,91 (9H, м), 1,95-2,09 (4H, м), 2,95-3,10 (4H, м), 3,17-3,29 (2H, м), 3,46-4,02 (14H, м), 4,51-4,57 (2H, м), 4,93-4,98 (1H, м).
Стадия 2
цис-5-[(Тетрагидро-2H-пиран-2-илокси)метил]тетрагидро-2H-пиран-3-ол
Указанное в заголовке соединение (136 мг) получали в виде бесцветного масла способом, аналогичным применяемому на стадии 4 примера 62, используя соединение, полученное на вышеуказанной стадии 1 (222 мг).
1H-ЯМР (CDCl3) δ: 1,17-1,32 (2H, м), 1,47-1,86 (6H, м), 1,97-2,18 (2H, м), 2,37 (1H, ушир. с), 3,02-3,33 (3H, м), 3,46-4,02 (5H, м), 4,53-4,60 (1H, м).
Стадия 3
цис-3-Метокси-5-[(тетрагидро-2H-пиран-2-илокси)метил]тетрагидро-2H-пиран
Указанное в заголовке соединение (123 мг) получали в виде бесцветного масла способом, аналогичным применяемому на стадии 1 примера 63, используя соединение, полученное на вышеуказанной стадии 2 (136 мг).
1H-ЯМР (CDCl3) δ: 1,08-1,20 (1H, м), 1,47-1,63 (4H, м), 1,64-1,74 (1H, м), 1,74-1,86 (1H, м), 1,96-2,08 (1H, м), 2,14-2,25 (1H, м), 2,99-3,15 (2H, м), 3,21-3,37 (2H, м), 3,38 (3H, с), 3,46-3,55 (1H, м), 3,56-3,66 (1H, м), 3,76-3,86 (1H, м), 3,91-4,10 (2H, м), 4,52-4,58 (1H, м).
Стадия 4
[цис-5-Метокситетрагидро-2H-пиран-3-ил]метанол
Соединение, полученное на описанной выше стадии 3 (115 мг), растворяли в метаноле (10 мл). Добавляли p-толуолсульфоновую кислоту (10 мг) и смесь перемешивали при комнатной температуре в течение 14 часов. После отгонки метанола остаток очищали хроматографией на колонке с силикагелем (элюируя смесью этилацетат-гексан) с получением указанного в заголовке соединения (68 мг) в виде бесцветного масла.
1H-ЯМР (CDCl3) δ: 1,14-1,28 (1H, м), 1,83-1,97 (2H, м), 2,13-2,20 (1H, м), 3,11-3,22 (2H, м), 3,28-3,37 (1H, м), 3,38 (3H, с), 3,53-3,61 (2H, м), 3,91-4,02 (2H, м).
Стадия 5
6-Бром-3-циклогекс-1-ен-1-ил-1-{[цис-5-метокситетрагидро-2H-пиран-3-ил]метил}-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (114 мг) получали способом, аналогичным применяемому на стадии 3 примера 35, используя соединение, полученное на стадии 2 примера 35 (137 мг), и соединение, полученное на описанной выше стадии 4 (68 мг).
1H-ЯМР (CDCl3) δ: 1,34-1,47 (1H, м), 1,70-1,80 (2H, м), 1,81-1,91 (2H, м), 2,07-2,17 (1H, м), 2,18-2,36 (3H, м), 2,38-2,45 (2H, м), 3,26-3,36 (3H, м), 3,38 (3H, с), 3,71-3,83 (2H, м), 3,86-3,95 (2H, м), 5,98-6,03 (1H, м), 7,38 (1H, д, J=2,0 Гц), 8,09 (1H, д, J=2,0 Гц).
Стадия 6
3-Циклогекс-1-ен-1-ил-1-{[цис-5-метокситетрагидро-2H-пиран-3-ил]метил}-6-(1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (113 мг) получали в виде светло-желтого масла способом, аналогичным применяемому на стадии 3 примера 1, используя соединение, полученное на вышеуказанной стадии 5 (114 мг), и 5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пирроло[2,3-b]пиридин (99 мг).
1H-ЯМР (CDCl3) δ: 1,37-1,48 (1H, м), 1,72-1,81 (2H, м), 1,83-1,95 (2H, м), 2,15-2,23 (1H, м), 2,28-2,37 (3H, м), 2,47-2,53 (2H, м), 3,27-3,37 (3H, м), 3,37 (3H, с), 3,78-4,03 (4H, м), 6,06-6,11 (1H, м), 6,60 (1H, дд, J=3,5, 1,8 Гц), 7,45-7,48 (2H, м), 8,11 (1H, д, J=2,0 Гц), 8,31 (1H, д, J=2,0 Гц), 8,53 (1H, д, J=2,2 Гц), 10,90 (1H, ушир. с).
Стадия 7
1-{[цис-5-Метокситетрагидро-2H-пиран-3-ил]метил}-6-(1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (68 мг) получали в виде светло-коричневого порошка способом, аналогичным применяемому на стадии 6 примера 35, используя соединение, полученное на вышеуказанной стадии 6 (113 мг).
MS (ESI) m/z: 380 (M+H)+.
1H-ЯМР (ДМСО-d6) δ: 1,07-1,21 (1H, м), 2,09-2,23 (2H, м), 2,95 (1H, т, J=10,1 Гц), 3,10 (1H, т, J=10,5 Гц), 3,17-3,25 (1H, м), 3,24 (3H, с), 3,67-3,95 (4H, м), 6,50-6,53 (1H, м), 7,51-7,55 (1H, м), 7,88-7,90 (1H, м), 8,24 (2H, д, J=1,7 Гц), 8,54 (1H, д, J=2,0 Гц), 11,62 (1H, ушир. с), 11,74 (1H, ушир. с).
(Пример 68)
1-[(4-Метокситетрагидро-2H-пиран-4-ил)метил]-6-(1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
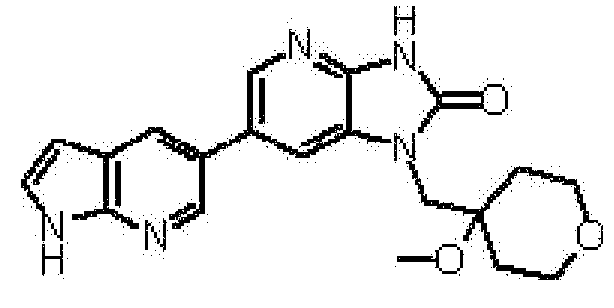
Стадия 1
4-Метокситетрагидро-2H-пиран-4-карбальдегид
Указанное в заголовке соединение (0,47 г) получали способом, аналогичным применяемому на стадии 1 примера 25, используя (4-метокситетрагидро-2H-пиран-4-ил)метанол, полученный способом, описанным в WO 2008/029825 (0,68 г).
Стадия 2
5-Бром-N3-[(4-метокситетрагидро-2H-пиран-4-ил)метил]пиридин-2,3-диамин
Указанное в заголовке соединение (0,11 г) получали способом, аналогичным применяемому на стадии 1 примера 24, используя 2,3-диамино-5-бромпиридин (0,56 г) и соединение, полученное на описанной выше стадии 1 (0,47 г).
MS (ESI) m/z: 316 (M+H)+.
Стадия 3
6-Бром-1-[(4-метокситетрагидро-2H-пиран-4-ил)метил]-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (0,12 г) получали способом, аналогичным применяемому на стадии 2 примера 1, используя соединение, полученное на вышеуказанной стадии 2 (0,11 г).
MS (ESI) m/z: 344 (M+H)+.
Стадия 4
1-[(4-Метокситетрагидро-2H-пиран-4-ил)метил]-6-(1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (45 мг) получали способом, аналогичным применяемому на стадии 3 примера 1, используя соединение, полученное на вышеуказанной стадии 3 (115 мг), и 5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пирроло[2,3-b]пиридин (82 мг).
HRMS (ESI) [(M+H)+] вычислено: C20H22N5O3 380,17226; найдено: 380,17388.
1H-ЯМР (ДМСО-d6) δ: 1,59-1,73 (4H, м), 3,40 (3H, с), 3,42-3,57 (2H, м), 3,61-3,70 (2H, м), 3,91-3,98 (2H, м), 6,49-6,54 (1H, м), 7,50-7,58 (1H, м), 7,82 (1H, д, J=1,8 Гц), 8,19-8,27 (2H, м), 8,50 (1H, дд, J=11,0, 1,8 Гц), 11,74 (1H, ушир. с).
(Пример 69)
1-[(4-Фтортетрагидро-2H-пиран-4-ил)метил]-6-(1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
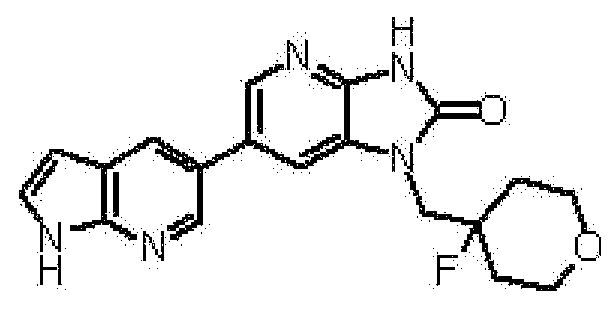
Стадия 1
Метил 4-фтортетрагидро-2H-пиран-4-карбоксилат
Указанное в заголовке соединение (0,4 г) получали в виде светло-желтого твердого вещества способом, аналогичным применяемому на стадии 1 примера 51, используя метил тетрагидро-2H-пиран-4-карбоксилат (2,0 г).
1H-ЯМР (CDCl3) δ: 1,83-1,93 (2H, м), 2,07-2,28 (2H, м), 3,71-3,79 (2H, м), 3,82 (3H, с), 3,88 (2H, ддд, J=11,7, 5,1, 2,4 Гц).
Стадия 2
(4-Фтортетрагидро-2H-пиран-4-ил)метанол
Указанное в заголовке соединение (0,15 г) получали в виде бесцветного масла способом, аналогичным применяемому на стадии 2 примера 33, используя соединение, полученное на вышеуказанной стадии 1 (0,41 г).
1H-ЯМР (CDCl3) δ: 1,63-1,89 (4H, м), 2,00 (1H, ушир. с), 3,61 (2H, д, J=20,7 Гц), 3,73 (2H, тд, J=11,3, 2,4 Гц), 3,79-3,87 (2H, м).
Стадия 3
6-Бром-3-циклогекс-1-ен-1-ил-1-[(4-фтортетрагидро-2H-пиран-4-ил)метил]-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (353 мг) получали способом, аналогичным применяемому на стадии 3 примера 35, используя соединение, полученное на стадии 2 примера 35 (200 мг), и соединение, полученное на описанной выше стадии 2 (134 мг).
1H-ЯМР (CDCl3) δ: 1,70-1,82 (4H, м), 1,82-2,01 (4H, м), 2,27-2,35 (2H, м), 2,38-2,46 (2H, м), 3,70 (2H, м), 3,82-3,90 (2H, м), 4,01 (2H, д, J=22,9 Гц), 5,99-6,05 (1H, м), 7,48 (1H, м), 8,11 (1H, д, J=1,7 Гц).
Стадия 4
3-Циклогекс-1-ен-1-ил-1-[(4-фтортетрагидро-2H-пиран-4-ил)метил]-6-(1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (200 мг) получали в виде светло-желтого твердого вещества способом, аналогичным применяемому на стадии 3 примера 1, используя соединение, полученное на вышеуказанной стадии 3 (353 мг), и 5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пирроло[2,3-b]пиридин (181 мг).
1H-ЯМР (CDCl3) δ: 1,73-2,06 (8H, м), 2,31-2,39 (2H, м), 2,46-2,53 (2H, м), 3,72 (2H, м), 3,84-3,93 (2H, м), 4,07-4,17 (2H, м), 6,06-6,11 (1H, м), 6,59 (1H, дд, J=3,4, 2,0 Гц), 7,39-7,43 (1H, м), 7,57 (1H, м), 8,09 (1H, J=2,2 Гц), 8,32 (1H, J=2,0 Гц), 8,51 (1H, J=2,0 Гц), 9,50 (1H, ушир. с).
Стадия 5
1-[(4-Фтортетрагидро-2H-пиран-4-ил)метил]-6-(1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (127 мг) получали в виде светло-коричневого порошка способом, аналогичным применяемому на стадии 6 примера 35, используя соединение, полученное на вышеуказанной стадии 4 (200 мг).
MS (ESI) m/z: 368 (M+H)+.
HRMS (ESI) [M+H]+ вычислено: C19H18FN5O2 368,15119; найдено: 368,15228.
1H-ЯМР (ДМСО-d6) δ: 1,66-1,95 (4H, м), 3,47-3,56 (2H, м), 3,72-3,80 (2H, м), 4,14 (2H, J=22,2 Гц), 6,50-6,54 (1H, м), 7,53 (1H, м), 7,77-7,80 (1H, м), 8,19 (1H, д, J=2,1 Гц), 8,26 (1H, д, J=1,7 Гц) 8,50 (1H, д, J=2,1 Гц), 11,71 (1H, ушир. с), 11,75 (1H, ушир. с).
(Пример 70)
1-[(2,2-Диметилтетрагидро-2H-пиран-4-ил)метил]-6-(1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
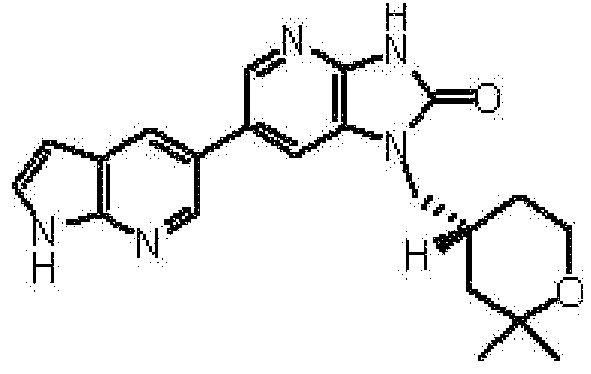
и его энантиомер
Стадия 1
2,2-Диметилтетрагидро-2H-пиран-4-карбонитрил
В раствор 2,2-диметилтетрагидро-4H-пиран-4-она (350 мг) в диметоксиэтане (10 мл) с перемешиванием добавляли п-толуолсульфонилметилизоцианид (693 мг) и трет-бутанол (438 мкл). Тремя частями добавляли трет-бутоксид калия (766 мг), охлаждая при -20°C. Смесь нагревали до комнатной температуры и потом перемешивали в течение 18 часов. Добавляли диэтиловый эфир и смесь фильтровали через целит. Затем растворитель упаривали при пониженном давлении с получением указанного в заголовке соединения (321 мг).
1H-ЯМР (CDCl3) δ: 1,21 (3H, с), 1,28 (3H, с), 1,69-1,93 (4H, м), 2,82-2,89 (1H, м), 3,61-3,66 (1H, м), 3,77-3,81 (1H, м).
Стадия 2
2,2-Диметилтетрагидро-2H-пиран-4-карбоновая кислота
К соединению, полученному на описанной выше стадии 1 (321 мг), добавляли 2,25 M водный раствор гидроксида калия (6 мл) и смесь нагревали с обратным холодильником в течение ночи. Реакционный раствор оставляли охлаждаться до комнатной температуры и потом промывали диэтиловым эфиром и добавляли концентрированную соляную кислоту до тех пор, пока реакционный раствор не стал кислым, затем экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором. После сушки над безводным сульфатом натрия растворитель упаривали при пониженном давлении с получением указанного в заголовке соединения (264 мг).
1H-ЯМР (CDCl3) δ: 1,23 (3H, с), 1,26 (3H, с), 1,55-1,71 (2H, м), 1,82 (2H, т, J=13,7 Гц), 2,69-2,75 (1H, м), 3,64-3,69 (1H, м), 3,78-3,81 (1H, м).
Стадия 3
(2,2-Диметилтетрагидро-2H-пиран-4-ил)метанол
Указанное в заголовке соединение (220 мг) получали способом, аналогичным применяемому на стадии 2 примера 33, используя соединение, полученное на вышеуказанной стадии 2 (264 мг).
1H-ЯМР (CDCl3) δ: 1,08-1,25 (8H, м), 1,58-1,65 (2H, м), 1,92-1,94 (1H, м), 3,46 (2H, т, J=6,6 Гц), 3,66-3,71 (1H, м), 3,76-3,81 (1H, м).
Стадия 4
6-Бром-3-циклогекс-1-ен-1-ил-1-[(2,2-диметилтетрагидро-2H-пиран-4-ил)метил]-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (255 мг) получали способом, аналогичным применяемому на стадии 3 примера 35, используя соединение, полученное на стадии 2 примера 35 (150 мг), и соединение, полученное на описанной выше стадии 3 (103 мг).
MS (ESI) m/z: 420 (M+H)+.
1H-ЯМР (CDCl3) δ: 1,19 (3H, с), 1,23 (3H, с), 1,53-1,56 (2H, м), 1,72-1,77 (2H, м), 1,84-1,89 (2H, м), 2,22-2,33 (3H, м), 2,40-2,44 (2H, м), 3,59-3,78 (5H, м), 6,01-6,02 (1H, м), 7,28 (1H, д, J=1,7 Гц), 8,10 (1H, д, J=1,7 Гц).
Стадия 5
3-Циклогекс-1-ен-1-ил-1-[(2,2-диметилтетрагидро-2H-пиран-4-ил)метил]-6-(1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (176 мг) получали способом, аналогичным применяемому на стадии 3 примера 1, используя соединение, полученное на вышеуказанной стадии 4 (255 мг), и 5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пирроло[2,3-b]пиридин (108 мг).
MS (ESI) m/z: 458 (M+H)+.
1H-ЯМР (CDCl3) δ: 1,19 (3H, с), 1,24 (3H, с), 1,57-1,62 (2H, м), 1,76-1,80 (2H, м), 1,88-1,93 (2H, м), 2,32-2,37 (3H, м), 2,49-2,52 (2H, м), 3,63 (1H, т, J=12,3 Гц), 3,73-3,82 (3H, м), 6,08-6,10 (1H, м), 6,60-6,61 (1H, м), 7,35-7,37 (1H, м), 8,07 (1H, с), 8,29-8,30 (1H, м), 8,49-8,50 (1H, м), 9,07 (1H, ушир. с).
Стадия 6
1-[(2,2-Диметилтетрагидро-2H-пиран-4-ил)метил]-6-(1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (57 мг) получали способом, аналогичным применяемому на стадии 6 примера 35, используя соединение, полученное на вышеуказанной стадии 5 (176 мг).
MS (ESI) m/z: 378 (M+H)+.
HRMS (ESI) [(M+H)+] вычислено: C21H23N5O2 378,19300; найдено: 378,19044.
1H-ЯМР (ДМСО-d6) δ: 1,09 (3H, с), 1,10-1,25 (2H, м), 1,11 (3H, с), 1,47 (2H, т, J=11,2 Гц), 2,22-2,31 (1H, м), 3,47-3,52 (1H, м), 3,59 (1H, дд, J=12,0, 4,0 Гц), 3,72 (2H, д, J=7,4 Гц), 6,51-6,52 (1H, м), 7,52-7,54 (1H, м), 7,91-7,92 (1H, м), 8,23-8,25 (2H, м), 8,55 (1H, д, J=2,3 Гц), 11,59 (1H, ушир. с), 11,75 (1H, ушир. с).
(Пример 71)
1-{[(2R-4r-6S)-2,6-Диметилтетрагидро-2H-пиран-4-ил]метил}-6-(1H-пирроло-[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
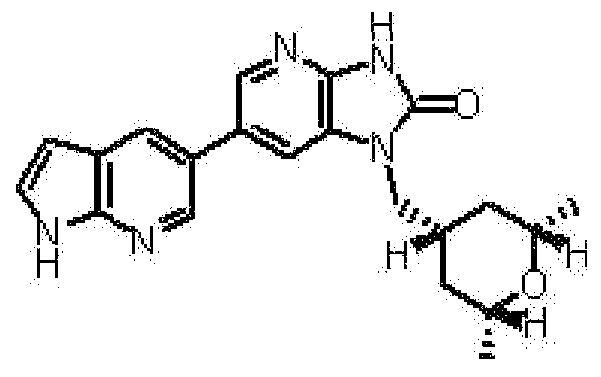
Стадия 1
6-Бром-3-циклогекс-1-ен-1-ил-1-{[(2R-4r-6S)-2,6-диметилтетрагидро-2H-пиран-4-ил]метил}-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (152 мг) получали способом, применяемым на стадии 3 примера 35, используя соединение, полученное на стадии 2 примера 35 (150 мг), и [(2R-4r-6S)-2,6-диметилтетрагидро-2H-пиран-4-ил]метанол (103 мг), полученный способом, описанным в WO 2007/070201.
MS (ESI) m/z: 420 (M+H)+.
1H-ЯМР (CDCl3) δ: 0,97-1,05 (2H, м), 1,19 (3H, с), 1,20 (3H, с), 1,58-1,62 (2H, м), 1,72-1,77 (2H, м), 1,84-1,89 (2H, м), 2,10-2,19 (1H, м), 2,29-2,33 (2H, м), 2,41-2,44 (2H, м), 3,42-3,48 (2H, м), 3,69 (2H, д, J=7,4 Гц), 6,01-6,02 (1H, м), 7,26-7,27 (1H, м), 8,10 (1H, д, J=1,7 Гц).
Стадия 2
3-Циклогекс-1-ен-1-ил-1-{[(2R-4r-6S)-2,6-диметилтетрагидро-2H-пиран-4-ил]метил}-6-(1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (150 мг) получали способом, аналогичным применяемому на стадии 3 примера 1, используя соединение, полученное на вышеуказанной стадии 1 (152 мг), и 5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пирроло[2,3-b]пиридин (97 мг).
MS (ESI) m/z: 458 (M+H)+.
1H-ЯМР (CDCl3) δ: 1,02-1,09 (2H, м), 1,19 (3H, с), 1,20 (3H, с), 1,65-1,68 (2H, м), 1,75-1,80 (2H, м), 1,88-1,93 (2H, м), 2,18-2,27 (1H, м), 2,33-2,36 (2H, м), 2,49-2,52 (2H, м), 3,44-3,48 (2H, м), 3,80 (2H, д, J=6,9 Гц), 6,08-6,09 (1H, м), 6,60 (1H, дд, J=3,4, 1,7 Гц), 7,35 (1H, д, J=1,7 Гц), 8,07 (1H, д, J=2,3 Гц), 8,29 (1H, д, J=1,7 Гц), 8,49 (1H, д, J=2,3 Гц), 8,76 (1H, ушир. с).
Стадия 3
1-{[(2R-4r-6S)-2,6-Диметилтетрагидро-2H-пиран-4-ил]метил}-6-(1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (65 мг) получали способом, аналогичным применяемому на стадии 6 примера 35, используя соединение, полученное на вышеуказанной стадии 2 (150 мг).
MS (ESI) m/z: 378 (M+H)+.
HRMS (ESI) [(M+H)+] вычислено: C21H23N5O2 378,19300; найдено: 378,19088.
1H-ЯМР (ДМСО-d6) δ: 0,86-0,93 (2H, м), 1,05 (3H, с), 1,06 (3H, с), 1,54-1,57 (2H, м), 2,12-2,21 (1H, м), 3,33-3,39 (2H, м), 3,74 (2H, д, J=7,4 Гц), 6,51-6,52 (1H, м), 7,52-7,53 (1H, м), 7,90 (1H, с), 8,24-8,25 (2H, м), 8,55 (1H, д, J=2,3 Гц), 11,59 (1H, ушир. с), 11,74 (1H, ушир. с).
(Пример 72)
6-(3-Амино-1H-индазол-5-ил)-1-(тетрагидро-2H-пиран-4-илметил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Стадия 1
2-Фтор-5-[2-оксо-1-(тетрагидро-2H-пиран-4-илметил)-2,3-дигидро-1H-имидазо[4,5-b]пиридин-6-ил]бензонитрил
Указанное в заголовке соединение (56 мг) получали способом, аналогичным применяемому на стадии 3 примера 1, используя (3-циано-4-фторфенил)борную кислоту (35 мг) и соединение, полученное на стадии 1 примера 4 (60 мг).
MS (ESI) m/z: 353 (M+H)+.
HRMS (ESI) [M+H]+ вычислено: C19H18FN4O2 353,14138; найдено: 353,14387.
1H-ЯМР (ДМСО-d6) δ: 1,21-1,38 (2H, м), 1,43-1,54 (2H, м), 2,01-2,17 (1H, м), 3,19-3,30 (1H, м), 3,71-3,88 (4H, м), 7,61-7,69 (1H, м), 7,93 (1H, д, J=1,8 Гц), 8,12-8,20 (1H, м), 8,28-8,33 (2H, м), 11,72 (1H, ушир. с).
Стадия 2
6-(3-Амино-1H-индазол-5-ил)-1-(тетрагидро-2H-пиран-4-илметил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Соединение, полученное на описанной выше стадии 1 (52 мг), приготавливали в виде раствора в этаноле (3 мл). Добавляли гидразинмоногидрат (36 мкл) и смесь нагревали с обратным холодильником в течение 3 часов. Дополнительно добавляли гидразинмоногидрат (72 мкл) и смесь нагревали с обратным холодильником в течение 24 часов. Добавляли еще гидразинмоногидрат (144 мкл) и смесь нагревали с обратным холодильником в течение 24 часов. После этого реакционный раствор концентрировали и очищали тонкослойной хроматографией (элюируя смесью метанол-дихлорметан) с получением указанного в заголовке соединения (27 мг).
MS (ESI) m/z: 365 (M+H)+.
HRMS (ESI) [M+H]+ вычислено: C19H20N6O2 365,17260; найдено: 365,17303.
1H-ЯМР (ДМСО-d6) δ: 1,22-1,39 (2H, м), 1,46-1,56 (2H, м), 2,02-2,17 (1H, м), 3,19-3,30 (2H, м), 3,72-3,87 (4H, м), 5,40 (2H, с), 7,32 (1H, д, J=8,7 Гц), 7,57 (1H, дд, J=8,7, 1,8 Гц), 7,77 (1H, д, J=1,8 Гц), 8,00 (1H, с), 8,18 (1H, д, J=2,3 Гц), 11,44 (1H, ушир. с), 11,55 (1H, ушир. с).
(Пример 73)
6-Пиразоло[1,5-a]пиримидин-6-ил-1-(тетрагидро-2H-пиран-4-илметил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
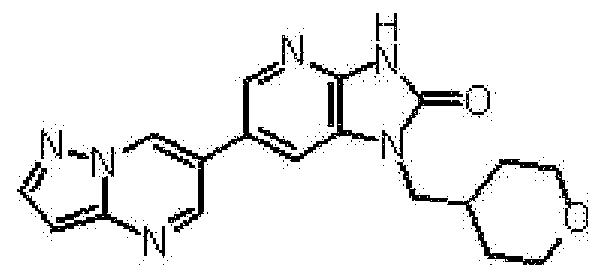
Стадия 1
6-(Триметилстаннил)пиразоло[1,5-a]пиримидин
6-Бромпиразоло[1,5-a]пиримидин (150 мг) растворяли в толуоле (3 мл). Добавляли гексаметилдитин (0,188 мл) и тетракистрифенилфосфин палладий (92 мг) и смесь перемешивали при 115°C в течение 2 часов. Реакционный раствор охлаждали до комнатной температуры и потом растворитель упаривали. Полученный остаток очищали тонкослойной хроматографией (элюируя смесью этилацетат-гексан) с получением указанного в заголовке соединения (145 мг).
MS (ESI) m/z: 284 (M+H)+.
1H-ЯМР (CDCl3) δ: 0,43 (9H, с), 6,64-6,65 (1H, м), 8,07-8,07 (1H, м), 8,41-8,41 (1H, м), 8,59-8,60 (1H, м).
Стадия 2
6-Пиразоло[1,5-a]пиримидин-6-ил-1-(тетрагидро-2H-пиран-4-илметил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Бис(трифенилфосфин)палладий(II) дихлорид (36 мг) добавляли в раствор соединения, полученного на описанной выше стадии 1 (145 мг), и соединения, полученного на стадии 1 примера 4 (60 мг), в N,N-диметилформамиде (2,6 мл) в атмосфере азота. Смесь перемешивали в условиях микроволнового излучения при 150°C в течение 15 минут. Реакционный раствор концентрировали при пониженном давлении и остаток очищали тонкослойной хроматографией (элюируя смесью метанол-дихлорметан) с получением указанного в заголовке соединения (28 мг).
MS (ESI) m/z: 351 (M+H)+.
HRMS (ESI) [M+H]+ вычислено: C18H19N6O2 351,15695; найдено: 351,16154.
1H-ЯМР (ДМСО-d6) δ: 1,21-1,38 (2H, м), 1,45-1,55 (2H, м), 2,04-2,19 (1H, м), 3,19-3,25 (2H, м), 3,74 (2H, д, J=7,3 Гц), 3,78-3,86 (2H, м), 6,77-6,80 (1H, м), 8,04 (1H, д, J=1,8 Гц), 8,26 (1H, д, J=2,3 Гц), 8,40 (1H, д, J=1,8 Гц), 8,99 (1H, д, J=2,3 Гц), 9,53-9,49 (1H, м), 11,73 (1H, с).
(Пример 74)
6-(1H-Пиразоло[3,4-b]пиридин-5-ил)-1-(тетрагидро-2H-пиран-4-илметил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
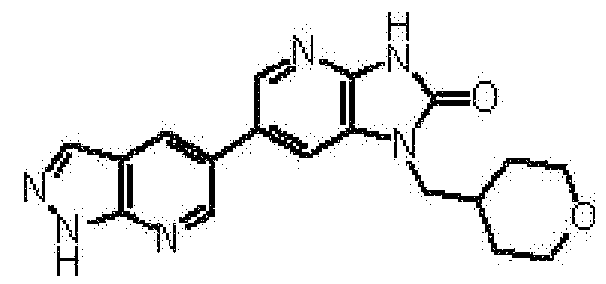
Стадия 1
5-Бром-1-{[2-(триметилсилил)этокси]метил}-1H-пиразоло[3,4-b]пиридин
5-Бром-1H-пиразоло[3,4-b]пиридин (200 мг) растворяли в N,N-диметилформамиде (5 мл). Добавляли 55% гидрид натрия при 0°C (53 мг) и смесь перемешивали при такой же температуре в течение пяти минут и потом перемешивали при комнатной температуре в течение 20 минут. Добавляли 2-(хлорметокси)этилтриметилсилан (0,213 мл) и смесь перемешивали при 0°C в течение 2 часов. При охлаждении льдом добавляли насыщенный водный раствор хлорида аммония, затем экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом натрия и растворитель упаривали. Остаток очищали хроматографией на колонке с силикагелем (элюируя смесью этилацетат-гексан) с получением указанного в заголовке соединения (0,224 г).
1H-ЯМР (CDCl3) δ: 0,00 (9H, с), 0,96-1,00 (2H, м), 3,68-3,72 (2H, м), 5,90 (2H, с), 8,07 (1H, с), 8,27 (1H, д, J=2,2 Гц), 8,65 (1H, д, J=2,2 Гц).
Стадия 2
5-Триметилстаннил-1-{[2-(триметилсилил)этокси]метил}-1H-пиразоло[3,4-b]пиридин
Указанное в заголовке соединение (115 мг) получали способом, аналогичным применяемому на стадии 1 примера 73, используя соединение, полученное на вышеуказанной стадии 1 (116 мг).
1H-ЯМР (CDCl3) δ: 1,71-1,81 (4H, м), 3,43 (3H, с), 3,64-3,67 (2H, м), 3,76-3,79 (2H, м), 4,01 (2H, с), 7,40 (1H, д, J=2,0 Гц), 8,10 (1H, д, J=2,0 Гц), 9,56 (1H, с).
Стадия 3
1-(Тетрагидро-2H-пиран-4-илметил)-6-(1-{[2-(триметилсилил)этокси]метил}-1H-пиразоло[3,4-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (13 мг) получали способом, аналогичным применяемому на стадии 2 примера 73, используя соединение, полученное на вышеуказанной стадии 2 (85 мг), и соединение, полученное на стадии 1 примера 4 (60 мг).
MS (ESI) m/z: 481 (M+H)+.
1H-ЯМР (CDCl3) δ: 0,04 (9H, с), 0,95-1,03 (2H, м), 1,49-1,58 (2H, м), 1,63-1,73 (2H, м), 2,12-2,29 (1H, м), 3,35-3,45 (2H, м), 3,69-3,76 (2H, м), 3,82-3,89 (2H, м), 3,98-4,07 (2H, м), 5,96 (2H, д, J=1,4 Гц), 7,37-7,41 (1H, м), 8,19 (1H, д, J=1,8 Гц), 8,23-8,26 (1H, м), 8,28-8,31 (1H, м), 8,60 (1H, ушир. с), 8,83-8,79 (1H, м).
Стадия 4
6-(1H-Пиразоло[3,4-b]пиридин-5-ил)-1-(тетрагидро-2H-пиран-4-илметил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
В раствор соединения, полученного на описанной выше стадии 3 (13 мг), в тетрагидрофуране (1 мл) добавляли флуорид тетрабутиламмония (1,0 M раствор в тетрагидрофуране) (0,3 мл) и смесь нагревали с обратным холодильником в течение 8,5 часов. Дополнительно добавляли флуорид тетрабутиламмония (1,0 M раствор в тетрагидрофуране) (1 мл) и смесь нагревали с обратным холодильником в течение 8 часов. Реакционный раствор концентрировали при пониженном давлении и остаток очищали тонкослойной хроматографией (элюируя смесью метанол-дихлорметан) с получением указанного в заголовке соединения (6 мг).
MS (ESI) m/z: 351 (M+H)+.
HRMS (ESI) [M+H]+ вычислено: C18H19N6O2 351,15695; найдено: 351,15591.
1H-ЯМР (ДМСО-d6) δ: 1,24-1,37 (4H, м), 1,44-1,61 (4H, м), 2,03-2,17 (1H, м), 3,10-3,22 (2H, м), 3,70-3,87 (4H, м), 7,95 (1H, д, J=1,8 Гц), 8,21 (1H, с), 8,28 (1H, д, J=1,4 Гц), 8,51 (1H, д, J=2,3 Гц), 8,87 (1H, д, J=2,3 Гц), 11,64 (1H, ушир. с).
(Пример 75)
6-(5H-Пирроло[2,3-b]пиразин-2-ил)-1-(тетрагидро-2H-пиран-4-илметил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
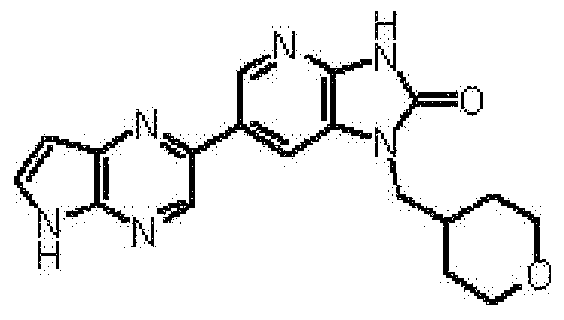
Стадия 1
Трет-бутил 2-бром-5H-пирроло[2,3-b]пиразин-5-карбоксилат
Указанное в заголовке соединение (244 мг) получали способом, аналогичным применяемому на стадии 1 примера 35, используя 2-бром-5H-пирроло[2,3-b]пиразин (168 мг).
1H-ЯМР (CDCl3) δ: 1,68 (9H, с), 6,71 (1H, J=4,1 Гц), 7,96 (1H, J=4,1 Гц), 8,49 (1H, с).
Стадия 2
3-Циклогекс-1-ен-1-ил-6-(5H-пирроло[2,3-b]пиразин-2-ил)-1-(тетрагидро-2H-пиран-4-илметил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (131 мг) получали в виде светло-желтого твердого вещества способом, аналогичным применяемому на стадии 3 примера 1, используя соединение, полученное на вышеуказанной стадии 1 (120 мг), и соединение, полученное на стадии 4 примера 35 (216 мг).
MS (ESI) m/z: 432 (M+H)+.
1H-ЯМР (CDCl3) δ: 1,46-1,57 (2H, м), 1,60-1,67 (2H, м), 1,75-1,80 (2H, м), 1,88-1,94 (2H, м), 2,18-2,24 (1H, м), 2,32-2,37 (2H, м), 2,48-2,52 (2H, м), 3,37 (2H, м), 3,87 (2H, д, J=7,1 Гц), 3,99 (2H, дд, J=11,6, 2,8 Гц), 6,08-6,10 (1H, м), 6,82-6,83 (1H, м), 7,67 (1H, м), 7,96 (1H, д, J=1,7 Гц), 8,64 (1H, д, J=2,0 Гц), 8,71 (1H, с), 8,99 (1H, м).
Стадия 3
6-(5H-Пирроло[2,3-b]пиразин-2-ил)-1-(тетрагидро-2H-пиран-4-илметил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (54 мг) получали в виде твердого вещества опалового цвета способом, аналогичным применяемому на стадии 6 примера 35, используя соединение, полученное на вышеуказанной стадии 2 (130 мг).
HRMS (ESI) [M+H]+ вычислено: C18H19N6O2 351,15695; найдено: 351,15860.
MS (ESI) m/z: 351 (M+H)+.
1H-ЯМР (ДМСО-d6) δ: 1,29-1,38 (2H, м), 1,50-1,55 (2H, м), 2,07-2,13 (1H, м), 3,22-3,30 (2H, м), 3,79-3,85 (4H, м), 6,69-6,70 (1H, м), 7,91 (1H, м), 8,17 (1H, д, J=2,0 Гц), 8,67 (1H, д, J=1,7 Гц), 8,89 (1H, с), 11,70 (1H, с), 12,11 (1H, м).
(Пример 76)
6-(7H-Пирроло[2,3-c]пиридазин-3-ил)-1-(тетрагидро-2H-пиран-4-илметил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
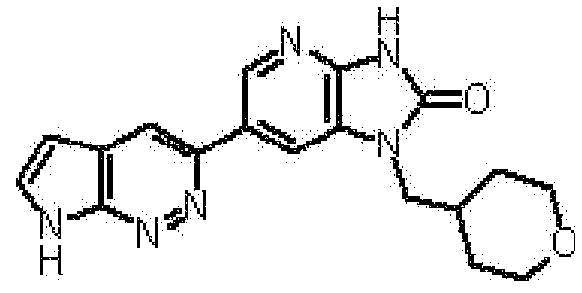
Стадия 1
4-Бром-6-хлорпиридазин-3-амин
3-Амино-6-хлор пиридазин (7,87 г) растворяли в метаноле (115 мл). Добавляли бикарбонат натрия (10,2 г) и потом по каплям добавляли бромин (3,1 мл) и смесь перемешивали при комнатной температуре в течение 16 часов. Реакционный раствор фильтровали и потом разбавляли водой (500 мл) и водный слой экстрагировали этилацетатом три раза. Органический слой сушили над безводным сульфатом натрия. Растворитель упаривали при пониженном давлении. Полученный остаток очищали хроматографией на колонке с силикагелем (элюируя смесью этилацетат-гексан) с получением указанного в заголовке соединения (5,2 г) в виде твердого вещества коричневого цвета.
MS (ESI) m/z: 208 (M+H)+.
1H-ЯМР (ДМСО-d6) δ: 6,98 (2H, ушир. с), 8,00 (1H, с).
Стадия 2
6-Хлор-4-[(триметилсилил)этинил]пиридазин-3-амин
Указанное в заголовке соединение (1,06 г) получали в виде твердого вещества коричневого цвета способом, аналогичным применяемому на стадии 2 примера 36, используя 4-бром-6-хлорпиридазин-3-амин, полученный на вышеуказанной стадии 1 (1,5 г).
MS (ESI) m/z: 226 (M+H)+.
1H-ЯМР (CDCl3) δ: 0,29 (9H, с), 5,37 (2H, ушир. с), 7,25 (1H, с).
Стадия 3
N-Ацетил-N-{6-хлор-4-[(триметилсилил)этинил]пиридазин-3-ил}ацетамид
Соединение, полученное на описанной выше стадии 2 (1,06 г), растворяли в дихлорметане (20 мл). Последовательно добавляли пиридин (0,57 мл) и ацетилхлорид (0,33 мл) при охлаждении льдом и смесь перемешивали при комнатной температуре в течение ночи. Реакционный раствор промывали водой и насыщенным солевым раствором в данном порядке и сушили над безводным сульфатом натрия. Растворитель упаривали при пониженном давлении. Полученный остаток очищали хроматографией на колонке с силикагелем (элюируя смесью этилацетат-гексан) с получением указанного в заголовке соединения (0,45 г) в виде твердого вещества светло-желтого цвета.
MS (ESI) m/z: 310 (M+H)+.
1H-ЯМР (CDCl3) δ: 0,26 (9H, с), 2,33 (6H, с), 7,65 (1H, с).
Стадия 4
6-Хлор-4-(2,2-диметоксиэтил)пиридазин-3-амин
Соединение, полученное на описанной выше стадии 3 (310 мг), растворяли в метаноле (20 мл). Добавляли карбонат калия (276 мг) и смесь перемешивали в течение ночи. Реакционный раствор концентрировали, разбавляли этилацетатом, промывали водой и насыщенным солевым раствором в данном порядке и сушили над безводным сульфатом натрия. Растворитель упаривали при пониженном давлении. Полученный остаток очищали хроматографией на колонке с силикагелем (элюируя смесью метанол-хлороформ) с получением указанного в заголовке соединения (233 мг) в виде масла коричневого цвета.
MS (ESI) m/z: 218 (M+H)+.
1H-ЯМР (CDCl3) δ: 2,80 (2H, д, J=5,0 Гц), 3,41 (6H, с), 4,53 (1H, т, J=5,0 Гц), 5,25 (2H, с), 7,09 (1H, с).
Стадия 5
3-Хлор-7H-пирроло[2,3-c]пиридазин
Соединение, полученное на описанной выше стадии 4 (250 мг), растворяли в этаноле (3 мл). Добавляли 1 н. водный раствор соляной кислоты (1 мл) и смесь перемешивали при 60°C в течение 3 часов. Дополнительно добавляли концентрированную соляную кислоту (0,5 мл) и смесь перемешивали при 80°C в течение 2 часов. Реакционный раствор нейтрализовали насыщенным водным раствором бикарбоната натрия и потом экстрагировали 10% смесью метанол/хлороформ три раза и органический слой сушили над безводным сульфатом натрия. Растворитель упаривали при пониженном давлении. Полученный остаток очищали хроматографией на колонке с силикагелем (элюируя смесью метанол-хлороформ) с получением указанного в заголовке соединения (150 мг) в виде твердого вещества светло-желтого цвета.
MS (ESI) m/z: 154 (M+H)+.
1H-ЯМР (CDCl3) δ: 6,54 (1H, д, J=3,4 Гц), 7,80 (1H, с), 7,84 (1H, д, J=2,0 Гц), 12,01 (1H, ушир. с).
Стадия 6
3-Циклогекс-1-ен-1-ил-6-(7H-пирроло[2,3-c]пиридазин-3-ил)-1-(тетрагидро-2H-пиран-4-илметил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (41 мг) получали в виде светло-желтого масла способом, аналогичным применяемому на стадии 3 примера 1, используя соединение, полученное на вышеуказанной стадии 5 (40 мг), и соединение, полученное на стадии 4 примера 35 (100 мг).
MS (ESI) m/z: 431 (M+H)+.
Стадия 7
6-(7H-Пирроло[2,3-c]пиридазин-3-ил)-1-(тетрагидро-2H-пиран-4-илметил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (8 мг) получали в виде твердого вещества зеленого цвета способом, аналогичным применяемому на стадии 6 примера 35, используя соединение, полученное на вышеуказанной стадии 6 (40 мг).
HRMS (ESI) [M+H]+ вычислено: C18H19N6O2 351,15695; найдено: 351,15944.
MS (ESI) m/z: 351 (M+H)+.
1H-ЯМР (ДМСО-d6) δ: 1,29-1,38 (2H, м), 1,51-1,55 (2H, м), 2,08-2,13 (1H, м), 3,24-3,26 (2H, м), 3,80-3,85 (4H, м), 6,60 (1H, д, J=2,9 Гц), 7,92 (1H, м), 8,24 (1H, с), 8,40 (1H, с), 8,67 (1H, д, J=1,7 Гц), 11,70 (1H, с), 12,48 (1H, с).
(Пример 77)
6-(3-Амино-1H-пирроло[2,3-b]пиридин-5-ил)-1-(тетрагидро-2H-пиран-4-илметил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
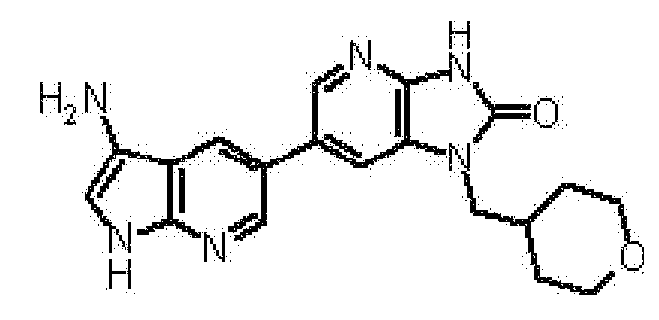
Стадия 1
[2-Оксо-1-(тетрагидро-2H-пиран-4-илметил)-2,3-дигидро-1H-имидазо[4,5-b]пиридин-6-ил]борная кислота
Указанное в заголовке соединение (0,98 г) получали способом, аналогичным применяемому на стадии 6 примера 35, используя соединение, полученное на стадии 4 примера 35 (1,56 г).
MS (ESI) m/z: 278 (M+H)+.
Стадия 2
Трет-бутил (5-бром-1H-пирроло[2,3-b]пиридин-3-ил)карбамат
Указанное в заголовке соединение (350 мг) получали в виде твердого вещества коричневого цвета способом, аналогичным применяемому на стадии 1 примера 35, используя 5-бром-1H-пирроло[2,3-b]пиридин-3-амин, полученный способом, описанным в WO 2003/028724 (300 мг).
MS (ESI) m/z: 312 (M+H)+.
1H-ЯМР (ДМСО-d6) δ: 1,49 (9H, с), 7,54 (1H, с), 8,23 (1H, д, J=2,3 Гц), 8,41 (1H, с), 9,34 (1H, с), 11,52 (1H, с).
Стадия 3
Трет-бутил {5-[2-оксо-1-(тетрагидро-2H-пиран-4-илметил)-2,3-дигидро-1H-имидазо[4,5-b]пиридин-6-ил]-1H-пирроло[2,3-b]пиридин-3-ил}карбамат
Указанное в заголовке соединение (90 мг) получали в виде светло-желтого твердого вещества способом, аналогичным применяемому на стадии 3 примера 1, используя соединение, полученное на вышеуказанной стадии 2 (150 мг), и соединение, полученное на описанной выше стадии 1 (173 мг).
MS (ESI) m/z: 465 (M+H)+.
1H-ЯМР (ДМСО-d6) δ: 1,29-1,37 (2H, м), 1,50 (9H, с), 2,07-2,13 (1H, м), 3,22-3,36 (4H, м), 3,77 (2H, м), 3,82-3,85 (2H, м), 7,53 (1H, с), 7,85 (1H, д, J=1,7 Гц), 8,20 (1H, д, J=1,7 Гц), 8,49 (1H, с), 8,53 (1H, д, J=1,7 Гц), 9,34 (1H, с), 11,35 (1H, с), 11,61 (1H, с).
Стадия 4
6-(3-Амино-1H-пирроло[2,3-b]пиридин-5-ил)-1-(тетрагидро-2H-пиран-4-илметил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
В раствор соединения, полученного на описанной выше стадии 3 (90 мг), в дихлорметане при охлаждении льдом добавляли по каплям трифторуксусную кислоту (1 мл) и смесь перемешивали в течение 6 часов при постепенном нагревании до комнатной температуры. Реакционный раствор, разбавленный водой, промывали хлороформ. Водный слой нейтрализовали насыщенным водным раствором бикарбоната натрия и потом экстрагировали 10% смесью метанол/хлороформ три раза и органический слой сушили над безводным сульфатом натрия. Растворитель упаривали при пониженном давлении и полученное твердое вещество промывали этилацетатом с получением указанного в заголовке соединения (12 мг) в виде твердого вещества светло-желтого цвета.
HRMS (ESI) [M+H]+ вычислено: C19H21N6O2 365,17260; найдено: 365,17097.
MS (ESI) m/z: 365 (M+H)+.
1H-ЯМР (ДМСО-d6) δ: 1,27-1,38 (2H, м), 1,48-1,54 (2H, м), 2,05-2,16 (1H, м), 3,21-3,27 (2H, м), 3,76-3,79 (2H, м), 3,82-3,84 (2H, м), 4,35 (2H, ушир. с), 6,71 (1H, д, J=1,8 Гц), 7,86 (1H, д, J=1,8 Гц), 8,20 (1H, д, J=1,8 Гц), 8,23 (1H, д, J=2,3 Гц), 8,44 (1H, д, J=2,3 Гц), 10,72 (1H, с), 11,59 (1H, с).
(Пример 78)
6-(6-Хлор-1H-пирроло[2,3-b]пиридин-5-ил)-1-(тетрагидро-2H-пиран-4-илметил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
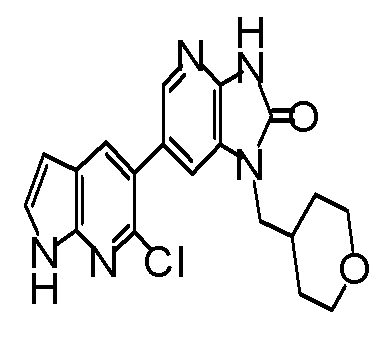
Стадия 1
5-Бром-6-хлорпиридин-2-амин
6-Хлорпиридин-2-амин (2,0 г) растворяли в ацетонитриле (40 мл). Добавляли N-бромсукцинимид (3,1 г) и смесь перемешивали в условиях затемнения при комнатной температуре в течение 13 часов. Реакционный раствор концентрировали и полученный остаток очищали хроматографией на колонке с силикагелем (элюируя смесью этилацетат-гексан) с получением указанного в заголовке соединения (2,8 г).
MS (ESI) m/z: 207 (M+H)+.
Стадия 2
5-Бром-6-хлор-3-йодпиридин-2-амин
Указанное в заголовке соединение (1,8 г) получали способом, аналогичным применяемому на стадии 1 примера 36, используя соединение, полученное на вышеуказанной стадии 1 (1,4 г).
MS (ESI) m/z: 333 (M+H)+.
1H-ЯМР (CDCl3) δ: 5,05 (2H, ушир. с), 7,99 (1H, с).
Стадия 3
5-Бром-6-хлор-3-[(триметилсилил)этинил]пиридин-2-амин
Указанное в заголовке соединение (1,8 г) получали способом, аналогичным применяемому на стадии 2 примера 36, используя соединение, полученное на вышеуказанной стадии 2 (1,8 г).
MS (ESI) m/z: 303 (M+H)+.
1H-ЯМР (CDCl3) δ: 0,26 (9H, с), 5,11 (2H, ушир. с), 7,70 (1H, с).
Стадия 4
N-{5-Бром-6-хлор-3-[(триметилсилил)этинил]пиридин-2-ил}ацетамид
Соединение, полученное на описанной выше стадии 3 (1,6 г), растворяли в пиридине (0,8 мл) и дихлорметане (11 мл). Медленно при охлаждении льдом добавляли по каплям ацетилхлорид (0,4 мл) и потом смесь нагревали до комнатной температуры и перемешивали в течение 4 часов. К реакционному раствору добавляли воду. Органический слой отделяли и сушили над безводным сульфатом натрия и растворитель упаривали. Полученный остаток очищали хроматографией на колонке с силикагелем (элюируя смесью этилацетат-гексан) с получением указанного в заголовке соединения (0,95 г).
MS (ESI) m/z: 345 (M+H)+.
1H-ЯМР (CDCl3) δ: 0,29 (9H, с), 2,53 (3H, с), 7,90 (1H, с), 8,02 (1H, с).
Стадия 5
5-Бром-6-хлор-1H-пирроло[2,3-b]пиридин
Соединение, полученное на описанной выше стадии 4 (0,95 г), растворяли в тетрагидрофуране (15 мл). Добавляли флуорид тетрабутиламмония (1,0 M раствор в тетрагидрофуран) (5,5 мл) и смесь нагревали с обратным холодильником в течение 1,5 часов. Реакционный раствор охлаждали до комнатной температуры и потом тетрагидрофуран отгоняли. Остаток распределяли между этилацетатом и водой. Органический слой сушили над безводным сульфатом натрия и растворитель упаривали. Полученное твердое вещество собирали фильтрованием из хлороформа с получением указанного в заголовке соединения (0,4 г).
MS (ESI) m/z: 231 (M+H)+.
1H-ЯМР (ДМСО-d6) δ: 6,47-6,49 (1H, м), 7,59-7,59 (1H, м), 8,40-8,42 (1H, м), 12,04-12,06 (1H, м).
Стадия 6
6-(6-Хлор-1H-пирроло[2,3-b]пиридин-5-ил)-1-(тетрагидро-2H-пиран-4-илметил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (11 мг) получали способом, аналогичным применяемому на стадии 3 примера 1, используя соединение, полученное на стадии 1 примера 77 (31 мг), и соединение, полученное на описанной выше стадии 5 (26 мг).
MS (ESI) m/z: 384 (M+H)+.
HRMS (ESI) [M+H]+ вычислено: C19H19ClN5O2 384,12273; найдено: 384,12511.
1H-ЯМР (ДМСО-d6) δ: 1,24-1,32 (2H, м), 1,45-1,51 (2H, м), 1,99-2,07 (1H, м), 3,22 (2H, т, J=11,2 Гц), 3,68-3,74 (2H, м), 3,80-3,83 (2H, м), 6,54 (1H, д, J=3,4 Гц), 7,58-7,59 (1H, м), 7,69 (1H, с), 7,97 (1H, д, J=1,7 Гц), 8,07 (1H, с), 11,67 (1H, с), 11,96 (1H, ушир. с).
(Пример 79)
6-(6-Фтор-1H-пирроло[2,3-b]пиридин-5-ил)-1-(тетрагидро-2H-пиран-4-илметил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
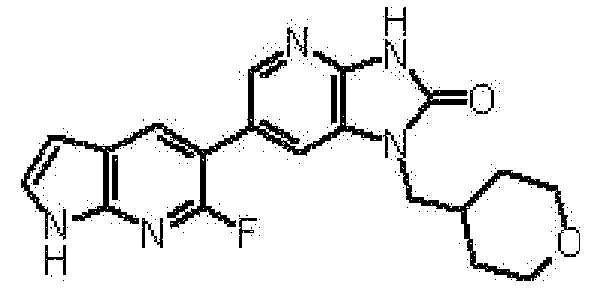
Стадия 1
5-Бром-6-фтор-3-йодпиридин-2-амин
Указанное в заголовке соединение (1,7 г) получали способом, аналогичным применяемому на стадии 1 примера 36, используя 5-бром-6-фторпиридин-2-амин, полученный способом, описанным в US 2008/221149 (1,3 г).
MS (ESI) m/z: 316 (M+H)+.
1H-ЯМР (CDCl3) δ: 5,01 (2H, ушир. с), 7,99 (1H, д, J=8,3 Гц).
Стадия 2
5-Бром-6-фтор-3-[(триметилсилил)этинил]пиридин-2-амин
Указанное в заголовке соединение (0,7 г) получали способом, аналогичным применяемому на стадии 2 примера 36, используя 5-бром-6-фтор-3-йодпиридин-2-амин, полученный на вышеуказанной стадии 1 (1,3 г).
MS (ESI) m/z: 287 (M+H)+.
1H-ЯМР (CDCl3) δ: 0,27 (9H, с), 5,11 (2H, ушир. с), 7,74 (1H, д, J=8,5 Гц).
Стадия 3
N-{5-Бром-6-фтор-3-[(триметилсилил)этинил]пиридин-2-ил}ацетамид
Указанное в заголовке соединение (165 мг) получали способом, аналогичным применяемому на стадии 4 примера 78, используя соединение, полученное на вышеуказанной стадии 2 (707 мг).
MS (ESI) m/z: 329 (M+H)+.
1H-ЯМР (CDCl3) δ: 0,29 (9H, с), 2,52 (3H, с), 7,95 (1H, д, J=8,3 Гц), 8,07 (1H, ушир. с).
Стадия 4
5-Бром-6-фтор-1H-пирроло[2,3-b]пиридин
Указанное в заголовке соединение (81 мг) получали способом, аналогичным применяемому на стадии 5 примера 78, используя соединение, полученное на вышеуказанной стадии 3 (165 мг).
MS (ESI) m/z: 215 (M+H)+.
1H-ЯМР (CDCl3) δ: 6,48-6,49 (1H, м), 7,26-7,29 (1H, м), 8,17 (1H, д, J=8,5 Гц), 8,63 (1H, ушир. с).
Стадия 5
6-(6-Фтор-1H-пирроло[2,3-b]пиридин-5-ил)-1-(тетрагидро-2H-пиран-4-илметил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (78 мг) получали способом, аналогичным применяемому на стадии 3 примера 1, используя соединение, полученное на стадии 1 примера 77 (119 мг), и 5-бром-6-фтор-1H-пирроло[2,3-b]пиридин, полученный на вышеуказанной стадии 4 (77 мг).
MS (ESI) m/z: 368 (M+H)+.
HRMS (ESI) [M+H]+ вычислено: C19H19FN5O2 368,15228; найдено: 368,15482.
1H-ЯМР (ДМСО-d6) δ: 1,26-1,35 (2H, м), 1,50 (2H, д, J=13,7 Гц), 2,04-2,10 (1H, м), 3,23 (2H, т, J=11,7 Гц), 3,74-3,76 (2H, м), 3,81-3,84 (2H, м), 6,56 (1H, с), 7,49-7,51 (1H, м), 7,78 (1H, с), 8,10 (1H, с), 8,23-8,26 (1H, м), 11,66 (1H, ушир. с), 11,87 (1H, ушир. с).
(Пример 80)
5-[2-Оксо-1-(тетрагидро-2H-пиран-4-илметил)-2,3-дигидро-1H-имидазо[4,5-b]пиридин-6-ил]-1H-индол-2-карбоновая кислота
Стадия 1
Бензил 5-бром-1H-индол-2-карбоксилат
В раствор 5-бром-1H-индол-2-карбоновой кислоты (161 мг) в ацетонитриле (3,5 мл) добавляли бензилбромид (160 мкл) и 1,8-диазабицикло[5,4,0]ундец-7-ен (201 мкл) при комнатной температуре, затем перемешивали в течение 22,5 часов. Реакционный раствор концентрировали и разделяли добавлением этилацетата и дистиллированной воды. Полученный органический слой промывали насыщенным солевым раствором и сушили над безводным сульфатом натрия. Растворитель упаривали при пониженном давлении. Полученный остаток кристаллизовали из смеси дихлорметан-гексан, собирали фильтрованием и промывали гексаном. Это вещество сушили при пониженном давлении с получением указанного в заголовке соединения (189 мг).
MS (ESI) m/z: 328 (M+H)+.
1H-ЯМР (CDCl3) δ: 5,39 (2H, с), 7,18-7,21 (1H, м), 7,27-7,31 (1H, м), 7,34-7,48 (6H, м), 7,81-7,83 (1H, м), 8,91 (1H, ушир. с).
Стадия 2
2-Бензил 1-трет-бутил 5-бром-1H-индол-1,2-дикарбоксилат
Указанное в заголовке соединение (225 мг) получали способом, аналогичным применяемому на стадии 1 примера 35, используя бензил 5-бром-1H-индол-2-карбоксилат, полученный на вышеуказанной стадии 1 (184 мг).
1H-ЯМР (CDCl3) δ: 5,35 (2H, с), 7,03-7,05 (1H, м), 7,32-7,41 (3H, м), 7,41-7,45 (2H, м), 7,46-7,51 (1H, м), 7,70-7,73 (1H, м), 7,98-7,93 (1H, м).
Стадия 3
2-Бензил 1-трет-бутил 5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-индол-1,2-дикарбоксилат
Указанное в заголовке соединение (150 мг) получали способом, аналогичным применяемому на стадии 1 примера 27, используя соединение, полученное на вышеуказанной стадии 2 (220 мг).
1H-ЯМР (CDCl3) δ: 1,36 (13H, с), 1,57 (9H, с), 5,36 (2H, д, J=1,8 Гц), 7,14 (1H, д, J=1,8 Гц), 7,31-7,42 (3H, м), 7,45 (2H, д, J=7,3 Гц), 7,84 (1H, д, J=8,3 Гц), 8,05 (1H, д, J=8,3 Гц), 8,08 (1H, с).
Стадия 4
Бензил 5-[2-оксо-1-(тетрагидро-2H-пиран-4-илметил)-2,3-дигидро-1H-имидазо[4,5-b]пиридин-6-ил]-1H-индол-2-карбоксилат
Указанное в заголовке соединение (52 мг) получали способом, аналогичным применяемому на стадии 1 примера 3, используя соединение, полученное на вышеуказанной стадии 3 (150 мг), и соединение, полученное на стадии 1 примера 4 (98 мг).
MS (ESI) m/z: 483 (M+H)+.
HRMS (ESI) [M+H]+ вычислено: C28H27N4O4 483,20323; найдено: 483,20082.
1H-ЯМР (ДМСО-d6) δ: 1,20-1,37 (2H, м), 1,42-1,54 (3H, м), 2,00-2,14 (1H, м), 3,16-3,30 (2H, м), 3,76 (2H, д, J=7,3 Гц), 3,78-3,85 (2H, м), 5,39 (2H, с), 7,24-7,27 (1H, м), 7,33-7,45 (3H, м), 7,47-7,52 (3H, м), 7,54 (1H, д, J=8,7 Гц), 7,61 (1H, дд, J=8,7, 1,8 Гц), 7,82 (1H, д, J=2,3 Гц), 7,95 (1H, с), 8,19 (1H, д, J=1,8 Гц), 11,56 (1H, ушир. с), 12,00 (1H, ушир. с).
Стадия 5
5-[2-Оксо-1-(тетрагидро-2H-пиран-4-илметил)-2,3-дигидро-1H-имидазо[4,5-b]пиридин-6-ил]-1H-индол-2-карбоновая кислота
В раствор соединения, полученного на описанной выше стадии 4 (49 мг), в этаноле (6 мл) добавляли смесь 4 н. соляной кислоты и диоксана (1 мл) и 10% катализатор - палладий на угле (30 мг), и смесь перемешивали в атмосфере водорода в течение 21 часа. Катализатор отфильтровывали. После промывания этанолом фильтрат концентрировали при пониженном давлении. Полученный остаток очищали тонкослойной хроматографией (элюируя смесью метанол-вода-хлороформ) с получением указанного в заголовке соединения (39 мг).
MS (ESI) m/z: 393 (M+H)+.
HRMS (ESI) [M+H]+ вычислено: C21H21N4O4 393,15628; найдено: 363,15310.
1H-ЯМР (ДМСО-d6) δ: 1,19-1,38 (2H, м), 1,42-1,54 (2H, м), 1,99-2,15 (1H, м), 3,18-3,31 (2H, м), 3,72-3,86 (4H, м), 6,71 (1H, с), 7,36-7,47 (2H, м), 7,79-7,81 (2H, м), 8,17 (1H, с), 11,01 (1H, ушир. с), 11,50 (1H, ушир. с).
(Пример 81)
5-[2-Оксо-1-(тетрагидро-2H-пиран-4-илметил)-2,3-дигидро-1H-имидазо[4,5-b]пиридин-6-ил]-1H-индол-3-карбальдегид
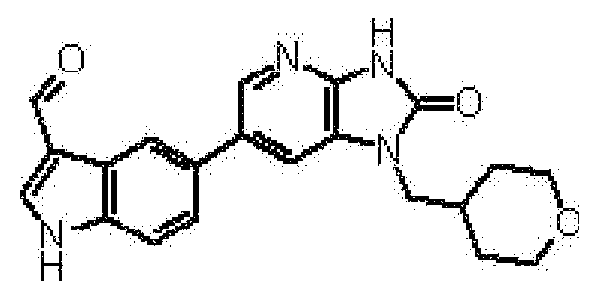
Стадия 1
5-(4,4,5,5-Тетраметил-1,3,2-диоксаборолан-2-ил)-1H-индол-3-карбальдегид
Указанное в заголовке соединение (0,65 г) получали способом, аналогичным применяемому на стадии 1 примера 27, используя 5-бром-1H-индол-3-карбальдегид (1,5 г).
MS (ESI) m/z: 272 (M+H)+.
1H-ЯМР (CDCl3) δ: 1,37 (11H, с), 7,43 (1H, д, J=8,3 Гц), 7,77 (1H, д, J=8,3 Гц), 7,86 (1H, д, J=2,8 Гц), 8,81 (1H, с), 8,83 (1H, ушир. с), 10,11 (1H, с).
Стадия 2
5-[2-Оксо-1-(тетрагидро-2H-пиран-4-илметил)-2,3-дигидро-1H-имидазо[4,5-b]пиридин-6-ил]-1H-индол-3-карбальдегид
Указанное в заголовке соединение (128 мг) получали способом, аналогичным применяемому на стадии 3 примера 1, используя соединение, полученное на вышеуказанной стадии 1 (150 мг), и соединение, полученное на стадии 1 примера 4 (173 мг).
HRMS (ESI) [M+H]+ вычислено: C21H21N4O3 377,16136; найдено: 377,16065.
1H-ЯМР (ДМСО-d6) δ: 1,19-1,32 (2H, м), 1,41-1,49 (2H, м), 1,98-2,11 (1H, м), 3,16-3,25 (2H, м), 3,95-3,97 (4H, м), 7,56 (1H, дд, J=8,3, 2,0 Гц), 7,62 (1H, д, J=8,6 Гц), 7,77 (1H, д, J=1,7 Гц), 8,16 (1H, д, J=2,3 Гц), 8,27 (1H, с), 8,31-8,28 (1H, м), 9,89 (1H, с).
(Пример 82)
6-(1H-Пирроло[3,2-b]пиридин-5-ил)-1-(тетрагидро-2H-пиран-4-илметил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
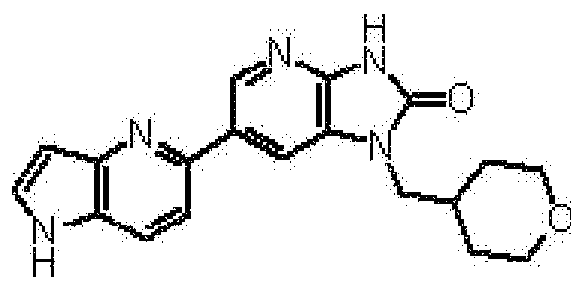
Стадия 1
Трет-бутил 5-хлор-1H-пирроло[3,2-b]пиридин-1-карбоксилат
Указанное в заголовке соединение (839 мг) получали способом, аналогичным применяемому на стадии 1 примера 35, используя 5-хлор-1H-пирроло[3,2-b]пиридин (600 мг).
1H-ЯМР (CDCl3) δ: 1,68 (9H, с), 6,71 (1H, дд, J=3,7, 0,6 Гц), 7,24 (1H, д, J=8,5 Гц), 7,83 (1H, д, J=3,7 Гц), 8,31-8,33 (1H, м).
Стадия 2
3-Циклогекс-1-ен-1-ил-6-(1H-пирроло[3,2-b]пиридин-5-ил)-1-(тетрагидро-2H-пиран-4-илметил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (95 мг) получали способом, аналогичным применяемому на стадии 3 примера 1, используя соединение, полученное на вышеуказанной стадии 1 (79 мг), и соединение, полученное на стадии 4 примера 35 (130 мг).
MS (ESI) m/z: 430 (M+H)+.
1H-ЯМР (CDCl3) δ: 1,45-1,54 (2H, м), 1,61-1,69 (2H, м), 1,73-1,82 (2H, м), 1,86-1,92 (2H, м), 2,15-2,28 (1H, м), 2,30-2,38 (2H, м), 2,46-2,54 (2H, м), 3,31-3,41 (2H, м), 3,87 (2H, д, J=7,3 Гц), 3,93-4,02 (2H, м), 6,05-6,11 (1H, м), 6,85 (1H, с), 7,49-7,54 (1H, м), 7,59 (1H, д, J=8,7 Гц), 7,79 (1H, д, J=8,7 Гц), 8,04 (1H, д, J=1,8 Гц), 8,33 (1H, ушир. с), 8,59 (1H, д, J=1,8 Гц).
Стадия 3
6-(1H-Пирроло[3,2-b]пиридин-5-ил)-1-(тетрагидро-2H-пиран-4-илметил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (30 мг) получали способом, аналогичным применяемому на стадии 6 примера 35, используя соединение, полученное на вышеуказанной стадии 2 (90 мг).
MS (ESI) m/z: 350 (M+H)+.
HRMS (ESI) [M+H]+ вычислено: C19H20N5O2 350,16170; найдено: 350,16064.
1H-ЯМР (ДМСО-d6) δ: 1,26-1,40 (2H, м), 1,47-1,57 (2H, м), 2,01-2,16 (1H, м), 3,20-3,29 (2H, м), 3,76-3,88 (4H, м), 6,60-6,64 (1H, м), 7,66-7,69 (1H, м), 7,73 (1H, д, J=8,7 Гц), 7,86 (1H, д, J=8,7 Гц), 8,12 (1H, д, J=1,8 Гц), 8,63 (1H, д, J=1,8 Гц), 11,35 (1H, ушир. с), 11,62 (1H, ушир. с).
(Пример 83)
6-(1H-Пирроло[2,3-c]пиридин-5-ил)-1-(тетрагидро-2H-пиран-4-илметил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
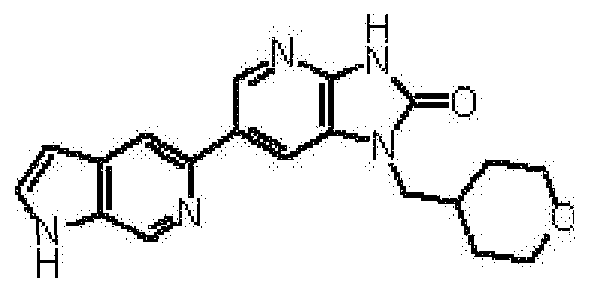
Стадия 1
Трет-бутил 5-хлор-1H-пирроло[2,3-c]пиридин-1-карбоксилат
Указанное в заголовке соединение (811 мг) получали способом, аналогичным применяемому на стадии 1 примера 35, используя 5-хлор-1H-пирроло[2,3-c]пиридин (583 мг).
1H-ЯМР (CDCl3) δ: 1,69 (9H, с), 6,55 (1H, д, J=3,7 Гц), 7,50-7,51 (1H, м), 7,77-7,78 (1H, м), 9,14 (1H, с).
Стадия 2
3-Циклогекс-1-ен-1-ил-6-(1H-пирроло[2,3-c]пиридин-5-ил)-1-(тетрагидро-2H-пиран-4-илметил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (79 мг) получали способом, аналогичным применяемому на стадии 3 примера 1, используя соединение, полученное на вышеуказанной стадии 1 (85 мг), и соединение, полученное на стадии 4 примера 35 (140 мг).
MS (ESI) m/z: 430 (M+H)+.
1H-ЯМР (CDCl3) δ: 1,43-1,57 (4H, м), 1,73-1,81 (2H, м), 1,86-1,94 (2H, м), 2,13-2,27 (1H, м), 2,30-2,38 (2H, м), 2,47-2,55 (2H, м), 3,31-3,41 (2H, м), 3,85 (2H, д, J=7,3 Гц), 3,93-4,01 (2H, м), 6,06-6,10 (1H, м), 6,67 (3H, д, J=3,2 Гц), 7,45 (1H, д, J=3,2 Гц), 7,98-7,93 (2H, м), 8,61 (1H, д, J=1,8 Гц), 8,67 (1H, ушир. с), 8,92 (1H, с).
Стадия 3
6-(1H-Пирроло[2,3-c]пиридин-5-ил)-1-(тетрагидро-2H-пиран-4-илметил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (58 мг) получали способом, аналогичным применяемому на стадии 6 примера 35, используя соединение, полученное на вышеуказанной стадии 2 (78 мг).
MS (ESI) m/z: 350 (M+H)+.
HRMS (ESI) [M+H]+ вычислено: C19H20N5O2 350,16170; найдено: 350,16216.
1H-ЯМР (ДМСО-d6) δ: 1,22-1,39 (2H, м), 1,45-1,58 (2H, м), 2,02-2,16 (1H, м), 3,21-3,29 (2H, м), 3,79 (2H, д, J=7,4 Гц), 3,81-3,87 (2H, м), 6,54-6,58 (1H, м), 7,62-7,66 (1H, м), 8,12 (1H, д, J=2,9 Гц), 8,15 (1H, с), 8,65 (1H, д, J=2,3 Гц), 8,84 (1H, с), 11,57 (1H, ушир. с), 11,63 (1H, ушир. с).
(Пример 84)
1-(Тетрагидро-2H-пиран-4-илметил)-6-[3-(трифторметил)-1H-пирроло[2,3-b]пиридин-5-ил]-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
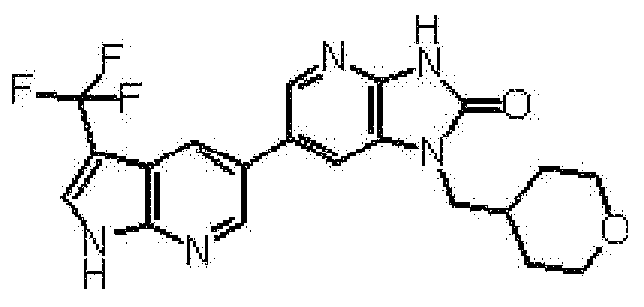
Стадия 1
5-Бром-1-[(4-метилфенил)сульфонил]-3-(трифторметил)-1H-пирроло[2,3-b]пиридин
5-Бром-3-йод-1-[(4-метилфенил)сульфонил]-1H-пирроло[2,3-b]пиридин, полученный способом, описанным в WO 2006/015123 (240 мг), растворяли в N,N-диметилформамиде (5 мл). Добавляли йодид меди (96 мг) и метил дифтор(фторсульфонил)ацетат (0,254 мл) и смесь перемешивали с нагреванием при 80°C в течение 18 часов. Реакционный раствор разбавляли этилацетатом и нерастворимое вещество разделяли фильтрованием. Фильтрат промывали насыщенным солевым раствором, насыщенным водным раствором бикарбоната натрия и вновь насыщенным солевым раствором. Органический слой сушили над безводным сульфатом натрия и растворитель упаривали. Полученный остаток очищали хроматографией на колонке с силикагелем (элюируя смесью этилацетат-гексан) с получением указанного в заголовке соединения (140 мг).
MS (ESI) m/z: 419 (M+H)+.
1H-ЯМР (CDCl3) δ: 2,43 (3H, с), 7,36 (2H, д, J=8,5 Гц), 8,13 (4H, м), 8,56 (1H, д, J=2,2 Гц).
Стадия 2
3-Циклогекс-1-ен-1-ил-6-{1-[(4-метилфенил)сульфонил]-3-(трифторметил)-1H-пирроло[2,3-b]пиридин-5-ил}-1-(тетрагидро-2H-пиран-4-илметил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (74 мг) получали способом, аналогичным применяемому на стадии 3 примера 1, используя соединение, полученное на вышеуказанной стадии 1 (122 мг), и соединение, полученное на стадии 4 примера 35 (120 мг).
MS (ESI) m/z: 652 (M+H)+.
1H-ЯМР (CDCl3) δ: 1,24-1,34 (2H, м), 1,41-1,54 (2H, м), 1,72-1,81 (2H, м), 1,86-1,93 (3H, м), 2,07-2,22 (1H, м), 2,29-2,37 (2H, м), 2,42 (3H, с), 2,44-2,52 (2H, м), 3,31-3,41 (2H, м), 3,83 (2H, д, J=6,9 Гц), 3,93-4,03 (2H, м), 6,04-6,09 (1H, м), 7,27 (1H, д, J=2,8 Гц), 7,36 (2H, д, J=8,3 Гц), 8,05-8,08 (1H, м), 8,20-8,15 (3H, м), 8,22 (1H, д, J=2,3 Гц), 8,68 (1H, д, J=1,8 Гц).
Стадия 3
3-Циклогекс-1-ен-1-ил-1-(тетрагидро-2H-пиран-4-илметил)-6-[3-(трифторметил)-1H-пирроло[2,3-b]пиридин-5-ил]-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
В раствор соединения, полученного на описанной выше стадии 2 (72 мг), в тетрагидрофуране (1 мл) добавляли флуорид тетрабутиламмония (1,0 M раствор в тетрагидрофуране) (280 мкл) и смесь перемешивали при комнатной температуре в течение 2 часов. Реакционный раствор концентрировали при пониженном давлении. Полученный остаток очищали тонкослойной хроматографией (элюируя смесью метанол-дихлорметан) с получением указанного в заголовке соединения (29 мг).
MS (ESI) m/z: 498 (M+H)+.
1H-ЯМР (CDCl3) δ: 1,46-1,55 (2H, м), 1,60-1,69 (2H, м), 1,74-1,82 (2H, м), 1,87-1,96 (2H, м), 2,11-2,26 (1H, м), 2,30-2,39 (2H, м), 2,46-2,54 (2H, м), 3,37 (2H, т, J=11,2 Гц), 3,85 (2H, д, J=7,3 Гц), 3,95-4,03 (2H, м), 6,08 (1H, с), 7,34-7,38 (1H, м), 7,75 (1H, с), 8,18 (1H, с), 8,26-8,30 (1H, м), 8,57-8,61 (1H, м), 9,32 (1H, ушир. с).
Стадия 4
1-(Тетрагидро-2H-пиран-4-илметил)-6-[3-(трифторметил)-1H-пирроло[2,3-b]пиридин-5-ил]-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (19 мг) получали способом, аналогичным применяемому на стадии 6 примера 35, используя соединение, полученное на вышеуказанной стадии 3 (28 мг).
MS (ESI) m/z: 418 (M+H)+.
HRMS (ESI) [M+H]+ вычислено: C20H19F3N5O2 418,14908; найдено: 418,14801.
1H-ЯМР (ДМСО-d6) δ: 1,22-1,39 (2H, м), 1,45-1,55 (2H, м), 2,03-2,18 (1H, м), 3,19-3,29 (2H, м), 3,74-3,86 (4H, м), 7,95 (1H, д, J=1,8 Гц), 8,21-8,25 (2H, м), 8,26 (1H, д, J=1,8 Гц), 8,71 (1H, д, J=1,8 Гц), 11,66 (1H, ушир. с).
(Пример 85)
6-(3-Ацетил-1H-пирроло[2,3-b]пиридин-5-ил)-1-(тетрагидро-2H-пиран-4-илметил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
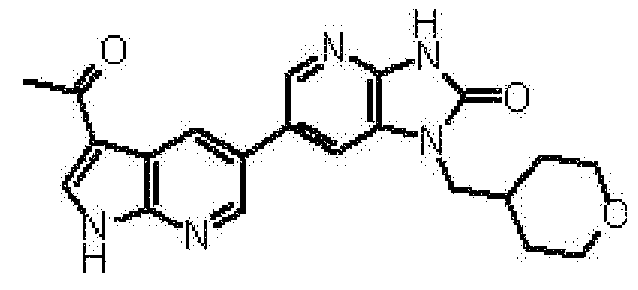
Стадия 1
1-(5-Бром-1H-пирроло[2,3-b]пиридин-3-ил)этанон
В раствор 5-бром-1H-пирроло[2,3-b]пиридина (250 мг) в дихлорметане (5 мл) при комнатной температуре в течение 10 минут добавляли трихлорид алюминия (846 мг). Затем добавляли ацетил хлорид (135 мкл) и смесь перемешивали при комнатной температуре в течение 5 часов. Реакционный раствор выливали в ледяную воду и разделяли добавлением дихлорметана. Полученный органический слой промывали насыщенным солевым раствором и сушили над безводным сульфатом натрия. Растворитель упаривали при пониженном давлении. Полученный остаток очищали хроматографией на колонке с силикагелем (элюируя смесью метанол-хлороформ) с получением указанного в заголовке соединения (186 мг).
MS (ESI) m/z: 239 (M+H)+.
1H-ЯМР (CDCl3) δ: 2,55 (3H, с), 7,98 (1H, д, J=2,8 Гц), 8,45 (1H, д, J=2,3 Гц), 8,85 (1H, д, J=1,8 Гц), 10,28 (1H, ушир. с).
Стадия 2
6-(3-Ацетил-1H-пирроло[2,3-b]пиридин-5-ил)-3-циклогекс-1-ен-1-ил-1-(тетрагидро-2H-пиран-4-илметил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (26 мг) получали способом, аналогичным применяемому на стадии 3 примера 1, используя соединение, полученное на вышеуказанной стадии 1 (65 мг), и соединение, полученное на стадии 4 примера 35 (113 мг).
MS (ESI) m/z: 472 (M+H)+.
1H-ЯМР (CDCl3) δ: 1,43-1,54 (2H, м), 1,61-1,70 (2H, м), 1,74-1,83 (2H, м), 1,86-1,96 (2H, м), 2,11-2,25 (1H, м), 2,31-2,38 (2H, м), 2,47-2,54 (2H, м), 2,59 (3H, д, J=2,8 Гц), 3,32-3,43 (2H, м), 3,82-3,89 (2H, м), 3,94-4,04 (2H, м), 6,05-6,12 (1H, м), 7,41 (1H, д, J=1,8 Гц), 8,01-8,06 (1H, м), 8,29-8,33 (1H, м), 8,59 (1H, с), 8,84-8,88 (1H, м), 9,63 (1H, ушир. с).
Стадия 3
6-(3-Ацетил-1H-пирроло[2,3-b]пиридин-5-ил)-1-(тетрагидро-2H-пиран-4-илметил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (5 мг) получали способом, аналогичным применяемому на стадии 6 примера 35, используя соединение, полученное на вышеуказанной стадии 2 (25 мг).
MS (ESI) m/z: 392 (M+H)+.
HRMS (ESI) [M+H]+ вычислено: C21H22N5O3 392,17226; найдено: 392,17437.
1H-ЯМР (ДМСО-d6) δ: 1,27-1,38 (2H, м), 1,46-1,55 (2H, м), 2,03-2,17 (1H, м), 3,19-3,28 (2H, м), 3,79 (2H, д, J=7,4 Гц), 3,80-3,86 (2H, м), 7,74 (1H, д, J=2,9 Гц), 7,97 (1H, д, J=1,7 Гц), 8,18 (1H, д, J=1,7 Гц), 8,28 (1H, д, J=1,7 Гц), 8,65 (1H, д, J=2,3 Гц), 11,63 (1H, ушир. с), 12,09 (1H, ушир. с).
(Пример 86)
6-[2-(Этоксиметил)-1H-пирроло[2,3-b]пиридин-5-ил]-1-(тетрагидро-2H-пиран-4-илметил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
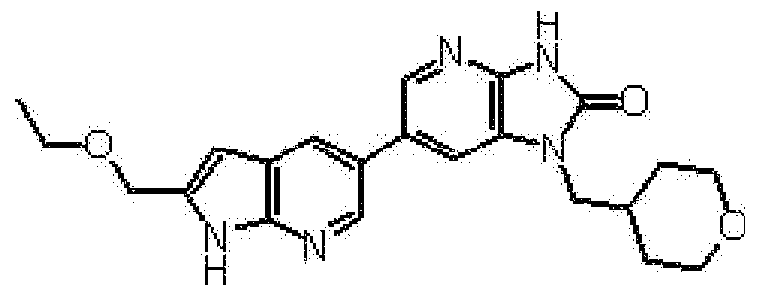
Стадия 1
5-Бром-3-(3-{[трет-бутил(диметил)силил]окси}проп-1-ин-1-ил)пиридин-2-амин
В раствор дихлорида бис(трифенилфосфин)палладия(II) (105 мг) в триэтиламине (10,4 мл) добавляли йодид меди (57 мг) и смесь нагревали с обратным холодильником в течение 15 минут. Реакционный раствор охлаждали до 40°C. Добавляли трет-бутил(диметил)(пропин-2-ин-1-илокси)силан (752 мг) и затем 5-бром-3-йодпиридин-2-амин (896 мг) и смесь перемешивали при такой же температуре в течение одного часа. Растворитель упаривали при пониженном давлении и полученный остаток разделяли добавлением этилацетата и дистиллированной воды. Полученный органический слой промывали 10% водным раствором лимонной кислоты и насыщенным солевым раствором и сушили над безводным сульфатом натрия. Растворитель упаривали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (элюируя смесью этилацетат-гексан) с получением указанного в заголовке соединения (606 мг).
MS (ESI) m/z: 341 (M+H)+.
1H-ЯМР (CDCl3) δ: 0,16 (6H, с), 0,93 (9H, с), 4,56 (2H, с), 5,00 (2H, ушир. с), 7,59 (1H, д, J=2,3 Гц), 8,05 (1H, д, J=2,3 Гц).
Стадия 2
6-[2-({[Трет-бутил(диметил)силил]окси}метил)-1H-пирроло[2,3-b]пиридин-5-ил]-3-циклогекс-1-ен-1-ил-1-(тетрагидро-2H-пиран-4-илметил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (64 мг) получали способом, аналогичным применяемому на стадии 3 примера 1, используя соединение, полученное на вышеуказанной стадии 1 (114 мг), и соединение, полученное на стадии 4 примера 35 (140 мг).
MS (ESI) m/z: 574 (M+H)+.
1H-ЯМР (CDCl3) δ: 0,15 (6H, с), 0,96 (9H, с), 1,44-1,69 (4H, м), 1,74-1,83 (2H, м), 1,86-1,96 (2H, м), 2,11-2,25 (1H, м), 2,30-2,39 (2H, м), 2,45-2,54 (2H, м), 3,31-3,42 (2H, м), 3,84 (2H, д, J=7,3 Гц), 3,95-4,04 (2H, м), 4,94 (2H, с), 6,04-6,10 (1H, м), 6,33-6,36 (1H, м), 7,36 (1H, д, J=1,8 Гц), 7,98 (1H, д, J=1,8 Гц), 8,28 (1H, д, J=1,8 Гц), 8,43 (1H, д, J=2,3 Гц), 8,90 (1H, ушир. с).
Стадия 3
6-[2-(Этоксиметил)-1H-пирроло[2,3-b]пиридин-5-ил]-1-(тетрагидро-2H-пиран-4-илметил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (9 мг) получали способом, аналогичным применяемому на стадии 6 примера 35, используя соединение, полученное на вышеуказанной стадии 2 (61 мг).
HRMS (ESI) [M+H]+ вычислено: C22H26N5O3 408,20356; найдено: 408,20579.
1H-ЯМР (CDCl3) δ: 1,24-1,31 (3H, м), 1,45-1,54 (2H, м), 1,61-1,68 (2H, м), 3,32-3,42 (2H, м), 3,57-3,66 (2H, м), 3,82 (2H, д, J=7,3 Гц), 3,94-4,03 (2H, м), 4,72 (2H, с), 6,44 (1H, с), 7,34-7,39 (1H, м), 8,00-8,02 (1H, м), 8,24-8,26 (1H, м), 8,44-8,47 (1H, м), 8,99 (1H, ушир. с).
(Пример 87)
6-(2,3-Диметил-1H-пирроло[2,3-b]пиридин-5-ил)-1-(тетрагидро-2H-пиран-4-илметил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
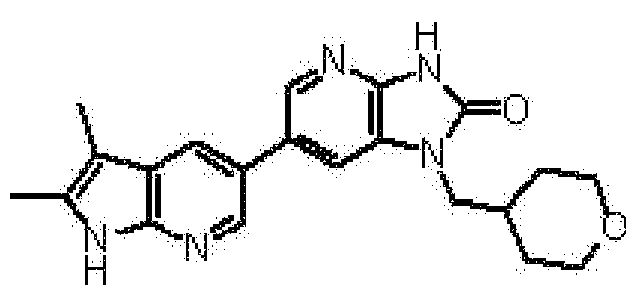
Стадия 1
5-Бром-2,3-диметил-1H-пирроло[2,3-b]пиридин
В раствор 5-бром-2-гидразинопиридина (1000 мг) в этаноле (10 мл) добавляли 2-бутанон (715 мкл) и смесь нагревали с обратным холодильником в течение 2 часов. Реакционный раствор концентрировали при пониженном давлении. Добавляли диэтиленгликоль (10 мл) и смесь нагревали с обратным холодильником в течение 23 часов. Реакционный раствор концентрировали при пониженном давлении и разделяли добавлением дихлорметана и дистиллированной воды. Полученный органический слой промывали насыщенным солевым раствором и сушили над безводным сульфатом натрия. Растворитель упаривали при пониженном давлении. Полученный остаток очищали хроматографией на колонке с силикагелем (элюируя смесью метанол-хлороформ) с получением указанного в заголовке соединения (104 мг).
1H-ЯМР (CDCl3) δ: 2,17 (3H, с), 2,40 (3H, с), 7,85 (1H, д, J=1,8 Гц), 8,20 (1H, д, J=1,8 Гц), 8,69 (1H, ушир. с).
Стадия 2
3-Циклогекс-1-ен-1-ил-6-(2,3-диметил-1H-пирроло[2,3-b]пиридин-5-ил)-1-(тетрагидро-2H-пиран-4-илметил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (37 мг) получали способом, аналогичным применяемому на стадии 3 примера 1, используя соединение, полученное на вышеуказанной стадии 1 (75 мг), и соединение, полученное на стадии 4 примера 35 (140 мг).
MS (ESI) m/z: 458 (M+H)+.
1H-ЯМР (CDCl3) δ: 1,42-1,58 (2H, м), 1,73-1,82 (2H, м), 1,85-1,99 (4H, м), 2,10-2,24 (1H, м), 2,27 (3H, с), 2,31-2,38 (2H, м), 2,44 (3H, с), 2,46-2,54 (2H, м), 3,31-3,42 (2H, м), 3,84 (2H, д, J=6,4 Гц), 3,93-4,03 (2H, м), 6,04-6,11 (1H, м), 7,34-7,38 (1H, м), 7,85 (1H, с), 8,26-8,30 (1H, м), 8,33-8,36 (1H, м), 8,54 (1H, ушир. с).
Стадия 3
6-(2,3-Диметил-1H-пирроло[2,3-b]пиридин-5-ил)-1-(тетрагидро-2H-пиран-4-илметил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (17 мг) получали способом, аналогичным применяемому на стадии 6 примера 35, используя соединение, полученное на вышеуказанной стадии 2 (37 мг).
MS (ESI) m/z: 378 (M+H)+.
HRMS (ESI) [M+H]+ вычислено: C21H24N5O2 378,19300; найдено: 378,19290.
1H-ЯМР (ДМСО-d6) δ: 1,22-1,38 (2H, м), 1,46-1,55 (2H, м), 2,04-2,15 (1H, м), 2,22 (3H, с), 2,34 (3H, с), 3,20-3,29 (2H, м), 3,78 (2H, д, J=7,4 Гц), 3,80-3,86 (2H, м), 7,89 (1H, д, J=1,7 Гц), 8,03 (1H, д, J=2,3 Гц), 8,23 (1H, д, J=1,7 Гц), 8,40 (1H, д, J=1,7 Гц), 11,29 (1H, с), 11,57 (1H, ушир. с).
(Пример 88)
6-(1H-Пирроло[3,2-b]пиридин-6-ил)-1-(тетрагидро-2H-пиран-4-илметил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
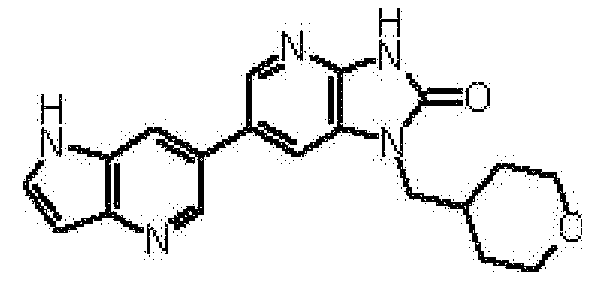
Указанное в заголовке соединение (33 мг) получали способом, аналогичным применяемому на стадии 3 примера 1, используя 6-бром-1H-пирроло[3,2-b]пиридин (100 мг) и соединение, полученное на стадии 1 примера 77 (118 мг).
MS (ESI) m/z: 350 (M+H)+.
HRMS (ESI) [M+H]+ вычислено: C19H19N5O2 350,16170; найдено: 350,1628.
1H-ЯМР (ДМСО-d6) δ: 1,21-1,39 (2H, м), 1,47-1,55 (2H, м), 2,03-2,17 (1H, м), 3,19-3,29 (2H, м), 3,78 (2H, д, J=7,3 Гц), 3,80-3,87 (2H, м), 6,61 (1H, с), 7,68-7,72 (1H, м), 7,94 (1H, д, J=1,8 Гц), 8,01-8,05 (1H, м), 8,26 (1H, д, J=1,8 Гц), 8,67 (1H, д, J=1,8 Гц), 11,46 (1H, ушир. с), 11,64 (1H, ушир. с).
(Пример 89)
6-{3-[(Диметиламино)метил]-1H-пирроло[2,3-b]пиридин-5-ил}-1-(тетрагидро-2H-пиран-4-илметил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
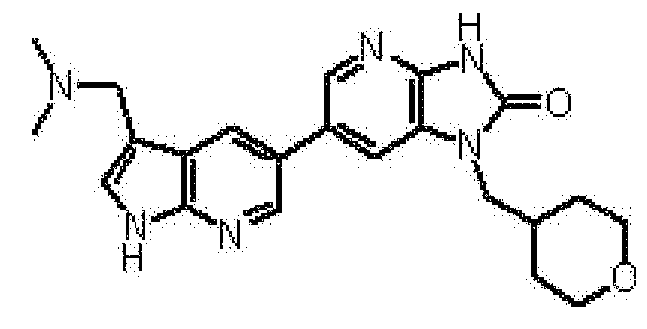
Стадия 1
3-Циклогекс-1-ен-1-ил-6-(1H-пирроло[2,3-b]пиридин-5-ил)-1-(тетрагидро-2H-пиран-4-илметил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (100 мг) получали способом, аналогичным применяемому на стадии 3 примера 1, используя соединение, полученное на стадии 4 примера 35 (200 мг), и 5-бром-1H-пирроло[2,3-b]пиридин (89 мг).
MS (ESI) m/z: 430 (M+H)+.
Стадия 2
3-Циклогекс-1-ен-1-ил-6-{3-[(диметиламино)метил]-1H-пирроло[2,3-b]пиридин-5-ил}-1-(тетрагидро-2H-пиран-4-илметил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
В раствор диметиламингидрохлорида (40 мг) в уксусной кислоте (0,5 мл) при охлаждении льдом добавляли формалин (34 мкл) и смесь перемешивали при такой же температуре в течение 10 минут. После нагревания до комнатной температуры добавляли 3-циклогекс-1-ен-1-ил-6-(1H-пирроло[2,3-b]пиридин-5-ил)-1-(тетрагидро-2H-пиран-4-илметил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он, полученный на вышеуказанной стадии 1 (100 мг), и смесь перемешивали при такой же температуре в течение 16 часов. Уксусную кислоту отгоняли при пониженном давлении и добавляли воду, затем экстрагировали хлороформом. Органический слой сушили над безводным сульфатом натрия. Растворитель упаривали при пониженном давлении. Полученный остаток очищали хроматографией на колонке с силикагелем (элюируя смесью метанол-хлороформ) с получением указанного в заголовке соединения (102 мг).
MS (ESI) m/z: 487 (M+H)+.
Стадия 3
6-{3-[(Диметиламино)метил]-1H-пирроло[2,3-b]пиридин-5-ил}-1-(тетрагидро-2H-пиран-4-илметил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (48 мг) получали способом, аналогичным применяемому на стадии 6 примера 35, используя соединение, полученное на вышеуказанной стадии 2 (102 мг).
MS (ESI) m/z: 407 (M+H)+.
HRMS (ESI) [(M+H)+] вычислено: C22H27N6O2 407,21955; найдено: 407,21458.
1H-ЯМР (ДМСО-d6) δ: 1,28-1,36 (2H, м), 1,51 (2H, д, J=10,9 Гц), 2,08-2,12 (1H, м), 2,18 (6H, с), 3,24 (2H, т, J=10,9 Гц), 3,61 (2H, с), 3,78-3,84 (4H, м), 7,40-7,42 (1H, м), 7,88-7,89 (1H, м), 8,20-8,21 (1H, м), 8,22-8,23 (1H, м), 8,52-8,53 (1H, м), 11,59 (1H, ушир. с), 11,61 (1H, ушир. с).
(Пример 90)
6-{3-Изопропил-1H-пирроло[2,3-b]пиридин-5-ил}-1-(тетрагидро-2H-пиран-4-илметил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
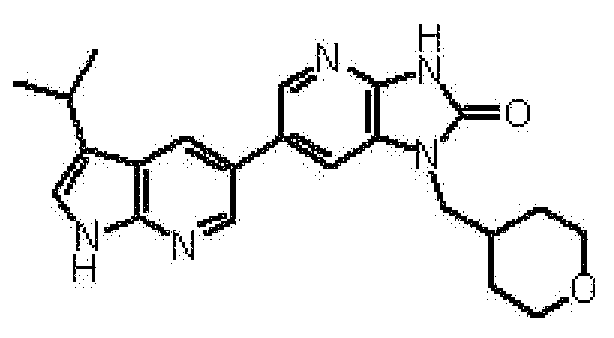
Стадия 1
5-Бром-3-изопропенил-1-[(4-метилфенил)сульфонил]-1H-пирроло[2,3-b]пиридин
5-Бром-3-йод-1-[(4-метилфенил)сульфонил]-1H-пирроло[2,3-b]пиридин, полученный способом, описанным в WO 2006/015123 (150 мг), растворяли в смешанном растворителе ацетонитрила (1,5 мл) и водном растворе карбоната натрия (2 M, 1,5 мл). Добавляли пинаколовый эфир изопропенил-бороновой кислоты (0,071 мл) и дихлорид бис(трифенилфосфин)палладия(II) (11 мг) и смесь нагревали с перемешиванием при 60°C в течение ночи и при 80°C в течение 7 часов в атмосфере азота в герметически закрытом сосуде. Реакционный раствор охлаждали до комнатной температуры, разбавляли этилацетатом и промывали насыщенным солевым раствором. Органический слой сушили над безводным сульфатом натрия и растворитель упаривали. Полученный остаток очищали тонкослойной хроматографией (элюируя смесью толуол) с получением указанного в заголовке соединения (53 мг).
MS (ESI) m/z: 391 (M+H)+.
1H-ЯМР (CDCl3) δ: 2,15-2,16 (3H, м), 2,38 (3H, с), 5,21-5,24 (1H, м), 5,40-5,42 (1H, м), 7,29 (2H, д, J=8,1 Гц), 7,71 (1H, с), 8,05 (2H, д, J=8,1 Гц), 8,22 (1H, д, J=2,2 Гц), 8,44 (1H, д, J=2,2 Гц).
Стадия 2
3-Циклогекс-1-ен-1-ил-6-{3-изопропенил-1-[(4-метилфенил)сульфонил]-1H-пирроло[2,3-b]пиридин-5-ил}-1-(тетрагидро-2H-пиран-4-илметил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (102 мг) получали способом, аналогичным применяемому на стадии 3 примера 1, используя соединение, полученное на стадии 4 примера 35 (100 мг), и соединение, полученное на описанной выше стадии 1 (88 мг).
MS (ESI) m/z: 624 (M+H)+.
Стадия 3
3-Циклогекс-1-ен-1-ил-6-{3-изопропенил-1H-пирроло[2,3-b]пиридин-5-ил}-1-(тетрагидро-2H-пиран-4-илметил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (50 мг) получали способом, аналогичным применяемому на стадии 3 примера 84, используя соединение, полученное на вышеуказанной стадии 2 (102 мг).
MS (ESI) m/z: 470 (M+H)+.
Стадия 4
6-{3-Изопропил-1H-пирроло[2,3-b]пиридин-5-ил}-1-(тетрагидро-2H-пиран-4-илметил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (8 мг) получали способом, аналогичным применяемому на стадии 6 примера 35, используя соединение, полученное на вышеуказанной стадии 3 (50 мг).
MS (ESI) m/z: 392 (M+H)+.
HRMS (ESI) [(M+H)+] вычислено: C22H26N5O2 392,20865; найдено: 392,20520.
1H-ЯМР (CDCl3) δ: 1,41 (3H, с), 1,42 (3H, с), 1,46-1,57 (2H, м), 1,64-1,71 (2H, м), 2,16-2,26 (1H, м), 3,23-3,30 (1H, м), 3,35-3,41 (2H, м), 3,87 (2H, д, J=7,3 Гц), 3,98-4,02 (2H, м), 7,19-7,20 (1H, м), 7,41-7,42 (1H, м), 8,11 (1H, д, J=1,8 Гц), 8,32 (1H, д, J=1,8 Гц), 8,53 (1H, д, J=1,8 Гц), 9,69 (1H, ушир. с), 10,80 (1H, ушир. с).
(Пример 91)
5-[2-Оксо-1-(тетрагидро-2H-пиран-4-илметил)-2,3-дигидро-1H-имидазо[4,5-b]пиридин-6-ил]-1H-пирроло[2,3-b]пиридин-4-карбонитрил
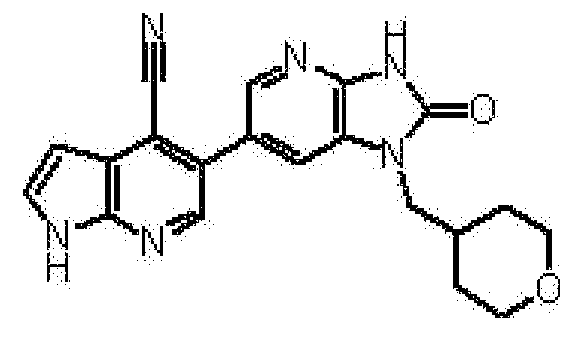
Стадия 1
2-Амино-5-бром-3-йодизоникотинонитрил
Указанное в заголовке соединение (5,47 г) получали способом, аналогичным применяемому на стадии 1 примера 36, используя 2-амино-5-бром-изоникотинонитрил, полученный способом, описанным в WO 2007/113226 (5,00 г).
MS (ESI) m/z: 324 (M+H)+.
Стадия 2
2-Амино-5-бром-3-[(триметилсилил)этинил]изоникотинонитрил
Указанное в заголовке соединение (1,38 г) получали способом, аналогичным применяемому на стадии 2 примера 36, используя соединение, полученное на вышеуказанной стадии 1 (3,00 г).
MS (ESI) m/z: 294 (M+H)+.
Стадия 3
N-{5-Бром-4-циано-3-[(триметилсилил)этинил]пиридин-2-ил}ацетамид
Указанное в заголовке соединение (646 мг) получали способом, аналогичным применяемому на стадии 4 примера 78, используя соединение, полученное на вышеуказанной стадии 2 (1,33 г).
MS (ESI) m/z: 336 (M+H)+.
Стадия 4
5-Бром-1H-пирроло[2,3-b]пиридин-4-карбонитрил
Указанное в заголовке соединение (78 мг) получали способом, аналогичным применяемому на стадии 5 примера 78, используя соединение, полученное на вышеуказанной стадии 3 (646 мг).
MS (ESI) m/z: 222 (M+H)+.
1H-ЯМР (ДМСО-d6) δ: 6,65 (1H, д, J=3,5 Гц), 7,90 (1H, д, J=3,5 Гц), 8,55 (1H, с).
Стадия 5
Трет-бутил 5-бром-4-циано-1H-пирроло[2,3-b]пиридин-карбоксилат
Указанное в заголовке соединение (108 мг) получали способом, аналогичным применяемому на стадии 1 примера 35, используя соединение, полученное на вышеуказанной стадии 4 (78 мг).
MS (ESI) m/z: 266 (M-tBu+H)+.
Стадия 6
5-[3-Циклогекс-1-ен-1-ил-2-оксо-1-(тетрагидро-2H-пиран-4-илметил)-2,3-дигидро-1H-имидазо[4,5-b]пиридин-6-ил]-1H-пирроло[2,3-b]пиридин-4-карбонитрил
Указанное в заголовке соединение (125 мг) получали способом, аналогичным применяемому на стадии 3 примера 1, используя соединение, полученное на стадии 4 примера 35 (163 мг), и соединение, полученное на описанной выше стадии 5 (108 мг).
MS (ESI) m/z: 455 (M+H)+.
Стадия 7
5-[2-Оксо-1-(тетрагидро-2H-пиран-4-илметил)-2,3-дигидро-1H-имидазо[4,5-b]пиридин-6-ил]-1H-пирроло[2,3-b]пиридин-4-карбонитрил
Указанное в заголовке соединение (54 мг) получали способом, аналогичным применяемому на стадии 6 примера 35, используя соединение, полученное на вышеуказанной стадии 6 (125 мг).
MS (ESI) m/z: 375 (M+H)+.
HRMS (ESI) [(M+H)+] вычислено: C20H19N6O2 375,15695; найдено: 375,15940.
1H-ЯМР (ДМСО-d6) δ: 1,30-1,33 (2H, м), 1,48-1,52 (2H, м), 2,05-2,12 (1H, м), 3,22 (2H, т, J=11,2 Гц), 3,72-3,75 (2H, м), 3,79-3,83 (2H, м), 6,67-6,69 (1H, м), 7,88-7,90 (2H, м), 8,15-8,17 (1H, м), 8,51-8,52 (1H, м), 11,79 (1H, ушир. с), 12,46 (1H, ушир. с).
(Пример 92)
Этил 5-[2-оксо-1-(тетрагидро-2H-пиран-4-илметил)-2,3-дигидро-1H-имидазо[4,5-b]пиридин-6-ил]-1H-пирроло[2,3-b]пиридин-3-карбоксилат
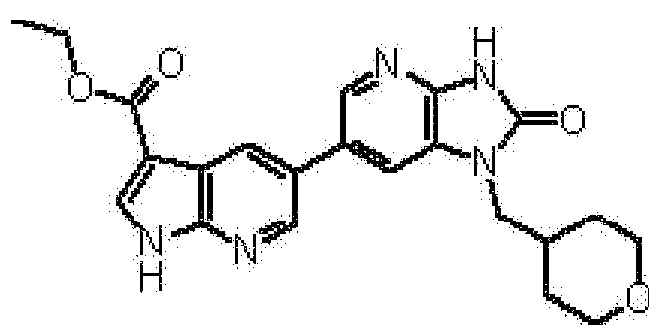
Стадия 1
5-Бром-1H-пирроло[2,3-b]пиридин-3-карбонитрил
К суспензии 5-бром-1H-пирроло[2,3-b]пиридин-3-карбальдегида, полученного способом, описанным в WO 2004/101565 (150 мг), в метаноле (1,0 мл) в атмосфере азота добавляли гидроксиламингидрохлорид (46 мг) и смесь перемешивали при комнатной температуре в течение одного часа. После азеотропной отгонки толуолом, к суспензии остатка в толуоле (2 мл) добавляли тионилхлорид (118 мкл), и смесь перемешивали при 80°C в течение 16 часов и при 100°C в течение 8 часов. После охлаждения до комнатной температуры добавляли насыщенный водный раствор бикарбоната натрия, затем экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом натрия. Растворитель упаривали при пониженном давлении. Полученный остаток очищали хроматографией на колонке с силикагелем (элюируя смесью метанол-хлороформ) с получением указанного в заголовке соединения (88 мг).
MS (ESI) m/z: 222 (M+H)+.
1H-ЯМР (ДМСО-d6) δ: 8,38-8,38 (1H, м), 8,47-8,47 (1H, м), 8,50 (1H, с).
Стадия 2
Трет-бутил 5-бром-3-циано-1H-пирроло[2,3-b]пиридин-3-карбоксилат
Указанное в заголовке соединение (91 мг) получали способом, аналогичным применяемому на стадии 1 примера 35, используя соединение, полученное на вышеуказанной стадии 1 (88 мг).
MS (ESI) m/z: 266 (M-tBu+H)+.
Стадия 3
5-[3-Циклогекс-1-ен-1-ил-2-оксо-1-(тетрагидро-2H-пиран-4-илметил)-2,3-дигидро-1H-имидазо[4,5-b]пиридин-6-ил]-1H-пирроло[2,3-b]пиридин-3-карбонитрил
Указанное в заголовке соединение (77 мг) получали способом, аналогичным применяемому на стадии 3 примера 1, используя соединение, полученное на стадии 4 примера 35 (138 мг), и соединение, полученное на описанной выше стадии 2 (91 мг).
MS (ESI) m/z: 455 (M+H)+.
Стадия 4
Этил 5-[2-оксо-1-(тетрагидро-2H-пиран-4-илметил)-2,3-дигидро-1H-имидазо[4,5-b]пиридин-6-ил]-1H-пирроло[2,3-b]пиридин-3-карбоксилат
Указанное в заголовке соединение (37 мг) получали способом, аналогичным применяемому на стадии 6 примера 35, используя соединение, полученное на вышеуказанной стадии 3 (75 мг).
MS (ESI) m/z: 422 (M+H)+.
HRMS (ESI) [(M+H)+] вычислено: C22H24N5O4 422,18283; найдено: 422,18716.
1H-ЯМР (ДМСО-d6) δ: 1,29-1,37 (5H, м), 1,50 (2H, д, J=10,9 Гц), 2,06-2,11 (1H, м), 3,22 (2H, т, J=10,9 Гц), 3,77-3,83 (4H, м), 4,31 (2H, кв, J=7,1 Гц), 7,92 (1H, д, J=1,7 Гц), 8,21 (1H, д, J=1,7 Гц), 8,26 (1H, с), 8,49 (1H, д, J=2,3 Гц), 8,63 (1H, д, J=2,3 Гц), 11,65 (1H, ушир. с).
(Пример 93)
5-[2-Оксо-1-(тетрагидро-2H-пиран-4-илметил)-2,3-дигидро-1H-имидазо[4,5-b]пиридин-6-ил]-1H-пирроло[2,3-b]пиридин-3-карбоновая кислота
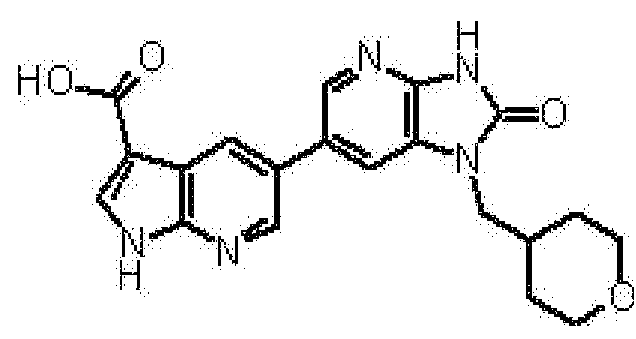
Стадия 1
5-[2-Оксо-1-(тетрагидро-2H-пиран-4-илметил)-2,3-дигидро-1H-имидазо[4,5-b]пиридин-6-ил]-1H-пирроло[2,3-b]пиридин-3-карбоновая кислота
Водный слой в процедуре разделения на стадии 4 примера 92 концентрировали и очищали тонкослойной хроматографией (элюируя смесью метанол-вода-хлороформ) с получением указанного в заголовке соединения (14 мг).
MS (ESI) m/z: 394 (M+H)+.
HRMS (ESI) [(M+H)+] вычислено: C20H20N5O4 394,15153; найдено: 394,15466.
1H-ЯМР (ДМСО-d6) δ: 1,27-1,35 (2H, м), 1,49 (2H, д, J=11,5 Гц), 2,05-2,12 (1H, м), 3,19-3,25 (1H, м), 3,77-3,83 (4H, м), 7,91 (1H, д, J=1,7 Гц), 8,16 (1H, с), 8,19 (1H, д, J=1,7 Гц), 8,49-8,50 (1H, м), 8,59-8,60 (1H, м), 11,63 (1H, ушир. с), 12,48 (1H, ушир. с).
(Пример 94)
N-Метил-5-[2-оксо-1-(тетрагидро-2H-пиран-4-илметил)-2,3-дигидро-1H-имидазо[4,5-b]пиридин-6-ил]-1H-пирроло[2,3-b]пиридин-3-карбоксамид
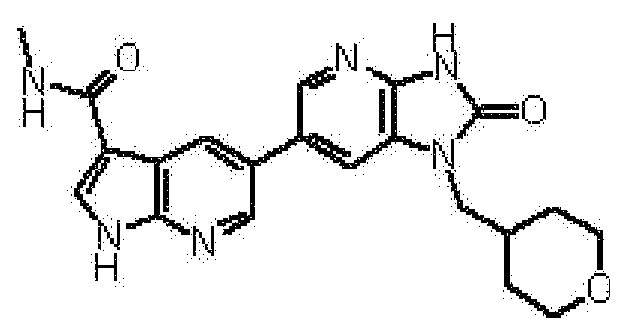
Стадия 1
N-Метил-5-[2-оксо-1-(тетрагидро-2H-пиран-4-илметил)-2,3-дигидро-1H-имидазо[4,5-b]пиридин-6-ил]-1H-пирроло[2,3-b]пиридин-3-карбоксамид
Соединение, полученное на стадии 4 примера 92 (34 мг), растворяли в растворе метиламина в метаноле (1 M, 20 мл) и раствор перемешивали в герметически закрытом сосуде при 100°C в течение 16 часов. Растворитель упаривали при пониженном давлении. Остаток вновь растворяли в растворе метиламина в метаноле (1 M, 20 мл) и раствор перемешивали в герметически закрытом сосуде при 120°C в течение 23 часов. После охлаждения до комнатной температуры растворитель концентрировали при пониженном давлении и остаток очищали тонкослойной хроматографией (элюируя смесью метанол-хлороформ) с получением указанного в заголовке соединения (14 мг).
MS (ESI) m/z: 407 (M+H)+.
HRMS (ESI) [(M+H)+] вычислено: C21H23N6O3 407,18316; найдено: 407,18633.
1H-ЯМР (ДМСО-d6) δ: 1,28-1,38 (2H, м), 1,48-1,55 (2H, м), 2,07-2,14 (1H, м), 2,82 (3H, с), 3,25 (2H, т, J=12,0 Гц), 3,79-3,85 (4H, м), 7,91 (1H, с), 8,08 (1H, ушир. с), 8,13 (1H, с), 8,24 (1H, с), 8,60 (1H, с), 8,68 (1H, с), 11,69 (1H, ушир. с), 12,21 (1H, ушир. с).
(Пример 95)
5-[2-Оксо-1-(тетрагидро-2H-пиран-4-илметил)-2,3-дигидро-1H-имидазо[4,5-b]пиридин-6-ил]-1H-пирроло[2,3-b]пиридин-3-карбонитрил
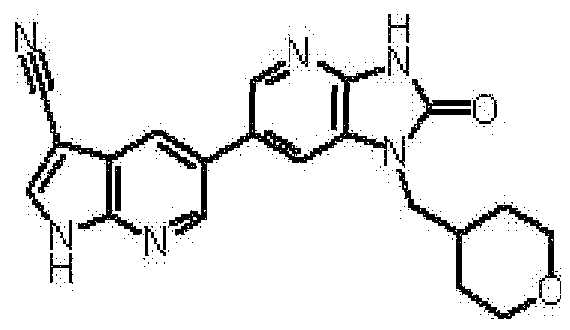
Стадия 1
5-[2-Оксо-1-(тетрагидро-2H-пиран-4-илметил)-2,3-дигидро-1H-имидазо[4,5-b]пиридин-6-ил]-1H-пирроло[2,3-b]пиридин-3-карбонитрил
Указанное в заголовке соединение (62 мг) получали способом, аналогичным применяемому на стадии 3 примера 1, используя соединение, полученное на стадии 1 примера 77 (112 мг), и соединение, полученное на стадии 1 примера 92 (75 мг).
MS (ESI) m/z: 375 (M+H)+.
HRMS (ESI) [(M+H)+] вычислено: C20H19FN6O2 375,15695; найдено: 375,15878.
1H-ЯМР (ДМСО-d6) δ: 1,28-1,37 (2H, м), 1,51 (2H, д, J=10,3 Гц), 2,08-2,14 (1H, м), 3,24 (2H, т, J=10,6 Гц), 3,79 (2H, д, J=7,4 Гц), 3,81-3,85 (2H, м), 7,80 (1H, ушир. с), 8,01 (1H, д, J=2,3 Гц), 8,33 (1H, д, J=2,3 Гц), 8,40 (1H, д, J=2,3 Гц), 8,51 (1H, с), 8,75 (1H, д, J=2,3 Гц), 11,66 (1H, ушир. с).
(Пример 96)
6-(3-Фтор-1H-пирроло[2,3-b]пиридин-5-ил)-1-(тетрагидро-2H-пиран-4-илметил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
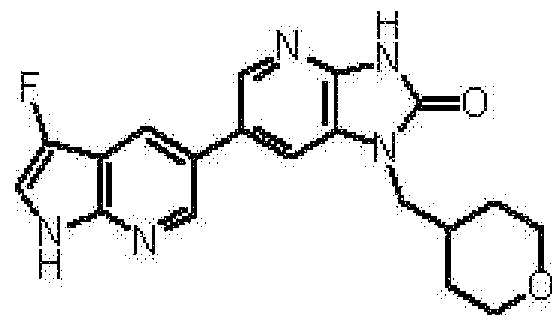
Стадия 1
Трет-бутил 5-бром-3-фтор-1H-пирроло[2,3-b]пиридин-1-карбоксилат
Указанное в заголовке соединение (0,52 г) получали способом, аналогичным применяемому на стадии 1 примера 35, используя 5-бром-3-фтор-1H-пирроло[2,3-b]пиридин, полученный способом, описанным в WO 2009/016460 (1,2 г).
1H-ЯМР (CDCl3) δ: 1,66 (9H, с), 7,42 (1H, д, J=2,0 Гц), 8,06 (1H, д, J=2,0 Гц), 8,57 (1H, д, J=2,0 Гц).
Стадия 2
3-Циклогекс-1-ен-1-ил-6-(3-фтор-1H-пирроло[2,3-b]пиридин-5-ил)-1-(тетрагидро-2H-пиран-4-илметил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (104 мг) получали способом, аналогичным применяемому на стадии 3 примера 1, используя соединение, полученное на стадии 4 примера 35 (192 мг), и соединение, полученное на описанной выше стадии 1 (125 мг).
MS (ESI) m/z: 448 (M+H)+.
Стадия 3
6-(3-Фтор-1H-пирроло[2,3-b]пиридин-5-ил)-1-(тетрагидро-2H-пиран-4-илметил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (60 мг) получали способом, аналогичным применяемому на стадии 6 примера 35, используя соединение, полученное на вышеуказанной стадии 2 (104 мг).
MS (ESI) m/z: 368 (M+H)+.
HRMS (ESI) [(M+H)+] вычислено: C19H18FN5O2 368,15228; найдено: 368,15682.
1H-ЯМР (ДМСО-d6) δ: 1,28-1,37 (2H, м), 1,49-1,52 (2H, м), 2,07-2,14 (1H, м), 3,24 (2H, т, J=11,2 Гц), 3,77 (2H, д, J=6,9 Гц), 3,81-3,85 (2H, м), 7,52-7,54 (1H, м), 7,97 (1H, с), 8,29-8,30 (2H, м), 8,63 (1H, д, J=1,7 Гц), 11,59 (1H, ушир. с), 11,62 (1H, ушир. с).
(Пример 97)
1-[(1,1-Диоксидотетрагидро-2H-тиопиран-4-ил)метил]-6-(1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
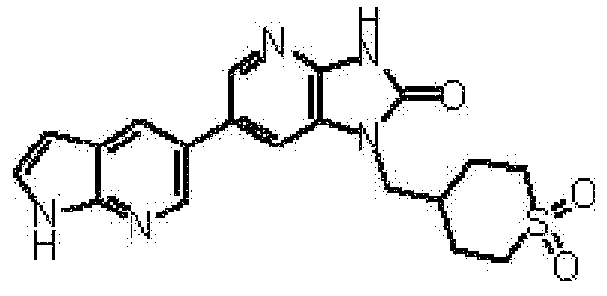
Стадия 1
6-Бром-3-циклогекс-1-ен-1-ил-1-[(1,1-диоксидотетрагидро-2H-тиопиран-4-ил)метил]-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (313 мг) получали способом, применяемым на стадии 3 примера 35, используя соединение, полученное на стадии 2 примера 35 (280 мг), и (1,1-диоксидотетрагидро-2H-тиопиран-4-ил)метанол, полученный способом, описанным в US 2007/82931 (187 мг).
MS (APCI) m/z: 440 [M+H]+.
1H-ЯМР (CDCl3) δ: 1,71-1,78 (2H, м), 1,83-1,90 (2H, м), 1,96-2,20 (5H, м), 2,28-2,34 (2H, м), 2,38-2,44 (2H, м), 2,97 (2H, дд, J=17,9, 8,7 Гц), 3,11 (2H, д, J=13,4 Гц), 3,78 (2H, д, J=6,8 Гц), 6,00-6,02 (1H, м), 7,28 (1H, д, J=2,0 Гц), 8,12 (1H, д, J=2,0 Гц).
Стадия 2
3-Циклогекс-1-ен-1-ил-1-[(1,1-диоксидотетрагидро-2H-тиопиран-4-ил)метил]-6-(1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (91 мг) получали способом, аналогичным применяемому на стадии 3 примера 1, используя соединение, полученное на вышеуказанной стадии 1 (309 мг), и 5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пирроло[2,3-b]пиридин (107 мг).
MS (APCI) m/z: 478 [M+H]+.
Стадия 3
1-[(1,1-Диоксидотетрагидро-2H-тиопиран-4-ил)метил]-6-(1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (63 мг) получали способом, аналогичным применяемому на стадии 6 примера 35, используя соединение, полученное на вышеуказанной стадии 4 (91 мг).
MS (APCI) m/z: 398 [M+H]+.
1H-ЯМР (ДМСО-d6) δ: 1,72-1,84 (2H, м), 1,97-2,00 (2H, ушир. м), 2,21-2,23 (1H, ушир. м), 3,09-3,11 (4H, м), 3,83 (2H, д, J=7,1 Гц), 6,52 (1H, дд, J=3,1, 1,9 Гц), 7,53 (1H, т, J=3,1 Гц), 7,95 (1H, д, J=1,9 Гц), 8,24-8,28 (2H, м), 8,56 (1H, д, J=1,9 Гц), 11,64 (1H, ушир. с), 11,75 (1H, ушир. с).
(Пример 98)
1-[(транс-4-Метоксициклогексил)метил]-6-(1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
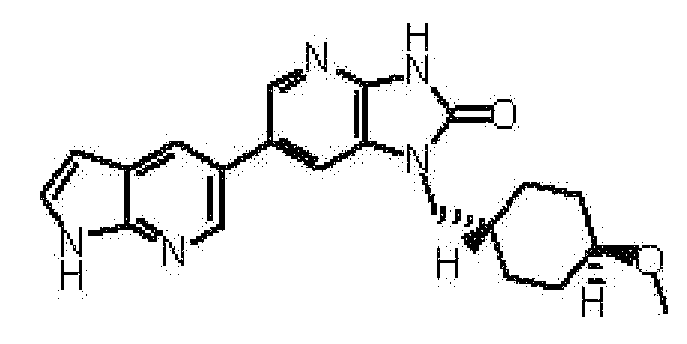
Стадия 1
(транс-4-Метоксициклогексил)метанол
(цис-4-Метоксициклогексил)метанол
Указанное в заголовке соединение транс-изомер (0,59 г) и цис-изомер (0,94 г) получали способом, аналогичным применяемому на стадии 2 примера 33, используя 4-метоксициклогексанкарбоновую кислоту (2,0 г).
транс-изомер
1H-ЯМР (CDCl3) δ: 0,98-1,02 (2H, м), 1,15-1,25 (2H, м), 1,44-1,50 (1H, м), 1,83-1,87 (2H, м), 2,08-2,13 (2H, м), 3,07-3,12 (1H, м), 3,35 (3H, с), 3,46 (2H, д, J=6,3 Гц).
цис-изомер
1H-ЯМР (CDCl3) δ: 1,32-1,55 (7H, м), 1,88-1,92 (2H, м), 3,31 (3H, с), 3,43-3,45 (1H, м), 3,47-3,48 (2H, м).
Стадия 2
6-Бром-3-циклогекс-1-ен-1-ил-1-[(транс-4-метоксициклогексил)метил]-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (216 мг) получали способом, аналогичным применяемому на стадии 3 примера 35, используя соединение, полученное на стадии 2 примера 35 (280 мг), и (транс-4-метоксициклогексил)метанол, полученный на вышеуказанной стадии 1 (164 мг).
MS (APCI) m/z: 420 [M+H]+.
1H-ЯМР (CDCl3) δ: 1,10-1,23 (5H, м), 1,73-1,88 (7H, м), 2,08-2,11 (2H, м), 2,30-2,31 (2H, м), 2,42-2,43 (2H, м), 3,34 (3H, с), 3,68 (2H, д, J=7,1 Гц), 6,00-6,02 (1H, м), 7,27 (1H, д, J=2,0 Гц), 8,09 (1H, д, J=2,0 Гц).
Стадия 3
3-Циклогекс-1-ен-1-ил-1-[(транс-4-метоксициклогексил)метил]-6-(1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (223 мг) получали способом, аналогичным применяемому на стадии 3 примера 1, используя соединение, полученное на вышеуказанной стадии 2 (205 мг), и 5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пирроло[2,3-b]пиридин (131 мг).
MS (APCI) m/z: 458 [M+H]+.
Стадия 4
1-[(транс-4-Метоксициклогексил)метил]-6-(1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (141 мг) получали способом, аналогичным применяемому на стадии 6 примера 35, используя соединение, полученное на вышеуказанной стадии 3 (223 мг).
MS (APCI) m/z: 378 [M+H]+.
1H-ЯМР (ДМСО-d6) δ: 1,08-1,14 (5H, м), 1,66-1,68 (2H, м), 1,81-1,84 (1H, м), 1,97-1,99 (2H, м), 3,19 (3H, с), 3,72-3,74 (3H, м), 6,52 (1H, дд, J=2,8, 1,9 Гц), 7,53 (1H, т, J=2,8 Гц), 7,86 (1H, д, J=1,9 Гц), 8,24 (2H, т, J=2,3 Гц), 8,55 (1H, д, J=2,3 Гц), 11,58 (1H, ушир. с), 11,74 (1H, ушир. с).
(Пример 99)
1-[(цис-4-Метоксициклогексил)метил]-6-(1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
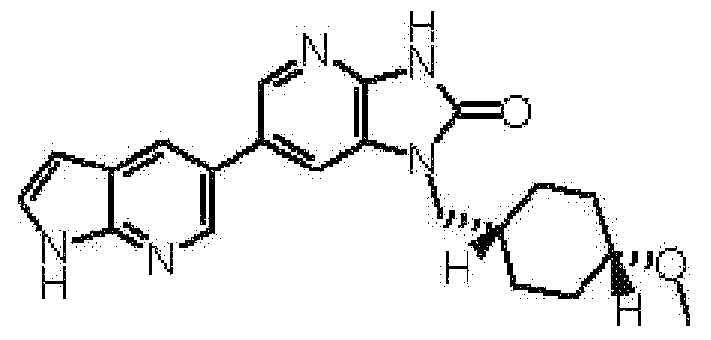
Стадия 1
6-Бром-3-циклогекс-1-ен-1-ил-1-[(цис-4-метоксициклогексил)метил]-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (298 мг) получали способом, аналогичным применяемому на стадии 3 примера 35, используя соединение, полученное на стадии 2 примера 35 (280 мг), и соединение, полученное на стадии 1 примера 98 (164 мг).
MS (APCI) m/z: 420 [M+H]+.
1H-ЯМР (CDCl3) δ: 1,33-1,46 (6H, м), 1,73-1,77 (2H, м), 1,86-1,93 (5H, м), 2,30-2,31 (2H, м), 2,42-2,42 (2H, м), 3,31 (3H, с), 3,43-3,46 (1H, ушир. м), 3,68 (2H, д, J=7,3 Гц), 6,00-6,02 (1H, м), 7,28 (1H, д, J=2,0 Гц), 8,07 (1H, д, J=2,0 Гц).
Стадия 2
3-Циклогекс-1-ен-1-ил-1-[(цис-4-метоксициклогексил)метил]-6-(1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (208 мг) получали способом, аналогичным применяемому на стадии 3 примера 1, используя соединение, полученное на вышеуказанной стадии 1 (191 мг), и 5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пирроло[2,3-b]пиридин (107 мг).
MS (APCI) m/z: 458 [M+H]+.
Стадия 3
1-[(цис-4-Метоксициклогексил)метил]-6-(1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (135 мг) получали способом, аналогичным применяемому на стадии 6 примера 35, используя соединение, полученное на вышеуказанной стадии 2 (208 мг).
MS (APCI) m/z: 378 [M+H]+.
1H-ЯМР (ДМСО-d6) δ: 1,40-1,92 (10H, м), 3,18 (4H, с), 3,73 (3H, д, J=7,1 Гц), 6,51 (1H, дд, J=3,3, 1,8 Гц), 7,52 (1H, т, J=2,8 Гц), 7,88 (1H, д, J=1,8 Гц), 8,24 (2H, дд, J=4,1, 2,1 Гц), 8,54 (1H, д, J=2,1 Гц), 11,57 (1H, ушир. с), 11,73 (1H, ушир. с).
(Пример 100)
4-{[2-Оксо-6-(1H-пирроло[2,3-b]пиридин-5-ил)-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил]метил}тетрагидро-2H-пиран-4-карбонитрил
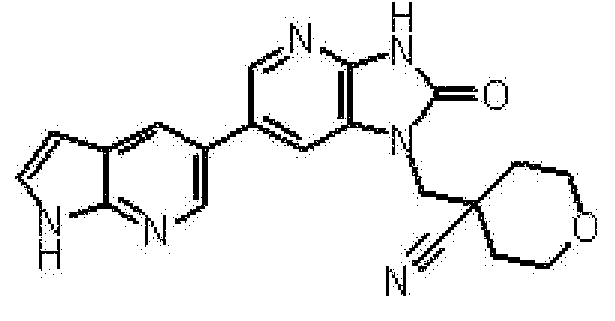
Стадия 1
4-[(6-Бром-3-циклогекс-1-ен-1-ил-2-оксо-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил)метил]тетрагидро-2H-пиран-4-карбонитрил
Указанное в заголовке соединение (39 мг) получали способом, применяемым на стадии 3 примера 35, используя соединение, полученное на стадии 2 примера 35 (280 мг), и (4-цианотетрагидро-2H-пиран-4-ил)метанол, полученный способом, описанным в WO 2008/029825 (161 мг).
MS (APCI) m/z: 417 [M+H]+.
Стадия 2
4-{[3-Циклогекс-1-ен-1-ил-2-оксо-6-(1H-пирроло[2,3-b]пиридин-5-ил)-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил]метил}тетрагидро-2H-пиран-4-карбонитрил
Указанное в заголовке соединение (39 мг) получали способом, аналогичным применяемому на стадии 3 примера 1, используя соединение, полученное на вышеуказанной стадии 1 (39 мг), и 5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пирроло[2,3-b]пиридин (25 мг).
MS (APCI) m/z: 455 [M+H]+.
Стадия 3
4-{[2-Оксо-6-(1H-пирроло[2,3-b]пиридин-5-ил)-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил]метил}тетрагидро-2H-пиран-4-карбонитрил
Указанное в заголовке соединение (15 мг) получали способом, аналогичным применяемому на стадии 6 примера 35, используя соединение, полученное на вышеуказанной стадии 2 (39 мг).
MS (APCI) m/z: 375 [M+H]+.
1H-ЯМР (ДМСО-d6) δ: 1,85-1,95 (4H, м), 3,46 (2H, т, J=12,0 Гц), 3,92-3,94 (2H, ушир. м), 4,22 (2H, с), 6,52 (1H, дд, J=3,3, 1,6 Гц), 7,53 (1H, дд, J=2,2, 1,6 Гц), 8,11 (1H, д, J=2,0 Гц), 8,21 (1H, д, J=2,2 Гц), 8,28 (1H, д, J=1,6 Гц), 8,53 (1H, д, J=2,0 Гц), 11,76 (2H, ушир. с).
(Пример 101)
1-[(транс-4-Гидроксициклогексил)метил]-6-(1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
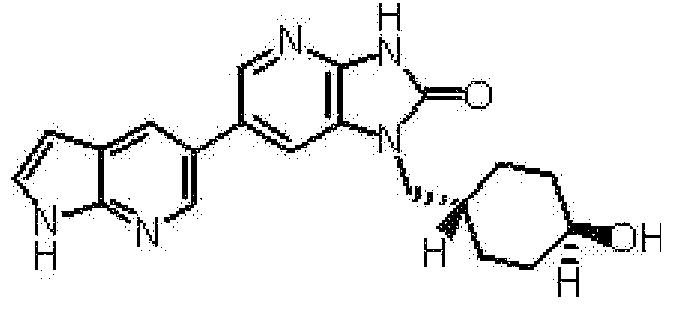
Стадия 1
транс-этил 4-{[Трет-бутил(диметил)силил]окси}циклогексанкарбоксилат
цис-этил 4-{[Трет-бутил(диметил)силил]окси}циклогексанкарбоксилат
Указанные в заголовке соединения, транс-изомер (0,85 г) и цис-изомер (1,0 г), получали способом, аналогичным применяемому на стадии 2 примера 62, используя этил 4-гидроксициклогексанкарбоксилат (2,0 г).
транс-изомер
1H-ЯМР (CDCl3) δ: 0,05 (6H, с), 0,88 (9H, с), 1,24 (3H, т, J=7,1 Гц), 1,30-1,32 (2H, м), 1,46-1,49 (2H, м), 1,89-1,96 (4H, м), 2,21-2,23 (1H, м), 3,55-3,58 (1H, м), 4,11 (2H, кв, J=7,1 Гц).
цис-изомер
1H-ЯМР (CDCl3) δ: 0,03 (6H, с), 0,89 (9H, с), 1,25 (3H, т, J=7,1 Гц), 1,49-1,50 (2H, м), 1,61-1,66 (4H, м), 1,92-1,95 (2H, м), 2,27-2,30 (1H, м), 3,88-3,90 (1H, м), 4,12 (2H, кв, J=7,1 Гц).
Стадия 2
(Транс-4-{[трет-бутил(диметил)силил]окси}циклогексил)метанол
Указанное в заголовке соединение (0,83 г) получали способом, аналогичным применяемому на стадии 2 примера 33, используя транс-этил 4-{[трет-бутил(диметил)силил]окси}циклогексанкарбоксилат, полученный на вышеуказанной стадии 1 (0,85 г).
1H-ЯМР (CDCl3) δ: 0,06 (6H, с), 0,89 (9H, с), 0,97-1,00 (2H, м), 1,27-1,32 (2H, м), 1,45-1,47 (1H, м), 1,78-1,81 (2H, м), 1,87-1,91 (2H, м), 3,45 (2H, д, J=6,3 Гц), 3,51-3,54 (1H, м).
Стадия 3
6-Бром-1-[(транс-4-{[трет-бутил(диметил)силил]окси}циклогексил)метил]-3-циклогекс-1-ен-1-ил-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (273 мг) получали способом, аналогичным применяемому на стадии 3 примера 35, используя соединение, полученное на стадии 2 примера 35 (280 мг), и соединение, полученное на описанной выше стадии 2 (279 мг).
MS (APCI) m/z: 520 [M+H]+.
Стадия 4
1-[(транс-4-{[трет-Бутил(диметил)силил]окси}циклогексил)метил]-3-циклогекс-1-ен-1-ил-6-(1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (205 мг) получали способом, аналогичным применяемому на стадии 3 примера 1, используя соединение, полученное на вышеуказанной стадии 3 (208 мг), и 5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пирроло[2,3-b]пиридин (107 мг).
MS (APCI) m/z: 558 [M+H]+.
Стадия 5
1-[(транс-4-Гидроксициклогексил)метил]-6-(1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (96 мг) получали способом, аналогичным применяемому на стадии 6 примера 35, используя соединение, полученное на вышеуказанной стадии 4 (205 мг).
MS (APCI) m/z: 364 [M+H]+.
1H-ЯМР (ДМСО-d6) δ: 1,06-1,14 (5H, м), 1,60-1,63 (2H, ушир. м), 1,81-1,87 (3H, ушир. м), 3,73 (2H, д, J=10,2 Гц), 4,49 (1H, д, J=4,4 Гц), 6,52 (1H, дд, J=3,3, 1,7 Гц), 7,53 (1H, дд, J=2,9, 1,7 Гц), 7,86 (1H, д, J=1,7 Гц), 8,24 (2H, дд, J=2,9, 2,0 Гц), 8,55 (1H, д, J=2,0 Гц), 11,58 (1H, ушир. с), 11,74 (1H, ушир. с).
(Пример 102)
1-[(цис-4-Гидроксициклогексил)метил]-6-(1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
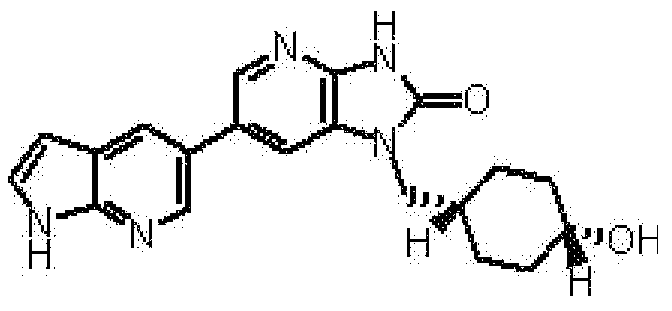
Стадия 1
(Цис-4-{[трет-бутил(диметил)силил]окси}циклогексил)метанол
Указанное в заголовке соединение (0,89 г) получали способом, аналогичным применяемому на стадии 2 примера 33, используя цис-этил 4-{[трет-бутил(диметил)силил]окси}циклогексанкарбоксилат, полученный на стадии 1 примера 101 (1,0 г).
1H-ЯМР (CDCl3) δ: 0,03 (6H, с), 0,89 (9H, с), 1,26-1,29 (1H, м), 1,46-1,48 (6H, м), 1,65-1,66 (2H, м), 3,46-3,49 (2H, м), 3,96-3,97 (1H, м).
Стадия 2
6-Бром-1-[(цис-4-{[трет-бутил(диметил)силил]окси}циклогексил)метил]-3-циклогекс-1-ен-1-ил-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (251 мг) получали способом, аналогичным применяемому на стадии 3 примера 35, используя соединение, полученное на стадии 2 примера 35 (280 мг), и соединение, полученное на описанной выше стадии 1 (279 мг).
MS (APCI) m/z: 520 [M+H]+.
Стадия 3
1-[(цис-4-{[трет-Бутил(диметил)силил]окси}циклогексил)метил]-3-циклогекс-1-ен-1-ил-6-(1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (194 мг) получали способом, аналогичным применяемому на стадии 3 примера 1, используя соединение, полученное на вышеуказанной стадии 2 (208 мг), и 5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пирроло[2,3-b]пиридин (107 мг).
MS (APCI) m/z: 558 [M+H]+.
Стадия 4
1-[(цис-4-Гидроксициклогексил)метил]-6-(1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (92 мг) получали способом, аналогичным применяемому на стадии 6 примера 35, используя соединение, полученное на вышеуказанной стадии 3 (194 мг).
MS (APCI) m/z: 364 [M+H]+.
1H-ЯМР (ДМСО-d6) δ: 1,30-1,98 (6H, м), 3,73-3,81 (3H, м), 4,29 (1H, д, J=3,2 Гц), 6,51-6,52 (1H, м), 7,52 (1H, дд, J=2,8, 1,6 Гц), 7,87 (1H, д, J=6,8 Гц), 8,23-8,26 (2H, м), 8,54 (1H, д, J=2,0 Гц), 11,58 (1H, ушир. с), 11,73 (1H, ушир. с).
(Пример 103)
1-[(4,4-Дифторциклогексил)метил]-6-(1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
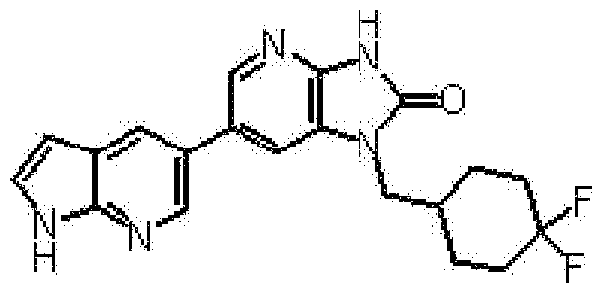
Стадия 1
(4,4-Дифторциклогексил)метанол
Указанное в заголовке соединение (0,423 г) получали способом, аналогичным применяемому на стадии 2 примера 33, используя этил 4,4-дифторциклогексанкарбоксилат (1,13 г).
1H-ЯМР (CDCl3) δ: 1,29-1,33 (2H, м), 1,56-1,58 (1H, м), 1,63-1,80 (2H, м), 1,84-1,86 (2H, м), 2,09-2,14 (2H, м), 3,52 (2H, д, J=6,6 Гц).
Стадия 2
6-Бром-3-циклогекс-1-ен-1-ил-1-[(4,4-дифторциклогексил)метил]-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (236 мг) получали способом, аналогичным применяемому на стадии 3 примера 35, используя соединение, полученное на стадии 2 примера 35 (280 мг), и (4,4-дифторциклогексил)метанол, полученный на вышеуказанной стадии 1 (171 мг).
MS (APCI) m/z: 426 [M+H]+.
Стадия 3
3-Циклогекс-1-ен-1-ил-1-[(4,4-дифторциклогексил)метил]-6-(1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (108 мг) получали способом, аналогичным применяемому на стадии 3 примера 1, используя соединение, полученное на вышеуказанной стадии 2 (171 мг), и 5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пирроло[2,3-b]пиридин (107 мг).
MS (APCI) m/z: 464 [M+H]+.
Стадия 4
1-[(4,4-Дифторциклогексил)метил]-6-(1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (86 мг) получали способом, аналогичным применяемому на стадии 6 примера 35, используя соединение, полученное на вышеуказанной стадии 3 (108 мг).
MS (APCI) m/z: 384 [M+H]+.
1H-ЯМР (ДМСО-d6) δ: 1,26-1,40 (2H, м), 1,66-1,78 (4H, м), 1,94-2,09 (3H, с), 3,80 (2H, д, J=7,3 Гц), 6,52 (1H, дд, J=3,3, 1,8 Гц), 7,52-7,54 (1H, м), 7,92 (1H, д, J=2,0 Гц), 8,25 (2H, д, J=2,0 Гц), 8,55 (1H, д, J=2,2 Гц), 11,61 (1H, с), 11,74 (1H, с).
(Пример 104)
1-{[транс-3-Метоксициклогексил]метил}-6-(1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
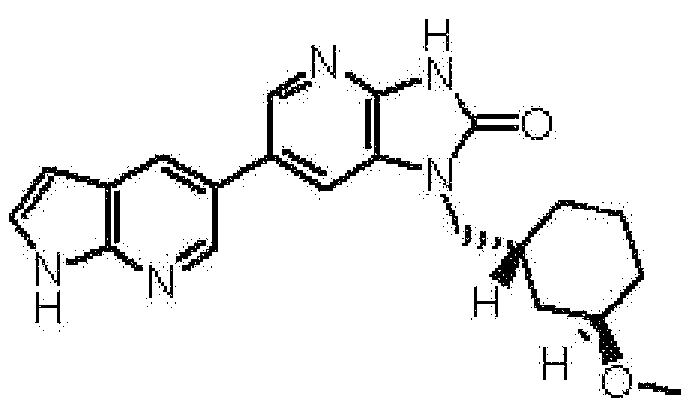
и его энантиомер
Стадия 1
(Транс-3-метоксициклогексил)метанол
(Цис-3-метоксициклогексил)метанол
Указанные в заголовке соединения, транс-изомер (0,41 г) и цис-изомер (0,39 г), получали способом, аналогичным применяемому на стадии 2 примера 33, используя 3-метоксициклогексанкарбоновую кислоту (2,0 г).
транс-изомер
1H-ЯМР (CDCl3) δ: 1,02-1,05 (1H, м), 1,14-1,21 (1H, м), 1,25-1,27 (1H, м), 1,33-1,36 (1H, м), 1,49-1,56 (1H, м), 1,71-1,75 (1H, м), 1,84-1,94 (3H, м), 3,31 (3H, с), 3,45-3,47 (2H, м), 3,53-3,54 (1H, м).
цис-изомер
1H-ЯМР (CDCl3) δ: 0,85-0,89 (2H, м), 1,09-1,16 (1H, м), 1,23-1,30 (1H, м), 1,53-1,57 (1H, м), 1,70-1,75 (1H, м), 1,82-1,85 (1H, м), 2,05-2,08 (1H, м), 2,13-2,15 (1H, м), 3,13-3,18 (1H, м), 3,36 (3H, с), 3,50-3,51 (2H, м).
Стадия 2
6-Бром-3-циклогекс-1-ен-1-ил-1-{[транс-4-метоксициклогексил]метил}-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (281 мг) получали способом, аналогичным применяемому на стадии 3 примера 35, используя соединение, полученное на стадии 2 примера 35 (280 мг), (транс-3-метоксициклогексил)метанол, полученный на вышеуказанной стадии 1 (164 мг), и бис(2-метоксиэтил) азодикарбоксилат вместо диизопропилазодикарбоксилата (267 мг).
MS (APCI) m/z: 420 [M+H]+.
1H-ЯМР (ДМСО-d6) δ: 1,03-1,05 (1H, м), 1,16-1,22 (1H, м), 1,28-1,33 (1H, м), 1,40-1,43 (2H, м), 1,52-1,55 (1H, м), 1,60-1,76 (6H, м), 2,05-2,10 (1H, м), 2,21-2,22 (2H, м), 2,32-2,32 (2H, м), 3,17 (3H, с), 3,46-3,48 (1H, м), 3,68 (2H, д, J=7,6 Гц), 5,91-5,93 (1H, м), 7,91 (1H, д, J=2,1 Гц), 8,06 (1H, д, J=2,1 Гц).
Стадия 3
3-Циклогекс-1-ен-1-ил-1-{[транс-3-метоксициклогексил]метил}-6-(1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (142 мг) получали способом, аналогичным применяемому на стадии 3 примера 1, используя соединение, полученное на вышеуказанной стадии 2 (168 мг), и 5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пирроло[2,3-b]пиридин (107 мг).
MS (APCI) m/z: 458 [M+H]+.
1H-ЯМР (CDCl3) δ: 1,09-1,98 (12H, м), 2,25-2,37 (3H, м), 2,47-2,53 (2H, м), 3,25 (4H, с), 3,54-3,59 (1H, м), 3,79 (2H, д, J=7,3 Гц), 6,06-6,09 (1H, м), 6,60 (1H, дд, J=3,7, 1,8 Гц), 7,37 (1H, д, J=1,8 Гц), 7,39-7,42 (1H, м), 8,09 (1H, д, J=1,8 Гц), 8,28 (1H, д, J=1,8 Гц), 8,50 (1H, с), 9,35 (1H, с).
Стадия 4
1-{[Транс-3-метоксициклогексил]метил}-6-(1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (86 мг) получали способом, аналогичным применяемому на стадии 6 примера 35, используя соединение, полученное на вышеуказанной стадии 3 (141 мг).
MS (APCI) m/z: 378 [M+H]+.
1H-ЯМР (ДМСО-d6) δ: 1,02-1,42 (5H, м), 1,54-1,57 (1H, м), 1,69-1,72 (2H, м), 2,12-2,15 (1H, м), 3,09 (3H, с), 3,44-3,47 (1H, ушир. м), 3,73 (2H, д, J=16,3 Гц), 6,50 (1H, дд, J=3,2, 1,8 Гц), 7,51 (1H, т, J=3,0 Гц), 7,84 (1H, д, J=1,8 Гц), 8,22 (2H, д, J=1,8 Гц), 8,52 (1H, д, J=2,3 Гц), 11,57 (1H, ушир. с), 11,72 (1H, ушир. с).
(Пример 105)
1-{[Цис-3-метоксициклогексил]метил}-6-(1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
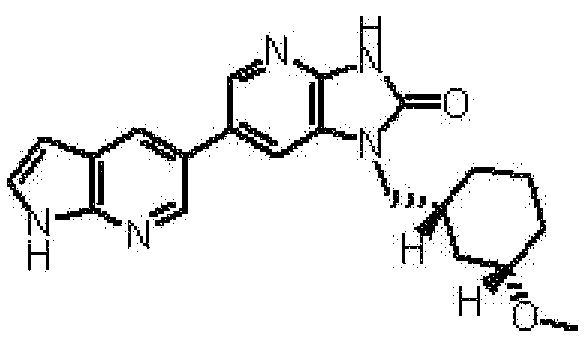
и его энантиомер
Стадия 1
6-Бром-3-циклогекс-1-ен-1-ил-1-{[цис-4-метоксициклогексил]метил}-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (215 мг) получали способом, аналогичным применяемому на стадии 2 примера 104, используя соединение, полученное на стадии 2 примера 35 (280 мг), и (цис-3-метоксициклогексил)метанол, полученный на стадии 1 примера 104 (164 мг).
MS (APCI) m/z: 420 [M+H]+.
1H-ЯМР (ДМСО-d6) δ: 0,83-1,01 (2H, м), 1,13-1,21 (1H, м), 1,51-1,54 (1H, м), 1,67-1,78 (6H, м), 1,94-1,97 (2H, м), 2,21-2,21 (2H, м), 2,32-2,33 (2H, м), 3,06-3,11 (1H, м), 3,21 (3H, с), 3,66-3,77 (2H, м), 5,91-5,93 (1H, м), 7,92 (1H, д, J=2,0 Гц), 8,07 (1H, д, J=2,0 Гц).
Стадия 2
3-Циклогекс-1-ен-1-ил-1-{[цис-3-метоксициклогексил]метил}-6-(1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (124 мг) получали способом, аналогичным применяемому на стадии 3 примера 1, используя соединение, полученное на вышеуказанной стадии 1 (168 мг), и 5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пирроло[2,3-b]пиридин (107 мг).
MS (APCI) m/z: 458 [M+H]+.
1H-ЯМР (CDCl3) δ: 0,98-1,94 (10H, м), 1,97-2,13 (3H, м), 2,32-2,35 (2H, м), 2,49-2,52 (2H, м), 3,11-3,16 (1H, м), 3,33 (3H, с), 3,81 (2H, ддд, J=27,9, 7,2, 3,6 Гц), 6,07-6,09 (1H, м), 6,60 (1H, дд, J=3,7, 1,8 Гц), 7,36 (1H, д, J=1,8 Гц), 7,43 (1H, т, J=2,7 Гц), 8,09 (1H, д, J=2,3 Гц), 8,29 (1H, д, J=1,8 Гц), 8,51 (1H, д, J=2,3 Гц), 9,80 (1H, ушир. с).
Стадия 3
1-{[цис-3-Метоксициклогексил]метил}-6-(1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (86 мг) получали способом, аналогичным применяемому на стадии 6 примера 35, используя соединение, полученное на вышеуказанной стадии 2 (123 мг).
MS (APCI) m/z: 378 [M+H]+.
1H-ЯМР (ДМСО-d6) δ: 0,86-1,01 (3H, м), 1,11-1,15 (1H, м), 1,52-1,55 (1H, м), 1,67-1,71 (1H, м), 1,83-1,96 (3H, м), 3,02-3,07 (1H, м), 3,17 (3H, с), 3,72-3,77 (2H, м), 6,50 (1H, дд, J=3,4, 1,6 Гц), 7,51 (1H, т, J=3,0 Гц), 7,86 (1H, д, J=1,8 Гц), 8,23 (2H, д, J=1,8 Гц), 8,53 (1H, д, J=2,3 Гц), 11,57 (1H, ушир. с), 11,72 (1H, ушир. с).
(Пример 106)
1-[(4-Оксотетрагидро-2H-пиран-3-ил)метил]-6-(1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
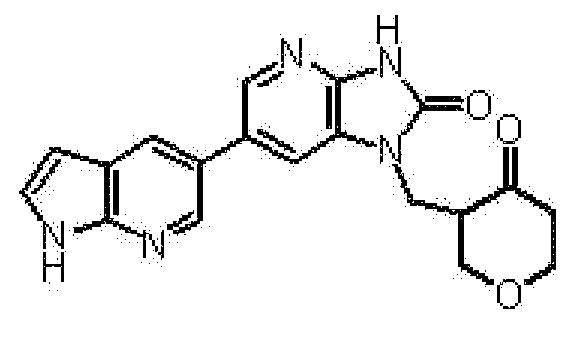
Стадия 1
Этил 4-оксотетрагидро-2H-пиран-3-карбоксилат
В растворе тетрагидро-4H-пиран-4-она (260 мг) в тетрагидрофуране (13 мл) при -78°C добавляли по каплям диизопропиламид лития (1,14 моль/л раствор в смеси н-гексан/тетрагидрофуран, 2,5 мл) и смесь перемешивали в течение одного часа при нагревании до 0°C. Реакционный раствор вновь охлаждали до -78°C, добавляли гексаметилфосфорный триамид (452 мкл) и затем добавляли этилцианоформат (280 мкл) при такой же температуре. Смесь перемешивали в течение одного часа при нагревании до 0°C. Реакционный раствор разделяли добавлением дистиллированной воды и этилацетата. Полученный органический слой промывали насыщенным солевым раствором и сушили над безводным сульфатом натрия. Растворитель упаривали при пониженном давлении. Полученный остаток очищали хроматографией на колонке с силикагелем (элюируя смесью этилацетат-гексан) с получением указанного в заголовке соединения (210 мг).
1H-ЯМР (CDCl3) δ: 1,30 (3H, т, J=6,9 Гц), 2,36-2,42 (2H, м), 3,82-3,88 (2H, м), 4,23 (3H, кв, J=7,3 Гц), 4,29-4,26 (2H, м), 11,86 (1H, с).
Стадия 2
Этил 1,4,8-триоксаспиро[4,5]декан-6-карбоксилат
В раствор соединения, полученного на описанной выше стадии 1 (860 мг), в дихлорметане (50 мл) при комнатной температуре добавляли бис(триметилсилокси)этан (3,68 мл). Реакционный раствор охлаждали до -15°C и добавляли триметилсилилтрифторметансульфонат (92 мкл). Смесь перемешивали в течение 2 часов при нагревании до 0°C и затем перемешивали при комнатной температуре в течение 3,5 часов. При охлаждении льдом добавляли пиридин (0,2 мл) и потом смесь разделяли добавлением дихлорметана и насыщенного водного раствора бикарбоната натрия. Полученный органический слой промывали насыщенным солевым раствором и сушили над безводным сульфатом натрия. Растворитель упаривали при пониженном давлении. Полученный остаток очищали хроматографией на колонке с силикагелем (элюируя смесью этилацетат-гексан) с получением указанного в заголовке соединения (956 мг).
1H-ЯМР (CDCl3) δ: 1,28 (3H, т, J=7,3 Гц), 1,65-1,75 (1H, м), 2,00-2,09 (1H, м), 2,75-2,82 (1H, м), 3,75-3,85 (2H, м), 3,90-4,03 (6H, м), 4,18 (2H, кв, J=6,9 Гц).
Стадия 3
1,4,8-Триоксаспиро[4,5]дец-6-илметанол
Указанное в заголовке соединение (152 мг) получали способом, аналогичным применяемому на стадии 2 примера 33, используя соединение, полученное на вышеуказанной стадии 2 (211 мг), и алюмогидрид лития (60 мг).
1H-ЯМР (CDCl3) δ: 1,17-1,27 (1H, м), 1,60-1,70 (1H, м), 1,81-1,90 (1H, м), 1,98-2,06 (1H, м), 2,45-2,52 (1H, м), 3,76-3,64 (4H, м), 3,92-3,76 (4H, м).
Стадия 4
6-Бром-3-циклогекс-1-ен-1-ил-1-(1,4,8-триоксаспиро[4,5]дец-6-илметил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (120 мг) получали способом, аналогичным применяемому на стадии 3 примера 35, используя соединение, полученное на вышеуказанной стадии 3 (151 мг), и соединение, полученное на стадии 2 примера 35 (243 мг).
MS (ESI) m/z: 450 (M+H)+.
1H-ЯМР (CDCl3) δ: 1,61-1,78 (3H, м), 1,82-1,92 (3H, м), 2,24-2,34 (3H, м), 2,37-2,44 (2H, м), 3,49 (1H, д, J=5,5 Гц), 3,55-3,63 (1H, м), 3,74-3,89 (4H, м), 3,96-4,11 (4H, м), 6,03-5,96 (1H, м), 7,40 (1H, д, J=1,8 Гц), 8,09 (1H, д, J=1,8 Гц).
Стадия 5
3-Циклогекс-1-ен-1-ил-6-(1H-пирроло[2,3-b]пиридин-5-ил)-1-(1,4,8-триоксаспиро[4,5]дец-6-илметил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (94 мг) получали способом, аналогичным применяемому на стадии 3 примера 1, используя соединение, полученное на вышеуказанной стадии 4 (115 мг), и 5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пирроло[2,3-b]пиридин (76 мг).
MS (ESI) m/z: 488 (M+H)+.
1H-ЯМР (CDCl3) δ: 1,62-1,71 (1H, м), 1,73-1,81 (2H, м), 1,85-1,95 (3H, м), 2,30-2,40 (3H, м), 2,45-2,53 (2H, м), 3,62-3,69 (1H, м), 3,77-3,84 (3H, м), 3,92-4,15 (6H, м), 6,03-6,09 (1H, м), 6,58-6,62 (1H, м), 7,36-7,40 (1H, м), 7,50 (1H, д, J=1,8 Гц), 8,08 (1H, д, J=2,3 Гц), 8,28 (1H, д, J=1,8 Гц), 8,50 (1H, д, J=2,3 Гц), 8,75 (1H, ушир. с).
Стадия 6
1-[(4-Оксотетрагидро-2H-пиран-3-ил)метил]-6-(1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (11 мг) получали способом, аналогичным применяемому на стадии 6 примера 35, используя соединение, полученное на вышеуказанной стадии 5 (90 мг).
MS (ESI) m/z: 346 (M+H)+.
HRMS (ESI) [M+H]+ вычислено: C19H17N5O3 364,14096; найдено: 364,14502.
1H-ЯМР (ДМСО-d6) δ: 2,34-2,47 (2H, м), 3,20-3,51 (4H, м), 4,59 (2H, с), 6,47-6,52 (1H, м), 7,40-7,44 (1H, м), 7,49-7,53 (1H, м), 7,74 (1H, д, J=2,3 Гц), 8,19 (1H, д, J=1,8 Гц), 8,24 (1H, д, J=1,8 Гц), 8,49 (1H, д, J=2,3 Гц), 11,65 (1H, ушир. с), 11,71 (1H, ушир. с).
(Пример 107)
6-(1H-Пирроло[2,3-b]пиридин-5-ил)-1-(тетрагидрофуран-3-илметил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Стадия 1
6-Бром-3-циклогекс-1-ен-1-ил-1-(тетрагидрофуран-3-илметил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (85 мг) получали способом, аналогичным применяемому на стадии 3 примера 35, используя соединение, полученное на стадии 2 примера 35 (100 мг), и тетрагидрофуран-3-илметанол (42 мкл).
MS (APCI) m/z: 378 [M+H]+.
1H-ЯМР (CDCl3) δ: 1,71-1,79 (5H, м), 1,86-1,88 (2H, м), 2,01-2,09 (1H, м), 2,30-2,32 (2H, м), 2,39-2,44 (2H, м), 2,78-2,85 (1H, м), 3,64 (1H, дд, J=8,9, 4,8 Гц), 3,77-3,80 (3H, м), 3,90 (1H, дд, J=14,2, 7,6 Гц), 3,99 (1H, тд, J=8,2, 5,8 Гц), 6,00-6,03 (1H, м), 7,34 (1H, д, J=2,0 Гц), 8,10 (1H, д, J=2,0 Гц).
Стадия 2
6-Бром-1-(тетрагидрофуран-3-илметил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (55 мг) получали способом, аналогичным применяемому на стадии 6 примера 35, используя соединение, полученное на вышеуказанной стадии 1 (85 мг).
MS (APCI) m/z: 298 [M+H]+.
Стадия 3
6-(1H-Пирроло[2,3-b]пиридин-5-ил)-1-(тетрагидрофуран-3-илметил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (39 мг) получали способом, аналогичным применяемому на стадии 3 примера 1, используя соединение, полученное на вышеуказанной стадии 2 (55 мг), и 5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пирроло[2,3-b]пиридин (50 мг).
MS (APCI) m/z: 336 [M+H]+.
1H-ЯМР (ДМСО-d6) δ: 1,64-1,67 (1H, м), 1,89-1,94 (1H, м), 2,48-2,50 (4H, м), 2,76-2,82 (1H, м), 3,51 (1H, дд, J=8,4, 5,5 Гц), 3,61-3,67 (2H, м), 3,80 (1H, тд, J=8,0, 5,5 Гц), 3,87 (2H, д, J=7,6 Гц), 6,50 (1H, дд, J=3,1, 1,8 Гц), 7,51 (1H, т, J=3,1 Гц), 7,92 (1H, д, J=2,1 Гц), 8,24 (2H, д, J=1,8 Гц), 8,52 (1H, д, J=2,1 Гц), 11,61 (1H, с), 11,71 (1H, ушир. с).
(Пример 108)
1-(Морфолин-3-илметил)-6-(1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Стадия 1
трет-Бутил 3-[(6-бром-3-циклогекс-1-ен-1-ил-2-оксо-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил)метил]морфолин-4-карбоксилат
Указанное в заголовке соединение (469 мг) получали способом, применяемым на стадии 3 примера 35, используя соединение, полученное на стадии 2 примера 35 (471 мг), и трет-бутил 3-(гидроксиметил)морфолин-4-карбоксилат, полученный способом, описанным в WO 2006/99352 (521 мг).
MS (APCI) m/z: 493 [M+H]+.
Стадия 2
трет-Бутил 3-{[3-циклогекс-1-ен-1-ил-2-оксо-6-(1H-пирроло[2,3-b]пиридин-5-ил)-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил]метил}морфолин-4-карбоксилат
Указанное в заголовке соединение (177 мг) получали способом, аналогичным применяемому на стадии 3 примера 1, используя соединение, полученное на вышеуказанной стадии 1 (197 мг), и 5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пирроло[2,3-b]пиридин (107 мг).
MS (APCI) m/z: 531 [M+H]+.
Стадия 3
1-(Морфолин-3-илметил)-6-(1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (64 мг) получали способом, аналогичным применяемому на стадии 6 примера 35, используя соединение, полученное на вышеуказанной стадии 2 (177 мг).
MS (APCI) m/z: 351 [M+H]+.
1H-ЯМР (ДМСО-d6) δ: 2,62-2,65 (1H, м), 2,76 (1H, д, J=10,0 Гц), 3,06-3,08 (1H, м), 3,20 (1H, т, J=9,8 Гц), 3,58 (1H, д, J=11,0 Гц), 3,70-3,79 (4H, м), 6,50 (1H, т, J=1,6 Гц), 7,51 (1H, д, J=2,3 Гц), 7,87 (1H, д, J=1,8 Гц), 8,23 (2H, д, J=1,8 Гц), 8,52 (1H, д, J=1,8 Гц), 11,72 (1H, ушир. с).
(Пример 109)
1-{[(3S)-4-Метил-5-оксоморфолин-3-ил]метил}-6-(1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
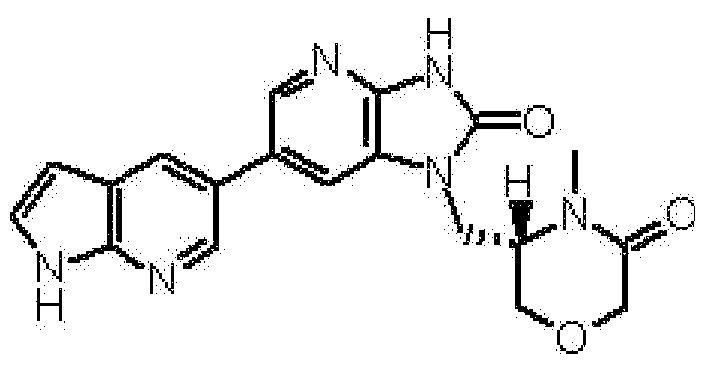
Стадия 1
N-[(1R)-2-(Бензилокси)-1-(гидроксиметил)этил]-2-хлорацетамид
(2R)-2-Амино-3-(бензилокси)пропан-1-ол (2,18 г) растворяли в ацетонитриле (38 мл) и метаноле (7 мл) и добавляли триэтиламин (2,0 мл). Атмосферу заменяли на азот и потом смесь охлаждали до -10°C. По каплям добавляли раствор хлорацетилхлорида (1,05 мл) в ацетонитриле (9 мл) и смесь перемешивали в течение 20 часов с постепенным нагреванием до комнатной температуры. Отгоняли растворитель реакционной смеси и остаток непосредственно очищали хроматографией на колонке с силикагелем (элюируя смесью этилацетат-гексан) с получением указанного в заголовке соединения (2,26 г).
MS (APCI) m/z: 258 [M+H]+.
1H-ЯМР (CDCl3) δ: 3,64 (1H, дд, J=9,5, 4,1 Гц), 3,69-3,73 (2H, м), 3,87 (1H, дд, J=11,3, 4,0 Гц), 4,05 (2H, д, J=2,9 Гц), 4,11-4,13 (1H, м), 4,55 (2H, с), 7,22 (1H, ушир. с), 7,32-7,37 (5H, м).
Стадия 2
(5S)-5-[(Бензилокси)метил]морфолин-3-он
Трет-бутоксид калия (982 мг) растворяли в 2-метилбутан-2-оле (7 мл). В атмосфере азота в течение одного часа добавляли по каплям раствор соединения, полученного на описанной выше стадии 1 (2,254 г), в 2-метилбутан-2-оле (15 мл). После завершения добавления смесь дополнительно перемешивали в течение одного часа и потом растворитель реакционной смеси отгоняли. Остаток очищали хроматографией на колонке с силикагелем (элюируя смесью этилацетат-этанол) с получением указанного в заголовке соединения (807 мг).
MS (APCI) m/z: 222 [M+H]+.
1H-ЯМР (CDCl3) δ: 3,43 (1H, дд, J=9,0, 8,1 Гц), 3,55 (1H, дд, J=9,0, 5,5 Гц), 3,64 (1H, дд, J=11,7, 5,5 Гц), 3,72-3,76 (1H, м), 3,86 (1H, дд, J=11,7, 3,8 Гц), 4,15 (2H, д, J=4,4 Гц), 4,54 (2H, дд, J=13,4, 11,7 Гц), 6,60 (1H, ушир. с), 7,29-7,39 (5H, м).
Стадия 3
(5S)-5-[(Бензилокси)метил]-4-метилморфолин-3-он
Соединение, полученное на описанной выше стадии 2 (449 мг), растворяли в тетрагидрофуране (6 мл) и раствор охлаждали льдом в атмосфере азота. Добавляли 55% гидрид натрия (133 мг) и смесь перемешивали при охлаждении льдом в течение 30 минут. После дополнительного добавления тетрагидрофурана (18 мл) добавляли метилйодид (695 мкл) и смесь перемешивали в течение 25 часов с постепенным нагреванием до комнатной температуры. Реакционный раствор экстрагировали однократным добавлением толуола и водный слой экстрагировали этилацетатом три раза. Органический слой промывали насыщенным солевым раствором и потом сушили над безводным сульфатом натрия и растворитель упаривали. Остаток очищали хроматографией на колонке с силикагелем (элюируя смесью этилацетат) с получением указанного в заголовке соединения (454 мг).
MS (APCI) m/z: 236 [M+H]+.
1H-ЯМР (CDCl3) δ: 3,02 (3H, с), 3,36-3,41 (1H, м), 3,65 (1H, дд, J=9,3, 4,6 Гц), 3,70 (1H, т, J=8,7 Гц), 3,76 (1H, дд, J=11,8, 3,1 Гц), 4,06 (1H, дд, J=12,0, 1,5 Гц), 4,15 (2H, кв, J=16,4 Гц), 4,56 (2H, т, J=12,5 Гц), 7,29-7,39 (5H, м).
Стадия 4
(5S)-5-(Гидроксиметил)-4-метилморфолин-3-он
Соединение, полученное на описанной выше стадии 3 (454 мг), растворяли в этаноле и добавляли 20% гидроксид палладия. Смесь подвергали взаимодействию в атмосфере водорода при комнатной температуре в течение 14 часов. Растворитель реакционной смеси фильтровали через целит, промывали этанолом и потом отгоняли. Остаток растворяли в небольшом количестве ацетонитрила и раствор фильтровали с помощью хлопкового фильтра. Фильтрат концентрировали с получением указанного в заголовке соединения (276 мг) в виде бесцветного масла.
MS (APCI) m/z: 146 [M+H]+.
1H-ЯМР (CDCl3) δ: 3,06 (3H, с), 3,28-3,32 (1H, м), 3,81-3,92 (3H, м).
Стадия 5
6-Бром-3-циклогекс-1-ен-1-ил-1-{[(3S)-4-метил-5-оксоморфолин-3-ил]метил}-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (318 мг) получали в виде бесцветных игольчатых кристаллов способом, аналогичным применяемому на стадии 3 примера 35, используя соединение, полученное на стадии 2 примера 35 (235 мг), и соединение, полученное на описанной выше стадии 4 (174 мг).
MS (APCI) m/z: 421 [M+H]+.
1H-ЯМР (CDCl3) δ: 1,71-1,79 (2H, м), 1,83-1,91 (2H, м), 2,28-2,46 (4H, м), 3,14 (3H, с), 3,62-3,68 (1H, м), 3,71-3,81 (2H, м), 4,00 (1H, дд, J=14,0, 9,9 Гц), 4,18 (1H, ддд, J=14,2, 3,9, 1,2 Гц), 4,19 (1H, д, J=16,6 Гц), 4,35 (1H, д, J=16,6 Гц), 6,00-6,03 (1H, м), 7,43 (1H, д, J=2,0 Гц), 8,13 (1H, д, J=2,0 Гц).
Стадия 6
3-Циклогекс-1-ен-1-ил-1-{[(3S)-4-метил-5-оксоморфолин-3-ил]метил}-6-(1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (133 мг) получали способом, аналогичным применяемому на стадии 3 примера 1, используя соединение, полученное на вышеуказанной стадии 5 (169 мг), и 5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пирроло[2,3-b]пиридин (107 мг).
MS (APCI) m/z: 459 [M+H]+.
Стадия 7
1-{[(3S)-4-Метил-5-оксоморфолин-3-ил]метил}-6-(1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Соединение, полученное на описанной выше стадии 6 (133 мг), растворяли в растворителе, состоящем из этанола (1 мл), воды (0,5 мл) и концентрированной серной кислоты (0,5 мл), и смесь перемешивали при 80°C в течение трех дней. Реакционный раствор нейтрализовали карбонатом натрия и потом концентрировали досуха. Остаток растворяли в 1,4-диоксане (10 мл) и 4 н. соляной кислоте (10 мл) и раствор перемешивали при комнатной температуре в течение двух дней. После экстрагирования смесью дихлорметан/метанол (9/1) неорганическую соль удаляли с помощью PorapakTM RxnCX, затем элюировали 5% водной смесью аммиак/этанол. Элюат концентрировали и потом растворяли в этаноле (3 мл) и воде (1 мл). Добавляли хлорид 4-(4,6-диметокси-1,3,5-триазин-2-ил)-4-метилморфолина (160 мг) и смесь перемешивали при комнатной температуре в течение 14 часов. Растворитель концентрировали и потом добавляли воду, затем в достаточной мере перемешивали. Нерастворимое вещество собирали фильтрованием, промывали водой и этилацетатом и затем сушили отсасыванием с получением указанного в заголовке соединения (30 мг) в виде кристаллического вещества кремового цвета.
MS (APCI) m/z: 379 [M+H]+.
1H-ЯМР (ДМСО-d6) δ: 2,91 (3H, с), 3,59-4,22 (7H, м), 6,49-6,52 (1H, м), 7,50-7,53 (1H, м), 7,72-7,76 (1H, м), 8,20-8,22 (1H, м), 8,23-8,25 (1H, м), 8,49-8,52 (1H, м), 11,72 (2H, ушир. с).
(Пример 110)
1-[(5-Оксоморфолин-2-ил)метил]-6-(1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
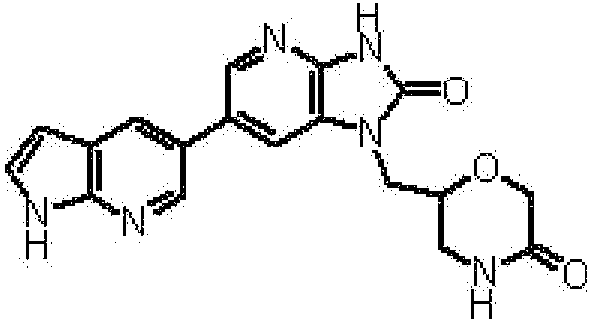
Стадия 1
6-(Гидроксиметил)морфолин-3-он
Трет-бутоксид калия (1,08 г) растворяли в 2-метилбутан-2-оле (7,7 мл). Раствор 2-хлор-N-(2,3-дигидроксипропил)ацетамида, полученный способом, описанным в WO 2007/6715 (1,61 г), в 2-метилбутан-2-оле (16,4 мл) добавляли по каплям в атмосфере азота в течение одного часа. После завершения добавления смесь далее перемешивали в течение одного часа и потом растворитель реакционной смеси отгоняли. Остаток очищали хроматографией на колонке с силикагелем (элюируя смесью этилацетат-этанол) с получением указанного в заголовке соединения (488 мг).
MS (APCI) m/z: 132 [M+H]+.
1H-ЯМР (ДМСО-d6) δ: 3,07 (1H, т, J=11,2 Гц), 3,13-3,20 (1H, м), 3,38-3,51 (2H, м), 3,62-3,68 (1H, м), 4,00 (2H, д, J=5,6 Гц).
Стадия 2
6-Бром-3-циклогекс-1-ен-1-ил-1-[(5-оксоморфолин-2-ил)метил]-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (285 мг) получали способом, аналогичным применяемому на стадии 3 примера 35, используя соединение, полученное на стадии 2 примера 35 (235 мг), и соединение, полученное на описанной выше стадии 1 (157 мг).
MS (APCI) m/z: 407 [M+H]+.
Стадия 3
3-Циклогекс-1-ен-1-ил-1-[(5-оксоморфолин-2-ил)метил]-6-(1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (117 мг) получали способом, аналогичным применяемому на стадии 3 примера 1, используя соединение, полученное на вышеуказанной стадии 2 (163 мг), и 5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пирроло[2,3-b]пиридин (107 мг).
MS (APCI) m/z: 445 [M+H]+.
Стадия 4
1-[(5-Оксоморфолин-2-ил)метил]-6-(1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (61 мг) получали способом, аналогичным применяемому на стадии 7 примера 109, используя соединение, полученное на вышеуказанной стадии 3 (117 мг).
MS (APCI) m/z: 365 [M+H]+.
1H-ЯМР (ДМСО-d6) δ: 3,93-4,15 (7H, м), 6,49 (1H, дд, J=3,7, 1,8 Гц), 7,51 (1H, т, J=2,3 Гц), 7,84 (1H, д, J=2,3 Гц), 7,98 (1H, д, J=3,7 Гц), 8,22 (1H, д, J=2,3 Гц), 8,24 (1H, д, J=1,8 Гц), 8,52 (1H, д, J=2,3 Гц), 11,64 (1H, ушир. с), 11,71 (1H, ушир. с).
(Пример 111)
2,6-Ангидро-1,3,4-тридеокси-1-[2-оксо-6-(1H-пирроло[2,3-b]пиридин-5-ил)-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил]-DL-эритро-гекситол
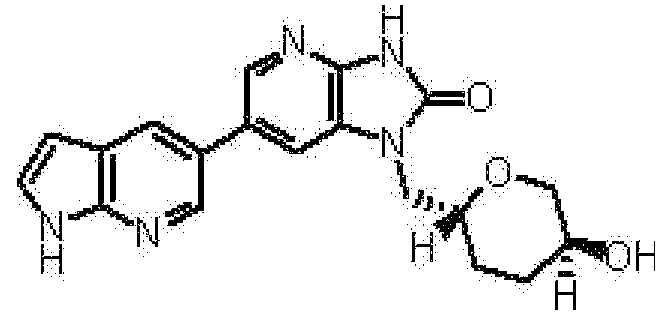
и его энантиомер
Стадия 1
2,6-Ангидро-5-O-бензоил-1-O-[трет-бутил(дифенил)силил]-3,4-дидеокси-DL-эритро-гекситол
2,6-Ангидро-1-O-[трет-бутил(дифенил)силил]-3,4-дидеокси-DL-эритро-гекситол, полученный способом, описанным в Bioorg. Med. Chem. 2006, 14, 3953 (542 мг), растворяли в метиленхлориде (15 мл). Пиридин (236 мкл) и бензоилхлорид (255 мкл) последовательно добавляли при охлаждении льдом и смесь перемешивали при комнатной температуре в течение ночи. К реакционному раствору добавляли воду, затем экстрагировали этилацетатом. Далее органический слой последовательно промывали 10% водным раствором лимонной кислоты, насыщенным водным раствором бикарбоната натрия и насыщенным солевым раствором. Полученный органический слой сушили над безводным сульфатом натрия. Растворитель упаривали при пониженном давлении. Полученный остаток очищали хроматографией на колонке с силикагелем (элюируя смесью этилацетат-гексан) с получением указанного в заголовке соединения (285 мг) в виде твердого вещества коричневого цвета.
1H-ЯМР (CDCl3) δ: 1,07 (9H, с), 1,52-1,58 (1H, м), 1,60-1,70 (1H, м), 1,88-1,93 (1H, м), 2,28-2,33 (1H, м), 3,35 (1H, т, J=10,4 Гц), 3,43-3,49 (1H, м), 3,59 (1H, дд, J=10,5, 5,6 Гц), 3,76 (1H, дд, J=10,3, 5,4 Гц), 4,13-4,17 (1H, м), 4,98-5,04 (1H, м), 7,37-7,45 (8H, м), 7,54-7,58 (1H, м), 7,66-7,69 (4H, м), 8,01-8,03 (2H, м).
Стадия 2
2,6-Ангидро-5-O-бензоил-3,4-дидеокси-DL-эритро-гекситол
Указанное в заголовке соединение (180 мг) получали в виде твердого вещества коричневого цвета способом, аналогичным применяемому на стадии 4 примера 62, используя соединение, полученное на вышеуказанной стадии 1 (400 мг).
1H-ЯМР (CDCl3) δ: 1,56-1,61 (1H, м), 1,66-1,76 (2H, м), 1,98 (1H, ушир. с), 2,30-2,35 (1H, м), 3,40 (1H, т, J=10,6 Гц), 3,47-3,52 (1H, м), 3,55-3,59 (1H, м), 3,63-3,67 (1H, м), 4,20-4,23 (1H, м), 4,99-5,06 (1H, м), 7,44 (2H, т, J=7,7 Гц), 7,57 (1H, т, J=7,5 Гц), 8,02 (2H, д, J=6,9 Гц).
Стадия 3
2,6-Ангидро-5-O-бензоил-1-(6-бром-3-циклогекс-1-ен-1-ил-2-оксо-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил)-1,3,4-тридеокси-DL-эритро-гекситол
Указанное в заголовке соединение (315 мг) получали в виде бесцветного твердого вещества способом, аналогичным применяемому на стадии 3 примера 35, используя соединение, полученное на стадии 2 примера 35 (200 мг), и соединение, полученное на описанной выше стадии 2 (176 мг).
MS (ESI) m/z: 512 (M+H)+.
1H-ЯМР (CDCl3) δ: 1,59-1,78 (4H, м), 1,84-1,89 (2H, м), 1,91-1,96 (1H, м), 2,29-2,34 (3H, м), 2,42-2,45 (2H, м), 3,29 (1H, м), 3,68-3,74 (1H, м), 3,79 (1H, дд, J=14,4, 7,3 Гц), 4,02 (1H, дд, J=14,4, 2,7 Гц), 4,14-4,18 (1H, м), 4,96-5,04 (1H, м), 6,01-6,03 (1H, м), 7,41-7,45 (2H, м), 7,51 (1H, д, J=2,0 Гц), 7,54-7,58 (1H, м), 7,99-8,01 (2H, м), 8,09 (1H, д, J=2,0 Гц).
Стадия 4
2,6-Ангидро-1-[3-циклогекс-1-ен-1-ил-2-оксо-6-(1H-пирроло[2,3-b]пиридин-5-ил)-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил]-1,3,4-тридеокси-DL-эритро-гекситол
5-(4,4,5,5-Тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пирроло[2,3-b]пиридин (85 мг) соединяли с соединением, полученным на описанной выше стадии 3 (150 мг), способом, аналогичным применяемому на стадии 3 примера 1. Затем полученный остаток растворяли в метаноле (5 мл), добавляли карбонат калия (81 мг) при охлаждении льдом и смесь перемешивали в течение ночи при постепенном нагревании до комнатной температуры. Растворитель реакционной смеси отгоняли при пониженном давлении, разбавляли этилацетатом и промывали насыщенным солевым раствором. Полученный органический слой сушили над безводным сульфатом натрия. Растворитель упаривали при пониженном давлении. Полученный остаток очищали хроматографией на колонке с силикагелем (элюируя смесью метанол-хлороформ) с получением указанного в заголовке соединения (92 мг) в виде твердого вещества светло-желтого цвета.
MS (ESI) m/z: 446 (M+H)+.
1H-ЯМР (CDCl3) δ: 1,43-1,51 (3H, м), 1,75-1,79 (2H, м), 1,88-1,91 (3H, м), 2,15-2,19 (1H, м), 2,32-2,36 (2H, м), 2,49-2,52 (2H, м), 3,08 (1H, т, J=10,6 Гц), 3,65-3,71 (2H, м), 3,88 (1H, дд, J=14,6, 7,2 Гц), 3,96-4,00 (1H, м), 4,06 (1H, дд, J=14,6, 3,2 Гц), 6,08 (1H, с), 6,58-6,60 (1H, м), 7,38 (1H, т, J=2,9 Гц), 7,57 (1H, д, J=1,7 Гц), 8,07 (1H, д, J=1,7 Гц), 8,28 (1H, д, J=1,7 Гц), 8,49 (1H, д, J=1,7 Гц), 8,88 (1H, ушир. с).
Стадия 5
2,6-Ангидро-1,3,4-тридеокси-1-[2-оксо-6-(1H-пирроло[2,3-b]пиридин-5-ил)-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил]-DL-эритро-гекситол
Указанное в заголовке соединение (7 мг) получали в виде матово-белого твердого вещества способом, аналогичным применяемому на стадии 6 примера 35, используя соединение, полученное на вышеуказанной стадии 4 (90 мг).
HRMS (ESI) [M+H]+ вычислено: C19H20N5O3 366,15661; найдено: 366,15678.
MS (ESI) m/z: 366 (M+H)+.
1H-ЯМР (ДМСО-d6) δ: 1,24-1,36 (2H, м), 1,69-1,73 (1H, м), 1,92-1,97 (1H, м), 2,89 (1H, т, J=10,4 Гц), 3,37-3,43 (1H, м), 3,58-3,64 (1H, м), 3,72-3,76 (1H, м), 3,82-3,95 (2H, м), 4,76 (1H, д, J=4,9 Гц), 6,52 (1H, дд, J=3,3, 1,8 Гц), 7,53 (1H, т, J=2,8 Гц), 7,80 (1H, д, J=2,0 Гц), 8,22-8,23 (2H, м), 8,52 (1H, д, J=2,0 Гц), 11,59 (1H, ушир. с), 11,74 (1H, ушир. с).
(Пример 112)
2,6-Ангидро-1,3,4-тридеокси-1-[2-оксо-6-(1H-пирроло[2,3-b]пиридин-5-ил)-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил]-DL-трео-гекситол
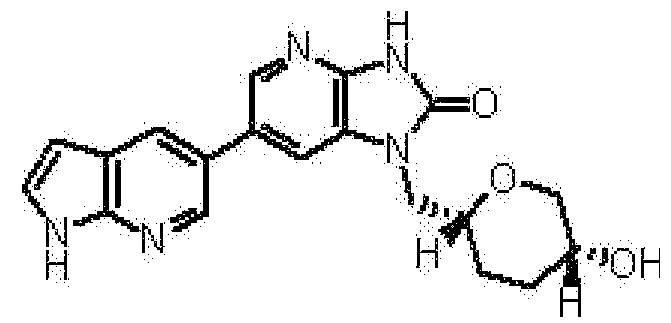
и его энантиомер
Стадия 1
2,6-Ангидро-5-O-бензоил-1-O-[трет-бутил(дифенил)силил]-3,4-дидеокси-DL-трео-гекситол
2,6-Ангидро-1-O-[трет-бутил(дифенил)силил]-3,4-дидеокси-DL-эритро-гекситол, полученный способом, описанным в Bioorg. Med. Chem. 2006, 14, 3953 (4,35 г), растворяли в тетрагидрофуране (80 мл) и добавляли бензойную кислоту (1,72 г) и трифенилфосфин (3,69 г). Добавляли по каплям при охлаждении льдом диизопропилазодикарбоксилат (2,87 мл) и смесь перемешивали в течение одного часа при постепенном нагревании до комнатной температуры. Реакционный раствор разбавляли этилацетатом и органический слой последовательно промывали водой, 10% водным раствором лимонной кислоты, насыщенным водным раствором бикарбоната натрия и насыщенным солевым раствором. Полученный органический слой сушили над безводным сульфатом натрия. Растворитель упаривали при пониженном давлении. Полученный остаток очищали хроматографией на колонке с силикагелем (элюируя смесью метанол-хлороформ) с получением указанного в заголовке соединения (2,94 г) в виде бесцветного масла.
1H-ЯМР (CDCl3) δ: 1,07 (9H, с), 1,62-1,66 (1H, м), 1,82-1,87 (2H, м), 2,13-2,18 (1H, м), 3,48-3,54 (1H, м), 3,64-3,69 (2H, м), 3,78 (1H, дд, J=10,5, 5,1 Гц), 4,11-4,16 (1H, м), 5,06 (1H, с), 7,35-7,44 (8H, м), 7,53-7,58 (1H, м), 7,67-7,71 (4H, м), 8,07-8,09 (2H, м).
Стадия 2
2,6-Ангидро-5-O-бензоил-3,4-дидеокси-DL-трео-гекситол
Указанное в заголовке соединение (0,43 г) получали в виде бесцветного масла способом, аналогичным применяемому на стадии 4 примера 62, используя соединение, полученное на вышеуказанной стадии 1 (1 г).
MS (ESI) m/z: 237 (M+H)+.
1H-ЯМР (CDCl3) δ: 1,47-1,51 (1H, м), 1,79-1,93 (2H, м), 2,05 (1H, дд, J=7,5, 4,6 Гц), 2,16-2,20 (1H, м), 3,55-3,69 (3H, м), 3,74 (1H, дд, J=12,9, 1,4 Гц), 4,20 (1H, м), 5,09 (1H, с), 7,44-7,47 (2H, м), 7,56-7,59 (1H, м), 8,08-8,10 (2H, м).
Стадия 3
2,6-Ангидро-5-O-бензоил-1-(6-бром-3-циклогекс-1-ен-1-ил-2-оксо-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил)-1,3,4-тридеокси-DL-трео-гекситол
Указанное в заголовке соединение (810 мг) получали в виде бесцветного твердого вещества способом, аналогичным применяемому на стадии 3 примера 35, используя соединение, полученное на стадии 2 примера 35 (480 мг), и соединение, полученное на описанной выше стадии 2 (424 мг).
MS (ESI) m/z: 512 (M+H)+.
1H-ЯМР (CDCl3) δ: 1,64-1,68 (1H, м), 1,72-1,78 (3H, м), 1,84-1,89 (3H, м), 2,14-2,19 (1H, м), 2,29-2,31 (2H, м), 2,40-2,43 (2H, м), 3,65 (1H, дд, J=12,9, 1,4 Гц), 3,78-3,82 (1H, м), 3,93-4,01 (2H, м), 4,13-4,17 (1H, м), 5,04 (1H, с), 6,00-6,01 (1H, м), 7,42 (2H, т, J=8,0 Гц), 7,55-7,58 (2H, м), 7,92 (2H, дд, J=8,0, 1,2 Гц), 8,08 (1H, д, J=1,7 Гц).
Стадия 4
2,6-Ангидро-1-[3-циклогекс-1-ен-1-ил-2-оксо-6-(1H-пирроло[2,3-b]пиридин-5-ил)-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил]-1,3,4-тридеокси-DL-трео-гекситол
Указанное в заголовке соединение (174 мг) получали в виде светло-желтого масла способом, аналогичным применяемому на стадии 4 примера 111, используя 5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пирроло[2,3-b]пиридин (171 мг) и соединение, полученное на описанной выше стадии 3 (300 мг).
MS (ESI) m/z: 446 (M+H)+.
1H-ЯМР (CDCl3) δ: 1,62-1,66 (2H, м), 1,73-1,81 (3H, м), 1,88-1,93 (2H, м), 1,95-1,99 (1H, м), 2,14-2,18 (1H, м), 2,33-2,36 (2H, м), 2,49-2,52 (2H, м), 3,56 (1H, дд, J=13,2, 1,7 Гц), 3,74-3,79 (2H, м), 3,89-3,95 (2H, м), 4,06 (1H, дд, J=14,6, 3,2 Гц), 6,07-6,09 (1H, м), 6,59 (1H, дд, J=3,4, 2,3 Гц), 7,39-7,40 (1H, м), 7,60 (1H, д, J=1,7 Гц), 8,07 (1H, д, J=2,3 Гц), 8,28 (1H, д, J=1,7 Гц), 8,49 (1H, д, J=2,3 Гц), 9,20 (1H, ушир. с).
Стадия 5
2,6-Ангидро-1,3,4-тридеокси-1-[2-оксо-6-(1H-пирроло[2,3-b]пиридин-5-ил)-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил]-DL-трео-гекситол
Указанное в заголовке соединение (10 мг) получали в виде светло-желтого твердого вещества способом, аналогичным применяемому на стадии 6 примера 35, используя соединение, полученное на вышеуказанной стадии 4 (170 мг).
MS (ESI) m/z: 366 (M+H)+.
1H-ЯМР (ДМСО-d6) δ: 1,61-1,73 (2H, м), 3,36-3,39 (1H, м), 3,53-3,70 (3H, м), 3,82-3,86 (1H, м), 3,94-3,99 (1H, м), 4,57 (1H, д, J=4,0 Гц), 6,51 (1H, дд, J=3,4, 1,7 Гц), 7,53 (1H, т, J=2,9 Гц), 7,82 (1H, д, J=1,7 Гц), 8,22 (2H, т, J=2,3 Гц), 8,52 (1H, д, J=2,3 Гц), 11,59 (1H, с), 11,74 (1H, с).
(Пример 113)
2,6-Ангидро-1,3,4-тридеокси-5-O-метил-1-[2-оксо-6-(1H-пирроло[2,3-b]пиридин-5-ил)-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил]-DL-трео-гекситол
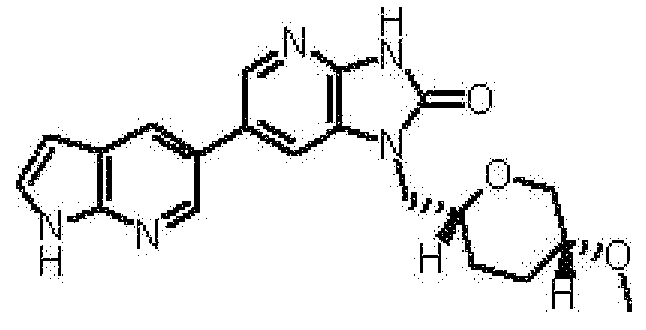
и его энантиомер
Стадия 1
2,6-Ангидро-1-O-[трет-бутил(дифенил)силил]-3,4-дидеокси-DL-трео-гекситол
Соединение, полученное на стадии 1 примера 112 (1 г), растворяли в метаноле (20 мл). Добавляли карбонат калия (0,58 г) при охлаждении льдом и смесь перемешивали в течение дня и ночи при постепенном нагревании до комнатной температуры. При пониженном давлении отгоняли растворитель реакционной смеси и потом разбавляли этилацетатом. Органический слой промывали насыщенным солевым раствором и полученный органический слой сушили над безводным сульфатом натрия. Растворитель упаривали при пониженном давлении. Полученный остаток очищали хроматографией на колонке с силикагелем (элюируя смесью этилацетат-гексан) с получением указанного в заголовке соединения (0,69 г) в виде бесцветного масла.
MS (ESI) m/z: 393 (M+Na)+.
1H-ЯМР (CDCl3) δ: 1,06 (9H, с), 1,65-1,70 (2H, м), 1,91-1,95 (1H, м), 2,16-2,18 (1H, м), 3,43-3,48 (1H, м), 3,55-3,60 (2H, м), 3,71-3,76 (2H, м), 3,88 (1H, м), 7,36-7,44 (6H, м), 7,66-7,68 (4H, м).
Стадия 2
2,6-Ангидро-1-O-[трет-бутил(дифенил)силил]-3,4-дидеокси-5-O-метил-DL-трео-гекситол
Указанное в заголовке соединение (0,69 г) получали в виде бесцветного масла способом, аналогичным применяемому на стадии 1 примера 63, используя соединение, полученное на вышеуказанной стадии 1 (0,68 г).
MS (ESI) m/z: 407 (M+Na)+.
1H-ЯМР (CDCl3) δ: 1,05 (9H, с), 1,59-1,64 (3H, м), 2,04-2,08 (1H, м), 3,23 (1H, ушир. с), 3,35 (3H, с), 3,44-3,50 (2H, м), 3,54 (1H, дд, J=10,0, 6,6 Гц), 3,76 (1H, дд, J=10,0, 5,4 Гц), 4,04 (1H, м), 7,35-7,42 (6H, м), 7,66 (4H, дд, J=8,0, 1,2 Гц).
Стадия 3
2,6-Ангидро-5-O-бензоил-3,4-дидеокси-DL-трео-гекситол
Указанное в заголовке соединение (220 мг) получали в виде бесцветного масла способом, аналогичным применяемому на стадии 4 примера 62, используя соединение, полученное на вышеуказанной стадии 2 (600 мг).
1H-ЯМР (CDCl3) δ: 1,58-1,70 (2H, м), 2,06-2,11 (1H, м), 3,26-3,28 (1H, м), 3,37 (3H, с), 3,46-3,49 (1H, м), 3,49-3,53 (1H, м), 3,56-3,59 (2H, м), 4,11 (1H, м).
Стадия 4
2,6-Ангидро-1-(6-бром-3-циклогекс-1-ен-1-ил-2-оксо-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил)-1,3,4-тридеокси-5-O-метил-DL-трео-гекситол
Указанное в заголовке соединение (440 мг) получали в виде бесцветного твердого вещества способом, аналогичным применяемому на стадии 3 примера 35, используя соединение, полученное на стадии 2 примера 35 (330 мг), и соединение, полученное на описанной выше стадии 3 (180 мг).
MS (ESI) m/z: 424 (M+H)+.
1H-ЯМР (CDCl3) δ: 1,52-1,55 (1H, м), 1,57-1,69 (1H, м), 1,71-1,77 (3H, м), 1,83-1,89 (2H, м), 2,12 (1H, м), 2,28-2,32 (2H, м), 2,40-2,44 (2H, м), 3,24 (1H, с), 3,39 (3H, с), 3,41 (1H, дд, J=12,6, 1,6 Гц), 3,65-3,77 (2H, м), 4,00 (1H, дд, J=14,0, 2,5 Гц), 4,03-4,08 (1H, м), 5,99-6,01 (1H, м), 7,60 (1H, д, J=1,8 Гц), 8,06 (1H, д, J=1,8 Гц).
Стадия 5
2,6-Ангидро-1-[3-циклогекс-1-ен-1-ил-2-оксо-6-(1H-пирроло[2,3-b]пиридин-5-ил)-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил]-1,3,4-тридеокси-5-O-метил-DL-трео-гекситол
Указанное в заголовке соединение (210 мг) получали в виде светло-желтого масла способом, аналогичным применяемому на стадии 2 примера 4, используя 5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пирроло[2,3-b]пиридин (138 мг) и соединение, полученное на описанной выше стадии 4 (200 мг).
MS (ESI) m/z: 460 (M+H)+.
1H-ЯМР (CDCl3) δ: 1,57-1,67 (3H, м), 1,75-1,80 (2H, м), 1,88-1,92 (2H, м), 2,13 (1H, д, J=13,3 Гц), 2,32-2,37 (2H, м), 2,48-2,52 (2H, ушир. м), 3,24 (1H, ушир. с), 3,37 (3H, с), 3,44 (1H, д, J=12,4 Гц), 3,71-3,77 (1H, м), 3,90 (1H, дд, J=14,7, 7,8 Гц), 4,04-4,10 (2H, м), 6,06-6,09 (1H, м), 6,58-6,60 (1H, м), 7,40 (1H, д, J=1,8 Гц), 7,68 (1H, с), 8,08 (1H, с), 8,28 (1H, с), 8,50 (1H, с), 9,24 (1H, с).
Стадия 6
2,6-Ангидро-1,3,4-тридеокси-5-O-метил-1-[2-оксо-6-(1H-пирроло[2,3-b]пиридин-5-ил)-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил]-DL-трео-гекситол
Указанное в заголовке соединение (55 мг) получали в виде светло-желтого твердого вещества способом, аналогичным применяемому на стадии 6 примера 35, используя соединение, полученное на вышеуказанной стадии 5 (210 мг).
MS (ESI) m/z: 380 (M+H)+.
1H-ЯМР (ДМСО-d6) δ: 1,41-1,45 (1H, м), 1,51-1,64 (2H, м), 1,90-1,94 (1H, м), 3,15-3,17 (1H, м), 3,20 (3H, с), 3,31-3,35 (1H, м), 3,71-3,75 (1H, м), 3,81-3,89 (2H, м), 3,92-3,97 (1H, м), 6,51 (1H, дд, J=3,4, 2,3 Гц), 7,53 (1H, т, J=2,9 Гц), 7,83 (1H, д, J=1,7 Гц), 8,23 (2H, т, J=1,7 Гц), 8,52 (1H, д, J=2,3 Гц), 11,60 (1H, с), 11,74 (1H, с).
(Пример 114)
2,6-Ангидро-1,3,5-тридеокси-4-O-метил-1-[2-оксо-6-(1H-пирроло[2,3-b]пиридин-5-ил)-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил]-DL-трео-гекситол
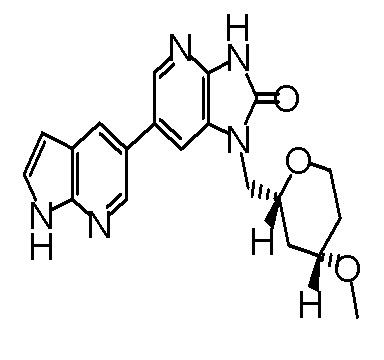
и его энантиомер
Стадия 1
2,6-Ангидро-1-O-бензил-3,5-дидеокси-DL-трео-гекс-5-энитол
2-[(Бензилокси)метил]-2,3-дигидро-4H-пиран-4-он, полученный способом, описанным в WO 2001/019831 (1,36 г), и хлоридгептагидрат церия(III) (2,31 г) растворяли в этаноле (26 мл) и метиленхлориде (52 мл). Далее атмосферу заменяли на азот, смесь охлаждали до -78°C и добавляли суспензию боргидрида натрия (259 мг) в этаноле (26 мл). После перемешивания при -78°C в течение 90 минут добавляли насыщенный водный раствор бикарбоната натрия. Смесь нагревали до комнатной температуры и потом фильтровали через целит. Фильтрат экстрагировали этилацетатом три раза. Органический слой промывали насыщенным солевым раствором и потом сушили над безводным сульфатом натрия и растворитель упаривали. Остаток очищали хроматографией на колонке с силикагелем (элюируя смесью этилацетат-гексан) с получением указанного в заголовке соединения (1,34 г) в виде масла коричневого цвета.
1H-ЯМР (CDCl3) δ: 1,75-1,77 (2H, м), 2,17-2,23 (1H, м), 3,62 (2H, дкв, J=23,2, 5,1 Гц), 4,16-4,22 (1H, м), 4,40-4,41 (1H, м), 4,60 (2H, с), 4,79 (1H, дкв, J=6,2, 1,2 Гц), 6,41 (1H, дд, J=6,2, 1,2 Гц), 7,29-7,34 (6H, м).
Стадия 2
2,6-Ангидро-1-O-бензил-3,5-дидеокси-DL-трео-гекситол
Соединение, полученное на описанной выше стадии 1 (1,33 мг), растворяли в этаноле (1 мл) и добавляли 10% палладий на угле. Смесь перемешивали в атмосфере водорода при комнатной температуре в течение 3 часов. Реакционный раствор фильтровали через целит и фильтрат концентрировали. После этого остаток очищали хроматографией на колонке с силикагелем (элюируя смесью этилацетат-гексан) с получением указанного в заголовке соединения (1,22 г) в виде бесцветного масла.
1H-ЯМР (CDCl3) δ: 1,26-1,34 (1H, м), 1,48-1,58 (2H, м), 1,86-1,95 (2H, м), 3,40-3,58 (4H, м), 3,79-3,82 (1H, м), 4,07 (1H, ддд, J=11,8, 2,2, 1,1 Гц), 4,58 (2H, дд, J=19,9, 12,1 Гц), 7,26-7,37 (5H, м).
Стадия 3
2,6-Ангидро-1-O-бензил-3,5-дидеокси-4-O-метил-DL-трео-гекситол
Указанное в заголовке соединение (569 мг) получали в виде бесцветного масла способом, аналогичным применяемому на стадии 1 примера 63, используя соединение, полученное на вышеуказанной стадии 2 (546 мг).
1H-ЯМР (CDCl3) δ: 1,19-1,28 (1H, м), 1,45-1,50 (1H, м), 1,92-2,02 (2H, м), 3,31-3,57 (5H, м), 3,35 (3H, с), 4,09 (1H, ддд, J=11,7, 4,9, 1,7 Гц), 4,58 (2H, дд, J=34,9, 17,5 Гц), 7,26-7,36 (5H, м).
Стадия 4
1,5-Ангидро-2,4-дидеокси-3-O-метил-DL-трео-гекситол
Соединение, полученное на описанной выше стадии 3 (561 мг), растворяли в этаноле (3 мл) и добавляли 20% гидроксид палладия. Смесь перемешивали в атмосфере водорода при комнатной температуре в течение 21 часов. Реакционный раствор фильтровали через целит и промывали этанолом и фильтрат концентрировали. Масло растворяли в этилацетате и раствор фильтровали с помощью хлопкового фильтра. После этого фильтрат концентрировали с получением указанного в заголовке соединения (337 мг) в виде бесцветного масла.
1H-ЯМР (CDCl3) δ: 1,22 (1H, дд, J=23,4, 11,4 Гц), 1,42-1,52 (1H, м), 1,91-2,00 (2H, м), 2,09 (1H, ушир. с), 3,19-3,47 (3H, м), 3,36 (3H, с), 3,57-3,61 (2H, м), 4,08 (1H, ддд, J=11,6, 4,9, 1,5 Гц).
Стадия 5
3-Циклогекс-1-ен-1-ил-6-(1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (1,39 г) получали способом, аналогичным применяемому на стадии 3 примера 1, используя 5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пирроло[2,3-b]пиридин (1,83 г) и соединение, полученное на стадии 2 примера 35 (2,00 г).
MS (APCI) m/z: 332 [M+H]+.
1H-ЯМР (ДМСО-d6) δ: 1,65-1,69 (2H, м), 1,75-1,81 (2H, м), 2,23-2,24 (2H, м), 2,39-2,39 (2H, м), 5,93-5,94 (1H, м), 6,51 (1H, дд, J=3,4, 2,0 Гц), 7,52-7,53 (1H, м), 7,56 (1H, д, J=2,0 Гц), 8,19 (1H, д, J=2,0 Гц), 8,24 (1H, д, J=2,0 Гц), 8,48 (1H, д, J=2,2 Гц), 11,27 (1H, ушир. с), 11,74 (1H, ушир. с).
Стадия 6
2,6-Ангидро-1-[3-циклогекс-1-ен-1-ил-2-оксо-6-(1H-пирроло[2,3-b]пиридин-5-ил)-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил]-1,3,5-тридеокси-4-O-метил-DL-трео-гекситол
Сырое указанное в заголовке соединение получали способом, аналогичным применяемому на стадии 3 примера 35, используя соединение, полученное на вышеуказанной стадии 4 (88 мг), и соединение, полученное на описанной выше стадии 5 (133 мг).
MS (APCI) m/z: 460 [M+H]+.
Стадия 7
2,6-Ангидро-1,3,5-тридеокси-4-O-метил-1-[2-оксо-6-(1H-пирроло[2,3-b]пиридин-5-ил)-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил]-DL-трео-гекситол
Указанное в заголовке соединение (41 мг) получали способом, аналогичным применяемому на стадии 6 примера 35, используя соединение, полученное на вышеуказанной стадии 7.
MS (APCI) m/z: 380 [M+H]+.
1H-ЯМР (ДМСО-d6) δ: 1,08 (1H, дд, J=11,4, 5,7 Гц), 1,20-1,24 (2H, м), 1,84-1,87 (1H, ушир. м), 2,03-2,05 (1H, ушир. м), 3,22 (3H, с), 3,67-3,69 (1H, ушир. м), 3,83-3,88 (2H, м), 3,97 (1H, дд, J=14,2, 7,8 Гц), 6,50 (1H, дд, J=3,4, 1,6 Гц), 7,51 (1H, т, J=3,0 Гц), 7,79 (1H, д, J=1,8 Гц), 8,21 (2H, дд, J=4,4, 2,1 Гц), 8,50 (1H, д, J=2,3 Гц), 11,70 (1H, ушир. с).
(Пример 115)
6-(3-Хлор-1H-пирроло[2,3-b]пиридин-5-ил)-1-[(цис-4-метоксициклогексил)метил]-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
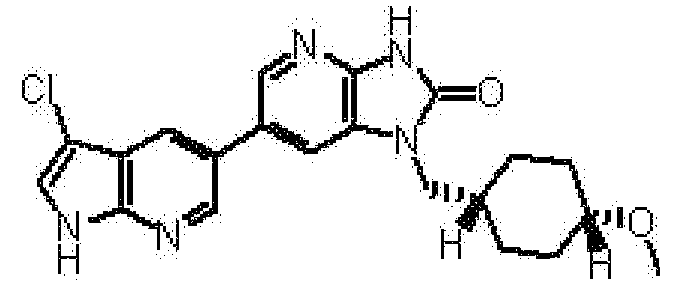
Стадия 1
3-Циклогекс-1-ен-1-ил-1-[(цис-4-метоксициклогексил)метил]-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (224 мг) получали способом, аналогичным применяемому на стадии 4 примера 35, используя соединение, полученное на стадии 2 примера 99 (300 мг).
1H-ЯМР (CDCl3) δ: 1,36 (12H, с), 1,41-1,44 (6H, м), 1,73-1,76 (2H, м), 1,86-1,88 (2H, м), 1,92-1,94 (3H, м), 2,30-2,32 (2H, м), 2,43-2,44 (2H, м), 3,31 (3H, с), 3,42-3,45 (1H, м), 3,71 (2H, д, J=7,3 Гц), 6,01-6,02 (1H, м), 7,48 (1H, д, J=1,5 Гц), 8,43 (1H, д, J=1,5 Гц).
Стадия 2
6-(3-Хлор-1H-пирроло[2,3-b]пиридин-5-ил)-3-циклогекс-1-ен-1-ил-1-[(цис-4-метоксициклогексил)метил]-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (145 мг) получали способом, аналогичным применяемому на стадии 3 примера 1, используя соединение, полученное на стадии 1 примера 35 (167 мг), и соединение, полученное на описанной выше стадии 1 (224 мг).
MS (ESI) m/z: 492 (M+H)+.
1H-ЯМР (CDCl3) δ: 1,34-1,55 (6H, м), 1,73-1,82 (2H, м), 1,86-2,01 (5H, м), 2,29-2,38 (2H, м), 2,46-2,54 (2H, м), 3,30 (3H, с), 3,41-3,47 (1H, м), 3,79 (2H, д, J=7,3 Гц), 6,05-6,11 (1H, м), 7,36 (2H, д, J=2,8 Гц), 7,38 (2H, д, J=1,8 Гц), 8,07 (1H, д, J=1,8 Гц), 8,27 (1H, д, J=1,8 Гц), 8,53 (1H, д, J=1,8 Гц), 8,81 (1H, ушир. с).
Стадия 3
6-(3-Хлор-1H-пирроло[2,3-b]пиридин-5-ил)-1-[(цис-4-метоксициклогексил)метил]-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (87 мг) получали способом, аналогичным применяемому на стадии 6 примера 35, используя соединение, полученное на вышеуказанной стадии 2 (143 мг).
HRMS (ESI) [M+H]+ вычислено: C21H23ClN5O2 412,15403; найдено: 412,15085.
1H-ЯМР (ДМСО-d6) δ: 1,27-1,40 (7H, м), 1,73-1,85 (2H, м), 1,87-1,98 (1H, м), 3,19 (3H, с), 3,75 (2H, д, J=7,4 Гц), 7,74 (1H, д, J=2,9 Гц), 7,95 (1H, д, J=2,3 Гц), 8,18 (1H, д, J=2,3 Гц), 8,27 (1H, д, J=1,7 Гц), 8,64 (1H, д, J=1,7 Гц), 11,61 (1H, с), 12,09 (1H, ушир. с).
(Пример 116)
6-(3-Хлор-1H-пирроло[2,3-b]пиридин-5-ил)-1-[(цис-4-гидроксициклогексил)метил]-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
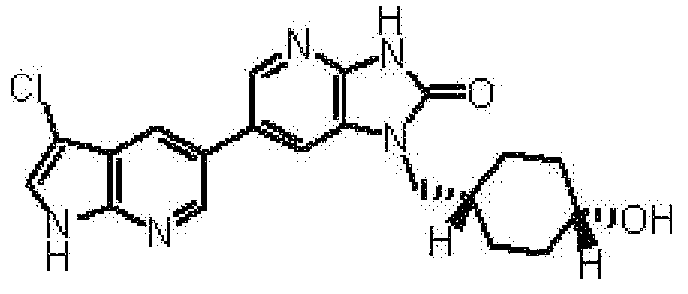
Стадия 1
1-[(Цис-4-{[трет-бутил(диметил)силил]окси}циклогексил)метил]-3-циклогекс-1-ен-1-ил-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (288 мг) получали способом, аналогичным применяемому на стадии 4 примера 35, используя соединение, полученное на стадии 2 примера 102 (400 мг).
1H-ЯМР (CDCl3) δ: 0,03 (6H, с), 0,89 (9H, с), 1,36 (12H, с), 1,40-1,43 (4H, м), 1,54-1,54 (2H, м), 1,65-1,77 (4H, м), 1,84-1,90 (3H, м), 2,28-2,33 (2H, м), 2,42-2,46 (2H, м), 3,73 (2H, д, J=7,6 Гц), 3,94-3,96 (1H, м), 6,00-6,02 (1H, м), 7,48 (1H, д, J=1,2 Гц), 8,43 (1H, д, J=1,2 Гц).
Стадия 2
1-[(Цис-4-{[трет-бутил(диметил)силил]окси}циклогексил)метил]-6-(3-хлор-1H-пирроло[2,3-b]пиридин-5-ил)-3-циклогекс-1-ен-1-ил-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (116 мг) получали способом, аналогичным применяемому на стадии 3 примера 1, используя соединение, полученное на стадии 1 примера 35 (143 мг), и соединение, полученное на описанной выше стадии 1 (245 мг).
1H-ЯМР (CDCl3) δ: 1,34-1,55 (6H, м), 1,73-1,82 (2H, м), 1,86-2,01 (5H, м), 2,29-2,38 (2H, м), 2,46-2,54 (2H, м), 3,30 (3H, с), 3,41-3,47 (1H, м), 3,79 (2H, д, J=7,3 Гц), 6,05-6,11 (1H, м), 7,36 (2H, д, J=2,8 Гц), 7,38 (2H, д, J=1,8 Гц), 8,07 (1H, д, J=1,8 Гц), 8,27 (1H, д, J=1,8 Гц), 8,53 (1H, д, J=1,8 Гц), 8,81 (1H, ушир. с).
Стадия 3
6-(3-Хлор-1H-пирроло[2,3-b]пиридин-5-ил)-1-[(цис-4-гидроксициклогексил)метил]-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (34 мг) получали способом, аналогичным применяемому на стадии 6 примера 35, используя соединение, полученное на вышеуказанной стадии 2 (115 мг).
HRMS (ESI) [M+H]+ вычислено: C20H21ClN5O2 398,13838; найдено: 398,13773.
1H-ЯМР (ДМСО-d6) δ: 0,99-1,15 (2H, м), 1,21-1,49 (4H, м), 1,51-1,70 (2H, м), 1,73-1,85 (1H, м), 3,67-3,85 (3H, м), 7,74 (1H, д, J=1,8 Гц), 7,85-7,97 (1H, м), 8,16-8,20 (1H, м), 8,27 (1H, д, J=1,8 Гц), 8,64 (1H, д, J=1,8 Гц), 11,61 (1H, ушир. с), 12,09 (1H, ушир. с).
(Пример 117)
6-(4-Хлор-1H-пирроло[2,3-b]пиридин-5-ил)-1-[(2S)-1,4-диоксан-2-илметил]-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
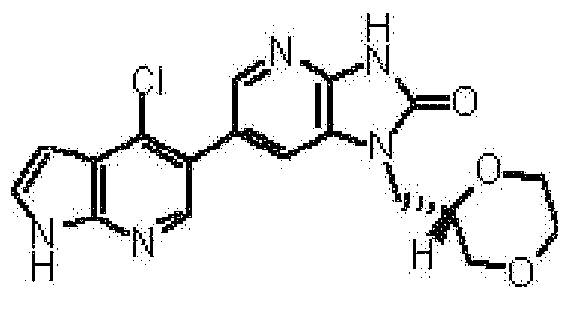
Стадия 1
6-(4-Хлор-1H-пирроло[2,3-b]пиридин-5-ил)-3-циклогекс-1-ен-1-ил-1-[(2S)-1,4-диоксан-2-илметил]-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (120 мг) получали способом, аналогичным применяемому на стадии 3 примера 1, используя 5-бром-4-хлор-1H-пирроло[2,3-b]пиридин (189 мг) и соединение, полученное на стадии 1 примера 41 (300 мг).
MS (ESI) m/z: 466 (M+H)+.
1H-ЯМР (CDCl3) δ: 1,73-1,82 (2H, м), 1,86-1,96 (3H, м), 2,30-2,39 (2H, м), 2,47-2,55 (2H, м), 3,37-3,45 (1H, м), 3,49 (2H, с), 3,53-3,62 (1H, м), 3,65-3,80 (3H, м), 3,86-4,02 (3H, м), 6,07-6,12 (1H, м), 6,66-6,71 (1H, м), 7,39-7,43 (1H, м), 7,56 (1H, д, J=1,8 Гц), 8,16 (1H, д, J=1,8 Гц), 8,27 (1H, с), 8,91 (1H, ушир. с).
Стадия 2
6-(4-Хлор-1H-пирроло[2,3-b]пиридин-5-ил)-1-[(2S)-1,4-диоксан-2-илметил]-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (71 мг) получали способом, аналогичным применяемому на стадии 6 примера 35, используя соединение, полученное на вышеуказанной стадии 1 (119 мг).
HRMS (ESI) [M+H]+ вычислено: C18H17ClN5O3 386,10199; найдено: 386,10206.
1H-ЯМР (ДМСО-d6) δ: 2,42-2,47 (1H, м), 3,37-3,62 (4H, м), 3,66-3,97 (4H, м), 6,53-6,59 (1H, м), 7,63-7,67 (2H, м), 8,01 (1H, д, J=1,8 Гц), 8,24 (1H, с), 11,72 (1H, ушир. с), 12,13 (1H, ушир. с).
(Пример 118)
1-[(2S)-1,4-Диоксан-2-илметил]-6-(3-фтор-1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
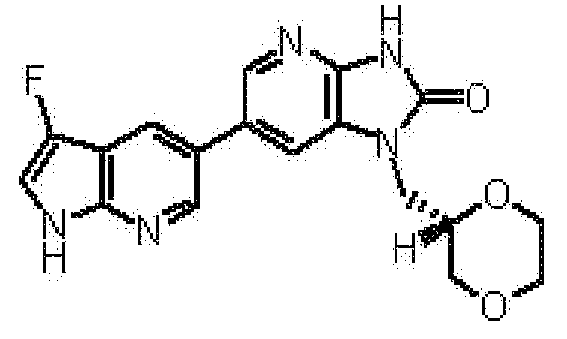
Стадия 1
3-Циклогекс-1-ен-1-ил-1-[(2S)-1,4-диоксан-2-илметил]-6-(3-фтор-1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (144 мг) получали способом, аналогичным применяемому на стадии 3 примера 1, используя соединение, полученное на стадии 1 примера 41 (350 мг), и соединение, полученное на стадии 1 примера 96 (275 мг).
MS (ESI) m/z: 450 (M+H)+.
Стадия 2
1-[(2S)-1,4-Диоксан-2-илметил]-6-(3-фтор-1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (83 мг) получали способом, аналогичным применяемому на стадии 6 примера 35, используя соединение, полученное на вышеуказанной стадии 1 (144 мг).
MS (ESI) m/z: 370 (M+H)+.
Стадия 3
1-[(2S)-1,4-Диоксан-2-илметил]-6-(3-фтор-1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он диметансульфонат
К суспензии соединения, полученного на описанной выше стадии 2 (83 мг), в хлороформе (1,5 мл) добавляли по каплям метансульфоновую кислоту (29 мкл). Затем добавляли по каплям метанол до тех пор, пока не образовался гомогенный раствор. После перемешивания при комнатной температуре в течение 30 минут, растворитель упаривали при пониженном давлении и добавляли гексан, потом перемешивали. Твердое вещество собирали фильтрованием и сушили при пониженном давлении в течение ночи при нагревании до 50°C с получением указанного в заголовке соединения (106 мг).
MS (ESI) m/z: 370 (M+H)+.
HRMS (ESI) [(M+H)+] вычислено: C18H17FN5O3 370,13154; найдено: 370,13332.
1H-ЯМР (ДМСО-d6) δ: 2,34 (6H, с), 3,31-3,38 (1H, м), 3,43-3,56 (2H, м), 3,61 (1H, д, J=10,9 Гц), 3,70-4,02 (5H, м), 7,53-7,55 (1H, м), 7,91 (1H, д, J=2,3 Гц), 8,29-8,31 (2H, м), 8,62 (1H, д, J=2,3 Гц), 11,61 (1H, ушир. с), 11,68 (1H, ушир. с).
(Пример 119)
1-[(2S)-1,4-Диоксан-2-илметил]-6-(3-фтор-1H-пирроло[2,3-b]пиридин-5-ил)-5-метил-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
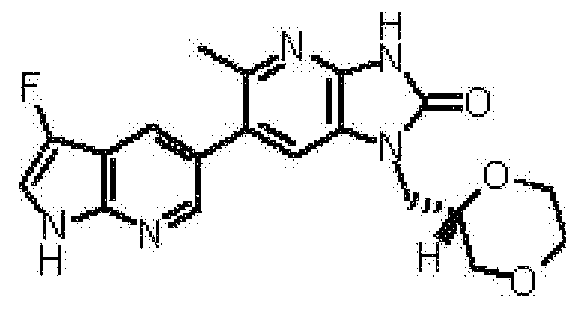
Стадия 1
3-Циклогекс-1-ен-1-ил-1-[(2S)-1,4-диоксан-2-илметил]-6-(3-фтор-1H-пирроло[2,3-b]пиридин-5-ил)-5-метил-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (60 мг) получали способом, аналогичным применяемому на стадии 2 примера 4, используя соединение, полученное на стадии 1 примера 96 (70 мг), и соединение, полученное на стадии 1 примера 45 (111 мг).
MS (ESI) m/z: 464 (M+H)+.
1H-ЯМР (CDCl3) δ: 1,75-1,79 (2H, м), 1,87-1,91 (2H, м), 2,31-2,35 (2H, м), 2,47 (3H, с), 2,52-2,55 (2H, м), 3,39 (1H, дд, J=11,7, 9,5 Гц), 3,53-3,58 (1H, м), 3,65-3,70 (2H, м), 3,73-3,76 (1H, м), 3,84-3,94 (4H, м), 6,06-6,08 (1H, м), 7,14 (1H, т, J=2,6 Гц), 7,23 (1H, с), 7,91 (1H, д, J=2,3 Гц), 8,27-8,29 (1H, м), 8,30 (1H, д, J=1,7 Гц).
Стадия 2
1-[(2S)-1,4-Диоксан-2-илметил]-6-(3-фтор-1H-пирроло[2,3-b]пиридин-5-ил)-5-метил-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (25 мг) получали способом, аналогичным применяемому на стадии 6 примера 35, используя соединение, полученное на вышеуказанной стадии 1 (60 мг).
HRMS (ESI) [M+H]+ вычислено: C19H19FN5O3 384,14719; найдено: 384,14985.
MS (ESI) m/z: 384 (M+H)+.
1H-ЯМР (ДМСО-d6) δ: 2,38 (3H, с), 3,27-3,31 (1H, м), 3,41-3,52 (2H, м), 3,59 (1H, д, J=11,5 Гц), 3,68-3,80 (3H, м), 3,84-3,93 (2H, м), 7,44 (1H, с), 7,54 (1H, т, J=2,3 Гц), 8,00 (1H, д, J=1,7 Гц), 8,29 (1H, д, J=2,3 Гц), 11,52 (1H, с), 11,61 (1H, с).
(Пример 120)
1-[(2S)-1,4-Диоксан-2-илметил]-6-(4-фтор-1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
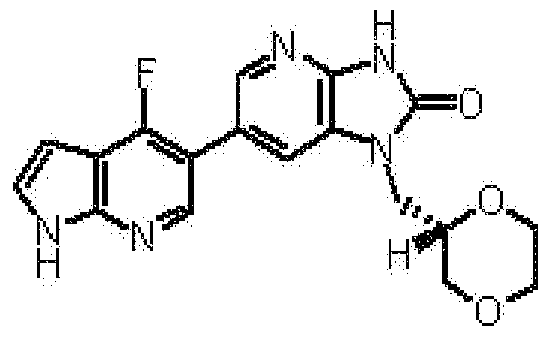
Стадия 1
5-Бром-4-фтор-1H-пирроло[2,3-b]пиридин
5-Бром-4-фтор-1-(триизопропилсилил)-1H-пирроло[2,3-b]пиридин, полученный способом, описанным в Tetrahedron Lett. 45, 2317-2319 (2004) (230 мг), растворяли в тетрагидрофуране (5,0 мл). Добавляли флуорид тетрабутиламмония (1,0 M раствор в тетрагидрофуране) (810 мкл) и смесь перемешивали при комнатной температуре в течение одного часа. К реакционному раствору добавляли воду, затем экстрагировали этилацетатом. Органический слой промывали насыщенным солевым раствором и потом сушили над безводным сульфатом натрия и растворитель упаривали. Остаток очищали хроматографией на колонке с силикагелем (элюируя смесью этилацетат-гексан) с получением указанного в заголовке соединения (103 мг).
MS (ESI) m/z: 215 (M+H)+.
Стадия 2
3-Циклогекс-1-ен-1-ил-1-[(2S)-1,4-диоксан-2-илметил]-6-(4-фтор-1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (212 мг) получали способом, аналогичным применяемому на стадии 3 примера 1, используя соединение, полученное на стадии 1 примера 41 (254 мг), и соединение, полученное на описанной выше стадии 1 (103 мг).
MS (ESI) m/z: 450 (M+H)+.
Стадия 3
1-[(2S)-1,4-Диоксан-2-илметил]-6-(4-фтор-1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (20 мг) получали способом, аналогичным применяемому на стадии 6 примера 35, используя соединение, полученное на вышеуказанной стадии 2 (212 мг).
MS (ESI) m/z: 370 (M+H)+.
HRMS (ESI) [(M+H)+] вычислено: C18H17FN5O3 370,13154; найдено: 370,13107.
1H-ЯМР (ДМСО-d6) δ: 3,33-3,62 (4H, м), 3,70-3,97 (5H, м), 6,59-6,61 (1H, м), 7,57-7,59 (1H, м), 7,74 (1H, с), 8,12 (1H, с), 8,35-8,36 (1H, м), 11,71 (1H, ушир. с), 12,10 (1H, ушир. с).
(Пример 121)
6-(2,3-Дигидро-1H-пирроло[2,3-b]пиридин-5-ил)-1-[(2S)-1,4-диоксан-2-илметил]-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
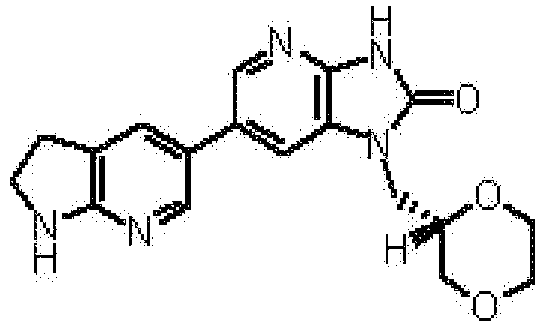
Стадия 1
3-Циклогекс-1-ен-1-ил-6-(2,3-дигидро-1H-пирроло[2,3-b]пиридин-5-ил)-1-[(2S)-1,4-диоксан-2-илметил]-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (118 мг) получали способом, аналогичным применяемому на стадии 3 примера 1, используя соединение, полученное на стадии 1 примера 41 (319 мг), и 5-бром-2,3-дигидро-1H-пирроло[2,3-b]пиридин (199 мг).
MS (ESI) m/z: 434 (M+H)+.
Стадия 2
6-(2,3-Дигидро-1H-пирроло[2,3-b]пиридин-5-ил)-1-[(2S)-1,4-диоксан-2-илметил]-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (28 мг) получали способом, аналогичным применяемому на стадии 6 примера 35, используя соединение, полученное на вышеуказанной стадии 1 (118 мг).
MS (ESI) m/z: 354 (M+H)+.
HRMS (ESI) [(M+H)+] вычислено: C18H20N5O3 354,15661; найдено: 354,15597.
1H-ЯМР (ДМСО-d6) δ: 3,04 (2H, т, J=8,6 Гц), 3,32-3,62 (6H, м), 3,71-3,96 (5H, м), 6,52 (1H, с), 7,57-7,59 (1H, м), 7,66-7,67 (1H, м), 8,00-8,01 (1H, м), 8,08 (1H, д, J=2,3 Гц), 11,54 (1H, ушир. с).
(Пример 122)
1-[(2S)-1,4-Диоксан-2-илметил]-6-(4-(трифторметил)-1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
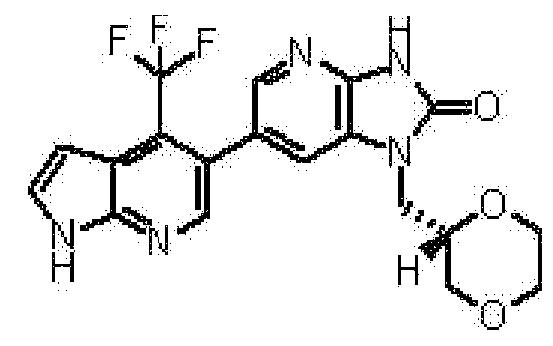
Стадия 1
5-Бром-4-йод-1-[(4-метилфенил)сульфонил]-1H-пирроло[2,3-b]пиридин
В раствор 5-бром-4-йод-1H-пирроло[2,3-b]пиридина, полученного способом, описанным в WO 2008/150914 (1,14 г), в N,N-диметилформамиде (12 мл) на ледяной бане добавляли 55% гидрид натрия (170 мг) и хлорид 4-метилбензолсульфонила (740 мг) и смесь перемешивали при комнатной температуре в течение 3 часов. К реакционному раствору добавляли водный раствор хлорида аммония и осажденное твердое вещество собирали фильтрованием и промывали водой. Это вещество растворяли в дихлорметане и сушили над безводным сульфатом натрия. Растворитель упаривали при пониженном давлении с получением указанного в заголовке соединения (1,68 г).
1H-ЯМР (CDCl3) δ: 2,39 (3H, с), 6,51 (1H, д, J=4,0 Гц), 7,26 (2H, д, J=8,6 Гц), 7,79 (1H, д, J=4,0 Гц), 8,04 (2H, д, J=8,6 Гц), 8,43 (1H, с).
Стадия 2
5-Бром-1-[(4-метилфенил)сульфонил]-4-(трифторметил)-1H-пирроло[2,3-b]пиридин
Указанное в заголовке соединение (168 мг) получали способом, аналогичным применяемому на стадии 1 примера 84, используя соединение, полученное на вышеуказанной стадии 1 (300 мг).
1H-ЯМР (CDCl3) δ: 2,39 (3H, с), 6,79-6,84 (1H, м), 7,31 (2H, д, J=8,3 Гц), 7,88 (1H, д, J=4,1 Гц), 8,05 (2H, д, J=8,3 Гц), 8,62 (1H, с).
Стадия 3
3-Циклогекс-1-ен-1-ил-1-[(2S)-1,4-диоксан-2-илметил]-6-{1-[(4-метилфенил)сульфонил]-4-(трифторметил)-1H-пирроло[2,3-b]пиридин-5-ил}-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (172 мг) получали способом, аналогичным применяемому на стадии 2 примера 4, используя соединение, полученное на вышеуказанной стадии 2 (242 мг), и соединение, полученное на стадии 1 примера 41 (306 мг).
MS (ESI) m/z: 654 (M+H)+.
1H-ЯМР (CDCl3) δ: 1,68-2,54 (8H, м), 2,41 (3H, с), 3,29-3,99 (9H, м), 6,07-6,11 (1H, м), 6,87 (1H, с), 7,34 (2H, д, J=7,8 Гц), 7,43-7,49 (1H, м), 7,96 (2H, с), 8,12 (2H, д, J=8,3 Гц), 8,40 (1H, с).
Стадия 4
3-Циклогекс-1-ен-1-ил-1-[(2S)-1,4-диоксан-2-илметил]-6-[4-(трифторметил)-1H-пирроло[2,3-b]пиридин-5-ил]-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
В раствор соединения, полученного на описанной выше стадии 3 (170 мг), в метаноле (2,6 мл) добавляли 1 н. водный раствор гидроксида натрия (0,52 мл) и смесь перемешивали при комнатной температуре в течение 17 часов. Реакционный раствор разделяли добавлением водного раствора хлорида аммония и этилацетата. Полученный органический слой промывали насыщенным солевым раствором и сушили над безводным сульфатом натрия. Растворитель упаривали при пониженном давлении. Полученный остаток очищали хроматографией на колонке с силикагелем (элюируя смесью этилацетат-гексан) с получением указанного в заголовке соединения (58 мг).
1H-ЯМР (CDCl3) δ: 1,73-1,82 (2H, м), 1,86-1,95 (2H, м), 2,29-2,39 (2H, м), 2,46-2,57 (2H, м), 3,33-4,00 (9H, м), 6,07-6,13 (1H, м), 6,78-6,83 (1H, м), 7,41-7,43 (1H, м), 7,54 (1H, с), 8,05 (1H, д, J=2,0 Гц), 8,29 (1H, с), 9,13 (1H, ушир. с).
Стадия 5
1-[(2S)-1,4-Диоксан-2-илметил]-6-(4-(трифторметил)-1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (17 мг) получали способом, аналогичным применяемому на стадии 6 примера 35, используя соединение, полученное на вышеуказанной стадии 4 (56 мг).
MS (ESI) m/z: 420 (M+H)+.
1H-ЯМР (ДМСО-d6) δ: 3,24-3,97 (9H, м), 6,62-6,67 (1H, м), 7,55 (1H, с), 7,83 (1H, с), 7,90 (1H, д, J=1,8 Гц), 8,27 (1H, с), 11,74 (1H, с), 12,37 (1H, с).
(Пример 123)
1-[(2S)-1,4-Диоксан-2-илметил]-6-(4-этил-1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Стадия 1
5-Бром-4-этил-1-[(4-метилфенил)сульфонил]-1H-пирроло[2,3-b]пиридин
В раствор соединения, полученного на стадии 1 примера 122 (300 мг), в N,N-диметилформамиде (12 мл) добавляли комплекс хлорид [1,1'-бис(дифенилфосфино)ферроцен]палладия(II) - дихлорметан (26 мг), карбонат калия (130 мг) и триэтилборан (1 M раствор в гексане) (0,75 мл). Смесь перемешивали в атмосфере азота при 80°C в течение 24 часов. Реакционный раствор охлаждали до комнатной температуры и потом разделяли добавлением этилацетата и дистиллированной воды. Полученный органический слой промывали насыщенным солевым раствором и сушили над безводным сульфатом натрия. Растворитель упаривали при пониженном давлении. Полученный остаток очищали хроматографией на колонке с силикагелем (элюируя смесью этилацетат-гексан) с получением указанного в заголовке соединения (147 мг).
MS (ESI) m/z: 380 (M+H)+.
1H-ЯМР (CDCl3) δ: 1,21 (3H, т, J=7,5 Гц), 2,38 (3H, с), 2,94 (2H, кв, J=7,5 Гц), 6,60 (1H, д, J=4,1 Гц), 7,28 (2H, д, J=8,3 Гц), 7,70 (1H, д, J=4,1 Гц), 8,05 (2H, д, J=8,3 Гц), 8,43 (1H, с).
Стадия 2
3-Циклогекс-1-ен-1-ил-1-[(2S)-1,4-диоксан-2-илметил]-6-{4-этил-1-[(4-метилфенил)сульфонил]-1H-пирроло[2,3-b]пиридин-5-ил}-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (122 мг) получали способом, аналогичным применяемому на стадии 3 примера 1, используя соединение, полученное на вышеуказанной стадии 1 (145 мг), и соединение, полученное на стадии 1 примера 41 (183 мг).
MS (ESI) m/z: 614 (M+H)+.
1H-ЯМР (CDCl3) δ: 1,14 (3H, т, J=7,5 Гц), 1,72-1,82 (2H, м), 1,86-1,94 (2H, м), 2,30-2,37 (2H, м), 2,39 (3H, с), 2,46-2,54 (2H, м), 2,81 (2H, кв, J=7,5 Гц), 3,33-3,41 (1H, м), 3,49-3,58 (1H, м), 3,62-3,75 (3H, м), 3,80-3,99 (4H, м), 6,08 (1H, с), 6,68 (1H, д, J=4,1 Гц), 7,29-7,34 (3H, м), 7,77 (1H, д, J=4,1 Гц), 7,97 (1H, д, J=1,4 Гц), 8,13 (2H, д, J=8,3 Гц), 8,26 (1H, с).
Стадия 3
3-Циклогекс-1-ен-1-ил-1-[(2S)-1,4-диоксан-2-илметил]-6-(4-этил-1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (75 мг) получали способом, аналогичным применяемому на стадии 4 примера 122, используя соединение, полученное на вышеуказанной стадии 2 (120 мг).
MS (ESI) m/z: 460 (M+H)+.
1H-ЯМР (CDCl3) δ: 1,24 (3H, т, J=7,3 Гц), 1,74-1,82 (2H, м), 1,87-1,95 (2H, м), 2,31-2,39 (2H, м), 2,48-2,56 (2H, м), 2,91 (2H, кв, J=7,3 Гц), 3,35-4,01 (9H, м), 6,07-6,13 (1H, м), 6,59-6,63 (1H, м), 7,34-7,38 (1H, м), 7,39 (1H, д, J=1,8 Гц), 8,06 (1H, д, J=1,8 Гц), 8,17 (1H, с), 9,21 (1H, ушир. с).
Стадия 4
1-[(2S)-1,4-Диоксан-2-илметил]-6-(4-этил-1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (27 мг) получали способом, аналогичным применяемому на стадии 6 примера 35, используя соединение, полученное на вышеуказанной стадии 3 (75 мг).
MS (ESI) m/z: 380 (M+H)+.
1H-ЯМР (ДМСО-d6) δ: 1,14 (3H, т, J=7,5 Гц), 2,84 (2H, кв, J=7,5 Гц), 3,25-3,97 (9H, м), 6,56-6,60 (1H, м), 7,47-7,50 (1H, м), 7,51 (1H, д, J=1,4 Гц), 7,88 (1H, д, J=1,4 Гц), 8,04 (1H, с), 11,66 (2H, с).
(Пример 124)
6-(3,4-Диметил-1H-пирроло[2,3-b]пиридин-5-ил)-1-[(2S)-1,4-диоксан-2-илметил]-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
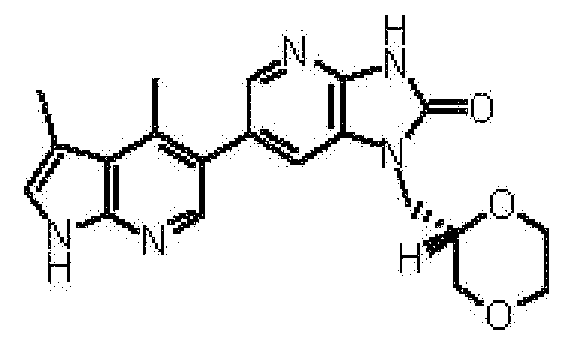
Стадия 1
5-Бром-3,4-диметил-2-(триметилсилил)-1H-пирроло[2,3-b]пиридин
Соединение, полученное на стадии 1 примера 36 (1,8 г), растворяли в N,N-диметилформамиде (40 мл) и добавляли ацетат калия (1,7 г) и хлорид лития (0,3 г). После замены атмосферы в системе на азот добавляли ацетат палладия (0,13 г) и 1-триметилсилил-1-пропин (4,3 мл) и смесь перемешивали при 90°C в течение трех дней. Реакционный раствор охлаждали до комнатной температуры и потом N,N-диметилформамид отгоняли. Полученный остаток разбавляли этилацетатом и потом промывали насыщенным солевым раствором. Органический слой сушили над безводным сульфатом натрия и растворитель упаривали с получением сырого соединения, указанного в заголовке (2,4 г).
MS (ESI) m/z: 297 (M+H)+.
Стадия 2
5-Бром-3,4-диметил-1H-пирроло[2,3-b]пиридин
Соединение, полученное на описанной выше стадии 1 (2,4 г), растворяли в тетрагидрофуране (25 мл). Добавляли 2 M водный раствор соляной кислоты (10 мл) и смесь нагревали с обратным холодильником в течение 18 часов. Реакционный раствор охлаждали до комнатной температуры, нейтрализовали насыщенным водным раствором бикарбоната натрия и потом экстрагировали этилацетатом. Органический слой сушили над безводным сульфатом натрия и растворитель упаривали. Полученный остаток очищали хроматографией на колонке с силикагелем (элюируя смесью этилацетат-гексан) с получением указанного в заголовке соединения (0,2 г).
MS (ESI) m/z: 225 (M+H)+.
1H-ЯМР (CDCl3) δ: 2,46 (3H, с), 2,76 (3H, с), 7,00 (1H, с), 8,29 (1H, с).
Стадия 3
3-Циклогекс-1-ен-1-ил-6-(3,4-диметил-1H-пирроло[2,3-b]пиридин-5-ил)-1-[(2S)-1,4-диоксан-2-илметил]-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (145 мг) получали способом, аналогичным применяемому на стадии 3 примера 1, используя соединение, полученное на стадии 1 примера 41 (306 мг), и соединение, полученное на описанной выше стадии 2 (142 мг).
MS (ESI) m/z: 460 (M+H)+.
Стадия 4
6-(3,4-Диметил-1H-пирроло[2,3-b]пиридин-5-ил)-1-[(2S)-1,4-диоксан-2-илметил]-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (135 мг) получали способом, аналогичным применяемому на стадии 6 примера 35, используя соединение, полученное на вышеуказанной стадии 3 (222 мг).
MS (ESI) m/z: 380 (M+H)+.
HRMS (ESI) [(M+H)+] вычислено: C20H21N5O3 380,17226; найдено: 380,17247.
1H-ЯМР (ДМСО-d6) δ: 2,46 (3H, с), 2,58 (3H, с), 3,29-3,33 (1H, м), 3,42-3,54 (2H, м), 3,59-3,61 (1H, м), 3,70-3,72 (1H, м), 3,76-3,95 (4H, м), 7,20 (1H, с), 7,51 (1H, д, J=1,7 Гц), 7,88 (1H, д, J=1,7 Гц), 8,00 (1H, с), 11,27-11,28 (1H, м), 11,64 (1H, с).
(Пример 125)
6-(3-Хлор-4-метил-1H-пирроло[2,3-b]пиридин-5-ил)-1-[(2S)-1,4-диоксан-2-илметил]-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
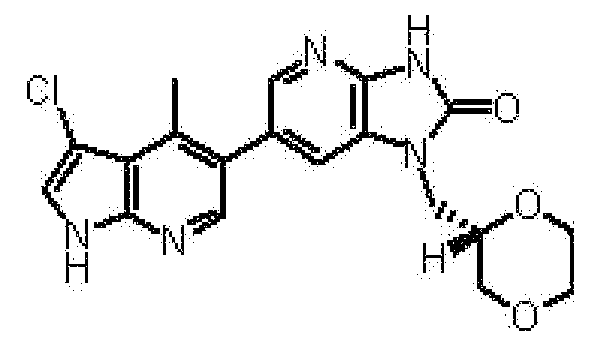
Стадия 1
5-Бром-3-хлор-4-метил-1H-пирроло[2,3-b]пиридин
Соединение, полученное на стадии 3 примера 36 (323 мг), растворяли в тетрагидрофуране (6 мл). Добавляли N-хлорсукцинимид (225 мг) и смесь перемешивали при комнатной температуре в течение трех дней. К реакционному раствору добавляли воду, затем экстрагировали хлороформом. Органический слой сушили над безводным сульфатом натрия и растворитель упаривали с получением указанного в заголовке соединения (364 мг).
MS (ESI) m/z: 245 (M+H)+.
Стадия 2
Трет-бутил 5-бром-3-хлор-4-метил-1H-пирроло[2,3-b]пиридин-1-карбоксилат
Указанное в заголовке соединение (430 мг) получали способом, аналогичным применяемому на стадии 1 примера 35, используя соединение, полученное на вышеуказанной стадии 1 (364 мг).
MS (ESI) m/z: 345 (M+H)+.
1H-ЯМР (CDCl3) δ: 1,66 (9H, с), 2,84 (3H, с), 7,59 (1H, с), 8,55 (1H, с).
Стадия 3
6-(3-Хлор-4-метил-1H-пирроло[2,3-b]пиридин-5-ил)-3-циклогекс-1-ен-1-ил-1-[(2S)-1,4-диоксан-2-илметил]-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (125 мг) получали способом, аналогичным применяемому на стадии 3 примера 1, используя соединение, полученное на стадии 1 примера 41 (302 мг), и соединение, полученное на описанной выше стадии 2 (215 мг).
MS (ESI) m/z: 480 (M+H)+.
Стадия 4
6-(3-Хлор-4-метил-1H-пирроло[2,3-b]пиридин-5-ил)-1-[(2S)-1,4-диоксан-2-илметил]-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (77 мг) получали способом, аналогичным применяемому на стадии 6 примера 35, используя соединение, полученное на вышеуказанной стадии 3 (125 мг).
MS (ESI) m/z: 400 (M+H)+.
HRMS (ESI) [(M+H)+] вычислено: C19H19ClN5O3 400,11764; найдено: 400,12198.
1H-ЯМР (ДМСО-d6) δ: 2,66 (3H, с), 3,28-3,97 (9H, м), 7,55 (1H, д, J=1,8 Гц), 7,66 (1H, д, J=2,7 Гц), 7,91 (1H, д, J=1,8 Гц), 8,13 (1H, с), 11,67 (1H, ушир. с), 12,00 (1H, ушир. с).
(Пример 126)
1-[(2S)-1,4-Диоксан-2-илметил]-6-(3-фтор-4-метил-1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
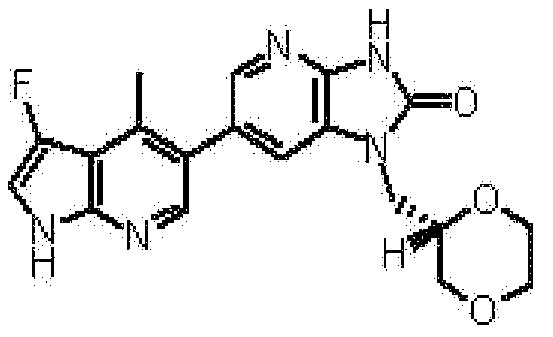
Стадия 1
5-Бром-3-фтор-4-метил-1H-пирроло[2,3-b]пиридин
Соединение, полученное на стадии 3 примера 36 (3,0 г), растворяли в ацетонитриле (400 мл) и уксусной кислоте (80 мл). Добавляли селектфтор (7,6 г) и смесь нагревали с перемешиванием при 80°C в течение 15 часов. Реакционный раствор охлаждали до комнатной температуры, концентрировали, разбавляли этилацетатом и последовательно промывали насыщенным водным раствором бикарбоната натрия и насыщенным солевым раствором. После сушки над безводным сульфатом натрия растворитель упаривали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (элюируя смесью метанол-хлороформ) с получением указанного в заголовке соединения (2,0 г).
MS (ESI) m/z: 229 (M+H)+.
1H-ЯМР (CDCl3) δ: 2,71 (3H, д, J=2,7 Гц), 7,04 (1H, д, J=2,3 Гц), 8,34 (1H, д, J=2,3 Гц), 8,76 (1H, ушир. с).
Стадия 2
Трет-бутил 5-бром-3-фтор-4-метил-1H-пирроло[2,3-b]пиридин-1-карбоксилат
Указанное в заголовке соединение (1,2 г) получали способом, аналогичным применяемому на стадии 1 примера 35, используя соединение, полученное на вышеуказанной стадии 1 (2,0 г).
1H-ЯМР (CDCl3) δ: 1,65 (9H, с), 2,67 (3H, с), 7,36-7,37 (1H, м), 8,54 (1H, с).
Стадия 3
3-Циклогекс-1-ен-1-ил-1-[(2S)-1,4-диоксан-2-илметил]-6-(3-фтор-4-метил-1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (237 мг) получали способом, аналогичным применяемому на стадии 3 примера 1, используя соединение, полученное на стадии 1 примера 41 (290 мг), и соединение, полученное на описанной выше стадии 2 (180 мг).
MS (ESI) m/z: 464 (M+H)+.
Стадия 4
1-[(2S)-1,4-Диоксан-2-илметил]-6-(3-фтор-4-метил-1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (68 мг) получали способом, аналогичным применяемому на стадии 6 примера 35, используя соединение, полученное на вышеуказанной стадии 3 (237 мг).
MS (ESI) m/z: 384 (M+H)+.
HRMS (ESI) [(M+H)+] вычислено: C19H19FN5O3 384,14719; найдено: 384,14806.
1H-ЯМР (ДМСО-d6) δ: 2,55 (3H, с), 3,28-3,62 (4H, м), 3,69-3,96 (5H, м), 7,44-7,47 (1H, м), 7,56-7,57 (1H, м), 7,92 (1H, д, J=1,4 Гц), 8,13 (1H, с), 11,48 (1H, ушир. с), 11,67 (1H, с).
(Пример 127)
6-(6-Хлор-1H-пирроло[2,3-b]пиридин-5-ил)-1-[(2S)-1,4-диоксан-2-илметил]-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Стадия 1
{1-[(2S)-1,4-Диоксан-2-илметил]-2-оксо-2,3-дигидро-1H-имидазо[4,5-b]пиридин-6-ил}борная кислота
Указанное в заголовке соединение (2,2 г) получали способом, аналогичным применяемому на стадии 6 примера 35, используя соединение, полученное на стадии 1 примера 41 (5,0 г).
MS (ESI) m/z: 280 (M+H)+.
Стадия 2
6-(6-Хлор-1H-пирроло[2,3-b]пиридин-5-ил)-1(тетрагидро-2H-пиран-4-илметил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (107 мг) получали способом, аналогичным применяемому на стадии 3 примера 1, используя соединение, полученное на вышеуказанной стадии 1 (75 мг), и соединение, полученное на стадии 5 примера 78 (68 мг).
MS (ESI) m/z: 386 (M+H)+.
HRMS (ESI) [(M+H)+] вычислено: C18H17ClN5O3 386,10199; найдено: 386,10355.
1H-ЯМР (ДМСО-d6) δ: 3,32-3,62 (4H, м), 3,67-3,97 (5H, м), 6,54 (1H, с), 7,57-7,60 (1H, м), 7,62-7,65 (1H, м), 7,96-7,99 (1H, м), 8,05-8,07 (1H, м), 11,70 (1H, ушир. с), 11,96 (1H, ушир. с).
(Пример 128)
1-[(2S)-1,4-Диоксан-2-илметил]-6-(7-фтор-4-метил-1H-индол-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Стадия 1
4-Бром-6-фтор-2-йод-3-метиланилин
Указанное в заголовке соединение (6,9 г) получали способом, аналогичным применяемому на стадии 1 примера 36, используя 4-бром-6-фтор-3-метиланилин (5,0 г).
MS (ESI) m/z: 330 (M+H)+.
Стадия 2
4-Бром-6-фтор-2-[(триметилсилил)этинил]-3-метиланилин
Указанное в заголовке соединение (6,9 г) получали способом, аналогичным применяемому на стадии 2 примера 36, используя 4-бром-6-фтор-2-йод-3-метиланилин, полученный на вышеуказанной стадии 1 (6,9 г).
MS (ESI) m/z: 300 (M+H)+.
Стадия 3
5-Бром-7-фтор-4-метил-1H-индол
Указанное в заголовке соединение (3,0 г) получали способом, аналогичным применяемому на стадии 3 примера 36, используя соединение, полученное на вышеуказанной стадии 2 (6,9 г).
MS (ESI) m/z: 228 (M+H)+.
1H-ЯМР (CDCl3) δ: 2,54 (3H, с), 6,57-6,59 (1H, м), 7,11 (1H, д, J=10,3 Гц), 7,23 (1H, т, J=2,9 Гц), 8,38 (1H, ушир. с).
Стадия 4
6-(6-Фтор-1H-пирроло[2,3-b]пиридин-5-ил)-1-(тетрагидро-2H-пиран-4-илметил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (109 мг) получали способом, аналогичным применяемому на стадии 3 примера 1, используя соединение, полученное на стадии 1 примера 127 (108 мг), и соединение, полученное на описанной выше стадии 3 (80 мг).
MS (ESI) m/z: 383 (M+H)+.
HRMS (ESI) [(M+H)+] вычислено: C20H20FN4O3 383,15194; найдено: 383,15248.
1H-ЯМР (ДМСО-D6) δ: 2,39 (3H, с), 3,31-3,97 (9H, м), 6,61 (1H, с), 6,87 (1H, д, J=10,9 Гц), 7,44-7,46 (1H, м), 7,51 (1H, с), 7,89-7,90 (1H, м), 11,61 (1H, ушир. с), 11,65 (1H, ушир. с).
(Пример 129)
1-[(2S)-1,4-Диоксан-2-илметил]-6-(6-метил-1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
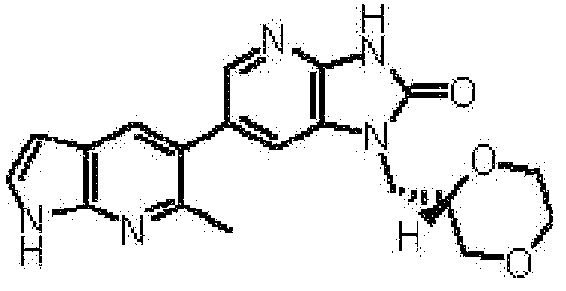
Стадия 1
6-Бром-1-[(2S)-1,4-диоксан-2-илметил]-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (0,8 г) получали способом, аналогичным применяемому на стадии 6 примера 35, используя соединение, полученное на стадии 1 примера 40 (1,4 г).
MS (ESI) m/z: 314 (M+H)+.
1H-ЯМР (ДМСО-d6) δ: 3,26-3,28 (1H, м), 3,45-3,49 (2H, м), 3,59-3,62 (1H, м), 3,70-3,89 (5H, м), 7,75-7,75 (1H, м), 8,00-8,00 (1H, м), 11,79 (1H, ушир. с).
Стадия 2
1-[(2S)-1,4-Диоксан-2-илметил]-6-(6-метил-1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (11 мг) получали способом, аналогичным применяемому на стадии 3 примера 1, используя соединение, полученное способом, описанным в WO 2007/135398 (69 мг), и соединение, полученное на описанной выше стадии 1 (50 мг).
MS (ESI) m/z: 366 (M+H)+.
HRMS (ESI) [M+H]+ вычислено: C19H19N5O3 366,15661; найдено: 366,15746.
1H-ЯМР (ДМСО-d6) δ: 2,48 (3H, с), 3,39-3,94 (9H, м), 6,42 (1H, д, J=3,24 Гц), 7,41-7,42 (1H, м), 7,56 (1H, д, J=1,84 Гц), 7,78 (1H, с), 7,91 (1H, д, J=1,84 Гц), 11,53 (1H, с), 11,63 (1H, с).
(Пример 130)
6-(4-Амино-1H-пирроло[2,3-b]пиридин-5-ил)-1-[(2S)-1,4-диоксан-2-илметил]-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
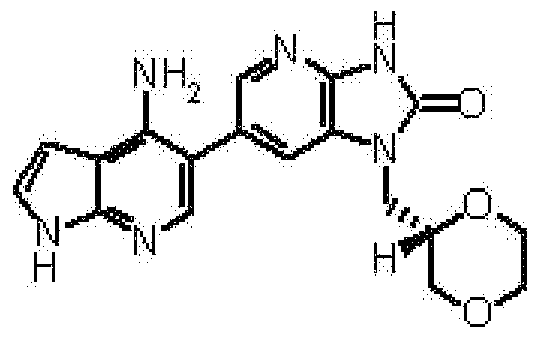
Стадия 1
4-Азидо-5-бром-1-[(4-метилфенил)сульфонил]-1H-пирроло[2,3-b]пиридин
Указанное в заголовке соединение (299 мг) получали способом, аналогичным применяемому на стадии 1 примера 122, используя 4-азидо-5-бром-1H-пирроло[2,3-b]пиридин, полученный способом, описанным в WO 2008/150914 (199 мг).
1H-ЯМР (CDCl3) δ: 2,39 (3H, с), 6,85 (1H, д, J=4,0 Гц), 7,29 (2H, д, J=8,3 Гц), 7,73 (1H, д, J=4,0 Гц), 8,04 (2H, д, J=8,3 Гц), 8,39 (1H, с).
Стадия 2
5-Бром-1-[(4-метилфенил)сульфонил]-1H-пирроло[2,3-b]пиридин-4-амин
В раствор соединения, полученного на описанной выше стадии 1 (275 мг), в 2-пропаноле (14 мл) на ледяной бане добавляли боргидрид натрия (27 мг) и смесь перемешивали при комнатной температуре в течение 4 часов. Реакционный раствор разделяли добавлением водного раствора хлорида аммония и этилацетата. Полученный органический слой промывали насыщенным солевым раствором и сушили над безводным сульфатом натрия. Растворитель упаривали при пониженном давлении. Полученный остаток очищали хроматографией на колонке с силикагелем (элюируя смесью этилацетат-гексан) с получением указанного в заголовке соединения (141 мг).
MS (ESI) m/z: 367 (M+H)+.
1H-ЯМР (ДМСО-d6) δ: 2,34 (3H, с), 6,79 (2H, ушир. с), 6,97 (1H, д, J=4,0 Гц), 7,40 (2H, д, J=8,0 Гц), 7,57 (1H, д, J=4,0 Гц), 7,91 (2H, д, J=8,0 Гц), 8,03 (1H, с).
Стадия 3
6-{4-Амино-1-[(4-метилфенил)сульфонил]-1H-пирроло[2,3-b]пиридин-5-ил}-1-[(2S)-1,4-диоксан-2-илметил]-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (55 мг) получали способом, аналогичным применяемому на стадии 3 примера 1, используя соединение, полученное на вышеуказанной стадии 2 (50 мг), и соединение, полученное на стадии 1 примера 127 (57 мг).
MS (ESI) m/z: 521 (M+H)+.
1H-ЯМР (CDCl3) δ: 2,39 (3H, с), 3,33-3,97 (9H, м), 4,51 (2H, с), 6,51 (1H, д, J=4,0 Гц), 7,30 (2H, д, J=8,0 Гц), 7,41 (1H, д, J=1,7 Гц), 7,59 (1H, д, J=4,0 Гц), 8,04-8,06 (2H, м), 8,10 (2H, д, J=8,0 Гц), 9,52 (1H, ушир. с).
Стадия 4
6-(4-Амино-1H-пирроло[2,3-b]пиридин-5-ил)-1-[(2S)-1,4-диоксан-2-илметил]-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (16 мг) получали способом, аналогичным применяемому на стадии 4 примера 122, используя соединение, полученное на вышеуказанной стадии 3 (43 мг).
MS (ESI) m/z: 367 (M+H)+.
1H-ЯМР (ДМСО-d6) δ: 3,38-3,98 (9H, м), 5,94 (2H, с), 6,63 (1H, с), 7,08-7,12 (1H, м), 7,49-7,53 (1H, м), 7,72 (1H, с), 7,89-7,93 (1H, м), 11,17 (1H, с), 11,59 (1H, с).
(Пример 131)
6-[4-(Диметиламино)-1H-пирроло[2,3-b]пиридин-5-ил]-1-[(2S)-1,4-диоксан-2-илметил]-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
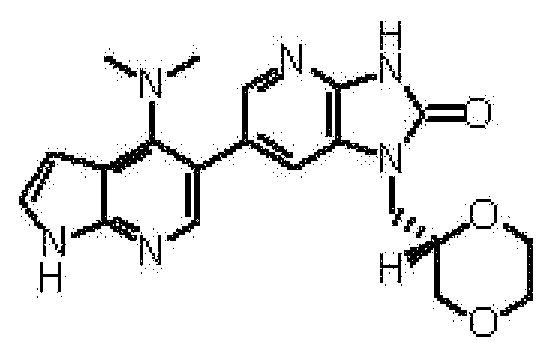
Стадия 1
5-Бром-N,N-диметил-1-[(4-метилфенил)сульфонил]-1H-пирроло[2,3-b]пиридин-4-амин
В раствор соединения, полученного на стадии 2 примера 130 (64 мг), в N,N-диметилформамиде (3,6 мл) на ледяной бане добавляли 55% гидрид натрия (19 мг) и метилйодид (0,027 мл) и смесь перемешивали на ледяной бане в течение 2 часов. Реакционный раствор разделяли добавлением водного раствора хлорида аммония и этилацетата. Полученный органический слой промывали насыщенным солевым раствором и сушили над безводным сульфатом натрия. Растворитель упаривали при пониженном давлении. Полученный остаток очищали хроматографией на колонке с силикагелем (элюируя смесью этилацетат-гексан) с получением указанного в заголовке соединения (73 мг).
MS (ESI) m/z: 395 (M+H)+.
1H-ЯМР (CDCl3) δ: 2,38 (3H, с), 3,13 (6H, с), 6,74 (1H, д, J=4,0 Гц), 7,25-7,29 (2H, м), 7,57 (1H, д, J=4,0 Гц), 8,04 (2H, д, J=8,0 Гц), 8,31 (1H, с).
Стадия 2
6-{4-(Диметиламино)-1-[(4-метилфенил)сульфонил]-1H-пирроло[2,3-b]пиридин-5-ил}-1-[(2S)-1,4-диоксан-2-илметил]-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (48 мг) получали способом, аналогичным применяемому на стадии 3 примера 1, используя соединение, полученное на вышеуказанной стадии 1 (59 мг), и соединение, полученное на стадии 1 примера 127 (63 мг).
MS (ESI) m/z: 549 (M+H)+.
1H-ЯМР (CDCl3) δ: 2,39 (3H, с), 2,85 (6H, с), 3,35-3,97 (9H, м), 6,81 (1H, д, J=4,0 Гц), 7,29 (2H, д, J=8,0 Гц), 7,37 (1H, д, J=1,7 Гц), 7,61 (1H, д, J=4,0 Гц), 8,03-8,07 (2H, м), 8,10 (2H, д, J=8,0 Гц), 9,37 (1H, ушир. с).
Стадия 3
6-[4-(Диметиламино)-1H-пирроло[2,3-b]пиридин-5-ил]-1-[(2S)-1,4-диоксан-2-илметил]-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (15 мг) получали способом, аналогичным применяемому на стадии 4 примера 122, используя соединение, полученное на вышеуказанной стадии 2 (47 мг).
MS (ESI) m/z: 395 (M+H)+.
1H-ЯМР (ДМСО-d6) δ: 2,84 (6H, с), 3,27-3,93 (9H, м), 6,64-6,67 (1H, м), 7,28 (1H, с), 7,50 (1H, д, J=1,7 Гц), 7,85 (1H, с), 7,93 (1H, д, J=1,7 Гц), 11,46 (1H, с), 11,57 (1H, с).
(Пример 132)
1-[(2S)-1,4-Диоксан-2-илметил]-6-{4-[(2-гидроксиэтил)(метил)амино]-1H-пирроло[2,3-b]пиридин-5-ил}-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
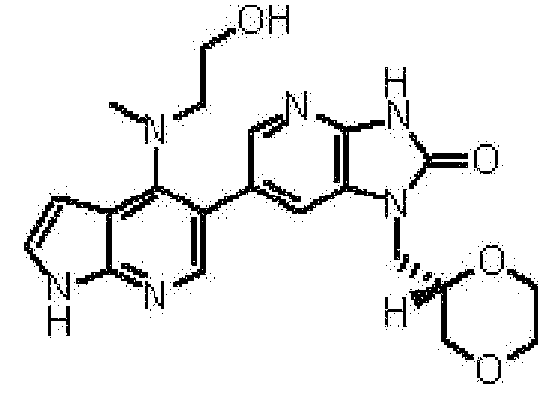
Стадия 1
2-[(5-Бром-1-{[2-(триметилсилил)этокси]метил}-1H-пирроло[2,3-b]пиридин-4-ил)(метил)амино]этанол
К 5-бром-4-хлор-1-{[2-(триметилсилил)этокси]метил}-1H-пирроло[2,3-b]пиридину, полученному способом, описанным в WO 2008/150914 (700 мг), добавляли 2-(метиламино)этанол (1,5 мл) и смесь нагревали с обратным холодильником при 145°C в течение 18 часов. Реакционный раствор охлаждали до комнатной температуры и потом концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на колонке с силикагелем (элюируя смесью этилацетат-гексан) с получением указанного в заголовке соединения (472 мг).
MS (ESI) m/z: 401 (M+H)+.
1H-ЯМР (CDCl3) δ: -0,06 (9H, с), 0,91 (2H, т, J=8,3 Гц), 2,45-2,50 (1H, м), 3,04 (3H, с), 3,50-3,61 (4H, м), 3,74 (2H, с), 5,62 (2H, с), 6,57-6,59 (1H, м), 7,25-7,28 (1H, м), 8,35 (1H, с).
Стадия 2
1-[(2S)-1,4-Диоксан-2-илметил]-6-(4-[(2-гидроксиэтил)(метил)амино]-1-{[2-(триметилсилил)этокси]метил}-1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (29 мг) получали способом, аналогичным применяемому на стадии 3 примера 1, используя соединение, полученное на вышеуказанной стадии 1 (100 мг), и соединение, полученное на стадии 1 примера 127 (84 мг).
MS (ESI) m/z: 555 (M+H)+.
1H-ЯМР (CDCl3) δ: -0,04 (9H, с), 0,94 (2H, т, J=8,3 Гц), 2,79 (3H, с), 3,40-4,03 (16H, м), 5,66 (2H, с), 6,67 (1H, д, J=3,4 Гц), 7,27 (1H, с), 7,67 (1H, д, J=1,7 Гц), 8,11 (1H, с), 8,41 (1H, д, J=1,7 Гц), 11,19 (1H, ушир. с).
Стадия 3
1-[(2S)-1,4-Диоксан-2-илметил]-6-{4-[(2-гидроксиэтил)(метил)амино]-1H-пирроло[2,3-b]пиридин-5-ил}-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
В раствор соединения, полученного на описанной выше стадии 2 (29 мг), в дихлорметане (0,5 мл) добавляли трифторуксусную кислоту (0,5 мл) и смесь перемешивали при комнатной температуре в течение 15 часов. Реакционный раствор концентрировали при пониженном давлении. К полученному остатку добавляли дихлорметан (0,5 мл) и этилендиамин (0,2 мл) и смесь перемешивали при комнатной температуре в течение 7 часов. Реакционный раствор разделяли добавлением водного раствора хлорида аммония и хлороформа. Полученный органический слой сушили над безводным сульфатом натрия. Растворитель упаривали при пониженном давлении. Полученный остаток очищали хроматографией на колонке с силикагелем (элюируя смесью метанол-дихлорметан) с получением указанного в заголовке соединения (6 мг).
MS (ESI) m/z: 425 (M+H)+.
1H-ЯМР (ДМСО-d6) δ: 2,74 (3H, с), 3,27-3,93 (13H, м), 4,60 (1H, т, J=5,4 Гц), 6,59 (1H, с), 7,28-7,31 (1H, м), 7,70-7,72 (1H, м), 7,89 (1H, с), 7,98 (1H, д, J=1,7 Гц), 11,46 (1H, с), 11,55 (1H, с).
(Пример 133)
1-[(2S)-1,4-Диоксан-2-илметил]-6-(4-метокси-1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
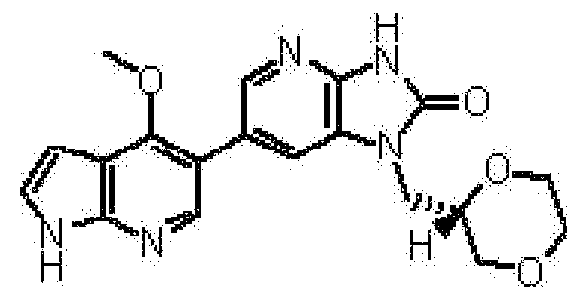
Стадия 1
5-Бром-4-метокси-1H-пирроло[2,3-b]пиридин
В раствор 5-бром-4-хлор-1H-пирроло[2,3-b]пиридина (81 мг) в ксилене (3,5 мл) добавляли метоксид калия (103 мг), метоксид лития (27 мг) и трет-бутанол (40 мкл) и смесь нагревали с обратным холодильником при 117°C в течение 16 часов. Реакционный раствор доводили до значения pH 4 добавлением концентрированной соляной кислоты небольшими частями и разделяли добавлением этилацетата и дистиллированной воды. Полученный водный слой доводили до значения pH 8 добавлением 5 н. водного раствора гидроксида натрия и разделяли добавлением этилацетата. Все полученные органические слои собирали, промывали насыщенным солевым раствором и сушили над безводным сульфатом натрия. Растворитель упаривали при пониженном давлении. Полученный остаток очищали тонкослойной хроматографией (элюируя смесью этилацетат-гексан) с получением указанного в заголовке соединения (20 мг).
MS (ESI) m/z: 227 (M+H)+.
1H-ЯМР (ДМСО-d6) δ: 4,29 (3H, с), 6,77-6,82 (1H, м), 7,37-7,42 (1H, м), 8,14 (1H, с), 11,82 (1H, ушир. с).
Стадия 2
1-[(2S)-1,4-Диоксан-2-илметил]-6-(4-метокси-1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (26 мг) получали способом, аналогичным применяемому на стадии 3 примера 1, используя соединение, полученное на вышеуказанной стадии 1 (64 мг), и соединение, полученное на стадии 1 примера 127 (79 мг).
MS (ESI) m/z: 382 (M+H)+.
HRMS (ESI) [M+H]+ вычислено: C19H20N5O4 382,15153; найдено: 382,15284.
1H-ЯМР (ДМСО-d6) δ: 2,50-2,52 (1H, м), 3,44-3,64 (4H, м), 3,67-3,93 (4H, м), 4,19 (3H, с), 6,76-6,81 (1H, м), 7,37-7,42 (1H, м), 7,57 (1H, д, J=1,8 Гц), 7,97 (1H, д, J=1,4 Гц), 8,04 (1H, с), 11,57 (1H, ушир. с), 11,71 (1H, ушир. с).
(Пример 134)
1-[(2S)-1,4-Диоксан-2-илметил]-6-(3-метокси-1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
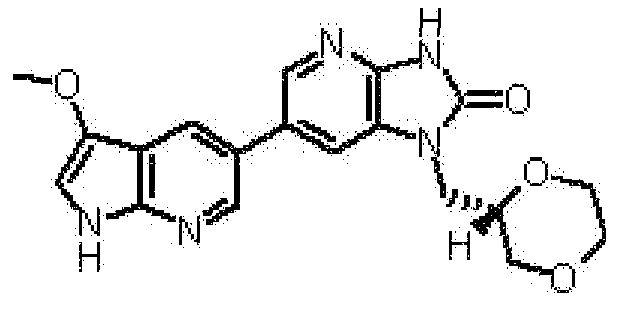
Стадия 1
5-Бром-1-[(4-метилфенил)сульфонил]-1,2-дигидро-3H-пирроло[2,3-b]пиридин-3-он
5-Бром-1H-пирроло[2,3-b]пиридин-3-карбальдегид, полученный способом, описанным в WO 2004/101565 (4,10 г), растворяли в THF (100 мл). Добавляли триэтиламин (3,05 мл) и p-толуолсульфонилхлорид (3,82 г) при комнатной температуре и смесь перемешивали в течение ночи. Растворитель реакционной смеси отгоняли при пониженном давлении и потом разбавляли этилацетатом. После промывания водой и насыщенным солевым раствором в данном порядке полученный органический слой сушили над безводным сульфатом натрия. Растворитель упаривали при пониженном давлении. Полученный остаток кристаллизовали с помощью (дихлорметан-диэтилового эфира) и потом собирали фильтрованием с получением 5-бром-1-[(4-метилфенил)сульфонил]-1H-пирроло[2,3-b]пиридин-3-карбальдегида (2,32 г). Затем фильтрат концентрировали при пониженном давлении. Полученный остаток очищали хроматографией на колонке с силикагелем (элюируя смесью этилацетат-гексан) с получением 5-бром-1-[(4-метилфенил)сульфонил]-1H-пирроло[2,3-b]пиридин-3-карбальдегида (2,55 г). Полученный 5-бром-1-[(4-метилфенил)сульфонил]-1H-пирроло[2,3-b]пиридин-3-карбальдегид (2,83 г) растворяли в метиленхлориде (50 мл). Добавляли 3-хлорпербензойную кислоту (2,13 г) при охлаждении льдом в течение 3 часов и смесь перемешивали при комнатной температуре в течение 2 часов. После этого к реакционному раствору добавляли 10% водный раствор сульфита натрия и насыщенный водный раствор бикарбоната натрия, затем перемешивали в течение ночи. Реакционный раствор разбавляли метиленхлоридом и нерастворимое вещество удаляли фильтрованием, затем экстрагировали метиленхлоридом три раза. Полученный органический слой сушили над безводным сульфатом натрия. Растворитель упаривали при пониженном давлении. Полученный остаток очищали хроматографией на колонке с силикагелем (элюируя смесью этилацетат-гексан) с получением указанного в заголовке соединения (0,18 г) в виде твердого вещества светло-красного цвета.
MS (ESI) m/z: 366 (M+H)+.
1H-ЯМР (CDCl3) δ: 2,42 (3H, с), 4,41 (2H, с), 7,32 (2H, д, J=7,1 Гц), 7,99 (2H, д, J=8,5 Гц), 8,02 (1H, д, J=2,7 Гц), 8,64 (1H, д, J=2,0 Гц).
Стадия 2
5-Бром-3-метокси-1-[(4-метилфенил)сульфонил]-1H-пирроло[2,3-b]пиридин
Соединение, полученное на описанной выше стадии 1 (110 мг), растворяли в метаноле (5 мл) и тетрагидрофуране (5 мл). Добавляли по каплям (триметилсилил)диазометан (0,75 мл) при охлаждении льдом и смесь перемешивали при комнатной температуре в течение 4 часов. Добавляли по каплям (триметилсилил)диазометан (0,75 мл), затем дополнительно перемешивали в течение ночи. К реакционному раствору добавляли уксусную кислоту (154 мкл) и потом растворитель упаривали при пониженном давлении. Полученный остаток очищали хроматографией на колонке с силикагелем (элюируя смесью этилацетат-гексан) с получением указанного в заголовке соединения (40 мг) в виде бесцветного масла.
MS (ESI) m/z: 381 (M+H)+.
1H-ЯМР (CDCl3) δ: 2,37 (3H, с), 3,88 (3H, с), 7,09 (1H, с), 7,25 (2H, д, J=8,7 Гц), 7,95-7,98 (3H, м), 8,45 (1H, д, J=2,3 Гц).
Стадия 3
1-[(2S)-1,4-Диоксан-2-илметил]-6-{3-метокси-1-[(4-метилфенил)сульфонил]-1H-пирроло[2,3-b]пиридин-5-ил}-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (45 мг) получали в виде светло-желтого твердого вещества способом, аналогичным применяемому на стадии 2 примера 4, используя соединение, полученное на вышеуказанной стадии 2 (40 мг), и соединение, полученное на стадии 1 примера 127 (38 мг).
MS (ESI) m/z: 536 (M+H)+.
Стадия 4
1-[(2S)-1,4-Диоксан-2-илметил]-6-(3-метокси-1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (10 мг) получали в виде светло-желтого твердого вещества способом, аналогичным применяемому на стадии 3 примера 84, используя соединение, полученное на вышеуказанной стадии 3 (45 мг).
HRMS (ESI) [M+H]+ вычислено: C19H20N5O4 382,15153; найдено: 382,15295.
MS (ESI) m/z: 382 (M+H)+.
1H-ЯМР (ДМСО-d6) δ: 3,31-3,37 (2H, м), 3,44-3,54 (2H, м), 3,59-3,62 (1H, м), 3,71-3,80 (2H, м), 3,84-3,94 (4H, м), 3,97-4,02 (1H, м), 7,08 (1H, д, J=2,9 Гц), 7,87 (1H, д, J=1,7 Гц), 8,16 (1H, д, J=2,3 Гц), 8,25 (1H, д, J=2,3 Гц), 8,53 (1H, д, J=2,3 Гц), 11,12 (1H, д, J=1,7 Гц), 11,61 (1H, с).
(Пример 135)
2,6-Ангидро-1,3,4-тридеокси-5-O-метил-1-[2-оксо-6-(1H-пирроло[2,3-b]пиридин-5-ил)-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил]-D-трео-гекситол
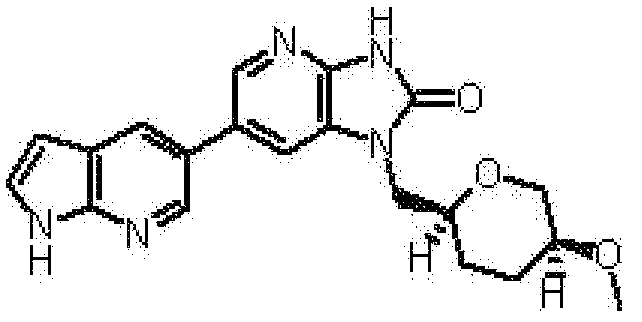
Стадия 1
2,6-Ангидро-1-(6-бром-3-циклогекс-1-ен-1-ил-2-оксо-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил)-1,3,4-тридеокси-5-O-метил-D-трео-гекситол
2,6-Ангидро-1-(6-бром-3-циклогекс-1-ен-1-ил-2-оксо-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил)-1,3,4-тридеокси-5-O-метил-L-трео-гекситол
Соединение, полученное на стадии 4 примера 113 (0,86 г), оптически анализировали с помощью ВЭЖХ с получением указанных в заголовке соединений, D-изомера (изомер A: 0,35 г) и L-изомера (изомер B: 0,36 г) соответственно.
Колонка: CHIRALPAK AD (5×50 см)
Элюент: 25% изопропанол/н-гексан
Скорость потока: 25 мл/мин
Время элюирования: изомер A: 56 мин, изомер B: 71 мин
Стадия 2
2,6-Ангидро-1-[3-циклогекс-1-ен-1-ил-2-оксо-6-(1H-пирроло[2,3-b]пиридин-5-ил)-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил]-1,3,4-тридеокси-5-O-метил-D-трео-гекситол
Указанное в заголовке соединение (220 мг) получали в виде светло-желтого масла способом, аналогичным применяемому на стадии 2 примера 4, используя 5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пирроло[2,3-b]пиридин (173 мг) и D-изомер, полученный на вышеуказанной стадии 1 (изомер A, 200 мг).
MS (ESI) m/z: 460 (M+H)+.
1H-ЯМР (CDCl3) δ: 1,57-1,66 (3H, м), 1,75-1,80 (2H, м), 1,88-1,92 (2H, м), 2,11-2,14 (1H, м), 2,32-2,36 (2H, м), 2,49-2,51 (2H, м), 3,23 (1H, с), 3,36 (3H, с), 3,44 (1H, дд, J=12,6, 1,1 Гц), 3,72-3,77 (1H, м), 3,89 (1H, дд, J=14,6, 7,7 Гц), 4,04-4,09 (2H, м), 6,07-6,08 (1H, м), 6,58-6,59 (1H, м), 7,39-7,40 (1H, м), 7,67 (1H, д, J=2,2 Гц), 8,08 (1H, д, J=1,7 Гц), 8,27 (1H, д, J=1,7 Гц), 8,50 (1H, д, J=2,2 Гц), 9,30 (1H, с).
Стадия 3
2,6-Ангидро-1,3,4-тридеокси-5-O-метил-1-[2-оксо-6-(1H-пирроло[2,3-b]пиридин-5-ил)-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил]-D-трео-гекситол
Указанное в заголовке соединение (55 мг) получали в виде светло-желтого твердого вещества способом, аналогичным применяемому на стадии 6 примера 35, используя соединение, полученное на вышеуказанной стадии 2 (220 мг).
MS (ESI) m/z: 380 (M+H)+.
1H-ЯМР (ДМСО-d6) δ: 1,40-1,45 (1H, м), 1,54-1,65 (3H, м), 1,89-1,95 (1H, м), 3,15-3,18 (1H, м), 3,20 (3H, с), 3,70-3,76 (1H, м), 3,80-3,98 (2H, м), 6,51 (1H, дд, J=3,2, 1,8 Гц), 7,52-7,53 (1H, м), 7,83 (1H, д, J=1,8 Гц), 8,23 (2H, с), 8,52 (1H, д, J=2,2 Гц), 11,59 (1H, с), 11,74 (1H, с).
(Пример 136)
2,6-Ангидро-1,3,4-тридеокси-5-O-метил-1-[2-оксо-6-(1H-пирроло[2,3-b]пиридин-5-ил)-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил]-L-трео-гекситол
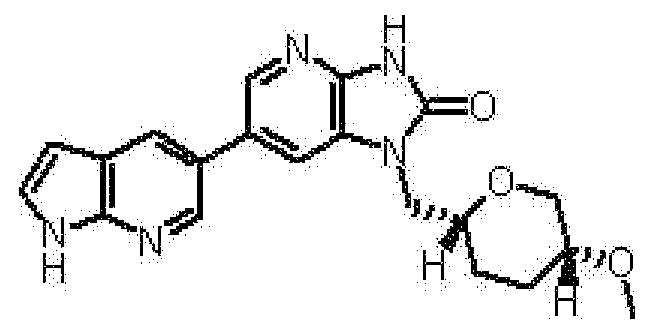
Стадия 1
2,6-Ангидро-1-[3-циклогекс-1-ен-1-ил-2-оксо-6-(1H-пирроло[2,3-b]пиридин-5-ил)-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил]-1,3,4-тридеокси-5-O-метил-L-трео-гекситол
Указанное в заголовке соединение (220 мг) получали в виде светло-желтого масла способом, аналогичным применяемому на стадии 2 примера 4, используя 5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пирроло[2,3-b]пиридин (173 мг) и L-изомер, полученный на стадии 1 примера 135 (изомер B, 200 мг).
MS (ESI) m/z: 460 (M+H)+.
1H-ЯМР (CDCl3) δ: 1,57-1,66 (3H, м), 1,75-1,80 (2H, м), 1,88-1,95 (2H, м), 2,11-2,15 (1H, м), 2,32-2,35 (2H, м), 2,49-2,52 (2H, м), 3,22-3,24 (1H, м), 3,36 (3H, с), 3,44 (1H, дд, J=12,6, 1,7 Гц), 3,72-3,76 (1H, м), 3,89 (1H, дд, J=14,8, 8,0 Гц), 4,04-4,09 (2H, м), 6,06-6,08 (1H, м), 6,59 (1H, дд, J=3,7, 2,0 Гц), 7,39 (1H, дд, J=3,4, 2,2 Гц), 7,67 (1H, д, J=2,2 Гц), 8,08 (1H, д, J=1,7 Гц), 8,27 (1H, д, J=2,2 Гц), 8,50 (1H, д, J=2,2 Гц), 9,13 (1H, с).
Стадия 2
2,6-Ангидро-1,3,4-тридеокси-5-O-метил-1-[2-оксо-6-(1H-пирроло[2,3-b]пиридин-5-ил)-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил]-L-трео-гекситол
Указанное в заголовке соединение (79 мг) получали в виде светло-желтого твердого вещества способом, аналогичным применяемому на стадии 6 примера 35, используя соединение, полученное на вышеуказанной стадии 1 (220 мг).
MS (ESI) m/z: 380 (M+H)+.
1H-ЯМР (ДМСО-d6) δ: 1,40-1,44 (1H, м), 1,54-1,64 (2H, м), 1,89-1,95 (1H, м), 3,20 (3H, с), 3,71-3,77 (1H, м), 3,80-3,98 (3H, м), 6,51 (1H, дд, J=3,4, 1,6 Гц), 7,52-7,54 (1H, м), 7,83 (1H, д, J=1,8 Гц), 8,22-8,23 (2H, м), 8,52 (1H, д, J=2,2 Гц), 11,59 (1H, с), 11,74 (1H, с).
(Пример 137)
2,6-Ангидро-1,3,5-тридеокси-4-O-метил-1-[2-оксо-6-(1H-пирроло[2,3-b]пиридин-5-ил)-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил]-L-трео-гекситол
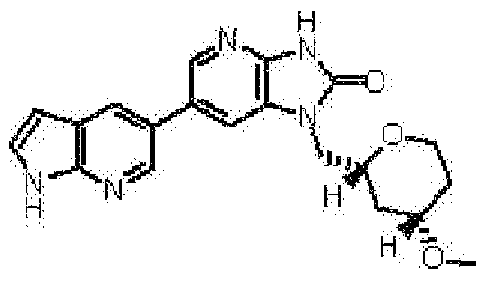
Стадия 1
2,6-Ангидро-1-O-бензил-3,5-дидеокси-L-трео-гекситол
2,6-Ангидро-1-O-бензил-3,5-дидеокси-D-трео-гекситол
Соединение, полученное на стадии 2 примера 114, оптически анализировали с помощью ВЭЖХ с получением указанных в заголовке соединений, L-изомера (изомер A: 0,47 г) и D-изомера (изомер B: 0,47 г) соответственно.
Препаративное разделение
Колонка: CHIRALCEL OD (5×50 см)
Элюент: 25% изопропанол/н-гексан
Скорость потока: 25 мл/мин
Время элюирования: изомер A: 48 мин, изомер B: 58 мин
Анализ
Колонка: CHIRALCEL OD (0,46×5 см)
Элюент: 10% изопропанол/н-гексан
Скорость потока: 1,0 мл/мин
Время элюирования: изомер A: 12 мин, изомер B: 16 мин
2,6-Ангидро-1-O-бензил-3,5-дидеокси-D-трео-гекситол получали из известного производного сахара в соответствии с приведенным ниже ссылочным примером.
Результат анализа, проведенного посредством хиральной ВЭЖХ
Время элюирования: 16 мин
Исходя из вышеуказанного результата изомер B и изомер A были определены как D-изомер и L-изомер соответственно.
Ссылочный пример 1
2,6-Ангидро-4-O-бензоил-1-O-бензил-3-хлор-3,5-дидеокси-D-арабино-гекситол
В раствор 1,5-ангидро-3-O-бензоил-6-O-бензил-2-деокси-D-арабино-гекситола, полученного способом, описанным в J. Org. Chem. 67. 3346-3354 (2002) (94 мг), в пиридине (27 мг) при охлаждении льдом добавляли сульфонилхлорид (29 мкл) и смесь перемешивали при комнатной температуре в течение 4 часов. Добавляли воду, затем экстрагировали этилацетатом. Далее органический слой сушили над безводным сульфатом магния и растворитель упаривали при пониженном давлении. Полученный остаток очищали хроматографией на колонке с силикагелем (элюируя смесью этилацетат-гексан) с получением указанного в заголовке соединения (27 мг).
1H-ЯМР (CDCl3) δ: 1,82-1,87 (1H, м), 2,32-2,42 (1H, м), 3,60-3,72 (3H, м), 3,84-3,88 (1H, м), 4,13-4,18 (1H, м), 4,52-4,62 (3H, м), 5,26-5,31 (1H, м), 7,27-7,38 (5H, м), 7,44-7,48 (2H, м), 7,57-7,60 (1H, м), 8,07-8,09 (2H, м).
Ссылочный пример 2
2,6-Ангидро-4-O-бензоил-1-O-бензил-3,5-дидеокси-D-трео-гекситол
В раствор соединения, полученного в описанном выше ссылочном примере 1 (27 мг), в бензоле (1,0 мл) добавляли гидрид трибутилолова (24 мкл) и азобисизобутиронитрил (6 мг) и смесь нагревали с обратным холодильником в течение одного часа. Дополнительно добавляли гидрид трибутилолова (24 мкл) и азобисизобутиронитрил (1 мг) и смесь нагревали с обратным холодильником в течение одного часа. Реакционный раствор концентрировали и потом остаток очищали тонкослойной хроматографией (элюируя смесью этилацетат-гексан) с получением указанного в заголовке сырого соединения (35 мг).
MS (ESI) m/z: 327 (M+H)+.
Ссылочный пример 3
2,6-Ангидро-1-O-бензил-3,5-дидеокси-D-трео-гекситол
В раствор соединения, полученного в вышеуказанном ссылочном примере 2 (35 мг), в метаноле (1,0 мл) добавляли по каплям раствор метоксида натрия в метаноле (5 M, 14 мкл) и смесь перемешивали при комнатной температуре в течение 6 часов. Добавляли насыщенный водный раствор бикарбоната натрия, затем экстрагировали этилацетатом. Потом органический слой промывали насыщенным солевым раствором и сушили над безводным сульфатом натрия и растворитель упаривали при пониженном давлении. Полученный остаток очищали хроматографией на колонке с силикагелем (элюируя смесью этилацетат-гексан) с получением указанного в заголовке соединения (10 мг).
1H-ЯМР (CDCl3) δ: 1,30 (1H, дд, J=22,9, 11,5 Гц), 1,49-1,57 (1H, м), 1,86-1,94 (2H, м), 3,41-3,57 (4H, м), 3,77-3,83 (1H, м), 4,05-4,08 (1H, м), 4,55 (2H, д, J=11,6 Гц), 4,60 (1H, д, J=11,6 Гц), 7,27-7,31 (1H, м), 7,33-7,35 (4H, м).
Стадия 2
2,6-Ангидро-1-O-бензил-3,5-дидеокси-4-O-метил-L-трео-гекситол
Указанное в заголовке соединение (322 мг) получали способом, аналогичным применяемому на стадии 1 примера 63, используя L-изомер, полученный на вышеуказанной стадии 1 (изомер A: 466 мг).
MS (ESI) m/z: 237 (M+H)+.
Стадия 3
1,5-Ангидро-2,4-дидеокси-3-O-метил-L-трео-гекситол
Указанное в заголовке соединение (180 мг) получали способом, аналогичным применяемому на стадии 4 примера 114, используя соединение, полученное на вышеуказанной стадии 2 (322 мг).
Стадия 4
5-(4,4,5,5-Тетраметил-1,3,2-диоксаборолан-2-ил)-1-{[2-(триметилсилил)этокси]метил}-1H-пирроло[2,3-b]пиридин
5-(4,4,5,5-Тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пирроло[2,3-b]пиридин (1,01 г) растворяли в тетрагидрофуране (10 мл). После замены атмосферы на азот раствор охлаждали льдом. Добавляли 55% гидрид натрия (216 мг) и смесь перемешивали при охлаждении льдом в течение 20 минут. Далее добавляли [2-(хлорметокси)этил](триметил)силан (875 мкл) и смесь перемешивали при комнатной температуре в течение 15,5 часов. Реакционный раствор разбавляли добавлением воды, нейтрализовали 1 н. соляной кислотой (0,85 мл) и экстрагировали этилацетатом три раза. Органический слой однократно промывали водой и потом насыщенным солевым раствором и сушили над безводным сульфатом натрия и растворитель упаривали. Масло коричневого цвета очищали хроматографией на колонке с силикагелем (элюируя смесью этилацетат-гексан) с получением указанного в заголовке соединения (691 мг) в виде бесцветного масла.
MS (APCI) m/z: 375 [M+H]+.
1H-ЯМР (CDCl3) δ: -0,08 (9H, с), 0,87-0,91 (2H, м), 1,37 (12H, с), 3,49-3,55 (2H, м), 5,70 (2H, с), 6,52 (1H, д, J=3,7 Гц), 7,32 (1H, д, J=3,7 Гц), 8,35 (1H, д, J=1,6 Гц), 8,69 (1H, д, J=1,6 Гц).
Стадия 5
6-Бром-3-{[2-(триметилсилил)этокси]метил}-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Этил 6-бром-2-оксо-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-карбоксилат, полученный в условиях, описанных в WO 2008/051493 (2,01 г), растворяли в тетрагидрофуране (40 мл) и добавляли [2-(хлорметокси)этил](триметил)силан (1,37 мл). После замены атмосферы на азот смесь охлаждали льдом. Добавляли 55% гидрид натрия (337 мг) и смесь перемешивали в течение 50 минут с постепенным нагреванием до комнатной температуры. Реакционный раствор экстрагировали три раза добавлением воды и этилацетата. Органический слой промывали насыщенным солевым раствором и потом сушили над безводным сульфатом натрия и растворитель упаривали. Полученное масло коричневого цвета растворяли в тетрагидрофуране (40 мл). После охлаждения льдом добавляли изопропиламин (0,9 мл) и смесь непосредственно перемешивали в течение одного часа. После отгонки растворителя реакционной смеси остаток очищали хроматографией на колонке с силикагелем (элюируя смесью этилацетат-гексан) с получением указанного в заголовке соединения (1,56 г) в виде бесцветного кристаллического вещества.
MS (APCI) m/z: 344 [M+H]+.
1H-ЯМР (CDCl3) δ: -0,02 (9H, с), 0,98-0,99 (2H, м), 3,70-3,74 (2H, м), 5,41 (2H, с), 7,50 (1H, д, J=2,3 Гц), 8,16 (1H, д, J=2,3 Гц), 10,08 (1H, ушир. с).
Стадия 6
3-{[2-(Триметилсилил)этокси]метил}-6-(1-{[2-(триметилсилил)этокси]метил}-1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (195 мг) получали способом, аналогичным применяемому на стадии 3 примера 1, используя соединение, полученное на вышеуказанной стадии 4 (216 мг), и соединение, полученное на описанной выше стадии 5 (145 мг).
MS (APCI) m/z: 512 [M+H]+.
1H-ЯМР (CDCl3) δ: -0,05 (9H, с), 0,01 (9H, с), 0,91-0,96 (2H, м), 0,99-1,05 (2H, м), 3,56-3,61 (2H, м), 3,75-3,80 (2H, м), 5,49 (2H, с), 5,72 (2H, с), 6,59 (1H, д, J=3,7 Гц), 7,42 (1H, д, J=3,7 Гц), 7,55 (1H, д, J=2,3 Гц), 8,05 (1H, д, J=2,3 Гц), 8,33 (1H, д, J=2,3 Гц), 8,52 (1H, д, J=2,3 Гц), 9,40 (1H, ушир. с).
Стадия 7
2,6-Ангидро-1,3,5-тридеокси-4-O-метил-1-[2-оксо-3-{[2-(триметилсилил)этокси]метил}-6-(1-{[2-(триметилсилил)этокси]метил}-1H-пирроло[2,3-b]пиридин-5-ил)-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил]-L-трео-гекситол
Соединение, полученное на описанной выше стадии 6 (130 мг), и соединение, полученное на описанной выше стадии 3 (60 мг), перемешивали при комнатной температуре в течение 55 минут способом, аналогичным применяемому на стадии 3 примера 35, и потом реакционный раствор охлаждали льдом. Добавляли триэтиламин (86 мкл) и метансульфонилхлорид (35 мкл) и смесь перемешивали при охлаждении льдом в течение 30 минут. Добавляли ацетонитрил (6 мл) и карбонат калия (70 мг) и смесь перемешивали при 80°C в течение 42 часов. Реакционный раствор фильтровали и промывали ацетонитрилом и потом фильтрат концентрировали. Остаток очищали хроматографией на колонке с силикагелем (элюируя смесью этилацетат-гексан) с получением указанного в заголовке соединения (114 мг) в виде бесцветного масла.
MS (APCI) m/z: 640 [M+H]+.
Стадия 8
2,6-Ангидро-1,3,5-тридеокси-4-O-метил-1-[2-оксо-6-(1H-пирроло[2,3-b]пиридин-5-ил)-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил]-L-трео-гекситол диметансульфонат
Соединение, полученное на описанной выше стадии 7 (109 мг), растворяли в тетрагидрофуране (3 мл). Добавляли флуорид тетрабутиламмония (1,0 M раствор в тетрагидрофуране) (1,7 мл) и смесь перемешивали при 80°C в течение 13 часов. Растворитель реакционной смеси отгоняли. Остаток очищали хроматографией на колонке с силикагелем (элюируя смесью этилацетат-этанол) и потом очищали, элюируя 5% водной смесью аммиак/этанол, используя PoraPakTMRxn CX (2 г). Полученное кристаллическое вещество растворяли в дихлорметане (3 мл)/этанол (0,5 мл) и добавляли метансульфоновую кислоту (22 мкл). Смесь перемешивали при комнатной температуре в течение 15 минут и потом растворитель упаривали. Остаток кристаллизовали из этилацетата и собирали фильтрованием в атмосфере азота с получением указанного в заголовке соединения (27 мг).
MS (APCI) m/z: 380 [M+H]+.
1H-ЯМР (ДМСО-d6) δ: 1,04-1,13 (1H, м), 1,15-1,27 (1H, м), 1,82-1,90 (1H, м), 2,00-2,08 (1H, м), 2,44 (6H, с), 3,18-3,38 (2H, м), 3,22 (3H, с), 3,64-3,73 (1H, ушир. м), 3,82-3,91 (2H, ушир. м), 3,98 (1H, дд, J=14,7, 7,8 Гц), 6,76 (1H, дд, J=3,7, 1,8 Гц), 7,74 (1H, т, J=2,7 Гц), 7,90 (1H, д, J=1,8 Гц), 8,30 (1H, д, J=1,8 Гц), 8,72 (2H, с), 12,46 (1H, ушир. с).
(Пример 138)
2,6-Ангидро-1,3,5-тридеокси-4-O-метил-1-[2-оксо-6-(1H-пирроло[2,3-b]пиридин-5-ил)-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил]-D-трео-гекситол
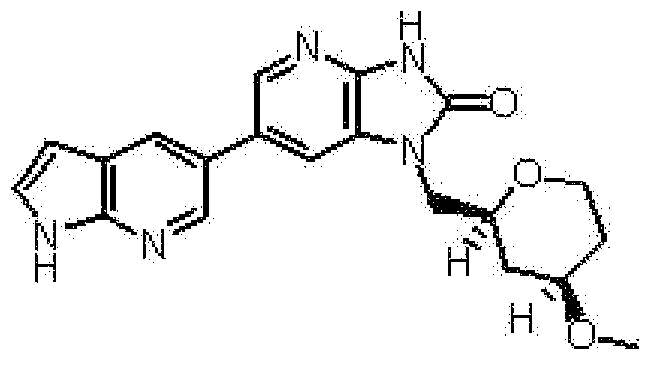
Стадия 1
2,6-Ангидро-1-O-бензил-3,5-дидеокси-4-O-метил-D-трео-гекситол
Указанное в заголовке соединение (340 мг) получали способом, аналогичным применяемому на стадии 1 примера 63, используя D-изомер, полученный на стадии 1 примера 137 (изомер B: 468 мг).
MS (ESI) m/z: 237 (M+H)+.
Стадия 2
1,5-Ангидро-2,4-дидеокси-3-O-метил-D-трео-гекситол
Указанное в заголовке соединение (195 мг) получали способом, аналогичным применяемому на стадии 4 примера 114, используя соединение, полученное на вышеуказанной стадии 1 (340 мг).
Стадия 3
2,6-Ангидро-1,3,5-тридеокси-4-O-метил-1-[2-оксо-3-{[2-(триметилсилил)этокси]метил}-6-(1-{[2-(триметилсилил)этокси]метил}-1H-пирроло[2,3-b]пиридин-5-ил)-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил]-D-трео-гекситол
Соединение, полученное на описанной выше стадии 2 (60 мг), растворяли в этилацетате (6 мл). Добавляли триэтиламин (86 мкл) и метансульфонилхлорид (35 мкл) и смесь перемешивали при охлаждении льдом в течение 30 минут. Осадок удаляли фильтрованием. После промывания этилацетатом фильтрат концентрировали. Добавляли ацетонитрил (6 мл), N,N-диметилформамид (2 мл), соединение, полученное на стадии 6 примера 137 (130 мг), и карбонат калия (70 мг) и смесь перемешивали при 80°C в течение 35 часов. Реакционный раствор фильтровали и промывали ацетонитрилом и потом фильтрат концентрировали. Остаток очищали хроматографией на колонке с силикагелем (элюируя смесью этилацетат-гексан) с получением указанного в заголовке соединения (128 мг) в виде бесцветного масла.
MS (APCI) m/z: 640 [M+H]+.
1H-ЯМР (CDCl3) δ: -0,04 (9H, с), 0,00 (9H, с), 0,91-0,96 (2H, м), 0,98-1,03 (2H, м), 1,19-1,29 (1H, м), 1,44 (1H, ддд, J=23,3, 12,4, 4,6 Гц), 1,90-1,97 (1H, м), 2,14-2,21 (1H, м), 3,29-3,39 (2H, м), 3,36 (3H, с), 3,57-3,62 (2H, м), 3,65-3,78 (3H, м), 3,92 (1H, дд, J=14,8, 7,8 Гц), 3,99 (1H, дд, J=11,4, 4,6 Гц), 4,07 (1H, дд, J=14,8, 2,7 Гц), 5,47 (2H, с), 5,74 (2H, с), 6,60 (1H, д, J=3,7 Гц), 7,43 (1H, д, J=3,7 Гц), 7,61 (1H, д, J=1,8 Гц), 8,09 (1H, д, J=1,8 Гц), 8,29 (1H, д, J=1,8 Гц), 8,52 (1H, д, J=1,8 Гц).
Стадия 4
2,6-Ангидро-1,3,5-тридеокси-4-O-метил-1-[2-оксо-6-(1H-пирроло[2,3-b]пиридин-5-ил)-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил]-D-трео-гекситол диметансульфонат
Указанное в заголовке соединение (24 мг) получали способом, аналогичным применяемому на стадии 8 примера 137, используя соединение, полученное на вышеуказанной стадии 3 (121 мг).
MS (APCI) m/z: 380 [M+H]+.
1H-ЯМР (ДМСО-d6) δ: 1,04-1,13 (1H, м), 1,15-1,27 (1H, м), 1,82-1,90 (1H, м), 2,00-2,08 (1H, м), 2,44 (6H, с), 3,18-3,38 (2H, м), 3,22 (3H, с), 3,64-3,73 (1H, ушир. м), 3,82-3,91 (2H, ушир. м), 3,98 (1H, дд, J=14,7, 7,8 Гц), 6,76 (1H, дд, J=3,7, 1,8 Гц), 7,74 (1H, т, J=2,7 Гц), 7,90 (1H, д, J=1,8 Гц), 8,30 (1H, д, J=1,8 Гц), 8,72 (2H, с), 12,46 (1H, ушир. с).
(Пример 139)
2,6-Ангидро-1,3,5-тридеокси-4-O-метил-1-[6-(4-метил-1H-пирроло[2,3-b]пиридин-5-ил)-2-оксо-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил]-L-трео-гекситол
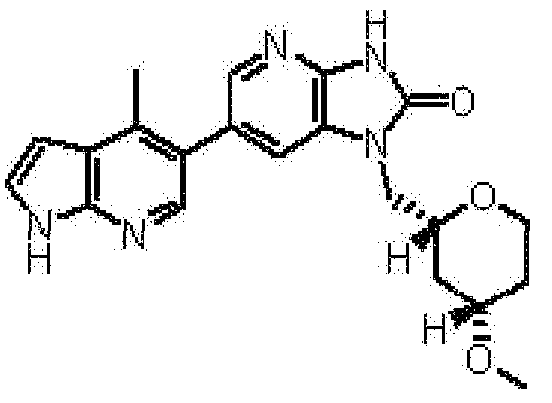
Стадия 1
2,6-Ангидро-3,5-дидеокси-4-O-метил-1-O-(метансульфонил)-L-трео-гекситол
В раствор соединения, полученного на стадии 3 примера 137 (120 мг), в дихлорметане (2,5 мл) добавляли триэтиламин (137 мкл) и добавляли по каплям метансульфонилхлорид (70 мкл) при охлаждении льдом. После перемешивания при комнатной температуре в течение 2 часов добавляли фосфатный буфер (pH 7,0), затем разбавляли дихлорметаном. Органический слой промывали насыщенным солевым раствором. После сушки над безводным сульфатом натрия растворитель упаривали при пониженном давлении с получением указанного в заголовке соединения (179 мг).
Стадия 2
2,6-Ангидро-1-(6-бром-3-циклогекс-1-ен-1-ил-2-оксо-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил)-1,3,5-тридеокси-4-O-метил-L-трео-гекситол
К смешанному раствору соединения, полученному на описанной выше стадии 1 (179 мг), в ацетонитрил-N,N-диметилформамиде (2:1, 7,5 мл) добавляли соединение, полученное на стадии 2 примера 35 (235 мг), и карбонат калия (221 мг) и смесь перемешивали при 80°C в течение ночи. После разбавления этилацетатом органический слой последовательно промывали водой и насыщенным солевым раствором и сушили над безводным сульфатом натрия. Растворитель упаривали при пониженном давлении. Полученный остаток очищали хроматографией на колонке с силикагелем (элюируя смесью этилацетат-гексан) с получением указанного в заголовке соединения (314 мг).
MS (ESI) m/z: 422 (M+H)+.
Стадия 3
2,6-Ангидро-1-[3-циклогекс-1-ен-1-ил-2-оксо-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил]-1,3,5-тридеокси-4-O-метил-L-трео-гекситол
Указанное в заголовке соединение (174 мг) получали способом, аналогичным применяемому на стадии 4 примера 35, используя соединение, полученное на вышеуказанной стадии 2 (314 мг).
MS (ESI) m/z: 470 (M+H)+.
Стадия 4
2,6-Ангидро-1-[3-циклогекс-1-ен-1-ил-6-(4-метил-1H-пирроло[2,3-b]пиридин-5-ил)-2-оксо-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил]-1,3,5-тридеокси-4-O-метил-L-трео-гекситол
Указанное в заголовке соединение (111 мг) получали способом, аналогичным применяемому на стадии 3 примера 1, используя соединение, полученное на вышеуказанной стадии 3 (174 мг), и соединение, полученное на стадии 3 примера 36 (94 мг).
MS (ESI) m/z: 474 (M+H)+.
Стадия 5
2,6-Ангидро-1,3,5-тридеокси-4-O-метил-1-[6-(4-метил-1H-пирроло[2,3-b]пиридин-5-ил)-2-оксо-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил]-L-трео-гекситол
Указанное в заголовке соединение (47 мг) получали способом, аналогичным применяемому на стадии 6 примера 35, используя соединение, полученное на вышеуказанной стадии 4 (111 мг).
MS (ESI) m/z: 394 (M+H)+.
Стадия 6
2,6-Ангидро-1,3,5-тридеокси-4-O-метил-1-[6-(4-метил-1H-пирроло[2,3-b]пиридин-5-ил)-2-оксо-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил]-L-трео-гекситол диметансульфонат
Указанное в заголовке соединение (62 мг) получали способом, аналогичным применяемому на стадии 3 примера 118, используя соединение, полученное на вышеуказанной стадии 5 (47 мг).
MS (ESI) m/z: 394 (M+H)+.
HRMS (ESI) [(M+H)+] вычислено: C21H24N5O3 394,18791; найдено: 394,18724.
1H-ЯМР (ДМСО-d6) δ: 1,02-1,09 (1H, м), 1,16-1,25 (1H, м), 1,85-1,90 (1H, м), 2,02-2,06 (1H, м), 2,32 (6H, с), 2,54 (3H, с), 3,22 (3H, с), 3,23-3,28 (1H, м), 3,31-3,37 (1H, м), 3,62-3,99 (4H, м), 6,73-6,75 (1H, м), 7,57-7,57 (1H, м), 7,60-7,62 (1H, м), 7,94 (1H, д, J=1,7 Гц), 8,21 (1H, с), 11,69 (1H, ушир. с), 12,08 (1H, ушир. с).
(Пример 140)
2,6-Ангидро-1,3,5-тридеокси-4-O-метил-1-[6-(4-метил-1H-пирроло[2,3-b]пиридин-5-ил)-2-оксо-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил]-D-трео-гекситол
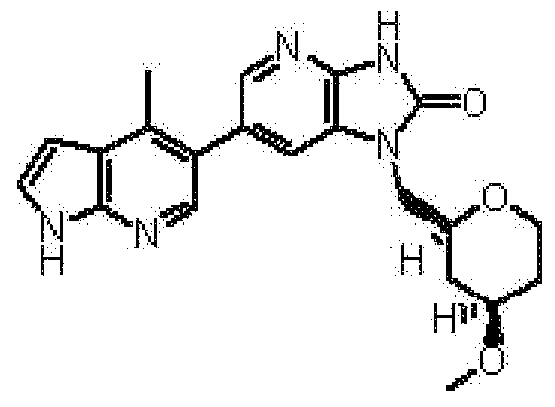
Стадия 1
2,6-Ангидро-3,5-дидеокси-4-O-метил-1-O-(метансульфонил)-D-трео-гекситол
Указанное в заголовке соединение (189 мг) получали способом, аналогичным применяемому на стадии 1 примера 139, используя соединение, полученное на стадии 2 примера 138 (128 мг).
Стадия 2
2,6-Ангидро-1-(6-бром-3-циклогекс-1-ен-1-ил-2-оксо-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил)-1,3,5-тридеокси-4-O-метил-D-трео-гекситол
Указанное в заголовке соединение (343 мг) получали способом, аналогичным применяемому на стадии 2 примера 139, используя соединение, полученное на вышеуказанной стадии 1 (189 мг), и соединение, полученное на стадии 2 примера 35 (248 мг).
MS (ESI) m/z: 422 (M+H)+.
Стадия 3
2,6-Ангидро-1-[3-циклогекс-1-ен-1-ил-2-оксо-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил]-1,3,5-тридеокси-4-O-метил-D-трео-гекситол
Указанное в заголовке соединение (215 мг) получали способом, аналогичным применяемому на стадии 4 примера 35, используя соединение, полученное на вышеуказанной стадии 2 (341 мг).
MS (ESI) m/z: 470 (M+H)+.
Стадия 4
2,6-Ангидро-1-[3-циклогекс-1-ен-1-ил-6-(4-метил-1H-пирроло[2,3-b]пиридин-5-ил)-2-оксо-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил]-1,3,5-тридеокси-4-O-метил-D-трео-гекситол
Указанное в заголовке соединение (150 мг) получали способом, аналогичным применяемому на стадии 3 примера 1, используя соединение, полученное на вышеуказанной стадии 3 (215 мг), и соединение, полученное на стадии 3 примера 36 (116 мг).
MS (ESI) m/z: 474 (M+H)+.
Стадия 5
2,6-Ангидро-1,3,5-тридеокси-4-O-метил-1-[6-(4-метил-1H-пирроло[2,3-b]пиридин-5-ил)-2-оксо-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил]-D-трео-гекситол
Указанное в заголовке соединение (76 мг) получали способом, аналогичным применяемому на стадии 6 примера 35, используя соединение, полученное на вышеуказанной стадии 4 (150 мг).
MS (ESI) m/z: 394 (M+H)+.
Стадия 6
2,6-Ангидро-1,3,5-тридеокси-4-O-метил-1-[6-(4-метил-1H-пирроло[2,3-b]пиридин-5-ил)-2-оксо-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил]-D-трео-гекситол диметансульфонат
Указанное в заголовке соединение (106 мг) получали способом, аналогичным применяемому на стадии 3 примера 118, используя соединение, полученное на вышеуказанной стадии 5 (76 мг).
MS (ESI) m/z: 394 (M+H)+.
HRMS (ESI) [(M+H)+] вычислено: C21H24N5O3 394,18791; найдено: 394,18758.
1H-ЯМР (ДМСО-D6) δ: 1,02-1,09 (1H, м), 1,16-1,25 (1H, м), 1,85-1,89 (1H, м), 2,02-2,06 (1H, м), 2,34 (6H, с), 2,57 (3H, с), 3,23 (3H, с), 3,23-3,28 (1H, м), 3,31-3,37 (1H, м), 3,62-3,99 (4H, м), 6,80-6,82 (1H, м), 7,58 (1H, д, J=2,3 Гц), 7,65-7,66 (1H, м), 7,95 (1H, д, J=1,7 Гц), 8,26 (1H, с), 11,72 (1H, ушир. с), 12,24 (1H, ушир. с).
(Пример 141)
2,6-Ангидро-1,3,4-тридеокси-1-[6-(4-метил-1H-пирроло[2,3-b]пиридин-5-ил)-2-оксо-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил]-DL-трео-гекситол
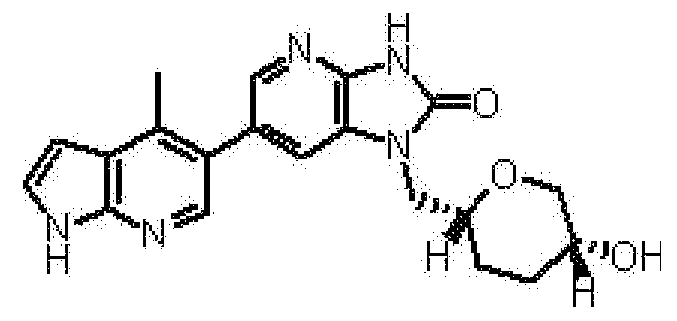
и его энантиомер
Стадия 1
4-Метил-5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пирроло[2,3-b]пиридин
Указанное в заголовке соединение (0,34 г) получали в виде бесцветного твердого вещества способом, аналогичным применяемому на стадии 4 примера 35, используя соединение, полученное на стадии 3 примера 36 (1 г).
MS (ESI) m/z: 259 (M+H)+.
1H-ЯМР (CDCl3) δ: 1,38 (9H, с), 2,78 (3H, с), 6,57 (1H, д, J=3,6 Гц), 7,28 (1H, д, J=3,2 Гц), 8,66 (1H, с), 10,24 (1H, с).
Стадия 2
2,6-Ангидро-5-O-бензоил-1-[3-циклогекс-1-ен-1-ил-6-(4-метил-1H-пирроло[2,3-b]пиридин-5-ил)-2-оксо-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил]-1,3,4-тридеокси-DL-трео-гекситол
Указанное в заголовке соединение (120 мг) получали в виде светло-желтого масла способом, аналогичным применяемому на стадии 2 примера 4, используя соединение, полученное на вышеуказанной стадии 1 (113 мг), и соединение, полученное на стадии 3 примера 112 (150 мг).
MS (ESI) m/z: 564 (M+H)+.
1H-ЯМР (CDCl3) δ: 1,69-1,74 (1H, м), 1,76-1,81 (2H, м), 1,84-1,91 (3H, м), 2,13-2,19 (1H, м), 2,33-2,37 (2H, м), 2,40 (3H, с), 2,48-2,55 (2H, м), 3,65 (1H, д, J=12,8 Гц), 3,82-3,87 (1H, м), 4,03-4,12 (3H, м), 5,04 (1H, с), 6,09 (1H, с), 6,52 (1H, д, J=2,2 Гц), 7,31-7,36 (3H, м), 7,46-7,52 (2H, м), 7,84 (2H, д, J=8,2 Гц), 8,04 (1H, с), 8,11 (1H, с), 8,92 (1H, ушир. с).
Стадия 3
2,6-Ангидро-1,3,4-тридеокси-1-[6-(4-метил-1H-пирроло[2,3-b]пиридин-5-ил)-2-оксо-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил]-DL-трео-гекситол
Указанное в заголовке соединение (10 мг) получали в виде светло-желтого твердого вещества способом, аналогичным применяемому на стадии 6 примера 35, используя соединение, полученное на вышеуказанной стадии 2 (120 мг).
MS (ESI) m/z: 380 (M+H)+.
1H-ЯМР (ДМСО-d6) δ: 1,38-1,41 (1H, м), 1,61-1,71 (3H, м), 2,47 (3H, с), 3,30-3,38 (1H, м), 3,52-3,54 (1H, м), 3,62-3,66 (2H, м), 3,80-3,93 (2H, м), 4,54 (1H, д, J=4,0 Гц), 6,56-6,57 (1H, м), 7,48 (1H, т, J=2,8 Гц), 7,54 (1H, д, J=1,7 Гц), 7,90 (1H, д, J=1,7 Гц), 8,08 (1H, с), 11,61 (1H, с), 11,65 (1H, с).
(Пример 142)
2,6-Ангидро-1,3,4-тридеокси-5-O-метил-1-[6-(4-метил-1H-пирроло[2,3-b]пиридин-5-ил)-2-оксо-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил]-DL-трео-гекситол
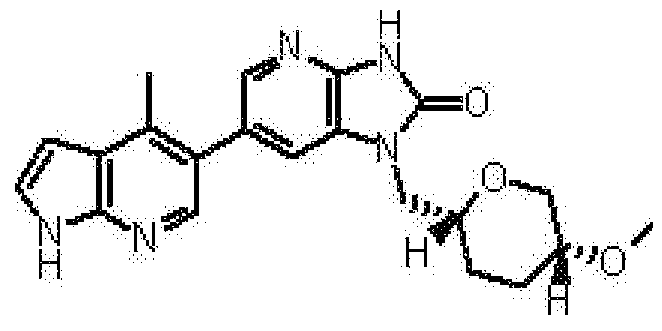
и его энантиомер
Стадия 1
2,6-Ангидро-1-[3-циклогекс-1-ен-1-ил-6-(4-метил-1H-пирроло[2,3-b]пиридин-5-ил)-2-оксо-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил]-1,3,4-тридеокси-5-O-метил-DL-трео-гекситол
Указанное в заголовке соединение (170 мг) получали в виде светло-желтого масла способом, аналогичным применяемому на стадии 2 примера 4, используя соединение, полученное на стадии 1 примера 141 (138 мг), и соединение, полученное на стадии 4 примера 113 (150 мг).
MS (ESI) m/z: 474 (M+H)+.
1H-ЯМР (CDCl3) δ: 1,55-1,65 (4H, м), 1,74-1,80 (2H, м), 1,87-1,93 (2H, м), 2,08-2,13 (1H, м), 2,32-2,36 (2H, м), 2,50-2,53 (4H, м), 3,21 (1H, с), 3,33 (3H, д, J=1,3 Гц), 3,42 (1H, д, J=12,8 Гц), 3,71 (1H, т, J=8,9 Гц), 3,84 (1H, дд, J=14,6, 7,7 Гц), 3,99-4,08 (2H, м), 6,08-6,10 (1H, м), 6,57-6,59 (1H, м), 7,35 (1H, с), 7,48 (1H, с), 8,03 (1H, т, J=1,8 Гц), 8,18 (1H, с), 9,14 (1H, с).
Стадия 2
2,6-Ангидро-1,3,4-тридеокси-5-O-метил-1-[6-(4-метил-1H-пирроло[2,3-b]пиридин-5-ил)-2-оксо-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил]-DL-трео-гекситол
Указанное в заголовке соединение (53 мг) получали в виде светло-желтого твердого вещества способом, аналогичным применяемому на стадии 6 примера 35, используя соединение, полученное на вышеуказанной стадии 1 (170 мг).
MS (ESI) m/z: 394 (M+H)+.
Стадия 3
2,6-Ангидро-1,3,4-тридеокси-5-O-метил-1-[6-(4-метил-1H-пирроло[2,3-b]пиридин-5-ил)-2-оксо-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил]-DL-трео-гекситол диметансульфонат
Указанное в заголовке соединение (78 мг) получали в виде светло-желтого твердого вещества способом, аналогичным применяемому на стадии 3 примера 118, используя соединение, полученное на вышеуказанной стадии 2 (53 мг).
MS (ESI) m/z: 394 (M+H)+.
1H-ЯМР (ДМСО-d6) δ: 1,39-1,43 (1H, м), 1,48-1,62 (2H, м), 1,89-1,93 (1H, м), 2,36-2,41 (9H, м), 2,60-2,62 (2H, м), 3,19 (3H, с), 3,32-3,35 (1H, м), 3,66-3,71 (1H, м), 3,79-3,92 (3H, м), 6,87-6,91 (1H, м), 7,61 (1H, д, J=4,0 Гц), 7,70-7,73 (1H, м), 7,96-7,97 (1H, м), 8,32-8,36 (1H, м), 11,74 (1H, с), 12,41 (1H, с).
(Пример 143)
2,6-Ангидро-1,3,4-тридеокси-1-[6-(4-метил-1H-пирроло[2,3-b]пиридин-5-ил)-2-оксо-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил]-L-трео-гекситол
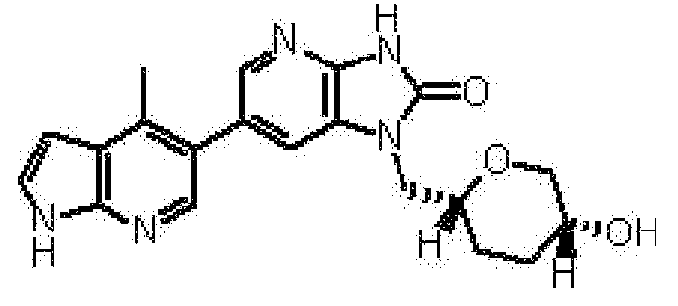
Стадия 1
2-[(Бензилокси)метил]-3,4-дигидро-2H-пиран
3,4-Дигидро-2H-пиран-2-илметанол (5,0 г) растворяли в тетрагидрофуране (100 мл). При охлаждении льдом добавляли 55% гидрид натрия (2,3 г) и бензилбромид (8,2 г), затем перемешивали в течение 17 часов. Добавляли насыщенный водный раствор хлорида аммония, затем экстрагировали этилацетатом и промывали насыщенным солевым раствором. Органический слой сушили над безводным сульфатом натрия и потом растворитель упаривали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (элюируя смесью этилацетат-гексан) с получением указанного в заголовке соединения (8,5 г) в виде светло-желтого масла.
MS (ESI) m/z: 205 (M+H)+.
1H-ЯМР (CDCl3) δ: 1,66-1,78 (1H, м), 1,85-1,92 (1H, м), 1,96-2,05 (1H, м), 2,07-2,18 (1H, м), 3,56 (1H, дд, J=4,3, 10,3 Гц), 3,63 (1H, дд, J=6,2, 10,3 Гц), 4,03-4,10 (1H, м), 4,61 (1H, д, J=12,4 Гц), 4,65 (1H, д, J=12,4 Гц), 4,69-4,74 (1H, м), 6,42-6,45 (1H, м), 7,28-7,40 (м, 5H).
Стадия 2
2,6-Ангидро-1-O-бензил-3,4-дидеокси-DL-эритро-гекситол
Соединение, полученное на описанной выше стадии 1 (8,9 г), растворяли в тетрагидрофуране (290 мл). Добавляли 0,5 н. раствор 9-борабицикло[3.3.1]нонана в тетрагидрофуране (122,5 мл) и смесь перемешивали при комнатной температуре в течение 17 часов. К реакционному раствору добавляли 3 н. водный раствор гидроксида натрия (43,8 мл), 35% водный раствор перекиси водорода (17 мл) и карбонат калия (30,2 г), затем перемешивали в течение одного часа. Далее реакционный раствор разбавляли этилацетатом и промывали насыщенным солевым раствором. Органический слой сушили над безводным сульфатом натрия и потом растворитель упаривали при пониженном давлении. Остаток очищали хроматографией на колонке с силикагелем (элюируя смесью этилацетат-гексан) с получением указанного в заголовке соединения (7,2 г) в виде светло-желтого масла.
1H-ЯМР (CDCl3) δ: 1,34-1,48 (2H, м), 1,51-1,57 (1H, м), 1,65-1,75 (1H, м), 3,15 (1H, т, J=10,53 Гц), 3,37-3,54 (3H, м), 3,65-3,78 (1H, м), 4,01-4,09 (1H, м), 4,54 (1H, д, J=12,4 Гц), 4,60 (1H, д, J=12,4 Гц), 7,24-7,37 (5H, м).
Стадия 3
2,6-Ангидро-1-O-бензил-3,4-дидеокси-5-O-(фенилкарбонил)-L-трео-гекситол
2,6-Ангидро-1-O-бензил-3,4-дидеокси-5-O-(фенилкарбонил)-D-трео-гекситол
Указанное в заголовке соединение получали в виде рацемата способом, аналогичным применяемому на стадии 1 примера 112, используя соединение, полученное на вышеуказанной стадии 2 (6,6 г), и бензойную кислоту (4,32 г).
MS (ESI) m/z: 327 (M+H)+.
1H-ЯМР (CDCl3) δ: 1,52-1,59 (1H, м), 1,76-1,92 (2H, м), 2,12-2,21 (1H, м), 3,48 (1H, дд, J=10,1, 3,7 Гц), 3,59 (1H, дд, J=10,1, 6,4 Гц), 3,64-3,77 (2H, м), 4,21 (1H, дт, J=13,0, 2,0 Гц), 4,57 (1H, д, J=12,4 Гц), 4,64 (1H, д, J=12,4 Гц), 5,05-5,09 (1H, м), 7,27-7,38 (5H, м), 7,40-7,47 (2H, м), 7,53-7,59 (1H, м), 8,07-8,11 (2H, м).
Полученный рацемат оптически анализировали с помощью ВЭЖХ с получением указанных в заголовке соединений, L-изомера (изомер A: 4,0 г) и D-изомера (изомер B: 3,7 г) соответственно.
Колонка: CHIRALCEL OD (5 × 50 см)
Элюент: 25% изопропанол/н-гексан
Скорость потока: 25 мл/мин
Время элюирования: изомер A: 52 мин, изомер B: 72 мин
Указанное выше соединение может также быть синтезировано из известного соединения и может быть определена его абсолютная конфигурация.
Стадия 4
1,5-Ангидро-3,4-дидеокси-2-O-(фенилкарбонил)-L-трео-гекситол
L-изомер, полученный на вышеуказанной стадии 3 (изомер A, 3,5 г), растворяли в метаноле (53 мл). Добавляли 5% палладий на угле (1,1 г) и смесь перемешивали в атмосфере водорода при комнатной температуре в течение 22 часов. Реакционный раствор фильтровали и фильтрат концентрировали при пониженном давлении с получением указанного в заголовке соединения (2,3 г) в виде бесцветного масла.
1H-ЯМР (CDCl3) δ: 1,45-1,53 (1H, м), 1,78-1,94 (2H, м), 2,14-2,22 (1H, м), 3,53-3,69 (3H, м), 3,74 (1H, д, J=12,8 Гц), 4,20 (1H, д, J=12,8 Гц), 5,07-5,11 (1H, ушир. м), 7,45 (2H, т, J=7,8 Гц), 7,57 (1H, т, J=7,8 Гц), 8,09 (2H, д, J=7,8 Гц).
Стадия 5
2,6-Ангидро-1-(6-бром-3-циклогекс-1-ен-1-ил-2-оксо-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил)-1,3,4-тридеокси-5-O-(фенилкарбонил)-L-трео-гекситол
Указанное в заголовке соединение (3,4 г) получали способом, аналогичным применяемому на стадии 3 примера 35, используя соединение, полученное на вышеуказанной стадии 4 (1,5 г), и соединение, полученное на стадии 2 примера 35 (2,5 г).
1H-ЯМР (CDCl3) δ: 1,63-1,67 (1H, м), 1,70-1,80 (3H, м), 1,81-1,92 (3H, м), 2,12-2,20 (1H, м), 2,27-2,34 (2H, м), 2,38-2,45 (2H, м), 3,65 (1H, дд, J=13,0, 1,5 Гц), 3,76-3,84 (1H, м), 3,97 (1H, т, J=4,4 Гц), 4,92-5,06 (3H, м), 5,98-6,04 (1H, м), 7,42 (2H, т, J=7,7 Гц), 7,53-7,60 (2H, м), 7,90-7,94 (2H, м), 8,08 (1H, д, J=2,0 Гц).
Стадия 6
2,6-Ангидро-1-(6-бром-3-циклогекс-1-ен-1-ил-2-оксо-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил)-1,3,4-тридеокси-L-трео-гекситол
Соединение, полученное на описанной выше стадии 5 (3,4 г), растворяли в метаноле (44 мл). Добавляли карбонат калия (2,7 г) и смесь перемешивали в течение 4 часов. Реакционный раствор разбавляли этилацетатом, промывали насыщенным солевым раствором и сушили над безводным сульфатом натрия. Растворитель упаривали при пониженном давлении. Полученный остаток очищали хроматографией на колонке с силикагелем (элюируя смесью этилацетат-гексан) с получением указанного в заголовке соединения (2,0 г).
MS (ESI) m/z: 408 (M+H)+.
1H-ЯМР (CDCl3) δ: 1,69-1,80 (4H, м), 1,82-1,91 (2H, м), 1,93-1,99 (1H, м), 2,01-2,04 (1H, м), 2,27-2,35 (2H, м), 2,39-2,46 (2H, м), 3,53 (1H, д, J=12,4 Гц), 3,64-3,73 (1H, м), 3,76-3,81 (2H, м), 3,87-3,93 (1H, м), 3,98 (1H, дд, J=14,7, 2,8 Гц), 5,99-6,04 (1H, м), 7,53 (1H, д, J=1,8 Гц), 8,08 (1H, д, J=1,8 Гц).
Стадия 7
2,6-Ангидро-1-[3-циклогекс-1-ен-1-ил-2-оксо-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил]-1,3,4-тридеокси-L-трео-гекситол
Указанное в заголовке соединение (1,2 г) получали способом, аналогичным применяемому на стадии 4 примера 35, используя соединение, полученное на вышеуказанной стадии 6 (1,1 г).
MS (ESI) m/z: 456 (M+H)+.
1H-ЯМР (CDCl3) δ: 1,35 (12H, с), 1,57-1,62 (1H, м), 1,65-1,80 (4H, м), 1,81-1,98 (3H, м), 2,27-2,34 (2H, м), 2,43-2,44 (2H, м), 3,53 (1H, дд, J=12,4, 1,4 Гц), 3,70-3,79 (2H, м), 3,84-3,97 (3H, м), 5,99-6,04 (1H, м), 7,63 (1H, д, J=1,4 Гц), 8,44 (1H, д, J=1,4 Гц).
Стадия 8
2,6-Ангидро-1-[3-циклогекс-1-ен-1-ил-6-(4-метил-1H-пирроло[2,3-b]пиридин-5-ил)-2-оксо-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил]-1,3,4-тридеокси-L-трео-гекситол
Указанное в заголовке соединение (48 мг) получали способом, аналогичным применяемому на стадии 3 примера 1, используя соединение, полученное на вышеуказанной стадии 7 (150 мг), и соединение, полученное на стадии 3 примера 36 (83 мг).
MS (ESI) m/z: 460 (M+H)+.
1H-ЯМР (CDCl3) δ: 1,61-1,67 (1H, м), 1,70-1,84 (4H, м), 1,87-1,93 (2H, м), 1,94-2,00 (1H, м), 2,31-2,36 (2H, м), 2,42 (3H, с), 2,49-2,54 (2H, ушир. м), 3,54 (1H, д, J=12,0 Гц), 3,71-3,77 (1H, м), 3,78-3,80 (1H, ушир. м), 3,84-3,89 (2H, м), 4,05 (1H, дд, J=14,6, 3,2 Гц), 6,07-6,11 (1H, м), 6,51-6,55 (1H, ушир. м), 7,33-7,37 (2H, м), 8,03 (1H, с), 8,17 (1H, с), 9,96 (1H, ушир. с).
Стадия 9
2,6-Ангидро-1,3,4-тридеокси-1-[6-(4-метил-1H-пирроло[2,3-b]пиридин-5-ил)-2-оксо-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил]-L-трео-гекситол
Указанное в заголовке соединение (31 мг) получали способом, аналогичным применяемому на стадии 6 примера 35, используя соединение, полученное на вышеуказанной стадии 8 (48 мг).
MS (ESI) m/z: 380 (M+H)+.
HRMS (ESI) [M+H]+ вычислено: C20H21N5O3 380,17226; найдено: 380,17420.
1H-ЯМР (ДМСО-d6) δ: 1,38-1,43 (1H, м), 1,56-1,75 (3H, м), 2,47 (3H, с), 3,48-3,56 (1H, м), 3,59-3,61 (2H, м), 3,79-3,94 (2H, м), 4,07-4,12 (1H, м), 6,55-6,57 (1H, м), 7,46-7,48 (1H, м), 7,54 (1H, д, J=1,7 Гц), 7,90 (1H, д, J=1,7 Гц), 8,08 (1H, с), 11,6 (1H, с), 11,7 (1H, с).
(Пример 144)
2,6-Ангидро-1,3,4-тридеокси-1-[6-(3,4-диметил-1H-пирроло[2,3-b]пиридин-5-ил)-2-оксо-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил]-L-трео-гекситол
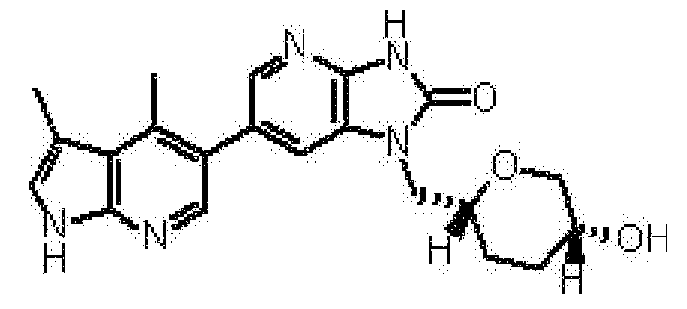
Стадия 1
2,6-Ангидро-1-[3-циклогекс-1-ен-1-ил-6-(3,4-диметил-1H-пирроло[2,3-b]пиридин-5-ил)-2-оксо-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил]-1,3,4-тридеокси-L-трео-гекситол
Указанное в заголовке соединение (57 мг) получали способом, аналогичным применяемому на стадии 3 примера 1, используя соединение, полученное на стадии 7 примера 143 (150 мг), и соединение, полученное на стадии 2 примера 124 (89 мг).
MS (ESI) m/z: 474 (M+H)+.
1H-ЯМР (CDCl3) δ: 1,60-1,81 (5H, м), 1,87-1,93 (2H, м), 1,94-1,99 (2H, м), 2,31-2,37 (2H, м), 2,48-2,54 (5H, м), 2,58-2,61 (3H, м), 3,54 (1H, д, J=12,6 Гц), 3,69-3,79 (2H, м), 3,82-3,90 (2H, м), 4,04 (1H, д, J=14,9 Гц), 6,08-6,10 (1H, м), 7,05 (1H, с), 7,37 (1H, с), 8,01 (1H, с), 8,09 (1H, с), 8,81 (1H, ушир. с).
Стадия 2
2,6-Ангидро-1,3,4-тридеокси-1-[6-(3,4-диметил-1H-пирроло[2,3-b]пиридин-5-ил)-2-оксо-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил]-L-трео-гекситол
Указанное в заголовке соединение (18 мг) получали способом, аналогичным применяемому на стадии 6 примера 35, используя соединение, полученное на вышеуказанной стадии 1 (57 мг).
MS (ESI) m/z: 394 (M+H)+.
HRMS (ESI) [M+H]+ вычислено: C21H23N5O3 394,18791; найдено: 394,18863.
1H-ЯМР (ДМСО-d6) δ: 1,31-1,50 (2H, м), 1,55-1,81 (3H, м), 2,46 (3H, с), 2,57 (3H, с), 3,47-4,06 (5H, м), 7,49 (1H, д, J=1,7 Гц), 7,86 (1H, д, J=1,7 Гц), 7,99 (1H, с), 11,61 (1H, с), 11,26 (1H, с).
(Пример 145)
2,6-Ангидро-1-[6-(3-хлор-4-метил-1H-пирроло[2,3-b]пиридин-5-ил)-2-оксо-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил]-1,3,4-тридеокси-L-трео-гекситол
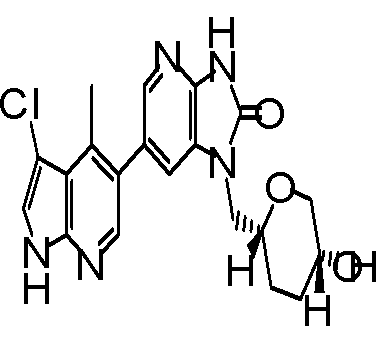
Стадия 1
2,6-Ангидро-1-[6-(3-хлор-4-метил-1H-пирроло[2,3-b]пиридин-5-ил)-3-(циклогекс-1-ен-1-ил)-2-оксо-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил]-1,3,4-тридеокси-L-трео-гекситол
Указанное в заголовке соединение (79 мг) получали способом, аналогичным применяемому на стадии 3 примера 1, используя соединение, полученное на стадии 7 примера 143 (150 мг), и соединение, полученное на стадии 2 примера 125 (137 мг).
MS (ESI) m/z: 494 (M+H)+.
1H-ЯМР (CDCl3) δ: 1,62-2,01 (8H, м), 2,30-2,38 (2H, м), 2,48-2,55 (2H, м), 2,68 (3H, с), 3,55 (1H, д, J=12,2 Гц), 3,70-3,82 (2H, м), 3,84-3,92 (2H, м), 4,06 (1H, дд, J=14,6, 2,7 Гц), 6,07-6,11 (1H, м), 7,30 (1H, с), 7,38 (1H, д, J=1,5 Гц), 8,00 (1H, д, J=1,5 Гц), 8,14 (1H, с).
Стадия 2
2,6-Ангидро-1-[6-(3-хлор-4-метил-1H-пирроло[2,3-b]пиридин-5-ил)-2-оксо-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил]-1,3,4-тридеокси-L-трео-гекситол
Указанное в заголовке соединение (58 мг) получали способом, аналогичным применяемому на стадии 6 примера 35, используя соединение, полученное на вышеуказанной стадии 1 (79 мг).
MS (ESI) m/z: 380 (M+H)+.
1H-ЯМР (ДМСО-d6) δ: 1,36-1,44 (1H, м), 1,56-1,80 (3H, м), 2,66 (3H, с), 3,50-3,56 (1H, м), 3,59-3,68 (2H, м), 3,70-4,15 (3H, м), 7,53 (1H, д, J=1,8 Гц), 7,66 (1H, д, J=2,8 Гц), 7,89 (1H, д, J=1,8 Гц), 8,13 (1H, с), 11,63 (1H, с), 12,00 (1H, с).
(Пример 146)
2,6-Ангидро-1,3,4-тридеокси-5-O-метил-1-[6-(4-метил-1H-пирроло[2,3-b]пиридин-5-ил)-2-оксо-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил]-L-трео-гекситол
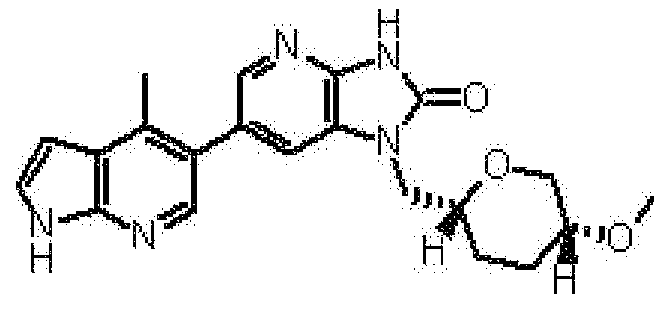
Стадия 1
2,6-Ангидро-1-[6-бром-3-циклогекс-1-ен-1-ил-2-оксо-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил]-1,3,4-тридеокси-5-O-метил-L-трео-гекситол
Указанное в заголовке соединение (790 мг) получали способом, аналогичным применяемому на стадии 1 примера 63, используя соединение, полученное на стадии 6 примера 143 (940 мг).
MS (ESI) m/z: 422 (M+H)+.
1H-ЯМР (CDCl3) δ: 1,52-1,77 (5H, м), 1,83-1,89 (2H, м), 2,08-2,16 (1H, м), 2,27-2,34 (2H, м), 2,39-2,45 (2H, м), 3,22-3,25 (1H, м), 3,37-3,44 (3H, м), 3,38 (1H, с), 3,63-3,78 (2H, м), 3,99 (1H, дд, J=14,0, 2,5 Гц), 4,05 (1H, д, J=12,8 Гц), 5,99-6,02 (1H, м), 7,60 (1H, д, J=1,8 Гц), 8,06 (1H, д, J=1,8 Гц).
Стадия 2
2,6-Ангидро-1-[3-циклогекс-1-ен-1-ил-2-оксо-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил]-1,3,4-тридеокси-5-O-метил-L-трео-гекситол
Указанное в заголовке соединение (812 мг) получали способом, аналогичным применяемому на стадии 4 примера 35, используя соединение, полученное на вышеуказанной стадии 1 (750 мг).
MS (ESI) m/z: 470 (M+H)+.
1H-ЯМР (CDCl3) δ: 1,35 (12H, с), 1,48-1,65 (2H, м), 1,69-1,80 (3H, м), 1,83-1,90 (2H, м), 2,08-2,13 (1H, м), 2,28-2,34 (2H, м), 2,41-2,47 (2H, м), 3,22-3,25 (1H, м), 3,38 (3H, с), 3,43 (1H, дд, J=12,4, 1,4 Гц), 3,71-3,78 (1H, м), 3,85 (1H, дд, J=14,7, 7,8 Гц), 3,95 (1H, дд, J=14,7, 4,6 Гц), 4,02-4,08 (1H, м), 5,99-6,03 (1H, м), 7,71 (1H, д, J=1,4 Гц), 8,42 (1H, д, J=1,4 Гц).
Стадия 3
2,6-Ангидро-1-[3-циклогекс-1-ен-1-ил-6-(4-метил-1H-пирроло[2,3-b]пиридин-5-ил)-2-оксо-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил]-1,3,4-тридеокси-5-O-метил-L-трео-гекситол
Указанное в заголовке соединение (67 мг) получали способом, аналогичным применяемому на стадии 3 примера 1, используя соединение, полученное на вышеуказанной стадии 2 (155 мг), и соединение, полученное на стадии 3 примера 36.
MS (ESI) m/z: 474 (M+H)+.
1H-ЯМР (CDCl3) δ: 1,54-1,68 (2H, м), 1,71-1,81 (3H, м), 1,87-1,94 (2H, м), 2,08-2,15 (1H, м), 2,31-2,38 (2H, м), 2,49-2,55 (5H, м), 3,22-3,24 (1H, м), 3,34 (3H, с), 3,43 (1H, д, J=12,4 Гц), 3,69-3,77 (1H, м), 3,88 (1H, дд, J=14,7, 7,8 Гц), 4,02 (1H, д, J=12,8 Гц), 4,07 (1H, дд, J=14,7, 2,8 Гц), 6,09 (1H, т, J=3,7 Гц), 6,56-6,59 (1H, м), 7,37 (1H, т, J=2,5 Гц), 7,48 (2H, д, J=1,8 Гц), 8,04 (1H, д, J=1,8 Гц), 8,18 (1H, с).
Стадия 4
2,6-Ангидро-1,3,4-тридеокси-5-O-метил-1-[6-(4-метил-1H-пирроло[2,3-b]пиридин-5-ил)-2-оксо-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил]-L-трео-гекситол
Указанное в заголовке соединение (17 мг) получали способом, аналогичным применяемому на стадии 6 примера 35, используя соединение, полученное на вышеуказанной стадии 3 (67 мг).
MS (ESI) m/z: 394 (M+H)+.
HRMS (ESI) [M+H]+ вычислено: C21H23N5O3 394,18791; найдено: 394,18779.
1H-ЯМР (ДМСО-d6) δ: 1,35-1,63 (3H, м), 1,86-1,92 (1H, м), 2,45 (3H, с), 3,28 (3H, с), 3,62-3,91 (6H, м), 6,54-6,56 (1H, м), 7,46 (1H, т, J=2,9 Гц), 7,51 (1H, д, J=2,3 Гц), 7,88 (1H, д, J=2,3 Гц), 8,06 (1H, с), 11,59 (1H, ушир. с), 11,63 (1H, ушир. с).
(Пример 147)
2,6-Ангидро-1,3,4-тридеокси-1-[6-(3,4-диметил-1H-пирроло[2,3-b]пиридин-5-ил)-2-оксо-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил]-5-O-метил-L-трео-гекситол
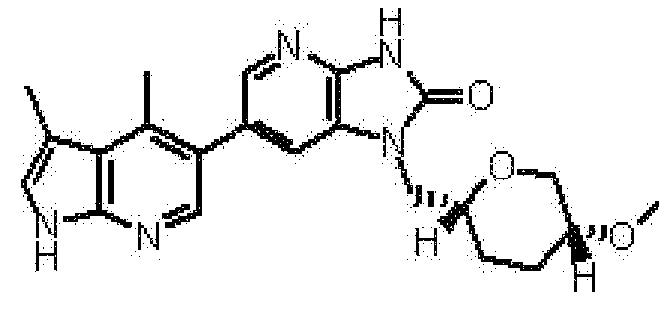
Стадия 1
2,6-Ангидро-1-[3-циклогекс-1-ен-1-ил-6-(3,4-диметил-1H-пирроло[2,3-b]пиридин-5-ил)-2-оксо-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил]-1,3,4-тридеокси-5-O-метил-L-трео-гекситол
Указанное в заголовке соединение (74 мг) получали способом, аналогичным применяемому на стадии 3 примера 1, используя соединение, полученное на стадии 2 примера 146 (155 мг), и соединение, полученное на стадии 2 примера 124 (89 мг).
MS (ESI) m/z: 488 (M+H)+.
1H-ЯМР (CDCl3) δ: 1,53-1,95 (7H, м), 2,08-2,15 (1H, м), 2,30-2,38 (2H, м), 2,49-2,55 (5H, м), 2,62 (3H, с), 3,21-3,24 (1H, м), 3,35 (3H, с), 3,43 (1H, дд, J=12,6, 1,1 Гц), 3,69-3,77 (1H, м), 3,86 (1H, дд, J=14,4, 7,8 Гц), 4,02 (2H, д, J=12,4 Гц), 4,06 (2H, дд, J=14,7, 3,7 Гц), 6,07-6,11 (1H, м), 7,07 (1H, с), 7,46 (1H, д, J=1,8 Гц), 8,01 (1H, д, J=1,8 Гц), 8,09 (1H, с), 9,37 (1H, с).
Стадия 2
2,6-Ангидро-1,3,4-тридеокси-1-[6-(3,4-диметил-1H-пирроло[2,3-b]пиридин-5-ил)-2-оксо-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил]-5-O-метил-L-трео-гекситол
Указанное в заголовке соединение (21 мг) получали способом, аналогичным применяемому на стадии 6 примера 35, используя соединение, полученное на вышеуказанной стадии 1 (74 мг).
MS (ESI) m/z: 408 (M+H)+.
HRMS (ESI) [M+H]+ вычислено: C22H25N5O3 408,20356; найдено: 408,20482.
1H-ЯМР (ДМСО-d6) δ: 1,32-1,73 (3H, м), 1,84-1,98 (1H, м), 2,46 (3H, с), 2,58 (3H, с), 3,30 (3H, с), 3,36-3,40 (2H, м), 3,62-3,93 (4H, м), 7,20 (1H, с), 7,48 (1H, д, J=1,7 Гц), 7,86 (1H, д, J=1,7 Гц), 7,99 (1H, с), 11,27 (1H, с), 11,61 (1H, с).
(Пример 148)
2,6-Ангидро-1-[6-(3-хлор-4-метил-1H-пирроло[2,3-b]пиридин-5-ил)-2-оксо-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил]-1,3,4-тридеокси-5-O-метил-L-трео-гекситол
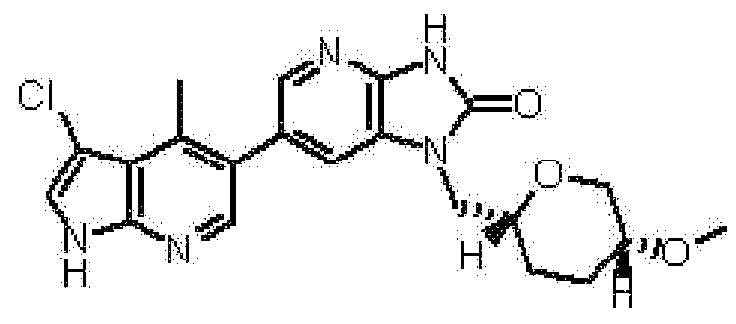
Стадия 1
2,6-Ангидро-1-[6-(3-хлор-4-метил-1H-пирроло[2,3-b]пиридин-5-ил)-3-циклогекс-1-ен-1-ил-2-оксо-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил]-1,3,4-тридеокси-5-O-метил-L-трео-гекситол
Указанное в заголовке соединение (103 мг) получали способом, аналогичным применяемому на стадии 3 примера 1, используя соединение, полученное на стадии 2 примера 146 (155 мг), и соединение, полученное на стадии 2 примера 125 (137 мг).
MS (ESI) m/z: 508 (M+H)+.
1H-ЯМР (CDCl3) δ: 1,54-1,68 (2H, м), 1,70-1,82 (3H, м), 1,88-1,94 (2H, м), 2,08-2,17 (1H, м), 2,30-2,38 (2H, м), 2,49-2,56 (2H, м), 2,72 (3H, с), 3,23-3,25 (1H, м), 3,35 (3H, с), 3,44 (1H, дд, J=12,6, 1,3 Гц), 3,69-3,77 (1H, м), 3,88 (1H, дд, J=14,4, 8,1 Гц), 4,02 (1H, д, J=12,7 Гц), 4,08 (1H, дд, J=14,6, 2,9 Гц), 6,09-6,11 (1H, м), 7,32 (1H, с), 7,48 (2H, д, J=1,9 Гц), 8,00 (1H, д, J=1,9 Гц), 8,15 (1H, с), 10,58 (1H, с).
Стадия 2
2,6-Ангидро-1-[6-(3-хлор-4-метил-1H-пирроло[2,3-b]пиридин-5-ил)-2-оксо-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил]-1,3,4-тридеокси-5-O-метил-L-трео-гекситол
Указанное в заголовке соединение (57 мг) получали способом, аналогичным применяемому на стадии 6 примера 35, используя соединение, полученное на вышеуказанной стадии 1 (103 мг).
MS (ESI) m/z: 428 (M+H)+.
1H-ЯМР (ДМСО-d6) δ: 1,35-1,66 (3H, м), 1,86-1,96 (1H, м), 2,66 (3H, с), 3,30 (3H, с), 3,50-4,02 (6H, м), 7,52 (1H, д, J=1,8 Гц), 7,66 (1H, д, J=2,8 Гц), 7,90 (1H, д, J=1,4 Гц), 8,13 (1H, с), 11,64 (1H, с), 12,00 (1H, с).
(Пример 149)
2,6-Ангидро-1,3,4-тридеокси-1-[5-метил-2-оксо-6-(1H-пирроло[2,3-b]пиридин-5-ил)-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил]-L-трео-гекситол
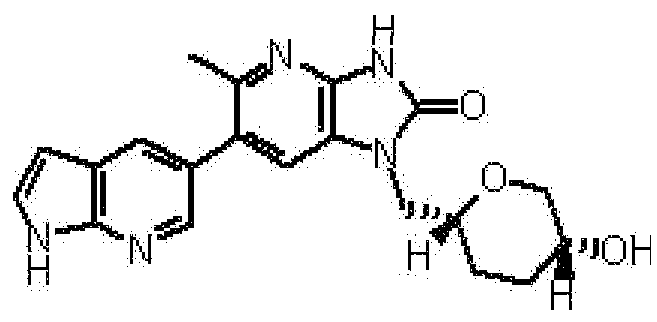
Стадия 1
2,6-Ангидро-1-[6-бром-3-циклогекс-1-ен-1-ил-5-метил-2-оксо-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил]-1,3,4-тридеокси-5-O-(фенилкарбонил)-L-трео-гекситол
Указанное в заголовке соединение (1,70 г) получали способом, аналогичным применяемому на стадии 3 примера 35, используя соединение, полученное на стадии 4 примера 143 (0,76 г), и соединение, полученное на стадии 1 примера 44 (1,29 г).
MS (ESI) m/z: 526 (M+H)+.
Стадия 2
2,6-Ангидро-1-[6-бром-3-циклогекс-1-ен-1-ил-5-метил-2-оксо-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил]-1,3,4-тридеокси-L-трео-гекситол
Указанное в заголовке соединение (0,627 г) получали способом, аналогичным применяемому на стадии 6 примера 143, используя соединение, полученное на вышеуказанной стадии 1 (1,70 г).
MS (ESI) m/z: 422 (M+H)+.
1H-ЯМР (CDCl3) δ: 1,55-1,61 (1H, м), 1,68-1,79 (4H, м), 1,82-1,88 (2H, м), 1,92-1,99 (1H, м), 2,27-2,33 (2H, м), 2,42-2,48 (2H, м), 2,59 (3H, с), 3,52 (1H, д, J=12,0 Гц), 3,66-3,72 (1H, м), 3,76-3,82 (2H, м), 3,89 (1H, дт, J=12,0, 2,3 Гц), 3,94 (1H, дд, J=14,3, 2,9 Гц), 5,99-6,01 (1H, м), 7,51 (1H, с).
Стадия 3
2,6-Ангидро-1-[3-циклогекс-1-ен-1-ил-5-метил-2-оксо-6-(1H-пирроло[2,3-b]пиридин-5-ил)-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил]-1,3,4-тридеокси-L-трео-гекситол
Указанное в заголовке соединение (128 мг) получали способом, аналогичным применяемому на стадии 3 примера 1, используя соединение, полученное на вышеуказанной стадии 2 (139 мг), и 5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пирроло[2,3-b]пиридин (96 мг).
MS (ESI) m/z: 460 (M+H)+.
1H-ЯМР (CDCl3) δ: 1,56-1,63 (1H, м), 1,65-1,82 (4H, м), 1,83-1,97 (3H, м), 2,28-2,36 (2H, м), 2,48 (3H, с), 2,52-2,58 (2H, м), 3,52 (1H, д, J=11,9 Гц), 3,70-3,79 (2H, м), 3,85-3,93 (2H, м), 3,97 (1H, дд, J=14,7, 3,7 Гц), 6,06-6,10 (1H, м), 6,52-6,55 (1H, м), 7,26 (1H, с), 7,40-7,43 (1H, м), 7,87 (1H, д, J=1,8 Гц), 8,26 (1H, д, J=1,8 Гц), 10,43 (1H, с).
Стадия 4
2,6-Ангидро-1,3,4-тридеокси-1-[5-метил-2-оксо-6-(1H-пирроло[2,3-b]пиридин-5-ил)-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил]-L-трео-гекситол
Указанное в заголовке соединение (20 мг) получали способом, аналогичным применяемому на стадии 6 примера 35, используя соединение, полученное на вышеуказанной стадии 3 (151 мг).
MS (ESI) m/z: 380 (M+H)+.
1H-ЯМР (ДМСО-d6) δ: 1,33-1,40 (1H, м), 1,58-1,73 (3H, м), 2,38 (3H, с), 3,35-3,38 (1H, м), 3,50-3,53 (1H, м), 3,59-3,67 (1H, м), 3,77 (1H, дд, J=14,3, 4,0 Гц), 3,87 (1H, дд, J=13,7, 7,4 Гц), 4,51 (1H, д, J=4,0 Гц), 6,48-6,50 (1H, м), 7,38 (1H, с), 7,52-7,54 (1H, м), 7,95 (1H, д, J=2,3 Гц), 8,20 (1H, д, J=2,3 Гц), 11,45 (1H, с), 11,73 (1H, с).
(Пример 150)
2,6-Ангидро-1,3,5-тридеокси-1-[6-(3,4-диметил-1H-пирроло[2,3-b]пиридин-5-ил)-2-оксо-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил]-L-трео-гекситол
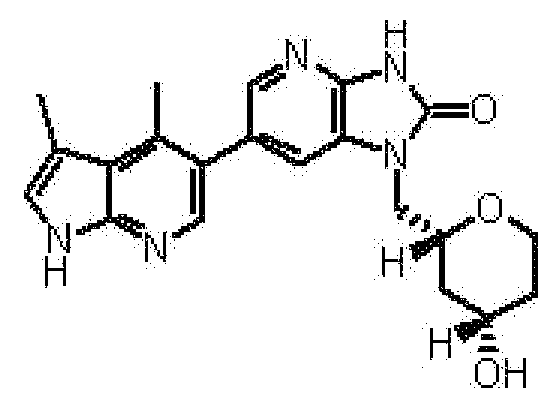
Стадия 1
2,6-Ангидро-4-O-бензоил-1-O-бензил-3,5-дидеокси-L-трео-гекситол
Указанное в заголовке соединение (2,05 г) получали способом, аналогичным применяемому на стадии 1 примера 111, используя L-изомер, полученный на стадии 1 примера 137 (изомер A, 1,48 г).
MS (ESI) m/z: 327 (M+H)+.
1H-ЯМР (CDCl3) δ: 1,54-1,63 (1H, м), 1,74-1,84 (1H, м), 2,02-2,13 (2H, м), 3,46-3,62 (3H, м), 3,66-3,72 (1H, м), 4,11-4,17 (1H, м), 4,57 (1H, д, J=12,0 Гц), 4,61 (1H, д, J=12,0 Гц), 5,12-5,20 (1H, м), 7,25-7,33 (2H, м), 7,33-7,35 (3H, м), 7,42-7,46 (2H, м), 7,54-7,58 (1H, м), 8,02-8,05 (2H, м).
Стадия 2
1,5-Ангидро-3-O-бензоил-2,4-дидеокси-L-трео-гекситол
Указанное в заголовке соединение (1,48 г) получали способом, аналогичным применяемому на стадии 4 примера 143, используя соединение, полученное на вышеуказанной стадии 1 (2,05 г).
MS (ESI) m/z: 237 (M+H)+.
1H-ЯМР (CDCl3) δ: 1,50-1,62 (1H, м), 1,73-1,83 (1H, м), 1,95-1,99 (1H, м), 2,02-2,12 (2H, м), 3,56-3,72 (4H, м), 4,10-4,16 (1H, м), 5,14-5,22 (1H, м), 7,42-7,47 (2H, м), 7,54-7,59 (1H, м), 8,02-8,05 (2H, м).
Стадия 3
2,6-Ангидро-4-O-бензоил-1-(6-бром-3-циклогекс-1-ен-1-ил-2-оксо-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил)-1,3,5-тридеокси-L-трео-гекситол
Указанное в заголовке соединение (3,15 г) получали способом, аналогичным применяемому на стадии 3 примера 35, используя соединение, полученное на вышеуказанной стадии 2 (1,48 г), и соединение, полученное на стадии 2 примера 35 (2,40 г).
MS (ESI) m/z: 512 (M+H)+.
1H-ЯМР (CDCl3) δ: 1,52-1,55 (1H, м), 1,70-1,79 (3H, м), 1,83-1,90 (2H, м), 2,03-2,09 (1H, м), 2,22-2,27 (1H, м), 2,28-2,33 (2H, м), 2,39-2,45 (2H, м), 3,50 (1H, тд, J=12,3, 2,3 Гц), 3,78-3,84 (1H, м), 3,88 (1H, дд, J=14,3, 6,9 Гц), 4,00 (1H, дд, J=14,3, 3,1 Гц), 4,06-4,11 (1H, м), 5,12-5,20 (1H, м), 6,01-6,04 (1H, м), 7,42-7,47 (2H, м), 7,52 (1H, д, J=2,3 Гц), 7,54-7,59 (1H, м), 8,01-8,04 (2H, м), 8,09 (1H, д, J=2,3 Гц).
Стадия 4
2,6-Ангидро-1-(6-бром-3-циклогекс-1-ен-1-ил-2-оксо-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил)-1,3,5-тридеокси-L-трео-гекситол
Указанное в заголовке соединение (1,78 г) получали способом, аналогичным применяемому на стадии 6 примера 143, используя соединение, полученное на вышеуказанной стадии 3 (3,15 г).
MS (ESI) m/z: 408 (M+H)+.
1H-ЯМР (CDCl3) δ: 1,24-1,32 (1H, м), 1,46-1,62 (2H, м), 1,71-1,78 (2H, м), 1,83-1,92 (3H, м), 2,03-2,09 (1H, м), 2,28-2,34 (2H, м), 2,39-2,45 (2H, м), 3,35 (1H, тд, J=12,0, 2,3 Гц), 3,63-3,69 (1H, м), 3,78-3,86 (2H, м), 3,96-4,03 (2H, м), 5,99-6,03 (1H, м), 7,50 (1H, д, J=1,7 Гц), 8,08 (1H, д, J=1,7 Гц).
Стадия 5
2,6-Ангидро-1-[3-циклогекс-1-ен-1-ил-2-оксо-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил]-1,3,5-тридеокси-L-трео-гекситол
Указанное в заголовке соединение (768 мг) получали способом, аналогичным применяемому на стадии 4 примера 35, используя соединение, полученное на вышеуказанной стадии 4 (800 мг).
MS (ESI) m/z: 456 (M+H)+.
1H-ЯМР (CDCl3) δ: 1,23-1,29 (1H, м), 1,35 (12H, с), 1,47-1,64 (2H, м), 1,72-1,79 (2H, м), 1,84-1,90 (3H, м), 2,01-2,07 (1H, м), 2,28-2,34 (2H, м), 2,41-2,47 (2H, м), 3,35 (1H, дд, J=12,7, 1,7 Гц), 3,69-4,02 (5H, м), 6,00-6,03 (1H, м), 7,62 (1H, д, J=1,7 Гц), 8,44 (1H, д, J=1,7 Гц).
Стадия 6
2,6-Ангидро-1-[3-циклогекс-1-ен-1-ил-6-(3,4-диметил-1H-пирроло[2,3-b]пиридин-5-ил)-2-оксо-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил]-1,3,5-тридеокси-L-трео-гекситол
Указанное в заголовке соединение (127 мг) получали способом, аналогичным применяемому на стадии 2 примера 4, используя соединение, полученное на вышеуказанной стадии 5 (147 мг), и соединение, полученное на стадии 2 примера 124 (66 мг).
MS (ESI) m/z: 474 (M+H)+.
1H-ЯМР (CDCl3) δ: 1,20-2,12 (8H, м), 2,26-2,55 (4H, м), 2,52 (3H, с), 2,64 (3H, с), 3,31-3,40 (1H, м), 3,64-4,08 (5H, м), 6,07-6,11 (1H, м), 7,06 (1H, с), 7,39 (1H, д, J=1,7 Гц), 8,03 (1H, д, J=1,7 Гц), 8,11 (1H, с), 8,62 (1H, ушир. с).
Стадия 7
2,6-Ангидро-1,3,5-тридеокси-1-[6-(3,4-диметил-1H-пирроло[2,3-b]пиридин-5-ил)-2-оксо-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил]-L-трео-гекситол
Указанное в заголовке соединение (44 мг) получали способом, аналогичным применяемому на стадии 6 примера 35, используя соединение, полученное на вышеуказанной стадии 6 (125 мг).
MS (ESI) m/z: 394 (M+H)+.
1H-ЯМР (ДМСО-d6) δ: 1,03-1,13 (1H, м), 1,19-1,30 (1H, м), 1,65-1,72 (1H, м), 1,79-1,87 (1H, м), 2,46 (3H, с), 2,57 (3H, с), 3,21-3,28 (1H, м), 3,52-3,65 (2H, м), 3,76-3,86 (2H, м), 3,92 (1H, дд, J=14,3, 7,4 Гц), 4,77 (1H, д, J=5,2 Гц), 7,19-7,21 (1H, м), 7,48 (1H, д, J=1,7 Гц), 7,87 (1H, д, J=1,7 Гц), 7,99 (1H, с), 11,27 (1H, с), 11,62 (1H, с).
(Пример 151)
2,6-Ангидро-1,3,5-тридеокси-1-[6-(3,4-диметил-1H-пирроло[2,3-b]пиридин-5-ил)-2-оксо-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил]-4-O-метил-L-трео-гекситол
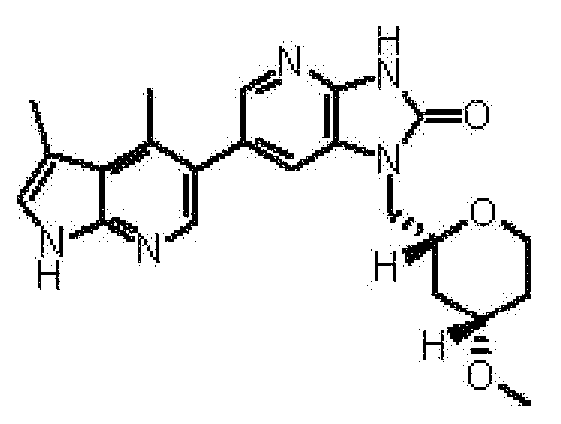
Стадия 1
2,6-Ангидро-1-[3-циклогекс-1-ен-1-ил-6-(3,4-диметил-1H-пирроло[2,3-b]пиридин-5-ил)-2-оксо-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил]-1,3,5-тридеокси-4-O-метил-L-трео-гекситол
Указанное в заголовке соединение (113 мг) получали способом, аналогичным применяемому на стадии 2 примера 4, используя соединение, полученное на стадии 3 примера 139 (165 мг), и соединение, полученное на стадии 2 примера 124 (66 мг).
MS (ESI) m/z: 488 (M+H)+.
1H-ЯМР (CDCl3) δ: 1,10-1,96 (8H, м), 2,32-2,38 (2H, м), 2,50-2,54 (2H, м), 2,52 (3H, с), 2,64 (3H, с), 3,29-3,40 (2H, м), 3,36 (3H, с), 3,65-3,72 (1H, м), 3,84-4,07 (3H, м), 6,07-6,22 (1H, м), 7,05 (1H, с), 7,39 (1H, д, J=1,7 Гц), 8,02 (1H, д, J=1,7 Гц), 8,10 (1H, с), 8,37 (1H, ушир. с).
Стадия 2
2,6-Ангидро-1,3,5-тридеокси-1-[6-(3,4-диметил-1H-пирроло[2,3-b]пиридин-5-ил)-2-оксо-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил]-4-O-метил-L-трео-гекситол
Указанное в заголовке соединение (28 мг) получали способом, аналогичным применяемому на стадии 6 примера 35, используя соединение, полученное на вышеуказанной стадии 1 (110 мг).
MS (ESI) m/z: 408 (M+H)+.
1H-ЯМР (ДМСО-d6) δ: 1,00-1,11 (1H, м), 1,15-1,26 (1H, м), 1,83-1,90 (1H, м), 2,01-2,07 (1H, м), 2,46 (3H, с), 2,57 (3H, с), 3,23 (3H, с), 3,24-3,40 (2H, м), 3,60-3,68 (1H, м), 3,81-3,98 (3H, м), 7,19-7,21 (1H, м), 7,48 (1H, д, J=1,7 Гц), 7,87 (1H, д, J=1,7 Гц), 7,99 (1H, с), 11,27 (1H, с), 11,61 (1H, с).
(Пример 152)
2,6-Ангидро-1-[6-(3-хлор-4-метил-1H-пирроло[2,3-b]пиридин-5-ил)-2-оксо-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил]-1,3,5-тридеокси-4-O-метил-L-трео-гекситол
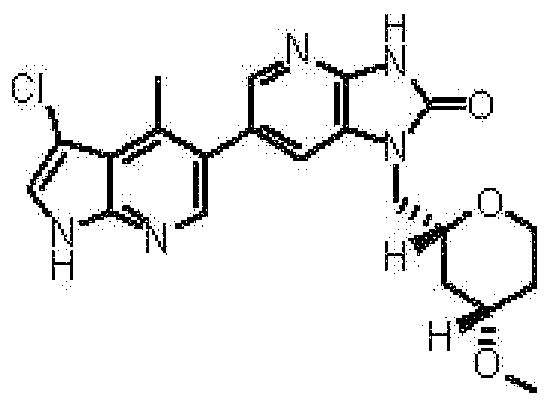
Стадия 1
2,6-Ангидро-1-{6-[1-(трет-бутоксикарбонил)-3-хлор-4-метил-1H-пирроло[2,3-b]пиридин-5-ил]-3-циклогекс-1-ен-1-ил-2-оксо-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил}-1,3,5-тридеокси-4-O-метил-L-трео-гекситол
Указанное в заголовке соединение (119 мг) получали способом, аналогичным применяемому на стадии 2 примера 4, используя соединение, полученное на стадии 3 примера 139 (163 мг), и соединение, полученное на стадии 2 примера 125 (100 мг).
1H-ЯМР (CDCl3) δ: 1,16-1,26 (1H, м), 1,24 (9H, с), 1,35-1,47 (1H, м), 1,73-1,81 (2H, м), 1,87-1,96 (3H, м), 2,13-2,19 (1H, м), 2,32-2,37 (2H, м), 2,48-2,54 (2H, м), 2,74 (3H, с), 3,30-3,40 (2H, м), 3,36 (3H, с), 3,65-3,71 (1H, м), 3,87 (1H, дд, J=14,9, 8,0 Гц), 3,95-3,99 (1H, м), 4,05 (1H, дд, J=14,9, 2,9 Гц), 6,08-6,11 (1H, м), 7,28-7,30 (1H, м), 7,40 (1H, д, J=1,7 Гц), 8,01 (1H, д, J=1,7 Гц), 8,18 (1H, с).
Стадия 2
2,6-Ангидро-1-[6-(3-хлор-4-метил-1H-пирроло[2,3-b]пиридин-5-ил)-2-оксо-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил]-1,3,5-тридеокси-4-O-метил-L-трео-гекситол
Указанное в заголовке соединение (28 мг) получали способом, аналогичным применяемому на стадии 6 примера 35, используя соединение, полученное на вышеуказанной стадии 1 (116 мг).
MS (ESI) m/z: 428 (M+H)+.
1H-ЯМР (ДМСО-d6) δ: 1,02-1,10 (1H, м), 1,15-1,26 (1H, м), 1,84-1,89 (1H, м), 2,01-2,07 (1H, м), 2,66 (3H, с), 3,23 (3H, с), 3,24-3,38 (2H, м), 3,62-3,68 (1H, м), 3,81-3,87 (2H, м), 3,94 (1H, дд, J=14,5, 7,8 Гц), 7,51-7,53 (1H, м), 7,66 (1H, д, J=2,9 Гц), 7,90 (1H, д, J=2,3 Гц), 8,12 (1H, с), 11,65 (1H, с), 11,98-12,02 (1H, м).
(Пример 153)
1-{[(2S)-6-(Метоксиметил)-1,4-диоксан-2-ил]метил}-6-(4-метил-1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
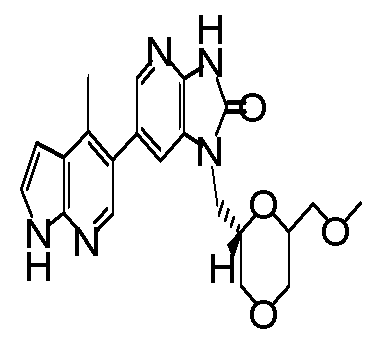
Стадия 1
(2R)-1-(Аллилокси)-3-хлорпропан-2-ол
К аллильному спирту (11 мл) добавляли комплекс борон трифлуорид-диэтиловый эфир (0,34 мл) и смесь нагревали до 45°C. Затем добавляли (R)-эпихлоргидрин (5,0 г) и смесь перемешивали при такой же температуре в течение 1,5 часов. Добавляли диэтиловый эфир, затем промывали водой и сушили над безводным сульфатом магния. Растворитель упаривали при пониженном давлении с получением сырого указанного в заголовке соединения (10 г).
1H-ЯМР (CDCl3) δ: 3,54-3,69 (4H, м), 3,97-4,05 (2H, м), 4,16-4,18 (1H, м), 5,15-5,24 (1H, м), 5,27-5,31 (1H, м), 5,85-6,05 (1H, м).
Стадия 2
(2R)-1-(Аллилокси)-3-(бензилокси)пропан-2-ол
В воде (6,4 мл) растворяли гидроксид натрия (5,4 г). Добавляли соединение, полученное на описанной выше стадии 1 (8,1 г), и смесь перемешивали при комнатной температуре в течение 1,5 часов. Добавляли диэтиловый эфир, затем промывали водой. Органический слой сушили над безводным сульфатом магния и растворитель упаривали при пониженном давлении. Полученный остаток растворяли в бензиловом спирте (27 мл) и медленно добавляли гидрид натрия (55%, 1,8 г) при охлаждении льдом. Смесь перемешивали при комнатной температуре в течение 4,5 часов и реакционный раствор разбавляли дихлорметаном. Затем органический слой последовательно промывали 1 M соляной кислотой и насыщенным водным раствором бикарбоната натрия. После сушки над безводным сульфатом магния растворитель упаривали при пониженном давлении. Полученный остаток очищали хроматографией на колонке с силикагелем (элюируя смесью этилацетат-гексан) с получением указанного в заголовке соединения (2,6 г).
1H-ЯМР (CDCl3) δ: 2,48 (1H, д, J=4,0 Гц), 3,47-3,58 (4H, м), 3,98-4,03 (3H, м), 4,56 (2H, с), 5,17-5,20 (1H, м), 5,25-5,29 (1H, м), 5,86-5,94 (1H, м), 7,30-7,35 (5H, м).
Стадия 3
(2S)-2-[(Бензилокси)метил]-6-(йодметил)1,4-диоксан
В раствор соединения, полученного на описанной выше стадии 2 (2,6 г), в ацетонитриле (40 мл) добавляли N-йодсукцинимид (4,5 г) и смесь нагревали с обратным холодильником в течение 2,5 часов. После охлаждения до комнатной температуры добавляли насыщенный водный раствор тиосульфата натрий, затем экстрагировали этилацетатом. После сушки над безводным сульфатом натрия растворитель упаривали при пониженном давлении. Полученный остаток очищали хроматографией на колонке с силикагелем (элюируя смесью этилацетат-гексан) с получением указанного в заголовке соединения (1,7 г).
1H-ЯМР (CDCl3) δ: 3,04-4,28 (10H, м), 4,54-4,59 (2H, м), 7,27-7,37 (5H, м).
Стадия 4
{(6S)-6-[(Бензилокси)метил]-1,4-диоксан-2-ил}метил 4-нитробензоат
В раствор соединения, полученного на описанной выше стадии 3 (1,7 г), в диметилсульфоксиде (60 мл) добавляли 4-нитробензоат калия (10 г) и 18-краун-6-эфир (0,13 г) и смесь перемешивали при 90°C в течение 4 часов. Реакционный раствор оставляли охлаждаться до комнатной температуры и разбавляли водой и диэтиловым эфиром. Органический слой последовательно промывали водой и насыщенным солевым раствором. После сушки над безводным сульфатом натрия растворитель упаривали при пониженном давлении. Полученный остаток очищали хроматографией на колонке с силикагелем (элюируя смесью этилацетат-гексан) с получением указанного в заголовке соединения (1,7 г).
1H-ЯМР (CD3OD) δ: 3,35-4,79 (12H, м), 7,24-7,34 (5H, м), 8,21-8,35 (5H, м).
Стадия 5
{(6S)-6-[(Бензилокси)метил]-1,4-диоксан-2-ил}метанол
В раствор соединения, полученного на описанной выше стадии 4 (1,7 г), в метаноле (40 мл) добавляли концентрированную соляную кислоту (1,0 мл). Смесь перемешивали при комнатной температуре в течение 24 часов и перемешивали при 50°C в течение 8 часов. Дополнительно добавляли концентрированную соляную кислоту (2,0 мл) и смесь перемешивали при такой же температуре в течение 16 часов. Добавляли еще концентрированную соляную кислоту (2,0 мл) и смесь перемешивали при такой же температуре в течение 8 часов. Реакционный раствор нейтрализовали насыщенным водным раствором бикарбоната натрия и метанол отгоняли при пониженном давлении. Добавляли воду, затем экстрагировали диэтиловым эфиром. Далее органический слой промывали насыщенным солевым раствором. После сушки над безводным сульфатом натрия растворитель упаривали при пониженном давлении. Полученный остаток очищали хроматографией на колонке с силикагелем (элюируя смесью этилацетат-гексан) с получением указанного в заголовке соединения (258 мг).
1H-ЯМР (CDCl3) δ: 1,93-2,01 (1H, м), 3,31-4,03 (10H, м), 4,53-4,60 (2H, м), 7,29-7,37 (5H, м).
Стадия 6
(2S)-2-[(Бензилокси)метил]-6-метоксиметил-1,4-диоксан
Указанное в заголовке соединение (261 мг) получали способом, аналогичным применяемому на стадии 1 примера 63, используя соединение, полученное на вышеуказанной стадии 5 (258 мг).
MS (ESI) m/z: 253 (M+H)+.
Стадия 7
[(2S)-6-(Метоксиметил)-1,4-диоксан-2-ил]метанол
Указанное в заголовке соединение (160 мг) получали способом, аналогичным применяемому на стадии 4 примера 114, используя соединение, полученное на вышеуказанной стадии 6 (261 мг).
Стадия 8
[(2S)-6-(Метоксиметил)-1,4-диоксан-2-ил]метил метансульфонат
Указанное в заголовке соединение (235 мг) получали способом, аналогичным применяемому на стадии 1 примера 139, используя соединение, полученное на вышеуказанной стадии 7 (160 мг).
Стадия 9
6-Бром-3-циклогекс-1-ен-1-ил-1-{[(2S)-6-(метоксиметил)-1,4-диоксан-2-ил]метил}-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (440 мг) получали способом, аналогичным применяемому на стадии 2 примера 139, используя соединение, полученное на вышеуказанной стадии 8 (235 мг), и соединение, полученное на стадии 2 примера 35 (288 мг).
MS (ESI) m/z: 438 (M+H)+.
Стадия 10
3-Циклогекс-1-ен-1-ил-1-{[(2S)-6-(метоксиметил)-1,4-диоксан-2-ил]метил}-6-(4,4,5,5-тетраметил-1,3,2-диоксаборан-2-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (611 мг) получали способом, аналогичным применяемому на стадии 4 примера 35, используя соединение, полученное на вышеуказанной стадии 9 (440 мг).
MS (ESI) m/z: 486 (M+H)+.
Стадия 11
3-Циклогекс-1-ен-1-ил-1-{[(2S)-6-(метоксиметил)-1,4-диоксан-2-ил]метил}-6-(4-метил-1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (370 мг) получали способом, аналогичным применяемому на стадии 3 примера 1, используя соединение, полученное на вышеуказанной стадии 10 (611 мг), и соединение, полученное на стадии 3 примера 36 (292 мг).
MS (ESI) m/z: 490 (M+H)+.
Стадия 12
1-{[(2S)-6-(Метоксиметил)-1,4-диоксан-2-ил]метил}-6-(4-метил-1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (85 мг) (представляющее собой, как было определено, смесь с соотношением диастереомеров, равным около 3:2 в соответствии с ЯМР) получали способом, аналогичным применяемому на стадии 6 примера 35, используя соединение, полученное на вышеуказанной стадии 11 (370 мг).
MS (ESI) m/z: 410 (M+H)+.
HRMS (ESI) [(M+H)+] вычислено: C21H24N5O4 410,18283; найдено: 410,18340.
1H-ЯМР (ДМСО-d6) δ: 2,46-2,47 (3H, м), 3,06 (1,8H, с), 3,14 (1,2H, с), 3,15-4,40 (10H, м), 6,56-6,58 (1H, м), 7,47-7,48 (1H, м), 7,54-7,55 (0,6H, м), 7,60-7,62 (0,4H, м), 7,91-7,92 (1H, м), 8,07-8,08 (1H, м), 11,64-11,65 (2H, м).
(Пример 154)
2,6-Ангидро-1,3,5-тридеокси-1-[2-оксо-6-(1H-пирроло[2,3-b]пиридин-5-ил)-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил]-D-эритро-гекситол
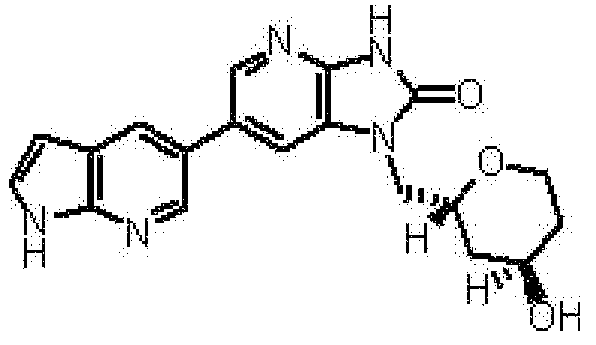
Стадия 1
2,6-Ангидро-1-O-бензил-3,5-дидеокси-4-O-(фенилкарбонил)-D-эритро-гекситол
Указанное в заголовке соединение (1175 мг) получали способом, аналогичным применяемому на стадии 1 примера 112, используя L-изомер, полученный на стадии 1 примера 137 (изомер A, 800 мг), и бензойную кислоту (571 мг).
MS (ESI) m/z: 327 (M+H)+.
1H-ЯМР (CDCl3) δ: 1,75-1,82 (1H, м), 1,85-1,92 (2H, м), 1,96-2,04 (1H, м), 3,45-3,53 (2H, м), 3,92-4,08 (3H, м), 4,58 (1H, д, J=12,4 Гц), 4,62 (1H, д, J=12,4 Гц), 5,46-5,50 (1H, м), 7,27-7,32 (1H, м), 7,33-7,40 (4H, м), 7,44-7,50 (2H, м), 7,57-7,62 (1H, м), 8,08 (2H, д, J=7,8 Гц).
Стадия 2
2,6-Ангидро-3,5-дидеокси-4-O-(фенилкарбонил)-D-эритро-гекситол
Указанное в заголовке соединение (71 мг) получали способом, аналогичным применяемому на стадии 4 примера 114, используя соединение, полученное на стадии 1 (120 мг), 20% гидроксид палладия (20 мг) и метанол в качестве растворителя.
MS (ESI) m/z: 237 (M+H)+.
Стадия 3
Этил 6-бром-3-(2-цианоэтил)-2-оксо-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-карбоксилат
Указанное в заголовке соединение (954 мг) получали способом, аналогичным применяемому на стадии 3 примера 35, используя 6-бром-2-оксо-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-карбоксилат, полученный в условиях, описанных в WO 2008/051493 (1,43 г), и 3-гидроксипропаннитрил (0,51 мл).
MS (APCI) m/z: 339 [M+H]+.
1H-ЯМР (CDCl3) δ: 1,49 (3H, т, J=7,2 Гц), 2,94 (2H, т, J=7,0 Гц), 4,28 (2H, т, J=7,0 Гц), 4,55 (2H, кв, J=7,2 Гц), 8,23 (2H, с).
Стадия 4
3-(6-Бром-2-оксо-1,2-дигидро-3H-имидазо[4,5-b]пиридин-3-ил)пропаннитрил
Соединение, полученное на описанной выше стадии 3 (954 мг), растворяли в тетрагидрофуране (28 мл). Добавляли изопропиламин (362 мкл) и смесь перемешивали при комнатной температуре в течение 70 минут. После отгонки растворителя реакционной смеси добавляли гексан и обрабатывали ультразвуком. Бесцветное кристаллическое вещество собирали фильтрованием с получением указанного в заголовке соединения (739 мг).
MS (APCI) m/z: 267 [M+H]+.
1H-ЯМР (ДМСО-d6) δ: 3,01 (2H, т, J=6,4 Гц), 4,07 (2H, т, J=6,4 Гц), 7,54 (1H, т, J=1,6 Гц), 8,07 (1H, т, J=1,8 Гц).
Стадия 5
2,6-Ангидро-1-[6-бром-3-(2-цианоэтил)-2-оксо-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил]-1,3,5-тридеокси-4-O-(фенилкарбонил)-D-эритро-гекситол
Указанное в заголовке соединение (96 мг) получали способом, аналогичным применяемому на стадии 3 примера 35, используя соединение, полученное на вышеуказанной стадии 2 (71 мг), и соединение, полученное на описанной выше стадии 4 (104 мг).
MS (ESI) m/z: 485 (M+H)+.
1H-ЯМР (CDCl3) δ: 1,67-1,72 (1H, м), 1,82-1,88 (1H, м), 1,90-1,97 (1H, м), 2,02-2,07 (1H, м), 2,95 (2H, т, J=6,3 Гц), 3,77-3,85 (2H, м), 3,88-3,93 (1H, м), 4,00 (1H, дд, J=14,3, 2,9 Гц), 4,08-4,14 (1H, м), 4,29 (2H, т, J=6,9 Гц), 5,45-5,48 (1H, м), 7,46 (2H, т, J=7,4 Гц), 7,56-7,60 (2H, м), 8,05-8,05 (2H, м), 8,09 (1H, д, J=2,3 Гц).
Стадия 6
2,6-Ангидро-1-[3-(2-цианоэтил)-2-оксо-6-(1H-пирроло[2,3-b]пиридин-5-ил)-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил]-1,3,5-тридеокси-D-эритро-гекситол
Указанное в заголовке соединение (20 мг) получали способом, аналогичным применяемому на стадии 4 примера 111, используя соединение, полученное на вышеуказанной стадии 5 (86 мг), и 5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пирроло[2,3-b]пиридин (52 мг).
MS (ESI) m/z: 419 (M+H)+.
1H-ЯМР (CDCl3) δ: 1,52-1,67 (2H, м), 1,76-1,87 (2H, м), 3,01 (2H, т, J=6,8 Гц), 3,73-3,79 (1H, м), 3,84 (1H, дд, J=12,9, 2,2 Гц), 3,87-3,96 (1H, м), 4,01 (1H, дд, J=14,6, 3,4 Гц), 4,15-4,21 (1H, м), 4,28-4,31 (1H, м), 4,37 (2H, т, J=7,1 Гц), 6,58-6,60 (1H, м), 7,42 (1H, дд, J=3,4, 2,2 Гц), 7,64 (1H, д, J=2,0 Гц), 8,09 (1H, д, J=1,7 Гц), 8,26 (1H, д, J=2,0 Гц), 8,49 (1H, д, J=2,2 Гц), 9,90 (1H, с).
Стадия 7
2,6-Ангидро-1,3,5-тридеокси-1-[2-оксо-6-(1H-пирроло[2,3-b]пиридин-5-ил)-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-ил]-D-эритро-гекситол
Соединение, полученное на описанной выше стадии 6 (20 мг), растворяли в тетрагидрофуране (1 мл). Добавляли трет-бутоксид калия (5,3 мг), затем перемешивали. Добавляли трет-бутоксид калия (11 мг) и ацетонитрил (4 мл) и потом дополнительно добавляли трет-бутоксид калия (33 мг). Смесь перемешивали при комнатной температуре в течение трех дней. Добавляли насыщенный водный раствор хлорида аммония, затем экстрагировали этилацетатом три раза. Органический слой сушили над безводным сульфатом натрия и далее растворитель упаривали при пониженном давлении. К остатку добавляли гексан и полученный осадок собирали фильтрованием с получением указанного в заголовке соединения (3 мг).
MS (ESI) m/z: 366 (M+H)+.
1H-ЯМР (ДМСО-d6) δ: 1,36-1,69 (4H, м), 3,58-3,71 (1H, м), 3,79-3,95 (2H, м), 4,00-4,08 (2H, м), 4,62-4,65 (1H, м), 6,51-6,53 (1H, м), 7,52-7,54 (1H, м), 7,78 (1H, д, J=1,7 Гц), 8,21-8,24 (2H, м), 8,51 (1H, д, J=2,0 Гц), 11,60 (1H, с), 11,73 (1H, с).
(Пример 155)
5-Хлор-1-[(2S)-1,4-диоксан-2-илметил]-6-(1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
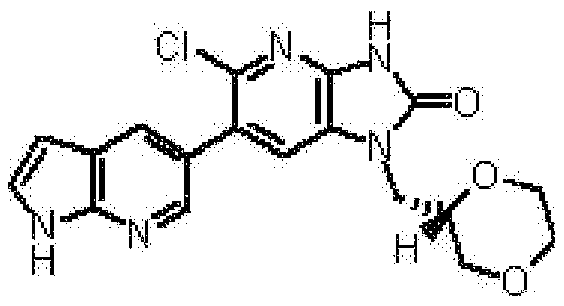
Стадия 1
6-Бром-5-хлор-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
5-Бром-6-хлорпиридин-2,3-диамин, полученный способом, описанным в Bioorg. Med. Chem. Lett. 1996, 22, 2749 (0,83 г), растворяли в тетрагидрофуране (40 мл). Добавляли 1,1-карбонилдиимидазол (0,91 г) и смесь нагревали с обратным холодильником в течение ночи. Растворитель реакционной смеси отгоняли при пониженном давлении. Полученный остаток промывали смесью гексан/этилацетат и затем сушили при пониженном давлении с получением указанного в заголовке соединения (0,81 г).
MS (ESI) m/z: 248 (M+H)+.
1H-ЯМР (ДМСО-d6) δ: 7,58 (1H, с), 11,18 (1H, с), 11,74 (1H, с).
Стадия 2
Этил 6-бром-5-хлор-2-оксо-2,3-дигидро-1H-имидазо[4,5-b]пиридин-1-карбоксилат
Соединение, полученное на описанной выше стадии 1 (300 мг), растворяли в диметилформамиде (5 мл). Добавляли этил пиридин-2-ил карбонат, полученный способом, описанным в WO 2008/051493 (242 мг), и карбонат калия (200 мг) и смесь перемешивали при 55°C в течение одного часа. После охлаждения реакционного раствора до комнатной температуры добавляли воду (6 мл) и 1 н. водный раствор соляной кислоты (2,9 мл) и смесь интенсивно перемешивали. Осажденное твердое вещество собирали фильтрованием, промывали водой и затем сушили при пониженном давлении с получением указанного в заголовке соединения (344 мг).
MS (ESI) m/z: 322 (M+H)+.
1H-ЯМР (ДМСО-d6) δ: 1,35 (3H, т, J=7,1 Гц), 4,42 (2H, кв, J=7,2 Гц), 8,08 (1H, с), 12,39 (1H, с).
Стадия 3
6-Бром-5-хлор-3-[2-(триметилсилил)этил]-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Соединение, полученное на описанной выше стадии 2 (340 мг), растворяли в тетрагидрофуране (10 мл). Добавляли 2-(триметилсилил)этанол (228 мкл) и трифенилфосфин (417 мг) и потом добавляли по каплям диизопропилазодикарбоксилат (324 мкл) при охлаждении льдом. Смесь перемешивали в течение ночи при постепенном нагревании до комнатной температуры. После этого дополнительно добавляли 2-(триметилсилил)этанол (228 мкл) и трифенилфосфин (417 г) и далее добавляли по каплям диизопропилазодикарбоксилат (324 мкл) при охлаждении льдом. Смесь перемешивали в течение 6 часов при постепенном нагревании до комнатной температуры. Реакционный раствор вновь охлаждали на ледяной бане и потом добавляли изопропиламин (136 мкл). Смесь перемешивали при комнатной температуре в течение одного часа. Растворитель реакционной смеси отгоняли при пониженном давлении. Полученный остаток очищали хроматографией на колонке с силикагелем (элюируя смесью этилацетат-гексан) с получением указанного в заголовке соединения (310 мг).
1H-ЯМР (CDCl3) δ: 0,09 (9H, с), 1,12-1,16 (2H, м), 3,97-4,01 (2H, м), 7,52 (1H, с), 9,16 (1H, с).
Стадия 4
6-Бром-5-хлор-1-[(2S)-1,4-диоксан-2-илметил]-3-[2-(триметилсилил)этил]-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (175 мг) получали способом, аналогичным применяемому на стадии 3 примера 35, используя соединение, полученное на вышеуказанной стадии 3 (150 мг), и (2S)-1,4-диоксан-2-илметанол (65 мг).
MS (ESI) m/z: 448 (M+H)+.
1H-ЯМР (CDCl3) δ: 0,07 (9H, с), 3,31-3,35 (1H, м), 3,52-3,58 (1H, м), 3,64-3,70 (2H, м), 3,76-3,81 (2H, м), 3,84-3,91 (3H, м), 3,98-4,01 (2H, м), 4,96-5,07 (2H, м), 7,56 (1H, с).
Стадия 5
5-Хлор-1-[(2S)-1,4-диоксан-2-илметил]-6-(1H-пирроло[2,3-b]пиридин-5-ил)-3-[2-(триметилсилил)этил]-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Указанное в заголовке соединение (160 мг) получали способом, аналогичным применяемому на стадии 2 примера 4, используя 5-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1H-пирроло[2,3-b]пиридин (110 мг) и соединение, полученное на описанной выше стадии 4 (170 мг).
MS (ESI) m/z: 486 (M+H)+.
1H-ЯМР (CDCl3) δ: 0,10 (9H, с), 1,18-1,28 (3H, м), 3,33-3,38 (1H, м), 3,50-3,57 (1H, м), 3,65-3,74 (3H, м), 3,84-3,95 (3H, м), 4,05-4,10 (2H, м), 6,58-6,59 (1H, м), 7,38 (2H, дд, J=6,4, 3,7 Гц), 8,03 (1H, д, J=1,8 Гц), 8,36 (1H, д, J=2,3 Гц), 8,87 (1H, с).
Стадия 6
5-Хлор-1-[(2S)-1,4-диоксан-2-илметил]-6-(1H-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2H-имидазо[4,5-b]пиридин-2-он
Соединение, полученное на описанной выше стадии 5 (130 мг), растворяли в тетрагидрофуране (5 мл). Добавляли флуорид тетрабутиламмония (1,0 M раствор в тетрагидрофуране) (1 мл) и смесь перемешивали при 80ºC в течение трех дней. Растворитель реакционной смеси отгоняли при пониженном давлении. Полученный остаток очищали хроматографией на колонке с силикагелем (элюируя смесью этилацетат-гексан). Далее полученный остаток промывали этилацетатом и затем сушили при пониженном давлении с получением указанного в заголовке соединения (50 мг) в виде твердого вещества светло-желтого цвета.
HRMS (ESI) [M+H]+ вычислено: C18H17ClN5O3 386,10199; найдено: 386,10351.
MS (ESI) m/z: 386 (M+H)+.
1H-ЯМР (ДМСО-d6) δ: 3,27-3,31 (1H, м), 3,40-3,53 (2H, м), 3,57-3,61 (1H, м), 3,68-3,72 (1H, м), 3,75-3,89 (3H, м), 3,91-3,96 (1H, м), 6,52 (1H, дд, J=3,7, 1,8 Гц), 7,54-7,56 (1H, м), 7,67 (1H, с), 8,04 (1H, д, J=1,8 Гц), 8,27 (1H, д, J=2,3 Гц), 11,79 (1H, ушир. с), 11,89 (1H, ушир. с).
(Пример получения фармацевтического препарата 1) Твердые капсулы
Для получения капсулы для однократного введения каждую стандартную капсулу, состоящую из двух твердых желатиновых частей, наполняют 100 мг приведенного в качестве примера порошкообразного соединения 1, 150 мг лактозы, 50 мг целлюлозы и 6 мг стеарата магния. Капсулу промывают и затем сушат.
(Пример получения фармацевтического препарата 2) Мягкие капсулы
Получают смесь приведенного в качестве примера соединения 1 в масле, способствующем пищеварению, таком как соевое масло, хлопковое масло или оливковое масло, и инжектируют в желатиновую капсулу с помощью поршневого насоса с получением мягкой капсулы, содержащей 100 мг активного ингредиента. Капсулу промывают и затем сушат.
(Пример получения фармацевтического препарата 3) Таблетки
Таблетки получают обычным способом, используя 100 мг приведенного в качестве примера соединения 1, 0,2 мг коллоидный диоксид силикона, 5 мг стеарата магния, 275 мг микрокристаллической целлюлозы, 11 мг крахмала и 98,8 мг лактозы. При необходимости таблетку покрывают оболочкой.
(Тестовый пример 1) Исследование ингибирования активности mTOR киназы
Активность mTOR киназы измеряли в присутствии или отсутствие исследуемого соединения. Субстратный пептид фосфорилируется под действием mTOR киназы. Комплекс стрептавидин-XL665 и антитело против фосфорилированного S6K (Thr389)/антимышиный IgG-криптат связывается с этим фосфорилированным пептидом. В этот момент передача энергии резонанса флюоресценции происходит от антитело/антимышиный IgG-криптата, подвергаемого световому облучению XL665, что приводит к эмиссии флюоресценции при длине волны 665 нм. Используя этот принцип регистрируют активность mTOR киназы. В присутствии ингибитора mTOR фосфорилирование субстратного пептида ингибируется и вышеуказанный комплекс не связывается с субстратным пептидом. В результате не происходит передачи энергии резонанса флюоресценции, и флуоресценция при длине волны 665 нм ослабевает.
(1) Получение образцов и ферментативная реакция
Получали клеточную линию HEK293, которая конституитивно экспрессирует His-метку, слитую с mTOR человека. His-метку вводили на N-конец части, соответствующей 1362-2549 аминокислотам на C-конце mTOR человека. Клеточный лизат получали из этой HEK293 клеточной линии, конститутивно экспрессирующей His-меченный mTOR (1362C), и His-меченный mTOR (1362C) очищали обычным способом, используя аффинность His-метки.
Затем получали mTOR ферментный раствор, который содержит вышеуказанный фермент His-меченный mTOR (1362C), 8 мкг/мл биотинилированного пептида (Biotin-Ahx-KKANQVFLGFTYVAPSVLESVKE-амид (Sigma)), а также 50 мМ HEPES (pH 7,5), 20 мМ MnCl2, 1 мг/мл BSA, подходящее количество коктейля, ингибирующего протеазу (полный свободный от EDTA, Roche), 100 нг/мл калицилина A, 4 мкг/мл кантаридина и 10 мМ DTT в качестве других компонентов.
Исследуемое соединение растворяли в ДМСО и последовательно разбавляли 20 мкМ раствора ATP (50 мМ HEPES (pH 7,5), 20 мкМ ATP) для достижения концентраций, необходимых для исследования. В каждую лунку 384-луночного белого планшета Greiner небольшого объема наносили 5 мкл этого раствора соединения.
В вышеуказанную лунку, содержащую исследуемое соединение, добавляли 5 мкл mTOR ферментного раствора. После смешивания для проведения ферментативной реакции смесь инкубировали при комнатной температуре в течение 3 часов.
Аналогичные действия выполняли с раствором ДМСО в 20 мкМ раствора ATP в качестве положительного контроля и с раствором ДМСО в 50 мМ HEPES (pH 7,5) в качестве отрицательного контроля.
(2) Детекция ферментативной реакции
После проведения ферментативной реакции добавляли 5 мкл каждого раствора европия (раствор антимышиный IgG-криптат (SCETI Medical Labo K.K) и антитело против фосфорилированного S6K (Thr389) (Cell Signaling Technology Inc) в 50 мМ HEPES (pH 7,5), 100 мМ EDTA и 1,5 мг/мл BSA) и XL665 раствор (раствор стрептавидин-XL665 (SCETI Medical Labo K.K) в 50 мМ HEPES (pH 7,5), 100 мМ EDTA, 0,8 M KF и 1,5 мг/мл BSA) в указанном порядке и потом перемешивали. Смесь инкубировали при 4°C в течение ночи. На следующий день смесь нагревали до комнатной температуры и подвергали световому облучению с длиной волны 337 нм. Флуоресценцию при длине волны 620 нм и флуоресценцию при длине волны 665 нм измеряли с помощью RUBYstar (BMG).
Используя соотношение, подсчитанное из измеренных значений, определяли ингибирование активности mTOR (%) в качестве индекса ферментативной активности. В данном случае соотношение подсчитывали с помощью следующей формулы (1).
Соотношение = 10000 × значение флуоресценции при 665 нм/значение флуоресценции при 620 нм … (1)
Активность ингибирования фермента mTOR (%) определяли по следующей формулы (2).
Активность ингибирования фермента mTOR (%) = 100×[(P-S)/(P-N)] ... (2)
P: Соотношение в лунке с положительным контролем
N: Соотношение в лунке с отрицательным контролем
S: Соотношение в лунке, содержащей исследуемое соединение
Далее оптимальную кривую определяли, исходя из каждой концентрации исследуемого соединения, полученной в последовательных разбавлениях, и ингибирования активности фермента mTOR (%) при данной концентрации. Концентрацию, при которой происходит 50% ингибирование, подсчитывали в виде IC50 значения ингибирования активности фермента mTOR.
Соединениями со значением IC50 меньше чем 0,05 мкМ были соединения примеров 1, 3-7, 9, 10, 15-29, 31-55, 58-72, 76, 78, 79, 81-84, 90, 92, 93, 95-130, 133-153 и 155. Соединениями со значением IC50, равным 0,05 мкМ или выше и ниже чем 0,1 мкМ, были соединения примеров 57, 75 и 77. Соединениями со значением IC50, равным 0,1 мкМ или выше и ниже чем 5 мкМ, были соединения примеров 2, 8, 11-14, 30, 56, 73, 74, 80, 85-89, 91, 94, 131 и 132.
(Тестовый пример 2) исследование ингибирования клеточной пролиферации
Клетки WM-266-4 (ATCC, USA) высевали в 96-луночный планшет и выращивали в течение ночи. Затем получали серийные разбавления образца, содержащего исследуемое соединение, добавляли в каждую лунку и выращивали в течение еще трех дней. После этого измеряли количество клеток в каждой лунке с помощью MTT (MOSMANN, T., Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays. J. Immunol. Methods, 65, 55-63 (1983)). 50% ингибирование активности клеточной пролиферации (GI50 значение) подсчитывали с помощью следующей формулы (3).
100×[(T-T0)/(C-T0)]=50 ... (3)
В этой формуле T представляет собой значения лунки с добавлением исследуемого соединения, C представляет собой значение лунки, в которую не добавляли исследуемое соединение в течение трех дней, и T0 представляет собой исходное измеренное значение во время добавления исследуемого соединения.
Соединениями, показавшими значение GI50 меньше чем 3 мкМ, были соединения примера 1-7, 9, 15-21, 23-29, 31-55, 58, 60-65, 67-71, 75, 78, 79, 81-83, 88, 90-92, 96, 98-105, 107, 108, 111-129, 133-153 и 155. Соединениями, показавшими значение GI50, равное 3 мкМ или выше и ниже чем 25 мкМ, были соединения примера 8, 10, 14, 56, 57, 59, 72-74, 76, 77, 84-87, 89, 93-95, 97, 109, 110 и 130-132.
(Тестовый пример 3) Противоопухолевый эффект in vivo
Суспензию объемом 0,1 мл опухолевых клеток, доведенную до концентрации 3-10×107 клеток на мл, или солидную опухоль, нарезанную размером 3-5 мм3, подкожно пересаживали BALB/c "голым" мышам (возраст 6-8 недель) и мышей содержали до тех пор, пока объем опухоли не достигал объема больше 100 мм3. В зависимости от объема опухоли мышей разделяли на группы. Исследуемое соединение растворяли или суспендировали в подходящем растворителе и вводили мышам перорально или внутрибрюшинно. Время введения составило от двух до четырех недель, в зависимости от типа опухоли. Длину (мм) и ширину (мм) опухоли измеряли с помощью электронного цифрового штангенциркуля и объем измеренной опухоли подсчитывали, используя формулу вычисления (4), приведенную ниже. Подсчитывали степень ингибирования роста опухоли на определенный день (TGI%). Измеряли вес тела и наблюдали общее состояние в процессе введения. Исследуемое соединение оценивали как эффективное в случае, если рост опухоли ингибировали без гибели животного, значительного снижения веса тела или патологических проявлений.
TGI (%) = (1-A/B)×100 ... (4)
A: средний объем опухоли в группе животных, которым вводили соединение (*) в определенный день.
B: средний объем опухоли в контрольной группе животных, которым не вводили соединение (*) в определенный день.
*: Объем опухоли вычисляли с помощью формулы: 1/2 × [длина опухоли] × [ширина опухоли] × [ширина опухоли].
Промышленная применимость
Соединение по настоящему изобретению обладает сильной активностью ингибирования mTOR и превосходной противоопухолевой активностью и соответственно используется в качестве лекарственного средства, в частности противоопухолевого средства.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ ПИРРОЛОПИРИДИНОНА В КАЧЕСТВЕ TTX-S БЛОКАТОРОВ | 2013 |
|
RU2646754C2 |
| ПРОИЗВОДНОЕ ПИРАЗОЛА, ПРИГОДНОЕ В КАЧЕСТВЕ ИНГИБИТОРА РI3К | 2016 |
|
RU2710549C2 |
| ИНГИБИТОРЫ ПРОТЕИНКИНАЗ ДЛЯ УСИЛЕНИЯ РЕГЕНЕРАЦИИ ПЕЧЕНИ ИЛИ СНИЖЕНИЯ ИЛИ ПРЕДОТВРАЩЕНИЯ ГИБЕЛИ ГЕПАТОЦИТОВ | 2019 |
|
RU2822216C2 |
| ГЕТЕРОАРИЛЬНЫЕ СОЕДИНЕНИЯ, СОДЕРЖАЩИЕ ИХ КОМПОЗИЦИИ И СПОСОБЫ ЛЕЧЕНИЯ С ПРИМЕНЕНИЕМ ЭТИХ СОЕДИНЕНИЙ | 2007 |
|
RU2478635C2 |
| ИНГИБИТОРЫ БРОМДОМЕНА | 2012 |
|
RU2671571C1 |
| ИНГИБИТОРЫ БРОМДОМЕНА | 2012 |
|
RU2647592C2 |
| ДИСПИРОПИРРОЛИДИНОВЫЕ ПРОИЗВОДНЫЕ | 2012 |
|
RU2612534C2 |
| ДИАМИНОВЫЕ ПРОИЗВОДНЫЕ | 2003 |
|
RU2333203C2 |
| БИЦИКЛИЧЕСКИЕ НИТРОИМИДАЗОЛЫ, КОВАЛЕНТНО СОЕДИНЕННЫЕ С ЗАМЕЩЕННЫМИ ФЕНИЛОКСАЗОЛИДИНОНАМИ | 2009 |
|
RU2504547C2 |
| НОВЫЕ КОНДЕНСИРОВАННЫЕ ПРОИЗВОДНЫЕ ИМИДАЗОЛА, ИНГИБИТОР ДИПЕПТИДИЛПЕПТИДАЗЫ IV, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СПОСОБ ЛЕЧЕНИЯ И ПРИМЕНЕНИЕ НА ИХ ОСНОВЕ | 2003 |
|
RU2297418C9 |
Настоящее изобретение относится к новым производным имидазопиридин-2-она общей формулой (I) или к его фармакологически приемлемым солям, где (R1)n-A представляет собой 1Н-пирроло[2,3-b]пиридин-5-ильную группу, 3-хлор-1Н-пирроло[2,3-b]пиридин-5-ильную группу, 4-хлор-1Н-пирроло[2,3-b]пиридин-5-ильную группу, 3-фтор-1Н-пирроло[2,3-b]пиридин-5-ильную группу, 4-фтор-1H-пирроло[2,3-b]пиридин-5-ильную группу, 3-метил-1Н-пирроло[2,3-b]пиридин-5-ильную группу, 4-метил-1Н-пирроло[2,3-b]пиридин-5-ильную группу, 3,4-диметил-1H-пирроло[2,3-b]пиридин-5-ильную группу, 3-фтор-4-метил-1Н-пирроло[2,3-b]пиридин-5-ильную группу или 3-хлор-4-метил-1Н-пирроло[2,3-b]пиридин-5-ильную группу, В представляет собой 3-6-членную насыщенную или частично насыщенную моноциклическую углеводородную группу и может содержать 1 или 2 атома кислорода, атома азота и/или сульфонильные группы в качестве составляющих кольца, В может в качестве заместителей иметь одинаковые или различные R2 в количестве m, R2 представляет собой заместитель, представленный на атоме углерода или атоме азота, образующем В, R2 представляет собой заместитель, выбранный из группы, состоящей из гидрокси группы, атома галогена, циано группы, оксо группы, С1-4 алкильной группы (где C1-4 алкильная группа может быть замещена 1 C1-4 алкокси группой) и С1-4 алкокси группы, когда R2 представляет собой заместитель, представленный на атоме углерода, образующем В, и R2 представляет собой заместитель, выбранный из группы, состоящей из C1-4 алкильной группы и С1-4 алкилкарбонильной группы, когда R2 представляет собой заместитель, представленный на атоме азота, образующем В, m равно любому целому числу от 0 до 2, Q представляет собой связь или С1-4 алкиленовую группу, R3 и R4 являются одинаковыми или различными и представляют собой каждый атом водорода или атом галогена и R5 и R6 являются одинаковыми или различными и представляют собой каждый атом водорода, атом галогена или С1-4 алкильную группу. Также изобретение относится к конкретным соединениям формулы (I), к фармакологически приемлемым солям соединений формулы (I), фармацевтической композиции на основе соединения формулы (I), применению соединения формулы (I). Технический результат: получены новые производные имидазопиридин-2-она, обладающие mTOR ингибирующей активностью. 16 н. и 5 з.п. ф-лы, 161 пр.
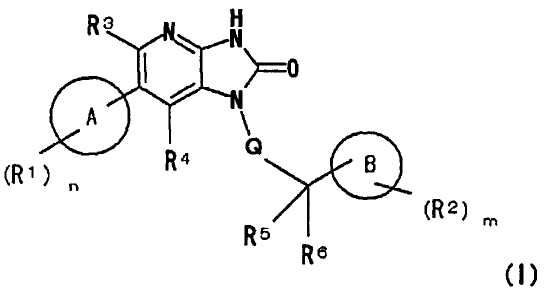
1. Соединение, представленное общей формулой (I):
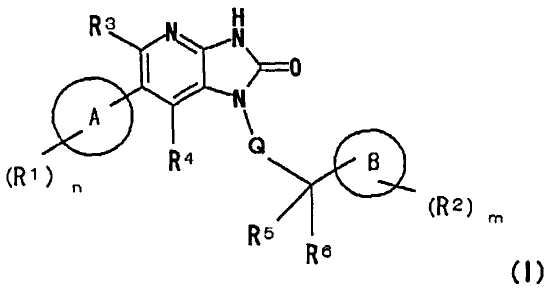
где в общей формуле (I)
(R1)n-A представляет собой 1Н-пирроло[2,3-b]пиридин-5-ильную группу, 3-хлор-1Н-пирроло[2,3-b]пиридин-5-ильную группу, 4-хлор-1Н-пирроло[2,3-b]пиридин-5-ильную группу, 3-фтор-1Н-пирроло[2,3-b]пиридин-5-ильную группу, 4-фтор-1Н-пирроло[2,3-b]пиридин-5-ильную группу, 3-метил-1Н-пирроло[2,3-b]пиридин-5-ильную группу, 4-метил-1Н-пирроло[2,3-b]пиридин-5-ильную группу, 3,4-диметил-1Н-пирроло[2,3-b]пиридин-5-ильную группу, 3-фтор-4-метил-1Н-пирроло[2,3-b]пиридин-5-ильную группу или 3-хлор-4-метил-1Н-пирроло[2,3-b]пиридин-5-ильную группу,
В представляет собой 3-6-членную насыщенную или частично насыщенную моноциклическую углеводородную группу и может содержать 1 или 2 атома кислорода, атома азота, и/или сульфонильные группы в качестве составляющих кольца,
В может в качестве заместителей иметь одинаковые или различные R2 в количестве m,
R2 представляет собой заместитель, представленный на атоме углерода или атоме азота, образующем В,
R2 представляет собой заместитель, выбранный из группы, состоящей из гидрокси группы, атома галогена, циано группы, оксо группы, С1-4 алкильной группы (где C1-4 алкильная группа может быть замещена 1 С1-4 алкокси группой) и С1-4 алкокси группы, когда R2 представляет собой заместитель, представленный на атоме углерода, образующем В, и R2 представляет собой заместитель, выбранный из группы, состоящей из С1-4 алкильной группы и С1-4 алкилкарбонильной группы, когда R2 представляет собой заместитель, представленный на атоме азота, образующем В,
m равно любому целому числу от 0 до 2,
Q представляет собой связь или С1-4 алкиленовую группу,
R3 и R4 являются одинаковыми или различными и представляют собой каждый атом водорода или атом галогена, и
R5 и R6 являются одинаковыми или различными и представляют собой каждый атом водорода, атом галогена или С1-4 алкильную группу,
или его фармакологически приемлемая соль.
2. Соединение или его фармакологически приемлемая соль по п.1, где R3 представляет собой атом водорода, атом фтора или атом хлора, и R4 представляет собой атом водорода.
3. Соединение или его фармакологически приемлемая соль по п.1, где Q представляет собой связь или метиленовую группу.
4. Соединение или его фармакологически приемлемая соль по п.1, где В представляет собой С3-6 циклоалкильную группу, тетрагидрофурильную группу, дигидропиранильную группу, тетрагидропиранильную группу, диоксанильную группу, пиперидильную группу, пиперазинильную группу или 1,1-диоксидотетрагидротиопиранильную группу.
5. Соединение по п.1, где соединение представляет собой любое соединение, выбранное из:
1-[(2S)-1,4-диоксан-2-илметил]-6-(1Н-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидроимидазо[4,5-b]пиридин-2-она,
1-[(2S)-1,4-диоксан-2-илметил]-6-(4-метил-1Н-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидроимидазо[4,5-b]пиридин-2-она,
6-(3,4-диметил-1H-пирроло[2,3-b]пиридин-5-ил)-1-[(2S)-1,4-диоксан-2-илметил]-1,3-дигидро-2Н-имидазо[4,5-b]пиридин-2-она,
6-(3-хлор-4-метил-1Н-пирроло[2,3-b]пиридин-5-ил)-1-[(2S)-1,4-диоксан-2-илметил]-1,3-дигидро-2Н-имидазо[4,5-b]пиридин-2-она,
1-[(2S)-1,4-диоксан-2-илметил]-6-(3-фтор-4-метил-1Н-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2Н-имидазо[4,5-b]пиридин-2-она,
2,6-ангидро-1,3,5-тридеокси-4-О-метил-1-[6-(4-метил-1Н-пирроло[2,3-b]пиридин-5-ил)-2-оксо-2,3-дигидро-1Н-имидазо[4,5-b]пиридин-1-ил]-L-трео-гекситола,
2,6-ангидро-1,3,4-тридеокси-5-О-метил-1-[6-(4-метил-1Н-пирроло[2,3-b]пиридин-5-ил)-2-оксо-2,3-дигидро-1Н-имидазо[4,5-b]пиридин-1-ил]-L-трео-гекситола,
2,6-ангидро-1,3,4-тридеокси-1-[6-(3,4-диметил-1Н-пирроло[2,3-b]пиридин-5-ил)-2-оксо-2,3-дигидро-1Н-имидазо[4,5-b] пиридин-1-ил]-5-O-метил-L-трео-гекситола,
2,6-ангидро-1-[6-(3-хлор-4-метил-1Н-пирроло[2,3-b]пиридин-5-ил)-2-оксо-2,3-дигидро-1Н-имидазо[4,5-b]пиридин-1-ил]-1,3,4-тридеокси-5-О-метил-L-трео-гекситола,
2,6-ангидро-1,3,5-тридеокси-1-[6-(3,4-диметил-1Н-пирроло[2,3-b]пиридин-5-ил)-2-оксо-2,3-дигидро-1Н-имидазо[4,5-b]пиридин-1-ил]-4-О-метил-L-трео-гекситола и
2,6-ангидро-1-[6-(3-хлор-4-метил-1Н-пирроло[2,3-b]пиридин-5-ил)-2-оксо-2,3-дигидро-1Н-имидазо[4,5-b]пиридин-1-ил]-1,3,5-тридеокси-4-О-метил-L-трео-гекситола.
6. 1-[(2S)-1,4-Диоксан-2-илметил]-6-(1Н-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидроимидазо[4,5-b]пиридин-2-он.
7. 1-[(2S)-1,4-Диоксан-2-илметил]-6-(4-метил-1Н-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидроимидазо[4,5-b]пиридин-2-он.
8. 6-(3,4-Диметил-1Н-пирроло[2,3-b]пиридин-5-ил)-1-[(2S)-1,4-диоксан-2-илметил]-1,3-дигидро-2Н-имидазо[4,5-b]пиридин-2-он.
9. 6-(3-Хлор-4-метил-1Н-пирроло[2,3-b]пиридин-5-ил)-1-[(2S)-1,4-диоксан-2-илметил]-1,3-дигидро-2Н-имидазо[4,5-b]пиридин-2-он.
10. 1-[(2S)-1,4-Диоксан-2-илметил]-6-(3-фтор-4-метил-1Н-пирроло[2,3-b]пиридин-5-ил)-1,3-дигидро-2Н-имидазо[4,5-b]пиридин-2-он.
11. 2,6-Ангидро-1,3,5-тридеокси-4-О-метил-1-[6-(4-метил-1Н-пирроло[2,3-b]пиридин-5-ил)-2-оксо-2,3-дигидро-1Н-имидазо[4,5-b]пиридин-1-ил]-L-трео-гекситол.
12. 2,6-Ангидро-1,3,4-тридеокси-5-О-метил-1-[6-(4-метил-1Н-пирроло[2,3-b]пиридин-5-ил)-2-оксо-2,3-дигидро-1Н-имидазо[4,5-b]пиридин-1-ил]-L-трео-гекситол.
13. 2,6-Ангидро-1,3,4-тридеокси-1-[6-(3,4-диметил-1Н-пирроло[2,3-b]пиридин-5-ил)-2-оксо-2,3-дигидро-1Н-имидазо[4,5-b]пиридин-1-ил]-5-О-метил-L-трео-гекситол.
14. 2,6-Ангидро-1-[6-(3-хлор-4-метил-1Н-пирроло[2,3-b]пиридин-5-ил)-2-оксо-2,3-дигидро-1Н-имидазо[4,5-b]пиридин-1-ил]-1,3,4-тридеокси-5-О-метил-L-трео-гекситол.
15. 2,6-Ангидро-1,3,5-тридеокси-1-[6-(3,4-диметил-1Н-пирроло[2,3-b]пиридин-5-ил)-2-оксо-2,3-дигидро-1Н-имидазо[4,5-b]пиридин-1-ил]-4-О-метил-L-трео-гекситол.
16. 2,6-Ангидро-1-[6-(3-хлор-4-метил-1Н-пирроло[2,3-b]пиридин-5-ил)-2-оксо-2,3-дигидро-1Н-имидазо[4,5-b]пиридин-1-ил]-1,3,5-тридеокси-4-О-метил-L-трео-гекситол.
17. Фармакологически приемлемая соль соединения по любому из пп.5-16.
18. Фармацевтическая композиция, обладающая mTOR ингибирующей активностью, содержащая соединение или его фармакологически приемлемую соль по любому из пп.1-16 в качестве активного ингредиента.
19. Применение соединения или его фармакологически приемлемой соли по любому из пп.1-16 в качестве активного ингредиента в производстве противоопухолевого средства.
20. Применение соединения или его фармакологически приемлемой соли по любому из пп.1-16 в качестве активного ингредиента при производстве ингибитора mTOR.
21. Применение по п.20, где опухоль представляет собой лейкоз, лимфому, множественную миелому, опухоль головного мозга, злокачественную опухоль головы и шеи, злокачественную опухоль пищевода, злокачественную опухоль желудка, апендикулярную злокачественную опухоль, злокачественную опухоль толстой кишки, злокачественную опухоль анального канала, злокачественную опухоль желчного пузыря, злокачественную опухоль желчных протоков, злокачественную опухоль поджелудочной железы, стромальную опухоль желудочно-кишечного тракта, злокачественную опухоль легкого, злокачественную опухоль печени, мезотелиому, злокачественную опухоль щитовидной железы, злокачественную опухоль почек, злокачественную опухоль предстательной железы, нейроэндокринную опухоль, меланому, злокачественную опухоль молочной железы, злокачественную опухоль эндометрия, злокачественную опухоль шейки матки, злокачественную опухоль яичников, остеосаркому, саркому мягких тканей, саркому Калоши, миосаркому, злокачественную опухоль почек, злокачественную опухоль мочевого пузыря и/или злокачественную опухоль яичек.
| Станок для изготовления деревянных ниточных катушек из цилиндрических, снабженных осевым отверстием, заготовок | 1923 |
|
SU2008A1 |
| Станок для изготовления деревянных ниточных катушек из цилиндрических, снабженных осевым отверстием, заготовок | 1923 |
|
SU2008A1 |
| RU 2006108799 A, 27.07.2006 | |||
| СОЕДИНЕНИЯ С КОНДЕНСИРОВАННЫМ 1,3-ДИГИДРОИМИДАЗОЛЬНЫМ ЦИКЛОМ | 2003 |
|
RU2328498C9 |
Авторы
Даты
2013-04-10—Публикация
2009-08-04—Подача