Область техники, к которой относится изобретение
Настоящее изобретение относится к новой системе доставки лекарственного средства, основывающейся на наносомальных системах.
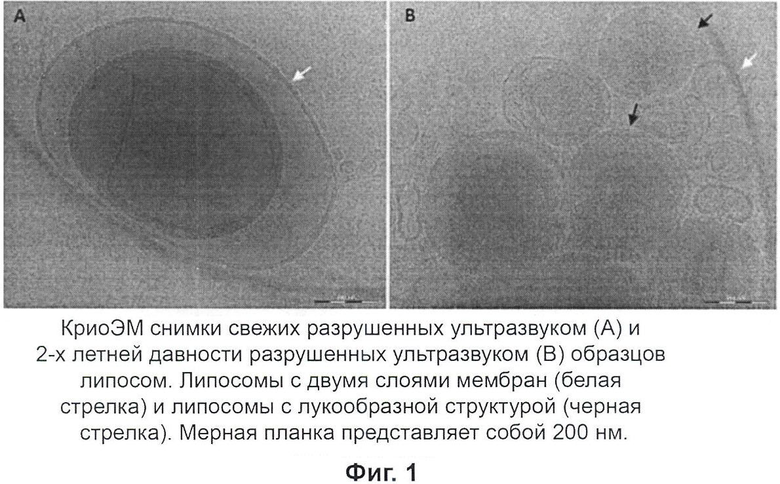
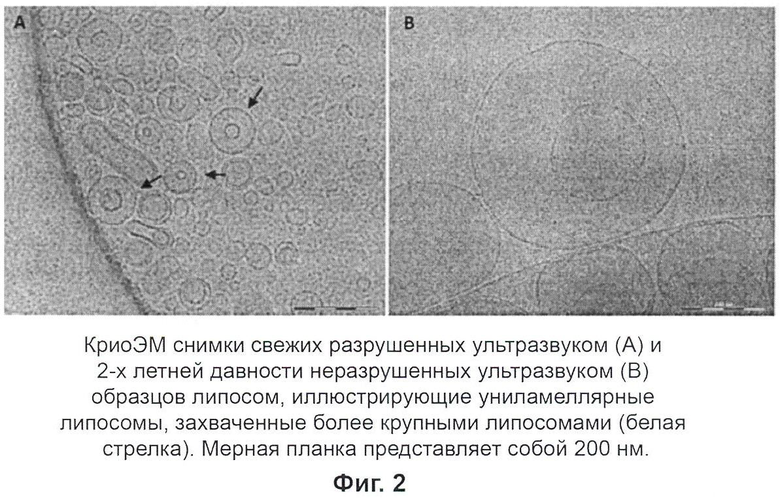
В этом исследовании образцы холестеринсодержащего наносомального амфотерицина B в физиологическом растворе исследовали с помощью криоэлектронной микроскопии (криоЭМ). Свежие и двухлетней давности образцы анализировали как не разрушенные ультразвуком, так и после разрушения ультразвуком. Анализ криоЭМ снимков включал в себя распределение по размерам и общее строение, такое как ламеллярность (моноламеллярное в сравнении с мультиламиллярным) и агрегацию.
Уровень техники
Растущая заболеваемость системными и поверхностными микозами (грибковыми заболеваниями), вызванная различными родами дрожжевых грибков и дерматофитов как у иммунодефицитных, так и у пациентов с нормальным иммунитетом, остается важной и недостаточно рассматриваемой медицинской проблемой. Обусловленная этим смертность и настораживающе увеличенный период заболеваемости вызывают сильную обеспокоенность. У всех лекарственных средств, открытых к настоящему времени, существуют проблемы ограниченного спектра действия, слабой активности, ограниченности подходящих лекарственных форм, нежелательных лекарственных реакций и угрожающей жизни токсичности и довольно часто сочетание нескольких или всех вышеперечисленных проблем. Группа полиеновых аминогликозидных антибиотиков представлялась наиболее подающей надежды, широкого спектра действия и активности. Однако токсичность большинства из этих соединений помешала их включению в терапевтические средства.
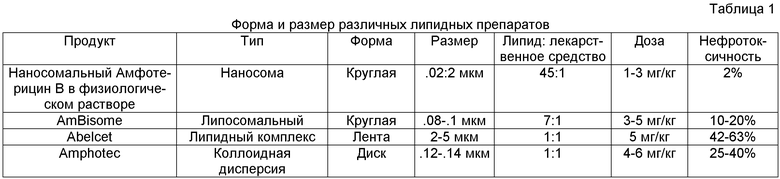
Амфотерицин В является единственным полиеновым макролидом, оставшимся в широком клиническом применении, несмотря на тот факт, что разнообразные лекарственные формы, такие как мицеллярная суспензия дезоксихолата натрия, липосомальная, липидный комплекс и липидная коллоидная дисперсия, все в различной степени обладают угрожающей жизни нефротоксичностью.
Задачами при разработке лекарственных форм Амфотерицина В являются исключение нефротоксичности, создание стабильного препарата, обеспечение эффективности в низких дозах и отсутствие токсичности и нежелательных лекарственных реакций даже в высоких дозах.
Существует большое количество выданных патентов и поданных заявок на выдачу патентов и публикаций, описывающих существующие лекарственные формы Амфотерицина В. За исключением описанных ниже четырех лекарственных форм никакие другие лекарственные формы не находят применения, так как они не были способны сделать подобные другие лекарственные формы достаточно безопасными для почек.
Во всех известных лекарственных формах Амфотерицина В формообразующие индифферентные вещества выбраны из большого списка вариантов фосфолипидов/липидов и стабилизаторов. Ни один из препаратов не вводили в физиологический раствор, так как известно, что Амфотерицин В осаждается в физиологическом растворе.
1. Стандартный Амфотерицин В: коллоидная суспензия Амфотерицин В - дезоксихолата в 5% декстрозе,
Амфотерицин В нерастворим в водной среде. Эту проблему удалось в незначительной степени преодолеть в конце 1950-х годов путем растворения Амфотерицина B в дезоксихолате и изготовлением лекарственной формы в виде мицеллярной суспензии в 5% водном растворе декстрозы. Амфотерицин В осаждается в NaCl и, следовательно, Амфотерицин B в дезоксихолате не был приготовлен в NaCl и не был растворен в физиологическом растворе. Более того, эту суспензию лиофилизировали для придания стабильности препарату.
2. Липосомальный Амфотерицин В, растворенный в 5% декстрозе
Липосомальный Амфотерицин В, состоящий из комбинации гидрогенированного фосфатидилхолина сои, дистеарилфосфатидилглицерина, холестерина и альфа-токоферола в 4,5% сахарозе и динатрия сукцината гексагидрата в качестве буфера был выбран из ряда комбинаций фосфолипидов, стеролов, мембраностабилизирующих сахаров и их различных соотношений. Несмотря на применение мембраностабилизирующей сахарозы, эти препараты лиофилизировали для преодоления нестабильности. Известно, что этот препарат липосомального Амфотерицина В осаждается в физиологическом растворе и, следовательно, растворение в/контакт с физиологическим раствором строго запрещен.
Патент Соединенных Штатов №4766046 описывает, что:
В связи с размером и нестабильностью липосом Амфотерицина В, невозможно изготовить и хранить липосомы Амфотерицина В маленького диаметра без значительного (в несколько раз) увеличения размера после периода хранения в несколько недель. В результате в связи с различным всасыванием липосом и высвобождением лекарства и токсическими свойствами in vivo, которые связаны с размером липосом, было трудно контролировать и оценивать терапевтический индекс липосом Амфотерицина В после хранения. Проблема нестабильности размера особенно важна при достижении липосомами размеров более 1-2 микрон, так как холестеринсодержащие липосомы Амфотерицина В значительно токсичнее более мелких липосом исходного размера. В связи с этим проблему постоянства размера решили только путем применения отсортированных по крупности липосом вскоре после изготовления. Вышеуказанное, несомненно, является непрактичным подходом для доставки лекарственных средств при традиционной клинической ситуации.
3. Липидный комплекс Амфотерицина В, растворенный в 5% декстрозе
Этот препарат состоит из Амфотерицина В, синтетических фосфолипидов, а именно из димиристилфосфатидилхолина и димиристилфосфатидилглицерина. Водную суспензию разводят в 5% декстрозе перед применением. Ни эффективность, ни профиль токсичности не улучшились по сравнению со стандартным Амфотерицином В.
4. Коллоидная дисперсия Амфотерицина В, растворенная в 5% декстрозе
Амфотерицин В и натрия холестерил сульфат, лиофилизированный с трометамином, динатрия ЭДТА дегидратом и лактозы HCl моногидратом.
Глюкоза, присутствующая в липидных лекарственных формах Амфотерицина В, заметно снижает положительное действие лекарственных форм, наносимых местно. Предполагают, что ингибиторный механизм глюкозы связан с высокой вязкостью, вызванной глюкозой, или с изменениями, вызванными глюкозой на поверхности раздела жир/вода коллоидных частиц (Crowe J.H. et. Al. 1988 Biochim. Biophys Acta. 947:367-384). Даже успешность лечения липосомальным Амфотерицином B в лучшем случае составляет 77%, что уступает настоящему изобретению.
В связи с вышеизложенным рассматривалась возможность заменить декстрозу физиологическим раствором в данном изобретении, что обладает дополнительным преимуществом снижения нефротоксичности Амфотерицина В. Принимая во внимание хорошо известный и задокументированный факт, что физиологический раствор вызывает осаждение Амфотерицина В1-4, липидный состав и соотношение липида и лекарственного средства были специально рассчитаны, чтобы удостовериться, что Амфотерицин B в наносомах иммобилизирован для предотвращения осаждения наносомального лекарственного средства.
Задачи изобретения
Задачей настоящего изобретения является обеспечение новой лекарственной формы холестеринсодержащих наносом, стабилизированных в суспензии физиологического раствора, со сниженной нефротоксичностью.
Еще одна задача настоящего изобретения заключается в обеспечении новой лекарственной формы холестеринсодержащих наносом, стабилизированных в суспензии физиологического раствора и обладающих усиленной противогрибковой активностью.
Еще одна задача настоящего изобретения заключается в обеспечении лекарственной формы холестеринсодержащих наносом, стабилизированных в суспензии физиологического раствора, которая является очень стабильной.
Дополнительная задача настоящего изобретения заключается в обеспечении новой лекарственной формы холестеринсодержащих наносом, стабилизированных в суспензии физиологического раствора, которая является менее токсичной.
Еще одна задача настоящего изобретения заключается в обеспечении новой лекарственной формы холестеринсодержащих наносом, стабилизированных в суспензии физиологического раствора, в которой использованная доза Амфотерицина В очень низка благодаря его высокой противоинфекционной активности. Еще одна задача настоящего изобретения заключается в обеспечении новой лекарственной формы для различных способов применения для оптимизации пониженных доз Амфотерицина В благодаря его высокой противоинфекционной активности, дальнейшего снижения нефротоксичности и стабильных препаратов для различных способов применения, таких как внутривенный, офтальмологический, местный и т.п.
Раскрытие изобретения
Согласно настоящему изобретению предлагается новая лекарственная форма для лечения грибковой инфекции, содержащая: наносомы холестеринсодердащего наносомального Амфотерицина В в суспензии.
В соответствии с настоящим изобретением также предлагается процесс изготовления новой лекарственной формы холестеринсодержащих наносом, стабилизированных в суспензии физиологического раствора.
Осуществление изобретения
В растворе концентрация - это число молекул растворяемого вещества в единице объема растворителя, который в случае растворов для инъекций и инфузий или любой другой жидкой формы для введения, как правило, водный, тогда как в дисперсных препаратах, включая суспензии, такие как коллоидные суспензии, эффективная концентрация лекарственного средства определяется количеством частиц, несущих препарат. Такими носителями являются разнообразные комплексы липидов, протеинов или другие биологически разлагаемые носители для инъекционных, пероральных или ингаляционных, трансдермальных и пр. и биологически неразлагаемых для препаратов главным образом для местного применения. В настоящем изобретении наносомы имеют оптимально высокое соотношение липида к лекарственному средству для увеличения числа содержащих лекарственное средство наносом на каждую единицу количества лекарственного средства и таким образом достигают оптимизации эффективности путем комбинирования с получением наносом перед применением.
Оптимизация соотношения липида к лекарственному средству с размером частиц основана на новой концепции настоящего изобретения по повышению эффективной концентрации активных лекарственных препаратов путем увеличения количества частиц-носителей АФИ (API) в лекарственных формах после изготовления и перед применением. Это достигается путем уменьшения размера частиц лекарственных форм, содержащих больше липида. В лекарственной форме благодаря оптимально более высокому соотношения липида к лекарственному средству содержится большее количество частиц/мг лекарственного средства. Большее количество частиц приводит к лучшему/более высокому распределению лекарственного средства в организме. Так как в суспензии существует более эффективная концентрация лекарственного средства, большее число молекул равномерно распределяется по организму. Это снижает требование терапевтической дозы. Так как АФИ, к примеру, Амфотерицин В, токсичен в более высоких дозах, путем снижения требования АФИ автоматически уменьшится токсичность для животных/пациентов и, следовательно, приведет к более безопасным лекарственным формам.
АФИ в дисперсных препаратах инкапсулированы во множество слоев частиц-носителей. Гидрофобные/липофильные лекарственные средства остаются включенными в липидный бислой липидных наносом и в связи с этим не высвобождаются в водную среду in vivo даже после фрагментации или разрушения подобных наносом. Такие лекарственные средства, инкапсулированные в липидные наносомы, переносятся с поверхности наносом на поверхность клетки-мишени. В таком случае лекарственные средства, инкапсулированные во внутренние ламеллы наносом, не используются терапевтически и завершают свое существование, подвергнувшись фагоцитозу клетками ретиколуэндотелиальной системы и выводятся из терапевтической цепи in vivo. Накопительное инкапсулирование лекарственного средства во внутренних ламеллах в несколько раз выше, чем в ламелле на поверхности наносом. Если все ламеллы мультиламеллярных наносом разделяются для образования многочисленных новых малых наносом, внутренняя ламелла, инкапсулирующая лекарственное средство, таким образом преобразуется в наружную ламеллу наносом, выводящую на поверхность лекарственное средство, и логично ожидать, что эффективная концентрация лекарственного средства будет увеличиваться без каких-то добавлений АФИ к такой смеси ламеллярной лекарственной формы. Эта оптимизация дает более высокую активную концентрацию для достижения более высокой терапевтической эффективности, что стало бы возможным после ультразвукового разрушения смеси ламеллярных микро и/или наносом у постели пациента. Из смеси множества ламелл каждая частица делает доступной несколько ламелл, каждая из которых преобразуется в несколько наносом. С увеличением числа наносом большинство АФИ в частицах-носителях доставляется на поверхность, таким образом увеличивая терапевтическую эффективность пропорционально увеличению количества переносящих лекарственное средство наносом. В данном случае соотношение липида к лекарственному средству колеблется между 45:1 и 45:15, как показано в таблице ниже.
Больше матрица липида: лекарственное средство означает - больше количество липосом/мг лекарственного средства, поэтому лучше доступность
Процесс получения наносом
В соответствии с настоящим изобретением введен ранее не существовавший подход проведения процесса получения наносом у постели пациента с помощью ультразвукового аппарата. Этот аппарат позволяет производить операцию автоматически и преобразует частицы в более мелкие и менее ламиллярные наносомы, что приводит к оптимально увеличенной терапевтической эффективности с помощью механизма, описанного ниже.
В воспаленном участке капилляры образуют свищи и становятся более проницаемыми, что позволяет клеткам передвигаться и частицам веществ мигрировать/переходить из циркулирующей крови в окружающий воспаленный участок. Увеличение доставки лекарственных средств с частицами веществ к воспаленным участкам с помощью свищей можно облегчить, преобразовав более крупные частицы частиц носителя в наносомы. Образование наносом приводит к увеличению терапевтической эффективности благодаря следующему из этого увеличению концентрации количества наносом, содержащих лекарственное средство, на участке-мишени.
Еще одним важным применением процесса образования наносом является уменьшение потери более крупных частиц из-за фагоцитарных клеток ретикуло-эндотелиальной системы. Более крупные частицы быстро распознаются как инородные частицы клетками гистиоцит-макрофагов и в результате фагоцитируются и быстро выводятся из кровотока. Степень фагоцитоза обратно пропорциональна размеру переносящих лекарственное средство частиц. Следовательно, уменьшение размера путем преобразования крупных и мультиламиллярных частиц в наносомы увеличило бы период полувыведения из плазмы и отсрочило потерю от фагоцитоза, таким образом в дальнейшем добавляя увеличение терапевтической эффективности.
Настоящее изобретение относится к лекарственным препаратам с контролируемым высвобождением, использующим ряд технологий новых систем доставки лекарственного средства, основанным на наносомальных системах. В этом исследовании образцы холестеринсодержащего наносомального Амфотерицина B в физиологическом растворе исследовали с помощью криоэлектронной микроскопии (криоЭМ). Свежие и двухлетней давности образцы анализировали как не разрушенные ультразвуком, так и после разрушения ультразвуком. Анализ криоЭМ снимков включал распределение по размерам и общее строение, такое как ламеллярность (моноламеллярное в сравнении с мультиламиллярным) и агрегацию.
Рассматривались следующие специфические вопросы:
- распределение по размерам,
- описание общего строения.
С помощью криоЭМ было получено изображение свежих и двухлетней давности образцов холестеринсодержащего наносомального Амфотерицина В в физиологическом растворе. Образцы разводили в 10 раз и делали снимки без разрушения ультразвуком и после 45-минутного разрушения ультразвуком. Разрушение ультразвуков проводили на водно-ледяной бане, в которой температура образца сохранялась ниже 8°C.
Распределение по размерам
КриоЭМ разведенных образцов наносом показала очень гетерогенный образец с частицами различных морфологий и размеров. Размер частиц колебался в пределах от 20 нм до микрометра в диаметре. Как можно было бы ожидать, большее число наносом с меньшими диаметрами, 20-200 нм, наблюдали в разрушенных ультразвуком образцах по сравнению с не подвергшимися ультразвуковому разрушению образцами. На криоЭМ снимках не наблюдалось четких отличий между старыми и свежими образцами наносом, так же как и в случае с не подвергшимися ультразвуковому разрушению и разрушенных ультразвуком. Так как образцы содержали частицы с таким широким распределением по размерам и формам, расчет и представление средних диаметров были бы неуместны, так как предоставили бы только вводящую в заблуждение информацию.
Общее строение
Снимки наносом, сделанные с помощью криоЭМ, показали хорошо обозначенные мембраны толщиной около 7 нм. Образцы, разрушенные ультразвуком, показали более высокое содержание малых наносом, которые часто наблюдались как отдельные частицы, по сравнению с не разрушенными ультразвуком образцами, где наносомы почти всегда соприкасались друг с другом. Наружная/наружные мембрана/мембраны частиц, не разрушенных ультразвуком, как в свежих, так и в старых образцах, часто окружала/окружали более чем одну наносому, осложняя разграничение между соседними наносомами.
Ламеллярность
КриоЭМ показала, что наносомы существуют в виде как моноламеллярных, так и муьтиламеллярных. Больше моноламеллярных наносом обнаружили в образцах, разрушенных ультразвуком, по сравнению с образцами, не разрушенными ультразвуком. Количество мембранных слоев, окружающих мультиламеллярные частицы, колебалось от 2 ламелл до подобных репчатому луку структур с более 10 мембранных слоев. Также, похоже, что большие частицы могут захватывать более мелкие там, где мембраны находятся не очень близко друг к другу. Однако, возможно, что толщина льда позволяет этим захваченным наносомам пространственно локализоваться по оси z.
Агрегация
КриоЭМ не показала много агрегатов трехмерных наносом в каком-либо из образцов. Частицы в образцах, не разрушенных ультразвуком, были в основном в близком контакте и часто было трудно установить границу между тем, где заканчивается одна наносома и начинается другая, так как они часто имели общий наружный мембранный слой/слои.
Вывод
Образцы наносом показали высокую гетерогенность образца с частицами разных строений и диаметрами, колеблющимися в пределах от 20 нм до микрометра. Моноламеллярные наносомы меньшего диаметра, 20-200 нм, намного чаще наблюдали в образцах, разрушенных ультразвуком, по сравнению с неразрушенными ультразвуком образцами. Похоже, что разрушение ультразвуком эффективно дробит крупные мультиламеллярные частицы, наблюдаемые в неразрушенных ультразвуком образцах, на малые моноламиллярные наносомы. Несмотря на это, некоторые большие мультиламиллярные липосомы все еще наблюдались в разрушенных ультразвуком образцах и они часто лучше разделялись по сравнению с большими мультиламеллярными частицами в неразрушенных ультразвуком образцах. Продленное разрушение ультразвуком может привести к более полному дроблению крупных частиц.
Не было четко видимых различий между старыми и свежими образцами наносом в сравнении как с неразрушенными ультразвуком, так и с разрушенными ультразвуком образцами.
Важность физиологического раствора в снижении нефротоксичности АмВ
Токсичности, зависимые от дозы, в том числе нефротоксичность, являются главным препятствием для парентерального применения Амфотерицина В. Известно, что Амфотерицин В связывается с богатыми стеролами мембранами и претерпевает образование самоорганизованных пор, которое приводит к разрушению этих клеток. Почки, будучи обогащенными содержанием холестерина, и полиеновые макролиды, такие как Амфотерицин В, обладающие высоким сродством к холестерину, представляют сложный вариант развития событий, ограничивающий применения таких соединений в качестве терапевтических агентов. Инкапсулированный Амфотерицин В в холестеринсодержащих липидных лекарственных формах обладал недостаточным преимуществом (см. Таблицу 2 ниже).
Более того, получено очевидное средство для преодоления токсичности Амфотерицина В с помощью лекарственной формы в виде суспензии в физиологическом растворе, тогда как ранее было известно, что Амфотерицин осаждается в физиологическом растворе. В настоящем изобретении Амфотерицин В иммобилизирован в холестеринсодержащей матрице, предотвращающей подвижность и последующее осаждение. Продукт настоящего изобретения - холестеринсодержащий наносомальный Амфотерицин В в суспензии физиологического раствора - существенно снижает нефротоксичность.
Тогда как эргостеролсодержащие наносомы обеспечили бы более высокие концентрации Амфотерицина В и имели бы значение только в лечении висцерального лейшманиоза, в настоящем изобретении предложено заменить эргостерол холестерином в наносомальном Амфотерицине B в суспензии физиологического раствора, что необходимо для усиления активности против дрожжевых грибков, плесневых грибков и дерматофитов, так же как и лейшмании.
Изобретение по включению физиологического раствора в качестве суспензионной среды основано на гипотезе, что нарушение функции почек, вызываемое Амфотерицином В, а именно гиперазотемия, связано со снижением скорости клубочковой фильтрации (СКФ) и почечного кровотока, снижении способности к концентрации, изменении подкисления мочи и потере калия. Нефротоксичность Амфотерицина В связана с его ионофорными свойствами к биологическим мембранам (Schell R.E.: Amphotericin В induced nephrotoxicity: Influence of Sodium Status (Letter). Nephron 1992; 60:52.)
Клубочковая токсичность может быстро развиться после одной дозы Амфотерицина В или медленно развиваться в течение от нескольких дней до недель терапии Амфотерицином В, в зависимости от статуса гидратации и состояния функции почек пациента. Сообщается, что внутривенное применение физиологического раствора перед и после инфузий Амфотерицина В, в практике известное как нагрузка натрием, замедляет снижение скорости клубочковой фильтрации, вызванное Амфотерицином В (R.Sabra & R.A.Branch (1991) Mechanism of Amphotericin B - Induced Decrease in Glumerular Filteration Rate in Rats/Antimicrobial Agents and Chemotherapy: 35; 2509-25014).
ЛД50
Путем увеличения соотношения липида к лекарственному средству, а также применения физиологического раствора для суспендирования наносом эти наносомы сделали очень безопасными. В доклинических испытаниях на токсичность на животных не смогли определить ЛД50 (LD50), так как ни одно животное не умерло вплоть до 60 мг/кг, а свыше 60 мг/кг невозможно было ввести. Эти наносомы представляют собой готовую к применению жидкую суспензию, поэтому не могут вводиться как концентрированная доза, а животные не могут перенести больший объем, чем у 60 мг дозы. Отмечено, что ни холестерин без физиологического раствора, как в липосомальном Амфотерицине В (см. ссылку на AmBiosome токсичность/состав, приведенную выше), ни физиологический раствор без холестерина, как в липидном комплексе Амфотерицина В (см. ссылку на Abelcet токсичность/состав, приведенную выше), не снижают нефротоксичность до незначительных уровней, как наша уникальная композиция холестеринсодержащих с высоким соотношением липида к лекарственному средству наносом в физиологическом растворе. Эффективность холестеринсодержащего наносомального Амфотерицина В в физиологическом растворе in vitro во множество раз выше (иногда в 10 раз)(МИК во много раз ниже) по сравнению со стандартным раствором Амфотерицина B в отношении большого числа клинических штаммов дрожжевых и плесневых грибков. Причина более высокой активности в том, что эти наносомы, так же как и мембраны грибков, имеют сходную и предпочтительно гидролипофильную природу, поэтому переход молекулы из наносомы в грибок прост.
Стабилизация наносом в холестерине и физиологическом растворе
Стабильность наносом холестеринсодержащего наносомального Амфотерицина B в физиологическом растворе без применения любого другого мембранстабилизирующего агента стала возможной с помощью новой композиции из настоящего изобретения. Наносомальный Амфотерицин В из настоящего изобретения сам по себе стабилен по крайней мере в течение 24 месяцев с даты производства. Следовательно, ясно, что холестерин и физиологический раствор играют главную роль в повышении стабильности композиции.
Примеры
Пример 1: инкапсулирование 1-15 мг лекарственного средства
В холестеринсодержащий наносомальный Амфотерицин B в физиологическом растворе могут быть успешно включены различные количества, то есть от 1 мг до 15 мг на мл, Амфотерицина В, без увеличения количества липидов, что значит, что для каждой из лекарственных форм от 1 до 15 мг/мл Амфотерицина В фиксированное количество липидов составляет 45 мг, то есть соотношение липида к лекарственному средству колеблется от 45:1 до 45:15.
Определение «Лекарственное средство: соотношение липида к наносомам» и «Амфотерицин B в супернатанте» новых лекарственных форм:
Количественное содержание Амфотерицина В и остаточное содержание метанола были определены, и результаты представлены ниже:
Результаты определений:
(A) Определение Амфотерицина В в жидком супернатанте
Все образцы центрифугировали и для проведения количественного определения Амфотерицина В отобрали жидкий супернатант. Измерение при 405 нм на спектрофотометре в УФ-диапазоне дало пренебрежительно малые результаты, что подтверждает отсутствие Амфотерицина B в жидком супернатанте, означающее, что в новой лекарственной форме Амфотерицина В не присутствует неинкапсулированного Амфотерицина В.
(B) Лекарственное средство: соотношение липида в наносомах
Определенный лекарственный препарат: соотношение липида в наносомах из приведенных выше лекарственных форм.
Результаты исследований приведены ниже -
Пример 2: Относительная нефротоксичность наносомального Амфотерицина В в физиологическом растворе v/s суспензии декстрозы-
Собственная нефротоксичность Амфотерицина В была главным ограничением на пути высвобождения полного потенциала этого сильного и широкого спектра действия противогрибкового лекарственного средства. Несмотря на известные отрицательные эффекты декстрозы, оказываемые на действие лекарственного средства, подробно описанные ранее, и возможные преимущества физиологического раствора, декстроза не могла быть заменена физиологическим раствором, так как, по иронии, хорошо известно, что Амфотерицин В осаждается в физиологическом растворе. Уникальная конструкция данного наносомального Амфотерицина В делает возможной стабильную лекарственную форму в суспензии физиологического раствора путем иммобилизации Амфотерицина B в наносомальной матрице.
Опыты проводились в двух группах швейцарских мышей-альбиносов, каждая группа включала в себя 6 самцов и 6 самок. Одной группе вводили лекарственную форму физиологического раствора, а другой с декстрозой, в суточной дозе 3 мг/кг в течение первых 8 дней, которую затем увеличили до 5 мг/кг/день на девятый и десятый. Забор крови осуществляли через день у половины численности каждой из групп животных и ежедневно со дня 2 до 11 определяли уровень сывороточного креатинина.
Индивидуальные данные по клинической химии у животных
Наносомальный Амфотерицин B в 5% декстрозе
Доза: 3 мг/ кг/день, 5 мг/ кг/день со дня 8
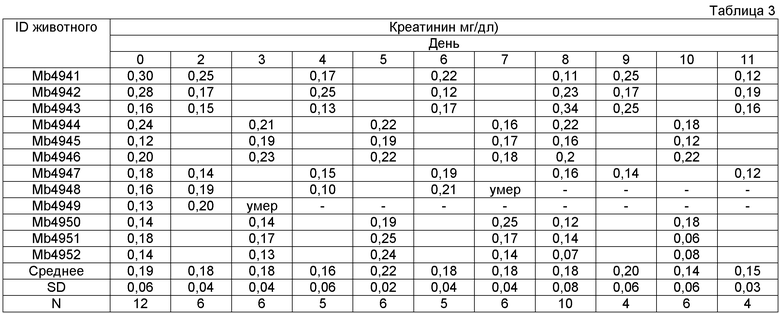
Животное с ID - Mb4949 - нашли мертвым на день 2 после забора крови
Животное с ID - Mb4948 - нашли мертвым на день 6 после забора крови
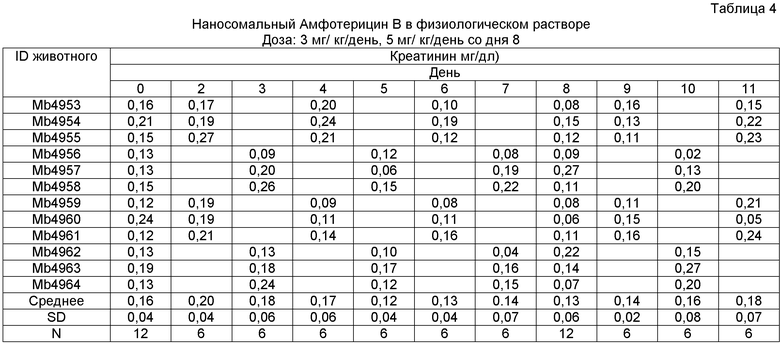
Не наблюдалось каких-либо значительных различий в уровнях сывороточного креатинина в обоих группах, что вызвало необходимость более длительных опытов с более высокими дозами.
В этих опытах две группы мышей, каждая состоящая из 50 мышей с равным числом самцов и самок. Ежедневное введение заменили введением через день дозы 10 мг/кг, одной группе давал наносомальный Амфотерицин B в 5% декстрозе, а другой - в физиологическом растворе. Для определения уровней сывороточного креатинина забор кровь проводили еженедельно.
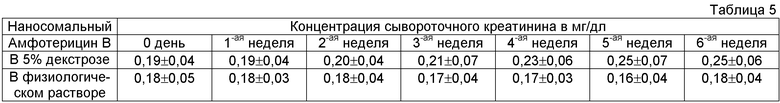
В группе декстрозы не наблюдали значительных различий до 2-ой недели, и даже впоследствии в течение до шести недель увеличение уровней сывороточного креатинина было незначительным. Увеличение сывороточного креатинина более чем в два раза от исходного наблюдали у 2 животных на 4-ой неделе, 3 животных на 5-ой неделе и одного животного на 6-ой неделе. Смерть одного животного на 3-ей неделе и другого на 5-ой неделе, видимо, связана с почечной токсичностью лекарственного средства. Всего нефротоксичность проявилась у 14% животных.
В группе физиологического раствора уровни сывороточного креатинина оставались постоянными на всем протяжении опыта длительностью 6 недель. Только у одного животного рост уровня сывороточного креатинина превысил более чем в два раза первоначальный чертеж 6 недель введения. Всего нефротоксичность проявилась только в 2% случаев. Во время опыта умерло 5 мышей, но смерть, видимо, не связана с лекарственным средством.
Пример 3: стабилизация наносом в холестерине и физиологическом растворе
Стабильность холестеринсодержащего наносомального Амфотерицина B в физиологическом растворе без каких-либо других мембранстабилизирующих агентов в течение двух лет стала возможной с помощью уникальной композиции, описанной в данном изобретении.
Испытание конечного продукта на стабильность в настоящем времени
Данные исследования стабильности в настоящем времени холестеринсодержащего наносомального Амфотерицина В в физиологическом растворе
Партия №: 50F07-147
Дата изготовления: 08/2007
Срок годности: 07/2009
Данные исследования стабильности в настоящем времени холестеринсодержащего липосомального Амфотерицина В в физиологическом растворе.
Партия №: 50F07-148
Дата изготовления: 08/2007
Срок годности: 07/2009
Данные исследования стабильности в настоящем времени холестерин-содержащего наносомального Амфотерицина И в физиологическом растворе
Партия №: 50F07-149
Дата изготовления: 08/2007
Срок годности: 07/2009
Пример 4: Сравнение активности in vitro стандартного Амфотерицина В и холестеринсодержащего наносомального Амфотерицина В в физиологическом растворе (N Амфотерицин В).
Опыты, проведенные для определения противогрибкового спектра и МИК наносомального Амфотерицина В по сравнению со стандартными противогрибковыми средствами, а именно
Амфотерицин В, Вориконазол, Итраконазол и Флуконазол, чтобы удостовериться в эффективности против патогенных дрожжевых грибков и плесневых грибков, включая дерматофиты.
Исследовали следующие клинические штаммы:
Активность in-vitro холестеринсодержащего наносомального Амфотерицина В в физиологическом растворе во много раз выше (в некоторых случаях в 10 раз и МИК значительно ниже), чем у стандартного Амфотерицина В при сравнении на большом количестве клинических штаммов дрожжевых и плесневых грибков. Более того, Амфотерицин В до этого момента был известен как неэффективный в отношении дерматофитов, тогда как наносомальный Амфотерицин В эффективен в отношении дерматофитов, включая Trichophyton rubrum, Т. tonsurans, T. Mentagrophytes, Microsporum gypseum и Epidermophyton floccosum. Причиной более высокой активности может быть то, что эти наносомы, так же как и мембрана гриба, имеют схожую и предпочтительно гидролипофильную природу, что делает легким переход молекулы Амфотерицина В из наносомы в гриб.
Наблюдения также поддерживают возможность снижения дозы, когда Амфотерицин В применяют в виде холестеринсодержащих наносом. Стандартный Амфотерицин В, представляющий собой коллоидную суспензию лекарственного средства в дезоксихолате натрия, применяют в суточной дозе 1 мг/кг веса тела/день, в то время как его имеющиеся в продаже липидные лекарственные формы, разработанные для преодоления ограничивающей дозировку токсичности, имеют дозировку 3-6 мг/кг веса тела/день. Экономические показатели эффекта лечения высокими дозами и делают лекарственное средство недоступным, тогда как холестеринсодержащий наносомальный Амфотерицин В помог бы снизить терапевтическую дозу и сделал бы лечение доступным.
Дерматофиты
1. Trichophyton rubrum, Т. tonsurans, T. mentagrophytes.
2. Microsporum gypseum
3. Epidermophyton floccosum
Грибки, вызывающие инфекцию кожи
1. Candida, Aspergillus, Mucor
Виды, устойчивые к азолам
Амфотерицин В:
Активен (0,5-2)
Амфотерицин В:
Активен (2)
Амфотерицин В:
Активен (0,5-1)
Амфотерицин В:
Активен (0,5-2)
Виды, устойчивые к флуконазолу: Microsporum gypseum, Trichophyton mentagrophytes, Trichophiton rubrum, Penicillinum marneffei, Sporthrix schenckii, Scytalidum dimidatum, Philaphora verrucosa, Cladophialophora bantiana, Alternaria spp., Curvularia spp., Apophysomyces elegans, Mucor spp., Absidia corymbifera, Rhizopus arrhizus, R. Pusilus, Pseudallescheria boydii, Fusarium spp., Aspergillus flavus, A. fumigatus, A. oryzae, Paeciliomyces spp.
Виды с переменной чувствительностью к флуконазолу: Candida albicans, Cryplococcus neoformans.
Виды, устойчивые к вориконазолу: Mucor spp.
Виды с переменной чувствительностью к вориконазолу: Sporthrix schenckii, Absidia corymbifera, Rhizopus arrhizus, R. pusilus, Cryptococcus neoformans, Candida albicans, Paeciliomyces spp.
Виды, устойчивые к итраконазолу: Trichophiton rubrum, Curvularia spp., Fusarium spp., Absidia corymbifera, Mucor spp., Apophysomyces elegans, Curvularia spp., Rhizopus arrhizus, R. pusilus, Philaphora verrucosa, Scytalidum dimidatum.
Виды с переменной чувствительностью к итраконазолу: Sporthrix schenckii, Aspergillus flavus, A. fumigatus, Candida albicans, Paeciliomyces spp.
Виды с переменной чувствительностью к наносомальному Амфотерицину В: Paeciliomyces spp.
Пример 5: ТЕМ и SEM криоскола до и после разрушения ультразвуком -
Эффект липида: соотношение лекарственного средства на число частиц/мл, влияние разрушения ультразвуком на число частиц/мл -
Образцы наносом показали высокую гетерогенность образца, с частицами различных строений и диаметров, колеблющихся в пределах от 20 нм до микрометра. Моноламеллярные наносомы более маленьких диаметров, от 20 до 200 нм, намного чаще наблюдали в разрушенных ультразвуком образцах по сравнению с неразрушенными ультразвуком образцами. Похоже, что разрушение ультразвуком эффективно разрушает крупные мультиламеллярные частицы, наблюдаемые в неразрушенных ультразвуком образцах, до малых моноламеллярных наносом. Тем не менее, некоторые мультиламеллярные частицы все еще обнаруживались в разрушенных ультразвуком образцах, и они были разделенными в отличие от крупных мультиламеллярных частиц в неразрушенных ультразвуком образцах. Продленное разрушение ультразвуком может привести к более полному разрушению крупных частиц.
Не было видимых различий между старыми и свежими образцами как при сравнении неразрушенных ультразвуком, так и разрушенных ультразвуком образцов. Образцы, таким образом, представляются стабильными в течение периода времени (2 года), исследованного, как показано на Фиг.1 и 2.
Пример 6: местное офтальмологическое применение суспензии в физиологическом растворе холестеринсодержащего наносомального Амфотерицина В -
Холестеринсодержащий наносомальный Амфотерицин В в физиологическом растворе также изучается местно на глазах и признан эффективным и безопасным. Модель кератита Aspergillus fumigatus, которую лечили с помощью наносомального и стандартного Амфотерицина В различной концентрации, и контрольные группы, не получавшие лечения. Результаты показали, что половинная концентрация холестеринсодержащего наносомального Амфотерицина И в физиологическом растворе так же эффективна, как полная концентрация стандартного Амфотерицина В.
Оценка эффективности и токсичности лекарственной формы холестеринсодержащего наносомального Амфотерицина В в физиологическом растворе во время лечения экспериментального грибкового кератита у кроликов.
Задачи:
А) Оценить эффективность местного наносомального Амфотерицина В при лечении индуцированного грибкового кератита на экспериментальной модели кроликов.
Б) Сравнить эффективность наносомального Амфотерицина B в конентрации 0,1% и 0,05% со стандартным Амфотерицином B в концентрации 0,1%.
Способы
Объекты: ново-зеландские белые кролики - 72
Грибковый изолят: Aspergillus fumigatus (ATCC 13073), Candida albicans, Fusarium solani
Aspergillus fumigatus и Fusarium solani выращивали на скошенном агаре картофельной декстрозы при 30°C в течение 3-10 дней. Суспензию конидий готовили, осторожно беря мазок культуры стерильным ватным тампоном, и перенося его в 3-4 мл стерильного физиологического раствора в 15-миллилитровой конической пробирке. Окончательную концентрацию конидий доводили до 106 конидий/мл. Candida albicans выращивали на чаше с агаром картофельной декстрозы в течение 24 часов при 35°C. Пять колоний >1 мм в диаметре собирали и суспендировали в 5 мл 0,85% стерильного физиологического раствора в стерильной 15-миллилитровой конической пробирке. Суспензию встряхивали на вортексе и клетки пересчитывали с помощью гемоцитометра. Рабочую суспензию дрожжевых клеток готовили в стерильном физиологическом растворе для получения окончательной концентрации 10 КОЭ/мл.
Индукция кератита и лечение
В исследовании было использовано 72 кролика, из которых 60 были заражены инокулятом Aspergillus fumigatum, из них 22 кролика было заражено с помощью модели контактных линз, тогда как 38 было заражено с помощью интрасомальной техники. Восемь кроликов инфицировали с помощью клинического штамма Candida albicans (4 кролика с помощью 108 дрожжевых грибков/мл и 2 с помощью 109 клеток/мл путем интрасомальной инокуляции, и 2 кролика были заражены с помощью модели контактных линз с 109 клеток/мл). Четыре кролика были заражены с помощью клинического штамма Fusarium Solani с дозой инокулята (106 спор/мл) с помощью интрасомальной техники.
Индукция кератита с помощью контактных линз: кроликов подвергли анестезии с помощью внутримышечного кетамина и ксилазина. Роговичную анестезию обеспечили с помощью 0,5% пропаракаина местно. Мигательную оболочку правого глаза удалили острым иссечением. 7-миллиметровый диск фильтровальной бумаги, смоченный 99% изопропиловым спиртом (Merck, США), поместили в центр роговицы на 30 секунд и атравматично удалили роговичный эпителий. Глаз промыли раствором лактата натрия для удаления оставшихся следов изопропилового спирта. В центре роговицы нанесли сетку царапин. Грибковый инокулят перенесли на лишенную оболочки роговицу с помощью наконечника пипетки большого диаметра, и инокулят задержали на роговице, поместив стерильную контактную линзу (диаметр 14,0 мм) (Pure vision, Bosch and Lomb, Ireland). Для предупреждения выпадания контактной линзы веки закрыли, проведя тарзорафию шелковыми нитями 5-0. Глаза обследовали через 48 часов, удалив контактную линзу, и в последующем каждые 48 часов. От каждого из этих кроликов получили роговичные узелки и подвергли микробиологическому и гистопатологическому исследованию.
Индукция кератита интрасомальной инъекцией инокулята: кроликов подвергли анестезии с помощью внутримышечного кетамина и ксилазина. Роговичную анестезию обеспечили с помощью 0,5% пропаракаина местно. 20 мл фунгального инокулята (106 спор/мл) ввели интрасомально с помощью изогнутой иглы для инсулина 30G, руководствуясь щелевой лампой. Кроликов обследовали через каждые 3 дня на наличие признаков кератита.
Оценка противогрибковых средств: так как стойкое заражение наблюдалось на модели интрасомальной инъекции инокулята, исследование лечения проводили на этой модели. Для лечения кроликов в случайном порядке разделили на четыре группы, в каждую вошло по 4 кролика.
Группы, инокулированные Aspergillus fumigatus, были:
Группа 1) получавшая лечение 0,1% наносомальным Амфотерицином В,
Группа 2) получавшая лечение 0,1% стандартным Амфотерицином В,
Группа 3) получавшая лечение 0,05% наносомальным Амфотерицином В
Группа 4) инстилляция физиологическим раствором (нелеченная контрольная группа).
Инфекции до и после лечения оценивали, давая составную оценку за различные клинические признаки, определенные с помощью микроскопа с щелевой лампой. Клинические оценки свели в таблицы для каждой группы и взяли их среднее.
Результаты
Модель контактных линз: для исходной стандартизации грибкового кератита, из 22 кроликов использовали восемь кроликов, зараженных инокулятом, содержащим только суспензию спор Aspergillus fumigatus, на следующей модели контактных линз. Однако это не дало каких-либо клинических или микробиологических доказательств инфекции (и мазок, и посев были отрицательны, Таблица 1). В последующем четырнадцать кроликов были заражены смесью спор и мицелия, что дало стойкую инфекцию у кроликов, как показано в Таблице 1. Хотя имелась стойкая клиническая инфекция, тяжесть инфекции снизилась через пять дней. Таким образом, невозможно было начинать лечение на 5-ый день. В связи с этим модель интрасомальной инъекции была принята для последующих экспериментов и лечение противогрибковыми средствами начинали на пятый день после заражения.
Оценка противогрибковой терапии на интрасомальной модели: нелеченные кролики имели среднюю оценку 16,1±4,1 SD на день 15. Однако кролики, получавшие лечение 0,1% наносомальным Амфотерицином В, имели среднюю оценку 8,6±2,37 SD, что являлось статистически значимым в сравнении с нелеченной группой (p<0,001). Схожим образом группы, получавшие лечение 0,05% наносомальным Амфотерицином В и 0,1% стандартным Амфотерицином В, имели средние оценки 8,8±2,37 SD и 8,4±2,0 SD соответственно.
Процесс выздоровления значительно различался, если кролики получали лечение всеми тремя лекарственными средствами, в сравнении с нелеченной группой, и это было статистически значимо (р<0,001). Однако составная клиническая оценка 0,05% наносомальной лекарственной формы сходна с таковой для 0,1% стандартного лекарственного средства для кератита, вызванного Aspergillus.
Пример 7: опытное доказательство инновационной разработанной «Опосредованной фосфолипидо-холестериновой наносомой кожной доставки Амфотерицина В»
Хорошо известный за отсутствие всасывания через кожу Амфотерицин В имеет ограниченное развитие эффективных лекарственных форм для местного применения, которое преодолели с помощью настоящего изобретения путем инкапсулирования Амфотерицина B в инновационные холестерин/фосфолипидные наносомы. Всасывание и кожная доставка инкапсулированного наносомами Амфотерицина B вполне может быть отнесена к специфическим преимуществам холестерин-фосфолипидных наносом, то есть взаимодействию фосфолипидов с внутриклеточными липидами; присутствию влажности в сочетании с липидами; и изменениям физико-химических свойств, таких как растворимость и разобщенность молекул Амфотерицина В, как требовалось. В дальнейшем, как замечено, достигнутое накопление Амфотерицина B в коже при местном нанесении наносомального Амфотерицина B в инновационной лекарственной форме является одним из самых искомых после схемы для улучшенного взаимодействия лекарственное средство-рецептор, так же как и для продленного действия Амфотерицина В.
Результаты, полученные после исследования поведения при всасывании в кожу и фотографического анализа флюоресцентных маркеров, убедительно указывают на превосходство лекарственной формы наносомального Амфотерицина В по сравнению со стандартно изготовленным кремом Амфотерицина В. Это создает основу для нововведения наносомального Амфотерицина В для местной кожной доставки Амфотерицина В.
Задачи:
Исследование влияния лекарственной формы холестеринсодержащих наносом в физиологическом растворе на кожную доставку Амфотерицина B в сравнении со стандартным кремом Амфотерицина В - Развитие подходящей среды для исследования для исследований по всасыванию,
Разработка способа и валидация для анализа,
Исследования по всасыванию in vitro с помощью диффузионной ячейки Франца,
Определение накопления лекарственное средство-кожа,
Наблюдение за перемещением лекарственного средства (исследования с флюоресцентными маркерами).
Амфотерицин В входит в класс IV лекарственных средств по BCS, следовательно, с трудом всасывается в любой биологический барьер, включая кожу. Разнообразные причины включают следующие:
Специфические проблемы лекарственного средства,
Растворимость,
Разобщение,
Специфические проблемы кожи (жесткий роговой кератиновый барьер),
Взаимодействия лекарственное средство-кожа,
Неправильные взаимодействия из-за разницы в физико-химических свойствах лекарственного средства и кожи.
Несмотря на предыдущие попытки сделать полезным местное нанесение, объемная молекула Амфотерицина В с трудом всасывается через кожу. В результате никому не удавалось успешно достигнуть цели. Основной проблемой молекулы являются ее физико-химические свойства, так же как и кожный барьер. Это обеспечивает обоснование для исследования потенциала наносомальной системы для местной доставки. При этом гипотеза основана на принципе, что лекарственное средство в водно-липидной пузырчатой среде могло бы приобрести другой набор физико-химических свойств для благоприятного взаимодействия, для более глубокого перемещения в кожные слои. Влага внутри пузырьков, вместе с липидной молекулой, играет основную роль в улучшенном переносе лекарственного средства в сравнении со стандартными системами. К тому же встраивание фосфолипидов в липиды кожи помогает построить проводящую среду для улучшенной доставки.
Методика:
Исследования диффузии и накопления - проникновения в кожу Амфотерицина В с помощью различных систем-переносчиков исследовали метом диффузионной ячейки Франца. Эффективная область проникновения для диффузионной ячейки и рецепторной ячейки составила 3,14 см2 и объемы соответствующих ячеек составили 10 мл и 30 мл. Температуру рецепторного раствора поддерживали при 32±1°C. Принимающее отделение содержало Briz-35 (5%) + докузат натрия (DOS) (1%) в дистиллированной воде для условия улучшенного погружения.
Кожу с брюшины мышей-самцов Laca (возрастом 4-6 недель) подготовили для микроскопического исследования, после удаления волос и обезжиривания кожи, между донорным и рецепторным отделом. Лекарственную форму, эквивалентную 358,5 мкг (наносомального/стандартного крема), нанесли на донорный отдел после достижения равновесия между кожей и средой погружения в течение 2 часов. Образцы (1 мл) отбирали с помощью отверстия для отбора проб рецепторного отдела с замещением в заранее определенный промежуток и анализировали на УФ-спектрофотометре после соответствующего разведения.
Исследование перемещения с флюоресцентными маркерами - собственный характер флуоресценции Амфотерицина В использовали для наблюдения за перемещением и местонахождением лекарственного средства с течением времени. Мышей Laca побрили с помощью крема для удаления волос за день до исследования. С мышей гуманно сняли кожу в заранее определенный промежуток, и кожу сразу же промыли PBS pH 7,4 и до изготовления криомикросрезов хранили в 10% формалине при -20°С. Срезы рассматривали в флюоресцентный микроскоп с фильтром F2.
Результаты наблюдений
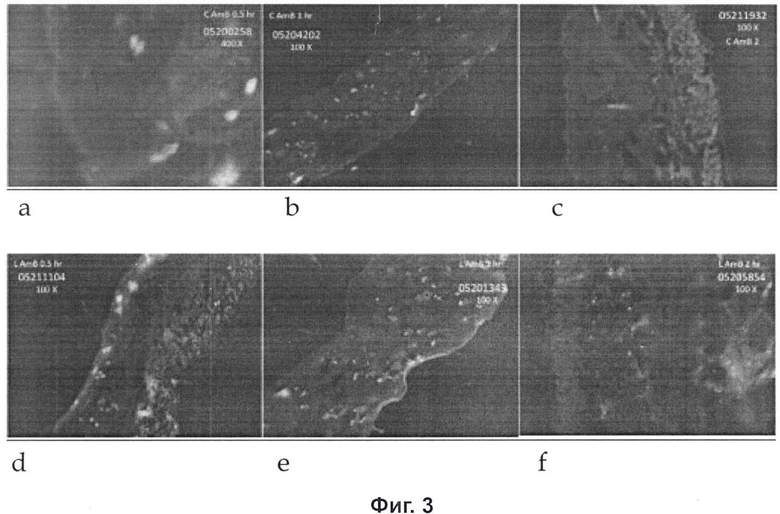
Исследования диффузии и накопления - был опробован ряд систем растворителей и в конечном итоге в качестве среды погружения выбрали систему, состоящую из Briz-35 (5%) + докузат натрия (1%). Задачей данного исследования было оценить прохождение, накопление и проникновение лекарственного средства через, в и сквозь слои кожи соответственно. Главным наблюдением данного исследования является то что существует значительное накопление лекарственного средства в слоях кожи после наносомального нанесения (то есть 1,291±0,04) по сравнению со стандартным кремом (0,142±0,05). Однако, что касается проникновения, лекарственное средство Амфотерицин В было не в состоянии проникнуть сквозь слои кожи (как случае наносомальных, так и стандартных систем), что является малозначимым, как показано на Фиг.3.
Фиг.3 иллюстрирует флуоресцентный поперечный срез кожи после нанесения (а) стандартного крема Амфотерицина B в 0,5 часа; (b) стандартного крема Амфотерицина B в 1,0 час; (с) стандартного крема Амфотерицина B в 2,0 часа; (d) лекарственной формы наносомального Амфотерицина B в 0,5 часа (е) лекарственной формы наносомального Амфотерицина B в 1,0 час (f) лекарственной формы наносомального Амфотерицина B в 2,0 часа.
Исследование перехода с флюоресцентным маркером - Исследование с флюоресцентным маркером (после нанесения стандартной и наносомальной лекарственных форм) для наблюдения за проникновением лекарственного средства в слой кожи показано на Фиг.1. Оно включает в себя наблюдение в различные промежутки времени, то есть 0.5, 1.0, 2.0 часов. Исследование обнаружило существенные различия на этих интервалах. Наиболее заметную разницу находили через 2 часа исследования.
Результат исследований характера прохождения (диффузионная ячейка Франца) и исследований проникновения (гистологические исследования кожи с флуоресцентным маркером) указывает на способность пузырьков наносом улучшать доставку Амфотерицина В. Как показали данные по накоплению лекарственного средства, так же как и 2-часовой снимок гистологии кожи, Амфотерицин В, содержавшийся в наносомах, способен проходить в значительной степени по сравнению со стандартной лекарственной фирмой. Небольшое проникновение наносомального Амфотерицина В, как и стандартной лекарственной формы, показывает, что лекарственное средство не проходит через кожу и не подходит для трансдермальной доставки лекарственного средства Амфотерицина В. В последующем Амфотерицин B в наносоме показал хороший потенциал для кожной доставки. Небольшое проникновение даже является преимуществом, так как не позволяет Амфотерицину В всасываться системно.
| название | год | авторы | номер документа |
|---|---|---|---|
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, ВКЛЮЧАЮЩАЯ ПРОИЗВОДНОЕ ФЕНИЛАМИДИНА, И СПОСОБ ПРИМЕНЕНИЯ ФАРМАЦЕВТИЧЕСКОЙ КОМПОЗИЦИИ В КОМБИНАЦИИ С ПРОТИВОГРИБКОВЫМ СРЕДСТВОМ | 2007 |
|
RU2429843C2 |
| ЛЕЧЕНИЕ МИКОЗОВ | 2005 |
|
RU2380116C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМБИНАЦИЯ И СПОСОБ ПРИМЕНЕНИЯ ПРОТИВОГРИБКОВОГО СРЕДСТВА В КОМБИНАЦИИ | 2006 |
|
RU2396955C2 |
| СПОСОБ ТЕРАПИИ ПОВЕРХНОСТНЫХ МИКОЗОВ | 2020 |
|
RU2749481C1 |
| Лекарственное средство для лечения резистентного грибкового кератита и способ его применения | 2022 |
|
RU2790703C1 |
| КОМБИНАЦИЯ ВОРИКОНАЗОЛА И ПРОТИВОГРИБКОВОГО ИНГИБИТОРА CYP2C19 | 2005 |
|
RU2345769C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ЛЕЧЕНИЯ РИНОСИНУСИТА | 2004 |
|
RU2410083C2 |
| СПОСОБ ПОЛУЧЕНИЯ СИСТЕМЫ ДОСТАВКИ ВОДОНЕРАСТВОРИМЫХ И ПЛОХОРАСТВОРИМЫХ БИОЛОГИЧЕСКИ АКТИВНЫХ ВЕЩЕСТВ И ЛЕКАРСТВЕННАЯ ФОРМА НА ЕЕ ОСНОВЕ | 2006 |
|
RU2325151C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ЛЕЧЕНИЯ МУКОРМИКОЗА И ДРУГИХ ГРИБКОВЫХ ЗАБОЛЕВАНИЙ | 2007 |
|
RU2464024C2 |
| КОМБИНАЦИЯ ФУЛЬВОВОЙ КИСЛОТЫ ДЛЯ ЛЕЧЕНИЯ РАЗЛИЧНЫХ СОСТОЯНИЙ И БОЛЕЗНЕЙ | 2010 |
|
RU2535037C2 |
Изобретение относится к области медицины. Лекарственная форма для лечения грибковых инфекций содержит наносомы холестеринсодержащего Амфотерицина В с диаметром в пределах 20-200 нм в физиологическом растворе, соотношение липида к Амфотерицину В варьирует от 45:1 до 45:15. Амфотерицин В подвергают разрушению ультразвуком на конечном этапе для преобразования частиц в более мелкие и менее ламеллярные наносомы. Изобретение обеспечивает сниженную нефротоксичность и эффективную противогрибковую активность. 2 з.п. ф-лы, 11 табл., 3 ил., 7 пр.
1. Лекарственная форма для лечения грибковых инфекций, содержащая наносомы холестеринсодержащего Амфотерицина В с диаметром в пределах 20-200 нм в физиологическом растворе.
2. Лекарственная форма по п.1, в которой соотношение липида к Амфотерицину В варьируется от 45:1 до 45:15.
3. Лекарственная форма по п.1, в которой Амфотерицин В подвергают разрушению ультразвуком на конечном этапе для преобразования частиц в более мелкие и менее ламеллярные наносомы.
| ROJANAPANTHUP at al | |||
| Physicochemical properties of amphotericin В liposomes preparated by reverse-phase evaporation method// Drug | |||
| Dev | |||
| Pharm | |||
| Способ и приспособление для нагревания хлебопекарных камер | 1923 |
|
SU2003A1 |
| US 5874104 A, 23.02.1999 | |||
| ЧАСТИЦЫ ЛЕКАРСТВЕННОГО ВЕЩЕСТВА, СПОСОБ ИХ ПОЛУЧЕНИЯ, СТАБИЛЬНАЯ ДИСПЕРСИЯ, СРЕДСТВО, СОДЕРЖАЩЕЕ ЛЕКАРСТВЕННОЕ ВЕЩЕСТВО В ВИДЕ ЧАСТИЦ | 1992 |
|
RU2066553C1 |
| СПОСОБ ЛЕЧЕНИЯ ГЕНЕРАЛИЗОВАННЫХ ИНФЕКЦИЙ, ВЫЗЫВАЕМЫХ БАКТЕРИЯМИ, ИЛИ ЗАБОЛЕВАНИЙ, ВЫЗЫВАЕМЫХ ГРИБАМИ И ПРОСТЕЙШИМИ, ИЛИ АТЕРОСКЛЕРОЗА, ИЛИ САХАРНОГО ДИАБЕТА, ИЛИ ЗАБОЛЕВАНИЙ, СВЯЗАННЫХ С РЕАКЦИЕЙ ГИПЕРЧУВСТВИТЕЛЬНОСТИ ЗАМЕДЛЕННОГО ТИПА, ИЛИ ЗАБОЛЕВАНИЙ, ОБУСЛОВЛЕННЫХ МУТАЦИЯМИ ГЕНОВ СОМАТИЧЕСКИХ КЛЕТОК | 2004 |
|
RU2269358C2 |
| RU 2139046 C1, 10.10.1999 | |||
| Преобразователь напряжения | 1983 |
|
SU1252885A1 |
| US 0007078015 B2, 18.07.2006. | |||
Авторы
Даты
2013-05-10—Публикация
2010-03-04—Подача