Группа изобретений в целом относится к лечению инфекционных заболеваний. Более конкретно заявляемая группа изобретений относится к офтальмологии и может быть использована в лечении резистентного грибкового кератита.
Инфекционный кератит характеризуется воспалением роговицы и может быть вызван бактериями, грибами, вирусами или паразитами. Несмотря на наличие современных методов лечения, кератиты разной этиологии приводят к формированию грубых помутнений роговицы, сопровождающихся рефракционными нарушениями и снижающих остроту и качество зрения пациентов. Грибковый кератит - это инфекционно-воспалительное заболевание роговицы, возникающее вследствие инвазии патогенных грибов и представляющее серьезную проблему практической офтальмологии в связи с гиподиагностикой, тяжелым течением, сложной и длительной терапией с не всегда благоприятным исходом, так как часто приводит к помутнению роговицы, слепоте и даже гибели глазного яблока. В 15-27% случаев грибкового кератита консервативное лечение, включающее местное и системное применение антимикотических препаратов, является неэффективным и пациентам требуется радикальные методы хирургического лечения.
На территории Российской Федерации не имеется специализированных препаратов для топического (местного) лечения резистентного грибкового кератита. Однако в офтальмологической практике off-label (по показаниям, не утвержденным государственными регулирующими органами) применяются растворы различных противогрибковых препаратов. Например, раствор Амфотерицина В в различных концентрациях (0,05-0,5%), который обладает большей чувствительностью в отношении дрожжевых грибов (Candida spp.) [1, 2]. Для получения 0,25% раствора Амфотерицина В коммерчески доступный лиофилизат для приготовления раствора для инфузий 50 мг разводят в 20 мл 5% раствора глюкозы. Флакон следует встряхивать до полного растворения препарата. Допустимо использование только прозрачного раствора; в случае образования крупных частиц раствор следует утилизировать. Полученный раствор хранится не более 24 часов при температуре 2-8°. С в том, случае, если он был приготовлен в контролируемых асептических условиях. Рекомендуются инстилляции каждые 30 минут в течении первых 24 часов, далее с постепенным уменьшением кратности в зависимости от терапевтического ответа [3].
Действие Амфотерицина В обусловлено связыванием эргостерола и вследствие этого лизисом клеточной стенки. Недостатком применения Амфотерицина В при лечении грибкового кератита является низкая проницаемость препарата в ткани глаза как при системном, так и при местном применении.
В отношении мицелиарных (плесневелых) грибов (Fusarium spp.) большей чувствительностью обладает 1% раствор Вориконазола [4]. 1 % раствор Вориконазола получают путем добавления 20 мл дистиллированной воды к 200 мг Вориконазола в коммерчески доступной форме лиофилизата для приготовления раствора для инфузий [5]. Флакон следует встряхивать до полного растворения препарата. Допустимо использование только прозрачного раствора; в случае образования крупных частиц раствор следует утилизировать. Полученный раствор хранится не более 24 часов при температуре 2-8°. С в том, случае, если он был приготовлен в контролируемых асептических условиях. Рекомендуются инстилляции каждый час в течении первых 24 часов с постепенным уменьшением кратности в зависимости от терапевтического ответа. Продолжительность лечения может доходить до 4-6 недель [6].
Антимикотическое действие Вориконазола обусловлено ингибированием образованием эргостерола, одного из компонентов клеточной стенки грибов, путем воздействия на процесс деметилирования фермента 14α-ланостерола. Недостатками лекарственного средства и его применения является наличие у грибов нескольких механизмов резистентности к препарату (активация систем выведения из клетки, точечная мутация гена - мишени), особенно развитых у Candida spp., но также и у других видов.
В связи с чем существует потребность в более эффективных способах лечения грибкового кератита, особенно в случаях, когда болезнь вызвана микроорганизмами, обладающими множественной лекарственной устойчивостью к антимикотикам. Кроме того, резистентные грибковые кератиты как правило приводят к функциональной и анатомической потере глаза.
В этих случаях особый интерес представляет терапия воспалительных заболеваний с использованием квантовых точек.
Квантовые точки представляют собой полупроводниковые нанокристаллы размером несколько нанометров (нм) с контролируемыми оптическими и электронными свойствами, за счет изменения их размера, морфологии и покрытия. Диаметр ядра, количество оболочек (одна, две, три) на поверхности квантовой точки, характер пассивации (покрытие на границе раздела ядра и оболочки для устранения электронных ловушек, как правило, за счет материала с большей шириной энергии запрещенной зоны), функционализации (специфического покрытия для связывания с биологически активными молекулами, белками, пептидами, нуклеиновыми кислотами - так называемое биоконъюгирование), позволяют использовать их в различных областях науки и техники.
Путем изменения состава, формы и размера фотовозбужденного носителя заряда, в качестве которого выступает квантовая точка и модуляции положения зоны проводимости и валентной зоны, можно осуществить избирательное возмущение окислительно-восстановительного гомеостаза в клеточной среде (грибковой клетке), тем самым создав субстрат для так называемой «световой терапии».
Одним из направлений в борьбе с мультирезистентной микрофлорой, является использование комбинации антиинфекционных агентов и фотоактивированных квантовых точек для увеличения потенциала активности используемых химиотерапевтических агентов. Таким образом, квантовые точки способны выступать в качестве нарушителя электронно-транспортной цепи грибковой клетки. Механизм действия квантовых точек выглядит следующим образом: фотосенсибилизированная (чрезвычайно реакционно активная) источником света определенной длины волны квантовая точка имеет на своей поверхности не спаренные электроны, которые выступают в качестве донора для молекулярного кислорода, трансформируя его в активные формы кислорода (АФК), которые в свою очередь обладают высокоспецифичным узконаправленным действием на внутриклеточные кластеры оксида железа и серы, разрушая нормальную внутриклеточную окислительно-восстановительную среду, необходимую для нормального функционирования патогенного микроорганизма.
Таким образом, проблема, на решение которой направлена заявляемая группа изобретении - разработка лекарственного средства и способа его применения, позволяющие достичь полного излечения резистентного грибкового кератита.
Техническим результатом заявляемой группы изобретений является расширение арсенала средств для борьбы с резистентным грибковым кератитом, полное излечение резистентного грибкового кератита.
В заявляемой группе изобретений предлагается эффективный подход к лечению кератитов, вызванных грибками рода Candida spp. и Fusarium spp., основанные на новых результатах, полученных путем добавления квантовых точек к известным противогрибковым препаратам, что ведет к полному излечению грибковых инфекций роговицы.
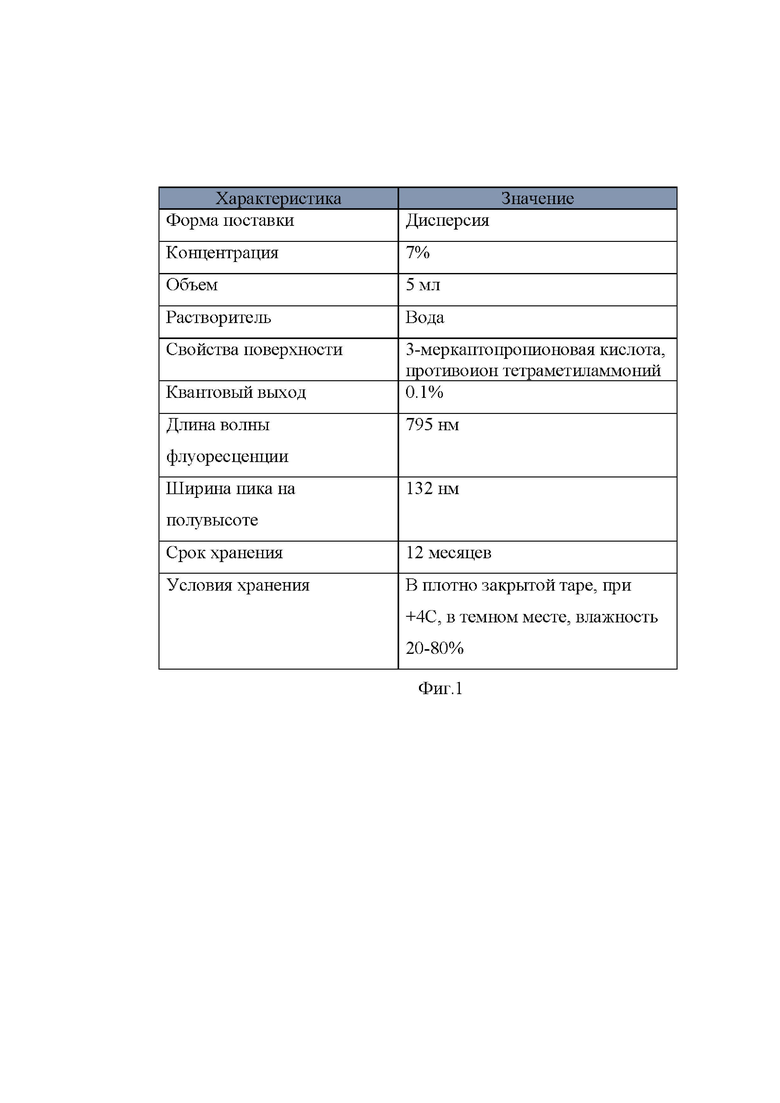
Сущность изобретения в отношении заявляемого продукта заключается в том, что лекарственное средство для лечения резистентного грибкового кератита биоконьюгат из 7% водной дисперсии квантовых точек группы Ag 10%:InP/ZnS с квантовым выходом 0,1% и длиной волны 795 нм и водного раствора противогрибкового препарата в пропорции 1:69.
Сущность изобретения в отношении заявляемого способа лечения резистентного грибкового кератита заключается в том, что вводят местно лекарственное средство, содержащее водный раствор из квантовых точек группы Ag(10%):InP/ZnS и противогрибковый препарат в количестве 0,05 мл, в конъюнктивальную полость глаза каждый час до полного подавления воспалительного процесса.
Группа изобретений поясняется чертежами.
На фиг. 1 показаны технические характеристики квантовых точек группы Ag(10%):InP/ZnS 795
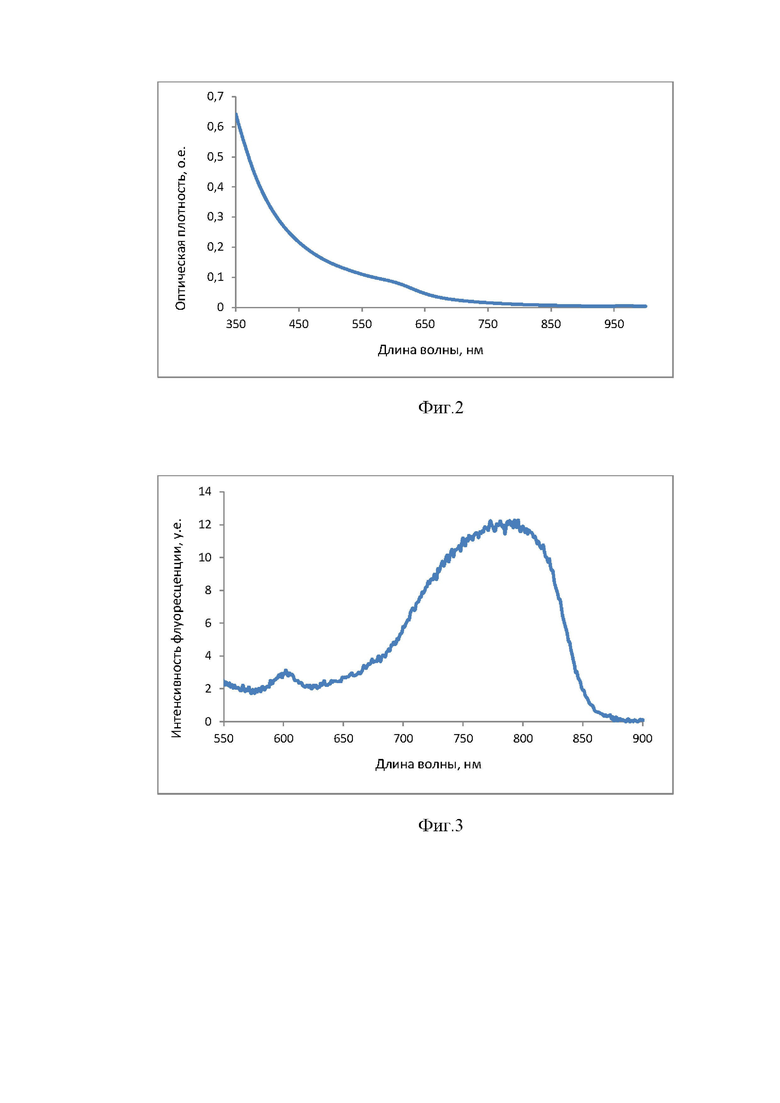
На фиг. 2 показан спектр поглощения квантовых точек группы Ag(10%):InP/ZnS 795
На фиг. 3 показан спектр флуоресценции Ag(10%):InP/ZnS 795
Пример 1 (синтез квантовых точек)
Спектральные и физико-химические требования, предъявляемые к квантовым точкам, для последующего использования в офтальмологии были следующими:
- потенциальные квантовые точки прежде всего должны содержать не менее 1% серебра в своем составе, для возможности потенциального антифунгального эффекта [7]
- иметь размер не более 5 нм (2-3 оболочки), для возможности обеспечения прохождения через клеточную мембрану потенциального возбудителя инфекции и обладать реакционогенностью;
- в составе квантовых точек не должны присутствовать потенциальные полупроводники, обладающие возможными токсическими свойствами во время полураспада молекулы;
- в качестве растворителя должна использоваться вода, для потенциальной возможности эпибульбарного использования;
- квантовый выход флуоресценции не должен превышать 0,5 %, являясь индикатором потенциальной возможности образования АФК (квантовый выход равный 1 стремится к образованию вотона, в ответ на каждый поглощенный, что нивелирует участие свободных электронов на внешнем энергетическом уровне квантовых точек в окислительно-восстановительных реакциях).
- широкий спектр поглощения световых волн для возможности их активации любым источником освещения, в том числе в видимой области спектра;
- узкий спектр флуоресценции, смещенный в инфракрасный диапазон, для минимизации токсического повреждения интраокулярных структур после активации и индукционного возбуждения фоторецептеров;
- полная растворимость в воде, для минимизации не запланированных физических взаимодействий, после интраокулярной имплантации;
- свойства поверхности: меркаптопропионовая кислота, бифункциональная молекула, содержащая как карбоновую кислоту, так и тиоловые группы. Позволяет минимизировать самоадгезию квантовых точек.;
- функционализация: карбоксильная группа - COOH, позволяющая формировать химически активные соединения при взаимодействии с активными молекулами;
Используемые реактивы: октадецен (Fluka, 90%), селен (Merck, 99%), теллур (Aldrich, 99,8%), олеиламин (90 %, Sigma), метанол (HPLC), триоктилфосфин (Sigma, 90%), ацетат цинка (Sigma, 99%), трис-(диэтиламино)фосфин (Aldrich, 97%), 3-меркаптопропионовая кислота (Enamine, 95%). Остальные реагенты были химически чистые.
Спектры поглощения образцов измеряли на спектрофотометре UV-Vis-NIR Cary 5000 (с шагом 1 нм). Спектры фотолюминесценции измеряли на спектрофлуориметре HORIBA Fluorolog-3.
Синтез проводили в соответствии с методикой [8]. Солюбилизацию в водную фазу проводили с использованием 3-меркаптопропионовой кислоты. Модификацию и очистку образцов проводили по методике [9]. Полученные растворы экспортировались как бактериологически чистые.
Квантовые точки в соответствии с техническим заданием представляют собой 7% водную дисперсию с квантовым выходом 0,1%, определяющим потенциальную способность к выработке АФК. Квантовые точки содержат в своем составе биологически инертные полупроводники, имеют широкий спектр поглощения, который определяет их активность в видимой области спектра. Спектр флуоресценции смещен в инфракрасную область.
Поверхность квантовых точек функционализирована 3-меркаптопропионовой кислотой, для повышения их физической стабильности при взаимодействии с биологическим окружением.
Пример 2 (Оценка токсичности синтезированных квантовых точек)
Для оценки токсичности синтезированных квантовых точек производилось их инстилляции в конъюнктивальную полость лабораторным кроликам породы Шиншилла, мужского пола, весом 3,5 кг. Кролики получали инстилляции в конъюнктивальный мешок в объеме 0,05 мл 7% Ag(10%):InP/ZnS 795 раствора квантовых точек. Оценка токсического повреждения зрительного анализатора осуществлялась с помощью клинического наблюдения через 7 суток после инстилляции, а также проведения осмотра состояния роговицы и фоторегистрации с помощью фотощелевой лампы. Раствор квантовых точек Ag(10%):InP/ZnS 795 в концентрации 7% не вызывали клинических изменений со стороны зрительного анализатора (отсутствие роговичного, воспалительного, токсико-аллергического синдрома).
Пример 3 (Создание биоконъюгатов на основе квантовых точек и противогрибковых препаратов, используемых в лечении резистентного грибкого кератита).
Для создания биоконъюгатов производились следующие действия. В качестве противогрибковых средств были использованы: раствор Амфотерицина В 0,25% или раствор Вориконазола 1% 7 мл для эпибульбарного применения и квантовые точки 7% Ag(10%):InP/ZnS 795. Методика подготовки биоконъюгатов заключалась в удалении 0,1 мл нативного раствора Вориконазола или Амфотерицина В с введением замещающего 7% масс. Коллоидного раствора квантовых точек Ag(10%):InP/ZnS 795 в объеме 0,1 мл (таким образом, получалась 0,1% концентрация раствора квантовых точек в растворе антимикотика - биоконъюгата). На завершающем этапе выполнялось механическое перемешивание полученной суспензии на лабораторном шейкере.
Были получены следующие конъюгаты:
Ag(10%):InP/ZnS 795 0,1% + Амфотерицин В 0,25% общим объемом 7 мл.
Ag(10%):InP/ZnS 795 0,1% + Вориконазол 1% общим объемом 7 мл.
Пример 4 (Моделирование и лечение резистентного грибкового дрожжевого кератита с использованием биоконъюгата из квантовых точек Ag(10%):InP/ZnS 795 0,1% и Амфотерицин В 0,25%)
В клиническую модель возбудителей острого кератита вошли резистентные штаммы грибов рода Candida spp.
Ход оперативного вмешательства:
На правых глазах животных в условиях операционной ветеринарной клиники с офтальмологическим профилем ООО «Здоровье животных» под операционным микроскопом с соблюдением всех правил асептики инициировался грибковый кератит, путем центральной скарификации эпителия роговицы с нанесением радиальных разрезов до десцеметовой оболочки после тугого пеленания и предварительной эпибульбарной анестезии проксиметакаином гидрохлоридом 0,5 %. Для дополнительной индукции иммунного ответа также выполнялось вскрытие лимбальной конъюнктивы на протяжении трехчасовых меридианов в височном секторе.
В качестве индуктора воспаления была взята культура различных штаммов грибка Candida (С.albicans, C.glabrata, C.tropicalis, C.parapsilosis), выделенная из клинического материала ГАУЗ СО «Клинико-дигностический центр», г. Екатеринбург. Вся совокупность микобиоты проявляла свойства множественной устойчивости к антифунгальным препаратам. Для приготовления инокулюма использовали суточные культуры исследуемых Candida spp. Мутность инокулюма соответствовала 0,5 McFarland (1×106 - 5×106 клеток/мл). Контроль оптической плотности суспензии осуществляли спектрофотометрически (денситометрически). Инокулюм использовали в течение 1-3 мин после приготовления. Нож для основного разреза погружался в инокулюм с последующим введением в структуры роговицы.
Завершение подготовительного этапа заключалось в разделении лабораторных животных на 2 группы по 4 кролика в каждой. Кролики первой группы после манефестации клинической картины грибкового кератита получали инстилляции раствора Амфотерицина В 0,25% в конъюнктивальный мешок каждые 30 мин на протяжении первых суток от возникновения симптомов, далее с постепенным уменьшением частоты инстилляций в период до 2-х недель наблюдения (как рекомендовано в литературе). Кролики второй группы получали инстилляции биоконъюгата (Ag(10%):InP/ZnS 795 0,1% + Амфотерицин В 0,25%), каждый час на протяжении 7 дней до полного исчезновения признаков воспалительного процесса.
В течение 5 суток после введения инокулюма в строму роговицы правых глаз лабораторных животных клинические проявления инфильтрации роговицы во всех случаях отсутствовали.
На 6-7 сутки динамического наблюдения у всех лабораторных животных были выявлены клинические признаки грибкового дрожжевого кератита, которые сопровождались гиперемией и инфильтрацией роговицы в месте ее индуцированного повреждения. Этот период явился стартовым для начала проведения противогрибковой терапии по вышеописанной схеме.
На 9-10 сутки динамического наблюдения у лабораторных животных получавших биоконъюгат был выявлен значительный регресс клинических проявлений, который проявлялся в уменьшении площади и интенсивности инфильтрации роговицы. В группе лабораторных животных, получавших инстилляции Амфотерицина В, не наблюдалось признаков ответа на проводимую терапию, наблюдалось прогрессирование инфекционного процесса.
Начиная с 11 суток динамического наблюдения за лабораторными животными, в группе кроликов, получивших эпибульбарные инстилляции биоконъюгатом был выявлен полный регресс клинической симптоматики со стороны роговицы - полная резолюция инфильтрата, с остаточной ограниченной «облаковидной запыленностью». В группе кроликов, получавших инстилляции чистого Амфотерицина В, положительной динамики в отношении обратного развития симптомов выявлено не было, в связи с чем было принято решение начать инстилляции биоконъюгатом в данной группе наблюдения.
Пример 5 (Моделирование и лечение резистентного грибкового плесневого кератита с использованием биоконъюгата из квантовых точек Ag(10%):InP/ZnS 795 0,1% и Вориконазола 1%)
В клиническую модель возбудителей острого кератита вошли резистентные штаммы грибов рода Fusarium spp.
Ход оперативного вмешательства:
На правых глазах животных в условиях операционной ветеринарной клиники с офтальмологическим профилем ООО «Здоровье животных» под операционным микроскопом с соблюдением всех правил асептики инициировался грибковый кератит, путем центральной скарификации эпителия роговицы с нанесением радиальных разрезов до десцеметовой оболочки после тугого пеленания и предварительной эпибульбарной анестезии проксиметакаином гидрохлоридом 0,5%. Для дополнительной индукции иммунного ответа также выполнялось вскрытие лимбальной конъюнктивы на протяжении трехчасовых меридианов в височном секторе.
В качестве индуктора воспаления была взята культура различных штаммов грибка Fusarium (F.oxysporum, F.solani), выделенная из клинического материала ГАУЗ СО «Клинико-дигностический центр», г. Екатеринбург. Вся совокупность микобиоты проявляла свойства множественной устойчивости к антифунгальным препаратам. Для приготовления инокулюма использовали суточные культуры исследуемых Fusarium spp. Мутность инокулюма соответствовала 0,5 McFarland (1×106 - 5×106 клеток/мл). Контроль оптической плотности суспензии осуществляли спектрофотометрически (денситометрически). Инокулюм использовали в течение 1-3 мин после приготовления. Нож для основного разреза погружался в инокулюм с последующим введением в структуры роговицы.
После процедуры внесения инокулюма лабораторные животные были разделены на 2 группы по 4 кролика в каждой. Первой группе лабораторных животных после манефестации клинической картины грибкового кератита планировалось проведение лечения с помощью инстилляций раствора Вориконазола 1% каждый час на протяжении первых суток, далее с постепенным уменьшением кратности инстилляций в зависимости от ответа на лечение. Кролики второй группы получали инстилляции биоконъюгата (Ag(10%):InP/ZnS 795 0,1% + Вориконазола 1%), каждый час на протяжении 7 дней до полного исчезновения признаков воспалительного процесса.
В течение первых суток после введения инокулюма в строму роговицы правых глаз лабораторных животных клинические проявления инфильтрации роговицы во всех случаях отсутствовали.
На 2-3 сутки динамического наблюдения у всех лабораторных животных были выявлены клинические признаки грибкового фузариозного кератита, которые сопровождались гиперемией и появление обширной инфильтрацией роговицы, выходящей за пределы ее индуцированного повреждения. Этот период явился стартовым для начала проведения противогрибковой терапии по вышеописанной схеме.
На 4-5 сутки динамического наблюдения у лабораторных животных получавших биоконъюгат был выявлен значительный регресс клинических проявлений, который проявлялся в уменьшении площади и интенсивности инфильтрации роговицы в сравнении с группой лабораторных животных, получавших инстилляции Вориконазола 1%.
Начиная с 7-8 суток динамического наблюдения за лабораторными животными, в группе кроликов, получивших эпибульбарные инстилляции биоконъюгатом был выявлен полный регресс клинической симптоматики со стороны роговицы - полная резолюция инфильтрата, с остаточной ограниченной «облаковидной запыленностью». В группе кроликов, получавших инстилляции чистого Вориконазола, положительной динамики в отношении обратного развития симптомов выявлено не было. На 9 сутки было принято решение перевести кроликов из данной группы на лечение биоконъюгатом, что к 14 суткам наблюдений привело к регрессу инфекционного процесса.
Список литературы:
1. Tran KD, Aldrich BT, D’Amato Tóthová J, Greiner MA. Efficacy and Safety of Various Amphotericin B Concentrations on Candida albicans in Cold Storage Conditions. Cornea. 2020 Jan; 39(1):110-117. doi: 10ю1097/ICO.0000000000002019. PMID:31206398.
2. Gilherme G, Newton K, Rosane S. Antifungals in eye infections: drugs and routes of administration. Rev Bras Oftalmol.2013; 72(2):132-141. Doi:10.1590/S0034-72802013000200014.
3. Ross M. Fungal Keratitis. Jul 19, 2019. Accessed 10.09.19 https://emedicine.medscape.com/article/1194167-overview.
4. Al-Badriyeh D, Neoh CF, Stewart K, Kong DC. Clinical utility of voricanazole eye drops in ophthalmic fungal keratitis. Clin Ophthalmol. 2010 May 6; DOI: 10.2147/OPTH.S6374.
5. Bhadange, Yogesh et al. «Review of doses of important drugs in ophthalmology» The Official Scientific Journal of Delhi Ophthalmological Society 21 (2011): 23-27.
6. Давлетшина Н.И., Самойлов А.Н. Эпидемиология и методы лечения грибковых кератитов. Вестник офтальмологии. 2020; 136(4):138-145.
7. Mohan M., Gupta S.K., Karla V.K., Vajpayee R.B., Sachdev M.S. Tropical silver sulphadiazine: a new drug for ocular keratomycosis. Br J Ophthalmol 1988; 72: 192-195.
8. Jo J.H., Jo D.Y., Lee S.H. et al. InP-Based Quantum Dots Having an InP Core, Composition-Gradient ZnSeS Inner Shell, and ZnS Outer Shell with Sharp, Bright Emissivity, and Blue Absorptivity for Display Devices. ACS Applied Nano Materials. 2020; 3 (2): 1972-1980. DOI: https://doi.org/10.1021/acsanm.0c00008.
9. Pong B.K., Trout B.L.. LeeLangmuir J.Y. Modified Ligand-Exchange for Efficient Solubilization of CdSe/ZnS Quantum Dots in Water: A Procedure Guided by Computational Studies. 2008; 24(10): 5270-5276. DOI:10.1021/la703431j.
| название | год | авторы | номер документа |
|---|---|---|---|
| Лечение резистентного бактериального кератита с помощью квантовых точек | 2022 |
|
RU2831782C2 |
| Лечение резистентного бактериального кератита с помощью мягкой контактной линзы на квантовых точках | 2023 |
|
RU2811935C1 |
| Лечение резистентного острого эндофтальмита с помощью квантовых точек | 2021 |
|
RU2803055C2 |
| Способ лечения грибковой язвы роговицы | 2021 |
|
RU2802388C2 |
| НОВАЯ ЛЕКАРСТВЕННАЯ ФОРМА ДЛЯ ЛЕЧЕНИЯ ГРИБКОВОЙ ИНФЕКЦИИ | 2010 |
|
RU2481100C2 |
| Способ лечения грибкового кератита после сквозной кератопластики | 2022 |
|
RU2820070C2 |
| СПОСОБ ЛЕЧЕНИЯ ИНФЕКЦИОННЫХ КЕРАТИТОВ | 2007 |
|
RU2352367C1 |
| Гелеобразные капли для лечения воспалительных заболеваний глаз, включая инфекционные, устойчивые к антибиотикам | 2017 |
|
RU2669768C1 |
| Способ создания экспериментальной модели грибкового кератита у кроликов | 2020 |
|
RU2746647C1 |
| Способ лечения микозных язв роговицы | 2021 |
|
RU2782494C1 |
Группа изобретений относится к офтальмологии, а именно к лечению резистентного грибкового кератита. Лекарственное средство для лечения резистентного грибкового кератита содержит биоконъюгат из 7% водной дисперсии квантовых точек группы Ag 10%:InP/ZnS с квантовым выходом 0,1% и длиной волны 795 нм и водного раствора противогрибкового препарата в пропорции 1:69. Способ лечения резистентного грибкового кератита, включающий местное введение вышеописанного лекарственного средства в количестве 0,05 мл в конъюнктивальную полость глаза каждый час до полного подавления воспалительного процесса. Вышеописанное средство и способ эффективны для лечения резистентного грибкового кератита. 2 н. и 3 з.п. ф-лы, 3 ил., 5 пр.
1. Лекарственное средство для лечения резистентного грибкового кератита содержит биоконъюгат из 7% водной дисперсии квантовых точек группы Ag 10%:InP/ZnS с квантовым выходом 0,1% и длиной волны 795 нм и водного раствора противогрибкового препарата в пропорции 1:69.
2. Лекарственное средство по п. 1, отличающееся тем, что в качестве водного раствора противогрибкового препарата используется 0,25% раствор Амфотерицина В.
3. Лекарственное средство по п. 1, отличающееся тем, что в качестве водного раствора противогрибкового препарата используется 1% раствор Вориконазола.
4. Способ лечения резистентного грибкового кератита, включающий местное введение лекарственного средства по п. 1 в количестве 0,05 мл в конъюнктивальную полость глаза каждый час до полного подавления воспалительного процесса.
5. Способ лечения по п. 4, отличающийся тем, что лекарственное средство по п. 1 представлено в виде капель.
| ДАВЛЕТШИНА Н.И | |||
| и др | |||
| Способ восстановления спиралей из вольфрамовой проволоки для электрических ламп накаливания, наполненных газом | 1924 |
|
SU2020A1 |
| Регулятор для ветряного двигателя в ветроэлектрических установках | 1921 |
|
SU136A1 |
| Прибор для определения всасывающей силы почвы | 1921 |
|
SU138A1 |
| ВОХМИНЦЕВ А.С | |||
| и др | |||
| Оценка офтальмотоксического воздействия квантовых точек и биоконъюгатов на их основе в аспекте перспектив лечения резистентных эндофтальмитов | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
Авторы
Даты
2023-02-28—Публикация
2022-09-02—Подача