Изобретение относится к области получения биосовместимых покрытий на поверхностях твердых тел, конкретно к способам получения белковых покрытий на поверхностях, содержащих ионы металлов переменной валентности. Изобретение может быть использовано в медицине, ветеринарии, в производстве косметических и гигиенических средств, а также в других областях техники, где необходимо нанесение белковых покрытий на металлические твердые тела, например частицы, пленки, мембраны.
Одно из актуальных медицинских применений изобретения - создание на основе магнитных наночастиц систем векторной доставки лекарственных и биологически активных препаратов. Необходимым этапом в технологии создания таких систем является формирование на поверхности частиц полифункционального биосовместимого покрытия, предназначенного для связывания подлежащих доставке биологически активных веществ. Наиболее удобно в качестве покрытий использовать белки, характеризующиеся высокой биосовместимостью и полифункциональностью, способностью придать поверхностям твердых тел физическую и химическую стабильность и инертность при физиологических условиях. Белковые покрытия защищают частицы от внешнего воздействия, в частности, обеспечивают защиту магнитного ядра и предотвращают непосредственный контакт поверхности металла с кровью, чреватый неконтролируемой активацией белков системы свертывания крови, приводящей к нежелательной активации иммунной системы, адгезии тромбоцитов и тромбообразованию. Формирование белковых покрытий на поверхности стабилизирует коллоидные суспензии, частицы которых не агрегируют, не диссоциируют, химически не взаимодействуют с растворителем.
Известен способ получения белкового покрытия на наночастицах Fe3O4-γFe2O3, который включает введение в систему белка, в частности трипсина, в водном растворе при температуре 4°С и при значении рН раствора, близкому к нейтральному, на стадии получения магнитных частиц [Nishimura K., Hasegawa M., Ogura Y., Nishi T., Kataoka K., Handa H., Abe M. 4°С preparation of ferrite nanoparticles having protein molecules immobilized on their surfaces. J.Appl. Phys. 2002. V.91. P.8555-8556]. Способ не предполагает закрепления белков на поверхности, поэтому макромолекулы белков могут десорбироваться с поверхности наночастиц, что является недостатком способа.
Известен способ создания на магнитных частицах полимерных покрытий, содержащих иммобилизованные биологические компоненты, в том числе белки, энзимы [JP 63005019, опубл. 11.01.1988]. На поверхность частиц наносят связывающий молекулярный слой, содержащий кремнийорганические соединения, функциональные группы которых используют для проведения реакции полимеризации и иммобилизации биологических компонентов. Недостатком способа является сложная технология получения конечного продукта.
Известен способ иммобилизации трипсина на поверхности ферромагнетита [SU 1518373 A1, опубл. 30.10.89], включающий обработку поверхности ферромагнетита γ-аминопропилтриэтоксисиланом, модифицирование полученного производного глутаровым альдегидом и последующее связывание трипсина с носителем. Недостатком способа являются многостадийность и необходимость использования токсичных растворителей, в частности толуола.
Известен способ формирования на поверхности суперпарамагнитных наночастиц покрытия из желатины и гуммиарабика [US 4965007, опубл. 23.10.90] через стадию образования коацерватов и ковалентное сшивание покрытия с использованием в качестве сшивающего агента глутарового альдегида с последующим удалением его избытка. Недостатками метода являются сложность технологии получения конечного продукта и возможность сшивания адсорбтивов в растворе.
Наиболее близким к заявляемому способу является способ закрепления адсорбционного слоя из макромолекул альбумина на наночастицах магнетита, включающий применение карбодиимида в качестве сшивающего агента [Peng Z.G., Hidajat K., Uddin M.S. Adsorption of bovine serum albumin on nanosized magnetic particles. Journal of Colloid and Interface Science. 2004. V.271. P.277-283]. Способ предполагает формирование реакционной смеси, состоящей из раствора альбумина, магнитных частиц и свежеприготовленного раствора карбодиимида. Смесь инкубируют в течение 24 часов при комнатной температуре при непрерывном перемешивании. Способ предполагает использование токсичного органического сшивателя (карбодиимида). Способ не позволяет получить достаточно прочное покрытие, что подтверждается экспериментами по десорбции альбумина. Кроме того, неизбирательное сшивание приводит не только к формированию покрытия на поверхности частиц, но и к образованию кластеров наночастиц за счет перекрестного сшивания молекул белка, адсорбированных на разных наночастицах. Вследствие этого получение данным способом частиц, однородных по размеру и толщине адсорбционного слоя, пригодных для использования в системах векторной доставки биологически активных веществ, является проблематичным.
Задачей настоящего изобретения является разработка простого не требующего применения токсичных агентов способа получения белковых покрытий на поверхностях твердых тел, содержащих ионы металлов переменной валентности, обеспечивающего получение прочных белковых покрытий и исключающего возможность протекания побочных процессов, связанных с образованием перекрестных сшивок и приводящих к агрегированию макромолекул белка в растворе и к кластерообразованию.
Поставленная задача решается предлагаемым способом получения белковых покрытий на поверхностях твердых тел, содержащих ионы металлов переменной валентности, включающим инкубирование указанных тел в растворе белка в присутствии инициатора образования свободных радикалов.
Сущность способа состоит в том, что при взаимодействии молекул инициатора образования свободных радикалов с металлической поверхностью, содержащей ионы металлов переменной валентности, происходит окисление последних, сопровождаемое образованием свободных радикалов, инициирующих процессы сшивки макромолекул белка между собой. Поскольку свободные радикалы возникают в области контакта поверхности, содержащей ионы металлов переменной валентности, с инициатором образования свободных радикалов, процессы образования сшивок, придающих покрытию повышенную прочность, локализуются строго в слое белка, адсорбированного на поверхности. Образовавшееся белковое покрытие, в свою очередь, препятствует распространению радикалов в раствор и протеканию побочных свободнорадикальных реакций в жидкой фазе. При этом исключается возможность образования перекрестных сшивок между макромолекулами белка, находящимися в растворе, а также исключается возможность образования кластеров вследствие сшивания молекул белка, иммобилизованных на разных частицах.
Наиболее чувствительны к свободнорадикальному окислению серосодержащие и циклические аминокислотные остатки. Например, радикальная модификация остатков цистеина приводит к образованию ковалентных межмолекулярных сшивок в белках за счет образования дисульфидных связей, а в случае тирозина сшивки образуются за счет взаимодействия двух тирозин-радикалов [Stadtman E.R., Levine R.L. Free radical-mediated oxidation of free amino acids and amino asid residues in proteins. Amino Acids. 2003. V.25. P.207-218].
Предлагаемым способом могут быть получены покрытия из любых белков, содержащих остатки серосодержащих и циклических аминокислот. Для создания систем векторной доставки биологически активных веществ предпочтительно использовать белки плазмы крови, характеризующиеся высокой биосовместимостью, позволяющие снизить токсичность вводимых в организм наночастиц и предотвратить нежелательное взаимодействие поверхности частиц с кровью. В спектре белков плазмы крови наиболее предпочтительными для создания покрытий являются коммерчески доступные альбумин и иммуноглобулин G, удовлетворяющие всем вышеперечисленным требованиям.
В качестве инициаторов образования свободных радикалов могут быть использованы пероксид водорода или органические водорастворимые гидропероксиды, а также гипохлориты металлов, например гипохлорит натрия, способные генерировать свободные радикалы при контактировании с ионами металлов переменной валентности, присутствующими на поверхности подлежащих покрытию твердых тел. Для обеспечения оптимальных фазовых условий протекания процесса получение покрытий предпочтительно проводить в водной среде.
Заявляемым способом белковые покрытия могут быть получены на поверхностях различных твердых тел - пленок, мембран, частиц, содержащих ионы металлов переменной валентности, - железа, меди, марганца, хрома и др. Для медицинских целей наиболее предпочтительными являются наночастицы магнетита, которые совмещают в себе хорошую магнитоуправляемость и возможность модификации поверхности. Например, при взаимодействии поверхности частиц магнетита с пероксидом водорода образование свободных радикалов происходит по схеме
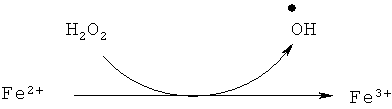
[Kitagawa M., Tokiwa Y. Polymerization of vinyl sugar ester using ascorbic acid and hydrogen peroxide as a redox reagent. Carbohydrate Polymers. 2006. V.64. P.218-223]. Аналогичные реакции в присутствии инициаторов образования свободных радикалов протекают и на поверхностях, содержащих ионы других металлов переменной валентности.
Способ осуществляют следующим образом. Формируют реакционную систему, включающую подлежащие покрытию твердые тела, раствор инициатора образования свободных радикалов и раствор белка в буфере с рН 6,5-8,0. Смесь инкубируют при комнатной температуре при перемешивании. Время инкубирования, зависящее от формы, размера и химической природы тел, на поверхности которых формируют покрытие, скорости адсорбции белка, а также от активности инициатора образования свободных радикалов, подбирают опытным путем. Оно может составлять от 1-2 часов до суток. Количество белка и инициатора образования свободных радикалов, вводимых в реакционную систему, также подбирают эмпирически, обеспечивая их избыток, необходимый для эффективного протекания свободнорадикальных реакций. Если в качестве твердых тел, на которых получают белковое покрытие, используют магнитные наночастицы, последние могут быть отделены от неиммобилизованного белка любым подходящим способом - центрифугированием, магнитной сепарацией, фильтрованием, диализом и т.п.
Краткое описание чертежей.
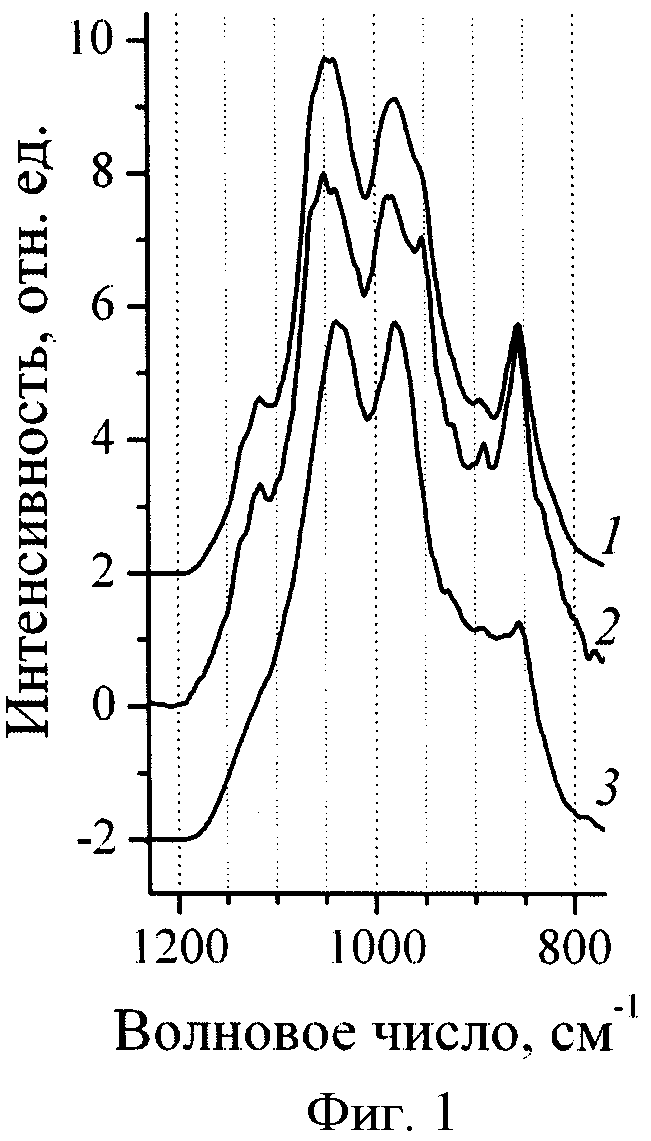
Фиг.1. ИК-спектры надосадочных растворов после ультрацентрифугирования образцов, полученных по примеру 1: 1 - контрольный образец, 2 - опытный образец, 3 - опытный образец в присутствии аскорбиновой кислоты (спектрометр Tenzor 27, "Bruker" (Германия) с разрешением 2 см-1, спектры записаны в режиме «на отражение» с использованием ячейки pike-miracle с селенидом цинка ZnSe).
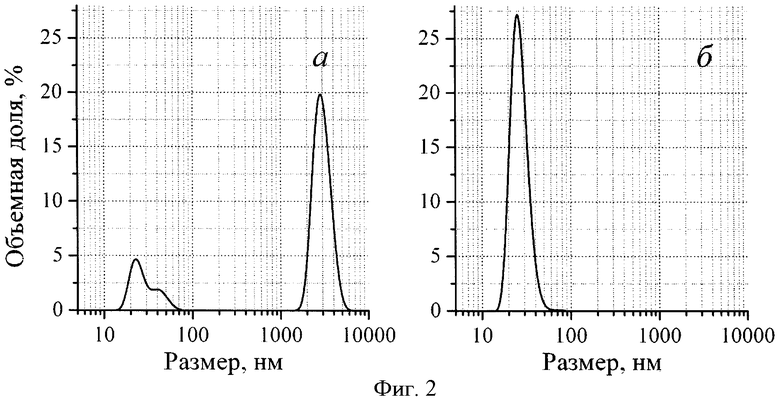
Фиг.2. Объемное распределение по размеру частиц, полученных по примеру 1, после инкубирования с фибриногеном: а - контрольный образец, б - опытный образец (спектрометр Malvern Zetasizer Nano S (Англия), угол детектирования 173°, разрешение 0,5 нм, температура 25°С).
Возможность практического осуществления заявляемого изобретения продемонстрирована ниже на примерах получения покрытий из альбумина и иммуноглобулина G на наночастицах магнетита с использованием в качестве инициаторов образования свободных радикалов пероксида водорода и гипохлорита натрия. Результаты сравнительного исследования опытных и контрольных образцов, полученных по примерам 1-4, представлены в Таблице.
Пример 1. Получение покрытия из альбумина на поверхности наночастиц магнетита под действием пероксида водорода.
Получение наночастиц магнетита
Наночастицы магнетита получают соосаждением солей двух- и трехвалентного железа при 4°С в водной среде в присутствии гидроксида аммония.
К 2,4 г FeSO4·7H2O и 1,42 г FeCl3·6H2O в 50 мл воды, содержащей 2,4 г ПЭГ (2 кДа), добавляют 10 мл 25%-ного NH4OH, частицы промывают дистиллированной водой до нейтрального рН и электростатически стабилизируют добавлением 0,1 М фосфат-цитратного буфера (0,05М NaCl) с рН 4,0. Получают гидрозоль, содержащий частицы магнетита, средний размер которых, по данным динамического светорассеяния, составляет 15,5 нм. Концентрация наночастиц в гидрозоле 37 мг/мл.
Получение опытного образца
К 2,80 мл раствора коммерческого препарата альбумина (Sigma) с концентрацией 2 мг/мл в 0,05 М фосфатном буфере добавляют 50 мкл 3%-ного пероксида водорода и 350 мкл полученного, как описано выше, гидрозоля наночастиц магнетита, содержащего 12,7 мг наночастиц. Смесь инкубируют в течение 20 часов при комнатной температуре при перемешивании.
Получение контрольного образца
В качестве контроля используют образец, отличающийся от опытного образца отсутствием в составе реакционной смеси пероксида водорода. К 2,80 мл раствора коммерческого препарата альбумина (Sigma) с концентрацией 2 мг/мл в 0,05 М фосфатном буфере добавляют 50 мкл дистиллированной воды и 350 мкл полученного, как описано выше, гидрозоля наночастиц магнетита. Смесь инкубируют в течение 20 часов при комнатной температуре при перемешивании.
Методом спиновых меток показано, что в контрольном образце в отсутствие инициатора образования свободных радикалов имеет место физическая адсорбция макромолекул альбумина на наночастицах в количестве 2,0 мг белка на 1,0 мг наночастиц [Сорокина О.Н., Бычкова А.В., Шапиро А.Б., Тихонов А.П., Коварский А.Л. Применение метода спиновых меток к исследованию адсорбции макромолекул на магнитных наночастицах. Химическая физика, 2010, том 29, №6, с.87-91]. Расчеты, основанные на данных по адсорбции, показывают, что на поверхности наночастиц при этом адсорбировано около 7 макромолекул альбумина, а средний размер частиц с адсорбированным на них альбумином составляет 23 нм.
Методом динамического светорассеяния (спектрометр Malvern Zetasizer Nano S (Англия), угол детектирования 173°, разрешение 0,5 нм, температура 25°С) показано, что как для контрольного, так и для опытного образцов характерно бимодальное объемное распределение частиц по размерам, причем в обоих образцах присутствуют лишь частицы, средний размер которых не превышает 25 нм, представляющие собой частицы альбумина и частицы магнетита, покрытые альбумином. Пики, соответствующие объектам больших размеров в спектрах обоих образцов, отсутствуют. Это говорит о том, что в присутствии пероксида водорода в системе не происходит ни сшивания макромолекул альбумина в растворе, ни образования кластеров наночастиц за счет сшивания молекул белка, принадлежащих разным наночастицам.
Для дополнительного подтверждения того, что при осуществлении заявляемого способа свободнорадикальное образование сшивок происходит только в слое иммобилизованного на поверхности наночастиц белка и при этом не происходит образование перекрестных сшивок между молекулами белка в растворе, получен еще один образец, в котором специально смоделирован процесс образования сшивок между молекулами белка в растворе. С этой целью в описанную выше систему, содержащую наночастицы магнетита, альбумин и пероксид водорода, дополнительно вводят аскорбиновую кислоту (9 мкл раствора с концентрацией аскорбиновой кислоты 152 мг/мл), которая взаимодействует с пероксидом водорода с образованием гидроксил-радикала [Kitagawa M., Tokiwa Y. Polymerization of vinyl sugar ester using ascorbic acid and hydrogen peroxide as a redox reagent. Carbohydrate Polymers. 2006. V.64. P.218-223] и конкурирует с ионами железа, находящимися на поверхности частиц магнетита, перенаправляя процесс радикального окисления белка с поверхности частиц в раствор. После ультрацентрифугирования всех трех образцов при 120000 g в течение 1 часа надосадочные растворы, содержащие макромолекулы белка, не адсорбированные на наночастицах или десорбированные с них в процессе ультрацентрифугирования, высушивают и полученные образцы подвергают ИК-анализу, результаты которого показаны на Фиг.1. Отличия в области 1200-800 см-1 в ИК-спектрах образцов, полученных в присутствии аскорбиновой кислоты (кривая 3), и ИК-спектрах контрольного (кривая 1) и опытного (кривая 2) образцов, полученных в отсутствие аскорбиновой кислоты, соответствуют протекающему в растворе окислению остатков серосодержащих и циклических аминокислот [Smith C.E., Stack M.S., Johnson D.A. Arch. Biochem. Biophys. 1987. V.253. P.146-155]. Совпадение ИК-спектров надосадочных жидкостей в контрольном и опытном образцах доказывает то, что свободнорадикальное сшивание молекул белка в присутствии пероксида водорода в растворе не происходит, а осуществляется только на поверхности наночастиц.
Прочность белкового покрытия на наночастицах проверяют, используя обнаруженную авторами способность фибриногена вытеснять несшитые между собой молекулы белков плазмы крови с поверхности частиц [Бычкова А.В., Сорокина О.Н., Коварский А.Л., Шапиро А.Б., Леонова В.Б., Розенфельд М.А. Взаимодействие фибриногена с наночастицами магнетита. Биофизика, 2010, том 55, №4, с.605-611]. Известно, что фибриноген, характеризующийся высоким содержанием гидрофобных аминокислотных остатков, активно взаимодействующих с металлической поверхностью, проявляет высокую склонность к физической адсорбции на поверхности частиц магнетита. Фибриноген проявляет не только высокую адсорбционную активность, но и способность образовывать кластеры микронных размеров (>2000 нм), обусловленную наличием двух идентичных концевых доменов, позволяющих молекуле фибриногена взаимодействовать сразу с двумя частицами. Это приводит к изменению характера объемного распределения присутствующих в системе объектов по размерам и появлению в спектрах пиков, соответствующих частицам микронных размеров.
К 1 мл контрольного и опытного образцов по примеру 1 добавляют по 250 мкл раствора коммерческого препарата фибриногена (Sigma) с концентрацией 4 мг/мл в 0,05 М фосфатном буфере и наблюдают за изменением размеров частиц в образцах методом динамического светорассеяния. В отсутствие инициатора образования свободных радикалов в контрольных образцах фибриноген вытесняет альбумин с поверхности наночастиц магнетита. При этом, как видно из таблицы, в системе, содержащей альбумин, средний размер частиц в системе возрастает с 23 до 2900 нм. На Фиг.2а видно, что в присутствии фибриногена объемная доля альбумина и наночастиц магнетита, покрытых альбумином, в контрольном образце, не содержащем инициатора образования свободных радикалов, резко уменьшается, а в области микронных размеров появляется интенсивный пик, соответствующий кластерам, образованным при участии фибриногена. В опытном образце в присутствии пероксида водорода (см. Фиг.2б) введение фибриногена не приводит к существенному изменению средних размеров частиц в системе, а в области микронных размеров пик, соответствующий кластерам, отсутствует. Это говорит о том, что при наличии в системе инициатора образования свободных радикалов слой иммобилизованного на поверхности белка обладает достаточно высокой прочностью и не разрушается под действием фибриногена. Под влиянием свободных радикалов, образующихся вблизи поверхности наночастиц, происходит ковалентное сшивание молекул белка между собой с образованием «белкового полимера», обладающего повышенной прочностью.
Принципиально разное поведение опытного и контрольного образцов в присутствии фибриногена можно наблюдать визуально. При добавлении фибриногена в контрольный образец происходит помутнение раствора за счет образования крупных частиц и их дальнейшей седиментации. При добавлении фибриногена в опытный образец раствор остается прозрачным.
Сравнительную устойчивость белковых покрытий на наночастицах в контрольном и опытном образцах оценивают также с помощью ультрацентрифугирования при 120000 g в течение 1 часа (см. таблицу). При заданных параметрах ультрацентрифугирования частицы магнетита образуют осадок, а молекулы альбумина, не связанные с поверхностью частиц, остаются в растворе. Анализ седиментационных осадков на содержание в них альбумина, проведенный колометрическим методом Бредфорда [Bradford M.M., A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal. Biochem. 1976. V.72. P.248-254], показывает, что в контрольном образце, полученном в отсутствие пероксида водорода, имеет место почти полная десорбция молекул альбумина с поверхности наночастиц. При этом ультрацентрифугирование лишь в небольшой степени затрагивает альбуминовую оболочку частиц в опытном образце, что указывает на ее высокую прочность и устойчивость, обусловленную образованием ковалентных сшивок между макромолекулами.
Пример 2. Получение покрытия из альбумина на поверхности наночастиц магнетита под действием гипохлорита натрия.
Для получения покрытия из альбумина используют наночастицы магнетита, полученные, как в примере 1. Получение опытного образца проводят аналогично примеру 1, используя в качестве инициатора образования свободных радикалов 25 мкл 6%-ного гипохлорита натрия. Смесь инкубируют в течение 10 часов при комнатной температуре при перемешивании. В качестве контроля используют реакционную систему, в которой раствора гипохлорита натрия заменяют на дистиллированную воду.
Как и в примере 1, спектры опытного и контрольного образцов характеризуются бимодальным объемным распределением частиц, которое соответствует присутствию в системе макромолекул альбумина и частиц магнетита, покрытых альбумином. Размер частиц не превышает 25 нм. Это свидетельствует о том, что в присутствии гипохлорита натрия не происходит ни сшивания макромолекул альбумина в растворе, ни образования кластеров наночастиц за счет сшивания молекул белка, принадлежащих разным наночастицам.
В присутствии гипохлорита натрия, инициирующего генерацию свободных радикалов, на поверхности наночастиц протекают реакции свободнорадикального сшивания белка с образованием прочного покрытия, препятствующего внедрению молекул фибриногена в белковый сорбционный слой. Прочность белкового покрытия подтверждена также данными ультрацентрифугирования (см. таблицу).
Таким образом, в присутствии гипохлорита натрия на поверхности наночастиц магнетита получают устойчивое покрытие из молекул альбумина, при этом не происходит кластерообразования или образования перекрестных сшивок между молекулами белка в растворе.
Пример 3. Получение покрытия из иммуноглобулина G на поверхности наночастиц магнетита под действием пероксида водорода.
Для получения покрытия из иммуноглобулина G используют магнитные наночастицы магнетита, полученные, как в примере 1. Получение опытного образца проводят аналогично примеру 1, используя в качестве белкового компонента 2,80 мл раствора коммерческого препарата иммуноглобулина G (Технология-Стандарт, Россия) с концентрацией 3,0 мг/мл в 0,05 М фосфатном буфере. Смесь инкубируют в течение 4 часов при комнатной температуре при перемешивании. В качестве контроля используют реакционную систему, в которой пероксид водорода заменяют на дистиллированную воду.
В отсутствие инициатора образования свободных радикалов имеет место физическая адсорбция макромолекул иммуноглобулина G на наночастицах в количестве 2,4 мг белка на 1,0 мг наночастиц [Сорокина О.Н., Бычкова А.В., Шапиро А.Б., Тихонов А.П., Коварский А.Л. Применение метода спиновых меток к исследованию адсорбции макромолекул на магнитных наночастицах. Химическая физика, 2010, том 29, №6, с.87-91]. Расчеты, основанные на данных по адсорбции, показывают, что на поверхности наночастиц при этом адсорбировано около 11 макромолекул иммуноглобулина G.
Как и в случае альбумина (см. примеры 1 и 2), спектры опытного и контрольного образцов характеризуются бимодальным объемным распределением частиц, которое соответствует присутствию в системе макромолекул иммуноглобулина G и частиц магнетита, покрытых иммуноглобулином G. Средний размер частиц находится в пределах 30 нм. Это свидетельствует о том, что в присутствии пероксида водорода не происходит ни сшивания макромолекул иммуноглобулина G в растворе, ни образования кластеров наночастиц за счет сшивания молекул белка, принадлежащих разным наночастицам.
Прочность полученного покрытия проверяют аналогично примеру 1, используя свойство фибриногена конкурировать с другими белками за участок связывания на поверхности наночастиц, а также ультрацентрифугированием.
Так же, как в случае покрытия альбумином, в контрольном образце в отсутствие пероксида водорода в реакционной смеси фибриноген вытесняет иммуноглобулин G с поверхности наночастиц, что приводит к образованию крупных кластеров с размерами, достигающими 2100 нм (см. таблицу). Добавление в опытном образце в реакционную смесь пероксида водорода, инициирующего генерацию гидроксильных радикалов на поверхности металла, способствует образованию прочного покрытия за счет свободнорадикального сшивания белка на поверхности наночастиц, вследствие чего фибриноген не вызывает изменений в структуре адсорбционного слоя. Анализ содержания иммуноглобулина G во фракции наночастиц контрольного и опытного образцов после их ультрацентрифугирования свидетельствует о том, что в присутствии пероксида водорода в процессе центрифугирования десорбция иммуноглобулина G происходит в незначительной степени, в то время как в отсутствие в реакционной системе пероксида водорода адсорбированный белок при центрифугировании почти полностью переходит в раствор (см. таблицу).
Таким образом, в присутствии пероксида водорода на поверхности наночастиц магнетита получают устойчивое покрытие из молекул иммуноглобулина G, при этом не происходит кластерообразования или образования перекрестных сшивок между молекулами белка в растворе.
Пример 4. Получение покрытия из иммуноглобулина G на поверхности наночастиц магнетита под действием гипохлорита натрия.
Для получения покрытия из иммуноглобулина G используют магнитные наночастицы магнетита, полученные, как в примере 1. Получение опытного образца проводят аналогично примеру 3, используя в качестве инициатора образования свободных радикалов 25 мкл 6%-ного водного раствора гипохлорита натрия. Смесь инкубируют в течение 2 часов при комнатной температуре при перемешивании. В качестве контроля используют реакционную систему, отличающуюся от опытного образца заменой раствора гипохлорита натрия на дистиллированную воду.
Сравнительное исследование образцов проводят аналогично примерам 1-3. Полученные результаты аналогичны результатам, полученным в примерах 1-3. В контроле в отсутствие в реакционной смеси гипохлорита натрия фибриноген вытесняет иммуноглобулин G с поверхности наночастиц, что вызывает образование крупных кластеров за счет ассоциации наночастиц под влиянием фибриногена. Добавление в реакционную смесь гипохлорита натрия, инициирующего генерацию свободных радикалов, способствует протеканию реакции свободнорадикального сшивания белка на поверхности наночастиц с образованием прочного покрытия, препятствующего внедрению молекул фибриногена в белковый сорбционный слой. Прочность белкового покрытия подтверждена также данными ультрацентрифугирования (см. таблицу).
Таким образом, в присутствии гипохлорита натрия на поверхности наночастиц магнетита получают устойчивое покрытие из молекул иммуноглобулина G, при этом не происходит кластерообразования или образования перекрестных сшивок между молекулами белка в растворе.
Возможности осуществления заявляемого способа не исчерпываются приведенными примерами, поскольку способ позволяет получать прочные белковые покрытия из любых белков, способных к радикальному окислению, на любых поверхностях, содержащих ионы металлов переменной валентности, под действием любых инициаторов образования свободных радикалов.
Таким образом, предложен простой не требующий применения токсичных агентов способ получения белковых покрытий на поверхностях твердых тел, содержащих ионы металлов переменной валентности, обеспечивающий получение прочных белковых покрытий, исключающий возможность протекания побочных процессов, связанных с образованием перекрестных сшивок и приводящих к агрегированию макромолекул белка в растворе и к кластерообразованию, и позволяющий получить покрытые белком частицы, однородные по размеру и по толщине покрытия.
Изобретение относится к получению биосовместимых покрытий на поверхностях твердых тел, содержащих ионы металлов переменной валентности, и может быть использовано в медицине, ветеринарии, в производстве косметических и гигиенических средств, а также в других областях техники, где необходимо нанесение белковых покрытий на металлические твердые тела, например частицы, пленки, мембраны. Способ получения белковых покрытий на поверхностях твердых тел, содержащих ионы металлов переменной валентности, включает инкубирование указанных твердых тел в растворе белка в присутствии инициатора образования свободных радикалов. Способ позволяет получать прочные белковые покрытия на поверхностях упомянутых твердых тел без применения токсичных химических веществ и исключает возможность протекания побочных процессов, связанных с образованием перекрестных сшивок и приводящих к агрегированию макромолекул белка в растворе и к кластерообразованию. 5 з.п. ф-лы, 2 ил., 1 табл., 4 пр.
1. Способ получения белковых покрытий на поверхностях твердых тел, содержащих ионы металлов переменной валентности, включающий инкубирование указанных твердых тел в растворе белка, отличающийся тем, что инкубирование осуществляют в присутствии инициатора образования свободных радикалов.
2. Способ по п.1, отличающийся тем, что в качестве твердых тел используют наночастицы магнетита.
3. Способ по п.1, отличающийся тем, что в качестве белка используют белок плазмы крови.
4. Способ по п.3, отличающийся тем, что в качестве белка плазмы крови используют альбумин или иммуноглобулин G.
5. Способ по п.1, отличающийся тем, что в качестве инициатора образования свободных радикалов используют пероксид водорода.
6. Способ по п.1, отличающийся тем, что в качестве инициатора образования свободных радикалов используют гипохлорит натрия.
| Peng Z.G | |||
| et | |||
| al | |||
| Adsorption of bovine serum albumin on nanosized magnetic particles, Journal of Colloid and Interface Science, 2004, Volume 271, Issue 2, Pages 277-283 | |||
| Приспособление для суммирования отрезков прямых линий | 1923 |
|
SU2010A1 |
| JP 2002235180 A, 23.08.2002 | |||
| ГАЗО-ГИДРАВЛИЧЕСКИЙ ДВИГАТЕЛЬ | 1927 |
|
SU9092A1 |
| Способ получения иммобилизованного трипсина | 1987 |
|
SU1518373A1 |
Авторы
Даты
2013-06-10—Публикация
2011-09-08—Подача