ПЕРЕКРЕСТНЫЕ ССЫЛКИ НА РОДСТВЕННЫЕ ЗАЯВКИ
По данной заявке испрашивается приоритет на основании предварительной заявки на патент США порядковый № 60/995636, поданной 26 сентября 2007 и озаглавленной «Производные N-гидроксилсульфонамида, как новые физиологически применимые доноры нитроксила», которая включена в настоящую заявку во всей полноте с помощью ссылки.
ЗАЯВЛЕНИЕ ОБ ИССЛЕДОВАНИЯХ ИЛИ РАЗРАБОТКАХ, ВЫПОЛНЕННЫХ ПРИ ФЕДЕРАЛЬНОЙ ФИНАНСОВОЙ ПОДДЕРЖКЕ
Настоящее изобретение частично было осуществлено при правительственной финансовой поддержке по гранту № CHE-0518406 Национального Научного Фонда. Правительство может обладать определенными правами на данное изобретение.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Краткая сводка данных по сердечной недостаточности
Застойная сердечная недостаточность (CHF), именуемая также декомпенсацией сердечной деятельности, как правило, представляет собой прогрессирующее, угрожающее жизни состояние, при котором подавлена сократительная способность сердца, так что сердце не способно в достаточной степени прокачивать возвращающуюся в него кровь. Симптомы включают нарушение дыхания, утомление, слабость, опухание ног и непереносимость физических нагрузок. При медицинском осмотре у пациентов с сердечной недостаточностью часто обнаруживаются повышенная частота сердцебиения и дыхания (показатель наличия жидкости в легких), отек, набухание шейных вен и увеличенный размер сердца. Наиболее распространенной причиной CHF является атеросклероз, который вызывает закупорку коронарных артерий, обеспечивающих кровоток сердечной мышцы. В конечном счете, такая закупорка может вызвать инфаркт миокарда с последующим упадком деятельности сердца и сердечной недостаточностью. Другие причины CHF включают заболевания клапанов сердца, гипертензию, вирусные инфекции сердца, употребление алкоголя и диабет. Некоторые случаи CHF возникают без ясной этиологии, и их именуют идиопатическими. Итог CHF для субъекта, у которого имеется сердечная недостаточность, может оказаться смертельным.
Существует несколько типов CHF. Выявлено два типа CHF, при которых наибольшему влиянию подвергается фаза цикла сердечной деятельности. Систолическая сердечная недостаточность наступает при уменьшении способности сердца к сжатию. Сердце не может осуществлять прокачку крови без выталкивания необходимого количества крови в кровоток с достаточным усилием, что ведет к уменьшению фракции выброса левого желудочка. Закупорка легких является типичным симптомом систолической сердечной недостаточности. Диастолическая сердечная недостаточность относится к неспособности сердца расслабиться между сжатиями и дать возможность войти в желудочки достаточному количеству крови. Для поддержания производительности работы сердца необходимы более высокие заполняющие давления, но способность к сжатию, измеренная на основании фракции выброса левого желудочка, как правило, остается нормальной. Опухание (отек) брюшной полости и ног является типичным симптомом диастолической сердечной недостаточности. Часто у индивидуума с сердечной недостаточностью будут в некоторой степени иметься оба указанных вида сердечной недостаточности - систолическая и диастолическая.
Кроме того, CHF классифицируют по тяжести заболевания. Нью-Йоркская ассоциация кардиологов разделяет CHF на четыре класса: класс I включает случаи с отсутствием очевидных симптомов, без ограничения на физическую активность; класс II включает случаи, при которых проявляются определенные симптомы во время или после обычной активности, и существуют незначительные ограничения физической активности; класс III включает случаи, когда симптомы проявляются при активности меньше обычной, и предполагаются ограничения на физическую активность от умеренных до значительных; и класс IV включает случаи с проявлением значительных симптомов в состоянии покоя, и требуются ограничения на физическую активность от строгого до полного исключения. Как правило, индивидуум, у которого имеется CHF, с течением времени проходит через указанные выше классы тяжести заболевания.
Хотя CHF обычно рассматривают как хроническое прогрессирующее состояние, оно может также развиваться внезапно. Этот тип CHF именуют острой CHF, и при этом состоянии требуется срочная медицинская помощь. Острая CHF может быть вызвана острым поражением сердца, которое влияет либо на производительность работы сердца, например, инфарктом миокарда, либо на целостность клапанов/полостей сердца, например, митральной регургитацией или разрывом межжелудочковой перегородки, которые ведут к резкому росту давления в левом желудочке и диастолического давления, приводящего к отеку легких и удушью.
Обычные средства для лечения CHF включают вазодилататоры (лекарственные препараты, которые расширяют кровеносные сосуды), положительные инотропы (лекарственные препараты, которые увеличивают способность сердца к сокращению) и диуретики (лекарственные препараты, которые уменьшают содержание жидкостей в организме). Кроме того, стандартными средствами лечения сердечной недостаточности в степени от легкой до умеренной становятся бета-антагонисты (лекарственные препараты, которые являются антагонистами бета-адренергических рецепторов). Lowes et al, Clin.Cardiol., 23: III 1 1-6 (2000).
В число положительных инотропных агентов входят агонисты бета-адренергических рецепторов, таких как дофамин, добутамин, допексамин и изопротеренол. Однако, применение бета-агонистов может вызывать потенциальные осложнения, такие как аритмогенез и повышенную потребность сердца в кислороде. Кроме того, вслед за первоначальным кратковременным улучшением способности сердца к сжатию, которое достигается при действии этих препаратов, начинается рост показателя смертности, причиной которого в основном является большая частота внезапных смертей. Katz, HEART FAILURE: PATHOPHYSIOLOGY, MOLECULAR BIOLOGY AND CLINICAL MANAGEMENT, Lippincott, Williams & Wilkins (1999).
Бета-антагонисты препятствуют действию бета-адренергического рецептора. Хотя изначально их считали противопоказанными при сердечной недостаточности, было обнаружено, что в клинических испытаниях они обеспечивают значительное сокращение заболеваемости и смертности. Bouzamondo et al., Fundam.Clin.Pharmacol., 15:95-109 (2001). Соответственно, они стали общепринятой терапией при сердечной недостаточности. Однако, даже у субъектов, у которых имело место улучшение при лечении бета-антагонистами, впоследствии может развиться декомпенсация и потребоваться интенсивное лечение положительным инотропным агентом. К сожалению, как и предполагает их название, бета-антагонисты блокируют механизм действия положительных инотропных бета-агонистов, которые применяются в центрах неотложной медицинской помощи. Bristow et al., J.Card. Fail., 7: 8-12 (2001).
Вазодилататоры, например, нитроглицерин, в течение долгого времени применяли для лечения сердечной недостаточности. Однако причина лечебного действия нитроглицерина не была известна до конца прошлого века, когда было обнаружено, что за полезное действие нитроглицерина отвечает молекула оксида азота (II) (NO). Некоторым субъектам с сердечной недостаточностью вводят донор оксида азота (II) в комбинации с положительным инотропным агентом, чтобы вызвать как расширение сосудов, так и увеличение сократительной способности сердца. Однако это комбинированное лечение может нарушить эффективность лечения положительными инотропными агентами. Например, Hart et al, Am. J. Physiol. Heart Circ. Physiol., 281:146-54 (2001) сообщали, что введение донора оксида азота (II) - нитропруссида натрия - в комбинации с положительным инотропным бета-адренергическим агонистом добутамином, нарушало положительное инотропное действие добутамина. Hare et al., Circulation, 92:2198-203 (1995) также раскрыли ингибирующее действие оксида азота (II) на эффективность добутамина.
Как указано в патенте США № 6936639, соединения, которые являются донорами нитроксила (HNO) в физиологических условиях, обладают как положительным инотропным, так и положительным лузитропным эффектами и обеспечивают значительные преимущества по сравнению с существующими способами лечения сердечной недостаточности. Благодаря их совместному положительному инотропному/лузитропному действию и разгружающему эффекту, доноры нитроксила, как сообщалось, полезны при лечении сердечно-сосудистых заболеваний, характеризуемых высокой резистивной нагрузкой и плохой эффективностью сокращений. В частности, сообщалось, что соединения, являющиеся донорами нитроксила, применимы в лечении сердечной недостаточности, включая сердечную недостаточность у индивидуумов, которых лечат бета-антагонистами.
Краткая сводка данных по ишемии
Ишемия представляет собой состояние, характеризуемое перерывом поступления или недостаточным поступлением крови в ткани, что приводит к лишению пораженной ткани кислорода. Сердечная ишемия представляет собой состояние, вызванное закупоркой или сужением одной или нескольких коронарных артерий, которые могут иметь место вследствие затруднения или прекращения кровотока из-за атеросклеротической бляшки. Закупорка или сужение приводят к тому, что ткань, в которую не поступает кровь, лишается кислорода, что может вызвать поражение ткани. Далее, при реперфузии с последующей реоксигенацией ткани, когда кровь вновь получает возможность поступать в ткань или потребность ткани в кислороде снижается, дополнительное поражение ткани может быть вызвано окислительным стрессом.
Термин «поражение от ишемии/реперфузии» относится к повреждению ткани, вызванному недостатком кислорода с последующей реоксигенацией. Результат поражения от ишемии/реперфузии для субъекта, у которого имеется это состояние, может оказаться смертельным, в частности, если поражение развивается в жизненно важном органе, таком как сердце или мозг.
Соответственно, соединения и композиции, проявляющие эффективность в предупреждении или защите от поражения вследствие ишемии/реперфузии могли бы стать полезными фармацевтическими средствами. Такие соединения как нитроглицерин в течение долгого времени применялись для помощи в регулировании тонуса сосудов и защиты против поражения сердца от ишемии/реперфузии. Было обнаружено, что молекулы оксида азота (II) являются причиной полезного действия нитроглицерина. Это открытие вызвало интерес к применению оксида азота (II) в медицине и исследованиям родственных частиц, например, нитроксила. Как сообщалось в заявке на патент США с порядковым № 10/463084 (публикация США № 2004/0038947), введение соединения, являющегося донором нитроксила в физиологических условиях, до наступления ишемии способно ослабить поражение тканей, например, тканей миокарда от ишемии/реперфузии. Об этом полезном эффекте сообщалось, как о неожиданном результате, с учетом того, что ранее имелись данные об усилении поражения от ишемии/реперфузии при действии нитроксила (смотрите работу Ma et al., “Opposite Effects of Nitric Oxide and Nitroxyl on Postischemic Myocardial Injury”, Proc.Nat'l Acad.Sci., 96(25): 14617-14622 (1999), в которой сообщалось, что введение соли Анджели (донора нитроксила в физиологических условиях) анестезированным кроликам во время ишемии и за 5 минут до реперфузии увеличивало поражение от ишемии/реперфузии, а также работу Takahira et al., “Dexamethasone Attenuates Neutrophil Infiltration in Rat Kidney in Ischemia/Reperfusion Injury: The Possible Role of Nitroxyl”, Free Radical Biology & Medicine, 31(6):809-815(2001), в которой сообщалось, что введение соли Анджели во время ишемии и за 5 минут до реперфузии почечной ткани крысы способствовало инфильтрации нейтрофилов в ткань, что, как считалось, опосредует поражение от ишемии/реперфузии). В частности, сообщалось, что введение соли Анджели и изопропиламина/NO до наступления ишемии, предотвращает или уменьшает поражение от ишемии/реперфузии.
Краткая сводка данных по донорам нитроксила
До настоящего времени в подавляющем большинстве исследований биологического действия HNO в качестве донора последнего применялся диоксотринитрат натрия («соль Анджели» или «AS»). Однако низкая химическая устойчивость AS делает ее неудобной для применения в качестве терапевтического средства. Предварительно было показано, что N-гидроксибензолсульфонамид («кислота Пилоти» или «PA») является донором нитроксила при высоких значениях pH (>9) (Bonner, F.T.; Ko, Y. Inorg.Chem.1992, 31, 2514-2519). Однако в физиологических условиях PA является донором оксида азота (II), который образуется за счет окислительного механизма реакции (Zamora, R.; Grzesiok, A.; Weber, H.; Feelisch, M. Biochem.J. 1995, 312, 333-339). Таким образом, физиологическое действие AS и PA не является одинаковым, т.к. AS в физиологических условиях является донором нитроксила, тогда как PA в физиологических условиях является донором оксида азота (II).
Хотя в патенте США № 6936639 и патентной публикации США № 2004/0038947 PA описана в качестве соединения, которое является донором нитроксила и отмечается, что, следовательно, другие сульфогидроксамовые кислоты и их производные также применимы в качестве доноров нитроксила, фактически PA не является донором значительных количеств нитроксила при физиологических условиях (смотрите Zamora выше).
Сообщалось, что некоторые замещенные N-гидроксилбензолсульфонамиды являются ингибиторами карбоангидразы, без упоминания об образовании HNO (смотрите (a) Mincione, F.; Menabuoni, L.; Briganti., F; Mincione, G.; Scozzafava, A.; Supuran, C.T. J.Enzyme Inhibition 1998, 13, 267-284 и (b) Scozzafava, A.; Supuran, C.T., J.Med.Chem. 2000, 43, 3677-3687).
Производные N-гидроксилсульфонамида в качестве новых физиологически применимых доноров нитроксила описаны также в заявке на патент по PCT №PCT/US2007/006710, поданной 16 марта 2007. Однако описанные в этой заявке соединения формулы (I) не замещены по меньшей мере одной карбоксильной, карбоксильно-сложноэфирной, ациламино или сульфониламино группой, и соединения формулы (II) или (III), описанные в упомянутой заявке, не замещены по меньшей мере одной карбониламино или сульфониламино группой.
Значительная потребность в медицине
Несмотря на усилия, направленные на разработку новых способов лечения таких заболеваний и состояний, как сердечная недостаточность и поражение от ишемии/реперфузии, сохраняется значительный интерес и потребность в дополнительных или альтернативных соединениях, которые применимы для лечения или предупреждения начала или ослабления тяжести этих и родственных заболеваний или состояний. В частности, в медицине остается значительная потребность в альтернативных или дополнительных видах терапии заболеваний или состояний, которые реагируют на лечение нитроксилом. Таким образом, новые соединения, которые выделяют нитроксил в физиологических условиях и способы применения соединений, которые выделяют нитроксил в физиологических условиях, могут найти применение в качестве способов лечения, профилактики и/или замедления наступления и/или развития заболеваний или состояний, которые реагируют на лечение нитроксилом, включая заболевания сердца и поражения от ишемии/реперфузии. Предпочтительно, эти терапевтические средства могут улучшать качество жизни и/или продлевать срок жизни пациентов с указанными заболеваниями или состояниями.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
В изобретении описаны способы, соединения и композиции, предназначенные для лечения и/или предупреждения начала или развития заболеваний или состояний, которые реагируют на лечение нитроксилом. Описаны ароматические и неароматические производные N-гидроксилсульфонамида, которые высвобождают нитроксил в физиологических условиях. Путем модификации PA с применением подходящих заместителей, например, электроноакцепторных групп, или групп, которые пространственно экранируют сульфонильный фрагмент, существенно улучшена способность указанных производных к высвобождению HNO в физиологических условиях. PA по сравнению с AS имеет значительно больший потенциал модификации за счет введения заместителей, что дает возможность оптимизации физико-химических и фармакологических свойств. Такая оптимизация описана в настоящей заявке.
В одном из вариантов осуществления настоящее изобретение относится к способу введения субъекту, нуждающемуся в этом, терапевтически эффективного количества производного PA, где указанное производное высвобождает нитроксил в физиологических условиях. В одном из вариантов осуществления, изобретение охватывает способ лечения или предотвращения начала и/или развития заболевания или состояния, которое реагирует на лечение нитроксилом, причем указанный способ включает введение индивидууму, нуждающемуся в этом, N-гидроксилсульфонамида, который высвобождает эффективное количество нитроксила в физиологических условиях. Кроме того, изобретение охватывает способы лечения сердечной недостаточности или поражения от ишемии/реперфузии путем введения индивидууму, нуждающемуся в этом, N-гидроксилсульфонамида, который высвобождает эффективное количество нитроксила в физиологических условиях.
Кроме того, в изобретении описаны наборы, включающие указанные соединения, которые могут необязательно включать второе терапевтическое средство, например, положительное инотропное соединение, которое может представлять собой, например, агонист бета-адренергического рецептора.
Новые соединения, которые применяются в изобретении и описаны в настоящей заявке, включают соединения формулы (I), (II) или (III):

где заместитель R1 представляет собой H; заместитель R2 представляет собой H, аралкил или гетероциклил; m и n независимо представляют собой целые числа от 0 до 2; x представляет собой целое число от 0 до 4, и y является целым числом от 0 до 3, при условии, что по меньшей мере одно число из x и y превышает 0; b является целым числом в диапазоне 1-4; заместители R3, R4, R5, R6 и R7 независимо выбраны из группы, состоящей из H, галогена, алкилсульфонила, N-гидроксилсульфонамидила, пергалогеналкила, нитро, арила, циано, алкокси, пергалогеналкокси, алкила, замещенной арилоксигруппы, алкилсульфанила, алкилсульфинила, гетероциклоалкила, замещенного гетероциклоалкила, диалкиламино, циклоалкокси, циклоалкилсульфанила, арилсульфанила, арилсульфинила, карбоксила, сложного эфира карбоксила, ациламино и сульфониламино, при условии, что хотя бы один из заместителей R3, R4, R5, R6 и R7 представляет собой карбоксил, сложный эфир карбоксила, ациламино или сульфониламиногруппу; каждый из заместителей R8 и R9 независимо выбран из группы, состоящей из галогена, алкилсульфонила, N-гидроксилсульфонамидила, пергалогеналкила, нитро, арила, циано, алкокси, пергалогеналкокси, алкила, замещенной арилоксигруппы, алкилсульфанила, алкилсульфинила, гетероциклоалкила, замещенного гетероциклоалкила, диалкиламино, групп NH2, OH, C(O)OH, C(O)Oалкил, NHC(O)алкилC(O)OH, C(O)NH2, NHC(O)алкилC(O)алкил, NHC(O)алкенилC(O)OH, NHC(O)NH2, OалкилC(O)Oалкил, NHC(O)алкил, C(=N-OH)NH2, циклоалкокси, циклоалкилсульфанила, арилсульфанила, арилсульфинила, карбониламино и сульфониламино, при условии, что: (1) по меньшей мере один заместитель R8 представляет собой карбониламино или сульфониламино, если соединение является соединением формулы (III), и (2) по меньшей мере один из заместителей R8 и R9 представляет собой карбониламино или сульфониламиногруппу, если соединение является соединением формулы (II); A представляет собой циклоалкил, гетероциклоалкил, ароматический или гетероароматический цикл, содержащий циклические фрагменты Q1, Q2, Q3 и Q4, которые совместно с фрагментами V и W образуют цикл A; B представляет собой циклоалкил, гетероциклоалкил, ароматический или гетероароматический цикл, содержащий циклические фрагменты Q5, Q6, Q7 и Q8, которые совместно с фрагментами V и W образуют цикл B; V и W независимо представляют собой C, CH, N или NR10; Q1, Q2, Q3, Q4, Q5, Q6, Q7 и Q8 независимо выбраны из группы, состоящей из C, CH2, CH, N, NR10, O и S; С представляет собой гетероароматический цикл, содержащий циклические фрагменты Q9, Q10, Q11, Q12, Q13 и Q14, которые независимо выбраны из группы, состоящей из C, CH2, CH, N, NR10, O и S, при условии, что по меньшей мере один из фрагментов Q9, Q10, Q11, Q12, Q13 и Q14 представляет собой N, NR10, O или S; и R10 представляет собой H, алкил, ацил или сульфонил. Кроме того, изобретение охватывает фармацевтически приемлемые соли любого из описанных выше соединений.
В одном из вариантов, соединение соответствует формуле (I), (II) или (III), где заместитель R1 представляет собой H; заместитель R2 представляет собой H; m и n независимо представляют собой целые числа от 0 до 2; x представляет собой целое число от 0 до 4, и y является целым числом от 0 до 3, при условии, что по меньшей мере одно из чисел x и y превышает 0; b является целым числом в диапазоне 1-4; заместители R3, R4, R5, R6 и R7 независимо выбраны из группы, состоящей из H, галогена, алкилсульфонила, замещенного алкилсульфонила, N-гидроксилсульфонамидила, замещенного N-гидроксилсульфонамидила, пергалогеналкила, замещенного пергалогеналкила (в котором один или несколько атомов галогена могут быть замещены заместителем), нитро, арила, замещенного арила, циано, алкокси, замещенной алкоксигруппы, пергалогеналкокси, замещенной пергалогеналкоксигруппы, алкила, замещенного алкила, арилокси, замещенной арилоксигруппы, алкилсульфанила, замещенного алкилсульфанила, алкилсульфинила, замещенного алкилсульфинила, гетероциклоалкила, замещенного гетероциклоалкила, диалкиламино, замещенной диалкиламиногруппы, циклоалкокси, замещенной циклоалкоксигруппы, циклоалкилсульфанила, замещенного циклоалкилсульфанила, арилсульфанила, замещенного арилсульфанила, арилсульфинила, замещенного арилсульфинила, карбоксила, сложного эфира карбоксила, ациламино и сульфониламино, при условии, что хотя бы один из заместителей R3, R4, R5, R6 и R7 представляет собой карбоксил, сложный эфир карбоксила, ациламино или сульфониламиногруппу; каждый из заместителей R8 и R9 независимо выбран из группы, состоящей из галогена, алкилсульфонила, замещенного алкилсульфонила, N-гидроксилсульфонамидила, замещенного N-гидроксилсульфонамидила, пергалогеналкила, замещенного пергалогеналкила, нитро, арила, замещенного арила, циано, алкокси, замещенной алкоксигруппы, пергалогеналкокси, замещенной пергалогеналкоксигруппы, алкила, замещенного алкила, арилокси, замещенной арилоксигруппы, алкилсульфанила, замещенного алкилсульфанила, алкилсульфинила, замещенного алкилсульфинила, гетероциклоалкила, замещенного гетероциклоалкила, диалкиламино, замещенной диалкиламиногруппы, групп NH2, OH, C(O)OH, C(O)Oалкил, NHC(O)алкилC(O)OH, C(O)NH2, NHC(O)алкилC(O)алкил, NHC(O)алкенилC(O)OH, NHC(O)NH2, OалкилC(O)Oалкил, NHC(O)алкил, C(=N-OH)NH2, циклоалкокси, замещенной циклоалкилоксигруппы, циклоалкилсульфанила, замещенного циклоалкилсульфанила, арилсульфанила, замещенного арилсульфанила, арилсульфинила, замещенного арилсульфинила, (где любое включение в перечень алкила или алкенила в указанных выше фрагментах предполагает незамещенный или замещенный алкил или алкенил), карбониламино и сульфониламино, при условии, что: (1) по меньшей мере один заместитель R8 представляет собой карбониламино или сульфониламиногруппу, если соединение является соединением формулы (III), и (2) по меньшей мере один из заместителей R8 и R9 представляет собой карбониламино или сульфониламиногруппу, если соединение является соединением формулы (II); A представляет собой циклоалкил, гетероциклоалкил, ароматический или гетероароматический цикл, содержащий циклические фрагменты Q1, Q2, Q3 и Q4, которые совместно с фрагментами V и W образуют цикл A; B представляет собой циклоалкил, гетероциклоалкил, ароматический или гетероароматический цикл, содержащий циклические фрагменты Q5, Q6, Q7 и Q8, которые совместно с фрагментами V и W образуют цикл B; V и W независимо представляют собой C, CH, N или NR10; Q1, Q2, Q3, Q4, Q5, Q6, Q7 и Q8 независимо выбраны из группы, состоящей из C, CH2, CH, N, NR10, O и S; С представляет собой гетероароматический цикл, содержащий циклические фрагменты Q9, Q10, Q11, Q12, Q13 и Q14, которые независимо выбраны из группы, состоящей из C, CH2, CH, N, NR10, O и S, при условии, что по меньшей мере один из фрагментов Q9, Q10, Q11, Q12, Q13 и Q14 представляет собой N, NR10, O или S; и R10 представляет собой H, алкил, ацил или сульфонил. Фармацевтически приемлемые соли любого из описанных выше соединений также включены в настоящее изобретение.
Кроме того, в изобретении раскрыты способы применения соединений, подробно описанных в тексте заявки, в том числе способ лечения, предупреждения или замедления наступления или развития заболевания или состояния, которое реагирует на лечение нитроксилом, включающий введение индивидууму, нуждающемуся в этом, соединения по настоящему изобретению, которое выделяет нитроксил в физиологических условиях, или его фармацевтически приемлемой соли.
В изобретении раскрыты фармацевтические композиции, содержащие соединения по настоящему изобретению, например, фармацевтические композиции, которые подходят для внутривенного введения. Кроме того, в изобретении описаны наборы, содержащие соединение по настоящему изобретению и инструкции по его применению.
КРАТКОЕ ОПИСАНИЕ РИСУНКОВ
На фиг.1 показано количество закиси азота, выделенной соединениями 1-5 в процентах от количества, выделенного солью Анджели, и мольный процент N2O, образовавшейся на моль образца, для соединений 1-5.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Определения
Если явно не указано иное, следующие термины, используемые в тексте заявки, имеют приведенные ниже значения.
Использование единственного числа соответствует одному или многим обозначаемым объектам.
Термин «аралкил» относится к органическому остатку, в котором арильный фрагмент присоединен к основной структуре через алкильный фрагмент. Примеры включают бензил (-CH2-Ph), фенетил (-CH2CH2Ph), фенилвинил (-CH=CH-Ph), фенилаллил и т.п.
Термин «ацил» включает группы -C(O)H, -C(O)алкил, -C(O)замещенный алкил, -C(O)алкенил, -C(O)замещенный алкенил, -C(O)алкинил, -C(O)замещенный алкинил, -C(O)циклоалкил, -C(O)замещенный циклоалкил, -C(O)арил, -C(O)замещенный арил, -C(O)гетероарил, -C(O)замещенный гетероарил, -C(O)гетероциклил и -C(O)замещенный гетероциклил, где алкил, замещенный алкил, алкенил, замещенный алкенил, алкинил, замещенный алкинил, циклоалкил, замещенный циклоалкил, арил, замещенный арил, гетероарил, замещенный гетероарил, гетероциклил и замещенный гетероциклил соответствуют определениям, данным в тексте заявки или, в случае отсутствия в тексте, известным в технике.
Термины «гетероциклил» или «гетероциклоалкил» относятся к циклоалкильному остатку, в котором один-четыре атома углерода заменены гетероатомами, такими как кислород, азот или сера. Примеры гетероциклов, радикалами которых являются гетероциклильные группы, включают тетрагидропиран, морфолин, пирролидин, пиперидин, тиазолидин, оксазол, оксазолин, изоксазол, диоксан, тетрагидрофуран и т.п. Конкретным примером гетероциклильного остатка является тетрагидропиран-2-ил.
Термины «замещенный гетероциклил» или «замещенный гетероциклоалкил» относятся к гетероциклильной группе, имеющей от 1 до 5 заместителей. Например, замещенным гетероциклоалкилом является гетероциклильная группа, замещенная 1-5 группами, такими как галоген, нитро, циано, оксо, арил, алкокси, алкил, ацил, ациламино, амино, гидроксил, карбоксил, карбоксиалкил, тиол, тиоалкил, гетероциклил, -OS(O)2-алкил и т.п. Конкретным примером замещенного гетероциклоалкила является N-метилпиперазиногруппа.
Термин «алкил» подразумевает линейную углеводородную структуру, включающую от 1 до 20 атомов углерода, предпочтительно от 1 до 12 атомов углерода и более предпочтительно от 1 до 8 атомов углерода. Термин «алкильные группы» охватывает группы с меньшим числом атомов углерода, как, например, т.н. «низшие алкильные» группы, содержащие от 1 до 4 атомов углерода. Термин «алкил» подразумевает также разветвленные или циклические углеводородные структуры, включающие от 3 до 20 атомов углерода, предпочтительно от 3 до 12 атомов углерода и более предпочтительно от 3 до 8 атомов углерода. В случае любого использования термина «алкил», если явно не утверждается иное, предполагается, что этот термин охватывает все варианты алкильных групп, раскрытых в настоящей заявке с соответствующим числом атомов углерода, как если бы любая и каждая алкильная группа была индивидуально и явно перечислена при каждом использовании данного термина. Например, если группа, такая как R3, может представлять собой «алкил», подразумевается C1-C20алкил или C1-C12алкил, или C1-C8алкил, или низший алкил, или C2-C20алкил, или C3-C12алкил, или C3-C8алкил. То же самое является верным и для других групп, перечисленных в настоящей заявке, которые могут включать группы, соответствующие другим определениям, где в определениях приведены соответствующие количества атомов. Если алкильная группа является циклической, она также может называться циклоалкильной группой и включать, например, от 3 до 20 циклических атомов углерода, предпочтительно от 3 до 12 циклических атомов углерода и более предпочтительно от 3 до 8 циклических атомов углерода. Если упомянут алкильный остаток, содержащий конкретное количество атомов углерода, имеется в виду, что данное упоминание охватывает все геометрические изомеры, содержащие это количество атомов углерода; так, например, подразумевается, что термин «бутил» включает н-бутил, втор-бутил, изобутил и трет-бутил; «пропил» включает н-пропил и изопропил. Примеры алкильных групп включают метил, этил, н-пропил, изопропил, т-буутил, н-гептил, октил, циклопентил, циклопропил, циклобутил, норборнил и т.п. В алкильной группе могут находиться один или несколько ненасыщенных фрагментов. Таким образом, термин «алкильная группа» охватывает также алкенильные и алкинильные остатки. Подразумевается, что термин «алкенил» относится к группе, состоящей из 2-ух или более атомов углерода, например, из 2-10 атомов углерода и более предпочтительно из 2-6 атомов углерода и имеющей по меньшей мере 1 и предпочтительно 1-2 фрагмента с ненасыщенными двойными связями. Примеры алкенильных групп включают -C=CH2, -CH2CH=CHCH3 и -CH2CH=CH-CH=CH2. Термин «алкинил» относится к алкинильной группе, предпочтительно включающей от 2 до 10 атомов углерода и более предпочтительно от 3 до 6 атомов углерода и имеющей, по меньшей мере, 1 и предпочтительно 1-2 фрагмента с ненасыщенными тройными связями, например, фрагмента -C≡CH. Термин «алкил» используется в настоящей заявке также для обозначения алкильного остатка, как части более крупной функциональной группы, и при таком использовании в сочетании с остальными атомами алкил образует другую функциональную группу. Например, упоминание группы -C(O)Oалкил означает сложноэфирную функциональную группу, где алкильная часть фрагмента может являться любой алкильной группой, и весь фрагмент, только в качестве примера, может представлять собой функциональную группу -C(O)OCH3, -C(O)(O)CH=CH2 и т.п. Другой пример алкильной группы в качестве части более крупной структуры включает остаток NHC(O)алкилC(O)OH, который, например, может представлять собой NHC(O)CH2CH2C(O)OH, где алкил представляет собой фрагмент -CH2CH2-.
Термин «замещенный алкил» относится к алкильной группе, имеющей от 1 до 5 заместителей. Например, замещенным алкилом является алкильная группа, замещенная такими группами, как галоген, нитро, циано, оксо, арил, алкокси, ацил, ациламино, амино, гидроксил, карбоксил, карбоксилалкил, тиол, тиоалкил, гетероциклил, -OS(O)2-алкил и т.п. Аналогично, термины «замещенный алкенил» и «замещенный алкинил» относятся к алкенильной или алкинильной группам, имеющим от 1 до 5 заместителей.
В настоящем описании термин «заместитель» или «замещенный» означает, что атом водорода соединения или группы (как, например, алкила, замещенного алкила, алкенила, замещенного алкенила, алкинила, замещенного алкинила, арила, замещенного арила, аралкила, замещенного аралкила, гетероарила, замещенного гетероарила, гетероаралкила, замещенного гетероаралкила, циклоалкила, замещенного циклоалкила, гетероциклоалкила, замещенного гетероциклоалкила, гетероциклила и замещенного гетероциклила) заменен на любую желаемую группу, которая не оказывает значительного неблагоприятного влияния на стабильность соединения. В одном из вариантов осуществления, желательными заместителями являются такие заместители, которые не оказывают неблагоприятного влияния на активность соединения. Термин «замещенный» относится к одному или нескольким заместителям (которые могут быть одинаковыми или различными), каждый из которых замещает атом водорода. Примеры заместителей включают, не ограничиваясь этим, галоген (F, Cl, Br или I), гидроксил, амино, алкиламино, ариламино, диалкиламино, диариламино, циано, нитро, меркапто, оксо (т.е. карбонил), тио, имино, формил, карбамидо, карбамил, карбоксил, тиоуреидо, тиоцианато, сульфоамидо, сульфонилалкил, сульфониларил, алкил, алкенил, алкокси, меркаптоалкокси, арил, гетероарил, циклил, гетероциклил, где алкил, алкенил, алкилокси, арил, гетероарил, циклил и гетероциклил необязательно замещены алкилом, арилом, гетероарилом, галогеном, гидроксилом, амино, меркапто, циано, нитро, оксо (=O), тиооксо (=S) или имино (=Nалкил). В других вариантах осуществления заместители у любой группы (такой как, например, алкил, замещенный алкил, алкенил, замещенный алкенил, алкинил, замещенный алкинил, арил, замещенный арил, аралкил, замещенный аралкил, гетероарил, замещенный гетероарил, гетероаралкил, замещенный гетероаралкил, циклоалкил, замещенный циклоалкил, гетероциклоалкил, замещенный гетероциклоалкил, гетероциклил и замещенный гетероциклил) могут находиться у любого атома этой группы (например, у атома углерода основной углеродной цепи замещенной алкильной группы или у заместителя, уже присутствующего в замещенной алкильной группе) или у любого атома, где любая группа, которая может быть замещена (как, например, алкил, алкенил, алкинил, арил, аралкил, гетероарил, гетероаралкил, циклоалкил, циклил, гетероциклоалкил, и гетероциклил), может быть необязательно замещена одним или несколькими заместителями (которые могут быть одинаковыми или различными), каждый из которых замещает атом водорода. Примеры подходящих заместителей включают, не ограничиваясь перечисленными, алкил, алкенил, алкинил, циклил, циклоалкил, гетероциклил, гетероциклоалкил, аралкил, гетероаралкил, арил, гетероарил, галоген, галогеналкил, циано, нитро, алкокси, арилокси, гидроксил, гидроксилалкил, оксо (т.е. карбонил), карбоксил, формил, алкилкарбонил, алкилкарбонилалкил, алкоксикарбонил, алкилкарбонилокси, арилоксикарбонил, гетероарилокси, гетероарилоксикарбонил, тио, меркапто, меркаптоалкил, арилсульфонил, амино, аминоалкил, диалкиламино, алкилкарбониламино, алкиламинокарбонил или алкоксикарбониламино; алкиламино, ариламино, диариламино, алкилкарбонил или ариламино-замещенный арил; арилалкиламино, аралкиламинокарбонил, амидо, алкиламиносульфонил, ариламиносульфонил, диалкиламиносульфонил, алкилсульфониламино, арилсульфониламино, имино, карбамидо, карбамил, тиоуреидо, тиоцианато, сульфоамидо, сульфонилалкил, сульфониларил или меркаптоалкокси. Дополнительные подходящие заместители у алкила, алкенила, алкинила, арила, аралкила, гетероарила, гетероаралкила, циклоалкила, циклила, гетероциклоалкила и гетероциклила включают, не ограничиваясь перечисленными, галоген, CN, NO2, OR11, SR11, S(O)2OR11, NR11R12, C1-C2перфторалкил, C1-C2перфторалкокси, 1,2-метилендиокси, (=O), (=S), (=NR11), C(O)OR11, C(O)R11R12, OC(O)NR11R12, NR11C(O)NR11R12, C(NR12)NR11R12, NR11C(NR12)NR11R12, S(O)2NR11R12R13, C(O)H, C(O)R13, NR11C(O)R13, Si(R11)3, OSi(R11)3, Si(OH)2R11, B(OH)2, P(O)(OR11)2, S(O)R13 или S(O)2R13. Каждый из заместителей R11 независимо представляет собой водород, C1-C6алкил, независимо замещенный циклоалкилом, арилом, гетероциклилом или гетероарилом. Каждый из заместителей R12 независимо представляет собой водород, C3-C6циклоалкил, арил, гетероциклил, гетероарил, C1-C4алкил или C1-C4алкил, замещенный C3-C6циклоалкилом, арилом, гетероциклилом или гетероарилом. Каждый из заместителей R13 независимо представляет собой C3-C6циклоалкил, арил, гетероциклил, гетероарил, C1-C4алкил или C1-C4алкил, замещенный C3-C6циклоалкилом, арилом, гетероциклилом или гетероарилом. Каждый заместитель из числа C3-C6циклоалкила, арила, гетероциклила, гетероарила и C1-C4алкила в каждом из фрагментов R11, R12 и R13 может быть необязательно замещен галогеном, CN, C1-C4алкилом, OH, C1-C4алкокси, COOH, C(O)OC1-C4алкилом, NH2, C1-C4алкиламино или C1-C4диалкиламино. Заместители также могут являться «электроноакцепторными группами».
Термин «электроноакцепторная группа» относится к группам, которые уменьшают электронную плотность на том фрагменте, к которому они присоединены (относительно плотности на том же фрагменте без заместителя). Такие группы включают, например, F, Cl, Br, I, -CN, -CF3, -NO2, -SH, -C(O)H, -C(O)алкил, -C(O)Oалкил, -C(O)OH, -C(O)Cl, -S(O)2OH, -S(O)2NHOH, -NH3 и т.п.
Термин «галоген» относится к фтору, хлору, брому или иоду.
Термин «алкилсульфонил» относится к группам -SO2алкил и -SO2замещенный алкил, которые включают остатки -SO2циклоалкил, -SO2замещенный циклоалкил, -SO2алкенил, -SO2замещенный алкенил, -SO2алкинил, -SO2замещенный алкинил, где алкил, замещенный алкил, алкенил, замещенный алкенил, алкинил, замещенный алкинил, циклоалкил и замещенный циклоалкил соответствуют данным в заявке определениям.
Термин «N-гидроксилсульфонамидил» относится к фрагменту -S(O)2NROH, где R представляет собой H или алкил.
Термин «пергалогеналкил» относится к алкильной группе, в которой каждый из атомов H углеводородного остатка замещен F. Примеры пергалогензамещенных групп включают -CF3 и CF2CF3.
Термин «арил» подразумевает моноциклическую, бициклическую или трициклическую ароматическую систему. Арильная группа предпочтительно является 5- или 6-членным ароматическим или гетероароматическим циклом, содержащим 0-3 циклических гетероатома, выбранных из O, N или S; бициклической 9- или 10-членной ароматической или гетероароматической циклической системой (это означает, что циклическая система включает 9 или 10 циклических атомов), содержащей 0-3 циклических гетероатомов, выбранных из O, N или S; или трициклической 13- или 14-членной ароматической или гетероароматической циклической системой (это означает, что система включает 13 или 14 циклических атомов), содержащей 0-3 циклических гетероатомов, выбранных из O, N или S. Примеры соединений, радикалы которых являются арильными группами, включают, например, бензол, нафталин, индан, тетралин, имидазол, пиридин, индол, тиофен, бензопиранон, тиазол, фуран, бензимидазол, бензоксазол, бензтиазол, хинолин, изохинолин, хиноксалин, пиримидин, пиразин, тетразол и пиразол.
Термин «замещенный арил» относится к группе, имеющей от 1 до 3 заместителей. Например, замещенным арилом является арильная группа, замещенная 1-3 такими группами, как галоген, нитро, циано, оксо, арил, алкокси, алкил, ацил, ациламино, амино, гидроксил, карбоксил, карбоксилалкил, тиол, тиоалкил, гетероциклил, -OS(O)2-алкил и т.п.
Термин «алкокси» относится к алкильной группе, которая присоединена к основной структуре через атом кислорода (-O-алкил). Если циклоалкильная группа с основной структурой через атом кислорода, эта группа может именоваться циклоалкоксигруппой. Примеры включают метокси, этокси, пропокси, изопропокси, циклопропилокси, циклогексилокси и т.п. Термин «пергалогеналкокси» подразумевает пергалогеналкильную группу, присоединенную к основной структуре через атом кислорода, например, остаток -O-CF3.
Термин «арилокси» относится к арильной группе, которая связана с основной структурой через атом кислорода (-O-арил), и в качестве примера, термин «арилокси» включает остатки фенокси, нафтокси и т.п. Термин «замещенная арилоксигруппа» относится к замещенной арильной группе, соединенной с основной структурой через атом кислорода (-O-замещенный арил).
Термин «алкилсульфанил» означает алкильную группу, которая соединена с основной структурой через атом серы (-S-алкил) и относится к группам -S-алкил и -S-замещенный алкил, которые включают остатки -S-циклоалкил, -S-замещенный циклоалкил, -S-алкенил, -S-замещенный алкенил, -S-алкинил, -S-замещенный алкинил, где алкил, замещенный алкил, алкенил, замещенный алкенил, алкинил, замещенный алкинил, циклоалкил и замещенный циклоалкил соответствуют определениям, данным в тексте заявки. Если циклоалкильная группа соединена с основной структурой через атом серы, эта группа может именоваться также циклоалкилсульфанильной группой. В качестве примера, алкилсульфанил включает -S-CH(CH3), -S-CH2CH3 и т.п.
Термин «алкилсульфинил» означает алкильную группу, которая соединена с основной структурой через фрагмент S(O) и относится к группам -S(O)алкил и -S(O)замещенный алкил, которые включают остатки -S(O)циклоалкил, -S(O)замещенный циклоалкил, -S(O)алкенил, -S(O)замещенный алкенил, -S(O)алкинил, -S(O)замещенный алкинил, где алкил, замещенный алкил, алкенил, замещенный алкенил, алкинил, замещенный алкинил, циклоалкил и замещенный циклоалкил соответствуют определениям, данным в тексте заявки. В качестве примера, алкилсульфинил включает остатки -S(O)CH(CH3), -S(O)CH3, -S(O)циклопентан и т.п.
Термин «арилсульфинил» относится к арильной группе, которая соединена с основной структурой молекулы через фрагмент S(O), и арилсульфинил в качестве примера включает остаток -S(O)Ph.
Термин «диалкиламино» относится к группе -NR2, где каждый из заместителей R является алкильной группой. Примеры диалкиламиногрупп включают -N(CH3)2, -N(CH2CH2CH2CH3)2 и N(CH3)(CH2CH2CH2CH3).
Термин «карбоксил» относится к фрагменту -C(O)OH.
Термин «сложный эфир карбоновой кислоты» в настоящей заявке относится к группам -C(O)O-алкил, -C(O)O-замещенный алкил, -C(O)O-арил, -C(O)O-замещенный арил, -C(O)O-алкенил, -C(O)O-замещенный алкенил, -C(O)O-алкинил, -C(O)O-замещенный алкинил, -C(O)O-гетероарил, -C(O)O-замещенный гетероарил, -C(O)O-гетероциклил или -C(O)O-замещенный гетероциклил.
Термин «ациламино» относится к группе -C(O)NRaRb, где каждая из групп Ra и Rb независимо выбрана из группы, состоящей из водорода, алкила, замещенного алкила, алкенила, замещенного алкенила, алкинила, замещенного алкинила, арила, замещенного арила, гетероарила, замещенного гетероарила, гетероциклила, замещенного гетероциклила, или же группы Ra и Rb могут быть объединены совместно с атомом азота в гетероцикл или замещенный гетероцикл. Примеры фрагмента ациламино включают -C(O)морфолино.
Термин «сульфониламино» относится к группам -SO2NH2, -SO2NR-алкил, -SO2NR-замещенный алкил, -SO2NR-алкенил, -SO2NR-замещенный алкенил, -SO2NR-алкинил, -SO2NR-замещенный алкинил, -SO2NR-арил, -SO2NR-замещенный арил, -SO2NR-гетероарил, -SO2NR-замещенный гетероарил, -SO2NR-гетероциклил и -SO2NR-замещенный гетероциклил, где R означает водород или алкил, или -SO2NR2, где две группы R вместе с атомом азота, к которому они присоединены, образуют гетероцикл или замещенный гетероцикл.
Термин «карбониламино» относится к группам -CONH2, -CONR-алкил, -CONR-замещенный алкил, -CONR-алкенил, -CONR-замещенный алкенил, -CONR-алкинил, -CONR-замещенный алкинил, -CONR-арил, -CONR-замещенный арил, -CONR-гетероарил, -CONR-замещенный гетероарил, -CONR-гетероциклил и -CONR-замещенный гетероциклил, где R представляет собой водород или алкил, или -CONR2, где две группы R вместе с атомом азота, к которому они присоединены, образуют гетероцикл или замещенный гетероцикл.
Термин «фармацевтически приемлемая соль» относится к фармацевтически приемлемым солям соединений, описанных в настоящей заявке, таких как соединения формул (I), (II) или (III), или других доноров нитроксила по настоящему изобретению, причем эти соли могут быть получены из широкого круга органических и неорганических противоионов, хорошо известных в технике, и включают, только в качестве примера, соли натрия, калия, кальция, магния, аммония, тетраалкиламмония и т.п.; если молекула включает основный функциональный фрагмент соли органических или неорганических кислот, такие как гидрохлорид, гидробромид, тартрат, мезилат, ацетат, малеат, оксалат и т.п. Иллюстративные примеры солей включают, не ограничиваясь этим, сульфат, цитрат, ацетат, хлорид, бромид, иодид, нитрат, бисульфат, фосфат, кислый фосфат, лактат, салицилат, кислый цитрат, тартрат, олеат, таннат, пантотенат, битартрат, аскорбат, сукцинат, малеат, безилат, фумарат, глюконат, глюкаронат, сахарат, формиат, бензоат, глутамат, метансульфоонат, этансульфонат, бензолсульфонат и п-толуолсульфонат. Соответственно, соль может быть получена из соединения любой из формул, раскрытых в настоящей заявке, имеющего кислотные функциональные группы, например, функциональные группы карбоновой кислоты, и фармацевтически приемлемого неорганического или органического основания. Подходящие основания включают, не ограничиваясь этим, гидроксиды щелочных металлов, например, натрия, калия и лития; гидроксиды щелочноземельных металлов, например, кальция и магния; гидроксиды других металлов, например, алюминия и цинка; аммиак и органические амины, например, незамещенные или гидроксизамещенные моно-, ди- или триалкиламины; дициклогексиламин; трибутиламин; пиридин; N-метил, N-этиламин; диэтиламин; триэтиламин; моно-, бис- или трис-(2-гидрокси-низший алкил амины), например, моно-, бис- или трис-(2-гидроксиэтил)амин, 2-гидрокси-трет-бутиламин или трис-(гидроксиметил)метиламин, N,N-ди-низший алкил-N-(гидрокси низший алкил)амины, например, N,N-диметил-N-(2-гидроксиэтил)амин или три(2-гидроксиэтил)амин; N-метил-D-глюкамин; а также аминокислоты, например, аргинин, лизин и т.п. Соли можно получать также из соединения любой из формул, раскрытых в настоящей заявке, имеющего основные функциональные группы, например, аминогруппы, и фармацевтически приемлемой неорганической или органической кислоты. Подходящие кислоты включают серную кислоту, лимонную кислоту, уксусную кислоту, хлористоводородную кислоту (HCl), бромистоводородную кислоту (HBr), иодистоводородную кислоту (HI), азотную кислоту, фосфорную кислоту, молочную кислоту, салициловую кислоту, винную кислоту, аскорбиновую кислоту, янтарную кислоту, малеиновую кислоту, безиловую кислоту, фумаровую кислоту, глюконовую кислоту, глюкуроновую кислоту, муравьиную кислоту, бензойную кислоту, глутаминовую кислоту, метансульфоновую кислоту, этансульфоновую кислоту, бензолсульфоновую кислоту и п-толуолсульфоновую кислоту.
Если в тексте явно не указано иное, «индивидуум» в настоящем описании означает млекопитающее, включая человека, но не ограничиваясь только им.
Термин «эффективное количество» предполагает такое количество соединения или его фармацевтически приемлемой соли, которое с учетом его характеристик эффективности и токсичности, а также на основе знаний практикующего специалиста должно оказаться эффективным при данной форме лечения. Как предполагается в технике, эффективное количество может быть введено в виде одной или нескольких доз.
В настоящем описании термин «лечение» означает способ получения полезного или желательного результата, в т.ч. клинического результата. Для целей настоящего изобретения, полезные или желательные результаты включают, не ограничиваясь этим, задержку и/или подавление наступления и/или развития заболевания или состояния, которое реагирует на лечение нитроксилом, или уменьшение тяжести такого заболевания или состояния, как, например, уменьшение количества и/или тяжести симптомов, связанных с заболеванием или состоянием, повышение качества жизни индивидуума, страдающего от заболевания или состояния, уменьшение дозы другого лекарственного средства, требуемого для лечения указанного заболевания или состояния, усиления действия на индивидуума другого лекарственного средства, которое принимается для лечения заболевания или состояния и увеличение срока жизни индивидуума, у которого имеется указанное заболевание или состояние. Заболевание или состояние может быть сердечно-сосудистым заболеванием или состоянием, включая, но не ограничиваясь перечисленным, коронарную обструкцию, болезнь коронарных артерий (CAD), стенокардию, сердечный приступ, инфаркт миокарда, высокое кровяное давление, ишемическую кардиомиопатию и инфаркт, диастолическую сердечную недостаточность, застой крови в легких, отек легких, фиброз сердца, болезнь сердечных клапанов, перикардиальные заболевания, состояния застоя кровообращения, периферический отек, асцит, болезнь Чагаса, гипертрофию желудочков, заболевания клапанов сердца, сердечную недостаточность, включая, но не ограничиваясь этим, застойную сердечную недостаточность, например, острую застойную сердечную недостаточность и острую декомпенсированную сердечную недостаточность. Родственные симптомы, которые могут быть облегчены способами по настоящему изобретению, включают затруднение дыхания, слабость, раздутые лодыжки ног, стенокардию, потерю аппетита, увеличение или потерю массы тела, связанные с упомянутыми выше заболеваниями или расстройствами. Заболевание или состояние может включать поражение от ишемии/реперфузии.
В настоящем описании термины «предупреждение», «профилактика» относятся к уменьшению вероятности развития расстройства или состояния у индивидуума, у которого его еще нет, но существует угроза развития заболевания или состояния.
Индивидуум, находящийся «под угрозой» может иметь или не иметь обнаружимого заболевания или состояния, а также может иметь или не иметь проявившегося обнаруживаемого заболевания или состояния до применения способов лечения, описанных в настоящей заявке. Термин «под угрозой» означает, что у индивидуума присутствуют один или несколько т.н. факторов риска, которые являются измеримыми параметрами, коррелирующими с развитием заболевания или состояния и известными в технике. Индивидуум, у которого присутствуют один или несколько этих факторов риска, имеет более высокую вероятность развития заболевания или состояния, чем индивидуум без этого фактора (факторов) риска.
Термин «нитроксил» относится к частицам HNO.
В настоящем описании соединение является «донором нитроксила», если оно высвобождает нитроксил в физиологических условиях. В описании донор нитроксила по настоящему изобретению может альтернативно именоваться «соединение» или «это соединение». Предпочтительно, донор нитроксила способен высвобождать эффективное количество нитроксила in vivo и имеет профиль безопасности, показывающий, что соединение переносится индивидуумом в количестве, необходимом для достижения терапевтического эффекта. Специалист в данной области техники был бы способен определить безопасность введения конкретных соединений и дозировок живым субъектам. Специалист в данной области может также определить является ли соединение донором нитроксила, путем оценки того, высвобождает ли оно HNO в физиологических условиях. Соединения легко тестируются на высвобождение нитроксила с помощью стандартных экспериментов. Хотя непосредственно измерить выделяется ли нитроксил практически невозможно, имеется несколько тестов, пригодных для определения того, высвобождает ли соединение нитроксил. Например, представляющее интерес соединение можно пометить в раствор, например, в воде, в запаянный контейнер. По истечении времени, достаточного для диссоциации, например, от нескольких минут до нескольких часов, отбирают пробу газа над жидкостью и анализируют для определения состава, например, с применением газовой хроматографии и/или масс-спектроскопии. Если образовалась газообразная N2O (которая возникает при димеризации HNO), проба на выделение нитроксила считается положительной и соединение является донором нитроксила. Уровень способности к высвобождению нитроксила может быть выражен в виде процента от теоретического максимума для данного соединения. Под соединением, которое высвобождает «значительное количество нитроксила» подразумевают соединение, которое высвобождает 40% или более, или 50% или более от своего теоретически максимального количества нитроксила. В одном из вариантов, соединения, предназначенные для применения по настоящему изобретению, высвобождают 60% или более от теоретически максимального количества нитроксила. В другом варианте, соединения, предназначенные для применения по настоящему изобретению, высвобождают 70% или более от теоретически максимального количества нитроксила. В другом варианте, соединения, предназначенные для применения по настоящему изобретению, высвобождают 80% или более от теоретически максимального количества нитроксила. В другом варианте, соединения, предназначенные для применения по настоящему изобретению, высвобождают 90% или более от теоретически максимального количества нитроксила. В еще одном варианте, соединения, предназначенные для применения по настоящему изобретению, высвобождают от примерно 70% до примерно 90% от теоретически максимального количества нитроксила. В еще одном варианте, соединения, предназначенные для применения по настоящему изобретению, высвобождают от примерно 85% до примерно 95% от теоретически максимального количества нитроксила. В еще одном варианте, соединения, предназначенные для применения по настоящему изобретению, высвобождают от примерно 90% до примерно 95% от теоретически максимального количества нитроксила. Соединения, которые высвобождают менее 40% или менее 50% от теоретически возможного для них количества нитроксила все-таки остаются донорами нитроксила и могут применяться в раскрытом в настоящей заявке изобретении. Соединение, которое высвобождает менее 50% теоретически возможного количества нитроксила может применяться в описанных способах, причем могут потребоваться более высокие уровни дозировки по сравнению с соединениями, которые высвобождают значительные количества нитроксила. Высвобождение нитроксила также может быть обнаружено при действии на тестируемое соединение метмиоглобина (Mb3+). Нитроксил взаимодействует с Mb3+, образуя комплекс Mb2+-NO, который может быть обнаружен по изменению ультрафиолетового/видимого спектра или способом Электронного Парамагнитного Резонанса (ЭПР). Комплекс Mb2+-NO имеет сигнал ЭПР, центрированный около g-фактора примерно 2. С другой стороны оксид азота (II) взаимодействует с Mb3+, образуя комплекс Mb3+-NO, который не проявляется в спектре ЭПР. Соответственно если испытуемое соединение взаимодействует с Mb3+, образуя комплекс, обнаруживаемый обычными способами, такими как спектроскопия в ультрафиолетовой/видимой области или ЭПР, то тест на высвобождение нитроксила является положительным. Тестирование на высвобождение нитроксила может осуществляться при характерных для физиологического окружения значениях pH.
Термин «положительный инотроп» в настоящем описании относится к агенту, который усиливает сократительную функцию сердца. В число таких агентов входят агонисты бета-адренергического рецептора, ингибиторы активности фосфодиэстеразы и препараты, повышающие чувствительность к кальцию. Агонисты бета-адренергического рецептора включают, в числе прочих, дофамин, добутамин, тербуталин и изопротеренол. Также имеются в виду аналоги и производные этих соединений. Например, в патенте США № 4663351 описаны пролекарства добутамина, которые можно принимать перорально. Специалист в данной области техники мог бы определить, способно ли соединение вызывать положительный инотропный эффект, а также дополнительные соединения, являющиеся бета-агонистами. В конкретных вариантах осуществления агонист бета-рецептора проявляет селективность в отношении рецептора бета-1. Однако в других вариантах осуществления бета-агонист проявляет селективность в отношении рецептора бета-2, или не является селективным в отношении какого-либо конкретного рецептора.
Под заболеваниями или состояниями, которые «реагируют на лечение нитроксилом», подразумеваются любые заболевания или состояния, при которых введение соединения, высвобождающего в физиологических условиях эффективное количество нитроксила, способствует лечению и/или предупреждению этого заболевания или состояния, в соответствии с определениями этих терминов, данными в настоящем описании. Заболевание или состояние, симптомы которых подавляются или уменьшаются при введении донора нитроксила, представляет собой заболевание или состояние, реагирующее на лечение нитроксилом. Не ограничивающие примеры заболеваний или состояний, которые реагируют на лечение нитроксилом, включают коронарную обструкцию, болезнь коронарных артерий (CAD), стенокардию, сердечный приступ, инфаркт миокарда, высокое кровяное давление, ишемическую кардиомиопатию и инфаркт, диастолическую сердечную недостаточность, застой крови в легких, отек легких, фиброз сердца, болезнь сердечных клапанов, перикардиальные заболевания, состояния застоя кровообращения, периферический отек, асцит, болезнь Чагаса, гипертрофию желудочков, заболевания клапанов сердца, сердечную недостаточность, включая, но не ограничиваясь этим, застойную сердечную недостаточность, например, острую застойную сердечную недостаточность и острую декомпенсированную сердечную недостаточность. Имеются в виду также другие сердечно-сосудистые заболевания или состояния, как например, заболевания или состояния, которые включают поражение от ишемии/реперфузии.
N-гидроксилсульфонамидные соединения
Соединения по настоящему изобретению и предназначенные для применения в способах, описанных в настоящей заявке, включают N-гидроксилсульфонамиды, которые высвобождают нитроксил в физиологических условиях. Предпочтительно, чтобы эти соединения высвобождали в физиологических условиях преимущественно нитроксил, что означает, что соединение, которое высвобождает в физиологических условиях как нитроксил, так и оксид азота (II), выделяет больше нитроксила, чем оксида азота (II). Предпочтительно, соединения, предназначенные для применения в настоящем изобретении, не высвобождают в физиологических условиях значительных количеств оксида азота (II). Наиболее предпочтительно, соединения, предназначенные для применения по настоящему изобретению, высвобождают значительные количества нитроксила в физиологических условиях.
В одном из вариантов осуществления изобретение охватывает соединение формулы (I):
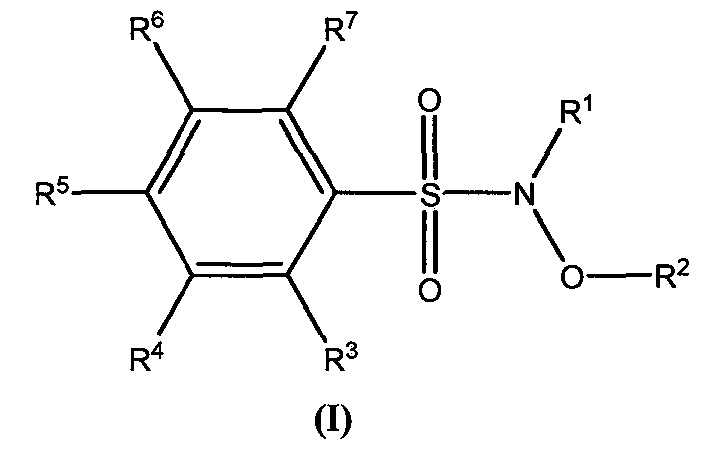
где заместитель R1 представляет собой H; заместитель R2 представляет собой H, аралкил или гетероциклил; заместители R3, R4, R5, R6 и R7 независимо выбраны из группы, состоящей из H, галогена, алкилсульфонила, N-гидроксилсульфонамидила, пергалогеналкила, нитро, арила, циано, алкокси, пергалогеналкокси, алкила, замещенной арилоксигруппы, алкилсульфанила, алкилсульфинила, гетероциклоалкила, замещенного гетероциклоалкила, диалкиламино, циклоалкокси, циклоалкилсульфанила, арилсульфанила, арилсульфинила, карбоксила, сложного эфира карбоксила, ациламино и сульфониламино, при условии, что хотя бы один из заместителей R3, R4, R5, R6 и R7 представляет собой карбоксил, сложный эфир карбоксила, ациламино или сульфониламиногруппу.
В другом варианте осуществления, соединение соответствует формуле (I), где заместитель R1 представляет собой H; заместитель R2 представляет собой H, аралкил или гетероциклил; заместители R4, R5 и R6 независимо представляют собой H, галоген, алкилсульфонил, N-гидроксилсульфонамидил, пергалогеналкил, нитро, арил, циано, алкокси, пергалогеналкокси, алкил, замещенную арилоксигруппу, алкилсульфанил, алкилсульфинил, гетероциклоалкил, замещенный гетероциклоалкил, диалкиламино, циклоалкокси, циклоалкилсульфанил, арилсульфанил, арилсульфинил, карбоксил, сложный эфир карбоксила, ациламино или сульфониламино; по меньшей мере один из заместителей R3 и R7 является электроноакцепторной группой или группой, которая пространственно экранирует сульфонильный фрагмент, при условии, что хотя бы один из заместителей R3, R4, R5, R6 и R7 представляет собой карбоксил, сложный эфир карбоксила, ациламино или сульфониламиногруппу. В одном из вариантов по меньшей мере один из заместителей R3 или R7 является электроноакцепторной группой. В другом варианте оба заместителя R3 и R7 являются электроноакцепторными группами. В другом варианте, по меньшей мере один из заместителей R3 или R7 является группой, которая пространственно экранирует сульфонильный фрагмент соединения (I). В одном из вариантов по меньшей мере один из заместителей R3 или R7 является разветвленной алкильной группой, например, изопропилом или т-бутилом. В другом варианте оба заместителя R3 и R7 являются алкильными группами, при условии, что одна из этих алкильных групп представляет собой разветвленную алкильную группу, например, когда обе эти группы являются изопропилами или когда одна группа является этилом и другая группа является втор-бутилом. В одном из вариантов один из заместителей R3 и R7 является электроноакцепторной группой и другой заместитель из числа R3 или R7, который не является электроноакцепторной группой, представляет собой алкильную группу, которая может быть разветвленной алкильной группой, например, изопропилом.
Кроме того, изобретение охватывает соединения формулы (I), в которых R1 представляет собой H; R2 представляет собой H, бензил или тетрагидропиран-2-ил; R3, R4, R5, R6 и R7 независимо выбраны из группы, состоящей из H, Cl, F, I, Br, SO2CH3, SO2NHOH, CF3, NO2, фенила, CN, OCH3, OCF3, t-Bu, O-iPr, 4-нитрофенилокси (OPh4-NO2), пропан-2-тиила (SCH(CH3)2), пропан-2-сульфинила (S(O)CH(CH3)2)), морфолино, N-метилпиперазино, диметиламино, пиперидино, циклогексилокси, циклопентилсульфанила, фенилсульфанила, фенилсульфинила, карбоксила, сложного эфира карбоксила, ациламино или сульфониламино при условии, что по меньшей мере один из заместителей R3, R4, R5, R6 и R7 представляет собой карбоксил, сложный эфир карбоксила, ациламино или сульфониламино.
В любые варианты осуществления, описанные для формулы (I), включены варианты формулы (I), в которых R1 представляет собой H и R2 представляет собой H, бензил или тетрагидрофуран-2-ил. В одном из вариантов, соединение является соединением формулы (I), в котором по меньшей мере два заместителя из числа R3, R4, R5, R6 и R7 являются галогенами, например, соединением формулы (I), в котором R5 представляет собой галоген (например, F или Br) и один из заместителей R3 и R7 является галогеном (например, Br или Cl), или в котором оба заместителя R3 и R7, или оба заместителя R3 и R4 являются галогенами (например, где оба являются Cl или оба являются F, или один из них является Cl и один F), и оставшиеся заместители соответствуют приведенным выше вариантам. В одном из вариантов, соединение является соединением формулы (I), в котором по меньшей мере один из заместителей R3, R4, R5, R6 и R7 представляет собой -S(O)2алкил, например, один из заместителей R3 или R7 представляет собой -S(O)2CH3. В одном из вариантов, соединение является соединением формулы (I), в котором по меньшей мере один из заместителей R3, R5 и R7 представляет собой пергалогеналкил, например, R3 представляет собой CF3, или R3 и R5 представляют собой CF3. В одном из вариантов, соединение по настоящему изобретению является соединением формулы (I), в котором R5 представляет собой CF3, и по меньшей мере один из заместителей R3 и R7 отличается от H, например, R5 представляет собой CF3, и R3 представляет собой NO2 или Cl. В одном из вариантов, соединение представляет собой соединение формулы (I), в котором по меньшей мере один из заместителей R3, R4, R5, R6 и R7 представляет собой арильную группу, например, по меньшей мере один из заместителей R3 и R7 является арильной группой, например, фенилом. В одном из вариантов соединение представляет собой соединение формулы (I), в котором по меньшей мере один из заместителей R3, R4, R5, R6 и R7 представляет собой гетероциклильную группу, например, по меньшей мере один из заместителей R3, R5 и R7 является гетероциклильной группой или замещенной гетероциклильной группой, например, морфолино, N-метил, пиперазино и пиперидино. В одном из вариантов, соединение по настоящему изобретению является соединением формулы (I), в котором по меньшей мере один из заместителей R3, R4, R5, R6 и R7 представляет собой циклоалкокси или циклоалкилсульфанильную группу, например, по меньшей мере один из заместителей R3, R5 и R7 представляет собой циклогексилокси, циклопентилокси, циклогексилсульфанильную или циклопентилсульфанильную группу. В одном из вариантов, соединение является соединением формулы (I), в котором по меньшей мере один из заместителей R3, R4, R5, R6 и R7 представляет собой арилсульфанильную или арилсульфинильную группу, например, по меньшей мере один из заместителей R3, R5 и R7 является фенилсульфанильной или фенилсульфинильной группой.
В любые варианты осуществления, описанные для формулы (I), включены варианты формулы (I), в которых по меньшей мере один из заместителей R3, R4, R5, R6 и R7 представляет собой карбоксил. В одном из таких вариантов R4 представляет собой карбоксил, R3, R5 и R6 представляют собой атомы H, и R7 является H или галогеном. В конкретном варианте, R4 представляет собой карбоксил, R3, R5 и R6 представляют собой атомы H, R7 является H или галогеном, и заместители R1 и R2 представляют собой атомы H. В любые варианты осуществления, описанные для формулы (I), включены варианты формулы (I), в которых по меньшей мере один из заместителей R3, R4, R5, R6 и R7 представляет собой фрагмент -COO-алкил. В одном из таких вариантов R3 представляет собой -COO-алкил, и заместители R4, R5, R6 и R7 представляет собой атомы H. В конкретном варианте осуществления, R3 представляет собой -COO-алкил, заместители R4, R5, R6 и R7 представляет собой атомы H, и заместители R1 и R2 представляют собой атомы H. В другом варианте заместитель R4 представляет собой -COO-алкил, один из заместителей R6 и R7 представляет собой -SR11, арил, -OR11, нитро, циано, ацил, -S(O)2NHOH, сульфониламино, C1-C2перфторалкил, низший алкил или амино, и заместитель R6 или R7, который не является -SR11, арилом, -OR11, нитро, циано, ацилом, -S(O)2NHOH, сульфониламино, C1-C2 перфторалкилом, низшим алкилом или амино, представляет собой водород. В другом варианте, заместитель R4 представляет собой -COO-алкил, один из заместителей R6 и R7 представляет собой -SR11, арил, -OR11, нитро, циано, ацил, -S(O)2NHOH, сульфониламино, C1-C2перфторалкил, низший алкил или амино, и заместитель R6 или R7, который не является -SR11, арилом, -OR11, нитро, циано, ацилом, -S(O)2NHOH, сульфониламино, C1-C2перфторалкилом, низшим алкилом или амино, представляет собой водород, и заместители R1, R2, R3 и R5 являются атомами водорода. В любые варианты осуществления, описанные для формулы (I), включены варианты формулы (I), в которых по меньшей мере один из заместителей R3, R4, R5, R6 и R7 представляет собой фрагмент -COO-замещенный алкил. В одном из таких вариантов, R4 представляет собой группу -COO-замещенный алкил, заместители R3, R5 и R6 являются атомами H, и заместитель R7 представляет собой галоген. В конкретном варианте заместитель R4 представляет собой группу -COO-замещенный алкил, заместитель R7 представляет собой галоген, заместители R3, R5 и R6 являются атомами H, и заместители R1 и R2 являются атомами H. В любые варианты осуществления, описанные для формулы (I), включены варианты формулы (I), в которых по меньшей мере один из заместителей R3, R4, R5, R6 и R7 представляет собой фрагмент -C(O)NH2. В любые варианты осуществления, описанные для формулы (I), включены варианты формулы (I), в которых по меньшей мере один из заместителей R3, R4, R5, R6 и R7 представляет собой группу -C(O)NRaRb, где Ra является водородом и Rb является алкилом. В одном из таких вариантов заместитель R4 представляет собой группу -C(O)NRaRb, где Ra является водородом, Rb является низшим алкилом, заместители R3, R5 и R6 являются атомами H, и заместитель R7 представляет собой галоген. В конкретном варианте заместитель R4 представляет собой группу -C(O)NRaRb, где Ra является водородом, Rb является низшим алкилом, заместители R3, R5 и R6 являются атомами H, заместитель R7 представляет собой галоген, и заместители R1 и R2 являются атомами H. В конкретном варианте Rb представляет собой C2-C4алкил, например, этил, пропил или бутил. В другом варианте Rb представляет собой разветвленный низший алкил, например, изопропил или изобутил. В любые варианты осуществления, описанные для формулы (I), включены варианты формулы (I), в которых по меньшей мере один из заместителей R3, R4, R5, R6 и R7 представляет собой группу -C(O)NRaRb, где Ra является алкилом, замещенным алкилом или водородом, и Rb является замещенным алкилом. В одном из таких вариантов заместитель R4 представляет собой группу -C(O)NRaRb, где Ra является алкилом, замещенным алкилом или водородом, Rb является замещенным алкилом, заместители R3, R5 и R6 являются атомами H, и заместитель R7 представляет собой галоген. В конкретном варианте заместитель R4 представляет собой группу -C(O)NRaRb, где Ra является алкилом, замещенным алкилом или водородом, Rb является замещенным алкилом, заместители R3, R5 и R6 являются атомами H, заместитель R7 представляет собой галоген, и заместители R1 и R2 являются атомами H. В еще одном варианте заместитель R4 представляет собой группу -C(O)NRaRb, где Ra является низшим алкилом, замещенным низшим алкилом или водородом, Rb является замещенным низшим алкилом, заместители R3, R5 и R6 являются атомами H, и заместитель R7 представляет собой галоген. Если заместитель Rb представляет собой замещенную низшую алкильную группу, в одном из вариантов он является низшим алкилом, замещенным гидроксилом, карбоксилом, амино или алкоксигруппой. Например, настоящее изобретение охватывает соединения, в которых R4 представляет собой группу -C(O)NRaRb, где Ra является водородом, метилом, этилом или низшим алкилом, замещенным гидроксилом или алкоксигруппой, Rb является низшим алкилом, замещенным гидроксилом, карбоксилом, амино или алкоксигруппой, заместители R3, R5 и R6 являются атомами H, и заместитель R7 представляет собой галоген; в дополнительном варианте заместители R1 и R2 являются атомами H. В любые варианты осуществления, описанные для формулы (I), включены варианты формулы (I), в которых по меньшей мере один из заместителей R3, R4, R5, R6 и R7 представляет собой группу -C(O)NRaRb, где Ra и Rb являются независимо выбранными алкилами. В одном из таких вариантов заместитель R4 представляет собой группу -C(O)NRaRb, где Ra и Rb являются независимо выбранными алкилами, заместители R3, R5 и R6 являются атомами H, и заместитель R7 представляет собой галоген. В другом варианте заместитель R4 представляет собой группу -C(O)NRaRb, где Ra и Rb являются независимо выбранными алкилами, заместители R3 и R5 являются атомами водорода, и один из заместителей R6 и R7 представляет собой -SR11, арил, -OR11, нитро, циано, ацил, -S(O)2NHOH, сульфонамино, C1-C2перфторалкил, низший алкил или амино, и заместитель R6 или R7, который не является -SR11, арилом, -OR11, нитро, циано, ацилом, -S(O)2NHOH, сульфониламино, C1-C2 перфторалкилом, низшим алкилом или амино, представляет собой водород. В конкретном варианте R4 представляет собой группу -C(O)NRaRb, где Ra и Rb являются независимо выбранными алкилами, заместители R3, R5 и R6 являются атомами H, заместитель R7 представляет собой галоген, и заместители R1 и R2 являются атомами H. Заместители Ra и Rb могут быть одинаковыми или различными, например, в одном варианте оба заместителя Ra и Rb являются метилами или этилами. В любые варианты осуществления, описанные для формулы (I), включены варианты формулы (I), в которых по меньшей мере один из заместителей R3, R4, R5, R6 и R7 представляет собой группу -C(O)NRaRb, где Ra и Rb совместно с атомом азота, к которому они присоединены, образуют гетероцикл или замещенный гетероцикл. В одном из таких вариантов заместитель R4 представляет собой группу -C(O)NRaRb, где Ra и Rb совместно с атомом азота, к которому они присоединены, образуют гетероцикл или замещенный гетероцикл. В другом варианте заместитель R4 представляет собой группу -C(O)NRaRb, где Ra и Rb совместно с атомом азота, к которому они присоединены, образуют гетероцикл или замещенный гетероцикл, заместители R3, R5 и R6 являются атомами H, и заместитель R7 представляет собой галоген. В конкретном варианте заместитель R4 представляет собой группу -C(O)NRaRb, где Ra и Rb совместно с атомом азота, к которому они присоединены, образуют гетероцикл или замещенный гетероцикл, заместители R3, R5 и R6 являются атомами H, заместитель R7 представляет собой галоген, и заместители R1 и R2 являются атомами H. В одном из вариантов, заместители Ra и Rb совместно с атомом азота, к которому они присоединены, образуют гетероцикл, например, морфолино. В любом варианте в случае, когда R4 представляет собой группу -C(O)NRaRb, в конкретном варианте, заместители Ra и Rb совместно с атомом азота, к которому они присоединены, образуют гетероцикл, выбранный из пиперазинила, азетидинила, пирролидинила, пиперидинила, тиоморфолинила и морфолинила. В любом варианте в случае, когда заместитель R4 представляет собой группу -C(O)NRaRb, в конкретном варианте, заместители Ra и Rb совместно с атомом азота, к которому они присоединены, образуют гетероцикл, замещенный 1 или 2 фрагментами, выбранными из низшего алкила, карбоксиэфира, ацила, галогена, амино, гидроксила, замещенного низшего алкила, оксо и алкокси. Например, в любом варианте осуществления в случае, когда заместитель R4 представляет собой группу -C(O)NRaRb, в конкретном варианте, заместители Ra и Rb совместно с атомом азота, к которому они присоединены, образуют замещенный гетероцикл, выбранный из 2,6-диметилпипераз-4-ила, 1-изопропилпипераз-4-ила, 1-(пиперазин-4-ил)этанона, трет-бутил пипераз-4-ил-1-карбоксилата, 4-фторпиперидила, 4,4-дифторпиперидила, 4-аминопиперидила, 4-гидроксипиперидила, 4-оксопиперидинила, 4-метоксипиперидила, 4-(2-гидроксиэтил)пиперидила, 2-(пиперид-4-ил)этоксиэтанола, 3-гидроксиазетидинила, 2-оксопиперазин-4-ила и 1-метил-2-оксопиперазин-4-ила. В любые варианты осуществления, описанные для формулы (I), включены варианты формулы (I), в которых по меньшей мере один из заместителей R3, R4, R5, R6 и R7 представляет собой группу -SO2NH2. В любые варианты осуществления, описанные для формулы (I), включены варианты формулы (I), в которых по меньшей мере один из заместителей R3, R4, R5, R6 и R7 представляет собой группу -SO2NR-алкил, где R представляет собой водород. В любые варианты осуществления, описанные для формулы (I), включены варианты формулы (I), в которых по меньшей мере один из заместителей R3, R4, R5, R6 и R7 представляет собой группу -SO2NR-алкил, где R представляет собой алкил. В конкретном варианте заместитель R4 представляет собой группу -SO2NR-алкил, где R представляет собой алкил, и заместители R3, R5, R6 и R7 являются атомами водорода. Например, в одном из вариантов заместитель R4 представляет собой группу -SO2N(низший алкил)2, и заместители R3, R5, R6 и R7 являются атомами водорода, где низшие алкильные заместители могут быть одинаковыми или различными, например, заместитель R4 может представлять собой -SO2N(Et)2 или -SO2N(Et)(Me). В любые варианты осуществления, описанные для формулы (I), включены варианты формулы (I), в которых по меньшей мере один из заместителей R3, R4, R5, R6 и R7 представляет собой группу -SO2NR2, где две группы R, совместно с атомом азота, к которому они присоединены, образуют гетероцикл или замещенный гетероцикл. В одном из таких вариантов, заместитель R3 представляет собой группу -SO2NR2, где две группы R, совместно с атомом азота, к которому они присоединены, образуют гетероцикл или замещенный гетероцикл. В другом варианте, заместитель R3 представляет собой группу -SO2NR2, где две группы R, совместно с атомом азота, к которому они присоединены, образуют гетероцикл или замещенный гетероцикл, и заместители R4, R5, R6 и R7 являются атомами H. В конкретном варианте осуществления, заместитель R3 представляет собой группу -SO2NR2, где две группы R, совместно с атомом азота, к которому они присоединены, образуют гетероцикл или замещенный гетероцикл, заместители R4, R5, R6 и R7 являются атомами H, и заместители R1 и R2 являются атомами H. В одном из вариантов по меньшей мере один из заместителей R3, R4, R5, R6 и R7 представляет собой группу -SO2NR2, где две группы R, совместно с атомом азота, к которому они присоединены, образуют гетероцикл, например, циклический фрагмент морфолино.
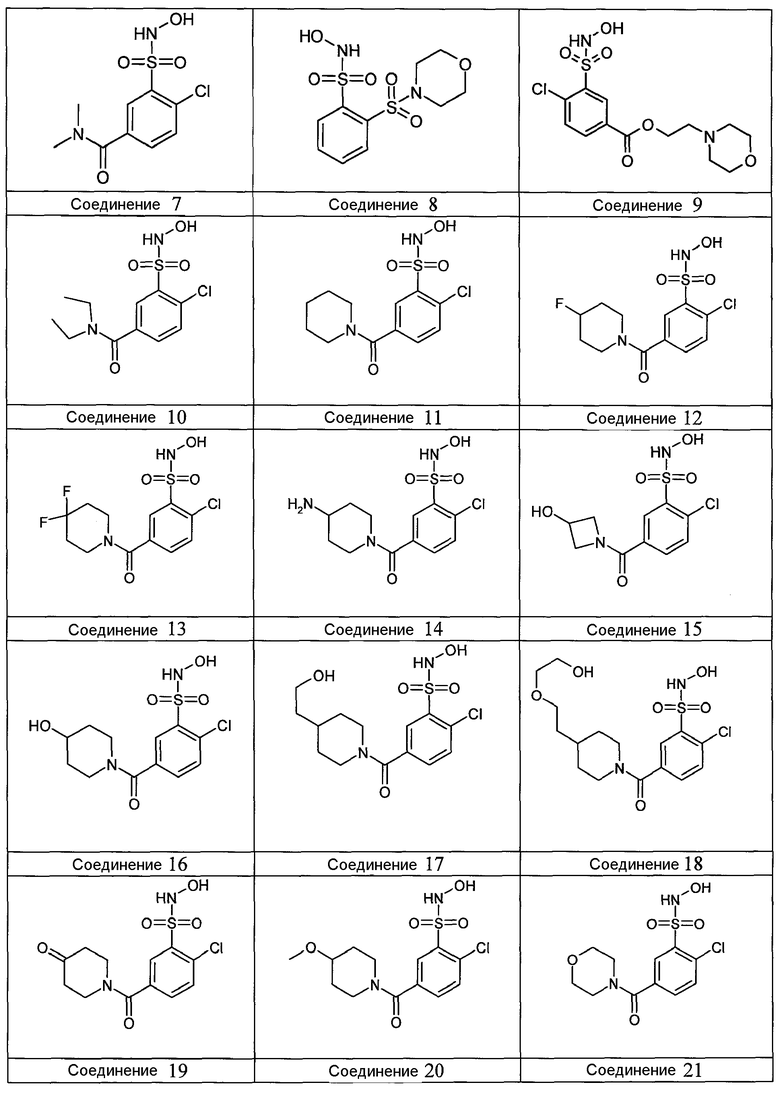
Типовые соединения формулы (I) включают, не ограничиваясь этим, соединения, приведенные в таблице 1.
Таблица 1
Типовые соединения формулы (I):




В одном из вариантов осуществления донор нитроксила, является соединением формулы (IIa):

где заместитель R1 представляет собой H; заместитель R2 представляет собой H, аралкил или гетероциклил; m и n независимо представляют собой целые числа от 0 до 1; x представляет собой целое число от 0 до 4, и y является целым числом от 0 до 3, при условии, что по меньшей мере одно из чисел x и y превышает 0; A представляет собой циклоалкил, гетероциклоалкил, ароматический или гетероароматический цикл, содержащий циклические фрагменты Q1, Q2, Q3 и Q4, которые совместно с атомами углерода в положениях a и a' образуют цикл A; B представляет собой циклоалкил, гетероциклоалкил, ароматический или гетероароматический цикл, содержащий циклические фрагменты Q5, Q6, Q7 и Q8, которые совместно с атомами углерода в положениях a и a' образуют цикл B; Q1, Q2, Q3, Q4, Q5, Q6, Q7 и Q8 независимо выбраны из группы, состоящей из C, CH2, CH, N, NR10, O и S; каждый из заместителей R8 и R9 независимо выбран из группы, состоящей из галогена, алкилсульфонила, N-гидроксилсульфонамидила, пергалогеналкила, нитро, арила, циано, алкокси, пергалогеналкокси, алкила, замещенной арилоксигруппы, алкилсульфанила, алкилсульфинила, гетероциклоалкила, замещенного гетероциклоалкила, диалкиламино, групп NH2, OH, C(O)OH, C(O)Oалкил, NHC(O)алкилC(O)OH, C(O)NH2, NHC(O)алкилC(O)алкил, NHC(O)алкенилC(O)OH, NHC(O)NH2, OалкилC(O)Oалкил, NHC(O)алкил, C(=N-OH)NH2, циклоалкокси, циклоалкилсульфанила, арилсульфанила, арилсульфинила, карбониламино и сульфониламино, при условии, что по меньшей мере один заместитель R8 представляет собой карбониламино или сульфониламино; и заместитель R10 представляет собой H, алкил, ацил или сульфонил.
В одном из вариантов, соединение по настоящему изобретению представляет собой соединение формулы (II) или (IIa), в котором каждый из заместителей R8 и R9 независимо выбран из группы, состоящей из Cl, F, I, Br, SO2CH3, SO2NHOH, CF3, CH3, NO2, фенила, CN, OCH3, OCF3, t-Bu, O-iPr, 4-нитрофенилокси(OPh4-NO2), пропан-2-тиила(SCH(CH3)2), пропан-2-сульфинила(S(O)CH(CH3)2), морфолино, N-метилпиперазино, диметиламино, пиперидино, циклогексилокси, циклопентилсульфанила, фенилсульфанила, фенилсульфинила, карбониламино и сульфониламино, при условии, что по меньшей мере один заместитель R8 представляет собой карбониламино или сульфониламино; и R10 представляет собой H, алкил, ацил или сульфонил, при условии, что если циклы A и B образуют нафталин, x является целым числом от 1 до 3, или y является целым числом от 2 до 4.
В любые варианты осуществления, описанные для формул (II) или (IIa), включены варианты формул (II) или (IIa), в которых заместитель R1 представляет собой H, и заместитель R2 представляет собой H, бензил или тетрагидропиран-2-ил. В одном из вариантов, A и B образуют бензофуран, бензотиофен, бензоимидазол, N-алкилбензоимидазол (например, N-метилбензоимидазол), N-ацилбензоимидазол (например, N-C(O)CH3бензоимидазол), бензотиазол или бензооксазол. В одном из вариантов, A и B отличаются от нафтила или хинолина. В одном из вариантов, A и B являются нафтилом или хинолином. В одном из вариантов, A и B образуют бензофуран. В одном из вариантов, A и B образуют бензотиофен. В одном из вариантов, A и B образуют бензотиофен, y равен 0, и x равен 1. В одном из вариантов, A и B образуют нафтил и x равен 0, y равен 1. В одном из вариантов цикл A является фенильной группой, и цикл B является гетероарильной группой, например, циклы A и B образуют хинолин, и цикл B является азотсодержащим циклом. Кроме того, изобретение охватывает соединения по любому из вариантов формул (II) или (IIa), где y равен 0, x равен 1, и заместитель R9 представляет собой галоген, алкил или пергалогеналкил. Помимо этого, изобретение охватывает соединения по любому из вариантов формул (II) или (IIa), где x равен 2, и y равен 0.
В любые варианты осуществления, описанные для формул (II) или (IIa), включены варианты формул (II) или (IIa), в которых по меньшей мере один из заместителей R8 и R9 представляет собой -CONH-алкил. В любые варианты осуществления, описанные для формул (II) или (IIa), включены варианты формул (II) или (IIa), в которых по меньшей мере один из заместителей R8 и R9 представляет собой -CONR-алкил, где R означает алкил. В любые варианты осуществления, описанные для формул (II) или (IIa), включены варианты формул (II) или (IIa), в которых по меньшей мере один из заместителей R8 и R9 представляет собой -CONR2, где каждый из заместителей R представляет собой независимо выбранный алкил. В конкретном варианте формул (II) или (IIa), y равен 0, x равен 1, и R9 представляет собой -CONR2, где каждый из заместителей R представляет собой независимо выбранный алкил. В другом варианте формул (II) или (IIa), y равен 0, x равен 1, и R9 представляет собой -CONR2, где каждый из заместителей R представляет собой независимо выбранный низший алкил, где оба низших алкила могут быть одинаковыми (например, -CON(Me)2) или различными. В любые варианты осуществления, описанные для формул (II) или (IIa), включены варианты формул (II) или (IIa), в которых по меньшей мере один из заместителей R8 и R9 представляет собой -CONR2, где оба заместителя R совместно с атомом азота, к которому они присоединены, образуют гетероцикл или замещенный гетероцикл. В любые варианты осуществления, описанные для формул (II) или (IIa), включены варианты формул (II) или (IIa), в которых по меньшей мере один из заместителей R8 и R9 представляет собой группу -CONR2, где каждый из заместителей R представляет собой независимо выбранный алкил. В любые варианты осуществления, описанные для формул (II) или (IIa), включены варианты формул (II) или (IIa), в которых по меньшей мере один из заместителей R8 и R9 представляет собой группу -NRaSO2NR-алкил, где Ra и R независимо представляют собой водород или алкил. В любые варианты осуществления, описанные для формул (II) или (IIa), включены варианты формул (II) или (IIa), в которых по меньшей мере один из заместителей R8 и R9 представляет собой -SO2NH2. В любые варианты осуществления, описанные для формул (II) или (IIa), включены варианты формул (II) или (IIa), в которых по меньшей мере один из заместителей R8 и R9 представляет собой -SO2NH2. В любые варианты осуществления, описанные для формул (II) или (IIa), включены варианты формул (II) или (IIa), в которых по меньшей мере один из заместителей R8 и R9 представляет собой группу -SO2NR-алкил, где R означает водород или алкил. В любые варианты осуществления, описанные для формул (II) или (IIa), включены варианты формул (II) или (IIa), в которых по меньшей мере один из заместителей R8 и R9 представляет собой группу -SO2NR2, где две группы R совместно с атомом азота, к которому они присоединены, образуют гетероцикл или замещенный гетероцикл. В конкретном варианте формул (II) или (IIa), y равен 0, x равен 1, и заместитель R9 представляет собой -SO2NR2, где обе группы R совместно с атомом азота, к которому они присоединены, образуют гетероцикл. В другом варианте формул (II) или (IIa), y равен 0, x равен 1, и заместитель R9 представляет собой -SO2NR2, где обе группы R совместно с атомом азота, к которому они присоединены, образуют группу морфолино.
Типовые соединения формулы (IIa) включают, не ограничиваясь этим, соединения, приведенные в таблице 2.
Таблица 2
Типовые соединения формулы (IIa):

В другом варианте осуществления донор нитроксила представляет собой соединение формулы (III):

где заместитель R1 представляет собой H; заместитель R2 представляет собой H, аралкил или гетероциклил; n означает целое число от 0 до 1; b является целым числом от 1 до 4; С представляет собой гетероароматический цикл, содержащий циклические фрагменты Q9, Q10, Q11, Q12, Q13 и Q14, которые независимо выбраны из группы, состоящей из C, CH2, CH, N, NR10, O и S, при условии, что по меньшей мере один из фрагментов Q9, Q10, Q11, Q12, Q13 и Q14 представляет собой N, NR10, O или S; каждый из заместителей R8 независимо выбран из группы, состоящей из галогена, алкилсульфонила, N-гидроксилсульфонамидила, пергалогеналкила, нитро, арила, циано, алкокси, пергалогеналкокси, алкила, замещенной арилоксигруппы, алкилсульфанила, алкилсульфинила, гетероциклоалкила, замещенного гетероциклоалкила, диалкиламино, групп NH2, OH, C(O)OH, C(O)Oалкил, NHC(O)алкилC(O)OH, C(O)NH2, NHC(O)алкилC(O)алкил, NHC(O)алкенилC(O)OH, NHC(O)NH2, OалкилC(O)Oалкил, NHC(O)алкил, C(=N-OH)NH2, циклоалкокси, циклоалкилсульфанила, арилсульфанила, арилсульфинила, карбониламино или сульфониламино, при условии, что по меньшей мере один заместитель R8 представляет собой карбониламино или сульфониламино; и заместитель R10 представляет собой H, алкил, ацил или сульфонил.
В одном из вариантов, соединение по настоящему изобретению представляет собой соединение формулы (III), и каждый из заместителей R8 независимо выбран из группы, состоящей из Cl, F, I, Br, SO2CH3, SO2NHOH, CF3, CH3, NO2, фенила, CN, OCH3, OCF3, t-Bu, O-iPr, 4-нитрофенилокси(OPh4-NO2), пропан-2-тиила(SCH(CH3)2), пропан-2-сульфинила(S(O)CH(CH3)2), морфолино, N-метилпиперазино, диметиламино, пиперидино, циклогексилокси, циклопентилсульфанила, фенилсульфанила, фенилсульфинила, карбониламино или сульфониламино, при условии, что по меньшей мере один заместитель R8 представляет собой карбониламино или сульфониламино. В другом варианте, соединение по настоящему изобретению представляет собой соединение формулы (III), и каждый из заместителей R8 независимо выбран из группы, состоящей из F, Br, Cl, CF3, фенила, метила, SO2NHOH, морфолино, пиперидино, 4-метилпиперазино, карбониламино и сульфониламино, при условии, что по меньшей мере один заместитель R8 представляет собой карбониламино или сульфониламино.
В любые варианты осуществления, описанные для формулы (III), включены варианты формулы (III), в которых заместитель R1 представляет собой H, и заместитель R2 представляет собой H, бензил или тетрагидропиран-2-ил. В одном из вариантов n равно 0, и фрагмент C представляет собой тиофен, изоксазол, пиразол, пиррол, имидазол, фуран, тиазол, триазол, N-метилимидазол или тиадиазол. В одном из вариантов фрагмент C отличается от тиенила. В другом варианте n равно 0, и C представляет собой тиофен, изоксазол, пиразол, пиррол, имидазол, фуран, тиазол, триазол, N-метилимидазол или тиадиазол. В одном из вариантов n равно 1, и C представляет собой пиримидин, пиразин или пиридин. В одном из вариантов n равно 1, C представляет собой пиримидин, пиразин или пиридин, и b равно 1. В одном из вариантов n равно 1, C представляет собой пиримидин, пиразин или пиридин, b равно 1, и по меньшей мере один из заместителей R8 представляет собой хлор, морфолино, пиперидино или N-метилпиперазино. В одном из вариантов фрагмент C является тиофеном, и b равно 1. В одном из вариантов фрагмент C является тиофеном, b равно 1, и по меньшей мере один заместитель R8 является галогеном. В одном из вариантов, фрагмент C является тиофеном.
В любые варианты осуществления, описанные для формулы (III), включены варианты формулы (III), в которых по меньшей мере один заместитель R8 представляет собой -CONH2. В одном из вариантов фрагмент C представляет собой тиофен, замещенный -CONH2 и необязательно замещенный дополнительным заместителем R8, например, аминогруппой. В любые варианты осуществления, описанные для формулы (III), включены варианты формулы (III), в которых по меньшей мере один заместитель R8 представляет собой -CONH-алкил. Например, изобретением охвачены соединения, в которых заместитель R8 представляет собой группу -CONH-низший алкил (например, изопропил). В любые варианты осуществления, описанные для формулы (III), включены варианты формулы (III), в которых по меньшей мере один заместитель R8 представляет собой группу -CONH-замещенный алкил. В конкретном варианте, C представляет собой тиофен, оба заместителя R1 и R2 являются атомами H, и по меньшей мере один заместитель R8 представляет собой группу -CONH-замещенный алкил. В любые варианты осуществления, описанные для формулы (III), включены варианты формулы (III), в которых по меньшей мере один заместитель R8 представляет собой группу -CONR- алкил, где заместитель R является алкилом. В любые варианты осуществления, описанные для формулы (III), включены варианты формулы (III), в которых по меньшей мере один заместитель R8 представляет собой группу -CONR2, где каждый из заместителей R является независимо выбранным алкилом, например, группу -CON(Me)2. В конкретном варианте, C представляет собой тиофен, b равно 2, один из заместителей R8 представляет собой группу -CONR2, где каждый из заместителей R является независимо выбранным алкилом (например, -CON(Me)2) и другой заместитель R8 представляет собой -S(O)2алкил, арил, гетероарил или -S-алкил. В любые варианты осуществления, описанные для формулы (III), включены варианты формулы (III), в которых по меньшей мере один заместитель R8 представляет собой группу -CONR2, где каждый из заместителей R является независимо выбранным замещенным алкилом, например -CH2CH2OCH3. В любые варианты осуществления, описанные для формулы (III), включены варианты формулы (III), в которых по меньшей мере один заместитель R8 представляет собой группу -CONR2, где оба заместителя R совместно с атомом азота, к которому они присоединены, образуют гетероцикл или замещенный гетероцикл. В конкретном варианте, C представляет собой тиофен, оба заместителя R1 и R2 являются атомами H, и по меньшей мере один заместитель R8 представляет собой группу -CONR2, где оба заместителя R совместно с атомом азота, к которому они присоединены, образуют гетероцикл или замещенный гетероцикл, например, морфолино. В другом варианте, C представляет собой тиофен, оба заместителя R1 и R2 являются атомами H, b означает 1 или 2, по меньшей мере один заместитель R8 представляет собой группу -CONR2, где оба заместителя R совместно с атомом азота, к которому они присоединены, образуют гетероцикл, выбранный из пиперидинила и морфолинила, и если b равно 2, заместитель R8, отличный от -CONR2, выбран из галогена, нитро и -OR11, например группы -Oалкил (например, метокси). В другом варианте, C представляет собой тиофен, оба заместителя R1 и R2 являются атомами H, b означает 1 или 2, по меньшей мере один заместитель R8 представляет собой группу -CONR2, где оба заместителя R совместно с атомом азота, к которому они присоединены, образуют гетероцикл, замещенный 1 или 2 фрагментами, выбранными из низшего алкила, карбоксиэфира, ацила, галогена, амино, гидроксила, замещенного низшего алкила, оксо и алкокси. Например, в любых вариантах, в тех случаях, когда R8 представляет собой группу -CONR2, где оба заместителя R совместно с атомом азота, к которому они присоединены, образуют замещенный гетероцикл, выбранный из 1-метилпипераз-4-ила, 4-фторпиперидила и 4-гидроксипиперидила. В любых вариантах, например, когда C является тиофеном, замещенным группой R8, представляющей собой -CONR2, фрагмент C может быть также замещен группой, выбранной из галогена, амино, гидроксила, алкокси, нитро и циано. В любые варианты осуществления, описанные для формулы (III), включены варианты формулы (III), в которых по меньшей мере один заместитель R8 представляет собой -CONR2, где каждый заместитель R является независимо выбранным алкилом. В любые варианты осуществления, описанные для формулы (III), включены варианты формулы (III), в которых по меньшей мере один заместитель R8 представляет собой группу -NRaSO2NR-алкил, где Ra и R независимо являются водородом или алкилом. В любые варианты осуществления, описанные для формулы (III), включены варианты формулы (III), в которых по меньшей мере один заместитель R8 представляет собой группу -SO2NH2. В любые варианты осуществления, описанные для формулы (III), включены варианты формулы (III), в которых по меньшей мере один заместитель R8 представляет собой группу -SO2NR-алкил, где R представляет собой водород или алкил. В любые варианты осуществления, описанные для формулы (III), включены варианты формулы (III), в которых по меньшей мере один заместитель R8 представляет собой группу -SO2NR2, где обе группы R совместно с атомом азота, к которому они присоединены, образуют гетероцикл или замещенный гетероцикл.
Типовые соединения формулы (III) включают, не ограничиваясь этим, соединения, приведенные в таблице 3.
Таблица 3
Типовые соединения формулы (III):


Соединения, предназначенные для применения в способах по настоящему изобретению
В описанных способах применяются соединения по настоящему изобретению, которые высвобождают эффективное количество нитроксила в физиологических условиях. В любых способах могут применяться N-гидроксилсульфонамидные соединения, описанные выше в разделе «N-гидроксилсульфонамидные соединения».
Для любых соединений по настоящему изобретению, например, соединений формул (I), (II) или (III), или других соединений, предназначенных для применения в способах, описанных в настоящей заявке, упоминание или изображение основного соединения подразумевает и включает все его соли, сольваты, гидраты, полиморфы или пролекарства, в случаях, когда они применимы. В силу этого, все соли, например, фармацевтически приемлемые соли, сольваты, гидраты, полиморфы и пролекарства соединений охвачены настоящим изобретением и описаны в данной заявке, как если бы любая и каждая соль, сольват, гидрат, полиморф или пролекарство были перечислены конкретно и индивидуально.
Для всех соединений, раскрытых в настоящей заявке, при наличии центра пространственной изомерии, предполагается, что изображение или описание такого соединения охватывает все возможные стереоизомеры. Композиции, содержащие соединение по меньшей мере с одним центром пространственной изомерии, также охвачены настоящим изобретением и включают рацемические смеси или смеси, содержащие энантиомерный избыток одного энантиомера или один диастереомер, или смеси диастереомеров. Все подобные изомерные формы этих соединений непосредственно включены в настоящую заявку, как если бы любая и каждая изомерная форма была перечислена конкретно и индивидуально. Соединения по настоящему изобретению могут также содержать связи (например, связи углерод-углерод), в которых вращение вокруг данной конкретной связи ограничено, например, из-за наличия цикла или двойной связи. Соответственно, все цис/транс и E/Z изомеры также непосредственно включены в настоящее изобретение. Соединения по настоящему изобретению также могут присутствовать в виде нескольких таутомерных форм, и в этом случае изобретение непосредственно включает все таутомерные формы описанного в настоящей заявке соединения, даже если может существовать только одна таутомерная форма. Также изобретение охватывает композиции в основном чистых соединений. Термин «композиция в основном чистого соединения» означает, что композиция содержит не более 25%, или не более 15%, или не более 10%, или не более 5%, или не более 3% примеси, или не более 1% примеси, например, другого биологически активного соединения, которое может включать другую стереоизомерную форму соединения, если композиция содержит один в основном чистый изомер.
Соединения по настоящему изобретению могут быть получены по общим методикам, приведенным на схемах A-D, или по способам, известным в технике. Исходные вещества для реакций либо являются коммерчески доступными, либо их можно получить по известным способам или их очевидным модификациям. Например, многие из исходных веществ можно приобрести у коммерческих поставщиков, таких как Sigms-Aldrich. Другие могут быть получены по способам или их очевидным модификациям, которые описаны в стандартных руководствах, таких как March's Advanced Organic Chemistry (John Wiley and Sons) и Larock's Comprehensive Organic Transformations (VCH Publishers Inc.).
Схема A. Общий способ синтеза N-гидроксисульфонамидов (способ 1)

На схеме A раствор гидрохлорида гидроксиламина в воде охлаждают до 0°C. По каплям добавляют раствор карбоната калия в воде, поддерживая внутреннюю температуру реакционной смеси в пределах от примерно 5°C до примерно 15°C. Реакционную смесь перемешивают в течение примерно 15 минут, после чего добавляют тетрагидрофуран (ТГФ) и метанол (MeOH). Порциями добавляют соединение A1 (в котором R представляет собой алкил, арил или гетероциклил), поддерживая температуру ниже примерно 15°C, и перемешивают реакционную смесь при комнатной температуре до полного исчезновения сульфонилхлорида из реакционной смеси по данным тонкослойной хроматографии (ТСХ). Полученную суспензию концентрируют, удаляя все летучие вещества, и экстрагируют водную суспензию диэтиловым эфиром. Органическую фракцию высушивают над сульфатом магния, фильтруют и концентрируют в вакууме, получая неочищенный N-гидроксисульфонамид A2. Очистку можно производить обычными способами, например, хроматографией, фильтрованием, кристаллизацией и т.п.
Схема B. Общий способ синтеза N-гидроксисульфонамидов (способ 2)

На схеме B раствор водного гидроксиламина в воде и ТГФ охлаждают до -5°C. Порциями добавляют соединение A1 (в котором заместитель R представляет собой алкил, арил или гетероциклил), поддерживая температуру ниже примерно 10°C, и перемешивают реакционную смесь при комнатной температуре до полного исчезновения сульфонилхлорида из реакционной смеси по данным тонкослойной хроматографии (ТСХ). Полученную суспензию концентрируют, удаляя все летучие вещества, и экстрагируют водную суспензию диэтиловым эфиром. Органическую фракцию высушивают над сульфатом магния, фильтруют и концентрируют в вакууме, получая неочищенный N-гидроксисульфонамид A2. Очистку можно производить обычными способами, например, хроматографией, фильтрованием, кристаллизацией и т.п.
Схема C. Общий способ синтеза промежуточных N-бензилоксисульфонамидов

N-бензилоксисульфонамиды являются химическими промежуточными содинениями, которые используются в качестве защищенных N-гидроксисульфонамидов с целью дальнейшей модификации фрагмента R соединения B2. На схеме C, суспензию гидрохлорида O-бензилгидроксиламина B1 в метаноле и воде добавляют к охлажденному раствору карбоната калия в воде, поддерживая внутреннюю температуру реакционной смеси ниже примерно 10°C. Реакционную смесь перемешивают в течение примерно 5 минут, после чего добавляют ТГФ и соединение A1 (в котором заместитель R представляет собой алкил, арил или гетероциклил). Перемешивают реакционную смесь при комнатной температуре до полного исчезновения сульфонилхлорида из реакционной смеси по данным ТСХ. Полученную суспензию концентрируют в вакууме, удаляя все летучие вещества, и экстрагируют водную суспензию диэтиловым эфиром. Органический слой высушивают над сульфатом натрия, фильтруют и концентрируют в вакууме, получая неочищенное целевое соединение B2. Очистку можно производить обычными способами, например, хроматографией, фильтрованием, кристаллизацией и т.п.
Защита с продукта реакции B2 может быть снята путем удаления бензильной группы. Например, к суспензии B2 в метаноле можно добавить 10% суспензию палладия на угле. Реакционную смесь перемешивают в атмосфере водорода при комнатной температуре и атмосферном давлении в течение ночи. Реакционную смесь фильтруют через микроволокнистую стеклянную бумагу. Полученный фильтрат концентрируют в вакууме и остаток очищают стандартными способами, получая соответствующий N-гидроксилсульфонамид.
Схема D. Общий способ синтеза промежуточных N-(тетрагидропиран-2-илокси)сульфонамидов

N-(тетрагидропиран-2-илокси)сульфонамиды являются химическими промежуточными соединениями, которые используются в качестве защищенных N-гидроксисульфонамидов для последующей модификации фрагмента R соединения C2. На схеме D к раствору C1 в воде при 0°C по каплям добавляют раствор карбоната калия в воде, поддерживая внутреннюю температуру реакционной смеси ниже примерно 10°C. Примерно через 15 минут по каплям добавляют метанол и ТГФ, и затем порциями соединение A1. Перемешивают реакционную смесь при комнатной температуре до полного исчезновения сульфонилхлорида из реакционной смеси по данным ТСХ. Полученную суспензию концентрируют в вакууме, удаляя все летучие вещества, и экстрагируют водную суспензию диэтиловым эфиром. Органическую фракцию высушивают над сульфатом натрия, фильтруют и концентрируют в вакууме, получая неочищенное целевое соединение C2. Очистку можно производить обычными способами, например, хроматографией, фильтрованием, кристаллизацией и т.п. Снятие защиты с соединения C2 с получением соответствующего N-гидроксилсульфонамида может быть выполнено в соответствии со способами, известными в технике.
Способы применения соединений и композиций
Соединения и композиции по настоящей заявке могут применяться для лечения и/или предупреждения наступления и/или развития заболевания или состояния, которое реагирует на лечение нитроксилом.
В объем изобретения входят способы введения индивидууму (включая индивидуума, нуждающегося в таком лечении) эффективного количества соединения для достижения желаемого эффекта. Выявление субъекта, нуждающегося в таком лечении, может осуществляться по решению врача, клинического персонала, персонала скорой помощи или других медицинских работников и может быть субъективным (например, согласно мнению) или объективным (например, по данным, измеренным согласно тестовым или диагностическим методикам).
Один из вариантов осуществления относится к способу модулирования (в т.ч. увеличения) уровней нитроксила у индивидуума in vivo, нуждающегося в этом, где указанный способ включает введение индивидууму соединения, которое высвобождает нитроксил в физиологических условиях, или его фармацевтически приемлемой соли. У индивидуума имеется потребность в модулировании нитроксилом, если у него имеется, или предполагается, что он находится под угрозой развития заболевания или состояния, которое реагирует на лечение нитроксилом.
Конкретные заболевания или состояния, охваченные способами по настоящему изобретению, включают сердечно-сосудистые заболевания, такие как сердечная недостаточность, или заболевания и состояния, которые включают или могут включать поражение от ишемии/реперфузии. Эти способы более подробно описаны ниже.
В объем настоящего изобретения входят композиции, содержащие доноры нитроксила по настоящему изобретению. Однако в описанных способах может применяться более одного донора нитроксила; например, в способах может применяться соль Анджели и N-гидроксилсульфонамид по настоящему изобретению, или же два или несколько N-гидроксилсульфонамидов по настоящему изобретению, которые можно вводить совместно или последовательно.
Сердечно-сосудистые заболевания
В настоящем изобретении разработаны способы лечения сердечно-сосудистых заболеваний, например, сердечной недостаточности, путем введения индивидууму, нуждающемуся в этом, эффективного количества по меньшей мере одного донора нитроксила. Кроме того, в изобретении разработаны способы введения индивидууму, нуждающемуся в этом, терапевтически эффективных доз по меньшей мере одного донора нитроксила в комбинации с по меньшей мере одним другим положительным инотропным агентом. Кроме того, разработаны способы введения терапевтически эффективного количества по меньшей мере одного донора нитроксила индивидууму, который получает лечение бета-антагонистами и у которого имеет место сердечная недостаточность. В настоящем изобретении разработаны способы введения соединений по настоящему изобретению в комбинации с агонистами бета-адренергического рецептора для лечения сердечной недостаточности. Такие агонисты включают дофамин, добутамин и изопроптеренол, а также аналоги и производные этих соединений. Помимо этого, в изобретении разработаны способы введения доноров нитроксила индивидуумам, получающим лечение бета-антагонистами, таким как пропранолол, метопролол, бизопролол, буциндолол и карведилол. Далее, в настоящем изобретении разработаны способы лечения конкретных классов сердечной недостаточности, например, сердечной недостаточности класса III и острой сердечной недостаточности.
В объем изобретения входит также способ лечения застойной сердечной недостаточности (CHF), в т.ч. острой застойной сердечной недостаточности, путем введения индивидууму, нуждающемуся в этом, эффективного количества по меньшей мере одного донора нитроксила, в случае когда у упомянутого индивидуума может иметься сердечная недостаточность. Также в изобретении раскрыт способ лечения CHF путем введения индивидууму, нуждающемуся в этом, эффективного количества по меньшей мере одного донора нитроксила в комбинации с эффективным количеством по меньшей мере одного другого положительного инотропного агента, где у упомянутого индивидуума может иметься сердечная недостаточность. В одном из вариантов этот другой положительный инотроп представляет собой агонист бета-адренергического рецептора, например, добутамин. Комбинированное введение донора нитроксила и по меньшей мере одного другого положительного инотропного агента включает введение донора нитроксила либо последовательно с другим положительным инотропным агентом, например, вначале введение первым одного агента, и затем второго агента, или введение обоих агентов в основном одновременно, где имеется частичное совпадение времени введения агентов. При последовательном введении индивидуум подвергается действию агентов в разные моменты времени, поскольку некоторое количество первого агента, которого достаточно для проявления терапевтического эффекта в комбинации со вторым агентом, остается в организме субъекта, когда вводят этот другой агент. Лечение двумя агентами одновременно может включать введение обоих агентов в составе одной и той же дозы, например, в виде физически смешанной дозы, или в виде отдельных доз, вводимых одновременно.
В конкретном варианте осуществления, донор нитроксила вводят индивидууму с сердечной недостаточностью, которые получает лечение бета-антагонистом. Бета-антагонисты (известные также как бета-блокаторы) включают любые соединения, которые эффективно действуют в качестве антагонистов бета-адренергических рецепторов субъекта, и обеспечивают желаемые терапевтические или фармацевтические результаты, например, уменьшение тонуса сосудов и/или частоты сердцебиения. Субъектом, получающим лечение бета-антагонистом, является любой субъект, которому вводили бета-антагонист, и в организме которого бета-антагонист продолжает действовать в качестве антагониста его бета-адренергических рецепторов. В конкретных вариантах осуществления определение того, получает ли субъект лечение бета-антагонистами, осуществляют путем изучения истории болезни субъекта. В другом варианте осуществления, субъекта исследуют на наличие бета-блокирующих агентов с помощью химических тестов, например, высокоскоростной жидкостной хроматографии, как описано в работе Thevis et al., Biomed.Chromatogr., 15:393-402(2001).
Введение донора нитроксила, либо самого по себе, либо в комбинации с положительным инотропным агентом, или субъекту, получающему лечение бета-антагонистом, применяется для лечения сердечной недостаточности всех разновидностей. В отдельных вариантах осуществления, донор нитроксила применяют для лечения хронической сердечной недостаточности на ранней стадии, например, сердечной недостаточности класса II. В других вариантах осуществления, донор нитроксила применяют в комбинации с положительным инотропным агентом, например, изопроптеренолом, для лечения сердечной недостаточности класса IV. В других вариантах осуществления, донор нитроксила применяют в комбинации с другим положительным инотропным агентом, например, изопротеренолом, для лечения острой сердечной недостаточности. В некоторых вариантах осуществления, когда донор нитроксила применяют для лечения ранней стадии сердечной недостаточности, вводимая доза ниже той, которую применяют для лечения острой сердечной недостаточности. В других вариантах осуществления, доза является такой же, как применяемая для лечения острой сердечной недостаточности.
Поражение от ишемии/реперфузии
Настоящее изобретение охватывает способы лечения, профилактики или защиты от поражения, вызванного ишемией/реперфузией. В частности, соединения по настоящему изобретению полезны для индивидуумов, находящихся под угрозой случая ишемии. Так, например, в настоящем изобретении разработан способ предупреждения или уменьшения поражения, связанного с ишемией/реперфузией, с помощью введения индивидууму эффективного количества по меньшей мере одного соединения, высвобождающего нитроксил, предпочтительно, до начала ишемии. Соединение по настоящему изобретению можно вводить индивидууму после ишемии, но до реперфузии. Соединение по настоящему изобретению можно также вводить после ишемии/реперфузии, но если это введение защищает от дальнейшего поражения. Кроме того, разработан способ, в котором выявляется индивидуум, находящийся под угрозой случая ишемии. Также в изобретении раскрыт способ введения донора нитроксила в орган, который предполагается трансплантировать, в количестве, эффективном для уменьшения поражения тканей органа от ишемии/реперфузии при реперфузии трансплантированного органа в организме реципиента.
Таким образом, доноры нитроксила по настоящему изобретению могут применяться в способах предупреждения или уменьшения поражения, связанного с будущей ишемией/реперфузией. Например, введение донора нитроксила до начала ишемии может уменьшить некроз тканей (размер инфаркта), находящихся под угрозой поражения. В живых субъектах это можно осуществить введением индивидууму эффективного количества донора нитроксила до наступления ишемии. В органах, предназначенных для трансплантации, это достигается приведением органа в соприкосновение с донором нитроксила до реперфузии органа в организме реципиента трансплантата. Композиции, содержащие более одного донора нитроксила, также могли бы найти применение в описанных способах, например, включающие соль Анджели и N-гидроксисульфонамид по настоящему изобретению или два, или несколько N-гидроксисульфонамидов по настоящему изобретению. С целью уменьшения ишемического поражения, доноры нитроксила могут также применяться в комбинации с терапевтическими агентами других описанных в заявке классов, например, бета-блокаторами, блокаторами кальциевого канала, антиагрегатной терапией или другими видами терапевтического вмешательства, предназначенными для защиты сердечной мышцы пациента от заболеваний коронарных артерий.
Один из способов введения донора нитроксила живым субъектам включает введение соединения, высвобождающего нитроксил, до наступления ишемии. Это относится только к началу каждого случая ишемии и не должно препятствовать применению этого способа в отношении субъектов, у которых ранее отмечались случаи ишемии, т.е. данный способ подразумевает также введение доноров нитроксила субъекту, у которого в прошлом имели место случаи ишемии.
Могут быть выбраны индивидуумы, которые находятся под угрозой первого или повторного случая ишемии. Примеры включают индивидуумов с установленной гиперхолестеринемией, нарушениями в ЭКГ, связанными с риском ишемии, малоподвижным образом жизни, данными ангиографии о частичной закупорке коронарной артерии, данными эхокардиографии о поражении сердечной мышцы, а также любыми другими данными, подтверждающими угрозу будущего или дополнительного случая ишемии (например, случая ишемии сердца, такого как инфаркт миокарда (MI), или нейроваскулярной ишемии, например, острого нарушения мозгового кровообращения CVA). В конкретных примерах описываемых способов, для лечения выбирают индивидуумов, которые находятся под угрозой ишемии в будущем, но не имеют признаков ишемии в настоящем (например, отклонений в кардиограмме, связанных с ишемией (например, остроконечных или инвертированных T-волн или подъемов, или понижений сегмента ST в соответствующем клиническом контексте), повышенных уровней CKMB или клинических признаков ишемии, таких как сильные боли за грудиной или в руке, затруднение дыхания и/или обильное потоотделение). Доноры нитроксила можно было бы также вводить перед процедурами, при которых может возникнуть ишемия миокарда, например, перед ангиопластикой или хирургическим вмешательством (например, операцией по шунтированию коронарной артерии). Кроме того, в объем изобретения входит способ введения донора нитроксила индивидууму с доказанной угрозой случая ишемии. Выбор индивидуума, находящегося в таком состоянии, мог бы осуществляться целым рядом способов, некоторые из которых отмечены выше. Например, индивидуум с одним или несколькими отклонениями в ЭКГ, не связанными с существующей ишемией, предыдущей историей инфаркта миокарда, повышенным уровнем холестерина в сыворотке и т.д. мог бы находиться под угрозой ишемии. Так, например, индивидуум, находящийся под угрозой ишемии мог бы быть выбран путем физического тестирования или выявления медицинской истории потенциального субъекта для определения, имел ли субъект какие-либо признаки угрозы случая ишемии. Если такая угроза продемонстрирована на основании обсуждавшихся выше признаков или любых других признаков, которые мог бы принять во внимание специалист в данной области, тогда следовало бы считать, что для данного индивидуума продемонстрирована угроза случая ишемии.
Ишемия/реперфузия может повреждать ткани, отличные от тканей сердечной мышцы, и настоящее изобретение охватывает способы лечения или профилактики такого повреждения. В одном из вариантов этот способ находит применение для уменьшения поражения от ишемии/реперфузии в тканях мозга, печени, внутренних органов, почек, кишечника или в любых других тканях. Указанные способы предпочтительно включают введение донора нитроксила индивидууму, находящемуся под угрозой такого поражения. Выбор человека, находящегося под угрозой не сердечной ишемии мог бы включать определение показателей, применяемых для оценки риска ишемии сердца. Однако на угрозу ишемии/реперфузии в других тканях могут указывать другие факторы. Например, хирургические пациенты часто сталкиваются с ишемией вследствие хирургического вмешательства. Таким образом, индивидуумы, которым назначена операция, могли бы считаться находящимися под угрозой ишемии. Следующие факторы риска удара (или подмножество этих факторов риска) могли бы продемонстрировать риск ишемии мозговой ткани для субъекта: гипертензия, курение сигарет, стеноз сонной артерии, недостаточная физическая активность, сахарный диабет, гиперлипидемия, преходящее нарушение мозгового кровообращения, мерцательная аритмия предсердий, болезнь коронарных артерий, застойная сердечная недостаточность, случай инфаркта миокарда в прошлом, дисфункция левого желудочка с пристеночным тромбозом и стеноз митрального клапана. Ingall, “Preventing ischemic stroke: current approaches to primary and secondary prevention”, Postgrad.Med., 107(6):34-50(2000). Далее, осложнения не леченной инфекционной диареи в пожилом возрасте могут включать сердечную, почечную, цереброваскулярную и кишечную ишемию. Slotwiner-Nie & Brandt, “Infectious diarrhea in the elderly”, Gastroenterol, Clin.N.Am., 30(3):625-635 (2001). В качестве альтернативы, можно отбирать индивидуумов, основываясь на факторах риска ишемических заболеваний кишечника, почек или печени. Например, можно начинать лечение субъектов пожилого возраста с риском случаев гипотензии (например, потери крови при хирургическом вмешательстве). Таким образом, субъекты, демонстрирующие такие признаки, могли бы считаться находящимися под угрозой случая ишемии. Также в объем изобретения входит способ введения донора нитроксила по настоящему изобретению индивидууму, у которого имеется одно или несколько состояний, перечисленных в настоящей заявке, например, сахарный диабет или гипертензия. Другие состояния, которые могут привести к ишемии, например, врожденный сосудистый артериовенозный порок, могли бы рассматриваться, как показатель риска случая ишемии.
Способ введения нитроксила в органы, предназначенные для трансплантации, включает введение нитроксила до удаления органа из организма донора, например, с помощью перфузионной канюли, применяемой в ходе удаления органа. Если донор органа, например, донор почки, является живым индивидуумом, вещество, высвобождающее нитроксил, можно вводить в орган донора как описано выше для субъекта, находящегося под угрозой случая ишемии. В других случаях донор нитроксила можно вводить путем хранения органа в растворе, содержащем донор нитроксила. Например, донор нитроксила может быть включен в раствор для хранения органа, например, раствор «UW» университета штата Висконсин, который представляет собой раствор, содержащий гидроксиэтилкрахмал, в основном свободный от этиленгликоля, этиленхлоргидрин и ацетон (смотрите патент США № 4 798 824).
Фармацевтические композиции, дозированные формы и режимы лечения
Также в объем изобретения входят фармацевтически приемлемые композиции, содержащие соединение по настоящему изобретению или их фармацевтически приемлемые соли, и в любых способах по настоящему изобретению могут применяться соединения в форме их фармацевтически приемлемых композиций. Фармацевтически приемлемая композиция включает одно или несколько соединений по настоящему изобретению, совместно с фармацевтически приемлемым носителем. Фармацевтические композиции по настоящему изобретению включают такие композиции, которые подходят для перорального, ректального, назального, местного (включая буккальное и сублингвальное), вагинального или парентерального (включая подкожное, внутримышечное, внутривенное и интрадермальное) введения.
Соединения или композиции по настоящему изобретению могут быть получены в виде любой доступной дозированной формы. Кроме того, предусмотрены дозированные формы, которые включают дискретные количества соединения или композиции, такие как капсулы, саше или таблетки, каждая из которых содержит заранее установленное количество соединения; такие как порошки или гранулы; такие как растворы или суспензии, в водном или неводном жидком носителе; или такие как жидкие эмульсии масло-в-воде или вода-в-масле, или заключенное в липосомы и в виде болюсов и т.д.
Таблетки, содержащие соединение или композицию по настоящему изобретению, могут быть изготовлены прессованием или формованием, необязательно с одним или несколькими дополнительными ингредиентами. Прессованные таблетки можно получить прессованием в подходящем устройстве действующего ингредиента в сыпучей форме, например, в порошке или гранулах, необязательно смешанного со связующим веществом, лубрикантом, инертным разбавителем, консервантом, ПАВ или диспергирующим средством. Формованные таблетки могут быть изготовлены формованием в подходящем агрегате смеси порошкообразного соединения, смоченного инертным жидким разбавителем. Таблетки необязательно могут быть снабжены покрытием или насечками, и могут иметь такой состав, чтобы обеспечивать замедленное или контролируемое высвобождение находящегося в них действующего ингредиента. Способы получения таких композиций фармацевтически активных ингредиентов с замедленным или контролируемым высвобождением, в т.ч. соединений по настоящему изобретению и других известных соединений, известны в технике и описаны в нескольких выданных патентах США, в том числе, но не ограничиваясь перечисленными, патентах США №№ 4369174 и 4842866, а также упомянутых в этих патентах источниках. Для высвобождения соединений в кишечнике могут применяться покрытия (смотрите, например, патенты США №№ 6638534, 5217720 и 6569457 и упомянутые в них источники). Квалифицированный специалист в данной области техники поймет, что, кроме таблеток, и другие дозированные формы могут быть получены таким образом, чтобы было обеспечено замедленное или контролируемое высвобождение действующего ингредиента. Такие дозированные формы включают, не ограничиваясь перечисленным, капсулы, грануляты и желатиновые капсулы.
Композиции, подходящие для местного введения, включают ромбические таблетки, содержащие ингредиенты во вкусоароматической основе, обычно сахарозе и гуммиарабике или трагаканте; и пастилки, включающие действующий ингредиент в инертной основе, например, желатине и глицерине, или сахарозе и гуммиарабике.
Композиции, подходящие для парентерального введения, включают водные и неводные стерильные растворы для инъекций, которые могут содержать антиоксиданты, буферы, бактериостаты и растворенные вещества, которые делают раствор изотоничным крови предполагаемого реципиента; а также водные и неводные стерильные суспензии, которые могут включать суспендирующие агенты и загустители. Эти составы могут выпускаться в контейнерах, содержащих одну или несколько доз, например, запаянных ампулах и пузырьках, и их можно хранить в высушенном (лиофилизованном) состоянии, что предполагает лишь добавку стерильного жидкого носителя, например, воды для инъекций, непосредственно перед применением.
Растворы и суспензии для немедленной инъекции могут быть получены из стерильных порошков, гранул и таблеток.
Введение соединений или композиций индивидууму может включать системное воздействие, или же введение может носить местный характер, как в случае, когда соединение или композицию необходимо ввести в определенный участок. Для введения композиции в представляющий интерес участок организма субъекта, могут применяться различные способы, например, инъекция, применение катетеров, троакаров, капсул, гелей на основе плуроников, стержней, полимеров, обеспечивающих продолжительное высвобождение лекарственного средства, или других устройств, которые обеспечивают доступ к внутренним органам. Если орган или ткань доступны по причине удаления из организма пациента, этот орган или ткань можно поместить в среду, содержащую описываемые композиции, орган можно покрыть композицией или нанести композицию любым обычным способом. Способы по настоящему изобретению охватывают введение соединений в донорский орган (например, для предотвращения поражения от ишемии/реперфузии). Соответственно, органы, которые удаляют из организма одного индивидуума для трансплантации в организм другого индивидуума, могут быть помещены в среду, содержащую соединение или композицию по настоящему изобретению, или подвергнуты действию этих соединений или композиций каким-либо другим образом.
Соединения по настоящему изобретению, например, соединения формул, которые приведены в заявке, можно вводить в любых подходящих дозировках, которые могут включать уровни дозировки примерно от 0,0001 до 4,0 граммов один раз в день (или несколько раз в день по части общей дозы) для взрослых. Так, например, в некоторых вариантах осуществления настоящего изобретения, соединения вводят в дозировке, находящейся в любом диапазоне, ограниченном нижним пределом от 0,1 мг/день до 400 мг/день и верхним пределом от 1 мг/день до 4000 мг/день (например, 5 мг/день и 100 мг/день, 150 мг/день и 500 мг/день). В других вариантах осуществления, соединение по настоящему изобретению вводят в дозировке, находящейся в любом диапазоне, ограниченном нижним пределом от 0,1 мг/кг/день до 90 мг/кг/день и верхним пределом от 1 мг/кг/день до 32 100 мг/кг/день (например, 0,5 мг/кг/день и 2 мг/кг/день, 5 мг/кг/день и 20 мг/кг/день). Интервал дозировок может быть отрегулирован в соответствии с потребностями индивидуума. Для достижения более продолжительных интервалов введения, могут применяться составы с пролонгированным или отсроченным высвобождением. Дозировка должна соответствовать внутривенному введению. Например, соединение может вводиться в виде фармацевтической композиции, которая пригодна для внутривенного введения в количестве от примерно 0,01 мкг/кг/мин до примерно 100 мкг/кг/мин или от примерно 0,05 мкг/кг/мин до примерно 95 мкг/кг/мин, или от примерно 0,1 мкг/кг/мин до примерно 90 мкг/кг/мин, или от примерно 1,0 мкг/кг/мин до примерно 80 мкг/кг/мин, или от примерно 10,0 мкг/кг/мин до примерно 70 мкг/кг/мин, или от примерно 20 мкг/кг/мин до примерно 60 мкг/кг/мин, или от примерно 30 мкг/кг/мин до примерно 50 мкг/кг/мин, или от примерно 0,01 мкг/кг/мин до примерно 1,0 мкг/кг/мин, или от примерно 0,01 мкг/кг/мин до примерно 10 мг/кг/мин, или от примерно 0,1 мкг/кг/мин до примерно 1,0 мкг/кг/мин, или от примерно 0,1 мкг/кг/мин до примерно 10 мкг/кг/мин, или от примерно 1,0 мкг/кг/мин до примерно 5 мкг/кг/мин, или от примерно 70 мкг/кг/мин до примерно 100 мкг/кг/мин, или от примерно 80 мкг/кг/мин до примерно 90 мкг/кг/мин. В одном из вариантов, соединение вводят индивидууму, например, в виде фармацевтической композиции, которая подходит для внутривенного введения, в количестве, по меньшей мере, примерно 0,01 мкг/кг/мин или по меньшей мере примерно 0,05 мкг/кг/мин, или по меньшей мере примерно 0,1 мкг/кг/мин, или по меньшей мере примерно 0,15 мкг/кг/мин, или по меньшей мере примерно 0,25 мкг/кг/мин, или по меньшей мере примерно 0,5 мкг/кг/мин, или по меньшей мере примерно 1,0 мкг/кг/мин, или по меньшей мере примерно 1,5 мкг/кг/мин, или по меньшей мере примерно 5,0 мкг/кг/мин, или по меньшей мере примерно 10,0 мкг/кг/мин, или по меньшей мере примерно 20,0 мкг/кг/мин, или по меньшей мере примерно 30,0 мкг/кг/мин, или по меньшей мере примерно 40,0 мкг/кг/мин, или по меньшей мере примерно 50,0 мкг/кг/мин, или по меньшей мере примерно 60,0 мкг/кг/мин, или по меньшей мере примерно 70,0 мкг/кг/мин, или по меньшей мере примерно 80,0 мкг/кг/мин, или по меньшей мере примерно 90,0 мкг/кг/мин, или по меньшей мере примерно 100,0 мкг/кг/мин или более. В другом варианте, соединение вводят индивидууму, например, в виде фармацевтической композиции, которая подходит для внутривенного введения, в количестве менее чем примерно 100,0 мкг/кг/мин, или менее чем примерно 90,0 мкг/кг/мин, или менее чем примерно 80,0 мкг/кг/мин, или менее чем примерно 70,0 мкг/кг/мин, или менее чем примерно 60,0 мкг/кг/мин, или менее чем примерно 50,0 мкг/кг/мин, или менее чем примерно 40,0 мкг/кг/мин, или менее чем примерно 30,0 мкг/кг/мин, или менее чем примерно 20,0 мкг/кг/мин, или менее чем примерно 10,0 мкг/кг/мин, или менее чем примерно 5,0 мкг/кг/мин, или менее чем примерно 2,5 мкг/кг/мин, или менее чем примерно 1,0 мкг/кг/мин, или менее чем примерно 0,5 мкг/кг/мин, или менее чем примерно 0,25 мкг/кг/мин, или менее чем примерно 0,15 мкг/кг/мин, или менее чем примерно 0,1 мкг/кг/мин, или менее чем примерно 0,05 мкг/кг/мин, или менее чем примерно 0,01 мкг/кг/мин.
Далее, в настоящем изобретении разработан набор, включающий одно или несколько соединений, описанных в настоящей заявке. В эти наборы могут входить любые из соединений, раскрытых в настоящем изобретении, а также инструкции по их применению. Соединения могут быть включены в состав любой приемлемой формы. Эти наборы могут употребляться для любых одного или нескольких применений, описанных в настоящей заявке и, соответственно, могут содержать инструкции по любым одному или нескольким заявленным применениям (например, лечению и/или профилактике, и/или задержке наступления, и/или развития сердечной недостаточности, или поражения от ишемии/реперфузии).
Наборы, как правило, включают подходящую упаковку. Эти наборы могут включать один или несколько контейнеров, содержащих любое из соединений, описанных в настоящей заявке. Каждый компонент (если в набор входит более одного компонента) может быть упакован в отдельный контейнер, или несколько компонентов могут быть совместно упакованы в один контейнер, если это позволяет сделать их взаимная реакционная способность и срок хранения.
Наборы могу необязательно включать комплект инструкций, как правило в печатном виде, хотя приемлемы также электронные носители (например, магнитная дискета или оптический диск), содержащие инструкции, которые относятся в применению компонента (компонентов) способов по настоящему изобретению (например, способов лечения, профилактики и/или задержки наступления, и/или развития сердечного заболевания, или поражения от ишемии/реперфузии). Инструкции, входящие в этот комплект, как правило, включают информацию, относящуюся к компонентам и их введению индивидууму.
Следующие примеры включены в описание для иллюстрации различных вариантов осуществления настоящего изобретения, и они не предназначены для какого бы то ни было ограничения объема изобретения.
ПРИМЕРЫ
Все анализы ВЭЖХ осуществляли с использованием автоматического дозатора CTC PAL HTS с УФ-детектором Waters 2487, снабженного двойным насосом Agilent G1312A. Для определения времени удерживания (TR) использовали следующую методику и колонку 0-100%B [MeCN:H2O:0,2% HCO2H], градиент 2,5 мин, выдерживание 0,5 мин, 215 нм, Atlantis dC18 2,1×50 мм, 5 мкм.
Все спектры ЯМР регистрировали на спектрометрах Bruker AVANCE 400 МГц или Bruker 500, работавших при комнатной температуре зонда с использованием внутреннего дейтериевого стандарта. Химические сдвиги приведены в миллионных долях (мд) в слабое поле относительно тетраметилсилана (ТМС). В данных спектроскопии ЯМР использованы стандартные сокращения (s синглет; уш.с уширенный синглет; д дублет; дд дублет дублетов; т триплет; кв квартет; кв квинтет; м мультиплет). Константы спин-спинового взаимодействия приведены в Герцах (Гц).
Пример 1. Получение соединений по настоящему изобретению согласно общей методике синтеза по Схеме A
Метиловый эфир 2-гидроксисульфамоилбензойной кислоты (соединение 1)

Раствор карбоната калия (3,53 г, 25,57 ммоль) в воде (3,6 мл) по каплям добавляли к раствору гидрохлорида гидроксиламина (1,76 г, 25,57 ммоль) в воде (2,4 мл) при 0°C, поддерживая температуру реакционной смеси в пределах от 5°C до 15°C. Добавляли ТГФ (12 мл) и метанол (3 мл), затем порциями добавляли метиловый эфир 2-хлорсульфонилбензойной кислоты (3 г, 12,78 ммоль), поддерживая температуру ниже 15°C, и реакционную смесь перемешивали при комнатной температуре до полного исчезновения из реакционной смеси сульфонилхлорида по данным ТСХ. Полученную суспензию концентрировали, удаляя все летучие компоненты, и водную суспензию экстрагировали диэтиловым эфиром (2×100 мл). Органическую фракцию высушивали над сульфатом натрия, фильтровали и концентрировали в вакууме, получая неочищенный N-гидроксисульфонамид. Очистку проводили хроматографией на силикагеле, элюируя смесью гептан:этилацетат (8:2 объем:объем), и получая целевое соединение в виде белого твердого вещества (1,3 г, выход 44%); δ H (400 МГц, ДМСО) 9,87 (1H, д, 3,4 Гц), 9,39 (1H, д, 3,2 Гц), 7,97 (1H, м), 7,77 (2H, м), 7,68-7,72 (1H, м), 3,83 (3H, c); TR=1,43 мин.
Пример 2. Получение соединений по настоящему изобретению согласно общей методике синтеза по Схеме A
3-гидроксисульфамоилбензойная кислота (соединение 2)

Раствор карбоната калия (0,43 г, 3,10 ммоль) в воде (1,2 мл) по каплям добавляли к раствору гидрохлорида гидроксиламина (0,21 г, 3,10 ммоль) в воде (0,8 мл) при 0°C, поддерживая температуру реакционной смеси в пределах от 5°C до 15°C. Добавляли ТГФ (4 мл) и метанол (1 мл), затем порциями добавляли 3-хлорсульфонилбензойную кислоту (0,34 г, 1,55 ммоль), поддерживая температуру ниже 15°C, и реакционную смесь перемешивали при комнатной температуре до полного исчезновения из реакционной смеси сульфонилхлорида по данным ЖХМС. Полученную суспензию концентрировали, удаляя все летучие компоненты, водную суспензию экстрагировали диэтиловым эфиром (2×100 мл) и объединенные органические фракции отбрасывали. Водный слой подкисляли до pH=1, добавляя по каплям раствор хлористоводородной кислоты (2н), затем экстрагировали диэтиловым эфиром (2×100 мл). Органическую фракцию высушивали над сульфатом натрия, фильтровали и концентрировали в вакууме, получая чистый N-гидроксисульфонамид в виде твердого вещества желтого цвета (0,9 г, выход 27%); δ H (400 МГц, ДМСО) 13,52 (1H, ушир.c), 9,72-9,74 (2H, м), 8,38 (1H, т, 1,6 Гц), 8,23 (1H, ддд, 7,9, 1,3, 1,2 Гц), 8,06 (1H, ддд, 7,8, 2,0, 1,2 Гц), 7,77 (1H, т, 7,7 Гц); TR=1,10 мин.
Пример 3. Получение соединений по настоящему изобретению согласно общей методике синтеза по Схеме B
4-бром-3-(гидроксисульфамоил)-N,N-диметилбензамид (соединение 6)

Раствор водного гидроксиламина (0,5 мл 50% водного раствора, 7,6 ммоль) в воде (1 мл) и ТГФ (5 мл) охлаждали до -5°C. Порциями добавляли 2-бром-5-(диметил-4-карбонил)бензолсульфонилхлорид, поддерживая температуру реакционной смеси ниже примерно 10°C, и реакционную смесь перемешивали при этой температуре до полного вхождения в реакцию сульфонилхлорида по данным тонкослойной хроматографии (ТСХ). Полученную суспензию концентрировали, удаляя все летучие компоненты, и полученное твердое вещество промывали диэтиловым эфиром, получая соединение, указанное в заглавии, в виде твердого вещества, напоминающего крем (0,36 г, 36%). δ H (500 МГц, ДМСО-d6) 10,00 (1H, ушир.c), 9,88 (1H, c), 7,95 (1H, д, 1,8 Гц), 7,93 (1H, д, 8,1 Гц), 7,61 (1H, дд, 8,3, 2,0 Гц), 3,00 (3H, c), 2,91 (3H, c), TR=1,19 мин.
Используя условия проведения реакций, описанные выше и подробно описанные в общих схемах синтеза A и B (способы 1 и 2) и соответствующие исходные вещества, которые либо являются коммерчески доступными, либо могут быть синтезированы по стандартным методикам, известным из литературы, получали следующие производные:
№
Синтез исходных сульфонилхлоридов
Сульфонилхлориды синтезировали из коммерчески доступных исходных веществ способами, описанными в J.Med.Chem, 40, 2017; Bioorg.Med.Chem, 2002, 639-656; Journal of Pharmacy and Pharmacology, 1963, 202-211 и в Australian Journal of Chemistry, 2000, 1-6. Например, некоторые сульфонилхлориды можно синтезировать согласно следующим схемам:

Показанная схема синтеза производных тиофена может быть адаптирована для синтеза аналогичных производных пиррола.
2-бром-5-(морфолин-4-карбонил)бензолсульфонилхлорид:

1: ClSO3H 2: SOCl2, толуол, D 3:R2NH·HCl, хлорбензол
Стадия 1
4-Бром-3-хлорсульфонилбензойная кислота
4-бромбензойную кислоту (10 г, 49,75 ммоль) порциями добавляли к хлорсульфоновой кислоте (25 мл, 373,13 ммоль) при 0°C. Смесь нагревали до 130°C в течение 10 часов, до полного вхождения в реакцию исходных веществ по данным ВЭЖХ. Реакционной смеси давали остыть до комнатной температуры и затем по каплям добавляли к смеси льда и воды (500 мл). Осадок отфильтровывали и промывали холодной водой (2×100 мл). Выделенное твердое вещество растворяли в диэтиловом эфире, затем раствор высушивали над сульфатом натрия, фильтровали и концентрировали в вакууме, получая ожидаемый продукт в виде бежевого твердого вещества (11,85 г, выход 79%); δ H (400 МГц, ДМСО) 8,45 (1H, д, 1,7 Гц), 7,72 (1H, д, 2,2 Гц), 7,71 (1H, c); TR=2,08 мин.
Стадия 2
4-Бром-3-хлорсульфонилбензоилхлорид
4-бром-3-хлорсульфонилбензойную кислоту (2 г, 6,68 ммоль) суспендировали в толуоле (20 мл). По каплям добавляли тионилхлорид (0,97 мл, 13,36 ммоль) и смесь нагревали при кипении с обратным холодильником в течение 14 часов в атмосфере азота до полного вхождения в реакцию карбоновой кислоты по данным ВЭЖХ. Реакционную смесь концентрировали в вакууме досуха, получая ожидаемый хлорангидрид кислоты в виде твердого вещества (2,12 г, выход 95%). Это соединение использовали в следующей стадии без какой-либо дальнейшей очистки или анализа; TR=2,38.
Стадия 3
2-Бром-5-(морфолин-4-карбонил)бензолсульфонилхлорид
Гидрохлорид морфолина (0,87 г, 7,01 ммоль) добавляли к раствору 4-бром-3-хлорсульфонилбензоилхлорида (2,12 г, 6,68 ммоль) в хлорбензоле (8 мл). Реакционную смесь нагревали при кипении с обратным холодильником в течение 2 часов, до полного вхождения в реакцию исходных веществ по данным ВЭЖХ. Реакционную смесь концентрировали досуха в вакууме. Остаток обрабатывали диэтиловым эфиром (20 мл), осадок фильтровали и промывали диэтиловым эфиром (2х10 мл), получая ожидаемый сульфонилхлорид в виде твердого вещества бежевого цвета (2,34 г, выход 95%); δ H (400 МГц, ДМСО) 7,90 (1H, д, 2,2 Гц), 7,64 (1H, д, 8,1 Гц), 7,25 (1H, дд, 8,1, 2,2 Гц), 3,25-3,70 (8H, м); TR=2,01 мин.
3-Хлорсульфонил-4-хлорбензойная кислота:
3-хлорсульфонил-4-хлорбензойную кислоту получали из коммерчески доступных исходных веществ по методике стадии 1 подробно описанного выше способа синтеза. δ H (400 МГц, ДМСО-d6) 14,03 (1H, ушир., c), 8,43 (1H, д, 2,2 Гц), 7,84 (1H, дд, 8,1, 2,2 Гц), 7,50 (1H, д, 8,1 Гц); TR=1,81 мин.
3-Хлорсульфонил-4-бромбензойная кислота:
3-хлорсульфонил-4-бромбензойную кислоту получали из коммерчески доступных исходных веществ по методике стадии 1 подробно описанного выше способа синтеза. δ H (400 МГц, ДМСО) 8,45 (1H, д, 1,7 Гц), 7,72 (1H, д, 2,2 Гц), 7,71 (1H, c); TR=2,08 мин.
2-Бром-5-(диметил-4-карбонил)бензолсульфонилхлорид:
2-бром-5-(диметил-4-карбонил)бензолсульфонилхлорид получали из коммерчески доступных исходных веществ по методике стадий 1-3 подробно описанного выше способа синтеза, используя диметиламин·HCl вместо морфолин·HCl на стадии 3 (4,35 г, 80%). δ H (500 МГц, ДМСО-d6) 7,89 (1H, д, 2,0 Гц), 7,63 (1H, д, 8,1 Гц), 7,25 (1H, дд, 8,1, 2,2 Гц), 2,96 (3H, ушир.с), 2,88 (3H, ушир.с.); TR=1,78 мин.
2-Хлор-5-(диметил-4-карбонил)бензолсульфонилхлорид:
2-хлор-5-(диметил-4-карбонил)бензолсульфонилхлорид получали из коммерчески доступных исходных веществ по методике стадий 1-3 подробно описанного выше способа синтеза, используя диметиламин HCl вместо морфолин HCl на стадии 3 (4,37 г, 79%). δ H (500 МГц, ДМСО-d6) 7,86 (1H, д, 2,0 Гц), 7,43 (1H, д, 8,1 Гц), 7,34 (1H, дд, 8,1, 2,2 Гц), 2,97 (3H, ушир.c), 2,90 (3H, ушир.c); TR=1,20 мин.
2-(Морфолин-4-илсульфонил)бензолсульфонилхлорид:

1: морфолин, Py, DCM; 2: NaSBn, ДМСО; 3: Cl2, HCl
Стадия 1:
2-(морфолин-4-илсульфонил)хлорбензол
К раствору 2-хлорбензолсульфонилхлорида (10г, 47,4 ммоль) в DCM (100 мл), охлажденному до 0°C, по каплям добавляли пиридин (5,7 мл, 71,1 ммоль) и морфолин (6,2 мл, 71,1 ммоль). Продолжали перемешивание в течение 15 мин, после чего присутствие сульфонилхлорида в реакционной смеси не удалось обнаружить с помощью ЖХ-МС. Реакционную смесь гасили добавлением 2н HCl, промывали дополнительной порцией 2н HCl, высушивали над сульфатом натрия, фильтровали и концентрировали в вакууме, получая указанное в заглавии соединение, которое не требовало дальнейшей очистки (11,2 г, 100%). δ H (400 МГц, ДМСО-d6) 7,97 (1H, дд, 7,8, 1,5 Гц), 7,66-7,77 (2H, м), 7,58 (1H, ддд, 8,1, 6,7,1,8 Гц), 3,57 -3,64 (4H, м), 3,11-3,18 (4H, м); TR=1,25 мин.
Стадия 2:
Бензил-2-(морфолин-4-илсульфонил)бензолсульфид
Фенилметантиол (7,6 мл, 43,5 ммоль) добавляли по каплям к 25% раствору NaOMe/MeOH (14,1 г, 65,2 ммоль) в MeOH (25 мл). Полученный тиолат выделяли, концентрируя реакционную смесь в вакууме. Выделенный тиолат натрия растворяли в ДМСО (65 мл) и порциями добавляли 2-(морфолин-4-илсульфонил)хлорбензол (11,1 г, 43,5 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 72 ч, после чего не удалось обнаружить в реакционной смеси присутствия исходного вещества. Реакционную смесь выливали в 2н раствор HCl (200 мл) и экстрагировали DCM (3×200 мл). Органическую фракцию высушивали над сульфатом натрия, фильтровали и концентрировали в вакууме. Неочищенный продукт очищали колоночной хроматографией, элюируя смесью гептан:этилацетат (8:2 объем:объем). (13,7 г, 90%), TR=1,00 мин.
Стадия 3:
2-(Морфолин-4-илсульфонил)бензолсульфонилхлорид
Газообразный хлор барботировали в охлажденную (0°C) суспензию бензил-2-(морфолин-4-илсульфонил)бензолсульфида (7,0 г, 1,1 ммоль) в концентрированной HCl (70 мл), поддерживая температуру реакционной смеси ниже 15°C, до полного исчезновения исходных веществ из реакционной смеси (приблизительно 45 минут). После завершения реакции через реакционную смесь в течение 15 минут барботировали азот для удаления избытка хлора, и реакционную смесь нагревали до комнатной температуры. Реакционную смесь выливали на лед, и образовавшееся желтое твердое вещество отфильтровывали и промывали ледяной водой. Полученное твердое вещество растирали с гептаном, фильтровали, промывали гептаном и высушивали в вакууме, получая неочищенный сульфонилхлорид в виде бледно-желтого твердого вещества, которое непосредственно в таком виде применяли в синтезе соединения 8.
2-(морфолин-4-ил)этил 4-хлор-3-(хлорсульфонил)бензоат

1: ClSO2H; 2: SOCl2, толуол, Δ; 3: гидроксиэтилморфолин, DCM
Синтез 4-хлор-3-(хлорсульфонил)бензойной кислоты и 2-хлор-5-(диметил-4-карбонил)бензолсульфонилхлорида осуществляли по той же методике, которая описана для синтеза 2-бром-5-(морфолин-4-карбонил)бензолсульфонилхлорида.
Стадия 3
2-(Морфолин-4-ил)этил 4-хлор-3-(хлорсульфонил)бензоат
К раствору 4-хлор-3-(хлорсульфонил)бензоилхлорида (1,0 г, 3,6 ммоль) в DCM (10 мл) добавляли раствор гидроксиэтилморфолина (443 мкл, 3,6 ммоль) в DCM (1 мл). Реакционную смесь перемешивали в течение 12 часов, и после этого сульфонилхлорид не удалось обнаружить в реакционной смеси с помощью ЖХ-МС. После концентрирования неочищенной реакционной смеси выделяли твердое вещество, которое растирали с эфиром, получая желаемое соединение в виде твердого коричневого вещества. (1,54 г, 100%) ИК (чистое в-во) ν макс/см-1 1724, 1174, 1450; δH (500 МГц, ДМСО-d6) 8,49 (1H, д, 1,8 Гц), 7,97 (1H, дд, 8,2, 1,9 Гц), 7,56 (1H, д, 8,2 Гц), 4,38-5,00 (2H, м), 3,88-4,07 (2H, м), 3,76-3,83 (2H, м), 3,56-3,62 (2H, м), 3,36-3,54 (2H, м), 3,14-3,28 (2H, м).
3-Бром-5-{[2-(морфолин-4-ил)этил]карбамоил}тиофен-2-сульфонилхлорид

1: RNH2, DIPEA, DCM; 2:ClSO3H
Стадия 1
4-Бром-N-[2-(морфолин-4-ил)этил]тиофен-2-карбоксамид
К раствору 4-бром-2-тиофенкарбонилхлорида (1,0 г, 4,4 ммоль) в DCM (10 мл), охлажденному до 0°C, по каплям добавляли DIPEA (0,85 мл, 4,8 ммоль) и 4-(2-аминоэтил)морфолин (0,6 мл, 4,6 ммоль). Перемешивание продолжали до полного исчезновения исходных веществ из реакционной смеси по данным ЖХ-МС. Реакционную смесь гасили добавлением воды, промывали дополнительной порцией 2н HCl, высушивали над сульфатом натрия, фильтровали и концентрировали в вакууме, получая желаемое соединение, которое не требовало дальнейшей очистки (1,6 г, 98%). δH (500 МГц, хлороформ-d) 7,38 (1H, д, 1,3 Гц), 7,37 (1H, д, 1,1 Гц), 3,72-3,80 (4H, м), 3,53 (2H, кв, 5,6 Гц), 2,59 (2H, т, 6,0 Гц), 2,48-2,54 (4H, м), TR=0,8 мин.
Стадия 2
3-Бром-5-{[2-(морфолин-4-ил)этил]карбамоил}тиофен-2-сульфонилхлорид
В колбу, содержавшую 4-бром-N-[2-(морфолин-4-ил)этил]тиофен-2-карбоксамид (1,6 г, 5,1 ммоль), добавляли хлорсульфоновую кислоту (10 мл, 30 экв). Реакционную смесь нагревали до 95°C в течение 90 мин и затем осторожно выливали в лед. Полученное твердое вещество отфильтровывали и высушивали в вакууме. Неочищенный продукт растирали со смесью гептан:этилацетат, получая указанное в заглавии вещество, которое не требовало дальнейшей очистки (0,62 г, 29%). δH (500 МГц, ДМСО-d6) 9,01, (1H, т, 5,5 Гц), 7,76 (1H, c), 3,97 (2H, д, 10,4 Гц), 3,78 (2H, т, 11,5 Гц), 3,63 (2H, кв, 6,0 Гц), 3,51 (2H, д, 12,3 Гц), 3,29 (2H, кв, 5,7 Гц), 3,03-3,17 (2H, м),
3-Бром-5-(морфолин-4-илкарбонил)тиофен-2-сульфонилхлорид
Стадия 1
4-Бром-N-(морфолин-4-ил)тиофен-2-карбоксамид
К раствору 4-бром-2-тиофенкарбонилхлорида (1,0 г, 4,4 ммоль) в DCM (10 мл), охлажденному до 0°C, по каплям добавляли DIPEA (0,85 мл, 4,8 ммоль) и морфолин (0,4 г, 4,6 ммоль). Перемешивание продолжали до полного вступления в реакцию исходных веществ по данным ЖХ-МС. Реакционную смесь гасили добавлением воды, промывали дополнительными порциями 2н HCl, высушивали над сульфатом натрия, фильтровали и концентрировали в вакууме, получая желаемое соединение, которое не требовало дальнейшей очистки (1,2 г, 100%). δH (500 МГц, хлороформ-d) 7,38 (1H, c), 7,18 (1H, c), 3,63-3,83 (8H, м); TR=1,52 мин.
Стадия 2
3-Бром-5-(морфолин-4-илкарбонил)тиофен-2-сульфонилхлорид
В колбу, содержащую 4-бром-N-(морфолин-4-ил)тиофен-2-карбоксамид (1,23 г, 4,5 ммоль), добавляли хлорсульфоновую кислоту (9 мл, 30 экв.). Реакционную смесь нагревали до 95°C в течение 90 минут, после чего осторожно выливали в лед. Полученную суспензию экстрагировали DCM (3×100 мл) и объединенные органические фазы высушивали над сульфатом натрия, фильтровали и концентрировали в вакууме, получая указанное в заглавии соединение, которое не требовало дальнейшей очистки (0,54 г, 32%). δH (500 МГц, хлороформ-d) 7,30 (1H, c) 3,69-3,81 (8H, м), TR=1,86 мин.
Пример 3. Кинетика высвобождения HNO
Скорости разложения соединений можно определить с помощью спектроскопии в УФ и видимой области.
За разложением соединений можно наблюдать с помощью УФ-видимой спектроскопии в 0,1М буфере PBS при pH 7,4 и температуре 37°C. Bonner, F.T.; Ko., Y., Inorg.Chem. 1992, 31, 2514-2519.
Пример 4. Количественное определение высвобождения HNO с помощью N 2 O
Высвобождение HNO соединениями по настоящему изобретению может быть определено с применением УФ-видимой спектроскопии.
Закись азота образуется при димеризации и дегидратации HNO, и она является наиболее обычным маркером образования HNO (Fukuto, J.M.; Batberger, M.D.; Dutton, A.S.; Paolocci, N.; Wink, D.A.; Houk, K.N. Chem.Res.Toxicol.2005, 18, 790-801). Однако частично HNO может взаимодействовать с кислородом, с образованием продукта, который не превращается в N2O (смотрите (a) Mincione, F.; Menabuoni, L.; Briganti, F.; Mincione, G.; Scozzafava, A.; Supuran, C.T. J.Enzyme Inhibition 1998, 13, 267-284 и (b) Scozzafava, A.; Supuran, C.T. J.Med.Chem.2000, 43, 3677-3687). Используя соль Анджели (AS) в качестве эталона, определяли относительные количества N2O, выделившиеся из соединений, осуществляя анализ объема газа над продуктом с помощью газовой хроматографии.
Оценивали способность соединений высвобождать нитроксил при pH 7,4 в буфере PBS при 37°C. В частности, проводили тестирование соединений и оценку их способности высвобождать нитроксил при pH 7,4 в буфере PBS при 37°C. Результаты приведены ниже в таблице 4, и результаты для соединений 1-5, кроме того, изображены на фиг.1
Пример 5. Использование модели in vitro для определения способности соединений по настоящему изобретению лечить, предупреждать и/или замедлять наступление и/или развитие заболевания или состояния, реагирующего на лечение нитроксилом
a. Сердечно-сосудистые заболевания или состояния
In vitro модели сердечно-сосудистых заболеваний также могут применяться для определения способности любого из соединений, описанных в настоящем изобретении, лечить, предупреждать и/или замедлять наступление и/или развитие сердечно-сосудистого заболевания или состояния у индивидуума. Ниже описана типовая модель in vitro сердечного заболевания.
Могут использоваться in vitro модели, позволяющие проверить способность соединений вызывать расслабление стенок сосудов. Изометрическое натяжение в кольцевом сегменте изолированной грудной аорты крысы может быть измерено по методике, описанной ранее Crawford, J.H., Huang, J, Isbell, T.S., Shiva, S., Chacko, B.K., Schechter, A., Darley-Usmar, V.M., Kerby, J.D., Lang, J.D., Krauss, D., Ho, C., Gladwin, M.T., Patel, R.P., Blood 2006, 107, 566-575. После умерщвления животных удаляли кольцевые сегменты аорты и очищали их от жира и прикрепленных к ним тканей. Затем сосуды разрезали на отдельные кольцевые сегменты (шириной 2-3 мм) и подвешивали на датчик, показывающий смещение в зависимости от силы, в растворе для тканей. Кольцевые сегменты погружали при 37°C в раствор Кребса-Хензелейта (K-H) с добавкой бикарбонатного буфера следующего состава (мМ): NaCl 118; KCl 4,6; NaHCO3 27,2; KH2PO4 1,2; MgSO4 1,2; CaCl2 1,75; Na2EDTA 0,03; и глюкоза 11,1 и непрерывно пропускали смесь 21% O2/5% CO2/74% N2. Ко всем кольцевым сегментам прикладывали пассивную нагрузку 2 г и сохраняли ее на этом уровне на протяжении всего эксперимента. В начале каждого эксперимента обработанные индометацином кольцевые сегменты деполяризовали с помощью KCl (70 мМ) для определения максимальной способности сосудов к сокращению. Затем кольца тщательно промывали и давали прийти в состояние равновесия. Для последующих экспериментов вызывали субмаксимальные сокращения сосудов (50% от реакции на KCl) действием фенилэфрина (PE, 3×10-8-10-7M) и, кроме того, добавляли L-NMMA, 0,1мМ для ингибирования eNOS и эндогенной выработки NO. После того, как график натяжения сосуда выходил на плоский участок, в сосуд с раствором добавляли донор нитроксила и наблюдали за его влиянием на натяжение сосудистой стенки.
Можно использовать модели in vitro для определения влияния доноров нитроксила на развиваемое усилие и внутриклеточные уровни кальция в сердечной мышце. Развиваемое усилие и внутриклеточный кальций можно измерить в сердечной перегородке нормальной или больной крысы (т.е. с застойной сердечной недостаточностью или гипертрофией), как описано ранее (Gao WD, Atar D, Backx PH, Marban E. Circ Res. 1995; 76:1036-1048). В этих экспериментах использовали крыс (Sprague-Dawley, 250-300 г). Крысам проводили обезболивание фенобарбиталом (100 мг/кг) с помощью внутрибрюшной инъекции, открывали доступ к сердцу посредством срединной стернотомии, быстро удаляли сердце и помещали в чашку для иссеченных органов. Подсоединяли аорту к трубке и пропускали в обратном направлении (~15 мМ/мин) раствор Кребса-Хензелейта (K-H) для иссеченных органов, насыщенный смесью 95% O2 и 5% CO2. Раствор Кребса-Хензелейта (K-H) для иссеченных органов состоял из (мМ): NaCl 120, NaHCO3 20, KCl 5, MgCl2 1,2, глюкозы 10, CaCl2 0,5 и 2,3-бутандион моноксимина (BDM) 20, pH 7,35-7,45 при комнатной температуре (21-22°C). Иссекали перегородку правого желудочка сердца, закрепляли между датчиком усилия и рычагом мотора, пропускали нормальный раствор K-H (KCl, 5мМ) со скоростью ~10 мл/мин и стимулировали с частотой 0,5 Гц. Размеры мышцы измеряли с помощью калибровочной сетки в окуляре микроскопа (х40, разрешение ~10 мкм).
Усилие измеряли с применением системы датчика усилия и выражали в миллиньютонах на квадратный миллиметр площади поперечного сечения. Длину саркомеров измеряли с помощью дифракции лазерных лучей. Длина саркомера в расслабленном состоянии в экспериментах считали равной 2,20-2,30 мкм.
Внутриклеточные уровни кальция измеряли с использованием свободной кислой формы красителя фура-2, как описано в ранее проведенных исследованиях (Gao et al., 1994; Backx et al., 1995; Gao et al., 1998). Производили ионтофоретическую микроинъекцию калиевой соли фура-2 в клетку и давали ей возможность распределиться по всей мышечной ткани (через щелевые соединения клеток). Кончик электрода (диаметром ~0,2 мкм) заполняли солью фура-2 (1 мМ) и остальной объем электрода заполняли 150 мМ KCl. После успешного введения в поверхностную клетку не стимулируемой мышцы, непрерывно в течение ~15 минут пропускали гиперполяризующий ток 5-10 нА. Эпифлуоресценцию фура-2 измеряли, осуществляя возбуждение на длине волны 380 и 340 нм. Флуоресцентный свет фиксировали на длине волны 510 нм с помощью трубки фотоумножителя. Выходной сигнал фотоумножителя фиксировали и оцифровывали. Для достижения равновесной активации использовали рианодин (1,0 мкМ). После 15-мин действия рианодина, на короткое время (~4-8 секунд) производили тетанизацию различных уровней, путем стимулирования мышц на частоте 10 Гц при различных концентрациях внеклеточного кальция (0,5-20 мМ). Все исследования проводили при комнатной температуре (20-22°C).
b. Заболевания или состояния, включающие ишемию/реперфузию
In vitro модели также могут использоваться для определения способности любого из соединений, описанных в настоящей заявке, лечить, предупреждать и/или замедлять наступление и/или развитие заболевания или состояния, включающего поражение от ишемии/реперфузии у индивидуума.
Пример 6. Применение in vivo и/или ex vivo моделей для определения способности соединений по настоящему изобретению лечить, предупреждать и/или замедлять наступление и/или развитие заболеваний или состояний, реагирующих на лечение нитроксилом
a. Сердечно-сосудистые заболевания или состояния
In vivo модели сердечно-сосудистых заболеваний также могут применяться для определения способности любого из соединений, описанных в настоящей заявке, лечить, предупреждать и/или замедлять наступление и/или развитие сердечно-сосудистого заболевания или состояния у индивидуума. Типовая животная модель сердечного заболевания описана ниже.
In vivo действие доноров нитроксила на сердечно-сосудистую систему может быть оценено у контрольных (нормальных) животных. Исследование проводили на взрослых (25 кг) собаках-дворнягах (самцах) оснащенных оборудованием для сознательного гемодинамического анализа и отбора образцов крови, которое было описано в ранее проведенных исследованиях (Katori, T.; Hoover, D.B.; Ardell, J.L.; Helm, R.H.; Belardi, D.F.; Tocchetti, C.G.; Forfia, P.R.; Kass, D.A.; Paolocci, N. Circ.Res. 96(2): 2004). Датчики микроманометра в левом желудочке служили источником данных о давлении, тогда как катетеры в правом предсердии и нисходящей аорте служили для определения давления жидкости и трубкой для отбора образцов. Внутрисердечные ультразвуковые микрометры (переднее-задний, перегородочно-боковой) определяли размеры сердца по короткой оси, пневматический блокатор вокруг полости нижней боковой вены облегчал предварительные операции для анализа параметров, связанных с давлением. Провода для эпикардиальной стимуляции располагали на правом предсердии, и другую пару проводов, помещенную на свободной стенке правого желудочка, связывали со стимулятором непрерывного действия для того, чтобы вызывать кратковременную сердечную недостаточность. После 10-дневного восстановления, у животных оценивали синусовый ритм в нормальном состоянии и при стимулировании предсердия (120-160 ударов в минуту). Измерения включали сознательную регистрацию гемодинамических параметров механизмов сердечной деятельности.
Соединения по настоящему изобретению вводили здоровым контрольным собакам в дозировке 1-5 мкг/кг/мин и получали данные, относящиеся к сердечно-сосудистой системе.
Демонстрация того, что соединение по настоящему изобретению улучшает сердечную гемодинамику при застойной сердечной недостаточности: после выполнения протокола в базовых условиях, вызывали застойную сердечную недостаточность путем стимулирования ускоренного сердцебиения (210 ударов в минуту × 3 недели, 240 ударов в минуту × 1 неделю), как было описано в ранее выполненных работах (Katori, T.; Hoover, D.B.; Ardell, J.L.; Helm, R.H.; Belardi, D.F.; Tocchetti, C.G.; Forfia, P.R.; Kass, D.A.; Paolocci, N. Circ.Res. 96(2): 2004). Вкратце, еженедельно измеряли конечное диастолическое давление и +dP/dt max для наблюдения за развитием сердечной недостаточности. Если животные демонстрировали рост EDP более чем в 2 раза и dp/dt, max >50% от исходного, считалось, что они готовы для исследования застойной сердечной недостаточности.
Значения для тестовых соединений получали после 15 мин непрерывной i.v. инфузии (2,5 или 1,25 мкг/кг/мин) контрольных препаратов и препаратов от сердечной недостаточности, соответственно, в обоих случаях в отсутствии и при наличии возмещения объема. Для сравнения, такие же гемодинамические измерения осуществляли при введении AS в препараты от сердечной недостаточности.
b. Заболевания или состояния, включающие ишемию/реперфузию
Ex-vivo модели ишемии/реперфузии могут использоваться также для определения способности любых соединений, описанных в настоящей заявке, лечить, предупреждать и/или замедлять наступление и/или развитие заболевания или состояния, включающего поражение от ишемии/реперфузии у индивидуума. Типовая ex vivo модель поражения от ишемии/реперфузии описана ниже.
Самцов крыс Wistar поселяли в одинаковые клетки и обеспечивали свободный доступ к водопроводной воде и стандартному корму для грызунов. Каждому животному проводили анестезию 1 г/кг уретана i.p. через 10 мин после введения гепарина (2 500 U, i.m.). Вскрывали грудную клетку, быстро удаляли сердце, помещали в ледяной буферный раствор и взвешивали. Изолированные крысиные сердца присоединяли к устройству для осуществления перфузии и прокачивали в обратном направлении насыщенный кислородом буферный раствор при 37°C. Сердца снабжали средствами измерения, как было описано ранее в работах Rastaldo et al., “P-450 metabolite of arachidonic acid mediates bradykinin-induced negative inotropic effect”, Am.J.Physiol., 280:H2823-H2832 (2001) и Paolocci et al., “cGMP-independent inotropic effects of nitric oxide and peroxynitrile donors: potential role for nitrosylation”, Am.J.Physiol., 279: H1982-H1988 (2000). Поток жидкости поддерживали постоянным (приблизительно 9 мл/мин/г сырого веса) для достижения типового давления коронарной перфузии 85-90 мм Hg. Применяли постоянное соотношение скоростей потоков, равное 10% с помощью одного из двух перфузионных насосов (Terumo, Tokyo, Japan) c использованием 50 мл шприца, присоединенного к трубке аорты. Введение лекарственного средства осуществляли путем переключения со шприца, содержащего только буфер, на шприц другого насоса, содержащий лекарственное средство (донор нитроксила), растворенный в носителе в концентрации в 10× большей, чем желаемая конечная концентрация в сердце. Небольшое отверстие в стенке левого желудочка позволяло осуществлять дренаж потока через тебезиевы вены, а в левый желудочек помещали баллон из поливинилхлорида и соединяли его с электрическим манометром для регистрации давления в левом желудочке (LVP). Осуществляли электростимулирование сердец при частоте 280-300 bpm и держали их в камере с регулируемой температурой (37°C). Следили за давлением коронарной перфузии (CPP) и коронарным потоком с помощью второго электрического манометра и электромагнитного зонда потока, соответственно, причем оба этих устройства были размещены по пути перфузии. Давление в левом желудочке, коронарный поток и давление коронарной перфузии регистрировали с использованием записывающего устройства TEAC R-71, оцифровывали на частоте 1000 Гц и анализировали в автономном режиме с помощью программы DataQ-Instrumenta/CODAS, которая позволяла количественно установить максимальную скорость роста LVP во время систолы (dP/dtmax).
Через сердца пропускали раствор Кребса-Хензелейта, насыщенный смесью 95% O2 и 5% CO2, следующего состава: бикарбонат натрия 17,7 мМ, 127 мМ NaCl, 5,1 мМ KCl, 1,5 мМ CaCl2, 1,26 мМ MgCl2 и 11 мМ D-глюкоза с добавкой 5 мкг/мл лидокаина.
Экспериментальные соединения. Доноры нитроксила разбавляли буферным раствором непосредственно перед применением.
Протоколы экспериментов. Сердцам давали стабилизироваться в течение 30 мин и регистрировали исходные параметры. Как правило, коронарный поток регулировали в течение первых 10 минут и после этого оставляли постоянным. После 30-мин стабилизации, сердца в случайном порядке приписывали к одной из групп и подвергали полной 30-мин ишемии с полным отсутствием потока, за которой следовала 30-мин реперфузия (I/R). Стимулирование сердца останавливали в начале периода ишемии и вновь запускали после третьей минуты реперфузии.
Через сердца контрольной группы прокачивали буфер в течение еще 29 минут после стабилизации. Сердца тестовых групп подвергали действию доноров нитроксила (например, в конечной концентрации 1 мкМ в течение примерно 20 мин, за которым следовал 10-мин период вымывания буфером).
Для всех сердец стимулирование временно прекращали при начале ишемии и вновь запускали через три минуты после реперфузии. Поскольку изолированные ткани сердца могут деградировать с течением времени (как правило после 2-2,5-часовой перфузии) продолжительность повторного пропускания потока была ограничена 30 минутами для минимизации влияния, оказываемого кристаллоидной перфузией на деятельность сердца, что соответствовало другим сообщениям.
Оценка функции желудочков. Для получения данных о максимальном развиваемом LVP, регулировали объем внутрижелудочкового баллона, таким образом, чтобы конечное диастолическое LVP во время периода стабилизации составляло 10 мм Hg, как было указано в сообщении Paolocci смотрите выше и Hare et al., “Pertussis toxin-sensitive G protein influence nitric oxide synthase III activity and protein levels in rat hearts”, J. Clin. Invest., 101: 1424-31 (1998). Непрерывно следили за изменениями развиваемого LVP, dP/dtmax и конечного диастолического давления, вызванными протоколом I/R. Разность между конечным диастолическим LVP (EDLVP) перед окончанием периода ишемии и во время периода, предшествовавшего ишемии, использовали как коэффициент степени развития контрактуры. Величины развиваемого LVP и dP/dtmax при максимальном восстановлении во время реперфузии сравнивали с соответствующими значениями, зафиксированными перед началом ишемии.
Оценка поражения сердечной мышцы. Выделение ферментов служило показателем тяжести поражения сердечной мышцы, которое уже развилось до необратимого повреждения клеток. Образцы жидкости, выходящей из коронарных артерий (2 мл), отбирали с помощью катетера, введенного в правый желудочек через легочную артерию. Образцы отбирали непосредственно перед ишемией и на 3, 6, 10, 20 и 30 минуте реперфузии. Выделение LDH измеряли по методике, ранее описанной Bergmeyer & Bernt, “Methods of Enzymatic Analysis”, Verlag Chemie (1974). Данные выражали в виде кумулятивных величин за весь период реперфузии.
Для подтверждения данных, относящихся к поражению миокарда, полученных по выделению LDH, области инфаркта оценивали также «слепым» способом. В конце эксперимента (30-мин реперфузии), каждое сердце быстро извлекали из устройства для перфузии и рассекали LV на 2-3 мм круговые срезы. После 15-мин инкубирования при 37°C в 0,1% растворе нитротетразолия синего в фосфатном буфере, как описано в у Ma et al., “Opposite effects of nitric oxide and nitroxyl on postischemic myocardial injury”, Proc. Natl. Acad. Sci., 96: 14617-14622 (1999), неокрашенную некротическую ткань отделяли от окрашенной живой ткани. Области живой и некротической ткани тщательно разделялись независимым наблюдателем, который не был осведомлен о происхождении сердечных тканей. Затем определяли массу некротической и не некротической ткани, и массу некротической ткани выражали в процентах от общей массы левого желудочка.
Данные можно подвергнуть статистическому анализу, например, по методике ANOVA с последующей коррекцией Бонферрони для применения апостериорного t-критерия.
Пример 7. Использование клинических испытаний для определения способности комбинированной терапии по настоящему изобретению лечить, предупреждать и/или замедлять наступление и/или развитие заболевания или состояния, реагирующего на лечение нитроксилом
Если это желательно, любое из соединений, описанных в настоящей заявке, может также быть испытано на людях для определения способности этого соединения лечить, предупреждать и/или замедлять наступление и/или развитие заболевания или состояния, реагирующего на лечение нитроксилом. Для этих клинических испытаний могут применяться стандартные методики. В одной из типовых методик, субъектов с таким заболеванием или состоянием, как застойная сердечная недостаточность, включают в исследование фазы I переносимости, фармакокинетики и фармакодинамики соединений по настоящему изобретению в соответствии со стандартными протоколами. Затем осуществляют рандомизованное с двойной анонимностью и плацебо-контролем исследование фазы II для определения эффективности соединений с использованием стандартных протоколов.
Хотя выше по тексту изобретение было описано с определенными подробностями с использованием иллюстраций и примеров для ясности и легкости понимания, специалисту в данной области техники очевидно, что при практическом применении в изобретение будут внесены некоторые небольшие изменения и модификации. Следовательно, описание и примеры не следует истолковывать, как ограничение объема изобретения.
Все ссылки, публикации, патенты и заявки на патенты, приведенные в настоящем описании, включены в заявку при помощи ссылок во всей их полноте.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ N-ГИДРОКСИЛСУЛЬФОНАМИДА В КАЧЕСТВЕ НОВЫХ ФИЗИОЛОГИЧЕСКИ ПОЛЕЗНЫХ ДОНОРОВ НИТРОКСИЛА | 2007 |
|
RU2616292C2 |
| ПРОИЗВОДНЫЕ N-ГИДРОКСИЛСУЛЬФОНАМИДА В КАЧЕСТВЕ НОВЫХ ФИЗИОЛОГИЧЕСКИ ПОЛЕЗНЫХ ДОНОРОВ НИТРОКСИЛА | 2007 |
|
RU2448087C2 |
| ЗАМЕЩЕННЫЕ 1-НАФТОИЛГУАНИДИНЫ И ЛЕКАРСТВЕННОЕ СРЕДСТВО НА ИХ ОСНОВЕ | 1997 |
|
RU2182901C2 |
| ЗАМЕЩЕННЫЕ ХРОМАН-6-ИЛОКСИЦИКЛОАЛКАНЫ, ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ЛЕКАРСТВЕННЫХ СРЕДСТВ | 2014 |
|
RU2666350C2 |
| СОЕДИНЕНИЯ ФЛАВОНОИДОВ И ИХ ПРИМЕНЕНИЕ | 2006 |
|
RU2431634C2 |
| ПИРРОЛОПИРРОЛОВЫЕ КОМПОЗИЦИИ В КАЧЕСТВЕ АКТИВАТОРОВ ПИРУВАТКИНАЗЫ (PKR) | 2018 |
|
RU2736217C2 |
| ПРОИЗВОДНЫЕ АМИНОПИПЕРИДИНА КАК ИНГИБИТОРЫ БПХЭ (БЕЛКА-ПЕРЕНОСЧИКА ХОЛЕСТЕРИЛОВОГО ЭФИРА) | 2007 |
|
RU2442782C2 |
| СПОСОБ ПОЛУЧЕНИЯ ЭНАНТИОМЕРНО-ОБОГАЩЕННЫХ ТЕТРАГИДРОБЕНЗОТИЕПИНОКСИДОВ | 1998 |
|
RU2236406C2 |
| ТЕРАПЕВТИЧЕСКИЕ СОЕДИНЕНИЯ И КОМПОЗИЦИИ | 2015 |
|
RU2733405C2 |
| СПИРОГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ТЕРАПЕВТИЧЕСКИХ СРЕДСТВ | 2006 |
|
RU2428424C2 |

Изобретение относится к производным N-гидроксилсульфонамида формул (I) или (III), где R1 представляет собой Н; R2 представляет собой H; n представляет собой 0; b является целым числом в диапазоне 1-4; R3, R4, R5, R6 и R7 независимо выбраны из Н, галогена, карбоксила, сложного эфира карбоксила, выбранного из группы, включающей -С(O)O-морфолино, -С(O)O-С1-С8алкил и -С(O)O-замещенный С1-С8алкил, где заместителем является морфолино; ациламино, представляющего собой группу -C(O)NRaRb, где Ra и Rb независимо представляют собой С1-С8алкил, или Ra и Rb вместе с атомом азота, к которому они присоединены, образуют морфолино; и сульфониламино, представляющего собой группу SO2NR2, где две группы R вместе с атомом азота, к которому они присоединены, образуют морфолино; R8 выбран из галогена и карбониламино, выбранного из группы -CONH-замещенный С1-С8алкил, где заместителем является морфолино; и -CONR2, где две группы R вместе с атомом азота, к которому они присоединены, образуют морфолино; С представляет собой гетероароматический цикл, содержащий циклические фрагменты Q9, Q10, Q11, Q12, Q13 и Q14, которые независимо выбраны из С, СН и S, при условии, что по меньшей мере один из фрагментов Q9, Q10, Q11, Q12, Q13 и Q14 представляет собой S. Также изобретение относится к способу модулирования уровней нитроксила, способу лечения заболеваний, которые реагируют на лечение нитроксилом, набору для лечения и фармацевтической композиции, содержащей соединения формулы (I) или (III). Технический результат - соединения формулы (I) или (III) для лечения заболеваний, которые реагируют на лечение нитроксилом. 5 н. и 15 з.п. ф-лы, 5 сх., 4 табл., 7 пр.

1. Соединения формул (I) или (III):
 или
или 
где R1 представляет собой Н;
R2 представляет собой Н;
n представляет собой 0;
b является целым числом в диапазоне 1-4;
R3, R4, R5, R6 и R7 независимо выбраны из группы, состоящей из Н, галогена, карбоксила, сложного эфира карбоксила, выбранного из группы, включающей -С(O)O-морфолино, -С(O)O-С1-С8алкил и -С(O)O-замещенный С1-С8алкил, где заместителем является морфолино; ациламино, представляющего собой группу -C(O)NRaRb, где Ra и Rb независимо представляют собой С1-С8алкил, или Ra и Rb вместе с атомом азота, к которому они присоединены, образуют морфолино; и сульфониламино, представляющего собой группу SO2NR2, где две группы R вместе с атомом азота, к которому они присоединены, образуют морфолино; при условии, что хотя бы один из R3, R4, R5, R6 и R7 представляет собой карбоксил, сложный эфир карбоксила, ациламино или сульфониламиногруппу; и при условии, что, когда один из R3, R4, R5, R6 и R7 представляет собой карбоксил или -C(O)O-C1-C8алкил, то хотя бы один из остальных заместителей R3, R4, R5, R6 и R7 представляет собой фрагмент, отличный от Н или галогена;
R8 в каждом случае независимо выбран из группы, состоящей из галогена и карбониламино, выбранного из группы -CONH-замещенный С1-С8алкил, где заместителем является морфолино; и -CONR2, где две группы R вместе с атомом азота, к которому они присоединены, образуют морфолино; при условии, по меньшей мере, один заместитель R8 представляет собой карбониламино;
С представляет собой гетероароматический цикл, содержащий циклические фрагменты Q9, Q10, Q11, Q12, Q13 и Q14, которые независимо выбраны из группы, состоящей из С, СН и S, при условии, что по меньшей мере один из фрагментов Q9, Q10, Q11, Q12, Q13 и Q14 представляет собой S.
2. Соединение по п.1, где соединение является соединением формулы (I).
3. Соединение по п.1, где соединение является соединением формулы (I), и хотя бы один из R3, R4, R5, R6 и R7 представляет собой карбоксил.
4. Соединение по п.1, где соединение является соединением формулы (I), и R4 представляет собой карбоксил.
5. Соединение по п.1, где соединение является соединением формулы (I), и хотя бы один из R3, R4, R5, R6 и R7 представляет собой сложный эфир карбоксила.
6. Соединение по п.1, где соединение является соединением формулы (I), и хотя бы один из R3, R4, R5, R6 и R7 представляет собой -C(O)NRaRb.
7. Соединение по п.1, где соединение является соединением формулы (I), и R4 представляет собой -C(O)NRaRb.
8. Соединение по п.1, где соединение является соединением формулы (I), и хотя бы один из R3, R4, R5, R6 и R7 представляет собой -SO2NR2.
9. Соединение по п.1, где R3 представляет собой -SO2NR2.
10. Соединение по п.1, где соединение выбрано из:

 и
и 
11. Соединение по п.1, где соединение является соединением формулы (III).
12. Соединение по п.1, где соединение является соединением формулы (III) и b представляет собой 1 или 2.
13. Соединение по п.1, где соединение является соединением формулы (III) и b представляет собой 2.
14. Соединение по п.1, где соединение является соединением формулы (III), b представляет собой 2, и R8 выбран из галогена и -CONH-замещенного С1-С8алкила.
15. Соединение по п.1, где соединение является соединением формулы (III), b представляет собой 2, и R8 выбран из галогена и -CONR2.
16. Соединение по п.1, где соединение выбрано из:
 и
и 
17. Способ модулирования уровней нитроксила in vivo в организме индивидуума, нуждающегося в этом, где способ включает введение индивидууму соединения любому из пп.1-16.
18. Способ лечения, предупреждения или замедления наступления или развития заболевания или состояния, которое реагирует на лечение нитроксилом, включающий введение индивидууму, нуждающемуся в этом, соединения по любому из пп.1-16.
19. Фармацевтическая композиция для лечения заболевания или состояния, которое реагирует на лечение нитроксилом, содержащая эффективное количество соединения по любому из пп.1-16 и фармацевтически приемлемый носитель.
20. Набор, включающий соединение по любому из пп.1-16 и инструкцию по его применению для лечения заболевания или состояния, которое реагирует на лечение нитроксилом.
| Установка для испытания образцов материалов на разрушение при изгибе | 1980 |
|
SU930060A1 |
| Способ получения алкилароматических полиимидов | 1979 |
|
SU790725A1 |
| Термостат | 1980 |
|
SU920663A1 |
| 0 |
|
SU402939A1 |
Авторы
Даты
2013-06-20—Публикация
2008-09-26—Подача