Область изобретения
Раскрыты соединения, которые являются ингибиторами фермента диацилглицерин-O-ацилтрансферазы типа 1 (DGAT-1). Также охвачены способы применения таких соединений для ингибирования активности диацилглицерин-O-ацилтрансферазы типа 1 и фармацевтические композиции, содержащие такие соединения.
Уровень техники
Триацилглицериды представляют собой основную форму аккумуляции энергии у эукариотов, и нарушения или дисбаланс в метаболизме триацилглицеридов участвует в патогенезе и увеличивает риск развития ожирения, резистентности к инсулину, диабета типа II, неалкогольного ожирения печени и ишемической болезни сердца (Lewis, et al., Endocrine Reviews 23:201, 2002). Накопление избытка триацилглицеридов в нежировых тканях, таких как печень, мышцы, и других периферических тканях приводит к липид-индуцированной дисфункции в этих тканях; таким образом, уменьшение аккумуляции жира в нежировых участках, по-видимому, может оказаться полезным в лечении липотоксичности (Unger, R. H. Endocrinology, 144: 5159-5165, 2003). Аккумуляция избытка триацилглицеридов в белой жировой ткани (БЖТ) приводит к ожирению, состоянию, которое связано со сниженной продолжительностью жизни, диабетом типа II, заболеванием коронарных артерий, артериальной гипертензией, инсультом и развитием некоторых видов рака (Grundy, S. M. Endocrine 13(2): 155-165, 2000). Ожирение представляет собой хроническое заболевание, которое является очень распространенным в современном обществе, и существующие виды фармакологического лечения являются ограниченными, что создает потребность в разработке фармацевтических средств для лечения ожирения, которые были бы безопасными и эффективными.
Диацилглицерин O-ацилтрансферазы (DGAT) представляют собой мембраносвязанные ферменты, которые катализируют финальную стадию биосинтеза триацилглицеридов. Два фермента, которые показывают активность DGAT, были охарактеризованы: DGAT-1 (диацилглицерин-O-ацилтрансфераза типа 1) (патент США 6 100 077; Cases, et al., Proc. Nat. Acad. Sci. 95:13018-13023, 1998) и DGAT-2 (диацилглицерин-O-ацилтрансфераза типа 2) (Cases, et al., J. Biol. Chem. 276:38870-38876, 2001). DGAT-1 и DGAT-2 имеют между собой только 12%-ую идентичность последовательностей. Существенно то, что DGAT-1-отрицательные мыши резистентны к вызванному диетой ожирению и имеют повышенную чувствительность к инсулину и лептину (Smith, et al., Nature Genetics 25:87-90, 2000; Chen and Farese, Trends Cardiovasc Med. 10:188, 2000; Chen et al., J. Clin. Invest. 109:10049, 2002). Мыши с дефицитом по DGAT-1 защищены против стеатоза печени, демонстрируют увеличенный расход энергии и сниженные уровни триацилглицеридов в ткани. В дополнение к улучшенному метаболизму триацилглицеридов, мыши с дефицитом по DGAT-1 также имеют улучшенный метаболизм глюкозы с более низкими уровнями глюкозы и инсулина после введения глюкозы по сравнению с мышами дикого типа. Частичный дефицит DGAT-1 у гетерозиготных DGAT-1+/- животных достаточен для придания промежуточного фенотипа в отношении массы тела, ожирения и метаболизма инсулина и глюкозы по сравнению с диким типом и гомозиготными однопометными животными (Chen and Farese, Arterioscler. Thromb. Vase. Biol. 25:482-486, 2005), и сообщалось, что малые молекулы-ингибиторы DGAT-1 вызывали снижение массы тела у мышей с индуцированным диетой ожирением (DIO) (US 2004/0224997). Фенотипы мышей с дефицитом по DGAT-1 и фармакологическая активность ингибиторов DGAT-I, о которой сообщалось, позволяют предположить, чтобы открытие малых молекул, которые эффективно блокируют преобразование диацилглицерина в триацилглицериды, ингибируя фермент DGAT-1, может оказаться полезным в лечении ожирения и других заболеваний, связанных с дисбалансом триацилглицеридов.
Сущность изобретения
Один аспект изобретения относится к соединениям формулы (I), или к их фармацевтически приемлемой соли, пролекарству, соли пролекарства, или их комбинациям,
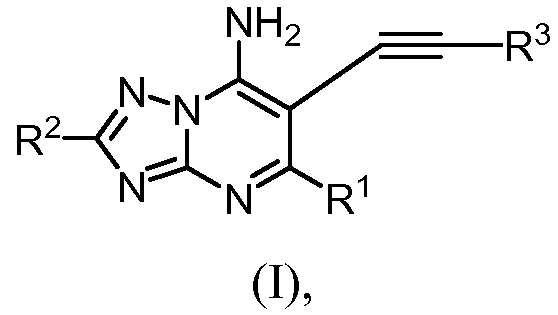
или к их фармацевтически приемлемой соли, пролекарству, соли пролекарства, или их комбинациям, в которой
R1 обозначает водород или алкил;
R2 обозначает водород, галоген, алкил, галогеналкил, арил, гетероарил, циклоалкил или гетероцикл;
R3 обозначает циклоалкил, арил, гетероарил, гетероцикл, -(CRaRb)m-R4, -C(O)OR5, -C(R5)=N-O(Ry), -C(O)-R5 или -C(O)-N(R5)(R6);
M = 1, 2, 3 или 4;
Ra, в каждом случае, является независимо водородом, галогеном, алкилом, алкенилом, галогеналкилом, -OR7a, -N(R8)(R9), -C(O)OR7b, -C(O)-R7b, -C(O)-N(R8)(R9), -(CRcRd)p-OR7a, -(CRcRd)p-N(R8)(R9), -(CRcRd)p-C(O)OR7b, -(CRcRd)p-C(O)-R7b, -(CRcRd)p-C(O)-N(R8)(R9), арилом, гетероарилом, циклоалкилом или гетероциклом;
Rb, в каждом случае, является независимо водородом, галогеном, алкилом, алкенилом, галогеналкилом, -C(O)OR7b, -C(O)-R7b, -C(O)-N(R8)(R9), -(CRcRd)p-OR7a, -(CRcRd)p-N(R8)(R9), -(CRcRd)p-C(O)OR7b, -(CRcRd)p-C(O)-R7b, -(CRcRd)p-C(O)-N(R8)(R9), арилом, гетероарилом, циклоалкилом или гетероциклом;
Ra и Rb могут вместе обозначать =CH2;
Rc и Rd, в каждом случае, обозначают, каждый независимо, водород, галоген, алкил или галогеналкил;
Ry обозначает водород, алкил, галогеналкил, циклоалкил, арил, гетероарил, гетероцикл, циклоалкилалкил, арилалкил, гетероарилалкил или гетероциклоалкил;
R4 обозначает водород, алкил, галогеналкил, циклоалкил, арил, гетероарил или гетероцикл, при условии, что, когда R4 обозначает водород, алкил или галогеналкил, тогда по меньшей мере один Ra обозначает -OR7a, -N(R8)(R9), -C(O)OR7b, -C(O)-R7b, -C(O)-N(R8)(R9), -(CRcRd)p-OR7a, -(CRcRd)p-N(R8)(R9), -(CRcRd)p-C(O)OR7b, -(CRcRd)p-C(O)-R7b или -(CRcRd)p-C(O)-N(R8)(R9); или Ra и Rb вместе обозначают =CH2;
R5, в каждом случае, независимо обозначает алкил, галогеналкил, циклоалкил, арил, гетероарил, гетероцикл, циклоалкилалкил, арилалкил, гетероарилалкил или гетероциклоалкил;
причем каждый циклоалкил, арил, гетероарил, гетероцикл, циклоалкильная группа циклоалкилалкила, арильная группа арилалкила, гетероарильная группа гетероарилалкила, и гетероциклическая группа гетероциклоалкила, представленные R2, R3, Ra, Rb, R4, R5 и Ry, является независимо незамещенными или дополнительно замещены 1, 2, 3, 4 или 5 заместителями, выбранными из, но не ограничиваясь ими, алкила, галогена, галогеналкила, оксо, -OR10, -S(R14), -S(O)2R15, -S(O)2N(R11)(R12), -N(R11)(R12), -C(O)OR10, -C(O)O(триалкилсилилалкила), -C(O)N(R11)(R12), -(CReRf)q-OR10, -(CReRf)q-N(R11)(R12), -(CReRf)q-C(O)OR10, -(CReRf)q-C(O)N(R11)(R12), G1 и =N-O(R10),
R6, R9 и R12, в каждом случае обозначают, каждый независимо, водород, алкил или галогеналкил;
R7a, в каждом случае обозначают, каждый независимо, водород, алкил, галогеналкил, -N=C(H)R13a, -(CRgRh)r-C(O)OR13 или G1,
R7b и R10, в каждом случае, обозначают, каждый независимо, водород, алкил, галогеналкил, -(CRgRh)r-C(O)OR13 или G1,
R8 и R11, в каждом случае, обозначают, каждый независимо, водород, алкил, галогеналкил, -S(O)2-R13a, -S(O)2-N(R13)(R14), -C(O)OR13, -C(O)N(R13)(R14) или G1;
p, q и r, в каждом случае, обозначают, каждый независимо, 1, 2, 3 или 4;
Re, Rf, Rg и Rh, в каждом случае, обозначают, каждый независимо, водород, галоген, алкил или галогеналкил;
R14, в каждом случае, независимо обозначает водород, алкил или галогеналкил;
R15, в каждом случае, независимо обозначает алкил, галогеналкил или G1;
R13, в каждом случае, независимо обозначает водород, алкил, галогеналкил или G1;
R13a, в каждом случае, независимо обозначает алкил, галогеналкил или G1; и
G1, в каждом случае, независимо обозначает арил, гетероарил, циклоалкил, гетероцикл, арилалкил, гетероарилалкил, циклоалкилалкил или гетероциклоалкил, причем арил, гетероарил, циклоалкил, гетероцикл, арильная группа арилалкила, гетероарильная группа гетероарилалкила, циклоалкильная группа циклоалкилалкила и гетероциклическая группа гетероциклоалкила являются, каждый независимо, незамещенным или дополнительно замещенным 1, 2, 3, 4 или 5 заместителями, выбранными из, но не ограничиваясь ими, алкила, галогена, -CN, -NO2, -OH, -O(алкила), -NH2, -N(H)(алкила), -N(алкила)2, -C(O)OH, -C(O)O(алкила), -C(O)NH2, -C(O)N(H)(алкила), -C(O)N(алкила)2, галогеналкила и алкила, замещенных одним заместителем, выбранным из, но не ограничиваясь ими, -CN, -NO2, -OH, -O(алкила), -NH2, -N(H)(алкила), -N(алкила)2, -C(O)OH, -C(O)O(алкила), -C(O)NH2, -C(O)N(H)(алкила) и -C(O)N(алкила)2.
Другой аспект изобретения относится к способам лечения различных заболеваний или состояний у пациента, предпочтительно человека, включающим введение пациенту терапевтически или профилактически эффективного количества соединения по изобретению, как оно раскрыто здесь, или его фармацевтически приемлемой соли, индивидуально или в комбинации с фармацевтически приемлемым носителем. В другом аспекте изобретение относится к способам профилактики или лечения заболевания или состояния, связанного с повышенными уровнями липидов, такими как плазменные уровни липидов, особенно повышенными уровнями триацилглицеридов, у пациента, в особенности, человека, страдающего такими повышенными уровнями, включающим введение пациенту терапевтически или профилактически эффективного количества соединения, его фармацевтически приемлемой соли или содержащей его фармацевтической композиции, как раскрыто здесь. Изобретение также относится к соединениям, имеющим терапевтическую способность снижать уровни липидов, особенно уровни триацилглицеридов, у пациента. Соответственно, соединения и композиции по изобретению, индивидуально или вместе с одним или более фармацевтическими средствами, выбранными из группы, состоящей из ингибитора DPPIV, миметика инкретина, метформина, фенофибрата, римонабанта, сибутрамина, орлистата, никотиновой кислоты и статина, могут быть использованы для получения лекарственного средства для лечения или профилактики заболеваний и нарушений, описанных здесь, в частности, для лечения или профилактики диабета типа 2, ожирения, повышенных плазменных уровней триглицеридов, метаболического синдрома, неалкогольного стеатогепатита и неалкогольного ожирения печени. Соединения по изобретению или их фармацевтически приемлемые соли или композиции, индивидуально или вместе с одним или более фармацевтическими средствами, как описано здесь, также могут быть использованы для получения лекарственного средства для снижения уровней липидов у пациента (например, млекопитающего, включая человека), особенно уровней триглицеридов. В другом аспекте изобретение относится к фармацевтическим композициям, содержащим одно или более соединений по изобретению, как раскрыто здесь, или их фармацевтически приемлемую соль, и фармацевтически приемлемый носитель.
Подробное описание изобретения
Для переменной, которая встречается более одного раза в любом заместителе или в соединении по изобретению или любых других формулах, его определение в каждом случае независимо от его определения в каждом другом случае. Комбинации заместителей допустимы, только если такие комбинации приводят к стабильным соединениям. Стабильные соединения представляют собой соединения, которые могут быть выделены с полезной степенью чистоты из реакционной смеси.
В описании и приложенной формуле изобретения, если не указано иное, следующие термины имеют следующие указанные значения:
Термин "алкенил" в рамках изобретения означает прямую или разветвленную углеводородную цепь, содержащую от 2 до 10 атомов углерода и содержащую по меньшей мере одну углерод-углеродную двойную связь, которая образуется в результате удаления двух атомов водорода. Репрезентативные примеры алкенила включают, но не ограничены ими, этенил, 2-пропенил, 2-метил-2-пропенил, 3-бутенил, 4-пентенил, 5-гексенил, 2-гептенил, 2-метил-1-гептенил и 3-деценил.
Термин "алкил" в рамках изобретения означает прямую или разветвленную насыщенную углеводородную цепь, содержащую от 1 до 10 атомов углерода. Термин "низший алкил" или "C1-6 алкил" означает углеводород c прямой или разветвленной цепью, содержащий от 1 до 6 атомов углерода. Термин "C1-3 алкил" означает углеводород с прямой или разветвленной цепью, содержащий от 1 до 3 атомов углерода.
Репрезентативные примеры алкила включают, но не ограничены ими, метил, этил, н-пропил, изопропил, н-бутил, втор-бутил, изобутил, трет-бутил, н-пентил, изопентил, неопентил, н-гексил, 3-метилгексил, 2,2-диметилпентил, 2,3-диметилпентил, н-гептил, н-октил, н-нонил и н-децил.
Термин "алкилен" обозначает двухвалентную группу, полученную из углеводорода с прямой или разветвленной цепью, содержащей от 1 до 10 атомов углерода. Репрезентативные примеры алкилена включают, но не ограничены ими, -CH2-, -CH2CH2-, -CH2CH2CH2-, -CH2CH2CH2CH2- и - CH2CH(CH3)CH2-.
Термин "алкинил" в рамках изобретения означает углеводород с прямой или разветвленной цепью, содержащей от 2 до 10 атомов углерода и содержащей по меньшей мере одну углерод-углеродную тройную связь. Репрезентативные примеры алкинила включают, но не ограничены ими, ацетиленил, 1-пропинил, 2-пропинил, 3-бутинил, 2-пентинил и 1-бутинил.
Термин "арил" в рамках изобретения означает фенил или бициклический арил. Бициклический арил представляет собой нафтил или фенил, конденсированный с моноциклическим циклоалкилом, или фенил, конденсированный с моноциклическим циклоалкенилом. Фенил и бициклический арил согласно настоящему изобретению незамещены или замещены. Бициклический арил присоединен к родительской молекулярной группе через любой атом углерода, содержащийся в составе бициклического арила. Репрезентативные примеры арила включают, но не ограничены ими, бицикло[4,2,0]окта-1,3,5-триен-7-ил, дигидроинденил, инденил, нафтил, дигидронафталинил и 5,6,7,8-тетрагидронафталинил.
Термин "арилалкил" в рамках изобретения означает арил, как определено здесь, присоединенный к родительской молекулярной группе через алкильную группу, как определено здесь. Репрезентативные примеры арилалкила включают, но не ограничены ими, бензил, 2-фенилэтил и 3-фенилпропил.
Термин "циклоалкил" или "циклоалкан" в рамках изобретения означает моноциклический, бициклический циклоалкил или трициклический циклоалкил. Моноциклический циклоалкил представляет собой кольцевую углеводородную систему, содержащую от трех до восьми атомов углерода, ноль гетероатомов и ноль двойных связей. Примеры моноциклических кольцевых систем включают циклопропил, циклобутил, циклопентил, циклогексил, циклогептил и циклооктил. Бициклический циклоалкил представляет собой моноциклический циклоалкил, конденсированный с моноциклическим циклоалкильным кольцом, или соединенный мостиковой связью моноциклический циклоалкил, в котором два несмежных атома углерода моноциклического кольца связаны алкиленовым мостиком, содержащим один, два, три или четыре атома углерода. Репрезентативные примеры бициклических кольцевых систем включают, но не ограничены ими, бицикло[3,1,1]гептан, бицикло[2,2,1]гептан, бицикло[2,2.2]октан, бицикло[3,2,2]нонан, бицикло[3,3,1]нонан, и бицикло[4,2,1]нонан. Трициклические циклоалкилы иллюстрируются бициклическим циклоалкилом, конденсированным с моноциклическим циклоалкилом, или соединенным мостиковой связью бициклическим циклоалкилом, в котором два несмежных атома углерода бициклической кольцевой системы связаны алкиленовым мостиком, содержащим от одного до четырех атомов углерода. Репрезентативные примеры трициклических кольцевых систем включают, но не ограничены ими, трицикло[3,3,1,03,7]нонан и трицикло[3,3,1,13,7]декан (адамантан). Моноциклические, бициклические и трициклические циклоалкилы могут быть присоединены к родительской молекулярной группе через любой пригодный для замещения атом, содержащийся в составе бициклических и трициклических циклоалкилов, и каждый из них является незамещенным или замещенным.
Термин "циклоалкилалкил" в рамках изобретения означает циклоалкил, как определено здесь, присоединенный к родительской молекулярной группе через алкильную группу, как определено здесь. Репрезентативные примеры циклоалкилалкила включают, но не ограничены ими, циклопропилметил, 2-циклобутилэтил, циклопентилметил и циклогексилметил.
Термин "циклоалкенил" или "циклоалкен" в рамках изобретения означает моноциклическую или бициклическую углеводородную кольцевую систему. Моноциклический циклоалкенил содержит четыре-, пять-, шесть-, семь- или восемь атомов углерода и ноль гетероатомов. Четырехчленные кольцевые системы имеют одну двойную связь, пяти- или шестичленные кольцевые системы имеют одну или две двойных связи, и семи- или восьмичленные кольцевые системы имеют одну, две или три двойных связи. Моноциклический циклоалкенил может быть присоединен к родительской молекулярной группе через любой пригодный для замещения атом, содержащийся в составе моноциклического циклоалкенила. Репрезентативные примеры моноциклических циклоалкенильных групп включают, но не ограничены ими, циклобутенил, циклопентенил, циклогексенил, циклогептенил и циклооктенил. Бициклический циклоалкенил представляет собой моноциклический циклоалкенил, конденсированный с моноциклической циклоалкильной группой, или моноциклический циклоалкенил, конденсированный с моноциклической циклоалкенильной группой. Моноциклическое или бициклическое циклоалкенильное кольцо может содержать один или два алкиленовых мостика, каждый из которых включает один, два, три или четыре атома углерода и каждый из которых связывает два несмежных атома углерода в кольце. Бициклический циклоалкенил может быть присоединен к родительской молекулярной группе через любой пригодный для замещения атом, содержащийся в составе бициклического циклоалкенила. Репрезентативные примеры бициклических циклоалкенильных групп включают, но не ограничены ими, 4,5,6,7-тетрагидро-3aH-инден, октагидронафталинил и 1,6-дигидро-пентален. Моноциклические и бициклические циклоалкенильные группы согласно настоящему изобретению могут быть незамещенными или замещенными.
Термин "циклоалкенилалкил" в рамках изобретения означает циклоалкенильную группу, как определено здесь, присоединенную к родительской молекулярной группе через алкильную группу, как определено здесь.
Термин "галоген" в рамках изобретения означает Cl, Br, I или F.
Термин "галогеналкил" в рамках изобретения означает алкил, как определено здесь, в котором, один, два, три, четыре, пять или шесть атомов водорода замещены галогеном. Репрезентативные примеры галогеналкила включают, но не ограничены ими, хлорметил, 2-фторэтил, трифторметил, дифторметил, пентафторэтил и 2-хлор-3-фторпентил.
Термин "гетероцикл" или "гетероциклический" в рамках изобретения означает моноциклический гетероцикл, бициклический или трициклический гетероцикл. Моноциклический гетероцикл представляет собой трех-, четырех-, пяти-, шести- или семичленное кольцо, содержащее по меньшей мере один гетероатом, независимо выбранный из, но не ограничиваясь ими, O, N и S. Трех- или четырехчленное кольцо содержат ноль или одну двойную связь и один гетероатом, выбранный из, но не ограничиваясь ими, O, N и S. Пятичленное кольцо содержит ноль или одну двойную связь и один, два или три гетероатома, выбранные из, но не ограничиваясь ими, O, N и S. Шестичленное кольцо содержит ноль, одну или две двойных связи и один, два или три гетероатома, выбранные из, но не ограничиваясь ими, O, N и S. Семичленное кольцо содержит ноль, одну, две или три двойных связи и один, два или три гетероатома, выбранные из, но не ограничиваясь ими, O, N и S. Репрезентативные примеры моноциклических гетероциклов включают, но не ограничены ими, азетидинил, азепанил, азиридинил, диазепанил, 1,3-диоксанил, 1,3-диоксоланил, 1,3-дитиоланил, 1,3-дитианил, имидазолинил, имидазолидинил, изотиазолинил, изотиазолидинил, изоксазолинил, изоксазолидинил, морфолинил, оксадиазолинил, оксадиазолидинил, оксазолинил, оксазолидинил, пиперазинил, пиперидинил, пиранил, пиразолинил, пиразолидинил, пирролинил, пирролидинил, тетрагидрофуранил, тетрагидро-2H-пиранил тетрагидротиенил, тиадиазолинил, тиадиазолидинил, тиазолинил, тиазолидинил, тиоморфолинил, 1,1-диоксидотиоморфолинил (тиоморфолин сульфон), тиопиранил и тритианил. Бициклический гетероцикл представляет собой моноциклический гетероцикл, конденсированный с фенилом, или моноциклический гетероцикл, конденсированный с моноциклическим циклоалкилом, или моноциклический гетероцикл, конденсированный с моноциклическим циклоалкенилом, или моноциклический гетероцикл, конденсированный с моноциклическим гетероциклом, или соединенную мостиковой связью моноциклическую гетероциклическую кольцевую систему, в которой два несмежных атома кольца связаны алкиленовым мостиком, содержащим один, два, три или четыре атома углерода. Репрезентативные примеры бициклических гетероциклов включают, но не ограничены ими, бензопиранил, бензотиопиранил, 2,3-дигидробензофуранил, 2,3-дигидробензотиенил и 2,3-дигидро-1Н-индолил. Трициклические гетероциклы иллюстрируются бициклическим гетероциклом, конденсированным с фенилом, или бициклическим гетероциклом, конденсированным с моноциклическим циклоалкилом, или бициклическим гетероциклом, конденсированным с моноциклическим циклоалкенилом, или бициклическим гетероциклом, конденсированным с моноциклическим гетероциклом, или соединенным мостиковой связью бициклическим гетероциклом, в котором два несмежных атома бициклического кольца связаны алкиленовым мостиком, включающим один, два, три или четыре атома углерода. Примеры трициклических гетероциклов включают, но не ограничены ими, оксаадамантан и аза-адамантан. Моноциклические, бициклические и трициклические гетероциклы связаны с родительской молекулярной группой через любой атом углерода или любой атом азота, содержащийся в составе колец. Моноциклические, бициклические и трициклические гетероциклы согласно настоящему изобретению могут быть незамещенными или замещенными.
Термин "гетероциклоалкил" в рамках изобретения означает гетероцикл, как определено здесь, присоединенный к родительской молекулярной группе через алкильную группу, как определено здесь.
Термин "гетероарил" в рамках изобретения означает моноциклический гетероарил или бициклический гетероарил. Моноциклический гетероарил представляет собой пяти- или шестичленное кольцо. Пятичленное кольцо содержит две двойные связи. Пятичленное кольцо может содержать один гетероатом, выбранный из O или S; или один, два или три атома азота и в случае необходимости дополнительный гетероатом, выбранный из кислорода или серы; или четыре атома азота. Шестичленное кольцо содержит три двойных связи и один, два, три или четыре атома азота. Репрезентативные примеры моноциклического гетероарила включают, но не ограничены ими, фуранил, имидазолил, изоксазолил, изотиазолил, оксадиазолил, 1,3-оксазолил, пиридинил, пиридазинил, пиримидинил, пиразинил, пиразолил, пирролил, тетразолил, тиадиазолил, 1,3-тиазолил, тиенил, триазолил и триазинил. Бициклический гетероарил иллюстрируется моноциклическим гетероарилом, конденсированным с фенилом, или моноциклическим гетероарилом, конденсированным с моноциклическим циклоалкилом, или моноциклическим гетероарилом, конденсированным с моноциклическим циклоалкенилом, или моноциклическим гетероарилом, конденсированным с моноциклическим гетероарилом, или моноциклическим гетероарилом, конденсированным с моноциклическим гетероциклом. Репрезентативные примеры бициклических гетероарильных групп включают, но не ограничены ими, бензофуранил, бензотиенил, бензоксазолил, бензимидазолил, бензоксадиазолил, 6,7-дигидро-1,3-бензотиазолил, имидазо[1,2-α]пиридинил, индазолил, индолил, изоиндолил, изохинолинил, нафтиридинил, пиридоимидазолил, хинолинил, тиазоло[5,4-b]пиридин-2-ил, тиазоло[5,4-d]пиримидин-2-ил и 5,6,7,8-тетрагидрохинолин-5-ил. Моноциклические и бициклические гетероарильные группы согласно настоящему изобретению связаны с родительской молекулярной группой через любой атом углерода или любой атом азота, содержащийся в составе колец, и замещены или незамещены.
Термин "гетероарилалкил" в рамках изобретения означает гетероарил, как определено здесь, присоединенный к родительской молекулярной группе через алкильную группу, как определено здесь.
Термин "гетероатом" в рамках изобретения означает атом азота, кислорода или серы.
Термин "оксо" в рамках изобретения означает группу =О.
Термин "триалкилсилил" в рамках изобретения означает группу (алкил)3-Si, присоединенную к родительской молекулярной группе через атом кремния.
Термин "триалкилсилилалкил" в рамках изобретения означает триалкилсилил, как определено здесь, присоединенный к родительской молекулярной группе через алкильную группу, как определено здесь.
Термин "млекопитающее" в рамках изобретения означает человека и животных, таких как кошки, собаки, свиньи, рогатый скот, лошади и т.п.
Соединения по изобретению имеют формулу (I), как описано выше.
Специфические значения переменных групп в соединениях формулы (I) являются следующими. Такие значения могут использоваться, в случае необходимости, с любым из других значений, определений, пунктов формулы изобретения или вариантов осуществления, определенных выше или ниже.
В соединениях формулы (I) R1 обозначает водород или алкил. Примеры алкильной группы для R1 включают, но не ограничены ими, метил и этил.
R2 обозначает водород, галоген, алкил, галогеналкил, арил, гетероарил, циклоалкил или гетероцикл, причем каждое из колец, обозначаемых R2, независимо незамещено или дополнительно замещенно, как описано в кратком описании. В некоторых вариантах осуществления R2 обозначает водород, галоген, алкил (например, метил, этил и т.п.) или галогеналкил. В других вариантах осуществления R2 обозначает водород.
R3 обозначает циклоалкил, арил, гетероарил, гетероцикл, -(CRaRb)m-R4, -C(O)OR5, -C(R5)=N-0(Ry), -C(O)-R5 или -C(O)-N(R5)(R6); причем каждое из колец независимо незамещено или дополнительно замещено, и возможные заместители, Ra, Rb, m, R4, R5, R6 и Ry, являются такими, как определены в кратком описании.
В некоторых вариантах осуществления R3 обозначает циклоалкил (например, циклопропил, циклобутил, циклопентил, циклогексил, бицикло[2,2,1]гептил или циклогептил) или гетероцикл (например, морфолинил или тетрагидро-2H-пиранил), каждый из которых независимо незамещен или дополнительно замещен, как раскрыто в разделе «сущность изобретения». Частные примеры возможных заместителей на кольце, обозначаемом R3, включают, но не ограничены ими, C1-6 алкил (например, метил, этил, изопропил или трет-бутил), галогеналкил (например, трифторметил или дифторметил), галоген, оксо, -OR10, -S(R14), -S(O)2R15, -S(O)2N(R11)(R12), -N(Rπ)(R12), -C(O)OR10, -C(O)O(триалкилсилилалкил), -C(O)N(R11)(R12), -(CReRf)q-OR10, -(CReRf)q-N(R11)(R12), -(CReRf)q-C(O)OR10, -(CReRf)q-C(O)N(R11)(R12) и =N-O(R10), причем R10, R11, R12, R14, R15, Re, Rf и q как определены в разделе «сущность изобретения». Например, R12, Re и Rf, в каждом случае, обозначают, каждый независимо, водород или C1-6 алкил (например, метил, этил, изопропил или трет-бутил). R10, в каждом случае, например, независимо обозначает водород, C1-6 алкил (например, метил, этил, изопропил или трет-бутил), галогеналкил (например, трифторметил или дифторметил), - (CRgRh)r-C(О)OR13, или фенил (незамещенный или замещенный, как описано для G1 в кратком описании), причем Rg, Rh и R13 обозначают, каждый независимо, водород или C1-6 алкил (например, метил, этил, изопропил или трет-бутил и т.п.), и r = 1, 2, 3 или 4, предпочтительно, r = 1 или 2. R11, в каждом случае, например, независимо обозначает водород, C1-6 алкил (например, метил, этил, изопропил или трет-бутил), галогеналкил (например, трифторметил или дифторметил), -S(O)2-R13a, -S(O)2-N(R13)(R14), -C(O)OR13 или -C(O)N(R13)(R14), где R13a, R13 и R14 имеют значения, раскрытые в разделе «сущность изобретения», и q, в каждом случае, означает, например, 1 или 2.
Когда R3 обозначает замещенный циклоалкил или замещенный гетероцикл, один из заместителей может быть присоединен к тому же самому углероду, который связан с алкинилом общей формулы (I). Таким образом в некоторых вариантах осуществления R3 представляет собой формулу (a),
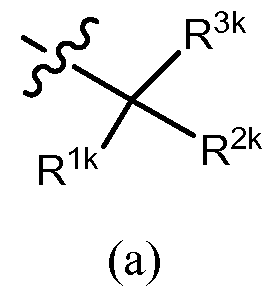 ,
,
в которой R1k и R2k вместе с атомом углерода, к которому они присоединены, образуют циклоалкильное кольцо (например, циклопропил, циклобутил, циклопентил, циклогексил, бицикло[2,2,1]гептил или циклогептил), или гетероциклическое кольцо (например, тетрагидро-2H-пиранил), каждое из которых независимо незамещено или дополнительно замещено, как описано в разделе «сущность изобретения» и в предыдущем параграфе, и R3k обозначает -OR10, -N(R11)(R12), -C(O)OR10 или -C(O)O(триалкилсилилалкил), где R10, R11 и R12 имеют значения, определенные в разделе «сущность изобретения». R12, например, обозначает водород или C1-6 алкил (например, метил, этил, изопропил или трет-бутил). Частный пример R10, в каждом случае, независимо обозначает водород, C1-6 алкил (например, метил, этил, изопропил или трет-бутил), галогеналкил (например, трифторметил или дифторметил), -(CRgRh)r-C(О)OR13, или фенил (незамещенный или замещенный, как описано для G1 в разделе «сущность изобретения»), причем Rg, Rh и R13, например, каждый независимо обозначают водород или C1-6 алкил (например, метил, этил, изопропил или трет-бутил), и r = 1, 2, 3 или 4, предпочтительно, r = 1 или 2. R11, например, обозначает водород, C1-6 алкил (например, метил, этил, изопропил или трет-бутил), галогеналкил (например, трифторметил или дифторметил), -S(O)2-R13a, -S(O)2-N(R13)(R14), -C(O)OR13 или -C(O)N(R13)(R14), причем R13a, R13 и R14 имеют значения, раскрытые в разделе «сущность изобретения». В некоторых вариантах осуществления R3k обозначает -OH или -OCH2COOH. В других вариантах осуществления R3k обозначает -NH2 или -N(H)S(O)2R13a, причем R13a обозначает в случае необходимости замещенный фенил.
В других вариантах осуществления R3 обозначает арил (например, фенил), незамещенный или замещенный, как описано в разделе «сущность изобретения». Примеры возможных заместителей на ариле, обозначаемом R3, включают, но не ограничены ими, алкил, такой как C1-6 алкил (например, метил, этил, изопропил или трет-бутил), галогеналкил (например, трифторметил или дифторметил), галоген, -OR10,, -S(R14), -S(O)2R15, -S(O)2N(R11)(R12), -N(R11)(R12), -C(O)OR10, -C(O)O(триалкилсилилалкил), -C(O)N(R11)(R12), -(CReRf)q-OR10, -(CReRf)q-N(R11)(R12), -(CReRf)q-C(O)OR10, -(CReRf)q-C(O)N(R11)(R12) и G1, причем G1, R10, R11, R12, R14, R15, Re, Rf и q имеют значения, определенные в разделе «сущность изобретения». Например, G1 обозначает арил (например, фенил) или гетероарил, каждый из которых в случае необходимости дополнительно замещен, как описано в разделе «сущность изобретения». R12, Re и Rf, в каждом случае, например, каждый независимо обозначает водород или C1-6 алкил (например, метил, этил, изопропил или трет-бутил). R10, в каждом случае, например, независимо обозначает водород, C1-6 алкил (например, метил, этил, изопропил, или трет-бутил), галогеналкил (например, трифторметил или дифторметил), -(CRgRh)r-C(O)OR13 или фенил (незамещенный или замещенный, как описано для G1 в разделе «сущность изобретения»), причем Rg, Rh и R13, например, каждый независимо обозначают водород или C1-6 алкил (например, метил, этил, изопропил или трет-бутил), и r = 1, 2, 3 или 4, предпочтительно, r = 1 или 2. R11, в каждом случае, например, независимо обозначает водород, C1-6 алкил (например, метил, этил, изопропил или трет-бутил), галогеналкил (например, трифторметил или дифторметил), -S(O)2-R13a, -S(O)2-N(R13)(R14), -C(O)OR13 или -C(O)N(R13)(R14), причем R13a, R13 и R14 являются такими, как раскрыто в разделе «сущность изобретения», q, в каждом случае, например, независимо означает 1 или 2. В некоторых вариантах осуществления R3 обозначает фенил, незамещенный или дополнительно замещенный, как описано в разделе «сущность изобретения» и в вариантах осуществления.
В других вариантах осуществления, R3 обозначает -(CRaRb)m-R4, где Ra, Rb, R4 и m имеют значения, определенные в разделе «сущность изобретения». В других вариантах осуществления, R3 обозначает -(CRaRb)m-R4, где Ra и Rb, в каждом случае, обозначают, каждый независимо, водород, алкил (например, C1-6 алкил, такой как метил, этил, изопропил или трет-бутил), алкенил, галоген или галогеналкил (например, трифторметил или дифторметил), m = 1, 2, 3 или 4, и R4 обозначает циклоалкил, арил, гетероарил или гетероцикл, каждый из которых в случае необходимости дополнительно замещен, как описано в разделе «сущность изобретения». В некоторых вариантах осуществления m = 1 или 2. Примеры подгруппы соединений, описанных здесь, включают, но не ограничены ими, соединения, в которых R3 представляет собой формулу (b)
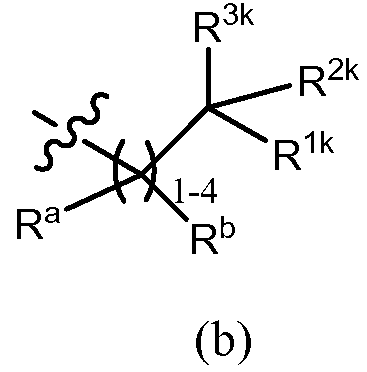 ,
,
в которой Ra и Rb, в каждом случае, обозначают, каждый независимо, водород, галоген, алкил, такой как C1-6 алкил (например, метил, этил, изопропил или трет-бутил), алкенил или галогеналкил (например, трифторметил или дифторметил), R1k и R2k вместе с атомом углерода, к которому они присоединены, образуют циклоалкил (например, циклопропил, циклобутил, циклопентил, циклогексил, бицикло[2,2,1]гептил или циклогептил) или гетероцикл (например, тетрагидро-2H-пиранил), каждый из которых независимо незамещен или дополнительно замещен, как описано для R3 в разделе «сущность изобретения», и R3k обозначает -OR10, -N(R11)(R12), -C(O)OR10 или -C(O)O(триалкилсилилалкил), причем R10, R11 и R12 имеют значения, определенные в разделе «сущность изобретения». Примеры возможных заместителей на кольце, которое образуют R1k, R2k и атом углерода, включают, но не ограничены ими, C1-6 алкил (например, метил, этил, изопропил или трет-бутил), галогеналкил (например, трифторметил или дифторметил), галоген, оксо, -OR10, -N(R11)(R12), -C(O)OR10, -C(O)O(триалкилсилилалкил), -C(O)N(R11)(R12), -(CReRf)q-OR10, -(CReRf)q-N(R11)(R12), -(CReRf)q-C(O)OR10, -(CReRf)q-C(O)N(R11)(R12) и =N-O(R10), причем R10, R11, R12, Re, Rf и q имеют значения, определенные в разделе «сущность изобретения». Например, R12, Re и Rf, в каждом случае, обозначают, каждый независимо, водород или C1-6 алкил (например, метил, этил, изопропил или трет-бутил). Например, R10, в каждом случае, независимо обозначает водород, C1-6 алкил (например, метил, этил, изопропил или трет-бутил), галогеналкил (например, трифторметил или дифторметил), -(CRgRh)r-C(О)OR13 или фенил (незамещенный или замещенный, как описано для G1 в разделе «сущность изобретения»), причем Rg, Rh и R13, например, каждый независимо обозначают водород или C1-6 алкил (например, метил, этил, изопропил или трет-бутил), и r = 1, 2, 3 или 4, предпочтительно, r = 1 или 2. R11, в каждом случае, например, независимо обозначает водород, C1-6 алкил (например, метил, этил, изопропил или трет-бутил), галогеналкил (например, трифторметил или дифторметил), -S(O)2-R13a, -S(O)2-N(R13)(R14), -C(O)OR13 или -C(O)N(R13)(R14), причем R13, R13a и R14 имеют значения, раскрытые в разделе «сущность изобретения», и q, в каждом случае, например, означает 1 или 2.
В других вариантах осуществления R3 представляет собой формулу (c)
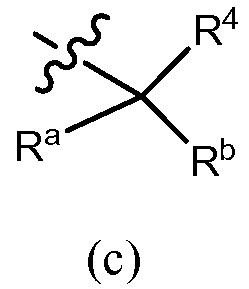 ,
,
в которой Rb обозначает водород, галоген, алкил (например, метил, этил, изопропил или трет-бутил), алкенил, -C(О)OR7b, галогеналкил (например, трифторметил или дифторметил), арил (например, фенил), гетероарил, циклоалкил (например, циклопропил, циклобутил, циклопентил, циклогексил или циклогептил) или гетероцикл (например, морфолинил), причем каждый арил, гетероарил, циклоалкил или гетероцикл независимо незамещен или замещен, как описано в разделе «сущность изобретения». Примеры возможных заместителей Rb как кольца включают, но не ограничены ими, C1-6 алкил, галоген и галогеналкил. Ra обозначает OR7a, N(R8)(R9) или -C(О)OR7b, или Ra и Rb вместе обозначают =CH2; R4 обозначает водород, алкил (например, метил, этил, изопропил или трет-бутил), галогеналкил, циклоалкил (например, циклопропил, циклобутил, циклопентил, циклогексил, циклогептил или бицикло[2,2,1]гептил), арил (например, фенил), гетероарил или гетероцикл (например, морфолинил, тетрагидро-2H-пиранил), причем каждое из колец, обозначаемых R4, могут независимо быть дополнительно замещено, как описано в разделе «сущность изобретения», и R7a, R7b, R8 и R9 являются такими, как они раскрыты в разделе «сущность изобретения». Например, R7a обозначает водород, C1-6 алкил (например, метил, этил, изопропил или трет-бутил), галогеналкил (например, трифторметил или дифторметил), -(CRgRh)r-C(O)OR13, причем Rg, Rh, R13 и r, как описаны в разделе «сущность изобретения», или фенил (незамещенный или замещенный, как описано в разделе «сущность изобретения»). R7b, Rg, Rh, R13 и R9, в каждом случае, например, каждый независимо обозначают водород, C1-6 алкил (например, метил, этил, изопропил или трет-бутил) или галогеналкил (например, трифторметил или дифторметил). r, например, означает 1 или 2. R8, например, обозначает водород, C1-6 алкил (например, метил, этил, изопропил или трет-бутил), галогеналкил (например, трифторметил или дифторметил), -S(O)2-R13a, -S(O)2-N(R13)(R14), -C(O)OR13 или -C(O)N(R13)(R14), причем R13, R13a и R14 являются такими, как они раскрыты в разделе «сущность изобретения».
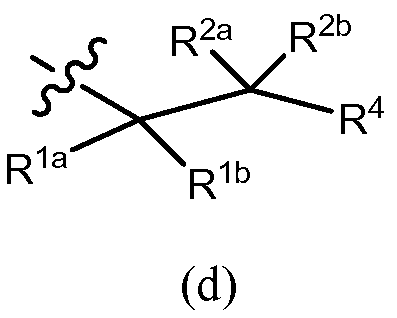
В другом варианте осуществления R3 представляет собой формулу (d)
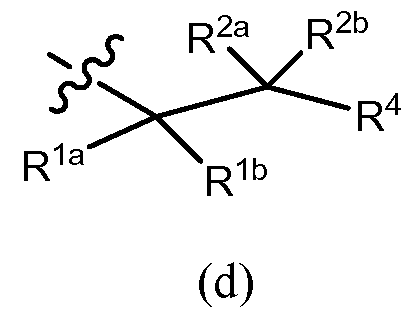 ,
,
в которой R1b обозначает водород, алкил (например, метил, этил, изопропил или трет-бутил), алкенил, галоген, -C(O)OR7b, галогеналкил (например, трифторметил или дифторметил), арил, гетероарил, циклоалкил (например, циклопропил, циклобутил, циклопентил или циклогексил) или гетероцикл (например, морфолинил), R1a обозначает OR7a, N(R8)(R9) или -C(O)OR7b, и R2a и R2b, в каждом случае, являются независимо водородом, галогеном, алкилом (например, метилом, этилом, изопропилом или трет-бутилом), алкенилом или галогеналкилом (например, трифторметилом или дифторметилом); или R2b обозначает водород, алкил (например, метил, этил, изопропил или трет-бутил), алкенил, галоген, -C(O)OR7b, галогеналкил (например, трифторметил или дифторметил), арил (например, фенил), гетероарил, циклоалкил (например, циклопропил, циклобутил, циклопентил, или циклогексил) или гетероцикл (например, морфолинил), R2a обозначает OR7a, N(R8)(R9) или -C(O)OR7b, и R1a и R1b, в каждом случае, являются независимо водородом, галогеном, алкилом (например, метилом, этилом, изопропилом или трет-бутилом), алкенилом или галогеналкилом (например, трифторметилом или дифторметилом); причем каждый арил, гетероарил, циклоалкил или гетероцикл, обозначаемый R1b и R2b, независимо незамещен или замещен, как описано для Rb в разделе «сущность изобретения». Примеры возможных заместителей R1b или R2b как колец включают, но не ограничены ими, C1-6 алкил, галоген и галогеналкил. R4 обозначает водород, алкил, галогеналкил, циклоалкил (например, циклопропил, циклобутил, циклопентил, циклогексил, циклогептил или бицикло[2,2,1]гептил), арил (например, фенил), гетероарил или гетероцикл (например, тетрагидро-2H-пиранил), причем каждый циклоалкил, арил, гетероарил или гетероцикл, обозначаемый R4, независимо в случае необходимости дополнительно замещен, как описано в разделе «сущность изобретения», и R7a, R7b, R8 и R9 являются такими, как они раскрыты в разделе «сущность изобретения». Например, R7a, в каждом случае, независимо обозначает водород, C1-6 алкил (например, метил, этил, изопропил или трет-бутил), галогеналкил (например, трифторметил или дифторметил), -(CRgRh)r-C(O)OR13, причем Rg, Rh, R13 и r имеют значения, описанные в разделе «сущность изобретения», или фенил (незамещенный или замещенный, как описано в разделе «сущность изобретения»). R7b, Rg, Rh, R9, R13 и R9, в каждом случае, например, каждый независимо обозначают водород, C1-6 алкил (например, метил, этил, изопропил или трет-бутил) или галогеналкил (например, трифторметил или дифторметил). r, например, означает 1 или 2. R8, в каждом случае, например, независимо обозначает водород, C1-6 алкил (например, метил, этил, изопропил или трет-бутил), галогеналкил (например, трифторметил или дифторметил), -S(O)2-R13a, -S(O)2-N(R13)(R14), -C(O)OR13 или -C(O)N(R13)(R14), причем R13, R13a и R14 являются такими, как они раскрыты в разделе «сущность изобретения».
В другом варианте осуществления R3 обозначает -C(O)-R5, причем R5 является таким, как он описан в разделе «сущность изобретения». Например, R5 обозначает арил, такой как фенил, незамещенный или дополнительно замещенный, как описано в разделе «сущность изобретения».
Следует понимать, что в настоящем изобретении рассматриваются соединения формулы (I) с комбинациями вышеуказанных вариантов осуществления, включая частные, более специфические и предпочтительные варианты осуществления.
Соответственно, один аспект изобретения относится к соединениям формулы (I), или к их фармацевтически приемлемым солям, пролекарствам, солям пролекарств, или к их комбинациям, в которых R2 обозначает водород, галоген, алкил, или галогеналкил, R3 обозначает арил (например, фенил), незамещенный или замещенный, как описано в разделе «сущность изобретения». Примеры возможных заместителей на ариле, обозначаемом R3, включают, но не ограничены ими, алкил, такой как C1-6 алкил (например, метил, этил, изопропил или трет-бутил), галогеналкил (например, трифторметил или дифторметил), галоген, -OR10,, -S(R14), -S(O)2R15, -S(O)2N(R11)(R12), -N(R11)(R12), -C(O)OR10, -C(O)O(триалкилсилилалкил), -C(O)N(R11)(R12), -(CReRf)q-OR10 -(CReRf)q-N(R11)(R12), -(CReRf)q-C(O)OR10, -(CReRf)q-C(O)N(R11)(R12) и G1, причем G1, R10, R11, R12, R14, R15, Re, Rf и q являются такими, как они определены в разделе «сущность изобретения». Например, G1 обозначает арил (например, фенил) или гетероарил, каждый из которых в случае необходимости дополнительно замещен, как описано в разделе «сущность изобретения». R12, Re и Rf, в каждом случае, например, каждый независимо обозначают водород или C1-6 алкил (например, метил, этил, изопропил или трет-бутил). R10, в каждом случае, например, независимо обозначает водород, C1-6 алкил (например, метил, этил, изопропил или трет-бутил), галогеналкил (например, трифторметил или дифторметил), -(CRgRh)r-C(O)OR13 или фенил (незамещенный или замещенный, как описано для G1 в разделе «сущность изобретения»), причем Rg, Rh и R13, например, каждый независимо обозначают водород или C1-6 алкил (например, метил, этил, изопропил или трет-бутил), и r = 1, 2, 3 или 4, предпочтительно, r = 1 или 2. R11, в каждом случае, например, независимо обозначает водород, C1-6 алкил (например, метил, этил, изопропил или трет-бутил), галогеналкил (например, трифторметил или дифторметил), -S(O)2-R13a, -S(O)2-N(R13)(R14), -C(O)OR13 или -C(O)N(R13)(R14), причем R13a, R13 и R14 являются такими, как они раскрыты в разделе «сущность изобретения», q, в каждом случае, например, независимо означает 1 или 2. В некоторых вариантах осуществления R3 обозначает фенил, незамещенный или дополнительно замещенный, как описано в разделе «сущность изобретения» и в вариантах осуществления. В некоторых вариантах осуществления R2 обозначает водород.
Другой аспект изобретения относится к соединениям формулы (I), или к их фармацевтически приемлемым солям, пролекарствам, солям пролекарств, или их комбинациям, в которых R3 обозначает циклоалкил (например, циклопропил, циклобутил, циклопентил, циклогексил, бицикло[2,2,1]гептил или циклогептил) или гетероцикл (например, морфолинил, или тетрагидро-2H-пиранил), каждый из которых независимо незамещен или дополнительно замещен, как раскрыто в разделе «сущность изобретения», и R2 обозначает водород, галоген, алкил или галогеналкил. Примеры возможных заместителей на кольце, обозначаемом R3, включают, но не ограничены ими, C1-6 алкил (например, метил, этил, изопропил или трет-бутил), галогеналкил (например, трифторметил или дифторметил), галоген, оксо, -OR10, -S(R14), -S(O)2R15, -S(O)2N(R11)(R12), -N(R11)(R12), -C(O)OR10, -C(O)O(триалкилсилилалкил), -C(O)N(R11)(R12), -(CReRf)q-OR10, -(CReRf)q-N(R11)(R12), -(CReRf)q-C(O)OR10, -(CReRf)q-C(O)N(R11)(R12) и =N-O(R10), причем R10, R11, R12, R14, R15, Re, Rf и q являются такими, как они определены в разделе «сущность изобретения». Например, R12, Re и Rf, в каждом случае, обозначают, каждый независимо, водород или C1-6 алкил (например, метил, этил, изопропил или трет-бутил). R10, в каждом случае, например, независимо обозначает водород, C1-6 алкил (например, метил, этил, изопропил или трет-бутил), галогеналкил (например, трифторметил или дифторметил), -(CRgRh)r-C(О)OR13, или фенил (незамещенный или замещенный, как описано для G1 в разделе «сущность изобретения»), причем Rg, Rh и R13 обозначают, каждый независимо, водород или C1-6 алкил (например, метил, этил, изопропил или трет-бутил, и т.п.), и r = 1, 2, 3 или 4, предпочтительно, r = 1 или 2. R11, в каждом случае, обозначает, например, водород, C1-6 алкил (например, метил, этил, изопропил или трет-бутил), галогеналкил (например, трифторметил или дифторметил), -S(O)2-R13a, -S(O)2-N(R13)(R14), -C(O)OR13 или -C(O)N(R13)(R14), причем R13, R13a и R14 являются такими, как они раскрыты в разделе «сущность изобретения», и q, например, означает 1 или 2. В некоторых вариантах осуществления R2 обозначает водород.
Из этой группы соединений примеры подгруппы включают соединения, в которых R3 представляет собой формулу (a),
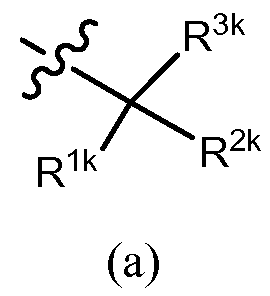 ,
,
в которой R1k и R2k вместе с атомом углерода, к которому они присоединены, образуют циклоалкил (например, циклопропил, циклобутил, циклопентил, циклогексил, бицикло[2,2,1]гептил или циклогептил) или гетероцикл (например, тетрагидро-2H-пиранил), каждый из которых независимо незамещен или дополнительно замещен, как описано в предыдущем абзаце, R3k обозначает -OR10, -N(R11)(R12), -C(O)OR10 или -C(O)O(триалкилсилилалкил), причем R10, R11 и R12 имеют значения, определенные в разделе «сущность изобретения», и R2 обозначает водород, галоген, алкил или галогеналкил. R12, например, обозначает водород или C1-6 алкил (например, метил, этил, изопропил или трет-бутил). Например, R10, в каждом случае, независимо обозначает водород, C1-6 алкил (например, метил, этил, изопропил или трет-бутил), галогеналкил (например, трифторметил или дифторметил), -(CRgRh)r-C(О)OR13, или фенил (незамещенный или замещенный, как описано для G1 в разделе «сущность изобретения»), причем Rg, Rh и R13, например, каждый независимо обозначают водород или C1-6 алкил (например, метил, этил, изопропил или трет-бутил), и r = 1, 2, 3 или 4, предпочтительно, r = 1 или 2. R11, например, обозначает водород, C1-6 алкил (например, метил, этил, изопропил или трет-бутил), галогеналкил (например, трифторметил или дифторметил), -S(O)2-R13a, -S(O)2-N(R13)(R14), -C(O)OR13 или -C(O)N(R13)(R14), причем R13, R13a и R14 являются такими, как они раскрыты в разделе «сущность изобретения». В некоторых вариантах осуществления R2 обозначает водород. В некоторых вариантах осуществления R3k обозначает -OH или -OCH2COOH. В других вариантах осуществления R3k обозначает -NH2 или -N(H)S(O)2R13a, причем R13a обозначает в случае необходимости замещенный фенил.
Другой аспект изобретения относится к соединениям формулы (I), или к их фармацевтически приемлемым солям, пролекарствам, солям пролекарств, или их комбинации, в которых R3 обозначает арил (например, фенил), незамещенный или замещенный, как описано в разделе «сущность изобретения», и R2 обозначает водород, галоген, алкил или галогеналкил. Примеры возможных заместителей на ариле, обозначаемом R3, включают, но не ограничены ими, алкил, такой как C1-6 алкил (например, метил, этил, изопропил или трет-бутил), галогеналкил (например, трифторметил или дифторметил), галоген, -OR10, -S(R14), -S(O)2R15, -S(O)2N(R11)(R12), -N(R11)(R12), -C(O)OR10, -C(O)O(триалкилсилилалкил), -C(O)N(R11)(R12), -(CReRf)q-OR10, -(CReRf)q-N(R11)(R12), -(CReRf)q-C(O)OR10, -(CReRf)q-C(O)N(R11)(R12) и G1, причем G1, R10, R11, R12, R14, R15, Re, Rf и q являются такими, как они определены в разделе «сущность изобретения». Например, G1 обозначает арил (например, фенил) или гетероарил, каждый из которых в случае необходимости дополнительно замещен, как описано в разделе «сущность изобретения». R12, Re и Rf, в каждом случае, например, каждый независимо обозначают водород или C1-6 алкил (например, метил, этил, изопропил или трет-бутил). R10, в каждом случае, например, независимо обозначает водород, C1-6 алкил (например, метил, этил, изопропил или трет-бутил), галогеналкил (например, трифторметил или дифторметил), -(CRgRh)r-C(О)OR13 или фенил (незамещенный или замещенный, как описано для G1 в разделе «сущность изобретения»), причем Rg, Rh, R13, например, каждый независимо обозначают водород или C1-6 алкил (например, метил, этил, изопропил или трет-бутил), и r = 1, 2, 3 или 4, предпочтительно, r = 1 или 2. R11, в каждом случае, например, независимо обозначает водород, C1-6 алкил (например, метил, этил, изопропил или трет-бутил), галогеналкил (например, трифторметил или дифторметил), -S(O)2-R13a, -S(O)2-N(R13)(R14), -C(O)OR13 или -C(O)N(R13)(R14), причем R13, R13a и R14 являются такими, как они раскрыты в разделе «сущность изобретения», q, в каждом случае, например, независимо означает 1 или 2. В некоторых вариантах осуществления R2 обозначает водород. В некоторых вариантах осуществления R3 обозначает фенил, в случае необходимости замещенный, как описано в разделе «сущность изобретения» и в вариантах осуществления.
Еще один аспект изобретения относится к соединениям формулы (I), или к их фармацевтически приемлемым солям, пролекарствам, солям пролекарств, или их комбинации, в которых R3 обозначает -(CRaRb)m-R4, причем Ra, в каждом случае, независимо обозначает водород, галоген, алкил, алкенил, галогеналкил, -OR7a, -N(R8)(R9), -C(O)OR7b, -C(O)-R7b, -C(O)-N(R8)(R9), -(CRcRd)p-OR7a, -(CRcRd)p-N(R8)(R9), -(CRcRd)p-C(O)OR7b, -(CRcRd)p-C(O)-R7b, -(CRcRd)p-C(O)-N(R8)(R9), арил, гетероарил, циклоалкил или гетероцикл; Rb, в каждом случае, независимо обозначает водород, галоген, алкил, алкенил, галогеналкил, -C(O)OR7b, -C(O)-R7b, -C(O)-N(R8)(R9), -(CRcRd)p-OR7a, -(CRcRd)p-N(R8)(R9), -(CRcRd)p-C(O)OR7b, -(CRcRd)p-C(O)-R7b, -(CRcRd)p-C(O)-N(R8)(R9), арил, гетероарил, циклоалкил или гетероцикл, или Ra и Rb вместе обозначают =CH2; причем каждое из колец, обозначаемых Ra и Rb, независимо незамещено или дополнительно замещено, как описано в разделе «сущность изобретения», R4 обозначает водород, алкил, галогеналкил, циклоалкил, арил, гетероарил или гетероцикл, причем каждый циклоалкил, арил, гетероарил или гетероцикл независимо в случае необходимости замещен, как описано в разделе «сущность изобретения», при условии, что, когда R4 обозначает водород, алкил или галогеналкил, тогда по меньшей мере один Ra обозначает -OR7a, -N(R8)(R9), -C(O)OR7b, -C(O)-R7b, -C(O)-N(R8)(R9), -(CRcRd)p-OR7a, -(CRcRd)p-N(R8)(R9), -(CRcRd)p-C(O)OR7b, -(CRcRd)p-C(O)-R7b или -(CRcRd)p-C(O)-N(R8)(R9), или Ra и Rb вместе обозначают =CH2; R2 обозначает водород, галоген, алкил или галогеналкил, и m, p, Rc, Rd, R7a, R7b, R8 и R9 являются такими, как они раскрыты в разделе «сущность изобретения». В одном варианте осуществления R2 обозначает водород.
Из этой группы соединений примеры включают соединения, в которых R3 обозначает -(CRaRb)m-R4, причем Ra и Rb, в каждом случае, обозначают, каждый независимо, водород, алкил (например, C1-6 алкил, такой как метил, этил, изопропил или трет-бутил), алкенил, галоген или галогеналкил (например, трифторметил или дифторметил), m = 1, 2, 3 или 4, и R4 обозначает циклоалкил (например, циклопропил, циклобутил, циклопентил, циклогексил, бицикло[2,2,1]гептил или циклогептил), арил (например, фенил), гетероарил или гетероцикл (например, тетрагидро-2H-пиранил), каждый из которых в случае необходимости дополнительно замещен, как описано в разделе «сущность изобретения». В некоторых вариантах осуществления, m = 1 или 2.
Из этой группы соединений другие примеры включают соединения, в которых R3 имеет формулу (b)
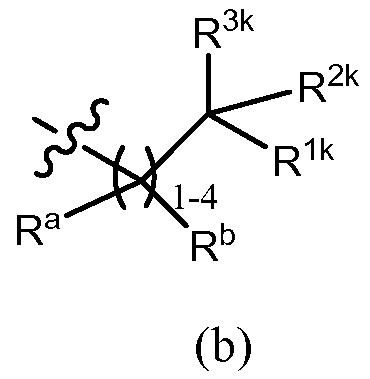 ,
,
в которой Ra и Rb, в каждом случае, обозначают, каждый независимо, водород, галоген, алкил (например, C1-6 алкил, такой как метил, этил, изопропил или трет-бутил), алкенил или галогеналкил (например, трифторметил или дифторметил), R1k и R2k вместе с атомом углерода, к которому они присоединены, образуют циклоалкил (например, циклопропил, циклобутил, циклопентил, циклогексил, бицикло[2,2,1]гептил или циклогептил) или гетероцикл (например, тетрагидро-2H-пиранил), каждый из которых независимо незамещен или дополнительно замещен, как описано для R3 в разделе «сущность изобретения», R3k обозначает -OR10, -N(R11)(R12), -C(O)OR10 или -C(O)O(триалкилсилилалкил), R2 обозначает водород, галоген, алкил или галогеналкил, и R10, R11 и R12 имеют значения, определенные в разделе «сущность изобретения». Примеры возможных заместителей на кольце, которое образуют R1k, R2k и атом углерода, включают, но не ограничены ими, C1-6 алкил (например, метил, этил, изопропил или трет-бутил), галогеналкил (например, трифторметил или дифторметил), галоген, оксо, -OR10, -N(R11)(R12), -C(O)OR10, -C(O)O(триалкилсилилалкил), -C(O)N(R11)(R12), -(CReRf)q-OR10, -(CReRf)q-N(R11)(R12), -(CReRf)q-C(O)OR10, -(CReRf)q-C(O)N(R11)(R12) и =N-O(R10), причем R10, R11, R12, Re, Rf и q являются такими, как они определены в разделе «сущность изобретения». R12, в каждом случае, например, независимо обозначает водород или C1-6 алкил (например, метил, этил, изопропил или трет-бутил). Например, R10, в каждом случае, независимо обозначает водород, C1-6 алкил (например, метил, этил, изопропил или трет-бутил), галогеналкил (например, трифторметил или дифторметил), -(CRgRh)r-C(O)OR13 или фенил (незамещенный или замещенный, как описано для G1 в разделе «сущность изобретения»), причем Rg, Rh и R13, например, каждый независимо обозначают водород или C1-6 алкил (например, метил, этил, изопропил или трет-бутил), и r = 1, 2, 3 или 4, предпочтительно, r = 1 или 2. R11, в каждом случае, например, независимо обозначает водород, C1-6 алкил (например, метил, этил, изопропил или трет-бутил), галогеналкил (например, трифторметил или дифторметил), -S(O)2-R13a, -S(O)2-N(R13)(R14), -C(O)OR13 или -C(O)N(R13)(R14), причем R13, R13a и R14 являются такими, как они раскрыты в разделе «сущность изобретения», и q, в каждом случае, например, независимо означает 1 или 2. В некоторых вариантах осуществления R2 обозначает водород.
Другие примеры этой группы соединений включают соединения, в которых R3 представляет собой формулу (c)
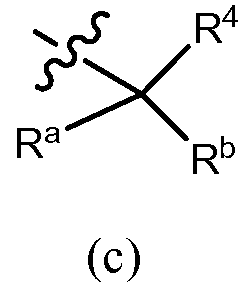
в которой Rb обозначает водород, галоген, алкил (например, C1-6 алкил, такой как метил, этил, изопропил или трет-бутил), алкенил, -C(O)OR7b, галогеналкил (например, трифторметил или дифторметил), арил (например, фенил), гетероарил, циклоалкил (например, циклопропил, циклобутил, циклопентил, циклогексил или циклогептил), или гетероцикл (например, морфолинил), причем каждый арил, гетероарил, циклоалкил или гетероцикл независимо незамещен или замещен, как описано в разделе «сущность изобретения», Ra обозначает OR7a, N(R8)(R9) или -C(O)OR7b, или Ra и Rb вместе обозначают =CH2; R4 обозначает водород, алкил (например, C1-6 алкил, такой как метил, этил, изопропил или трет-бутил), галогеналкил, циклоалкил (например, циклопропил, циклобутил, циклопентил, циклогексил, циклогептил или бицикло[2,2,1]гептил), арил (например, фенил), гетероарил или гетероцикл (например, тетрагидро-2H-пиранил), причем каждое из колец, обозначаемых R4, может быть независимо дополнительно замещено, как описано в разделе «сущность изобретения» и в вариантах осуществления, и R7a, R7b, R8 и R9 являются такими, как они раскрыты в разделе «сущность изобретения». Примеры возможных заместителей Rb как кольца включают, но не ограничены ими, C1-6 алкил, галоген и галогеналкил. R7a, например, обозначает водород, C1-6 алкил (например, метил, этил, изопропил или трет-бутил), галогеналкил (например, трифторметил или дифторметил), -(CRgRh)r-C(O)OR13, причем Rg, Rh, R13 и r являются такими, как они описаны в разделе «сущность изобретения», или фенил (незамещенный или замещенный, как описано в разделе «сущность изобретения»). R7b, Rg, Rh, R13 и R9, в каждом случае, например, каждый независимо обозначают водород, C1-6 алкил (например, метил, этил, изопропил или трет-бутил) или галогеналкил (например, трифторметил или дифторметил). r, например, означает 1 или 2. R8, например, обозначает водород, C1-6 алкил (например, метил, этил, изопропил или трет-бутил), галогеналкил (например, трифторметил или дифторметил), -S(O)2-R13a, -S(O)2-N(R13)(R14), -C(O)OR13 или -C(O)N(R13)(R14), причем R13, R13a и R14 являются такими, как они раскрыты в разделе «сущность изобретения».
Другие примеры этой группы соединений включают соединения, в которых R3 представляет собой формулу (d)
 ,
,
в которой R1b обозначает водород, алкил (например, C1-6 алкил, такой как метил, этил, изопропил или трет-бутил), алкенил, галоген, -C(O)OR7b, галогеналкил (например, трифторметил или дифторметил), арил, гетероарил, циклоалкил (например, циклопропил, циклобутил, циклопентил или циклогексил) или гетероцикл (например, морфолинил), R1a обозначает OR7a, N(R8)(R9) или -C(O)OR7b, и R2a и R2b, в каждом случае, являются независимо водородом, галогеном, алкилом (например, метилом, этилом, изопропилом или трет-бутилом), алкенилом или галогеналкилом (например, трифторметилом или дифторметилом); или R2b обозначает водород, алкил (например, метил, этил, изопропил или трет-бутил), алкенил, галоген, -C(O)OR7b, галогеналкил (например, трифторметил или дифторметил), арил (например, фенил), гетероарил, циклоалкил (например, циклопропил, циклобутил, циклопентил или циклогексил) или гетероцикл (например, морфолинил), R2a обозначает OR7a, N(R8)(R9) или -C(O)OR7b, и R1a и R1b, в каждом случае, обозначают, каждый независимо, водород, галоген, алкил (например, C1-6 алкил, такой как метил, этил, изопропил или трет-бутил), алкенил, или галогеналкил (например, трифторметил или дифторметил); причем каждый арил, гетероарил, циклоалкил или гетероцикл, обозначаемый R1b и R2b, независимо незамещен или дополнительно замещен, как описано в случае колец, обозначаемых Rb, в разделе «сущность изобретения». Примеры возможных заместителей R1b или R2b как колец включают, но не ограничены ими, C1-6 алкил, галоген и галогеналкил. R4 обозначает водород, алкил, галогеналкил, циклоалкил (например, циклопропил, циклобутил, циклопентил, циклогексил, циклогептил или бицикло[2,2,1]гептил), арил (например, фенил), гетероарил или гетероцикл (например, тетрагидро-2H-пиранил), причем каждое из колец, обозначаемых R4, может быть независимо дополнительно замещено, как описано в разделе «сущность изобретения», и R7a, R7b, R8 и R9 являются такими, как они раскрыты в разделе «сущность изобретения». Например, R7a, в каждом случае, независимо обозначает водород, C1-6 алкил (например, метил, этил, изопропил или трет-бутил), галогеналкил (например, трифторметил или дифторметил), -(CRgRh)r-C(O)OR13, причем Rg, Rh, R13 и r являются такими, как они описаны в разделе «сущность изобретения», или фенил (незамещенный или замещенный, как описано в разделе «сущность изобретения»). R7b, Rg, Rh, R13 и R9, в каждом случае, например, каждый независимо обозначают водород, C1-6 алкил (например, метил, этил, изопропил или трет-бутил) или галогеналкил (например, трифторметил или дифторметил). r, например, означает 1 или 2. R8, в каждом случае, например, независимо обозначает водород, C1-6 алкил (например, метил, этил, изопропил или трет-бутил), галогеналкил (например, трифторметил или дифторметил), -S(O)2-R13a, -S(O)2-N(R13)(R14), -C(O)OR13 или -C(O)N(R13)(R14), причем R13, R13a и R14 являются такими, как они раскрыты в разделе «сущность изобретения».
Еще один аспект изобретения относится к соединениям формулы (I) или к их фармацевтически приемлемым солям, пролекарствам, солям пролекарств или их комбинациям, в которых R3 обозначает -C(O)-R5, R2 обозначает водород, галоген, алкил или галогеналкил, и R5 является таким, как он раскрыт в разделе «сущность изобретения». Например, R5 обозначает арил, такой как фенил, в случае необходимости дополнительно замещенный, как описано в разделе «сущность изобретения». В некоторых вариантах осуществления R2 обозначает водород.
Примеры соединений согласно настоящему изобретению включают, но не ограничены ими, следующие соединения:
6-[(4-аминофенил)этинил]-5-метил[1,2,4]триазоло[1,5-a]пиримидин-7-амин;
6-(циклогексилэтинил)-5-метил[1,2,4]триазоло[1,5-a]пиримидин-7-амин;
5-метил-6-(4-фенилбут-1-инил)[1,2,4]триазоло[1,5-a]пиримидин-7-амин;
1-[(7-амино-5-метил[1,2,4]триазоло[1,5-a]пиримидин-6-ил)этинил]циклопентанол;
1-[(7-амино-5-метил[1,2,4]триазоло[1,5-a]пиримидин-6-ил)этинил]циклогексанол;
4-[(7-амино-5-метил[1,2,4]триазоло[1,5-a]пиримидин-6-ил)этинил]тетрагидро-2H-пиран-4-ол;
4-(7-амино-5-метил[1,2,4]триазоло[1,5-a]пиримидин-6-ил)-2-циклопентилбут-3-ин-2-ол;
4-(7-амино-5-метил[1,2,4]триазоло[1,5-a]пиримидин-6-ил)-2-фенилбут-3-ин-2-ол;
4-(7-амино-5-метил[1,2,4]триазоло[1,5-a]пиримидин-6-ил)-1,1,1-трифтор-2-фенилбут-3-ин-2-ол;
3-(7-амино-5-метил[1,2,4]триазоло[1,5-a]пиримидин-6-ил)-1,1-дифенилпроп-2-ин-1-ол;
3-(7-амино-5-метил[1,2,4]триазоло[1,5-a]пиримидин-6-ил)-1-фенилпроп-2-ин-1-ол;
6-(3-циклогексилпроп-1-инил)-5-метил[1,2,4]триазоло[1,5-a]пиримидин-7-амин;
3-(7-амино-5-метил[1,2,4]триазоло[1,5-a]пиримидин-6-ил)-1-циклопропил-1-фенилпроп-2-ин-1-ол;
6-[(4-метоксифенил)этинил]-5-метил[1,2,4]триазоло[1,5-a]пиримидин-7-амин;
3-(7-амино-5-метил[1,2,4]триазоло[1,5-a]пиримидин-6-ил)-1,1-бис(4-хлорфенил)проп-2-ин-1-ол;
5-метил-6-(3-морфолин-4-ил-3-фенилпроп-1-инил)[1,2,4]триазоло[1,5-a]пиримидин-7-амин;
3-(7-амино-5-метил[1,2,4]триазоло[1,5-a]пиримидин-6-ил)-1-(1-метилциклогексил)-1-фенилпроп-2-ин-1-ол;
3-(7-амино-5-метил[1,2,4]триазоло[1,5-a]пиримидин-6-ил)-1-(3,4'-дихлор-1,1'- бифенил-4-ил)проп-2-ин-1-ол;
1-(7-амино-5-метил[1,2,4]триазоло[1,5-a]пиримидин-6-ил)-3-(1,1'-бифенил-4-ил)-4,4-диметилпент-1-ин-3-ол;
4-(7-амино-5-метил[1,2,4]триазоло[1,5-a]пиримидин-6-ил)-2-гидрокси-2-фенилметилбут-3-иноат;
N-{1-[(7-амино-5-метил[1,2,4]триазоло[1,5-a]пиримидин-6-ил)этинил]циклогексил}-3-хлорбензолсульфонамид;
N-(4-[(7-амино-5-метил[1,2,4]триазоло[1,5-a]пиримидин-6-ил)этинил]фенил}-N'-(3-хлорфенил)мочевина;
(1R,4R)-2-[(7-амино-5-метил[1,2,4]триазоло[1,5-a]пиримидин-6-ил)этинил]-1,7,7-триметилбицикло[2,2,1]гептан-2-ол;
(1Z)-2-[3-(7-амино-5-метил[1,2,4]триазоло[1,5-a]пиримидин-6-ил)проп-2-инил]-4-трет-бутилциклогексанон оксим;
4-(7-амино-5-метил[1,2,4]триазоло[1,5-a]пиримидин-6-ил)-2-(4-изопропил-2-метилциклопентил)бут-3-ин-2-ол;
{[3-(7-амино-5-метил[1,2,4]триазоло[1,5-a]пиримидин-6-ил)-1-фенилпроп-2-инил]окси}метилацетат;
{[3-(7-амино-5-метил[1,2,4]триазоло[1,5-a]пиримидин-6-ил)-1-фенилпроп-2-инил]окси}уксусная ксилота;
{2-[(7-амино-5-метил[1,2,4]триазоло[1,5-a]пиримидин-6-ил)этинил]фенил}метанол;
{3-[3-(7-амино-5-метил[1,2,4]триазоло[1,5-a]пиримидин-6-ил)-1-гидрокси-1-метилпроп-2-инил]-2,2-диметилциклобутил}уксусная кислота;
4-(7-амино-5-метил[1,2,4]триазоло[1,5-a]пиримидин-6-ил)-2-циклобутилбут-3-ин-2-ол;
4-(7-амино-5-метил[1,2,4]триазоло[1,5-a]пиримидин-6-ил)-2-(3-метилциклобутил)бут-3-ин-2-ол;
5-метил-6-(3-фенилпроп-1-инил)[1,2,4]триазоло[1,5-a]пиримидин-7-амин;
6-(3-циклопентилпроп-1-инил)-5-метил[1,2,4]триазоло[1,5-a]пиримидин-7-амин;
6-[(1-аминоциклогексил)этинил]-5-метил[1,2,4]триазоло[1,5-a]пиримидин-7-амин;
3-(7-амино-5-метил[1,2,4]триазоло[1,5-a]пиримидин-6-ил)-1-циклопентилпроп-2-ин-1-ол;
3-(7-амино-5-метил[1,2,4]триазоло[1,5-a]пиримидин-6-ил)-1-(2,4-дихлорфенил)проп-2-ин-1-ол;
4-(7-амино-5-метил[1,2,4]триазоло[1,5-a]пиримидин-6-ил)-1-циклопентил-2-метилбут-3-ин-2-ол;
{4-[(7-амино-5-метил[1,2,4]триазоло[1,5-a]пиримидин-6-ил)этинил]-4-гидроксициклогексил}уксусная кислота;
{4-[(7-амино-5-метил[1,2,4]триазоло[1,5-a]пиримидин-6-ил)этинил]-4- гидроксициклогексил}метилацетат;
(1R,4S)-2-[(7-амино-5-метил[1,2,4]триазоло[1,5-a]пиримидин-6-ил)этинил]бицикло[2,2,1]гептан-2-ол;
(1R,2S,4R)-2-[(7-амино-5-метил[1,2,4]триазоло[1,5-a]пиримидин-6-ил)этинил]-1,7,7-триметилбицикло[2,2,1]гептан-2-ол;
(1R,2R,4S)-2-[(7-амино-5-метил[1,2,4]триазоло[1,5-a]пиримидин-6-ил)этинил]-1,3,3-триметилбицикло[2,2,1]гептан-2-ол;
{4-[(7-амино-5-метил[1,2,4]триазоло[1,5-a]пиримидин-6-ил)этинил]-4-гидроксициклогексил}трет-бутилацетат;
(1S,2S,4R)-2-[(7-амино-5-метил[1,2,4]триазоло[1,5-a]пиримидин-6-ил)этинил]-1,3,3-триметилбицикло[2,2,1]гептан-2-ол;
(1S,2R,4S)-2-[(7-амино-5-метил[1,2,4]триазоло[1,5-a]пиримидин-6-ил)этинил]-1,7,7-триметилбицикло[2,2,1]гептан-2-ол;
1-[3-(7-амино-5-метил[1,2,4]триазоло[1,5-a]пиримидин-6-ил)проп-2-инил]циклопентанол;
1-[(7-амино[1,2,4]триазоло[1,5-a]пиримидин-6-ил)этинил]циклопентанол;
1-[3-(7-амино[1,2,4]триазоло[1,5-a]пиримидин-6-ил)проп-2-инил]циклопентанол;
(1R,2S,4R)-2-[3-(7-амино-5-метил[1,2,4]триазоло[1,5-a]пиримидин-6-ил)проп-2-инил]-1,7,7-триметилбицикло[2,2,1]гептан-2-ол;
1-[3-(7-амино-5-метил[1,2,4]триазоло[1,5-a]пиримидин-6-ил)проп-2-инил]циклогексанметилкарбоксилат;
6-[3-(4-метоксифенокси)бут-1-инил]-5-метил[1,2,4]триазоло[1,5-a]пиримидин-7-амин;
(1R)-3-(7-амино-5-метил[1,2,4]триазоло[1,5-a]пиримидин-6-ил)-1-фенилпроп-2-ин-1-ол;
(1S)-3-(7-амино-5-метил[1,2,4]триазоло[1,5-a]пиримидин-6-ил)-1-фенилпроп-2-ин-1-ол;
4-(7-амино-5-метил[1,2,4]триазоло[1,5-a]пиримидин-6-ил)-1-фенилбут-3-ин-1-ол;
(транс)-2-[3-(7-амино-5-метил[1,2,4]триазоло[1,5-α]пиримидин-6-ил)-1-гидроксипроп-2-инил]циклопропанэтилкарбоксилат;
1-[3-(7-амино-5-метил[1,2,4]триазоло[1,5-α]пиримидин-6-ил)проп-2-инил]циклогексанкарбоновая кислота;
1-[(7-амино-5-этил[1,2,4]триазоло[1,5-α]пиримидин-6-ил)этинил]циклопентанол;
3-(7-амино-5-метил[1,2,4]триазоло[1,5-α]пиримидин-6-ил)-1-фенилпроп-2-ин-1-он;
2-{3-[3-(7-амино-5-метил[1,2,4]триазоло[1,5-α]пиримидин-6-ил)-1-гидрокси-1-метилпроп-2-инил]-2,2-диметилциклобутил}ацетамид;
(1R,2S,4R)-2-[(7-амино-5-этил[1,2,4]триазоло[1,5-α]пиримидин-6-ил)этинил]-1,7,7-триметилбицикло[2,2,1]гептан-2-ол;
1-[(7-амино-5-метил[1,2,4]триазоло[1,5-α]пиримидин-6-ил)этинил]циклогептанол;
{[3-(7-амино-5-метил[1,2,4]триазоло[1,5-α]пиримидин-6-ил)-1-циклопентилпроп-2-инил]окси}уксусная кислота;
({1-[(7-амино-5-метил[1,2,4]триазоло[1,5-α]пиримидин-6-ил)этинил]циклопентил}окси)уксусная кислота;
3-(7-амино-5-метил[1,2,4]триазоло[1,5-α]пиримидин-6-ил)-1-циклогексилпроп-2-ин-1-ол;
4-[3-(7-амино-5-метил[1,2,4]триазоло[1,5-α]пиримидин-6-ил)-1-гидроксипроп-2-инил]циклогексанметилкарбоксилат;
4-[3-(7-амино-5-метил[1,2,4]триазоло[1,5-α]пиримидин-6-ил)-1-гидроксипроп-2-инил]циклогексанкарбоновая кислота;
{3-[3-(7-амино-5-метил[1,2,4]триазоло[1,5-α]пиримидин-6-ил)-1-метиленпроп-2-инил]-2,2-диметилциклобутил}уксусная кислота;
1-[3-(7-амино-5-метил[1,2,4]триазоло[1,5-α]пиримидин-6-ил)проп-2-инил]циклопентанметилкарбоксилат;
1-[3-(7-амино-5-метил[1,2,4]триазоло[1,5-α]пиримидин-6-ил)проп-2-инил]циклогексан-2-(триметилсилил)этилкарбоксилат;
6-[(4-бромфенил)этинил]-5-метил[1,2,4]триазоло[1,5-α]пиримидин-7-амин;
6-[(4-хлорфенил)этинил]-5-метил[1,2,4]триазоло[1,5-α]пиримидин-7-амин;
2-{4-[(7-амино-5-метил[1,2,4]триазоло[1,5-α]пиримидин-6-ил)этинил]фенил}-2-метилметилпропаноат;
1-[4-(7-амино-5-метил[1,2,4]триазоло[1,5-α]пиримидин-6-ил)бут-3-инил]-2-оксоциклопентанэтилкарбоксилат;
и их фармацевтически приемлемых солей, пролекарств или солей пролекарств.
Соединения, раскрытые здесь, могут содержать асимметрически замещенные атомы углерода или серы, и соответственно могут существовать в виде, и быть выделены в виде, отдельных стереоизомеров (например, отдельного энантиомера или отдельного диастереомера), смеси стереоизомеров (например, любой смеси энантиомеров или диастереомеров) или их рацемических смесей. Индивидуальные оптически активные формы соединений могут быть получены, например, синтезом из оптически активных исходных материалов, хиральным синтезом, ферментативным разделением, биотрансформацией или хроматографическим разделением. Следует понимать, что настоящее изобретение охватывает любую рацемическую, оптически активную, стереоизомерную форму или смеси этих форм в различных пропорциях, которые обладают свойствами, пригодными для ингибирования активности DGAT-1. Если стереохимия хиральных центров в иллюстрируемых здесь химических структурах не определена, химическая структура охватывает соединения, содержащие любой стереоизомер каждого хирального центра в соединении, и их смеси.
Соединения по изобретению могут существовать в виде геометрических изомеров. В изобретении рассматриваются различные геометрические изомеры и их смеси, являющиеся результатом размещения заместителей вокруг углерод-углеродной двойной связи, циклоалкильной группы или гетероциклоалкильной группы. Заместители вокруг углерод-углеродной двойной связи определяют как имеющие конфигурацию Z или E, и заместители вокруг циклоалкила или гетероциклоалкила определяют как имеющие конфигурацию транс или цис.
В рамках настоящего изобретения следует понимать, что соединения, раскрытые здесь, могут демонстрировать явление таутомерии и что рисунки формул в рамках этого описания могут представлять только одну из возможных таутомерных форм. Следует понимать, что изобретение охватывает любую таутомерную форму и не должно быть ограничено никакой таутомерной формой, используемой в называниях рисунков формул или соединений.
Способы синтеза
Это изобретение охватывает соединения по изобретению, полученные в результате синтетических процессов или метаболических процессов. Получение соединений по изобретению метаболическими процессами включает процессы, которые имеют место в организме человека или животных (in vivo) или процессы, происходящие in vitro.
Синтез соединений формулы (I), в которой группы R1 и R2 имеют значения, как сформулировано в разделе «сущность изобретения», если не указано иное, иллюстрируется Схемами 1-8.
В описаниях схем и примерах, некоторые аббревиаторы имеют следующие значения: ДМСО для диметилсульфоксида, RP-ВЭЖХ для препаративной высокоэффективной жидкостной хроматографии с обратной фазой, Вос обозначает трет-бутоксикарбонил и OTs обозначает п-толилсульфонат.
Соединения по изобретению называли с использованием ACD/ChemSketch версии 5,06 (разработанной Advanced Chemistry Development, Inc, Торонто, Онтарио, Канада) или им присваивали названия, исходя из номенклатуры ACD.
Соединения общей формулы (I) могут быть получены с использованием общих процедур, как показано на Схеме 1.
Схема 1
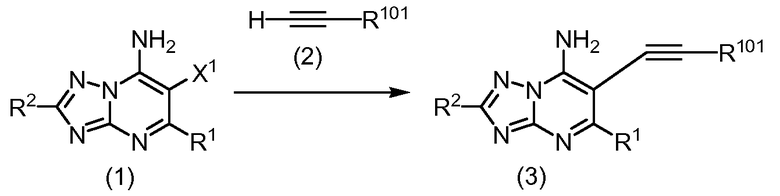
Ароматические галогениды формулы (1), в которой X1 обозначает галоген, могут быть присоединены к алкинам формулы (2), в котрой R101 обозначает R3 или триалкилсилил, такой как триметилсилил, с использованием условий реакции сочетания Sonogashira. Например, реакцию обычно проводят в присутствии основания, катализатора на основе палладия и солей меди (I). Примером солей меди (I), которые могут использоваться для осуществления реакции сочетания, является йодид меди (I). Примеры катализаторов на основе палладия включают, но не ограничены ими, бис(трифенилфосфин)палладий (II) дихлорид и тетракис(трифенилфосфин)палладий (0). Примеры оснований включают органическое основание, такое как триалкиламин (например, диизопропилэтиламин или триэтиламин), или неорганические основания, такие как натриевая или калиевая соль C1-6 алкоголята (например, метилат натрия), фторид цезия, карбонат натрия, калия или цезия и т.п. Реакцию обычно проводят при температуре в пределах от приблизительно температуры окружающей среды до приблизительно 150°C, предпочтительно приблизительно в 50°C до приблизительно 150°C, и более предпочтительно от приблизительно 90°C до приблизительно 120°C, в растворителе, таком как ацетонитрил, ароматический углеводород, такой как толуол, ксилол или бензол, вода, N,N-диметилформамид, диметилсульфоксид, диоксан или их смеси.
Соединения формулы (3), в которой R101 обозначает триалкилсилил, могут быть превращены в соединения формулы (3), в которой R101 обозначает водород, например, обработкой основанием, такой как карбонат калия, в растворителе, таком как смесь тетрагидрофурана и метанола.
Соединения формулы (3), в которой R101 обозначает водород, могут быть подвергнуты реакции сочетания с галогенидами формулы R3-X2, в которой X2 обозначает галогенид, и R3 обозначает арил или гетероарил, с использованием условий реакции сочетания Sonogashira, как описано выше.
Промежуточные соединения формулы (2) могут быть приобретены или получены с использованием условий реакции, аналогичных известным из литературы. Например, алкины формулы (6), (6a) или (8), в которых R102 и R103, каждый независимо, обозначают арил, алкил, галогеналкил, водород, арил, гетероарил, циклоалкил, гетероцикл, арилалкил, гетероарилалкил, циклоалкилалкил, или гетероциклоалкил, или R102 и R103, вместе с углеродом, к которому они присоединены, образуют циклоалкил или гетероцикл, могут быть получены с использованием общих процедур, как проиллюстрировано на Схеме 2.
Схема 2
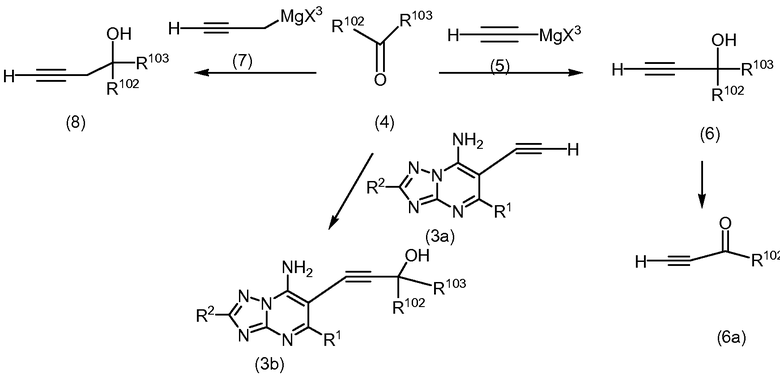
Реактивы Гриньяра формулы (5) или (7), в которой X3 обозначает галоген, могут быть обработаны кетонами или альдегидами формулы (4) в растворителе, таком как, но не ограничиваясь ими, тетрагидрофуран и простой диэтиловый эфир, с получением спиртов формулы (6). Реактивы Гриньяра формулы (7) могут быть получены, например, реакцией галогеналлиленов формулы (H)CCCH2X3 с магнием в присутствии галогенидов ртути (II), в растворителе, таком как простой диэтиловый эфир. Соединения формулы (6a), в которой R102 обозначает водород, арил, алкил, галогеналкил, арил, гетероарил, циклоалкил, гетероцикл, арилалкил, гетероарилалкил, циклоалкилалкил или гетероциклоалкил, могут быть получены окислением (6), в котором R103 обозначает водород, окислителем, таким как, но не ограничиваясь им, реактивом Десса Мартина.
В присутствии основание, такого как н-бутиллитий, соединения формулы (3a) могут быть депротонированы, и полученный анион, будучи обработан кетонами или альдегидами формулы (4) в растворителе, таком как, но не ограничиваясь ими, тетрагидрофуран и простой диэтиловый эфир, дает соединения формулы (3b), в которой R102 и R103 являются такими, как они определены на Схеме 1.
Схема 3
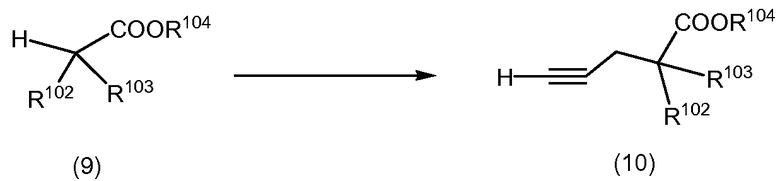
Алкины формулы (10), в которой R102 и R103 являются такими, как они определены выше, могут быть получены из соединений формулы (9), в которой R104 обозначает кислотно-защитную группу, такую как, но не ограничиваясь ими, C1-6 алкил, триалкилсилилалкил, бензил (замещенный или незамещенный) и т.д. Такие кислотно-защитные группы могут быть получены из соответствующих кислот с использованием процедур, аналогичных известным из уровня техники. Например, 2-(триметилсилил)этил может быть включен в соответствующую кислоту, вводя кислоту в реакцию с 2-(триметилсилил)этанолом в присутствии реагента сочетания, такого как 1-этил-3-[3-(диметиламино)пропил]-карбодиимид гидрохлорид. В присутствии сильного основания, такого как гидрид натрия или диизопропиламид лития, в растворителе, таком как, но не ограничиваясь ими, тетрагидрофуран или N,N-диметилформамид, при температуре от приблизительно -78°C до приблизительно температуры окружающей среды, защищенные кислоты могут быть депротонированы, и полученные анионы могут быть обработаны in situ галогеналлиленами формулы (H)CCCH2X3, где X3 обозначает галоген, при температуре, приблизительно равной температуре окружающей среды, с получением соединений формулы (10).
Схема 4
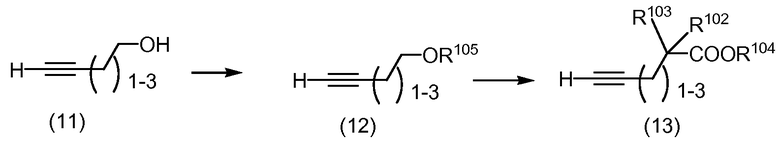
Защищенные кислоты формулы (13) могут быть получены из соответствующих спиртов формулы (11) (a) обработкой галогенидом, таким как трифторметансульфонилгалогенид, бензолсульфонилгалогенид или толуолсульфонилгалогенид, в присутствии органического основания, такого как пиридин, или неорганического основания, такого как карбонат натрия, с получением соединений формулы (12), в которой R105 обозначает трифторметансульфонил, бензолсульфонил или толуолсульфонил; и (b) введением соединения формулы (12) в реакцию с анионами, образованными in situ из (9), как описано на Схеме 3.
Схема 5
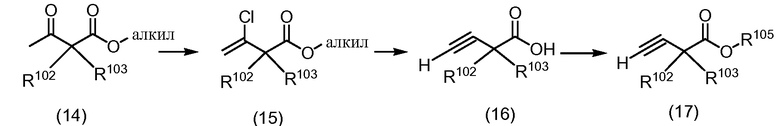
Защищенные кислоты формулы (17) могут быть получены из сложных β-кетоэфиров формулы (14), как показано на Схеме 5.
Обработка (14) пентахлоридом фосфора дает хлориды формулы (15). Гидролиз сложного эфира до соответствующей кислоты с последующей обработкой с использованием NaNH2 в диметилсульфоксиде дает кислоты формулы (16), которые могут быть защищены с получением (17) с использованием методологий, аналогичных известным из уровня техники.
Схема 6
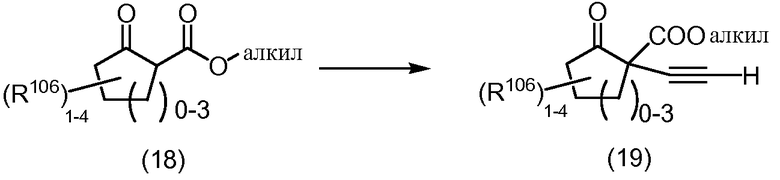
Алкины формулы (19), в которой R106 обозначает алкил, галогеналкил или галоген, могут быть получены из соответствующих соединений формулы (18) с использованием процедур, аналогичных описанным в J. Chem. Soc, Chem. Commun., 1990, 2, p. 118-119, и Tetrahedron Lett., 1986, 27, p.5024-5028.
Схема 7
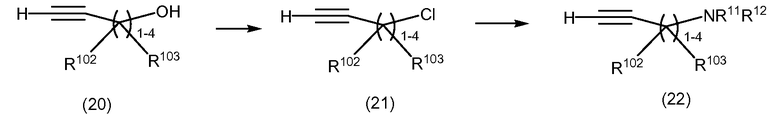
Алкины формулы (22) могут быть получены из соответствующих спиртов формулы (20), как проиллюстрировано на Схеме 5.
Преобразование спиртов формулы (20) в хлориды формулы (21) может быть осуществлено с использованием процедур, аналогичных описанным в JACS, 1957, 79, p.2142-2144. Смещение хлоридов с NaNH2 или аминами формулы HNR11R12, в которой R11 и R12 одновременно не обозначает водород, дает амины формулы (22).
Схема 8
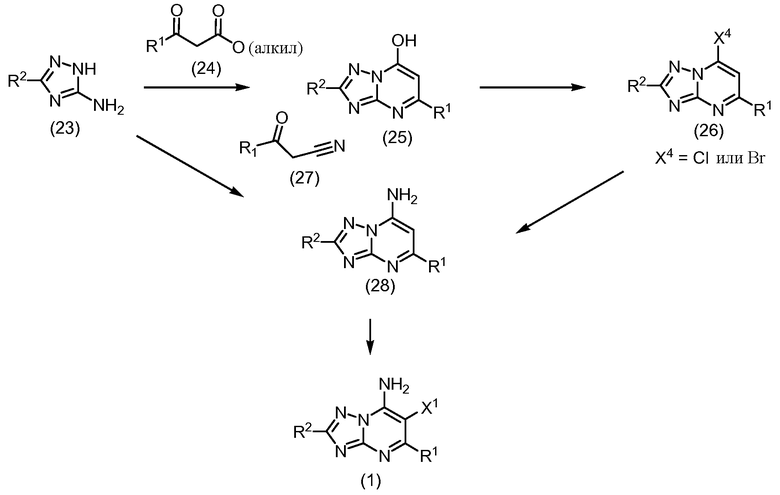
Конденсация соответствующих сложных β-кетоэфиров формулы (24) с аминотриазолами формулы (23) при температуре в пределах от приблизительно температуры окружающей среды до приблизительно температуры кипения используемого растворителя, дает производные гидроксипиримидина формулы (25). Примеры инертного растворителя, используемого в этой реакции, включают уксусную кислоту, низший спиртовой растворитель, такой как этанол, метанол, изопропиловый спирт и т.п.; ароматический углеводородный растворитель, такой как толуол, бензол, хлорбензол, ксилол и т.д.; и эфирный растворитель, такой как тетрагидрофуран, 1,4-диоксан и т.д.
Производные галогенпиримидина формулы (26) могут быть получены реакцией (25) с соответствующим галогенирующим реагентом, предпочтительно бромирующим (например, оксибромидом фосфора) или хлорирующим средством (например, оксихлоридом фосфора), в чистом виде или в присутствии растворителя, и в присутствии подходящего поглотителя кислоты. Примерами поглотителя кислоты являются органические основания, такие как триэтиламин, диизопропилэтиламин, диметиламинопиридин, пиридин и т.д.; и неорганические основания, такие как гидроксид натрия, бикарбонат натрия или калия и т.д. Реакцию предпочтительно проводят при температуре от приблизительно 25°C до приблизительно 150°C, предпочтительно от приблизительно 80°C до приблизительно 120°C. Примеры растворителя включают, но не ограничены ими, ароматические углеводородные растворители, такие как бензол, ксилол, хлорбензол, толуол и т.д.
Превращение соединений формулы (26) в соединения формулы (28) может быть осуществлено реакцией первых с раствором аммиака в растворителе, таком как, но не ограничиваясь им, метанол. Реакцию обычно проводят при от приблизительно 60°C до приблизительно 100°C.
Альтернативно, аминотриазолы формулы (23) могут быть обработаны нитрилами формулы (27) при температуре в пределах от температуры окружающей среды до температуры кипения используемого растворителя, с получением соединений формулы (28). Примеры инертного растворителя, используемого в этой реакции, включают уксусную кислоту, низший спиртовой растворитель, такой как этанол, метанол, изопропиловый спирт и т.п.; ароматический углеводородный растворитель, такой как толуол, бензол, хлорбензол, ксилол и т.д.; и эфирный растворитель, такой как тетрагидрофуран, 1,4-диоксан и т.д.
Йодирование соединений формулы (28) дает соединения формулы (1), в которой X1 обозначает йод, и может быть осуществлено путем введения (28) в реакцию с йодирующим реагентом. Примерами йодирующего реагента являются, например, IC1 (коммерчески доступный или полученный in situ реакцией йодида натрия и гидрата хлораминов-T в присутствии уксусной кислоты), N-йодсукцинимид, йод, бензилтриметиламмоний дихлорйодид и т.п.
Аминотриазолы формулы (23) либо являются коммерчески доступными, либо могут быть получены реакциями в условиях, аналогичных известным из уровня техники. Например, (23) может быть получен реакцией карбоновых кислот формулы R2COOH, или их эфиров, или хлорангидридов этих кислот, с аминогуанидингидрохлоридом или аминогуанидинбикарбонатом.
Следует понимать, что схемы синтеза и частные примеры, иллюстрируемые в разделе примеров синтеза, являются иллюстративными и не могут считаться ограничивающими объем изобретения, как оно определено в приложенной формуле изобретения. Все альтернативы, модификации и эквиваленты способов синтеза и частных примеров входят в рамки формулы изобретения.
Оптимальные условия реакции и времена реакции для каждой индивидуальной стадии могут варьировать в зависимости от конкретных используемых реагентов и заместителей, присутствующих в используемых реагентах. Если не указано иное, растворители, температуры и другие условия реакции могут быть легко выбраны специалистом. Конкретные процедуры описаны в разделе Примеров синтеза. Реакции могут быть обработаны обычным образом, например, удалением растворителя от остатка, и далее очищены согласно методам, известным из уровня техники, таким как, но не ограничиваясь ими, кристаллизация, дистилляция, экстракция, порошкование и хроматография. Если не указано иное, исходные материалы и реактивы либо являются коммерчески доступными, либо могут быть получены специалистом из коммерчески доступных материалов с использованием способов, описанных в химической литературе.
Обычные эксперименты, включая соответствующую манипуляцию условиями реакции, реактивами и последовательностями пути синтеза, защита любой химической функциональной группы, которая не может быть совместима с условиями реакции, и удаление защитной группы в подходящий момент в последовательности реакций способа, находятся в рамках изобретения. Подходящие защитные группы и способы защиты и снятия защиты различных заместителей с использованием таких подходящих защитных групп известны специалисту; примеры могут быть найдены в T. Greene and P. Wuts, Protecting Groups in Chemical Synthesis (3rd ed.), John Wiley & Sons, NY (1999), который полностью включен в настоящее описание путем ссылки. Синтез соединений по изобретению может быть осуществлен способами, аналогичными описанным в схемах синтеза, описанных выше, и в частных примерах.
Исходные материалы, если они не являются коммерчески доступными, могут быть получены в соответствии с процедурами, выбранными из стандартных методик органической химии, методик, аналогичных методикам синтеза известных структурно подобных соединений, или методик, аналогичных вышеописанным схемам или процедурам, описанным в разделе примеров синтеза.
Если требуется оптически активная форма соединения по изобретению, она может быть получена осуществлением одной из процедур, описанных здесь, с использованием оптически активного исходного материала (полученного, например, асимметрической индукцией подходящей стадии реакции), или разделением смеси стереоизомеров соединения по изобретению или промежуточных соединений с использованием стандартной процедуры (такой как хроматографическое разделение, перекристаллизация или ферментативное разделение).
Точно так же, если требуется чистый геометрический изомер соединения по изобретению, он может быть получен осуществлением одной из вышеуказанных процедур с использованием чистого геометрического изомера в качестве исходного материала или разделением смеси геометрических изомеров соединения по изобретению или промежуточных соединений с использованием стандартной процедуры, такой как хроматографическое разделение.
Биологические данные
Ингибирование DGAT-I
Идентификацию соединений по изобретению как ингибиторов DGAT-I легко осуществляли, используя тест высокопроизводительного скрининга FlashPlate. В этом тесте рекомбинантный человеческий DGAT-1, содержащий метку в виде N-концевого His6-эпитопа, получали в бакуловирусной системе экспрессии. Клетки насекомого (например, Sf9 или High Five) инфицировали в течение 24-72 часов и собирали центрифугированием. Осадки клеток повторно суспендировали в буфере для гомогенизации [250 мМ сахарозы, 10 мМ Tris-HCl (pH 7,4), 1 мМ EDTA] и лизировали с использованием прибора для гомогенизации, такого как Microfluidizer (единственный пассаж, 4°C). Клеточный детрит удаляли центрифугированием при 10000×g в течение 30 минут, и микросомальные мембраны собирали ультрацентрифугированием при 100000×g в течение 30 мин.
Активность DGAT-1 определяли следующим образом: тестовый буфер [20 мМ HEPES (pH 7,5), 2 мМ MgCl2, 0,04% BSA], содержащий 50 мкМ ферментного субстрата (дидеканоил глицерин) и 7,5 мкМ меченных радиоактивным изотопом субстратов ацил-CoA[1-14C]деканоил-CoA), добавляли в каждую лунку фосфолипидного FlashPlate (PerkinElmer Life Sciences). Небольшую аликвоту мембраны (1 мкг/лунка) добавляли, чтобы начать реакцию, которой давали проходить в течение 60 мин. Реакцию завершали после добавления равного объема (100 мкл) изопропанола. Планшеты герметизировали, инкубировали в течение ночи и подсчитывали следующим утром на TopCount Scintillation Plate Reader (PerkinElmer Life Science). DGAT-1 катализирует перенос меченной изотопом деканоильной группы на sn-3 положение дидеканоилглицерина. Полученный меченный радиоактивным изотопом тридеканоилглицерин (трикаприн) связывается преимущественным образом с гидрофобным покрытием на фосфолипидном FlashPlate. Сближение меченного радиоактивным изотопом продукта с твердым сцинтиллятором, включенным в основание FlashPlate, индуцировал высвобождение фтора из сцинтиллятора, которое измеряли в TopCount Plate Reader. Различные концентрации (например, 0,0001 мкМ, 0,001 мкМ, 0,01 мкМ, 0,1 мкМ, 1,0 мкМ, 10,0 мкМ) репрезентативных соединений по изобретению добавляли в индивидуальную лунку до добавления мембран. Потенциал ингибирования DGAT-1 для соединений согласно настоящему изобретению определяли, вычисляя значения IC50, определенные как концентрация ингибитора на основании сигмовидной кривой доза-ответ, на которой ферментативная активность ингибировалась на 50%. Соединения согласно настоящему изобретению были эффективны в ингибировании активности DGAT-1 и таким образом могут быть использованы в качестве терапевтических средств для лечения состояний и заболеваний, которые связаны с активностью DGAT-1.
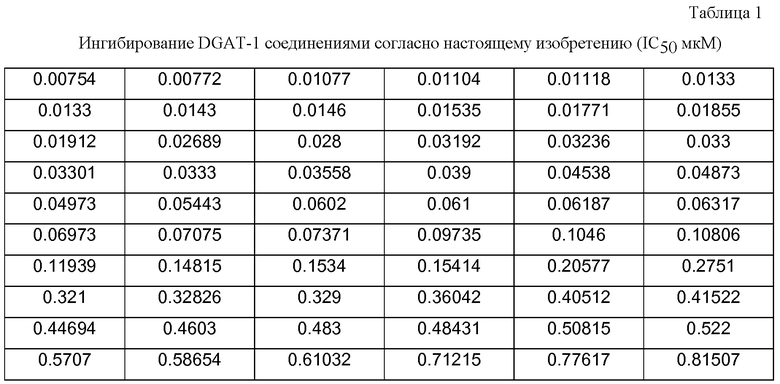
Оценка эффективности соединения в отношении уменьшения отклонения хиломикронов у мышей DIO или CD1
Цель этого протокола состояла в том, чтобы определить эффект однократного введения соединения на отклонение хиломикронов, индуцированное болюсом кукурузного масла, либо у мышей, не страдающих ожирением (мыши CD1, Jackson Laboratories), либо у мышей, заработавших ожирение спонтанным потреблением ad libitum рациона с высоким содержанием жира (Buhman, K.K. et al, J Biol Chem. 2002, 277, 25474-25479). Индуцированное диетой ожирение (DIO) у грызунов воспроизводит ключевые аспекты человеческого ожирения и метаболического синдрома. У мышей DIO, используемых в этом исследовании, были показаны гиперинсулинемия и резистентность к инсулину, гиперлептинемия и резистентность к лептину, и было отмечено висцеральное ожирение (в отношении мышей DIO, см. Collins et al., Physiol. Behav. 81:243-248, 2004).
Репрезентативные соединения по изобретению вводили обычноым образом в количествах 0,03 мг/кг, 0,3 мг/кг, 3 мг/кг или 10 мг/кг per os в форме состава в 1%-ом Tween 80 в воде за один час до введения болюса кукурузного масла. Спустя один час после введения болюса образцы плазмы отбирали и анализировали на триглицериды. Считалось, что соединения активны, если фармакотерапия привела к > 30%-ому снижению плазменных триглицеридов у обработанных лекарственным средством животных (при измерении спустя один час после введения болюса кукурузного масла) относительно контрольных животных, получавших только носитель. В этой модели репрезентативные соединения привели к значительным снижениям плазменных триглицеридов относительно контрольных животных, получавших только носитель.
Соединения согласно настоящему изобретению и фармацевтически приемлемые соли могут быть использованы в качестве терапевтических средств. Соответственно, вариант осуществления этого изобретения включает способ лечения различных состояний у пациента (включая млекопитающих), который включает введение указанному пациенту количества соединения формулы (I), или его фармацевтически приемлемой соли, пролекарства или соли пролекарства, которое является эффективным в лечении целевого состояния, или содержащей его фармацевтической композиции.
Другой аспект настоящего изобретения относится к способу лечения, задержки или профилактики различных состояний у пациента (такого как млекопитающее, предпочтительно человек), которые опосредуются DGAT-1, включающему введение указанному пациенту соединения формулы (I), или его фармацевтически приемлемой соли, пролекарства, соли пролекарства, или содержащей его фармацевтической композиции.
Другой аспект настоящего изобретения относится к способам профилактики, задержки или лечения ожирения и индукции снижения массы тела у человека, который включает введение указанному человеку соединения по изобретению, или его фармацевтически приемлемой соли, пролекарства, соли пролекарства, или содержащей его фармацевтической композиции. Еще один аспект изобретения относится к способу предотвращения увеличения массы тела у человека путем введения по меньшей мере одного соединения по изобретению, или его фармацевтически приемлемой соли, пролекарства, соли пролекарства или их комбинации, в количестве, которое является достаточным для предотвращения увеличения массы тела.
Настоящее изобретение также относится к применению соединений по изобретению для лечения связанных с ожирением заболеваний, включая связанную дислипидемию и другие связанные с ожирением избытком массы тела осложнения, такие как, например, желчные конкременты холестерина, заболевание желчного пузыря, подагру, рак (например, толстой кишки, прямой кишки, предстательной железы, молочной железы, яичника, эндометрия, шейки матки, желчного пузыря и желчного протока), менструальные аномалии, бесплодие, поликистоз яичников, остеоартрит и апноэ во сне, а также для множества других фармацевтических применений, связанных с этим же, таких как регулирование аппетита и рациона питания, дислипидемия, гипертриглицеридемия, метаболический синдром или Синдром X, диабет типа 2 (инсулиннезависимый диабет), атеросклеротические заболевания, такие как сердечная недостаточность, гиперлипидемия, гиперхолистеринемия, низкие уровни ЛПВП, артериальная гипертензия, сердечно-сосудистое заболевание (включая атеросклероз, ишемическую болезнь сердца, заболевание коронарных артерий и артериальную гипертензию), цереброваскулярные нарушения, такие как инсульт, и заболевания периферических сосудов. Соединения по изобретению могут также быть использованы для лечения физиологических нарушений, связанных с, например, регулированием чувствительности к инсулину, воспалительным ответом, стеатозом печени, повышенными уровнями триацилглицеридов в печени, неалкогольным ожирением печени, неалкогольным стеатогепатитом, уровнями триацилглицеридов плазмы, ЛПВП, ЛПНП и холестерина и т.п. Метаболический синдром характеризуется группой метаболических факторов риска у одного человека. Такие факторы включают, но не ограничены ими, абдоминальное ожирение, атерогенную дислипидемию (нарушения жира крови, такие как высокие триглицериды, низкий холестерин ЛПВП и высокий холестерин ЛПНП), повышенное кровяное давление, резистентность к инсулину (или отсутствие переносимости глюкозы), предтромбозное состояние (например, высокий фибриноген или ингибитор-1 активатора плазмогена в крови) и провоспалительное состояние (например, повышенный С-реактивный белок в крови). В одном варианте осуществления настоящее изобретение относится к способам лечения перечисленных выше нарушений, включающим стадию введения пациенту одного или более соединений по изобретению, или их фармацевтически приемлемой соли, или содержащей их фармацевтической композиции. Соединения по изобретению, или их фармацевтических приемлемые соли, или содержащие их фармацевтические композиции также могут быть использованы в снижении плазменного уровня триглицеридов. Таким образом, в одном варианте осуществления, настоящее изобретение относится к способу снижения плазменных триглицеридов у пациента (включая млекопитающее), включающему стадию введения пациенту одного или более соединений по изобретению, или их фармацевтически приемлемой соли, или содержащей их фармацевтической композиции.
Термин "лечение" включает любой процесс, действие, применение, терапию или подобное, при котором пациенту, включая человека, оказывают медицинскую помощь с целью улучшения, прямого или косвенного, состояния пациента или замедления развития состояния или нарушения у пациента.
Соединения по изобретению, или их фармацевтически приемлемые соли, пролекарства, соли пролекарств, или их комбинации, могут вводиться индивидуально или в комбинации (то есть использованы совместно) с одним или более дополнительными фармацевтическими средствами. Комбинированная терапия включает введение единственного фармацевтического состава, содержащего одно или более соединений по изобретению, или их фармацевтически приемлемых солей, пролекарств, солей пролекарств, и одно или более дополнительных фармацевтических средств, а также введение соединений по изобретению, или их фармацевтически приемлемых солей, пролекарств, солей пролекарств и каждого дополнительного фармацевтического средства, в его собственном отдельном фармацевтическом составе. Например, соединение формулы (I), или его фармацевтически приемлемые соли, пролекарства, соли пролекарств, и одно или более дополнительных фармацевтических средств, могут вводиться пациенту вместе, в единственной пероральной композиции, имеющей фиксированное отношение каждого активного ингредиента, такой как таблетка или капсула; или каждое средство может вводиться в отдельных пероральных лекарственных составах.
Если используются отдельные лекарственные составы, соединения по изобретению (или их фармацевтические соли, пролекарства или соли пролекарств) и одно или более дополнительных фармацевтических средств могут вводиться в по существу одно и то же время (например, одновременно) или в разное время (например, последовательно).
Например, соединения по изобретению (или их фармацевтические соли, пролекарства или соли пролекарств) могут использоваться в комбинации с одним из более следующих фармацевтических средств, включая, но не ограничиваясь ими, средства против ожирения, включая агонист β-3, такой как CL 316,243; антагонисты и/или обратные агонисты СВ-1 (например, римонабант); ингибиторы нейропептида Y5; подавители аппетита, такие как, например, сибутрамин (Meridia); Антагонисты MCHr1 и ингибиторы липазы, такие как, например, орлистат (Xenical), и лекарственное соединение, которое модулирует пищеварение и/или метаболизм, такое как лекарственные средства, которые модулируют термогенез, расщепление жира, перистальтику кишечника, абсорбцию жира и насыщение.
Кроме того, соединения по изобретению (или их фармацевтические соли, пролекарства или соли пролекарств) могут вводиться в комбинации с один или более следующих фармацевтических средств, включая лиганды PPAR (агонисты, антагонисты), средства, усиливающие секрецию инсулина (например, сульфонилмочевина и не являющиеся сульфонилмочевиной средства, усиливающие секрецию), ингибиторы α-глюкозидазы, сенсибилизаторы инсулина, соединения, снижающие продукцию глюкозы в печени, и производные инсулина и инсулин. Такие средства могут вводиться до, одновременно с или после введения соединений по изобретению. Инсулин и производные инсулина включают и долго- и коротко-действующие формы и составы инсулина. Лиганды PPAR могут включать агонисты и/или антагонисты любого из рецепторов PPAR или их комбинации. Например, лиганды PPAR могут включать лиганды PPAR-α, PPAR-γ, PPAR-δ или любую комбинацию двух или трех рецепторов PPAR. Лиганды PPAR включают, например, розиглитазон, троглитазон и пиоглитазон. Сульфонилмочевина-содержащие средства включают, например, глибурид, глимепирид, хлорпропамид, толбутамид и глипизид, ингибиторы α-глюкозидазы включают акарбоз, миглитол и воглибоз. Сенсибилизаторы инсулина включают агонисты PPAR-γ, такие как глитазоны (например, троглитазон, пиоглитазон, энглитазон, МСС-555, розиглитазон и т.п.) и другие тиазолидиндионовые и нетиазолидиндионовые соединения; бигуаниды, такие как метформин и фенформин; ингибиторы протеинтирозинфосфатазы-1B (РР-1В); ингибиторы дипептидилпептидазы IV (DPP-IV) (например, ситаглиптин), и ингибиторы 11бета-HSD. Соединения, снижающие продукцию глюкозы в печени, включают антагонисты глюкагона и метформин, такой как Glucophage и Glucophage XR. Средства, усиливающие секрецию инсулина, включают сульфонилмочевину и не являющиеся сульфонилмочевиной лекарственные средства: GLP-1, GIP, PACAP, секретин и его производные; натеглинид, меглитинид, репаглинид, глибенкламид, глимепирид, хлорпропамид, глипизид. GLP-1 включает производные GLP-1 с более длинными периодами полужизни, чем у нативного GLP-1, такие как, например, дериватизованный с жирной кислотой GLP-1 и эксендин.
Соединения по изобретению (или их фармацевтические соли, пролекарства или соли пролекарств) могут также использоваться в способах по изобретению в комбинации с одним или более фармацевтическими средствами, включая, но не ограничиваясь ими, ингибиторы HMG-CoA редуктазы, никотиновую кислоту (например, Niaspan), соединения, снижающие уровень жирных кислот (например, аципимокс); липид-понижающие лекарственные средства (например, сложные эфиры станола, стерингликозиды, такие как тиквезид, и азетидиноны, такие как эзетимиб), ингибиторы ACAT (такие как авасимиб), комплексообразователи желчных кислот, ингибиторы обратного захвата желчной кислоты, ингибиторы транспорта микросомальных триацилглицеридов и производные фибриновой кислоты. Ингибиторы HMG-CoA редуктазы включают, например, статин, такой как ловастатин, симвастатин, правастатин, флувастатин, аторвастатин, ривастатин, итавастатин, церивастатин и ZD-4522. Производные фибриновой кислоты включают, например, клофибрат, фенофибрат, безафибрат, ципрофибрат, беклофибрат, этофибрат и гемфиброзил. Комплексообразователи включают, например, холестирамин, колестипол и диалкиламиноалкиловые производные поперечно-сшитого декстрана.
Соединения по изобретению (или их фармацевтические соли, пролекарства или соли пролекарств) могут также использоваться в комбинации с анти-гипертензивными лекарственными средствами, такими как, например, β-блокаторы и ингибиторы АСЕ. Примеры дополнительных гипотензивных средств для использования в комбинации с соединениями согласно настоящему изобретению включают блокаторы кальциевых каналов (L-типа и T-типа; например, дилтиазем, верапамил, нифедипин, амлодипин и мибефрадил), мочегонные средства (например, хлортиазид, гидрохлортиазид, флуметиазид, гидрофлуметиазид, бендрофлуметиазид, метилхлортиазид, трихлорметиазид, политиазид, бензтиазид, этакриновую кислоту трикринафен, хлорталидон, фуросемид, мусолимин, буметанид, триамтренен, амилорид, спиронолактон), ингибиторы ренина, ингибиторы АСЕ (например, каптоприл, зофеноприл, фосиноприл, эналаприл, цераноприл, цилазоприл, делаприл, пентоприл, хинаприл, рамиприл, лизиноприл), антагонисты рецептора АТ-1 (например, лосартан, ирбесартан, валсартан), антагонисты рецептора ЕТ (например, ситакссентан, атрсентан, ингибиторы нейтральной эндопептидазы (NEP), ингибиторы вазопепсидазы (двойные ингибиторы NEP-ACE) (например, омапатрилат и гемопатрилат) и нитраты.
Соединения по изобретению можно также использовать совместно с миметиками инкретина, такими как, но не ограничиваясь им, эксенатид.
Соединения по изобретению (или их фармацевтические соли, пролекарства или соли пролекарств) могут использоваться для достижения желаемого фармакологического эффекта введением пациенту в соответствующим образом составленной фармацевтической композиции. Пациент, например, может быть млекопитающим, включая человека, которому требуется лечение специфического состояния или заболевания. Поэтому настоящее изобретение включает фармацевтические композиции, которые состоят из терапевтически эффективного количества соединения (или его фармацевтических солей, пролекарств или солей пролекарств), идентифицированного способами, описанными здесь, в комбинации с фармацевтически приемлемым носителем. Соединения, идентифицированные способами, описанными здесь, могут вводиться с фармацевтически приемлемым носителем с использованием любых обычных эффективных стандартных лекарственных форм, например, препаратов немедленного и отсроченного высвобождения, перорально, парентерально, топически и т.п.
Фармацевтические композиции могут быть составлены для перорального введения в твердой или жидкой форме, для парентеральной инъекции или для ректального введения.
Термин "фармацевтически приемлемый носитель" в рамках изобретения означает нетоксичный твердый, полутвердый или жидкий наполнитель, разбавитель, инкапсулирующий материал или вспомогательный состав любого типа. Примеры терапевтически подходящих эксципиентов включают сахара; целлюлозу и ее производные; масла; гликоли; растворы; буферизующие, красящие, высвобождающие, покрывающие, подслащивающие, вкусовые и ароматизирующие средства; и т.п. Эти терапевтические композиции можно вводить парентерально, интрацистернально, перорально, ректально, внутривенно или внутрибрюшинно.
Жидкие лекарственные формы для перорального введения соединений по изобретению включают составы в форме эмульсий, микроэмульсий, растворов, суспензий, сиропов и эликсиров. В дополнение к соединениям, жидкие лекарственные формы могут содержать разбавители и/или растворители или эмульгаторы. Помимо инертных разбавителей, пероральные композиции могут включать смачивающие, эмульгирующие, подслащивающие, вкусовые и ароматизирующие средства.
Препараты для инъекций соединений по изобретению включают стерильные инъецируемые, водные и масляные растворы, суспензии или эмульсии, любой из которых может быть в случае необходимости составлен с пригодными для парентерального введения разбавителями, диспергирующими, смачивающими или суспендирующими агентами. Эти препараты для инъекций могут стерилизоваться фильтрацией через задерживающий бактерии фильтр или составлены со стерилизующими средствами, которые растворяют или диспергируют в инъецируемой среде.
Ингибирование DGAT-1 соединениями согласно настоящему изобретению может быть отсрочено при использовании жидкой суспензии кристаллического или аморфного материала с низкой водорастворимостью. Скорость всасывания соединений зависит от их скорости растворения, которая, в свою очередь, зависит от их кристалличности. Отсроченное всасывание вводимого парентерально соединения может быть достигнуто растворением или суспендированием соединения в масле. Инъецируемые формы депо соединений могут также быть получены микроинкапсуляцией соединения в биоразлагаемых полимерах. В зависимости от отношения соединения к полимеру и природы используемого полимера можно контролировать скорость высвобождения. Инъецируемые составы депо также получают, захватывая соединения в липосомах или микроэмульсиях, которые являются совместимыми с тканями организма.
Твердые лекарственные формы для перорального введения соединений по изобретению включают капсулы, таблетки, пилюли, порошки и гранулы. В таких формах соединение смешано с по меньшей мере одним инертным терапевтически подходящим эксципиентом, таким как носитель, наполнитель, экстендер, дезинтегратор, ингибитор растворения, смачивающее вещество, абсорбирующее вещество или лубрикант. В случае капсул, таблеток и пилюль, эксципиент может также содержать буферизующие средства. Суппозитории для ректального введения могут быть получены путем смешивания соединения с подходящим нераздражающим эксципиентом, который является твердым при обычной температуре, но жидким в прямой кишке.
Соединения по изобретению могут быть микроинкапсулированы с одним или более эксципиентов, обсужденных выше. Твердые лекарственные формы в виде таблеток, драже, капсул, пилюль и гранул могут быть получены с покрытиями и оболочками, такими как энтеросолюбильные и обеспечивающие контролируемое высвобождение. В этих формах соединения могут быть смешаны по меньшей мере с одним инертным разбавителем и могут в случае необходимости включать лубриканты для таблетирования и вспомогательные вещества. Капсулы могут также в случае необходимости содержать замутняющие средства, которые задерживают высвобождение соединений в желаемой части кишечника.
Трансдермальные пластыри имеют дополнительное преимущество в том, что они обеспечивают контролируемую доставку соединений по изобретению в организм. Такие лекарственные формы получают, растворяя или распределяя соединения в соответствующей среде. Могут также использоваться усилители абсорбции, чтобы ускорить движение соединений через кожу, и скорость абсорбции можно контролировать с помощью контролирующей скорость мембраны или диспергируя соединения в полимерной матрице или геле.
Соединения по изобретению могут использоваться в форме фармацевтически приемлемых солей, сложных эфиров или амидов, полученных из неорганических или органических кислот. Термин "фармацевтически приемлемые соли, сложные эфиры и амиды" в рамках изобретения включает соли, цвиттерионы, сложные эфиры и амиды соединений, раскрытых здесь, которые, в рамках нормального медицинского суждения, являются подходящими для использования в контакте с тканями человека и животных без нежелательной токсичности, раздражения, аллергической реакции и т.п., соразмерны с приемлемым отношением выгоды/риска и эффективны для их намеченного использования.
Фармацевтически приемлемые соли известны из уровня техники. Соли могут быть получены в ходе финального выделения и очистки соединений или отдельно реакцией аминогруппы соединений с подходящей кислотой. Репрезентативные соли включают ацетат, адипат, альгинат, цитрат, аспартат, бензоат, бензолсульфонат, бисульфат, бутират, камфорат, камфорсульфонат, диглюконат, глицерофосфат, гемисульфат, гептаноат, гексаноат, формиат, изетионат, фумарат, лактат, малат, малеат, метансульфонат, нафтиленсульфонат, никотинат, оксалат, памоат, пектинат, персульфат, 3-фенилпропионат, пикрат, оксалат, пивалат, пропионат, сукцинат, тартрат, трихлорацетат, трифторацетат, глутамат, п-толуолсульфонат, ундеканоат, хлорид, бромид, сульфат, фосфат и т.п. Аминогруппы соединений могут также быть кватернизованы с алкилхлоридами, бромидами и йодидами, такими как метил, этил, пропил, изопропил, бутил, лаурил, миристил, стеарил и т.п.
Соли присоединения с основанием могут быть получены в ходе финального выделения и очистки соединений по изобретению реакцией карбоксильной группы с подходящим основанием, таким как гидроксид, карбонат или бикарбонат катиона металла, такого как литий, натрий, калий, кальций, магний или алюминий, или органического первичного, вторичного или третичного амина. Четверичные соли амина, полученные из метиламина, диметиламина, триметиламина, триэтиламина, диэтиламина, этиламина, трибутиламин, пиридина, N,N-диметиланилина, N-метилпиперидина, N-метилморфолина, дициклогексиламина, прокаина, дибензиламина, N,N-дибензилфенетиламина, 1-эфенамина и N,N'-дибензилэтилендиамина, этилендиамина, этаноламина, диэтаноламина, пиперидина, пиперазина и т.п., рассматриваются как входящие в рамки настоящего изобретения.
Термин "фармацевтически приемлемый сложный эфир" в рамках изобретения относится к сложным эфирам соединений по изобретению, которые гидролизуются in vivo и включают такие, которые легко расщепляются в организме человека, высвобождая родительское соединение или его соль. Примеры фармацевтически приемлемых, нетоксичных сложных эфиров по изобретению включают сложные C1-6 алкиловые эфиры и сложные C5-7 циклоалкиловые эфиры, хотя сложные C1-4 алкиловые эфиры являются предпочтительными. Сложные эфиры соединений по изобретению могут быть получены согласно обычным способам. Фармацевтически приемлемые сложные эфиры могут быть присоединены к гидроксильным группам реакцией соединения, которое содержит гидроксильную группу, с кислотой и алкилкарбоновой кислотой, такой как уксусная кислота, или с кислотой и арилкарбоновой кислотой, такой как бензойная кислота. В случае соединений, содержащих группы карбоновой кислоты, фармацевтически приемлемые сложные эфиры получают из соединений, содержащих группы карбоновой кислоты, реакцией соединения с основанием, таким как триэтиламин, и алкилгалогенидом, алкилтрифлатом, например, метилйодидом, бензилйодидом, циклопентилйодидом. Они также могут быть получены реакцией соединения с кислотой, такой как соляная кислота, и алкилкарбоновой кислотой, такой как уксусная кислота, или с кислотой и арилкарбоновой кислотой, такой как бензойная кислота.
Термин "фармацевтически приемлемый амид" в рамках изобретения относится к нетоксичным амидам по изобретению, полученным из аммиака, первичных C1-6 алкиламинов и вторичных ди(C1-6)алкиламинов. В случае вторичных аминов, амин может также быть в форме 5- или 6-членного гетероцикла, содержащего один атом азота. Амиды, полученные из аммиака, первичные C1-3 алкиламиды и вторичные ди(C1-2)алкиламиды являются предпочтительными. Амиды соединений по изобретению могут быть получены согласно обычным способам. Фармацевтически приемлемые амиды могут быть получены из соединений, содержащих группы первичного или вторичного амина, реакцией соединения, которое содержит аминогруппу, с алкилангидридом, арилангидридом, ацилгалогенидом или ароилгалогенидом. В случае соединений, содержащих группы карбоновой кислоты, фармацевтически приемлемые сложные эфиры получают из соединений, содержащих группы карбоновой кислоты, реакцией соединения с основанием, таким как триэтиламин, дегидратирующим агентом, таким как дициклогексил карбодиимид или карбонилдиимидазол, и алкиламином, диалкиламином, например, с метиламином, диэтиламином, пиперидином. Они также могут быть получены реакцией соединения с кислотой, такой как серная кислота, и алкилкарбоновой кислотой, такой как уксусная кислота, или с кислотой и арилкарбоновой кислотой, такой как бензойная кислота, в дегидратирующих условиях, таких как с добавлением молекулярных сит. Композиция может содержать соединение по изобретению в форме фармацевтически приемлемого пролекарства.
Термин "фармацевтически приемлемое пролекарство" или "пролекарство" в рамках изобретения означает такие пролекарства соединений по изобретению, которые, в рамках нормального медицинского суждения, являются подходящими для использования в контакте с тканями человека и животных без нежелательной токсичности, раздражения, аллергической реакции и т.п., соразмерны с приемлемым отношением выгоды/риска и эффективны для их намеченного использования. Пролекарства по изобретению могут быть быстро преобразованы in vivo в родительское соединение по изобретению, например, гидролизом в крови. Полное обсуждение приведено в T. Higuchi and V. Stella, Prodrugs as Novel Delivery Systems, V. 14, A.C.S. Symposium Series, и в Edward B. Roche, ed., Bioreversible Carriers in Drug Design, American Pharmaceutical Association and Pergamon Press (1987).
Нарушения, которые могут быть подвергнуты лечению или являться объектом профилактики у пациента путем введения пациенту терапевтически эффективного количества соединения (или его фармацевтических солей, пролекарств или солей пролекарств) согласно настоящему изобретению в таком количестве и в течение такого времени, которые необходимы для достижения желаемого результата. Термин "терапевтически эффективное количество" относится к количеству соединения по изобретению, достаточному, чтобы эффективно облегчать нарушения, ингибируя DGAT-1 в приемлемом отношении выгоды/риска, применимом к любому лечению. Конкретный терапевтически эффективный уровень дозы для любого конкретного пациента может зависеть от различных факторов, включая подвергаемое лечению нарушение и серьезность нарушения; активность используемого соединения; конкретную используемую композицию; возраст, массу тела, общее состояние здоровья, пол и режим питания пациента; время введения, путь введения, скорость экскреции; продолжительность лечения; и лекарственные средства, используемые в комбинированной или сопутствующей терапии.
Полная суточная доза соединений согласно настоящему изобретению, необходимая для ингибирования действия DGAT-1, в виде единственной дозы или разделенных доз может быть в количествах, например, от приблизительно 0,01 до 50 мг/кг массы тела. В более предпочтительном диапазоне, соединения согласно настоящему изобретению ингибируют действие DGAT-1 в виде единственной дозы или разделенных доз от приблизительно 0,05 до 25 мг/кг массы тела. Композиции с единственной дозой могут содержать такие количества или их субдозы соединений согласно настоящему изобретению, чтобы составить суточную дозу. В общем, режимы лечения включают введение пациенту от приблизительно 1 мг до приблизительно 1000 мг соединений в сутки в виде единственной дозы или нескольких доз.
Соединения, идентифицированные способами, описанными здесь, могут вводиться как единственное фармацевтическое средство или в комбинации с одним или более другими фармацевтическими средствами, если комбинация не вызывает никаких недопустимых побочных эффектов. Например, соединения по изобретению могут быть скомбинированы со средством против ожирения или с известными антидиабетическими или другими показанными для данного назначения средствами и т.п. Таким образом, настоящее изобретение также включает фармацевтические композиции, которые состоят из терапевтически эффективного количества соединения, идентифицированного способами, описанными здесь, или его фармацевтически приемлемой соли, фармацевтически приемлемого носителя и одного или более фармацевтических средств, как раскрыто выше.
Примеры
Пример 1
6-[(4-аминофенил)этинил]-5-метил[1,2,4]триазоло[1,5-a]пиримидин-7-амин
Целевое соединение получали согласно процедурам, описанным в Примере 4B, заменяя 1-этинилциклопентанол, используемый в Примере 4B, коммерчески доступным 4-этиниланилином. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,56 (с, 1Н), 8,44 (ушир.с, 2H), 7,40 (д, J=8,8 Гц, 2H), 6,67 (д, J=8,8 Гц, 2H), 4,51 (ушир.с, 2H), 2,59 (с, 3H). MS (ESI) m/z 265 (M+H)+.
Пример 2
6-(циклогексилэтинил)-5-метил[1,2,4]триазоло[1,5-a]пиримидин-7-амин
Целевое соединение получали согласно процедурам, описанным в Примере 4B, заменяя 1-этинилциклопентанол, используемый в Примере 4B, коммерчески доступным этинилциклогексаном. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,47 (с, 1Н), 8,26 (ушир.с, 2H), 2,79-2,69 (м, 1Н), 2,52 (с, 3H), 1,93-1,81 (м, 2H), 1,63-1,77 (м, 2H), 1,64-1,28 (м, 6H). MS (ESI) m/z 256 (M+H)+.
Пример 3
5-метил-6-(4-фенилбут-1-инил)[1,2,4]триазоло[1,5-a]пиримидин-7-амин
Целевое соединение получали согласно процедурам, описанным в Примере 4B, заменяя 1-этинилциклопентанол, используемый в Примере 4B, коммерчески доступным бут-3-инилбензолом. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,40 (с, 1Н), 8,12 (ушир.с, 2H), 7,35-7,29 (м, 5H), 2,97-2,88 (м, 2H), 2,86-2,78 (м, 2H), 2,39 (с, 3H). MS (ESI) m/z 278 (M+H)+.
Пример 4
1-[(7-амино-5-метил[1,2,4]триазоло[1,5-a]пиримидин-6-ил)этинил]циклопентанол
Пример 4A
6-йод-5-метил-[1,2,4]триазоло[1,5-α]пиримидин-7-амин
К перемешиваемой смеси 3,05 г (20,4 ммоль) 5-метил[1,2,4]триазоло[1,5-α]пиримидин-7-амина (полученного как описано в Kano; Makisumi; Chem. Pharm. Bull.; 6; 1958; 583, 585) в 50 мл уксусной кислоты при температуре окружающей среды добавляли NaI (3,2 г, 21,5 ммоль). Затем по каплям добавляли хлорамин-T тригидрат (6,0 г, 21,5 ммоль). Полученную смесь затем перемешивали в течение 1 ч при температуре окружающей среды. Большую часть органического растворителя удаляли на роторном испарителе. Смесь суспендировали в 40 мл CH3CN и фильтровали. Собранное твердое вещество промывали простым диэтиловым эфиром и высушивали в вакуумном сушильном шкафу, получая целевое соединение в форме твердого вещества светло-желтого цвета (4,93 г, 88%-ый выход).
Пример 4B
1-[(7-амино-5-метил[1,2,4]триазоло[1,5-a]пиримидин-6-ил)этинил]циклопентанол
Пример 4A (350 мг, 1,27 ммоль), бис(трифенилфосфин)палладий (II) дихлорид (38 мг, 0,64 ммоль) и CuI (21 мг, 0,13 ммоль) навешивали в пробирку. Добавляли CH3CN (10 мл) и барботировали азот. Затем последовательно добавляли 1-этинилциклопентанол (180 мг, 1,91 ммоль) и триэтиламин (382 мкл, 3,18 ммоль). Пробирку затем заглушали и нагревали при 110°C в течение 20 мин. Реакционной смеси затем давали охладиться до температуры окружающей среды и разделяли между этилацетатом (15 мл) и солевым раствором (10 мл). Водный слой экстрагировали однократно этилацетатом (15 мл). Объединенный органический слой высушивали над MgSO4 и концентрировали в вакууме. Остаток очищали ВЭЖХ с обратной фазой (колонка C-18, элюируя с градиентом 5-100% CH3CN в 10 мМ ацетата аммония)), получая целевое соединение в форме твердого вещества белого цвета (140 мг, 43%-ый выход). 1H ЯМР (300 МГц, ДМСО-d6) δ 8,42 (с, 1Н), 8,14 (ушир.с, 2H), 5,36 (с, 1Н), 2,51 (с, 3H), 2,05-1,84 (м, 4H), 1,83-1,62 (м, 4H). MS (ESI) m/z 258 (M+H)+.
Пример 5
1-[(7-амино-5-метил[1,2,4]триазоло[1,5-a]пиримидин-6-ил)этинил]циклогексанол
Целевое соединение получали согласно процедурам, описанным в Примере 4B, заменяя 1-этинилциклопентанол, используемый в Примере 4B, коммерчески доступным 1-этинил-1-циклогексанолом. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,43 (с, 1Н), 8,19 (ушир.с, 2H), 5,53 (с, 1Н), 3,29 (с, 3H), 1,96-1,83 (м, 2H), 1,75-1,43 (м, 6H), 1,29-1,10 (м, 2H). MS (ESI) m/z 272 (M+H)+.
Пример 6
4-[(7-амино-5-метил[1,2,4]триазоло[1,5-a]пиримидин-6-ил)этинил]тетрагидро-2H-пиран-4-ол
Пример 6A
4-Этинил-тетрагидро-пиран-4-ол
Раствор этинилмагнийхлорида в тетрагидрофуране (0,5 м., 12 мл, 6,0 ммоль) добавляли по каплям за 15 мин с охлаждением в ванне с водой со льдом к раствору тетрагидро-4H-пиран-4-она (0,496 г, 5,0 ммоль) в простом диэтиловом эфире (300 мл). Смесь перемешивали при температуре окружающей среды в течение 1 часа. Затем добавляли насыщенный водный раствор хлорида аммония (10,0 мл), и смесь экстрагировали простым эфиром (2×20 мл). Эфирные слои промывали насыщенным водным раствором хлорида натрия (20 мл), затем объединяли, высушивали над MgSO4, фильтровали и концентрировали, получая 4-этинил-тетрагидро-пиран-4-ол в форме бесцветного масла, которое затвердевало при отстаивании. (0,60 г, выход 96,2%).
Пример 6B
4-[(7-амино-5-метил[1,2,4]триазоло[1,5-a]пиримидин-6-ил)этинил]тетрагидро-2H-пиран-4-ол
Целевое соединение получали согласно процедурам, описанным в Примере 4B, заменяя 1-этинилциклопентанол, используемый в Примере 4B, Примером 6A. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,52 (с, 1Н), 8,31 (ушир.с, 2H), 3,89-3,75 (м, 2H), 3,63-3,51 (м, 2H), 2,54 (с, 3H), 2,10-1,89 (м, 2H), 1,79-1,63 (м, 2H). MS (ESI) m/z 274 (M+H)+.
Пример 7
4-(7-амино-5-метил[1,2,4]триазоло[1,5-a]пиримидин-6-ил)-2-циклопентилбут-3-ин-2-ол
Пример 7A
2-циклопентилбут-3-ин-2-ол
Целевое соединение получали согласно процедурам, описанным в Примере 6A, заменяя тетрагидро-4H-пиран-4-он, используемый в Примере 6A, 1-циклопентилэтаноном.
Пример 7B
4-(7-амино-5-метил[1,2,4]триазоло[1,5-a]пиримидин-6-ил)-2-циклопентилбут-3-ин-2-ол
Целевое соединение получали согласно процедурам, описанным в Примере 4B, заменяя 1-этинилциклопентанол, используемый в Примере 4B, Примером 7A. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,47 (с, 1Н), 8,21 (ушир.с, 2H), 2,50 (с, 3H), 2,17-2,03 (м, 1Н), 1,81-1,43 (м, 8H), 1,46 (с, 3H). MS (ESI) m/z 286 (M+H)+.
Пример 8
4-(7-амино-5-метил[1,2,4]триазоло[1,5-a]пиримидин-6-ил)-2-фенилбут-3-ин-2-ол
Целевое соединение получали согласно процедурам, описанным в Примере 4B, заменяя 1-этинилциклопентанол, используемый в Примере 4B, коммерчески доступным 2-фенил-3-бутин-2-олом. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,45 (с, 1Н), 8,26 (ушир.с, 2H), 7,67 (д, J=7,5 Гц, 2H), 7,39 (т, J=7,5 Гц, 2H), 7,28 (м, 1Н), 6,16 (с, 1Н), 2,54 (с, 3H), 1,75 (с, 3H). MS (ESI) m/z 294 (M+H)+.
Пример 9
4-(7-амино-5-метил[1,2,4]триазоло[1,5-a]пиримидин-6-ил)-1,1,1-трифтор-2-фенилбут-3-ин-2-ол
Целевое соединение получали согласно процедурам, описанным в Примере 4B, заменяя 1-этинилциклопентанол, используемый в Примере 4B, коммерчески доступным 1,1,1-трифтор-2-фенил-3-бутин-2-олом. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,49 (с, 1Н), 7,88 (с, 1Н), 7,79-7,72 (м, 2H), 7,54-7,42 (м, 3H), 2,60 (с, 3H). MS (ESI) m/z 348 (M+H)+.
Пример 10
3-(7-амино-5-метил[1,2,4]триазоло[1,5-a]пиримидин-6-ил)-1,1-дифенилпроп-2-ин-1-ол
Целевое соединение получали согласно процедурам, описанным в Примере 4B, заменяя 1-этинилциклопентанол, используемый в Примере 4B, коммерчески доступным 1,1-дифенил-2-пропин-1-олом. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,48 (с, 1Н), 8,28 (ушир.с, 2H), 7,68-7,62 (м, 2H), 7,47-7,21 (м, 6H), 7,04-7,00 (м, 1Н), 2,59 (с, 3H). MS (ESI) m/z 356 (M+H)+.
Пример 11
3-(7-амино-5-метил[1,2,4]триазоло[1,5-a]пиримидин-6-ил)-1-фенилпроп-2-ин-1-ол
Целевое соединение получали согласно процедурам, описанным в Примере 4B, заменяя 1-этинилциклопентанол, используемый в Примере 4B, коммерчески доступным 1-фенил-2-пропин-1-олом. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,43 (с, 1Н), 8,28 (ушир.с, 2H), 7,60-7,55 (м, 2H), 7,44-7,36 (м, 3H), 7,34-7,27 (м, 1Н), 6,08 (д, J=6,1 Гц, 1Н), 5,68 (д, J=6,1 Гц, 1Н), 2,50 (с, 3H). MS (ESI) m/z 280 (M+H)+.
Пример 12
6-(3-циклогексилпроп-1-инил)-5-метил[1,2,4]триазоло[1,5-a]пиримидин-7-амин
Целевое соединение получали согласно процедурам, описанным в Примере 4B, заменяя 1-этинилциклопентанол, используемый в Примере 4B, коммерчески доступным 3-циклогексил-1-пропином. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,47 (с, 1Н), 8,27 (ушир.с, 2H), 2,43 (д, J=6,8 Гц, 2H), 1,89-1,50 (м, 5H), 1,34-0,99 (м, 6H). MS (ESI) m/z 270 (M+H)+.
Пример 13
3-(7-амино-5-метил[1,2,4]триазоло[1,5-a]пиримидин-6-ил)-1-циклопропил-1-фенилпроп-2-ин-1-ол
Пример 13A
1-циклопропил-1-фенилпроп-2-ин-1-ол
Целевое соединение получали согласно процедурам, описанным в Примере 6A, заменяя тетрагидро-4H-пиран-4-он, используемый в Примере 6A, циклопропил(фенил)метаноном.
Пример 13B
3-(7-амино-5-метил[1,2,4]триазоло[1,5-a]пиримидин-6-ил)-1-циклопропил-1-фенилпроп-2-ин-1-ол
Целевое соединение получали согласно процедурам, описанным в Примере 4B, заменяя 1-этинилциклопентанол, используемый в Примере 4B, Примером 13A. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,47 (с, 1Н), 8,30 (ушир.с, 2H), 7,74-7,68 (м, 2H), 7,44-7,37 (м, 3H), 7,35-7,27 (м, 1Н), 6,69 (т, J=7,5 Гц, 1Н), 2,61 (с, 3H), 3,63 (т, J=6,4 Гц, 2H), 2,71 (м, 2H). MS (ESI) m/z 320 (M+H)+.
Пример 14
6-[(4-метоксифенил)этинил]-5-метил[1,2,4]триазоло[1,5-a]пиримидин-7-амин
Целевое соединение получали согласно процедурам, описанным в Примере 4B, заменяя 1-этинилциклопентанол, используемый в Примере 4B, 1-этинил-4-метоксибензолом. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,52 (ушир.с, 2H), 8,50 (с, 1Н), 7,63 (д, J=9,2 Гц, 2H), 6,99 (д, J=9,2 Гц, 2H), 3,80 (с, 3H), 2,61 (с, 3H). MS (ESI) m/z 280 (M+H)+.
Пример 15
3-(7-амино-5-метил[1,2,4]триазоло[1,5-a]пиримидин-6-ил)-1,1-бис(4-хлорфенил)проп-2-ин-1-ол
Пример 15A
1,1-бис(4-хлорфенил)проп-2-ин-1-ол
Целевое соединение получали согласно процедурам, описанным в Примере 6A, заменяя тетрагидро-4H-пиран-4-он, используемый в Примере 6A, бис(4-хлорфенил)метаноном.
Пример 15B
3-(7-амино-5-метил[1,2,4]триазоло[1,5-a]пиримидин-6-ил)-1,1-бис(4-хлорфенил)проп-2-ин-1-ол
Целевое соединение получали согласно процедурам, описанным в Примере 4B, заменяя 1-этинилциклопентанол, используемый в Примере 4B, Примером 15A. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,47 (с, 1Н), 8,31 (ушир.с, 2H), 7,64 (д, J=8,8 Гц, 4H), 7,42 (д, J=8,8 Гц, 4H), 7,12 (ушир.с, 1Н), 2,56 (с, 3H). MS (ESI) m/z 424 (M+H)+.
Пример 16
5-метил-6-(3-морфолин-4-ил-3-фенилпроп-1-инил)[1,2,4]триазоло[1,5-a]пиримидин-7-амин
Целевое соединение получали согласно процедурам, описанным в Примере 4B, заменяя 1-этинилциклопентанол, используемый в Примере 4B, 4-(1-фенил-проп-2-инил)-морфолином (полученным, как описано в Ahn, Jin Hee; Joung, Meyoung Ju; Yoon, Nung Min; J. Org. Chem.; EN; 64; 2; 1999; 488-492). 1H ЯМР (300 МГц, ДМСО-d6) δ 8,49 (с, 1Н), 7,99-7,94 (м, 1Н), 7,74-7,65 (м, 1Н), 7,63-7,42 (м, 4H), 3,81-3,66 (м, 4H), 3,15-2,90 (м, 4H), 2,60 (с, 3H). MS (ESI) m/z 349 (M+H)+.
Пример 17
3-(7-амино-5-метил[1,2,4]триазоло[1,5-a]пиримидин-6-ил)-1-(1-метилциклогексил)-1-фенилпроп-2-ин-1-ол
Пример 17A
1-(1-метилциклогексил)-1-фенилпроп-2-ин-1-ол
Целевое соединение получали согласно процедурам, описанным в Примере 6A, заменяя тетрагидро-4H-пиран-4-он, используемый в Примере 6A, (1-метил-циклогексил)-бензофеноном (полученным, как описано в Rouzaud, J. et al; BSCFAS; Bull. Soc. Chim. Fr.; FR; 1965; 2030-2037).
Пример 17B
3-(7-амино-5-метил[1,2,4]триазоло[1,5-a]пиримидин-6-ил)-1-(1-метилциклогексил)-1-фенилпроп-2-ин-1-ол
Целевое соединение получали согласно процедурам, описанным в Примере 4B, заменяя 1-этинилциклопентанол, используемый в Примере 4B, Примером 17A. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,47 (с, 1Н), 8,20 (ушир.с, 2H), 7,63-7,56 (м, 2H), 7,42-7,23 (м, 3H), 2,65 (с, 3H), 1,74-1,46 (м, 4H), 1,46-0,90 (м, 6H), 0,93 (с, 3H). MS (ESI) m/z 376 (M+H)+.
Пример 18
3-(7-амино-5-метил[1,2,4]триазоло[1,5-a]пиримидин-6-ил)-1-(3,4'-дихлор-1,1'-бифенил-4-ил)проп-2-ин-1-ол
Пример 18A
1-(3,4'-дихлорбифенил-4-ил)проп-2-ин-1-ол
Целевое соединение получали согласно процедурам, описанным в Примере 6 A, заменяя тетрагидро-4H-пиран-4-он, используемый в Примере 6 A, 3,4'-дихлорбифенил-4-карбоксальдегидом (полученным, как описано в WO2001039773A1).
Пример 18B
3-(7-амино-5-метил[1,2,4]триазоло[1,5-a]пиримидин-6-ил)-1-(3,4'-дихлор-1,1'-бифенил-4-ил)проп-2-ин-1-ол
Целевое соединение получали согласно процедурам, описанным в Примере 4B, заменяя 1-этинилциклопентанол, используемый в Примере 4B, Примером 18A. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,47 (с, 1Н), 8,30 (ушир.с, 2H), 7,68-7,60 (м, 4H), 7,46-7,39 (м, 4H), 7,13 (м, 1Н), 2,56 (с, 3H). MS (ESI) m/z 424, 426, 428 (M+H)+.
Пример 19
1-(7-амино-5-метил[1,2,4]триазоло[1,5-a]пиримидин-6-ил)-3-(1,1'-бифенил-4-ил)-4,4-диметилпент-1-ин-3-ол
Пример 19A
3-(бифенил-4-ил)-4,4-диметилпент-1-ин-3-ол
Целевое соединение получали согласно процедурам, описанным в Примере 6A, заменяя тетрагидро-4H-пиран-4-он, используемый в Примере 6A, 4-бифенил-трет-бутилкетоном (полученным, как описано в Tsuji, Yutaka; Fujio, Mizue; Tsuno, Yuho; Bull. Chem. Soc. Jpn.; 63; 3; 1990; 856-866).
Пример 19B
1-(7-амино-5-метил[1,2,4]триазоло[1,5-a]пиримидин-6-ил)-3-(1,1'-бифенил-4-ил)-4,4-диметилпент-1-ин-3-ол
Целевое соединение получали согласно процедурам, описанным в Примере 4B, заменяя 1-этинилциклопентанол, используемый в Примере 4B, Примером 19A. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,45 (с, 1Н), 8,20 (ушир.с, 2H), 7,74-7,63 (м, 6H), 7,51-7,31 (м, 3H), 6,19 (с, 1Н), 2,67 (с, 3H), 1,05 (с, 9H). MS (ESI) m/z 412 (M+H)+.
Пример 20
4-(7-амино-5-метил[1,2,4]триазоло[1,5-a]пиримидин-6-ил)-2-гидрокси-2-фенилметилбут-3-иноат
Пример 20A
2-гидрокси-2-фенилметилбут-3-иноат
Целевое соединение получали согласно процедурам, описанным в Примере 6A, заменяя тетрагидро-4H-пиран-4-он, используемый в Примере 6A, метилбензоилформиатом.
Пример 20B
4-(7-амино-5-метил[1,2,4]триазоло[1,5-a]пиримидин-6-ил)-2-гидрокси-2-фенилметилбут-3-иноат
Целевое соединение получали согласно процедурам, описанным в Примере 4B, заменяя 1-этинилциклопентанол, используемый в Примере 4B, Примером 20A. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,45 (с, 1Н), 8,20 (ушир.с, 2H), 7,75-7,22 (м, 5H), 3,68 (с, 3H), 2,58 (с, 3H). MS (ESI) m/z 338 (M+H)+.
Пример 21
N-{1-[(7-амино-5-метил[1,2,4]триазоло[1,5-a]пиримидин-6-ил)этинил]циклогексил}-3-хлорбензолсульфонамид
Пример 21A
3-хлор-N-(1-этинилциклогексил)бензолсульфонамид
К раствору 1-этинилциклогексанамина (40 мг, 0,32 ммоль) в CH2Cl2 добавляли триэтиламин (68 мл, 0,48 ммоль), затем 3-хлорбензолсульфонилхлорид (68,2 мг, 0,32 ммоль). Через 30 минут смесь разделяли между этилацетатом и 3н. водным раствором HCl. Органический слой промывали насыщ. NaHCO3, солевым раствором, высушивали над Na2SO4, концентрировали в вакууме, получая целевое соединение в форме твердого вещества белого цвета (90 мг, 93%-ый выход).
Пример 21B
N-{1-[(7-амино-5-метил[1,2,4]триазоло[1,5-a]пиримидин-6-ил)этинил]циклогексил}-3-хлорбензолсульфонамид
Целевое соединение получали согласно процедурам, описанным в Примере 4B, заменяя 1-этинилциклопентанол, используемый в Примере 4B, Примером 21A. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,47 (с, 1Н), 8,17 (с, 1Н), 7,80-7,28 (м, 4H), 2,26 (с, 3H), 2,11-1,99 (м, 2H), 1,79-1,38 (м, 6H), 1,32-1,10 (м, 2H). MS (ESI) m/z 445 (M+H)+.
Пример 22
N-{4-[(7-амино-5-метил[1,2,4]триазоло[1,5-a]пиримидин-6-ил)этинил]фенил}-N'-(3-хлорфенил)мочевина
К перемешиваемому раствору Примера 1 (10 мг, 0,038 ммоль) в 1,0 мл CH3CN добавляли 3-хлорфенилизоцианат (6,4 мг, 0,046 ммоль) и триэтиламин (8 мкл, 0,057 ммоль). Полученную смесь перемешивали в течение ночи при температуре окружающей среды. Полученную смесь очищали ВЭЖХ с обратной фазой (колонка C-18, элюируя с градиентом 5-100% CH3CN в 0,1% трифторуксусной кислоты), получая целевое соединение в форме его соли трифторуксусной кислоты (3,5 мг, выход 17,3%). MS (ESI) m/z 416, 418 (M+H)+.
Пример 23
(1R,4R)-2-[(7-амино-5-метил[1,2,4]триазоло[1,5-a]пиримидин-6-ил)этинил]-1,7,7-триметилбицикло[2,2,1]гептан-2-ол
Пример 23A
(1R,4R)-2-этинил-1,7,7-триметилбицикло[2,2,1]гептан-2-ол
Целевое соединение получали согласно процедурам, описанным в Примере 6A, заменяя тетрагидро-4H-пиран-4-он, используемый в Примере 6A, (±)-камфорой.
Пример 23B
(1R, 4R)-2-[(7-амино-5-метил[1,2,4]триазоло[1,5-a]пиримидин-6-ил)этинил]-1,7,7-триметилбицикло[2,2,1]гептан-2-ол
Целевое соединение получали согласно процедурам, описанным в Примере 4B, заменяя 1-этинилциклопентанол, используемый в Примере 4B, Примером 23. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,43 (с, 1Н), 8,23 (ушир.с, 2H), 5,55 (с, 1Н), 2,50 (с, 3H), 2,50 (с, 3H), 2,24-2,14 (м, 2H), 1,96-1,83 (м, 3H), 1,78-1,63 (м, 3H), 1,54-1,41 (м, 2H), 1,20-1,09 (м, 2H), 1,08 (с, 3H), 0,93 (с, 3H), 0,86 (с, 3H). MS (ESI) m/z 326 (M+H)+.
Пример 24
(1Z)-2-[3-(7-амино-5-метил[1,2,4]триазоло[1,5-a]пиримидин-6-ил)проп-2-инил]-4-трет-бутилциклогексанон оксим
Пример 24A
(Z)-4-трет-бутил-2-(проп-2-инил)циклогексанон оксим
Смесь 4-трет-бутил-2-проп-2-инил-циклогексанона (50 мг, 0,26 ммоль) (полученного, как описано в Dufey, P.; Bull. Soc. Chim. Fr.; 1968, 4653-4662) в 1,0 мл этанола нагревали с обратным холодильником с гидроксиламингидрохлоридом (25 мг, 0,36 ммоль) и пиридином (0,25 мл, избыток) в течение 3 ч. Смеси затем давали охладиться до температуры окружающей среды и разделяли между этилацетатом и 3н. водным раствором HCl. Органические слои промывали насыщенным водным раствором хлорида натрия, высушивали над MgSO4, фильтровали и концентрировали, получая целевое соединение в форме твердого вещества светло-желтого цвета (50 мг, 93%-ый выход).
Пример 24B
(1Z)-2-[3-(7-амино-5-метил[1,2,4]триазоло[1,5-a]пиримидин-6-ил)проп-2-инил]-4-трет-бутилциклогексанон оксим
Целевое соединение получали согласно процедурам, описанным в Примере 4B, заменяя 1-этинилциклопентанол, используемый в Примере 4B, Примером 24A. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,42 (с, 1Н), 8,15 (ушир.с, 2H), 3,02-2,90 (м, 1Н), 2,80-2,69 (м, 1Н), 2,50 (с, 3H), 2,60-2,22 (м, 2H), 1,93-1,79 (м, 1Н), 1,66-0,95 (м, 3H), 0,87 (с, 9H). MS (ESI) m/z 355 (M+H)+.
Пример 25
4-(7-амино-5-метил[1,2,4]триазоло[1,5-a]пиримидин-6-ил)-2-(4-изопропил-2-метилциклопентил)бут-3-ин-2-ол
Пример 25A
2-(4-изопропил-2-метилциклопентил)бут-3-ин-2-ол
Целевое соединение получали согласно процедурам, описанным в Примере 6A, заменяя тетрагидро-4H-пиран-4-он, используемый в Примере 6A, 1-(4-изопропил-2-метилциклопентил)этаноном (полученным, как описано в Roger, A. et al. Bull. Soc. Chim. Fr. 1967, 3030-3037).
Пример 25B
4-(7-амино-5-метил[1,2,4]триазоло[1,5-a]пиримидин-6-ил)-2-(4-изопропил-2-метилциклопентил)-бут-3-ин-2-ол
Целевое соединение получали согласно процедурам, описанным в Примере 4B, заменяя 1-этинилциклопентанол, используемый в Примере 4B, Примером 25А. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,46 (с, 1Н), 8,22 (ушир.с, 2H), 5,40 (ушир.с, 1Н), 2,50 (с, 3H), 2,14-1,97 (м, 1Н), 1,85-1,54 (м, 3H), 1,43 (с, 3H), 1,49-1,13 (м, 3H), 1,10 и 1,08 (с, 3H всего), 0,88 (с, 3H), 0,85 (с, 3H). MS (ESI) m/z 342 (M+H)+.
Пример 26
{[3-(7-амино-5-метил[1,2,4]триазоло[1,5-a]пиримидин-6-ил)-1-фенилпроп-2-инил]окси}метилацетат
Пример 26A
2-(1-фенилпроп-2-инилокси)метилацетат
К перемешиваемой суспензии NaH (60%, 76 мг, 1,89 ммоль) в 5 мл безводного N,N-диметилформамида добавляли 1-фенилпроп-2-ин-1-ол (250 мг, 1,89 ммоль). Через 15 минут при температуре окружающей среды добавляли метилбромацетат (179 мкл, 1,89 ммоль). Полученную смесь перемешивали при температуре окружающей среды в течение 90 минут, после чего гасили насыщенным раствором хлорида аммония и экстрагировали этилацетатом (2×15 мл). Объединенный органический слой промывали солевым раствором, высушивали над Na2SO4, фильтровали и концентрировали в вакууме. Остаток очищали флэш-хроматографией на силикагеле, элюируя смесью этилацетат:гексан (1:9), получая целевое соединение в форме бесцветного масла (160 мг, 41%-ый выход).
Пример 26B
{[3-(7-амино-5-метил[1,2,4]триазоло[1,5-a]пиримидин-6-ил)-1-фенилпроп-2-инил]окси}метилацетат
Целевое соединение получали согласно процедурам, описанным в Примере 4B, заменяя 1-этинилциклопентанол, используемый в Примере 4B, Примером 26A. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,44 (с, 1Н), 8,44 (ушир.с, 2H), 7,64 (д, J=6,4 Гц, 2H), 7,49-7,35 (м, 3H), 5,72 (с, 1Н), 4,41 (кв, J=16,5 Гц, 2H), 3,69 (с, 3H), 2,50 (с, 3H). MS (ESI) m/z 352 (M+H)+.
Пример 27
{[3-(7-амино-5-метил[1,2,4]триазоло[1,5-a]пиримидин-6-ил)-1-фенилпроп-2-инил]окси}уксусная кислота
Пример 26B (60 мг, 0,17 ммоль) перемешивали в смеси метанол/тетрагидрофуран (1 мл, 1:1, об./об.) и добавляли 3н. водный раствор NaOH (171 мкл, 0,51 ммоль). Смесь перемешивали при температуре окружающей среды в течение 5 часов. Летучий органический растворитель выпаривали в вакууме, и остаток обрабатывали 1н. NaOH, чтобы установить рН 5. Образованный осадок собирали фильтрацией и высушивали в вакуумном сушильном шкафу, получая целевое соединение (25 мг, 45%-ый выход) в форме твердого вещества коричневого цвета. 1H ЯМР (300 МГц, ДМСО-d6) δ 12,75 (с, 1Н), 8,44 (с, 1Н), 8,44 (ушир.с, 2H), 7,64 (д, J=6,8 Гц, 2H), 7,48-7,33 (м, 3H), 5,72 (с, 1Н), 4,32 (д, J=16,6 Гц, 1Н), 4,23 (д, J=16,6 Гц, 1Н), 2,52 (с, 3H). MS (ESI) m/z 338 (M+H)+.
Пример 28
{2-[(7-амино-5-метил[1,2,4]триазоло[1,5-a]пиримидин-6-ил)этинил]фенил}метанол
Целевое соединение получали согласно процедурам, описанным в Примере 4B, заменяя 1-этинилциклопентанол, используемый в Примере 4B, (2-этинилфенил)метанолом. MS (ESI) m/z 280 (M+H)+.
Пример 29
{3-[3-(7-амино-5-метил[1,2,4]триазоло[1,5-a]пиримидин-6-ил)-1-гидрокси-1-метилпроп-2-инил]-2,2-диметилциклобутил}уксусная кислота
Пример 29A
2-(3-(2-гидроксибут-3-ин-2-ил)-2,2-диметилциклобутил)уксусная кислота
Целевое соединение получали согласно процедурам, описанным в Примере 6A, заменяя тетрагидро-4H-пиран-4-он, используемый в Примере 6A, 2-(3-ацетил-2,2-диметилциклобутил)уксусной кислотой (полученной, как описано в Burgess, K. et al. Tetrahedron Lett. 38, 1997, 1681-1684).
Пример 29B
{3-[3-(7-амино-5-метил[1,2,4]триазоло[1,5-a]пиримидин-6-ил)-1-гидрокси-1-метилпроп-2-инил]-2,2-диметилциклобутил}уксусная кислота
Смесь Примера 4A (28 мг, 0,1 ммоль), Примера 29A (21 мг, 0,1 ммоль), бис(трифенилфосфин)палладий (II) дихлорида (3,5 мг, 0,005 ммоль), CuI (1 мг, 0,005 ммоль) и триэтиламина (28 мкл, 0,2 ммоль) в ацетонитриле (500 мкл) нагревали при 100°C в течение 5 минут в микроволновом реакторе под атмосферой азота. Полученную смесь очищали ВЭЖХ с обратной фазой (колонка C-18, элюируя с градиентом 5-100% CH3CN в 0,1% трифторуксусной кислоты), и далее очищали флэш-хроматографией на силикагеле (элюируя 10% метанола в этилацетате), получая целевое соединение в форме твердого вещества белого цвета (6 мг, 17%-ый выход). 1H ЯМР (300 МГц, ДМСО-d6) δ 11,93 (с, 1H), 8,42 (с, 1H), 8,12 (с, 2H), 5,32 (с, 1H), 2,52 (с, 3H), 1,82-2,32 (м, 6H), 1,42 (с, 3H), 1,12 (с, 6H). MS (ESI) m/z 358 (M+H)+.
Пример 30
4-(7-амино-5-метил[1,2,4]триазоло[1,5-a]пиримидин-6-ил)-2-циклобутилбут-3-ин-2-ол
Целевое соединение получали согласно процедурам, описанным в Примере 29B, заменяя Пример 29A 2-циклобутилбут-3-ин-2-олом (полученным, как описано в патенте США 2779799), получая твердое вещество белого цвета (11 мг, 41%). 1Н ЯМР (300 МГц, ДМСО-d6) δ 8,43 (с, 1H), 8,16 (с, 2H), 5,39 (с, 1H), 2,52 (с, 3H), 1,58-2,21 (м, 7H), 1,37 (с, 3H). MS (ESI) m/z 272 (M+H)+.
Пример 31
4-(7-амино-5-метил[1,2,4]триазоло[1,5-a]пиримидин-6-ил)-2-(3-метилциклобутил)бут-3-ин-2-ол
Целевое соединение получали согласно процедурам, описанным в Примере 29B, заменяя Пример 29A 2-(3-метилциклобутил)бут-3-ин-2-олом (полученным, как описано в патенте США 2779799), получая твердое вещество белого цвета (4 мг, 14%). 1H ЯМР (300 МГц, ДМСО-d6) δ 8,43 (с, 1H), 8,12 (с, 2H), 5,37 (с, 1H), 2,52 (с, 3H), 1,45-2,38 (м, 6H), 1,34 (д, Гц J=7,12, 3H), 0,93-1,17 (м, 3H). MS (ESI) m/z 286 (M+H)+.
Пример 32
5-метил-6-(3-фенилпроп-1-инил)[1,2,4]триазоло[1,5-a]пиримидин-7-амин
Целевое соединение получали согласно процедурам, описанным в Примере 4B, заменяя 1-этинилциклопентанол, используемый в Примере 4B, коммерчески доступным проп-2-инилбензолом. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,41 (с, 1H), 8,27 (с, 2H), 7,21-7,51 (м, 5H), 3,98 (с, 2H), 2,54 (с, 3H). MS (ESI) m/z 264 (M+H)+.
Пример 33
6-(3-циклопентилпроп-1-инил)-5-метил[1,2,4]триазоло[1,5-a]пиримидин-7-амин
Целевое соединение получали согласно процедурам, описанным в Примере 4B, заменяя 1-этинилциклопентанол, используемый в Примере 4B, коммерчески доступным проп-2-инилциклопентаном. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,40 (с, 1H), 8,12 (с, 2H), 2,51 (с, 3H), 2,08-2,22 (м, 1H), 1,73-1,87 (м, 2H), 1,45-1,70 (м, 4H), 1,27-1,42 (м, 2H). MS (ESI) m/z 256 (M+H)+.
Пример 34
6-[(1-аминоциклогексил)этинил]-5-метил[1,2,4]триазоло[1,5-a]пиримидин-7-амин
Целевое соединение получали согласно процедурам, описанным в Примере 4B, заменяя 1-этинилциклопентанол, используемый в Примере 4B, коммерчески доступным 1-этинилциклогексанамином. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,69 (с, 1Н), 8,49 (ушир.с, 2H), 2,55 (с, 3H), 2,18-2,09 (м, 1Н), 2,07-1,96 (м, 1Н), 1,84-1,50 (м, 6H), 1,50-1,33 (м, 1Н), 1,26-1,05 (м, 1Н). MS (ESI) m/z 271 (M+H)+.
Пример 35
3-(7-амино-5-метил[1,2,4]триазоло[1,5-a]пиримидин-6-ил)-1-циклопентилпроп-2-ин-1-ол
Пример 35 A
1-циклопентилпроп-2-ин-1-ол
Целевое соединение получали согласно процедурам, описанным в Примере 6A, заменяя тетрагидро-4H-пиран-4-он, используемый в Примере 6A, циклопентанкарбоксальдегидом.
Пример 35B
3-(7-амино-5-метил[1,2,4]триазоло[1,5-a]пиримидин-6-ил)-1-циклопентилпроп-2-ин-1-ол
Целевое соединение получали согласно процедурам, описанным в Примере 4B, заменяя 1-этинилциклопентанол, используемый в Примере 4B, Примером 35A. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,42 (с, 1Н), 8,17 (ушир.с, 2H), 5,37 (д, J=5,1 Гц, 1Н), 4,41-4,34 (м, 1Н), 2,50 (ушир.с, 3H), 2,30-2,11 (м, 1Н), 1,81-1,40 (м, 8H). MS (ESI) m/z 272 (M+H)+.
Пример 36
3-(7-амино-5-метил[1,2,4]триазоло[1,5-a]пиримидин-6-ил)-1-(2,4-дихлорфенил)проп-2-ин-1-ол
Пример 36A
1-(2,4-дихлорфенил) проп-2-ин-1-ол целевое соединение получали согласно процедурам, описанным в Примере 6A, заменяя тетрагидро-4H-пиран-4-он, используемый в Примере 6A, 2,4-дихлорбензальдегидом.
Пример 36B
3-(7-амино-5-метил[1,2,4]триазоло[1,5-a]пиримидин-6-ил)-1-(2,4-дихлорфенил)проп-2-ин-1-ол
Целевое соединение получали согласно процедурам, описанным в Примере 4B, заменяя 1-этинилциклопентанол, используемый в Примере 4B, Примером 36A. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,43 (с, 1Н), 8,28 (ушир.с, 2H), 7,82 (д, J=8,5 Гц, 1Н), 7,65 (д, J=2,0 Гц, 1Н), 7,53 (дд, J=8,5, 2,0 Гц, 1Н), 6,40 (д, J=5,8 Гц, 1Н), 5,88 (д, J=5,8 Гц, 1Н), 2,50 (с, 3H). MS (ESI) m/z 348, 350, 352 (M+H)+.
Пример 37
4-(7-амино-5-метил[1,2,4]триазоло[1,5-a]пиримидин-6-ил)-1-циклопентил-2-метилбут-3-ин-2-ол
Пример 37A
1-циклопентил-1-метилбут-3-ин-2-ол
Целевое соединение получали согласно процедурам, описанным в Примере 6A, заменяя тетрагидро-4H-пиран-4-он, используемый в Примере 6A, циклопентилацетоном.
Пример 37B
4-(7-амино-5-метил[1,2,4]триазоло[1,5-a]пиримидин-6-ил)-1-циклопентил-2-метилбут-3-ин-2-ол
Смесь Примера 4A (28 мг, 0,1 ммоль), Примера 37A (18 мг, 0,12 ммоль), бис(трифенилфосфин)палладий (II) дихлорида (3,5 мг, 0,005 ммоль), CuI (1 мг, 0,005 ммоль) и триэтиламина (28 мкл, 0,2 ммоль) в ацетонитриле (500 мкл) нагревали при 100°C в течение 5 минут в микроволновом реакторе под атмосферой азота. Полученную смесь разделяли между этилацетатом и водой. Органическую фазу промывали солевым раствором, высушивали над MgSO4, фильтровали и концентрировали в вакууме. Остаток очищали флэш-хроматографией на силикагеле (элюируя этилацетатом), получая целевое соединение в форме твердого вещества светло-желтого цвета (9 мг, 30%-ый выход). 1H ЯМР (300 МГц, ДМСО-d6) δ 8,42 (с, 1H), 8,13 (с, 2H), 5,38 (с, 1H), 2,49 (с, 3H), 1,99-2,20 (м, 1H), 1,80-1,94 (м, 2H), 1,76 (дд, J=6,27, 2,88 Гц, 2H), 1,49 (с, 3H), 1,37-1,65 (м, 4H), 1,08-1,28 (м, 2H). MS (ESI) m/z 300 (M+H)+
Пример 38
{4-[(7-амино-5-метил[1,2,4]триазоло[1,5-a]пиримидин-6-ил)этинил]-4-гидроксициклогексил}уксусная кислота
Пример 43B (5,0 мг) в смеси CH2Cl2/трифторуксусная кислота (0,5 мл, 1:1, об./об.) оставляли при температуре окружающей среды на 2 часа. Растворитель затем удаляли в вакууме, получая целевое соединение в форме его соли трифторуксусной кислоты (6,0 мг, 100%). 1H ЯМР (300 МГц, ДМСО-d6) δ 8,43 (с, 1Н), 5,65 (ушир.с, 1Н), 2,53 (с, 3H), 2,29-2,08 (м, 2H), 2,05-1,90 (м, 2H), 1,81-1,59 (м, 3H), 1,59-1,44 (м, 2H), 1,41-1,21 (м, 2H). MS (ESI) m/z 330 (M+H)+.
Пример 39
{4-[(7-амино-5-метил[1,2,4]триазоло[1,5-a]пиримидин-6-ил)этинил]-4-гидроксициклогексил}метилацетат
Пример 39A
2-(4-этинил-4-гидроксициклогексил)метилацетат
Целевое соединение получали согласно процедурам, описанным в Примере 6A, заменяя тетрагидро-4H-пиран-4-он, используемый в Примере 6A, метиловым эфиром (4-оксо-циклогексил)-уксусной кислоты (полученным, как описано в Suemune, Hiroshi; Oda, Kozo; Sakai, Kiyoshi; Tetrahedron Lett.; 28; 29; 1987; 3373-3376).
Пример 39B
{4-[(7-амино-5-метил[1,2,4]триазоло[1,5-a]пиримидин-6-ил)этинил]-4-гидроксициклогексил}метилацетат
Целевое соединение получали согласно процедурам, описанным в Примере 4B, заменяя 1-этинилциклопентанол, используемый в Примере 4B, Примером 39A. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,45 (с, 1Н), 8,18 (ушир.с, 2H), 3,58 (с, 3H), 2,53 (с, 3H), 2,27-22,0 (м, 2H), 2,02-1,94 (м, 2H), 1,77-1,65 (м, 3H), 1,58-1,45 (м, 2H), 1,40-1,24 (м, 2H). MS (ESI) m/z 344 (M+H)+.
Пример 40
(1R,4S)-2-[(7-амино-5-метил[1,2,4]триазоло[1,5-a]пиримидин-6-ил)этинил]бицикло[2,2,1]гептан-2-ол
Пример 40A
(1R,4S)-2-этинилбицикло[2,2,1]гептан-2-ол
Целевое соединение получали согласно процедурам, описанным в Примере 6A, заменяя тетрагидро-4H-пиран-4-он, используемый в Примере 6A, норкамфорой.
Пример 40B
(1R,4S)-2-[(7-амино-5-метил[1,2,4]триазоло[1,5-a]пиримидин-6-ил)этинил]бицикло[2,2,1]гептан-2-ол
Целевое соединение получали согласно процедурам, описанным в Примере 4B, заменяя 1-этинилциклопентанол, используемый в Примере 4B, Примером 40A. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,43 (с, 1Н), 8,16 (ушир.с, 2H), 5,45 (ушир.с, 1Н), 2,51 (с, 3H), 2,42-2,37 (м, 1Н), 2,25-2,10 (м, 2H), 2,04-1,92 (м, 1Н), 1,80-1,73 (м, 1Н), 1,59-1,45 (м, 1Н), 1,39-1,18 (м, 3H). MS (ESI) m/z 284 (M+H)+.
Пример 41
(1R,2S,4R)-2-[(7-амино-5-метил[1,2,4]триазоло[1,5-a]пиримидин-6-ил)этинил]-1,7,7-триметилбицикло[2,2,1]гептан-2-ол
Пример 41 A
(1R,2S,4R)-2-этинил-1,7,7-триметилбицикло[2,2,1]гептан-2-ол
Целевое соединение получали согласно процедурам, описанным в Примере 6A, заменяя тетрагидро-4H-пиран-4-он, используемый в Примере 6A, R-(+)-камфорой.
Пример 41B
(1R,2S,4R)-2-[(7-амино-5-метил[1,2,4]триазоло[1,5-a]пиримидин-6-ил)этинил]-1,7,7-триметилбицикло[2,2,1]гептан-2-ол
Целевое соединение получали согласно процедурам, описанным в Примере 4B, заменяя 1-этинилциклопентанол, используемый в Примере 4B, Примером 41A. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,43 (с, 1Н), 8,23 (ушир.с, 2H), 5,55 (с, 1Н), 2,50 (с, 3H), 2,50 (с, 3H), 2,24-2,14 (м, 2H), 1,96-1,83 (м, 3H), 1,78-1,63 (м, 3H), 1,54-1,41 (м, 2H), 1,20-1,09 (м, 2H), 1,08 (с, 3H), 0,93 (с, 3H), 0,86 (с, 3H). MS (ESI) m/z 326 (M+H)+.
Пример 42
(1R,2R,4S)-2-[(7-амино-5-метил[1,2,4]триазоло[1,5-a]пиримидин-6-ил)этинил]-1,3,3-триметилбицикло[2,2,1]гептан-2-ол
Пример 42A
(1R,2S,4S)-2-этинил-l,3,3-триметилбицикло[2,2,1]гептан-2-ол
Целевое соединение получали согласно процедурам, описанным в Примере 6A, заменяя тетрагидро-4H-пиран-4-он, используемый в Примере 6A, (1R)-(-)-фенхоном.
Пример 42B
(1R,2R,4S)-2-[(7-амино-5-метил[1,2,4]триазоло[1,5-a]пиримидин-6-ил)этинил]-1,3,3-триметилбицикло[2,2,1]гептан-2-ол
Целевое соединение получали согласно процедурам, описанным в Примере 4B, заменяя 1-этинилциклопентанол, используемый в Примере 4B, Примером 42A. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,43 (с, 1Н), 8,15 (ушир.с, 2H), 5,30 (с, 1Н), 2,52 (с, 3H), 2,02-1,90 (м, 1Н), 1,78-1,59 (м, 4H), 1,46-1,31 (м, 1Н), 1,19 (с, 3H), 1,14 (с, 3H), 1,12-1,04 (м, 1Н), 0,94 (с, 3H). MS (ESI) m/z 326 (M+H)+.
Пример 43
{4-[(7-амино-5-метил[1,2,4]триазоло[1,5-a]пиримидин-6-ил)этинил]-4-гидроксициклогексил}трет-бутилацетат
Пример 43A
2-(4-этинил-4-гидроксициклогексил)трет-бутилацетат
Целевое соединение получали согласно процедурам, описанным в Примере 6A, заменяя тетрагидро-4H-пиран-4-он, используемый в Примере 6A, трет-бутиловым эфиром (4-оксо-циклогексил)-уксусной кислоты (полученным, как описано в Suemune, Hiroshi; Oda, Kozo; Sakai, Kiyoshi; Tetrahedron Lett.; 28; 29; 1987; 3373-3376).
Пример 43B
{4-[(7-амино-5-метил[1,2,4]триазоло[1,5-a]пиримидин-6-ил)этинил]-4-гидроксициклогексил}трет-бутилацетат
Целевое соединение получали согласно процедурам, описанным в Примере 4B, заменяя 1-этинилциклопентанол, используемый в Примере 4B, Примером 43А. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,43 (с, 1Н), 8,18 (ушир.с, 2H), 5,65 (с, 1Н), 2,50 (с, 3H), 2,14-2,08 (м, 2H), 2,03-1,94 (м, 2H), 1,77-1,65 (м, 3H), 1,58-1,45 (м, 2H), 1,40-1,28 (м, 2H), 1,39 (с, 9H). MS (ESI) m/z 386 (M+H)+.
Пример 44
(1S,2S,4R)-2-[(7-амино-5-метил[1,2,4]триазоло[1,5-a]пиримидин-6-ил)этинил]-1,3,3-триметилбицикло[2,2,1]гептан-2-ол
Пример 44A
(1S,2S,4R)-2-этинил-1,3,3-триметилбицикло[2,2,1]гептан-2-ол
Целевое соединение получали согласно процедурам, описанным в Примере 6A, заменяя тетрагидро-4H-пиран-4-он, используемый в Примере 6A, (1S)-(+)-фенхоном.
Пример 44B
(1S,2S,4R)-2-[(7-амино-5-метил[1,2,4]триазоло[1,5-a]пиримидин-6-ил)этинил]-1,3,3-триметилбицикло[2,2,1]гептан-2-ол
Целевое соединение получали согласно процедурам, описанным в Примере 4B, заменяя 1-этинилциклопентанол, используемый в Примере 4B, Примером 44A. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,43 (с, 1Н), 8,15 (ушир.с, 2H), 5,30 (с, 1Н), 2,52 (с, 3H), 2,02-1,90 (м, 1Н), 1,78-1,59 (м, 4H), 1,46-1,31 (м, 1Н), 1,19 (с, 3H), 1,14 (с, 3H), 1,12-1,04 (м, 1Н), 0,94 (с, 3H). MS (ESI) m/z 326 (M+H)+.
Пример 45
(1S,2R,4S)-2-[(7-амино-5-метил[1,2,4]триазоло[1,5-a]пиримидин-6-ил)этинил]-1,7,7-триметилбицикло[2,2,1]гептан-2-ол
Пример 45A
(1S,2R,4S)-2-этинил-1,7,7-триметилбицикло[2,2,1]гептан-2-ол
Целевое соединение получали согласно процедурам, описанным в Примере 6A, заменяя тетрагидро-4H-пиран-4-он, используемый в Примере 6A, S-(-)-камфорой.
Пример 45B
(1S,2R,4S)-2-[(7-амино-5-метил[1,2,4]триазоло[1,5-a]пиримидин-6-ил)этинил]-1,7,7-триметилбицикло[2,2,1]гептан-2-ол
Целевое соединение получали согласно процедурам, описанным в Примере 4B, заменяя 1-этинилциклопентанол, используемый в Примере 4B, Примером 45А. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,43 (с, 1Н), 8,23 (ушир.с, 2H), 5,55 (с, 1Н), 2,50 (с, 3H), 2,50 (с, 3H), 2,24-2,14 (м, 2H), 1,96-1,83 (м, 3H), 1,78-1,63 (м, 3H), 1,54-1,41 (м, 2H), 1,20-1,09 (м, 2H), 1,08 (с, 3H), 0,93 (с, 3H), 0,86 (с, 3H). MS (ESI) m/z 326 (M+H)+.
Пример 46
1-[3-(7-амино-5-метил[1,2,4]триазоло[1,5-a]пиримидин-6-ил)проп-2-инил]циклопентанол
Пример 46A
1-(проп-2-инил)циклопентанол
Магниевую стружку (350 мг, 14,4 ммоль) и HgCl2 (16 мг, 0,059 ммоль) перемешивали с 20 мл безводного простого диэтилового эфира в круглодонной колбе на 100 мл. Добавляли пропаргилбромид (80% в ксилоле, 2,5 мл, 13,2 ммоль). Смесь перемешивали в течение 30 минут при температуре окружающей среды, после чего добавляли циклопентанон (1,0 г, 11,9 ммоль) в 10 мл тетрагидрофурана. Полученную смесь нагревали с обратным холодильником в течение 2 часов, затем давали охлаждаться до температуры окружающей среды и гасили насыщенным водным раствором хлорида аммония (15 мл). Бифазную смесь экстрагировали этилацетатом (50 мл), и органический слой промывали солевым раствором, высушивали над Na2SO4, фильтровали и концентрировали в вакууме. Остаток очищали флэш-хроматографией на силикагеле (элюируя с 10% гексанов в этилацетате), получая целевое соединение (800 мг, 54%) в форме бесцветного масла.
Пример 46B
1-[3-(7-амино-5-метил[1,2,4]триазоло[1,5-a]пиримидин-6-ил) проп-2-инил]циклопентанол
Целевое соединение получали согласно процедурам, описанным в Примере 4B, заменяя 1-этинилциклопентанол, используемый в Примере 4B, Примером 46A. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,41 (с, 1Н), 8,15 (ушир.с, 2H), 4,68 (с, 1Н), 2,75 (с, 2H), 2,50 (с, 3H), 1,80-1,52 (м, 8H). MS (ESI) m/z 272 (M+H)+.
Пример 47
1-[(7-амино[1,2,4]триазоло[1,5-a]пиримидин-6-ил)этинил]циклопентанол
Целевое соединение получали согласно процедурам, описанным в Примере 4B, заменяя Пример 4A, используемый в Примере 4B, коммерчески доступным 6-бром-[1,2,4]триазоло[1,5-α]пиримидин-7-амином. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,50 (с, 1Н), 8,40 (ушир.с, 2H), 8,32 (с, 1Н), 5,34 (с, 1Н), 2,50 (с, 3H), 2,07-1,63 (м, 8H). MS (ESI) m/z 244 (M+H)+.
Пример 48
1-[3-(7-амино[1,2,4]триазоло[1,5-a]пиримидин-6-ил)проп-2-инил]циклопентанол
Целевое соединение получали согласно процедурам, описанным в Примере 4B, заменяя Пример 4A коммерчески доступным 6-бром-[1,2,4]триазоло[1,5-α]пиримидин-7-амином, и заменяя 1-этинилциклопентанол, используемый в Примере 4B, Примером 46A. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,49 (с, 1Н), 8,35 (ушир.с, 2H), 8,34 (с, 1Н), 4,68 (с, 1Н), 2,71 (с, 2H), 2,50 (с, 3H), 1,80-1,53 (м, 8H). MS (ESI) m/z 258 (M+H)+.
Пример 49
(1R,2S,4R)-2-[3-(7-амино-5-метил[1,2,4]триазоло[1,5-a]пиримидин-6-ил)проп-2-инил]-1,7,7-триметилбицикло[2,2,1]гептан-2-ол
Пример 49A
(1R,2S,4R)-1,7,7-триметил-2-(проп-2-инил)бицикло[2,2,1]гептан-2-ол
Целевое соединение получали согласно процедурам, описанным в Примере 46A, заменяя циклопентанон, используемый в Примере 46A, R-(+)-камфорой.
Пример 49B
(1R,2S,4R)-2-[3-(7-амино-5-метил[1,2,4]триазоло[1,5-a]пиримидин-6-ил)проп-2-инил]-1,7,7-триметилбицикло[2,2,1]гептан-2-ол
Целевое соединение получали согласно процедурам, описанным в Примере 4B, заменяя 1-этинилциклопентанол, используемый в Примере 4B, Примером 49A. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,41 (с, 1Н), 8,14 (ушир.с, 2H), 4,56 (с, 1Н), 2,73 (с, 2H), 2,53 (с, 3H), 2,01-1,90 (м, 1Н), 1,73-1,59 (м, 2H), 1,52-1,32 (м, 3H), 1,09 (с, 3H), 1,16-1,02 (м, 1Н), 0,91 (с, 3H), 0,82 (с, 3H). MS (ESI) m/z 340 (M+H)+.
Пример 50
1-[3-(7-амино-5-метил[1,2,4]триазоло[1,5-a]пиримидин-6-ил)проп-2-инил]циклогексанметилкарбоксилат
Пример 50A
1-(проп-2-инил)циклогексанметилкарбоксилат
К раствору диизопропиламина (879 мкл, 6,22 ммоль) в безводном тетрагидрофуране (12 мл) при -40°C под азотом добавляли 1,6 М н-бутиллития в гексане (3,9 мл, 6,22 ммоль), с последующим добавлением гексаметилфосфорамида (4 мл). Смесь охлаждали до -78°C и добавляли раствор циклогексанметилкарбоксилата (807 мкл, 5,65 ммоль) в тетрагидрофуране (4 мл), постоянно поддерживая температуру ниже -70°C. Через 15 минут добавляли пропаргилбромид (80% вес./вес. в ксилоле, 2,5 мл, 22,6 ммоль), и реакционной смеси давали нагреться до температуры окружающей среды. Через 30 минут ее гасили насыщенным раствором хлорида аммония и экстрагировали этилацетатом. Органическую фазу промывали водой (×4), высушивали над MgSO4, фильтровали и концентрировали, получая 900 мг промежуточного соединения в форме светло-коричневого масла.
Пример 50B
1-[3-(7-амино-5-метил[1,2,4]триазоло[1,5-a]пиримидин-6-ил)проп-2-инил]циклогексанметилкарбоксилат
Смесь Примера 4A (28 мг, 0,1 ммоль), Примера 50A (36 мг, 0,2 ммоль), бис(трифенилфосфин)палладий (II) дихлорида (3,5 мг, 0,005 ммоль), CuI (1 мг, 0,005 ммоль) и триэтиламина (28 мкл, 0,2 ммоль) в ацетонитриле (500 мкл) нагревали в герметизированной трубке под азотом при 90°C на масляной бане в течение 3 часов. Полученную смесь очищали ВЭЖХ с обратной фазой (колонка C-18, элюируя с градиентом 5-100% CH3CN в 10 мМ водного раствора ацетата аммония), получая целевое соединение в форме твердого вещества светло-розового цвета (8 мг, 24%-ый выход). 1H ЯМР (300 МГц, ДМСО-d6) δ 8,41 (с, 1H), 8,10 (с, 2H), 3,67 (с, 3H), 2,48 (с, 3H), 2,73 (с, 2H), 2,00-2,15 (м, 2H), 1,17-1,68 (м, 8H). MS (ESI) m/z 328 (M+H)+.
Пример 51
6-[3-(4-метоксифенокси)бут-1-инил]-5-метил[1,2,4]триазоло[1,5-a]пиримидин-7-амин
Целевое соединение получали согласно процедурам, описанным в Примере 50B, заменяя Пример 50A 1-(бут-3-ин-2-илокси)-4-метоксибензолом (полученным, как описано в Harfenist; J. Org. Chem.; 37; 1972; 841). 1H ЯМР (300 МГц, ДМСО-d6) δ 8,42 (с, 1H), 8,28 (с, 2H), 7,05-7,08 (м, 2H), 6,81-6,92 (м, 2H), 5,27 (кв, J=6,44 Гц, 3H), 3,70 (с, 3H), 2,38 (с, 3H), 1,69 (д, J=6,44 Гц, 3H). MS (ESI) m/z 324 (M+H)+.
Пример 52
(1R)-3-(7-амино-5-метил[1,2,4]триазоло[1,5-a]пиримидин-6-ил)-1-фенилпроп-2-ин-1-ол
Целевое соединение получали согласно процедурам, описанным в Примере 4B, заменяя 1-этинилциклопентанол, используемый в Примере 4B, коммерчески доступным (S)-1-фенил-2-пропин-1-олом. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,43 (с, 1Н), 8,28 (ушир.с, 2H), 7,60-7,55 (м, 2H), 7,44-7,36 (м, 3H), 7,34-7,27 (м, 1Н), 6,08 (д, J=6,1 Гц, 1Н), 5,68 (д, J=6,1 Гц, 1Н), 2,50 (с, 3H). MS (ESI) m/z 280 (M+H)+.
Пример 53
(1S)-3-(7-амино-5-метил[1,2,4]триазоло[1,5-a]пиримидин-6-ил)-1-фенилпроп-2-ин-1-ол
Целевое соединение получали согласно процедурам, описанным в Примере 4B, заменяя 1-этинилциклопентанол, используемый в Примере 4B, коммерчески доступным (R)-1-фенил-2-пропин-1-олом. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,43 (с, 1Н), 8,28 (ушир.с, 2H), 7,60-7,55 (м, 2H), 7,44-7,36 (м, 3H), 7,34-7,27 (м, 1Н), 6,08 (д, J=6,1 Гц, 1Н), 5,68 (д, J=6,1 Гц, 1Н), 2,50 (с, 3H). MS (ESI) m/z 280 (M+H)+.
Пример 54
4-(7-амино-5-метил[1,2,4]триазоло[1,5-a]пиримидин-6-ил)-1-фенилбут-3-ин-1-ол
Целевое соединение получали, как описано в Примере 50B, заменяя Пример 50A 1-фенил-3-бутин-1-олом. 1Н ЯМР (300 МГц, ДМСО-d6) δ 8,40 (с, 1H), 8,09 (с, 2H), 7,20-7,49 (м, 5H), 5,67 (д, J=4,07 Гц, 1H), 4,75-4,97 (м, 1H), 2,89 (дд, J=6,27, 1,53 Гц, 2H), 2,35 (с, 3H). MS (ESI) m/z 294 (M+H)+.
Пример 55
(транс)-2-[3-(7-амино-5-метил[1,2,4]триазоло[1,5-α]пиримидин-6-ил)-1-гидроксипроп-2-инил]циклопропанэтилкарбоксилат
Пример 55A
(транс)-2-(-1-гидроксипроп-2-инил)циклопропанэтилкарбоксилат
Раствор 2-формил-1-циклопропанэтилкарбоксилата (преимущественно транс, 331 мкл, 2,5 ммоль) в тетрагидрофуране (5 мл) охлаждали до -70°C. К указанному раствору под атмосферой азота по каплям добавляли этинилмагнийбромид (0,5 М в тетрагидрофуране, 5 мл, 2,5 ммоль) и перемешивали при -70°C в течение 1 часа. Реакционную смесь гасили водой и экстрагировали этилацетатом. Органическую фазу промывали солевым раствором, высушивали над MgSO4, фильтровали и концентрировали, получая 419 мг целевого соединения (выход 100%, неочищенным) в форме светло-желтого масла.
Пример 55B
(транс)-2-[3-(7-амино-5-метил[1,2,4]триазоло[1,5-α]пиримидин-6-ил)-1-гидроксипроп-2-инил]циклопропанэтилкарбоксилат
Смесь Примера 4A (28 мг, 0,1 ммоль), Примера 55A (20 мг, 0,12 ммоль), бис(трифенилфосфин)палладий (II) дихлорида (3,5 мг, 0,005 ммоль), CuI (1 мг, 0,005 ммоль) и триэтиламина (28 мкл, 0,2 ммоль) в ацетонитриле (500 мкл) нагревали в герметизированной трубке под атмосферой азота при 90°C на масляной бане в течение 1,5 часов. Полученную смесь разделяли между этилацетатом и водой. Органическую фазу промывали солевым раствором, высушивали (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали флэш-хроматографией на силикагеле (элюируя этилацетатом), получая целевое соединение в форме твердого вещества белого цвета (2 мг, 6%-ый выход). 1H ЯМР (500 МГц, ДМСО-d6) δ 8,43 (с, 1H), 8,26 (с, 2H), 5,67 (дд, J=13,73, 6,10 Гц, 1H), 4,39-4,65 (м, 1H), 4,07 (кв, J=7,02 Гц, 2H), 2,47 (с, 3H), 1,69-1,86 (м, 2H), 1,19 (т, J=7,02 Гц, 2H), 1,03-1,14 (м, 2H). MS (ESI) m/z 316 (M+H)+.
Пример 56
1-[3-(7-амино-5-метил[1,2,4]триазоло[1,5-α]пиримидин-6-ил)проп-2-инил]циклогексанкарбоновая кислота
К раствору Примера 69 (83 мг, 0,2 ммоль) в тетрагидрофуране (2 мл) добавляли тетрабутиламмоний фторид (1M в тетрагидрофуране, 500 мкл, 0,5 ммоль) при температуре окружающей среды и перемешивали при температуре окружающей среды в течение 24 часов. Реакционную смесь гасили 2н. HCl (3 мл). Через 5 минут устанавливали pH ~4-5 с помощью насыщенного раствора NaHCO3, смесь разделяли между этилацетатом и водой. Органическую фазу промывали солевым раствором, высушивали (MgSO4), фильтровали и концентрировали в вакууме, получая целевое соединение в форме твердого вещества грязно-белого цвета (63 мг, 100%). 1H ЯМР (300 МГц, ДМСО-D6) δ 12,53 (с, 1H), 8,40 (с, 1H), 8,09 (с, 2H), 2,70 (с, 2H), 2,49 (с, 3H), 2,01-2,14 (м, 2H), 1,20-1,65 (м, 8H). MS (ESI) m/z 314 (M+H)+.
Пример 57
1-[(7-амино-5-этил[1,2,4]триазоло[1,5-α]пиримидин-6-ил)этинил]циклопентанол
Пример 57A
5-этил-[1,2,4]триазоло[1,5-a]пиримидин-7-амин
Смесь 3-оксопентаннитрила (1,0 г, 10,3 ммоль) и 3-амино-1,2,4-триазола (0,91 г, 10,8 ммоль) в 10 мл уксусной кислоты нагревали в закрытой пробирке при 150°C в течение 24 ч. Реакционной смеси давали охладиться до температуры окружающей среды, и растворитель удаляли в вакууме. Твердое вещество удаляли фильтрацией. Фильтрат частично затвердевал при отстаивании при температуре окружающей среды, и твердое вещество собирали фильтрацией, получая целевое соединение (200 мг, 12%-ый выход).
Пример 57B
5-этил-6-йод-[1,2,4]триазоло[1,5-a]пиримидин-7-амин
Целевое соединение получали согласно процедурам, описанным в Примере 4A, заменяя 5-метил[1,2,4]триазоло[1,5-α]пиримидин-7-амин, используемый в Примере 4A, Примером 57A.
Пример 57C
1-[(7-амино-5-этил[1,2,4]триазоло[1,5-α]пиримидин-6-ил)этинил]циклопентанол
Целевое соединение получали согласно процедурам, описанным в Примере 4B, заменяя Пример 4A, используемый в Примере 4B, Примером 57B. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,44 (с, 1Н), 8,12 (ушир.с, 2H), 5,37 (с, 1Н), 2,84 (кв, J=7,5 Гц, 2H), 2,05-1,62 (м, 8H), 1,24 (т, J=7,5 Гц, 3H). (MS (ESI) m/z 272 (M+H)+.
Пример 58
3-(7-амино-5-метил[1,2,4]триазоло[1,5-α]пиримидин-6-ил)-1-фенилпроп-2-ин-1-он
Пример 11 (35 мг, 0,153 ммоль) суспендировали в 1,0 мл CH2Cl2. Затем добавляли реактив Десса-Мартина (100 мг, 0,235 ммоль). Полученную молочную смесь перемешивали при температуре окружающей среды в течение 5 часов. Растворитель удаляли в вакууме, остаток суспендировали в смеси ДМСО/метанол (1,5 мл, 1:1, об./об.) и фильтровали через целит. Фильтрат очищали, используя ВЭЖХ с обратной фазой (колонка C-18, элюируя с градиентом 5-100% CH3CN в 10 мМ ацетата аммония (водный раствор)), получая целевое соединение (5 мг, 14%). 1H ЯМР (300 МГц, ДМСО-d6) δ 8,84 (ушир.с, 2H), 8,50 (с, 1Н), 8,25-8,18 (м, 2H), 7,79-7,58 (м, 3H), 2,67 (с, 3H). MS (ESI) m/z 278 (M+H)+.
Пример 59
2-{3-[3-(7-амино-5-метил[1,2,4]триазоло[1,5-α]пиримидин-6-ил)-1-гидрокси-1-метилпроп-2-инил]- 2,2-диметилциклобутил}ацетамид
Пример 59A
2-(3-(2-гидроксибут-3-ин-2-ил)-2,2-диметилциклобутил)ацетамид
К смеси Примера 29A (84 мг, 0,4 ммоль), хлорида аммония (32 мг, 0,6 ммоль), O-(бензотриазол-1-ил)-N,N,N',N'-тетраметилуроний тетрафторбората (154 мг, 0,48 ммоль) в N,N-диметилформамиде добавляли N,N-диизопропилэтиламин (348 мкл, 2,0 ммоль). Реакционную смесь перемешивали при температуре окружающей среды в течение ночи. Ее разделяли между этилацетатом и насыщенным NaHCO3. Органическую фазу промывали дважды солевым раствором, высушивали (MgSO4), фильтровали и концентрировали в вакууме, получая промежуточное соединение в форме твердого вещества белого цвета (50 мг, 60%-ый выход).
Пример 59B
2-{3-[3-(7-амино-5-метил[1,2,4]триазоло[1,5-α]пиримидин-6-ил)-1-гидрокси-1-метилпроп-2-инил]-2,2-диметилциклобутил}ацетамид
Целевое соединение получали, как описано в Примере 29B, заменяя Пример 29A Примером 59A. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,43 (с, 1H), 7,94 (с, 2H), 7,18 (с, 1H), 6,61 (с, 1H), 5,30 (с, 1H), 2,52 (с, 3H), 1,79-2,15 (м, 5H), 1,58-1,75 (м, 1H), 1,42 (с, 3H), 1,13 (с, 3H), 1,10 (с, 3H). MS (ESI) m/z 357 (M+H)+.
Пример 60
(1R,2S,4R)-2-[(7-амино-5-этил[1,2,4]триазоло[1,5-α]пиримидин-6-ил)этинил]-1,7,7-триметилбицикло[2,2,1]гептан-2-ол
Целевое соединение получали согласно процедурам, описанным в Примере 4B, заменяя Пример 4A Примером 57B, и заменяя 1-этинилциклопентанол, используемый в Примере 4B, продуктом Примера 41А. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,44 (с, 1Н), 8,18 (ушир.с, 2H), 5,57 (с, 1Н), 2,83 (кв, J=7,5 Гц, 2H), 2,29-2,14 (м, 1Н), 1,96-1,82 (м, 2H), 1,78-1,64 (м, 2H), 1,55-1,41 (м, 1Н), 1,24 (т, J=7,5 Гц, 3H), 1,18-1,09 (м, 1Н), 1,08 (с, 3H), 0,93 (с, 3H), 0,86 (с, 3H). MS (ESI) m/z 340 (M+H)+.
Пример 61
1-[(7-амино-5-метил[1,2,4]триазоло[1,5-α]пиримидин-6-ил)этинил]циклогептанол
Целевое соединение получали согласно процедурам, описанным в Примере 4B, заменяя 1-этинилциклопентанол, используемый в Примере 4B, коммерчески доступным 1-этинилциклогепентанолом. 1Н ЯМР (300 МГц, ДМСО-d6) δ 8,42 (с, 1Н), 8,15 (ушир.с, 2H), 5,41 (с, 1Н), 2,50 (с, 3H), 2,08-1,97 (м, 2H), 1,87-1,76 (м, 2H), 1,71-1,46 (м, 8H). MS (ESI) m/z 286 (M+H)+.
Пример 62
{[3-(7-амино-5-метил[1,2,4]триазоло[1,5-α]пиримидин-6-ил)-1-циклопентилпроп-2-инил]окси}уксусная кислота
К перемешиваемому раствору Примера 35B (20 мг, 0,074 ммоль) в 0,5 мл безводного N,N-диметилформамида добавляли NaH (60%, 4,0 мг, 0,096 ммоль). Полученную смесь перемешивали в течение 20 минут, после чего добавляли трет-бутилбромацетат (11 мкл, 0,074 ммоль), и перемешивание продолжали в течение 2 часов. Реакционную смесь затем разделяли между этилацетатом (10 мл) и солевым раствором (10 мл), органический слой высушивали над MgSO4, фильтровали, упаривали досуха в вакууме. Остаток обрабатывали 1,0 мл 4н. HCl в 1,4-диоксане в течение 3 часов. Органический растворитель затем удаляли на роторном испарителе, и остаток очищали, используя ВЭЖХ с обратной фазой (колонка C-18, элюируя с градиентом 5-100% CH3CN в 10 мМ ацетата аммония (водный раствор)), получая целевое соединение (5 мг, 21%-ый выход). 1H ЯМР (300 МГц, ДМСО-d6) δ 8,45 (с, 1Н), 8,15 (ушир.с, 2H), 4,79-4,60 (м, 2H), 4,34 (д, J=7,1 Гц, 1Н), 2,54 (с, 3H), 2,25-2,15 (м, 1Н), 1,81-1,38 (м, 8H). MS (ESI) m/z 330 (M+H)+.
Пример 63
({1-[(7-амино-5-метил[1,2,4]триазоло[1,5-α]пиримидин-6-ил)этинил]циклопентил}окси)уксусная кислота
Целевое соединение получали согласно процедурам, описанным в Примере 62, заменяя Пример 35B Примером 4B. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,46 (с, 1Н), 8,36 (ушир.с, 2H), 6,27-6,23 (м, 1Н), 3,91 (с, 1Н), 2,52 (с, 3H), 2,60-2,39 (м, 4H), 1,97-1,86 (м, 4H). MS (ESI) m/z 298 (М-H2O)+.
Пример 64
3-(7-амино-5-метил[1,2,4]триазоло[1,5-α]пиримидин-6-ил)-1-циклогексилпроп-2-ин-1-ол
Пример 64A
1-циклогексилпроп-2-ин-1-ол
Целевое соединение получали согласно процедурам, описанным в Примере 6A, заменяя тетрагидро-4H-пиран-4-он, используемый в Примере 6A, циклогексан карбоксальдегидом.
Пример 64B
3-(7-амино-5-метил[1,2,4]триазоло[1,5-α]пиримидин-6-ил)-1-циклогексилпроп-2-ин-1-ол
Целевое соединение получали, как описано в Примере 4B, заменяя 1-этинилциклопентанол, используемый в Примере 4B, Примером 64A. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,43 (с, 1H), 8,19 (с, 2H), 5,30 (д, J=5,09 Гц, 1H), 4,39-4,24 (м, 1H), 2,52 (с, 3H), 2,01-0,96 (м, 11H). MS (ESI) m/z 286 (M+H)+.
Пример 65
4-[3-(7-амино-5-метил[1,2,4]триазоло[1,5-α]пиримидин-6-ил)-1-гидроксипроп-2-инил]циклогексанметилкарбоксилат
Пример 65A
4-формилциклогексанметилкарбоксилат
4-гидроксиметил-1-циклогексанкарбоновую кислоту (1,58 г, 10 ммоль) растворяли в насыщенном растворе HCl в метаноле (20 мл). Этот раствор нагревали в масляной бане (70-80°C) в течение 3 часов. Реакционную смесь концентрировали в вакууме и упаривали совместно с этилацетатом, получая 1,8 г масла (> 100%). Половину этой загрузки (~5 ммоль) в тетрагидрофуране (15 мл) обрабатывали перйодатом Десса-Мартина (2,8 г, 6,6 ммоль) при температуре окружающей среды в течение 1 часа. Полученную смесь концентрировали и очищали флэш-хроматографией на силикагеле (элюируя с 20-40% этилацетата в Гексане), получая целевое соединение в форме бесцветного масла (540 мг, 64%-ый выход).
Пример 65B
4-(1-гидроксипроп-2-инил)циклогексанметилкарбоксилат
Целевое соединение получали согласно процедурам, описанным в Примере 6A, заменяя тетрагидро-4H-пиран-4-он, используемый в Примере 6A, Примером 65А.
Пример 65С
4-[3-(7-амино-5-метил[1,2,4]триазоло[1,5-α]пиримидин-6-ил)-1-гидроксипроп-2-инил]циклогексанметилкарбоксилат
Целевое соединение получали, как описано в Примере 4B, заменяя 1-этинилциклопентанол, используемый в Примере 4B, Примером 65B. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,43 (с, 1H), 8,00 (с, 2H), 5,33 (д, J=4,41 Гц, 1H), 4,30-4,44 (м, 1H), 3,60 (с, 3H), 2,60-2,72 (м, 1H), 2,49 (с, 3H), 1,21-2,15 (м, 9H). MS (ESI) m/z 344 (M+H)+.
Пример 66
4-[3-(7-амино-5-метил[1,2,4]триазоло[1,5-α]пиримидин-6-ил)-1-гидроксипроп-2-инил]циклогексанкарбоновая кислота
К раствору Примера 65C (26,5 мг, 0,077 ммоль) в смеси тетрагидрофуран (0,5 мл)/метанол (0,5 мл) добавляли 2н. NaOH (77 мкл, 0,154 ммоль). Реакционную смесь перемешивали при температуре окружающей среды в течение ночи и нейтрализовали 2н. HCl (0,154 ммоль). Эту смесь очищали ВЭЖХ с обратной фазой (колонка C-18, элюируя с градиентом 5-100% CH3CN в 10 мМ ацетата аммония (водный раствор)), получая целевое соединение в форме твердого вещества белого цвета (10 мг, 40%-ый выход). 1H ЯМР (300 МГц, ДМСО-d6) δ 8,42 (с, 1H), 8,31 (с, 2H), 5,31 (с, 1H), 4,37 (д, J=5,43 Гц, 1H), 2,49 (с, 3H), 2,48-2,50 (м, 1H), 1,26-2,13 (м, 9H). MS (ESI) m/z 330 (M+H)+.
Пример 67
{3-[3-(7-амино-5-метил[1,2,4]триазоло[1,5-α]пиримидин-6-ил)-1-метиленпроп-2-инил]-2,2-диметилциклобутил}уксусная кислота
Пример 67A
2-(3-(бут-1-ен-3-ин-2-ил)-2,2-диметилциклобутил)уксусная кислота
К перемешиваемому раствору Примера 29A (253 мг, 1,2 ммоль) в 5 мл CH2Cl2 добавляли триэтилсилан (250 мкл, 1,6 ммоль) с последующим добавлением трифторуксусной кислоты (116 мкл, 1,6 ммоль). Полученную смесь перемешивали при температуре окружающей среды в течение ночи. Летучие органические компоненты удаляли в вакууме, и остаток выпаривали с толуолом (2×10 мл). Полученное целевое соединение использовали без дальнейшей очистки.
Пример 67B
{3-[3-(7-амино-5-метил[1,2,4]триазоло[1,5-α]пиримидин-6-ил)-1-метиленпроп-2-инил]-2,2-диметилциклобутил}уксусная кислота
Целевое соединение получали согласно процедурам, описанным в Примере 4B, заменяя 1-этинилциклопентанол, используемый в Примере 4B, Примером 67A. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,42 (с, 1Н), 7,86 (ушир.с, 2H), 6,07-5,96 (м, 2H), 2,67-2,11 (м, 5H), 2,52 (с, 3H), 1,94-1,87 (м, 1Н), 1,41 (с, 3H), 1,26 (с, 3H). MS (ESI) m/z 340 (M+H)+.
Пример 68
1-[3-(7-амино-5-метил[1,2,4]триазоло[1,5-α]пиримидин-6-ил)проп-2-инил]циклопентанметилкарбоксилат
Пример 68A
1-(проп-2-инил)циклопентанметилкарбоксилат
Целевое соединение получали согласно процедурам, описанным в Примере 50A, заменяя циклогексанметилкарбоксилат циклопентанметилкарбоксилатом.
Пример 68B
1-[3-(7-амино-5-метил[1,2,4]триазоло[1,5-α]пиримидин-6-ил) проп-2-инил]циклопентанметилкарбоксилат
Целевое соединение получали, как описано в Примере 4B, заменяя 1-этинилциклопентанол, используемый в Примере 4B, Примером 68A. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,40 (с, 1H), 8,13 (с, 2H), 3,66 (с, 3H), 2,82 (с, 2H), 2,46 (с, 3H), 1,96-2,17 (м, 2H), 1,54-1,83 (м, 6H). MS (ESI) m/z 314 (M+H)+.
Пример 69
1-[3-(7-амино-5-метил[1,2,4]триазоло[1,5-α]пиримидин-6-ил) проп-2-инил]циклогексан-2-(триметилсилил)этилкарбоксилат
Пример 69A
Циклогексан-2-(триметилсилил)этилкарбоксилат
К смеси циклогексанкарбоновой кислоты (1,28 г, 10 ммоль), 2-(триметилсилил)этанола (1,3 г, 11 ммоль), 1-этил-3-[3-(диметиламино)пропил]-карбодиимида гидрохлорида (2,11 г, 11 ммоль) в дихлорметане добавляли 4-диметиламинопиридин (123 мг, 1,0 ммоль). Реакционную смесь перемешивали при температуре окружающей среды в течение 3 дней. Ее разделяли между этилацетатом и 2н. HCl. Органическую фазу промывали солевым раствором, насыщенным NaHCO3, солевым раствором, высушивали над MgSO4, фильтровали и концентрировали в вакууме. Остаток очищали флэш-хроматографией на силикагеле (элюируя с 0-20% этилацетата в гексане), получая целевое соединение в форме бесцветного масла (1,7 г, 75%-ый выход).
Пример 69B
1-(проп-2-инил)циклогексан-2-(триметилсилил)этилкарбоксилат
Целевое соединение получали, как описано в Примере 50A, заменяя циклогексанметилкарбоксилат, используемый в Примере 50A, Примером 69А (выход 39%).
Пример 69C
1-[3-(7-амино-5-метил[1,2,4]триазоло[1,5-α]пиримидин-6-ил)проп-2-инил]циклогексан-2-(триметилсилил)этилкарбоксилат
Целевое соединение получали, как описано в Примере 4B, заменяя 1-этинилциклопентанол, используемый в Примере 4B, Примером 69B (выход 39%). 1H ЯМР (300 МГц, ДМСО-d6) δ 8,39 (с, 1H), 8,10 (с, 2H), 4,07-4,20 (м, 2H), 2,70 (с, 2H), 2,47 (с, 3H), 2,00-2,18 (м, 2H), 1,19-1,67 (м, 8H), 0,86-0,99 (м, 2H),-0,01 (с, 9H). MS (ESI) m/z 414 (M+H)+.
Пример 70
6-[(4-бромфенил)этинил]-5-метил[1,2,4]триазоло[1,5-α]пиримидин-7-амин
Целевое соединение получали согласно процедурам, описанным в Примере 4B, заменяя 1-этинилциклопентанол, используемый в Примере 4B, коммерчески доступным 1-бром-4-этинилбензолом. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,52 (с, 2H), 8,45 (с, 1H), 7,65 (с, 4H), 2,61 (с, 3H). MS (ESI) m/z 328 (M+H)+.
Пример 71
6-[(4-хлорфенил)этинил]-5-метил[1,2,4]триазоло[1,5-α]пиримидин-7-амин
Целевое соединение получали согласно процедурам, описанным в Примере 4B, заменяя 1-этинилциклопентанол, используемый в Примере 4B, коммерчески доступным 1-хлор-4-этинилбензолом. 1H ЯМР (300 МГц, ДМСО-d6) δ 8,51 (с, 2H), 8,45 (с, 1H), 7,68 - 7,76 (м, 2H), 7,45-7,54 (м, 2H), 2,61 (с, 3H). MS (ESI) m/z 283 (M+H)+.
Пример 72
2-{4-[(7-амино-5-метил[1,2,4]триазоло[1,5-α]пиримидин-6-ил)этинил]фенил}-2-метилметилпропаноат
Пример 72A
5-метил-6-((триметилсилил)этинил)-[1,2,4]триазоло[1,5-a]пиримидин-7-амин
Смесь Примера 4A (275 мг, 1,0 ммоль), этинилтриметилсилана (283 мкл, 2,0 ммоль), бис(трифенилфосфин)палладий (II) дихлорида (35 мг, 0,05 ммоль), CuI (10 мг, 0,05 ммоль) и триэтиламина (279 мкл, 2 ммоль) в ацетонитриле (4 мл) нагревали при 90°C под атмосферой азота в течение 1 часа. Полученную смесь разделяли между этилацетатом и водой. Органическую фазу промывали солевым раствором, высушивали (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали флэш-хроматографией на силикагеле (элюируя этилацетатом), получая целевое соединение в форме твердого вещества светло-желтого цвета (123 мг, 50%-ый выход).
Пример 72B
6-этинил-5-метил-[1,2,4]триазоло[1,5-a]пиримидин-7-амин
Смесь Примера 72A (122 мг, 0,5 ммоль), карбоната калия (138 мг, 1,0 ммоль) в смеси метанол/тетрагидрофуран/H2O (3 мл/3 мл/0,5 мл) перемешивали при температуре окружающей среды в течение 1,5 часов. Реакционную смесь подкисляли 1н. HCl. Твердое вещество отфильтровывали, промывали водой и этилацетатом, получая целевое соединение в форме твердого вещества грязно-белого цвета (35 мг, 40%-ый выход).
Пример 72C
2-{4-[(7-амино-5-метил[1,2,4]триазоло[1,5-α]пиримидин-6-ил)этинил]фенил}-2-метилметилпропаноат
Смесь Примера 72B (17 мг, 0,1 ммоль), 2-(4-бромфенил)-2-метилметилпропаноата (38 мг, 0,15 ммоль), бис(трифенилфосфин)палладий (II) дихлорида (3,5 мг, 0,005 ммоль), CuI (1 мг, 0,005 ммоль) и триэтиламина (28 мкл, 0,2 ммоль) в ацетонитриле (500 мкл) нагревали при 95°C в атмосфере азота в течение 1 часа. Полученную смесь разделяли между этилацетатом и водой. Органическую фазу промывали солевым раствором, высушивали над MgSO4, фильтровали и концентрировали в вакууме. Остаток очищали флэш-хроматографией на силикагеле (элюируя этилацетатом), получая целевое соединение в форме твердого вещества белого цвета (16 мг, 45%-ый выход). 1H ЯМР (300 МГц, ДМСО-d6) δ 8,44 (с, 3H), 7,64 (д, J=8,48 Гц, 2H), 7,36 (д, J=8,48 Гц, 2H), 3,61 (с, 3H), 2,60 (с, 3H), 1,52 (с, 6H). MS (ESI) m/z 350 (M+H)+.
Пример 73
1-[4-(7-амино-5-метил[1,2,4]триазоло[1,5-α]пиримидин-6-ил)бут-3-инил]-2-оксоциклопентанэтилкарбоксилат
Целевое соединение получали согласно процедурам, описанным в Примере 4B, заменяя 1-этинилциклопентанол, используемый в Примере 4B, этиловым эфиром 1-бут-3-инил-2-оксо-циклопентанкарбоновой кислоты (полученной, как описано в Belotti, D.; Cossy, J.; Pete, J. P.; Portella, C; J. Org. Chem.; 51; 22; 1986; 4196- 4200). 1H ЯМР (300 МГц, ДМСО-d6) δ 8,41 (с, 1Н), 8,18 (ушир.с, 2H), 4,03 (кв, J=7,1 Гц, 2H), 2,87 (т, J=6,8 Гц, 2H), 2,76-2,68 (м, 2H), 2,58-2,23 (м, 6H), 2,50 (с, 3H), 1,15 (т, J=7,1 Гц, 3H). MS (ESI) m/z 356 (M+H)+.
Следует понимать, что предшествующее детализированное описание и сопутствующие примеры являются просто иллюстративными и не должны восприниматься как ограничение объема изобретения. Различные изменения и модификации, включая, но не ограничиваясь ими, такие, которые касаются химических структур, заместителей, производных, промежуточных соединений, синтезов, составов и/или способов применения изобретения, могут быть сделаны без отхода от духа настоящего изобретения и его объема.
| название | год | авторы | номер документа |
|---|---|---|---|
| НОВОЕ ФОСФОРАМИДАТНОЕ ПРОИЗВОДНОЕ НУКЛЕОЗИДА И ЕГО ПРИМЕНЕНИЕ | 2014 |
|
RU2621709C2 |
| ИНГИБИТОР, ПРЕДСТАВЛЯЮЩИЙ СОБОЙ ПРОИЗВОДНОЕ ПИРИДАЗИНА, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ЕГО ПРИМЕНЕНИЕ | 2020 |
|
RU2807611C2 |
| Соединения формул (I) и (A), фармацевтическая композиция, лекарственное средство, применение и способ получения соединения формулы (I) | 2018 |
|
RU2822758C2 |
| ИНГИБИТОРНЫЕ СОЕДИНЕНИЯ | 2013 |
|
RU2673079C2 |
| ИНГИБИТОРЫ ФЕРМЕНТА ДИАЦИЛГЛИЦЕРИН О-АЦИЛТРАНСФЕРАЗА ТИПА 1 | 2007 |
|
RU2474576C2 |
| ИНГИБИТОРЫ CDK | 2011 |
|
RU2621674C2 |
| Ингибитор ДНК-зависимой протеинкиназы | 2020 |
|
RU2835434C2 |
| ПРОИЗВОДНЫЕ ПИПЕРИДИНОВ | 2011 |
|
RU2554353C2 |
| АРИЛ- И ГЕТЕРОАРИЛЗАМЕЩЕННЫЕ ТЕТРАГИДРОИЗОХИНОЛИНЫ И ИХ ПРИМЕНЕНИЕ ДЛЯ БЛОКИРОВАНИЯ ОБРАТНОГО ЗАХВАТА НОРЭПИНЕФРИНА, ДОПАМИНА И СЕРОТОНИНА | 2005 |
|
RU2388751C2 |
| ИНГИБИТОР, СОДЕРЖАЩИЙ БИЦИКЛИЧЕСКОЕ ПРОИЗВОДНОЕ, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ЕГО ПРИМЕНЕНИЕ | 2020 |
|
RU2820948C2 |
Описываются новые производные триазолопиримидина общей формулы (I): 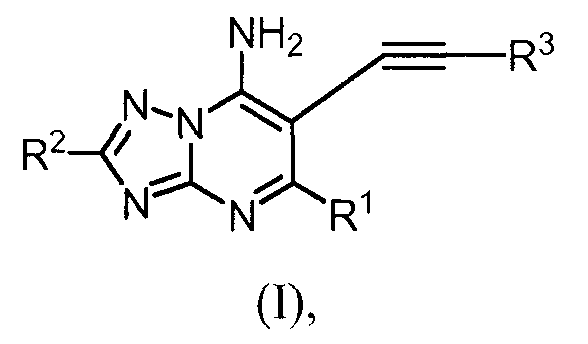
где R1 означает водород или алкил; R2 означает водород; R3 означает С3-8циклоалкил, возможно замещенный, соединенный мостиковой связью моноциклический С6-циклоалкил, возможно замещенный, фенил, возможно замещенный, 6-членный гетероциклил, содержащий один или два гетероатома, выбранных из О и N, возможно замещенный, и другие, фармацевтическая композиция, их содержащая, и применение соединений и композиции для ингибирования ферментов диацилглицерин-О-ацилтрансферазы типа 1 (DGAT) для лечения диабета типа 2, ожирения, повышенного плазменного уровня триглицеридов, метаболического синдрома и т.д. 4 н. и 7 з.п. ф-лы, 1 табл., 73 пр.
1. Соединение, имеющее формулу (I)
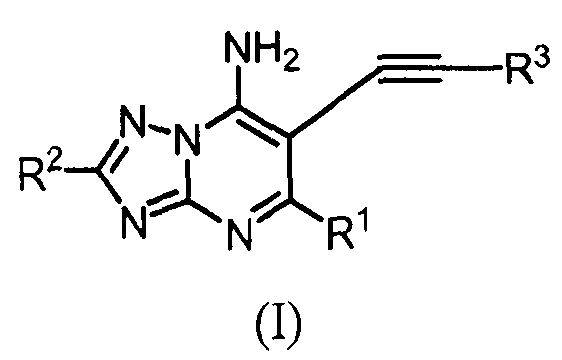
или его фармацевтически приемлемые соли, в которой
R1 обозначает водород или алкил;
R2 обозначает водород;
R3 обозначает моноциклический С3-С8-циклоалкил, в случае необходимости замещенный 1 или 2 заместителями, выбранными из группы, состоящей из -OR10, -N(R11)(R12) и -(CR11R12)C(O)OR10,
соединенный мостиковой связью моноциклический циклоалкил, в случае необходимости замещенный 1, 2, 3 или 4 заместителями, независимо выбранными из группы, состоящей из C1-C6-алкила и -ОН, причем соединенный мостиковой связью моноциклический циклоалкил представляет собой моноциклический С6-циклоалкил, в котором два несмежных атома углерода моноциклического кольца связаны алкиленовым мостиком, содержащим один атом углерода,
фенил, в случае необходимости замещенный 1 заместителем, независимо выбранным из группы, состоящей из галогена, -OR10, -N(R11R12), -(CReRf)q-OR10 и -(CR11R12)C(O)OR10, шестичленный моноциклический гетероцикл, содержащий один или два гетероатома, выбранных из группы, состоящей из О и N, причем указанный гетероцикл может быть замещен 1 заместителем, выбранным из группы, состоящей из -ОН,
-(CRaRb)m-R4, или
-C(O)-R5;
m=1 или 2;
Ra в каждом случае независимо обозначает
водород, C1-С6-алкил, галоген-С1-С6-алкил, -OR7a, -C(O)OR7b или
фенил, в случае необходимости замещенный 1 заместителем, выбранным из группы, состоящей из галогена;
Rb в каждом случае независимо обозначает водород или -ОН; или
Ra и Rb могут вместе обозначать =СН2;
R4 обозначает
C1-С6-алкил, моноциклический С3-С6-циклоалкил, в случае необходимости замещенный 1, 2 или 3 заместителями, независимо выбранными из группы, состоящей из C1-С6-алкила, оксо, -OR10, -C(O)OR10, С(O)O(триметилсилилэтила), -(CR11R12)C(O)OR10, -(CReRf)q-C(O)N(R11)(R12), G1 и =N-O(R10),
соединенный мостиковой связью моноциклический циклоалкил, в случае необходимости замещенный 1, 2, 3 или 4 заместителями, независимо выбранными из группы, состоящей из C1-С6-алкила и -ОН, причем соединенный мостиковой связью моноциклический циклоалкил представляет собой моноциклический С6-циклоалкил, в котором два несмежных атома углерода моноциклического кольца соединены алкиленовым мостиком, содержащим один атом углерода, фенил, в случае необходимости замещенный 1 или 2 заместителями, независимо выбранными из группы, состоящей из C1-С6-алкила, галогена и G1, или шестичленный моноциклический гетероцикл, содержащий два гетероатома, выбранных из группы, состоящей из О и N,
при условии, что, когда R4 обозначает C1-С6-алкил, тогда по
меньшей мере один Ra обозначает -OR7a;
R5 в каждом случае независимо обозначает фенил;
R7a в каждом случае независимо обозначает водород, -(CRgRh)r-C(O)OR13 или G1,
R7b в каждом случае независимо обозначает C1-С6-алкил,
R10 в каждом случае независимо обозначает водород, C1-С6-алкил или -(CRgRh)r-С(O)OR13;
R11 в каждом случае независимо обозначает водород, С1-С6-алкил, -S(O)2-R13a или -C(O)N(R13)(R14);
R12 в каждом случае независимо обозначает водород или C1-С6-алкил;
R13 в каждом случае независимо обозначает водород, C1-С6-алкил или G1;
R13a в каждом случае независимо обозначает G1;
R14 в каждом случае независимо обозначает водород;
q и r в каждом случае обозначают 1;
Re, Rf, Rg и Rh в каждом случае независимо обозначают водород,- и
G1 в каждом случае независимо обозначает фенил, в случае необходимости замещенный 1 заместителем, выбранным из группы, состоящей из галогена и -O(С1-С6-алкила),
причем галоген представляет собой Cl, Br, I или F.
2. Соединение по п.1 или его фармацевтически приемлемая соль, в котором R3 обозначает моноциклический С3-С8-циклоалкил, в случае необходимости замещенный 1 или 2 заместителями, независимо выбранными из группы, состоящей из -OR10, -N(R11)(R12) и -(CR11R12)C(O)OR10.
3. Соединение по п.1 или его фармацевтически приемлемая соль, в котором R обозначает соединенный мостиковой связью моноциклический циклоалкил, в случае необходимости замещенный 1, 2, 3 или 4 заместителями, независимо выбранными из группы, состоящей из С1-С6-алкила и -ОН.
4. Соединение по п.1 или его фармацевтически приемлемая соль, в котором R3 обозначает фенил, в случае необходимости замещенный 1 заместителем, выбранным из группы, состоящей из галогена, -OR10, -N(R11)(R12), -(CReRf)q-OR10 и -(CR11R12)С(O)OR10.
5. Соединение по п.1 или его фармацевтически приемлемая соль, в котором R3 обозначает шестичленный моноциклический гетероцикл, содержащий один или два гетероатома, выбранных из группы, состоящей из О и N, причем указанный гетероцикл может быть замещен 1 заместителем, выбранным из группы, состоящей из -ОН.
6. Соединение по п.1 или его фармацевтически приемлемая соль, в котором R3 обозначает -(CRaRb)m-R4.
7. Соединение по п.1 или его фармацевтически приемлемая соль, в котором R3 обозначает -C(O)-R5.
8. Соединение по п.1, выбранное из группы, состоящей из следующих соединений:
6-[(4-аминофенил)этинил]-5-метил[1,2,4]триазоло[1,5-а]пиримидин-7-амин;
6-(циклогексилэтинил)-5-метил[1,2,4]триазоло[1,5-а]пиримидин-7-амин;
5-метил-6-(4-фенилбут-1-инил)[1,2,4]триазоло[1,5-а]пиримидин-7-амин;
1-[(7-амино-5-метил[1,2,4]триазоло[1,5-а]пиримидин-6-ил)этинил] циклопентанол;
1-[(7-амино-5-метил[1,2,4]триазоло[1,5-а]пиримидин-6-ил)этинил]циклогексанол;
4-[(7-амино-5-метил[1,2,4]триазоло[1,5-а]пиримидин-6-ил)этинил]тетрагидро-2Н-пиран-4-ол;
4-(7-амино-5-метил[1,2,4]триазоло[1,5-а]пиримидин-6-ил)-2-циклопентилбут-3-ин-2-ол;
4-(7-амино-5-метил[1,2,4]триазоло[1,5-а]пиримидин-6-ил)-2-фенилбут-3-ин-2-ол;
4-(7-амино-5-метил[1,2,4]триазоло[1,5-а]пиримидин-6-ил)-1,1,1-трифтор-2-фенилбут-3-ин-2-ол;
3-(7-амино-5-метил[1,2,4]триазоло[1,5-а]пиримидин-6-ил)-1,1-дифенилпроп-2-ин-1-ол;
3-(7-амино-5-метил[1,2,4]триазоло[1,5-а]пиримидин-6-ил)-1-фенилпроп-2-ин-1-ол;
6-(3-циклогексилпроп-1-инил)-5-метил[1,2,4]триазоло[1,5-а]пиримидин-7-амин;
3-(7-амино-5-метил[1,2,4]триазоло[1,5-а]пиримидин-6-ил)-1-циклопропил-1-фенилпроп-2-ин-1-ол;
6-[(4-метоксифенил)этинил]-5-метил[1,2,4]триазоло[1,5-а]пиримидин-7-амин;
3-(7-амино-5-метил[1,2,4]триазоло[1,5-а]пиримидин-6-ил)-1,1-бис(4-хлорфенил)проп-2-ин-1-ол;
5-метил-6-(3-морфолин-4-ил-3-фенилпроп-1-инил)[1,2,4]триазоло[1,5-а]пиримидин-7-амин;
3-(7-амино-5-метил[1,2,4]триазоло[1,5-а]пиримидин-6-ил)-1-(1-метилциклогексил)-1-фенилпроп-2-ин-1-ол;
3-(7-амино-5-метил[1,2,4]триазоло[1,5-а]пиримидин-6-ил)-1-(3,4'-дихлор-1,1'-бифенил-4-ил)проп-2-ин-1-ол;
1-(7-амино-5-метил[1,2,4]триазоло[1,5-а]пиримидин-6-ил)-3-(1,1'-бифенил-4-ил)-4,4-диметилпент-1-ин-3-ол;
4-(7-амино-5-метил[1,2,4]триазоло[1,5-а]пиримидин-6-ил)-2-гидрокси-2-фенилметилбут-3-иноат;
N-{1-[(7-амино-5-метил[1,2,4]триазоло[1,5-а]пиримидин-6-ил)этинил]циклогексил}-3-хлорбензолсульфонамид;
N-{4-[(7-амино-5-метил[1,2,4]триазоло[1,5-а]пиримидин-6-ил)этинил]фенил}-N'-(3-хлорфенил)мочевина;
(1R,4R)-2-[(7-амино-5-метил[1,2,4]триазоло[1,5-а]пиримидин-6-ил)этинил]-1,7,7-триметилбицикло[2,2,1]гептан-2-ол;
(1Z)-2-[3-(7-амино-5-метил[1,2,4]триазоло[1,5-а]пиримидин-6-ил)проп-2-инил]-4-трет-бутилциклогексанон оксим;
4-(7-амино-5-метил[1,2,4]триазоло[1,5-а]пиримидин-6-ил)-2-(4-изопропил-2-метилциклопентил)бут-3-ин-2-ол;
{[3-(7-амино-5-метил[1,2,4]триазоло[1,5-а]пиримидин-6-ил)-1-фенилпроп-2-инил]окси}метилацетат;
{[3-(7-амино-5-метил[1,2,4]триазоло[1,5-а]пиримидин-6-ил)-1-фенилпроп-2-инил]окси}уксусная кислота;
{2-[(7-амино-5-метил[1,2,4]триазоло[1,5-а]пиримидин-6-ил)этинил]фенил}метанол;
{3-[3-(7-амино-5-метил[1,2,4]триазоло[1,5-а]пиримидин-6-ил)-1-гидрокси-1-метилпроп-2-инил]-2,2-диметилциклобутил}уксусная кислота;
4-(7-амино-5-метил[1,2,4]триазоло[1,5-а]пиримидин-6-ил)-2-циклобутилбут-3-ин-2-ол;
4-(7-амино-5-метил[1,2,4]триазоло[1,5-а]пиримидин-6-ил)-2-(3-метилциклобутил)-бут-3-ин-2-ол;
5-метил-6-(3-фенилпроп-1-инил)[1,2,4]триазоло[1,5-а]пиримидин-7-амин;
6-(3-циклопентилпроп-1-инил)-5-метил[1,2,4]триазоло[1,5-а]пиримидин-7-амин;
6-[(1-аминоциклогексил)этинил]-5-метил[1,2,4]триазоло[1,5-а]пиримидин-7-амин;
3-(7-амино-5-метил[1,2,4]триазоло[1,5-а]пиримидин-6-ил)-1-циклопентилпроп-2-ин-1-ол;
3-(7-амино-5-метил[1,2,4]триазоло[1,5-а]пиримидин-6-ил)-1-(2,4-дихлорфенил)проп-2-ин-1-ол;
4-(7-амино-5-метил[1,2,4]триазоло[1,5-а]пиримидин-6-ил)-1-циклопентил-2-метилбут-3-ин-2-ол;
{4-[(7-амино-5-метил[1,2,4]триазоло[1,5-а]пиримидин-6-ил)этинил]-4-гидроксициклогексил}уксусная кислота;
{4-[{7-амино-5-метил[1,2,4]триазоло[1,5-а]пиримидин-6-ил)этинил]-4-гидроксициклогексил}метилацетат;
(1R,4S)-2-[(7-амино-5-метил[1,2,4]триазоло[1,5-а]пиримидин-6-ил)этинил]бицикло[2,2,1]гептан-2-ол;
(1R,2S,4R)-2-[(7-амино-5-метил[1,2,4]триазоло[1,5-а]пиримидин-6-ил)этинил]-1,7,7-триметилбицикло[2,2,1]гептан-2-ол;
(1R,2R,43)-2-[(7-амино-5-метил[1,2,4]триазоло[1,5-а]пиримидин-6-ил)этинил]-1,3,3-триметилбицикло[2,2,1]гептан-2-ол;
{4-[(7-амино-5-метил[1,2,4]триазоло[1,5-а]пиримидин-6-ил)этинил]-4-гидроксициклогексил} трет-бутилацетат;
(1S,2S,4R)-2-[(7-амино-5-метил[1,2,4]триазоло[1,5-а]пиримидин-6-ил)этинил]-1,3,3-триметилбицикло[2,2,1]гептан-2-ол;
(1S,2R,4S)-2-[(7-амино-5-метил[1,2,4]триазоло[1,5-а]пиримидин-6-ил)этинил]-1,7,7-триметилбицикло[2,2,1]гептан-2-ол;
1-[3-(7-амино-5-метил[1,2,4]триазоло[1,5-а]пиримидин-6-ил)проп-2-инил]циклопентанол;
1-[(7-амино[1,2,4]триазоло[1,5-а]пиримидин-6-ил)этинил]циклопентанол;
1-[3-(7-амино[1,2,4]триазоло[1,5-а]пиримидин-6-ил)проп-2-инил]циклопентанол;
(1R,2S,4R)-2-[3-(7-амино-5-метил[1,2,4]триазоло[1,5-а]пиримидин-6-ил)проп-2-инил]-1,7,7-триметилбицикло[2,2,1]гептан-2-ол;
1-[3-(7-амино-5-метил[1,2,4]триазоло[1,5-а]пиримидин-6-ил)проп-2-инил]циклогексанметилкарбоксилат;
6-[3-(4-метоксифенокси)бут-1-инил]-5-метил[1,2,4]триазоло[1,5-а]пиримидин-7-амин;
(1R)-3-(7-амино-5-метил[1,2,4]триазоло[1,5-а]пиримидин-6-ил)-1-фенилпроп-2-ин-1-ол;
(1S)-3-(7-амино-5-метил[1,2,4]триазоло[1,5-а]пиримидин-6-ил)-1-фенилпроп-2-ин-1-ол;
4-(7-амино-5-метил[1,2,4]триазоло[1,5-а]пиримидин-6-ил)-1-фенилбут-3-ин-1-ол;
(транс)-2-[3-(7-амино-5-метил[1,2,4]триазоло[1,5-α]пиримидин-6-ил)-1-гидроксипроп-2-инил]циклопропанэтилкарбоксилат;
1-[3-(7-амино-5-метил[1,2,4]триазоло[1,5-α]пиримидин-6-ил)проп-2-инил]циклогексанкарбоновая кислота;
1-[(7-амино-5-этил[1,2,4]триазоло[1,5-α]пиримидин-6-ил)этинил]циклопентанол;
3-(7-амино-5-метил[1,2,4]триазоло[1,5-α]пиримидин-6-ил)-1-фенилпроп-2-ин-1-он;
2-{3-[3-(7-амино-5-метил[1,2,4]триазоло[1,5-α]пиримидин-6-ил)-1-гидрокси-1-метилпроп-2-инил]-2,2-диметилциклобутил}ацетамид;
(1R,2S,4R)-2-[(7-амино-5-этил[1,2,4]триазоло[1,5-α]пиримидин-6-ил)этинил]-1,7,7-триметилбицикло[2,2,1]гептан-2-ол;
1-[(7-амино-5-метил[1,2,4]триазоло[1,5-α]пиримидин-6-ил)этинил]циклогептанол;
{[3-(7-амино-5-метил[1,2,4]триазоло[1,5-α]пиримидин-6-ил)-1-циклопентилпроп-2-инил]окси}уксусная кислота;
({1-[(7-амино-5-метил[1,2,4]триазоло[1,5-α]пиримидин-6-ил)этинил]циклопентил}окси)уксусная кислота;
3-(7-амино-5-метил[1,2,4]триазоло[1,5-α]пиримидин-6-ил)-1-циклогексилпроп-2-ин-1-ол;
4-[3-(7-амино-5-метил[1,2,4]триазоло[1,5-α]пиримидин-6-ил)-1-гидроксипроп-2-инил]циклогексанметилкарбоксилат;
4-[3-(7-амино-5-метил[1,2,4]триазоло[1,5-α]пиримидин-6-ил)-1-гидроксипроп-2-инил]циклогексанкарбоновая кислота;
{3-[3-(7-амино-5-метил[1,2,4]триазоло[1,5-α]пиримидин-6-ил)-1-метиленпроп-2-инил]-2,2-диметилциклобутил} уксусная кислота;
1-[3-(7-амино-5-метил[1,2,4]триазоло[1,5-α]пиримидин-6-ил)проп-2-инил]циклопентанметилкарбоксилат;
1-[3-(7-амино-5-метил[1,2,4]триазоло[1,5-α]пиримидин-6-ил)проп-2-инил]циклогексан-2-(триметилсилил)этилкарбоксилат;
6-[(4-бромфенил)этинил]-5-метил[1,2,4]триазоло[1,5-α]пиримидин-7-амин;
6-[(4-хлорфенил)этинил]-5-метил[1,2,4]триазоло[1,5-α]пиримидин-7-амин;
2-{4-[(7-амино-5-метил[1,2,4]триазоло[1,5-α]пиримидин-6-ил)этинил]фенил}-2-метилметилпропаноат; и
1-[4-(7-амино-5-метил[1,2,4]триазоло[1,5-α]пиримидин-6-ил)бут-3-инил]-2-оксоциклопентанэтилкарбоксилат; или его фармацевтически приемлемая соль.
9. Применение соединения по п.1 или его фармацевтически приемлемой соли для получения лекарственного средства для лечения нарушения, выбранного из группы, состоящей из диабета типа 2, ожирения, повышенного плазменного уровня триглицеридов, метаболического синдрома, неалкогольного стеатогепатита и неалкогольного ожирения печени.
10. Фармацевтическая композиция для ингибирования ферментов диацилглицерин 0-ацилтрансферазы типа 1 (DGAT-1), включающая терапевтически эффективное количество соединения по п.1 или его фармацевтически приемлемой соли в комбинации с фармацевтически приемлемым носителем.
11. Применение фармацевтической композиции по п.10 для получения лекарственного средства для лечения нарушения, выбранного из группы, состоящей из диабета типа 2, ожирения, повышенного плазменного уровня триглицеридов, метаболического синдрома, неалкогольного стеатогепатита и неалкогольного ожирения печени.
| Пломбировальные щипцы | 1923 |
|
SU2006A1 |
| Пломбировальные щипцы | 1923 |
|
SU2006A1 |
| ГЕТЕРОЦИКЛИЧЕСКИЕ ДИГИДРОПИРИМИДИНОВЫЕ СОЕДИНЕНИЯ | 2000 |
|
RU2296766C2 |
Авторы
Даты
2013-06-27—Публикация
2008-04-30—Подача