ПЕРЕКРЕСТНАЯ ССЫЛКА НА СВЯЗАННУЮ ЗАЯВКУ
Настоящая заявка испрашивает приоритет предварительной заявки на патент США 60/913,009, поданной 20 апреля 2007 года, содержание которой включено в настоящий документ путем ссылки.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Изобретение обеспечивает рекомбинантную аденозиндеаминазу, мутированную с целью повышения стабильности.
УРОВЕНЬ ТЕХНИКИ
Аденозиндеаминазу (АДА) использовали при лечении заболевания, обусловленного ферментной недостаточностью, называемого тяжелым комбинированным иммунодефицитом (ТКИД) или "бабл-бой" (мальчик в пузыре), в течение некоторого времени. Более 15 лет компания Энзон Фармасьютикалз делала терапевтическую АДА доступной для пациентов в форме ПЭГилированной АДА, полученной с использованием бычьего фермента АДА.
Недавно были предприняты попытки заменить бычий фермент рекомбинантным ферментом (в дальнейшем "рАДА"). В качестве замены очищенной природной бычьей АДА рассматривали как рекомбинантный человеческий ("рчАДА"), так и рекомбинантный бычий ("рбАДА") ферменты. Ферменты рбАДА и рчАДА несколько менее устойчивы по сравнению с нативным очищенным бычьим ферментом, который применяется в настоящее время. И рчАДА, и рбАДА, как полагают, разлагаются по механизму, согласуемому с разложением цистеина: добавление кислорода; формирование дитиолов; ускорение разложения при повышении pH; осаждение, особенно при повышенном pH и концентрации образцов. В восстановленном состоянии цистеин содержит реакционно-способную SH- группу (сульфгидрильную), и в такой форме ответственен за разложение.
Экспериментальные данные позволили предположить, что единственный, внешний цистеин может являться ответственным за разложение, наблюдаемое и для рбАДА, и для рчАДА. Структура бычьей АДА (то есть, нативной бычьей АДА, очищенной из бычьего источника) в значительной мере схожа со структурой рчАДА: и бычья АДА, и рчАДА имеют одинаковое количество цистеинов в одних и тех же положениях первичной последовательности. Получаемая в настоящее время рекомбинантная человеческая и рекомбинантная бычья АДА содержат продукты разложения/примеси (дитиолы), которые согласуются с реакционной способностью цистеина. Нативная бычья АДА отличается по структуре от рекомбинантной бычьей АДА тем, что в нативной бычьей АДА с каждым молем АДА связан один моль цистеина. Кроме того, нативная бычья АДА устойчива при высоком pH, что позволяет предположить, что цистеин, связанный с АДА, функционирует как блокирующая группа.
Одним из способов стабилизации рекомбинантной человеческой и/или рекомбинантной бычьей АДА является кэпирование активного остатка Cys (Cys 74 в зрелом рбАДА и зрелом рчАДА) любым из окисленного глутатиона, иодоацетамида, йодуксусной кислоты, цистина, других дитиолов и их смесей. Данный способ описан в заявке на патент США 11/738,012 (настоящего заявителя), озаглавленной "Стабилизированные белки" (Stabilized Proteins), содержание которой путем отсылки включено в настоящий документ в полном объеме.
Несмотря на вышеизложенное, устранение потребности в дополнительной стадии кэпирования посредством изменения структуры белка с целью обеспечения собственной стабильности непосредственно при экспрессии является предпочтительным. В патенте США 5346823 описана стабилизация прокариотических протеаз, таких как субтилизин, а также нейтральной протеазы, путем замены дестабилизирующих остатков Cys на Ser и другие аминокислотные остатки, посредством мутации. Однако мутационный анализ активных сайтов в АДА показал, что замена остатка Cys (Cys 262) приводила к значительному снижению активности фермента, Bhaumik et al 1993, The J. of Biol. Chem., 268 (8):5464-5470. Таким образом, до настоящего изобретения стабилизация аденозиндезаминаз путем замены активного и внешнего остатка Cys другим аминокислотным остатком с сохранением оптимальной полезной активности фермента не была известна.
Таким образом, выгодно обеспечить устойчивые рбАДА и рчАДА, то есть, без значительного разложения во время хранения и обработки, при уровнях pH, используемых при оптимальном ПЭГилировании фермента.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Таким образом, изобретение обеспечивает рекомбинантную АДА, в которой любой окисляемый остаток цистеина заменен неокисляемым аминокислотным остатком по сравнению с формой дикого типа фермента АДА. Мутеин АДА включает неокисляемый аминокислотный остаток, который является одной из природных L-аминокислот, например, аланином, аспарагиновой кислотой, глутаминовой кислотой, фенилаланином, глицином, гистидином, изолейцином, лизином, лейцином, метионином, аспарагином, пролином, глутамином, аргинином, серином, треонином, валином, триптофаном, тирозином и/или известными в уровне техники вариантами и производными природных L-аминокислот, например, 2-аминоадипиновой кислотой, 3-аминоадипиновой кислотой, бета-аланином, бета-аминопропионовой кислотой, 2-аминомасляной кислотой, 4-аминомасляной кислотой, пиперидиновой кислотой, 6-аминокапроновой кислотой, 2-аминогептановой кислотой, 2-аминоизомасляной кислотой, 3-аминоизомасляной кислотой, 2-аминопимелиновой кислотой, 2,4-диаминомасляной кислотой, десмозином, 2,2'-диаминопимелиновой кислотой, 2,3-диаминопропионовой кислотой, н-этилглицином, н-этиласпарагином, гидроксилизином, алло-гидроксилизином, 3-гидроксипролином, 4-гидроксипролином, изодесмозином, алло-изолейцином, н-метилглицином, саркозином, н-метилизолейцином, 6-н-метиллизином, н-метилвалин, норвалин, норлейцин, орнитин и т.п. Необязательно, метионин или триптофан исключаются, поскольку они являются потенциально окисляемыми.
Более предпочтительно, неокисляемым аминокислотным остатком является один из серина, аланина, аспарагина, глутамина, глицина, изолейцина, лейцина, фенилаланина, треонина, тирозина и валина. Серин является наиболее предпочтительным. В некоторых предпочтительных вариантах осуществления окисляемый цистеин расположен приблизительно в 74 положении зрелого белка АДА. Рекомбинантным АДА предпочтительно является рекомбинантная бычья АДА или рекомбинантная АДА человека, то есть, например, транслированная с молекулы ДНК, соответствующей SEQ ID NO: 2 или SEQ ID NO: 4, и которая предпочтительно включает SEQ ID NO: 1 или SEQ ID NO: 3. Когда рекомбинантной АДА является рекомбинантная бычья АДА, соответствующая SEQ ID NO: 1, АДА необязательно экспрессируется с полиморфизмом, выбранным из одного или более Gln вместо Lys198; Ala вместо Thr245; и Arg вместо Gly351.
Изобретение также обеспечивает конъюгат полиалкиленоксид-АДА, где полиалкиленоксид предпочтительно является полиэтиленгликолем. Необязательно полиэтиленгликоль конъюгирован с рекомбинантной аденозиндеаминазой посредством химического линкера, выбранного из группы, состоящей из сукцинимидилкарбоната, тиазолидинтиона, уретана, сукцинимидилсукцината и линкеров на основе амидов. Предпочтительным является сукцинимидилкарбонат. Полиэтиленгликоль предпочтительно ковалентно присоединен к эпсилон-аминогруппе Lys рекомбинантной аденозиндеаминазы.
Конъюгат полиэтиленгликоль-АДА включает, по меньшей мере, 1 (то есть, один или более) полиэтиленгликолевых цепей, присоединенных к эпсилон-аминогруппам, предпочтительно, по меньшей мере, 5 (то есть, пять или более) полиэтиленгликолевых цепей, присоединенных к эпсилон-аминогруппам, или, более предпочтительно, от приблизительно 11 до приблизительно 18 полиэтиленгликолевых цепей, присоединенных к эпсилон-аминогруппам остатков Lys рекомбинантной АДА.
Полиэтиленгликоль конъюгатов изобретения имеет молекулярную массу приблизительно от 2000 до приблизительно 100000 кДа, или, более предпочтительно, приблизительно от 4000 до приблизительно 45000 кДа.
Изобретение дополнительно обеспечивает способ очистки рекомбинантных аденозиндеаминаз изобретения. Например, рекомбинантную аденозиндеаминазу предпочтительно очищают с помощью ионообменной хроматографии (например, Capto Q, DEAE и SP хроматографии), а рекомбинантную аденозиндеаминазу SEQ ID NO: 1 предпочтительно очищают с помощью хроматографии гидрофобного взаимодействия.
Кроме того, настоящее изобретение дополнительно обеспечивает способ лечения АДА-опосредованного заболевания у млекопитающих, включающий введение эффективного количества рекомбинантной АДА согласно настоящему изобретению. АДА-опосредованное заболевание включает, например, ТКИД, рак и т.п.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение обеспечивает стабильные рекомбинантные ферменты - аденозиндеаминазы. Аденозиндеаминазы изобретения получают посредством замены остатка цистеина, который подвергается процессам окисления, когда фермент находится в растворе, приемлемым альтернативным аминокислотным остатком, который сохраняет активность, заряд и третичную структуру фермента при одновременном устранении источника деструктивной нестабильности.
A. Определения
В целях обеспечения ясности при описании изобретения ниже приведены определения нескольких терминов.
Термин "рекомбинантный" относится к белку, полученному с помощью клеток, которые в нативном состоянии не содержат эндогенной копии ДНК, способной экспрессировать указанный белок. Клетки продуцируют рекомбинантный белок, поскольку они были генетически изменены посредством введения соответствующей выделенной последовательности нуклеиновой кислоты. Термин также включает ссылку на клетку, или нуклеиновую кислоту, или вектор, которые были модифицированы посредством введения гетерологичной (экзогенной или чужеродной) нуклеиновой кислоты или посредством изменения нативной нуклеиновой кислоты с получением формы, которая не является нативной для данной клетки, или указанная клетка получена из клетки, модифицированной таким способом. Таким образом, например, рекомбинантные клетки экспрессируют гены, которые не присутствуют в нативной (нерекомбинантной) форме клетки, экспрессируют мутантные гены, которые присутствуют в нативной форме, или экспрессируют нативные гены, которые каким-либо иным образом неправильно экспрессируются, экспрессируются недостаточно или не экспрессируются вообще.
Используемая в настоящем описании "нуклеиновая кислота" или "последовательность нуклеиновых кислот" включают ссылку на дезоксирибонуклеотидный или рибонуклеотидный полимер или в одно- или двунитевой форме и, если нет иного ограничения, охватывают известные аналоги природных нуклеотидов, которые гибридизуются с нуклеиновыми кислотами аналогично природным нуклеотидам. Если не указано иное, конкретная последовательность нуклеиновых кислот включает соответствующую комплементарную последовательность.
Термин "кодирующий" применительно к указанной нуклеиновой кислоте включает ссылку на нуклеиновые кислоты, которые включают информацию для трансляции в специфический белок. Информация определяется посредством кодонов.
"Клетка-хозяин" является клеткой, которая может поддерживать репликацию или экспрессию экспрессионного вектора. Клетки-хозяева могут являться прокариотическими клетками, такими как клетки E. coli, или эукариотическими, такими как клетки дрожжей, насекомых, амфибиий или млекопитающих.
Используемые в настоящем описании "полипептид", "пептид" и "белок" используются попеременно и включают ссылку на полимер, состоящий из аминокислотных остатков.
Термин "остаток" или "аминокислотный остаток", или "аминокислота" включает ссылку на аминокислоту, которая входит в состав белка, полипептида или пептида (совокупно "пептид").
Аминокислота может являться природной аминокислотой и, если нет иного ограничения, может охватывать известные аналоги природных аминокислот, которые могут функционировать аналогично природным аминокислотам.
"Трансфекция" относится к поглощению вектора экспрессии клеткой-хозяином, независимо от того, экспрессируются ли какие-то кодирующие последовательности фактически, или нет. Многочисленные способы трансфекции известны среднему специалисту в данной области. Например, трансфекцию проводят в присутствии вектора экспрессии и высоких концентраций CaPO4, с помощью электропорации, при использовании фага или вирусного вектора экспрессии для встраивания в клетку-хозяина, посредством механического встраивания нуклеиновой кислоты, и даже путем культивирования клетки-хозяина в присутствии неупакованных фрагментов нуклеиновой кислоты. Трансфекцию обычно считают успешной, когда в клетке-хозяине наблюдается какая-либо индикация работы целевого вектора.
"Трансформация" описывает введение нуклеиновой кислоты в организм таким образом, чтобы нуклеиновая кислота была способна к репликации либо в качестве внехромосомного элемента, либо путем интегрирования в хозяйскую хромосому. В зависимости от используемой клетки-хозяина трансформацию проводят, применяя известные из уровня техники способы, соответствующие конкретным клеткам-хозяевам. Кальциевую обработку, в которой применяется хлорид кальция, как описано Cohen, S. N. Proc. Natl. Acad. Sci. (USA), 69:2110 (1972) и Mandel et al, J. Mol. Biol. 53:154 (1970), обычно используют для прокариотических или других клеток, которые имеют клеточные стенки (например, многие бактериальные и/или растительные клетки). Для клеток млекопитающих, не имеющих подобных клеточных стенок, предпочтителен способ преципитации фосфатом кальция Graham, F. and van der Eb, A., Virology, 52: 456-457 (1978). Общие аспекты трансформации системы хозяйских клеток млекопитающих были описаны в патенте США 4,399,216, опубликованном 16 августа 1983 года. Трансформацию дрожжей обычно выполняют согласно методу Van Solingen, P., et a!., J. Bad., 130: 946 (1977) и Hsiao, C. L., et al., Proc. Natl. Acad. Sci, (USA) 76: 3829 (1979). Однако также могут использоваться любые другие известные из уровня техники способы введения нуклеиновой кислоты, например, ДНК, в клетки, такие как, например, микроинъекция, липофекция или слияние протопластов.
Используемый в настоящем описании термин "комплементарный" применительно к нуклеиновой кислоте относится к парной противоположной цепи, синтезируемой (с использованием принципа коплементарности Уотсона-Крика) при репликации первой молекулы нуклеиновой кислоты с использованием указанной молекулы в качестве матрицы для формирования новой, второй цепи нуклеиновых кислот. В одном аспекте изобретения две молекулы нуклеиновой кислоты считаются комплементарными друг другу, когда они гибридизуются или связываются при жестких условиях.
Понятие "функционально связанный" относится к такому смежному расположению элементов, например, регуляторной области и открытой рамки считывания, при котором может осуществляться нормальное функционирование элементов. Таким образом, открытая рамка считывания, которая "функционально связана" с регуляторными последовательностями, относится к конфигурации, в которой кодирующая последовательность может экспрессироваться под контролем указанных последовательностей.
"Регуляторные последовательности" относятся к последовательностям нуклеиновых кислот, необходимым для экспрессии функционально связанной кодирующей последовательности в специфическом организме-хозяине. Регуляторные последовательности, подходящие для прокариотов, например, включают промотор, необязательно последовательность оператора, сайт связывания рибосомы и, возможно, другие пока еще плохо изученные последовательности. Эукариотические клетки, как известно, используют, например, такие регуляторные последовательности как промоторы, сигналы полиаденилирования и энхансеры, а также многие другие.
"Система экспрессии" или "экспрессионный вектор" относятся к последовательностям нуклеиновых кислот, содержащим целевую кодирующую последовательность и регуляторные последовательности в функциональной связи, посредством которых организмы-хозяева, трансформированные указанными последовательностями, способны продуцировать кодируемые белки. Для осуществления трансформации система экспрессии может быть включена в вектор, впрочем, затем соответствующая молекула нуклеиновой кислоты может быть также интегрирована в хромосому организма-хозяина.
Используемые в настоящем описании "клетка", "клеточная линия" "культура клеток" используются попеременно, при этом все подобные обозначения включают потомство. Таким образом, "трансформанты" или "трансформированные клетки" включают первичную целевую клетку и культуры, полученные из нее без учета количества пассажей. Также следует понимать, что все потомство может не являться строго идентичным по геномному содержанию, что обусловлено намеренными или случайными мутациями. Также включено мутантное потомство, обладающее такими же функциональными свойствами, которые выявлены у первоначально трансформированной клетки. В случаях, когда необходимы иные определения, это будет понятно из контекста.
В рамках настоящего изобретения термин "остаток", как следует понимать, означает ту часть соединения, к которому он относится, например, ПЭГ, АДА, аминокислоту и т.д., которая остается после того, как она подверглась реакции замещения другим соединением.
В рамках настоящего изобретения термин "полимерный остаток" например, "остаток ПЭГ", как следует понимать, означает ту часть полимера или ПЭГ, которая остается после того, как она подверглась реакции с другими соединениями, группами и т.д.
В рамках настоящего изобретения термин "алкил", используемый в настоящем описании, относится к насыщенному алифатическому углеводороду, включая линейные, разветвленные и циклические алкильные группы. Термин "алкил" также включает алкил-тио-алкильные, алкоксиалкильные, циклоалкилалкильные, гетероциклоалкильные и C1-6-алкилкарбонилалкильные группы. Предпочтительно, алкильная группа включает 1-12 атомов углерода. Более предпочтительно, алкильная группа является низшим алкилом, включающим приблизительно от 1-7 атомов углерода, наиболее предпочтительно приблизительно 1-4 атомов углерода. Алкильная группа может быть замещена или незамещена. Когда алкильная группа замещена, замещенная группа (группы) предпочтительно включает гало, окси, азидо, нитро, циано, алкил, алкокси, алкил-тио, алкил-тио-алкил, алкоксиалкил, алкиламино, тригалометил, гидроксил, меркапто, гидрокси, циано, алкилсилил, циклоалкил, циклоалкилалкил, гетероциклоалкил, гетероарил, алкенил, алкинил, C1-6-гидрокарбонил, арил и амино.
В рамках настоящего изобретения термин "замещенный", используемый в настоящем описании, относится к добавлению или замене одного или нескольких атомов, содержащихся в пределах функциональной группы или соединения, одной из групп, выбранных из гало, окси, азидо, нитро, циано, алкил, алкокси, алкил-тио, алкил-тио-алкил, алкоксиалкил, алкиламино, тригалометил, гидроксил, меркапто, гидрокси, циано, алкилсилил, циклоалкил, циклоалкилалкил, гетероциклоалкил, гетероарил, алкенил, алкинил, C1-6-карбонил, арил и амино.
Термин "алкенил", используемый в настоящем описании, относится к группам, содержащим, по меньшей мере, одну углерод-углеродную двойную связь, включая линейные, разветвленные и циклические группы. Предпочтительно, алкенильная группа включает приблизительно 2-12 атомов углерода. Более предпочтительно, алкенильная группа является низшим алкенилом, включающим приблизительно от 2-7 атомов углерода, наиболее предпочтительно приблизительно 2-4 атома углерода. Алкенильная группа может быть замещена или незамещена. Когда алкенильная группа замещена, замещенная группа (группы) предпочтительно включает гало, окси, азидо, циано, нитро, алкил, алкокси, алкил-тио, алкил-тио-алкил, алкоксиалкил, алкиламино, тригалометил, гидроксил, меркапто, гидрокси, циано, алкилсилил, циклоалкил, циклоалкилалкил, гетероциклоалкил, гетероарил, алкенил, алкинил, C1-6-алкилкарбонилалкил, арил и амино.
Термин "алкинил", используемый в настоящем описании, относится к группам, содержащим, по меньшей мере, одну углерод-углеродную тройную связь, включая линейные, разветвленные и циклические группы. Предпочтительно алкинильная группа включает приблизительно 2-12 атомов углерода. Более предпочтительно алкинильная группа является низшим алкинилом, включающим приблизительно от 2-7 атомов углерода, наиболее предпочтительно приблизительно 2-4 атома углерода. Алкинильная группа может быть замещена или незамещена. Когда алкинильная группа замещена, замещенная группа (группы) предпочтительно включает гало, окси, азидо, нитро, циано, алкил, алкокси, алкил-тио, алкил-тио-алкил, алкоксиалкил, алкиламино, тригалометил, гидроксил, меркапто, гидрокси, циано, алкилсилил, циклоалкил, циклоалкилалкил, гетероциклоалкил, гетероарил, алкенил, алкинил, C1-6-гидрокарбонил, арил и амино. Примеры "алкинила" включают пропаргил, пропин и 3-гексин.
В рамках настоящего изобретения термин "арил" относится к ароматической углеводородной кольцевой системе, содержащей, по меньшей мере, одно ароматическое кольцо. Ароматическое кольцо необязательно может быть сконденсировано или иным образом присоединено к другим ароматическим углеводородным кольцам или неароматическим углеводородным кольцам. Примеры арильных групп включают, например, фенил, нафтил, 1,2,3,4-тетрагидронафталин и бифенил. Предпочтительные примеры арильных групп включают фенил и нафтил.
В рамках настоящего изобретения термин "циклоалкил" относится к циклическому C3-8-углеводороду. Примеры циклоалкила включают циклопропил, циклобутил, циклопентил, циклогексил. циклогептил и циклооктил.
В рамках настоящего изобретения термин "циклоалкенил" относится к циклическому C3-8-углеводороду, содержащему, по меньшей мере, одну углерод-углеродную двойную связь. Примеры циклоалкенила включают циклопентенил, циклопентадиенил, циклогексенил, 1,3-циклогексадиенил, циклогептенил, циклогептатриенил и циклооктенил.
В рамках настоящего изобретения термин "циклоалкилалкил" относится к алкильной группе, замещенной C3-8-циклоалкильной группой. Примеры циклоалкилалкильной группы включают циклопропилметил и циклопентилэтил.
В рамках настоящего изобретения термин "алкокси" относится к алкильной группе с указанным количеством атомов углерода, присоединенной к основной части молекулы через кислородный мостик. Примеры алкоксигрупп включают, например, метокси, этокси, пропокси и изопропокси.
В рамках настоящего изобретения "алкиларильная" группа относится к арильной группе, замещенной алкильной группой.
В рамках настоящего изобретения "аралкильная" группа относится к алкильной группе, замещенной арильной группой.
В рамках настоящего изобретения термин "алкоксиалкил" относится к алкильной группе, замещенной алкоксигруппой.
В рамках настоящего изобретения термин "алкил-тио-алкил" относится к алкил-S-алкил-тиоэфирной группе, например метилтио метильной или метилтиоэтильной.
В рамках настоящего изобретения термин "амино" относится к азотсодержащей группе, которая, как известно из уровня техники, получена из аммиака путем замещения одного или нескольких водородных радикалов органическими радикалами. Например, термины "ациламино" и "алкиламино" относятся к определенным органическим радикалам, N-замещенным арильной и алкильной замещающими группами, соответственно.
В рамках настоящего изобретения термин "алкилкарбонил" относится к карбонильной группе, замещенной алкильной группой.
В рамках настоящего изобретения термины "галоген" или "гало" относятся к фтору, хлору, брому и иоду.
В рамках настоящего изобретения термин "гетероциклоалкил" относится к неароматической кольцевой системе, содержащей, по меньшей мере, один гетероатом, выбранный из азота, кислорода и серы. Гетероциклоалкильное кольцо необязательно может быть сконденсировано или иным образом присоединено к другим гетероциклоалкильным кольцам и/или неароматическим углеводородным кольцам. Предпочтительные гетероциклоалкильные группы включают от 3 до 7 членов. Примеры гетероциклоалкильных групп включают, например, пиперазин, морфолин, пиперидин, тетрагидрофуран, пирролидин и пиразол. Предпочтительные гетероциклоалкильные группы включают пиперидинил, пиперазинил, морфолинил и пирролидинил.
В рамках настоящего изобретения термин "гетероарил" относится к ароматической кольцевой системе, содержащей, по меньшей мере, один гетероатом, выбранный из азота, кислорода и серы. Гетероарильное кольцо может быть сконденсировано или иным образом присоединено к одному или нескольким гетероарильным кольцам, ароматическим или неароматическим углеводородным кольцам, или гетероциклоалкильным кольцам. Примеры гетероарильных групп включают, например, пиридин, фуран, тиофен, 5,6,7,8-тетрагидроизохинолин и пиримидин. Предпочтительные примеры гетероарильных групп включают тиенил, бензотиенил, пиридил, хинолил, пиразинил, пиримидил, имидазолил, бензимидазолил, фуранил, бензофуранил, тиазолил, бензотиазолил, изоксазолил, оксадиазолил, изотиазолил, бензизотиазолил, триазолил, тетразолил, пирролил, индолил, пиразолил и бензопиразолил.
В рамках настоящего изобретения термин "гетероатом" относится к азоту, кислороду и сере.
В некоторых вариантах осуществления замещенные алкилы включают карбоксиалкилы, аминоалкилы, диалкиламино, гидроксиалкилы и меркаптоалкилы; замещенные алкенилы включают карбоксиалкенилы, аминоалкенилы, диалкениламино, гидроксиалкенилы и меркаптоалкенилы; замещенные алкинилы включают карбоксиалкинилы, аминоалкинилы, диалкиниламино, гидроксиалкинилы и меркаптоалкинилы; замещенные циклоалкилы включают такие группы, как 4-хлорциклогексил; арилы включают такие группы, как нафтил; замещенные арилы включают такие группы, как 3-бромфенил; аралкилы включают такие группы, как толил; гетероалкилы включают такие группы, как этилтиофен; замещенные гетероалкилы включают такие группы, как 3-метокси-тиофен; алкокси включает такие группы, как метокси; и фенокси включает такие группы, как 3-нитрофенокси. «Гало», как следует понимать, включает фтор, хлор, йод и бром.
В рамках настоящего изобретения "положительное целое число", как следует понимать, включает целое число, большее или равное 1 и, как будет понятно средним специалистам в данной области, находится в пределах области рациональности.
В рамках настоящего изобретения термин "связанный", как следует понимать, включает ковалентное (предпочтительно) или нековалентное присоединение одной группы к другой, то есть, в результате химической реакции.
Понятия "эффективные количества" и "достаточные количества" в рамках настоящего изобретения должны означать количество, которое обеспечивает достижение требуемого эффекта или терапевтического эффекта, причем эффект как таковой понятен средним специалистам в данной области.
В рамках настоящего изобретения термин "аденозин", как следует понимать, включает нуклеозиды аденозин и дезоксиаденозин. Аденозин также включает аденозин и дезоксиаденозин, присутствующие в форме АМФ, АДФ, ATP, дАМФ, дАДФ или дАТФ.
В рамках настоящего изобретения "аденозин-опосредованное заболевание" или "аденозиндеаминаза-реактивное заболевание", как следует понимать, широко включает любые заболевания, патологические состояния или нарушения, при которых успешно применяют введение АДА или ее активной фракции, и т.д., независимо от пути введения.
В рамках настоящего изобретения "лечение аденозин-опосредованного заболевания" или "лечение аденозиндеаминаза-реактивного заболевания", такого как ТКИД, как следует понимать, означает устранение, минимизацию или уменьшение проявления симптомов или состояний, по сравнению с наблюдаемыми в отсутствие лечения с применением АДА. Степень реконвалесценции можно подтвердить, например, по снижению уровня аденозина.
В широком смысле, лечение аденозин-опосредованного заболевания следует считать успешным, когда получен требуемый клинический ответ. В альтернативе, успешность лечения можно подтвердить, получив, по меньшей мере, 20%-е или предпочтительно 30%-е, более предпочтительно 40%-е или выше (то есть, 50%-е или 80%-е) снижение уровня аденозина, включая другие клинические показатели, рассматриваемые специалистом в данной области, по сравнению с наблюдаемым в отсутствие лечения с применением АДА.
Кроме того, применение терминов в форме единственного числа для удобства описания никоим образом не следует считать ограничивающим в какой-либо мере. Таким образом, например, ссылка на композицию, включающую фермент, относится к одной или более молекулам данного фермента. Нужно также понимать, что настоящее изобретение не ограничено конкретными конфигурациями, стадиями способов и материалами, описанными в настоящей заявке, поскольку такие конфигурации, стадии способов и материалы могут несколько изменяться.
Нужно также понимать, что терминология, используемая в настоящей заявке, используется лишь с целью описания конкретных вариантов осуществления и не должна являться ограничивающей, поскольку объем настоящего изобретения будет определяться прилагаемой формулой и ее эквивалентами.
B. Ферменты АДА, полученные генно-инженерными методами
Первоначальные попытки получить рекомбинантный фермент АДА, включая ферменты, экспрессируемые с человеческих или бычьих генов, выявили неустойчивость при хранении, не наблюдаемую ранее для природной АДА, получаемой из кишечного тракта крупного рогатого скота. Проведенные исследования продуктов деградации рчАДА и рбАДА подтвердили, что оба фермента АДА разлагаются по механизму, согласуемому с разложением цистеина. Например, добавление кислорода к рчАДА приводит к формированию более гидрофильных соединений, чем рчАДА, имеющих массу на 16 и 32 Да выше, чем у рчАДА. Кроме того, это приводит к формированию дитиолов (на что указывает реверсия формирования продуктов деградации в результате добавления дитиотреитола [ДТТ]); увеличение интенсивности разложения при повышении pH; осаждение, в особенности при повышении pH и при высокой концентрации образцов, что позволяет предположить возможность формирования межмолекулярных дисульфидных связей, приводящего к образованию нерастворимых агрегатов.
Авторы настоящего изобретения определили, что единственный, внешний цистеин ответственен за разложение, наблюдаемое для рчАДА. Бычья (неразлагаемая) АДА обладает структурой, схожей со структурой рчАДА: и бычья АДА, и рчАДА содержат одинаковое количество цистеинов в одних и тех же положениях первичной последовательности. При этом рбАДА также содержит продукты деградации/примеси (дитиолы), которые согласуются с реакционной способностью цистеина. Нативная бычья АДА отличается по структуре от рбАДА тем, что в ней один моль цистеина связан с каждым молем АДА, причем нативная бычья АДА стабильна при высоком pH, что позволяет предположить то, что цистеин, связанный с АДА, функционирует как блокирующая группа. Цистеин, связанный с нативной бычьей АДА, может быть удален путем обработки восстановителем, таким как монотиогликоль или ДТТ. Не желая связывать это с какой-либо теорией или гипотезой, можно предположить, что цистеиновая группа сопряжена с АДА через дисульфидную связь следующим образом:
АДА-S-S-цистеин,
где один цистеин в первичной последовательности АДА связан с молекулой цистеина. Цистеины, присутствующие в таких дисульфидных связях, устойчивы к процессам окислительной деструкции, упомянутым в первом разделе. Остатки цистеина расположены в положениях 74, 152, 153, 168 и 261 человеческой и бычьей зрелой АДА. Изучение трехмерной структуры бычьей АДА, полученной с помощью рентгеноструктурного анализа (Kinoshita et al., 2005, Biochemistry, 44:10562-10569) показало, что цистеины в положениях 74, 152, 153, 168 и 261 не могут участвовать в образовании внутримолекулярных дисульфидных связей. Структурные геометрические ограничения, как известно, вообще предотвращают образование дисульфидных связей вицинальными остатками цистеина, такими как те, которые находятся в положениях 152 и 153 АДА. Таким образом, все остатки цистеина потенциально находятся в восстановленном состоянии и, следовательно, являются потенциальными кандидатными сайтами для реакций окислительной деструкции. Однако вышеуказанный визуальный анализ трехмерной структуры бычьей АДА показал, что цистеин 74 совершенно точно подвергается воздействию растворителя в большей степени, чем другие четыре цистеина и, кроме того, что другие четыре цистеина, по-видимому, углублены внутрь структуры фермента в такой степени, что существенное взаимодействие с сольватированными реагентами, вероятно, предотвращается (если белок не денатурирован). Существование единственного реакционно-способного остатка цистеина могло бы объяснить монодериватизацию нативной бычьей аденозиндеаминазы, что, по-видимому, происходит в результате посттрансляционной модификации.
Факты, изложенные выше, указывают, что реакционно-способный цистеин в положении 74 может являться ответственным за разложение, наблюдаемое для рчАДА и рбАДА, и что кэпирование реакционно-способной -S-H группы цистеина защищает рчАДА или рбАДА от очевидных процессов окислительной деструкции, наблюдаемых для указанных рекомбинантных ферментов. С целью подтверждения этого проводили следующий эксперимент. Рекомбинантный чАДА в концентрации приблизительно 0,6 мг/мл обрабатывали 125 мМ иодоацетамида (IAA) в натрий-фосфатном буфере с pH 7,4 в течение 16 часов при 37°C. В течение нескольких минут после начала реакции анализ пробы с помощью ОФ-ВЭЖХ с УФ- и масс-спектрометрическим детектированием показал, что приблизительно 70,9% рчАДА подверглось монодериватизации IAA, а 17,2% подверглось дериватизации по двум сайтам. После инкубирования в течение 2 и 16 часов хроматографический профиль не был значительно изменен, что указывает на то, что производное являлось устойчивым к окислительной деструкции, типичной для рчАДА. Затем приготовили подобный образец рчАДА, но без IAA, который анализировали аналогичным образом. После инкубирования в течение 16 часов при 37°C и pH 7,4 белок рчАДА деградировал на 30% (степень разложения образца по сравнению с исходной деградацией). Результаты соответствуют единственному, преобладающему внешнему цистеину, который может быть защищен путем кэпирования иодоацетамидом. Данные эксперименты описаны более подробно в патенте США (настоящего заявителя) 11/738,012, озаглавленном "Стабилизированные белки", включенном в настоящее описание путем отсылки, как указано выше.
Хотя кэпирование эффективно предотвращает окислительную деструкцию реакционно-активного цистеина в АДА, применение подобного блокированного фермента требует дополнительной технологической стадии. Таким образом, было исследовано прямое устранение нестабильного остатка Cys из кодирующего гена путем замены другой аминокислотой. Подходящей для замены аминокислотой является такая аминокислота, которая не подвергается такому же типу окисления, не нарушает формирование третичной структуры свернутого белка АДА, а в обычном варианте осуществления изобретения подобрана так, чтобы не подвергаться случайному связыванию с активированным полиалкиленоксидом в процессе формирования конъюгата. Подходящей для замены окисляемого цистеина согласно изобретению является любая из известных в уровне техники природных аминокислот и/или неприродных аминокислот, и/или их производных, которые соответствуют указанному критерию. Примерный список таких аминокислот включает природные L-аминокислоты, такие как: аланин, аспарагиновую кислоту, глутаминовую кислоту, фенилаланин, глицин, гистидин, изолейцин, лизин, лейцин, метионин, аспарагин, пролин, глутамин, аргинин, серин, треонин, валин, триптофан и тирозин. Триптофан и метионин могут окисляться относительно легко и в некоторых необязательных вариантах осуществления являются менее предпочтительными.
Способы получения рекомбинантных белков с применением сайт-специфического включения неприродных аминокислот в клетки-хозяева описаны в литературе, например, Liu et al., 2007, Nat. Methods 4(3):239-44, Xie et al., 2006 Nat. Rev. Mol. Cell. Biol. 7(10):775-82, Ryu et al., 2006, Nat. Methods 3(4):263-65, Deiters et al, 2004, Bioorg. Med. Chem Lett. 14(23):5743-5, Bogosian et al., 1989, J. Biol. Chem. 264(1):531-9, Tang et al., 2002, Biochemistry 41(34):10635-45, Budisa et al., 1995. Eur. J. Biochem. 230(2): 788-96, а также Randhawa et al., 1994, Biochemistry, 33(14):4352-62. Таким образом, заменяющая аминокислота может также включать модифицированную или менее типичную аминокислоту, такую как: 2-аминоадипиновую кислоту, 3-аминоадипиновую кислоту, бета-аланин, бета-аминопропионовую кислоту, 2-аминомасляную кислоту, 4-аминомасляную кислоту, пиперидиновую кислоту, 6-аминокапроновую кислоту, 2-аминогептановую кислоту, 2-аминоизомасляную кислоту, 3-аминоизомасляную кислоту, 2-аминопимелиновую кислоту, 2,4-диаминомасляную кислоту, десмозин, 2,2'-диаминопимелиновую кислоту, 2,3-диаминопропионовую кислоту, н-этилглицин, н-этиласпарагин, гидроксилизин, алло-гидроксилизин, 3-гидроксипролин, 4-гидроксипролин, изодесмозин, алло-изолейцин, н-метилглицин, саркозин, н-метилизолейцин, 6-н-метиллизин, н-метилвалин, норвалин, норлейцин и орнитин.
Более предпочтительные природные аминокислоты, которыми необязательно заменяют цистеин в рекомбинантной АДА, включают, например, аланин, серин, аспаргин, глутамин, глицин, изолейцин, лейцин, фенилаланин, треонин, тирозин и валин. Серин является наиболее предпочтительным и приводится в качестве примера в дальнейшем.
Таким образом, были получены экспрессирующие человеческую и бычью аденозиндеаминазу дикого типа молекулы ДНК, подвергнутые оптимизации кодонов для экспрессии в E. coli и мутации с целью экспрессии мутеина рбАДА и мутеина рчАДА, включающих остаток Ser в положении 74 соответствующих зрелых белков (положение 75 транслированного белка) вместо природного остатка Cys. Это Ser74-рбАДА (SEQ ID NO: 1) и Ser74-рчАДА (SEQ ID NO: 3), соответственно. Кроме того, нужно отметить, что природная бычья АДА, выделенная из кишечного тракта крупного рогатого скота, также содержит 6 остатков, посттрансляционно удаляемых из С-концевой области. Необязательным признаком настоящего изобретения является то, что Ser74-рбАДА согласно изобретению либо экспрессируется без 6 C-концевых остатков (в виде мутеина), либо подвергается посттрансляционной модификации с целью удаления указанных 6 C-концевых остатков, отсутствующих в очищенной природной бычьей АДА.
Следует также отметить, что природная бычья АДА, выделенная из кишечного тракта крупного рогатого скота, имеет полиморфизмы: в отношении SEQ ID NO: 5, полиморфизмы бычей АДА включают, например, глутамин в положении 198 вместо лизина, аланин в положении 245 вместо треонина; аргинин в положении 351 вместо глицина. Таким образом, предполагается, что рекомбинантный мутеин (по положению 74) бычьей АДА согласно изобретению может также включать дополнительные замены в одном или нескольких указанных положений или в аналогах данных положений: Gln вместо Lys198; Ala вместо Thr245; Arg вместо Gly351.
В дополнительном аспекте изобретения настоящее изобретение обеспечивает выделенные ДНК, которые кодируют мутеин АДА, имеющий аминокислотную последовательность согласно SEQ ID NO:1 или SEQ ID NO:3, описанным в настоящей заявке. Другие ДНК, кодирующие мутеин АДА с одной или несколькими заменами: Gln вместо Lys198; Ala вместо Thr245; Arg вместо Gly351, - также включены в объем настоящего изобретения.
Подходящий экспрессионный вектор может быть получен из геномной или кДНК, кодирующей рчАДА или рбАДА, соответственно, которые необязательно находятся под контролем подходящего функционально связанного индуцируемого промотора. ДНК предпочтительно является кодон-оптимизированной для соответствующей клетки-хозяина и мутированной с помощью любого подходящего, известного из уровня техники способа, например, высокоэффективного сайтнаправленного мутагенеза с использованием олигонуклеотидов (Olsen DB and Eckstein F, Proc Natl Acad Sci USA 87:1451-5; 1990), синтез полноразмерных генов с использованием перекрывающихся длинных олигонуклеотидов (Vasantha N and Filpula D., Gene 76:53-60; 3989), ПЦР-опосредованный синтез генов (Jayaraman K et al., Proc Natl Acad Sci USA 88:4084-88: 1991) или ПЦР с удлинением перекрывающихся праймеров (Pogulis RJ et al., Methods Mol Biol 57:167-76; 1996).
Обычно прокариоты являются предпочтительными для исходного клонирования последовательностей ДНК и векторных конструкций, применяемых в изобретении. Например, наиболее предпочтительным является штамм E. coli K12 ММ 294 (ATCC No.31,446). Другие микробные штаммы, которые могут использоваться, просто в качестве примера, включают такие штаммы E. coli, как E. coli B и E. coli X1776 (ATCC No.31,537). Могут использоваться вышеуказанные штаммы, а также, например, штаммы E. coli W3110 (F-, лямбда-, прототрофный, ATCC No.27,325), K5772 (ATCC No.53,635) и SR101, бациллы, такие как Bacillus subtilis, и другие энтеробактерии, такие как Salmonella typhimurium или Serratia marcescens, и различные виды псевдомонад.
Обычно плазмидные векторы, содержащие репликон и регуляторные последовательности, полученные из видов, совместимых с клеткой-хозяином, используются вместе с указанными организмами-хозяевами. Обычные плазмидные векторы представляют собой двунитевые молекулы ДНК, предпочтительно содержащие сайты узнавания ферментов, подходящие для встраивания экзогенных последовательностей ДНК, селективный ген устойчивости к антибиотику, сайт инициации репликации для автономного воспроизводства в клетке-хозяине и ген для отбора или селекции клонов, которые содержат вставку рекомбинантной ДНК. Доступные плазмидные векторы, подходящие для использования в клетках E. coli, включают, например, pET3, pET9, pET11 и другие серии pET (включенные в каталог Корпорации Novagen), pBAD, trc, phoA, trp и плазмиды OL/R/PL/R.
Просто в качестве примера E. coli обычно трансформируют, используя плазмиду pBR322, полученную из E. coli (см., например, Bolivar et al., 1977, Gene. 2:95). pBR322 содержит гены устойчивости к ампициллину и тетрациклину, и обеспечивает, таким образом, простой способ идентификации трансформированных клеток. Точно так же плазмиды pUC являются удобными векторами для отбора и репликации молекул ДНК (Yanisch-Perron, et al., 1985, Gene 33: 103-119, содержание которой полностью включено в настоящую заявку путем отсылки). Плазмида pBR322 или другая микробная плазмида, или фаг, также должны содержать, или модифицированы с целью включения промоторов, которые могут использоваться микробным организмом для экспрессии его собственных кодируемых белков.
Промоторы, используемые обычно в рекомбинантной ДНК конструкции, включают системы на основе промотора бета-лактамазы (пенициллиназы) и лактозного промотора (Chang et al., 1978, Nature, 375:615; Itakura ef al., 1977, Science, 198:1056; Goeddel et al., 1979, Nature, 281:544), а также триптофанового (trp) промотора (Goeddel et al., 1980, Nucleic Acids Res., 8:4057; EPO Appl. Publ. No.0036,776). Они используются наиболее часто, хотя были открыты и использованы другие микробные промоторы, опубликованы их нуклеотидные последовательности, что позволяет квалифицированному специалисту функционально встроить их в известные векторы, например, плазмидные векторы.
Просто в качестве примера регуляция транскрипции в E. coli может обеспечиваться любым из следующих индуцируемых промоторов: lac, trp, phoA, araBAD, T7, trc и производными лямбда промоторов PL и PR, а также других, известных в уровне техники (например, Makrides, 1996, Microbiol. Rev. 60:512-538, содержание которой полностью включено в настоящую заявку путем ссылки).
Подходящие условия индукции необязательно совместимые с вектором, включают, например, добавление арабинозы, лактозы или тепловую индукцию, недостаток фосфатов, недостаток триптофана и прочее. Предпочтительно, идуцирующим элементом является Lac-оперон, который индуцируется изопропилтиогалактозидом (IPTG).
Подходящая сигнальная последовательность (сигнальный пептид) может быть получена из pelB, fd pIII или ompA.
Подходящие селективные маркеры устойчивости к антибиотикам известны в уровне техники и включают, например, те, которые придают устойчивость к ампициллину, канамицину, хлорамфениколу, рифампицину или тетрациклину, среди прочих.
Подходящие последовательности инициации репликации включают соответствующие последовательности из следующих плазмид: pUC19, pACYC117, pUB110, pE194, pAMB1, pIJ702, pBR322, pBR327 и pSC101.
Подходящие терминирующие последовательности включают, например, основной терминатор фага fd, TΦ и rrnB.
В дополнение к прокариотам могут также использоваться эукариотические микроорганизмы, такие как дрожжевые культуры. Из эукариотических микроорганизмов наиболее часто используются Saccharomyces cerevisiae или обычные хлебопекарные дрожжи, хотя также существует много других доступных штаммов. Для экспрессии в Saccharomyces обычно используется плазмида YRp7, например (Stinchcomb et al., 1979, Nature, 282:39; Kingsman et al., 1979, Gene, 7:141; Tschemper et al., 1980, Gene, 10:157). Данная плазмида уже содержит ген trp1, который обеспечивает селективный маркер выбора для мутантного штамма дрожжей, лишенного способности расти в отсутствие триптофана, например, ATCC No.44,076 или PEP4-1 (Jones, 1977, Genetics, 85:12). Присутствие нарушения в trp1, являющегося особенностью генома дрожжевой клетки-хозяина, обеспечивает эффективную среду для обнаружения трансформантов по росту в отсутствие триптофана.
Система экспрессии на основе Pichia pastoris, как было показано, обеспечивает высокий уровень продукции нескольких белков (Cregg, J.M. et al., 1993, Bio/Technology 11:905-910, содержание которой полностью включено в настоящее описание путем отсылки) и может использоваться для экспрессии АДА в форме растворимого белка в цитоплазме Pichia pastoris.
Подходящие промоторные последовательности в дрожжевых векторах включают промоторы 3-фосфоглицераткиназы (Hitzeman et al., 1980, J. Biol. Chem., 255:2073) или других гликолитических ферментов (Hess et al., 1968, J. Adv. Enzyme Reg., 7:149; Holland et al., 1978, Biochemistry, 17:4900), таких как енолаза, глицеральдегид-3-фосфатдегидрогеназа, гексокиназа, пироватдекарбоксилаза, фосфофруктокиназа, глюкозо-6-фосфатизомераза, 3-фосфоглицератмутаза, пироваткиназа, триозофосфатизомераза, фосфоглюкозоизомераза и глюкокиназа. При конструировании подходящих экспрессионных плазмид терминирующие последовательности, связанные с указанными генами, также встраивают в вектор экспрессии, лигируя их с 3'-концом экспрессируемой последовательности, чтобы обеспечить полиаденилирование мРНК и терминацию транскрипции. Другие промоторы, которые обладают дополнительным преимуществом регулируемой условиями роста транскрипции, включают промоторную область алкогольдегидрогеназы 2, изоцитотохрома C, кислой фосфатазы, ферментов деградации, связанные с метаболизмом азота, а также вышеуказанной глицеральдегид-3-фосфатдегидрогеназы и ферментов, ответственных за использование мальтозы и галактозы. Подходящим является любой плазмидный вектор, содержащий совместимый с дрожжами промотор, сайт инициации репликации и терминирующие последовательности.
Сайт инициации репликации может быть обеспечен либо конструкцией вектора, включающего экзогенный сайт инициации, например такой, который может происходить из SV40 или другого вирусного источника (например, вируса полиомы, аденовируса, VSV, BPV), или может обеспечиваться механизмом хромосомной репликации клетки-хозяина. Если вектор интегрирован в хромосому клетки-хозяина, последнее часто является достаточным. Другие полезные элементы плазмиды могут включать экспрессируемые гены, кодирующие белки-шапероны, пролинизомеразы или протеин-дисульфидизомеразы.
C. Полимерные конъюгаты
В другом аспекте изобретения мутеин АДА, такой как белки Ser74-рбАДА (SEQ ID NO: 1) и Ser74-рчАДА (SEQ ID NO: 3), конъюгирован с подходящим полимером с целью получения полимерных конъюгатов.
В предпочтительных аспектах мутеин АДА полипептид конъюгирован с по существу неантигенным полимером, предпочтительно полиалкиленоксидом (ПАО).
АДА-полимерный конъюгат в целом соответствуют формуле (I):
(I) [R-NH]z-(АДА)
в которой
(АДА) представляет собой рекомбинантный мутеин аденозиндеаминазы или его активный фрагмент;
NH- представляет собой аминогруппу аминокислоты, присутствующей в мутеине АДА, служащую для присоединения к полимеру;
(z) является положительным целым числом, предпочтительно от приблизительно 1 до приблизительно 80, более предпочтительно от приблизительно 5 до приблизительно 80, наиболее предпочтительно от приблизительно 11 до приблизительно 18; и
R включает по существу неантигенный полимерный остаток, который присоединен к АДА обратимым или необратимым способом.
В более предпочтительных аспектах полимеры включают полиэтиленгликоль (ПЭГ), где ПЭГ может являться линейным, разветвленным или многолучевым. Полиэтиленгликоль имеет общую формулу:
-О-(CH2CH2O)n-,
в которой (n) является положительным целым числом, предпочтительно от приблизительно 10 до приблизительно 2300, более предпочтительно от приблизительно 40 до приблизительно 2300. Средняя молекулярная масса полимеров находится в диапазоне от приблизительно 2000 до приблизительно 300000 Да. Более предпочтительно, полимеры имеют среднюю молекулярную массу приблизительно от 4000 Да приблизительно до 45 000 Да, еще более предпочтительно, от 4000 Да до приблизительно 20000 Да. Наиболее предпочтительно, ПЭГ имеет молекулярную массу приблизительно 5000 дальтон. Также рассматриваются другие молекулярные массы в целях соответствия потребностям специалиста.
В альтернативе часть остатка полиэтиленгликоля (ПЭГ) изобретения может быть представлена структурой:
-Y11-(CH2CH2O)n-CH2CH2Y11-,
-Y11-(CH2CH2O)n-CH2C(=Y12)-Y11-,
-Y11-(=Y12)-(CH2)а11-Y13-(CH2CH2O)n-CH2CH2-Y13-(CH2)а11-C(=Y12)-Y11-,
-Y11-(CR11R12)a12-Y13-(CH2)b11-O-(CH2CH2O)n-(CH2)b11-Y13-(CR11R12)a12-Y11-,
-Y11-(CH2CH2O)n-CH2CH2-,
-Y11-(CH2CH2O)n-CH2C(=Y12)-,
C(=Y12)-(CH2)а11-Y13-(CH2CH2O)n-CH2CH2-Y13-(CH2)а11-C(=Y12)-, и
-(CR11R12)a12-Y13-(CH2)b11-O-(CH2CH2O)n-(CH2)b11-Y13-(CR11R12)a12-,
где:
Y11 и Y13 независимо представляют собой O, S, SO, SO2, NR13 или связь;
Y12 представляют собой O, S или NR14
R11-14 независимо выбраны из водорода, C1-6-алкила, C2-6-алкенила, C2-6-алкинила, разветвленного C3-19-алкила, C3-8-циклоалкила, замещенного C1-6-алкила, замещенного C2-6-алкенила, замещенного C2-6-алкинила, замещенного C3-8-циклоалкила, арила, замещенного арила, гетероарила, замещенного гетероарила, C1-6-гетероалкила, замещенного C1-6-гетероалкила, C1-6-алкокси, арилокси, C1-6-гетероалкокси, гетероарилокси, C2-6-алканоила, арилкарбонила, C2-6-алкоксикарбонила, арилоксикарбонила, C2-6-алканоилокси, арилкарбонилокси, замещенного C2-6-алканоила, замещенного арилкарбонила, замещенного C2-6-алканоилокси, замещенного арилоксикарбонила, замещенного C2-6-алканоилокси и замещенного арилкарбонилокси;
(a11), (a12) и (b11) независимо являются нолем или положительным целым числом, предпочтительно 0-6, а более предпочтительно 0, 1 или 2; и
(n) является целым числом от приблизительно 10 до приблизительно 2300.
Например, ПЭГ может быть функционализован следующим неограничивающим образом:
-C(=Y14)-(CH2)m-(CH2CH2O)n-,
-C(=Y14)-O-Y)-(CH2)m-(CH2CH2O)n-,
-C(=Y14)-NR11-(CH2)m-(CH2CH2O)n-,
-CR15R16-(CH2)m-(CH2CH2O)n-
где
R11, R15 и R16 независимо выбраны из H, C1-6-алкилов, арилов, замещенных арилов, аралкилов, гетероалкилов, замещенных гетероалкилов и замещенных C1-6-алкилов;
(m) является нолем или положительным целым числом, и предпочтительно равно 1 или 2;
Y14 является O или S; и
(n) представляет собой степень полимеризации.
В указанных аспектах полимер (R-группа) включает блокирующую группу, то есть, группу, расположенную на конце полимера. Блокирующая группа может быть выбрана из любого из NH2, ОН, SH, CO2H, C1-6-алкилов, предпочтительно метила, при этом перечисленные группы известны средним специалистам в данной области.
В другом аспекте полимерная часть конъюгата может являться такой частью, которая содержит множество точек для присоединения АДА. В альтернативе к АДА может быть присоединено множество молекул ПЭГ.
Фармакокинетические и другие свойства ПЭГилированной АДА могут быть отрегулированы при необходимости в зависимости от требуемого клинического применения посредством изменения молекулярной массы ПЭГ, химических линкеров, а также соотношения цепей ПЭГ и фермента.
В указанных аспектах АДА может быть присоединена к неантигенному полимеру обратимым или необратимым способом с помощью различных линкеров, известных в уровне техники.
Обратимо-связанные полимерные системы могут быть основаны на отщеплении бензила или лактонизации триметильного замка. Активированные полимерные линкеры обратимо-связанных полимерных систем могут быть получены в соответствии с патентами США (настоящего заявителя) 6180095, 6720306, 5965119, 6624142 и 6303569, содержание которых включено в настоящее описание путем ссылки. В альтернативе АДА-полимерные конъюгаты получают с использованием определенных бицин-полимерных остатков, таких как описанные в патентах США 7122189 и 7087229, а также в заявках на патент США 10/557,522, 11/502,108 и 11/011,818 (все настоящего заявителя), включенных в настоящее описание путем отсылки. Другие рассматриваемые обратимо-связанные полимерные системы также описаны в PCT/US07/78600, содержание которого включено в настоящее описание путем отсылки.
Иллюстративные примеры обратимо-связанных или необратимо-связанных АДА-полимерных конъюгатов, рассматриваемые в настоящей заявке, описаны в заявке на патент США 60/913,039, содержание которой включено в настоящее описание путем ссылки.
Конъюгирование с полимером предпочтительно представляет собой реакцию ПЭГилирования, при этом такие реакции известны средним специалистам в данной области. Вкратце, мутеин рбАДА или рчАДА, реагирует с активированным полимером, формируя АДА-полимерный конъюгат. В этой связи может использоваться большое разнообразие активированных или функционализированных полиэтиленгликолей, включая описанные, например, в патентах США (настоящего заявителя) 5122614, 5324844, 5612460 и 5808096 (сукцинимидилкарбонат-активированный полиэтиленгликоль (СК-ПЭГ) и аналогичные активированные ПЭГ), патенте США 5349001 (ПЭГ, активированные циклическим имидтионом), патенте США 5650234, а также другие, известные средним специалистам в данной области. Описание каждого из вышеуказанных документов включено в настоящую заявку путем отсылки. См. также активированные полимеры, поставляемые компанией Nektar/Shearwater Polymers. Средние специалисты в данной области могут использовать различные активированные формы полимеров для присоединения без лишней экспериментальной работы.
Средние специалисты в данной области смогут оценить, что такие реакции конъюгирования обычно проводят в подходящем буфере, используя молярный избыток (в несколько раз) активированного ПЭГ. Некоторые предпочтительные конъюгаты, полученные с линейными молекулами ПЭГ, такими как вышеуказанный СК-ПЭГ, могут содержать, в среднем, от приблизительно 10 до приблизительно 80 цепей ПЭГ на молекулу фермента АДА. Таким образом, в таком случае могут использоваться молярные избытки в несколько сотен раз, например, 200-1000x. Молярный избыток, используемый для разветвленного ПЭГ и ПЭГ, присоединенного к ферменту, обычно ниже и может быть определен с использованием методик, описанных в патентах и заявках на патент, описывающих то же, которые указаны ниже в настоящей заявке.
В указанных аспектах полиалкиленоксид конъюгирован с белком с помощью химического линкера, включающего, например, сукцинимидилкарбонатные, тиазолидинтионовые, уретановые и амидные линкеры. Полиалкиленоксид предпочтительно ковалентно присоединен к эпсилон-аминогруппе Lys в АДА, хотя из уровня техники известны другие сайты ковалентного присоединения. АДА-полимерный конъюгат может включать, по меньшей мере, 5 цепей полиэтиленгликоля, присоединенных к эпсилон-аминогруппам Lys в ферменте, а в альтернативе может включать приблизительно 11-18 цепей ПЭГ, присоединенных к эпсилон-аминогруппам Lys в ферменте.
Хотя АДА конъюгирована с приблизительно от 11 до приблизительно 18 молекул ПЭГ на молекулу фермента, через лизиновые связи, отношение ПЭГ и АДА может быть различным с целью изменения физических и кинетических свойств комбинированного конъюгата, чтобы соответствовать любой конкретной клинической ситуации.
Из приведенного выше очевидно, что дополнительные аспекты изобретения включают применение любого коммерчески доступного или известного активированного ПЭГ, или подобного полимера, для конъюгирования с ферментом АДА, или его фрагментом, в целях обеспечения конъюгатов, применяемых в способах лечения, описанных в настоящей заявке. См., например, каталог Nektar Advanced Pegylation 2004 (Nektar, San Carlos, California), полностью включенные в настоящее описание путем отсылки.
Активированные ПЭГ могут включать линейные, разветвленные или U-ПЭГ производные, такие как описанные в патентах США 5681567, 5756593, 5643575, 5919455, 6113906, 6566506, 6153655, 6395266 и 6638499, 6251382 и 6824766 (также включенных здесь в настоящее описание путем ссылки). Неограниченный список таких полимеров соответствует полимерным системам (i)-(vii) со следующими структурами:
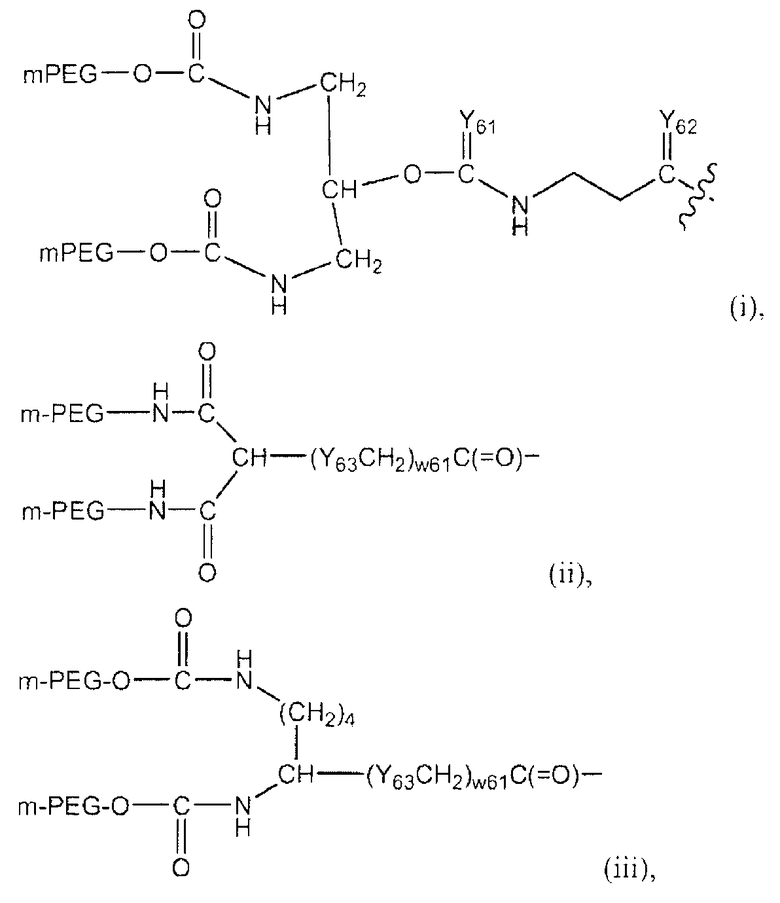
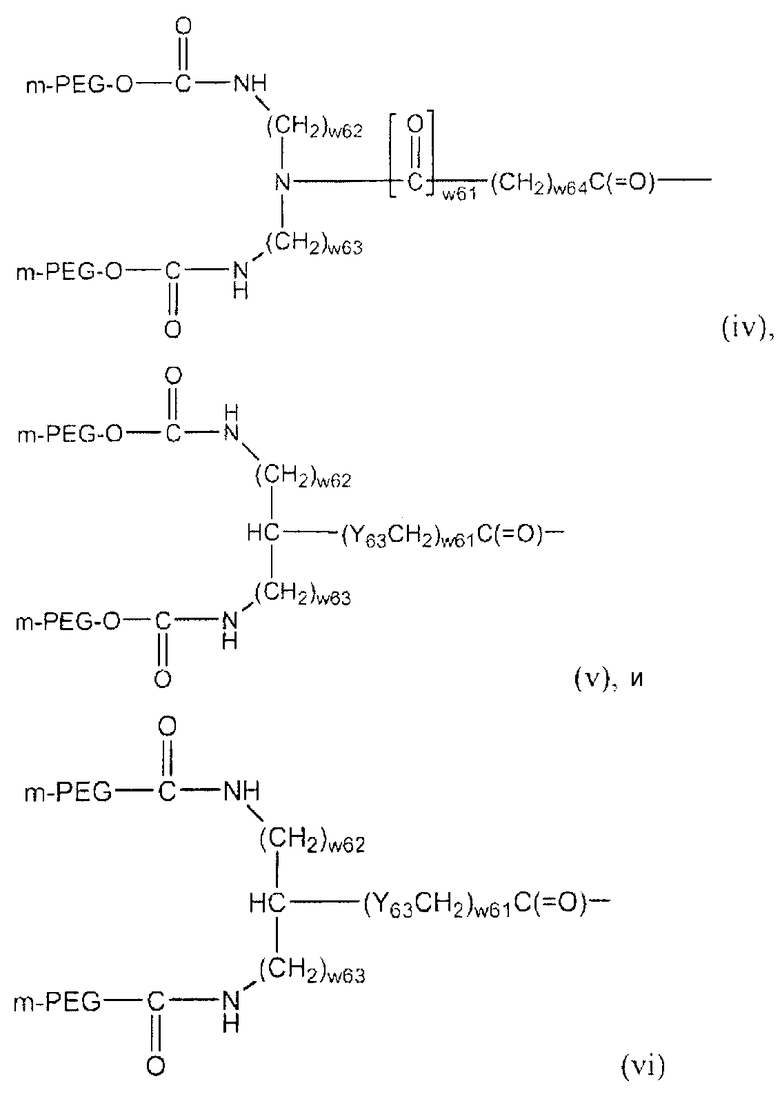
в которых:
Y61-62 независимо представляют собой O, S или NR61;
Y63 представляет собой O, NR62, S, SO или SO2;
(w62), (w63) и (w64) независимо представляет собой 0 или положительное целое число, предпочтительно от приблизительно 0 до приблизительно 10, более предпочтительно от приблизительно 1 до приблизительно 6;
(w61) является 0 или 1;
мПЭГ представляет собой метокси-ПЭГ,
где ПЭГ определен выше, а полная молекулярная масса полимерной части составляет от приблизительно 2000 до приблизительно 100000 дальтон; и
R61 и R62 независимо представляют собой одинаковые группы, которые могут использоваться в качестве R11.
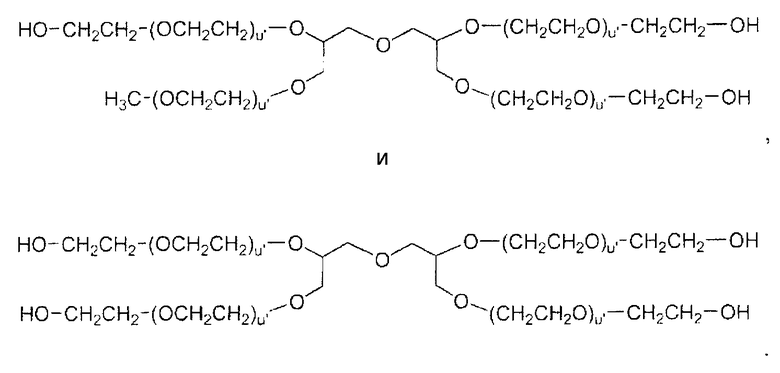
Кроме того, следует понимать, что в дополнение к полимерам на основе ПЭГ могут также использоваться много других полиалкиленоксидов. Например, конъюгаты настоящего изобретения могут быть получены способами, которые включают превращение многолучевых ПЭГ-ОН и "звездообразных ПЭГ" продуктов, таких как описанные в каталоге корпорации Shearwater "Polyethylene Glycol and Derivatives for Biomedical Application", 2001. См. также каталог NOF Corp. Drug Delivery System catalog. Ver. 8, апрель 2006. Содержание каждого из указанных каталогов включено в настоящее описание путем отсылки. Многолучевые полимеры содержат четыре или более полимерных цепей, а предпочтительно четыре или восемь полимерных цепей. В целях неограничевающей иллюстрации остаток многолучевого полиэтиленгликоля (ПЭГ) может иметь формулу:
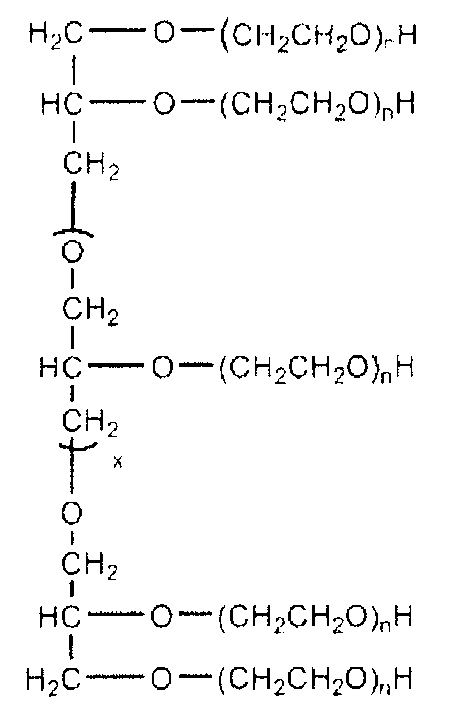
в которой:
(x) является 0 и положительным целым числом, то есть приблизительно от 0 до приблизительно 28; и
(n) является степенью полимеризации.
В одном конкретном варианте осуществления настоящего изобретения многолучевой ПЭГ имеет следующую структуру:
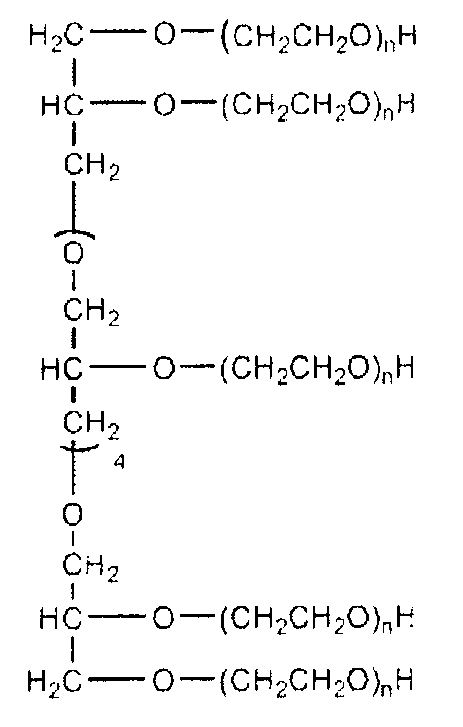
в которой (n) является положительным целым числом. В одном предпочтительном варианте осуществления изобретения полимеры имеют полную молекулярную массу приблизительно от 2000 Да до приблизительно 100000 Да, и предпочтительно от 4000 Да до 45000 Да.
В другом конкретном варианте осуществления многолучевой ПЭГ имеет следующую структуру:
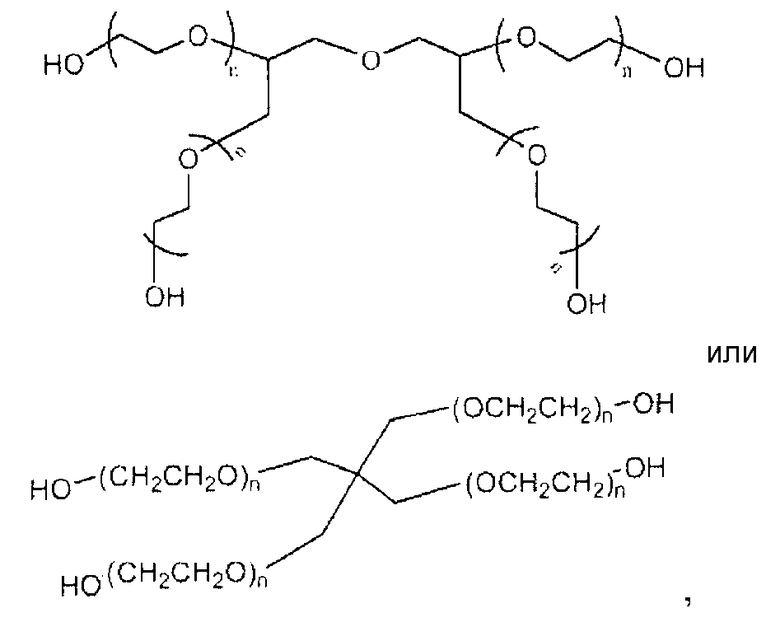
в которой n является положительным целым числом. В одном предпочтительном варианте осуществления изобретения полимеры имеют полную молекулярную массу приблизительно от 2000 Да до приблизительно 100000 Да, и предпочтительно от 4000 Да до 45000 Да.
Полимеры могут быть превращены в активированный подходящим образом полимер с использованием методик активации, описанных в патентах США 5122614 или 5808096. В частности, такой ПЭГ может иметь формулу:
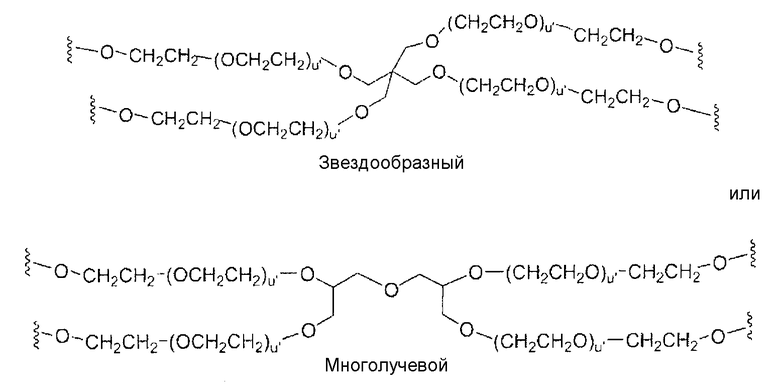
в которой:
(u') является целым числом от приблизительно 10 до приблизительно 570, чтобы предпочтительно обеспечивать полимеры, имеющие полную молекулярную массу приблизительно от 2000 Да до приблизительно 100000 Да, и предпочтительно приблизительно от 4000 Да до приблизительно 45000 Да; и при этом до 3 концевых частей остатка кэпированы метилом или другим низшим алкилом.
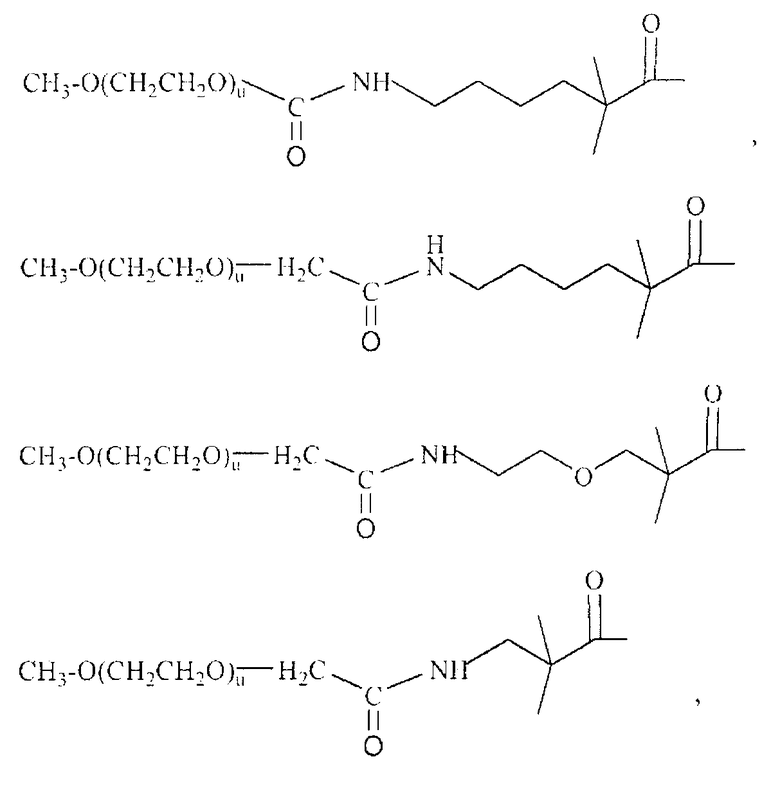
В некоторых предпочтительных вариантах осуществления все 4 цепи ПЭГ превращены в подходящие функциональные группы, то есть СК и т.д., для того, чтобы облегчить присоединение к рекомбинантному белку. Такие соединения до превращения включают:
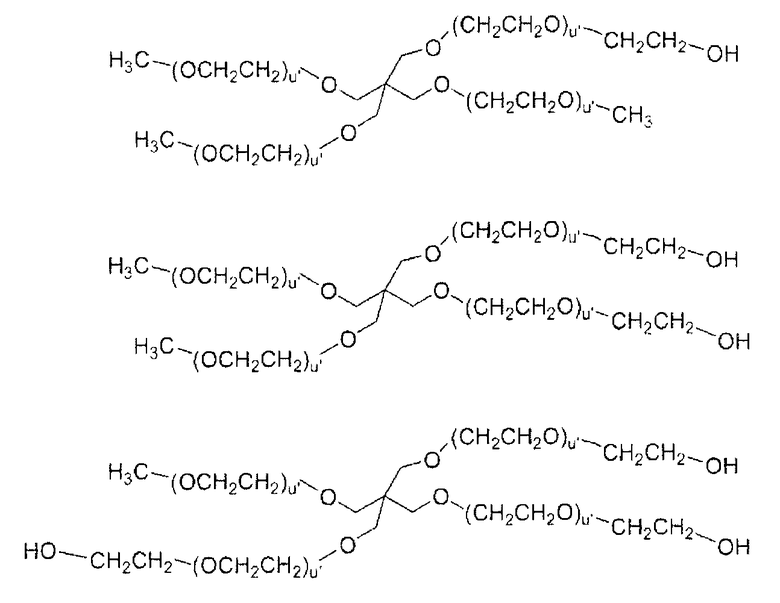
В наиболее предпочтительных аспектах изобретения активированный полиэтиленгликоль представляет собой полиэтиленгликоль, который обеспечивает образованием уретановой связи или амидной связи с белком.
В других альтернативных аспектах в активированных полимерах может применяться стерически затрудненный линкер на основе сложного эфира. См. PCT/US07/78593, озаглавленный "Polyalkylene Oxides Having Hindered Ester-Based Biodegradable Linkers", содержание которого включено в настоящую заявку путем отсылки. Например, неограничивающий список таких соединений включает:
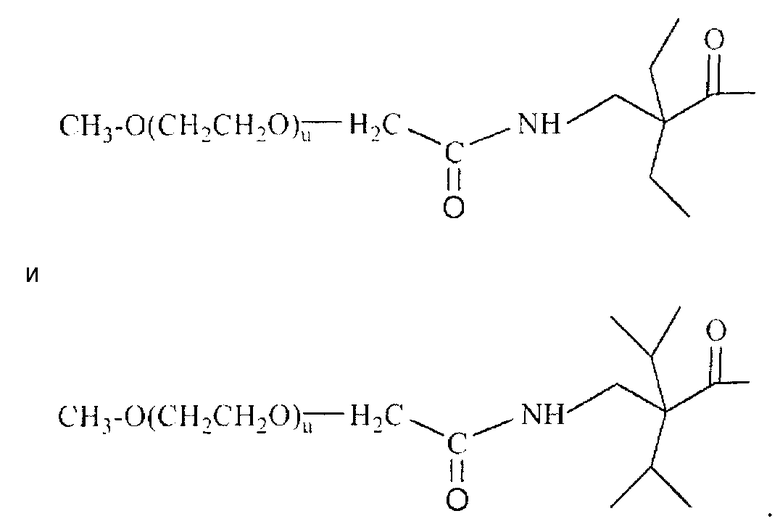
где (u) является целым числом, предпочтительно обеспечивающим полимеры, имеющие полную молекулярную массу приблизительно от 2000 Да до приблизительно 100000 Да.
В одном предпочтительном варианте осуществления ПЭГ конъюгат включает:
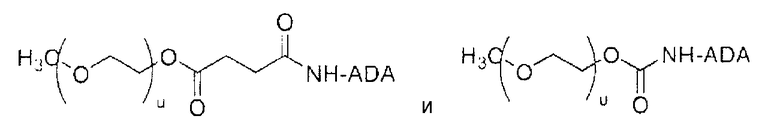 ,
,
где (u) является целым числом, обеспечивающим полимерную часть, имеющую молекулярную массу приблизительно от 2000 Да до приблизительно 100000 Да, и предпочтительно приблизительно от 4000 Да до приблизительно 45000 Да, более предпочтительно приблизительно 5000 Да.
Подходящие полимеры существенно различаются по массе. Полимеры, имеющие среднечисловую молекулярную массу в пределах от приблизительно 2000 до приблизительно 100000, обычно включены в рамки настоящего изобретения. Молекулярные массы от приблизительно 4000 до приблизительно 45000 являются предпочтительными, а от 5000 до приблизительно 12000 - наиболее предпочтительными. Включенные полимерные вещества также предпочтительно являются растворимыми в воде при комнатной температуре. Неограничивающий список таких полимеров включает гомополимеры полиалкиленоксидов, таких как полиэтиленгликоль (ПЭГ) или полипропиленгликоли, полиоксиэтилированные полиолы, их сополимеры и блок-сополимеры, при условии, что сохраняется водорастворимость блок-сополимеров. В дополнение к мПЭГ также могут применяться полимеры с концевыми C1-4-алкилами.
Способы получения полимеров, имеющих концевые карбоксильные группы, с высокой чистотой, описаны в заявке на патент США 11/328,662, содержание которой включено в настоящую заявку путем отсылки. Способы включают сначала получение сложного третичного алкилэфира полиалкиленоксида с последующим превращением в соответствующее производное карбоновой кислоты. Первая стадия получения ПАО карбоновых кислот способа включает формирование промежуточного соединения, такого как т-бутиловый эфир полиалкиленоксид-карбоновой кислоты. Данное промежуточное соединение образуется в реакции ПАО с т-бутилгалогенацетатом в присутствии основания, такого как т-бутилат калия. После образования промежуточного т-бутилового эфира производное полиалкиленоксид-карбоновой кислоты может быть легко получено с чистотой, превышающей 92%, предпочтительно, превышающей 97%, более предпочтительно, превышающей 99% и наиболее предпочтительно с чистотой, превышающей 99,5%.
В других альтернативных аспектах полимеры, имеющие концевые аминогруппы, могут использоваться для получения АДА конъюгатов. Способы получения полимеров, содержащих концевые амины, с высокой чистотой, описаны в заявках на патент США 11/508,507 и 11/537,172, содержание которых включено путем отсылки. Например, полимеры, имеющие азиды, взаимодействуют с восстановителем на основе фосфина, таким как трифенилфосфин, или с боргидридом щелочного металла, таким как NaBH4. В альтернативе полимеры, включающие уходящие группы, взаимодействуют с солями защищенных аминов, такими как калиевая соль метил-трет-бутилимидодикарбоната (KNMeBoc) или калиевая соль ди-трет- бутилимидодикарбоната (KNBoc2), с последующим снятием защиты с защищенной аминогруппы. Чистота полимеров, содержащих концевые амины, полученных с помощью указанных способов, превышает приблизительно 95% и предпочтительно превышает 99%.
Разветвление, которое обеспечивают полимеры патента 6,153,655, указанные выше, допускает вторичное или третичное разветвление в качестве способа увеличения нагрузки полимера на биологически активной молекуле из одиночной точки присоединения. Следует понимать, что растворимый в воде полимер может быть функционализирован с целью присоединения бифункциональных сшивающих групп при необходимости без лишней экспериментальной работы.
Полимерные вещества, включенные в настоящее изобретение, предпочтительно растворимы в воде при комнатной температуре. Неограничивающий список таких полимеров включает гомополимеры полиалкиленоксидов, таких как полиэтиленгликоль (ПЭГ) или полипропиленгликоли, полиоксиэтилированные полиолы, их сополимеры и блок-сополимеры, при условии, что сохраняется водорастворимость блок-сополимеров.
В качестве альтернативы полимерам на основе ПАО могут использоваться фактически неаллергенные материалы, такие как декстран, поливинилпирролидоны, полиакриламиды, такие как HPMA (гидроксипропилметакриламиды), поливиниловые спирты, полимеры на основе углеводов, сополимеры вышеуказанных полимеров, и т.п. Средние специалисты в данной области техники осведомлены, что вышеприведенный список является лишь иллюстративным, и что рассматриваются все полимерные материалы, обладающие описанными в настоящей заявке качествами. В рамках настоящего изобретения понятие "по существу или фактически неаллергенный" означает все материалы, являющиеся, как известно из уровня техники, нетоксичными и не вызывающими заметного иммунного ответа у млекопитающих.
D. Применение
Специалист сумеет оценить, что мутеин АДА настоящего изобретения с готовностью найдет применение в клинической ситуации для лечения любого заболевания или нарушения, поддающегося воздействию фермента АДА. Такое заболевание или нарушение является заболеванием или нарушением, которое реагирует на снижение уровней аденозина или дезоксиаденозина в тканях или крови. Такое заболевание или нарушение может включать, например, ТКИД, болезни легких, например, астму, а также раковые опухоли, которые реагируют на снижение локальных или системных уровней аденозина или дезоксиаденозина. Более подробные данные относительно применения АДА при лечении опухолей или рака приведены в поданной в одну и ту же дату с настоящей заявкой заявке (настоящего заявителя) на патент США ________ (которая испрашивает приоритет предварительной заявки на патент США 60/913,039), озаглавленной "Ферментативная противоопухолевая терапия" и полностью включенной путем отсылки в настоящую заявку. Терапевтическим средством может являться, например, мутеин рчАДА или мутеин рбАДА. Предпочтительно, терапевтический мутеин рАДА является конъюгированным с полимером, как описано выше, например, ПЭГилированным. Доза АДА или АДА-полимерного конъюгата индивидуализирована в зависимости от клинического ответа опухоли и профиля побочного действия у отдельного пациента - животного или человека. В примерах, приведенных ниже, наиболее высокая доза является максимально допустимой дозой, которую можно перенести.
Например, Adagen® поставляется коммерчески в форме 250Е бычьей АДА/мл. Это соответствует 2000 Е/кг для мыши весом приблизительно 25 г после введения 0,2 мл Adagen®. Конечно, специалист сумеет оценить, что доза АДА-полимерного конъюгата может быть также скорректирована в зависимости от размера конкретного полимера, химического линкера и валентности. Например, режим дозирования для полимерного конъюгата, включающего два или более ферментов АДА на полимер, регулируется согласно единицам АДА в мл раствора любого конкретного полимерного конъюгата АДА.
При обеспечении АДА или конъюгата АДА с ПЭГ посредством инъекции, оптимальный диапазон доз предпочтительно устанавливают при контроле плазмы. В целом желательно предоставить реципиенту такую дозировку, которая поддерживает активность АДА в плазме (минимальные уровни) в диапазоне от приблизительно 10 до 100 мкмоль/ч/мл, предпочтительно от приблизительно 15 до приблизительно 35 мкмоль/ч/мл (в анализе при 37°C), и демонстрирует снижение эритроцитарного аденозина, то есть дАТФ, до ≤ приблизительно 0,001-0,057 мкмоль/мл, предпочтительно приблизительно до 0,005 - приблизительно 0,015 мкмоль/мл в упакованных эритроцитах, или ≤ приблизительно 1% общего эритроцитарного аденозина (то есть, содержание АТФ + дАТФ), относительно нормального уровня аденозина, при измерении в образце, взятом до инъекции. Нормальное значение дАТФ составляет менее чем приблизительно 0,001 мкмоль/мл.
Доза, основанная на количестве фермента, варьирует, например, от приблизительно 0,1 Е/кг до приблизительно 30 Е/кг включительно, или выше, предпочтительно от приблизительно 0,5 Е/кг до приблизительно 20 Е/кг, и более предпочтительно от приблизительно 0,5 Е/кг до приблизительно 12 Е/кг (то есть, на кг веса пациента), как например, от приблизительно 0,5 Е/кг до приблизительно 5 Е/кг. Общая еженедельная доза может составлять до 40 Е/кг или более, если переносится реципиентом. Допускаются последующие повышения дозы в размере 5 Е/кг/неделя, до максимальной разовой дозы 30 Е/кг или более, если указанная доза переносится реципиентом. Обычно после еженедельных инъекций ADAGEN® при дозировке 15 Е/кг средний минимальный уровень активности АДА в плазме составляет от 20 до 25 мкмоль/ч/мл.
Нужно отметить, что доза 100 Е/кг является мышиной дозой, эквивалентной клинической детской дозе приблизительно 12 Е/кг.
Подробная информация относительно дозировки АДА известна в уровне техники и приведена на вкладыше с инструкцией по медицинскому применению препарата ADAGEN® (Enzon, Inc.), содержание которого включено в настоящую заявку.
ПРИМЕРЫ
Следующие примеры служат для обеспечения более полного понимания изобретения, но никоим образом не ограничивают фактический объем изобретения.
ПРИМЕР 1
Конструирование экспрессионного штамма E. Coli, экспрессирующего рекомбинантную АДА человека с заменой Cys/Ser в положении 74 зрелого белка
Опубликованную аминокислотную последовательность длиной 363 а.к. аденозиндеаминазы человека (GenBank NP_000013, включенная в настоящую заявку путем отсылки) проанализировали на присутствие кодонов цистеина. Пять положений в зрелом (с отщепленным N-концевым Met) полипептиде кодируют цистеин (C74, C 12, C153, C168, C261). В сконструированном и модифицированном гене, экспрессирующем АДА человека, лишь один из указанных пяти кодонов цистеина (Цистеин 74, TGC) заменили кодоном серина (TCC) (это 75 положение в транслированном белке). Определенную полипептидную последовательность (см. SEQ ID NO: 3) предоставили корпорации Blue Heron (Bothell, Вашингтон, США) для синтеза нового полноразмерного гена, включающего кодоны, оптимизированные для экспрессии в E. coli, с использованием стандартного химического синтеза с перекрывающимися олигонуклеотидными фрагментами. Вкратце, последовательность оптимизировали для бактериальной экспрессии в соответствии со стандартными бактериальными кодонами, используемыми для Escherichia coli K12, используя данные по кодонам, описанные Grantham R. et al.; 1981, "Codon catalogue usage in genome strategy modulated for gene expressivity," Nucleic Acid Res. 9:r43-r47, и Lathe, R. 1985, "Synthetic oligonucleotide probes deduced from amino acid sequence data, Theoretical and practical considerations," J. Mol. Biol.; 183:1-12.
Затем соответствующую последовательность РНК анализировали на предмет формирования шпилечной структуры или петель и подвергали вычислениям минимальной свободной энергии. Фланкирующие сайты рестрикции NdeI и BamHI вводили в концевые участки гена. После расщепления синтетической ДНК ферментами рестрикции NdeI и BamHI 1,1 т.п.н. ген лигировали с помощью T4 ДНК лигазы в плазмидный вектор pET-28a (Novagen), который был также расщеплен указанными двумя ферментами. Рекомбинантную плазмиду вводили в штамм E. coli BLR (DE3) или HMS 174 (DE3) с помощью электропорации, используя BTX Electro Cell Manipulator 600, согласно инструкциям изготовителя. Трансформированную культуру высевали на чашки с LB агаром, содержащие канамицин (15 мкг/мл) с целью отбора колоний, содержащих плазмиду pET-28a/ADAcysSer (обозначенных ADAc75s/pET28a:BLR (DE3) или ADAc75s/pET28a:HMS174 (DE3)). Нуклеотидную последовательность варианта гена АДА подтверждали посредством анализа последовательности ДНК с помощью ABI Prism 310 Genetic Analyzer, используя Big Dye Terminators. Последовательность ДНК, кодирующая открытую рамку считывания Ser74-рчАДА, соответствовала SEQ ID NO: 4.
Затем выделенные колонии очищали, пересевая на чашки, и анализировали на предмет экспрессии, индуцируемой изопропил-β-D-1-тиогалактопиранозидом (IPTG), в среде LB стандартными методами, такими как описанные в девятом выпуске Novagen pET System Manual, включенном путем отсылки в настоящую заявку.
Исследовали несколько параметров индукции, включая время, температуру и концентрацию индуктора. Предпочтительные условия индукции, включающие индукцию 50 мкМ IPTG в течение 12 часов при 25°C, обеспечивали продукцию АДА с высоким уровнем в цитоплазме бактерий-хозяев в количестве приблизительно 20% от суммарного белка клетки. Экспрессированный белок АДА, пронализированный с помощью электрофореза в ДСН-ПААГ, обладал требуемой молекулярной массой приблизительно 40 кДа (данные не показаны).
ПРИМЕР 2
Конструирование экспрессионного штамма E. Coli, экспрессирующего рекомбинантную бычью АДА с заменой Cys/Ser в положении 74 зрелого белка
Очищенный зрелый белок АДА, полученный из препаратов кишечного тракта крупного рогатого скота, является белком длиной 356 аминокислот, без N-концевого метионина, а также без шести C-концевых остатков, предсказанных из последовательности кДНК (GenBank NP_776312, включенной путем отсылки в настоящую заявку). Аминокислотная последовательность бычьей АДА анализировали на предмет присутствия кодонов цистеина. Пять положений в зрелом полипептиде кодируют цистеин (C74, C152, C153, C168, C261). В сконструированном и модифицированном синтетическом гене бычьей АДА только одно из указанных пяти положений цистеина (цистеин 74) заменили остатком серина. Это выполняли, вводя кодон серина (TCC) вместо нормального кодона цистеина в положение 74 зрелого полипептида (или положение 75 продукта трансляции). Ген также оптимизировали по кодонам для экспрессии в E. coli.
Вкратце, определенную полипептидную последовательность (см. SEQ ID NO: 1) предоставили компании BioCatalytics для синтеза нового полноразмерного гена, включающего кодоны, оптимизированные для экспрессии в E. coli, с использованием собственных способов BioCatalytics, которые включают химический синтез с перекрывающимися олигонуклеотидными фрагментами. Способы BioCatalytics более подробно описаны в патенте США 6366860, содержание которого полностью включено путем отсылки в настоящую заявку.
Экспрессию бычьей АДА анализировали в нескольких системах экспрессии. Например, в концевые участки гена вводили фланкирующие сайты рестрикции NdeI и BamHI. После расщепления синтетической ДНК ферментами рестрикции NdeI и BamHI ген 1,1 т.п.н. лигировали с помощью T4 ДНК лигазы в плазмидный вектор pET-9d (Novagen), который был также расщеплен указанными двумя ферментами. Рекомбинантную плазмиду вводили в штамм E. coli BLR (DE3) или HMS 174 (DE3) с помощью электропорации, используя BTX Electro Cell Manipulator 600, согласно инструкциям изготовителя. Трансформированную культуру высевали на чашки с LB агаром, содержащие канамицин (15 мкг/мл) с целью отбора колоний, содержащих плазмиду pET-9d/bADA (обозначенных bADA/pET9d:BLR(DE3) или bADA/pET9d:HMS 174(DE3)). Нуклеотидную последовательность варианта гена АДА подтверждали посредством анализа последовательности ДНК с помощью ABI Prism 310 Genetic Analyzer, используя Big Dye Terminators. Последовательность ДНК, содержащая открытую рамку считывания Ser74-рчАДА, приведена в SEQ ID NO: 2.
Затем выделенные колонии очищали, пересевая на чашки, и анализировали на предмет IPTG-индуцируемой экспрессии гена в среде LB стандартными методами, такими как описанные в девятом выпуске Novagen pET System Manual. Анализировали несколько параметров индукции, включая время, температуру и концентрацию индуктора. Предпочтительные условия индукции, включающие индукцию 0,3% лактозой в течение 12 часов при 37°C, обеспечивали продукцию АДА с высоким уровнем в цитоплазме бактерий-хозяев в количестве приблизительно 20% от суммарного белка клетки. Продукт АДА, пронализированный с помощью электрофореза в ДСН-ПААГ, обладал требуемой молекулярной массой приблизительно 40 кДа.
ПРИМЕР 3
Очистка мутеина рчАДА
Очистку мутеина рчАДА выполняли с использованием 3-стадийной хроматографической очистки, разработанной Enzon. Культивирование бактериальных клеток проводили со штаммом E. coli, экспрессирующим белок рчАДА с синтетического гена в плазмиде pET28a (Novagen) в клетке-хозяине HMS 174(DE3). В минимальную среду с глицерином включали рифампицин (200 мкг/мл) и канамицин (мкг/мл) с добавлением дрожжевого экстракта (30 г/л), и выращивали клетки при 28°C до OD600 11, после чего добавляли индуктор IPTG до конечной концентрации 5 мМ. Через 40 часов (OD600~110) клетки собирали центрифугированием и замораживали при -20°C. Вкратце, размороженную клеточную пасту (50 г) ресуспендировали в 1800 мл буфера, содержащего 10 мМ Трис [трисгидроксиметиламинометан], 1 мМ ДТТ, pH 8,0, и гомогенизировали при 1200 об/мин в течение 10 секунд на Tempest Virtis (SentryTM, Microprocessor, Boston, MA). Полученную суспензию пропускали через сито из нержавеющей стали (с отверстиями 250 мкм, №60, W.S Tyler) для удаления крупных частиц. Однородную клеточную суспензию гомогенизировали с использованием гомогенизатора высокого давления в 3 циклах при 103,4 МПа (15000 psi) (установку охлаждали льдом) (MicroFluidizer, Microfluidics Corp., Model#110Y, Boston, MA). В конце микрогомогенизации 200 мл того же указанного выше буфера использовали для промывки установки, а полученный раствор объединяли с вышеуказанной суспензией. Растворимый белок из лизатов клеток выделяли центрифугированием при 16000 об/мин в течение 40 минут при 4°C (Sorvall® RC 5C plus, ротор SLA-1000). Супернатант собирали осторожно, чтобы избежать нежелательного смешивания. Уровень pH доводили до 8,0, после чего добавляли 1 мМ MgCl2 и 20 мг/мл ДНКазы, и инкубировали при комнатной температуре в течение 2 часов. Затем pH доводили до 6,5 1 н. HCl. Второе центрифугирование проводили так же, как описано выше, супернатант собирали и добавляли ЭДТА до концентрации 2 мМ с последующим фильтрованием с использованием 90 мм фильтровального прибора Nalgene®. Объем отфильтрованного супернатанта составлял 500 мл, концентрация общего белка по методу BCA (с бицинхониновой кислотой) составила 8,5 мг/мл.
Клеточный экстракт (100 мл) доводили до pH 7,2, 4,5 мС/см и наносили на HiTrap® DEAE ff (ff означает высокую скорость потока) в 20 мМ Бис-Трис, 20 мМ NaCl, pH 6,5, и элюировали в 20 мМ Бис-Трис, 500 мМ NaCl, pH 6,5. Пиковые фракции анализировали с помощью ферментного анализа и электрофореза в ДСН-ПААГ, после чего добавляли сульфат аммония до концентрации 1,5 М в 20 мМ NaHPO4, pH 6,5 и наносили на колонку HiTrap Phenyl ff. Белок элюировали в градиенте буфера для нанесения и 20 мМ NaHPO4, pH 6,5. Пиковую фракцию (55 мл, 0,4 мг/мл) подвергали диафильтрации против буфера, содержащего 20 мМ NaHPO4, 1 мМ ЭДТА, 1 мМ ДТТ, pH 6,5 и наносили на HiTrap SP-Sepharose ff и элюировали в 20 мМ NaHPO4, 500 мМ NaCl, 1 мМ ЭДТА, 1 мМ ДТТ, pH 6,5. Собранная фракция содержала очищенный белок АДА (77 мл, 0,1 мг/мл).
ПРИМЕР 4
Очистка рекомбинантного бычьего белка АДА
Очистку мутеина рбАДА, экспрессируемого клоном Примера 2, выполняли с использованием 3-стадийной хроматографической очистки, разработанной Enzon. Вкратце, 200 г размороженной клеточной пасты (полученной от Blue Hereon или Biocatalytics, соответственно), которую хранили при -80°C, ресуспендировали в 1800 мл буфера, содержащего 20 мМ Бис-Трис, 1 мМ ЭДТА, pH 7,4, и гомогенизировали при 1200 об/мин в течение 5 минут на Tempest Virtis (SentryTM, Microprocessor, Boston, MA). Полученную суспензию пропускали через сито из нержавеющей стали (с отверстиями 250 мкм, №60, W.S Tyler) для удаления крупных частиц. Однородную суспензию клеток гомогенизировали с использованием гомогенизатора высокого давления в 3 циклах при 103,4 МПа (15000 psi) (установку охлаждали льдом) (MicroFluidizer, Microfluidics Corp., Model#110Y, Boston, MA). В конце микрогомогенизации 200 мл того же указанного выше буфера использовали для промывки установки, а полученный раствор объединяли с вышеуказанной суспензией. Растворимый белок из лизатов клеток выделяли центрифугированием при 7100 об/мин (12000×g) в течение 60 минут при 4°C (Avanti J-201, Beckman Coulter, ротор JLA8.1000). Супернатант собирали осторожно, чтобы избежать нежелательного смешивания.
Для удаления нуклеотидов в данном клеточном экстракте к вышеуказанному супернатанту добавляли полиэтиленимин (PEI) (до конечной концентрации 0,15%, масс/об) и тщательно смешивали в течение 10 мин. Затем полученный клеточный экстракт оставляли на ночь при 4°C. Осадок из указанного ночного образца удаляли с помощью центрифугирования при 7100 об/мин (12000×g) в течение 60 минут при 4°C (Avanti J-201, Beckman Coulter, ротор JLA8.1000). Точно так же супернатант осторожно собирали, чтобы избежать нежелательного смешивания. Чтобы поспособствовать связыванию АДА на первой колонке к данному клеточному экстракту медленно добавляли 10%-ый PEG4600, и pH полученного клеточного экстракта медленно доводили до 6,5 1 н. NaOH и 1 н. HCl. Затем супернатант снова центрифугировали при 7100 об/мин (12000×g) в течение 60 минут при 4°C (Avanti J-201, Beckman Coulter, ротор JLA8.1000) перед нанесением на следующую колонку.
Клеточный экстракт наносили на предварительно уравновешенную колонку Capto Q (номер по кат. 17-5316-01, GE Healthcare, Piscataway, NJ). Объем слоя 350 мл в колонке XK-50 заранее насыщали буфером, содержащим 20 мМ Бис-Трис, 1 мМ ЭДТА, pH 6,5. Перед элюированием АДА из колонки уравновешивающим буфером с 80 мМ NaCl, для удаления примесей сначала выполняли элюирование с 60 мМ и 70 мМ NaCl. Профиль элюции анализировали на активность АДА, с помощью электрофореза в ДСН-ПААГ, вестерн-блоттинга и ОФ-ВЭЖХ.
После колонки Capto Q одну за другой проводили две очистки с помощью хроматографии гидрофобного взаимодействия (HIC), чтобы дополнительно повысить чистоту белка. Первую HIC-очистку проводили на октил-сефарозе 4FF (номер по кат. 17-0946-02, GE Healthcare, Piscataway, NJ). Объединенные фракции АДА после колонки Capto Q непосредственно осаждали порошком сульфата аммония при концентрации 1,5 М (NH4)2SO4, и доводили pH до 6,5. Отфильтрованный образец (Nalgene Nunc, номер по кат. 540887, MEMB 0.2 PES, Rochester, NY) наносили на первую колонку HIC, предварительно уравновешенную 1,5 М (NH4)2SO4, 20 мМ фосфатом калия, 1 мМ ЭДТА, pH 6,5 (объем слоя 150 мл, в XK-50, GE Healthcare, Piscataway, NJ). Белок АДА элюировали в градиенте сульфата аммония, а профиль чистоты полученного элюата определяли с помощью электрофореза в ДСН-ПААГ и ОФ-ВЭЖХ. Белок АДА во фракциях первой колонки HIC объединяли и доводили концентрацию (NH4)2SO4 до 1 М, после чего непосредственно наносили на вторую колонку HIC (объем слоя 150 мл, XK-50, HIC Phenyl HP, номер по кат. 17-1082-01, Piscataway, NJ), предварительно уравновешенную 1 М (NH4)2SO4, 20 мМ KH2PO4-K2HPO4, 1 мМ ЭДТА, pH 6,5. АДА элюировали в градиенте сульфата аммония от 1 М до 300 мМ в 20 мМ KH2PO4-K2HPO4, 1 мМ ЭДТА, pH 6,5. Чистоту АДА в полученных фракциях анализировали с помощью электрофореза в ДСН-ПААГ и ОФ-ВЭЖХ. Затем очищенные рбАДА или рчАДА обессоливали и концентрировали с помощью систем LabScale™ TFF (Membrane BioMax 5, Bedford, MA) против буфера для хранения (например, 100 мМ фосфат натрия, 1 мМ ЭДТА, pH 6,5).
ПРИМЕР 5
Анализы стабильности рбАДА и Ser74-рбАДА
Следующие анализы проводили с целью продемонстрировать, что стабильность рбАДА при окислительной деструкции была действительно улучшена благодаря мутации с заменой cys74/ser74. Для анализа стабильности использовали образцы рекомбинантной бычьей АДА (рбАДА) и рекомбинантной бычьей АДА с мутацией cys74/ser74 (Ser-74-рбАДА) в концентрациях приблизительно 0,5 мг/мл в натрий фосфатном буфере (pH 7,8). Стабильность контролировали с помощью обращенно-фазовой ВЭЖХ (ОФ-ВЭЖХ), используя УФ детекцию при 220 нм и масс-спектрометрическую детекцию (масс-спектрометр Micromass Q-TOF с ионизацией электрораспылением). Условия ВЭЖХ были следующими:
Чистоту соединений определяли с помощью ОФ-ВЭЖХ анализа в исходный момент начала анализа стабильности и в различные моменты времени, включая 4, 8 и 17 дней после начала анализа. Нужно отметить, что образцы рбАДА (не мутеина) перед данным исследованием хранились приблизительно два месяца и уже подверглись некоторому разложению. Образец Ser74-рбАДА был подготовлен недавно и являлся относительно чистым. Однако в рамках данного исследования анализируемым параметром являлось различие в чистоте между исходным моментом времени и через 17 дней инкубирования при 25°C.
Как показано в Таблице 1, чистота рбАДА составляла 83,7% на исходный момент времени и уменьшилась до 66,1% спустя 17 дней, что указывает на то, что 17,6% рбАДА разложилось в течение указанного промежутка времени. Масс-спектрометрический анализ хроматографически разделенных пиков показал, что главный продукт деградации, элюируемый на 31,851 минуте и занимавший 30,5% площади хроматограммы, имел массу на 32 Да выше, чем рбАДА. Данное изменение массы соответствует присоединению к рбАДА 2 атомов кислорода с формированием продукта деградации, содержащего сульфиновую кислоту вместо свободного цистеина в положении 74 рбАДА. Масса продукта деградации, имевшего минорный пик, элюируемого на 32,538 минуте, соответствовала присоединению 1 атома кислорода к рбАДА с формированием продукта деградации, содержащего сульфеновую кислоту вместо свободного цистеина в положении 74 рбАДА. Ser74-рбАДА, содержащая остаток серина, заменяющий реакционно-способный остаток цистеина 74, показала небольшое разложение в течение 17 дней, при этом чистота через 17 дней (97,9%) фактически не изменилась по сравнению с чистотой на начальный момент времени (97,2%). Это доказывает, что цистеин 74 действительно является источником окислительной деструкции, которая происходит в рбАДА, а мутация с заменой указанного остатка на серин, который не склонен к окислению, предотвращает подобное разложение.
(pH 7,8) при 25°C
ПРИМЕР 6
Применение мутеинов АДА в терапии АДА-дефицитных пациентов, страдающих ТКИД
Описанные мутированные ферменты АДА применяли в терапевтических схемах, которые на настоящий момент применяют для ADAGEN®. Ser74-rb или рчАДА может быть модифицирован посредством конъюгирования с полиэтиленгликолем (ПЭГ), например, с 11-17 ПЭГ 5 кДа полимерами на белок АДА. ПЭГилированные препараты мутеина АДА вводят в стерильный раствор хлорида натрия при pH 7,2-7,4 и в концентрации приблизительно 250 единиц в миллилитре. ПЭГилированный мутеин АДА вводят пациентам перентерально, например, внутримышечно. Пациенты, имеющие показания к подобной терапии, включают пациентов с тяжелым комбинированным иммунодефицитом, вызванным недостаточной активностью АДА. Введение ПЭГ-АДА мутеина обычно выполняют через каждые семь дней согласно схеме дозирования 10 Е/кг для первой дозы и 20 Е/кг в неделю для последующих доз. Ser74-рб или рч ПЭГ-АДА хранят при 2-8°C в водном растворе с одной дозой во флаконе объемом 1,5 миллилитра. Схема дозирования разработана таким образом, чтобы обеспечивать уровни активности АДА в плазме порядка 15-35 мкмоль/ч/мл (в анализе при 37°C) и снижать эритроцитарный дАТФ до ≤0,005-0,015 мкмоль/мл упакованных эритроцитов.
ПРИМЕР 7
Получение ПЭГилированной Ser74-рбАДА через образование
уретановой связи
СК-ПЭГ (N-гидроксисукцинимидилкарбонат-активированный полиэтиленгликоль, 0,084 ммоль) добавляли к раствору Ser74-рбАДА (0,00027 ммоль) в 3 мл натрий фосфатного буфера (0,1 М, pH 7,8) при легком перемешивании. Раствор перемешивали при 30°C в течение 30 минут. С целью контроля ПЭГ-конъюгирования использовали ГПХ-колонку (Zorbax GF-450). В конце реакции (о чем свидетельствовало отсутствие нативного фермента) смесь разбавляли 12 мл буфера для приготовления композиции (0,05 М фосфат натрия, 0,85% хлорид натрия, pH 7,3), после чего подвергали диафильтрации с использованием концентратора Centriprep (Amicon) для удаления непрореагировавшего ПЭГ. Диафильтрацию продолжали при 4°C столько, сколько необходимо, пока свободного ПЭГ более не обнаруживалось при смешивании равных количеств фильтрата и 0,1% PMA (полиметакриловой кислоты в 0,1 М HCl).
ПРИМЕР 8
Получение ПЭГилированной Ser74-рчАДА через образование
уретановой связи
Реакцию СК-ПЭГ (0,084 ммоль) и Ser74-рчАДА (0,00027 ммоль) проводили с использованием тех же условий, как описано в Примере 7.
ПРИМЕР 9
Получение ПЭГилированной Ser74-рбАДА через образование
амидной связи
СС-ПЭГ (N-гидроксисукцинимидилсукцинат-активированный полиэтиленгликоль, 0,084 ммоль) добавляли к раствору Ser74-рбАДА (0,00027 ммоль) в 3 мл натрий фосфатного буфера (0,1 М, pH 7,8) при легком перемешивании. Раствор перемешивали при 30°C в течение 30 минут. С целью контроля ПЭГ-конъюгирования использовали ГПХ-колонку (Zorbax GF-450). В конце реакции (о чем свидетельствовало отсутствие нативного фермента) смесь разбавляли 12 мл буфера для приготовления композиции (0,05 М фосфат натрия, 0,85% хлорид натрия, pH 7,3), после чего подвергали диафильтрации с использованием концентратора Centriprep (Amicon) для удаления непрореагировавшего ПЭГ. Диафильтрацию продолжали при 4°C столько, сколько необходимо, пока свободного ПЭГ более не обнаруживалось при смешивании равных количеств фильтрата и 0,1% PMA (полиметакриловой кислоты в 0,1 М HCl).
ПРИМЕР 10
Получение ПЭГилированного мутеина рчАДА через образование амидной связи
Реакцию СС-ПЭГ (0,084 ммоль) и мутеина рчАДА (0,00027 ммоль) проводили с использованием тех же условий, как описано в Примере 9.








Изобретение относится к области биотехнологии. Описаны выделенная рекомбинантная аденозиндеаминаза, включающая полипептид SEQ ID NO: 1 или вариантный полипептид SEQ ID NO: 1 выделенной рекомбинантной аденозиндеаминазы, где вариантный полипептид SEQ ID NO: 1 включает одну или более аминокислотных замен, выбранных из группы, состоящей из: Gln вместо Lys198; Ala вместо Thr245; и Arg вместо Gly351, и кодирующая ее ДНК. Представлен конъюгат полиалкиленоксида с указанной аденозиндеаминазой для лечения аденозиндеаминаза-опосредованных заболеваний, где аденозиндеаминаза включает от 11 до 17 цепей полиалкиленоксида с молекулярной массой 5 кДа на белок АДА. Предложены способы очистки рекомбинантной аденозиндеаминазы, включающие очистку белка с помощью ионообменной хроматографии или очистку белка с помощью хроматографии гидрофобного взаимодействия. Кроме того, представлены препараты рекомбинантной аденозиндеаминазы, полученные указанными способами. Изобретение позволяет получить рекомбинантную аденозиндеаминазу, обладающую повышенной стабильностью. 8 н. и 6 з.п. ф-лы, 1 табл., 10 пр.
1. Выделенная рекомбинантная аденозиндеаминаза, включающая полипептид SEQ ID NO: 1 или вариантный полипептид SEQ ID NO: 1 выделенной рекомбинантной аденозиндеаминазы, где вариантный полипептид SEQ ID NO: 1 включает одну или более аминокислотных замен, выбранных из группы, состоящей из: Gln вместо Lys198; Ala вместо Thr245; и Arg вместо Gly351.
2. Рекомбинантная аденозиндеаминаза по п.1, кодированная молекулой ДНК SEQ ID NO: 2.
3. Конъюгат полиалкиленоксида с аденозиндеаминазой для лечения аденозиндеаминаза-опосредованных заболеваний, где аденозиндеаминаза является рекомбинантной аденозиндеаминазой по п.1, где рекомбинантная аденозиндеаминаза включает от 11 до 17 цепей полиалкиленоксида с молекулярной массой 5 кДа на белок АДА.
4. Конъюгат полиалкиленоксида с аденозиндеаминазой по п.3, где полиалкиленоксид является полиэтиленгликолем.
5. Конъюгат полиалкиленоксида с аденозиндеаминазой по п.4, где полиэтиленгликоль конъюгирован с рекомбинантной аденозиндеаминазой через линкер, выбранный из группы, состоящей из сукцинимидилкарбонатного, тиазолидинтионового, уретанового и амидного линкеров.
6. Конъюгат полиалкиленоксида с аденозиндеаминазой по п.4, где полиэтиленгликоль ковалентно присоединен к эпсилон-аминогруппе Lys рекомбинантной аденозиндеаминазы.
7. Конъюгат полиалкиленоксида с аденозиндеаминазой по п.4, где полиэтиленгликоль конъюгирован с рекомбинантной аденозиндеаминазой через сукцинимидилкарбонатный линкер.
8. Способ очистки рекомбинантной аденозиндеаминазы по п.1, включающий очистку белка с помощью ионообменной хроматографии.
9. Способ очистки рекомбинантной аденозиндеаминазы по п.1, включающий очистку белка с помощью хроматографии гидрофобного взаимодействия.
10. Препарат рекомбинантной аденозиндеаминазы, полученный способом по п.8.
11. Препарат рекомбинантной аденозиндеаминазы, полученный способом по п.9.
12. Выделенная ДНК, которая кодирует рекомбинантную аденозиндеаминазу, имеющую аминокислотную последовательность, включающую SEQ ID NO: 1.
13. Выделенная ДНК, которая кодирует рекомбинантную аденозиндеаминазу по п.1.
14. Выделенная рекомбинантная аденозиндеаминаза по п.1, включающая полипептид SEQ ID NO: 1.
| DIPA BHAUMIK, et al | |||
| "Mutational Analysis of Active Site Residues of Human Adenosine Deaminase", THE JOURNAL OF BIOLOGICAL CHEMISTRY, Vol.268, No | |||
| E, Issue of March 15, 1993, pp.5464-5470 | |||
| US 5849549 A, 15.12.1998 | |||
| KOSUKE MORIKAWA, et al | |||
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
Авторы
Даты
2013-06-27—Публикация
2008-04-18—Подача