В данной заявке заявлен приоритет предварительной заявки США 61/024658, поданной 30 января 2008, содержание которой включено таким образом посредством ссылки во всей ее полноте для всех целей.
Настоящее изобретение относится к мутеину липокалина слезной жидкости человека (hTLc), обладающему обнаруживаемой способностью связывания с Met-рецепторной тирозинкиназой (c-Met), или ее доменом, или фрагментом. Такой мутеин содержит аминокислотные замены по меньшей мере в одном положении последовательности, соответствующем положениям последовательности 26-34, 56-58, 80, 83, 104-106 и 108 в hTLC. Изобретение также относится к соответствующим молекулам нуклеиновых кислот, кодирующим такой мутеин, и к способу их получения. Кроме того, изобретение относится к способу продуцирования такого мутеина. Наконец, изобретение направлено на фармацевтическую композицию, содержащую такой липокалиновый мутеин, а также на различные применения мутеина.
Met-рецепторную тирозинкиназу (RTK) сначала идентифицировали как продукт человеческого онкогена Tpr-Met (Park et al., Proc. Natl. Acad. Sci, USA, Vol.84, стр.6379-6383, 1987). Лиганд для c-Met идентифицировали как фактор роста гепацитов (HGF). HGF первоначально идентифицировали как митоген для гепатоцитов при культивировании. HGF идентичен рассеивающему фактору (SF), произведенному из фибропласта фактору, который способствует рассеянию слоев эпителиальных клеток, а также генезису ветвящихся трубочек эпителия, выращенному в объемных культурах. HGF/SF является, таким образом, уникальным фактором роста, который вызывает множественные клеточные ответы, включая митогенез, клеточную подвижность и морфогенез.
HGF/SF и c-Met экспрессируются во многих тканях у взрослых. Белок с-Met экспрессируется, главным образом, в эпителиальных клетках, но также в эндотелиальных клетках, нервных клеток, гепатоцитах, гематопоэтических клетках, меланоцитах. Возможно, c-Met представляет собой один из наиболее важных мембранных рецепторов. Его активация играет ключевую роль в клеточной физиологии: митогенезе, мотогенезе, морфогенезе. Представляется, что HGF/SF продуцируется клетками мезенхимного происхождения.
Если HGF/SF активирует c-Met, то первыми белками, активируемыми по ходу транскрипции, являются Grb2 (белок 2, связывающийся с рецептором фактора роста) и Gab 1 (связывающий элемент 1, ассоциированный с белком 2, связывающимся с рецептором фактора роста). Grb2, в свою очередь, может активировать ряд киназных путей, включая путь от Ras до Raf до Мек и до МАРК (митоген-активированная протеинкиназа). Gab 1 активирует PI3K (фосфоинозитид-3-киназу), которая активирует STAT3 (преобразователь сигнала и активатор транскрипции). Активация c-Met также индуцирует активацию бета-катенина, ключевого компонента wnt-пути, который перемещается в ядро и участвует в регуляции транскрипции.
Путь HGF/c-Met играет важную роль в развитии рака. Во-первых, посредством активации ключевых онкогенных путей (Ras, PI3K/STAT3, бета-катенин), во-вторых, посредством пролиферации эндотелиальных клеток (неоангиогенез), в-третьих, посредством усиленного продуцирования протеазы и, следовательно, клеточной диссоциации, приводящей к метастазированию.
Различные новые терапевтические подходы, некоторые из них в фазе I или II клинических испытаний, нацелены на путь HGF/c-Met. Такие подходы включают анти-HGF моноклональные антитела, такие как гуманизированная форма AV299 от AVEO или полностью человеческое антитело, называемое антителом АМВ 102 от Amgen (AMGI 02). Другой подход представляет собой использование укороченных вариантов c-Met, которые действуют, как ловушки. Одним таким примером является укороченная версия, названная CGEN241, от COMPUGEN. Также для терапевтической цели используют ингибиторы протеинкиназы (небольшие молекулы), которые блокируют c-Met-индуцированные пути. Примеры таких небольших молекул ингибиторов протеинкиназы включают ARQI 97 от ARQULE, XL880 от EXELIXIS, SGX523 от SGX Pharmaceuticals, MP470 от SUPERGEN или PF2341066 от PFIZER.
Однако по-прежнему желательно иметь дополнительные доступные соединения, которые связывают c-Met и которые можно, например, использовать для терапевтических целей.
Таким образом, целью изобретения является предложение мутеинов липокалина слезной жидкости человека, обладающих высоким сродством связывания с данной мишенью.
Данная цель достигается, например, с помощью мутеина липокалина слезной жидкости человека (hTIc), имеющего обнаруживаемую аффинность связывания с Met-рецепторной тирозинкиназой человека (c-Met), или ее доменом, или фрагментом, где такой мутеин содержит аминокислотную замену по меньшей мере в одном положении последовательности, соответствующем положениям последовательности hTLC 26-34, 56-58, 80з83, 104-106 и 108.
В родственном аспекте настоящего изобретения предлагается способ получения мутеина липокалина слезной жидкости человека, где мутеин связывает c-Met с обнаруживаемой аффинностью связывания. Данный способ включает:
(а) подвергание молекулы нуклеиновой кислоты, кодирующей липокалин слезной жидкости человека, мутагенезу по меньшей мере в одном кодоне в каком-либо из положений аминокислотной последовательности 26-34, 56-58, 80, 83, 104-106 и 108 линейной полипептидной последовательности нативного зрелого липокалина слезной жидкости человека, где по меньшей мере один из кодонов, кодирующий остатки цистеина в положениях последовательности 61 и 153 линейной полипептидной последовательности зрелого липокалина слезной жидкости человека, мутирован, чтобы кодировать любой другой аминокислотный остаток, таким образом получается совокупность нуклеиновых кислот, кодирующих мутеины липокалина слезной жидкости человека,
(б) экспрессирование одной или более молекул нуклеиновой кислоты мутеина, полученных в (а), в системе экспрессии, таким образом получается один или более чем один мутеин, и
(в) обогащение одного или более мутеинов, полученных на стадии (б) и имеющих обнаруживаемую аффинность связывания в отношении Met, путем селекции и/или изоляции.
В данном контексте следует отметить, что авторы изобретения неожиданно обнаружили, что удаление структурной дисульфидной связи (на уровне библиотеки соответствующих неподвергнутых воздействию нуклеиновых кислот) липокалина дикого типа из слезной жидкости, которую образуют остатки 61 и 153 цистеина (смотри Breustedt, et al. (2005), The 1.8-A crystal structure of human tear lipocalin reveals an extended branched cavity with capacity for multiple ligands. J. Biol. Chem. 280, 484-493), дает мутеины липокалина слезной жидкости, которые не только устойчиво сложены, но, кроме того, также способны связывать данный искусственный лиганд с аффинностью в низком пикомолярном интервале.
Термин "мутагенез" при использовании в данном описании изобретения означает, что экспериментальные условия выбраны так, что аминокислота, встречающаяся в природе в данном положении последовательности липокалина слезной жидкости человека (Swiss-Prot data bank entry P31025), может быть заменена по меньшей мере одной аминокислотой, которая не присутствует в данном конкретном положении в соответствующей природной полипептидной последовательности. Термин "мутагенез" также включает (дополнительную) модификацию длины сегментов последовательности путем делеции или вставки одной или более аминокислот. Таким образом, в рамки изобретения входит то, что, например, одна аминокислота в выбранном положении последовательности заменена отрезком из трех случайных мутаций, что приводит к вставке двух аминокислотных остатков по сравнению с длиной соответствующего сегмента белка дикого типа. Такую вставку делеции можно вводить независимо друг от друга в любой из пептидных сегментов, который может быть подвержен мутагенезу по изобретению. В одном типичном воплощении изобретения вставку нескольких мутаций можно вводить в петлю АВ выбранного липокалинового каркаса (смотри международную патентную заявку WO 2005/019256, которая включена в данное описание изобретения посредством ссылки во всей полноте). Термин "случайный мутагенез" означает, что в некотором положении последовательности отсутствует заданная единственная аминокислота (мутация), но что по меньшей мере две аминокислоты могут быть введены с определенной вероятностью в заданное положение последовательности во время мутагенеза.
Кодирующую последовательность липокалина слезной жидкости человека (Redl, В. et al. (1992) J. Biol, Chem. 267, 20282-20287) используют в качестве отправной точки для мутагенеза пептидных сегментов, выбранных в настоящем изобретении. В отношении мутагенеза указанных аминокислотных положений, специалист в данной области техники имеет в своем распоряжении различные общепринятые стандартные способы для сайт-направленного мутагенеза (Sambrook, J. et al. (1989), выше). Широко используемым способом является введение мутаций при помощи PCR (полимеразной цепной реакции), с использованием смесей синтетических олигонуклеотидов, которые несут композицию вырожденных оснований в желательных положениях последовательности. Например, использование кодона NNK или NNS (где M = аденин, гуанин или цитозин или тимин; K = гуанин или тимин; S = аденин или цитозин) позволяет включить все 20 аминокислот в дополнение к янтарному стоп-кодону в процессе мутагенеза, тогда как кодон WS ограничивает количество возможно включенных аминокислот до 12, так как он исключает аминокислоты Cys, Ile, Leu, Met, Phe, Trp, Tyr, Val из введенных в выбранное положение полипептидной последовательности; использование кодона HMS (где M = аденин или цитозин), например, ограничивает количество возможных аминокислот до 11 в выбранном положении последовательности, так как он исключает аминокислоты Arg, Cys, Gly, Ile, Leu, Met, Phe, Trp, Val из введенных в выбранное положению последовательности. В этом отношении следует отметить, что кодоны для других аминокислот (кроме обычных 20 встречающихся в природе аминокислот), таких как селеноцистеин или пирролизин, также могут быть включены в нуклеиновую кислоту мутеина. Также возможно, как описано в Wang, L., et al. (2001) Science 292, 498-500, или Wang, L., and Schultz, P.G. (2002) Chem. Comm. 1, 1-11, использовать "искусственные" кодоны, такие как UAG, которые обычно признают стоп-кодонами, для вставки других необычных аминокислот, например орто-метил-L-тирозина или пара-аминофенилаланина.
Использование нуклеотидных конструктивных блоков с пониженной специфичностью пар оснований, таких как, например, инозин, 8-оксо-2'-дезоксигуанозин или 6(2-дезокси-β-D-рибофуранозил)-3,4-дигидро-8Н-пириминдо-1,2-оксазин-7-он (Zaccolo et al. (1996) J. Mol. Biol. 255, 589-603), является еще одной возможностью введения мутаций в выбранный сегмент последовательности.
Еще одной возможностью является так называемый триплет-мутагенез. В этом способе используются смеси разных нуклеотидных триплетов, каждый из которых кодирует одну аминокислоту, для включения в кодирующую последовательность (Virnekas В, Ge L, Pluckthun A, Schneider KC, Wellnhofer G, Moroney SE. 1994 Trinucleotide phosphoramidites: ideal reagents for synthesis of mixed oligonucleotides for random mutagenesis. Nucleic Acids Res 22, 5600-5607).
Одна возможная методика ввода мутаций в выбранные участки соответствующих полипептидов основана на использовании четырех олигонуклеотидов, каждый из которых частично производят из одного из соответствующих сегментов последовательности, подлежащих мутированию. При синтезировании таких олигонуклеотидов специалист в данной области техники может использовать смеси нуклеиновокислотных конструктивных блоков для синтеза таких нуклеотидных триплетов, которые соответствуют аминокислотным положениям, подлежащим мутированию, так, что случайным образом возникают кодоны, кодирующие все природные аминокислоты, что, наконец, приводит к образованию библиотеки липокалиновых пептидов. Например, первый олигонуклеотид соответствует по своей последовательности - за исключением мутированных положений - кодирующей нити для пептидного сегмента, подлежащего мутированию, в наиболее M-концевом положении липокалинового полипептида. Соответственно, второй олигонуклеотид соответствует некодирующей нити для второго сегмента последовательности, следующего в полипептидной последовательности. Третий олигонуклеотид соответствует, в свою очередь, кодирующей нити соответствующего третьего сегмента последовательности. Наконец, четвертый олигонуклеотид соответствует некодирующей нити четвертого сегмента последовательности. Полимеразную цепную реакцию можно осуществлять с соответствующим первым и вторым олигонуклеотидом и отдельно, при необходимости, с соответствующим третьим и четвертым олигонуклеотидом.
Продукты амплификации обоих таких взаимодействий можно объединять различными известными способами в одну нуклеиновую кислоту, содержащую последовательность от первого до четвертого сегментов последовательности, где мутации были введены в выбранные положении. Для этого оба продукта можно, например, подвергать новой полимеразной цепной реакции, используя фланкирующие олигонуклеотиды, а также одну или более медиаторные нуклеиновокислые молекулы, которые составляют последовательность между вторым и третьим сегментом последовательности. В выборе количества и расположения в последовательности олигонуклеотидов, используемой для мутагенеза, специалист в данной области техники имеет в своем распоряжении многочисленные альтернативы.
Молекулы нуклеиновых кислот, определенные выше, можно соединять посредством лигирования с отсутствующими 5'- и 3'-последовательностями нуклеиновой кислоты, кодирующей липокалиновый полипептид и/или вектор, и можно клонировать в известный организм-хозяин. Для сшивания и клонирования доступно множество общепринятых способов (Sambrook, J. et al. (1989), выше). Например, распознаваемые последовательности для рестрикционных эндонуклеаз, также присутствующих в последовательности клонирующего вектора, можно сконструированы в последовательности синтетических олигонуклеотидов. Таким образом, после амплификации соответствующего продукта PCR и ферментного расщепления, полученный фрагмент можно легко клонировать, используя соответствующие распознаваемые последовательности.
Более длинные сегменты последовательности в гене, кодирующем белок, выбранный для мутагенеза, также можно подвергать случайному мутагенезу известными способами, например посредством полимеразной цепной реакции в условиях повышенной частоты появления ошибок, при помощи химического мутагенеза, или используя бактериальные штаммы мутаторов. Такие способы также можно использовать для дополнительной оптимизации целевой аффинности или специфичности липокалинового мутеина. Мутации, вероятно происходящие за пределами сегментов экспериментального мутагенеза, часто допустимы или даже могут оказываться полезными, например, если они способствуют улучшенной эффективности фолдинга или стабильности фолдинга липокалинового мутеина,
Термин "липокалин слезной жидкости человека" при использовании в данном описании изобретения относится к зрелому липокалину слезной жидкости человека, который депонирован в банке данных SWISS-PROT под учетным номером Р31025 и аминокислотная последовательность которого указана в SEQ ID NO: 36 в данном описании изобретения.
В одном воплощении изобретения способ образования мутеина липокалина слезной жидкости человека включает мутацию по меньшей мере 2, 3, 4, 5, 6, 8, 10, 12, 14, 15, 16 или 17 кодонов в любом из положений аминокислотной последовательности 26-34, 56-58, 80, 83, 104-106 и 108 линейной полипептидной последовательности зрелого липокалина слезной жидкости человека. В другом воплощении мутированы все 18 кодонов в положениях аминокислотной последовательности 26,27, 28, 29, 30, 31, 32, 33, 34, 56, 57, 58, 80, 83, 104, 105, 106 и 108 линейной полипептидной последовательности зрелого липокалин слезной жидкости человека. Таким образом, Met-связывающий мутеин по изобретению может содержать мутацию в любой из положений 2, 3, 4, 5, 6, 8, 10, 12, 14, 15, 16, 17 или 18 аминокислотной последовательности 26-34, 56-58, 80, 83, 104-106 и 108 линейной полипептидной последовательности зрелого липокалина слезной жидкости человека. Однако специалисту в данной области техники понятно что, то проведение в некотором положении последовательности мутагенеза необязательно означает, что выбранная возможная аминокислотная замена будет действительно иметь место в мутеине по изобретению. Из-за обратных мутаций или структурно-функционального соотношения аминокислотный остаток последовательности дикого типа липокалина слезной жидкости также может сохраняться в мутеине по изобретению.
В другом аспекте настоящее изобретение включает способ получения мутеина липокалина слезной жидкости человека, где мутеин связывает c-Met как данный искусственный лиганд липокалина слезной жидкости человека с обнаруживаемой связывающей способностью, включающий:
(а) подвергание молекулы нуклеиновой кислоты, кодирующей липокалин слезной жидкости человека, мутагенезу в по меньшей мере одном кодоне любой из положений аминокислотной последовательности 34, 80 и 104 линейной полипептидной последовательности зрелого липокалина слезной жидкости человека, таким образом получение совокупности нуклеиновых кислот, кодирующих мутеины липокалина слезной жидкости человека,
(б) экспрессирование одной или более молекул нуклеиновой кислоты мутеина, полученных в (а), в системе экспрессии, получение таким образом одного или более мутеинов, и
(в) обогащение одного или более мутеинов, полученных в стадии (б) и имеющих обнаруживаемую аффинность связывания с c-Met в качестве данного искусственного лиганда липокалина слезной жидкости человека, посредством селекции и/или выделения.
В одном воплощении вышеизложенного способа дополнительно по меньшей мере 2, 3, 4, 5, 6, 8, 10, 12, 14 или 15 кодонов в любом из положений аминокислотной последовательности 26-33, 56-58, 83, 105-106 и 108 линейной полипептидной последовательности зрелого липокалина слезной жидкости человека мутированы.
В еще одном воплощении изобретения способы по изобретению включают мутацию обоих кодонов, кодирующих цистеин в положениях 61 и 153 в линейной полипептидной последовательности зрелого липокалина слезной жидкости человека. Оба положения могут, например, быть мутированы, чтобы кодировать остаток серина.
В другом воплощении изобретения, которое описано в данном описании изобретения, кодоны, кодирующие положении аминокислотной последовательности 111 и/или 114 линейной полипептидной последовательности зрелого липокалина слезной жидкости человека, мутированы для кодирования, например пролина в положении 111 и триптофана в положении 114.
Другое воплощение способов по изобретению включает мутагенез кодона, кодирующего цистеин в положении 101 линейной полипептидной последовательности зрелого липокалина слезной жидкости человека, так, чтобы данный кодон кодировал любую другую аминокислоту. В одном воплощении мутированный кодон, кодирующий положению 101, кодирует серин. Таким образом, в некоторых воплощениях или два, или все три цистеиновых кодона в положении 61, 101 и 153 заменен кодоном другой аминокислоты.
Согласно способу по изобретению мутеин получают, начиная с нуклеиновой кислоты, кодирующей липокалин слезной жидкости человека. Такую нуклеиновую кислоту подвергают мутагенезу и помещают в подходящий бактериальный или эукариотический организм-хозяин посредством техники рекомбинанирования ДНК. Получение библиотеки нуклеиновых кислот для липокалина слезной жидкости может быть выполнено с использованием любого подходящего способа, который известен в данной области техники, для получения липокалиновых мутеинов с антитело-подобными свойствами, то есть мутеинов, которые обладают аффинностью в отношении данной мишени. Примеры таких комбинаторных способов подробно описаны в международных патентных заявках WO 99/16873, WO 00/75308, WO 03/029471, WO 03/029462 WO 03/029463, WO 2005/019254, WO 2005/019255, WO 2005/019256, WO 2006/56464, или в международной патентной заявке РСТ/ЕР2007/057971, описание которой, например, посредством ссылки, полностью включено в данное описание изобретения. После экспрессии нуклеиновокислотных последовательностей, которые были подвергнуты мутагенезу в подходящем хозяине, из полученной библиотеки можно выбрать клоны, несущие генетическую информацию для совокупности соответствующих липокалиновых мутеинов, которые связывают данную мишень. Для селекции данных клонов может использовать хорошо известные методы, такие как фаговый дисплей (рассмотрен в Kay, B.K. et al. (1996) выше; Lowman, H.B. (1997) выше или Rodi, D.J., and Makowski, L. (1999) выше), скрининг колоний (рассмотрен в Pini, A. et al. (2002) Comb. Chem. High Throughtput Screen. 5, 503-510), рибосомный дисплей (рассмотрен в Amstutz, P. et al. (2001) Curr. Opin. Biotechnol. 12, 400-405) или мРНК дисплей, как сообщалось в Wilson, D.S. et al. (2001) Proc. Natl. Acad. Sci. USA 98, 3750-3755, или способы, конкретно описанные в WO 99/16873, WO 00/75308, WO 03/029471, WO 03/029462, WO 03/029463, WO 2005/019254, WO 2005/019255, WO 2005/019256, WO 2006/56464, или в международной патентной заявке РСТ/ЕР 2007/057971, описание которой, например, полностью включено посредством ссылки в данное описание изобретения.
В соответствии с данным описанием, стадия (в) способа получения c-Met-связывающего мутеина липокалина слезной жидкости дополнительно включает в другом воплощении вышеуказанных способов:
(1) получение c-Met, или его домена, или фрагмента в качестве данного лиганда,
(2) приведение совокупности мутеинов в контакт с указанным лигандом с целью обеспечения образования комплексов между указанным лигандом и мутеинами, обладающими связывающей аффинностью в отношении указанного лиганда, и
(3) удаление мутеинов, не имеющих или имеющих несущественную связывающую аффинность.
Для образования c-Met-связывающих мутеинов липокалина слезной жидкости любую часть (например, фрагмент или один домен) внеклеточных доменов Met-рецепторной тирозинкиназы человека (c-Met) или целые внеклеточные домены (которые содержат N-концевые аминокислотные остатки 1 метионин-треонин 932 зрелого целого рецептора (SWISS Prot: P08581) можно приводить в контакт с мутеинами (совокупностью), которые были получены в результате экспрессии библиотеки (ранее не подверженных воздействию) нуклеиновых кислот, которые кодируют эти мутеины. Можно использовать имеющиеся в продаже внеклеточные домены, которые, например, предлагают в виде остатков 1-932, слитых с Fc-областью человеческого IgG посредством полипептидного линкера, например (R&D Systems, USA, номер в каталоге 358-МТ). Дополнительные примеры фрагментов c-Met, которые можно использовать для получения мутеинов, описанных здесь, включают, без ограничения ими, фрагмент, состоящий из остатков Met 25-567, как описано в Stamos et al., The EMBO Journal Vol.23, No. 12, 2004, стр.2325-2335, которые содержат семь доменов Sema, или более крупные фрагменты, которые содержат остатки 25-567. Фрагменты, связывающие домен SEMA, можно использовать, если мутеины по изобретению предназначены для конкурирования со связыванием HGF с доменами Sema. Такие мутеины могут (но не обязательно должны, смотри примеры) являться антагонистами HGF. Также можно использовать фрагменты, такие как фрагмент, содержащий остатки 568-932, если следует избежать связывания с доменами Sema. Скрининг также можно осуществлять, используя фрагменты или другие домены, такие как домен PSI (плексин-семафорин-интегрин) или IgG-подобные домены c-Met. Также можно использовать для целей скрининга, например, гомолог обыкновенных шимпанзе (pan troglodytes, 99%-ная идентичность человеческому c-Met), гомолог макак (тасаса mulatta, 98%-ная идентичность), ортолог собаки (cam's familiaris, 88%-ная идентичность), ортолог мыши (SWISS Prot: AI A597, 87%-ная идентичность) или ортолог крысы (rattus norvegicus, 86%-ная идентичность) вместо (внеклеточных доменов) c-Met человека. Такой подход можно, например, использовать, если желательны мутеины, обладающие перекрестной реакционной способностью между человеком и мышиным или крысиным ортологом (или, например, внеклеточными доменами). Как ясно из вышесказанного, можно получать в настоящем изобретении мутеины липокалина слезной жидкости, которые могут обладать антагонистическим действием в отношении HGF. Альтернативно, мутеины могут иметь соответствующий неантагонистический характер связывания (в этом отношении смотри Примеры).
В одном воплощении способа по изобретению селекцию на стадии (в) выполняют в конкурентных условиях. Конкурентные условия при использовании в данном описании изобретения означают, что селекция мутеинов может включать по меньшей мере одну стадию, на которой мутеины и данный искусственный лиганд липокалина слезной жидкости человека (мишень) приводят в контакт в присутствии дополнительного лиганда, такого как HGF, который конкурирует со связыванием мутеинов с мишенью. Такой дополнительный лиганд может представлять собой физиологический лиганд c-Met, такой как HGF, или любой другой нефизиологический лиганд c-Met, такой как анти-c-Met антитело, или небольшую молекулу ингибитора протеин-тирозинкиназы, который связывает по меньшей мере перекрывающийся или частично перекрывающийся эпитоп с эпитопом, распознаваемым мутеинами по изобретению, и таким образом препятствует связыванию мутеинов с мишенью. Альтернативно, такой дополнительный лиганд может конкурировать со связыванием мутеинов путем образования комплекса с эпитопом, отличным от сайта связывания мутеинов с c-Met, посредством аллостерических эффектов.
Воплощение метода фагового дисплея (рассмотрен в Kay, B, K. et al. (1996), выше; Lowman, Н. В. (1997) выше или Rodi, D, J., and Makowski, L. (1999), выше) с использованием умеренного фага М13 приведено в качестве примера способа селекции, который может быть использован в настоящем изобретении. Другим воплощением метода фагового дисплея, которое может быть использовано для селекции мутеинов по изобретению (смотри экспериментальный раздел), является гиперфаговый фаговый метод, который описан Broders et al. (Broders et al. (2003) "Hyperphage. Improving antibody presentation in phage display." Methods MoL Biol. 205: 295-302). Также можно использовать другой умеренный фаг, такой как f1, или литический фаг, такой как Т7. Для типичного метода селекции продуцируют фагмиды М13, что обеспечивает возможность экспрессии мутированной липокалиновой нуклеиновокислотной последовательности в виде слитого белка с сигнальной последовательностью на N-конце, предпочтительно сигнальной последовательностью OmpA, и с капсидным белком pill фага М13 или его фрагментами, способными включаться в капсид фага на С-конце. C-концевой фрагмент ΔpIII фагового капсидного белка, содержащий аминокислоты 217-406 последовательности дикого типа, предпочтительно используют для продуцирования слитых белков. Особенно предпочтительным в одном воплощении является С-концевой фрагмент pIII, в котором остаток цистеина в положении 201 отсутствует или заменен другой аминокислотой.
Таким образом, еще одно воплощение способов по изобретению включает функциональное слияние нуклеиновой кислоты, кодирующей совокупность мутеинов липокалина слезной жидкости человека и полученной в результате мутагенеза на 3'-конце, с геном, кодирующим оболочечный белок pill филаментного бактериофага семейства М13 или фрагмент этого оболочечного белка, чтобы выбрать по меньшей мере один мутеин для связывания c-Met.
Слитый белок может содержать дополнительные компоненты, такие как маркер аффинности, который делает возможной иммобилизацию, обнаружение и/или очистку слитого белка или его частей. Кроме того, стоп-кодон может быть помещен между участками последовательности, кодирующей липокалин или его мутеины, и геном фагового капсида или его фрагментами, где стоп-кодон, предпочтительно янтарный стоп-кодон, по меньшей мере частично транслируется в аминокислоту в ходе трансляции в подходящем супрессорном штамме.
Например, фазмидный вектор pTLPC27, в настоящее время также называемый рТ1 с27, который описан в международной патентной заявке РСТ/ЕР 2007/057971, может быть использован для получения фагмидной библиотеки, кодирующей мутеины липокалина слезной жидкости человека. Молекулы нуклеиновых кислот по изобретению, кодирующие мутеины липокалина слезной жидкости, могут быть вставлены в вектор с использованием двух сайтов рестрикции BstXI. После сшивания подходящий хозяйский штамм, такой как Е.coli XLI-Blue, трансформируют полученной смесью нуклеиновых кислот с получением большого количества независимых клонов. При желании может быть получен соответствующей вектор для получения гиперфагмидной библиотеки. Альтернативно, любой другой подходящий фагмидный вектор, такой как, например, вектор pTLPC59, который используют в Примерах настоящей заявки (смотри Пример 1 и Фиг.1), также можно использовать для получения фагмидной библиотеки. Вектор pTLPC59 идентичен вектору pTLc27 за исключением того, что библиотечную генную конструкцию для фагового дисплея помещают под контроль lac p/о вместо tet p/о и генетически сливают в полноразмерный ген III фага VCSM13.
Полученная библиотека может быть затем суперинфицирована в жидкостной культуре подходящим М13-хелперным фагом или гипрефагом для продуцирования функциональных фагмид. Рекомбинантная фагмида экспонирует липокалиновый мутеин на своей поверхности в виде слитого белка с оболочкой белка pIII или его фрагментом, в то время как N-концевая сигнальная последовательность слитого белка обычно отщепляется. В то же время, она также несет одну или более копий нативного капсидного белка pill, поставляемого хелперным фагом, и, таким образом, способна инфицировать реципиента в общем случае бактериальным штаммом, несущим F- или F'-плазмиду. В случае гиперфагового дисплея гиперфагмиды экспонируют липокалиновые мутеины на своей поверхности в виде слитого белка с инфицирующим оболочечным белком pIII, но не нативным капсидным белком. Во время или после инфицирования хелперным фагом или гиперфагом можно индуцировать экспрессию гена слитого белка между липокалиновым мутеином и капсидным белком pIII, например путем добавления ангидротетрациклина. Условия индицирования выбирают так, чтобы существенная фракция полученных фагмид экспонировала по меньшей мере один липокалиновый мутеин на своей поверхности. В случае гиперфагового дисплея условия индуцирования приводят к популяции гиперфагмид, несущих от трех до пяти слитых белков, состоящих из липокалинового мутеина и капсидного белка pIII. Известны различные способы выделения фагмид, такие как осаждение полиэтиленгликолем. Выделение обычно происходит после инкубационного периода 6-8 часов.
Выделенные фазмиды затем можно подвергать селекции путем инкубирования с желательной мишенью (то есть внеклеточными доменами c-Met или его частями или фрагментами), где мишень представлена в форме, обеспечивающей по меньшей мере временную иммобилизацию тех фагмид, которые несут мутеины с желательной связывающей активностью, в виде слитых белков на их оболочке. Среди различных воплощений, известных специалисту в данной области техники, мишень можно, например, конъюгировать с белком-носителем, таким как сывороточный альбумин, и связывать посредством такого белка-носителя с поверхностью, связывающей белок, например полистиролом. Для такой иммобилизации мишени можно предпочтительно использовать микротитрационные планшеты, подходящие для методов ELISA (твердофазный иммуноферментный анализ), или так называемые "иммуноадгезивы". Альтернативно можно использовать конъюгаты мишени с другими связывающими группами, такими как биотин. Затем мишень можно иммобилизовать на поверхности, которая избирательно связывает данную группу, например на микротитрационных планшетах или парамагнитных частицах, покрытые стрептавидином, нейтравидином или авидином. Если мишень слита с Fc-областью иммуноглобулина, иммобилизацию также можно осуществлять на поверхностях, например микротитрационных планшетах или парамагнитных частицах, которые покрыты белком А или белком G.
Неспецифические фагмид-связывающие сайты, имеющиеся на поверхностях, могут быть насыщены блокирующими растворами, как известно для методов ELISA. Обычно затем фагмиды приводят в контакт с мишенью, иммобилизованной на поверхности в присутствии физиологического буфера. Несвязанные фагмиды удаляют многократными промываниями. Фагмидные частицы, остающиеся на поверхности, затем элюируют. Для элюирования возможны несколько способов. Например, фагмиды можно элюировать путем добавления протеаз или в присутствии кислот, оснований, детергентов или хаотропных солей или в умеренно денатурирующих условиях. Предпочтительным способом является элюирование с использованием буферов с рН 2,2, где элюат затем нейтрализуют. Альтернативно, можно добавлять раствор свободной мишени (то есть внеклеточные домены c-Met или его части или фрагменты) с целью конкурирования с иммобилизованной мишенью за связывание с фагмидами, или мишень-специфичные фагмиды можно элюировать посредством конкурирования с иммуноглобулинами или природными лигандными белками, которые специфически связываются с интересующей мишенью.
Затем клетки Е. coli инфицируют элюированными фагмидами. Альтернативно, нуклеиновые кислоты можно экстрагировать из элюированных фагмид и использовать для анализа последовательности, амплификации или трансформации клеток другим образом. Начиная с клонов Е.coli, полученных таким образом, свежие фагмиды или гиперфагмиды опять получают посредством суперинфицирования фагами-помощниками М13 или гиперфагами согласно способу, описанному выше, и фагмиды, амплифицированные таким образом, снова подвергают селекции на иммобилизованной мишени. Многократные циклы селекции часто необходимы для получения фагмид с мутеинами по изобретению в достаточно обогащенной форме. Количество циклов селекции предпочтительно выбирают так, чтобы в последующем функциональном анализе по меньшей мере 0,1% исследованных клонов продуцировали мутеины с обнаруживаемой аффинностью в отношении данной мишени. В зависимости от размера, то есть сложности используемой библиотеки, для этого обычно требуется 2-8 циклов.
Для функционального анализа выбранных мутеинов штамм Е.coli можно затем инфицировать фагмидами, полученными в циклах селекции, и выделять соответствующую двухнитевую фазмидную ДНК. Начиная с этой фазмидной ДНК, или также с однонитевой ДНК, экстрагированной из фагмид, последовательности нуклеиновых кислот выбранных мутеинов по изобретению можно определить способами, известными в данной области техники, и на основании этого можно установить аминокислотные последовательности. Мутированную область или последовательность целого мутеина липокалина слезной жидкости можно субклонировать на другом векторе экспрессии и экспрессировать в подходящем организме-хозяине. Например, вектор рТ1 с26, описанный в международной патентной заявке РСТ/ЕР 2007/057971, можно использовать для экспрессии в штаммах Е.coli, таких как Е.coli TGI. Таким образом продуцированные мутеины липокалина слезной жидкости можно очищать различными биохимическими методами. Мутеины липокалина слезной жидкости, продуцируемые, например, рТ1 с26, несут аффинный пептид Strep-tag® II (Schmidt et al., выше) на своем С-конце и, следовательно, предпочтительно могут быть очищены стрептавидин-аффинной хроматографией.
Также селекцию можно выполнять другими способами. Многие соответствующие воплощения известны специалисту в данной области техники или описаны в литературе. Кроме того, можно использовать комбинацию способов. Например, клоны, селектированные или по меньшей мере обогащенные посредством "фагового дисплея", можно дополнительно подвергать "скринингу колоний". Преимуществом этого способа является то, что отдельные клоны можно непосредственно выделять с учетом получения мутеина липокалина слезной жидкости с обнаруживаемой связывающей способностью в отношении c-Met или, например, внеклеточного домена c-Met.
В дополнение к использованию Е.coli в качестве организма-хозяина в методе "фагового дисплея" или в методе "скрининга колоний", для этой цели можно использовать другие бактериальные штаммы, дрожжи или также клетки насекомого или клетки млекопитающего. В дополнение к селекции мутеина липокалина слезной жидкости из случайной (ранее не подверженной воздействию) библиотеки, как описано выше, также можно использовать эволютивные методы, включающие ограниченный мутагенез, для оптимизирования мутеина, который уже обладает некоторой связывающей активностью в отношении мишени с учетом аффинности или специфичности в отношении мишени после повторенных циклов скрининга.
Когда выбран мутеин с аффинностью к c-Met, или его домену, или фрагменту, такой мутеин можно дополнительно подвергнуть другому мутагенезу, чтобы выбрать затем варианты с еще более высокой аффинностью или варианты с улучшенными свойствами, такими как более высокая термостабильность, улучшенная сывороточная стабильность, термодинамическая стабильность, улучшенная растворимость, улучшенные свойства мономера, улучшенная устойчивость против термической денатурации, химической денатурации, протеолиза или детергентов и так далее. Такой дополнительный мутагенез, который в случае стремления к более высокой аффинности можно рассматривать как "созревание аффинности" in vitro, может быть осуществлен посредством сайт-специфической мутации, основанной на рациональном дизайне, или случайной мутации. Другим возможным подходом к получению более высокой аффинности или улучшенных свойств является использование подверженной ошибкам ПЦР, что приводит к точечным мутациям на выбранном интервале положений последовательности липокалинового мутеина. Подверженную ошибкам ПЦР можно осуществлять согласно любому известному протоколу, такому как протокол, описанный в Zaccolo et al. (1996) J. MoL Biol. 255, 589-603. Другие методы случайного мутагенеза, пригодные для таких целей, включают случайный мутагенез вставка/делеция (RID), как описано в Murakami, H et al. (2002) Nat.Biotechnol. 20, 76-81 или негомологичную случайную рекомбинацию (NRR), как описано в Bittker, J. A et al. (2002) Nat. Biotechnol. 20, 1024-1029. При желании созревание аффинности также можно осуществлять способом, описанным в WO 00/75308 или Schlehuber, S. et al. (2000) J. Mol. Biol. 297, 1105-1120, где получали мутеины билин-связывающего белка с высокой аффинностью к дигоксигенину. Еще одним подходом к улучшению аффинности является выполнение позиционного насыщающего мутагенеза. В данном подходе могут быть созданы "небольшие" библиотеки нуклеиновых кислот, в которых аминокислотные замены/мутации введены только в единичные положении в рамках любого из четырех сегментов петель, определенных в здесь (смотри Пример 21). Такие библиотеки затем непосредственно подвергают стадии селекции (скрининг аффинности) без дополнительных циклов пэннинга. Такой подход позволяет идентифицировать остатки, которые способствуют улучшенному связыванию желательной мишени, и позволяют идентифицировать "горячие точки", которые являются важными для связывания. При таком подходе возможна, например, идентификация ключевых остатков в первых двух сегментах (положения последовательности 24-36 или 56-58).
В еще одном аспекте настоящее изобретение направлено на мутеин липокалина слезной жидкости человека, обладающий обнаруживаемой связывающей способностью с c-Met, или его доменом, или его частью, который можно получать или получают подробно описанными выше способами по изобретению.
В одном воплощении мутеин липокалина слезной жидкости человека, полученный согласно вышеуказанным способам, содержит замену по меньшей мере одного или двух остатков цистеина, встречающихся в каждом из положений 61 и 153 последовательностей, на другую аминокислоту и мутацию по меньшей мере одного аминокислотного остатка в любом из положений последовательности 26-34, 56-58, 80, 83, 104-106 и 108 линейной полипептидной последовательности зрелого липокалина слезной жидкости человека. Положения 24-36 включены в петлю АВ, положения 53-66 включены в петлю CD, положения 69-77 включены в петлю EF и положения 103-110 включены в петлю GH в сайте связывания на открытом конце β-цилиндрической структуры липокалина слезной жидкости. Определение этих четырех петель используют в данном описании изобретения в соответствии с Flower (Flower, D.R. (1996), выше и Flower, D.R. et al. (2000), выше). Обычно такой мутеин содержит по меньшей мере 2, 3, 4, 5, 6, 8, 10, 12, 14, 15, 16, 17 или 18 мутированных аминокислотных остатка в положениях последовательности 26-34, 56-58, 80, 83, 104-106 и 108 линейной полипептидной последовательности зрелого липокалина слезной жидкости человека. В конкретном воплощении мутеин содержит аминокислотные замены Cys 61→Ala, Phe, Lys, Arg, Thr, Asn, Tyr, Met, Ser, Pro или Trp и Cys 153→Ser или Ala. Было показано, что такая замена полезна для предотвращения образования встречающейся в природе дисульфидного мостика, связывающего Cys 61 и Cys 153 и, таким образом, для облегчения обработки мутеина.
В еще одном воплощении мутеин содержит по меньшей мере одну дополнительную аминокислотную замену, выбранную из Arg 111→Pro и Lys 114→Trp. Мутеин по изобретению может дополнительно содержать цистеин в положении 101 последовательности нативного зрелого липокалина слезной жидкости человека, замененный другой аминокислотой. Данная замена может представлять собой, например, мутацию Cys 101→Ser или Cys 101→Thr.
Липокалиновые мутеины по изобретению могут содержать (природную) аминокислотную последовательность дикого типа вне мутированных положений аминокислотной последовательности. С другой стороны, липокалиновые мутеины, раскрытые в данном описании изобретения, также могут содержать аминокислотные мутации вне положений последовательности, подвергнутых мутагенезу, пока эти мутации не мешают связывающей активности и фолдингу мутеина. Такие мутации можно очень легко осуществлять на уровне ДНК, используя общепринятые стандартные способы (Sambrook, J. et al. (1989) Molecular Cloning: A Laboratory Manual, 2nd Ed., Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY). Возможные замены аминокислотной последовательности представляют собой вставки или делеции, а также аминокислотные замены. Такие замены могут быть консервативными, то есть аминокислотный остаток замещают химически подобным аминокислотным остатком. Примерами консервативных замен являются замены среди членов следующих групп: 1) аланин, серин и треонин; 2) аспарагиновая кислота и глутаминовая кислота; 3) аспарагин и глутамин; 4) аргинин и лизин; 5) изолейцин, лейцин, метионин и валин; и 6) фенилаланин, тирозин и триптофан. С другой стороны, также можно вводить неконсервативные изменения в аминокислотную последовательность. Кроме того, вместо замены одиночных аминокислотных остатков, также можно либо вставлять, либо удалять одну или более из последовательных аминокислот первичной структуры липокалина слезной жидкости, пока такие делеции или вставки приводят к стабильно уложенному/функциональному мутеину (смотри, например, экспериментальный раздел, в котором получают мутеины с укороченным N- и С-концом).
Такие модификации аминокислотной последовательности включают направленный мутагенез отдельных аминокислотных положений для облегчения субклонирования мутированного гена липокалина или его частей путем введения сайтов расщепления для определенных рестрикционных ферментов. Кроме того, такие мутации также могут быть включены, чтобы дополнительно улучшить аффинность липокалинового мутеина к данной мишени. Кроме того, мутации могут быть введены, чтобы модулировать некоторые характеристики мутеина, например улучшить стабильность фолдинга, сывороточную стабильность, белковую устойчивость или растворимость в воде или, при необходимости, снизить тенденцию к агрегации. Например, встречающиеся в природе остатки цистеина могут быть мутированы в другие аминокислоты для предотвращения образования дисульфидного мостика. Однако также можно преднамеренно мутировать другое положение аминокислотной последовательности в цистеин с целью ввода новых реакционно-способных групп, например для конъюгации с другими соединениями, такими как полиэтиленгликоль (PEG), гидроксиэтиловый крахмал (HES), биотин, пептиды или белки, или для образования не встречающихся в природе дисульфидных связей. Типичные возможности такой мутации для ввода остатка цистеина в аминокислотную последовательность мутеина липокалина слезной жидкости человека включают замены Thr 40→Cys, Glu 73→Cys, Arg 90→Cys, Asp 95→Cys, Lys 121→Cys, Asn 123→Cys и Glu 131→Cys. Полученную тиольную группу рядом с любым из аминокислотных положений 40, 73, 90, 95, 121, 123 и/или 131 можно использовать для PEGилирования или HESилирования мутеина, например, для увеличения периода полувыведения соответствующего мутеина липокалина слезной жидкости из сыворотки. Мутеин S244.2-H08, в котором цистеин введен в любые из этих положений последовательности (смотри Пример 9), является иллюстративным примером таких мутеинов по изобретению. Боковую цепь любого из остатков цистеина, конечно, можно использовать не только для конъюгации с соединениями, увеличивающими период полувыведения из сыворотки, но также и для конъюгации любого требующегося партнера для конъюгации, такого как органическая молекула, ферментная метка, токсин, цитостатический агент, фармацевтически подходящая градиоактивная метка, флуоресцентная метка, хромогенная метка, люминесцентная метка, гаптен, дигоксигенин, биотин, комплекс металла, металл или коллоидное золото, чтобы назвать только несколько показательных примеров. Конъюгацию можно выполнять, используя любой общепринятый способ сочетания, известный в данной области техники (смотри, например, Пример 18, где остаток цистеина может быть активирован реагентом, таким как трис[2-карбоксиэтил]фосфин (ТСЕР) или дитиотреитол (DTT), и затем дополнительно взаимодействует с реагентом, таким как 3-N-малеимидо-6-гидразинпиридина гидрохлорид (HYNIC).
Настоящее изобретение также включает укороченные мутеины (то есть фрагменты), как определено выше, в которых, например, первые четыре N-концевые аминокислотные остатка последовательности зрелого липокалина слезной жидкости человека (His-His-Leu-Leu; положения 1-4) и/или последние два C-концевые аминокислотные остатка (Ser-Asp; положения 157-158) последовательности зрелого липокалина слезной жидкости человека были удалены (смотри также Примеры и прилагаемый перечень последовательностей).
Липокалиновые мутеины по изобретению способны связываться с желательной мишенью, то есть c-Met рецепторной тирозинкиназой, или ее доменом, или его фрагментом, с обнаруживаемой аффинностью, то есть с константой диссоциации по меньшей мере 200 нМ. В настоящее время в некоторых воплощениях предпочтительными являются липокалиновые мутеины, которые связываются с желательной мишенью с константой диссоциации для данной мишени по меньшей мере 100, 20, 1 нМ или еще меньше. Аффинность связывания мутеина с желательной мишенью можно измерять множеством способов, таких как флуоресцентное титрование, конкурентный ELISA или поверхностный плазменный резонанс (BIAcore).
Специалисту совершенно очевидно, что образование комплекса зависит от многих факторов, таких как концентрация партнеров по связыванию, присутствие конкурентов, ионная сила буферной системы и так далее. Селекцию и обогащение обычно выполняют в условиях, обеспечивающих выделение липокалиновых мутеинов, имеющих, в комплексе с желательной мишенью (c-Met или его доменом или его фрагментом), константу диссоциации по меньшей мере 200 нМ. Однако стадии промывания и элюирования могут быть выполнены с варьируемой жесткостью. Также возможна селекция с учетом кинетических характеристик. Например, селекцию можно осуществлять в условиях, которые способствуют комплексообразованию мишени с мутеинами, которые демонстрируют медленную диссоциацию от мишени, или, другими словами, низкую величину koff. Альтернативно, селекцию можно осуществлять в условиях, которые способствуют быстрому комплексообразованию мутеина с мишенью, или, другими словами, высокой величине kon. В качестве дополнительной иллюстративной альтернативы, скрининг может быть выполнен в условиях, которые подбирают для улучшенной термостабильности мутеинов (по сравнению либо с липокалином дикого типа слезной жидкости или с мутеином, который уже имеет аффинность к заранее выбранной мишени), или для рН-стабильности мутеина.
Мутеин липокалина слезной жидкости по изобретении обычно существует в виде мономерного белка. Однако также возможно, что липокалиновый мутеин по изобретению способен спонтанно димеризоваться или образовывать высшие олигомеры. Хотя использование липокалиновых мутеинов, которые образует стабильные мономеры, может быть предпочтительным для некоторых применений, например из-за более быстрой диффузии и лучшего проникновения в ткань, в других случаях может быть выгодным использование липокалиновых мутеинов, которые спонтанно образуют стабильные гомодимеры или мультимеры, так как такие мультимеры могут обеспечивать (дополнительно) повышенную аффинность и/или авидность к данной мишени. Кроме того, олигомерные формы липокалинового мутеина могут иметь более медленные скорости диссоциации или пролонгированный период полувыведения из сыворотки. Если желательна димеризация или мультимеризация мутеинов с образованием стабильных мономеров, этого можно, например, достичь посредством слияния соответствующих доменов олигомеризации, таких как домены jun-fos или «лейциновые застежки», с мутеинами по изобретению или с использованием "дуокалинов" (также смотри ниже).
Мутеин липокалина слезной жидкости по изобретению можно использовать для образования комплекса с c-Met, или его доменом, или фрагментом, например, in vitro, для диагностических целей ex vivo, или для терапевтических целей in vivo.
В общем случае термин "фрагмент" при использовании в данном описании изобретения в отношении c-Met, относится к белку или пептидным лигандам, укороченным по N-концу и/или С-концу, которые сохраняют способность полноразмерного лиганда распознаваться и/или связываться мутеином по изобретению. Термин "домен" в отношении c-Met следует понимать в соответствии с обычным значением, используемым в данной области техники. Например, термин "домен" включает домены Sema, которые структурно определены в Stamos et al., The EMBO Journal, Vol.23, стр.2325-2335, 2004 (смотри например, Фиг.3а или Фиг.4 в Stamos et al.), домен PSI, IgG-подобные домены, трансмембранный домен или также домен тирозинкиназы, который структурно определен в Schiering et al., Proc. Natl. Acad. Sci USA, Vol.100, No. 22, стр.12654-12659, 2003). Термин "домен" также включает целый внеклеточный участок c-Met, образованный остатками от Met 1 до Thr 932 полноразмерного рецепторного белка или укороченных фрагментов, образованных, например, остатками от 2, 3, 4, 5, 6 до остатков 920, 925, 930 или 931 полноразмерного рецептора. Как отмечалось выше, путем использования, например, целых внеклеточных доменов или только некоторых внеклеточных доменов, например доменов Sema, можно получить либо мутеины, которые связываются с HGF-связывающим сайтом (и в таком случае, вероятно, обладают антагонистическим режимом связывания в отношении HGF), либо также мутеины, которые обладают неантагонистическим режимом связывания по отношению к связыванию HGF.
В данном контексте также следует отметить, что комплексообразование между соответствующим мутеином и c-Met, или его доменом, или фрагментом находится под влиянием многих разных факторов, таких как концентрации соответствующих партнеров по связыванию, присутствие конкурентов, рН и ионная сила используемой буферной системы и экспериментальный метод, используемый для определения константы диссоциации KD (например, флуоресцентное титрование, конкурентный ELISA или, например, поверхностный плазменный резонанс) или даже математический алгоритм, используемый для оценки экспериментальных данных.
Таким образом, специалисту также ясно, что значения KD (константы диссоциации комплекса, образованного соответствующим мутеином и его лигандом), приведенные в данной работе, могут варьироваться в рамках некоторого экспериментального диапазона в зависимости от способа и экспериментальной установки, которую используют для определения аффинности конкретного липокалинового мутеина к данному лиганду. Это означает, что может быть незначительное отклонение измеренных значений KD или допустимой области, в зависимости, например, от того, определяли значение KD при помощи поверхностного плазменного резонанса (Biacore) или конкурентного ELISA.
В конкретном воплощении изобретения мутеин липокалина слезной жидкости содержит по отношению к аминокислотной последовательности зрелого липокалина слезной жидкости человека по меньшей мере 6, 8, 10, 12, 14, 16 или 17 аминокислотных замены по отношению к аминокислотной последовательности зрелого липокалина слезной жидкости человека, которые выбраны из группы, состоящей из Arg 26→Thr, Val, Pro, Ser, Gly; Glu 27→Gln, Gly, Val, Ser; Phe 28→Met, Asp; Pro 29→Leu, Ile, Ala, Trp; Glu 30→Leu, Gly, Arg, Phe; Met 31→Ser; Asn 32→Leu, Arg, Val, Gln; Leu 33→Tyr3 Val, Ile, Thr, Phe; Glu 34→Val, Arg, Ala; Leu 56→Asn; Ile 57→Gln; Ser 58→Ile, Val; Asp 80→Tyr; Lys 83→Ala; Glu 104→Asp; Leu 105→Thr; His 106→Trp и Lys 108→Gly.
В одном более конкретном воплощении мутеин по изобретению дополнительно содержит по меньшей мере одну аминокислотную замену, выбранную из группы, состоящей из Thr 37→Ser; Met 39→Ile, Leu; Asn 48→Ser; Lys 52→Thr, Met; Met 55→Leu; Lys 65→Arg, Leu; Ala 79→Leu, Ser; Ala 86→Thr и Ile 89→Ser, Gln, Thr, His.
В другом более конкретном воплощении мутеин содержит аминокислотные замены: Arg 26→Thr; Glu 27→Gln; Glu 30→Leu; Met 31→Ser; Asn 32→Leu; Leu 33→Tyr; Glu 34→Val; Leu 56→Asn; Ile 57→Gln; Asp 80→Tyr; Lys 83→Ala; Glu 104→Asp; Leu 105→Thr; His 106→Tip и Lys 108→Gly.
В еще одном более конкретном воплощении изобретения мутеин по изобретению содержит аминокислотные замены: Met 31→Ser; Leu 56→Asn; Ile 57→Gln; Asp 80→Tyr; Lys 83→Ala; Glu 104→Asp; Leu 105→Thr; His 106→Trp и Lys 108→Gly.
В других воплощениях мутеин по изобретению может содержать один из следующих наборов аминокислотных замен:
(1) Arg 26→Thr; Glu 27→Gln; Phe 28→Met; Glu 30→Leu; Met 31→Ser; Asn 32→Leu; Leu 33→Tyr; Glu 34→Val; Leu 56→Asn; Ile 57→Gln; Ser 58→Ile; Asp 80→Tyr; Lys 83→Ala; Glu 104→Asp; Leu 105→Thr; His 106→Trp и Lys 108→Gly;
(2) Arg 26→Thr; Glu 27→Gln; Phe 28→Asp; Glu 30→Leu; Met 31→Ser; Asn 32→Leu; Leu 33→Tyr; Glu 34→Val; Leu 56→Asn; Ile 57→Gln; Ser 58→Val; Asp 80→Tyr; Lys 83→Ala; Glu 104→Asp; Leu 105→Thr; His 106→Trp и Lys 108→Gly;
(3) Arg 26→Thr; Glu 27→Gln; Phe 28→Asp; Glu 30→Leu; Met 31→Ser; Asn 32→Leu; Leu 33→Tyr; Glu 34→Val; Leu 56→Asn; Ile 57→Gln; Ser 58→Ile; Asp 80→Tyr; Lys 83→Ala; Glu 104→Asp; Leu 105→Thr; His 106→Trp и Lys 108→Gly;
(4) Arg 26→Val; Glu 27→Gly; Phe 28→Asp; Pro 29→Leu; Glu 30→Gly; Met 31→Ser; Asn 32→Arg; Leu 33→Val; Glu 34→Val; Leu 56→Asn; Ile 57→Gln; Ser 58→Ile; Asp 80→Tyr; Lys 83→Ala; Glu 104→Asp; Leu 105→Thr; His 106→Trp и Lys 108→Gly;
(5) Arg 26→Pro; Glu 27→Gly; Phe 28→Asp; Pro 29→Ile; Glu 30→Arg; Met 31→Ser; Asn 32→Leu; Leu 33→Ile; Glu 34→Val; Leu 56→Asn; Ile 57→Gln; Ser 58→Ile; Asp 80→Tyr; Lys 83→Ala; Glu 104→Asp; Leu 105→Thr; His 106→Trp и Lys 108→Gly;
(6) Arg 26→Ser; Phe 28→Asp; Pro 29→Ala; Glu 30→Phe; Met 31→Ser; Asn 32→Val; Leu 33→Thr; Glu 34→Val; Leu 56→Asn; Ile 57→Gln; Ser 58→Ile; Asp 80→Tyr; Lys 83→Ala; Glu 104→Asp; Leu 105→Thr; His 106→Trp и Lys 108→Gly;
(7) Arg 26→Val; Glu 27→Val; Phe 28→Asp; Pro 29→Trp; Glu 30→Arg; Met 31→Ser; Asn 32→Gln; Leu 33→Val; Glu 34→Arg; Leu 56→Asn; Ile 57→Gln; Ser 58→Ile; Asp 80→Tyr; Lys 83→Ala; Glu 104→Asp; Leu 105→Thr; His 106→Trp и Lys 108→Gly и
(8) Arg 26→Gly; Glu 27→Ser; Phe 28→Asp; Pro 29→Trp; Met 31→Ser; Asn 32→Val; Leu 33→Phe; Glu 34→Ala; Leu 56→Asn; Ile 57→Gln; Ser 58→Ile; Asp 80→Tyr; Lys 83→Ala; Glu l04→Asp; Leu 105→Thr; His 106→Trp и Lys 108→Gly.
Мутеин липокалина слезной жидкости человека, связывающий c-Met, или его домен, или фрагмент, может содержать, по существу состоять из или состоять из любой из аминокислотных последовательностей, представленных в любой из SEQ ID NO: 1, SEQ ID NO: 4-9, SEQ ID NO: 22-26 или SEQ ID NO: 32-35 и 37-49, или ее фрагмента, или ее варианта. В одном воплощении мутеин по изобретению содержит, по существу состоит из или состоит из аминокислотной последовательности, представленной в SEQ ID NO: 1, 4, 5, 6, 7, 8, 9, 22-26, 32-35 или 42-49, или ее фрагмента, или ее варианта. При этом следует отметить, что все мутеины, раскрытые в данном описании изобретения, могут быть соединены или по N-, или по С-концу с аффинным маркером, таким как пентагистидиновый маркер, гексагистидиновая метка или Streptag® (смотри, например, SEQ ID NO: 37-41, где гексагистидиновая метка слита с С-концом мутеинов). Таким образом, настоящая заявка включает также все подробно и в общем виде описанные мутеины, снабженные такими метками.
Термин "фрагмент" при использовании в настоящем изобретении в отношению к мутеинам по изобретению относится к белкам или пептидам, произведенным из полноразмерного зрелого липокалина слезной жидкости человека, который укорочен по N-концу и/или С-концу, то есть у которого отсутствует по меньшей мере одна N-концевая и/или C-концевая аминокислота. Такие фрагменты предпочтительно содержат по меньшей мере 10, более предпочтительно 20, наиболее предпочтительно 30 или более последовательных аминокислот первичной последовательности зрелого липокалина слезной жидкости человека и обычно обнаруживаются в иммуноанализе зрелого липокалина слезной жидкости человека.
Термин "вариант" при использовании в настоящем изобретении относится к производным белка или пептида, которые содержат модификации аминокислотной последовательности, например замену, делецию, вставку или химическую модификацию. Предпочтительно такие модификации не уменьшают функциональность белка или пептида. Такие варианты включают белки, где одна или более чем одна аминокислота была замещена соответствующими D-стереоизомерами или аминокислотами, отличными от встречающихся в природе 20 аминокислот, такими как, например, орнитин, гидроксипролин, цитруллин, гомосерин, гидроксилизин, норвалин. Однако такие замены также могут быть консервативными, то есть аминокислотный остаток заменен химически подобным аминокислотным остатком. Примерами консервативных замен являются замены среди членов следующих групп: 1) аланин, серин и треонин; 2) аспарагиновая кислота и глутаминовая кислота; 3) аспарагин и глутамин; 4) аргинин и лизин; 5) изолейцин, лейцин, метионин и валин; и б) фенилаланин, тирозин и триптофан.
В данном контексте следует отметить, что мутеины по изобретению, как было обнаружено, стабильны в большом интервале рН от примерно рН 2,5 до примерно рН 9,5, например в интервале рН от примерно рН 3,0 до примерно рН 9,2.
Вышеуказанные мутеины, которые были изменены с учетом их потенциальной иммуногенности, также включены в объем настоящего изобретения.
Цитотоксические Т-клетки распознают пептидные антигены на клеточной поверхности антиген-презентирующей клетки совместно с молекулой главного комплекса гистосовместимости (МНС) класса I. Способность пептидов связываться с молекулами МНС является аллель-специфичной и коррелирует с их иммуногенностью. Для снижения иммуногенности данного белка представляет собой большую ценность способность прогнозировать, какие пептиды в белке обладают способностью связываться с определенной молекулой МНС. Подходы, в которых используется подход компьютерной обработки для идентификации потенциальных Т-клеточных эпитопов, был ранее описан для прогнозирования связывания данной пептидной последовательности с молекулами МНС класса 1 (Altuvia et al. (1995) J. Mol. Biol. 249: 244-250).
Такой подход также можно использовать для идентификации потенциальных Т-клеточных эпитопов в мутеинах по изобретению и для осуществления зависящего от его предполагаемого использования выбора конкретного мутеина на основе его прогнозированной иммуногенности. Кроме того, можно подвергать области пептида, которые согласно прогнозу содержат Т-клеточные эпитопы, дополнительному мутагенезу для сокращения или исключения таких Т-клеточных эпитопов и минимизации таким образом иммуногенности. Удаление амфипатических эпитопов из генетически сконструированных антител описано (Mateo et al. (2000) Hybridoma 19(6); 463-471) и может быть адаптировано к мутеинам по настоящему изобретению.
Мутеины, полученные таким образом, могут обладать минимизированной иммуногенностью, которая желательна для их применения в терапии и диагностике, как описано ниже.
Для некоторых применений также полезно использовать мутеины по изобретению в конъюгированной форме. Соответственно, изобретение также направлено на липокалиновые мутеины, которые конъюгированы с партнером по конъюгации, который может быть выбран из группы, состоящей из ферментной метки, окрашенной метки, цитостатического агента, метки, которая может быть фотоактивируемой и которая пригодна для использования в фотодинамической терапии, гаптенов, дигоксигенина, биотина, химиотерапевтического металла или химиотерапевтического металла и коллоидного золота. Мутеин также может быть конъюгирован с органической молекулой лекарственного средства. Термин "органическая молекула" при использовании в данном описании изобретения предпочтительно означает органическую молекулу, содержащую по меньшей мере два атома углерода, но предпочтительно не более 7 или 12 вращающихся углеродных связей, имеющую молекулярную массу в интервале от 100-2000 Да, предпочтительно 100-1000 Да и возможно включающую один или два атома металла.
В общем случае можно метить мутеин липокалина слезной жидкости, описанный в данном описании изобретения, с помощью любого подходящего химического вещества или фермента, которые прямо или косвенно генерируют обнаруживаемое соединение или сигнал в химической, физической, оптической или ферментативной реакции. Примером физической реакции и в то же самое время оптической реакции/маркера является излучение флуоресценции при облучении. Щелочная фосфатаза, пероксидаза хрена или β-галактозидаза являются примерами ферментных меток (и в то же время оптических меток), которые катализируют образование хромогенных продуктов реакции. В общем случае все метки, обычно используемые для антител (исключая используемые исключительно с сахарной группировкой в Fc-области иммуноглобулинов), также можно использовать для конъюгации с мутеинами по настоящему изобретению. Мутеины по изобретению также могут быть конъюгированными с любым подходящим терапевтически активным агентом, например для нацеленной доставки таких агентов к определенной клетке, ткани или органу или для селективного нацеливания на клетки, например опухолевые клетки, без воздействия на окружающие нормальные клетки. Примеры таких терапевтически активных агентов включают радионуклиды, токсины, небольшие органические молекулы и терапевтические пептиды (такие как пептиды, действующие в качестве агонистов/антагонистов рецепторов клеточной поверхности, или пептиды, конкурирующие за белок-связывающий сайт на данной клеточной мишени). Примеры подходящих токсинов включают, без ограничения ими, коклюшный токсин, дифтерийный токсин, рицин, сапорин, псевдомонадный экзотоксин, калихимицин или его производное, таксоид, майтанзиноид, тубулизин или аналог доластатина. Аналог доластатина может представлять собой ауристатин Е, монометилауристатин Е, ауристатин PYE и ауристатин РНЕ. Примеры цитостатического агента включают, без ограничения ими, цисплатин, карбоплатин, оксалиплатин, 5-срторурацил, таксотер (доцетаксел), паклитаксел, антрациклин (доксорубицин), метотрексат, винбластин, винкристин, виндезин, винорелбин, дакарбазин, циклофосфамид, этопозид, адриамицин, камптотецин, соединения, родственные комбретатастину А-4, сульфонамиды, оксадиазолины, бензо[b]тиофены, синтетические спирокетальные пираны, монотетрагидрофурановые соединения, курацин и производные курацина, производные метоксиэстрадиола и лейковорин. Липокалиновые мутеины по изобретению также могут быть конъюгированы с терапевтически активными нуклеиновыми кислотами, такими как молекулы антисмысловых нуклеиновых кислот, небольшие интерферирующие РНК, микро-РНК или рибозимы. Такие конъюгаты могут быть получены способами, хорошо известными в данной области техники.
В одном воплощении мутеины по изобретению также могут быть соединены с нацеленной группировкой, которая нацелена на конкретную область организма с целью доставки мутеинов по изобретению к нужной области или участку внутри организма. Одним примером, где такая модификация может быть желательна, является преодоление гематоэнцефалического барьера. Для преодоления гематоэнцефалического барьера мутеины по изобретению можно соединять с группировками, которые облегчают активный транспорт через этот барьер (смотри Gaillard PJ, et al,. Diphtheria-toxin receptor-targeted brain drug delivery. International Congress Series. 2005 1277; 185-198 или Gaillard P J, et al. Targeted delivery across the blood-brain barrier. Expert Opin Drug Deliv. 2005 2(2): 299-309. Такие группировки, например, доступны под торговой маркой 2B-Trans™ (BBB technologies BV5 Leiden, NL).
Как указано выше, мутеин по изобретению в некоторых воплощениях может быть конъюгирован с группировкой, которая продлевает период полувыведения мутеина из сыворотки (в этой связи смотри также международную патентную заявку РСТ/ЕР2007/057971 или также публикацию РСТ WO 2006/56464, где такие конъюгационные стратегии описаны со ссылкой на мутеины липокалина человека, соединенного с нейтрофильной желатиназой, со связывающей способностью в отношении CTLA-4 (цитотоксический Т-лимфоцит-ассоциированный антиген 4)). Группировка, которая увеличивает период полувыведения из сыворотки, может представлять собой молекулу полиалкиленгликоля, гидроксиэтиловый крахмал, молекулы жирной кислоты, такой как пальмитиновая кислота (Vajo & Duckworth 2000, Pharmacol Rev. 52, 1-9), Fc-область иммуноглобулина, домен СНЗ иммуноглобулина, домен СН4 иммуноглобулина, альбумин или его фрагмент, альбумин-связывающий пептид, альбумин-связывающий белок, IgG-Fc-связывающий белок или трансферрин (названы только некоторые). Альбумин-связывающий белок может представлять собой бактериальный альбумин-связывающий белок, антитело, фрагмент антитела, включая доменные антитела (смотри, например, патент US 6696245), липокалиновый мутеин или другой белок или домен белка со связывающей активностью в отношении альбумина. Таким образом, подходящие партнеры по конъюгации для продления периода полувыведения липокалинового мутеина по изобретению включают альбумин (Osborn, В.L. et al. (2002) Pharmacokinetic and pharmacodynamic studies of a human serum albumin-interferon-alpha fusion protein in cynomolgus monkeys J. Pharmacol. Exp, Ther, 303, 540-548), или альбумин-связывающий белок, например бактериальный альбумин-связывающий домен, такой как домен стрептококкового белка G (Konig, Т. and Skerra, A. (1998). Use of an albumin-binding domain for the selective immobilisation of recombinant capture antibody fragments on ELISA plates. J. Immunol. Methods 218, 73-83). Другие примеры альбумин-связывающих пептидов, которые можно использовать в качестве партнера конъюгации, представляют собой, например, пептиды, имеющие Cys-Xaa1-Xaa2-Xaa3-Xaa4-Cys консенсусные последовательности, где Xaa1 представляет собой Asp, Asn, Ser, Thr или Trp; Xaa2 представляет собой Asn, Gln, His, Ile, Leu или Lys; Хааз представляет собой Ala, Asp, Phe, Trp или Туr; и Xaa4 представляет собой Asp, Gly, Leu, Phe, Ser или Thr, как описано в патентной заявке США 2003/0069395 или Dennis et al. (Dennis, M. S., Zhang, M., Meng, Y. G., Kadkhodayan, M., Kirchhofer, D, Combs, D. & Damico, L. A. (2002). "Albumin binding as a general strategy for improving the pharmacokinetics of proteins". J Biol Chem 277, 35035-35043).
В других воплощениях сам альбумин или биологически активный фрагмент альбумина может быть использован в качестве партнера конъюгации для липокалинового мутеина по изобретению. Термин "альбумин" включает все альбумины млекопитающих, такие как сывороточный альбумин человека, или бычий сывороточный альбумин, или альбумин крысы. Альбумин или его фрагмент можно продуцировать рекомбинантно, как описано в патенте US 5728553 или европейских патентных заявках ЕР 0330451 и ЕР 0361991. Рекомбинантный альбумин человека (Recombumin®) Novozymes Delta Ltd. (Nottingham, UK) может быть конъюгирован или слит с липокалиновым мутеином с целью продления периода полувыведения мутеина.
Если альбумин-связывающий белок представляет собой фрагмент антитела, он может представлять собой доменное антитело. Доменные антитела (dAbs) создают для обеспечения точного контроля над биофизическими свойствами и периодом полувыведения in vivo, для создания оптимального профиля безопасности и эффективности продукта. Доменные антитела, например, имеются в продаже в Domantis Ltd. (Cambridge, UK and MA, USA).
Используя трансферрин в качестве группировки для увеличения периода полувыведения мутеинов по изобретению из сыворотки, мутеины можно генетически сливать с N- или С-концом, или тем и другим, негликолизированного трансферрина. Негликолизированный трансферрин имеет период полувыведения 14-17 суток, и трансферрин, слитый с белком, аналогично будет иметь увеличенный период полувыведения. Трансферриновый носитель также обеспечивает высокую биодоступность, биораспределение и стабильность в кровообращении. Такая технология имеются в продаже у BioRexis (BioRexis Pharmaceutical Corporation, PA, USA). Рекомбинантный трансферрин человека (DeltaFerrin™) для использования в качестве белка-стабилизатора/партнера, увеличивающего период полувыведения, также имеется в продаже у Novozymes Delta Ltd. (Nottingham, UK).
Если Fc-область иммуноглобулина используется для пролонгирования периода полувыведения мутеинов по изобретению из сыворотки, можно использовать метод SynFusion™, имеющийся в продаже у Syntonix Pharmaceuticals, Inc (MA, USA). Использование данного метода Fc-слияния обеспечивает создание долгодействующих биофармацевтических средств и может, например, состоять из двух копий мутеина, соединенного с Fc-областью антитела для улучшения фармокинетики, растворимости и эффективности получения.
Еще одной альтернативой для пролонгирования периода полувыведения мутеина по изобретению является слияние с N- или С-концом мутеина по изобретению длинных, неструктурированных, гибких, богатых глицином последовательностей (например, полиглицин примерно с 20-80 идущими подряд остатками глицина). Такой подход, раскрытый в WO 2007/038619, например, также был назван "rPEG" (рекомбинантный PEG).
Если в качестве партнера по конъюгации используют полиалкиленгликоль, этот полиалкиленгликоль может быть замещенным, незамещенным, линейным или разветвленным. Он также может представлять собой активированное полиалкиленовое производное. Примерами подходящих соединений являются молекулы полиэтиленгликоля (PEG), как описано в WO 99/64016, в патенте US 6177074 или в патенте US 6403564 в отношении интерферона, или как описано для других белков, таких как PEG-модифицированная аспарагиназа, PEG-аденозиндезаминаза (PEG-ADA) или PEG-супероксиддисмутаза (смотри, например, Fuertges et al. (1990) The Clinical Efficacy of Poly(Ethylene Glycol)-Modified Proteins J. Control. Release 11, 139-148). Молекулярная масса такого полимера, предпочтительно полиэтиленгликоля, может изменятьсяот примерно 300 до примерно 70000 Да, включая, например, полиэтиленгликоль с молекулярной массой примерно 10000, примерно 20000, примерно 30000 или примерно 40000 Да. Кроме того, как, например, описано в патентах US 6500930 или 6620413, углеводные олиго- и полимеры, такие как крахмал или гидроксиэтиловый крахмал (HES), можно конъюгировать с мутеином по изобретению с целью увеличения периода полувыведения из сыворотки.
Если одна из вышеприведенных группировок конъюгирована с мутеином липокалина слезной жидкости человека по изобретению, может быть полезной конъюгация с боковой цепью аминокислоты. Подходящие боковые цепи аминокислот могут встречаться в природе в аминокислотной последовательности липокалина слезной жидкости человека или могут быть введены посредством мутагенеза. В случае, когда подходящий участок связывания вводят посредством мутагенеза, одной возможностью является замена аминокислоты в подходящей положении остатком цистеина. В одном воплощении такая мутация включает по меньшей мере одну из замен Thr 40→Cys, Glu 73→Cys, Arg 90→Cys, Asp 95→Cys, Lys 121→Cys, Asn 123→Cys или Glu 131→Cys. Только что образованный остаток цистеина в любой из таких положений можно затем использовать для конъюгации мутеина с группировкой, пролонгирующей период полувыведения мутеина из сыворотки, такой как PEG или его активированное производное.
В другом воплощении для получения подходящих боковых цепей аминокислот для конъюгирования одной из вышеуказанных группировок с мутеинами по изобретению при помощи мутагенеза можно вводить искусственные аминокислоты. В общем случае такие искусственные аминокислоты конструируют более реакционноспособными, и таким образом облегчают конъюгацию с нужной группировкой. Одним примером такой искусственной аминокислоты, которую можно вводить при помощи искусственной тРНК, является пара-ацетил-фенилаланин.
Для некоторых применений мутеинов, раскрытых в данном описании изобретения, может быть выгодно использовать их в форме слитых белков. В некоторых воплощениях мутеин липокалина слезной жидкости человека в соответствии с изобретением сливают по его М-концу или его С-концу с белком, доменом белка или пептидом, таким как сигнальная последовательность и/или метка аффинности.
Для фармацевтических применений мутеин по изобретению может быть слит с партнером по слиянию, что продлевает период полувыведения мутеина из сыворотки in vivo (смотри еще раз РСТ публикацию WO 2006/56464, где подходящий партнер по слиянию описан со ссылками на мутеины нейтрофильного желатиназо-ассоциированного липокалина со связывающей способностью в отношении CTLA-4). Подобно конъюгатам, описанным выше, партнер по слиянию может представлять собой Fc-область иммуноглобулина, домен СНЗ иммуноглобулина, домен СН4 иммуноглобулина, альбумин, альбумин-связывающий пептид или альбумин-связывающий белок, в качестве примера. Кроме того, альбумин-связывающий белок может представлять собой бактериальный альбумин-связывающий белок или липокалиновый мутеин со связывающей активностью в отношении альбумина. Соответственно, подходящие партнеры по слиянию для увеличения периода полувыведения липокалинового мутеина по изобретению включают альбумин (Osborn, В. L. et а1. (2002) (выше) J. Pharmacol. Exp.Ther. 303, 540-548) или альбумин-связывающий белок, например бактериальный альбумин-связывающий домен, такой как домен стрептококкового белка G (Konig, Т. and Skerra, A. (1998) выше J. Immunol. Methods 218, 73-83). Альбумин-связывающие пептиды, описанные в Dennis et al., выше (2002), или в патентной заявке США 2003/0069395, имеющие Cys-Xaa1-Xaa2-Xaa3-Xaa4-Cys консенсусную последовательность, где Xaa1 представляет собой Asp, Asn, Ser, Thr или Trp; Хаа2 представляет собой Asn, Gln, His, Ile, Leu или Lys; Хаа3 представляет собой Ala, Asp, Phe, Trp или Tyr и Хаа4 представляет собой Asp, Gly, Leu, Phe, Ser или Thr, также можно использовать в качестве партнера по слиянию. Также можно использовать сам альбумин или биологически активный фрагмент альбумина в качестве партнера по слиянию липокалинового мутеина по изобретению. Термин "альбумин" включает все альбумины млекопитающего, такие как сывороточный альбумин человека, или бычий сывороточный альбумин, или сывороточный альбумин крысы. Рекомбинантное производство альбумина или его фрагментов хорошо известно в данной области техники и описано, например, в патенте США 5728553, европейской патентной заявке ЕР 0330451 или ЕР 0361991.
Партнер по слиянию может придавать новые характеристики липокалиновому мутеину по изобретению, такие как ферментная активность или связывающая способность в отношении других молекул. Примерами подходящих слитых белков являются щелочная фосфатаза, пероксидаза хрена, глутатион-6-трансфераза, альбумин-связывающийдомен белка G, белок А, фрагменты антитела, домены олигомеризации, липокалиновые мутеины с такой же или отличающейся специфичностью связывания (что приводит к образованию "Duocalins", смотри Schlehuber, S., and Skerra, A. (2001), Duocalins, engineered ligand-binding proteins with dual specificity derived from the lipocalin fold. В/о/. Chem. 382, 1335-1342) или токсины.
В частности, может быть возможным слияние липокалинового мутеина по изобретению с отдельным ферментным активным сайтом, так что оба "компонента" полученного слитого белка вместе воздействуют на данную терапевтическую мишень. Связывающий домен липокалинового мутеина присоединяется к мишени, вызывающей заболевание, позволяя домену фермента аннулировать биологическую функцию мишени.
Маркеры аффинности, такие как Strep-tag® или Strep-tag® II (Schmidt, T.G.M. et al. (1996) J. Mol. В/о/. 255, 753-766), myc-tag, FLAG-tag, His6-tag или HA-tag или белки, такие как глутатион-8-трансфераза, также позволяют легко определять и/или очищать рекомбинантные белки, представляют собой дополнительные примеры предпочтительных партнеров по слиянию. Наконец, белки с хромогенными или флуоресцентными свойствами, такие как зеленый флуоресцентный белок (GFP) или желтый флуоресцентный белок (YFP), также являются подходящими партнерами по слиянию для липокалинового мутеина по изобретению.
Термин "слитый белок" при использовании в данном описании изобретения также включает липокалиновые мутеины по изобретению, содержащие сигнальную последовательность. Сигнальные последовательности на N-конце полипептида направляют такой полипептид в конкретное клеточное пространство, например периплазму Е.coli или эндоплазматическую сеть эукариотических клеток. Большое количество сигнальных последовательностей известно в данной области техники. Предпочтительная сигнальная последовательность для секреции полипептида в периплазму Е.coli представляет собой сигнальную последовательность QmpA.
Настоящее изобретение также относится к молекулам нуклеиновых кислот (ДНК и РНК), содержащим нуклеотидные последовательности, кодирующие мутеины, как описано в данном описании изобретения. Так как дегенерация генетического кода разрешает замены некоторых кодонов другими кодонами, определяющими ту же самую аминокислоту, изобретение не ограничено конкретной молекулой нуклеиновой кислоты, кодирующей мутеин по изобретению, но включают все молекулы нуклеиновых кислот, содержащие нуклеотидные последовательности, кодирующие функциональный мутеин.
Таким образом, настоящее изобретение также включает последовательность нуклеиновой кислоты, кодирующую мутеин по изобретению, содержащий мутацию по меньшей мере в одном кодоне в любом из положений аминокислотной последовательности 26-34, 56-58, 80, 83, 104-106 и 108 линейной полипептидной последовательности нативного зрелого липокалин слезной жидкости человека, где кодоны, кодирующие по меньшей мере один из остатков цистеина в положениях последовательности 61 и 153 линейной полипептидной последовательности зрелого липокалина слезной жидкости человека подвергнуты мутации для кодирования любого другого аминокислотного остатка.
Изобретение, которое раскрыто в данном описании изобретения, также включает молекулы нуклеиновых кислот, кодирующие мутеины липокалина слезной жидкости, которые содержат дополнительные мутации вне указанных положений последовательности экспериментального мутагенеза. Такие мутации часто допустимы или могут даже оказаться выгодными, например, если, они способствуют улучшенной эффективности фолдинга, стабильности сыворотки, термической стабильности или лиганд-связывающей аффинности мутеина.
Молекула нуклеиновой кислоты, раскрытая в данной заявке, может быть "функционально связана" с регуляторной последовательностью (или регуляторными последовательностями) для обеспечения экспрессии данной молекулы нуклеиновой кислоты.
Молекула нуклеиновой кислоты, такая как ДНК, упоминается как "способная экспрессировать молекулу нуклеиновой кислоты" или способная "обеспечивать экспрессию нуклеотидной последовательности", если она включает элементы последовательности, которые содержат информацию, относящуюся к регуляции транскрипции и/или трансляции, и такие последовательности "функционально связаны" с нуклеотидной последовательностью, кодирующей полипептид. Оперативная связь представляет собой связь, в которой элементы регуляторной последовательности и последовательности, подлежащей экспрессированию, соединены таким образом, который делает возможным экспрессию гена.
Точная природа регуляторных областей, необходимых для экспрессии гена, может варьироваться между видами, но обычно такие области содержат промотор, который у прокариот содержит как промотор сам по себе, то есть элементы ДНК, направляющие инициацию транскрипции, а также элементы ДНК, которые при транскрибировании в РНК будут передавать сигнал об инициации трансляции. Такие промоторные области обычно включают 5'-некодирующие последовательности, вовлеченные в инициацию транскрипции и трансляции, такие как -35/-10 боксы и элемент Шайн-Дальгарно у прокариот или бокс ТАТА, последовательности СААТ и элементы 5'-кэппинга у эукариот. Такие области могут также включать энхансерные или репрессорные элементы, а также транслируемые сигнальные и лидерные последовательности для нацеливания нативного полипептида на конкретный компартмент клетки-хозяина.
Кроме того, 3'-некодирующие последовательности могут содержать регуляторные элементы, вовлеченные в окончание транскрипции, полиаденилирование или тому подобное. Если, однако, такие терминирующие последовательности не являются достаточно функциональными в конкретной клетке-хозяине, они могут быть заменены сигналами, функциональными в такой клетке.
Таким образом, молекула нуклеиновой кислоты по изобретению может включать регуляторную последовательность, предпочтительно промоторную последовательность. В другом предпочтительном воплощении молекула нуклеиновой кислоты по изобретению содержит промоторную последовательность и транскрипционную терминирующую последовательность. Подходящими прокариотическими промоторами являются, например, промотор tet, промотор /acUV5 или промотор Т7. Примерами промоторов, полезных для экспрессии в эукариотических клетках, являются промотор SV40 или промотор CMV.
Молекулы нуклеиновых кислот по изобретению также могут являться частью вектора или клонирующего носителя любого другого вида, такого как плазмида, фагмида, фаг, бакуловирус, космида или искусственная хромосома.
В одном воплощении молекула нуклеиновых кислот содержится в фазмиде. Фазмидный вектор означает вектор, кодирующий межгенный участок умеренного фага, такого как М13 или f1, или его функциональную часть, слитую с интересующей кДНК. После суперинфицирования бактериальных клеток-хозяев таким фагмидным вектором и подходящим фагом-помощником (например М13К07, VCS-M13 или R408) продуцируются целые фаговые частицы, способствуя, таким образом, физическому соединению кодирующей гетерологичной кДНК с ее соответствующим полипептидом, экспонированным на поверхности фага (рассмотрено, например, в Kay, B. K. et al. (1996) Phage Display of Peptides and Proteins - A Laboratory Manual, 1st Ed., Academic Press, New York NY; Lowman, H. B. (1997) Annu. Rev. Biophys, Biomol. Struct. 26, 401-424, или Rodi, DJ, and Makowski, L. (1999) Curr. Opin. Biotechnol. 10, 87-93).
Такие клонирующие носители могут включать, кроме регуляторных последовательностей, описанных выше, и последовательности нуклеиновой кислоты, кодирующей липокалиновый мутеин по изобретению, репликационные и контрольные последовательности, происходящие из видов, совместимых с клеткой-хозяином, которую используют для экспрессии, а также как селектируемые маркеры, придающие селектируемый фенотип трансформированным или трансфицированным клеткам. В данной области техники известно и имеется в продаже большое количество подходящих клонирующих векторов.
Молекула ДНК, кодирующая липокалиновые мутеины по изобретению, и, в частности, клонирующий вектор, содержащий кодирующую последовательность такого липокалинового мутеина, может быть трансформирована в клетке-хозяине, способной экспрессировать ген. Трансформацию можно выполнять, используя стандартные способы (Sambrook, J. et al. (1989), выше). Таким образом, данное изобретение также направлено на клетку-хозяин, содержащую молекулу нуклеиновой кислоты, как она раскрыта в данном описании изобретения.
Трансформированные хозяйские клетки культивируют в условиях, подходящих для экспрессии нуклеотидной последовательности, кодирующей слитый белок по изобретению. Подходящими хозяйскими клетками могут быть прокариотические, такие как Escherichia coli (Е. coli) или Bacillus subtilis, или эукариотическими, такие как Saccharomyces cerevisiae, Pichia pastoris, клетки насекомых SF9 или High5, иммобилизованные клеточные линии млекопитающих (например, клетки HeLa или клетки СНО) или эмбриональные клетки млекопитающих.
Изобретение также относится к способу получения мутеина по изобретению, где мутеин, фрагмент мутеина или слитый белок мутеина и другого полипептида получают, начиная с нуклеиновой кислоты, кодирующей мутеин, при помощи генно-инженерных способов. Способ может быть выполнен in vivo, мутеин может быть получен, например, в бактериальном или эукариотическом организме-хозяине и затем выделен из данного организма-хозяина или его культуры. Также возможно получать белок in vitro, например, используя систему трансляции in vitro.
При получении мутеина in vivo нуклеиновую кислоту, кодирующую мутеин по изобретению, вводят в подходящий бактериальный или эукариотический организм-хозяин при помощи технологии рекомбинантной ДНК (как уже изложено выше). С этой целью клетку-хозяина, используя общепринятые стандартные методы (Sambrook, J. et al. (1989), выше), сначала трансформируют клонирующим вектором, содержащим молекулу нуклеиновой кислоты, кодирующую мутеин по изобретению. Затем клетку-хозяина культивируют в условиях, которые делают возможной экспрессию гетерологичной ДНК и, таким образом, синтез соответствующего полипептида. Затем полипептид извлекают или из клетки, или из среды для культивирования.
В некоторых мутеинах липокалина слезной жидкости по изобретению разорвана встречающаяся в природе дисульфидная связь между Cys 61 и Cys 153. Соответственно такие мутеины (или любой другой мутеин липокалина слезной жидкости, который не содержит внутримолекулярную дисульфидную связь) могут быть получены в клеточном компартменте, имеющем восстанавливающий окислительно-восстановительную среду, например, в цитоплазме грамотрицательных бактерий. В случае, когда липокалиновый мутеин по изобретению содержит внутримолекулярные дисульфидные связи, может быть предпочтительно направлять образующийся полипептид в клеточный компартмент, имеющий окисляющую окислительно-восстановительную среду, используя подходящие сигнальные последовательности. Такая окисляющая окружающая среда может быть обеспечена периплазмой грамотрицательных бактерий, таких как Е.coli, во внеклеточной среде грамположительных бактерий или в просвете эндоплазматической сети эукариотических клеток и обычно способствует образованию структурных дисульфидных связей. Также возможно, однако, получать мутеин по изобретению в цитозоле клетки-хозяина, предпочтительно Е.coli. В этом случае полипептид можно либо непосредственно получать в растворимом и свернутом состоянии или извлекать в форме телец включения с последующей ренатурацией in vitro. Еще один вариант представляет собой использование конкретных штаммов-хозяев, имеющих окисляющую внутриклеточную среду, которые могут, таким образом, обеспечивать образование дисульфидных связей в цитозоле (Venturi M, Seifert С, Hunte С. (2002) "High level production of functional antibody Fab fragment in an oxidizing bacterial cytoplasm. "J. Mol. Biol. 315, 1-8).
Однако мутеин по изобретению необязательно может быть образован или получен только с использованием генной инженерии. Предпочтительнее липокалиновый мутеин также может быть получен посредством химического синтеза, такого как твердофазный полипептидный синтез Меррифилда, или посредством транскрипции и трансляции in vitro. Например, возможно идентифицировать перспективные мутации, используя молекулярное моделирование, и затем синтезировать требующийся (конструируемый) полипептид in vitro и изучать активность связывания в отношении данной мишени. Способы твердофазного синтеза белков и/или синтеза в фазе раствора хорошо известны в данной области техники (рассмотрены, например, в Lloyd-Williams, P. et al. (1997) Chemical Approaches to the Synthesis of Peptides and Proteins. CRC Press, Boca Raton, Fields, G.B., и Colowick, S.P. (1997) Solid-Phase Peptide Sunthesis. Academic Press, San Diego, или Bruckdorfer, T. et al. (2004) Curr. Pharm. Biotechnol. 5, 29-43).
В другом воплощении мутеины по изобретению могут получены посредством транскрипции/трансляции in vitro, используя общепринятые способы, известные специалисту в данной области техники.
Изобретение также относится к фармацевтической композиции, содержащей по меньшей мере один мутеин липокалина слезной жидкости человека в соответствии с изобретением, или его слитый белок или конъюгат, и фармацевтически приемлемый эксципиент.
Липокалиновые мутеины по изобретению можно вводить при помощи любого парентерального или непарентерального (энтерального) пути, который является терапевтически эффективным для белковых лекарственных средств. Способы парентерального применения включают, например, внутрикожные, подкожные, внутримышечные, внутритрахеальные, интраназальные, в стекловидное тело или внутривенные инъекции и инфузионные методы, например в форме инъекционных растворов, инфузионных растворов или тинктур, а также аэрозольной установки и ингаляции, например в форме аэрозольных смесей, спреев или порошков. Общее представление о доставке лекарственного средства в легкие, то есть либо при помощи ингаляции аэрозолей (которые также можно использовать в интраназальном введении), либо внутритрахеальной установки, дано, например, в J. S. Patton et al. The lungs as aportal of entry for systemic drug delivery. Proc. Amer. Thoracic Soc. 2004 Vol.1 pages 338-344). Способы непарентеральной доставки представляют собой, например, пероральный, например в форме драже, таблеток, капсул, растворов или суспензий, или ректальный, например в форме суппозиториев. Мутеины по изобретению можно вводить системно или местно в композициях, содержащих обычные нетоксичные фармацевтически приемлемые эксципиенты или носители, добавки и наполнители по желанию.
В одном воплощении настоящего изобретения фармацевтическое средство вводят парентерально млекопитающему и, в частности, людям. Соответствующие способы введения включают, без ограничения ими, например, внутрикожные, подкожные, внутримышечные, внутритрахеальные или внутривенные инъекции и инфузионные методы, например в форме инъекционных растворов, инфузионных растворов или тинктур, а также аэрозольной установки и ингаляции, например в форме аэрозольных смесей, спреев или порошков. Комбинация внутривенной и подкожной инфузии и/или инъекции может являться наиболее удобной в случае соединений с относительно коротким периодом полувыведения из сыворотки. Фармацевтическая композиция может представлять собой водный раствор, эмульсию масло-в-воде или эмульсию вода-в-масле.
При этом следует отметить, что способы трансдермальной доставки, например ионтофорез, сонофорез или улучшенная доставка микроиглой, которые описаны в Meidan VM and Michniak BB 2004 Am. J. Ther. 11(4): 312-316, также можно использовать для трансдермальной доставки мутеинов, описанных в данном описании изобретения. Способы непарентеральной доставки представляют собой, например, пероральный, например в форме драже, таблеток, капсул, растворов или суспензий, или ректальное введение, например в форме суппозиториев. Мутеины по изобретению могут быть введены системно или местно в композициях, содержащих ряд обычных нетоксичных фармацевтически приемлемых эксципиентов или носителей, добавок и носителей.
Дозирование используемого мутеина можно варьировать в широких пределах для достижения желательного профилактического эффекта или терапевтического ответа. Оно будет зависеть, например, от аффинности соединения в отношении выбранного лиганда, а также от периода полувыведения комплекса мутеина и лиганда in vivo. Кроме того, оптимальное дозирование будет зависеть от биораспределения мутеина, или его слитого белка, или его конъюгата, способа введения, тяжести заболевания/расстройства, подлежащего лечению, а также медицинского состояния пациента. Например, при использовании в мази для местных применений можно использовать высокую концентрацию мутеина липокалина слезной жидкости. Однако, если требуется, мутеин также может быть дан в композиции с замедленным высвобождением, например в липосомальных дисперсиях или полимерных микросферах на основе гидрогеля, подобных PolyActive™ или OctoDEX™ (смотри Bos et al., Business Briefing: Pharmatech 2003: 1-6). Другие доступные композиции с замедленным высвобождением представляют собой, например, полимеры на основе PLGA (сополимер молочной и гликолевой кислот) (PR фармацевтики), гидрогели на основе PLA-PEG (полимолочная кислота-полиэтиленгликоль) (Medincell) и полимеры на основе PEA (полиэфирамид) (Medivas).
Таким образом, мутеины по настоящему изобретению могут быть приготовлены в виде композиций, с использованием фармацевтически приемлемых ингредиентов, а также общепринятых способов получения (Gennaro, A.L. and Gennaro, A.R. (2000) Remington: The Science and Practice of Pharmacy, 20th Ed., Lippincott Williams & Wilkins, Philadelphia, PA). Для получения фармацевтических композиций можно использовать фармацевтически инертные неорганические или органические эксципиенты. Для получения, например, драже, порошков, желатиновых капсул или суппозиториев можно использовать, например, лактозу, тальк, стеариновую кислоту и ее соли, жиры, воски, твердые или жидкие полиолы, природные и твердые масла. Подходящие эксципиенты для получения растворов, суспензий, эмульсий, аэрозольных смесей или порошков для восстановления в растворы или аэрозольные смеси перед использованием включают воду, спирты, глицерин, полиолы и их подходящие смеси, а также растительные масла.
Фармацевтическая композиция также может содержать добавки, такие как, например, наполнители, связывающие вещества, увлажняющие агенты, скользящие вещества, стабилизаторы, консерванты, эмульгаторы и, кроме того, растворители или солюбилизаторы или агенты для достижения эффекта депо. Последнее заключается в том, что слитые белки могут быть включены в системы медленного или замедленного высвобождения или целевой доставки, такие как липосомы и микрокапсулы.
Композиции могут быть стерилизованы множеством способов, включая фильтрование через задерживающий бактерии фильтр, или путем введения стерилизующих агентов в форме стерильных твердых композиций, которые могут быть растворены или диспергированы в стерильной воде или другой стерильной среде непосредственно перед применением.
Другой аспект настоящего изобретения относится к способу лечения заболевания или расстройства у субъекта, нуждающегося в этом. Такое заболевания может включать или может не включать связывание/взаимодействие c-Met рецепторной тирозинкиназы. Заболевание может представлять собой заболевание, в развитие которого вовлечен путь HGF/c-Met. Такое заболевание или расстройство может представлять собой клеточное пролиферативное расстройство. Примером клеточного пролиферативного заболевания является рак. Примеры рака, подлежащего лечению, включают, без ограничения, рак печени, рак толстой кишки (например, первичный рак толстой кишки, смотри, например, Clin Cancer Res.2003, 9(4), pages 1480-1488), колоректальный рак (смотри Zeng et al., Clin. Exp.Metastasis, 200004, 21 (5), pages 409-417), гепатокарциному, папиллярный рак почек, плоскоклеточный рак головы и шеи (HNSC), метастазы лимфатических узлов при плоскоклеточном раке головы и шеи, например (смотри, например, Schiering et al., PNAS, Vol.100, No. 22, pages 12654-12559, 2003, или обзоры Trusolino & Comoglio (2002), Nat. Rev. Cancer, 289-300 или Maulik et al. (2002) Cytokine Growth FaktorRev. 13, 41-59). Для таких терапевтических целей можно использовать мутеины липокалина слезной жидкости, которые противодействуют пути HGF/c-Met и/или слияниям токсинов или конъюгатов мутеина липокалина слезной жидкости или конъюгатов мутеина липокалина слезной жидкости с цитостатическим агентом, как описано выше.
Субъект, нуждающийся в таком лечении, может представлять собой млекопитающее, такое как человек, собака, мышь, крыса, свинья, примат, такой как Cymologous, названы лишь несколько иллюстративных примеров.
Из приведенного выше описания очевидно, что мутеин по настоящему изобретению, или его слитый белок, или конъюгат можно использовать во многих применениях. В общем случае такой мутеин можно использовать во всех применениях, где используются антитела, за исключением конкретно основанных на гликолизировании Fc-области.
Таким образом, в другом аспекте изобретения мутеины липокалина слезной жидкости человека в соответствии с изобретением можно использовать для обнаружения in vitro данного лиганда, то есть рецептора с-Met, или его домена, или его фрагмента. Такое применение может включать стадии взаимодействия мутеина с образцом, который, как предполагается, содержит данный лиганд, в подходящих условиях, таким образом обеспечивая образование комплекса мутеина и данного лиганда, и обнаружение связанного мутеина при помощи подходящего сигнала.
Обнаруживаемый сигнал может быть вызван меткой, как объяснялось выше, или изменением физических свойств из-за связывания, то есть образования комплекса как такового. Одним примером является плазменный поверхностный резонанс, величина которого изменяется во время связывания партнеров по связыванию, один из которых иммобилизован на поверхности, такой как золотая фольга.
Мутеины липокалина слезной жидкости человека, раскрытые в данном описании изобретения, можно также использовать для выделения in vitro данного лиганда липокалина слезной жидкости человека. Такое применение может включать стадии взаимодействия мутеина с образцом, содержащим, как предполагается, указанный лиганд, в подходящих условиях, таким образом обеспечивая образование комплекса мутеина с данным лигандом, и выделение комплекса мутеин/лиганд из образца.
В обоих слоях, применении мутеина для обнаружения данного лиганда, а также для выделения данного лиганда, мутеин и/или мишень могут быть иммобилизованы на подходящей твердой фазе.
Мутеины липокалина слезной жидкости человека в соответствии с изобретением могут также быть использованы для нацеливания соединения на заранее выбранный участок. В одном таком воплощении мутеин липокалина слезной жидкости человека используют для нацеливания фармацевтически активного соединения на заранее выбранный участок в организме или ткани, включающего:
а) конъюгирование мутеина с указанным соединением, и
б) доставку комплекса мутеин/соединение в заранее выбранный участок, Фармацевтически активное соединение может быть выбрано из группы, состоящей из токсина, цитостатического агента или антагониста c-Met. Примеры антагонистов c-Met включают моноклональное антитело (которое обычно связывает внеклеточные домены c-Met), или ингибиторы, которые нацелены на внутриклеточные домены (в частности, домен тирозинкиназы). Примеры низкомолекулярных ингибиторов включают, без ограничения ими, производное 1,3,5,-триазин-2,4-диамина, которое описано в WO 2004/031184, производное 2-(2,6-дихлорфенил)имидазола, бициклическое азотсодержащее производное, 5-бензилсульфонил и сульфонамид-замещенный пиррол-индолин (например, соединение РНА-665752, разработанное Sugen и описанное в Christenson J.G. AACR, Abst 4963 и 6200, 2003, или Sattler M et al, AACR, Abst 1005,2003).
С этой целью мутеин приводят во взаимодействие с c-Met рецепторной тирозинкиназой или с доменом с целью обеспечения образования комплекса. Затем комплекс, содержащий мутеин и интересующее соединение, доставляют в заранее выбранный участок. Такое использование является, в частности, подходящим, но не ограничено им, для доставки лекарственного средства (избирательно) в заранее выбранный участок в организме, такой как инфицированная область организма, ткань или орган, который предполагают лечить этим лекарственным средством. Кроме образования комплекса мутеина и интересующего соединения, мутеин может также взаимодействовать с данным соединением с получением конъюгата мутеина и соединения. Подобно указанному выше комплексу, такой конъюгат может быть подходящим для доставки соединения в заранее выбранный целевой участок. Такой конъюгат мутеина и соединения также может включать линкер, который ковалентно связывает мутеин и соединение друг с другом. Возможно, такой линкер является стабильным в кровотоке, но расщепляем в клеточной среде.
Мутеины, раскрытые в данном описании изобретения, и их производные можно, таким образом, использовать во многих областях, подобно антителам или их фрагментам. В дополнение к их использованию для связывания с подложкой, позволяющей иммобилизовать или отделить мишень данного мутеина, или конъюгат, или слитый белок этой мишени, мутеины можно использовать для мечения ферментом, антителом, радиоактивным веществом или любой другой группой, обладающей биохимической активностью или определенными характеристиками связывания. При этом их соответствующие мишени, или их конъюгаты, или их слитые белки могут быть обнаружены или приведены в контакт с ними. Например, мутеины по изобретению могут служить для определения химических структур при помощи общепринятых аналитических методов (например, ELISA или вестерн-блоттинг) или при помощи микроскопии или иммуносенсорных веществ. При этом сигнал обнаружения может быть сгенерирован непосредственно при использовании подходящего конъюгата мутеина или слитого белка, или косвенно, посредством иммунохимического определения связанного мутеина при помощи антитела.
Многочисленные возможные применения изобретательских мутеинов также имеются в медицине. Кроме применения в in vitro диагностических средствах и средствах доставки лекарственных средств, может быть образован мутантный полипептид по изобретению, который связывается, например, с ткане- или опухолеспецифичными молекулами клеточной поверхности.
Изобретение дополнительно проиллюстрировано следующими неограничивающими примерами и прилагаемыми графическими материалами.
На Фиг.1 показана карта фазмидного вектора pTLPC59, где на Фиг.1а, показано схематическое представление регуляторных элементов вектора, и на Фиг.1б представлено схематическое увеличение генной конструкции мутеинов липокалина слезной жидкости, которую используют для экспрессирования ранее не подверженной воздействиям библиотеки.
На Фиг.2 показана карта вектора экспрессии pTLPC 10.
На Фиг.3 показаны полипептидные последовательности мутеинов липокалина слезной жидкости S225.4-K24 (SEQ ID NO: 1), выровненные с полипептидными последовательностями липокалина слезной жидкости дикого типа.
На Фиг.4 показывает способ скрининг аффинности при помощи ELISA и результаты, полученные для мутеинов с аффинностью к c-Met.
На Фиг.5 показано выравнивание полипептидных последовательностей мутеинов липокалина слезной жидкости S225.4-K24 (SEQ ID NO: 1), и S244.2-Н08, S244.2-L01, S244.4-NO5, S244.5-J05, S244.8-I20, S244.8-I07 (SEQ ID NO: 4-9).
На Фиг.6 показаны измерения на BIAcore связывания мутеина липокалина слезной жидкости человека в соответствии с изобретением (S244.2-H08; SEQ ID NO:4) с c-Met.
На Фиг.7 показан результат оценки аффинности c-Met-связывающих мутеинов S244.2-H08, S244.2-L01, S244.4-N05, S244.5-J05, S244.8-I20, S244.8-I07 (SEQ ID NO: 4-9) в клеточной среде на клетках НТ-29.
На Фиг.8 показан способ скрининга аффинности при помощи ELISA и результаты, полученные для мутеинов с аффинностью к c-Met.
На Фиг.9 показано выравнивание полипептидных последовательностей мутеинов S225.4-K24 (SEQ ID NO: 1), S244.2-H08 (SEQ ID NO: 4), S261.1-L12, S261.1-J01, и S261.1-L17 (SEQ ID NO: 32-34) липокалина слезной жидкости.
На Фиг.10 показана карта вектора экспрессии pTLPC 47.
На Фиг.11 показан результат оценки аффинности c-Met-связывающих мутеинов S261.1-L12, S261.1-J01, и S261.1-L17 (SEQ ID NO: 32-34) в клеточной среде на клетках НТ-29.
На Фиг.12 показаны измерения связывания мутеина по изобретению (S261.1-L17; SEQ ID NO: 34) липокалина слезной жидкости человека с c-Met посредством конкурентного ELISA.
На Фиг.13 показан результат оценки аффинности c-Met-связывающего мутеина S261.1-L12_C123 (SEQ ID NO: 35) вклеточной среде наклетках НТ-29.
На Фиг.14 показаны результаты испытания на рН-стабильность мутеина S261.1-J01 (SEQ ID NO: 33) липокалина слезной жидкости.
На Фиг.15 показано выравнивание полипептидных последовательностей дополнительных мутеинов липокалина слезной жидкости по изобретению (в которые были введены дополнительные одиночные мутации) вместе с их значением kd в отношении связывания с c-Met.
На Фиг.16 показан результат оценки аффинности c-Met-связывающих мутеинов S318.1-C10, S318.1-L13, S318.1-A16, S318.2-I24, и S318.1-012 (SEQ ID NO: 42, 44, 45, 46 и 49) в клеточном окружении на клетках НТ-29.
Примеры
Если не указано иное, использовали общепринятые способы рекомбинантной генной технологии, например, как описано в Sambrook et al.
(выше).
Пример 1: Получение библиотеки 1.6×1010 независимых мутеинов Tic
Случайную библиотеку липокалина слезной жидкости (Tic) с высокой сложностью получали, по существу, как описано в Примере 1 РСТ заявки РСТ/ЕР2007/057971, описание которой полностью включено посредством ссылки в данное описание изобретения за исключением того, что конструкция библиотечного гена для фагового дисплея pTLPC59 (Фиг.1а и 1б) помещена под контроль lac р/о вместо tet р/о и генетически слита с полноразмерным геном III фага VCSM 13.
Фаговое продуцирование мутеина липокалина слезной жидкости в формате мультивалентного фагового дисплея выполняли, используя гиперфаг М13К07 (Progen) для инфицирования Е. соli в соответствии стандартным способам, которые описаны в литературе (М. Kirsch et al. / Journal of Immunological Methods 301 (2005) 173-185).
Пример 2: Фагмидная презентация и селекция мутеинов Tic с аффинностью к рецептору c-Met
Фагмидный дисплей и селекцию выполняли, используя фагмиды, полученные в Примере 1, по существу, как описано в Примере 3 WO 2005/019256 со следующими модификациями: белок-мишень (рецептор c-Met-Fc, R&D systems) использовали в концентрации 200 нМ и осуществляли его презентацию библиотеке в виде Fc-слитого белка с последующим захватом комплекса фаг-мишень с использованием гранул белка G (Dynal). Для выбора связывающих веществ, которые действуют неантагонистически к природному лиганду HGF, вводили стадию дополнительного промывания, используя 200 нМ растворимого HGF (R&D systems), затем c-Met библиотечные фаги элюировали в щелочных условиях. Выполняли четыре цикла селекции.
Пример 3: Идентификация мутеинов, специфичных к рецептору с-Met, с использованием высокопроизводительного ELISA-скрининга
Скрининг мутеинов, выбранных согласно Примеру 2, выполняли, по существу, как описано в Примере 3 WO 2006/56464. Модификации протокола описаны ниже: вектор экспрессии представлял собой pTLPC 10 (Фиг.2). Используемый белок-мишень представлял собой рецептор c-Met-Fc (R&D Systems) в концентрации 1 мкг/мл, и 3%-ное молоко использовали в качестве неродственной контрольной мишени вместо сывороточного альбумина человека.
Скрининг 2880 клонов, выбранных, как описано в Примере 2, приводил к идентификации 342 первичных попаданий, указывающих на то, что имело место успешное выделение мутеинов из библиотеки. Используя данный подход, идентифицировали клон S225.4-K24 (SEQ ID NO: 1). Последовательности S225.4-K24 также представлены на Фиг.3.
Пример 4: Созревание аффинности мутеина S225.4-K24 с использованием подверженной ошибкам PCR
Получение библиотеки вариантов на основе мутеина S225.4-K24 (SEQ ID NO: 1) выполняли, по существу, как описано в Примере 5 WO 2006/56464, используя олигонуклеотиды TL50 bio: TATCTGAAGGCCATGACGGTGGAC (SEQ ID NO: 2) и TL51 bio: TGCCCACGAGCCACACCCCTGGGA (SEQ ID NO: 3), что давало в результате библиотеку в среднем с 5 заменами на структурный ген.
Селекцию фагмид выполняли, как описано в Примере 2, но используя ограниченную целевую концентрацию (2 нМ, 0,5 нМ и 0,1 нМ) рецептора c-Met -Fc, и захватывая мишень и фагмидный комплекс при помощи mAb специфичных к IgG-Fc человека, иммобилизованных на полистирольном планшете. Дополнительные селекции выполняли в идентичных условиях, но с ограничением объединенной мишени (1 нМ) и коротким периодом инкубирования (5 минут) или ограничением мишени (5 нМ, 0,5 нМ и 0,1 нМ) вместе с инкубированием фагмид при рН 3, 60°С в течение 15 мин или рН 10, комнатная температура, в течение 30 мин. Выполняли четыре цикла селекции.
Пример 5: Скрининг аффинности мутеинов, связывающих рецептор c-Met с использованием высокопроизводительного EUSA-скрининга
Скрининг выполняли, как описано в Примере 3, с модификацией, заключающейся в использовании концентрации рецептора c-Met-Fc (R&D Systems) 2,5 мкг/мл или 0,6 мкг/мл. Всего проводили скрининг 2880 клонов, получая 1510 попаданий, указывающих на то, что имело место успешное обогащение созревших мутеинов из библиотеки. Дополнительно в альтернативной организации скрининга моноклональное анти-Т7 антитело наносили на полистирольный планшет, и эспрессированные мутеины захватывали при помощи маркера Т7 перед инкубированием с ограниченными концентрациями рецептора c-Met-Fc (60 нМ, 15 нМ и 2,5 нМ). Связывание рецептора c-Met-Fc определяли, используя поликлональное конъюгированное с HRP антитело против IgG человека - домена Fc.
Результат такого скрининга представлен на Фиг.4. Было идентифицировано большое количество мутеинов, выбранных, как описано в Примерах 4 и 5, имеющих улучшенную аффинность в отношении рецептора с-Met по сравнению с мутеином S225.4-K24 (SEQ ID NO: 1), который служил в качестве основы для созревания аффинности. Используя данный подход, идентифицировали мутеины S244.2-H08, S244.2-L01, S244.4-N05, S244.5-J05, S244.8-I20, S244.8-I07 (SEQ ID NO: 4-9). Последовательности S244.2- Н08, S244.2-L01, S244.4-N05, S244.5-J05, S244.8-I20, S244.8-107 также изображены на Фиг.5.
Пример 6: Получение мутеинов, связывающихся с рецептором c-Met
Для препаративного получения мутеинов, специфичных к рецептору с-Met, штамм JM83 Е.coli KI 2, содержащий соответствующий мутеин, закодированный в векторе экспрессии pTLPCIO (Фиг.2), выращивали в 2 л встряхиваемой колбе, культивировали в среде LB (Луриа-Бертани)-ампициллин согласно протоколу, описанному в Schlehuber, S. et al. (J. Mot. В/о/. (2000), 297, 1105-1120). Когда были необходимы более значительные количества белка, штамм W3110 Е.coli, содержащий соответствующей вектор экспрессии, использовали для периплазматического продуцирования посредством культивирования в настольном ферментере в 1 л или 10 л сосуде на основе протокола, описанного в Schiweck, W., and Skerra, A, Proteins (1995) 23, 561-565).
Мутеины очищали от периплазматической фракции за одну стадию при помощи стрептавидин-аффинной хроматографии, используя колонку с подходящим объемом слоя согласно способу, описанному в Skerra, A. & Schmidt, Т. G. М. (2000) (Use of the Strep-tag and streptovidin for detection and purification of recombinant proteins. Methods Enzymol. 326A. 271-304). Для достижения более высокой очистки и для удаления любого агрегированного рекомбинантного белка, в заключение выполняли гель-фильтрацию мутеинов на колонке Superdex 75 HR 10/30 (24 мл объем слоя, Amersham Pharmacia Biotech) в присутствии буфера PBS (фосфатный буферный солевой раствор). Фракции мономерного белка объединяли, проверяли на чистоту при помощи SDS-PAGE (электрофорез на полиакриламидном геле с додецилсульфатом натрия) и использовали для дополнительной биохимической характеристики.
Пример 7: Измерение аффинности с использованием спектроскопии поверхностно плазменного резонанса (SPR)
Измерение аффинности выполняли главным образом, как описано в Примере 9 WO 2006/56464 с модификациями, заключающимися в том, что приблизительно 9000 RU (условных единиц) рецептора c-Met -Fc (R&D Systems) были непосредственно иммобилизованы на поверхности чипа СМ5 (вместо 2000 RU CTLA-4 человека или CTLA-4-Fc мыши, используемых в качестве мишени в WO 2006/56464), и 80 мкл мутеина инъецировали в концентрации 0,2-0,5 мкМ (вместо 40 мкл образца очищенных липокалиновых мутеинов в концентрациях 5-0,3 мкМ, которые использовали в WO 2006/56464). Поверхность чипа регенерировали между измерениями при помощи инъекции 5-10 мкл 50 мМ NaOH, pH 10, 2,5 М NaCI. Поддерживали постоянную скорость потока 10 мкл/мин.
Результаты измерений аффинности с использованием S244.2-H08, S244.2-L01, S244.4-N05, S244.5-J05, S244.8-I20, S244.8-I07 обобщены в Таблице I и оценка сенсограмм, типичных для S244.2-H08, представлена на Фиг.6.
Таблица I. Аффинности выбранных мутеинов по изобретению к рецептору с-Met при определении посредством SPR. Средние значения рассчитывают на основании по меньшей мере 3 независимых измерений.
Пример 8: Ранжирование аффинности липокалиновых мутеинов на интактных клетках с помощью проточной цитометрии
Липокалиновые мутеины титровали на клетках НТ-29 (АТСС), которые показывают эндогенную экспрессию HGFR/c-Met. Липокалиновые мутеины тестировали в 24 разведениях 1:2, начиная с концентрации 10 мкМ в общем объеме 30 мкл. Для каждой реакции связывания 100000 клеток инкубировали в PBS, содержащем 2% фетальной телячьей сыворотки (FCS), в течение 2 ч при 4°С. Клетки промывали дважды PBS, 2% FCS и инкубировали с 375 нг биотинилированной, аффинно-очищенной козьей антисыворотки против липокалина слезной жидкости на реакцию в течение 30 мин. После промывания и еще 30 мин инкубирования со стрептавидином-фикоэритрином выполняли определение. Клетки промывали, и флуоресценцию анализировали на проточном цитометре FACS Calibur. Среднюю интенсивность флуоресценции (MFI) наносили на диаграмму против концентрации липокалинового мутеина и аппроксимировали к сигмоидальной кривой доза-эффект, и значения ЕС50 определяли, используя программное обеспечение GraphPad Prism.
Кривые титрования, из которых определяли значения ЕС50 для S244.2-Н08, S244.2-L01, S244.4-N05, S244.5-J05, S244.8-I20, S244.8-I07, представлены на Фиг.7, и рассчитанные значения ЕС50 обобщены в Таблице II.
Таблица II. Значения ЕС50 и стандартные отклонения селектированных мутеинов по изобретению для рецептора c-Met, при определении посредством титрования FACS на клетках НТ-29.
Пример 9: Скрининг Суs-вариантов липокалинового мутеина
С целью получения реакционно-способной группы для сайт-направленного сочетания, например с активированным PEG или фармацевтически подходящей меткой, посредством сайт-направленного мутагенеза вводили неспаренный остаток цистеина. Рекомбинантный мутеин, несущий свободный остаток Cys, затем продуцировали в Е.coli, как описано в Примере 6, определяли выход экспрессии, и аффинность измеряли спомощью SPR, по существу, как описано в Примере 7.
Цистеин вводили вместо любой из аминокислот Thr 40, Asp 95, Arg 90, Lys 121, Asn 123 или Val 93, используя попарно олигонуклеотиды
Н08_Т40С прямой CGTCTCGGTAACACCCATATGCCTCACGACCCTGGAAGGG(SEQ ID NO: 10) и
H08JT40C обратный CCCTTCCAGGGTCGTGAGGCATATGGGTGTTACCGAGACG (SEQ ID NO: 11), или H08JD95C прямой
CAGGTCGCACGTGAAGTGCCACTACATCTTTTACTCTGAGGG (SEQ ID NO: 12) и H08_D95C обратный
CCCTCAGAGTAAAAGATGMAPKEPTGGCACTTCACGTGCGACCTG (SEQ ID NO: 13), или Н08 R90C прямой CGTGGCATACATCAGCTGCTCGCACGTGAAGGATCAC (SEQ ID NO: 14) и
H08_ R90C GTGATCCTTCACGTGCGAGCAGCTGATGTATGCCACG (SEQ ID NO: 15), или
A22JC121C прямой GGCAGAGACCCCTGCAACAACCTGGAAGCCTTG (SEQ ID NO: 16) и
A22JC121C обратный CAAGGCTTCCAGGTTGTTGCAGGGGTCTCTGCC (SEQ ID NO: 17), или
A22_N123C прямой GGCAGAGACCCCAAGAACTGCCTGGAAGCCTTGGAG (SEQ ID NO: 18) и
A22_N123C прямой GGCAGAGACCCCAAGAACTGCCTGGAAGCCTTGGAG (SEQ ID NO: 19), или H08_V93C прямой
CATCAGCAGGTCGCACTGCAAGGATCACTACATCTTTTAC (SEQID NO: 20) и H08_V93C обратный GTAAAAGATGMAPKEPTGATCCTTGCAGTGCGACCTGCTGATG (SEQ ID NO: 21), соответственно.
В качестве примера результаты Cys-скрининга мутеина S244.2-H08 (SEQ ID NO: 4), специфичного к рецептору c-Met, приведены в Таблице III ниже.
Таблица III. SPR-аффинности к рецептору c-Met мутеина S244.2-H08 и его мутантов, содержащих аминокислотные замены Thr 40→Cys (SEQ ID NO: 22), Asn 123→Cys (SEQ ID NO: 23), Asp 95→Cys (SEQ ID NO: 24), Arg 90→Cys (SEQ IDNO: 25), nLys 121→Cys (SEQID NO: 26).
Пример 10: Аффинное созревание мутеина S225.4-K24 с использованием сайт-направленного случайного подхода
Библиотеку вариантов на основе мутеина S225.4-K24 (SEQ ID NO: 1) конструировали случайным выбором положении остаток 28, 39, 52, 5, 58, 65, и 89 для учета всех 20 аминокислот на этих положениях. Библиотеку создавали, по существу, как описано в Примере 1, с модификацией, заключающейся в том, что получали три рандомизированных PCR-фрагмента, используя попарно дезоксинуклеотиды K24_1
GCCATGACGGTGGACACGCAGNNSCCGCTGAGCCTCTAC (SEQ NO: 27) (покрывающий положение 28) и K24_2:
CAGGGTCGTGAGGGTSNNGGGTGTCACCGAGAC (SEQ NO: 28) (покрывающий положение 39), K24_3:
GGGGGCAACCTGGAAGCCNNSGTCACCNNSAACCAGNNSGGCCGGTCCCAGG AGGTG (SEQ NO: 29) (покрывающий положения 52, 55 и 58) и K24_4:
GTATTTTCCCGGCTCATCAGTTTTCTCCAGGACGGCSNNCACCTCCTGGGACCG GCC (SEQ NO: 30) (покрывающий положение 65), K24_5:
GTGCTCACGTGGCATACATCNNSAGGTCGCACGTGAAGGAC (SEQ NO: 31) (покрывающий положение 89) и TL51bio (SEQ NO: 3) вместо TL46, TL47, TL48 и TL49 соответственно. Фагмидный дисплей и селекцию выполняли, используя фагмиды, по существу, как описано в Примере 2, со следующими модификациями: белок-мишень представлял собой мономерный рецептор с-Met без Fc-участка (R&D systems) в биотинилированной форме, которая дает возможность захвата мишени: фагмидного комплекса при помощи нейтравидина (Pierce), иммобилизованного на полистирольном планшете. Селекцию выполняли, используя либо ограниченную концентрацию мишени (1,5 нМ и 0,5 нМ и 0,1 нМ биотинилированного рецептора c-Met) или ограниченную концентрацию мишени (3 мкг/мл, 1 мкг/мл, и 0,3 мкг/мл) вместе с более коротким временем инкубирования (10 мин) или конкурентным подходом, с использованием значительного избытка (10 мкМ) очищенного c-Met-специфичного мутеина S244.2-H08 (SEQ NO: 4), полученного в результате допускающего ошибки созревания, как описано в Примере 5. Выполняли три цикла селекции.
Пример 11: Скрининг аффинности мутеинов, связывающих рецептор c-Met, с использованием высокопроизводительного скрининга EUSA
Скрининг выполняли, по существу, как описано в Примере 5 в организации альтернативного скрининга со следующими модификациями;
1) моноклональное анти-Т7 антитело наносили на полистирольный планшет, и экспрессируемые мутеины захватывали при помощи маркера Т7 перед инкубированием с ограниченными концентрациями мономерного рецептора c-Met-bio (50 нМ, 10 нМ и 2,5 нМ). Связывание мишени определяли, используя HRP (пероксидазу хрена), конъюгированную с экстравидином.
2) Биотинилированный рецептор c-Met (1 мкг/мл) захватывали на нейтравидиновые микропланшеты. Связывание экспрессируемых мутеинов, специфичных к c-Met, определяли при помощи конъюгата HRP с анти-Т7 антителом mAb (Novagen) или после неограниченного (60 мин) или ограниченного (5 мин) периода инкубирования.
3) Экстракт, содержащий c-Met-связывающие мутеины, нагревали до 70°С в течение 1 часа.
4) Биотинилированный рецептор c-Met (R&D Systems, 2,5 мкг/мл) захватывали на нейтравидиновые планшеты. Экстракты мутеина предварительно инкубировали со значительным избытком (1 мкМ) очищенного, специфичного к c-Met мутеина S244.2-H08 (SEQ NO: 4) из Примера 5, в качестве конкурента для связывания с мишенью. Связывание экспрессируемых мутеинов, специфичных к c-Met, определяли при помощи конъюгированного с HRP анти-Т7 mAb (Novagen).
Результат такого скрининга представлен на Фиг.8. Было идентифицировано большое количество мутеинов, выбранных, как описано в Примерах 12 и 13, имеющих улучшенную аффинность к рецептору c-Met по сравнению с мутеином S225.4-K24 (SEQ ID NO: 1), который служил в качестве основы для созревания аффинности. Используя данный подход, идентифицировали мутеины S261.1-L12, S261.1-J01, S261.1-L17 (SEQ ID NO: 32-34). Последовательности S261.1-L12, S261.1-J01, S261.1-L17 также представлены на Фиг.9 вместе с последовательностями S225.4-K24 (SEQ NO: 1) и S244.2-H08 (SEQ NO: 4), которые представляют собой мутеин, полученный в результате допускающего ошибки созревания, как описано в Примере 5.
Пример 12: Получение мутеинов, связывающих рецептор c-Met, в His-меченном формате
Периплазматическое получение при помощи культивирования в ферментере в биореакторе на 0,75 л, выполняли, по существу, согласно Примеру 6 с модификацией, заключающейся в том, что соответствующий мутеин кодируют вектором экспрессии pTLPC47 (Фиг.10) вместо pTLPCIO. Векторные элементы pTLPC47 идентичны pTLPCIO с модификацией, заключающейся в том, что pTLPC47 кодирует мутеин Tic, который С-концом слит с маркером Hexa-His, и маркер Т7, слитый с М-концом, удален.
Мутеин очищали от периплазмтической фракции в хроматографическом протоколе с одной стадией при помощи сефарозы (GE) Ni-NTA, используя колонку с подходящим объемом слоя и подходящее оборудование согласно рекомендациям производителя.
Для достижения более высокой чистоты и для удаления любого агрегированного рекомбинантного белка, в заключение выполняли гель-фильтрацию мутеинов на колонке Superdex 75 HR 10/30 (24 мл объем слоя, Amersham Pharmacia Biotech) в присутствии буфера PBS. Фракции мономерного белка объединяли, проверяли на чистоту при помощи SDS-PAGE и использовали для дополнительной биохимической характеристики.
Пример 13: Измерение аффинности с использованием спектроскопию поверхностного плазменного резонанса (SPR)
Измерения аффинности выполняли, по существу, как описано в Примере 7.
Результаты измерений аффинности с использованием S261.1-L12, S261.1-J01, S261.1-L17 (SEQ ID NO: 32-34) и S244.2-H08 (SEQ NO: 4), которые представляют собой мутеин, полученный в результате допускающего ошибки созревания, описанного в Примерах 4 и 5, обобщены в Таблице IV.
Таблица IV. Улучшение аффинности выбранных мутеинов из второго созревания аффинности, как описано в Примерах 10 и 11, по сравнению с мутеином S244.2-H08 из первого цикла созревания аффинности, определенное при помощи SPR.
Пример 14: Ранжирование аффинности липокалиновых мутеинов на интактных клетках при помощи проточной цитометрии
Липокалиновые мутеины титровали на НТ-29 клетках (АТСС), по существу, как описано в Примере 8.
Кривые титрования, из которых определяли значения ЕС50 для S261.1-L12, S261.1-J01, S261.1-L17 (SEQ ID NO: 32-34), представлены на Фиг.11, и рассчитанные значения ЕС50 обобщены в Таблице V.
Таблица V. Значения ЕС50 выбранных мутеинов по изобретению в отношении рецептора c-Met, при определении посредством титрования FACS на клетках НТ-29.
Пример 15: Идентификация неантагонистического характера связывания мутеина, специфичного к рецептору c-Met с использованием HGF-KOHKVpeHTHoro ELISA
Характер взаимодействия между HGF (фактор р,оста гепатоцитов, R&D Systems) и рецептором c-Met при помощи выбранных мутеинов, специфичных к c-Met, оценивали в конкурентном ELISA. Таким образом, постоянную концентрацию рецептора c-Met-Fc (R&D Systems) 2,5 мкг/мл фиксировали при помощи анти-IgG человека-Fc специфичного mAb (Jackson Immuno Research), которое предварительно иммобилизовали на поверхности полистирольного планшета. Затем мишень инкубировали в течение 1 часа при комнатной температуре с серийными разведениями мутеина, специфичного к c-Met, начиная с 100 нМ, в двухстадийных серийных разведениях, и связывание происходит либо в отсутствие, либо в присутствии 300 нМ HGF в качестве конкурента. Связанный мутеин, специфичный к рецептору c-Met, обнаруживали, используя поликлональное биотинилированное антитело против липокалина 1 (R&D Systems), и связанный HGF обнаруживали, используя поликлональное анти-HGF-bio антитело (R&D Systems). В обоих случаях в качестве вспомогательного реагента для обнаружения использовали HRP-конъюгированный экстравидин (Sigma).
Результат измерения с использованием мутеина S261.1-L7 (SEQ NO: 34) служит примером и представлен на Фиг.12. Значения KD, определенные из кривых титрования мутеина, обобщены в Таблице VI.
Таблица VI. Неантагонистическая способность и аффинности выбранного мутеина липокалина слезной жидкости S261.1-L17 по изобретению в отношении рецептора c-Met при определении посредством конкурентного ELISA.
Пример 16: Определение термической денатурации для мутеинов, связывающих c-Met, с использованием спектроскопии CD
Измерения кругового дихроизма выполняли, по существу, как описано в Примере 14 международной патентной заявки WO 2006/056464, с модификацией, заключающейся в том, что используемая длина волны составляла 230 нМ, и концентрация мутеина составляла 250 мкг/мл. Температуры плавления Тгл мутеинов S261.1-L12, S261.1-J01, S261.1-L17 (SEQ ID NO: 32-34) и S244.2-H08 (SEQ ID NO: 4) липокалина слезной жидкости обобщены в Таблице VII.
Таблица VII. Температуры плавления выбранных мутеинов по изобретению для рецептора c-Met при определении посредством измерений кругового дихроизма.
Пример 17: Получение c-Met-специфичного мутеина 5261.1-Ц2 С123 с неспаренным цистеином в положении 123
Препаративное получение c-Met-специфичного мутеина S261.1-L12_C123 (SEQ NO: 35) выполняли, по существу, как описано в Примере 6 с модификацией, заключающейся в том, что аминокислоту Asn 123 заменяли цистеином с целью введения неспаренного цистеина для последующих сайт-направленных конъюгаций. Цистеин 123 выбирали согласно переносу результатов скрининга цистеина, описанного в Примере 9, который демонстрирует хороший выход экспрессии и хорошую аффинность по сравнению с первичным мутеином S261.1-L12 (SEQ NO: 32) в отсутствие неспаренного цистеина.
Пример 18: Сайт-направленная конъюгация HYNIC с c-Met-специфичным мутеином S261.1-L12 С123
Очищенный мутеин S262.1-112_C123 (SEQ NO: 35) из Примера 17 использовали в концентрации 0,8 мг/мл в буфере PBS рН 7,4, и неспаренный цистеин активировали добавлением 100 мМ ТСЕР (Sigma) до конечной концентрации 1 мМ. После 2 часов инкубирования при комнатной температуре непрореагировавший избыток ТСЕР удаляли гель-фильтрацией, используя колонку NAP-5 (GE), согласно рекомендациям производителя. Добавляли 10-молярный избыток HYNIC (3-N-малеимид-6-гидразиний-пиридина гидрохлорид, приобретенный у SoluLink) и инкубировали в течение 2 ч при комнатной температуре. Для отделения непрореагировавшего HYNIC от конъюгированного мутеина реакционную смесь концентрировали в Ultracentricon (Amicon) и промывали по меньшей мере 5 раз, используя подходящие объемы буфера PBS.
Пример 19: Измерения аффинности HYNIC-конъюгированного c-Met-специфичного мутеина S261.1-L12 С123 на интактных клетках посредством проточной цитометрии
c-Met-специфичный мутеин S261.1-L12_C123 (SEQ NO: 35) в присутствии и в отсутствие конъюгированного HYNIC титровали на клетках НТ-29 (АТСС), по существу, как описано в Примере 8.
Кривые титрования, из которых определяли значения ЕС50, представлены на Фиг.13, и рассчитанные значения ЕС50 обобщены в Таблице VII.
Таблица VII. Значения ЕС50 и стандартные отклонения выбранных мутеинов по изобретении для рецептора c-Met при определении посредством титрования FACS на клетках НТ-29.
Пример 20: рН стабильность c-Met-специфичных мутеинов
Очищенный мутеин S261.1-J01 из Примера 12 инкубировали в течение 60 мин при разных значениях рН в интервале от рН 3 до рН 9,2. После нейтрализации до рН 7,4 мутеин анализировали посредством эксклюзионной хроматографии, используя аналитическую колонку Superdex 75 (GE) согласно рекомендациям производителей.
Нельзя было обнаружить никаких изменения мутеина в течение инкубационного периода при оценке с помощью HPLC-SEC, за исключением значений рН 5-6, которые представляют собой интервал вокруг р1 мутеина, где до некоторой степени имела место димеризации, как представлено на Фиг.14.
Пример 21: Позиционный насыщающий мутагенез
Сайт-специфический мутагенез выполняли в положениях 26, 27 и 29 последовательности аффинно-созревших мутеинов L17, 024, М02, K22, А22, K15, L03, 007 и К06 липокалина слезной жидкости для оценки, можно ли существенно влиять на аффинность связывания. Как показано на Фиг.15, все созданные мутанты показывают, по существу, одинаковую аффинность.
Пример 22: аффинность созревания мутеина S261.1-L17 при использовании сайт-направленного случайного подхода
Библиотеку из 8×108 вариантов на основе мутеина S261.1 -LI 7 (SEQ ID NO: 34) конструировали случайным образом в положениях 26, 27, 29,30, 32, 33, 34 и 79, допуская все 20 аминокислот в данных положениях. Библиотеку создавали, по существу, как описано в Примере 1 международной патентной заявки РСТ/ЕР 2007/057971, опубликованной как WO 2008/015239, с модификацией, заключающейся в том, что для рандомизации использовали дезоксинуклеотиды L12-1:
GAAGGCCATGACGGTGGACNNKNNKGACNNKNNKAGCNNKNNKNNKTCGGTGA САСССАТСАСС (SEQ ID NO: 50); L12-2:
CACGTGAGCACCTCCGTAMNNCGTGTATTTTCCCGGCTC (SEQ ID NO: 51) и L12-3: ACGGAGGTGCTCACGTGGCATACATCCAGAGG (SEQ ID NO: 52) вместо раскрытых в РСТ/ЕР 2007/057971. Фагмидный дисплей и селекцию выполняли, используя фагмиды, по существу, как описано в Примере 3 международной патентной публикации WO 2005/019256, со следующими модификациями:
белок-мишень (рецептор c-Met Fc, R&D systems) использовали или в ограниченной концентрации (40 пМ, и 6 пМ, и 1 пМ) и осуществляли презентацию библиотеке в виде Fc-слитого белка с последующим захватом комплекса фаг-мишень с использованием гранул белка G (Dynal), или сначала мишень захватывали при ограниченных концентрациях (50 нг/мл, и 10 нг/мл, и 1 нг/мл) на гранулы белка G, затем осуществляли презентацию комплекса мишень-гранулы библиотечным фагмидам. C-Met-связанные библиотечные фаги элюировали в кислых и затем в основных условиях. Выполняли три цикла селекции.
Пример 23: Скрининг аффинности мутеинов, связывающих рецептор c-Met, с использованием высокопроизводительного скрининга ELISA
Скрининг выполняли, по существу, как описано в Примере 5 в организации альтернативного скрининга со следующими модификациями:
1) моноклональное анти-Т7 антитело наносили в концентрации 5 мкг/мл на полистирольный планшет и экспрессированные мутеины захватывали при помощи маркера Т7 перед инкубированием с ограниченными концентрациями рецептора c-Met-Fc (1 нМ, 0,2 нМ и 0,1 нМ). Связывание мишени обнаруживали, используя HRP (пероксидазу хрена), конъюгированную со анти-IgG человека-Fc-специфичным антителом козы;
2) экстракт, содержащий c-Met-связывающие мутеины, нагревали до 70°С в течение 1 часа перед образованием комплекса с мишенью c-Met рецептор-Fc. При такой организации c-Met рецептор-Fc захватывали при помощи мышиных анти-IgG-Fc человека специфичных моноклональных антител, которые иммобилизованы на полистирольных планшетах в концентрации 5 мкг/мл.
Был идентифицирован ряд мутеинов, выбранных, как описано выше, имеющих улучшенную аффинность к рецептору c-Met по сравнению с мутеином S261.1-L17 (SEQ ID NO: 34), который служил основой для созревания аффинности. С использованием данного подхода были идентифицированы мутеины S318.1-C10, S318.1-N21, S318.1-L13, S318.1-A16, S318.2-I24, S318.4-М11, S318.1-G18, и S318.1-012 (SEQ ID NO:42-49).
Пример 24: Измерения аффинности c-Met-специфичных мутеинов на интактных клетках при помощи проточной цитометрии
После экспрессии и очистки мутеинов при помощи аффинной хроматографии с использованием Strep-Tag, слитого с С-концом соответствующего мутеина (смотри Пример 6), c-Met-специфичные мутеины S318.1-C10, S318.1-L13, S318.1-A16, S318.2-I24 и S318.1-012 (SEQ IDNO: 42, 44,45, 46 и 49) титровали на клетках НТ-29 (АТСС), по существу, как описано в Примере 8, и их аффинность связывания сравнивали с аффинностью мутеина S261.1-L17 (SEQ ID NO: 34), несущего маркер His6 на своем С-конце.
Кривые титрования, из которых определяли значения ЕС50, представлены на Фиг.13, и рассчитанные значения ЕС50 обобщены в Таблице VIII.
Таблица VIII. Значения ЕС50 и среднеквадратичные отклонения выбранных мутеинов по изобретению по отношению к рецептору c-Met при определении посредством титрования FACS на клетках НТ-29.
Пример 25: Определение термической денатурации для c-Met-связывающих мутеинов при использовании спектроскопии CD
Измерения кругового дихроизма выполняли, по существу, как описано в Примере 14 международной патентной заявки WO 2006/056464, с модификацией, заключающейся в том, что используемая длина волны составляла 230 нМ и концентрация мутеина составляла 250 мкг/мл. Температуры плавления Тm мутеинов S318.1-C10 (SEQ ID NO: 42) и S318.1-012 (SEQ ID NO: 49) липокалина слезной жидкости обобщены в Таблице IX и сравниваются с температурой плавления мутеина S261.1 -LI 7 (SEQ ID NO: 34) (с маркером His6), от которого они происходят.
Таблица IX. Температуры плавления выбранных мутеинов по изобретению для рецептора c-Met при определении посредством измерений кругового дихроизма.
Результаты Примеров 24 и 25 показали, что мутеин S318.1-C10 имеет, по существу, такую же аффинность связывания, что и мутеин S261.1-L17, который служил в качестве основы для его получения, но в то же время мутеин S138.1-C 10 имеет более высокую стабильность, чем мутеин S261.1-L17.
Изобретение, иллюстративно описанное в данном описании изобретения, можно соответствующим образом осуществлять на практике в отсутствие любого элемента или любых элементов, ограничения или ограничений, конкретно не раскрытых в данном описании изобретения. Таким образом, например, термины "содержащий", "включающий", "вмещающий" и так далее следует читать широко и без ограничения. Кроме того, термины и выражения, применяемые в данном описании изобретения, были использованы в качестве терминов описания, а не ограничения, и без намерения использовать такие термины и выражения, исключая какие-либо эквиваленты показанных и описанных признаков или их частей, но следует отметить, что в объеме заявленного изобретения возможны различные модификации. Таким образом, следует понимать, что хотя настоящее изобретении было конкретно раскрыто при помощи предпочтительных воплощений и возможных признаков, специалист в данной области техники может обратиться к модификации и варианту, воплощенных в данном описании изобретения, раскрытых в данном описании изобретения, и что такие модификации и варианты рассматриваются как входящие в объем данного изобретения. Данное изобретение было описано в данном описании изобретения широко и в общем виде. Каждая из более узких и субгенерических групп, попадая в общее описание, также образует часть изобретения. Она включает общее описание изобретения с условием или негативным ограничением для удаления любого объекта из рода, независимо от того, изложен или нет конкретно в данном описании изобретения исключаемый материал. Кроме того, когда признаки или аспекты изобретения описаны в терминах групп Маркуша, специалисту в данной области техники очевидно, что таким образом изобретение также описано в терминах любого отдельного члена или подгруппы членов группы Маркуша. Дополнительные воплощения изобретения станут очевидными из прилагаемой формулы изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| НОВЫЕ ПОЛИПЕПТИДЫ СО СПЕЦИФИЧЕСКИМ СВЯЗЫВАНИЕМ И ПУТИ ИХ ПРИМЕНЕНИЯ | 2015 |
|
RU2723034C2 |
| БЕЛКИ, СПЕЦИФИЧНЫЕ В ОТНОШЕНИИ CD137 | 2016 |
|
RU2736312C2 |
| НОВЫЙ СЛИТЫЙ БЕЛОК, СПЕЦИФИЧНЫЙ ДЛЯ CD137 И PD-L1 | 2019 |
|
RU2818349C2 |
| НОВЫЕ СЛИТЫЕ БЕЛКИ, СПЕЦИФИЧЕСКИЕ В ОТНОШЕНИИ CD137 И GPC3 | 2020 |
|
RU2814653C2 |
| СЛИТЫЙ ПОЛИПЕПТИД С ПРОТИВОРАКОВОЙ АКТИВНОСТЬЮ | 2016 |
|
RU2754466C2 |
| МУТЕИНЫ ЛИПОКАЛИНА 2 ЧЕЛОВЕКА С АФФИННОСТЬЮ В ОТНОШЕНИИ ГЛИПИКАНА-3 (GPC3) | 2016 |
|
RU2756318C2 |
| НОВЫЕ БЕЛКИ, СПЕЦИФИЧЕСКИЕ В ОТНОШЕНИИ АНГИОГЕНЕЗА | 2016 |
|
RU2720688C2 |
| МУТЕИНЫ ЛИПОКАЛИНА 2 ЧЕЛОВЕКА (Lcn2, hNGAL) С АФФИННОСТЬЮ ДЛЯ ОПРЕДЕЛЕННОЙ МИШЕНИ | 2019 |
|
RU2804336C2 |
| МУТЕИНЫ ЛИПОКАЛИНА 2 ЧЕЛОВЕКА (Lcn2, hNGAL) С АФФИННОСТЬЮ ДЛЯ ОПРЕДЕЛЕННОЙ МИШЕНИ | 2010 |
|
RU2707126C2 |
| МУТЕИНЫ ЛИПОКАЛИНА СЛЕЗЫ, СВЯЗЫВАЮЩИЕ АЛЬФА IL-4 R | 2011 |
|
RU2569745C2 |


























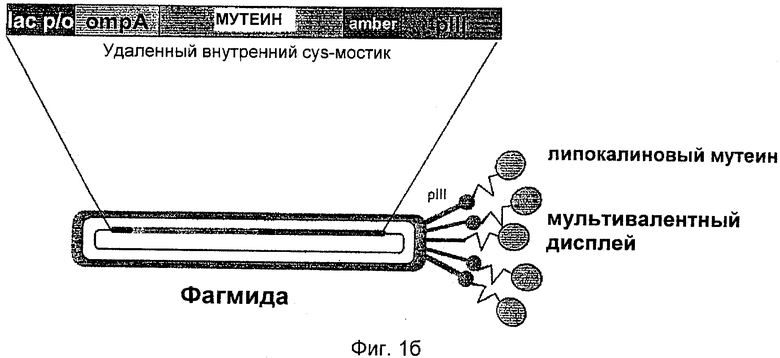
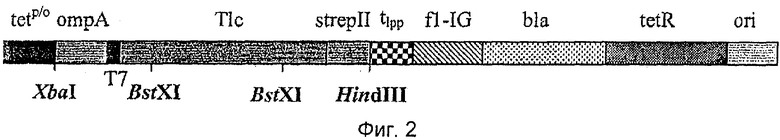
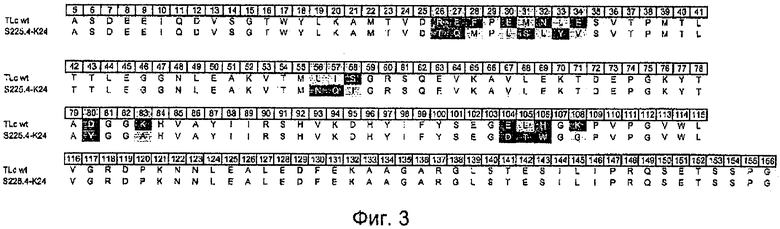
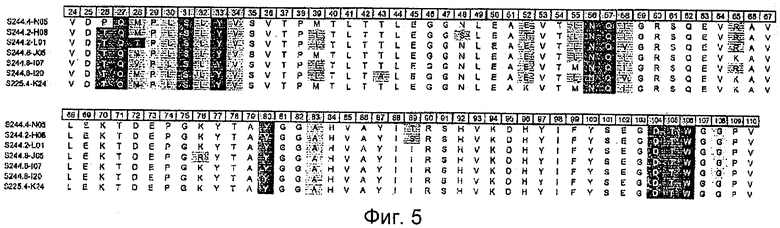
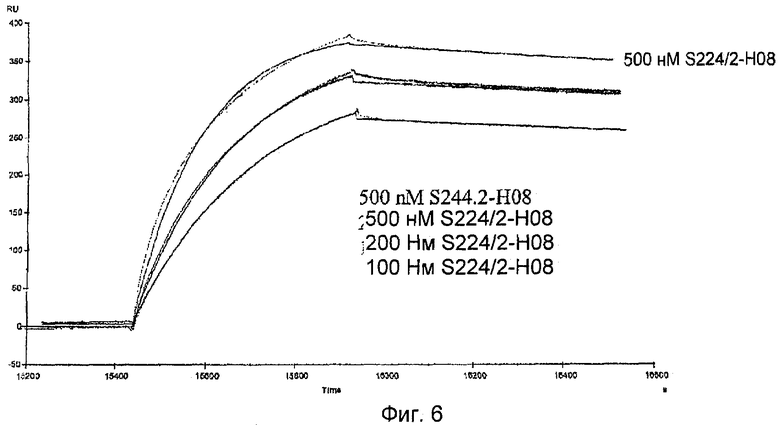
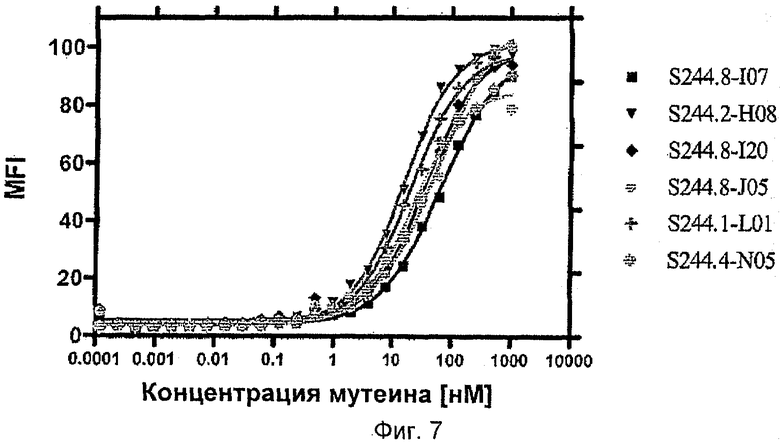

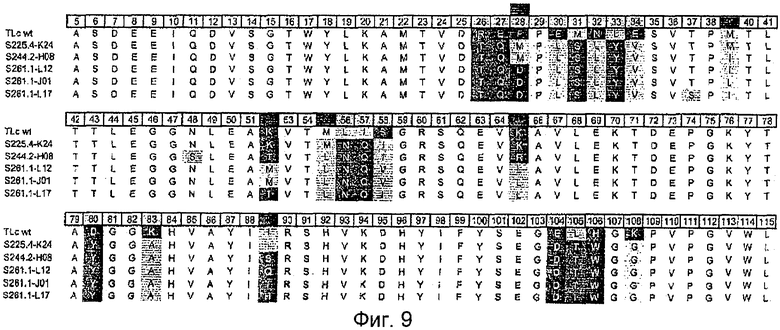
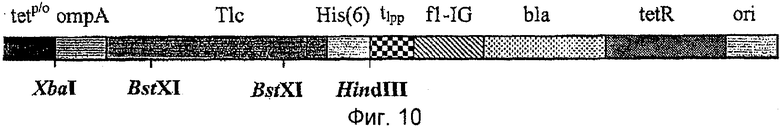
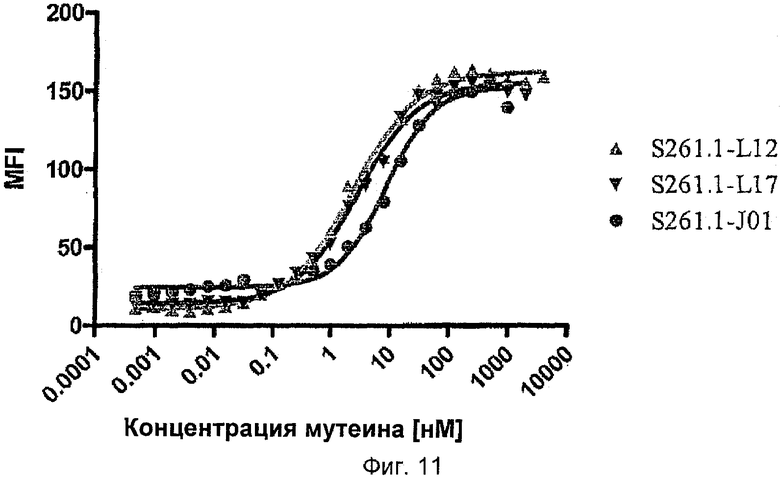
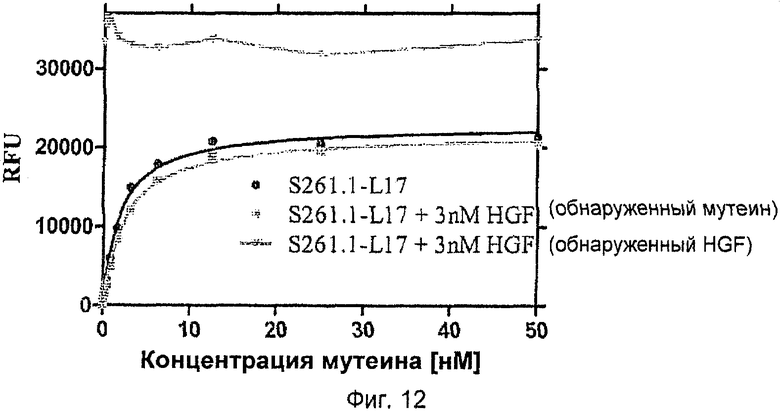
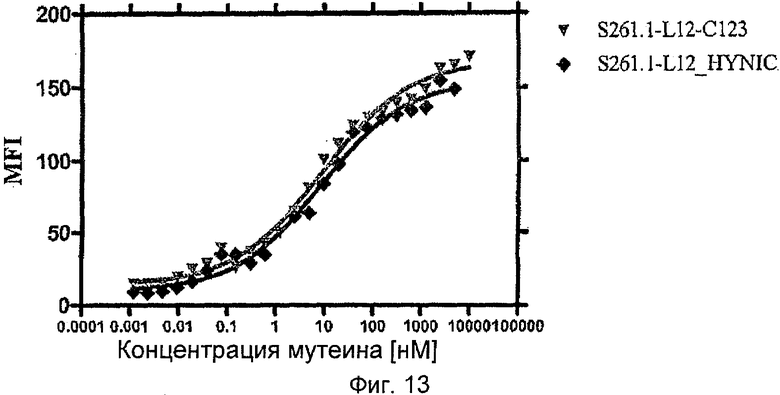
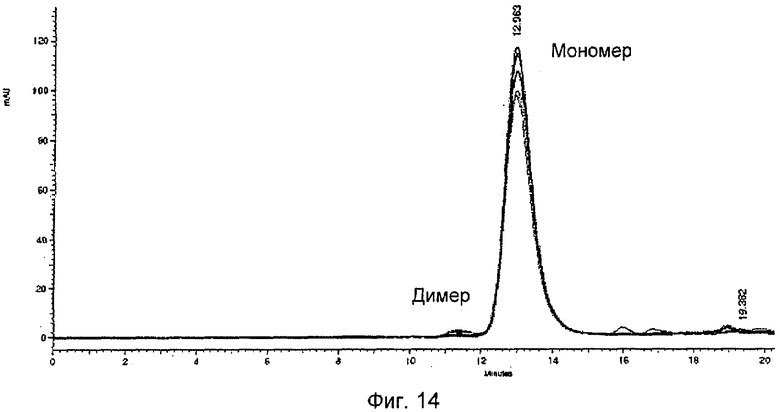
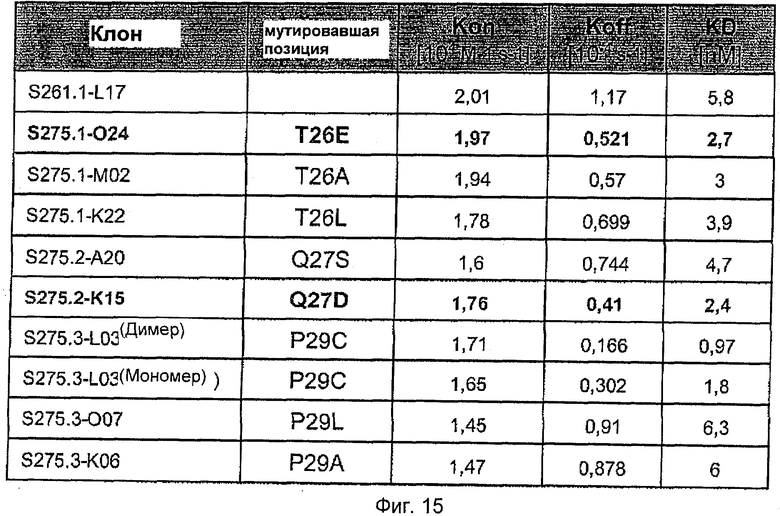
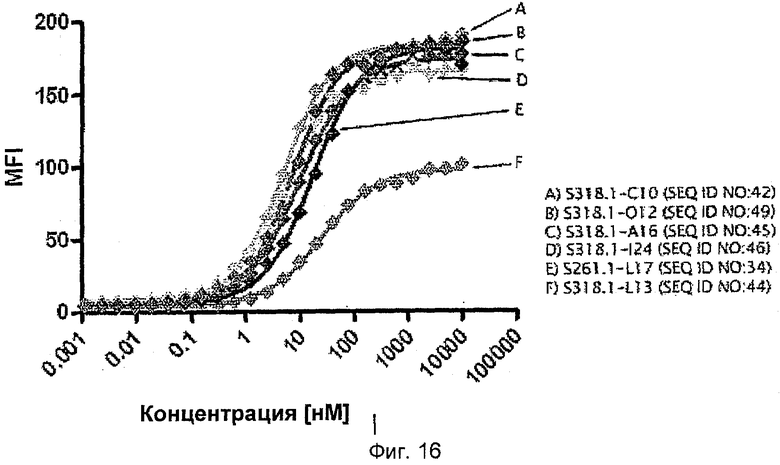
Изобретение относится к области биотехнологии, конкретно к мутеинам липокалина слезной жидкости человека, и может быть использовано в медицине. Мутеин липокалина слезной жидкости человека (hTLc) имеет обнаруживаемую аффинность связывания с рецепторной тирозинкиназой Met (c-Met) человека, или ее доменом, или фрагментом c-Met человека. Мутеин содержит от 6 до 18 аминокислотных замен относительно аминокислотной последовательности зрелого липокалина слезной жидкости человека (SWISSPROT DATABANK ENTRY P31025; SEQ ID NO:36), которые выбраны из группы, состоящей из Arg 26→Thr, Val, Pro, Ser, Gly; Glu 27→Gln, Gly, Val, Ser; Phe 28→Met, Asp; Pro 29→Leu, Ile, Ala, Trp; Glu 30→Leu, Gly, Arg, Phe; Met 31→Ser; Asn 32→Leu, Arg, Val, Gln; Leu 33→Tyr, Val, Ile, Thr, Phe; Glu 34→Val, Arg, Ala; Leu 56→Asn; Ile 57→Gln; Ser 58→Ile, Val; Asp 80→Tyr; Lys 83→Ala; Glu 104→Asp; Leu 105→Thr; His 106→Trp и Lys 108→Gly. Также мутеин может дополнительно содержать следующие замены: Cys 61→Ser; Cys 101→Ser; Cys 153→Ser; Arg 111→Pro; Lys 114→Trp; Thr 37→Ser; Met 39→Ile, Leu; Asn 48→Ser; Lys 52→Thr, Met; Met 55→Leu; Lys 65→Arg, Leu; Ala 79→Leu, Ser; Ala 86→Thr; Ile 89→Ser, Gln, Thr, His; Thr 40→Cys; Glu 73→Cys; Arg 90→Cys; Asp 95→Cys; Lys 121→Cys; Asn 123→Cys и Glu 131→Cys. Изобретение позволяет эффективно лечить патологические расстройства, в которые вовлечен путь HGF/c-Met, а также проводить идентификацию c-Met человека в образце. 12 н. и 38 з.п. ф-лы, 16 ил., 9 табл., 25 пр.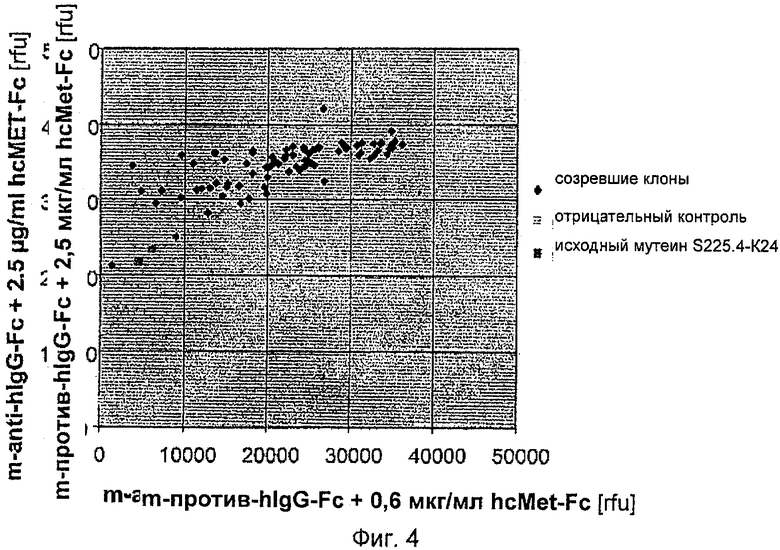
1. Мутеин липокалина слезной жидкости человека (hTLc), имеющий обнаруживаемую аффинность связывания с заданным искусственным лигандом липокалина слезной жидкости человека, где указанный искусственный лиганд представляет собой рецепторную тирозинкиназу Met (c-Met) человека или домен или фрагмент c-Met человека, и где указанный мутеин содержит от 6 до 18 аминокислотных замен относительно аминокислотной последовательности зрелого липокалина слезной жидкости человека (SWISSPROT DATABANK ENTRY P31025; SEQ ID NO:36), которые выбраны из группы, состоящей из Arg 26→Thr, Val, Pro, Ser, Gly; Glu 27→Gln, Gly, Val, Ser; Phe 28→Met, Asp; Pro 29→Leu, Ile, Ala, Trp; Glu 30→Leu, Gly, Arg, Phe; Met 31→Ser; Asn 32→Leu, Arg, Val, Gln; Leu 33→Tyr, Val, Ile, Thr, Phe; Glu 34→Val, Arg, Ala; Leu 56→Asn; Ile 57→Gln; Ser 58→Ile, Val; Asp 80→Tyr; Lys 83→Ala; Glu 104→Asp; Leu 105→Thr; His 106→Trp; и Lys 108→Gly,
и возможно содержит по меньшей мере одну дополнительную аминокислотную замену, выбранную из Cys 61→Ser; Cys 101→Ser; Cys 153→Ser; Arg 111→Pro; Lys 114→Trp; Thr 37→Ser; Met 39→Ile, Leu; Asn 48→Ser; Lys 52→Thr, Met; Met 55→Leu; Lys 65→Arg, Leu; Ala 79→Leu, Ser; Ala 86→Thr; Ile 89→Ser, Gln, Thr, His; Thr 40→Cys; Glu 73→Cys; Arg 90→Cys; Asp 95→Cys; Lys 121→Cys; Asn 123→Cys и Glu 131→Cys.
2. Мутеин по п.1, где искусственный лиганд представляет собой внеклеточную область или домен рецепторной тирозинкиназы Met человека.
3. Мутеин по п.1, который не действует в качестве антагониста фактора роста гепатоцитов человека (HGF) или рассеивающего фактора человека (SF).
4. Мутеин по п.1, который связывается с внеклеточной областью или доменом рецептора Met с KD равной 200 нМ или менее.
5. Мутеин по п.4, который связывается с внеклеточной областью или доменом рецептора Met с KD равной 100 нМ или менее.
6. Мутеин по п.5, который связывается с внеклеточной областью или доменом рецептора Met с KD равной 20 нМ или менее.
7. Мутеин по п.6, который связывается с внеклеточной областью или доменом рецептора Met с KD равной 1 нМ или менее.
8. Мутеин по п.1, который содержит аминокислотные замены: Arg 26→Thr; Glu 27→Gln; Glu 30→Leu; Met 31→Ser; Asn 32→Leu; Leu 33→Tyr; Glu 34→Val; Leu 56→Asn; Ile 57→Gln; Asp 80→Tyr; Lys 83→Ala; Glu 104→Asp; Leu 105→Thr; His 106→Trp; и Lys 108→Gly.
9. Мутеин по п.1, который содержит аминокислотные замены: Met 31→Ser; Leu 56→Asn; Ile 57→Gln; Asp 80→Tyr; Lys 83→Ala; Glu 104→Asp; Leu 105→Thr; His 106→Trp; и Lys 108→Gly.
10. Мутеин по п.1, который содержит аминокислотные замены: Cys 61→Ser; Cys 101→Ser; Arg 111→Pro; Lys 114→Trp; и Cys 153→Ser.
11. Мутеин по п.1, который содержит один из следующих наборов аминокислотных замен:
(1) Arg 26→Thr; Glu 27→Gln; Phe 28→Met; Glu 30→Leu; Met 31→Ser; Asn 32→Leu; Leu 33→Tyr; Glu 34→Val; Leu 56→Asn; Ile 57→Gln; Ser 58→Ile; Asp 80→Tyr; Lys 83→Ala; Glu 104→Asp; Leu 105→Thr; His 106→Trp; и Lys 108→Gly;
(2) Arg 26→Thr; Glu 27→Gln; Phe 28→Asp; Glu 30→Leu; Met 31→Ser; Asn 32→Leu; Leu 33→Tyr; Glu 34→Val; Leu 56→Asn; Ile 57→Gln; Ser 58→Val; Asp 80→Tyr; Lys 83→Ala; Glu 104→Asp; Leu 105→Thr; His 106→Trp; и Lys 108→Gly;
(3) Arg 26→Thr; Glu 27→Gln; Phe 28→Asp; Glu 30→Leu; Met 31→Ser; Asn 32→Leu; Leu 33→Tyr; Glu 34→Val; Leu 56→Asn; Ile 57→Gln; Ser 58→Ile; Asp 80→Tyr; Lys 83→Ala; Glu 104→Asp; Leu 105→Thr; His 106→Trp; и Lys 108→Gly;
(4) Arg 26→Val; Glu 27→Gly; Phe 28→Asp; Pro 29→Leu; Glu 30→Gly; Met 31→Ser; Asn 32→Arg; Leu 33→Val; Glu 34→Val; Leu 56→Asn; Ile 57→Gln; Ser 58→Ile; Asp 80→Tyr; Lys 83→Ala; Glu 104→Asp; Leu 105→Thr; His 106→Trp; и Lys 108→Gly;
(5) Arg 26→Pro; Glu 27→Gly; Phe 28→Asp; Pro 29→Ile; Glu 30→Arg; Met 31→Ser; Asn 32→Leu; Leu 33→Ile; Glu 34→Val; Leu 56→Asn; Ile 57→Gln; Ser 58→Ile; Asp 80→Tyr; Lys 83→Ala; Glu 104→Asp; Leu 105→Thr; His 106→Trp; и Lys 108→Gly;
(6) Arg 26→Ser; Phe 28→Asp; Pro 29→Ala; Glu 30→Phe; Met 31→Ser; Asn 32→Val; Leu 33→Thr; Glu 34→Val; Leu 56→Asn; Ile 57→Gln; Ser 58→Ile; Asp 80→Tyr; Lys 83→Ala; Glu 104→Asp; Leu 105→Thr; His 106→Trp; и Lys 108→Gly;
(7) Arg 26→Val; Glu 27→Val; Phe 28→Asp; Pro 29→Trp; Glu 30→Arg; Met 31→Ser; Asn 32→Gln; Leu 33→Val; Glu 34→Arg; Leu 56→Asn; Ile 57→Gln; Ser 58→Ile; Asp 80→Tyr; Lys 83→Ala; Glu 104→Asp; Leu 105→Thr; His 106→Trp; и Lys 108→Gly; и
(8) Arg 26→Gly; Glu 27→Ser; Phe 28→Asp; Pro 29→Trp; Met 31→Ser; Asn 32→Val; Leu 33→Phe; Glu 34→Ala; Leu 56→Asn; Ile 57→Gln; Ser 58→Ile; Asp 80→Tyr; Lys 83→Ala; Glu 104→Asp; Leu 105→Thr; His 106→Trp; и Lys 108→Gly.
12. Мутеин по п.1, который имеет аминокислотную последовательность, представленную в любой из SEQ ID NO:1, SEQ ID NO:4-9, SEQ ID NO:22-26, SEQ ID NO:32-35 или SEQ ID NO:42-49.
13. Мутеин по любому из пп.1-12, являющийся стабильным в диапазоне pH от примерно 2,5 до примерно 9,5.
14. Мутеин по п.13, являющийся стабильным в диапазоне pH от примерно 3,0 до примерно 9,3.
15. Слитый белок, имеющий обнаруживаемую аффинность связывания с рецепторной тирозинкиназой Met человека (c-Met человека) или доменом или фрагментом c-Met человека, содержащий мутеин по любому из пп.1-14, где мутеин на его N-конце или его C-конце функционально слит с ферментом, белком или доменом белка, пептидом, сигнальной последовательностью и/или аффинным маркером.
16. Слитый белок по п.15, являющийся стабильным в диапазоне pH от примерно 2,5 до примерно 9,5.
17. Слитый белок по п.16, являющийся стабильным в диапазоне pH от примерно 3,0 до примерно 9,3.
18. Слитый белок по п.15, где мутеин имеет аминокислотную последовательность, которая представлена в любой из SEQ ID NO:37-41.
19. Конъюгат мутеина по любому из пп.1-14, имеющий обнаруживаемую аффинность связывания с рецепторной тирозинкиназой Met человека (c-Met человека) или доменом или фрагментом c-Met человека, где мутеин конъюгирован с партнером по конъюгации, выбранным из групп, состоящих из молекулы органического лекарственного средства, ферментной метки, токсина, цитостатического агента, метки, которая может быть фотоактивирована и которая пригодна в фотодинамической терапии, фармацевтически приемлемой радиоактивной метки, гаптена, дигоксигенина, биотина, химиотерапевтического комплекса металла или металла, коллоидного золота и группировки, которая увеличивает период полувыведения мутеина из сыворотки.
20. Конъюгат по п.19, где группировка, которая увеличивает период полувыведения из сыворотки, выбрана из группы, состоящей из молекулы полиалкиленгликоля, гидроксиэтилового крахмала, пальмитиновой кислоты или других молекул жирных кислот, Fc-участка иммуноглобулина, домена CH3 иммуноглобулина, домена CH4 иммуноглобулина, альбумина или фрагмента альбумина, альбумин-связывающего пептида, альбумин-связывающего белка и трансферрина.
21. Конъюгат по п.20, где альбумин-связывающий белок представляет собой бактериальный альбумин-связывающий белок, антитело или фрагмент антитела, направленные против альбумина, или липокалиновый мутеин со связывающей активностью в отношении альбумина.
22. Конъюгат по п.21, где бактериальный альбуминовый домен представляет собой альбумин-связывающий домен стрептококкового белка G.
23. Конъюгат по п.20, где альбумин-связывающий пептид имеет формулу Cys-Xaa1-Xaa2-Xaa3-Xaa4-Cys, где Xaa1 представляет собой Asp, Asn, Ser, Thr или Trp; Xaa2 представляет собой Asn, Gln, His, Ile, Leu или Lys; Xaa3 представляет собой Ala, Asp, Phe, Trp или Tyr; и Xaa4 представляет собой Asp, Gly, Leu, Phe, Ser или Thr.
24. Конъюгат по п.20, где полиалкиленгликоль представляет собой полиэтиленгликоль (PEG) или его активированное производное.
25. Конъюгат по п.19, где токсин выбран из группы, состоящей из коклюшного токсина, дифтерийного токсина, рицина, сапорина, псевдомонадного экзотоксина, калихимицина или его производного, таксоида, майтансиноида, тубулизина и аналога доластатина.
26. Конъюгат по п.25, где аналог доластатина выбран из группы, состоящей из ауристатина E, монометилауристатина E, ауристатина PYE и ауристатина PHE.
27. Конъюгат по п.19, где цитостатический агент выбран из группы, состоящей из цисплатина, карбоплатина, оксалиплатина, 5-фторурацила, таксотера (доцетаксела), паклитаксела, антрациклина (доксорубицина), метотрексата, винбластина, винкристина, виндезина, винорелбина, дакарбазина, циклофосфамида, этопозида, адриамицина, камптотецина, соединений, родственных комбретатастину A-4, сульфонамидов, оксадиазолинов, бензо[b]тиофенов, синтетических спирокетальных пиранов, монотетрагидрофурановых соединений, курацина и производных курацина, производных метоксиэстрадиола и лейковорина.
28. Конъюгат по п.19, где мутеин содержит по меньшей мере одну аминокислотную замену, выбранную из группы, состоящей из Thr 40→Cys, Glu 73→Cys, Arg 90→Cys, Asp 95→Cys, Lys 121→Cys, Asn 123→Cys и Glu 131→Cys и партнер по конъюгации присоединен к мутеину посредством любого из остатков Cys в положении 40, 73, 90, 95, 121, 123 или 131 последовательности.
29. Конъюгат по п.28, где партнер по конъюгации выбран из группы, состоящей из органической молекулы, ферментной метки, токсина, цитостатического агента, фармацевтически приемлемой радиоактивной метки, флуоресцентной метки, хромогенной метки, люминесцентной метки, гаптена, дигоксигенина, биотина, комплекса металла, металла, коллоидного золота и группировки, которая увеличивает период полувыведения мутеина из сыворотки.
30. Конъюгат по любому из пп.19-29, являющийся стабильным в диапазоне pH от примерно 2,5 до примерно 9,5.
31. Конъюгат по п.30, являющийся стабильным в диапазоне pH от примерно 3,0 до примерно 9,3.
32. Молекула нуклеиновой кислоты, кодирующая мутеин по любому из пп.1-14.
33. Вектор для экспрессии мутеина по любому из пп.1-14.
34. Вектор по п.33, представляющий собой фагмидный вектор.
35. Клетка-хозяин для экспрессии мутеина по любому из пп.1-14, содержащая молекулу нуклеиновой кислоты по п.32 или вектор по любому из пп.33-34.
36. Фармацевтическая композиция, обладающая связывающей активностью с c-Met человека, содержащая эффективное количество мутеина липокалина слезной жидкости человека, как он определен в любом из пп.1-14, слитого белка по любому из пп.15-18 или конъюгата по любому из пп.19-31 и фармацевтически приемлемый эксципиент.
37. Способ получения мутеина липокалина слезной жидкости человека, как он определен в любом из пп.1-14, включающий
(а) культивирование клетки-хозяина по п.35 в условиях, подходящих для экспрессии мутеина(ов), и
(б) извлечение экспрессированного(ых) мутеина(ов) из клетки-хозяина или ее культуры.
38. Способ лечения заболевания или расстройства, в которое вовлечен путь HGF/c-Met, включающий введение фармацевтической композиции по п.36 субъекту, нуждающемуся в этом.
39. Способ по п.38, где заболевание или расстройство представляет собой клеточное пролиферативное расстройство.
40. Способ по п.38 или 39, где заболевание или расстройство представляет собой рак.
41. Способ по п.40, где указанный рак представляет собой рак печени, рак прямой кишки, колоректальный рак, гепатоцеллюлярную карциному, папиллярную почечную карциному, плоскоклеточную карциному головы и шеи (HNSC) или метастазы плоскоклеточной карциномы головы и шеи в лимфатические узлы.
42. Применение мутеина липокалина слезной жидкости человека по любому из пп.1-14, слитого белка по любому из пп.15-18 или конъюгата по любому из пп.19-31 для обнаружения in vitro рецепторной тирозинкиназы Met человека (c-Met человека) или домена или фрагмента c-Met человека, включающее стадии:
приведения мутеина, слитого белка или конъюгата в контакт с образцом, в котором предполагается присутствие рецепторной тирозинкиназы Met человека (c-Met человека) или домена или фрагмента c-Met человека, в подходящих условиях, тем самым обеспечения образования комплекса между мутеином, слитым белком или конъюгатом и рецепторной тирозинкиназой Met человека (c-Met человека) или доменом или фрагментом c-Met человека и
обнаружения связанного мутеина, слитого белка или конъюгата при помощи подходящего сигнала.
43. Применение мутеина липокалина слезной жидкости человека по любому из пп.1-14, слитого белка по любому из пп.15-18 или конъюгата по любому из пп.19-31 для выделения in vitro рецепторной тирозинкиназы Met человека (c-Met человека) или домена или фрагмента c-Met человека, включающее:
приведение мутеина, слитого белка или конъюгата в контакт с образцом, в котором предполагается присутствие рецепторной тирозинкиназы Met человека (c-Met человека) или домена или фрагмента c-Met человека, в подходящих условиях, тем самым обеспечения образования комплекса между мутеином, слитым белком или конъюгатом и рецепторной тирозинкиназой Met человека (c-Met человека) или доменом или фрагментом c-Met человека и
выделение указанного комплекса из образца.
44. Применение по п.42 или 43, где указанный комплекс связан с твердым носителем.
45. Применение мутеина липокалина слезной жидкости человека по любому из пп.1-14 для нацеливания фармацевтически активного соединения на предварительно выбранный участок, который следует лечить этим соединением, в организме или ткани, включающее стадии:
конъюгации мутеина с указанным соединением и
доставки комплекса мутеин/соединение к предварительно выбранному участку.
46. Применение по п.45, где фармацевтически активное соединение выбрано из группы, состоящей из токсина, цитостатического агента или антагониста c-Met.
47. Применение по п.46, где токсин выбран из группы, состоящей из коклюшного токсина, дифтерийного токсина, рицина, сапорина, псевдомонадного экзотоксина, калихимицина или его производного, таксоида, майтансиноида, тубулизина и аналога доластатина.
48. Применение по п.47, где аналог доластатина выбран из группы, состоящей из ауристатина E, монометилауристатина E, ауристатина PYE и ауристатина PHE.
49. Применение по п.46, где цитостатический агент выбран из группы, состоящей из цисплатина, карбоплатина, оксалиплатина, 5-фторурацила, таксотера (доцетаксела), паклитаксела, антрациклина (доксорубицина), метотрексата, винбластина, винкристина, виндезина, винорелбина, дакарбазина, циклофосфамида, этопозида, адриамицина, камптотецина, соединений, родственных комбретатастину A-4, сульфонамидов, оксадиазолинов, бензо[b]тиофенов, синтетических спирокетальных пиранов, монотетрагидрофурановых соединений, курацина и производных курацина, производных метоксиэстрадиола и лейковорина.
50. Применение по п.46, где антагонист c-Met выбран из группы, состоящей из моноклонального антитела, производного 1,3,5-триазин-2,4-диамина, производного 2-(2,6-дихлорфенил)имидазола, азот-содержащего бициклического производного, 5-бензилсульфонила и пирролиндолина, замещенного сульфонамидом.
| WO 2007107563 A2, 27.09.2007 | |||
| MA P | |||
| C | |||
| ET AL., c-Met: Structure, functions and potential for therapeutic inhibition, CANCER METASTASIS, KLUWER ACADEMIC PUBLISHERS, DORDRECHT, NL, 2003, v | |||
| Машина для добывания торфа и т.п. | 1922 |
|
SU22A1 |
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| Переставная шейка для вала | 1921 |
|
SU309A1 |
| RU 2004139096 A, 10.06.2005 | |||
Авторы
Даты
2014-05-10—Публикация
2009-01-29—Подача