Изобретение относится к химии производных адамантана, а именно к новому способу получения 1,3-дизамещенных мочевин производных 1,3-диметиладамантана общей формулы:

где n=0, 1



который может найти применение в химико-фармацевтической промышленности.
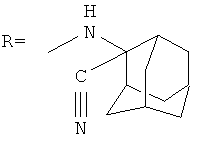
Известно, что 1,3-дизамещенные мочевины, имеющие структурную формулу:

где R=-NHCH2CH2OH, -NHCH2CH2Br, -NH(CH2)5O(CH2)3CH3, -NH(CH2)5O(CH2)3O(CH2)2CH3, -NH(CH2)5O(CH2)2O(CH2)2OPhCH2CH3, получаемые из 1-изоцианатоадамантана активно исследуются в качестве полупродуктов для синтеза ингибиторов растворимого эпоксида гидролазы. Их применяют в качестве нейромедиаторов, влияющих на кровяное давление и воспалительные процессы. Одним из важнейших параметров исследуемых соединений является их температура плавления и растворимость, влияющие на биодоступность соединений, которая для многих испытанных веществ была достаточно высока [In-Hae Kim, Hsing-Ju Tsai, and Bruce D.Hammock. 1,3-Disubstituted Ureas Functionalized with Ether Groups are Potent Inhibitors of the Soluble Epoxide Hydrolase with Improved Pharmacokinetic Properties, J. Med. Chem. 2007, 50, p.5217-5226].
Аналогичными свойствами обладает 1,1′-(адамант-1,3-диил)бис[3-(нафтален-2-ил)мочевина] [Vesna Blazek, Nikola Bregovic, Nikola Basaric, Tetrahedron 2011, 67, 3846-3857].
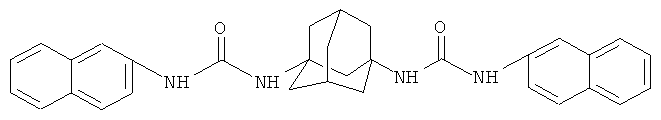
Однако эти способы не позволяют получать соединения заявляемой структурной формулы.
Техническим результатом предлагаемого изобретения является разработка технологичного способа получения новых 1,3-дизамещенных мочевин производных 1,3-диметиладамантана с высоким выходом по исходному изоцианату.
Поставленный технический результат достигается предлагаемым способом получения 1,3-дизамещенных мочевин производных 1,3-диметиладамантана общей формулы:

где n=0, 1





заключающимся во взаимодействии изоцианата общей формулы:
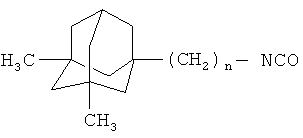
где n=0, 1,
с аминами, выбранными из ряда: 1,2-этилендиамин, пиперидин, 1-аминометиладамантан, 2-амино-2-цианоадамантан и 2-аминоэтанол, при температуре 0-25°C, в течение 3-8 часов в диметилформамиде при мольном соотношении изоцианат:амин:диметилформамид (1:1,1-7,2:65-107) с выделением целевого продукта.
Выход целевого продукта по предлагаемому способу составляет 94-97%.
Введение метильных групп в молекулу адамантана снижает температуру плавления соединений. Так, метиладамантан имеет температуру плавления 104°C, что на 165°C ниже, чем у адамантана, а 1,3-диметиладамантан вообще является жидким веществом. Такие же закономерности сохраняются и для производных адамантана. В этой связи, использование изоцианатов, содержащих в своей структуре 1,3-диметил(адамант-5-ил)ный фрагмент, устраняет имеющиеся недостатки 1,3-дизамещенных мочевин. Использование таких изоцианатов существенно уменьшает температуру плавления, а следовательно, и биодоступность получаемых на их основе 1,3-дизамещенных мочевин.
Реакция взаимодействия изоцианата с аминами, выбранными из ряда: 1,2-этилендиамин, пиперидин, 1-аминометиладамантан, 2-амино-2-цианоадамантан, проводится в течение 3-4 часов. При уменьшении продолжительности реакции не достигается высокий выход основного продукта. Увеличение продолжительности реакции является нецелесообразным и экономически невыгодным.
Найдено, что оптимальным условием проведения реакции взаимодействия изоцианата с аминами, выбранными из ряда: 1,2-этилендиамин, пиперидин, 1-аминометиладамантан, 2-амино-2-цианоадамантан в диметилформамиде, является ее осуществление при мольном соотношении изоцианат:амин:диметилформамид (1:1,1-2:65-78). Использование большего избытка амина не влияло на выход целевых продуктов, а только усложняло процесс выделения и поэтому являлось нецелесообразным. Меньший избыток диметилформамида приводил к некоторому снижению выхода целевых продуктов. Дальнейшее увеличение избытка диметилформамида не влияло на выход целевых продуктов и являлось нецелесообразным.
Найдено, что оптимальным условием проведения реакции взаимодействия изоцианата с аминами, выбранными из ряда 1,2-этилендиамин, пиперидин, 1-аминометиладамантан, 2-амино-2-цианоадамантан, является ее осуществление при комнатной температуре. Проведение реакции при более низкой температуре приводило к значительному увеличению времени реакции, а дальнейшее увеличение температуры связано с большими затратами энергии и является нецелесообразным.
Реакция взаимодействия изоцианата с 2-аминоэтанолом проводится в течение 7-8 часов. При уменьшении продолжительности реакции не достигается высокий выход основного продукта. Увеличение продолжительности реакции является нецелесообразным и экономически невыгодным.
Найдено, что оптимальным условием проведения реакции взаимодействия изоцианата с 2-аминоэтанолом в диметилформамиде является ее осуществление при мольном соотношении изоцианат:2-аминоэтанол:диметилформамид (1:5,4-7,2:80-107). Применение большего избытка 2-аминоэтанола не влияло на выход целевых продуктов, а только усложняло процесс выделения и поэтому являлось нецелесообразным. Меньший избыток диметилформамида приводил к некоторому снижению выхода целевых продуктов. Дальнейшее увеличение избытка диметилформамида не влияло на выход целевых продуктов и являлось нецелесообразным.
Найдено, что оптимальным условием проведения реакции взаимодействия изоцианата с 2-аминоэтанолом в диметилформамиде является ее осуществление при температуре 0°C. Проведение реакции при более высокой температуре приводило к значительному снижению селективности реакции и к образованию уретанов, а дальнейшее понижение температуры связано с большими затратами энергии и является нецелесообразным.
Способ осуществляется следующим образом.
К соответствующему изоцианату из ряда: 1-изоцианато-3,5-диметиладамантан, 1-изоцианатометил-3,5-диметиладамантана, добавляют амин из ряда: этилендиамин, пиперидин, 2-амино-2-цианоадамантан, 1-аминометиладамантан и диметилфорамид, в соотношении 1:1,1-2:65-78 и перемешивают при комнатной температуре в течение 3-4 часов либо 2-аминоэтанол и диметилформамид в соотношении 1:5,4-7,2:80-107 и перемешивают при температуре 0°C в течение 7-8 часов. Затем выпавший осадок белого цвета отфильтровывают, сушат и перекристаллизовывают из этанола.
Изобретение иллюстрируется следующими примерами.
Пример 1
Получение 1-[3,5-диметил(адамант-1-ил)]-3-(2-гидроксиэтил)-мочевины

К раствору 500 мг (2,43 ммоль) 1-изоцианато-3,5-диметиладамантана (n=0) в 10 мл диметилформамида добавляли раствор 800 мг (13,11 ммоль) 2-аминоэтанола в 5 мл диметилформамида (мольное соотношение 1:5,4:80) при температуре 0°C. После перемешивания в течение 8 часов кристаллический осадок отфильтровывали и промывали 50 мл воды, а затем 30 мл этилацетата. Полученное твердое вещество сушили в вакууме. Получено 620 мг (2,36 ммоль, 97%), твердое вещество белого цвета. Т.пл. 125°C. Масс-спектр, m/z (Iотн., %): 266 (1%, [M]+), 249 (2%, [М-OH]+), 163 (100%, [Ad(CH3)2]+).
Пример 2
Получение 1-{[3,5-диметил(адамант-1-ил)]метил}-3-(2-гидроксиэтил)мочевины
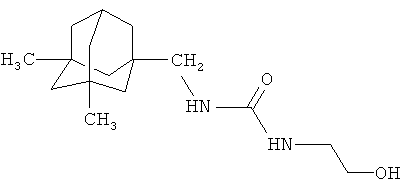
К раствору 400 мг (1,82 ммоль) 1-изоцианатометил-3,5-диметиладамантана (n=1) в 10 мл диметилформамида добавляли раствор 800 мг (13,11 ммоль) 2-аминоэтанола в 5 мл диметилформамида (мольное соотношение 1:7,2:107) при температуре 0°C. После перемешивания в течение 7 часов кристаллический осадок отфильтровывали и промывали 50 мл воды, а затем 30 мл этилацетата. Полученное твердое вещество сушили в вакууме. Получено 480 мг (1,71 ммоль, 94%), твердое вещество белого цвета. Т.пл. 118°С. Масс-спектр, m/z (Iотн., %): 280 (1%, [М]+), 263 (2%, [М-ОН]+), 163 (100%, [Ad(CH3)2]+).
Пример 3
Получение N-[3,5-диметил(адамант-1-ил)]пиперидино-1-карбоксиамида

К раствору 510 мг (2,50 ммоль) 1-изоцианато-3,5-диметиладамантана (n=0) в 10 мл диметилформамида добавляли раствор 240 мг (2,80 ммоль) пиперидина в 5 мл диметилформамида (мольное соотношение 1:1,1:78) при температуре 15-25°С. После перемешивания в течение 4 часов кристаллический осадок отфильтровывали и промывали 50 мл воды, а затем 30 мл этилацетата. Полученное твердое вещество сушили в вакууме. Получено 700 мг (2,41 ммоль, 96,5%), твердое вещество белого цвета. Т.пл. 120-122°С. Масс-спектр, m/z (Iотн., %): 290 (65%, [М]+), 205 (19%, [М-(CH2)5N]+), 178 (2%, [Ad(CH3)2NH]+), 163 (70%, [Ad(СН3)2]+), 127 (20%, [М-Ad(СН3)2]+), 107 (33%), 84 (100%, [(CH2)5N]+). Спектр ЯМР 1Н δ, м.д.: 0.80 с (6Н, 2СН3); 1.20-1.60 (19Н, Ad+3CH2); 2.73 с (1Н, NH); 3.17-3.20 т (4Н, 2СН2).
Пример 4
Получение 1-(2-аминоэтил)-3-[3,5-диметил(адамант-1-ил)1-мочевины

К раствору 615 мг (3,0 ммоль) 1-изоцианато-3,5-диметиладамантана (n=0) в 10 мл диметилформамида добавляли раствор 360 мг (6,00 ммоль) 1,2-этилендиамина в 5 мл диметилформамида (мольное соотношение 1:2:65) при температуре 15-25°С. После перемешивания в течение 3 часов кристаллический осадок отфильтровывали и промывали 50 мл воды, а затем 30 мл этилацетата. Полученное твердое вещество сушили в вакууме. Получено 755 мг (2,85 ммоль, 95%), твердое вещество белого цвета. Т.пл. 250-252°С. Масс-спектр, m/z (Iотн., %): 265 (1%, [М]+), 248 (12%, [M-NH2]+), 236 (25%, [М-CH2NH2]+), 223 (64%, [M-(CH2)2NH2]+), 208 (35%, [(CH3)2AdNHC(O)]+), 179 (46%, [Ad(CH3)2NH]+), 163 (100%, [Ad(CH3)2]+) 122 (61%), 108 (61%), 107 (42%), 93 (35%). Спектр ЯМР 1Н δ, м.д.: 0.79-1.29 м (19Н, Ad(СН3)2); 1.46-1.52 кв (2H, 2NH); 2.03-2.05 т (2Н, NH2); 2.73 с (2Н, СН2); 2.89 с (2Н, СН2).
Пример 5
Получение 1-[3,5-диметил(адамант-1-ил)]-3-[(адамант-1-ил)метил]-мочевины

К раствору 510 мг (2,5 ммоль) 1-изоцианато-3,5-диметиладамантана (n=0) в 10 мл диметилформамида добавляли раствор 410 мг (2,5 ммоль) 1-аминометиладамантана в 5 мл диметилформамида (мольное соотношение 1:1:78) при температуре 15-25°С. После перемешивания в течение 4 часов кристаллический осадок отфильтровывали и промывали 50 мл воды, а затем 30 мл этилацетата. Полученное твердое вещество сушили в вакууме. Получено 880 мг (2,4 ммоль, 96%), твердое вещество белого цвета. Т.пл. >300°С. Масс-спектр, m/z (Iотн., %): 370 (15%, [М]+), 355 (100%, [M-CH3]+), 265 (43%), 190 (26%), 179 (30%, [Ad(CH3)2NH]+), 164 (41%), 163 (99%, [Ad(СН3)2]+), 149 (26%, [AdCH2]+), 135 (53%, [Ad]+), 108 (85%), 107 (50%), 93 (44%), 78 (39%). Спектр ЯМР 1Н δ, м.д.: 0.79-1.65 м (34Н, Ad, Ad(CH3)2); 2.04 кв (2H, 2NH); 2.75 д (2Н, CH2).
Пример 6
Получение 1-[3,5-диметил(адамант-1-ил)]-3-[2-нитрило(адамант-2-ил)]-мочевины

К раствору 510 мг (2,5 ммоль) 1-изоцианато-3,5-диметиладамантана (n=0) в 10 мл диметилформамида добавляли раствор 440 мг (2,5 ммоль) 2-амино-2-цианоадамантана в 5 мл диметилформамида (мольное соотношение 1:1:78) при температуре 15-25°С. После перемешивания в течение 4 часов кристаллический осадок отфильтровывали и промывали 50 мл воды, а затем 30 мл этилацетата. Полученное твердое вещество сушили в вакууме. Получено 910 мг (2,4 ммоль, 96%), твердое вещество белого цвета. Т.пл. 200-202°С. Масс-спектр, m/z (Iотн., %): 383 (4%, [М+2Н]+), 355 (1%, [M-CN]+), 205 (22%, [М-Ad(CN)NH]+), 177 (26%, [Ad(CH3)2NH]+), 164 (36%), 163 (45%, [Ad(CH3)2]+), 150 (100%, [AdNH]+), 134 (41%, [Ad-2H]+), 107 (70%), 91 (78%), 80 (85%). Спектр ЯМР 1Н δ, м.д.: 0.80-1.90 м (33Н, Ad, Ad(CH3)2); 2.00-2.06 т (2Н, 2NH).
Таким образом, вышеизложенные сведения свидетельствуют о выполнении при использовании заявленного изобретения следующей совокупности условий:
- средство, воплощающее заявленное изобретение при его осуществлении, предназначено для применения в различных отраслях промышленности;
- для заявленного изобретения в том виде, как оно охарактеризовано в независимом пункте нижеизложенной формулы изобретения, подтверждена возможность его осуществления с помощью вышеописанных или известных средств и методов;
- средство, воплощающее заявленное изобретение при его осуществлении, способно обеспечить достижение технического результата.
Следовательно, заявленное изобретение соответствует требованию "промышленная применимость".
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ БИС[3-МЕТИЛ(АДАМАНТ-1-ИЛ)]МОЧЕВИН | 2012 |
|
RU2486893C1 |
| СПОСОБ ПОЛУЧЕНИЯ ГИДРОХЛОРИДОВ АМИНОПРОИЗВОДНЫХ АДАМАНТАНА | 2010 |
|
RU2440971C1 |
| СПОСОБ ПОЛУЧЕНИЯ 2-АМИНОМЕТИЛАЛКИЛ(АРИЛ)АМИНОАДАМАНТАНОВ | 2012 |
|
RU2484083C1 |
| СПОСОБ ПОЛУЧЕНИЯ АДАМАНТИЛСОДЕРЖАЩИХ ИЗОТИОЦИАНАТОВ | 2015 |
|
RU2599993C1 |
| СПОСОБ ПОЛУЧЕНИЯ 2-(2-АЛКИЛ(ДИАЛКИЛ)АМИНО)АДАМАНТИЛАЛКИЛ(АРИЛ)КЕТОНОВ | 2009 |
|
RU2408570C1 |
| СПОСОБ ПОЛУЧЕНИЯ 1,3-ДИКАРБОНИЛЬНЫХ ПРОИЗВОДНЫХ АДАМАНТАНОВ | 2011 |
|
RU2476421C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 2-АМИНО-2-ЦИАНОАДАМАНТАНА | 2013 |
|
RU2523462C1 |
| СПОСОБ ПОЛУЧЕНИЯ 2-АМИНО-2-ЦИАНОАДАМАНТАНА ИЛИ ЕГО ПРОИЗВОДНЫХ | 2006 |
|
RU2307123C1 |
| СПОСОБ ПОЛУЧЕНИЯ 1-ХЛОР-3-ЦИАНОАДАМАНТАНА | 2009 |
|
RU2434848C2 |
| СПОСОБ ПОЛУЧЕНИЯ 1,3-ДИМЕТИЛАДАМАНТАН-5-ОЛА | 2012 |
|
RU2510962C2 |
Изобретение относится к химии производных адамантана, а именно к способу получения 1,3-дизамещенных мочевин производных 1,3-диметиладамантана общей формулы:

где n=0, 1





Способ заключается во взаимодействии изоцианата общей формулы:

где n=0, 1, с аминами, выбранными из ряда: 1,2-этилендиамин, пиперидин, 1-аминометиладамантан, 2-амино-2-цианоадамантан и 2-аминоэтанол, при температуре 0-25°С, в течение 3-8 часов в диметилформамиде при мольном соотношении изоцианат:амин:диметилформамид = 1:1,1-7,2:65-107. Изобретение позволяет получить новые 1,3-дизамещенные мочевины заявляемой структурной формулы с пониженной температурой плавления. 6 пр.
Способ получения 1,3-дизамещенных мочевин производных 1,3-диметиладамантана общей формулы:

где n=0, 1





заключающийся во взаимодействии изоцианата общей формулы:

где n=0, 1,
с аминами, выбранными из ряда: 1,2-этилендиамин, пиперидин, 1-аминометиладамантан, 2-амино-2-цианоадамантан и 2-аминоэтанол, при температуре 0-25°С в течение 3-8 ч в диметилформамиде при мольном соотношении изоцианат:амин:диметилформамид 1:1,1-7,2:65-107 и выделением целевого продукта.
| IN-HAE RIM et al, 1,3-Disubstituted Ureas Functionalized with Ether Groups are Potent Inhibitors of the Soluble Epoxide Hydrolase with Improved Pharmacokinetic Properties, J | |||
| Med | |||
| Chem., 2007, v.50, p.5217-5226 | |||
| Передвижная тележка для перемещения грузов по монорельсовому пути | 1961 |
|
SU146457A1 |
| GERZON Koert et al, Adamantyl group in medical agents | |||
| I | |||
| hypoglycemic N-arylsulfonyl-N'-adamantylureas, Journal | |||
Авторы
Даты
2013-07-10—Публикация
2012-06-13—Подача