Область техники, к которой относится изобретение
Настоящее изобретение относится к стимулированию иммунологических ответов, в частности, к фармацевтическим композициям и способам для стимулирования профилактического и/или терапевтического иммунного ответа против Mycobacterium avium подвида paratuberculosis.
Уровень техники
Mycobacterium avium подвида paratuberculosis (далее MAP) является этиологическим фактором болезни Джона, болезни которую первым исследовал и описал (в 1907 г.) немецкий этимолог Хайнрих Йоне), которая вызывает хронический гранулематозный энтерит крупного рогатого скота. У животных с клиническими проявлениями заболевания развивается хроническая диарея и прогрессирующая потеря веса, которая в конечном итоге приводит к смерти, в то время как субклинически инфицированные животные производят меньше молока. Болезнь Джона имеет огромное экономическое значение для мировой молочной промышленности, являясь причиной основных потерь из-за пониженной продукции и ранней выбраковки животных, по оценкам около 20% молочного стада поражено заболеванием, что приносит убыток молочной промышленности 220 миллионов долларов в год (Wells, и соавт. 2000. J. Am. Vet. Med. Assoc.216: 1450-1457). Крупный рогатый скот наиболее восприимчив к инфекции этим организмом в первые 6 месяцев жизни, но заболевание обычно не проявляется раньше возраста 3 или 5 лет. Инфицирование происходит при проглатывании зараженного навоза, молозива или молока от инфицированных коров (Sweeney, 1996. Vet. Clin. N. Am. Food Anim. Pract. 12:305-312). Также происходит внутриутробное заражение, особенно у беременных коров, имеющих прогрессирующее заболевание (Sweeney, и соавт. 1992. Am. J. Vet. Res. 53: 477-480). Более того, важность MAP значительно возрастает из-за их потенциальной роли в качестве этиологического фактора при болезни Крона у людей (Chamberlin, и соавт. Aliment Pharmacol Ther 2001; 15(3): 337-46; Naser SA, и соавт. Mol Cell Probes 2002; 16(1): 41-8).
Одобренная в настоящее время вакцина против болезни Джона для применения в этой области представляет собой масляную суспензию убитого штамма MAP, которая имеет значительные ограничения. В первую очередь, эффективность этой вакцина является спорной, с переменными результатами в различных исследованиях вакцинации. Другая проблема представляет собой взаимное влияние всей клеточной бактериальной вакцины и диагностической пробы, поскольку вакцинированные животные проявляли ложноположительную реакцию на туберкулез и туберкулид. Таким образом, возникает необходимость в улучшенной вакцине, но она должна быть действенной и в то же время не должна мешать диагностике туберкулеза и болезни Джона. Для достижения этой цели были опробованы несколько подходов, которые включают рекомбинантные вакцины, ДНК вакцины и вакцины субъединицы 13 (Shin SJ, и соавт. Infect Immun 2005; 73(8): 5074-85). Однако, сохраняется потребность в разработке улучшенных MAP вакцин.
Раскрытие изобретения
Настоящее изобретение предлагает фармацевтические композиции и способы стимулирования иммунного ответа против MAP у млекопитающих. Композиции включают новый рекомбинантный полипептид с массой 79 кДа, обозначенный в заявке как “Map74F”. Map74F был получен сшиванием C-концевого фрагмента белка MAP_3527 с массой около 17,6 кДа с фрагментом белка MAP_1519, за которым на C-конце следует N-концевой участок белка MAP_3527 весом 14,6 кДа.
Кроме Map74F, композиции изобретения также могут включать белки MAP, такие как антигены 85A, 85B, 85C, белок с массой 35 кДа, суперокиддисмутазу (далее СОД), белки MptC, MptD и ESAT-6 подобный белок или их комбинации.
Способ включает введение композиции млекопитающим в количестве, достаточном для стимулировании иммунного ответа против MAP. Ожидается, что способ будет благоприятным для любого животного, восприимчивого к инфекции MAP, но особенно благоприятным для жвачных животных.
Фармацевтические композиции могут включать в состав стандартные фармацевтические наполнители и могут вводиться любым традиционным способом. Композиции могут назначаться в любое время животному, восприимчивому к заражению инфекцией MAP, или животному, инфицированному MAP. Однако, предпочтительно вводить композиции по изобретению до инфицирования MAP, например, введение беременным животным, которые могут доставить профилактические иммунологические компоненты своим новорожденным детям с помощью молозива, или введение в период от одной до пяти недель после рождения.
Настоящее изобретение предлагает фармацевтические композиции и способы для стимулирования иммунного ответа против MAP у животных. Композиции включают рекомбинантный полипептид, упоминаемый в заявке как Map74F. Открытая рамка считывания (ОРС), кодирующая Map74F, представляет собой 2397-членный нуклеотид и кодирует полипептид, содержащий 799 аминокислот. Последовательность полипептида Map74F приведена в SEQ ID NO: 1. Молекулярная масса Map74F, рассчитанная на основе его аминокислотного состава составляет 79 кДа, хотя реальная молекулярная масса, определенная методом SDS-PAGE анализа составляет 74 кДа. Последовательность, показанная в SEQ ID NO: 1, дается без необязательных меток для очистки, таких как гистидиновая метка.
Map74F был создан посредством сшивания, по направлению от N-конца к C-концу, C-концевого фрагмента белка MAP_3527 с массой около 17,6 кДа, фрагмента белка MAP_1519 с массой 46,8 кДа, а затем N-концевого фрагмента белка MAP_3527 с массой около 14,6 кДа. Схематическое изображение Map74F дано на Фиг.1. Полные аминокислотные последовательности MAP_3527 и MAP_1519 представлены, соответственно, как SEQ ID NO: 2 и SEQ ID NO: 3. C-концевой фрагмент белка MAP_3527 с массой 17,6 кДа, присутствующий в Map74F, представлен аминокислотами 183-361 последовательности SEQ ID NO: 2. Фрагмент MAP_1519 с массой 46,8 кДа, присутствующий в Map74F, представлен аминокислотами 1-460 последовательности SEQ ID NO: 3. N-концевой фрагмент белка MAP_3527 с массой 14,6 кДа, присутствующий в Map74F, представлен аминокислотами 33-180 последовательности SEQ ID NO: 2. Ожидается, что более длинные фрагменты MAP_1519 и N- и C-концы MAP_3527 могут быть включены в рекомбинантный белок, который мог бы применяться в способе изобретения. Помимо Map74F, фармацевтические композиции изобретения могут включать другие вещества, которые могут стимулировать иммунный ответ против MAP_бактерий. Например, композиции могут включать один или более других белков MAP, таких как антигены 85A, 85B, 85C, белок массой 35 кДа, супероксиддисмутазу (СОД), белок MptC, MptD и ESAT-6 подобный белок и их комбинации. Такие белки описаны в заявке США №11/816,365, и описание этих белков и ДНК последовательностей, кодирующих их, и способы применения белков и кодирующих их ДНК в фармацевтических композициях для стимулирования иммунного ответа против MAP включены в заявку посредством ссылки.
В одном варианте осуществления фармацевтическая композиция включает Map74F и один или более из белков MAP антигены 85A, 85B или СОД. ДНК последовательность, кодирующая ген MAP антигена 85A, и аминокислотная последовательность, соответствующая гену MAP антигена 85A, дана в GenBank, номер доступа AF280067 (запись от 10 октября, 2003). ДНК последовательность, кодирующая ген MAP антигена 85B, и аминокислотная последовательность, соответствующая гену MAP антигена 85B, дана в GenBank, номер доступа AF219121 (запись от 21 ноября, 2002). ДНК последовательность, кодирующая ген MAP антигена 85C, и аминокислотная последовательность, соответствующая гену MAP антигена 85C, дана в GenBank, номер доступа AF280068 (запись от 21 ноября, 2002). ДНК последовательность, кодирующая ген супероксиддисмутазы MAP, и аминокислотная последовательность, соответствующая гену супероксиддисмутазы MAP, дана в GenBank, номер доступа AF 180816 (запись от 30 ноября 2001).
Способ изобретения включает введение фармацевтической композиции, включающей Map74F, млекопитающим в количестве, достаточном для стимулирования иммунного ответа против MAP. Стимулированный иммунный ответ может включать стимулирование любого компонента иммунной системы, включая, но не ограничиваясь, выработку антител, реактивных к антигенам MAP, стимулирование пролиферации лимфоцитов, выработку Th 1-ассоциированных цитокинов, таких как гамма-интерферон, и комбинацию изложенного выше.
Map74F может вводиться животным в форме вектора. Например, последовательность нуклеиновых кислот, кодирующая Map74F, может быть клонирована в геном бактерии (например, Salmonella) или вируса (например, вирус бычьего герпеса - 1 (BHV-I)), и полученная рекомбинантная бактерия или вирус может вводиться животным. Таким образом, настоящее изобретение также включает бактериальные или вирусные векторы, экспрессирующие Map74F. Также в охват данного изобретения входят методологии ДНК вакцин, в которых молекулы нуклеиновой кислоты, кодирующей Map74F, вводятся непосредственно животным либо в чистом виде, либо в комбинации с вспомогательным веществом или веществом, облегчающим трансфекцию.
Способ согласно изобретению может быть благоприятным для любого животного, восприимчивого к MAP инфекции. Фармацевтические композиции и способы особенно хорошо подходят для профилактики или лечения инфекции MAP у жвачных животных, включая крупный рогатый скот, овец, коз, оленей и лосей, антилоп и буйволов, но не ограничиваясь ими. В одном варианте осуществления способ может применяться для профилактики или лечения болезни Джона.
Фармацевтические композиции могут вводиться любым инфицированным или неинфицированным MAP животным. Считается, что введение композиций инфицированным животным в соответствии со способом изобретения, стимулирует терапевтический иммунный ответ. Однако, изобретение также включает введение фармацевтических композиций изобретения до инфицирования MAP для стимулирования профилактического ответа. Например, композиции могут вводиться беременным животным, которые могут передать профилактические иммунологические компоненты своим неинфицированным новорожденным детям через молозиво или молоко во время лактации. Альтернативно, композиции могут вводиться на протяжении периода от одной до пяти недель после рождения для обеспечения профилактического эффекта, который может предотвратить инфицирование MAP или уменьшить тяжесть заболевания, если инфицирование произойдет.
Таким образом, в одном варианте осуществления способ изобретения представляет собой профилактику инфекции MAP, в то время как в другом варианте осуществления способ представляет собой лечение инфекции MAP.
Фармацевтические композиции могут формироваться вместе со стандартными фармацевтическими наполнителями и могут вводиться с помощью любого из разнообразных обычных путей введения. Некоторые примеры приемлемых фармацевтических наполнителей для применения с белками описаны в Remington's Pharmaceutical Sciences (18-е издание, A.R. Gennaro et al. Eds., Mack Publishing Co., Easton, Pa., 1990).
Фармацевтические композиции, применяемые в способе изобретения, могут также включать вспомогательные вещества. Может применяться любое стандартное вспомогательное вещество.
В одном варианте осуществления вспомогательное вещество может представлять собой монофосфорил липид A (МФЛ), который может предусматриваться в комбинации с синтетическим дикориномиколатом трегалозы. В другом варианте осуществления вспомогательное вещество можетпредставлять собой диметилдиоктадециламмонийбромид (далее ДДА). Фармацевтические композиции изобретения могут вводиться любым приемлемым способом. Подходящие способы введения включают пероральный, мукозальный и парентеральный (например, интраваскулярные, внутримышечные и подкожные инъекции). Композиции могут вводиться в любое время любому животному, восприимчивому к заражению инфекцией MAP или животному, инфицированному MAP.
Специалисту в данной области очевидно, что количество Map74F и любого другого антигенного вещества в фармацевтической композиции, вводимой конкретному животному, будет зависеть от ряда факторов, таких как способ введения, и размер, физическое состояние и статус MAP животного, и может подбираться специалистами в данной области для достижения желаемого результата. Композиции могут применяться путем одного введения или сериями введений для стимулирования иммунного ответа. В целом, может вводиться общая доза в количестве 10-200 мкг белка.
Краткое описание чертежей
Фиг.1 представляет схематическое изображение конструкции Map74F. Map74F был получен последовательным сшиванием в направлении от N к С концу открытых рамок считывания, кодирующих C-концевой фрагмент белка MAP_3527, сшитых с открытой рамкой считывания, кодирующей аминокислоты 1-460 белка MAP_1519, и терминирован открытой рамкой считывания, кодирующей N-концевой фрагмент MAP_3527. ОРС, кодирующая Map74F представляет собой 2397-членный нуклеотид, который кодирует 799-аминокислотный полипептид с предсказанной молекулярной массой около 79 кДа.
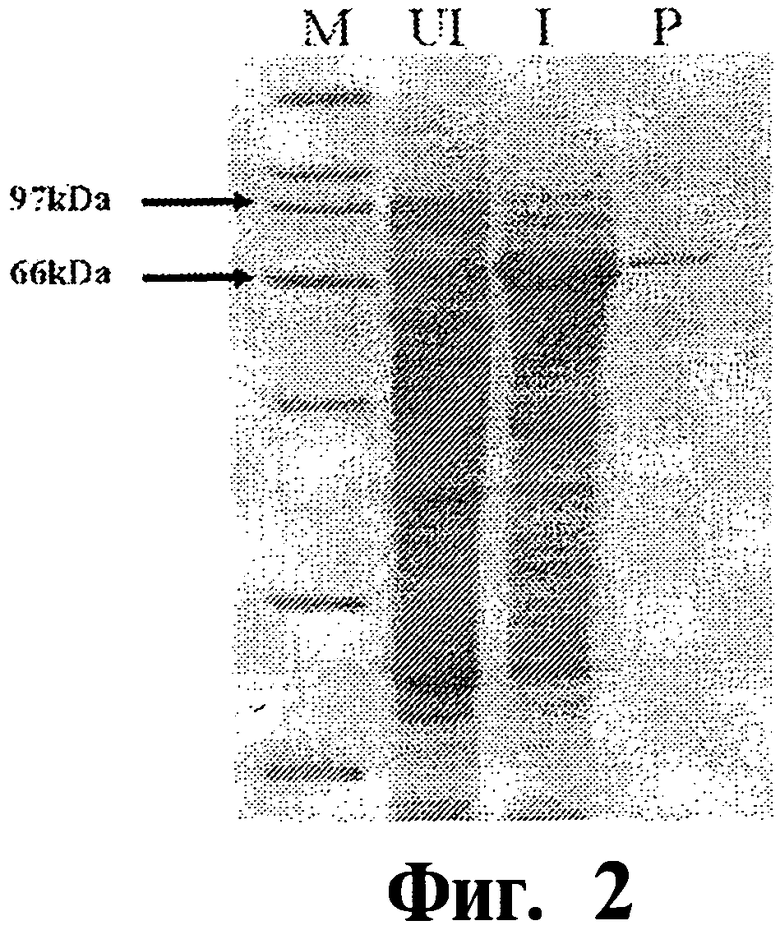
Фиг.2 представляет собой фотографию окрашенного кумасси голубым 10% SDS-PAGE электрофореза лизатов E.coli из штамма E.coli (BL21/pLysE), трансформированного экспрессирующим вектором, кодирующим Map74F. Клетки были выращены и индуцированы 1 мМ ИПТГ (изопропилтиогалактозид). Линии отображают лизаты до (линия UI) или спустя 3 часа после (линия I) индукции ИПТГ. Очищенные рекомбинанты Map74F показаны на линии Р вместе с маркером молекулярных весов (линия М).
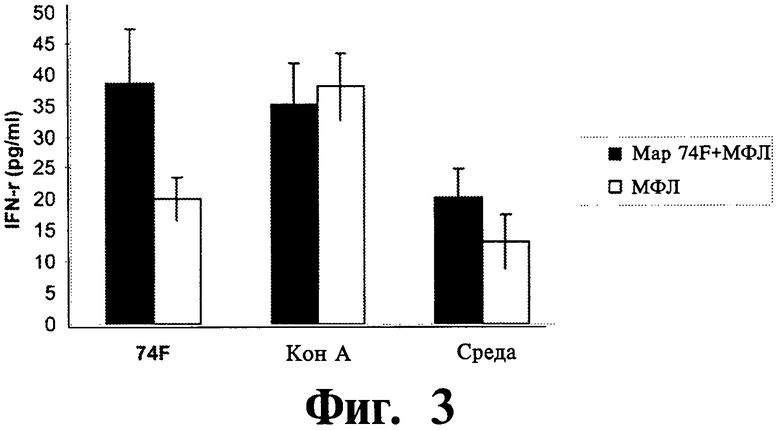
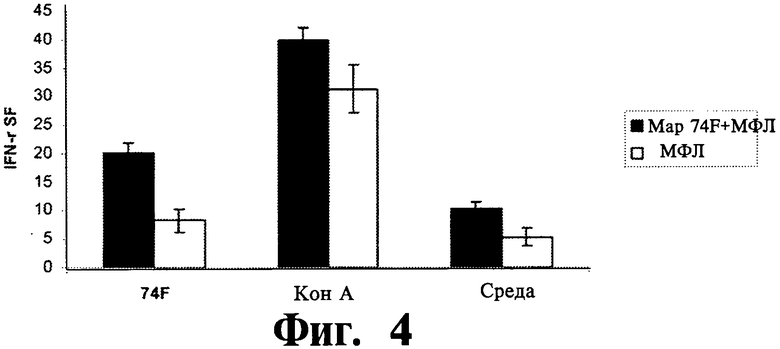
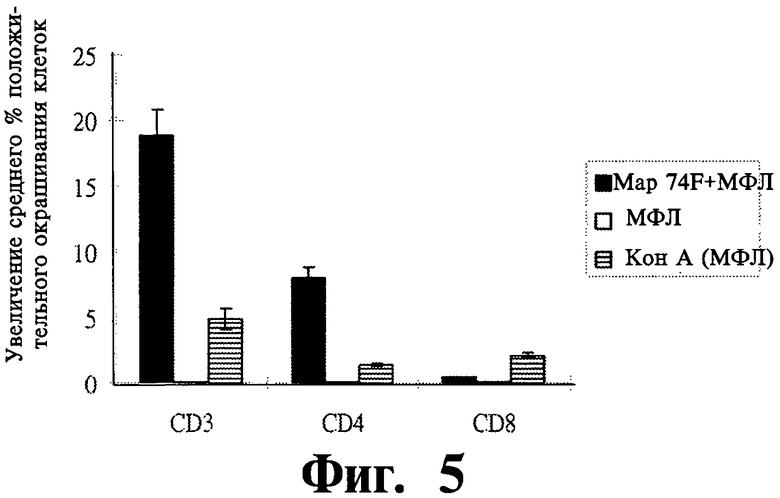
На Фиг.3-6 показаны графические изображения данных, полученных на мышах, убитых через 3 недели после вторичной вакцинации. Клетки селезенки мышей, получавших Мар74Р + МФЛ или только МФЛ были стимулированы в течении 2 дней 10 мг/мл Map74F, КонА (конканавалин А) и средой.
На Фиг.3 представлены данные, которые показывают уровень ИФН-γ в супернатантах культур, измеренный методом твердофазного иммуноферментного анализа (ИФА).
На Фиг.4 представлены данные, которые показывают определенный методом ELIspot (иммуноферментный спот-анализ) относительный уровень ИФН-γ-экспрессирующих клеток в суспензии моноклеток селезенки иммунизированных и контрольных мышей с или без стимуляции антигеном.
На Фиг.5 представлены данные FACS (флуоресцентная сортировка клеток) анализа популяции лимфоцитов селезенки, полученные от вакцинированных (Map74F + МФЛ) и контрольных животных (МФЛ, КонА-МФЛ) после стимуляции рекомбинантными и контрольными антигенами.
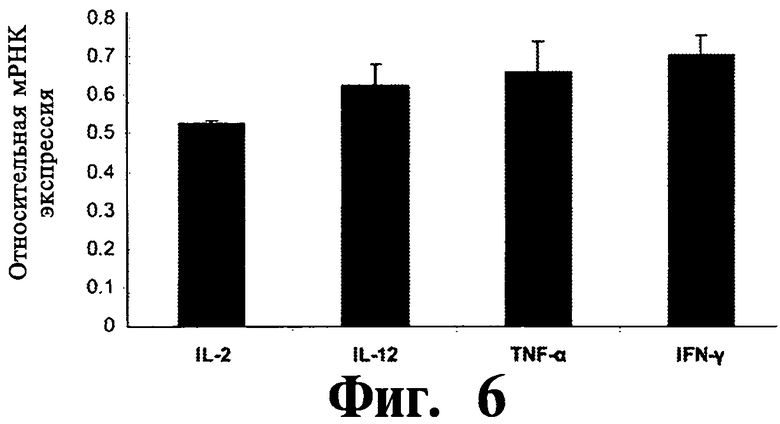
На Фиг.6, представлены данные экспрессии мРНК цитокинов в ответ на Map74F, нормализованный относительно “гена домашнего хозяйства” ГАФД. Представлены данные трех независимых экспериментов.
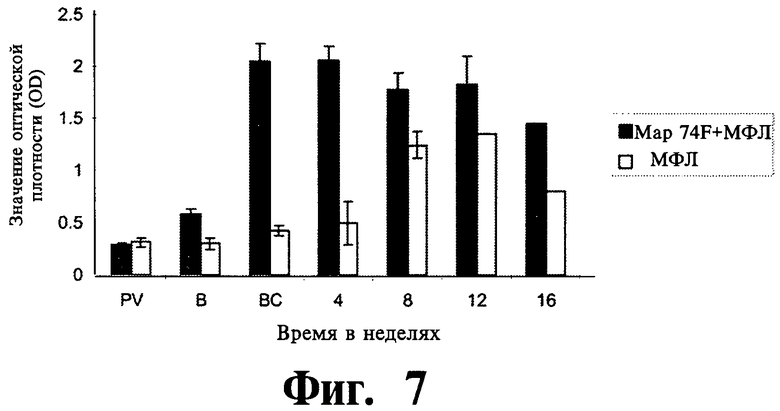
На Фиг.7 и 8 представлены данные, полученные из сыворотки вакцинированных и контрольных животных, собранные в разное время (превакцинация/ первичная вакцинация (PV), вторичная вакцинация (В), до заражения (ВС), и 4, 8, 12, и 16 недель после заражения) и проверенные на ответ к антителам.
На Фиг.7 показаны данные для сыворотки, протестированной на присутствие специфических антител к Map74F.
На Фиг.8 показано отношение lgGl/lgG2, полученное методом ИФА. Данные отражают три независимых эксперимента.
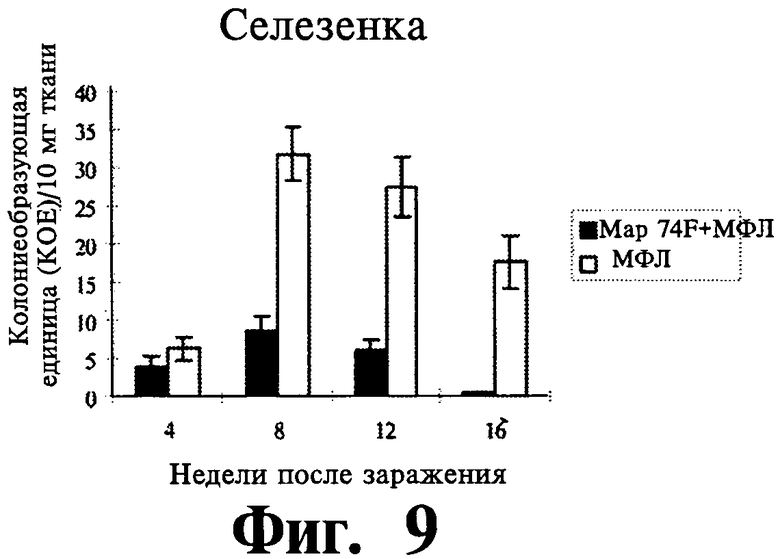
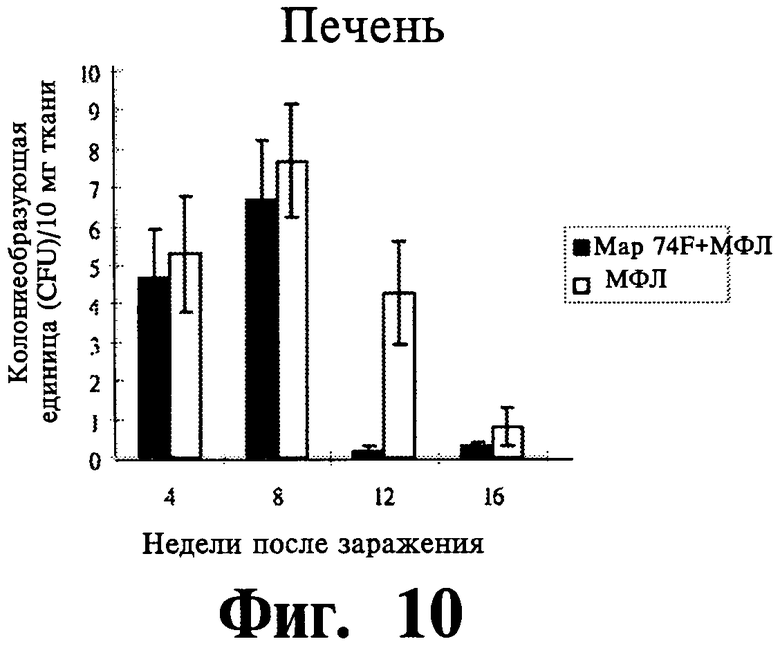
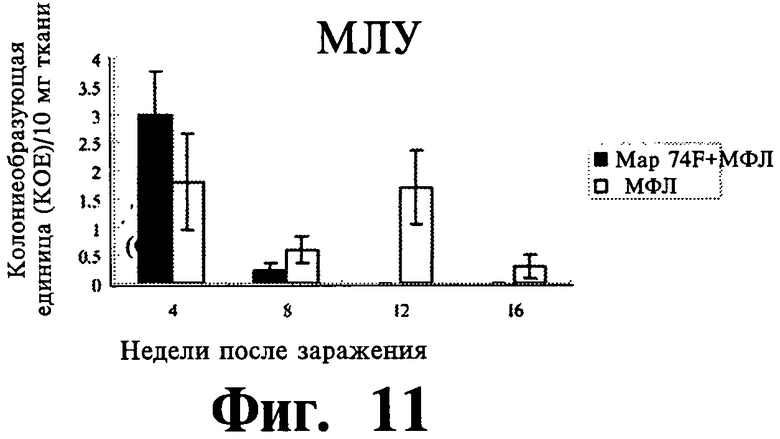
Фиг.9-11 отражают данные экспрессии защитного иммунитета селезенки (Фиг.9), печени (Фиг.10) и мезентеричного лимфатического узла (далее МЛУ) (Фиг.11), вызванной вакцинацией Map74F + МФЛ. Map74F значительно уменьшает действие MAP в селезенке (на 8-16 неделях после заражения), печени (на 12-16 неделях после заражеия) и МЛУ (на 8-16 неделях после заражения). Представлены данные трех независимых экспериментов.
На Фиг.12-15 представлены фотографии гистопатологического исследования тканей вакцинированных и невакцинированных мышей.
На Фиг.12 показана печень невакцинированной контрольной мыши. Многочисленные большие гранулемы распределены случайно по всей печени. Гематоксилин и эозин. Толщина 100 мкм. Вставка: Большее увеличение гранулемы, демонстрирующее многочисленных кислотоустойчивых бацилл. Окрашивание по Циль-Нильсену.
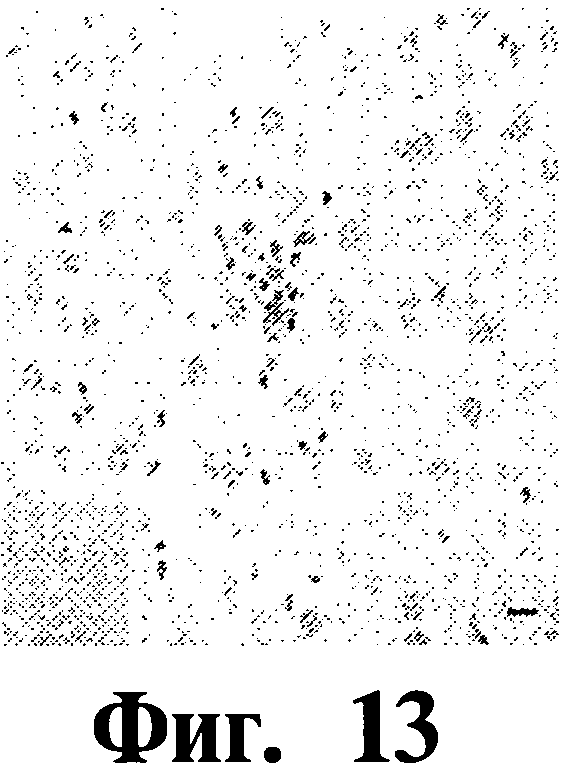
На Фиг.13 показана печень мыши, вакцинированной Map74F. Видны только единичные маленькие лимфоидные комплексы, окруженные несколькими макрофагами.
На Фиг.14 показана селезенка из невакцинированной контрольной мыши, с присутствием случайных гранулем в белой пульпе.
На Фиг.15 показана селезенка мыши, вакцинированной Map74F. Белая и красная пульпы свободны от гранулем. Гематоксилиновое и эозиновое окрашивание. Толщина 100 нм. Вставка: Большее увеличение гранулемы, демонстрирующее отсутствие кислотоустойчивых бацилл. Окрашивание по Циль-Нильсену.
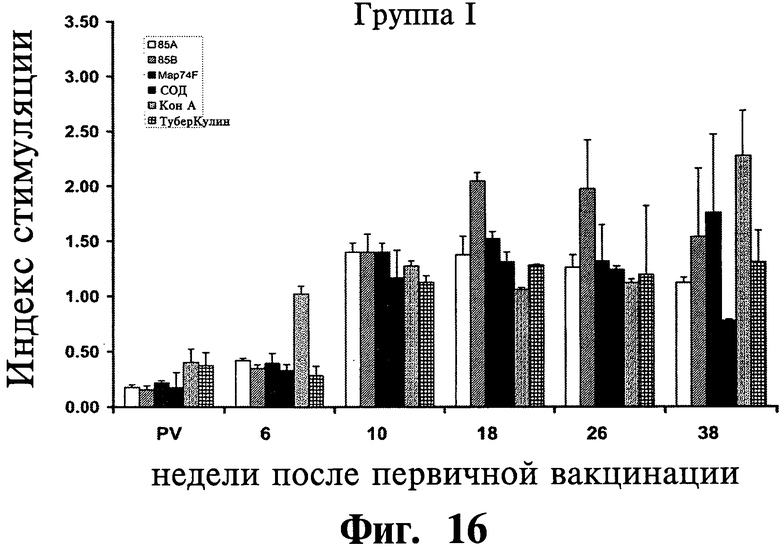
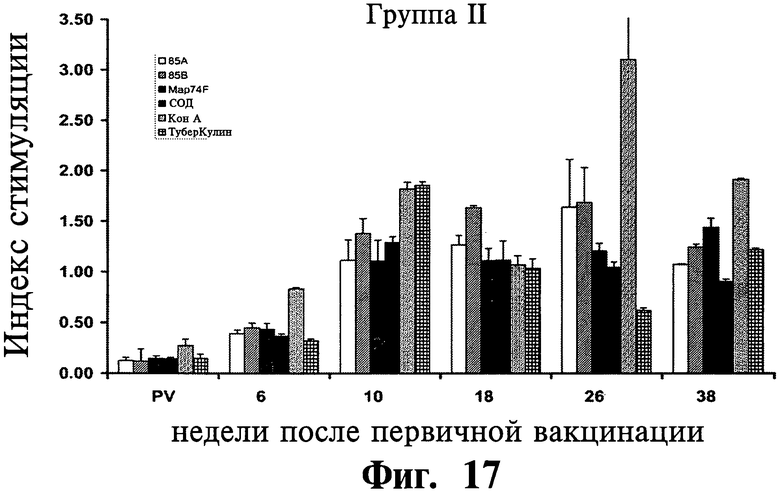
На Фиг.16-18 приведены данные, показывающие лимфопролиферативный отклик одноядерных периферических кровяных клеток (далее МКПК) у иммунизированных (группа I и II) и контрольных (группа III) групп животных на рекомбинантные антигены (85A, 85B, Map74F и СОД), КонА и туберкулин. Результаты выражены в виде индекса стимуляции (SI), и планки погрешностей показывают стандартное отклонение от среднего.
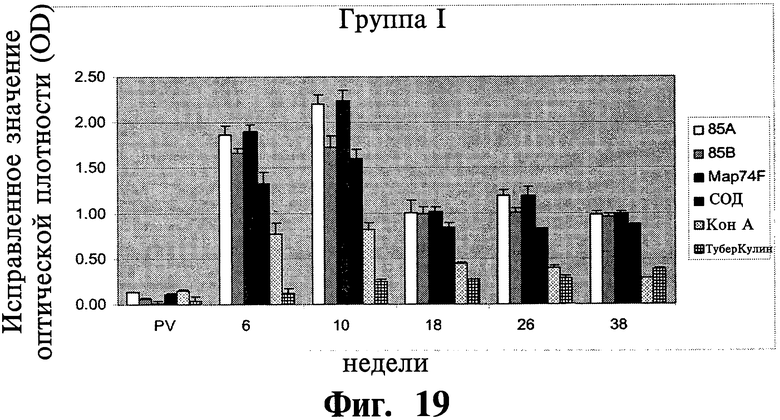
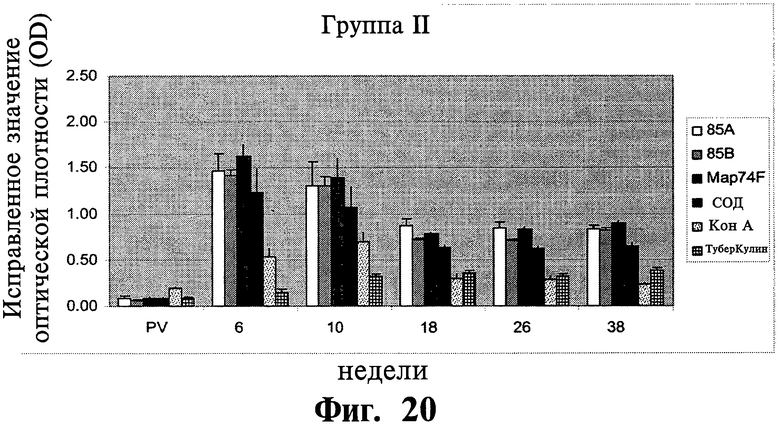
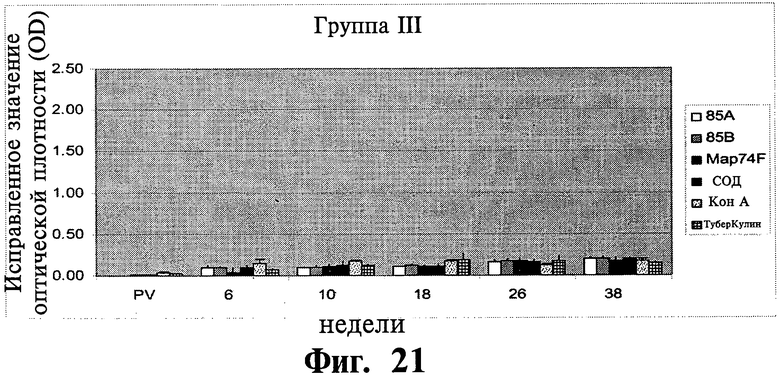
Фиг.19-21 отображают данные, показывающие антиген-специфичный ИФН-котклик МКПКу иммунизированных (группа I и II) и контрольных (группа III) групп животных. Результаты показаны в виде значений оптической плотности, и планки погрешностей показывают стандартное отклонение от среднего.
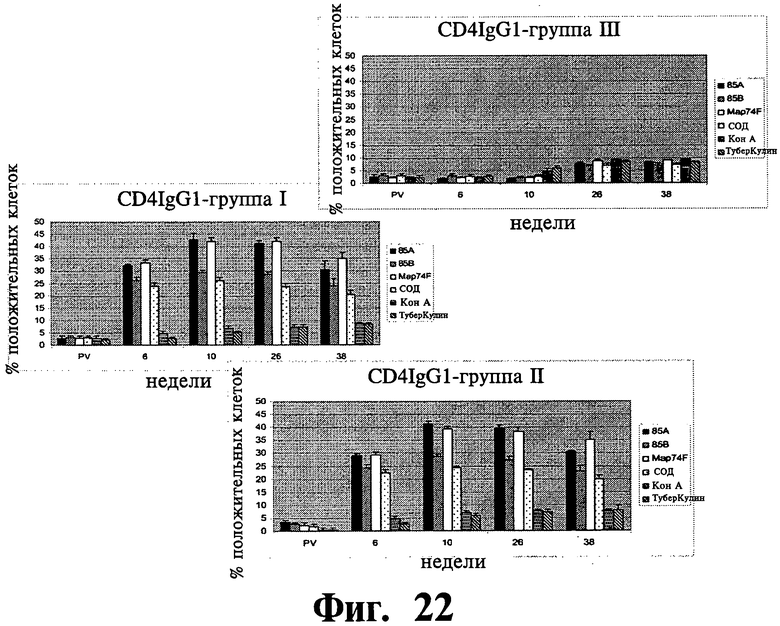
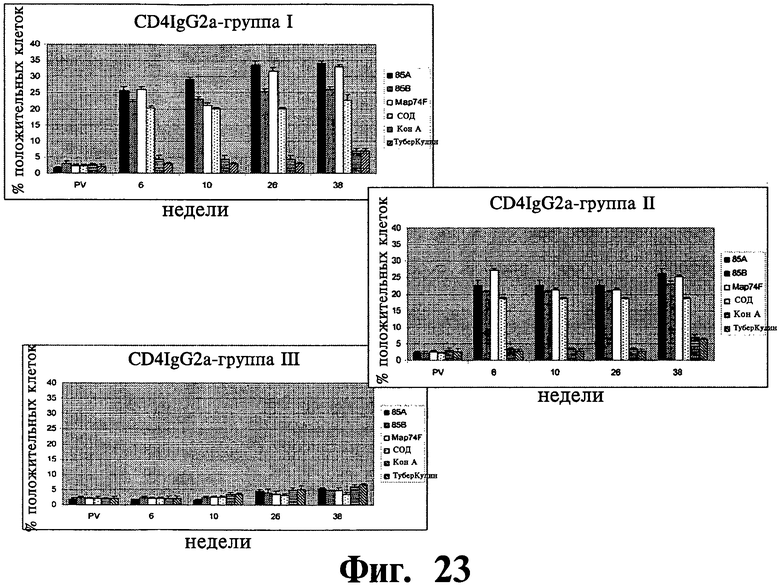
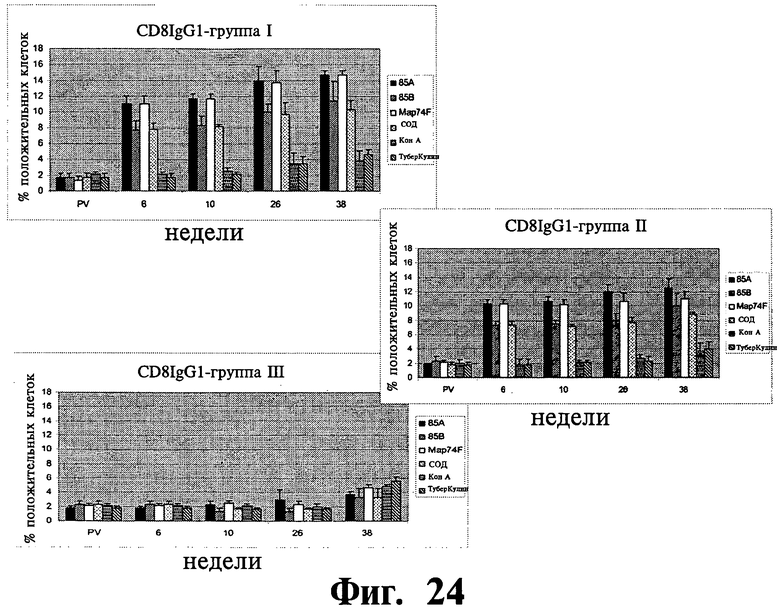
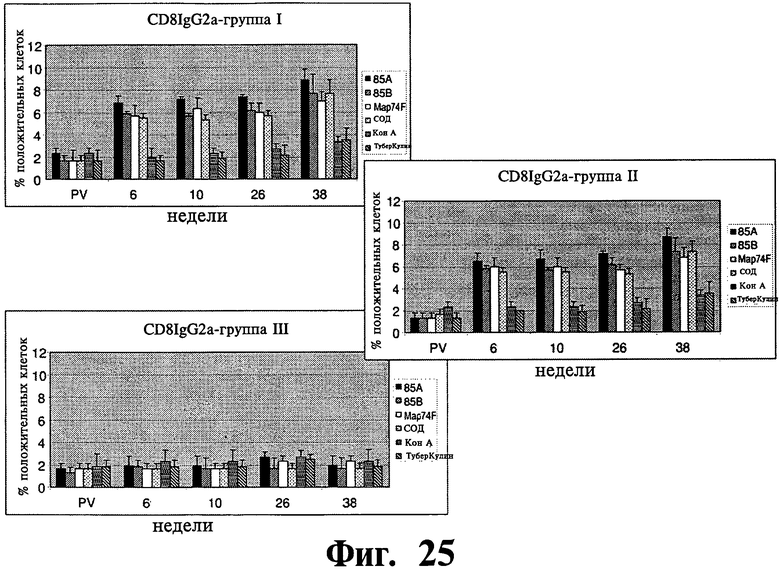
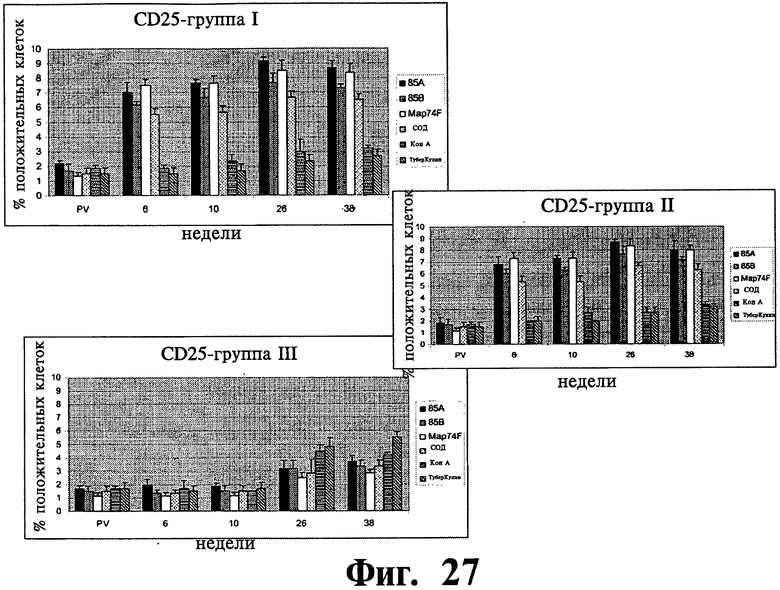
Фиг.22-27 отображают данные, показывающие экспрессию субпопуляции лимфоцитов в МКПК, взятых у иммунизированных (группа I и II) и контрольных (группа III) групп животных в заданное время после стимуляции рекомбинантными и контрольными антигенами и анализированные с помощью проточной цитофлюометрии. Результаты выражены, как процент клеток, дающих положительное окрашивание, относительно неиндуцированных образцов (обработанных средой). Планки погрешностей показывают стандартное отклонение от среднего значения.
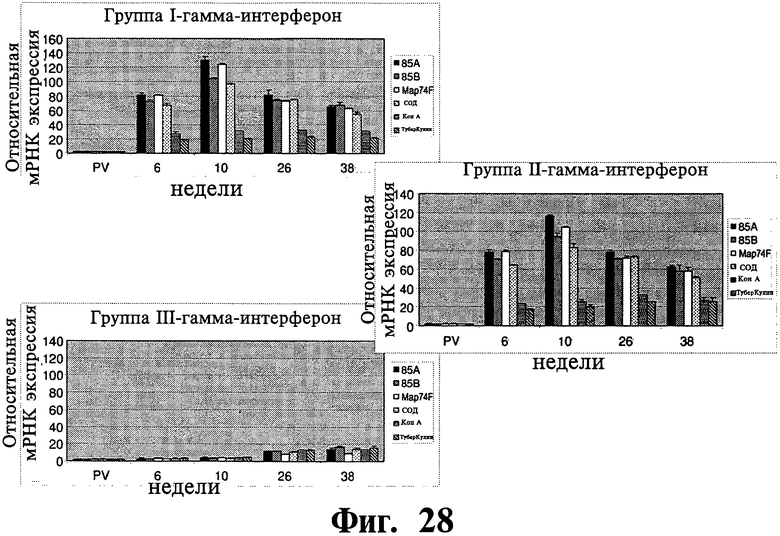
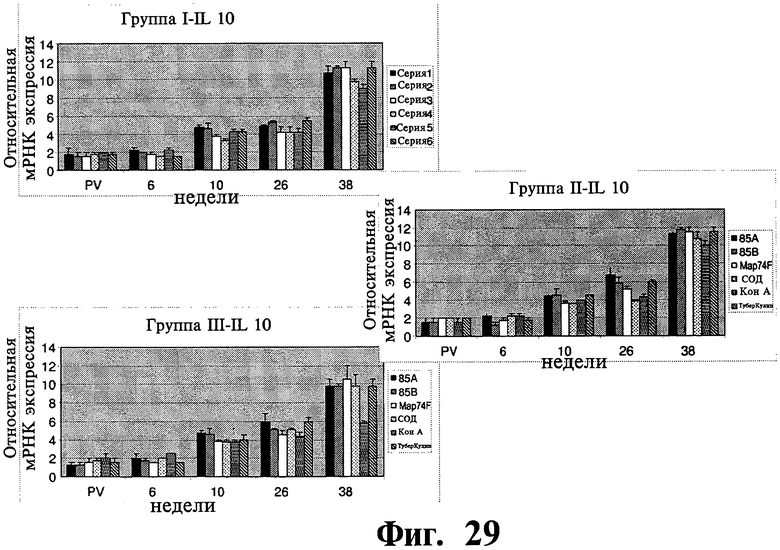
Фиг.28 и 29 отображают данные, показывающие экспрессию мРНКгена цитокина в ответ на рекомбинантные антигены для иммунизированных групп (I и II) и контрольной группы (III). Результаты выражены как средняя кратность увеличения по сравнению с нестимулированным МКПК, который служит в качестве контроля. Планки погрешностей указывают на стандартное отклонение от среднего значения.
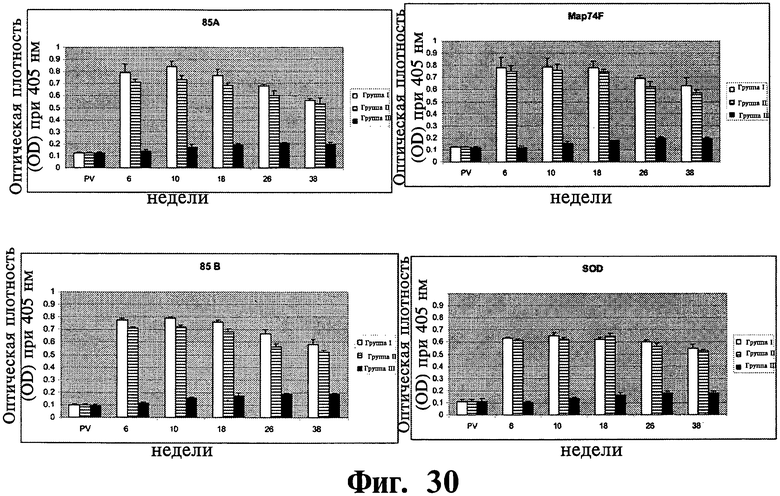
Фиг.30 отражает иммунный ответ на индивидуальные рекомбинантные антигены в вакцинированных группах животных I и II и контрольной группе животных III. Планки погрешностей указывают на стандартное отклонение от среднего значения.
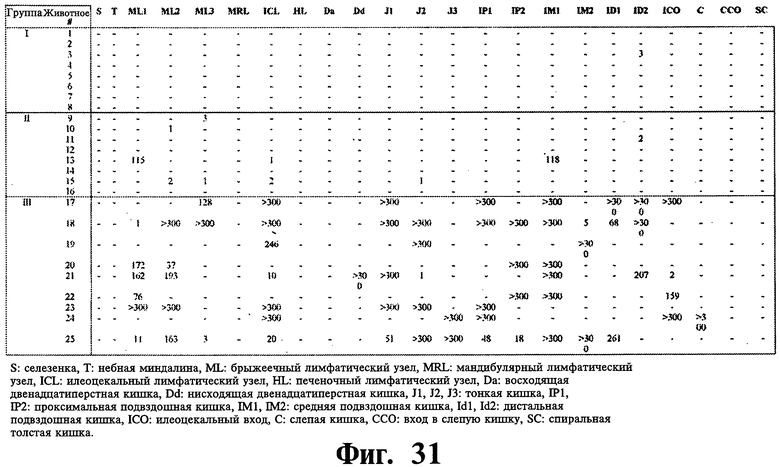
Фиг.31 показывает сводку в виде таблицы результатов MAP культур (в колониеобразующих единицах, далее KOE), измеренных в различных тканях, собранных во время некропсии.
Осуществление изобретения
Следующие примеры описывают различные варианты осуществления изобретения. Эти примеры являются иллюстративными и не должны рассматриваться как ограничивающие.
Пример 1
Данный Пример предлагает описание клонирования, экспрессии и очистки Map74F.
Образование тандемсвязанной ОРС, кодирующей Map74F
Map74F был образован путем последовательного сшивания в тандем рамок ОРС C-концевого фрагмента MAP_3527 с массой 16,6 кДа с ОРС, кодирующей MAP_1519 белок, обладающий молекулярной массой 46,8 кДа, а затем на C-конце - N-концевого участка MAP_3527 с массой окло 14,6 кДа. Образование конструкции MAP_3527 с, лишенной стоп-кодона.
5' и 3' олигонуклеотиды к C-концевому MAP_3527 (MAP_3527 с) были сконструированы следующим образом: 5' (ТА CATATG CAT CAT CAT CAT CAT CAT CTC AAC CAG AGC GTC TCG GC 3'' (SEQ ID NO: 4)) и (5'' ТА GAATTC GGC CGG CGG CCC CTC CGC С 3' (SEQ ID NO: 5)). После 5' олигонуклеотида, содержащего Ndel сайт рестрикции, предшествующий ATG инициирующему кодону, следовали нуклеотидные последовательности, кодирующие шесть гистидиновых остатков (курсив). 3' Олигонуклеотид содержал EcoRI сайт рестрикции. Эти олигонуклеотиды применялись для амплифицирования MAP_3527 с, карбоксильного 540-нуклеотидного участка (14,6 кДа, 180 аминокислотных остатков) MAP_3527, и полученный ПЦР-амплифицированный продукт лигировали в ПЦР2.1 Торо вектор. Плазмидную ДНК с правильной вставкой обрабатывали Ndel и EcoRI, и лигировали в pET17b экспрессирующий вектор, расщепленный теми же ферментами. Продукты лигирования переносили в клетки Escherichia coli DH5ct и один трансформант с правильной вставкой (MAP_3527c) идентифицировали с помощью рестрикционного картирования и ДНК секвенирования.
ПЦР амплификация полноразмерных кодирующих последовательностей MAP_1519 и лигирование в MAP_3527 c-pET плазм иду.
5' и 3' олигонуклеотиды MAP_1519, содержали следующие последовательности: 5'(5'-CTA ATC GAATTC ATG TTC TAT GGG GCC TTT C-3' SEQ ID NO: 6)) и 3'(5'-TA ATC GATATC CAG GAC CTT GGA CTT GTC-3' SEQ ID NO: 7)). 5' Олигонуклеотид содержал EcoRI сайт рестрикции. 3' Оли гону клеотид содержал EcoRV сайт рестрикции, непосредственно за которым шли последовательности, включающие шесть C-концевых аминокислотных остатков, и не содержал стоп-кодона. Амплифицирование кодирующей последовательности MAP_1519 (1380 пар оснований; длиной 460-аминокислот с предсказанным размером около 46,8 кДа), и полученный ПЦР-амплифицированный продукт лигировали в ПЦР 2,1 Торо вектор, расщепленный теми же ферментами. Клон с правильной вставкой обрабатывали EcoRI и EcoRV и лигировали в предварительно обработанную ферментами EcoRI/EcoRV плазмиду MAP_3527 c-pET. Продукты лигирования затем переносили в клетки E.coli DH5α, и трансформанты с правильной вставкой (MAP_3527c-MAP_I 519) идентифицировали с помощью рестрикционного картирования и подтверждали ДНК секвенированием. Клонирование N-концевого фрагмента MAP_3527 в MAP_3527C-MAP_1519 конструкцию.
5' и 3' олигонуклеотиды N-концевого фрагмента MAP_3527 были сконструированы следующим образом: 5'(5'-AT GATATC GGG CTG GCG CCG GCG TCC-3' SEQ ID NO: 8)) и 3'(5'-AT CTCGAG TCA CGC GAC CTT GCC GGC-3' SEQ ID NO: 9)). 5' олигонуклеотид содержал EcoRV сайт рестрикции. 3' олигонуклеотид содержал Xhol сайт рестрикции. Они конструировались для того, чтобы амплифицировать N-концевой, содержащий 447-пар оснований (149-аминокислотных остатков) фрагмент MAP_3527. Полученный ПЦР-амплифицированный продукт был обработан EcoRV и Xhol, и лигирован в MAP_3527 с-MAP_1519 слитую pET плазмиду, обработанную EcoRV and Xhol. Лигирующая смесь использовалась для транформирования клеток E.coli DH5α и положительные клоны были идентифицированы рестрикционным картированием и подтверждены ДНКсеквенированием. Конечная конструкция кодирует полипептид с массой 75 кДа (Map74F), включающий единственную ОРС, организованную в линейном порядке MAP_3527C-MAP_1519-MAP_3527N. Экспрессия и очистка Map74F рекомбинантного полипептида
Конструкция плазмидной ДНК была трансформирована в клетки E.coli BL21 (DE3 pLysE). Трансформированные клетки E.coli были помещены на LB агар (среда Лурия-Бертани), дополненный ампициллином (100 мкг/мл). Каждая колония засевалась в 10 мл LB питательной среды, содержащей ампициллин (100 мкг/мл), и выращивалась при 37°C в течение ночи при встряхивании. Культура была разбавлена 1:100 LB питательной средой, содержащей ампициллин (100 мкг/мл) и хлоромицеитин (34 мкг/мл), и выращивалась при 37°C при встряхивании. Через 3 ч индукции с 1 мМ ИПТГ (Invitrogen Co, Carlsbad, CA), клетки отделяли центрифугированием (5000 g) и однократно промывали фосфатно-солевым буфером (ФСБ). Клетки суспендировали в буфере A (50 мМ ТрисHCl, 1 мМ ЭДТА, 50 мМ NaCl, pH 8,0) и лизировали в клеточном дезинтеграторе высокого давления или клеточном дезинтеграторе. После осаждения центрифугированием телец включения, осадки были трижды промыты промывочным буфером для телец включения (буфер А + 1% Triton Х-100) и дважды - буфером CHAPS (Sigma-Aldrich, St.Louis, МО) (1% CHAPS в 10 мМ ТрисHCl, pH 8,0) для удаления липополисахарида. Тельца включения растворяли в буфере В (100 мМ фосфата натрия, 10 мМ Трис-HCl, 8 М мочевины, 2 мМ PMSF (Sigma) и 20 мкг/мл леупептина (Sigma), pH 8,0) и очищали на Ni-NTA агарозной колонке (Invitrogen). Элюированные фракции исследовали с помощью SDS-PAGE электрофореза, и фракции, содержащие рекомбинантный полипептид, объединяли и диализировали против 10 мМ Трис-HCl (pH 7,8) в течение ночи при 40С° два раза. Полипептид пропускали через Detoxi-GelTM Endotoxin Removing Gel (Pierce, Rockford, IL) и очищенный полипептид исследовали на уровень эндотоксина с помощью ЛАЛ-теста (Limulus amoebocyte assay). Очищенный полипептид имел ничтожно малый уровень (10 пг/мл) эндотоксина.
На Фиг.1 дано схематическое изображение Map74F, показывающее структуру и сайты ферментативной рестрикции, используемые в конструкции полипептида. ОРС Map74F составляет 2397 нуклеотидов в длину, кодируя полипептид, состоящий из 799 аминокислот (Фиг.2), с предсказанной молекулярной массой около 79 кДа. Дизайн и конструкция ОРС вылились в введение двух шарнирных последовательностей (EcoRI и EcoKV) из шести нуклеотидов, которые кодируют две аминокислоты в каждом сайте соединения, соединяя три первоначальных ОРС. Кроме того, ОРС (Map74F) была сконструирована таким образом, что содержит шесть гистидиновых остатков на N-конце для очистки с использованием Ni-NTA матрицы. После экспрессии в E.coli, рекомбинантный полипептид был очищен от телец включения и проанализирован с помощью SDS-PAGE электрофореза (Фиг.2) с выходом в диапазоне около 1,5-2,0 мг очищенного полипептида на литр индуцированной культуры.
Пример 2
Данный пример демонстрирует применение Map74F для стимулирования иммунного ответа против MAP в модели на мышах. Было найдено, что мыши являются подходящей моделью для изучения MAP инфекции. Бактериальная нагрузка и патология специфических органов представляют хорошие показатели инфекционного статуса мышей после заражения MAP. У мышей печень, селезенка и мезентеричные лимфатические узлы являются лучшими органами для оценки бактериальной нагрузки после заражения MAP. В данном примере оценивалась нагрузка MAP на эти органы для определения эффективности защитных свойств Map74F после заражения. Из результатов, представленных ниже, очевидно, что Map74F иммунизированные животные были в состоянии либо ликвидировать, либо замедлить пролиферацию MAP в течение 16-недельного периода инфекции. В селезенке, печени и мезентеричных лимфатических узлах, число колониеобразующих единиц (KOE) уменьшалось через 8 недель после заражения, что предполагало уничтожение MAP. Кроме бактериальной нагрузки в печени и селезенке вакцинированных животных наблюдалось меньшее число гранулем и меньшее число кислотоустойчивых микроорганизмов, что указывало на защитное действие полипротеина. Значительно уменьшенная нагрузка MAP на органы и улучшение патологии печени и селезенки указывают, что иммунизация Map74F защищала мышей от инфекции MAP путем быстрого уменьшения или уничтожения нагрузки MAP. Map74F также вызывал установление высокого уровня γ-интерферона. Map74F вызывал хороший ответ T-хелперных клеток 1 типа (Th1 - ответ).
Материалы и методы Примера 2.
Животные
Эксперименты выполнялись с использованием самок мышей C57/BL6 (Harlan Sprague, Indianapolis, Indiana) в возрасте 6-8 недель. Животные содержались в лаборатории II уровня биологической безопасности и имели неограниченный доступ к пище и воде. Все экспериментальные работы проводились в соответствии с правилами, нормами и принципами законодательства об охране животных управления министерства здравоохранения по гуманному обращению и использованию лабораторных животных, применяемых для исследования, изучения и тренировки, Руководства Национальных Институтов Здоровья (NIH) по изучению и использованию лабораторных животных и Нью-Йоркского государственного управления здравоохранения.
Бактериальные штаммы
MAP выделенный из инфицированных коров, обозначенный как MAP 661 15-98, использовался для заражения мышей и для выделения геномной ДНК. MAP 661 15-98 культур провал и в среде 7Н9, с добавкой 10% олеиновая кислота - альбумин - декстроза - каталазы (Becton, Dickinson and Со, Sparks, MD) и микобактина J (Allied Monitor, Inc, Fayette, МО). После культурирования в течение 6-8 недель организмы собирали центрифугированием при 10 000 g и дважды промывали фосфатно-солевым буфером (ФСБ; pH 7,2). Микроорганизмы разбавляли ФСБ до требуемой концентрации и использовали для заражения мышей.
Иммунизация мышей
Мыши были поделены на две группы по 36 мышей в каждой группе. Животные группы I были иммунизированы дважды, с интервалом в три недели, 50 мкг/животное, рекомбинантным полипептидом вместе сэмульсией МФЛ + TDM (Ribi-адъювант, Corixa, Hamilton, МТ) в суммарном объеме 100 мкл на дозу путем подкожной инъекции в спину. Животные группы II были оставлены в качестве невакцинированного контроля, им вводили только эмульсию МФЛ + TDM. Через три недели после второй иммунизации 12 животных из каждой группы, предназначенных для определения иммуногенности, были забиты, и клетки селезенки были извлечены обычным способом. Клетки селезенки выращивались в среде RPMI 1640 (Gibco, Grand Island, NY), содержащей 10%FBS (Gibco) при 37°C и при 5% CO2. Эксперименты по иммунизации были повторены дважды с одинаковыми дозировками и в одинаковом режиме. Заражение мышей MAP
Через три недели после второй иммунизации 24 животных из групп I и II были заражены с помощью внутрибрюшинной инъекции 109 колониеобразующими единицами (KOE) Mycobacterium avium подвида paratuberculosis. По шесть животных в каждой группе были умерщвлены на 4, 8, 12 и 16 неделях после заражения, и селезенка, печень и брыжеечные лимфатические узлы были собраны и поделены на две части. Один набор тканей был гомогенизирован в ФСБ (100 мг/мл) и 100 мкл гомогенатов индивидуальных тканей были посеяны на яично-желточный скошенный агар (Herald's egg yolk (HEY), Becton, Dickinson and Co, Sparks, MD), содержащий микобактин J., для оценки бактериальной нагрузки. Культуры на скошенном агаре были изучены на рост бактерий путем подсчета колоний через 8-12 недель после высеивания. Другой набор тканей использовался для гистопатологического исследования.
Гистопатологическое исследование
Участки селезенки, печени и МЛУ фиксировали путем погружения в 10% нейтральный буферный формалин, заливали в парафин, делали срезы 4 мкм и окрашивали гематоксилином и эозином, окрашивали по Цилю-Нельсену с помощью обычных гистологических методов, а затем изучали с помощью оптической микроскопии.
Твердофазный иммуноферментный анализ гуморального иммунного ответа Антигенспецифичный lgG ответ измеряли с помощью обычного метода иммуноферментного анализа ИФА. На ИФА плашки (Nunc-immuno module, Nunc, Roskilde, Denmark) наносили 200 нг/лунку рекомбинантного полипептида и инкубировали при 4°C в течение ночи. После однократного промывания ФСБ-Т (0,05% Tween 20 в ФСБ), добавили 300 мкл блокирующего буфера (1% бычьего сывороточного альбумина (БСА) в ФСБ-Т) и инкубировали при 25°C в течение 1 часа. Плашки промыли три раза ФСБ-Т и добавили в каждую лунку 100 мкл разбавленных образцов сыворотки и инкубировали при 37°C в течение 1 часа. Для измерения общего иммуноглобулин-G (lgG) ответа, после промывания к каждой лунке добавили 50 нг конъюгированного с щелочной фосфатазой козлиного антимышиного lgG (KPL, Gaithersburg, MD) и инкубировали при 25°C в течение 30 минут. После промывания добавили 50 мкл субстрата BluePhos (KPL) и инкубировали 10 минут. После добавления 50 мкл стоп-раствора (KPL) плашки считывали на ELX 808 Ultra планшет-ридере (Bio-Tek Instruments, Inc. Winooski, VT) при 630 нм. Для измерения ответа по изотипам, после промывания к каждой лунке добавили 25 нг конъюгированного с биотином козлиного антимышиного lgG1 или lgG2a (Southern Biotech, Birmingham, AL) и инкубировали при 25°C в течение 30 минут. После промывания добавили 0,2 мкг/мл стрептавидина, меченного пероксидазой (KPL) и инкубировали при 25°C в течение 30 минут. После промывания к каждой лунке добавили 50 мкл 3,3',5,5'-тетраметилбензидина и инкубировали в течение 15 минут. Планшеты считывали на ELX 808 Ultra микропланшет-ридере (Bio-Tek Instruments) с помощью метода конечных точек при 450 нм после добавления 50 мкл 1N H2SO4 в качестве стоп-раствора.
Анализ интерферона-гамма
Клетки селезенки, полученные стандартными методами были засеяны в повторе с концентрацией 5×105 клеток/лунку и культивировались с и без рекомбинантного полипептида в качестве антигена в течение 48 ч. Супернатанты культур были собраны и проанализированы на γ-интерферон с использованием набора для твердофазного иммуноферментного сэндвич-метода (Biosource, Camarillo, CA) в соответствии с инструкцией производителя. Вкратце, 50 мкл супернатанта культуры добавляли в лунки с нанесенными моноклональными антителами, специфичными для мышиного γ-интерферона. Через 2 ч совместной инкубации при комнатной температуре с биотинилированными поликлональными антителами, лунки промывали и добавляли стрептавидин-пероксидазу. После 30 минутного инкубирования и промывания к лункам добавили раствор тетраметилбензидина и результаты считывали при 450 нм в ELx 808 Ultra микропланшет-ридере (Bio-Tek Instruments).
Иммуноферментный спот-анализ (ELIspot)
Набор для иммуноферментного спот-анализа (KPL) использовался для определения относительного числа клеток, экспрессирующих γ-интерферон, в суспензии единичных клеток селезенки в соответствии с инструкциями производителя. Вкратце, 10 мкг/мл антител, иммобилизованных интерфероном (BD Biosciences, San Jose, СА) были нанесены на Multiscreen 96-луночный фильтровальный планшет (Millipore, Bedford, MA) на ночь при 4°C. После однократного промывания промывочным раствором, плашки блокировали с помощью 1×БСА раствора в течение 1 часа при 25°C и снова промывали. Клетки селезенки помещали в повторе в концентрации 5×105 клеток/лунку и выращивали с и без антигена в течение 48 часов при 37°C. Плашки промывали однократно промывочным раствором и инкубировали 1 ч при 25°C с 5 мкг/мл вторичных крысиных антимышиных антител к γ-интерферону, конъюгированных с биотином (BD Biosciences). Плашки промывали и инкубировали 30 мин при 25°C с 0,2 мкг/мл HRP-стрептавидина. Фильтры проявляли TureBlue субстратом в течение 15 минут, высушивали в темноте и подсчитывали пятна.
Анализ возбужденной флюоресценции сортированных клеток (FACS анализ) на маркеры клеточной поверхности
Клетки селезенки наносили в повторе на 96-луночные культуральные микропланшеты в концентрации 1×106 клеток/лунку и культурировали 24 часа. Анализ возбужденной флюоресценции сортированных клеток проводили после стимулирования клеток селезенки полипептидом Map74F и конкавалином A с подходящими нестимулированными контрольными клетками. После трехкратного промывания FACS буфером (1% БСА и 0,05% азида натрия в ФСБ), клетки суспендировали в 50 мкл FACS буфера и смешивали с 0,5 мкг CD3, CD4 и CD8 антител, конъюгированных с ФИТЦ (флуоресцеин изотиацианат) или ФЭ (фикоэритрин, eBioscience, San Diego, СА), и инкубировали на льду 30 минут.Клетки дважды промывали FACS буфером и суспендировали в 100 мкл 3% формальдегида в ФСБ, а затем переносили в FACS пробирки, содержащие 500 мкл ФСБ. Данные получали для 10000 событий с использованием проточного цитомера FACS калибра (Becton-Dickinson, San Jose, СА) и обрабатывали с использованием программы Cellquest. Результаты выражали как увеличение среднего процента клеток с положительным окрашиванием по отношению к клеткам неиндуцированного образца, окрашенного тем же антителом. ПЦР в реальном времени для анализа экспрессии цитокиновой мРНК.
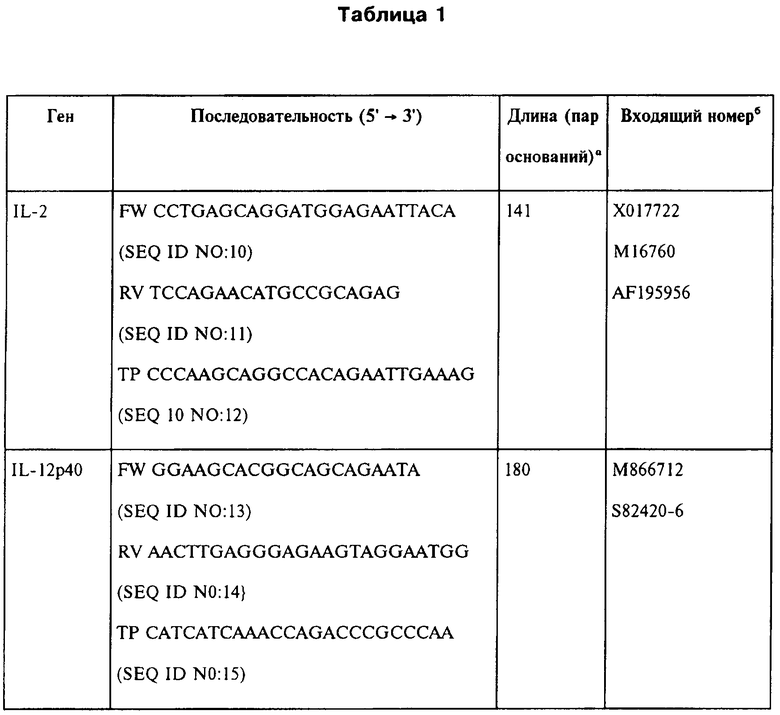
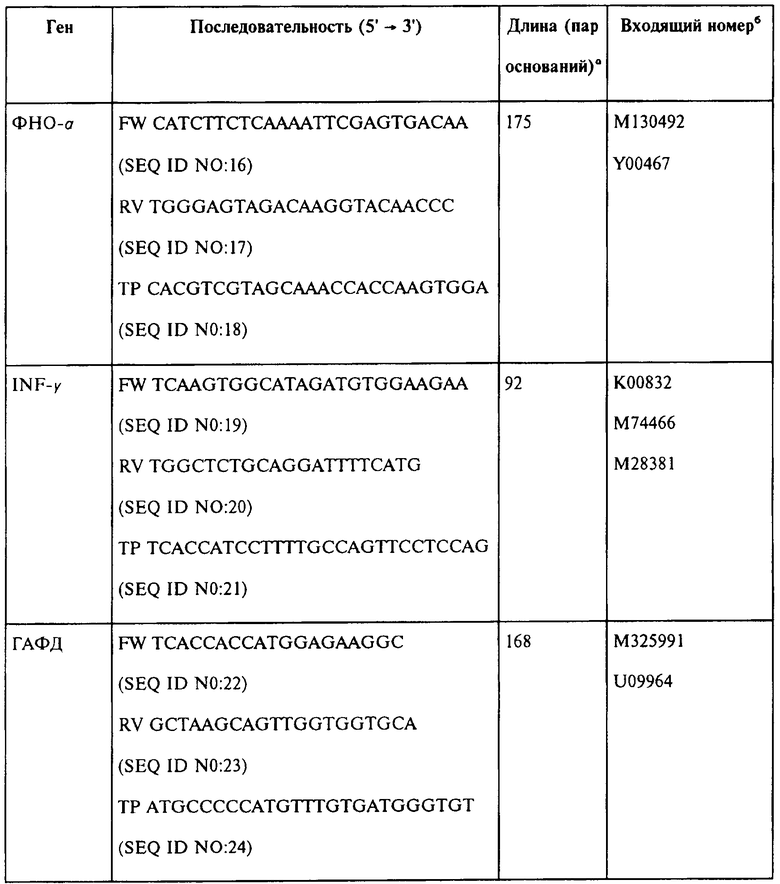
Тотальная РНК была выделена из тканей селезенки иммунизованных мышей с использованием мининабора RNeasy mini kit (Qiagen, Valencia, СА). Матричная РНК была обратно-транскрибирована с использованием Superscript™ II (Invitrogen) и использовалась в качестве матричной кДНК. Последовательности праймера и образцов представлены в Таблице 1. В Таблице 1 применялись следующие сокращения: FW, прямой праймер; RV, обратный праймер; TP, TaqMan проба, дважды меченная 5'FAM и 3TAMRA; а Длина ампликона в парах оснований. b Входящий номер кДНК и соответствующего гена в Genbank. c Антисмысловой образец.
Образцы были мечены флуоресцентным красителем, 6-карбоксифлуоресцеином на 5' конце и гасителем люминесценции, N', N\N',N',N'-6-карбокситетраметилродамином на 3' конце. Реакцию проводили в повторе в объеме 25 мкл, содержащем 2 мкл 10 пМ прямого и обратного праймеров, 2 мкл 2 пМ пробы, 12,5 мкл TaqMan ПЦР мастер-микса и 9,5 мкл разбавленной кДНК, используя следующие условия: 10 мин при 94°C с последующими 40 полными двухтемпературными циклами (15 секунд при 95°C и 1 мин при 60°C), в автоматическом флуориметре (7700 Sequence detector, Applied Biosystems, Foster city, СА). Количественная оценка проводилась с использованием сравнительного метода пороговых циклов и выражалась в виде относительной транскрипции или кратности n-раз по сравнению с калибровочной кДНК.
Статистический анализ
Данные были статистически обработаны с использованием программы Excel. Расхождение между группами и индивидуальными антигенами анализировали однофакторным дисперсионным анализом с последующим критерием множественных сравнений Тьюки-Крамера или критерием Стьюдента. Расхождения считались значимыми, когда были получены значения вероятности менее 0,05.
С помощью материалов и методов, изложенных в данном Примере, были получены следующие результаты.
Иммунный ответ у мышей, иммунизованных полипептидом Map74F
Через три недели после вторичной вакцинации четыре мыши из каждой группы были убиты, и была проведена оценка образования анти-Map74F антител и T-клеточной иммунной реакции. Мыши, иммунизированные Map74F, имели существенно (P<0,01) более сильный lgG1, но не lgG2a ответ против Map74F. Напротив, в контрольной группе не было обнаружено Map74F-специфичных антител.
ИФН-γ ответ оценивался с помощью методов ИФН-γ ИФА супернатанта культуры и ИФН-γ ELISPOT. Антиген-специфичный γ-интерфероновый ответ был существенно выше (P<0,05) у мышей, иммунизированных Map74F по сравнению с контрольными животными, получавшими только МФЛ (Фиг.3). Результаты ИФН-γ ELISPOT также оказались сравнимыми с результатами ИФН-γ ELISA (Фиг.4), что дополнительно подтверждало увеличенный ИФН-γ ответу вакцинированных животных. Вакцинированная группа имела среднее число колоний, образуемых единичной клеткой, равное 20, в отличие от 7 в контрольной группе. Распределение антиген-специфических CD3+, CD4+ и CD8+ T клеток в клетках селезенки оценивалось с помощью FACS. Число CD3+ и CD4+ T клеток было существенно выше (P<0,01) у мышей, иммунизированных Map74F (Фиг.5) по сравнению с контрольными мышами. Наоборот, между вакцинироваными и контрольными животными не наблюдалось никакого существенного различия в популяциях CD8+ T клеток. Уровни экспрессии цитокиновых генов оценивались с помощью ПЦР в реальном времени. Не было обнаружено никакой существенной разницы (P>0,05) в уровнях экспрессии цитокиновых генов ИЛ-2, ИЛ-12, ФНО-α и ИФН-γ между вакцинированными и контрольными животными (Фиг.6).
Map74F защищает C57/BL6 мышей против инфекции MAP
На основании иммунных ответов, полученных у вакцинированных мышей, планировалось оценить защитный эффект полипептида Map74F против инфекции MAP у мышей. Сыворотка, отобранная в различных временных точках, исследовалась с помощью ИФА на общий lgG ответ (Фиг.7) и отношение lgG1/lgG2a (Фиг.8). Мыши, иммунизированные 74F, показали значительное (P<0,01) увеличение уровня 74F специфичных антител на 3 и 7 неделях (4 недели после заражения) после вторичной вакцинации по сравнению с контрольными животными. Несмотря на то, что у контрольных животных уровни антител увеличивались после заражения, ответ был выше у вакцинированных животных на 8, 12 и 16 неделях после заражения. Существенные различия были обнаружены в соотношении lgG1/lgG2a для вакцинированных и контрольных животных к 3 неделе после вторичной вакцинации. У вакцинированных животных соотношение lgG1/lgG2a увеличивалось после вторичной вакцинации вплоть до 4 недели после заражения. После этого у вакцинированных животных отмечалось уменьшение соотношения lgG1/lgG2a вплоть до конца периода наблюдения 16 недель после заражения.
Для оценки защитного эффекта 74F, делались посевы на MAP клеток селезенки, печени и МЛУ в разных временных точках после заражения MAP. В селезенке нагрузка MAP была существенно (P<0,01) ниже у вакцинированных животных по сравнению с контрольными животными на 8, 12 и 16 неделях после заражения (Фиг.9). В печени вакцинированные животные имели более низкую MAP нагрузку, чем контрольные животные, и нагрузка была значительно (P<0,01) ниже на 12 неделе после заражения (Фиг.10). У вакцинированных животных, MAP_ нагрузка на MLN была существенно ниже с 8 недели после заражения (Фиг.11). Гистопаталогическое исследование печени (Фиг.12 и 13) и селезенки (Фиг.14 и 15) показало, что внутрибрюшинное заражение MAP привело к большему количеству гранулем у контрольных животных на 8, 12 и 16 неделях после заражения. У невакцинированных контрольных животных в печени содержались многочисленные, большие, случайным образом расположенные гранулемы (Фиг.12), в то время, как печень вакцинированных животных содержала только незначительное число небольших лимфоидных образований (Фиг.13). Аналогично, селезенка невакцинированных контрольных животных содержала больше гранулем (Фиг.14), чем селезенка вакцинированных животных (Фиг.15). Когда ткани печени и селезенки из контрольных животных были окрашены по Цилю-Нельсону, были видны многочисленные кислотоустойчивые бациллы. Напротив, число гранулем и кислотоустойчивых бацилл было меньшим у животных, иммунизированных Map74F.
Таким образом, в данном примере использовались клетки селезенки от вакцинированных и контрольных животных для установления типа T-клеточного ответа, вызванного рекомбинантным полипептидом. При микобактериальных инфекциях Th1 клетки являются ответственными за защиту на ранней фазе инфекции. Считается, что наиболее эффективная стратегия вакцинации против внутриклеточных патогенных факторов представляет собой вакцинацию, которая вызывает как CD4+, так и CD8+ T-клеточный ответ в виде выработки Th1 -ассоциированных цитокинов. В целом, γ-интерферон рассматривают как основной компонент при активации макрофагов и считается, что их выработка Th 1 CD4+ T клетками является необходимым для содержащейся MAP инфекции. Полученные результаты указывают на то, что вакцинация рекомбинантным полипептидом Map74F вызывает значительный ИФН-γ ответ. Аналогично было установлено, что иммунизация Map74F вызывает сильный CD3+ и CD4+ T клеточный ответ у вакцинированных животных, в отличие от CD8+ T клеток, указывая на то, что увеличение уровня ИФН-γ может происходить благодаря увеличению CD4+ T клеточных популяций. Результаты подтверждают, что экспрессия ИФН-γ главным образом происходила в активированных CD4+ T клетках. Повышенный CD4+ T клеточный ответ и уровни защиты, раскрытые в настоящем изобретении вслед за заражением MAP, указывают на защитный эффект Map74F.
Представленное в данном примере изучение иммуногенности также указывает, что Map74F с МФЛ вызывал хороший иммунный ответ у вакцинированных животных. Соотношение lgG1/lgG2a увеличивалось до 4 недель после заражения MAP, указывая на Th2 специфичный ответ. Однако, соотношение lgG1/lgG2a постепенно уменьшалось, начиная с 8 недели, указывая на возможный сдвиг на Th1 ответ. Из результатов, представленных в данном примере, очевидно, что Map74F вызывает какТМ, так и Th2 ответы, при этом первый ответ является более выраженным, что демонстрирует значительный ИФН-γ ответ.
Пример 3
Данный пример демонстрирует применение Map74F и других выбранных белков MAP для стимулирования иммунного ответа против MAP у жвачных животных.
Следующие материалы и методы использовались для получения данных, представленных в данном примере.
Животные. В данном исследовании использовали всего 25 козлят возраста от 5 до 10 дней из стада, не зараженного MAP. Образцы фекалия, взятые у козлят перед экспериментами по иммунизации, были отрицательными на MAP, как с помощью посева, так и методом ПЦР для IS900 гена. Все экспериментальные работы выполнялись в соответствии с правилами, нормами и принципами законодательства об охране животных управления министерства здравоохранения по гуманному обращению и использованию лабораторных животных, применяемых для исследования, изучения и тренировке, Руководства Национальных Институтов Здоровья (NIH) по изучению и использованию лабораторных животных и Нью-Йоркского государственного управления здравоохранения.
Бактерии. Клинический штамм MAP 66115-98 был использован для заражения козлят после иммунизации. Этот штамм был IS900 положительным и микобактин-зависимым. MAP 66115-98 культурировался в 7Н9 среде с добавкой 10% олеиновая кислота - альбумин - декстроза - каталазы (Becton Dickinson Со, Sparks, MD) и микобактина J (Allied Monitor, Inc, Fayette, MO). После культурирования в течение 8 недель микроорганизмы отделяли центрифугированием при 4000×g в течение 10 мин и промывали дважды фосфатно-солевым буфером (ФСБ; pH 7,2). Микроорганизмы разбавляли ФСБ до требуемой концентрации и использовали для заражения телят.
Антигены и вспомогательные вещества. Три рекомбинантных антигена MAP - 85A, 85В, СОД и рекомбинантный полипептид Map74F, были клонированы, экспрессированы и очищены с использованием стандартных методик и так, как изложено в заявке США №11/816,365, описание клонирования, экспрессии и очистки которой включены в заявку посредством ссылки. Экспрессированные полипептиды очищали с использованием Ni-NTA агарозных колонок (Qiagen, Valencia, СА). Примеси эндотоксина удаляли с использованием Affinity Рак Detoxi Gel (Pierce, Rockford, IL), и антигены имели незначительный уровень (10 пг/мл) эндотоксина в LAL-тесте. DDA (Sigma, USA) перемешивали в стерильной дистиллированной воде до концентрации 2,5 мг/мл, нагревали до 80°C при постоянном перемешивании в течение 20 мин и охлаждали до комнатной температуры. ДЦА тщательно смешивали с рекомбинантными антигенами до конечной концентрации 250 мкг/дозу.
Иммунизация животных. Козлята были разделены на три группы, по восемь животных в группах I и II и 9 животных в группе III (поскольку был дополнительный козленок). Все козлята оставались со своими матерями до достижения возраста трех месяцев. Группу животных I иммунизировали по 100 мкг каждым из четырех антигенов (85A, 85B, СОД и Map74F) в ДДА в форме подкожной инъекции. Группу животных II иммунизировали по 100 мкг каждого антигена без ДДА. Группа III была оставлена в качестве контрольных животных и ей вводили только ДДА. Через три недели после первичной иммунизации козлят вакцинировали вторично тем же самым набором антигенов и вспомогательных веществ.
Заражение животных MAP. Через три недели после вторичной вакцинации все 24 козленка были заражены перорально с использованием 5×108 MAP_ клеток/животное в 10 мл заменителя молока в течение 7 дней подряд. Для каждого животного была проведена микроскопия фекалий на 2, 4, 6, 8 и 10 дни после каждого заражения, а затем один раз каждый месяц.
Выделение и культурирование одноядерных клеток периферической крови. МКПК были выделены у экспериментальных козлят с использованием стандартных методик. Вкратце, 10-15 мл периферической крови собирали из яремной вены в ЭДТА вакуумированные пробирки (Becton Dickinson and Co, Franklin Lakes, NJ). Лимфоциты отделяли дифференциальным центрифугированием с использованием Histopaque 1,077 (Sigma-Aldrich, St. Louis, MO). Мононуклеарные клетки промывали три раза фосфатно-солевым буфером (ФСБ, pH 7,2). Промытый клеточный осадок суспендировали в ФСБ и анализировали на жизнеспособность после окрашивания 0,4% трипановым синим. Лимфоциты вновь суспендировали в среде RPMI-1640, содержащей 10% эмбриональной телячьей сыворотки (Gibco, Grand Island, NY), 2 мМ L-глутамина, 100 мМ HEPES, 100 МЕ/мл пеницилина, 100 мкг/мл стрептомицина и 50 мкг/мл гентамицина (Gibco), до конечной концентрации 2×106 жизнеспособных клеток/мл. Клетки засеивали (200 мкл/лунку) на 96-луночные кругло- или плоскодонные микропланшеты, в зависимости от типа эксперимента.
Исследование пролиферации лимфоцитов. Исследование пролиферации лимфоцитов выполняли с использованием стандартных методик. Вкратце, МКПК в 96-луночных плоскодонных микропланшетах инкубировали при 37°C в увлажненной атмосфере 5% CO2 и стимулировали каждым из четырех очищенных рекомбинантных антигенов (10 мкг/мл), конковалином A (КонА; 10 мкг/мл, Sigma-Aldrich, St. Louis, MO) и очищенным белковым производным (туберкулин; 10 мкг/мл, DBL, National Veterinary Services Laboratory, Ames, IA) в течение 72 часов. Синтез ДНК в стимулированных и нестимулированных контрольных клетках измеряли путем введения бромдеоксиуридина (BrdU) с помощью BrdU колориметрического набора для иммуноферментного анализа (Cell proliferation ELISA, BrdU colorimetric kit) (Roche Diagnostics, Indianapolis, IN) в соответствии с инструкциями производителя. Вкратце, клетки метили в течение 2 ч 10 мкл BrdU раствора для нанесения метки. Добавили анти-BrdU антитело, меченное пероксидазой, и инкубировали в течение 90 мин. Затем добавили раствор субстрата фермента и инкубировали при комнатной температуре 15 мин. Ферментативную реакцию останавливали 1 M H2SO4, и считывали оптическую плотность (OD) при 450 нм, используя ELX 808 Ultra микропланшет-ридер (Bio-Tek Instruments, Inc, Winooski, VT). Тесты проводили в триплете, и результаты выражали как средний индекс стимулирования (SI), рассчитанный как соотношение между средней OD клеток, культурированных с антигенами и средней OD клеток, культурированных без антигенов.
ИФН-γ исследование. Уровни γ-интерферона определяли в кондиционированных супернатантах МКПК с использованием ИФА-метода двойного связывания с использованием моноклональных антител (BOVIGAM; Biocor Animal Health, Omaha, NE), как указано в инструкции производителя. Планшеты считывали при 450 нм с использованием ELX 808 Ultra микропланшет-ридера (Bio-Tek Instruments, Inc). Результаты интерпретировали, сравнивая оптическую плотность (OD) отрицательного и положительного контроля. Результаты определялись либо как положительные (если OD был больше, чем для положительного контроля) либо как отрицательные (OD был меньше, чем для положительного контроля), относительно граничных значений, как предлагается производителем.
Проточный цитометрический анализ лимфоцитарных маркеров.
Был проведен одноцветный проточный цитометрический анализ поверхностных дифференцировочных антигенов лимфоцитов с использованием специфичных для козлят моноклональных антител (CD2-MUC2A; CD4-17D-lgG1; CD4-GCIAI-lgG2a; CD8-CACT80C-lgG1; CD8-7C2B-lgG2a; CD25-CACT116A-lgG1; CD45RO-ILA116A-lgG3; γδSTCR alpha chain specific lgG2b-GB21 AI; ACTI-CACT7A-lgM; ACT16-GB110A-lgM) (VMRD, Inc, Pullman, WA) в соответствии со стандартными протоколами. Вкратце, клетки промывали три раза в буфере клеточного сортера с активацией флуоресценции (FACS) и инкубировали с первичным антителом, предварительно оттитрованным на оптимальную реактивность в течение 30 мин при 4°C. Вслед за этим образцы три раза промывали и инкубировали с антимышиным иммуноглобулином, меченным флуоресцеин изотиоцианатом (Vector Laboratories, Burlingame, СА), 30 минут при 4°C. Клетки трижды промывали FACS буфером и суспендировали в 100 мкл 3% нейтрального буферного формалина в ФСБ. Наконец, клетки перенесли в FACS пробирку и довели объем до 500 мкл с помощью ФСБ перед измерением с использованием FACS откалиброванного проточного цитомера (Becton Dickinson, San Jose, СА). Данные собирались для 5,000-10,000 событий и анализировались с использованием программы Cellquest.
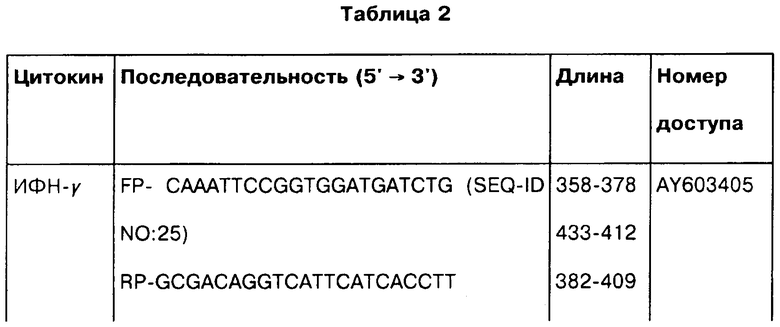
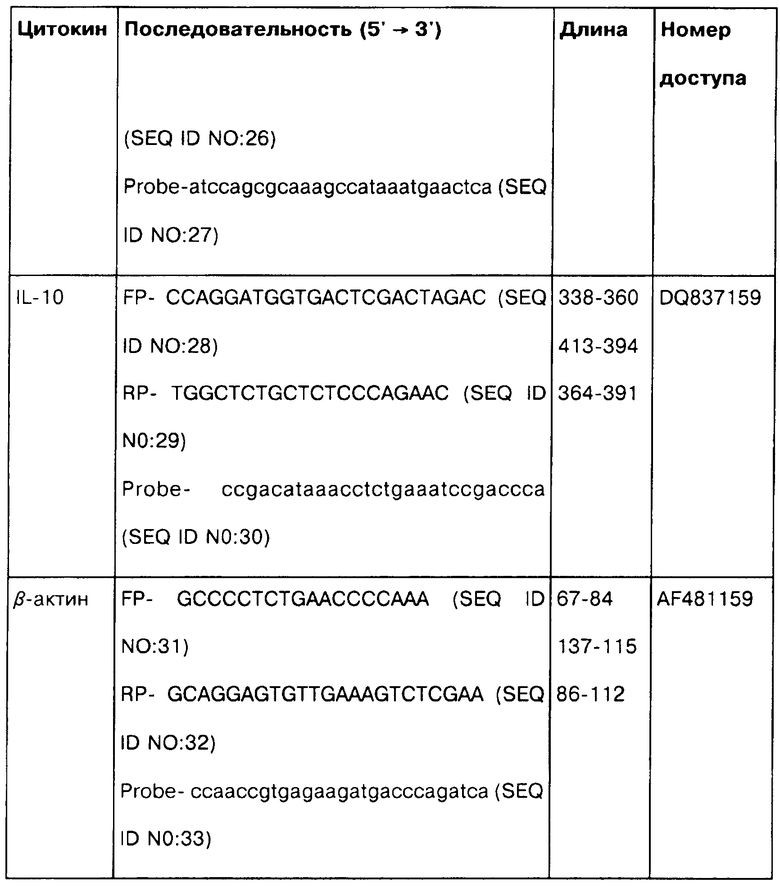
Количественный ПЦР в реальном времени для анализа экспрессии цитокиновых генов. Выделение тотальной РНК, синтез кДНК и количественную ПЦР в реальном времени проводили в соответствии со стандартными методиками. Вкратце, РНК выделяли из лизированных МКПК с использованием RNeasy mini Kit (Qiagen, Valencia, CA). Выделенные образцы РНК обрабатывали 10 E/мкл ДНКазой I, не содержащей РНКазы (Qiagen) при 37°C в течение 10 мин, а затем термически инактивировали при 95°C в течение 5 мин, после чего охлаждали на льду. Обратная транскрипция образцов РНК была выполнена в реакционном объеме 20 мкл (1,6 мкл общей РНК, 200 Е Superscript II обратной транскриптазы от Invitrogen, 50 мМ Трис-HCl, 75 мМ KCl, 3 мМ MgCl2, 0,01 M дитиотреитола и 0,6 мМ dNTP) при 42°С в течение 50 мин, а затем инактивировалась при 70°C в течение 15 мин. Пробы и праймеры для количественной ПЦР в реальном времени конструировали по программе Primer Express (Applied Biosystems, Foster city, СА) с использованием бычьего бета-актина и последовательностей гена цитокина, полученного из GenBank. Детальное описание проб и праймеров, используемых в данном исследовании, представлено в Таблице 2.
Образцы были мечены флуоресцентной меткой, 6-карбоксифлуоресцеином (FAM) по 5' концу и гасителем флуоресценции, N',N',N',N',N'-6-карбокситетраметилродамином (TAMRA) по 3' концу. ПЦР проводили в реакционном объеме 25 мкл с 10 мкл разбавленной кДНК, концентрацией праймеров 400 нМ, 80 нМ пробы TaqMan (Integrated DNA Technologies, Inc., Coralville, IO) и универсальной мастер-смесью ПЦР (Applied Biosystems), содержащим 10 мМ Трис-HCl (pH 8,3), 50 мМ KCl, 5 мМ MgCl2, 2,5 мМ концентрацию дезоксинуклеотидтрифосфатов, 0,625 Е AmpliTaq Gold ДНК полимеразы и 0,25 E AmpErase урацил-N-гликозилазы на реакцию. Образцы в повторе находились в 96-луночном микропланшете и амплифицировались в автоматическом флуориметре (7700 Sequence Detector, Applied Biosystems). Условия ПЦР были следующими: 2 мин при 50°C и 10 мин при 95°C, а затем 40 циклов при 95°C в течение 15 сек и 60°C в течение 1 мин. Количественная оценка была сделана с использованием сравнительного метода пороговых циклов и выражалась в виде относительной транскрипции или кратности n-раз по сравнению с калибровочной кДНК.
Иммунный ответ на рекомбинантные антитела. Иммунные ответы на четыре рекомбинантных антигена, КонА и туберкулин оценивались с помощью ИФА в соответствии со стандартным протоколом. Непрямой ИФА проводили в 96-луночных плоскодонных планшетах с нанесенными 100 мкл каждого из антигенов, держали при 4°C в течение ночи и три раза промывали ФСБ, содержащим 0,05% Tween 20 (ФСБ-Т). Несвязанные сайты блокировали 5% снятым молоком в ФСБ-Т при 37°C в течение одного часа и дважды промывали ФСБ-Т. В каждую лунку добавили 100 мкл разбавленного 1:25,000 конъюгированного с пероксидазой хрена антимышиного иммуноглобулина G (Sigma) и инкубировали при 37°C один час. Планшеты три раза промыли ФСБ-Т и в каждую лунку добавили 200 мкл 2,2'-азинобис-тиазолин-6-сульфоновой кислоты (Sigma). Планшеты инкубировали при 37°C в течение 30 мин в темноте, а затем добавили стоп-раствор (1 M HCl), и три раза считывали при 405 нм с 2 мин интервалом с использованием микропланшет-ридера (BioTEK Instruments, Inc, Winooski, VT). В каждый планшет включались подходящие положительные и отрицательные сыворотки и антиген, и контрольные антитела.
Посевы на MAP фекалий и органов. После заражения были сделаны попытки выделить MAP организмы из фекалий с использованием яично-желточной среды (Herald's egg yolk (HEY), Becton, Dickinson and Co. Sparks, MD) в соответствии со стандартными протоколами. Образцы фекалия были отобраны у всех животных на 2, 4, 6, 8 и 10 дни после заражения, а затем каждый месяц, для посева на MAP. Аналогично, 23 образца тканей были взяты у каждого из 24 животных при некропсии и также исследованы на MAP с помощью посевов. Посевы проводили в Бактериологическом отделении в Cornell Animal Health Diagnostic center, слепым методом.
Перекрестная патология и гистопатологическое исследование. Все козлята были умерщвлены на 38 неделе после первичной вакцинации, и было выполнено вскрытие. У каждого животного было взято 23 образца тканей, которые включали селезенку, миндалины, мезеньеричные лимфатические узлы (3), мандибулярные лимфатические узлы, илеоцекальные лимфатические узлы, печеночные лимфатические узлы, двенадцатиперстную кишку (восходящую и нисходящую), тонкую кишку (3 участка через приблизительно равные интервалы от проксимального до дистального конца), подвздошную кишку (2 участка на проксимальном конце, 2 участка в середине подвздошной кишки, 2 участка на дистальном конце), вход в слепую кишку, слепую кишку и спираль толстой кишки, которые были взяты во время вскрытия. Собранные ткани фиксировали погружением в 10% нейтральный буферный формалин, запаивали в парафин, делали срезы толщиной 4 мкм и окрашивали гематоксилином и эозином с помощью стандартных гистологических методик. Срезы были исследованы сертифицированным ветеринарным патологоанатомом, который не имел представления о вакцинированной группе.
Статистический анализ. Данные были статистически обработаны с использованием программы Excel. Расхождение между группами и индивидуальными антигенами анализировали однофакторным дисперсионным анализом с последующим критерием множественных сравнений Тьюки-Крамера или критерием Стьюдента. Расхождения считались значимыми, когда были получены значения вероятности менее 0,05. С помощью материалов и методов, изложенных в данном Примере, были получены следующие результаты.
Лимфопролиферативный ответ на антигены: Хотя антигенспецифические лимфопролиферативные ответы были обнаружены на 6 неделе после первичной вакцинации (APV), ответы были существенно выше (P<0,05) в обеих вакцинированных группах (I и II) по сравнению с невакцинированной контрольной группой (III) на 10 неделе после первичной вакцинации APV (Фиг.16-18). Тем не менее, не было обнаружено существенного различия в ответах между различными исследуемыми антигенами.
Антигенспецифичные ИФН-γ ответы: Были обнаружены существенные различия (P<0,01) в ИФН-γ ответах между вакцинированными и контрольными животными на 6 и 10 неделях после первичной вакцинации (Фиг.19-21). У вакцинированных животных наилучший ответ был зафиксирован для Map74F. ИФН-γ ответы были значительно выше (Р<0,05) для антигенов 85А и Map74F в группе животных I по сравнению с группой животных II на 10 неделе APV. Однако, не было найдено существенного различия между другими исследуемыми рекомбинантными генами. Хотя уровни ИФН-γ, специфичные к рекомбинантным антигенам, уменьшался с 18 недели до 38 недели после первичной вакцинации, они оставались значительно выше (P<0,05) у вакцинированных животных по сравнению с контролем.
Распределение суб-популяции лимфоцитов в ответ на рекомбинантные антигены: Субпопуляция антигенстимулированных лимфоцитов изучалась на различия в их долях методом поточной цитометрии. Наблюдалось существенное (P<0,01) увеличение CD4+lgGI, CD4+lgG2a, CD8+lgGI, CD8+lgG2a клеточных подтипов в иммунизированных группах по сравнению с контрольной группой (Фиг.22-25). Увеличение начиналось на 6 неделе после первичной вакцинации и продолжалось на протяжении всего эксперимента до 38 недели после первичной вакцинации. Популяции Т клеток, CD4+ and CD8+, специфичные к рекомбинантным антигенам, были больше у иммунизированных животных, но доля CD4+ клеток была выше, чем доля CD8+ леток. Однако, наблюдалось увеличение, хотя и несущественное, популяции CD8+ T клеток на 26 и 38 неделях после первичной вакцинации. В то время как все рекомбинантные антигены, изучаемые в нашем исследовании увеличивали γδTCR+ клеточную популяцию в обеих вакцинированных группах по сравнению с контрольными животными, увеличение было значительно выше (P<0,05) для 85A и Map74F антигенов. Опять же, как и в случае CD4+ и CD8+ T клеточных популяций, было отмечено устойчивое увеличение γδTCR+ леточной популяции вплоть до конца эксперимента (Фиг.26). У иммунизированных животных доля антигенспецифичных CD25+ Т клеток была выше для четырех исследуемых рекомбинантных антигенов. Хотя наблюдалась небольшое различие в CD25+ T клеточных ответах между различными изучаемыми антигенами, оно не было существенным.
Экспрессия специфичной мРНКцитокинового гена: Было обнаружено значительное увеличение экспрессии ИФН-γ, специфичного к рекомбинантному антигену, у иммунизированных животных (P<0,01) по сравнению с контрольными животными начиная с 6 недели после первичной вакцинации (Фиг.28). Хотя уровень экспрессии достигал максимума на 10 неделе после первичной вакцинации, вплоть до 38 недели уровень оставался значительно более высоким у иммунизированных животных по сравнению с контрольными животными. Напротив, не было обнаружено никакого существенного различия в экспрессии IL-10 между иммунизированными и контрольными животными ни в одной временной точке нашего исследования, за исключением общего увеличения уровня экспрессии IL-10 на 26-38 неделях после первичной вакцинации во всех трех группах (Фиг.29).
Иммунный ответ, специфичный к рекомбинантному антигену: Все четыре рекомбинантных антигена, изученные в настоящем изобретении, вызывали устойчивый иммунный ответ в обеих вакцинированных группах. Ответы были значительно выше (P<0,01) в вакцинированных группах по сравнению с контрольной группой начиная с шестой недели APV вплоть до окончания эксперимента (Фиг.30). Не было обнаружено никаких существенных различий в иммунных ответах между различными применяемыми рекомбинантными антигенами.
Гистопатология тканей, отобранных во время некропсии:
Гистопатологическое исследование тканей, отобранных от каждого животного во время некропсии, указывает, что 75% невакцинированных контрольных животных (Группа III) имела гранулемы по крайней мере в одной ткани, в то время как среди животных групп I и II только 25 и 50% животных, соответственно, имели гранулемы. Гранулемы были найдены в брыжеечном лимфатическом узле и тонкой кишке животного 1 и илеоцекальном лимфатическом узле другого животного из Группы I. В отличие от этого, гранулемы в группах II и III были локализованы в первую очередь в подвздошной кишке, илеоцекальном соединении или в слепой кишке, в то время как илеоцекальный лимфатический узел был затронут у 5 животных из этих двух групп. Не было найдено ни одной гранулемы в двенадцатиперстной кишке, и только 2 животных, одно из Группы I и одно из Группы III, имело гранулемы в тонкой кишке. Другие поврежденные ткани включали соединение слепой кишки и печеночные лимфатические узлы у двух невакцинированных контрольных животных из Группы III.
Нагрузка MAP в тканях после заражения: нагрузка MAP в 23 тканях, отобранных у каждого животного во время некроскопии, оценивалась с помощью бактериального посева (Фиг.31). Среди вакцинированных животных только одно животное в группе I показало положительный результат при посеве с очень низким KOE. В группе II, хотя 5 из 8 животных были позитивными к MAP, бактериальная нагрузка была очень низкой у четырех из пяти животных (менее 5), из которых выделяли MAP. В невакцинированной группе III, все девять животных были позитивными к MAP, при этом большинство животных имели по крайней мере 5 тканей, позитивных к MAP с более 300 KOE (слишком много для подсчета).
Как видно из вышеизложенного, в данном примере оценивалось защитное действие рекомбинантных антигенов 85А, 85 В, СОД и Map74F в модели на козлятах. Поскольку MAP представляет собой внутриклеточный организм, представляется, что ТЫ ответ, который опосредуется сенсибилизированными T-клетками и, в частности, γ-интерфероном, вырабатываемым сенсибилизированными T-клетками, играет существенную роль в защите. Среди различных методов исследования, измерение ответа в пролиферации лимфоцитов на специфический исследуемый антиген представляет собой широко применимый способ определения клеточного иммунного ответа. Продемонстрировано определение пролиферации лимфоцитов, специфичных к рекомбинантному антигену, три недели спустя повторной вакцинации, которая была существенно выше в вакцинированной группе после заражения по сравнению с контролем, что указывает на проявление антигенспецифического клеточного иммунитета.
К-Интерферон представляет собой один из основных цитокиновых генов, активируемых в ответ на MAP инфекцию у крупного рогатого скота. Кроме того, главный комплекс гистосовместимости класса I, ограниченный CD8+ T клетками, которые вырабатывают такие цитокины, как ИФН-γ, требуется для сопротивляемости другим микобактериальным инфекциям, таким как М. tuberculosis. В данном примере, опосредуемый Map74F ИФН-γ ответ был обнаружен после вторичной вакцинации и заражения. Не желая привязываться к какой-либо теории, предполагается, что повышенный ИФН-γ мог играть важную роль в защитном иммунитете козлят после заражения живыми MAP_ с помощью опосредованной ИФН-γ передачей сигнала макрофага.
Результаты, представленные в данном примере, также показывают более высокий CD4+ и CD8+ T клеточный ответу иммунизированных животных. Результаты также подтверждают вклад CD4+ T клеток в периферический уровень γ-интерферона и пролиферативный ответ после иммунизации рекомбинантными антигенами. CD25 экспрессируется активированными Т-клетками. Наши результаты явно указывают на рост активированных Т-клетоку вакцинированныхживотных. Хотя популяция γδTCR+ клеток остается относительно небольшой по сравнению с CD4 + и CD8+ T клетками, она значительно выше (P<0,05) у иммунизированных животных по сравнению с контрольными животными. CD4+ T клеточный эффекторный механизм связан с выработкой γ-интерферона, который активирует бактерицидную активность в макрофагах, лимфотоксине, перфорине и гранулизине. CD8+ и γδ+ T клетки также вырабатывают гранулизин. Это согласуется с результатами раскрытых здесь исследований по заражению и подтверждает защитное действие указанных рекомбинантных антигенов. Повышенный уровень экспрессии мРНК γ-интерферона ясно указывает на то, что существует определенный антигенспецифический Th1 ответ у иммунизированных животных, который подтверждается незначительным уровнем экспрессии Th2 специфического IL-10.
Наряду с лимфопролиферативным ответом, γ-интерферон ответом, CD4+T и CD8+T клеточным ответом показаны доказательства существенного Th1 ответа в иммунизированных группах. Были проанализированы результаты экспериментов по заражению для того, чтобы оценить защитное действие рекомбинантных антигенов у козлят. Считается, что в отсутствии характерных клинических симптомов, гистопатология и бактериальная нагрузка на ткани, собранные во время некропсии, являются наилучшими стандартами для оценки защитного действия вакцинации MAP. Было собрано 23 вида тканей у каждого из 25 животных и проанализированы ткани на гистопатологические изменения и нагрузку MAP с помощью посевов. Наблюдалось значительное уменьшение числа животных и тканей с повреждениями в группе, получавшей рекомбинантные антигены и ДДА, что указывало на защитное действие.
Выделение MAP в посеве представляет собой наиболее чувствительный метод определения MAP в тканях, по сравнению как с кислотоустойчивым окрашиванием, так и микроскопическим исследованием, особенно во время ранней фазы инфекции. Однако, распределение гранулематозных повреждений в целом отражает результаты посевов MAP. Результаты посева MAP, представленные в данном примере, ясно показывают защитное действие четырех применяемых рекомбинантных антигенов. Защита была почти полной, когда антигены давались вместе с ДДА. MAP излечивался только у одного из восьми животных из этой группы (I), и это животное имело значительно более низкий потенциал MAP только в одной позитивной ткани, а именно, в дистальной подвздошной кишке. Применение антигенов без вспомогательных веществ показало защитное действие, хотя эффективность защитного действия была несколько меньшей, когда антигены применялись без вспомогательного вещества. Это можно наблюдать из результатов посевов животных группы II, которые получали антигены без вспомогательного вещества. Хотя 5/8 животных были позитивными на MAP, бактериальная нагрузка была у этих животных значительно ниже по сравнению с контрольной группой животных III, указывая на защитную природу антигенов даже без вспомогательного вещества. Значительно более высокий показатель MAP был найден у всех животных невакцинированной контрольной группы, что вновь указывает на защитное действие антигенов. Иммунизация козлят рекомбинантными антигенами привела к устойчивому иммунному ответу на протяжении продолжительного периода. Результаты, представленные в данном Примере, таким образом, указывают на то, что рекомбинантные антигены стимулируют как опосредованную клеточную, так и гуморальную иммунную системы. После вторичной вакцинации, значительное усиление иммунного ответа было обнаружено для всех рекомбинантных антигенов в обеих вакцинированных группах по сравнению с невакцинированной контрольной группой. Ответ имеет тенденцию быть выше в группе животных I, которые получали антигены со вспомогательной добавкой, хотя и незначительно. Раннее появление реактивности клеточно-опосредованного иммунитета (CMI) после серологической конверсии является постоянным признаком микобактериальных инфекций у жвачных животных. Однако, наши многокомпонентные субъединицы, использованные в данном Примере, придают существенную защиту в смысле уменьшения бактериальной нагрузки на целевые органы по сравнению с ложноиммунизированными козлятами.
Настоящее изобретение не ограничивается рамками конкретных вариантов осуществления, описанных в заявке. В действительности, из вышеизложенного описания специалисту в данной области будут очевидны различные модификации изобретения помимо тех, которые описаны в заявке. Подразумевается, что такие модификации также попадают в рамки прилагаемой формулы изобретения.
Все ссылки, данные в данной заявке, включены в заявку посредством ссылки во всей своей полноте и для всех целей в той же самой степени, как если каждая индивидуальная публикация, патент или заявка на патент упоминалась бы конкретно и индивидуально для внесения посредством ссылки во всей своей полноте и для всех целей.
Цитирование любых публикаций приводится для раскрытия их сущности перед датой подачи заявки и не должно рассматриваться как признание того, что настоящее изобретение дает право датировать задним числом такую публикацию в соответствии с предыдущим изобретением.
| название | год | авторы | номер документа |
|---|---|---|---|
| ЛЕЧЕНИЕ, ДИАГНОСТИКА ИЛИ ПРОФИЛАКТИКА ЛЕЙШМАНИОЗА, ВЫЗВАННОГО РАЗЛИЧНЫМИ ВИДАМИ ПАРАЗИТОВ, КРОМЕ ВИДА, ИЗ КОТОРОГО ПОЛУЧЕНЫ ГИСТОНЫ, С ИСПОЛЬЗОВАНИЕМ ВСЕХ ЧЕТЫРЕХ ГИСТОНОВ H2A, H2B, H3 И H4, ВЫДЕЛЕННЫХ ИЗ LEISHMANIA INFANTUM С ИСПОЛЬЗОВАНИЕМ ВЕКТОРА, СОДЕРЖАЩЕГО НУКЛЕОТИДЫ, КОДИРУЮЩИЕ УКАЗАННЫЕ ГИСТОНЫ | 2004 |
|
RU2380710C2 |
| РЕКОМБИНАНТНЫЙ БЕЛОК, НЕСУЩИЙ ЭПИТОПЫ ВИРУСА ПАПИЛЛОМЫ ЧЕЛОВЕКА, ВСТРОЕННЫЕ В БЕЛОК АДЕНИЛАТЦИКЛАЗУ ИЛИ ЕГО ФРАГМЕНТ, ЕГО ТЕРАПЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2005 |
|
RU2441022C2 |
| СРЕДСТВА И СПОСОБЫ ЛЕЧЕНИЯ ВИРУСА ГЕПАТИТА B | 2017 |
|
RU2740802C2 |
| ВАКЦИНЫ ПРОТИВ ВИРУСА ПРОСТОГО ГЕРПЕСА 2 ТИПА: КОМПОЗИЦИИ И СПОСОБЫ ЗАПУСКА ИММУННОГО ОТВЕТА | 2010 |
|
RU2585961C9 |
| РЕКОМБИНАНТНЫЕ ШТАММЫ ВИРУСА ГРИППА, ЭКСПРЕССИРУЮЩИЕ МИКОБАКТЕРИАЛЬНЫЙ ПРОТЕКТИВНЫЙ АНТИГЕН ESAT-6, И ИХ ИСПОЛЬЗОВАНИЕ ДЛЯ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ ТУБЕРКУЛЕЗА | 2005 |
|
RU2318872C2 |
| ВАКЦИНА MYCOBACTERIUM TUBERCULOSIS | 2009 |
|
RU2473365C1 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДА pAg85A-CBD, ШТАММ Escherichia coli [pREP4, pAg85A-CBD], ХИМЕРНЫЙ БЕЛОК Ag85A-CBD И ИХ ПРИМЕНЕНИЕ | 2010 |
|
RU2429292C1 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДА, ШТАММ Escherichia coli, ХИМЕРНЫЙ БЕЛОК И ИХ ПРИМЕНЕНИЕ | 2010 |
|
RU2422525C1 |
| Мутантные полимеразы вируса гепатита В | 2012 |
|
RU2625021C2 |
| ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ ДЛЯ ТЕРАПЕВТИЧЕСКОГО ПРИМЕНЕНИЯ | 2004 |
|
RU2362586C2 |


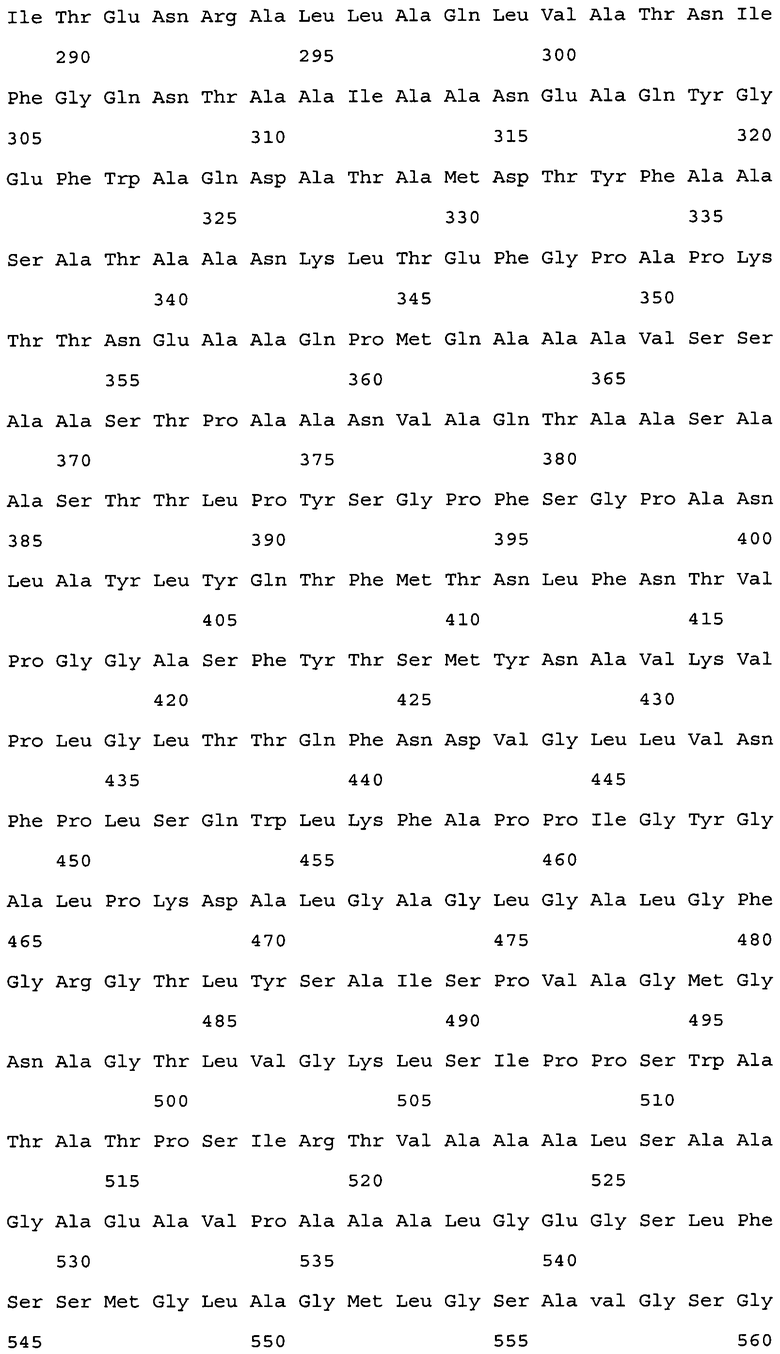
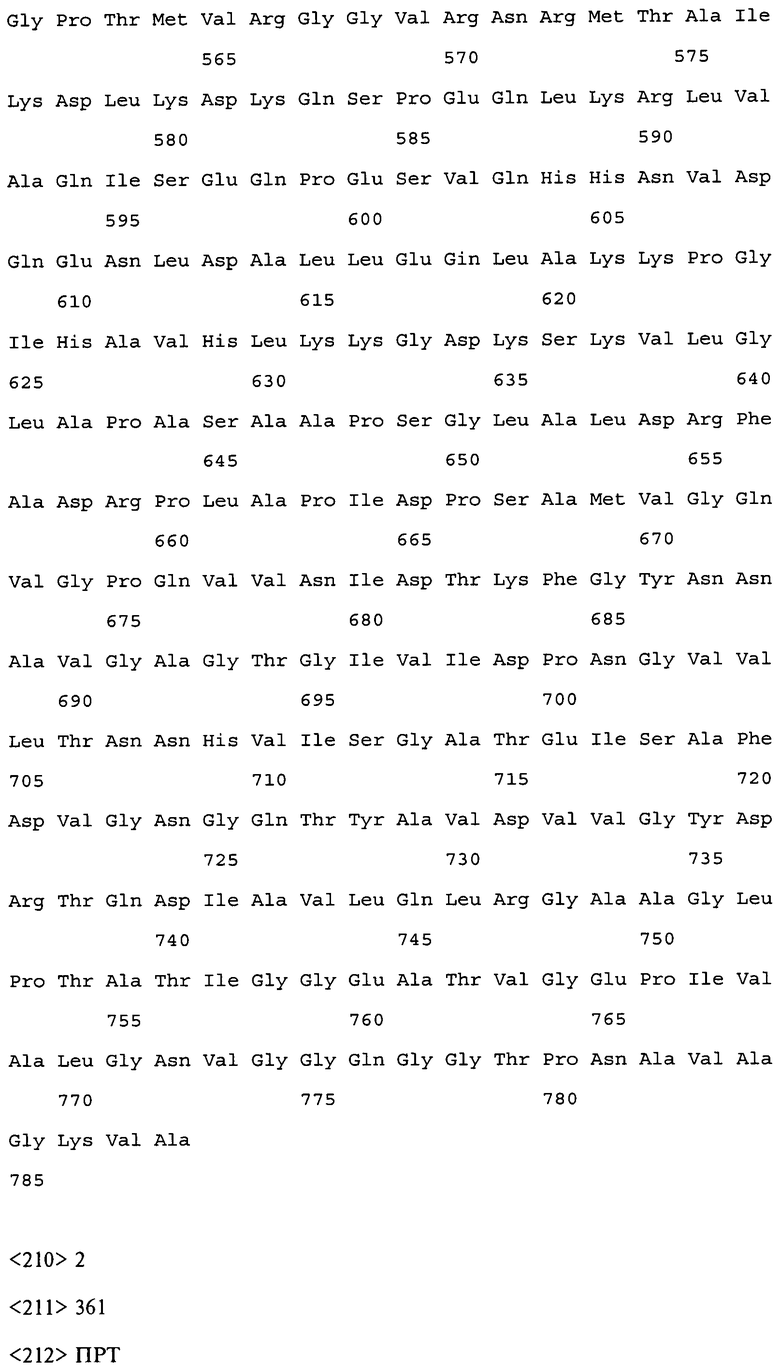


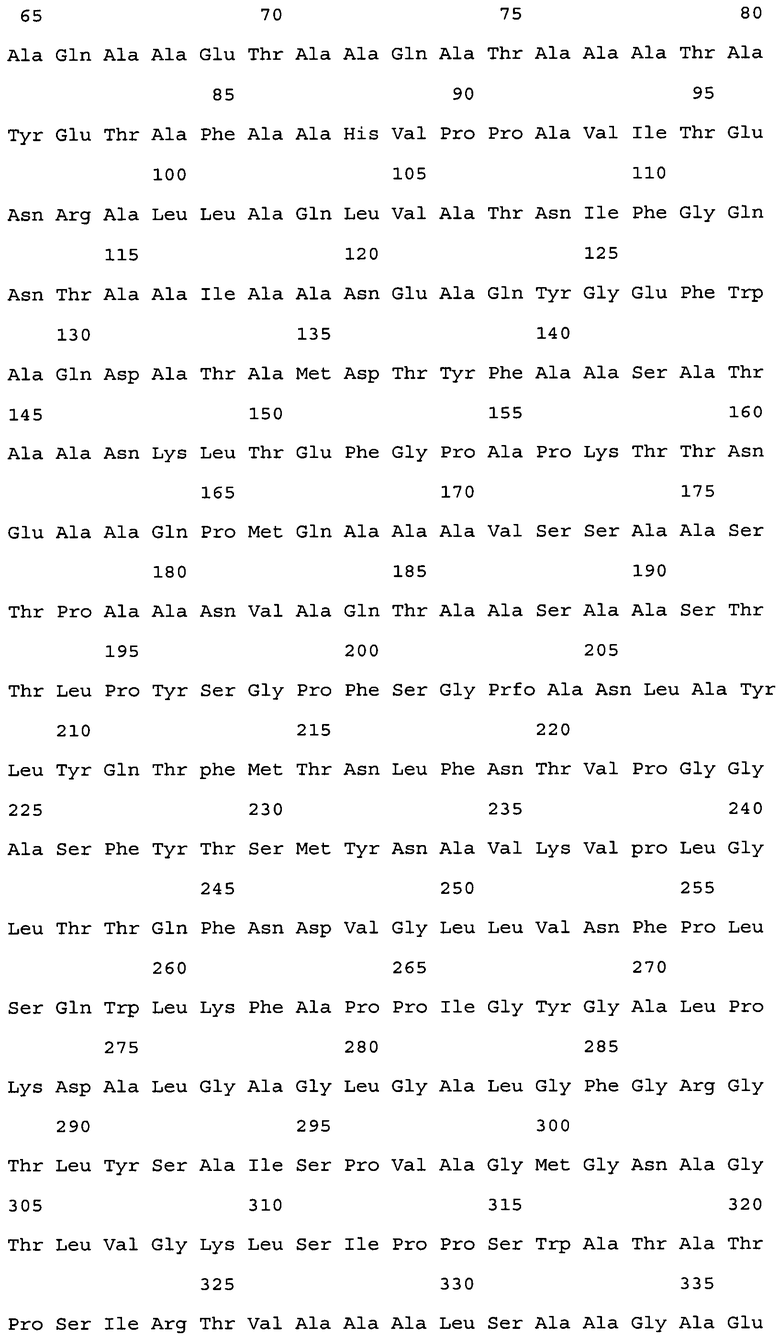

















Группа изобретений относится к медицине и касается фармацевтической композиции и способа стимулирования иммунного ответа против Mycobacterium avium подвида paratuberculosis (MAP) у млекопитающего. Композиция включает рекомбинантный полипептид, содержащий, от N-конца к С-концу: С-концевой фрагмент белка МАР_3527, аминокислотную последовательность белка МАР_1519, а затем N-концевой участок белка МАР_3527. Способ включает введение фармацевтической композиции животным в количествах, достаточных для стимулирования иммунного ответа против MAP. Группа изобретений обеспечивает ликвидацию, либо замедление пролиферации MAP в течение периода инфекции. 2 н. и 16 з.п. ф-лы, 3 пр., 31 ил., 2 табл.
1. Фармацевтическая композиция для стимулирования иммунного ответа к Mycobacterium avium подвида paratuberculosis (MAP) у млекопитающего, включающая рекомбинантный полипептид, содержащий от N-конца к С-концу:
i) С-концевой фрагмент белка МАР_3527, причем указанный С-концевой фрагмент MAP_3527 содержит аминокислоты 183-361 последовательности SEQ ID NO: 2;
ii) последовательность белка МАР_1519, причем указанная последовательность белка МАР_1519 содержит аминокислоты 1-460 последовательности SEQ ID NO: 3; и
iii) N-концевой фрагмент белка МАР_3527, причем указанный N-концевой фрагмент белка МАР_3527 содержит аминокислоты 33-180 последовательности SEQ ID NO: 2.
2. Композиция по п.1, отличающаяся тем, что последовательность белка МАР_1519 содержит аминокислотную последовательность SEQ ID NO: 3.
3. Композиция по п.1, отличающаяся тем, что рекомбинантный белок содержит аминокислотную последовательность SEQ ID NO: 1.
4. Композиция по п.1, отличающаяся тем, что указанная композиция дополнительно содержит вспомогательное вещество.
5. Композиция по п.4, отличающаяся тем, что вспомогательное вещество выбрано из группы, состоящей из монофосфориллипида А (МФЛ), диметилдиоктадециламмонийбромида (ДДА) и их комбинаций.
6. Композиция по п.1, дополнительно содержащая белок Mycobacterium avium подвида paratuberculosis (MAP), выбранный из группы, состоящей из MAP белка 85А, MAP белка 85В, супероксиддисмутазы (СОД) MAP белка и их комбинаций.
7. Способ стимулирования иммунного ответа к Mycobacterium avium подвида paratuberculosis (MAP) у млекопитающего, включающий введение млекопитающему композиции по п.1, стимулирующей иммунный ответ к Mycobacterium avium подвида paratuberculosis (MAP) у млекопитающего.
8. Способ по п.7, отличающийся тем, что композиция дополнительно содержит вспомогательное вещество.
9. Способ по п.8, отличающийся тем, что вспомогательное вещество выбрано из группы, состоящей из монофосфориллипида А (МФА) и диметилдиоктадециламмонийбромида (ДДА).
10. Способ по п.7, отличающийся тем, что млекопитающее представляет собой жвачное животное, и указанную композицию вводят указанному жвачному животному.
11. Способ по п.10, отличающийся тем, что жвачное животное представляет собой крупный рогатый скот, овцу, козу, оленя или лося.
12. Способ по п.11, отличающийся тем, что жвачное животное представляет собой крупный рогатый скот.
13. Способ по п.10, отличающийся тем, что жвачное животное является не инфицированным MAP.
14. Способ по п.10, отличающийся тем, что жвачное животное является инфицированным MAP.
15. Способ по п.12, отличающийся тем, что крупный рогатый скот страдает болезнью Джона.
16. Способ по п.7, отличающийся тем, что указанное млекопитающее является беременным.
17. Способ по п.7, отличающийся тем, что композиция дополнительно содержит белок Mycobacterium avium подвида paratuberculosis (MAP), выбранный из группы, состоящей из MAP белка 85А, MAP белка 85В, супероксиддисмутазы (СОД) MAP белка и их комбинаций.
18. Способ по п.7, отличающийся тем, что рекомбинантный белок в указанной композиции содержит последовательность SEQ ID NO: 1.
| Пломбировальные щипцы | 1923 |
|
SU2006A1 |
| Li L., et al | |||
| "The complete genome sequence of Mycobacterium avium subspecies paratuberculosis." Proc Natl Acad Sci USA | |||
| Способ обработки целлюлозных материалов, с целью тонкого измельчения или переведения в коллоидальный раствор | 1923 |
|
SU2005A1 |
| Способ обработки целлюлозных материалов, с целью тонкого измельчения или переведения в коллоидальный раствор | 1923 |
|
SU2005A1 |
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
| N,N'-ЗАМЕЩЕННЫЕ ИМИДОКАРБОНИМИДНЫЕ ДИАМИДЫ, ПРОФИЛАКТИЧЕСКАЯ КОМПОЗИЦИЯ, КОМПОЗИЦИЯ ДЛЯ СНИЖЕНИЯ УРОВНЯ ИНФЕКЦИИ | 1993 |
|
RU2133737C1 |
Авторы
Даты
2013-08-10—Публикация
2008-10-09—Подача