Изобретение относится к водной токсикологии и токсикогенетике и может быть использовано для оценки генотоксических эффектов водорастворимых соединений, в частности для оценки экологогигиенического состояния водоемов, испытывающих постоянное воздействие промышленных сточных вод и их растворимых компонентов, по комплексу количественных показателей токсичности и мутагенности, для определения специфичности мутагенного действия и обоснования выбора лимитирующего фактора вредности.
Известен способ оценки токсичности тяжелых металлов [Малева М.Г., Некрасова Г.Ф., Безель B.C. Реакция гидрофитов на загрязнение среды тяжелыми металлами. - Экология. - 2004. - №4. - С.266-272.]. Способ основан на определении накопительной возможности гидрофитов, подвергшихся действию тяжелых металлов, на оценке пигментного комплекса и интенсивности фотосинтеза.
Существенным недостатком данного способа является отсутствие оценки генетических эффектов тяжелых металлов.
Известен способ оценки действия ядохимикатов по фенетической изменчивости элитр колорадских жуков [Леонтьев В.В, Хрусталева Т.А., Иванова Е.Е. Полиморфизм колорадского жука (Leptinotarsa decemlineaya Say) как индикатор состояния среды. - Естествознание и гуманизм. Сб. научн. работ. Томск. - Т.2. - №1. - 2005. С.107-108]. Способ основан на анализе характера расположения полос на надкрыльях жуков, собранных в некоторых районах Татарстана и Удмуртии, где были применены различные ядохимикаты.
Существенным недостатком этого метода является отсутствие критериев оценки действия ядохимикатов.
Известен способ определения мутагенной активности жидких отходов производства с использованием тест-системы, разработанной на сое (Glycine max (L.) Merill) [Биттуева М.М., Абилев С.К. Мутагенная активность жидких стоков Тырныаузского горно-обогатительного комбината в Кабардино-Балкарии. - Естествознание и гуманизм. Сб. научн. работ. Томск. - Т.2. - №1. - 2005. - С.120.]. Способ основан на учете и анализе различных типов пятен, появляющихся на листьях растений (линии Т-219, L 65-1237 и L-72-1937), выросших из семян, обработанных мутагенами.
Существенным недостатком этого способа является оценка тестируемого агента по качественным, а не количественным показателям, отсутствие критериальной оценки уровня мутагенности и сложность проведения экспериментов. Последнее связано с необходимостью использовать семена растений определенных линий и их проращиванием.
Известен способ регистрации морфологических изменений у хирономид [Ильяшук Б.П., Ильяшук Е.А., Даувальтер В.А., Каган Л.Я. Закономерности развития экологического кризиса в гидроэкосистеме, подверженной многолетнему влиянию загрязняющих веществ горно-металлургического производства. - Институт проблем промышленной экологии Севера, Кольский НЦ РАН, г.Апатиты. http://www.kolasc.net.ru/mssian/innovation/ksc70.html]. Способ основан на наблюдениях за хирономидами из природного водоема. Обнаружены хирономиды с морфологическими изменениями, выражающимися в деформации элементов ротового аппарата, в частности, субментума.
Недостатком данного способа является отсутствие критериев оценки токсичности и мутагенности по анализируемым признакам.
Известны исследования Каспийского филиала Института Океанологии РАН по исследованию состояния поисково-оценочных скважин [http://caspian.by.ru/Issledovania.shtml]. Обнаружены аномалии в строении конечностей (уроподы III) у Dikerogammarus haemobaphes (ракообразные). Авторы связывают выявленные морфологические изменения с неустановленными неблагоприятными факторами, приводящими к повышенной мутагенности.
Недостатком этих исследований является сложность в анализе генезиса этих отклонений, не систематичности исследований, отсутствии критериев оценки воздействия изучаемых факторов.
Известен способ оценки генотоксических эффектов химических веществ, разработанный на использовании клеток крови рыб Carasius auratus gibelio [Веголяс М.Р. Оценка цитогенетических проявлений нестабильности геномов у рыб Carasius auratus gibelio при влиянии тяжелых металлов. - Современные фундаментальные проблемы гидрохимии и мониторинга качества поверхностных вод России (материалы научно-практической конференции с международным участием). - Ч.2 - Ростов-на-Дону, 2009. - С.126-129.]. Способ основан на изучении крови рыб: ядер эритроцитов. В результате микроскопирования регистрируют различные аномалии ядер.
Недостатком этого способа является отсутствие критериев оценки токсичности и мутагенности по анализируемым признакам, полученные результаты не предоставляют возможности прогнозировать отдаленные генетические последствия.
Наиболее близким к изобретению по технической сущности и достигаемому результату является «Способ оценки токсичности водных сред» [А.С. №1234770 (СССР). Заявл. 25.06.84, №3765741/23-26; МКИ G01N 33/18 // С02А 3/34. Павленко В.В., Денисова Т.П. - Опубл. 30.05.86, Бюл. №20]. Способ оценивает токсические и генетические эффекты водных растворов на дафниях, учитывая гибель и плодовитость особей в исходном и втором поколениях, а также появление морфологически измененных особей.
Недостатком данного способа является использование несинхронизированной культуры дафний, вследствие чего получаемые результаты имеют выраженную гетерогенность. Кроме того уровень генотоксической активности сравнивают только с контролем (вода), что не дает возможности оценивать их активность в сравнении с эталонными токсикантами и мутагенами на основе изоэффективных концентраций; не разработаны оценочные шкалы, а при расчете показателей мутагенности не учитывают суммарное мутирование: индуцированное и спонтанное. Не дифференцирована оценка мутагенности по видам мутаций, что не позволяет оценивать специфичность мутагенного действия. Не проводится сопоставление величин показателей токсического и мутагенного действия агента, что не позволяет обосновать лимитирующий показатель вредности в диапазоне действующих концентраций с учетом специфичности выявленного действия.
Задачей предлагаемого изобретения является разработка способа комплексной оценки токсичности и мутагенности водных сред, повышающего точность оценки генетических эффектов, индуцированных исследуемыми агентами, определяющего специфичность мутагенного действия и лимитирующий показатель вредности.
Поставленная задача решается предлагаемым способом, включающим приготовление опытных проб, получение синхронизированной культуры дафний от одного наиболее плодовитого клона из популяции дафнии, за исключением лабораторной популяции, экспонирование одновозрастных, партеногенетических дафний из синхронизированной культуры параллельно в исследуемом растворе (опыт), в воде (К-контроль), в растворе эталонного токсиканта (Кт +), в растворе эталонном мутагена (Км +), регистрацию физиологического состояния у особей исходного поколения (F0), определение коэффициентов токсичности, а именно коэффициента гибели (L0) и коэффициента плодовитости (Р0), регистрацию физиологического состояния дафний второго поколения (F2), определение суммарной мутагенной активности по формуле &=fоп/fк, где foп - частота появления летальных, сублетальных и морфологических мутаций в опыте, a fк - частота появления летальных, сублетальных и морфологических мутаций в контроле, сравнение ее значения с изоэффективными концентрациями эталонных мутагенов и токсикантов, выделение лимитирующего показателя вредности, установление уровня генотоксической активности на основании полученных результатов.
Способ осуществляется следующим образом.
Используют дафний из любой популяции дафний, за исключением лабораторной популяции. От дафний, используемой популяции, получают синхронизированную двухсуточную тест-культуру одного вымета [Бакаева Е.Н., Никаноров A.M. Гидробионты в оценке качества вод суши. - Наука, М., 2006. - с.106, с.194, с.215-216; Методика определения токсичности воды и водных вытяжек из почв, осадков сточных вод, отходов по смертности и изменению плодовитости дафний. - ФР. 1.39.2007.03222. - Акварос, М., 2007. - стр.9; Строганов Н.С., Колосова Л.В. Ведение лабораторной культуры и определение плодовитости дафний в ряде поколений. - Методики биологических исследований по водной токсикологии. - Наука, 1971. - с.213-214]. Такая тест-культура, обладает достаточной стабильностью и однородностью по генетическим и физиолого-биохимическим свойствам, что позволяет снизить ошибку опыта.
Дафний, из полученной синхронизированной тест-культуры, имеющих нормальный фенотип, экспонируют в водном растворе агента. Приготовление опытной пробы включает растворение вновь исследуемых химических соединений в отстоянной дехлорированной воде в нужных для опытов концентрациях. В случаях исследования сточных вод, различного происхождения, в эксперименты включают при необходимости пробы с различных технологических этапов производства, очищенные неразбавленные и разбавленные сточные воды.
Выживших после экспонирования особей помещают в чистую водную среду.
Параллельно опытным вариантам ставят три контроля. В первом дафний содержат в дехлорированной водопроводной воде (К), во втором - в растворе эталонного токсиканта (Кт +), в третьем - в растворе эталонного мутагена (Км +).
У обработанных дафний (F0) регистрируют гибель и плодовитость выживших особей. Сравнивают показатели гибели обработанных особей, показатели плодовитости выживших особей исходного поколения с соответствующими величинами в контролях (К, Кт + и Км +).
Количественным выражением изменения гибели и плодовитости исходного поколения, индуцированного агентами за счет их токсичности, являются коэффициенты гибели (L0) и плодовитости (P0).
Коэффициент гибели L0 определяют как отношение величины летального эффекта у дафний f0 в опытном варианте к контрольному: 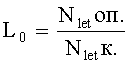
Коэффициент плодовитости P0 определялся отношением величины плодовитости дафний F0 в опытном варианте к соответствующему показателю в контроле: 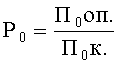
Анализ величин показателей L0 и P0 позволяет сделать заключение о степени выраженности токсической активности агента. Для ее определения используют оценочные шкалы, где величина определяемого показателя коррелирует со степенью активности эталонного токсиканта (таблица 1, 2).
Во втором поколении (F2) учитывают сублетальные, летальные и морфологические мутации, причем, отдельно регистрируют индуцированых (опыт) и спонтанно возникших (контроль-вода) мутантов.
Сублетальные мутации проявляются в гибели дафний F2. Частоту появления сублетальных мутантов рассчитывают по формуле:
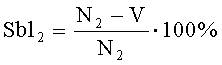
где Sbl2 - частота появления сублетальных мутантов, выявленных за период наблюдений в F2 в опыте (Sbl2-oп.) или в контроле с водой (Sbl2-к);
N2 - количество родившихся особей второго поколения;
V - количество живых особей второго поколения через 480 часов.
Частоту индуцированных сублетальных мутантов (Sbl2-инд.) в опыте рассчитывают по формуле:
Sbl2-инд.=Sbl2-оп.-Sbl2-к.
Летальные мутации проявляются в снижении плодовитости опытных дафний второго поколения за счет спонтанной или индуцированной гибели их потомства на стадии эмбриогенеза. Их появление оценивают по изменению среднесуточной плодовитости (Р2) на одну выжившую самку F2 в контрольном (с водой) (Р2-к.) или в опытном (Р2-оп.) вариантах, которую рассчитывают по формуле:
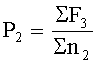
где Σ F3 - суммарное количество потомков, родившихся от особей второго поколения, в опыте (Σ F3-оп) или в контроле (с водой) (Σ F3-к),
Σ n2 - суммарное количество особей F2 в опыте (Σ n2-оп) или в контроле (с водой) (Σ n2-к).
Таким образом, частоту появления индуцированных летальных мутантов в опыте рассчитывают по формуле:
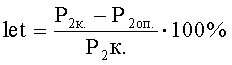
Морфологические мутации прослеживают по фенотипическому разнообразию хитинового покрова особей, изменению строения антенн и антеннул. Частоту появления морфологических мутантов (М) во втором поколении (в опыте и в контроле) рассчитывают по формуле:
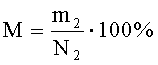
где m2 - количество особей F2 с морфологическими изменениями;
N2 - количество всех родившихся и промикроскопированных особей второго поколения.
Далее определяют суммарную величину выявленных мутантов (сублетальных, летальных и морфологических) в опыте (fоп) и в контроле (с водой) (fк.) по формуле:
f=Sbl2+let+М.
На основании полученных данных рассчитывают коэффициент суммарной мутагенности &, по которому оценивают степень мутагенной активности:
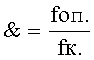
где foп. - суммарная частота появления сублетальных, летальных и морфологических мутантов в опыте,
fк. - суммарная частота появления сублетальных, летальных и морфологических мутантов в контроле (с водой).
Степень генотоксической опасности исследуемых агентов определяют по ранее разработанным шкалам (табл.1-3) [Денисова Т.П. Токсико-генетический подход к санитарно-гигиенической оценке промышленных сточных вод и их химических компонентов. Дис., Иркутск, 2006, с.56, с.58.].
Для определения специфичности мутагенного действия изучаемых агентов используют коэффициенты L2, К2 и µ, демонстрирующие, соответственно, превышение над контролем (К) (или спонтанным уровнем) частоты появления сублетальных, летальных и морфологических мутантов в опыте.
Коэффициент сублетальных мутантов (L2) определяют по отношению частоты появления сублетальных мутантов в опытном варианте к контролю (К):
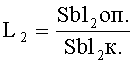
Коэффициент летальных мутантов (К2) определяют по отношению среднесуточной плодовитости особей в опыте к соответствующему контролю (К):
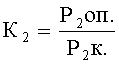
Коэффициент морфологических мутантов (µ) определяют по отношению частоты индуцированных мутаций к контролю (К) (или спонтанному уровню):
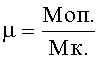
Или
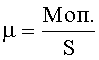
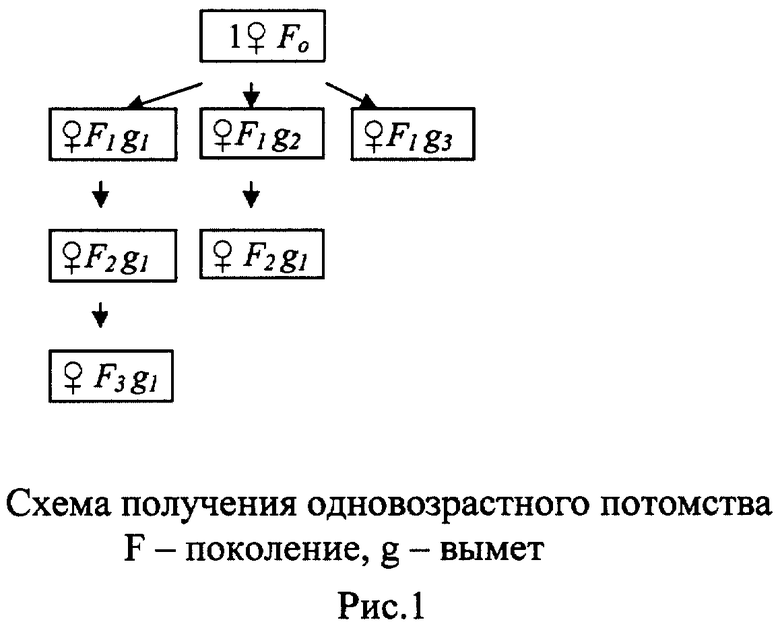
Пример 1. С целью получения синхронизированной культуры популяции любого вида дафний, отличающейся физиологической и генетической однородностью, производят следующие операции. От дафний, взятых из любой популяции, за исключением лабораторной популяции, получают одновозрастное потомство, из которого отбирают 8-10 партеногенетических самок, рассаживают их индивидуально в сосуды с дехлорированной водой. Плотность посадки: 1 особь на 50 мл воды. Через 12-18 дней от каждой из них получают до 300 и более одновозрастных партеногенетических потомков (рисунок 1). Потомки от каждой материнской особи не смешиваются. Для опыта отбирают потомство одного наиболее плодовитого клона.
В качестве примеров в предлагаемом способе использовали дафний из популяций различных водоемов Иркутской области (р.Ангара и Братское водохранилище): Daphnia galeata, Daphnia longispina, Daphnia cristata.
Пример 2. Определяют спонтанную частоту появления морфологических мутаций. Все виды дафний обладают примерно одинаковыми морфологическими признаками: плавательными антеннами, антеннулами, хитиновым покровом, спинальным отростком и т.д. [Мануйлова Е.Ф. Ветвестоусые рачки фауны (Cladocera). - сер. Определители по фауне СССР. - Л., 1965. - №88. - 327 с.; А.В.Иванов, А.С.Мончадский, Ю.И.Полянский, А.А.Стрелков. Большой практикум по зоологии беспозвоночных. - Высшая школа, ч.2 Москва 1983, 543 с.] (рис.2 A).
Многолетние наблюдения позволяют рассчитать спонтанный уровень появления морфологических мутантов в синхронизированной популяции дафний. На предмет изменения морфологических признаков было проанализировано 67 тыс.особей из постоянно поддерживаемой синхронизированной популяции дафний. Среди них было обнаружено 2 особи с измененными антеннами (рис.2, из группы Г-1).
Рассчитанный спонтанный уровень появления дафний с морфологическими изменениями составил 0,003% или 3×10-5.
Морфологические изменения у дафний способствуют снижению жизнеспособности особей, поскольку затрагивают жизненно важные органы (рисунок 2, Б, В, Г).
Пример 3. Определяют токсикогенетическое действие стандартного токсиканта - фенола в диапазоне концентраций 0,01 мг/л - 100,0 мг/л. По десять дафний из синхронизированной и промикроскопированной культуры в двухсуточном возрасте помещают в аквариумы с растворами фенола на каждый опытный образец. Параллельно опытному образцу ставят контрольный вариант с водой. Плотность посадки во всех вариантах - 10 особей на 500 мл среды. В течение 24 часов экспонирования дафний учитывают их гибель. После окончания экспозиции выживших особей переносят в аквариумы с чистой водой и содержат в ней до достижения ими 20-суточного возраста. При этом учитывают гибель дафний и плодовитость выживших.
Все появившееся потомство (первое поколение - F1) пересаживают в аквариумы с чистой водой и содержат там до достижения ими 20-суточного возраста. В течение этого периода появляющееся от них потомство (второе поколение - F2) пересаживают в аквариумы с чистой водой. За появившимися особями второго поколения ежедневно наблюдают и учитывают их гибель и плодовитость.
Всех дафнии второго поколения микроскопируют с целью изучения их морфологических признаков.
Фенол в концентрации 1,0-0,01 мг/л индуцирует снижение плодовитости обработанных особей F0 по сравнению с контрольным уровнем (Р<0,05).
На основании изложенного, фенол оценивают как чрезвычайно токсичное соединение в диапазоне концентраций от 1,0 до 100,0 мг/л (D.longispina, D.cristatd). Для D.galeata фенол является чрезвычайно токсичным соединением в диапазоне концентраций от 10,0 до 100,0 мг/л, высокую токсичность он обнаруживает при концентрации 1,0 мг/л.
При концентрации 0,1 мг/л фенол проявляет себя как токсичный, а при концентрации 0,01 мг/л - как умеренно токсичный агент для всех видов дафний (табл.4).
Оценку уровня мутагенной активности фенола производили по коэффициенту & (таблица 5). Показано, что при концентрации 1,0-0,1 мг/л фенол проявляет слабое мутагенное действие в отношении D.galeata, индуцируя в 6,0-7,2 раза больше мутаций, чем их выявлено в контрольном варианте. У D.cristata фенол в концентрации 0,1 мг/л индуцирует в 6,9 раз больше мутаций, по сравнению с контролем.
Более чувствительной к фенолу оказалась D.longispina: в опытных вариантах при концентрации 0,1 мг/л выявлено мутаций в 8,7 раз больше, чем в контрольном варианте.
О специфичности мутагенного действия фенола свидетельствуют коэффициенты L2, K2 и µ. (таблица 6).
Они указывают на то, что раствор фенола индуцирует в основном сублетальные мутации. Морфологических изменений у дафний не выявлено.
Таким образом, в диапазоне исследованных концентраций фенол является токсикантом и слабым мутагеном. При этом он обладает выраженной специфичностью, проявляющейся в его способности индуцировать сублетальные мутации, снижающие продолжительность жизни особей исследуемых популяций дафний (таблица 7-9).
Пример 4. Исследуют генотоксическую активность супермутагена этилметансульфоната (ЭМС).
Двухсуточных дафний из подготовленной синхронизированной и промикроскопированной культуры помещают в аквариумы с растворами ЭМС по 10 штук на каждый опытный образец. Исследуют растворы ЭМС в диапазоне концентраций 0,1 мг/л - 400,0 мг/л. Параллельно опытному образцу ставят контрольный вариант с водой. Плотность посадки во всех вариантах - 10 особей на 500 мл среды. Дафний экспонируют 24 ч. После окончания экспозиции выживших особей переносят в аквариумы с чистой водой и содержат в ней до достижения ими 20-суточного возраста. Все появившееся потомство (первое поколение - F1) пересаживают в аквариумы с чистой водой и содержат там до достижения ими 20-суточного возраста. В течение этого периода появляющееся от них потомство (второе поколение - F2) пересаживают в аквариумы с чистой водой. За появившимися особями второго поколения ежедневно наблюдают и учитывают их гибель и плодовитость.
Всех дафнии второго поколения микроскопируют с целью изучения их морфологических признаков.
В таблице 10 представлены коэффициенты токсичности ЭМС, позволяющие оценить уровень его токсического действия.
Величины коэффициентов L0, характеризующих степень выраженности летального эффекта, указывают на то, что ЭМС в диапазоне концентраций от 300,0 до 400,0 мг/л действует на дафний исследуемых популяций как чрезвычайный токсикант (L0>10), индуцируя 100% их гибель. При концентрации 200 мг/л ЭМС проявил себя как высокотоксичный агент в отношении D.galeata и как токсичный агент в отношении D.longispina и D.cristata. При концентрации 100 мг/л для всех трех популяций ЭМС проявил себя как токсичный агент. Действие ЭМС в диапазоне концентраций 100-200 мг/л выражалось как в снижении продолжительности жизни (L0=9,1-4,6), так и в снижении плодовитости выживших особей (Р0=0,2-0,4).
Более низкие концентрации ЭМС (0,1-10,0 мг/л) характеризовались как умеренно токсичные для всех исследуемых популяций дафний.
Мутагенную активность ЭМС оценивают по частоте появления сублетальных, летальных и морфологических мутантов. Уровень мутагенности ЭМС оценивают по коэффициенту & (таблица 11).
В исследуемом диапазоне концентраций ЭМС проявил себя как активный мутаген и индуцировал мутантов в 28,3-49,1 раза больше, чем в контроле. В соответствии с оценочной шкалой (табл.3) мутагенное действие ЭМС характеризуется средней активностью в отношении все трех популяций дафний.
О специфичности мутагенного действия ЭМС судили по коэффициентам, представленным в таблице 12.
ЭМС индуцирует сублетальные мутации. Так, у D.galeata в концентрациях 100,0-200,0 мг/л коэффициент L2 достигает 4,1-3,7, что свидетельствует высокой гибели дафний второго поколения по сравнению с контролем за счет индукции сублетальных мутаций.
ЭМС в концентрации 0,1-10,0 мг/л у D.galeata и в концентрациях от 0,1 до 200 мг/л у D.longispina и D.cristata также индуцирует сублетальные мутации, но в меньшей степени (L2=2,6-1,4).
Летальные мутации индуцируются ЭМС у всех трех популяций дафний во всем диапазоне исследованных концентраций и частота их встречаемости практически не различается (К2=0,1-0,2). Указанный коэффициент свидетельствует о снижении плодовитости опытных дафний во втором поколении в 5-6 раз по сравнению с контролем.
Во всех опытных вариантах обнаружены особи, имеющие различные морфологические изменения антенн.
По способности индуцировать морфологические мутации у дафний трех популяций ЭМС во всех исследуемых концентрациях характеризуется как высоко активный мутаген. Частота возникновения морфологических мутантов (µ) в опыте существенно превышала величину их спонтанного возникновения (в 327-4223 раза).
Сопоставление полученных результатов экспериментов доказывает, что ЭМС обладает токсичностью и мутагенностью (табл.13-15). Обнаружена тенденция снижения мутагенности ЭМС с уменьшением его концентрации.
Исходя из всех полученных результатов, ЭМС следует отнести к токсикантам (300-400 мг/л - чрезвычайным, 100,0-200,0-токсичным и 0,1-10,0 мг/л - умеренным), причем при концентрациях 0,1-200,0 мг/л - со средней мутагенной активностью. Специфичность действия проявляется в слабой индукции сублетальных и летальных мутаций на фоне сильно выраженной индукции морфологических мутаций. Для концентраций ЭМС 300,0-400,0 мг/л лимитирующий показатель вредности - токсичность, а для концентраций 0,1-200,0 мг/л - мутагенность (табл.13-15).
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ОЦЕНКИ ГЕНОТОКСИЧНОСТИ ВОДНЫХ СРЕД | 2010 |
|
RU2478582C2 |
| Способ оценки токсичности водных сред | 1984 |
|
SU1234770A1 |
| СПОСОБ БИОТЕСТИРОВАНИЯ ТОКСИЧНОСТИ ВОДНОЙ СРЕДЫ | 2011 |
|
RU2462707C1 |
| СПОСОБ ЭКОЛОГИЧЕСКОЙ ОЦЕНКИ ОСТРОЙ ТОКСИЧНОСТИ ВОДЫ | 2004 |
|
RU2279072C2 |
| СПОСОБ БИОТЕСТИРОВАНИЯ ТОКСИЧНОСТИ ВОДЫ НА НИЗШИХ РАКООБРАЗНЫХ ЖИВОТНЫХ | 2008 |
|
RU2377560C1 |
| Способ определения токсичности водной среды | 1990 |
|
SU1748060A1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ТОКСИЧЕСКОГО ЗАГРЯЗНЕНИЯ СТОЧНЫХ И ПРИРОДНЫХ ПРЕСНЫХ ВОД | 2006 |
|
RU2308719C1 |
| СПОСОБ БИОМОНИТОРИНГА ВОДОЕМА С ИСПОЛЬЗОВАНИЕМ ГЕНЕТИЧЕСКОГО СОСТАВА ПОПУЛЯЦИЙ ХИРОНОМИД | 2014 |
|
RU2569354C1 |
| СПОСОБ ДЕТОКСИКАЦИИ ВОДНОЙ СРЕДЫ, ЗАГРЯЗНЕННОЙ НИТРОБЕНЗОЛОМ | 2009 |
|
RU2424197C2 |
| СПОСОБ МУТАГЕННОЙ ОБРАБОТКИ СЕМЯН ЯЧМЕНЯ | 2011 |
|
RU2464779C1 |


Изобретение относится к биотехнологии и может быть использовано для оценки генотоксических эффектов водорастворимых соединений или промышленных сточных вод, в частности для оценки экологогигиенического состояния водоемов, испытывающих постоянное воздействие промышленных сточных вод и их растворимых компонентов. Способ осуществляют следующим образом. Получают синхронизированную культуру дафний от наиболее плодовитого клона из популяции дафнии, за исключением лабораторной популяции. Готовят опытные пробы. Из полученных дафний отбирают одновозрастные, партеногенетические и проводят параллельно экспонирование в исследуемом растворе (опыт), в воде (контроль), в растворе эталонного токсиканта (Кт +) и в растворе мутагена (Км +). Регистрируют физиологическое состояние у дафний исходного поколения (F0). Определяют коэффициенты токсичности, а именно коэффициент гибели (L0) и коэффициент плодовитости (Р0). Регистрируют физиологическое состояние дафний второго поколения (F2) и определяют суммарную мутагенную активность по формуле &=foп/fк, где foп - частота появления летальных, сублетальных и морфологических мутаций в опыте, а fк - частота появления летальных, сублетальных и морфологических мутаций в контроле с последующим сравнением ее значения с изоэффективными концентрациями эталонных мутагентов (Км +) и токсикантов (Кт +), выделением лимитирующего показателя вредности и установления уровня генотоксической активности на основании полученных результатов. 2 ил., 15 табл., 4 пр.
Способ оценки генотоксической активности водных сред, включающий приготовление опытных проб, получение синхронизированной культуры дафний от одного наиболее плодовитого клона из популяции дафнии, за исключением лабораторной популяции, экспонирование одновозрастных, партеногенетических дафний из синхронизированной культуры параллельно в исследуемом растворе (опыт), в воде (К - контроль), в растворе эталонного токсиканта (Кт +), в растворе и эталонного мутагена (Км +), регистрацию физиологического состояния у особей исходного поколения (F0), определение коэффициентов токсичности, а именно коэффициента гибели (L0) и коэффициента плодовитости (Р0), регистрацию физиологического состояния дафний второго поколения (F2), определение суммарной мутагенной активности по формуле
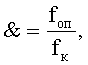
где foп - частота появления летальных, сублетальных и морфологических мутаций в опыте, а fк - частота появления летальных, сублетальных и морфологических мутаций в контроле, сравнение ее значения с изоэффективными концентрациями эталонных мутагенов и токсикантов, выделение лимитирующего показателя вредности, установление уровня генотоксической активности на основании полученных результатов.
| ДЕНИСОВА Т.П | |||
| Токсико-генетический подход к санитарно-гигиенической оценке промышленных сточных и их химических компонентов: Дисс | |||
| на соискание ученой степени кандидата медицинских наук | |||
| - Иркутск, 2006, с.36-38, 40-122 | |||
| Способ оценки токсичности водных сред | 1984 |
|
SU1234770A1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ТОКСИЧНОСТИ ПРИРОДНЫХ ВОД | 1991 |
|
RU2029948C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ЧУВСТВИТЕЛЬНОСТИ ГИДРОБИОНТОВ Daphnia magna STRAUS К ТОКСИЧЕСКОМУ ДЕЙСТВИЮ ВОДОРАСТВОРИМЫХ ХИМИЧЕСКИХ ВЕЩЕСТВ | 2003 |
|
RU2256910C2 |
| См | |||
| Интернет: | |||
Авторы
Даты
2013-08-27—Публикация
2011-02-11—Подача