Настоящее изобретение относится к таблетке на основе улипристала ацетата для перорального введения, а также к ее изготовлению и применениям.
Предпосылки создания изобретения
Улипристала ацетат, ранее известный как CDB-2914, означает в рамках контекста этой заявки 17α-ацетокси-11β-[4-(N,N-диметиламино)-фенил]-19-норпрегна-4,9-диен-3,20-дион, представленный формулой I:
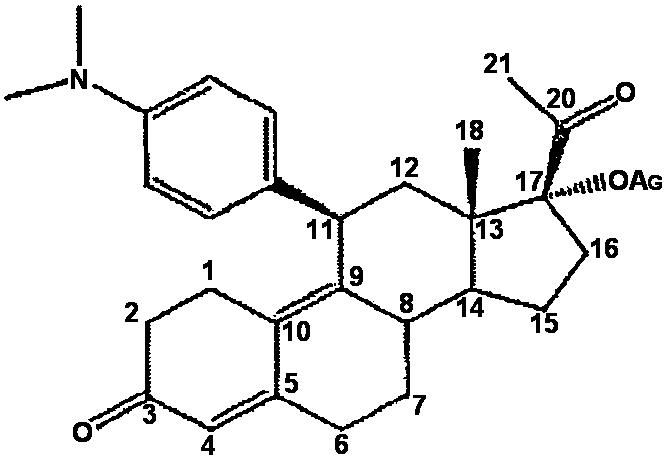
Улипристала ацетат, и способы его получения, описаны, например, в патенте: US Patent Nos. 4954490; 5073548, и 5929262, а также в международных патентных заявках WO2004/065405 и WO2004/078709.
Улипристала ацетат обладает антипрогестагенной и антиглюкокортикоидной активностью, и был предложен для контрацепции, в частности, для экстренной контрацепции, и для терапии различных гормональных заболеваний. Свойства этого соединения дополнительно описаны в работе: Blithe et al., Steroids. 2003 68 (10-13): 1013-7. К настоящему времени, были проведены клинические испытания с использованием капсул на основе улипристала ацетата для перорального введения (Creinin et., Obstetrics & Gynecology 2006; 108: 1089-1097; Levens et al., Obstet. Gynecol. 2008, 111(5): 1129-36). Для того, чтобы улучшить свойства и клиническую пользу этой молекулы, существует необходимость в улучшенных составах, содержащих молекулы этого соединения.
Краткое изложение сущности изобретения
Настоящее изобретение относится к новым составам улипристала ацетата. Более конкретно, изобретение относится к конкретным таблеткам для перорального введения на основе микронизированного улипристала ацетата. Авторы изобретения к настоящему моменту показали, что биологическая усвояемость, и, следовательно, эффективность улипристала ацетата, могут быть улучшены при приготовлении составов улипристала ацетата в форме таблетки в особых условиях. Более конкретно, авторы изобретения провели много испытаний и обнаружили, что свойства улипристала ацетата могут быть улучшены в том случае, когда приготовление состава, содержащего это соединение, в форме таблетки для перорального введения выполняют с использованием конкретных типов и количеств эксципиентов.
В соответствии с вышеизложенным, изобретение относится к фармацевтической таблетке для перорального введения, содержащей улипристала ацетат в количестве 1-18 масс.%, вместе со следующими эксципиентами: разбавителем в количестве 50-98,5 масс.%, связующим веществом в количестве 0-10 масс.%, веществом для улучшения распадаемости таблеток в количестве 0,5-10 масс.%, и скользящим веществом в количестве 0-10 масс.%.
В предпочтительном варианте осуществления, изобретение относится к фармацевтической таблетке для перорального введения, содержащей улипристала ацетат в количестве 3-18 масс.%, наряду со следующими эксципиентами: разбавителем в количестве 60-95 масс.%, связующим веществом в количестве 0-10 масс.%, веществом для улучшения распадаемости таблеток в количестве 1-10 масс.%, и скользящим веществом в количестве 0-5 масс.%.
В другом предпочтительном варианте осуществления, изобретение относится к фармацевтической таблетке для перорального введения, содержащей улипристала ацетат в количестве 3-18 масс.%, наряду со следующими эксципиентами: разбавителем в общем количестве 60-95 масс.%, кроскармеллозой натрия в количестве 1-10 масс.%, и скользящим веществом в общем количестве 0-5 масс.%.
В еще одном предпочтительном варианте осуществления, изобретение относится к фармацевтической таблетке для перорального введения, содержащей улипристала ацетат в количестве 3-18 масс.%, наряду со следующими эксципиентами: разбавителем в количестве 60-95 масс.%, связующим веществом в количестве 0-10 масс.% (предпочтительно 1-10 масс.%), кроскармеллозой натрия в количестве 1-10 масс.%, и стеаратом магния в количестве 0-5 масс.%.
Неожиданно, авторы изобретения показали, что микронизированный состав улипристала ацетата в соответствии с настоящим изобретением проявляет не только очень хорошие фармакотехнические характеристики (в частности, твердость, прочность таблеток на истирание, стабильность) для изготовления таблетки, но также обеспечивает существенно улучшенный профиль растворения для улипристала ацетата.
В соответствии с предпочтительными вариантами осуществления, состав содержит 10 масс.% улипристала ацетата и, как предусматривается, содержит от 5 до 50 мг улипристала ацетата.
Дополнительная цель этого изобретения относится к способу изготовления таблетки на основе улипристала ацетата, где способ включает смешение вышеупомянутых ингредиентов и улипристала ацетата и формование таблетки.
Дополнительная цель этого изобретения заключается в способе контрацепции, включающем введение субъекту, нуждающемуся в том, эффективного количества таблетки этого изобретения.
Дополнительная цель этого изобретения представляет собой таблетку на основе улипристала ацетата, которая определена выше, в качестве контрацептивного средства.
Предпочтительной целью этого изобретения является таблетка на основе улипристала ацетата, которая определена выше, для экстренной контрацепции.
Дополнительная цель этого изобретения заключается в способе лечения гормонального заболевания, такого как лейомиома матки, включающем введение субъекту, нуждающемуся в том, эффективного количества таблетки этого изобретения.
Дополнительная цель этого изобретения представляет собой таблетку на основе улипристала ацетата, которая определена выше, в качестве лекарственного средства для лечения гормонального заболевания.
Надписи и условные обозначения на чертежах
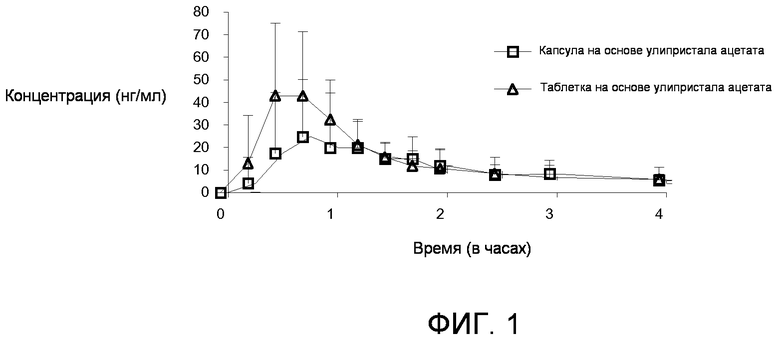
Фиг.1. Средняя (±S.D. (стандартное отклонение)) плазменная концентрация в зависимости от временных профилей улипристала ацетата в линейном и в логарифмически-линейном масштабе. Сравнение собранных данных по таблетке, содержащей 10 мг улипристала ацетата, с данными по капсуле, содержащей 10 мг улипристала ацетата, в 120 мг микрокристаллической целлюлозы.
Х-ось: Время в часах
Y-ось: Концентрация улипристала ацетата, измеренная в плазме в нг/мл.
Концентрацию улипристала ацетата измеряют с использованием жидкостной хроматографии с тандемным масс-спектрометрическим детектированием LC-MS/MS, с валидированным диапазоном калибровки между 0,100 и 20,0 нг/мл. Образец позднее повторно анализируют с использованием неспецифического радиоиммунологического анализа RIA Bioqual Inc.
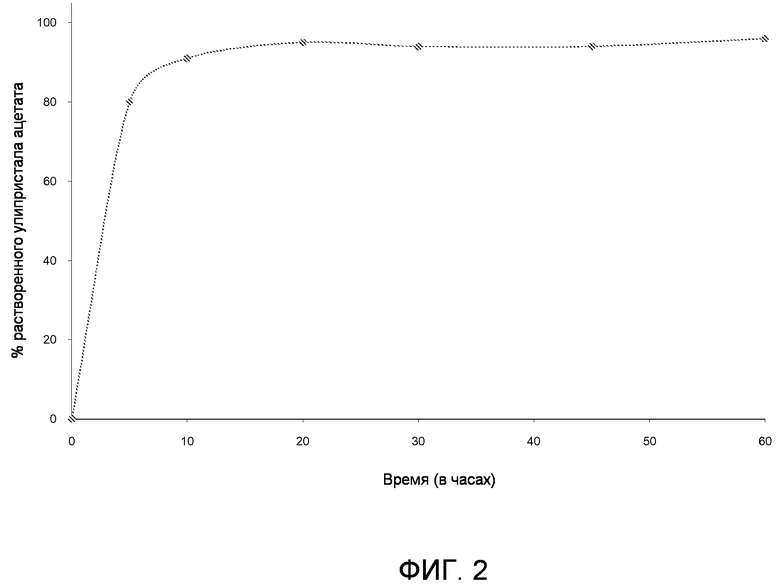
Фиг.2. Профиль растворения таблетки, содержащей 30 мг улипристала ацетата, наряду со следующими эксципиентами: моногидратом лактозы (79 масс.%), повидоном (5 масс.%), кроскармеллозой натрия (5 масс.%), и стеаратом магния (1 масс.%).
Х-ось: Время в минутах
Y-ось: % растворенной композиции
Подробное описание изобретения
Настоящее изобретение относится к новым составам улипристала ацетата, имеющим улучшенные свойства. Как раскрыто выше, изобретение относится к таблеткам для перорального введения, содержащим улипристала ацетат в комбинации с конкретными типами и количествами эксципиентов, а именно:
- разбавителя,
- необязательно связующего вещества,
- вещества для улучшения распадаемости таблеток, и
- скользящего вещества.
Термин «разбавитель» означает то, что может быть использован один разбавитель или может быть использована смесь нескольких разбавителей. Подобно тому, термин «вещество для улучшения распадаемости таблеток» означает то, что может быть использовано одно вещество для улучшения распадаемости таблеток или может быть использована смесь нескольких веществ для улучшения распадаемости таблеток. Термин «связующее вещество» означает то, что может быть использовано одно связующее вещество или может быть использована смесь нескольких связующих веществ. Термин «скользящее вещество» означает, что может быть использовано одно скользящее вещество или может быть использована смесь нескольких скользящих веществ. Если не определено иное, то термин «разбавитель в количестве», следовательно, является синонимом термину «по меньшей мере, один разбавитель в общем количестве». Термин «вещество для улучшения распадаемости таблеток в количестве», следовательно, является синонимом термину «по меньшей мере, одно вещество для улучшения распадаемости таблеток в общем количестве». Термин «связующее вещество в количестве», следовательно, является синонимом термину «по меньшей мере, одно связующее вещество в общем количестве». Термин «скользящее вещество в количестве», следовательно, является синонимом термину «по меньшей мере, одно скользящее вещество в общем количестве».
Как проиллюстрировано в экспериментальной части, выбранные эксципиенты позволяют получить гранулы, имеющие хорошие технологические свойства (прессуемость, сыпучесть), и таблетки с улучшенными фармакотехническими свойствами: с хорошим диапазоном твердости, с низкой истираемостью и с быстрой распадаемостью таблетки.
Свойства ингредиентов:
Таблетки этого изобретения содержат:
- улипристала ацетат в количестве 3-18 масс.%, предпочтительно 5-15 масс.%, еще более предпочтительно 8-12 масс.%, наряду со следующими эксципиентами:
- с разбавителем в количестве 50-98,5 масс.%, предпочтительно 60-95 масс.%, более предпочтительно 65-92 масс.%, даже еще более предпочтительно 70-85 масс.%;
- со связующим веществом в количестве 0-10 масс.%, предпочтительно 1-10 масс.%, более предпочтительно 1,5-8,5 масс.%,
- с веществом для улучшения распадаемости таблеток, таким как, например, кроскармеллоза натрия, в количестве 0,5-10 масс.%, предпочтительно 1-10 масс.%, более предпочтительно 1,5-8,5 масс.%, и
- со скользящим веществом, таким как, например, стеарат магния, в количестве 0-5 масс.%, предпочтительно 0,5-4 масс.%.
Термин «масс.%» означает количество по массе, выраженное в процентах относительно общей массы композиции. Общее процентное содержание ингредиентов в таблетке в сумме составляет 100.
В предпочтительном варианте осуществления, композиция содержит от 5-15 масс.% улипристала ацетата, еще более предпочтительно от 8-12 масс.%, более предпочтительно приблизительно 10 масс.%.
Предпочтительная композиция этого изобретения содержит:
- улипристала ацетат в количестве 5-15 масс.%, предпочтительно 8-12 масс.%, более предпочтительно приблизительно 10 масс.%,
- разбавитель в количестве 65-92 масс.%,
- связующее вещество в количестве 0-10 масс.%, предпочтительно 1-10 масс.%,
- кроскармеллозу натрия в количестве 1-10 масс.%, и
- стеарат магния в количестве 0,5-5 масс.%,
где общее процентное содержание вышеупомянутых ингредиентов в таблетке в сумме составляет 100.
В конкретных вариантах осуществления, улипристала ацетат используют в дозировке от 1 до 50 мг на таблетку, предпочтительно от 5 до 30 мг, в особенности от 10 до 30 мг.
Как раскрыто в экспериментальной части, эти относительные количества дают в результате таблетки, которые действуют с обеспечением улучшенных свойств улипристала ацетата. В частности, представленные результаты показывают, что применение таблетки в сравнении с капсулой улучшает биологическую усвояемость, и, что конкретные соотношения эксципиентов и микронизирование, которые определены в пунктах формулы, улучшают профиль растворения.
Разбавители:
Разбавители могут быть выбраны из любых фармацевтически приемлемых веществ или комбинаций веществ, которые увеличивают объемное количество улипристала ацетата с тем, чтобы сделать возможным изготовление прессуемой таблетки с удобным для применения на практике размером.
В предпочтительном варианте осуществления, разбавитель(и) выбирают из группы, состоящей из соответствующих солей, моносахаридов, дисахаридов, полиолов-производных моносахаридов и их гидратов. Термин «полиолы-производные моносахаридов» предусматривает сахарные спирты, такие как маннитол, ксилит или сорбитол.
Предпочтительно, разбавитель(и) выбирают из группы, состоящей из фосфата кальция, фосфата натрия, карбоната кальция, карбоната натрия, целлюлозы, микрокристаллической целлюлозы, моногидрата лактозы и маннитола. Например, авторы изобретения провели исследования по оцениванию эффекта нескольких различных разбавителей на таблетку. Для оценивания относительной эффективности разбавителей испытывали различные замесы. После добавления кроскармеллозы (5 масс.%) и стеарата магния (1 масс.%), композиции с моногидратом лактозы или маннитолом (70-85 масс.%) дают в результате таблетки с превосходными визуальными характеристиками (внешний вид), характеристиками прессуемости и сыпучести.
Еще предпочтительно, разбавитель(и) выбирают из моногидрата лактозы, микрокристаллической целлюлозы, и маннитола.
В наиболее предпочтительном варианте осуществления, разбавитель представляет собой моногидрат лактозы, который присутствует в количестве 65-92 масс.%, более предпочтительно 70-85 масс.%.
Предпочтительно, соотношение 'разбавители: другие эксципиенты' (масс.%: масс.%) колеблется в диапазоне от приблизительно 5 до приблизительно 25, предпочтительно от приблизительно 7 до приблизительно 18, еще предпочтительно от приблизительно 7 до приблизительно 12.
Предпочтительно, соотношение 'разбавители: улипристала ацетат' (масс.%: масс.%) находится в диапазоне от приблизительно 5 до приблизительно 40.
В том случае, когда присутствует в таблетке связующее вещество, соотношение 'разбавители: связующие вещества' (масс.%: масс.%) предпочтительно колеблется в диапазоне от приблизительно 10 до приблизительно 20.
Предпочтительно, соотношение 'разбавители: вещества для улучшения распадаемости таблеток' (масс.%: масс.%) находится в диапазоне от приблизительно 10 до приблизительно 80.
Предпочтительно, соотношение 'разбавители: скользящие вещества' (масс.%: масс.%) находится в диапазоне от приблизительно 20 до приблизительно 90.
Связующие вещества:
В том случае когда присутствуют, связующие вещества, или связующие, могут быть выбраны из любых фармацевтически приемлемых веществ (или комбинаций веществ), которые придают когезионные качества порошкообразным материалам. Связующие вещества могут быть выбраны из крахмала, желатина, сахаров, таких как производные целлюлозы (включая гидроксипропил-метилцеллюлозу), и могут быть использованы природные и синтетические камеди (например, альгинаты).
Преимущественно, связующее вещество таблетки в соответствии с изобретением выбирают из группы, состоящей из полимеров. Связующее вещество может представлять собой вещество на основе природного полимера, такое как полисахарид, или синтетический полимер, такой как полимер-пластик. Предпочтительно, связующее вещество представляет собой гидроксипропил-метилцеллюлозу и/или повидон.
Например, различные таблетки, содержащие от 1 до 20 масс.% различных связующих веществ (например, повидон, гидроксипропил-метилцеллюлоза или маисовый крахмал) изготавливают путем влажной грануляции так, как описано ниже. Основываясь на этих испытаниях, оставили относительное количество связующего вещества 1-10 масс.%, поскольку некоторые гранулы, полученные с другими количествами, не смогли выдержать стадии сушки (образование порошка) и/или имели более низкие профили растворения. Повидон или гидроксипропил-метилцеллюлоза дали наилучшие результаты, в том отношении, что они дали возможность получить гранулы вне зависимости от используемых разбавителей (моногидрат лактозы или маннитол в количестве 70-85 масс.%). Повидон является особенно предпочтительным, поскольку с повидоном были получены очень твердые и гомогенные гранулы, которые могли легко выдерживать стадию сушки.
В связи с вышеизложенным, в предпочтительном варианте осуществления, связующее вещество представляет собой повидон или содержит повидон, предпочтительно в количестве 1,5-8,5 масс.% повидона, еще более предпочтительно от 3 до 7 масс.%, наиболее предпочтительно приблизительно 5 масс.% повидона.
Предпочтительно, соотношение 'связующие вещества: другие эксципиенты' (масс.%: масс.%) колеблется в диапазоне от приблизительно 0,025 до приблизительно 0,075.
Предпочтительно, соотношение 'связующие вещества: улипристала ацетат' (масс.%: масс.%) находится в диапазоне от приблизительно 0,25 до приблизительно 0,75.
Предпочтительно, соотношение 'связующие вещества: вещества для улучшения распадаемости таблеток' (масс.%: масс.%) находится в диапазоне от приблизительно 0,5 до приблизительно 1,5.
Предпочтительно, соотношение 'связующие вещества: скользящие вещества'(масс.%: масс.%) находится в диапазоне от приблизительно 3 до приблизительно 7.
Вещества для улучшения распадаемости таблеток:
Таблетки настоящего изобретения содержат, по меньшей мере, одно вещество для улучшения распадаемости таблеток, которое, например, облегчает разрушение таблетки.
Вещества, улучшающие распадаемость таблеток, могут быть выбраны из маисового крахмала, альгиновой кислоты и кроскармеллозы натрия. Например, кроскармеллоза натрия может быть использована как таковая или в комбинации с другими веществами для улучшения распадаемости таблеток, предпочтительно как таковая.
Эксперименты, выполненные автором изобретения, показали, что кроскармеллоза натрия, при использовании в комбинации с другими ингредиентами настоящего изобретения, позволяет снижать период времени распадаемости таблеток и поддерживать хорошие фармакотехнические характеристики в том случае, когда присутствует в количестве 0,5-10 масс.%, предпочтительно 1-10 масс.%, также предпочтительно 1,5-8,5 масс.%, и более предпочтительно 4,5-5,5 масс.%, и еще более предпочтительно приблизительно 5 масс.%.
Предпочтительно, соотношение 'вещества, улучшающие распадаемость таблеток: другие эксципиенты' (масс.%: масс.%) колеблется в диапазоне от приблизительно 0,005 до приблизительно 0,1.
Предпочтительно, соотношение 'вещества, улучшающие распадаемость таблеток: улипристала ацетат' (масс.%: масс.%) колеблется в диапазоне от приблизительно 0,25 до приблизительно 0,75.
Предпочтительно, соотношение 'вещества, улучшающие распадаемость таблеток: скользящие вещества' (масс.%: масс.%) колеблется в диапазоне от приблизительно 0,5 до приблизительно 7.
Скользящие вещества:
Таблетки настоящего изобретения содержат одно или более скользящих веществ.
Скользящие вещества могут быть выбраны из стеариновой кислоты, талька и стеарата магния.
В предпочтительных вариантах осуществления, таблетки настоящего изобретения содержат, по меньшей мере, стеарат магния, и необязательно тальк. На самом деле, авторы изобретения показали, что стеарат магния является наиболее действенным скользящим веществом в предотвращении адгезии материала таблетки к поверхностям в производственном процессе и в улучшении характеристик сыпучести порошкового материала во время изготовления таблеток на основе улипристала ацетата.
Стеарат магния может быть использован в комбинации с другими скользящими веществами или как таковой, в количестве, составляющем от 0,5 до 4 масс.%.
Предпочтительно, соотношение 'скользящие вещества: другие эксципиенты' (масс.%: масс.%) колеблется в диапазоне от приблизительно 0,01 до приблизительно 0,06.
Предпочтительно, соотношение 'скользящие вещества: улипристала ацетат' (масс.%: масс.%) колеблется в диапазоне от приблизительно 0,1 до приблизительно 2.
В конкретном варианте осуществления, соотношение 'кроскармеллоза натрия: стеарат магния' (масс.%: масс.%) колеблется в диапазоне от приблизительно 0,75 до приблизительно 5, предпочтительно приблизительно 5, или от приблизительно 1 до приблизительно 2, более предпочтительно приблизительно 1,5 или 1,7.
Предпочтительные варианты осуществления:
Предпочтительно, таблетка в соответствии с настоящим изобретением содержит моногидрат лактозы в качестве разбавителя и повидон в качестве связующего вещества.
Альтернативно, таблетка в соответствии с настоящим изобретением содержит маннитол и целлюлозу (такую как микрокристаллическая целлюлоза) в качестве разбавителей и не содержит никакое связующее вещество.
В более конкретном варианте осуществления, таблетка содержит: улипристала ацетат (5-15 масс.%), моногидрат лактозы (71-87 масс.%), повидон (4,5-5,5 масс.%), кроскармеллозу натрия (4,5-5,5 масс.%) и стеарат магния (1-4 масс.%), где общее процентное содержание составляет в сумме 100.
В еще более конкретном варианте осуществления, таблетка содержит: улипристала ацетат (10 масс.%), моногидрат лактозы (79 масс.%), повидон (5 масс.%), кроскармеллозу натрия (5 масс.%) и стеарат магния (1 масс.%).
В еще одном конкретном варианте осуществления, таблетка содержит: улипристала ацетат - приблизительно 10 мг (6,7 масс.%), микрокристаллическую целлюлозу - приблизительно 91 мг (61 масс.%), маннитол - приблизительно 41 мг (27 масс.%), кроскармеллозу натрия - приблизительно 2,5 мг (1,7 масс.%), тальк - приблизительно 4 мг (2,6 масс.%) и стеарат магния - приблизительно 1,5 мг (1 масс.%), где общее процентное содержание составляет в сумме 100.
Таблетки могут быть получены с дозировкой, например, 5, 10, 15, 20 или 30 мг улипристала ацетата.
Изготовление таблеток:
Таблетки настоящего изобретения могут быть получены в соответствии с методами, известными по сути в данной области. Подходящие способы включают прямое прессование («сухое смешение»), сухое гранулирование с последующим прессованием, и влажное гранулирование с последующими сушкой и прессованием. Несколько способов включают применение технологии компактирования вальцеванием, такой как технология с использованием chilsonator или валкового таблеточного пресса, или технологий формования, литья или экструзии. Все эти способы известны по сути в данной области, и описаны подробно, например, в публикации: Lachman, et al., «The Theory and Practice of Industrial Pharmacy», Chapter 11, (3.sup.rd Ed. 1986), которая включена в этот документ путем ссылки. Таблетка в соответствии с изобретением может быть покрыта оболочкой или не покрыта оболочкой, и/или выполнена с разделительной риской и гравировкой или без этого.
Предпочтительный способ получения таблеток этого изобретения представляет собой процесс влажного гранулирования. Действительно, авторы изобретения показали, что такой способ улучшает качественные характеристики порошка до прессования и снижает размер таблетки. Более конкретно, процесс влажного гранулирования дает лучшие фармакотехнические результаты по смесям, улучшение характеристик прессуемости и снижение конечной массы таблетки.
Целью настоящего изобретения является способ изготовления таблетки улипристала ацетата, где способ включает смешение вышеупомянутых ингредиентов и улипристала ацетата и формование таблетки. В предпочтительном варианте осуществления, таблетку получают влажной грануляцией, особенно в том случае, когда получают таблетки на основе улипристала ацетата 10-30 мг, более предпочтительно таблетки на основе улипристала ацетата 30 мг.
Ингредиенты могут быть все смешаны вместе одновременно, или последовательно. В типичном варианте осуществления, разбавитель (например, моногидрат лактозы), улипристала ацетат и связующее вещество (например, повидон) сначала смешивают вместе, с последующим добавлением очищенной воды. Затем после стадии грануляции следует стадия сушки (например, в сушильном шкафу при температуре приблизительно 40°С, или на псевдоожиженном слое, или в однореакторном грануляторе). Необязательно, затем выполняют стадию калибровки, например, с помощью сита, имеющего размер ячеек от приблизительно 600 до 850 мкм, такого как сито с размером ячеек 800 мкм или сито Frewitt с размером ячеек 710 мкм. Для смазывания затем добавляют кроскармеллозу натрия и стеарат магния. Полученный состав затем прессуют с получением таблетки (стадия прессования). В результате этого процесса, кроскармеллоза (которую добавляют после стадии грануляции) представляет собой внешнюю фазу таблетки, что позволяет добиться лучшей распадаемости таблетки и лучшего растворения.
При получении таблеток этого изобретения, могут быть использованы промышленно выпускаемые смеси, содержащие разбавители и связующие вещества, такие как Avicel® (микрокристаллическая целлюлоза), Starlac® (моногидрат лактозы (85%) с маисовым крахмалом (15%)) или Ludipress® (моногидрат лактозы (93%) с Повидоном (7%)).
В другом варианте осуществления, таблетку формуют прямым прессованием, особенно в том случае, когда получают таблетки на основе улипристала ацетата, содержащие 5 или 10 мг. В том случае, когда проводят прямое прессование, можно обойтись без присутствия связующего вещества.
Пример способа прямого прессования включает стадию наслаивания (например, посредством маннитола), затем стадию предварительного смешения путем добавления улипристала ацетата, с последующим просеиванием через сито, и стадию смешения сразу после того, как добавлены микрокристаллическая целлюлоза и кроскармеллоза натрия. Затем наступает стадия смазывания (введения скользящего вещества) путем добавления других эксципиентов (например, тальк и стеарат магния) перед таблетированием. Специалист в данной области несомненно сможет адаптировать такие стадии для получения желательных таблеток.
Терапевтические применения:
Таблетки на основе улипристала ацетата настоящего изобретения являются полезными в ряде терапевтических показаний, включая контрацепцию, в том числе экстренную контрацепцию.
Таблетки изобретения являются полезными в других показаниях, включающих эндометриоз, дисменорею, лейомиому матки (лейомиомы матки), фиброму матки, обильное маточное кровотечение (меноррагия), идиопатические или спонтанные или ятрогенные нарушения коагуляции, менингиому, гормональные расстройства, такие как гормоночувствительные типы рака, гормонозависимые опухоли эндокринной системы, рак молочной железы и ингибирование пролиферации эндометрия матки, но не ограниченных этим.
Дополнительно предусматривается обеспечение подобных составов для других антипрогестинов, таких как антипрогестины, описанные в международных патентных заявках WO2008/083192 или WO2008/067086.
Дополнительные аспекты и преимущества настоящего изобретения будут раскрыты в следующих примерах, которые следует рассматривать как иллюстративные, а не как ограничивающие объем настоящей заявки.
Примеры
Пример 1: Таблетка на основе улипристала ацетата, содержащая 30 мг улипристала ацетата, полученная влажной грануляцией
Моногидрат лактозы (79 масс.%), улипристала ацетат (10 масс.%) и повидон (5 масс.%) смешивают, и добавляют очищенную воду. За этой стадией грануляции непосредственно сразу следует стадия сушки в сушильном шкафу при 40°С. Затем, выполняют стадию калибровки с помощью сита Frewitt с размером ячеек 630 мкм. На стадии смазывания вводят кроскармеллозу натрия (5 масс.%) и стеарат магния (1 масс.%). Полученный состав прессуют с получением таблетки.
Пример 2: Другие таблетки на основе улипристала ацетата, полученные влажной грануляцией
Дополнительные композиции этого изобретения содержат следующие ингредиенты:
Пример 3: Таблетка на основе улипристала ацетата, содержащие 10 мг улипристала ацетата, полученные прямым прессованием
Эту таблетку получают смешением маннитола и улипристала ацетата, затем просеиванием через сито, например, с размером ячеек сита 315 мкм, и добавлением микрокристаллической целлюлозы и кроскармеллозы натрия. Затем к смеси добавляют тальк и стеарат магния в качестве скользящих веществ, и гомогенизируют. Таблетирование осуществляют прямым прессованием смеси. Количества эксципиентов могут быть изменены (например, уполовинены или удвоены) при сохранении тех же самых пропорций в масс.%. Таблетки с общей массой 75, 150, 300 мг, содержащие 10 мг улипристала ацетата, и такие же эксципиенты, которые перечислены в Таблице 3, могут быть приготовлены соответствующим образом.
Пример 4: Исследования биологической усвояемости
Проводят сравнительное исследование биологической усвояемости таблетки (10 мг) (которая изготовлена в соответствии с примером 3) в сравнении с различными составами капсулы на основе улипристала ацетата и исследование, охарактеризовывающее фармакокинетический профиль. Для измерения улипристала ацетата в плазме или сыворотке применяют различные методы анализа, включающие радиоиммунологический анализ (RIA) и жидкостную хроматографию в сочетании с тандемной масс-спектрометрией (LC-MS/MS). Вследствие присутствия перекрестно реагирующих метаболитов, RIA не позволяет отличить исходный улипристала ацетат от возможных перекрестно реагирующих метаболитов, присутствующих в кровотоке, и результаты, представленные с использованием этого метода, следовательно, представляют собой сумму улипристала ацетата и его перекрестно реагирующих метаболитов. Метод LC-MS/MS разрабатывают для применения в исследовании плазмы и сыворотки крови человека в период менопаузы и в период отсутствия менопаузы, и этот метод позволяет отделить и определить как улипристала ацетат, так и его фармакологически активный метаболит, 17α-ацетокси-11β-[4-(N-метиламино)-фенил)-19-норпрегна-4,9-диен-3,20-дион.
Сравнительное исследование биологической усвояемости также включает повторный анализ образцов с использованием неселективного радиоиммунологического анализа, посредством чего обеспечивают точку отсчета, с которой можно сравнивать результаты, полученные в других исследованиях вне зависимости от применяемого аналитического метода.
Сравнительные исследования биологической усвояемости проводят как фармакокинетическое вспомогательное исследование различных составов улипристала ацетата. Испытываемые составы включают капсулу (10 мг) с микронизированным ацетатом улипристала в 120 мг микрокристаллической целлюлозы, и таблетку на основе улипристала ацетата (10 мг). Эксперименты проводят с выполнением сравнения биологической усвояемости и биоэквивалентности улипристала ацетата или его метаболитов, в этих двух составах. Как раскрыто в Таблице 4 ниже, наилучший профиль абсорбции наблюдают для состава таблетки со следующими фармакокинетическими (PK) параметрами (среднее значение ± SD или диапазон): Cmax: 56,7±29,1 нг/мл, tmax: 0,63 час (средний диапазон: 0,50-2,00 час), AUC0-t: 171,79±85,59 час·нг/мл.
Термин 'Смах' означает пиковое значение концентрации улипристала ацетата в плазме крови.
Термин 'AUC0-t' обозначает площадь под кривой профиля концентрации в зависимости от времени 0 до времени t. Термин 'SD' относится к стандартному отклонению.
Результаты сравнительных исследований биологической усвояемости также позволяют предположить, что улипристала ацетат абсорбируется быстрее и имеет большую общую биологическую усвояемость для таблетки по сравнению с капсулой. Средние значения Cmax и AUC0-t для улипристала ацетата являются в самых лучших случаях на 95% и на 40% выше, соответственно, после введения таблетки по сравнению с капсулой (смотри фиг.1). Эта тенденция также сказывается и прослеживается и на средних значениях Cmax и AUC0-t для активного монодеметилированного метаболита, 17α-ацетокси-11β-[4-(N-метиламино)-фенил)-19-норпрегна-4,9-диен-3,20-диона, для которого средние значения Cmax и AUC0-t являются на 92% и на 25% выше, соответственно, для таблетки в сравнении с капсулой.
Липиды или поверхностно-активные вещества, которые присутствуют в композиции в капсулах, как ожидают, помогают добиться мгновенного растворения соединения, и облегчают абсорбирование как в желудке, так и в кишечнике, с преимущественным абсорбированием в кишечнике, то есть, с более низким абсорбированием в GIT (желудочно-кишечный тракт). Однако, результаты, полученные авторами изобретения, неожиданно показывают, что, в сравнении с составом в капсулах, состав в таблетках абсорбируется быстрее, имеет более высокий пик концентрации в плазме, и имеет большую общую биологическую усвояемость, что измерено посредством AUC (площадь под кривой), измеренной в исследовании и экстраполированной в бесконечность для исходного соединения и метаболита.
Фармакокинетические результаты демонстрируют преимущества таблеточной формы в сравнении с капсульной формой.
Пример 5: Профиль растворения для таблетки в соответствии с Примером 1
Исследования процесса растворения выполняют с использованием различных таблеток, включая таблетку примера 1. Испытания растворения проводят в соответствии с общей статьей на лекарственное средство Европейской Фармакопеи § 2.9.3:
- прибор с лопастью для проведения испытания «Растворение»
- Среда для проведения испытания на растворение: HCl 0,1 N раствор
- Скорость вращения: 50 оборотов в минуту
- Температура: 37°С ± 0,5°С
Результаты, отраженные на Фиг.2, показывают, что таблетки этого изобретения растворяются полностью и быстро.
Пример 6: Сравнительные профили растворения
Таблица 5 представляет сравнительные профили растворения для таблеток примеров 1 и 3, которые содержат различные соотношения ингредиентов. Результаты неожиданно показывают, что таблетка Примера 1 имеет намного лучший профиль растворения, чем таблетка примера 3, что иллюстрирует важность конкретных эксципиентов и соотношений для составов на основе улипристала ацетата.
Сравнительные профили растворения: растворенный улипристала ацетат (%) в зависимости от времени (мин)
| название | год | авторы | номер документа |
|---|---|---|---|
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ФАБОМОТИЗОЛА ДИГИДРОХЛОРИДА | 2022 |
|
RU2828872C2 |
| НОВАЯ КОМПОЗИЦИЯ ЛАПАТИНИБА В ВИДЕ ТВЕРДОЙ ЛЕКАРСТВЕННОЙ ФОРМЫ ДЛЯ ПЕРОРАЛЬНОГО ПРИМЕНЕНИЯ И СПОСОБ ЕЕ ИЗГОТОВЛЕНИЯ | 2019 |
|
RU2821950C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ АЛЕГЛИТАЗАР | 2010 |
|
RU2537224C2 |
| СПОСОБ СУХОГО ГРАНУЛИРОВАНИЯ ДЛЯ ПОЛУЧЕНИЯ КОМПОЗИЦИЙ МЕТФОРМИНА В ВИДЕ ТАБЛЕТОК И ЕГО КОМПОЗИЦИИ | 2013 |
|
RU2647421C2 |
| ТВЕРДЫЕ ПРЕПАРАТЫ, СОДЕРЖАЩИЕ ТОФОГЛИФЛОЗИН, И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2014 |
|
RU2700164C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ В ФОРМЕ ТАБЛЕТКИ И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2014 |
|
RU2546002C1 |
| ЛЕКАРСТВЕННАЯ ФОРМА, СОДЕРЖАЩАЯ ДЕЗЛОРАТАДИН И СПОСОБ ЕЕ ИЗГОТОВЛЕНИЯ | 2013 |
|
RU2550958C2 |
| Твёрдые лекарственные формы палбоциклиба | 2016 |
|
RU2686840C1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ, СОДЕРЖАЩАЯ ПРОИЗВОДНОЕ ПИРИМИДИН-А-ОНА, ПОКРЫТАЯ КИШЕЧНОРАСТВОРИМЫМ ПОЛИМЕРОМ | 2004 |
|
RU2359660C2 |
| ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ, СОДЕРЖАЩИЕ ZD6474 | 2005 |
|
RU2383343C2 |
Изобретение относится к фармацевтической таблетке для перорального введения, содержащей 3-18 масс.% улипристала ацетата; 60-95 масс.% разбавителя, выбранного из моногидрата лактозы, микрокристаллической целлюлозы, целлюлозы, маннитола и их комбинаций; 0-10 масс.% связующего вещества, выбранного из гидроксипропилметилцеллюлозы, повидона и их комбинаций; 1-10 масс.% кроскармеллозы натрия и 0,5-4 масс.% стеарата магния. Изобретение также относится к способу изготовления данной таблетки, который включает смешивание ингредиентов и формование таблетки посредством влажной грануляции или посредством прямого прессования. Изобретение обеспечивает новый состав таблетки с улучшенной распадаемостью. 2 н. и 11 з.п. ф-лы, 2 ил., 5 табл., 6 пр.
1. Фармацевтическая таблетка для перорального введения, содержащая:
- от 3 до 18 мас.% улипристала ацетата;
- от 60 до 95 мас.% разбавителя, выбранного из моногидрата лактозы, микрокристаллической целлюлозы, целлюлозы, маннитола и их комбинаций;
- от 0 до 10 мас.% связующего вещества, выбранного из гидроксипропилметилцеллюлозы, повидона и их комбинаций;
- от 1 до 10 мас.% кроскармеллозы натрия и
- от 0,5 до 4 мас.% стеарата магния.
2. Таблетка по п.1, где разбавитель находится в количестве 65-92 мас.%.
3. Таблетка по п.1, где кроскармеллоза натрия находится в количестве 1,5-8,5 мас.%.
4. Таблетка по п.1, содержащая 5-30 мг улипристала ацетата.
5. Таблетка по п.1, где количество улипристала ацетата от 5 до 15 мас.%.
6. Таблетка по п.1, где количество связующего вещества от 1,5 до 8,5 мас.%.
7. Таблетка по любому из пп.1-6, где разбавитель представляет собой моногидрат лактозы, а связующее вещество представляет собой повидон.
8. Таблетка по любому из пп.1-6, содержащая улипристала ацетат 6-12 мас.%, моногидрат лактозы 71-87 мас.%, повидон 4,5-5,5 мас.%, кроскармеллозу натрия 4,5-5,5 мас.% и стеарат магния 1-4 мас.%.
9. Таблетка по п.8, содержащая улипристала ацетат 10 мас.%, моногидрат лактозы 79 мас.%, повидон 5 мас.%, кроскармеллозу натрия 5 мас.% и стеарат магния 1 мас.%.
10. Таблетка по любому из пп.1-5, которая содержит маннитол и микрокристаллическую целлюлозу в качестве разбавителя и которая свободна от связующего вещества.
11. Таблетка по любому из пп.1-6, дополнительно содержащая тальк.
12. Таблетка по п.1, содержащая улипристала ацетат 6,7 мас.%, микрокристаллическую целлюлозу 61 мас.%, маннитол 27 мас.%, кроскармеллозу натрия 1,7 мас.%, тальк 2,6 мас.% и стеарат магния 1 мас.%.
13. Способ получения таблетки на основе улипристала ацетата по любому из пп.1-12, где способ включает смешивание ингредиентов и улипристала ацетата и формование таблетки, предпочтительно посредством влажной грануляции или посредством прямого прессования.
| WO 2008067086 А2, 05.06.2008 | |||
| WO 2008083192 А2, 10.07.2008 | |||
| US 0005073548 A1, 17.12.1991 | |||
| ЧУЕШОВ В.И | |||
| Промышленная технология лекарств, т.2 | |||
| - Харьков, 2002, с.10 2 абзац снизу | |||
| БЕЛИКОВ В.Г | |||
| Фармацевтическая химия, ч.1 | |||
| Способ изготовления фанеры-переклейки | 1921 |
|
SU1993A1 |
Авторы
Даты
2013-09-20—Публикация
2009-12-08—Подача