Родственная заявка
Настоящая заявка претендует на приоритет согласно предварительной заявке на патент США №61/033877, поданной 5 марта 2008 года, содержание которой во всей ее полноте настоящим указанием включено в настоящий документ посредством ссылки.
Предпосылки создания изобретения
Дипептидилпептидаза IV (DPP-IV), член семейства пролилпептидаз, отщепляет определенные дипептиды в предпоследнем положении от амино-концов белков. Она участвует в быстром разложении глюкагоноподобного пептида-1 (GLP-1), гормона желудочно-кишечного тракта, продуцируемого эндокринными L-клетками кишечника в ответ на прием пищи.
В свою очередь, GLP-1 ингибирует секрецию глюкагона и стимулирует глюкозозависимое высвобождение инсулина из поджелудочной железы (Zander M, et al. Lancet 2002, 359: 824-830). Было показано, что результатом ингибирования DPP-IV является повышение секреции инсулина, снижение уровня глюкозы в плазме и улучшение функции панкреатических β-клеток (Pederson R.A., et al. Diabetes 1998, 47: 1253-1258; и Ahren B., et al. Diabetes Care 2002, 25: 869-875). Поэтому ингибиторы DPP-IV являются потенциальными кандидатами на роль лекарственных средств против диабета типа II.
Недавние исследования указывают, что ингибиторы DPP-IV были потенциальными ингибиторами дипептидилпептидазы VIII (DPP-VIII), другого члена семейства пролилпептидаз, и что результатом ингибирования DPP-VIII были побочные эффекты, например, токсичность и тромбоцитопения (Diabetes, 2005, 54: 2988-2994). Поэтому ингибиторы DPP-IV как кандидаты на роль лекарственных средств при диабете типа II, предпочтительно, обладают лишь небольшой ингибиторной активностью в отношении DPP-VIII, либо совсем не имеют такой активности.
Сущность изобретения
Настоящее изобретение основано на неожиданном открытии, что некоторая группа пирролидиновых соединений ингибирует DPP-IV.
Один аспект настоящего изобретения относится к пирролидиновым соединениям формулы (I), показанной ниже:
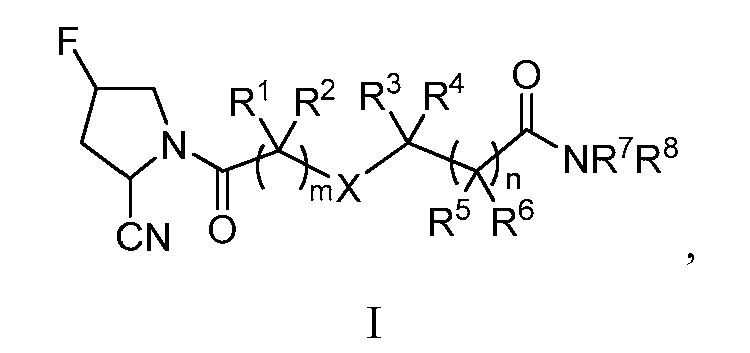
где каждый из R1, R2, R3, R4, R5 и R6, независимо, представляет собой Н, галоген, нитро, циано, амино, гидрокси, алкил, галогеналкил, алкокси, арилокси, аралкил, циклил, гетероциклил, арил или гетероарил; R7 представляет собой алкил или гетероарил и R8 представляет собой Н или алкил; или R7 и R8, совместно с атомом азота, к которому они присоединены, образуют 3-10-членное моноциклическое или бициклическое, насыщенное или ненасыщенное кольцо, необязательно замещенное галогеном, CN, NO2, -OR', алкилом, арилом, гетероарилом, галогеналкилом, гидроксиалкилом, алкоксиалкилом, -C(O)R', -SR', -S(O)R', -S(O)2R', -NR'R”, -C(O)OR', -C(O)NR'R”, -OC(O)R', -NR'C(O)R”, -NR'C(O)OR” или -R'C(O)NR”R”'; каждый из R', R” и R”', независимо, представляет собой Н, алкил или арил; каждое из m и n, независимо, равно 0, 1, 2 или 3; и X представляет собой NRa, в котором Ra представляет собой Н, алкил или арил.
Соединения формулы (I) могут, кроме того, иметь один или более из следующих вариантов: X представляет собой NH; m равно 1; n равно 1; каждый из R1 и R2 представляет собой Н; каждый из R3 и R4 представляет собой алкил (например, метил); каждый из R5 и R6 представляет собой Н; и R7 и R8 представляют собой алкил, R7 и R8, совместно с атомом азота, к которому они присоединены, образуют 3-10-членное моноциклическое или бициклическое, насыщенное или ненасыщенное кольцо, необязательно замещенное галогеном, CN, NO2, -OR', алкилом, арилом, гетероарилом, галогеналкилом, гидроксиалкилом, алкоксиалкилом, -C(O)R', -SR', -S(O)R', -S(O)2R', -NR'R”, -C(O)OR', -C(O)NR'R”, -OC(O)R', -NR'C(O)R”, -NR'C(O)OR” или -R'C(О)NR”R”'; каждый из R', R” и R”', независимо, представляет собой Н, алкил или арил. Примеры только что упомянутого кольца включают, но не ограничиваются ими, замещенные или незамещенные пирролидинил, тиазолидинил, пиперидинил, морфолинил, тиоморфолинил, пиперизинил, 1,2,3,6-тетрагидропиридинил, изоиндолинил и 7-азабицикло[2.2.1]гептан-7-ил.
Другой аспект настоящего изобретения относится к пирролидиновым соединениям формулы (II), показанной ниже:
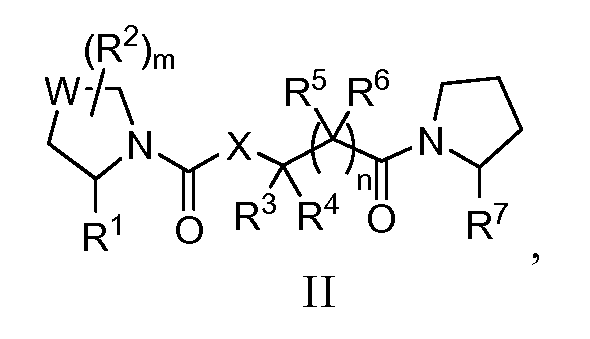
где R1 представляет собой Н или CN; каждый из R2, R3, R4, R5 и R6, независимо, представляет собой Н, галоген, нитро, циано, амино, гидрокси, алкил, галогеналкил, гидроксиалкил, алкоксиалкил, алкокси, арилокси, аралкил, циклил, гетероциклил, арил или гетероарил; R7 представляет собой Н, алкил, гидроксиалкил или алкоксиалкил; m равно 0, 1, 2, 3, 4 или 5; n равно 0, 1 или 2; W представляет собой CRaRa', NRa, O или S, где каждый из Ra и Ra', независимо, представляет собой Н, галоген, алкил или арил; и X представляет собой O, S или CRb(NRbRb''), где каждый из Rb, Rb' и Rb'', независимо, представляет собой Н, алкил или арил.
Соединения формулы (I) могут, кроме того, иметь один или более из следующих вариантов: W представляет собой CRaRa'; R1 представляет собой CN; X представляет собой CH(NH2); n равно 1; каждый из R3 и R4, независимо, представляет собой Н или алкил; каждый из R5 и R6 представляет собой Н; и R7 представляет собой алкил (например, метил), гидроксиалкил (например, гидроксиметил) или алкоксиалкил (например, метоксиметил).
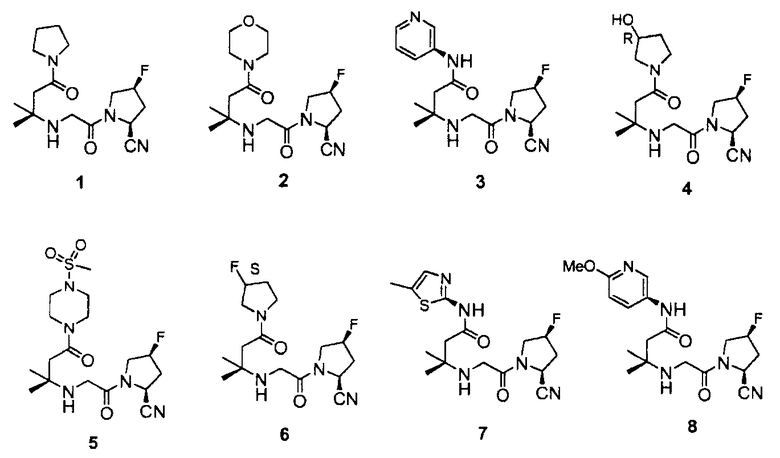
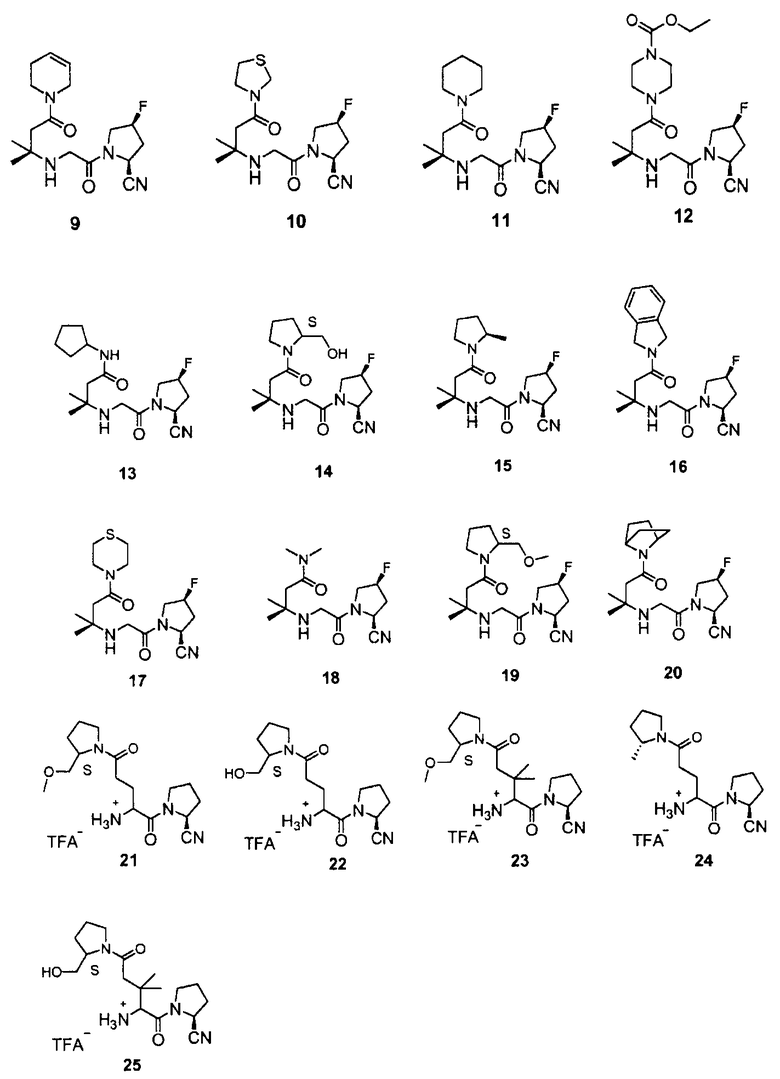
Ниже показаны типичные примеры соединений согласно настоящему изобретению:
Термин «алкил» в настоящем документе относится к прямому или разветвленному углеводороду, содержащему 1-10 углеродных атомов.
Примеры алкильных групп включают, но не ограничиваются ими, метил, этил, н-пропил, изопропил, н-бутил, изобутил и трет-бутил. Термин «алкокси» относится к -O-алкилу. Термин «алкоксиалкил» относится к алкильной группе, замещенной одной или более алкоксигруппами. Термин «галогеналкил» относится к алкильной группе, замещенной одним или более галогенами. Термин «гидроксиалкил» относится к алкильной группе, замещенной одной или более гидроксильными группами.
Термин «арил» относится к 6-углеродной моноциклической, 10-углеродной бициклической, 14-углеродной трициклической ароматической кольцевой системе, где каждое кольцо может иметь от 1 до 4 заместителей. Примеры арильных групп включают, но не ограничиваются ими, фенил, нафтил и антраценил. Термин «арилокси» относится к -O-арилу. Термин «аралкил» относится к алкильной группе, замещенной арильной группой.
Термин «циклил» относится к насыщенной и частично ненасыщенной циклической углеводородной группе, имеющей от 3 до 12 углеродов. Примеры циклильных групп включают, но не ограничиваются ими, циклопропил, циклобутил, циклопентил, циклопентенил, циклогексил, циклогексенил, циклогептил и циклооктил.
Термин «гетероарил» относится к ароматической 5-8-членной моноциклической, 8-12-членной бициклической или 11-14-членной трициклической кольцевой системе, имеющей один или несколько гетероатомов (таких как O, N или S). Примеры гетероарильных групп включают пиридил, фурил, имидазолил, бензимидазолил, пиримидинил, тиенил, хинолинил, индолил и тиазолил. Термин «гетероаралкил» относится к алкильной группе, замещенной гетероарильной группой.
Термин «гетероциклил» относится к неароматической 5-8-членной моноциклической, 8-12-членной бициклической или 11-14-членной трициклической кольцевой системе, имеющей один или несколько гетероатомов (такого как O, N или S). Примеры гетероциклильных групп включают, но не ограничиваются ими, пиперазинил, пирролидинил, диоксанил, морфолинил и тетрагидрофуранил.
Алкил, циклил, гетероциклил, арил, гетероарил, аралкил, гетероаралкил, алкокси и арилокси, указанные в настоящем документе, включают как замещенные, так и незамещенные фрагменты. Примеры заместителей включают, но не ограничиваются ими, галоген, гидроксил, амино, циано, нитро, меркапто, алкоксикарбонил, амидо, карбокси, алкансульфонил, алкилкарбонил, карбамидо, карбамоил, карбоксил, тиоуреидо, тиоцианато, сульфонамидо, алкил, алкенил, алкинил, алкилокси, арил, гетероарил, циклил, гетероциклил, в которых алкил, алкенил, алкинил, алкилокси, арил, гетероарил, циклил и гетероциклил могут быть дополнительно замещены.
Моноциклическое кольцо, указанное в настоящем документе, является замещенным или незамещенным, но не может быть конденсированным с другим ароматическим или неароматическим кольцом.
Пирролидиновые соединения, описанные выше, включают их фармацевтически приемлемые соли и пролекарства, если они применимы. Такая соль может быть образована между положительно заряженной ионной группой в пирролидиновом соединении (например, аммонием) и отрицательно заряженным противоионом (например, трифторацетатом). Аналогичным образом, отрицательно заряженная ионная группа в пирролидиновом соединении (например, карбоксилат) может также образовывать соль с положительно заряженным противоионом (например, натрием, калием, кальцием или магнием). Пирролидиновые соединения могут содержать неароматическую двойную связь и один или более асимметрических центров. Таким образом, они могут появляться в виде рацемических смесей, единичных энантиомеров, индивидуальных диастереомеров, диастереомерных смесей и цис- или транс-изомерных форм. Все такие изомерные формы предусмотрены в настоящем изобретении.
Пирролидиновые соединения, описанные выше, можно применять для ингибирования DPP-IV. Соответственно, другой аспект настоящего изобретения относится к способу ингибирования DPP-IV одним или более пирролидиновыми соединениями. Поскольку результатом ингибирования DPP-IV являются пониженные уровни глюкозы в крови и повышенная секреция инсулина, соединения согласно настоящему изобретению можно также применять для лечения диабета типа II. Таким образом, настоящее изобретение дополнительно распространяется на способ лечения диабета типа II посредством введения субъекту, нуждающемуся в лечении, эффективного количества одного или более пирролидиновых соединений.
Кроме того, в объем настоящего изобретения включена фармацевтическая композиция, содержащая одно или более из вышеописанных пирролидиновых соединений, а также применение этой композиции для лечения диабета типа II и для изготовления лекарственного средства для только что указанного лечения.
Подробности многих вариантов осуществления настоящего изобретения изложены в подробном описании и в указанных ниже пунктах формулы изобретения. Другие варианты, предметы и преимущества настоящего изобретения будут очевидны из подробного описания и пунктов формулы изобретения.
Подробное описание
Пирролидиновые соединения согласно настоящему изобретению могут быть синтезированы посредством способов, хорошо известных в данной области техники. Типичные способы синтеза этих соединений показаны ниже на схемах 1-3.
Схема 1
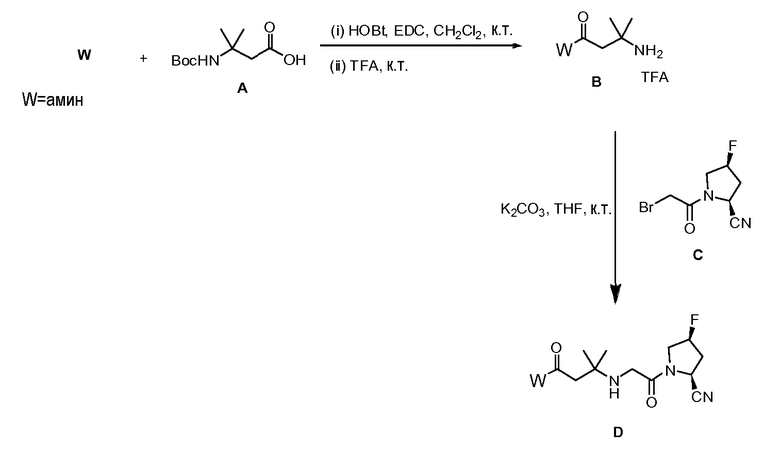
Схема 1 иллюстрирует путь синтеза до соединений формулы (I). Исходное вещество (А) представляет собой N-замещенную β-аминокислоту. Она реагирует с амином (W) в присутствии конденсирующего агента, например, N-(3-диметиламинопропил)-N-этилкарбодиимида (EDC), с последующим снятием защиты, что приводит к амиду (В), который имеет свободную аминогруппу. Затем амид конденсируют с пирролидином (С), образуя желаемое соединение (D). N-защищенная β-аминокислота (A) и пирролидин (C) могут быть получены известными способами. См., например, J. Med. Chem. 2006, 49, 373; J. Med. Chem. 1988, 31, 92; J. Med. Chem. 2002, 45, 2362.; и Bioorg. Med. Chem. 2004, 12, 6053.
Схема 2
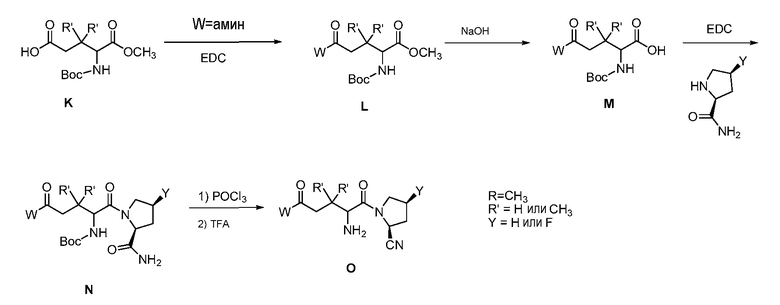
Схема 2 иллюстрирует путь синтеза до соединений формулы (II). В этой схеме исходное соединение представляет собой замещенную по амину дикарбоновую кислоту (К), в которой аминогруппа и одна из двух карбоксильных групп являются защищенными. Соединение (К) конденсируют с амином, получая соединение L, которое гидролизуют, образуя кислоту (М). Кислоту (М) конденсируют с L-пролинамидом с образованием соединения (N). Соединение (N) дегидратируют, после чего удаляют защиту с аминогруппы, получая желаемый продукт (О). Некоторые соединения, применяемые в вышеуказанном синтезе, могут быть получены посредством способов, хорошо известных в данной области техники. См., например, Bioorg. Med. Chem. 2004, 12, 6053.
Вышеуказанные схемы предоставлены только для иллюстративных целей. Специалист в данной области техники мог бы синтезировать все пирролидиновые соединения согласно настоящему изобретению по пути, показанному на схемах, с модификациями или без них. Преобразования, проводимые в синтетической химии, и методологии защитных групп (введение и снятие защиты), полезные при синтезе применяемых пирролидиновых соединений, известны в данной области и включают, например, те, которые описаны в R. Larock, Comprehensive Organic Transformations, VCH Publishers (1989); T.W. Greene and P.G.M. Wuts, Protective Groups in Organic Synthesis, 3rd Ed., John Wiley and Sons (1999); L. Fieser and M. Fieser, Fieser and Fieser's Reagents for Organic Synthesis, John Wiley and Sons (1994); и L. Paquette, ed., Encyclopedia of Reagents for Organic Synthesis, John Wiley and Sons (1995) и их последующие издания.
Пирролидиновые соединения, полученные таким образом, могут быть дополнительно очищены посредством колоночной хроматографии, высокоэффективной жидкостной хроматографии или кристаллизации.
Настоящее изобретение распространяется на способ ингибирования DPP-IV посредством ее контакта с эффективным количеством одного или более из пирролидиновых соединений, описанных выше. Настоящее изобретение также распространяется на способ лечения диабета типа II посредством введения субъекту, нуждающемуся в этом, эффективного количества одного или более из пирролидиновых соединений, описанных выше. Термин «лечение» относится к применению или введению пирролидинового соединения субъекту, который имеет диабет типа II, симптом диабета типа II или предрасположенность к диабету типа II, с целью лечения, исцеления, ослабления, уменьшения тяжести, изменения, устранения, облегчения, улучшения состояния при заболевании, симптоме или предрасположенности или с целью воздействия на заболевание, симптом или предрасположенность. Термин «эффективное количество» относится к количеству пирролидинового соединения, которое требуется для достижения желаемого эффекта у субъекта. Как признано специалистами в данной области, эффективные количества варьируют в зависимости от пути введения, применения эксципиентов и возможности совместного применения с другими терапевтическими воздействиями, такими как применение других активных средств.
Для практического применения способа лечения согласно настоящему изобретению композицию, имеющую одно или более из пирролидиновых соединений, описанных выше, можно вводить парентерально, перорально, интраназально, ректально, местно или буккально. Термин «парентерально», используемый в настоящем документе, относится к подкожной, внутрикожной, внутривенной, внутримышечной, внутрисуставной, внутриартериальной, интрасиновиальной, интрастернальной, интратекальной, внутрираневой или внутричерепной инъекции, а также к любому подходящему способу инфузии.
Стерильной инъецируемой композицией может быть раствор или суспензия в нетоксичном разбавителе или растворителе, приемлемом для парентерального введения, таком как раствор в 1,3-бутандиоле. К приемлемым носителям и растворителям, которые можно применять, относятся маннит и вода. Кроме того, в качестве растворителя или суспендирующей среды традиционно применяют нелетучие масла (например, синтетические моно- или диглицериды). Для получения инъекционных препаратов можно применять жирные кислоты, такие как олеиновая кислота и ее глицеридные производные, так же, как природные фармацевтически приемлемые масла, такие как оливковое масло или касторовое масло, особенно в их полиэтоксилированных формах. Эти масляные растворы или суспензии могут также содержать длинноцепочечный спирт в качестве разбавителя или диспергирующего средства, карбоксиметилцеллюлозу или аналогичные диспергирующие средства. Для получения препарата можно также применять другие широко применяемые поверхностно-активные вещества, такие как Твины или Спаны, или другие аналогичные эмульгаторы или средства повышения биодоступности, которые обычно применяют при изготовлении фармацевтически приемлемых твердых, жидких или других дозированных форм.
Композицией для перорального введения может быть любая дозированная форма, приемлемая для перорального введения, включая капсулы, таблетки, эмульсии и водные суспензии, дисперсии и растворы. В случае таблеток обычно применяемые носители включают лактозу и кукурузный крахмал. Обычно также добавляют смазывающие средства, такие как стеарат магния. Разбавители, применимые для перорального введения в форме капсул, включают лактозу и высушенный кукурузный крахмал. Когда водные суспензии или эмульсии вводят перорально, активный ингредиент может быть суспендированным или растворенным в масляной фазе, смешанной с эмульгаторами или суспендирующими средствами. Если желательно, можно добавлять определенные подсластители, отдушки или окрашивающие средства.
Интраназальная аэрозольная или ингаляционная композиция может быть получена способами, хорошо известными в области приготовления фармацевтических препаратов. Например, такую композицию можно получать в виде раствора в солевом физиологическом растворе, применяя бензиловый спирт или другой подходящий консервант, стимуляторы всасывания, способствующие увеличению биодоступности, фторуглероды и/или другие солюбилизаторы или диспергирующие средства, известные в данной области техники. Композицию, имеющую активные пирролидиновые соединения, можно также применять в форме суппозиториев для ректального введения.
Носитель в фармацевтической композиции должен быть «приемлемым» в том смысле, что он должен быть совместимым с активным ингредиентом композиции (и, предпочтительно, способным стабилизировать активный ингредиент) и безопасным для субъекта, подвергаемого лечению. В качестве эксципиентов для доставки активного пирролидинового соединения можно применять одно или более солюбилизирующих средств. Примеры других носителей включают коллоидный оксид кремния, стеарат магния, целлюлозу, лаурилсульфат натрия и D&C Yellow # 10.
При лечении диабета типа II пирролидиновые соединения согласно настоящему изобретению можно применять отдельно или совместно с другим противодиабетическим лекарственным средством. Примеры противодиабетических лекарственных средств включают, но не ограничиваются ими, стимуляторы секреции инсулина (сульфонилмочевины или меглитиниды), средства, повышающие чувствительность к инсулину (тиазолидиндионы), бигуанид или ингибитор α-глюкозидазы.
Предварительный скрининг пирролидиновых соединений согласно настоящему изобретению можно проводить посредством исследования in vitro одного или более из видов их желаемой активности, например, по ингибированию DPP-IV. Для соединений, продемонстрировавших высокую активность при предварительном скрининге, можно проводить дальнейший скрининг по их эффективности в исследованиях in vivo. Например, испытуемое соединение можно вводить животному (например, модель с мышами), имеющему диабет типа II, и затем оценивать его терапевтические эффекты. На основании полученных результатов можно также определять соответствующий диапазон доз и путь введения.
Конкретные примеры, приведенные ниже, следует истолковывать только как иллюстративные и никоим образом не ограничивающие остальную часть настоящего раскрытия. Без дальнейших уточнений предполагается, что специалист в данной области техники, основываясь на описании, представленном в настоящем документе, сможет применять настоящее изобретение в его самой полной степени. Все публикации, цитируемые в настоящем документе, настоящим указанием во всей их полноте включены в настоящий документ посредством ссылки.
Пример 1
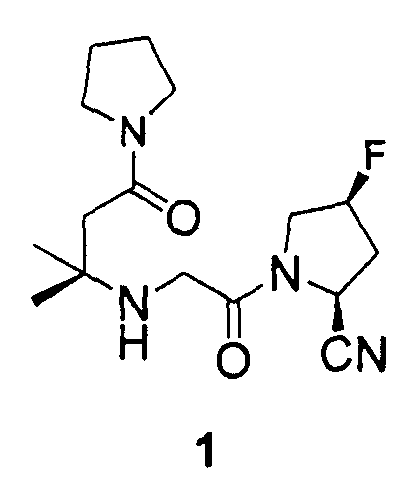
Синтез (2S,4S)-1-[2-(1,1-диметил-3-оксо-3-пирролидин-1-ил-пропиламино)ацетил]-4-фторпирролидин-2-карбонитрила (соединение 1)
(1) Получение трифторацетата 3-амино-3-метил-1-пирролидин-1-илбутан-1-она
К смеси 3-(трет-бутоксикарбониламино)-3-метилбутановой кислоты (0,87 г, 4 ммоль), пирролидина (0,28 г, 4 ммоль) и гидрата 1-гидроксибензотриазола (HOBt гидрат, 0,54 г, 4 ммоль) в CH2Cl2 (10 мл) добавляли гидрохлорид N-этил-N'-(3-диметиламинопропил)карбодиимида (EDC, 0,77 г, 4 ммоль). Реакционную смесь перемешивали при температуре окружающей среды в течение 12 ч, разбавляли CH2Cl2 (40 мл) и промывали насыщенным водным бикарбонатом натрия (20 мл), 0,5н водной лимонной кислотой (20 мл) и солевым раствором (20 мл). Органический слой отделяли, сушили над сульфатом магния, фильтровали и концентрировали при пониженном давлении, получая неочищенное вязкое масло. Неочищенное масло очищали посредством флэш-хроматографии (силикагель, 40% этилацетат/гексаны), получая N-Boc-защищенный амин (1,03 г) в виде бесцветного масла.
Раствор вышеуказанного амина в трифторуксусной кислоте (TFA, 2 мл) перемешивали при комнатной температуре в течение 10 мин и концентрировали в вакууме, получая трифторацетат 3-амино-3-метил-1-пирролидин-1-илбутан-1-она (1,08 г, 95% общий выход) в виде бесцветного масла, которое применяли на следующей стадии без дальнейшей очистки.
(2) Получение (2S,4S)-1-[2-(1,1-диметил-3-оксо-3-пирролидин-1-илпропиламино)ацетил]-4-фторпирролидин-2-карбонитрила (соединение 1)
К перемешиваемому раствору трифторацетата 3-амино-3-метил-1-пирролидин-1-илбутан-1-она (0,28 г, 1 ммоль) в безводном THF (5 мл) добавляли карбонат калия (0,55 г, 4 ммоль). После перемешивания при комнатной температуре в течение 1 ч смесь фильтровали через слой Целита, который ополаскивали этилацетатом (5 мл). К вышеуказанному фильтрату добавляли (2S,4S)-1-(2-бромацетил)-4-фторпирролидин-2-карбонитрил (0,12 г, 0,5 ммоль) и реакционную смесь перемешивали при комнатной температуре в атмосфере азота в течение 12 ч. Большую часть растворителя удаляли при пониженном давлении и остаток распределяли между CH2Cl2 (20 мл) и H2O (5 мл). Водный слой дополнительно экстрагировали CH2Cl2 (10 мл). Объединенные органические слои сушили над сульфатом магния, фильтровали и концентрировали при пониженном давлении, получая неочищенное вязкое масло. Неочищенное масло очищали посредством хроматографии (силикагель, градиент от 4 до 10% CH3OH/CH2Cl2), получая соединение 1 (0,12 г, 74% общий выход) в виде белого твердого вещества.
1H ЯМР (CDCl3, 300 МГц, δ): (2/1 смесь транс/цис амидных ротомеров) 5,53 (д, J=9,0 Гц, 1/3H), 5,49 (т, J=3,3 Гц, 1/3H), 5,40 (т, J=3,3 Гц, 1/6H), 5,32 (т, J=3,3 Гц, 1/3H), 5,22 (т, J=3,3 Гц, 1/6H), 4,95 (д, J=9,0 Гц, 2/3H), 4,04-3,52 (м, 2H), 3,48-3,39 (м, 6H), 2,70 (т, J=15,9 Гц, 1/3H), 2,62 (т, J=15,9 Гц, 2/3H), 2,44-2,26 (м, 3H, перекрываемый синглет при 2,39), 1,98-1,79 (м, 4H), 1,22 (с, 6H);
MS (ES+) m/z рассчитано для C16H25FN4O2: 324,39; найдено: 325,2 (M+H), 347,2 (M+Na).
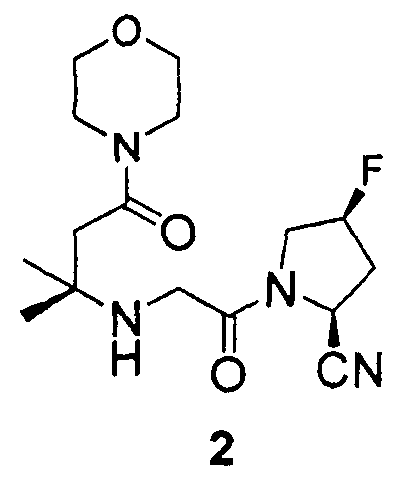
Пример 2
Синтез (2S,4S)-1-[2-(1,1-диметил-3-морфолин-4-ил-3-оксопропиламино)ацетил]-4-фторпирролидин-2-карбонитрила (соединение 2)
Соединение 2 получали способом, подобным способу, описанному в примере 1.
1H ЯМР (CDCl3, 300 МГц, δ): (2/1 смесь транс/цис амидных ротомеров) 5,50 (т, J=3,3 Гц, 1/3H), 5,42 (т, J=3,3 Гц, 1/6H), 5,38 (д, J=9,0 Гц, 1/3H), 5,32 (т, J=3,3 Гц, 1/3H), 5,23 (т, J=3,3 Гц, 1/6H), 4,94 (д, J=9,0 Гц, 2/3H), 4,12-3,35 (м, 12H, перекрываемый синглет при 3,41), 2,70 (т, J=15,6 Гц, 1/3H), 2,65 (т, J=15,6 Гц, 2/3H), 2,50-2,18 (м, 3H), 1,20 (c, 6H);
MS (ES+) m/z рассчитано для C16H25FN4O3: 340,39; найдено: 341,2 (M+H), 363,2 (M+Na).
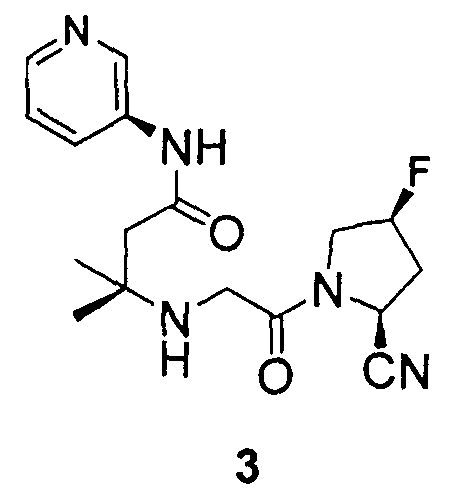
Пример 3
Синтез 3-[2-((2S,4S)-2-циано-4-фторпирролидин-1-ил)-2-оксоэтиламино]-3-метил-N-пиридин-3-илбутирамида (соединение 3)
Соединение 3 получали способом, подобным способу, описанному в примере 1.
1H ЯМР (CDCl3, 300 МГц, δ): (3/1 смесь транс/цис амидных ротомеров) 11,12 (ушир.с, 3/4H), 11,01 (ушир.с, 1/4H), 8,66-8,63 (м, 1H), 8,28 (д, J=4,5 Гц, 1H), 8,22-8,14 (м, 1H), 7,26-7,21 (м, 1H), 5,53 (т, J=3,3 Гц, 3/8H), 5,46 (т, J=3,3 Гц, 1/8H), 5,36 (т, J=3,3 Гц, 3/8H), 5,29 (т, J=3,3 Гц, 1/8H), 4,98 (д, J=9,3 Гц, 3/4H), 4,80 (д, J=9,3 Гц, 1/4H), 3,97-3,61 (м, 2H), 3,46 (кв-подобн., J=16,8 Гц, 2H), 2,79 (т, J=15,3 Гц, 1/4H), 2,71 (т, J=15,3 Гц, 3/4H), 2,50-2,39 (м, 3H, 2 перекрывающихся синглета при 2,45, 2,44), 1,26 (с, 3H), 1,24 (с, 3H);
MS (ES+) m/z рассчитано для C17H22FN5O2:347,39; найдено: 348,2 (M+H), 370,2 (M+Na).
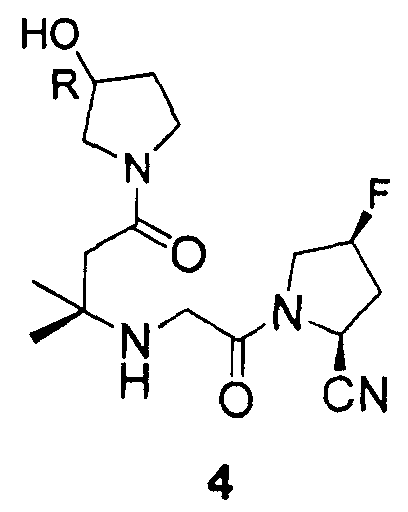
Пример 4
Синтез (2S,4S)-4-фтор-1-{2-[3-((R)-3-гидроксипирролидин-1-ил)-1,1-диметил-3-оксопропиламино]ацетил}пирролидин-2-карбонитрила (соединение 4)
Соединение 4 получали способом, подобным способу, описанному в примере 1.
1H ЯМР (CDCl3, 300 МГц, δ): (2/1 смесь транс/цис амидных ротомеров) 5,50 (т, J=3,3 Гц, 1/3H), 5,40 (т, J=3,3 Гц, 1/6H), 5,38 (д, J=9,0 Гц, 1/3H), 5,32 (т, J=3,3 Гц, 1/3H), 5,23 (т, J=3,3 Гц, 1/6H), 4,94 (д, J=9,0 Гц, 2/3H), 4,47-4,21 (м, 1H), 3,99-3,22 (м, 8H), 2,84 (ушир.с, OH), 2,69 (т, J=15,3 Гц, 1/3H), 2,61 (т, J=15,3 Гц, 2/3H), 2,50-2,15 (м, 3H), 2,04-1,89 (м, 2H), 1,21 (с, 3H), 1,18 (с, 3H);
MS (ES+) m/z рассчитано для C16H25FN4O3: 340,39; найдено: 341,2 (M+H), 363,2 (M+Na).
Пример 5
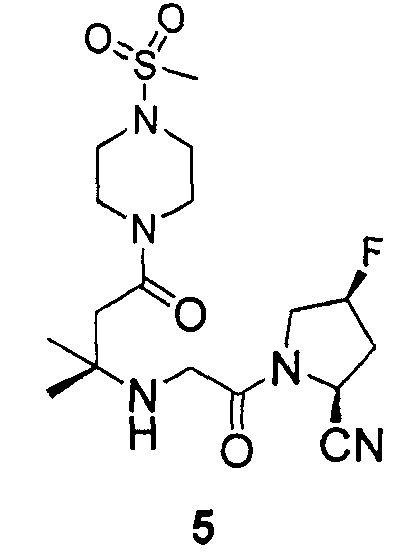
Синтез (2S,4S)-4-фтор-1-(2-(2-метил-4-(4-(метилсульфонил)пиперазин-1-ил)-4-оксобутан-2-иламино)ацетил)пирролидин-2-карбонитрила (соединение 5)
Соединение 5 получали способом, подобным способу, описанному в примере 1.
Пример 6
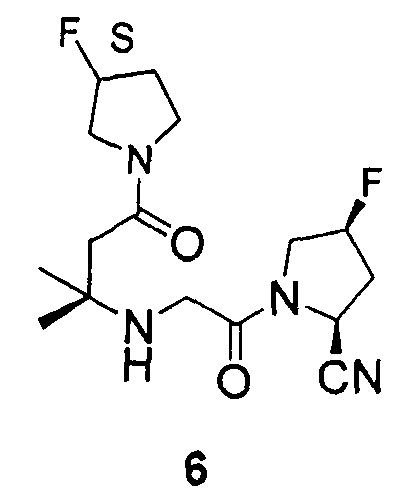
Синтез (2S,4S)-4-фтор-1-(2-(4-((R)-3-фторпирролидин-1-ил)-2-метил-4-оксобутан-2-иламино)ацетил)пирролидин-2-карбонитрила (соединение 6)
Соединение 6 получали способом, подобным способу, описанному в примере 1.
1H ЯМР (CDCl3, 300 МГц, δ): (3/1 смесь транс/цис амидных ротомеров) 5,50 (т, J=3,0 Гц, 3/8H), 5,41 (т, J=3,0 Гц, 1/8H), 5,3 (т, J=3,0 Гц, 3/8H), 5,25 (т, J=3,0 Гц, 1/8H), 5,23 (д, J=9,3 Гц, 1/4H), 4,92 (д, J=9,3 Гц, 3/4H), 4,00-3,40 (м, 8H, перекрываемый синглет при 3,46), 3,31-3,20 (м, 4H), 2,80 (c, 9/4H), 2,78 (c, 3/4H), 2,69 (т, J=15,6 Гц, 1/4H), 2,64 (т, J=15,6 Гц, 3/4H), 2,54-2,23 (м, 3H, перекрываемый синглет при 2,51), 1,24 (c, 6H);
MS (ES+) m/z рассчитано для C17H28FN5O4S: 417,50; найдено: 418,2 (M+H), 440,1 (M+Na).
Пример 7
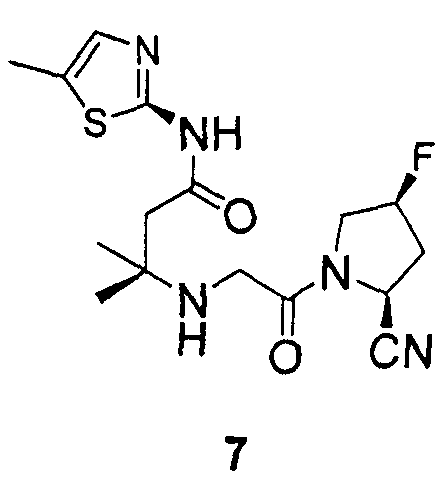
Синтез 3-[2-((2S,4S)-2-циано-4-фторпирролидин-1-ил)-2-оксоэтиламино]-3-метил-N-(5-метилтиазол-2-ил)бутирамида (соединение 7)
Соединение 7 получали способом, подобным способу, описанному в примере 1.
1H ЯМР (CDCl3, 300 МГц, δ): (3/1 смесь транс/цис амидных ротомеров) 6,48 (c, 1H), 5,53 (т, J=3,3 Гц, 3/8H), 5,45 (т, J=3,3 Гц, 1/8H), 5,36 (т, J=3,3 Гц, 3/8H), 5,32 (т, J=3,3 Гц, 1/8H), 4,89 (д, J=9,0 Гц, 3/4H), 4,87 (д, J=9,0 Гц, 1/4H), 4,12-3,63 (м, 2H), 3,52-3,39 (м, 2H), 2,75 (т, J=15,6 Гц, 1/4H), 2,70 (т, J=15,6 Гц, 3/4H), 2,60-2,26 (м, 6H, перекрываемый дублет при 2,51, J=2,4 Гц и синглет при 2,31), 1,25 (c, 3H), 1,22 (c, 3H);
MS (ES+) m/z рассчитано для C16H22FN5O2S: 367,44; найдено: 368,1 (M+H), 390,1 (M+Na).
Пример 8
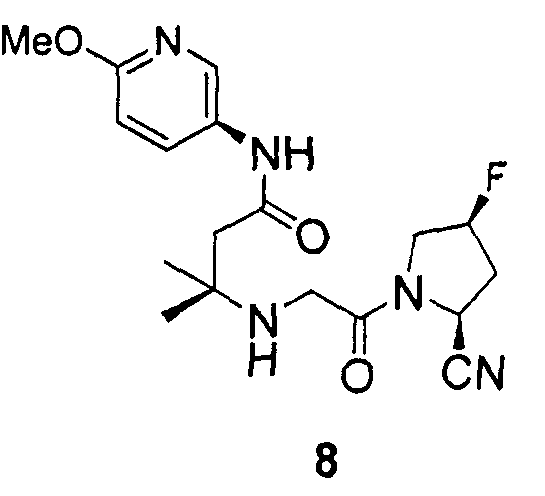
Синтез 3-[2-((2S,4S)-2-циано-4-фторпирролидин-1-ил)-2-оксоэтиламино]-N-(6-метоксипиридин-3-ил)-3-метилбутирамида (соединение 8)
Соединение 8 получали способом, подобным способу, описанному в примере 1.
1H ЯМР (CDCl3, 300 МГц, δ): (3/1 смесь транс/цис амидных ротомеров) 10,76 (ушир.с, 3/4H), 10,59 (ушир.с, 1/4H), 8,29-8,26 (м, 1H), 7,96 (дд, J=9,0, 3,0 Гц, 1H), 6,70 (д, J=9,0 Гц, 1H), 5,54 (т, J=3,6 Гц, 3/8H), 5,46 (т, J=3,6 Гц, 1/8H), 5,36 (т, J=3,6 Гц, 3/8H), 5,29 (т, J=3,6 Гц, 1/8H), 4,98 (д, J=9,0 Гц, 3/4H), 4,80 (д, J=9,0 Гц, 1/4H), 4,13-3,55 (м, 5H, перекрываемый синглет при 3,89), 3,45 (кв-подобн., J=16,2 Гц, 2H), 2,79 (т, J=15,3 Гц, 1/4H), 2,71 (т, J=15,3 Гц, 3/4H), 2,49-2,23 (м, 3H, 2 перекрывающихся синглета при 2,44, 2,42), 1,26 (с, 3H), 1,24 (с, 3H);
MS (ES+) m/z рассчитано для C18H24FN5O3: 377,41; найдено: 378,2 (M+H), 400,1 (M+Na).
Пример 9
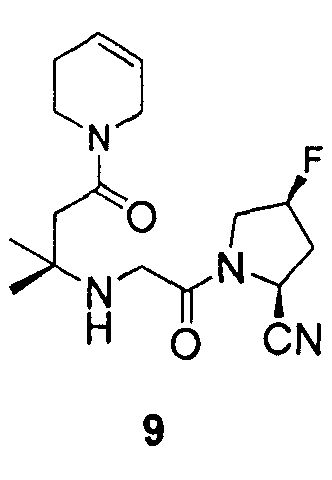
Синтез (2S,4S)-1-{2-[3-(3,6-дигидро-2H-пиридин-1-ил)-1,1-диметил-3-оксопропиламино]ацетил}-4-фторпирролидин-2-карбонитрила (соединение 9)
Соединение 9 получали способом, подобным способу, описанному в примере 1.
1H ЯМР (CDCl3, 300 МГц, δ): (2/1 смесь транс/цис амидных ротомеров) 5,89-5,77 (м, 1H), 5,69-5,60 (м, 1H), 5,49 (т, J=3,3 Гц, 1/3H), 5,46 (д, J=9,3 Гц, 1/3H), 5,40 (т, J=3,3 Гц, 1/6H), 5,31 (т, J=3,3 Гц, 1/3H), 5,22 (т, J=3,3 Гц, 1/6H), 4,92 (д, J=9,3 Гц, 2/3H), 4,02-3,39 (м, 8H), 2,67 (т, J=15,3 Гц, 1/3H), 2,61 (т, J=15,3 Гц, 2/3H), 2,48-2,12 (м, 5H), 1,19 (c, 3H), 1,18 (c, 3H);
MS (ES+) m/z рассчитано для C17H25FN4O2: 336,40; найдено: 337,2 (M+H), 359,2 (M+Na).
Пример 10
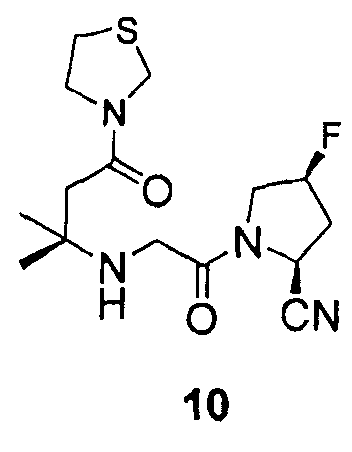
Синтез (2S,4S)-1-[2-(1,1-диметил-3-оксо-3-тиазолидин-3-илпропиламино)ацетил]-4-фторпирролидин-2-карбонитрила (соединение 10)
Соединение 10 получали способом, подобным способу, описанному в примере 1.
1H ЯМР (CDCl3, 300 МГц, δ): (2/1 смесь транс/цис амидных ротомеров) 5,52 (т, J=3,3 Гц, 1/3H), 5,43 (т, J=3,3 Гц, 1/6H), 5,36 (т, J=3,3 Гц, 1/3H), 5,33 (д, J=9,0 Гц, 1/3H), 5,25 (т, J=3,3 Гц, 1/6H), 4,96 (д, J=9,0 Гц, 2/3H), 4,57 (c, 1H), 4,51 (c, 1H), 4,02-3,04 (м, 6H, перекрываемый синглет при 3,43), 3,10 (т, J=6,3 Гц, 1H), 3,00 (т, J=6,3 Гц, 1H), 2,75 (т, J=15,6 Гц, 1/3H), 2,64 (т, J=15,6 Гц, 2/3H), 2,51-2,24 (м, 3H, 2 перекрывающихся синглета при 2,47, 2,46), 1,23 (c, 6H);
MS (ES+) m/z рассчитано для C15H23FN4O2S: 342,43; найдено: 343,1 (M+H), 365,1 (M+Na).
Пример 11
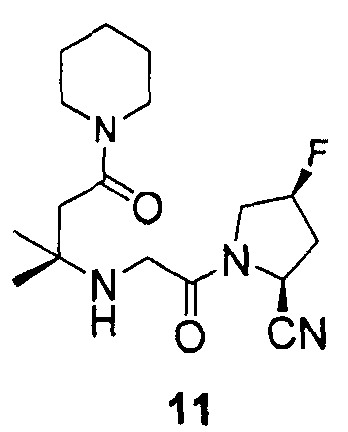
Синтез (2S,4S)-1-[2-(1,1-диметил-3-оксо-3-пиперидин-1-илпропиламино)ацетил]-4-фторпирролидин-2-карбонитрила (соединение 11)
Соединение 11 получали способом, подобным способу, описанному в примере 1.
1H ЯМР (CDCl3, 300 МГц, δ): (2/1 смесь транс/цис амидных ротомеров) 5,48 (т, J=3,3 Гц, 1/3H), 5,45 (д, J=9,3 Гц, 1/3H), 5,39 (т, J=3,3 Гц, 1/6H), 5,30 (т, J=3,3 Гц, 1/3H), 5,22 (т, J=3,3 Гц, 1/6H), 4,93 (д, J=9,3 Гц, 2/3H), 4,00-3,35 (м, 8H), 2,67 (т, J=15,6 Гц, 1/3H), 2,60 (т, J=15,6 Гц, 2/3H), 2,50-2,20 (м, 3H, перекрываемый синглет при 2,41), 1,64-1,44 (м, 6H), 1,18 (c, 6H);
MS (ES+) m/z рассчитано для C17H27FN4O2: 338,42; найдено: 339,2 (M+H), 361,2 (M+Na).
Пример 12
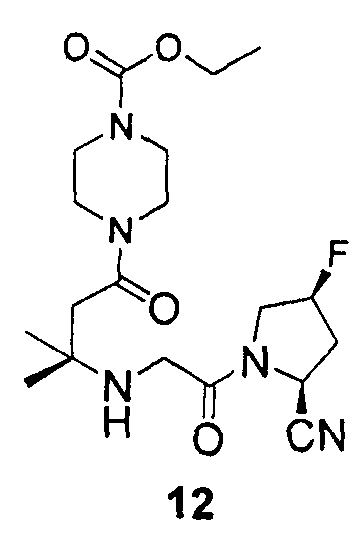
Синтез этилового эфира 4-{3-[2-((2S,4S)-2-циано-4-фторпирролидин-1-ил)-2-оксоэтиламино]-3-метил-бутирил}пиперазин-1-карбоновой кислоты (соединение 12)
Соединение 12 получали способом, подобным способу, описанному в примере 1.
1H ЯМР (CDCl3, 300 МГц, δ): (2/1 смесь транс/цис амидных ротомеров) 5,51 (т, J=3,3 Гц, 1/3H), 5,42 (т, J=3,3 Гц, 1/6H), 5,36 (д, J=9,0 Гц, 1/3H), 5,34 (т, J=3,3 Гц, 1/3H), 5,25 (т, J=3,3 Гц, 1/6H), 4,96 (д, J=9,0 Гц, 2/3H), 4,16 (кв, J=6,9 Гц, 2H), 4,19-3,38 (м, 12H), 2,72 (т, J=15,3 Гц, 1/3H), 2,65 (т, J=15,3 Гц, 2/3H), 2,53-2,22 (м, 3H, 2 перекрывающихся синглета при 2,46, 2,43), 1,27 (т, J=6,9 Гц, 3H), 1,22 (с, 6H).
MS (ES+) m/z рассчитано для C19H30FN5O4: 411,47; найдено: 412,2 (M+H), 434,2 (M+Na).
Пример 13
Синтез 3-[2-((2S,4S)-2-циано-4-фторпирролидин-1-ил)-2-оксоэтиламино]-N-циклопентил-3-метилбутирамида (соединение 13)
Соединение 13 получали способом, подобным способу, описанному в примере 1.
1H ЯМР (CDCl3, 300 МГц, δ): (4/1 смесь транс/цис амидных ротомеров) 7,94 (д, J=7,2 Гц, 4/5H), 7,59 (д, J=7,2 Гц, 1/5H), 5,51 (т, J=3,3 Гц, 2/5H), 5,4 (т, J=3,3 Гц, 1/10H), 5,34 (т, J=3,3 Гц, 2/5H), 5,25 (т, J=3,3 Гц, 1/10H), 5,02 (д, J=9,0 Гц, 1/5H), 4,92 (д, J=9,0 Гц, 4/5H), 4,20-4,07 (м, 1H), 4,03-3,27 (м, 4H), 2,73 (т, J=15,6 Гц, 1/5H), 2,65 (т, J=15,6 Гц, 4/5H), 2,44-2,10 (м, 3H), 1,91-1,82 (м, 2H), 1,68-1,48 (м, 4H), 1,43-1,31 (м, 2H), 1,15 (с, 6H).
MS (ES+) m/z рассчитано для C17H27FN4O2: 338,42; найдено: 339,4 (M+H), 361,4 (M+Na).
Пример 14
Синтез (2S,4S)-4-фтор-1-{2-[3-((S)-2-гидроксиметилпирролидин-1-ил)-1,1-диметил-3-оксопропиламино]ацетил}пирролидин-2-карбонитрила (соединение 14)
Соединение 14 получали способом, подобным способу, описанному в примере 1.
1H ЯМР (CDCl3, 300 МГц, δ): (2/1 смесь транс/цис амидных ротомеров) 5,50 (т, J=3,3 Гц, 1/3H), 5,41 (т, J=3,3 Гц, 1/6H), 5,37 (д, J=9,3 Гц, 1/3H), 5,32 (т, J=3,3 Гц, 1/3H), 5,22 (т, J=3,3 Гц, 1/6H), 4,95 (д, J=9,0 Гц, 2/3H), 4,26-4,19 (м, 1H), 4,03-3,37 (м, 8H, перекрываемый синглет при 3,43), 2,70 (т, J=15,6 Гц, 1/3H), 2,63 (т, J=15,6 Гц, 2/3H), 2,55 (ушир.с, OH), 2,52-2,21 (м, 3H, перекрываемый синглет при 2,42), 2,07-1,79 (м, 3H), 1,69-1,57 (м, 1H), 1,22 (с, 6H);
MS (ES+) m/z рассчитано для C17H27FN4O3: 354,42; найдено: 355,2 (M+H), 377,2 (M+Na).
Пример 15
Синтез (2S,4S)-1-{2-[1,1-диметил-3-((R)-2-метил-пирролидин-1-ил)-3-оксопропиламино]ацетил}-4-фторпирролидин-2-карбонитрил (соединение 15)
Соединение 15 получали способом, подобным способу, описанному в примере 1.
1H ЯМР (CDCl3, 300 МГц, δ): (2/1 смесь транс/цис амидных ротомеров) 5,52-5,47 (м, 2/3H), 5,39 (т, J=3,3 Гц, 1/6H), 5,31 (т, J=3,3 Гц, 1/3H), 5,22 (т, J=3,3 Гц, 1/6H), 4,92 (д, J=9,3 Гц, 2/3H), 4,19-3,31 (м, 6H, перекрываемый синглет при 3,39), 2,78-2,19 (м, 5H), 2,02-1,83 (м, 3H), 1,68-1,49 (м, 1H), 1,19-1,12 (м, 9H);
MS (ES+) m/z рассчитано для C17H27FN4O2: 338,42; найдено: 339,4 (M+H), 361,4 (M+Na).
Пример 16
Синтез (2S,4S)-1-{2-[3-(1,3-дигидроизоиндол-2-ил)-1,1-диметил-3-оксопропиламино]ацетил}-4-фторпирролидин-2-карбонитрил (соединение 16)
Соединение 16 получали способом, подобным способу, описанному в примере 1.
1H ЯМР (CDCl3, 300 МГц, δ): (3/1 смесь транс/цис амидных ротомеров) 7,30-7,16 (м, 4H), 5,52 (д, J=9,3 Гц, 1/4H), 5,50 (т, J=3,3 Гц, 3/8H), 5,40 (т, J=3,3 Гц, 1/8H), 5,31 (т, J=3,3 Гц, 3/8H), 5,23 (т, J=3,3 Гц, 1/8H), 4,94 (д, J=9 Гц, 3/4H), 4,83 (c, 2H), 4,78 (c, 2H), 4,15-3,35 (м, 4H, перекрываемый синглет при 3,45), 2,70 (т, J=15,3 Гц, 1/4H), 2,64 (т, J=15,3 Гц, 3/4H), 2,59-2,18 (м, 3H), 1,22 (c, 6H);
MS (ES+) m/z рассчитано для C20H25FN4O2: 372,44; найдено: 373,2 (M+H), 395,2 (M+Na).
Примеры 17-20
Синтез соединений 17-20
Соединения 17-20 получали способами, подобными способу, описанному в примере 1.
Пример 21
Синтез трифторацетата (2S)-1-[2-амино-5-((S)-2-метоксиметилпирролидин-1-ил)-5-оксопентаноил]пирролидин-2-карбонитрила (соединение 21)
(1) Получение метилового эфира 2-трет-бутоксикарбониламино-5-((S)-2-метоксиметилпирролидин-1-ил)-5-оксопентановой кислоты
К смеси 4-(трет-бутоксикарбониламино)-5-метокси-5-оксопентановой кислоты (1,05 г, 4 ммоль), (S)-2-(метоксиметил)пирролидина (0,46 г, 4 ммоль) и гидрата 1-гидроксибензотриазола (HOBt-гидрат, 0,54 г, 4 ммоль) в CH2Cl2 (10 мл) добавляли EDC (0,77 г, 4 ммоль). Реакционную смесь перемешивали при температуре окружающей среды в течение 12 ч, разбавляли CH2Cl2 (40 мл), промывали последовательно насыщенным водным бикарбонатом натрия (20 мл), 0,5н лимонной кислотой (20 мл) и солевым раствором (20 мл), сушили над сульфатом магния, фильтровали и концентрировали при пониженном давлении, получая неочищенное вязкое масло. Неочищенное масло очищали посредством флэш-хроматографии (силикагель, 50% этилацетат/гексаны), получая соединение, указанное в заголовке (1,36 г, 95%) в виде бесцветного масла.
(2) Получение 2-трет-бутоксикарбониламино-5-((S)-2-метоксиметилпирролидин-1-ил)-5-оксопентановой кислоты
К перемешиваемому раствору метилового эфира 2-трет-бутоксикарбониламино-5-((S)-2-метоксиметилпирролидин-1-ил)-5-оксопентановой кислоты (0,72 г, 2 ммоль) в CH3OH (20 мл) добавляли 2н водный гидроксид натрия (20 мл). После перемешивания при комнатной температуре в течение 12 ч смесь подкисляли добавлением 6н водной хлористоводородной кислоты при 0°С до рН=4. Большую часть метанола удаляли при пониженном давлении и остаток распределяли между CH2Cl2 (20 мл) и H2O (20 мл). Водный слой дополнительно экстрагировали CH2Cl2 (20 мл). Объединенные органические слои сушили над сульфатом магния, фильтровали и концентрировали при пониженном давлении, получая соединение, указанное в заголовке (0,54 г, 79%), в виде пенообразного твердого вещества, которое применяли на следующей стадии без дальнейшей очистки.
(3) Получение трет-бутил-1-((S)-2-карбамоилпирролидин-1-ил)-5-((S)-2-(метоксиметил)пирролидин-1-ил)-1,5-диоксопентан-2-илкарбамата
К смеси 2-трет-бутоксикарбониламино-5-((S)-2-метоксиметилпирролидин-1-ил)-5-оксопентановой кислоты (0,34 г, 1 ммоль), L-пролинамида (0,11 г, 1 ммоль) и HOBt-гидрата (0,14 г, 1 ммоль) в CH2Cl2 (5 мл) добавляли EDC (0,19 г, 1 ммоль). Реакционную смесь перемешивали при температуре окружающей среды в течение 12 ч, разбавляли CH2Cl2 (20 мл), промывали последовательно насыщенным водным бикарбонатом натрия (10 мл), 0,5н водной лимонной кислотой (10 мл) и солевым раствором (10 мл), сушили над сульфатом магния, фильтровали и концентрировали при пониженном давлении, получая неочищенное вязкое масло. Неочищенное масло очищали посредством флэш-хроматографии (силикагель, градиент от 2 до 8% CH3OH/CH2Cl2), получая соединение, указанное в заголовке (0,36 г, 81%) в виде пенообразного твердого вещества.
(4) Получение трифторацетата (2S)-1-[2-амино-5-((S)-2-метоксиметил-пирролидин-1-ил)-5-оксопентаноил]пирролидин-2-карбонитрила (соединение 21)
К смеси трет-бутил-1-((S)-2-карбамоилпирролидин-1-ил)-5-((S)-2-(метоксиметил)пирролидин-1-ил)-1,5-диоксопентан-2-илкарбамата (0,36 г, 0,8 ммоль) и имидазола (0,68 г, 1 ммоль) в пиридине (4 мл) при -20°С добавляли фосфорилхлорид (0,32 г, 2,1 ммоль). Суспензию перемешивали при -20°С в течение 1 ч, нагревали до комнатной температуры и концентрировали в вакууме. Остаток распределяли между CH2Cl2 (10 мл) и 0,5н водной лимонной кислотой (10 мл). Водный слой дополнительно экстрагировали CH2Cl2 (10 мл). Объединенные органические слои сушили над сульфатом магния, фильтровали и концентрировали при пониженном давлении, получая бледно-желтое масло. Неочищенное масло очищали посредством флэш-хроматографии (силикагель, 50% этилацетат/дихлорметан), получая бесцветное масло.
Раствор вышеуказанного масла в трифторуксусной кислоте (TFA, 1 мл) перемешивали при комнатной температуре в течение 10 мин и концентрировали в вакууме, получая соединение 21 (0,27 г, 77%) в виде пенообразного твердого вещества.
MS (ES+) m/z рассчитано для C16H26N4O3: 322,40; найдено: 323,6 (M+H), 345,6 (M+Na).
Пример 22
Синтез трифторацетата (2S)-1-[2-амино-5-((S)-2-гидроксиметилпирролидин-1-ил)-5-оксопентаноил]пирролидин-2-карбонитрила (соединение 22)
Соединение 22 получали способом, подобным способу, описанному в примере 21.
MS (ES+) m/z рассчитано для C15H24N4O3: 308,38; найдено: 309,1 (M+H), 331,1 (M+Na).
Пример 23
Синтез трифторацетата (2S)-1-[2-амино-5-((S)-2-метоксиметилпирролидин-1-ил)-3,3-диметил-5-оксопентаноил]пирролидин-2-карбонитрила (соединение 23)
Соединение 23 получали способом, подобным способу, описанному в примере 21.
MS (ES+) m/z рассчитано для C18H30N4O3: 350,46; найдено: 351,6 (M+H), 373,7 (M+Na).
Пример 24
Синтез трифторацетата (2S)-1-[2-амино-5-((R)-2-метилпирролидин-1-ил)-5-оксопентаноил]пирролидин-2-карбонитрила (соединение 24)
Соединение 24 получали способом, подобным способу, описанному в примере 21.
MS (ES+) m/z рассчитано для C18H30N4O3: 292,38; найдено: 293,6 (M+H), 315,6 (M+Na).
Пример 25
Синтез трифторацетата (2S)-1-(2-амино-5-((S)-2-(гидроксиметил)пирролидин-1-ил)-3,3-диметил-5-оксопентаноил)пирролидин-2-карбонитрила (соединение 25)
Соединение 25 получали способом, подобным способу, описанному в примере 21.
Пример 26
DPP-IV очищали из сыворотки человека и клеток насекомого способом, подобным способу, описанному в Biochemistry, 2006, 45: 7006-7012.
DPP-VIII очищали из клеток sfa, инфицированных бакуловирусом, способом, подобным способу, описанному в J. Biol. Chem. 2006, 28: 138653-138662.
Чистоту DPP-IV или DPP-VIII проверяли посредством SDS-PAGE с последующим окрашиванием красителем Commassie blue или серебряным красителем. Концентрации DPP-IV и DPP-VIII измеряли способом Bradford, применяя BSA в качестве стандарта (Anal. Biochem. 1976, 72: 248-254).
Соединения 1-24 испытывали по их ингибиторному эффекту на DPP-IV следующим образом: Для каждого соединения готовили и применяли 8 серийных разбавлений (конечные концентрации от 0,0046 до 10 мкмоль/л). 40 мкл DPP-IV в Tris (40 мМ, pH 8,3) инкубировали с 10 мкл испытуемого соединения в Tris, содержащем 1% DMSO при 37°C в инкубаторе при комнатной температуре в течение 10 мин. 50 мкл Gly-Pro-7-амино-4-метилкумарина (конечная концентрация: 150 мкМ) добавляли к раствору и инкубировали при 37°С в течение 1 ч. Высвобождение 7-амино-4-метилкумарина мониторировали непрерывно в фотометре (Victor2 V) для 96-луночных плашек и данные записывали на конечной точке реакции ингибирования. Значения IC50 рассчитывали, основываясь на результатах.
Аналогичным образом соединения 1-24 тестировали по их ингибиторному эффекту на DPP-VIII. DPP-VIII в PBS (137 мМ NaCl, 2,7 мМ KCl, 1,4 мМ KH2PO4, 4,3 мМ Na2HPO4, pH 7,4) инкубировали с 1 мкл испытуемого соединения в DMSO при 37°C в течение 10 мин. Добавляли 0,5 мкл Gly-Pro-пара-нитроанилида (конечная концентрация: 2,5 мМ). Раствор, полученный в результате этого, инкубировали при 37°С в течение 30-45 мин. Реакции мониторировали и измеряли при OD 405 нм. Значения IC50 рассчитывали, основываясь на результатах.
Все испытуемые соединения продемонстрировали низкие значения IC50 при ингибировании DPP-IV (как с ферментом из сыворотки человека, так и с ферментом из клеток насекомого) и высокие значения IC50 при ингибировании DPP-VIII (из клеток sfa, инфицированных бакуловирусом). Некоторые из испытуемых соединений показывали очень высокое отношение значения IC50 при ингибировании DPP-VIII к значению IC50 при ингибировании DPP-IV, например, 100 или даже более. Таким образом, все соединения 1-24 имеют высокую селективность ингибирования DPP-VI по сравнению с ингибированием DPP-VIII.
Другие варианты осуществления
Все варианты, раскрытые в настоящем описании, могут быть объединены в любой комбинации. Каждая особенность, раскрытая в настоящем описании, может быть заменена альтернативным вариантом, служащим той же самой, эквивалентной или подобной цели. Таким образом, если явно не указано иначе, каждый раскрытый вариант представляет собой только пример группового ряда эквивалентных или сходных вариантов.
Из описания, приведенного выше, специалист в данной области техники может легко определить существенные характеристики настоящего изобретения и, не отдаляясь от его сущности и объема, может сделать разнообразные изменения и модификации настоящего изобретения для адаптации его к различным областям применения и условиям. Например, соединения, структурно аналогичные пирролидиновым соединениям по настоящему изобретению, также могут быть получены, проскринированы по их ингибиторной активности в отношении DPP-IV и лечения диабета типа II и использованы в практическом применении по настоящему изобретению. Таким образом, другие варианты осуществления также включены в объем пунктов формулы изобретения.
IC50 (нМ)
IC50 (нМ)
IC50 (нМ)
| название | год | авторы | номер документа |
|---|---|---|---|
| ИНГИБИТОРЫ ДИПЕПТИДИЛПЕПТИДАЗЫ IV | 2010 |
|
RU2574410C2 |
| ПРОИЗВОДНОЕ 2-ЦИАНО-4-ФТОРПИРРОЛИДИНА ИЛИ ЕГО СОЛЬ | 2003 |
|
RU2288222C2 |
| ПРОТИВОВИРУСНЫЕ СОЕДИНЕНИЯ | 2010 |
|
RU2541571C2 |
| ПРОИЗВОДНЫЕ ДИЦИКЛОАЗААЛКАНА, СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ИХ ПРИМЕНЕНИЕ В МЕДИЦИНЕ | 2008 |
|
RU2487866C2 |
| ПОЛИЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ И СПОСОБЫ ЦЕЛЕНАПРАВЛЕННОЙ ДЕГРАДАЦИИ ПОЛИПЕПТИДОВ БЫСТРО УСКОРЕННОЙ ФИБРОСАРКОМЫ | 2019 |
|
RU2830173C2 |
| ПРОИЗВОДНЫЕ ХИНАЗОЛИНА, ИНГИБИРУЮЩИЕ АКТИВНОСТЬ EGFR | 2009 |
|
RU2505534C2 |
| ПРОИЗВОДНОЕ ВИТАМИНА D, СОДЕРЖАЩЕЕ ЦИКЛИЧЕСКИЙ АМИН В БОКОВОЙ ЦЕПИ | 2021 |
|
RU2819389C1 |
| ПРОИЗВОДНЫЕ ЦИКЛОПРОПИЛАМИНА В КАЧЕСТВЕ МОДУЛЯТОРОВ H-ГИСТАМИНОВОГО РЕЦЕПТОРА | 2007 |
|
RU2449989C2 |
| ПУРИНОВЫЕ ИНГИБИТОРЫ ЧЕЛОВЕЧЕСКОЙ ФОСФАТИДИЛИНОЗИТ 3-КИНАЗЫ ДЕЛЬТА | 2013 |
|
RU2658006C2 |
| СОЕДИНЕНИЯ И КОМПОЗИЦИИ, ПРИМЕНЯЕМЫЕ ДЛЯ ЛЕЧЕНИЯ РАССТРОЙСТВ, СВЯЗАННЫХ С NTRK | 2016 |
|
RU2744974C2 |
Изобретение относится к производным пирролидина формулы:
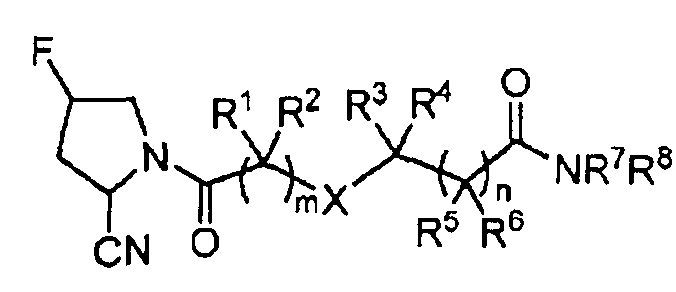
где каждый из R1, R2, R3, R4, R5 и R6 независимо означает Н, C1-10алкил; R7 означает C1-10алкил, 5-6-членный моноциклический ароматический гетероарил, имеющий один или два гетероатома, выбранных из N, S, необязательно замещенный С1-10алкилом; R8 означает Н, С1-10алкил; или R7 и R8 совместно с атомом N, к которому они присоединены, образуют 5-8-членное моноциклическое насыщенное или ненасыщенное кольцо, необязательно включающее второй гетероатом, выбранный из N, S, О, необязательно замещенное галогеном, CN, -OR', С1-10алкилом, гидроксиС1-10алкилом, C1-10алкоксиС1-10алкилом, -S(O)2R', -C(O)OR', или образуют 8-12-членное бициклическое насыщенное или ненасыщенное кольцо; R' означает Н, С1-10алкил; m и n независимо равны 0, 1, 2 или 3; X означает NRa, Ra означает Н. Соединения используют в способе ингибирования дипептидилпептидазы IV. 2 н. и 11 з.п. ф-лы, 1 табл, 26 пр.
1. Соединение следующей формулы:
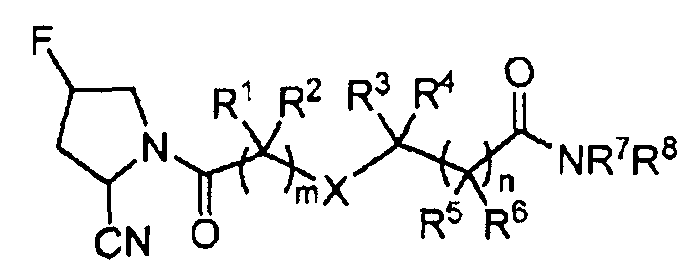
где каждый из R1, R2, R3, R4, R5 и R6, независимо, представляет собой Н или C1-10алкил;
R7 представляет собой С1-10алкил или 5-6-членный моноциклический ароматический гетероарил, имеющий один или два гетероатома, выбранных из азота или серы, необязательно замещенный С1-10алкилом; и
R8 представляет собой Н или С1-10алкил; или
R7 и R8, совместно с атомом N, к которому они присоединены, образуют 5-8-членное моноциклическое, насыщенное или ненасыщенное кольцо, необязательно включающее второй гетероатом, выбранный из азота, кислорода или серы, необязательно замещенное галогеном, CN, -OR', C1-10алкилом, гидроксиС1-10алкилом, С1-10алкоксиС1-10алкилом, -S(O)2R', -C(O)OR', или образуют 8-12-членное бициклическое, насыщенное или ненасыщенное кольцо; R' представляет собой Н или С1-10алкил;
каждое из m и n, независимо, равно 0, 1, 2 или 3; и
Х представляет собой NRa в котором Ra представляет собой Н.
2. Соединение по п.1, где каждый из R3 и R4 представляет собой C1-10алкил.
3. Соединение по п.2, где каждый из R3 и R4 представляет собой метил.
4. Соединение по п.2, где каждое из m и n равно 1 и каждый из R1, R2, R5 и R6 представляет собой Н.
5. Соединение по п.4, где каждый из R7 и R8 представляет собой C1-10алкил.
6. Соединение по п.4, где R7 и R8, совместно с атомом N, к которому они присоединены, образуют 5-8-членное моноциклическое, насыщенное или ненасыщенное кольцо, необязательно включающее второй гетероатом, выбранный из азота, кислорода или серы, необязательно замещенное галогеном, CN, -OR', С1-10алкилом, гидроксиС1-10алкилом, С1-10алкоксиС1-10алкилом, -S(O)2R', -C(O)OR', или образуют 8-12-членное бициклическое, насыщенное или ненасыщенное кольцо; R' представляет собой Н или C1-10алкил.
7. Соединение по п.1, где каждый из R3 и R4 представляет собой C1-10алкил.
8. Соединение по п.1, где m равно 1 и каждый из R1 и R2 представляет собой Н.
9. Соединение по п.1, где n равно 1 и каждый из R5 и R6 представляет собой Н.
10. Соединение по п.1, где каждый из R7 и R8 представляет собой C1-10алкил.
11. Соединение по п.1, где R7 и R8, совместно с атомом N, к которому они присоединены, образуют 5-8-членное моноциклическое, насыщенное или ненасыщенное кольцо, необязательно включающее второй гетероатом, выбранный из азота, кислорода или серы, необязательно замещенное галогеном, CN, -OR', С1-10алкилом, гидроксиС1-10алкилом, С1-10алкоксиС1-10алкилом, -S(O)2R', -C(O)OR', или образуют 8-12-членное бициклическое, насыщенное или ненасыщенное кольцо; R' представляет собой Н или C1-10алкил.
12. Соединение по п.1, которое представляет собой одно из следующих соединений
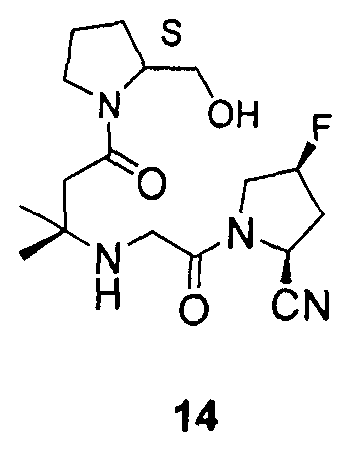
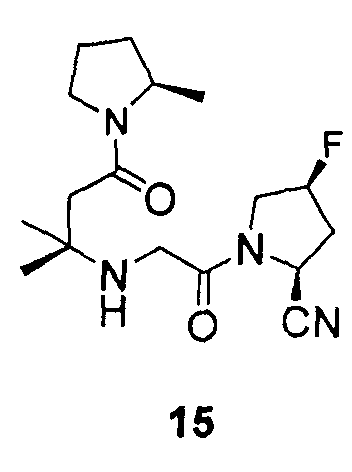
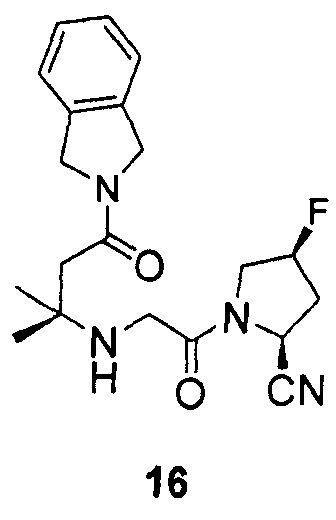
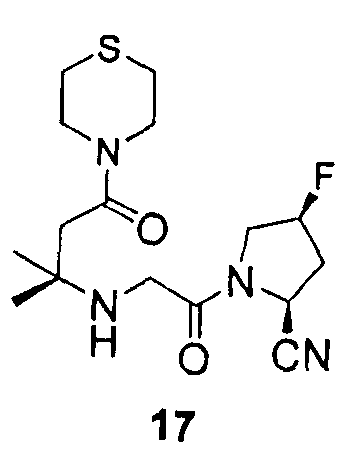
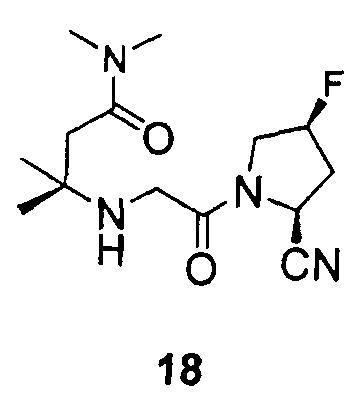
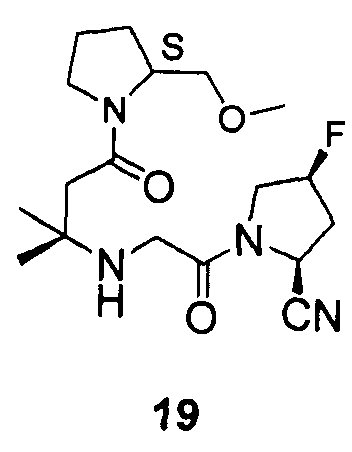
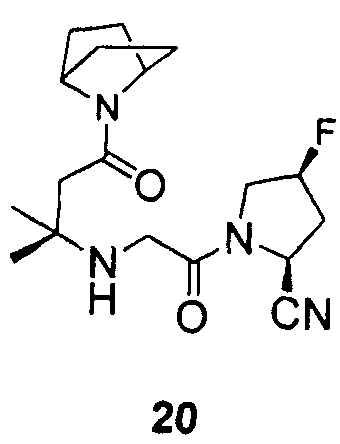
13. Способ ингибирования DPP-IV, включающий введение субъекту, нуждающемуся в этом, эффективного количества соединения по п.1.
| Пресс для выдавливания из деревянных дисков заготовок для ниточных катушек | 1923 |
|
SU2007A1 |
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| Bioorganic & Medicinal Chemistry Letters, 2005, v.15, n.12, p.3048-3052 | |||
| Пресс для выдавливания из деревянных дисков заготовок для ниточных катушек | 1923 |
|
SU2007A1 |
| НОВЫЕ АНТИДИАБЕТИЧЕСКИЕ АГЕНТЫ | 2000 |
|
RU2265012C2 |
Авторы
Даты
2013-09-27—Публикация
2009-02-25—Подача