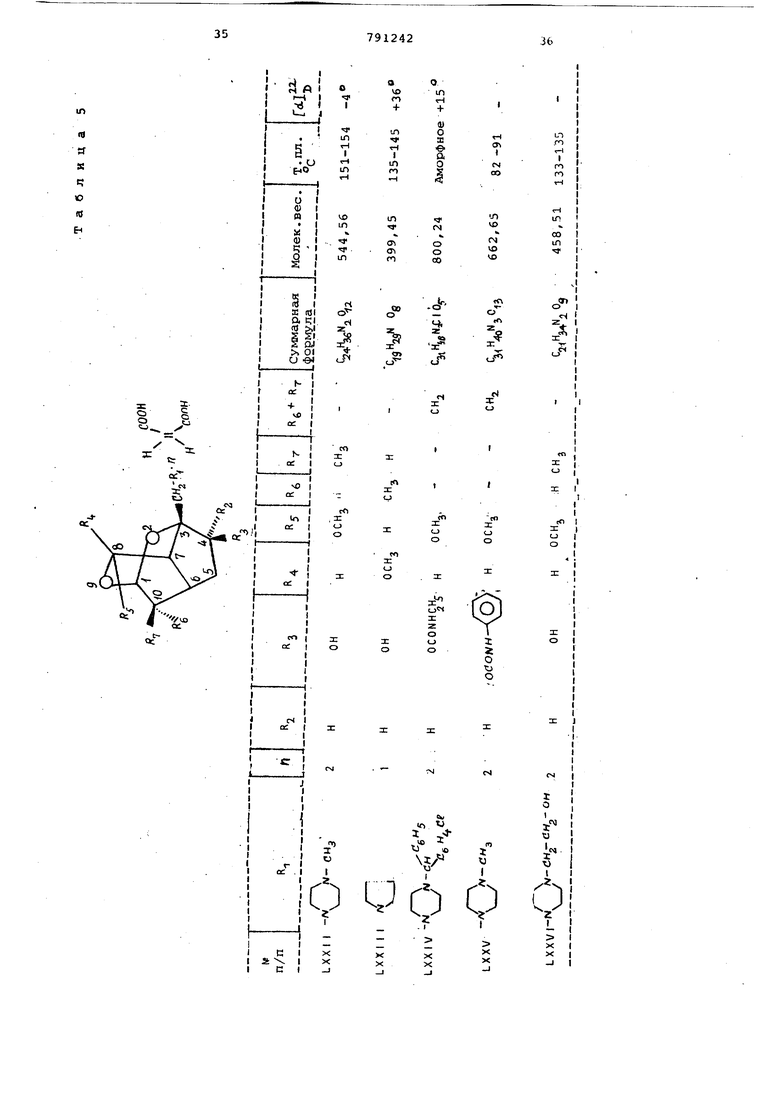
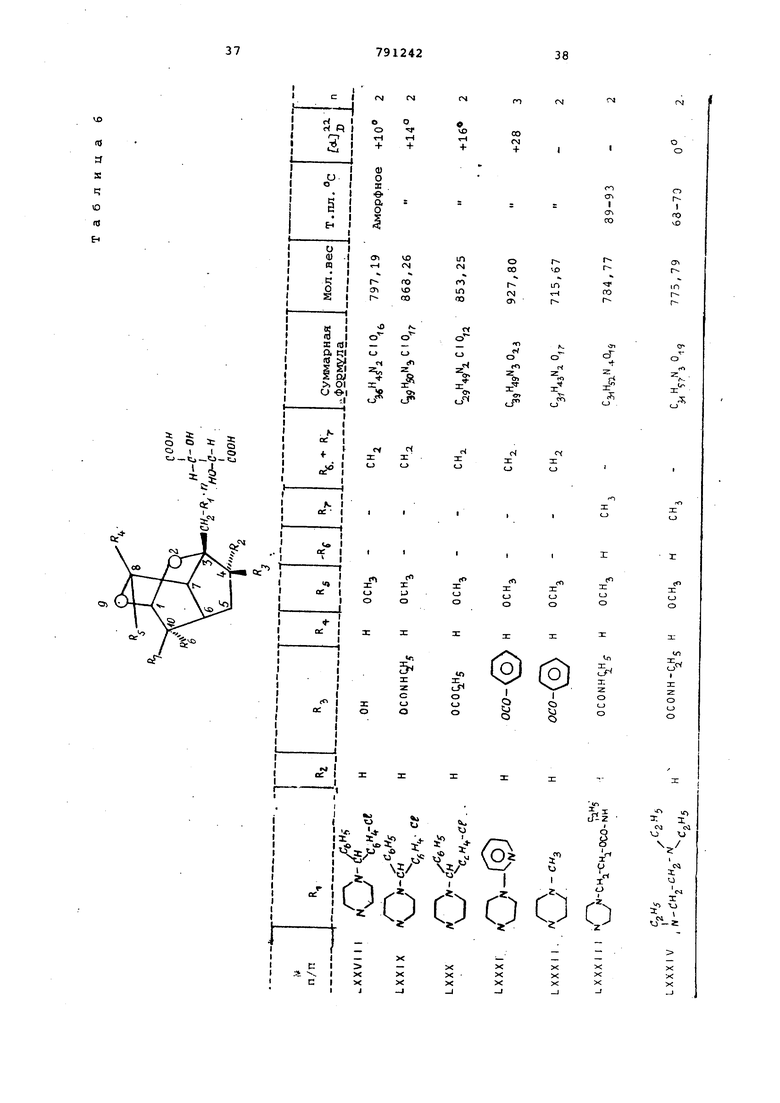
цикло (4, 3,1 С цекана формулы (1), обладсцощих биологической активностью.
Это достигается тем, что 2,9-диоксатрицикло- 4,3,1,0 5 1екан формулы
где X - иод, бром или хлор; R- водород,
окси- или ацетоксигруппа и К4.и RS имеют вышеуказанные значения,
подверганл: взаимодействию с амином формулы.
, н ft, , (i
(Где R имеет вышеуказанные значения :при нагревании в среде органического растворителя и при желании связь 10; 11 гидрируют и/или соединение формулы 41), где RJ -оксигруппа и
водород, ацилируют или окисляют до соединения формулы (1), где
R.- образуют кислород, и выделяют целевой продукт в свободном виде или в виде соли.
Предпочтительно процесс проводят при температуре кипения реакционной среды в присутствии основания, например бикарбоната калия или натрия.
Процесс предпочтительно проводят в среде апротонного растворителя, такого, как диметилформамид, или диметилсульфоксид или триамид гексаметилфосфорной кислоты.
Соли соединений формулы (1)полу-„ чают взаимодействием соединений формулы (1)с кислотой, преимущественно малеиновой или винной, в среде органического растворителя, такого как метанол, этанол, иэопропанол, этиловый эфир или их смеси.
В табл. 1-6 величины вращения определены для солей в воде и для индивидуальных веществ в метаноле.
Пример 1, Получение 3-пиперидинометил-4 fb -окси-8-метокси-10- .. -метилен-2,9-диоксатрицикло 4, 3,1, (Г-декана (v) из З-иодметил-4 (Ь-ацетокси-8-метокси-10-метилен-2,9-диоксатрцикло 14,3,1, О чекана (у) .
190 г (V) вместе с 250 г бикарбоната суспендируют в 500 мл пиперидина. Смесь нагревают 4 ч. при 150°С на масляной бане, с обратным холодильником и при интенсивном перемешивании, затем охлаяадают до ком.натной температуры. Добавляют 1,5 л
эфира, смесь растворяют в 1 л воды, затем смешивают с 200 мл 40%-ного раствора едкого натра и встряхивают. После отделения эфирной фазы водную фазу экстрагируют еще 3 раза по f 500 мл эфира. Объединенные эфирные экстракты сушат над сульфатом натрия и осветляют активированным углем. Отсасывают на нутч-фильтре через Теорит и промывают эфиром, фильтрат выпаривают при 50°с в вакууме водоструйного насоса и затем при в вакууме масляного насоса в роторном испарителе, причем получают 180 г маслянистого продукта формулы (IV). Его используют без дальнейшей очистки для получения соединения формулы (0)
11
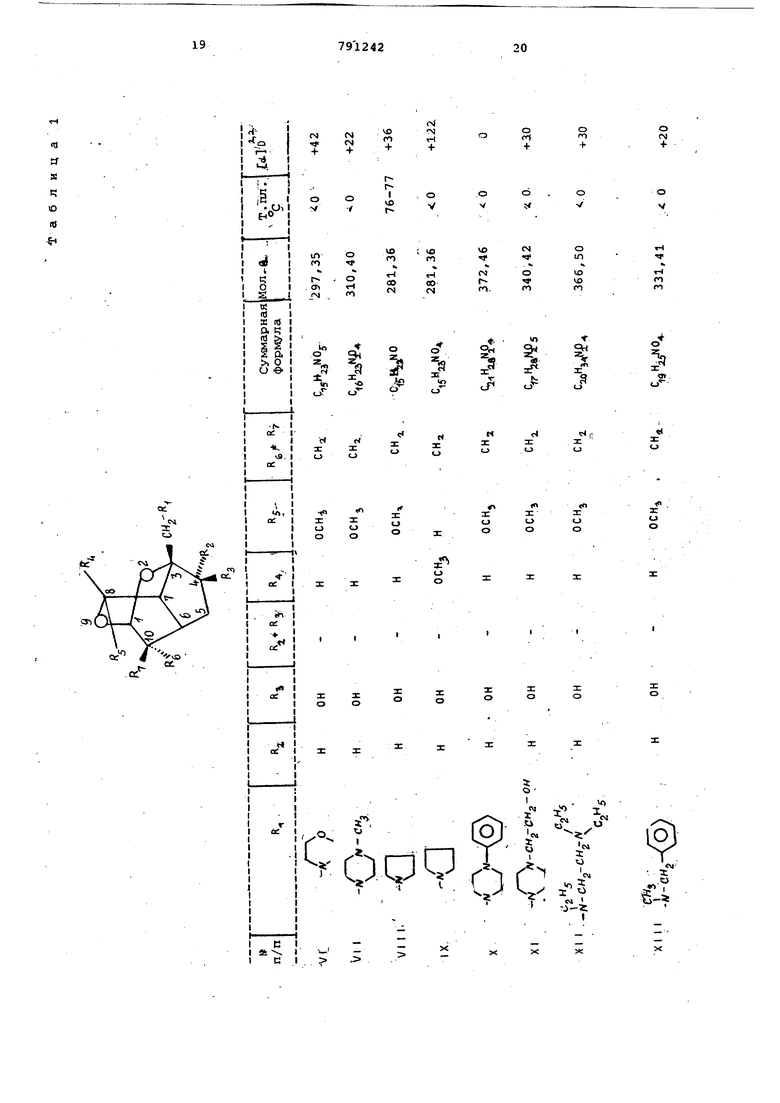
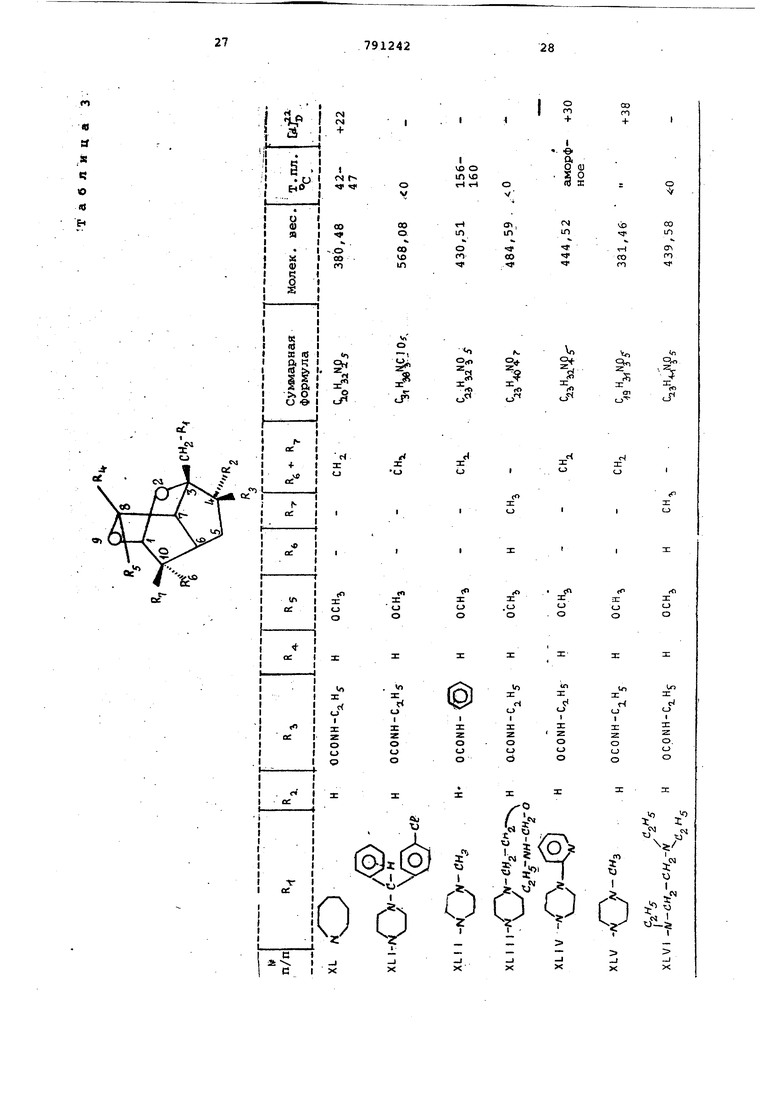
Мол.в. 295,38; V +41,6°(в метаноле) . 20 Аналогично примеру 1 получают соединения частично представленные в табл. 1.
З Морфолинометил-4 р -окси-8-метокси-10-метилен-2,9-диоксатрицикло ,3,1,0 5эекан (VI)
3-(4-Метил-1-пиперазинилметил)-4 Р -окси-8-метокси-10-метилен-2,9-диоксатрицикло 4,3,1,и аекан (VI I )
З-Пирролидинометил-4 р) -окси-В-метокси-10-метилен-2,9-диоксатрицикло 4,3, 1, (VIII)
З-Пирролидинометил-4 (Ъ -окси-8 Ы метокси-10-метилен-2,9-диоксатрицикло
5 ,3,1,0 цекан (IX)
3-( 4-Фенил-1-пиперазинилметил)--4,Р -окси-3-метокси-10-метилен-2, 9-диоксатрициклоГ4,3,1, 0 цекан ( X)
3-(4-Окоиэтил-1-пиперазинилметил)-4 р -окси-8-метокси-10-метилен-2,90 -диоксатрицикло 4,3,1,0 цекан (XI)
3-(N,N,N-Триэтилэтилендиаминометил)-415 -oкcи-8-мeтoкcи-10-J leтилeн-4 , 9-диоксатрицикло f4 , 3,1, СГ декан (XII)
3-(N-Бензил-N-метиламинометил)5 -4 р, -окси-З-метокси-10-метилен-2, 9-диоксатрицикло 4, 3,1,0 цекан
(XIII)
3- (N , N -Дибензиламинометил) -4 (Ь -окси-8-метокси-10-метилен-2,9-диоксатри0 цикло 4,3,1, (XIV)
3-Г ксаметилениминометил-4 р-окси-8-метокси-10-метилен-2,9-диоксатрицикло 4 , 3, 1, о декан (XV)
3-(1-Индолиноме1ил)-4 |Ь -окси-8г -метокси-10-метилен-2,9-диоксатри цикло{;4,3,1, (XVI)
3-.Пиперидинометил-4-оксо-8-метокси- 10метилен-2,9-диоксатрицикло- 4, 3,1, (XVI I )
. . 3-(N,N -Диэтиламиноэтил )-4/3-ок0 си-8-метокси-10-метилен-2,9-диоксатрицикло 4 , 3, 1, (Г декан (XVIII)
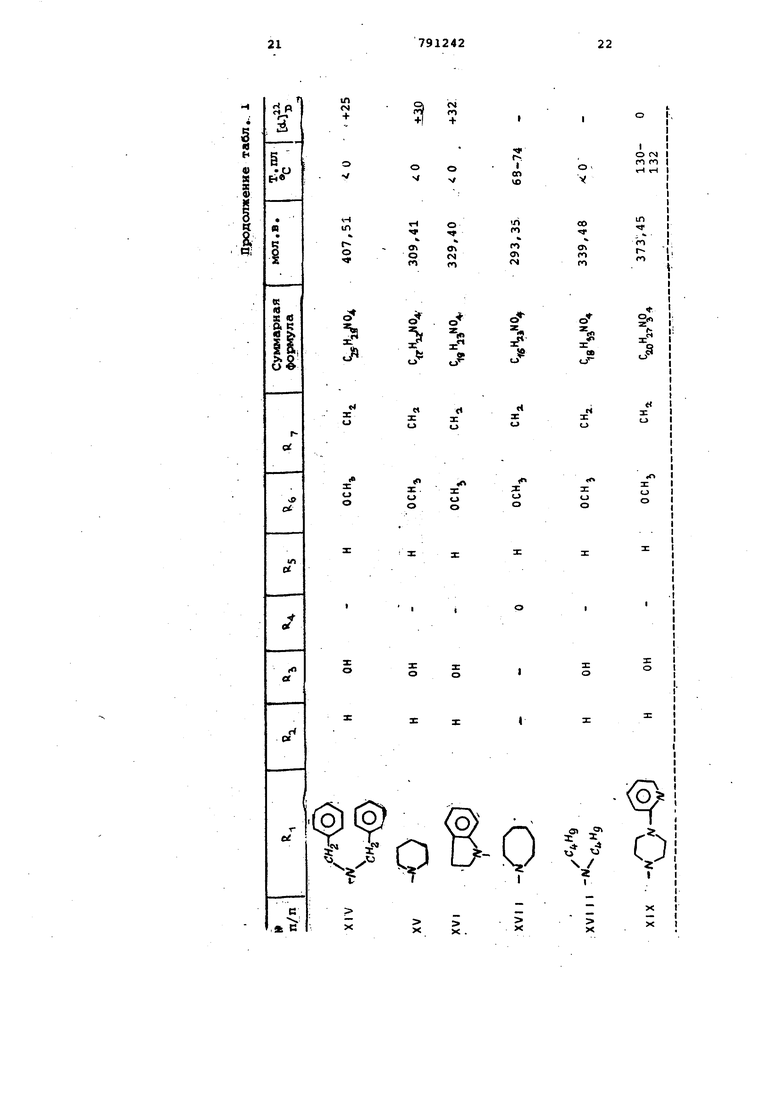
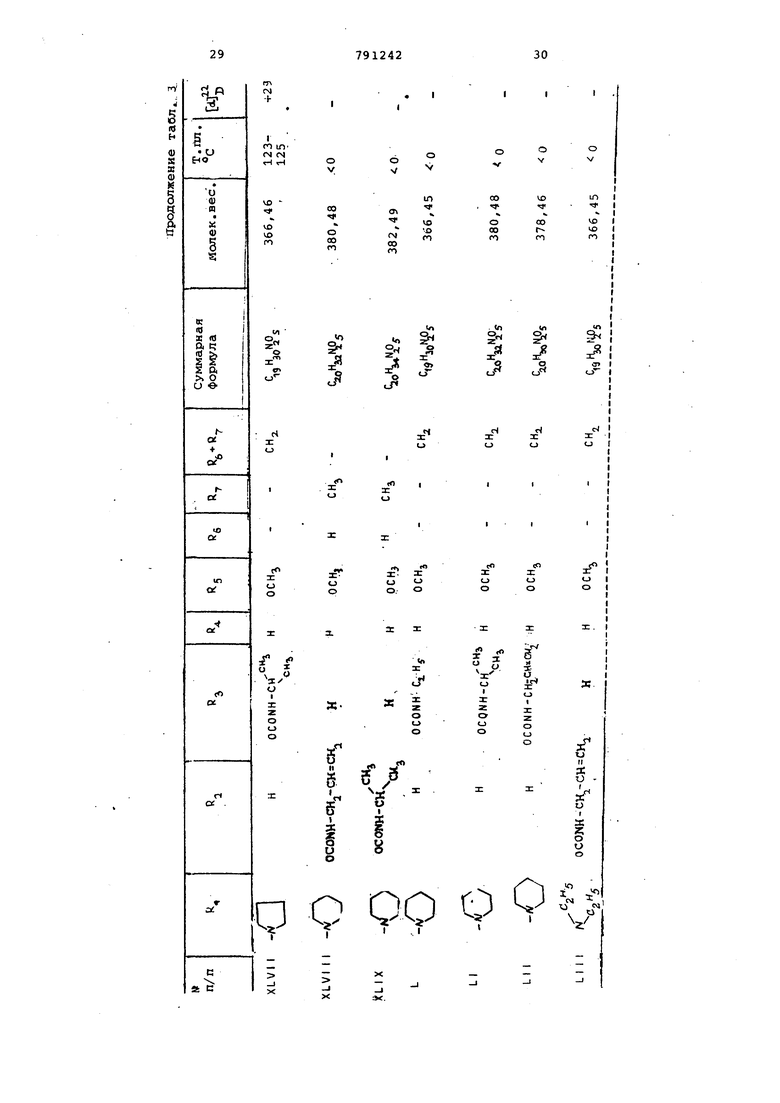
(2-Пиридил)-1-пиперазинилметилЗ-4 | 1-окси-8-метокси-10-гиетилен-2, 9-диоксатрицикло 4,3,1, о пекан 5 (XIX). П р и м е р 2. Получение 3-морфолинометил-4 р) -окси-З-метокси-10-метилен-2 , 9-диоксатрицикло 4,3,1, (г}декана (VI) из соединения (V). 38 г соединения формулы (V) вместе с 50 г йодистого натрия суспендируют в 100 мл морфолина. Смесь кипятят с обратным холодильником 3 ч,затем охлаждают до комнатной температуры.После выпаривания растворителя смесь сме шивают с 200 мл 2н.соляной кислоты,за тем с небольшим количеством метанола для.растворения.Реакционный раствор дважды экстрагируют эфиром 100 -мл. Водную фазу смешивают с 200 мл 2н. раствора едкого натра, насыщают хлористым натрием и затем экстрагируют 5 раз эфиром (100 мл1. Эфирную вытяжку сушат над сульфатом натрия, осветляют активированным 5/.глем и отсасывают на нутч-фильтре через Теорит.Ко центрируют в вакууме, получают 17,92 маслянистого продукта, 61% от теории C,5K2,N05 Мол. в. 297.35; d- +42 (в метаноле jj Пример 3. По;тучение 3- 4-(2Пиридил)-1-пиперазинилметил -4 fi -окси-8-метокси-10-метилен-2,0-диоксатрицикло 4, 3,1,0 декана (XI Х) из соединения формулы V 38 г соединения формулы V вместе с 39 г 1-(2-пиридил)-пиперазина и 50 г бикарбоната натрия суспендируют в 100 мл диметилформамида и затем кипятят с обратным холодильником 8 ч после отсасывают на нутч-фильт е черех Теорит и промывают метанолом, фильтрат концентрируют в вакууме. Остаток после выпаривания растворяют в 200 мл метанола и смешивают с раст вором 8 г гидроксинатрия в 10 мл воды, затем оставляют на 10 мин при комнатной температуре, нейтрализуют разбавленной соляной кислотой и растворитель выпаривают, остаток под щелачивают 2н. раствором едкого натра и экстрагируют хлороформом. Объединенные эфирные экстракты обрабатывают сульфатом натрия и осветляют активированным углем, отсасывают на нутч-фильтре через Теорит. Очищают хроматографией на силикагеле элюентом (50%-ным эфиром в гексане). Пос ле концентрирования элюата и растира ния остатка в метаноле продукт крист лизуется. Отсасывают и промывают мет нолом, получают 29,0 г белого кристал лического продукта, 77,7% от теории. Gi 27 3°4Мол. в. 373,45; т.пл. 130-132°С d-J 0° (в метаноле) . Пример 4. Получение 3-(,-диэтиламинометил)-4 р) -окси-8-меток си-10-метилен-2,9-диоксатрицикло 4,3 1,0 }цекана (XX) из соединения формулы (V). 38 г соединения формулы (V) вмест с 50 г бикарбоната натрия суспендиру 200 мл диэтиламина. Смесь в тугоплавкой трубке выдерживают 6 ч. при в масляной бане, затем охлаждают до комнатной температуры и смешивают с 4 г гидроокисинатрия. в 10 мл воды и 100 мл метанола. Выстаивают 10 мин при комнатной температуре, к смеси добавляют 6 MLTI уксусной кислоты. Растворитель упаривают, смешивают с 10 мл эфира, смесь астворяют в 100 мл воды, смешивают с 40 мл 30%-ного раствора едкого натра и встряхивают. После отделения эфирной фазы водную фазу экстрагируют трижды по 100 мл эфира. Объединенные эфирные фазы высушивают над сульфатом натрия и осветляют активированным углем. Отсасывают на нутч-фильтре через Теорит, промывают эфиром, фильтрат выпаривают сначала при 50°С в вакууме водоструйного насоса и затем при 100°С в вакууме масляного насоса в роторном испарителе, получают 32 г маслянистого продукта. «о Мол.в. 283,37; СА +48 (в метаноле) . Аналогично примеру 4 получают следующие вещества: 3- (N , N -диэтиламинометил) -4-оксо--8-метокси-10-метилея-2,9-диоксатрицикло 4 , 3, 1 , О цекан (XXI) из 3-иодметил-4-оксо-8-метокси-10-метилен-2 , 9-диоксатрицикло 4,3,1,0 декана (XX ) С 5 аъМ04 Мол.в. 281.34. 3-(N ,N-диэтиламинометил )-4 f -окси-8-метокси-10-метилен-2,9-диоксатрицикло 4 , 3, 1 , С декан (XXII) из 3-иодметил-4 -окси-8-метокси-10-метилен-2,9-диоксатрицикло 4,3,1,0 декана (XXII). С,5Н:г5 0 Мол.в. 283,.36. При мер 5. Получение 3-пиперидинометил-4 f} -окси-8-метокси-1 0-метил-2,9-диоксатрицикло 4,3,1,О декана из (IV). Аппаратуру для гидрирования продувают 10 мин азотом и 10 мин водородом. Затем заполняют водородом. В колбе для гидрирования 100 г влажного никеля Ренея ополаскивают метанолом и при перемешивании и при незначительном избыточном давлении предварительно гидрируют примерно 2мин при комнатной температуре. После введения раствора 180 г соединения формулы IV в 250 МП метанола в колбу для гидрирования раствор пром11 вают 20 г гидроокиси натрия,растворяют в небольшом количёЪтве воды и охлаждают до комнатной температуры, затем розбавляют 5-кратно метанолом и охлаждают до комнатной температуры. При перемешивании и незначительном и: 0ыточном давлении смесь гидрируют 30 и при комнатной температуре. Посмю прокрацения поглощения водорода смесь отфильтровывают на нутч-фильтре через Теорит и промывают метанолом,. Добавляют 30 мл уксусной кислоты и выпаривают при , охлаждают до комнатнойтелйтературы, остаток обрабатывают эфиром и растирают с 250 МП силикагеля (размер частиц 0,2-0,5 мм). После выпаривания раст ворителя при , остаток растворя в н.гексане и концентрируют при . Остаток фильтруют 500 г силик геля в колонне (ра-змер частиц 0,20,5 мм) сначала с 1 л н.тексана, затем с 1,5% диэтиламина в н.гексане . Фильтрат выпаривают при , получают 150 г маслянистого продукта формулы 11 С бЬд7М04,,,„ Мол.в. 297,399; td-l О (в метаноле). Аналогично получают соединения, представленные в табл. 2.. З-Морфолинометил-4 fb -окси-8-метокси-10-метил-2,9-диоксатрицикло- 4 , 3,1,(г5цекана (XXI 11), 3- (4-Метил-1-пиперазинилметил)-4 |Ъ -окси-8-метскси-10-метил-2 ,9-ди оксатрицикло 4 ,3,1,СГ цекан (XXIV.) З-Пирролидинометил-4 pj -OKCH-8ct -метокси-10 d ,,-метил-2,9-диокс атрицикло 4,3,1, О Удекан (XXV) 3-(4-Фенил-1-пиперазинилметил)-4 Р) -окси-8 метокси-10- етил-2 , 9-диоксатрицикло 4,3,1,Сг1декан (XXV I 3- (4-Оксиэтил-1-пиперазинилметил -4 f -окси-8-метокси-10-74етил-2 ,.9.-диоксатрициклоГ4 , 3,1, Сг декан (XXVI 3.- (N ,м , N-Ipиэтилэтилeндиaминoмeтил)-4 fb -окёи-З-метокси-10-метил-2,9-диоксатрицикло 4,3,1,0 Ьекан (XXVI11) 3-(М-Бензил-М-метиламинометил)-4 {ь -окси-8-метокси-1йгметил-2 , 9-диоксатрицикло 4 , 3,1,(Г декан (XXIX 3-( N ,N-Дибутиламинометил )-4 |Ъ ОКСИ-- 8-метокси-10-метил-2,9-диокса трицикло 4 , 3, 1,С декан (XXX) З-Гексаметилениминометил-4 f -окси-8-метокси-10-метил-2,9-диоксатрицикло 4 , 3, 1, 0 декан (XXX)) 3-(t-Индолинометил)-4 р-окси-8-м токси-10-метил-2,9-диоксатрйцикло 4,3,1,0 Ьекан (XXXI I ) 3 (2-Пиридил)-1-пиперазинилме р -окси-8-метокс11-10-метил-2 , -диоксатрицикло 4,3,1,(Г декан (XXXI З-Пирролидинометил-4 -окси-8-ме токси-10-метил-2,9-диоксатрицикло ,3,1,декан (XXXIV) 3-Пиперидинометил-4| 1 -окси-8-мет окси-10-метил-2,9-диоксатрицикло 4,3,1,СГ7декан (XXXV) 3-( N , ;: -Днбу гиламинометил-4 р -окси-8-метокси-10-метил-2,9-диокса трицикло 4 , 3 , 1 , СГ декан (XXXVI) 3-(N,М Диэтиламинометил)-4 -окси-8-метокси-10-метил-2,9-диокса трицикло 4,3,1, Г декан (XXXVII) П р им е р- 6. Получение 3-(М-метиламинометил)-4 )% -окси-8-метокси- ,-, -10-метил-2,9-диоксатрицикло 4,3,l,ffj .декан-моногидрата (XXXVI II) 16,9 г 3-(М-бензил-К-метиламинометил)- /4 -окси-8-метокси-10-метил-2,9-диоксатрицикло 4,3,1, о декана растворяют в этаноле, гидрируют с помощью водорода при использовании 5,0 г окиси палладия. Продолжительность гидрирования 2 ч. После прекращения поглощения водорода смесь фильтруют на нутч-фильтре через Теорит и промывают.затем этанолом. Выпаривают фильтрат, кристаллизуют из смеси хлороформа с эфиром 11 г дебензилированного соединения (84% от теории). Кристаллы промывают эфиром и высушивают ня . Мол.в. 261,30; т.пл. 161-164 С, W -25° (ъ метаноле). Пример. Получение 3-пиперидинометил-4 |Ь -фенилкарбамоилокси -8-мeтoкcи-10-мeтил-2 ,9-диоксатрицикло L4, 3,1,0 1цекана (XXXIX). i 5,0 г соединения формулы (V) растворяют в 10 мл хлористого метилена, . смешивают с 3 мл фенилизоцианата и 680 мг фенилртутьацетата в качестве катализатора, смесь кипятят- с обратным холодильником в течение 1-2 ч. Добавляют 5 МП метанола, смесь выпаривают. Остаток растворяют в эфире и обрабатывают сульфатом натрия и активированным углем. Отфильтровывают, промывают эфиром, выпаривают, получают 6,27 г кристаллического фенилкаобамата (90% от теории). CaiH t Oj-д Мол.в. 416,52; т.пл. 81-86 С. Аналогично получают вещества представленные в табл. 3. З-Гексаметилениминометил-4 р, -этилкарбамоилокси-8-метркси-10-метилен 2 , 9-диоксатрицикло 4,3,1, СГ декан ( XU) 3- 4- (п -kлopбeнзгидpи i) -1-пиперазинилметил -4 -этилкарбамоил-8-метокси-10-метилен-2,9-диоксатрицикло 4,3,l,CfJдeкaн (XLI) 3- («-Метил-1-пиперазинилметил) -4 (i -фенилкарбамоилокси-8-метокси-1р-метилен-2 ,9-диоксатрицикло 4 , 3,1,0 декан (XLII) (2-Этилкарбамоилоксиэтил)-1-пиперазинилметил -4 4 -этилкарбамоил6кси-8-метокси-ДО-метил-2,9-диоксатрицикло- 4,3,1, 0 декан (XL I II) 3- 4-Пиридил-2-( 1-пиперазинилметил)-4 |i -этилкарбамоилокси-8-метокси-10-метилен-2,9-диоксатрицикло 4,3,1,(екан (XL IV) 3-(4-Метил-1-пиперазинилметил)-4 р -этилкарбамоилокси-8-метокси-10-метилен-2,9-диоксатрицикло 4,3,1,Оj декан (XL IV) 3-(N,N,Н-Триэтилендиаминометил)-4 (1 -этилкарбамоил-8-метокси-10-метил-2 ,9-дио сатрицикло 4,3,1,0 декан (XLVI) З-Пирролидинометил-4 (J -изопропил карбамоилокси-8-метокси-10-метилен-2 , 9-диоксатрицикло 4,3,1, (XLVII). З-Пиперидинометил-4d -аллилкарба илокси-8-метокси-10-метил-2,9 диокс трицикло 4 , 3,1, 0 5декан (XLVIIl) З-Пнперидинометил-4 d -изопропилкарбамоилокси-8-метокси-10-метил-2 , 9-диоксатрицикло 4,3,1, О цекан (XLIX) З-Пиперидинометил-4 (Ь-этилкарбам илокси-8-метокси-10-метилен-2,9-диоксатрицикло 4 , 3 , 1 , Сг/декан (L) З-Пиперидинометил-4 (Ь -изопропилкарбамоилокси-8-метокси-10-метилен-2, 9-диоксатрицикло 4,3,1 ;0 декан (LI) , N-диэтиламиноэтил -4fi -алли карбамоилокси-8-метокси-10-метилен-2, 9-диоксатрицикло 4,3,1, СГ декан (L I I ) З-ПиперидинометиЛ-4 f -аллилкарба моилокси-8-метокси-10-метилен-2 , 9-диоксатрицикло 4,3,1, О екан { L И ) П ри м е р 8. Получение 3-мор фолинометил- р -бензоилокси-В-метокси-10-метил-2,9-диоксатрицикло 4,3, 1,0 цекана (LIV) 3,73 г соединения формулы (V) растворяют в 15 мл пиридина, смешивают с 7,05 г бейзойного ангидрида и кипятят 2 ч с обратным холодильни ком. Добавляют хлороформ, смесь вст хивают с 2 н. раствором соды. Органическую фазу промывают водой и вод ные фазы по отдельности дважды экст гируют хлороформом. Органические эк ракты обрабатывают сульфатом натрия и активированным углем и фильтруют нутч-фильтре через Теорит. Фильтрат выпаривают, остаток хроматографичес ки на силикагеле 50%-ным эфиром в н.гексане в качестве элюирующего ср ства. После выпаривания элюата 2,9 бензоата кристаллизуют из изопропан ла, что составляет 57% от теории. Мол. в. 403,45; т.пл. 120-121°С; djjj +60° (в метаноле). Аналогично примеру 8 получают: Пиридил-2 )-1-пиперазинилметил -4 -бензо«локси-8-метокси-10 метилен-2 , 9-диоксатрицикло 4,3,1, Сг кан (LV) Мол.в. 477,54. 3-(4-Метил-1-пиперазинилметил)-4 (Ь -бензоилокси-8-метокси-10-метилен-2 , 9-диоксатрицикло 4,3,1, (LVI) C,,H5, Мол.в. 116,09; т.пл. 99-102 С. 3- 1-(2-Бензоилоксизтил)-1-пипер ЭинилмeтилJ-4 ft -бензоилокси-8-меток -10-метил-2 , 9-диоксатрицикло 4,3,1 декан (LVII) Мол. в. 550,63. Пример. Получение 3-гексаметилениминометил-4 ft -ацетокси-8-метокси-1,0-метил-2,9-диоксатрицмкло 4 , 3,1,0 декана (LVlll) из 3-гексаметилениминометил-4 Р -окси-8-метокси-10-метил-2,9-диоксатрицикдо 4,3, 1,0 екана. Зг З-гексаметилениминометил-4р -окси-8-метокси-1 0-метил-2, 9-диоксатрицикло- 4,3,1,0 декана растворяют в 6 МП уксусного ангидрида и смесь оставляют на 30 мин при комнатной температуре. После добавки хлороформа смесь -встряхивают с 2н. содовым раствором. Органическую фазу промывают один раз водой. Обе водные фазы по отдельности экстрагируют дважды хлороформом. Объединенные органические экстракты обрабатывают сульфатом натрия и активированным углем. Остаток после отсасывания и выпаривания очищают хроматографически на окиси алюминия с помощью 50%ньтм эфиром в н. reKcaffe, затем эфиром и, наконец, 10%-ным метанолом в эфире. После упаривания элюата получают 2,2 г маслянистого ацетата, что составляет 67,8% от теории. , .г о Мол. в. 337,44-, А to -С QB метаноле) . Пример 10. Получение 3-гексаметилениминометил-4 Э -пропионилокси-8-метокси-10-метил-2,9-диоксатрицикло 4, 3, 1,0 декана (L1X). 2,74 г 3-гексаметилениминометил-4 ) -окси-8-метокси-10-метил-2,9диоксатрицикло 4,3,1, 0 цекана растворяют в б мл пррпионового ангидрида и вьщерживсоот 30 мин при комнатной температуре. После добавки хлороформа смесь встряхивают с 2н. содовым раствором. Органическую фазу обрабатывают сульфатом натрия и активированным углем. После отфильтровывания и упаривания органической фазы получают 950 мг пропионата, который кристаллизуют из изопропанола, что составляет 29,4% от теории. C23H«N05 о .Мол.в. 367,47; т.пл. 52-54 С/ ( метаноле). Аналогично примеру 10 получают следующие вещества. -(п-Хлорбензгидрил)-1-пиперазинилметил -4 & -пропионилокси-8-метокси-10-метилен-2,9-диоксатрицикло 4 , 3, 1, аи (LX). Мол.в. 552,78. П р и/м е р 11. Получение 3-пиперидинометил-4 р -окси-8-метокси-10-метил-2,9-диоксатрицикло 4,3,1,0 декангидрохлорида (LX1). 5 г соединения й) растворяют в 50 мл эфира. Через раствор пропускают сухой газообразный НС1 до тех пор, пока не будет образовываться осадок. После удаления эфира ;путем декантации, осадок обрабатывают не содержащим НС2 эфиром и растирают. После отсасывания, промывки эфиром и высушивания получают 5,4 г кристаллического гидрохлорида, что составляет 97% от теории. C.H2gNCeo
Мол.в. 333,86 т.пл. 182-188 С, fd. - 18 (в метаноле) .
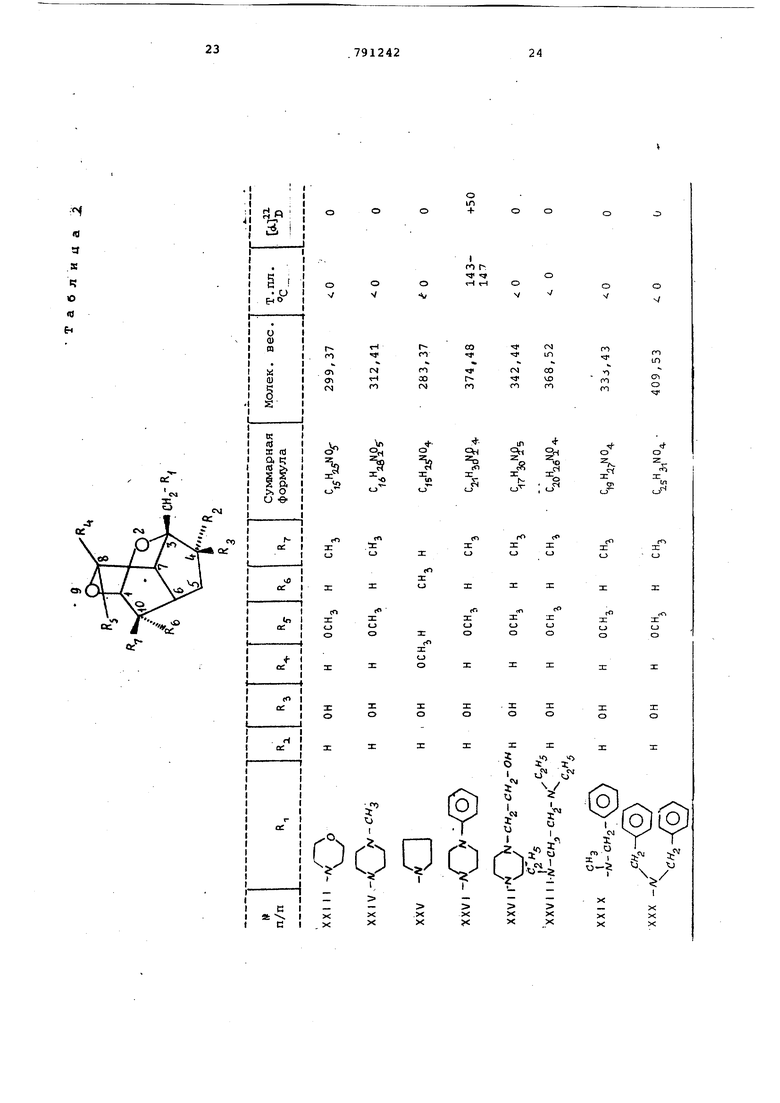
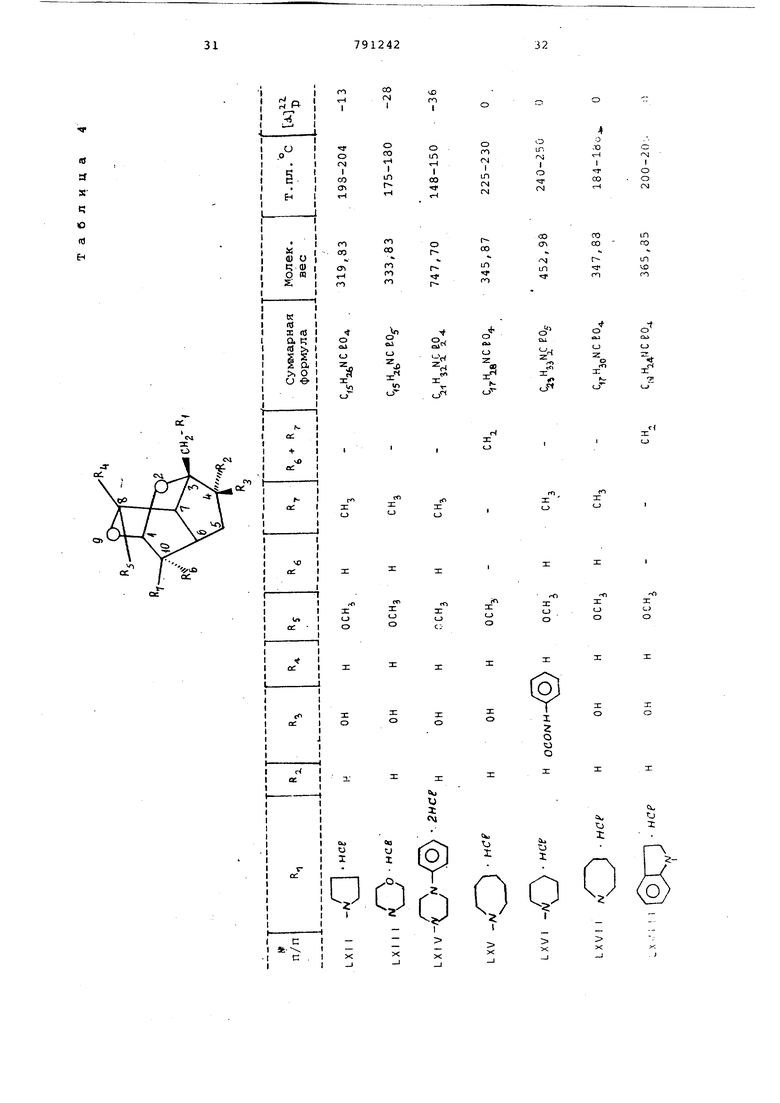
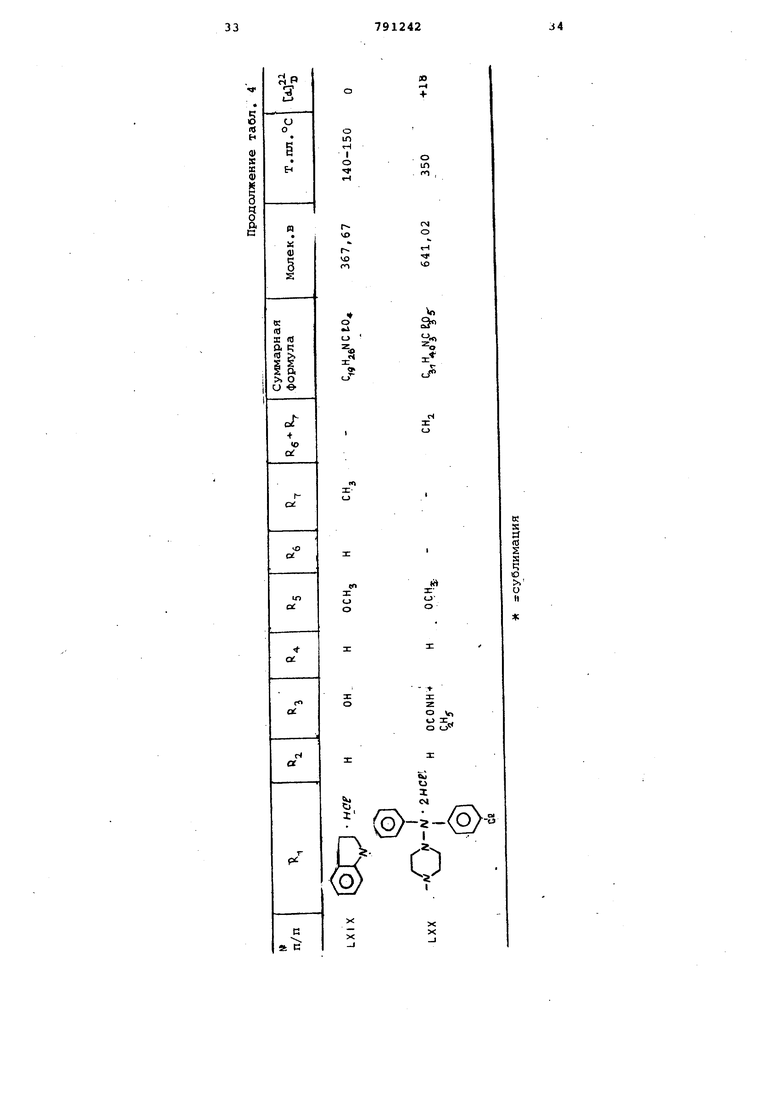
Т налогично получают вещества, представленные в табл. 4.
З-Пирролидинометил-4 Э-окси-8-метокси-10-метил-2,9-диoкcaтpициклo 4, 3, 1,Сг екангидрохлорид (LXII)
3-Морфолинометил-4|Ь -окси-8-меток .0-метил-2, 9-диоксатрицикло 4,3, 1, CrJaeK аи гидрохлорид (LX I t)
3 - (4 -Фе ни л -1 - пи пер аз и нил метил) -4 -окси-8-метокси-10-метил-2,9-ди оксатрицикло- 4,3,1, Сгудекандигидрохлорид ( L X I V)
З-Гексаметилениминометил-4 {Ь -окси-8-метоксн-10- етилен-2,9-диоксатрицикло 4,3,1, ( к аи гидрохлорид (LXV)
З-Пиперидинометил-4 f -фенилкарбамоилокси-в-метокси-10-мф ил 2,9-диоксатрицикло- 4,3,1, О екангидрохлорид (LXVI)
3-Гексаметилениминометил-4(-окси-8-метокси-10-метил-2,9-диоксатрицикло- 4,3,1, аи гидрохлорид (LXVI1)
3-Г1-йндолинометил1 -4 р -окси-8-метокси-10-метилен-2,9-диоксатрицикло 4, 3,1, Опекай гидрохлорид (LXVI II)
3- l-Индолинометил -4 -окси-8метокси-10-метил-2,9-диоксатрицикло t, 3,1, О эекангидрохлорид (LXIX)
3-Г4-(п-хлорбензгидрил)-1-пиперазинилметил -4 |Ь -зтил-карбамоилоксй-8-метокси-10-метилен-2,9-диоксатрицикло 4,3,1, О 7деканди гидрохлорид {LXX)
Пример 12. Получение 3-пирролидинометил-4 р -окси-З-метокси-Ю-. метилен-2, 9-диоксатрицикло 4,3,1,0 дкангидромалеинат (LXX/).
3,3 г соединения формулы (IV) растворяют в 20 мл эфира и смешивают с раствором 1,4 г малеиновой кислоты в эфире. После удаления растворителя декантацией остаток обрабатывают эфиром и растирают. Отсасывают, промвают эфиром и высушивают, получают 4,4 г малеината (IV), что составляет 90,2% от теории,
qqHj-.NOgМол.в. 397,43; т.пл. 155-157 С, И +8° (в метаноле).
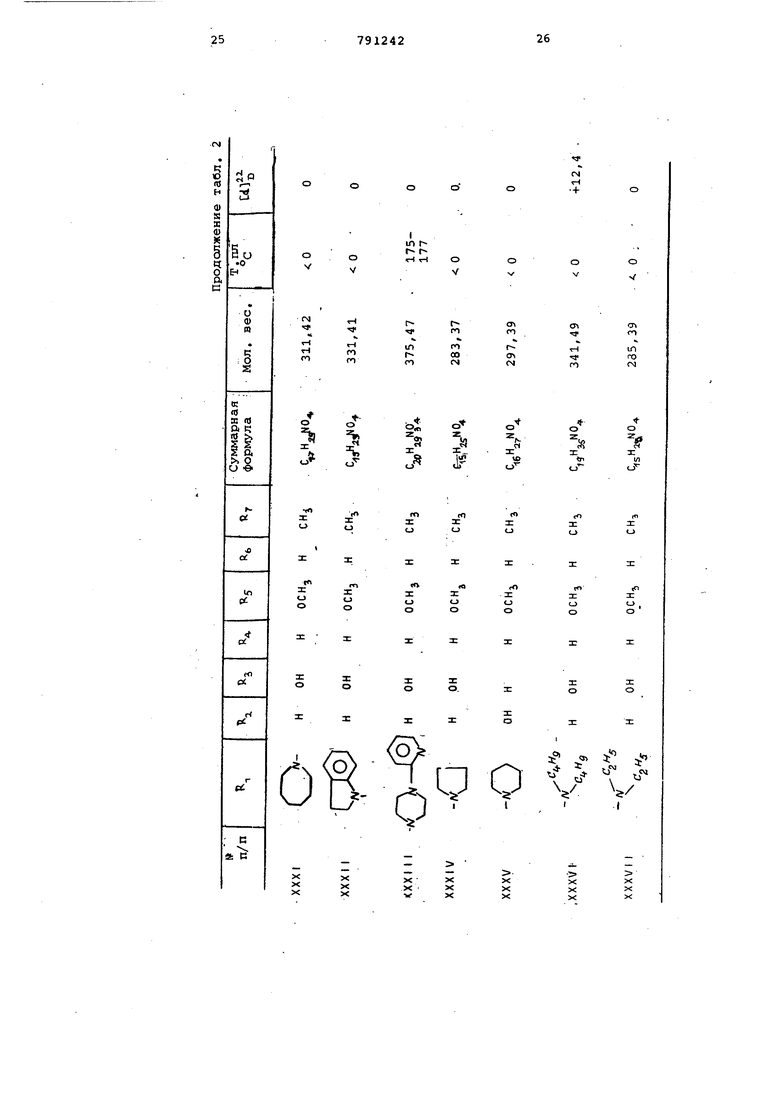
Аналогично получают соединения .приведенные в табл. 5.
3-(4-Метил-1-пиперазинилметил) р -окси-8-метокси-10-метил-2,9-диоксатрицикло 4 ,3,1, СГ1аекандигидромалеинат (LXXIl)
З-Пирролидинометил-4 f -окси-8-метокси-10-метил-2,9-диоксатридикло 4, ЗЛ ,0 1де-кангидромалеинат (LXXI I I )
3- 4-(п -Хлорбензгидрил )-l-пипepaзинилмeтилJ.-4(-этилкapб$мoилoкcи-8-мётoкcи-lQ-мeтилeн-2 ,9-диоксатрицикло 4, 3,1, СГ|цекандигидромалеинат (LXXIV)
3-Г4-Метил-1-пиперазинилметил -4fb -фенилкарбамоиЛокси-8-метокси-10-метилен-2,9-диоксатрицикло 4,3,1, О екандигидромалеинат (LXXV)
3-Г4-(2-рксиэтил)-1-пиперазинилметил -4 f -окси-8-метокси-10-метил-2, 9-диоксатрицикло 4,3,1,СГ декандигидромалеинат (LXXVI).
П р и м е р 13. Получение 3-пиперидинометил-4 f -окси-8-метокси-10-метил-2,9-диоксатрициклоГ4,3,1,0 декангидротартрат (LXXVII)
150 г соединения формулы (ij) растворяют в 150 мл этанола, смешивают с 75,0 г -винной кислоты, 0 растворяют в 525,35 мл этанола при .
При выпаривании раствора при 60°С выкристаллизовывают гидротартарат. Упаривают кристаллы, обрабатывают эфи5 ром, отсасывают на нутч-фильтре и промывают эфиром. Сушат в вакууме при 50с, получают 203,6 г продукта белого кристаллического гидротартрата общей формулы СО) i что составляет 91% от теории.
СаМО,и
Мол.в. 44-7.46; т.пл. 178 с (по
Кофлеру); d. воде)., Аналогично получают следующие соединения приведенные в табл. 6,
3- 4-(п-Хлорбензгидрил)-1-пиперазинилметил -4 р -окси-8-метокси-10-метилен-2,9-диоксатрициклоГ4,3, 1,0 цекандегидротартрат (LXXVI I I ) 3 4-(п-Хлорбензгидрил )-1-пипе0 разинилметил -4()-этилкарбамоилокси-8-метокси-10-метилен-2,9-диоксатрицикло 4,3,1, О екандигидротартрат (LXXIX)
3- 4-(п-Хлорбензгидрил)-1-пипе разинилметил -4 f -пропионилокси-8-метокси-10 -метилен-2,9-диоксатрицикло Г4 , 3,1, О 7декандигидротартрат (LXXX)
(2-Пиридил)-1-пиперазинилметил -4 1Ь-бензоилокси-8-метокси-10. -метилен-2 , 9-диоксатрицикло 4,3,1,0 декантригидротартрат (LXXXl)
3-(4-Метил-1-пиперазинилметил)-4-|%-бенЗоилокси-8-метокси-10-метилен-2, 9-диоксатрицикло 4,3,1, О удекан5 дигидротартрат (LXXXI I)
3-14-(2-этилкарбамоилоксиэтил)-1-пиперазинилметил -4|Ь -этилкарбамоилокси-8-метокси-10-метил-2,9-диоксатри0 циклоГ4, 3,1,о}декандигидротартрат (LXXXIII)
3-(N ,N , 1ч-триэтилэтилендиаминометйл)- , р -этилкарбамоилокси-8-метокси-10-ыетил-2,9-диоксатрицикло 4,3, 5 1,0 декандигидротартрат (LXXX IV)
З-пиперидинометил-4 d. -окси-8-меток си-ID-метил-2 , 9--диоксатрицикло ,3,1,СГЗцекангидротартрат (LXXXV)
3-пиперидинометил-4 -иэопропилкарбамоилокси-8-метокси-10-метил-:г, 9-диоксатрицикло Г4, 3,1,0 декангидротартрат (LXXXVI)
3-N, М.,7диэтиламинометил-4с(:-ок- си-8-метокси-10-метилен-2,9-диоксатрицикло Г4 , 3,1, Сг7декангидротартрат (LXXXV I)
3-пиперидинометил-4 -аллилкарбамоилокси-8-метокси-10-метил-2,9-диоксатрицикло f4 , 3,1,СГ декангидротартрат {LXXXVIII)
3-N, М-Диэтйламинометил-4о(;-аллилкарбамоилокси-8-метокси-10- летилен-2 , 9-диоксатрицикло f4 , 3 ,1 ,CГJдeкaнгидротартрат (LXXXiX)
3-N,N-диэтиламинометил-4-оксо-8-метокси-10-метилен-2,9-диоксатридикло 4,3,1,05цекангидротартрат (ХС ),
3-морфолинометил 4 р -окси-8-метокси-10-метил-2,Э-диоксатрицикло 4,3, 1, 0 декангидротартрат (XCI)
,3-пирролидинометил-4 fb -окси-8-метокси-10-метилен-2,9-диоксатрицикло 4 , 3,1,,.кангидротартрат (ХС1 I)
3-пиперидинометил-4о(.-окси-8-метоктокси-10-метил-2,9-диоксатрицикло 4,3,1, (Г декангидротартрат ( ХС I 11 )
3-N , N -Дибутиламинометил-4 f -окси-8-метокси-10-метил-2,9-диоксатрицикло 4 , 3, 1, О декангидротартрат. (ХС1 V)
Пример 14. Получение 3-аминометил-4 ь -окси-8-метокси-10-метилен-2,9-диоксатрицикло 4,3,1, oVjдекана (XCIV)
а)Получение З-азидометил-4 fb -ацетокси-8-метокси-10-метилен-2,9-диоксатрицикло 4 , 3, 1, 0 декана (XCV) из .З-иодметил-4 р -ацетокси-8-метокси-10-метилен-2 , 9-диоксатрицикло 4 /3, 1 0 декана (V),
14 г соединения формулы (VIM) растворяют в 100 мл триамидгексаметилфосфорной кислоты и смешивают с 30 г азида натрия. При сильном перемешивании нагревают 4 ч при . К раствору добавляют 600 мл эфира и органическую фазу промывают 5 раз по 150 мл воды. Объединенные водные фазы встряхивают с эфиром. Затем объединенные органические фазы высушивают над сульфатом натрия. Отфильтровывают и промывают эфиром, фильтрат сгущают в роторном испарителе при 50°С. Получают 11,5 г продукта в виде бесцветного масла.
.-,о-о о.
Мол.в. 295,33,- И.р-57 Св метаноле
б)Получение З-азидометил-4 Р -окси-8-метокси-10- 1етилен-2 , 9-диоксатрицикло f4 , 3 , 1, О декана (XCVI) из 3 азидометил-4 р -ацетокси-8-метокси 10 метилен-2,9-диоксатрицикло 4,3, 1,0 декана..
10,55 г З-азидометил-4 ji-ацетокси-8-метокси-10-метилен-2,9-диоксатрицикло 4 , 3,1, 0 }декана растворяют в 250 мл эфира и смешивают с раствором 1,5 г гидроокиси натрия в 70 мл метанола.
Раствор перемешивают 1 ч при комнатной температуре, затем ледяной уксусной кислотой доводят до рН 7, упаривают в вакууме водоструйного насоса. Остаток обрабатывают водойу водную фазу высаливают, с пометцью сульфата аммония и экстрагируют эфиром. Объединенные органические фазы высушивают над сульфатом натрия, фильтруют и упаривагот в роторном испарителе при 50с. Получают 7,9 г продукта в виде бесцветного масла, что
S соответствует 87,2% от теорий.
С,, „
Мол. в. 253,26; (в метаноле)
в) Получение З-аминометил-4 р-окси-8 -метокси- 10 -метилен -2 ,9-диоксатри цикло 4, 3,1,СГ декана (XCVII) из 3- азидометил-4 р)-окси-8-метокси-10- у метилен-2,9-диоксатрицикло 4,3,1,0J декана .
17,7 г 3-азидометш1-4 |Ь -окси-8-метоксй-10-метилен-2,9-диоксатрицикло 4 , 3, 1 , 0 декана растворяют в 700 мл метанола и смешивают с 35 мл 80%-ного гидразин гидрат а. Затем добавляют 1 г никеля Ренея и смесь вьщерживают при комнатной температуре в
0 течение часа. Катализатор отсасывают через асбест и фильтрат упаривают в вакууме водоструйного насоса при . Остаток растворяют в бензоле, фильтруют и после отгонки раствори5теля перекристаллизовывают из эфира. Получают 15,3 г продукта в виде бесцветных кристаллов, что составляет 94,6% от .теории. C HjyNO
Мол. в. 227,62, т.пл. 108-109с;
0 CdJ -37 (в метаноле) .
Пример 15. Получение З-аминометил-4 (Ь -окси-8-метокси-10-метил-2,9-диоксатрицикло 4,3,1, 0 декана.
5
а). Получение З-иодметил-4 ft -окси-8-метокси-10-метилен-2,9-диоксатрицикло 4,3,1, декана ( ХС V I 1 О из З-иодметил-4 Р -ацетокси-8-метокси-10-метилен-2, 9-диоксатрицикло 4,3,
0
1,0 декана (V).
38 г соединения формулы (VIII) в 250 мл метанола смешивают.с 4 г гидроокиси натрия в 50 мл метанола и перемешивают 30 мин при комнатной
5 температуре. Добавляют 500 мл воды, нейтрализуют ледяной уксусной кислотой, смешивают с сульфатом аммония до насыщения и экстрагируют эфиром. Сушат над сульфатом натрия, фильтруют и промывают эфиром, объединенные
0 органические фазы упаривают в вакууме при 50°С. Получают 36,64 г. продукта в виде бесцветного масла, что составляет 94,5% от теории. q,H,.3
5
Мол.в. 338,15;Г 1}|ч-13 (э метаноле).
б) Получение З-иодметил-4/i-окси-8-метокси-10-метил-2,9-диоксатрицикло 14, 3, 1,03 декана (XCIX) из 3-иодметил-4 р) -окси-8-метокси-10-метилен-2,9-диоксатрицикло f4,3,l,o jfleKaHa.
75 г З-йодметил-4 Ь -окси-8-метокси-10-метилен-2,9-диоксатрицикло{4,3, i,О декана в 250 мл этанола смешивают с 6 г окиси платины (IV) в 100 МП этанола и гидрируют при комнатной температуре (поглощение водорода 5 л). Катализатор отсасывают, раствор упаривают в роторном испарителе при 50°С. Остаток очищают на силикагеле смесью и.гексана с эфиром и перекристаллизовывают из смеси н.гексана с эфиром. Выход 69,9 г, что составляет 92,8% от теории. С H,
Мол.в. 340,166; Т.Ш1., 92-93 0, -к -35,3 в метаноле/. ,
в ) Получение З-иодметил-4 f -ацетокси-8-метокси-10-метил-2,9-диоксатрицикло 4 , 3,1,СГ екана (с) .
20 г З-иодметил-4 р -окси-8-метокси-10-метйл-2,9-диоксатрицикло 4 , 3, 1 0 декана растворяют в 20 мл пиридина и 10 мл уксусного ангидрида и выдерживают в течение часа при комнатной. температуре. Затем реакционную смесь несколько раз выпаривают досуха с этанолом. Очищают через силикагель смесью н.гексана с эфиром получают 15,4 г вещества, что составляет 68,5% от теории.
Мол. в. 33,1о2; Т. пл. 120-123с, ,8° (в метаноле).
) Получение З-азидометил-4 р -ацетокси-8-метокси-10-метил-2,9-диоксатрицикло 4, 3, 1,и цекана (С1)
15,4 г З-иодметил-4 Р -ацетокси-8-метокси-10-метил-2,9-диоксатрицикло 4, 3,1,0 Т декана растворяют и 100 мл триамидгексаметилфосфорной кислоты и смешивают с 31 г азида нат-i рия. Смесь перемешивают в течение часа при 100°С. Добавляют 600 мл эфира и встряхивают 5 раз с 150 мл воды. Водные фазы встряхивгиот 2 раза с эфиром и объединенные органические фазы высушивают над сульфатом натрия., фильтруют и концентрируют в вакууме при 50°С. Получают 12 г продукта бесцветного масла (что соответствует 100% от теории)
-S „ о ,
Мол. в. 297,32; ИГ+З CB метаноле).
д) Получение З-азидометил-4/Ь -окси-8-метокси-10-метил-2,9-диоксатрицикло 4 , 3, 1, СГУдекана (СИ).
К 12 г З-азидометил-4 р -ацетокси-8-метокси-10-метил-2,9-диоксатрицикло 4 , 3, 1, декана в 200 мл эфира добавляют 1,5 г гидроокиси натрия в 20 мл метанола. Раствор перемешивают 10 мин при комнатной температуре, затем выливают в 200 мл ледяной воды, нейтрализуют ледяной уксусной кислотой и смешивают с сульфатом г ммония до насыщения. Экстрагируют эфиром,- объединенные органические фазы высушивают над сульфатом натрия, фильтруют-и концентрируют в вакууме, Получают 10,7 г продукта в виде бесцветного масла, что соответствует 100% от теории.
Ач ал
Мол. в. 255,28; (в метанолеХ,
е)Получение З-аминЬмётил-4 р) -окси-8-метокси-10-метил-2,9-диоксатрицико Г4,3, 1,о 7декана (CIII)
10,6 г З-азидометил-4 1) -окси-8-метокси-10-метил-2,9-диоксатрицикло 4,3,1,0 декана в 200 мл метанола смешивают с 32 мл 80%-ного гидразингидрата. Добавляют 1 г никеля Ренея
в 100 мл метанола перемешивают 1 ч при комнатной температуре. Катализатор отфильтровывают и фильтрат упаривают в вакууме досуха. Остаток в воде растворяют, раствор подщелачивают гидроокисью натрия и заггем экстагируют эфиром. Объединенные эфирные фазы высушивают над сульфатом натрия, фильтруют и концентрируют в вакууме при . Получают 9,1 г продукта в виде бесцветного масла, что
составляет 94,3% от теории.
CiAoNO ,,
Мол.в. 229,28; )-9 (в метаноле . П р и м е р 16. Получение p-N,N-димeтилaIvIинoмeтил-4 р -окси-8-метокси-10-метил-2,9-диоксатрицикло 4,3, 1,о екана (-CIV)
800 мг З-аминометил-4 р .-окси-8-метокси-10-метил-2,9-диоксатрицикло 4, 3, 1,0 декана в 5 мл метанопа. смешивают с. 5 мл 37%-ного раствора формалина и перемешивают Юмин при комнатной температуре. Добавляют на кончике штапеля никеля Ренея, гид.рируют при комнатной температуре. По
окончании поглощения водорода отфильтровывают от катализатора и выпаривают в вакууме досуха. Очищают хроматографией на силикагеле с помощью смеси хлороформа с метанолом. Получают
780 мг продукта, что составляет 86,9% QT теории.
Мол.в. 267,.Ш1. 85-86 С,
fdl -32,5 CB метаноле).
Пример 17. Получение 3-tl,-азабицикло СЗ, 2., 2) нонанил -метил-4Р -окси.-8-метокси-10-метил-2, 9-диоксатрицикло 4,3,1, О екангидротартрата (CV)..
. 7,6 г соединения формулы V вместе с 10 г бикарбоната натрия суспендируют в 100 мл диметилформамида, затем смешивают с 7,5 г З.-аэабицикло (3,2,2)нонана. Смесь кипятят 6 час при 170°С намасляной бане, затем
охлаждают до комнатной температуры.
Смесь упаривают, остаток смешивают с 40 мл воды и 8 мл 30%-него раствора едкого натра, затем экстрагируют 3 раза по 20 мл эфира. После выпаривания эфирных экс- рактов получают. 5,8 г 3- 1-аэабицикло(3,2,2)нонанил -метил-4 р -окси-8-метокси-10-метилен-2,9-диоксатрицикло- Г4 ,3,1,0 декана (С IX)
5,3 г соединения формулы (С IX) растворяют в метаноле, добавляют 4 г никеля Ренея и 0,8 г гидроокиси натрия гидрируют водородом. После прекращения поглощения водорода смесь отсасывают на нутч-фильтре через Теорит и промывают метанолом.
К фильтрату добавляют 1,2 мл уксусной кислоты и упаривают, остаток растворяют в эфире и очищают хроматографией на силикагеле (размер частиц 0,2-0,5 мм).
Элюируют н.гексаном с 1,5% диэтиламина. Элюат выпаривают, получают 4,4 г кристаллического 3- 1-азабицикло-(3 , 2 , 2)нонанш13 -метил-4 f -окси-8-метокси-10-метил-2,9-диоксатрицикло 4,3,1,(л5цекана.
4-г соединения формулы (С IV) растворяют в 8 мл этанола., за-рем смешивают с 1,94 г L (+)-винной кислоты, которые растворены в 13,6 мл этанола. После упаривания растворителя,и высушивания получают 5,7 г кристаллического (CV)
Мол.в. 487,55,- т.пл. 73-81 С, ШУ +7,7(8 метаноле).
ffl fj
s R
«D «
:
« tj ж ч о
0 Ен










а а
16 tt о « н
а а
у с: с а
н
iP
и о
о in
H
о
X 0)
r
o n
о
оГ
+
«о (
Хtu or:
vO
tf
X
IT)
J о ОС
X
rn
о
of
go
1-1
+
о
in m
CN
о
Ч
ю
Vo
Э
ё:
X
uS
г) X
к s я
ЯЗ
s;
Ч
о
и
и
о о
Ч) U
I см
.
о
X X
in
1в
tf
X
ч с а
EH
л
m я s ч ю п н
о
о
о г- I
по
vO
г
0
г
гк
Ч
1П
го
г г
г
о
Т
о
г
;
t
X LJ О
X с о
( I
« 01
т.
J
U
V)
г/
i- 5
I
с
U
о
т
о
ЛГ V)
X X X
X X X
X
X X
41
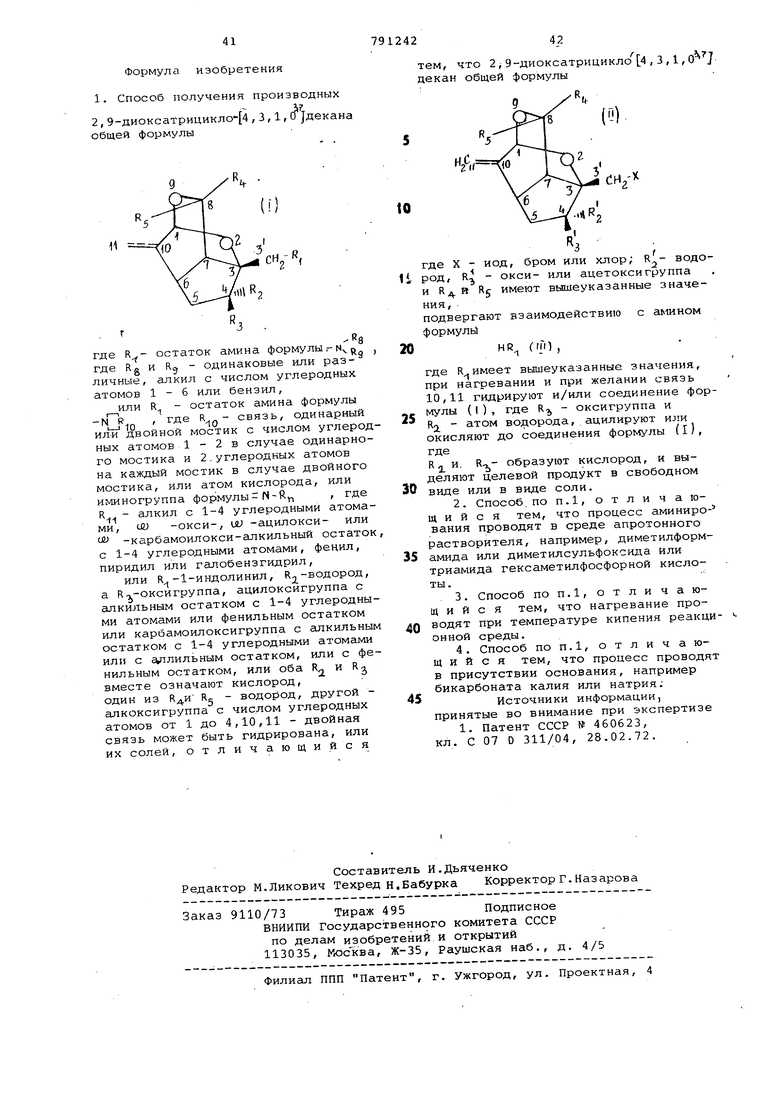
Формул а
изобретения
общей формулы
11
где остаток амина формулы г N j. где Rg и Kg - одинаковые или различные , алкил с числом углеродных атомов 1-6 или бензил,
или R - остаток амина формулы
одинарный
- связь.
-N R
где
10
ил-и двойной мостик с числом углеродных атомов 1 - 2 в случае одинарного мостика и 2.углеродных атомов на каждый мостик в случае двойного мостика, или атом кислорода, или иминогруппа формулы , где
R - алкил с 1-4 углеродными атомами, (Jtu -ОКСИ-, (Jt -ацилокси- или ( -карбамоилокси-алкильный остаток с 1-4 углеродными атомами, фенил, пиридил или Гсшобензгидрил,
или R -1-индолинил, К2.водород, а Кт -оксигруппа, ацилоксигруппа с алкильным остатком с 1-4 углеродными атомами или фенильным остатком или карбамоилоксигруппа с гшкильным остатком с 1-4 углеродными атомс1ми или с плильным остатком, или с фенильным остатком, или оба R,-j и R вместе означают кислород, один из Rg - водород, другой алкоксигруппа с числом углеродных атомов от 1 до 4,10,11 - двойная связь может быть гидрирована, или их солей, отличающийся
79124242
тем, что 2 j 9-диоксатрицикло 4 , 3 ,1, декан общей формулы
to
где X - иод, бром или хлор; R - водород, R - окси- или ацетоксигруппа и R.я Rj имеют вышеуказанные значения,
подвергают взаимодействию с a 1инoм формула
0
HR (ml ,
где R. имеет вьдиеуказанные значения, при нагревании и при желании связь 10,11 гидрируют и/или соединение формулы (I), где R,, - оксигруппа и
5 К - атом во;(Орода, ацилируют или окисляют до соединения формулы (I), где
R 2 и, R-,- образуют кислород, и выделяют целевой продукт в свободном
0 виде или в виде соли.
растворителя, например, диметилформ5амида или диметилсульфоксида или триамида гексаметилфосфорной кислоты .
5
Источники информации, принятые во внимание при экспертизе

Авторы
Даты
1980-12-23—Публикация
1977-02-21—Подача