Изобретение относится к способу получения третичных циклоалканолов, содержащих 2,2'-битиофеновый фрагмент, которые могут быть исходными соединениями в синтезе органических люминофоров.
Данным изобретением решена задача получения циклических третичных спиртов, содержащих 2,2'-битиофеновый фрагмент.
Известные методы синтеза 1-арилциклоалканолов и 2-ариладамантанолов [1-3], которые имеют ряд существенных недостатков:
1. Использование дорогостоящих и токсичных реагентов.
2. Длительное время протекания реакции.
3. Сложность технологического исполнения.
Известен метод синтеза 2-ариладамантанолов-2, в котором к раствору кетона в абсолютном эфире добавляют арилмагний бромид и кипятят в течение 3-х часов [1]. Данный метод не является достаточно удобным в технологическом исполнении, так как проводят дозирование разбавленного раствора арилмагнийбромида в абсолютном эфире.
Имеется ссылка на синтез третичных спиртов, содержащих тиофеновое кольцо [2]. Однако в качестве исходного соединения используют тиофен, который обрабатывают н-бутиллитием, добавляют кетон и выдерживают реакционную массу в течение 16 часов [2]. В данном случае используют взрывоопасный и дорогостоящий н-бутиллитий, при этом время проведения реакции значительно увеличивается. Выходы третичных спиртов не представлены, в связи с этим сложно оценить эффективность данного метода, по сравнению с условиями реакции Гриньяра.
Наиболее близким по техническому исполнению общим методом синтеза 1-арилциклоалканолов является получение соответствующего реактива Гриньяра из арилбромидов в абсолютном эфире с инициированием реакции метилйодидом и последующим добавление эфирного раствора кетона при температуре 0-5°С в инертной атмосфере [3]. Описанный общий метод синтеза не учитывает необходимое количество абсолютного эфира для проведения реакции и не рассматривает оптимальное время выдержки реакционной массы.
Однако использование этих методов в ряду 2,2'-битиофена приводит к образованию значительного количества побочного продукта - циклоалкена, а не третичного спирта. Полученный нами результат является более простым в техническом отношении, экономически эффективным и безопасным методом синтеза 1-(2,2'-битиенил-5)циклоалкан-1-олов. Технический результат достигается тем, что в способе получения третичных циклических спиртов ряда 2,2'-битиофена реакцией 5-бром-2,2'-битиофена или 5-йод-2,2'-битиофена и магния в абсолютном диэтиловом эфире с циклоалканоном в мольном соотношении 1:1:1 (для адамантанона 1:1:0.8), при температуре 35-36°С в течение часа. Синтез целевых спиртов проводили следующим образом: получали реактив Гриньяра из доступных 5-бром-2,2'-битиофена или 5-иод-2,2'-битиофена и магния в мольном соотношении 1:1,05 в абсолютном диэтиловом эфире в течение часа, затем добавляли эфирный раствор кетона в соотношении при температуре 8-10°С в течение 30 мин. и кипятили реакционную массу 1 час. Разложение проводили раствором хлорида аммония при температуре 10-15°С, отделяли эфирный слой, сушили, удаляли эфир и очищали методом колоночной хроматографии, используя в качестве элюента гексан.
Основные отличительные признаки предлагаемого метода можно сформулировать следующим образом:
1. В предлагаемом методе в качестве исходного соединения используются как 5-бром-2,2'-битиофен, так и 5-иод-2,2'-битиофен, в представленных выше методах синтеза применяют только бромпроизводные.
2. Наиболее приемлемым мольным соотношением магния и галоидпроизводного для синтеза реактива Гриньяра является 1:1. В зависимости от структуры установлено, что в случае циклоалканонов мольное соотношение - 1:1.05, для 2-адамантанона используется мольный недостаток - 1:0.8.
3. Значительно сокращается время проведения реакции (с 4 ч [5] или 16 ч [4] до 1 ч). Сокращение времени реакции позволяет избежать побочной реакции дегидратации третичного спирта.
4. Предлагаемый метод не предполагает использование инертной атмосферы, что существенно упрощает схему реактора, и не требует применения сложного и дорогостоящего оборудования.
Получение 5-бром-2,2'-битиофена и 5-иод-2,2'-битиофена проводили по ранее описанным методам [4, 5].
Выполнение метода
Строение синтезированных соединений подтверждено данными ИК и масс-спектров, контроль над ходом реакции и индивидуальность соединений определялись с помощью ТСХ и ГЖХ. ГЖХ анализ проводился на газовом хроматографе «Кристалл 2000М». ИК спектр записан на спектрометре Shimadzu FTIR-8400S в таблетках бромида калия либо в тонком слое в призмах. Масс-спектр получен на хроматомасс-спектрометре «Finnigan Trace DSQ» при энергии ионизирующих электронов 70 эВ. Элементный анализ выполнен на автоматическом CHNS-анализаторе "EuroVector ЕА-3000". Спектры ЯМР Н записаны на приборе Jeol JNM ЕСХ 400 (400 Мгц), в CDCl3, ДМСО-d6.
Способ получения 1-(2,2'-Битиен-5-ил)циклоакан-1-олов (Ia-с). Общая методика.

Пример 1. 1-(2,2'-Битиен-5-ил)циклоаканолы (Ia-с). Общая методика. К реактиву Гриньяра [2,45 г (0,01 моль) 5-бром-2,2'-битиофена или 2,92 г (0,01 моль) 5-йод-2,2'-битиофена и 0,24 г (0,01 моль) магния в 15 мл абсолютного диэтилового эфира] прибавляли раствор 0,01 моль циклоалканона в 15 мл эфира, кипятили 1 ч., обрабатывали 10% раствором NH4Cl. Эфирный слой промывали водой, сушили, эфир отгоняли, остаток очищали колоночной хроматографией.
1-(2,2'-Битиен-5-ил)циклобутанол (Ia). Выход 3 г (33%). Т.пл. 65-68°С (CCl4). ИК спектр, см-1: ν 3260 (ОН). Спектр ЯМР 1Н, δ, м.д.: 2.22 м (2Н, CH2), 2.50-2.65 м (4Н, СН2-СН2), 6.92 дд (1Н, Н-4', 3J4'-5' 5.1 Гц, 3J4'-3' 3.7 Гц), 6.98 д (1Н, Н-3,3J 3.6 Гц), 7.05 д (1Н, Н-3',3J 3.7 Гц), 7.12 д (1Н, Н-4, 3J 3.7 Гц), 7.40 д (1Н, Н-5', 3J 5.0 Гц). Найдено, %: С 60.95, Н 5.09, S 27.18. C12H12OS2. Вычислено, %: С 60.98, Н 5.12, S 27.13.
1-(2,2'-Битиен-5-ил)циклопентанол (Ib). Выход 1 г (40%), т.пл. 53-54°С (н-гексан). ИК спектр, ν, см-1: 3336 (ОН). Спектр ЯМР 1Н, δ, м.д.: 1.70-1.90 м (8Н, CH2), 6.82 д (1Н, Н-3. 3J 3.6 Гц), 6.98 д (1Н, Н-4', 3J4'-5' 5.1 Гц, 3J4'-5' 3.7 Гц), 7.02 д (1Н, Н-4, 3J 3.7 Гц), 7.14 д (1Н, Н-3', 3J 3.7 Гц), 7.26 д (1Н, Н-5', 3J 5.0 Гц). Найдено, %: С 62.31, Н 5.69, S 25.58. C13H14OS2. Вычислено, %: С 62.36, Н 5.64, S 25.61.
1-(2,2'-Битиен-5-ил)циклогексанол (Ic). Выход 1,5 г (56%), т.пл. 73-76°С (н-гексан). ИК спектр, ν, см-1: 3309 (ОН). Спектр ЯМР 1Н, δ, м.д.: 1.40-1.50 м (4Н, CH2), 1.60-1.80 м (6Н, СН2), 5.26 с (1Н, ОН), 6.82 д (1Н, Н-3, 3J 3.7 Гц), 7.02 д (1Н, Н-4', 3J4'-5' 5.1 Гц, 3J4'-5' 3.6 Гц), 7.08 д (1Н, Н-4, 3J 3.7 Гц), 7.18 д (1Н, Н-3', 3J 3.7 Гц), 7.41 д (1Н, Н-5', 3J 4.1 Гц). Найдено, %: С 63.63, Н 6.07, S 24.28. C14H16OS2. Вычислено, %: С 63.60, Н 6.10, S 24.25.
5-(Циклопент-1''-ен-1''-ил)-2,2'-битиофен (IIb). Выход 0,60 г (10%), т.пл. 99-100°С (н-гексан). ИК спектр, ν, см-1: 1654 (ОС). Спектр ЯМР 1Н, δ, м.д.: 2.01 м (2Н, CH2-4''), 2.50 м (2Н, СН2-5''), 2.70 м (2Н, СН3-3''), 6.11 м (1Н, Н-2''), 6.79 д (1Н, Н-3, 3J 4.1 Гц), 6.98 дд (1Н, Н-4', 3J4'-5' 5.1 Гц, 3J4'-5' 3.7 Гц), 7.02 д (1Н, H-4, 3J 3.7 Гц), 7.13 д (1Н, Н-3', 3J 3.5 Гц), 7.18 д (1Н, Н-5', 3J 5.1 Гц). Найдено, %: С 67.25, Н 5.19, S 27.57. C13H12S2. Вычислено, %: С 67.20, Н 5.21, S 27.60.
5-(Циклогекс-1''-ен-1''-ил)-2,2'-битиофен (IIc). Выход 2 г (50%), т. пл. 107-110°С (н-гексан). ИК спектр, ν, см-1: 2925 (С-Н). Спектр ЯМР 1Н, δ, м.д.: 1.52 м (2Н, СН2), 1.62 м (2Н, СН2), 2.11 м (2Н, СН2), 2.30 м (2Н, СН2), 6.11 м (1Н, Н-2''), 6.92 д (1Н, Н-3, 3J 3.7 Гц), 7.02 д (1Н, Н-4', 3J4'-5' 5.1 Гц, 3J4'-3' 3.7), 7.11 д (1Н, Н-4, 3J 5.0 Гц), 7.21 д (1Н, Н-3', 3J 3.7 Гц), 7.43 д (1Н, Н-5', 3J 5.0 Гц). Найдено, %: С 68.33, Н 5.75, S 25.99. C14H14S2. Вычислено, %: С 68.25, Н 5.73, S 26.03.
Способ получения 2-(2,2'-битиофен-5-ил)трицикло[3.3.1.13,7]декан-2-ола.
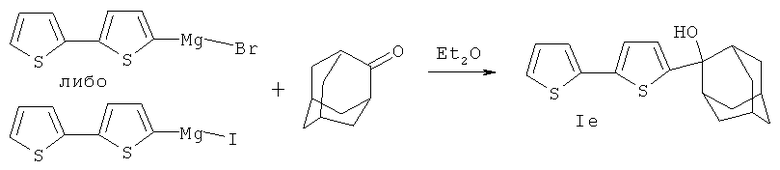
Пример 2. 2-(2,2'-битиофен-5-ил)трицикло[3.3.1.13,7]декан-2-ол (Ie). К реактиву Гриньяра [2,45 г (0,01 моль) 5-бром-2,2'-битиофена или 2,92 г (0,01 моль) и 0,24 г (0,01 моль) магния в 15 мл эфира], прибавляли раствор 1,2 г (0,008 моль) адамантанона в 20 мл эфира, кипятили 1 ч, обрабатывали 7% раствором HCl. Эфирный слой промывали водой, сушили, эфир отгоняли, очищали колоночной хроматографией. Выход 1.43 г (45%). Т пл. 141,5-142°С (бензол). ИК спектр, см-1: 3545 ν (ОН), 2900 ν (Ad). Масс-спектр, m/z (Iотн., %): 316 (100) [М+]; 299 (55) [M+-OH]; 298 (30) [M+-H2O]; 283 (62) [M+-33]. Спектр ЯМР 1Н, δ, м.д.: 2.22 м (2Н, СН2), 2.50-2.65 м (4Н, СН2-СН2), 6.92 дд (1Н, Н-4', 3J4'-5' 5.1 Гц. 3J4'-3' 3.7 Гц), 6.98 д (1Н, Н-3, 3J 3.6 Гц), 7.05 д (1Н, Н-3', 3J 3.7 Гц), 7.12 д (1Н, Н-4, 3J 3.7 Гц), 7.40 д (1Н, H-5', 3J 5.0 Гц). Найдено, %: С 68.35, Н 6.34, S 20.21. C18H20OS2. Вычислено, %: С 68.31, Н 6.37,8 20.26.
Литература:
[1] Olah G.A., Wu A., Farooq O. Preparation of 2-aryladamantanes and 3-aryldiamantanes by improved ionic hydrogenation oa the corresponding tertiary alcohols with sodium borohydride-triflic acid or formic acid-triflic acid. // J. Org. Chem., vol.53, 1988, 5143-5145.
[2] Olah G.A., Berrier A.L., Surya Prakash G.K. Use 2-thienyl, 2-furyl, 5-ethyl-2-furyl, and protonated 4-acetylphenyl substituents in Carbon-14 nuclear magnetic resonance chemical shift correlations. // J. Org. Chem., vol.47, 1982, 3903-3909.
[3] Tanida Н., Tsushima Т. Solvolyses of tertiary a-arylcycloalkyi and -polycycloalkyi chlorides. Effects of ring size and substituents in thy aryl ring on the solvolyses rates. // J. Am. Chem. Soc., vol.92, 1970, 3397-3403.
[4] Eberhard O. Ueber die chlorierten α,α-Dithienyle. // Berichte der deutschen chemischen Gesellschaft, B.28, N.3, 1895, 2385-2386.
[5] Wu R., Schumm J.S., Pearson D.L., Tour J.M. Convergent synthetic routes to orthogonally fused conjugated oligomers directed toward molecular scale electronic device applications. // J. Org. Chem., vol.61, n.20, 1996, 6906-6921.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ 3-АЛКИЛ(АРИЛ)-2,2'-БИТИОФЕН-5-КАРБОНОВЫХ КИСЛОТ И ИХ ЭФИРОВ | 2011 |
|
RU2470930C1 |
| СПОСОБ ПОЛУЧЕНИЯ ХИРАЛЬНЫХ ГЕТЕРОЦИКЛИЧЕСКИХ ЛИГАНДОВ НА ОСНОВЕ 1,2-ДИАМИНОЦИКЛОГЕКСАНА | 2013 |
|
RU2533424C1 |
| СПОСОБ ПОЛУЧЕНИЯ 11(Е)-ТЕТРАДЕЦЕН-1-ИЛАЦЕТАТА | 2010 |
|
RU2429220C1 |
| СПОСОБ ПОЛУЧЕНИЯ 2-(1-АДАМАНТИЛКАРБОНИЛ)-1,2-ДИГИДРОНАФТО[2,1-b]ФУРАНОВ | 2011 |
|
RU2495033C2 |
| Донорно-акцепторные сопряженные молекулы и способ их получения | 2014 |
|
RU2624820C2 |
| РАЗВЕТВЛЕННЫЕ ОЛИГОАРИЛСИЛАНЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2008 |
|
RU2396290C1 |
| ПОЛИАРИЛСИЛАНОВЫЕ ДЕНДРИМЕРЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2007 |
|
RU2353629C1 |
| СПОСОБ ПОЛУЧЕНИЯ АЛЬФА-АЛКОКСИДИАЛКИЛПЕРОКСИДОВ | 2005 |
|
RU2284321C1 |
| ПОЛИАРИЛСИЛАНОВЫЕ МОНОДЕНДРОНЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2007 |
|
RU2348657C1 |
| СПОСОБ ПОЛУЧЕНИЯ 2-N-ФЕНИЛАМИНО-2-ЦИАНОАДАМАНТАНА ИЛИ ЕГО ПРОИЗВОДНЫХ | 2007 |
|
RU2344124C1 |
Изобретение относится к способу получения третичных циклических спиртов ряда 2,2'-битиофена реакцией 5-бром-2,2'-битиофена или 5-йод-2,2'-битиофена и магния в абсолютном диэтиловом эфире с циклоалканоном в мольном соотношении 1:1:1 (для адамантанона 1:1:0.8), при температуре 35-36°С в течение часа. Упрощение технологического процесса достигается за счет использования доступных реагентов, использование приемлемого мольного соотношения реагентов, уменьшения общего времени проведения реакции, уменьшение стоимости производства достигается за счет упрощения схемы реактора. 2 пр.
Способ получения третичных циклических спиртов ряда 2,2'-битиофена реакцией 5-бром-2,2'-битиофена или 5-йод-2,2'-битиофена и магния в абсолютном диэтиловом эфире с циклоалканоном в мольном соотношении 1:1:1 (для адамантанона 1:1:0.8), при температуре 35-36°С в течение часа.
| Tanida H, Tsushima Т., "Solvolyses of tertiary alfa-arylcycloalkyl and - polycycloalkyl chlorides | |||
| Effects of ring size and substituents in the aryl ring on the solvolyses rates", Journal Am | |||
| Chem | |||
| Soc., vol.92., 1970, p.p.3397-3403 | |||
| Станок для изготовления деревянных ниточных катушек из цилиндрических, снабженных осевым отверстием, заготовок | 1923 |
|
SU2008A1 |
| RU 94042908 A1, 10.05.1996. | |||
Авторы
Даты
2013-10-10—Публикация
2011-09-20—Подача