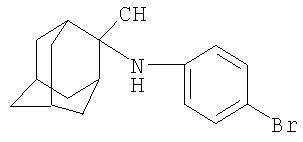
Изобретение относится к химии производных адамантана, а именно к новому способу получения 2-N-фениламино-2-цианоадамантана или его производных общей формулы

которые представляют собой полупродукты в синтезе вероятных биологически активных веществ. В частности, они являются структурными аналогами известного препарата «бромантан» (4-бромфениламино-2-адамантана гидрохлорид), применявшегося в спортивной медицине. В литературе сведения о методах получения соединений заявляемой структурной формулы отсутствуют.
Известен способ получения аминодиэтилуксусной кислоты, причем исходным соединением является диэтилкетон, который вводят в реакцию с цианистым натрием в присутствие хлористого аммония с получением циангидрина кетона, который по реакции с концентрированным гидроксидом аммония в среде метанола при 60°С или с метанольным раствором аммиака и при небольшом давлении превращается в нитрил α-аминодиэтилуксусной кислоты [Robert Е.Steiger. Organic synthesis, CV3, 66.; Tiemann and Friedländer, Ber., 14, 1973 (1881)].
Данный метод не приводит к получению веществ заявляемой структурной формулы. Кроме этого, среди недостатков этого метода можно отметить использование метанола и токсичного цианистого натрия.
Наиболее близким к предлагаемому изобретению является способ получения замещенных N-адамантиланилинов, заключающийся в реакции адамантанона-2 с некоторыми производными анилина в условиях реакции Лейкарта-Валлаха [SU 1018361 А1, МПК С07С 211/00, А61К 31/13, Опубл. 30.04.94].
Данный метод не приводит к получению веществ заявляемой структурной формулы.
Задачей предлагаемого изобретения является разработка технологичного метода синтеза 2-N-фениламино-2-цианоадамантана или его производных различного строения, протекающего с высоким выходом по исходному адамантанону-2.
Техническим результатом является расширение ассортимента производных адамантана, а именно полупродуктов в синтезе вероятных биологически активных соединений, разработка метода синтеза новых производных адамантана с высоким выходом.
Поставленный технический результат достигается в новом способе получения 2-N-фениламино-2-цианоадамантана или его производных общей формулы
 .
.
заключающемся во взаимодействии адамантанона-2 с анилином или его производными из ряда: п-толуидин, п-анизидин, п-броманилин, о-фенилендиамин при мольном соотношении 1:1.04-1.25 соответственно, в среде толуола в присутствии толуолсульфокислоты в течение 1.5-3 часа с образованием 2-адамантилиденфенилимина или его производного, и его последующем взаимодействии с ацетонциангидрином при мольном соотношении реагентов, равном 1:3-4 соответственно, в присутствии каталитических количеств карбоната калия при температуре 60-80°С в течение 15-30 минут.
Сущностью метода является реакция адамантанона-2 с анилином или его производными из ряда: п-толуидин, п-анизидин, п-броманилин, о-фенилендиамин, приводящая к образованию 2-адамантилиденфенилимина или его производных, и последующее получение 2-N-фениламино-2-цианоадамантана по реакции 2-адамантилиденфенилимина или его производного с ацетонциангидрином в присутствии карбоната калия.
 .
.
Способ осуществляется следующим образом.
Взаимодействием адамантанона-2 с анилином или его производными из ряда п-толуидин, п-анизидин, п-броманилин, о-фенилендиамин при мольном соотношении 1:1.04-1.25 в кипящем толуоле в присутствии каталитических количеств толуолсульфокислоты с выходом 81-90% получают 2-адамантилиденфенилимин или его производные, которые очищают перегонкой в вакууме.
Далее к смеси 2-адамантилиденфенилимина или его производного и ацетонциангидрина в соотношении 1: 3-4 при 60-80°С прибавляют каталитическое количество карбоната калия и нагревают в колбе с нисходящим холодильником в течение 15-30 минут до прекращения отгонки ацетона. По окончании реакции продукт очищают с помощью перекристаллизации из этанола и получают 2-N-фениламино-2-цианоадамантан или его производные. Выход данных продуктов составляет 70-98%.
Как показали проведенные исследования, наиболее удобным условием проведения первой стадии является ее осуществление в среде небольшого (4-25%) избытка анилина или его производных. Обнаружено, что меньший избыток анилина или его производных может привести к неполной конверсии адамантанона-2 (избыток анилина или его производных связывается с толуолсульфокислотой в каталитический комплекс) и чистота целевых продуктов снижается. Дальнейшее увеличение избытка анилина или его производных являлось нецелесообразным. Выбор температуры реакции определяется температурой кипения толуола, применяемого в качестве растворителя для азеотропной отгонки воды (110-111°С). Время реакции обычно составляет 1.5-3 часа, определяется по окончанию выделения реакционной воды и зависит от количества толуолсульфокислоты и основности анилина или его производных.
Наиболее удобным способом проведения второй стадии является ее осуществление в среде 3-4-кратного избытка ацетонциангидрина. Обнаружено, что меньший избыток ацетонциангидрина может привести к неполной конверсии 2-адамантилиденфенилимина и некоторому снижению чистоты целевых продуктов из-за присутствия непрореагировавшего 2-адамантилиденфенилимина. Дальнейшее увеличение избытка ацетонциангидрина не влияло на выход целевых продуктов и являлось нецелесообразным. В отсутствие катализатора - карбоната калия данное взаимодействие не протекает. Выбор температуры реакции определяется температурой кипения ацетона (56°С), по отгонке которого судят об окончании реакции. Оптимальной температурой является 60-80°С, ее увеличение приводит к некоторому потемнению реакционной массы и снижению чистоты синтезируемых соединений.
Строение синтезированных соединений подтверждено ИК-, ЯМР1H-спектроскопией и элементным анализом.
Изобретение иллюстрируется следующими примерами:
Пример 1. 2-N-Фениламино-2-цианоадамантан.

Синтез 2-адамантилиденфенилимина.
К 7,5 г (0,05 моль) адамантанона-2 прибавляют 5,5 г (0,059 моль) анилина (мольное соотношение 1:1.18), 0,2 г толуолсульфокислоты и 50 мл толуола, после чего реакционную смесь кипятят при температуре кипения толуола в течение 2-3 часов до выделения эквимолярного количества воды. По окончании реакции смесь охлаждают, промывают водой, из органического слоя отгонкой удаляют толуол, остаток перегоняют в вакууме. Получают 9,4 г (0.0418 моль) 2-адамантилиденфенилимина, выход 83,6%. Ткип=181÷183°С/ 10 мм рт.ст. Спектр ЯМР1Н, δ, м.д.: 1.76-1.99 4 с (12 Н (Ad), 2.386 с (2Н, Ad); 6.43-6.54, 6.83-6.93, 7.09-7.12 3 м (2+2+1Н, С6Н5-). Найдено, %: С 85.31, Н 8.47, N 6.18.C16H19N. Вычислено, %: С 85.28, Н 8.50, N 6.22.
Синтез 2-N-фениламино-2-цианоадамантана.
Смесь 5 г (0.0222 моль) 2-адамантилиденфенилимина и 5.66 г (0.667 моль) ацетонциангидрина (мольное соотношение 1:3) нагревают до растворения в колбе с нисходящим холодильником (установке для простой перегонки) до 60°С и при включенной вытяжной вентиляции присыпают 0.1 г карбоната калия. Наблюдается вскипание реакционной массы и отгонка реакционного ацетона. По окончании отгонки ацетона (15-20 мин) реакционная масса затвердевает. Полученную массу растворяют при кипячении с этаноле, декантируют горячий спиртовой раствор с нерастворимого карбоната калия и после кристаллизации получают 5.1 г (0.0202 моль) 2-N-фениламино-2-цианоадамантана, Тпл. 172-173°С. Выход 91%. Спектр ЯМР 1H, δ, м.д.: [1.558-1.601д (2Н), 1.718 с (2Н), 1.792 с, 1.825 с, 1.869 с (3Н), 1.951 с (1Н), 2.024 с, 2.057 с, 2.100 с (2Н), 2.256 с (1Н), 2.327 с (3Н), 2,2-Ad]; 3.497 с (1Н, NH); [6.740-6.767д (3Н), 7.078-7.129 т (2Н), С6Н5]. Спектр ИК, см-1: 2218 (C≡N), 3406 (NH). Найдено, %: С 80.95, Н 9.97, N 11.04. C17H20N2. Вычислено, %: С 80.91, Н 7.99, N 11.10.
Пример 2. 2-N-(4-Метил)фениламино-2-цианоадамантан.

Синтез 2-адамантилиден-(n-метил)фенилимина.
К 3 г (0.02 моль) адамантанона-2 прибавляют 2.68 г (0.025 моль) п-толуидина (мольное соотношение 1:1.25), 0.1 г толуолсульфокислоты и 30 мл толуола, после чего реакционную смесь кипятят при температуре кипения толуола в течение 1.5-2.5 часов до выделения эквимолярного количества воды. По окончании реакции реакционную смесь охлаждают, промывают водой, из органического слоя отгонкой удаляют толуол, остаток перегоняют в вакууме. Получают 4.3 г (0.018 моль) 2-адамантилиден-(n-метил)фенилимина. Выход 90.1%. Ткип=199÷202°С/ 10 мм рт.ст. Спектр ЯМР1Н, δ, м.д.: 1.743-1.971 4 с, 1.971 с (14 Н (Ad), 2.215 с (3Н, Me), 6.393-6.42, 6.888-6.913 2д (2+2Н, 14-С6Н4-). Спектр ИК, см-1: 1720 (C=N). Найдено, %: С 85.26, Н 8.86, N 5.88. C17H21N. Вычислено, %: С 85.30, Н 8.84, N 5.85.
Синтез 2-N-(4-метил)фениламино-2-цианоадамантана.
Смесь 1.7 г (0.00711 моль) 2-адамантилиден-(n-метил)фенилимина и 1.81 г (0.021 моль) ацетонциангидрина (мольное соотношение 1:3) нагревают до растворения в колбе с нисходящим холодильником (установке для простой перегонки) до 70-75°С и при включенной вытяжной вентиляции присыпают 0.1 г карбоната калия. Наблюдается вскипание реакционной массы и отгонка реакционного ацетона. По окончании отгонки ацетона (15-20 мин) реакционная масса затвердевает. Полученную массу растворяют при кипячении в этаноле, декантируют горячий спиртовой раствор с нерастворимого карбоната калия и после кристаллизации получают 1.49 г (0.0056 моль) 2-N-(4-метил)фениламино-2-цианоадамантана, Тпл. 138-139°С. Выход 79%. Спектр ЯМР 1H, δ, м.д.: [1.532 с (1Н), 1.575 с (1Н), 1.705 с (2Н), 1.802 с (1Н), 1.848 с (1Н), 1.931 с (1Н), 2.021 с (2Н), 2.090 с (2Н), 2.133 с (3Н), 2,2-Ad]; 2.206 с (3Н, СН3); 3.333 с (1Н, NH); [6.666-6.693д (2Н), 6.886-6.913д (2Н), С6Н4]. Спектр ИК, см-1: 2224 (C≡N), 3400 (NH). Найдено, %: С 81.11, Н 8.37, N 11.48. C18H22N2. Вычислено, %: С 81.16, Н 8.32, N 10.52.
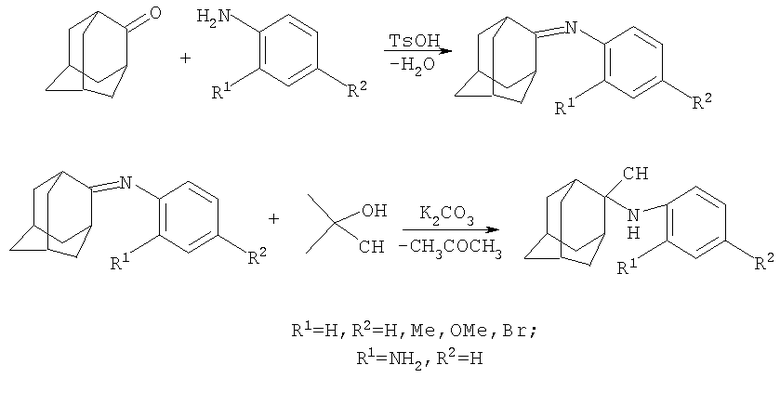
Пример 3. 2-N-(4-Метокси)фениламино-2-цианоадамантан.
Синтез 2-адамантилиден-(n-метокси)фенилимина.
Смесь 7.5 г (0.05 моль) исходного адамантанона-2 и 6.5 г (0.052 моль) п-анизидина (мольное соотношение 1:1.04), 0.1 г толуолсульфокислоты и 30 мл толуола кипятят при температуре кипения толуола в течение 1,5-2 часов до выделения эквимолярного количества воды. По окончании реакции смесь охлаждают, промывают водой, из органического слоя отгонкой удаляют толуол, остаток перегоняют в вакууме. Получают 11,1 г (0.0435 моль) 2-адамантилиден-(n-метокси)фенилимина. Выход 87%, Ткип=217-220°С/20 мм рт.ст. Спектр ЯМР1H, δ, м.д.: 1.708-1.986 3 с (12 Н (Ad)), 2.597 с (1Н (Ad)), 2.729 с (1Н (Ad)); 3.677 с (3Н, ОСН3); 6.43, 6.64 2д (2+2Н, 1,4 -С6Н4-). Найдено, %: С 79.98, Н 8.27, N 5.45. C17H21NO. Вычислено, %: С 79.96, Н 8.29, N 5.49.
Синтез 2-N-(4-метокси)фениламино-2-цианоадамантана.
Смесь 2.6 г (0.01 моль) 2-адамантилиден-(n-метокси)фенилимина и г (0.0035 моль) ацетонциангидрина (мольное соотношение 1:3.5) нагревают до растворения в колбе с нисходящим холодильником (установке для простой перегонки) до 60°С и при включенной вытяжной вентиляции присыпают 0.05 г карбоната калия. Наблюдается вскипание реакционной массы и отгонка реакционного ацетона. По окончании отгонки ацетона (20-25 мин) реакционная масса затвердевает. Полученную массу растворяют при кипячении в этаноле, декантируют горячий спиртовой раствор с нерастворимого карбоната калия и после кристаллизации получают 2.764 г (0.0098 моль) 2-N-(4-метокси)фениламино-2-цианоадамантана, Тпл. 119-121°С. Выход 98%. Спектр ЯМР 1Н, δ, м.д.: [1.516 с, 1.558 с (2Н), 1.699 с (2Н), 1.792 с, 1.835 с (3Н), 1.917 с (2Н), 2.173 с (3Н), 2.225 с (2Н), 2,2-Ad]; 3.113 с (1Н, NH); 3.670 с (3Н, ОСН3); [6.646-6.674д (2Н), 6.792-6.820д (2Н), С6Н4]. Спектр ИК, см-1: 2224 (C≡N), 3364 (NH). Найдено, %: С 76.51, Н 7.87, N 9.89.C18H22N2O. Вычислено, %: С 76.56, Н 7.85, N 9.92.
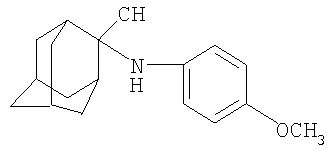
Пример 4. 2-N-(4-Бром)фениламино-2-цианоадамантан
Синтез 2-адамантилиден-(п-бром)фенилимина.
Смесь 7.5 г (0.05 моль) адамантанона-2 и 9 г (0.052 моль) п-броманилина (мольное соотношение 1:1.04), 0.2 г толуолсульфокислоты и 30 мл толуола кипятят при температуре кипения толуола в течение 2.5-3 часов до выделения эквимолярного количества воды. По окончании реакции смесь охлаждают, промывают водой, из органического слоя отгонкой удаляют толуол, остаток перегоняют в вакууме. Получают 13.3 г (0.0435 моль) 2-адамантилиден-(п-бром)фенилимина. Выход 88%. Ткип=213-216°С/ 8 мм рт.ст. Спектр ЯМР1Н, δ, м.д.: 1.680-2.023 5 с (12 Н (Ad)); 2.619 с (2Н (Ad); 6.42-6.45, 7.23-7.27 2д (2+2Н, 1,4-С6Н4-). Найдено, %: С 63.14, Н 5.90, N 4.56. C16H18NBr. Вычислено, %: С 63.17, Н 5.96, N 4.60.
Синтез 2-N-(4-бром)фениламино-2-цианоадамантана.
Смесь 2 г (0.00658 моль) 2-адамантилиден-(п-бром)фенилимина и 1.96 г (0.023 моль) ацетонциангидрина (мольное соотношение 1:3.5) нагревают до растворения в колбе с нисходящим холодильником (установке для простой перегонки) до 65-70°С и при включенной вытяжной вентиляции присыпают 0.05 г карбоната калия. Наблюдается вскипание реакционной массы и отгонка реакционного ацетона. По окончании отгонки ацетона (15-20 мин) реакционная масса затвердевает. Полученный твердый остаток растворяют при кипячении в этаноле, декантируют горячий спиртовой раствор с нерастворимого карбоната калия и после кристаллизации получают 1.79 г (0.0054 моль) 2-N-(4-бром)фениламино-2-цианоадамантана, Тпл. 145-146°С. Выход 82%. Спектр ЯМР 1Н, δ, м.д.: [1.564-1.608д (2Н), 1.719 с (2Н), 1.790 с, 1.830 с, 1.873 с (3Н), 1.956 с, 1.991 с, 2.025 с (3Н), 2.238 с (1Н), 2.292 с (3Н), 2,2-Ad]; 3.554 с (1Н, NH); [6.653-6.682д (2Н), 7.213-7.242д (2Н), С6Н4]. Найдено, %:С 61.68, Н 5.77, N 8.51. C17H19N2Br. Вычислено, %: С 61.64, Н 5.78, N 8.46.
Пример 5. 2-Н-(2-Амино)фениламино-2-цианоадамантан

Синтез 2-адамантилиден-(о-амино)фенилимина.
К 3 г (0.02 моль) адамантан-2-она прибавляют 2.7 г (0.025 моль) анилина (мольное соотношение 1:1.25), 0,1 г толуолсульфокислоты и 50 мл толуола, после чего смесь кипятят при температуре кипения толуола в течение 2-3 часов до выделения эквимолярного количества воды. После перегонки получают 3.89 г (0.0162 моль) 2-адамантилиден-(о-амино)фенилимина. Выход 81%. Ткип=228-230°С/ 8 мм. рт.ст.Спектр ЯМР1H, δ, м.д.: 1.004, 1.192, 1.477, 1.587, 1.690, 1.780, 1.897, 1.961, 2.019 (14 H (Ad), 3.375 с (2Н, NH2), 6.310, 6.378, 6.481 3 м (5Н, 1,2-C6H4-). Найдено, %: С 80.02, H 8.34, N 11.59.C16H20N2. Вычислено, %: С 79.96, H 8.39, N 11.66.
Синтез 2-N-(2-амино)фениламино-2-цианоадамантана.
Смесь 1.4 г (0.00583 моль) 2-адамантилиден-(о-амино)фенилимина и г (0.0233 моль) ацетонциангидрина (мольное соотношение 1:4) нагревают до растворения в колбе с нисходящим холодильником (установке для простой перегонки) до 75-80°С и при включенной вытяжной вентиляции присыпают 0.05 г карбоната калия. Наблюдается вскипание реакционной массы и отгонка реакционного ацетона. По окончании отгонки ацетона (25-30 мин) полученную массу растворяют при кипячении с этаноле, декантируют горячий спиртовой раствор с нерастворимого карбоната калия и после перекристаллизации получают 1.089 г (0.00408 моль) 2-N-(2-амино)фениламино-2-цианоадамантана, Тпл.162-164°С. Выход 70%. Спектр ЯМР 1H, δ, м.д.: [1.536-1.578д (2Н), 1.715 с (2Н), 1.792 с, 1.828 с, 1.872 с (3Н), 1.951 с (1Н), 2.023 с (1Н), 2.099 с (1Н), 2.143 с (1Н), 2.259 с (1Н), 2.317 с (2Н), 2,2-Ad]; 3.289 с (3Н, NH+NH2); [6.609 с (1Н), 6.654-6.676 т (2Н), 7.038-7.062д (1Н), С6Н4]. Найдено, %: С 76.35, Н 7.97, N 15.66.C17H21N3. Вычислено, %: С 76.37, Н 7.92, N 15.72.
Таким образом, вышеизложенные сведения свидетельствуют о выполнении при использовании заявленного изобретения следующей совокупности условий:
- средство, воплощающее заявленное изобретение при его осуществлении, предназначено для применения в различных отраслях промышленности;
- для заявленного изобретения в том виде, как оно охарактеризовано в независимом пункте нижеизложенной формулы изобретения, подтверждена возможность его осуществления с помощью вышеописанных в заявке или известных до даты приоритета средств и методов;
- средство, воплощающее заявленное изобретение при его осуществлении, способно обеспечить достижение технического результата.
Следовательно, заявленное изобретение соответствует требованию "промышленная применимость".
Выводы
Разработан технологически малостадийный метод синтеза 2-N-фениламино-2-цианоадамантана или его производных, позволяющий получать широкий ряд соединений с высоким выходом. Структура синтезированных соединений подтверждена ИК-, ЯМР1H-спектроскопией и элементным анализом.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 2-АМИНО-2-ЦИАНОАДАМАНТАНА | 2013 |
|
RU2523462C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 2-АМИНО-2-ЦИАНОАДАМАНТАНА | 2013 |
|
RU2523461C1 |
| СПОСОБ ПОЛУЧЕНИЯ 2-АМИНОМЕТИЛАЛКИЛ(АРИЛ)АМИНОАДАМАНТАНОВ | 2012 |
|
RU2484083C1 |
| СПОСОБ ПОЛУЧЕНИЯ 2-АМИНО-2-ЦИАНОАДАМАНТАНА ИЛИ ЕГО ПРОИЗВОДНЫХ | 2006 |
|
RU2307123C1 |
| СПОСОБ ПОЛУЧЕНИЯ 1-АРИЛ-4-ОКСОАДАМАНТАНОВ | 2005 |
|
RU2295512C1 |
| СПОСОБ ПОЛУЧЕНИЯ 2-(2-АЛКИЛ(ДИАЛКИЛ)АМИНО)АДАМАНТИЛАЛКИЛ(АРИЛ)КЕТОНОВ | 2009 |
|
RU2408570C1 |
| СПОСОБ ПОЛУЧЕНИЯ 2-(2-АМИНО)АЛКИЛАДАМАНТАНОВ | 2012 |
|
RU2495020C1 |
| СПОСОБ ПЕРЕАМИНИРОВАНИЯ 2-АМИНО-2-ЦИАНОАДАМАНТАНА | 2013 |
|
RU2523463C1 |
| СПОСОБ ПОЛУЧЕНИЯ 1-(4-R-АРИЛ)АДАМАНТАНОВ ИЛИ ИХ ПРОИЗВОДНЫХ | 2006 |
|
RU2307116C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 2,2-АДАМАНТИЛЕНСПИРООКСИРАНА | 2013 |
|
RU2529025C1 |
Изобретение относится к химии производных адамантана, а именно к новому способу получения 2-N-фениламино-2-цианоадамантана или его производных общей формулы 1. Техническим результатом является расширение ассортимента производных адамантана, разработка нового метода синтеза производных адамантана с высоким выходом. Способ заключается во взаимодействии адамантанона-2 с анилином или его производными из ряда: п-толуидин, п-анизидин, п-броманилин, о-фенилендиамин при мольном соотношении 1:1,04-1,25 соответственно, в среде толуола в присутствии толуолсульфокислоты в течение 1,5-3 часа с образованием 2-адамантилиденфенилимина или его производного, и его последующем взаимодействии с ацетонциангидрином при мольном соотношении реагентов, равном 1:3-4 соответственно, в присутствии каталитических количеств карбоната калия при температуре 60-80°С в течение 15-30 минут. Выход 2-N-фениламино-2-цианоадамантана или его производных составляет 79-98%.
 .
.

заключающийся во взаимодействии адамантанона-2 с анилином или его производными из ряда: п-толуидин, п-анизидин, п-броманилин, о-фенилендиамин при мольном соотношении 1:1,04-1,25 соответственно, в среде толуола в присутствии толуолсульфокислоты в течение 1,5-3 ч, с образованием 2-адамантилиденфенилимина или его производного, и его последующем взаимодействии с ацетонциангидрином при мольных соотношениях реагентов, равном 1:3-4 соответственно, в присутствии каталитических количеств карбоната калия при температуре 60-80°С в течение 15-30 мин.
| СПОСОБ ПОЛУЧЕНИЯ АДАМАНТИЛСОДЕРЖАЩИХ НИТРИЛОВ | 2003 |
|
RU2240310C1 |
| ЗАМЕЩЕННЫЕ N-АДАМАНТИЛАНИЛИНЫ, ПРОЯВЛЯЮЩИЕ ПСИХОСТИМУЛИРУЮЩУЮ И АНТИКАТАЛЕПТИЧЕСКУЮ АКТИВНОСТЬ | 1981 |
|
SU1018361A1 |
| СПОСОБ ПОЛУЧЕНИЯ N-(4-БРОМФЕНИЛ)-N-(2-АДАМАНТИЛ)АМИНА | 1988 |
|
RU1601978C |
| US 20060063834 A1, 23.03.2006. | |||
Авторы
Даты
2009-01-20—Публикация
2007-06-18—Подача