Перекрестная ссылка
Данная заявка заявляет приоритет по первоначальной заявке США под номером 61/037,625, поданной 18 марта 2008 года, и безусловной заявке на патент под номером 12/404,753, поданной 16 марта 2009 года, которые таким образом включены в данный документ во всей полноте посредством ссылки.
Предшествующий уровень техники
Офтальмологические гипотензивные вещества полезны при лечении ряда различных офтальмологических гипертензивных состояний, таких как офтальмологические гипертензивные кризы после хирургической или лазерной трабекулэктомии, глаукома, и в виде прехирургического вспомогательного вещества.
Глаукома представляет собой заболевание глаза, характеризующееся повышенным внутриглазным давлением. На основании своей этиологии, глаукому подразделяют на первичную и вторичную. Например, первичная глаукома взрослых (врожденная глаукома) может быть или открытоугольной или хронической закрытоугольной. Вторичная глаукома возникает в результате предшествующих офтальмологических заболеваний, таких как увеит, внутриглазная опухоль или увеличенная катаракта.
Истинные причины первичной глаукомы до сих пор неизвестны. Повышенное внутриглазное давление обусловлено нарушением оттока внутриглазной жидкости. При хронической открытоугольной глаукоме передняя камера глаза и ее анатомические структуры кажутся нормальными, но отток внутриглазной жидкости затруднен. При острой или хронической закрытоугольной глаукоме передняя камера глаза уменьшена, угол передней камеры сужен, и радужная оболочка может блокировать трабекулярную сеть при вхождении шлеммова канала. Расширение зрачка может приводить к смещению корня радужки вперед к углу и может вызывать зрачковый блок и таким образом провоцировать острый приступ. Глаза с суженным углом передней камеры предрасположены к острым приступам закрытоугольной глаукомы различной степени тяжести.
Вторичная глаукома возникает в результате любого нарушения тока внутриглазной жидкости из задней камеры в переднюю камеру и затем в Шлеммов канал. Воспалительные заболевания переднего сегмента могут препятствовать водному оттоку по причине полной задней синехии в бомбированной радужной оболочке и закупоривать канал оттока при помощи экссудатов. Другими частыми причинами являются внутриглазные опухоли, увеличенные катаракты, закупорка центральной вены сетчатки, травма глаза, оперативные приемы и внутриглазное кровоизлияние.
При рассмотрении всех типов вместе, глаукома встречается у 2% всех людей старше 40 лет и может быть асимптотической в течение лет до прогрессирующего развития, приводящего к быстрой потери зрения. В случаях, когда хирургическое вмешательство не показано, традиционно в качестве лекарственных средств для лечения глаукомы предпочитают местные антагонисты β-адренорецепторов.
Некоторые эйкозаноиды и их производные в настоящее время коммерчески доступны для применения при лечении глаукомы. Эйкозаноиды и производные включают многочисленные биологически важные соединения, такие как простагландины и их производные. Простагландины могут быть описаны в качестве производных простаноевой кислоты, обладающей следующей структурной формулой:
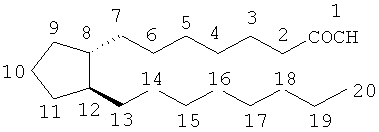
Известны различные типы простагландинов, в зависимости от структуры и заместителей, содержащихся в алициклическом кольце структуры простаноевой кислоты. Дальнейшая классификация основана на количестве ненасыщенных связей в боковой цепи, отмеченном числовыми индексами после общего типа простагландина ([например, простагландин Е1(PGE1)], простагландин E2, и на конфигурации заместителей в алициклическом кольце, отмеченной посредством α или β [например, простагладин F2α(PGF2β)].
Аналог простагландина Е, показанный ниже, раскрыт в следующих документах, прямо включенных в данный документ посредством ссылки: патент США №5,462,968; патент США №5,698,598 и патент США №6,090,847.
Селективные агонисты простагландина EP2 полезны при лечении глаукомы и, как полагают, для некоторых медицинских применений. Например, патент США №6,437,146 сообщает о применении селективных агонистов простагландина ЕР2 «для лечения и предупреждения воспаления и боли в суставе и мыщце (например, ревматоидного артрита, ревматоидного спондилита, остеоартрита, подагрического артрита, ювенильного артрита и т.д.), воспалительного состояния кожи (например, солнечного ожога, ожога, экземы, дерматита и т.д.), воспалительного состояние глаза (например, коньюктивита и т.д.), заболевания легких, в которое вовлечено воспаление (например, астмы, бронхита, болезни голубятника, аллергического альвеолита фермера и т.д.), состояния желудочно-кишечного тракта, ассоциированного с воспалением (например, афтозной язвы, болезни Крона, атрофического гастрита, вариалоформного гастрита, язвенного колита, целиакии, регионарного илеита, синдрома раздраженного кишечника и т.д.), гингивита, воспаления, боли и опухания после операции или травмы, гипертермии, боли и других состояний, ассоциированных с воспалением, аллергических заболеваний, системной красной волчанки, склеродермии, полимиозита, тендинита, бурсита, нодозного периартериита, ревматической лихорадки, синдрома Сьегрена, болезни Бехчета, тиреоидита, диабета 1 типа, диабетического осложнения (диабетической микроангиопатии, диабетической ретинопатии, диабетической нефропатии и т.д.), нефротического синдрома, апластической анемии, миастении гравис, увеитного контактного дерматита, псориаза, болезни Кавасаки, саркоидоза, болезни Ходжкина, болезни Альцгеймера, почечной дисфункции (нефрита, нефритического синдрома и т.д.), дисфункции печени (гепатита, цирроза и т.д.), желудочно-кишечной дисфункции (диареи, синдрома раздраженного кишечника и т.д.), шока, заболевания костей, характеризующегося ненормальным обменом веществ в костной ткани, такогой как остеопороз (особенно, постклимактеритический остеопороз), гиперкальцемии, гиперпаратиреоза, заболевания костей Педжета, остеолиза, гиперкальцемии в результате злокачественной опухоли с и без метастаз в костях, ревматоидного артрита, периодонрита, остеоартрита, боли в костях, остеопении, раковой кахексии, калькулеза, литиаза (уролитиаза), солидного рака, мезангиального пролиферативного гломерулонефрита, отека (особенно сердечного отека, отека мозга и т.д.), гипертензии, такой как злокачественная гипертензия, или т.п., предменструального синдрома, уролита, олигурии, такой как, вызванной острой или хронической недостаточностью, гиперфосфатурии или т.п.».
Патент США №6,710, 072 сообщает о применении агонистов EP2 при лечении или предупреждении «остеопороза, констипации, заболеваний почек, половой дисфункции, облысения, диабета, рака и при расстройстве иммунной регуляции… различных патофизиологических заболеваний, включая острый инфаркт миокарда, тромбоз сосудов, гипертензию, легочную гипертензию, ишемическую болезнь сердца, острую сердечную недостаточность и стенокардию».
Краткое описание изобретения
В данном документе раскрыты соединения полезные при лечении глаукомы, воспалительного заболевания кишечника, стимуляции роста волос и превращения пушковых волос в терминальные волосы. Сами соединения раскрыты ниже.
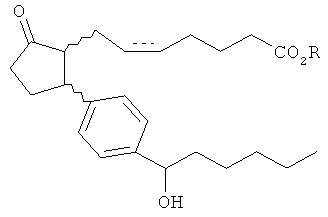
Описание изобретения В данном документе раскрыто соединение, содержащее
 '
'
или его фармацевтически приемлемую соль или пролекарственную форму, где пунктирная линия показывает наличие или отсутствие связи.
Поскольку пунктирная линия показывает наличие или отсутствие связи, возможны соединения, показанные ниже, или их фармацевтически приемлемые соли или пролекарственные формы.
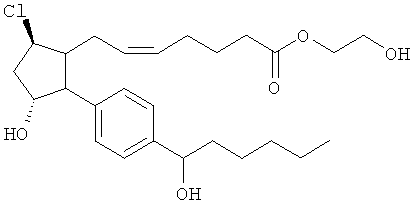
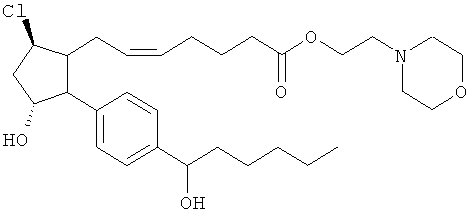
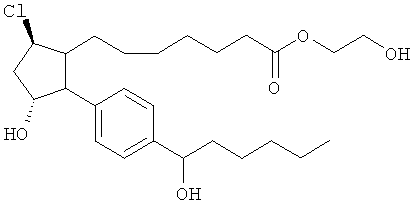
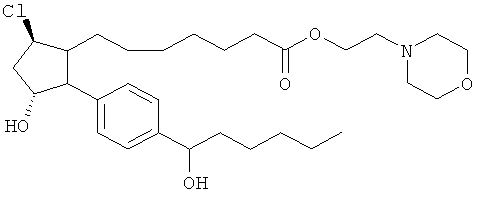
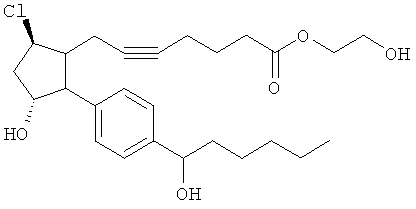
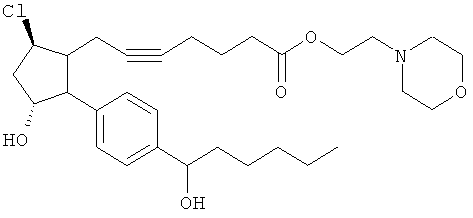
Не ограничивая объем изобретения каким-либо образом, в частности предусмотрены соединения, обладающие стереохимией, показанной на структурных формулах, приведенных ниже, а также их фармацевтически приемлемые соли и пролекарственные формы.
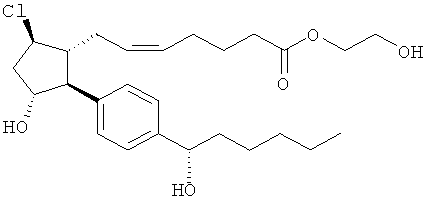
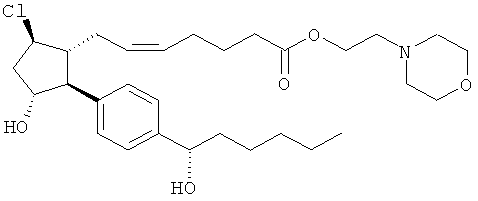
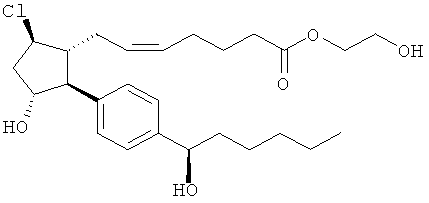
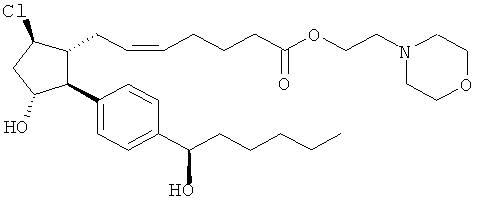
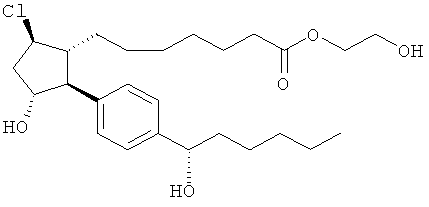
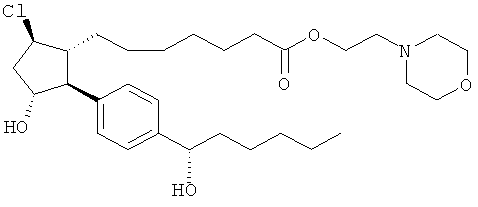
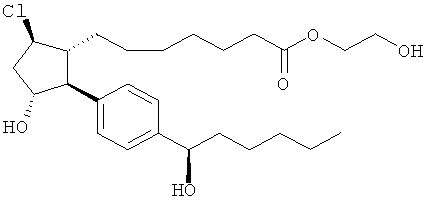
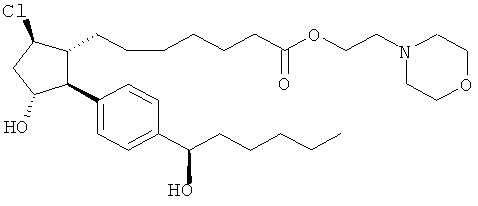
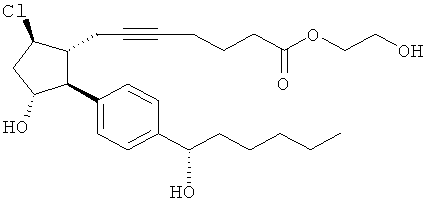
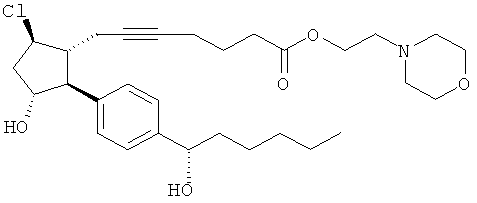
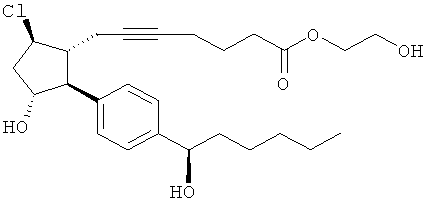
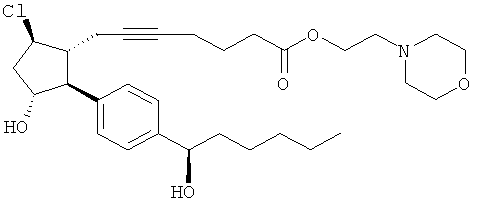
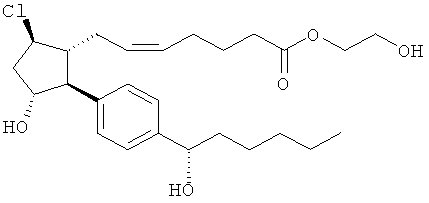
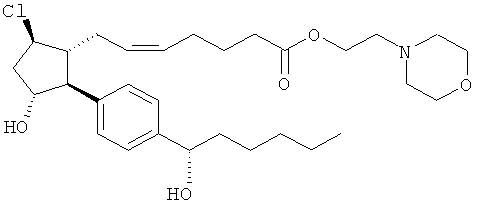
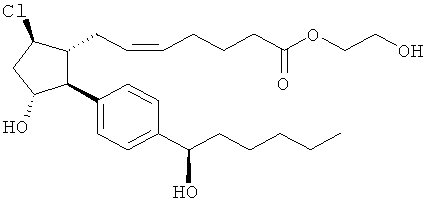
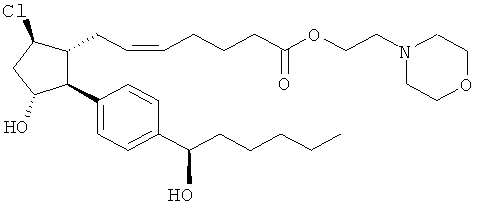
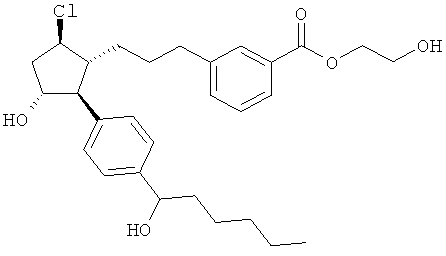
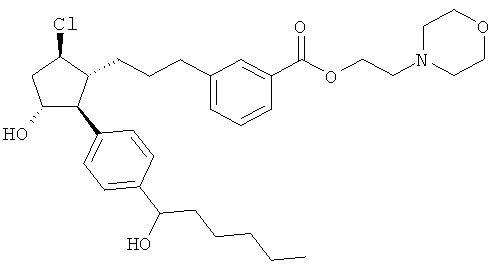
Соединения, раскрытые в данном документе, полезны для предотвращения и лечения глаукомы или глазной гипертензии у млекопитающих, или для производства лекарственных препаратов для лечения глаукомы или глазной гипертензии. Кроме того, соединения, описанные в данном документе, могут быть полезны при лечении облысения. Также они полезны для лечения заболеваний, раскрытых в области техники, как поддающихся лечению агонистом простагландина ЕР2, таких как изложенные ранее.
«Фармацевтически приемлемая соль» представляет собой любую соль, сохраняющую активность исходного соединения и не оказывающую никаких дополнительных вредных или неблагоприятных воздействий на субъекта, которому ее вводят, и в среде, в которой ее вводят, по сравнению с исходным соединением. Фармацевтически приемлемая соль также относится к любой соли, которая может образовываться in vivo в результате введения кислоты, другой соли или пролекарственной формы, которая превращается в кислоту или соль.
Фармацевтически приемлемые соли кислых функциональных групп могут быть получены из органических и неорганических оснований. Соль может содержать моно или поливалентный ион. Особый интерес представляют неорганические ионы лития, натрия, калия, кальция и магния. Органические соли могут быть получены при помощи аминов, особенно солей аммония, таких как моно-, ди- и триалкиламины или этаноламины. Также соли могут быть получены при помощи кофеина, трометамина и подобных молекул. Соляная кислота или какая-либо другая фармацевтически приемлемая кислота могут образовывать соли с соединением, которое включает основную группу, такую как аминная группа или пиридиновое кольцо.
«Пролекарственная форма» представляет собой соединение, которое превращается в терапевтически активное соединение после введения и этот термин следует интерпретировать в данном документе также широко, как обычно в данной области техники. Не с целью ограничения объема изобретения, превращение может происходить посредством гидролиза сложноэфирной группы или какой-либо другой биологически лабильной группы. В основном, но не необязательно, пролекарственная форма является неактивной или менее активной, чем терапевтически активное соединение, в которое она превращается. В частности предусмотрены эфирные пролекарственные формы соединений, раскрытых в данном документе. Эфир может быть получен из карбоновой кислоты C1 (т.е. концевой карбоновой кислоты естественного простагландина) или эфир может быть получен из функциональной группы карбоновой кислоты на другой стороне молекулы, такой как фенильное кольцо. Без ограничения, эфир может быть алкиловым эфиром, ариловым эфиром или гетероариловым эфиром. Термин алкил имеет значение, обычно понимаемое специалистами в данной области техники, и относится к линейным, разветвленным и циклическим молекулам. Особенно полезны C1-6алкиловые эфиры, где алкильная часть эфира содержит от 1 до 6 атомов углерода и включает, но не ограничивается, метил, этил, пропил, изопропил, н-бутил, втор-бутил, изо-бутил, трет-бутил, изомеры пентила, изомеры гексила, циклопропил, циклобутил, циклопентил, циклогексил и их комбинации, содержащие от 1 до 6 атомов углерода и т.д. C1-6 алкиловые эфиры обладают молекулой алкила, состоящей из от 1 до 6 атомов углерода непосредственно связанных с кислородом эфира.
Также предусмотрены следующие соединения, а также их любая фармацевтически приемлемая соль или любая пролекарственная форма, в частности предусмотренная в данном документе. Все соединения представляют собой смеси диастериомеров, кроме указных случаев:
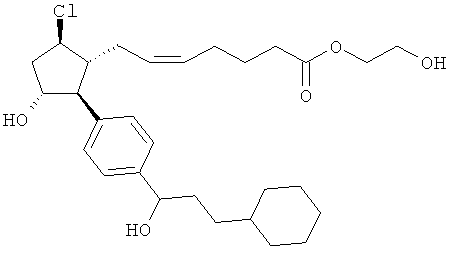
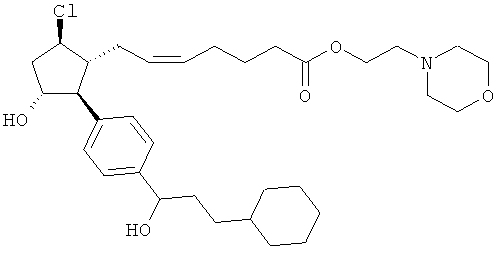
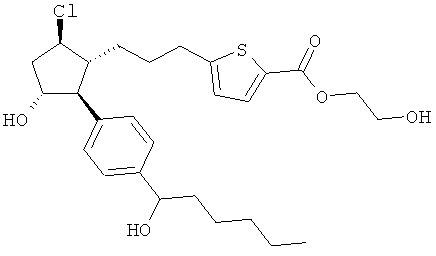
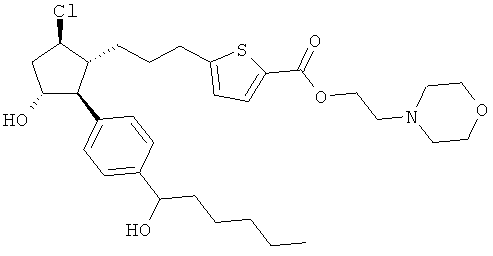
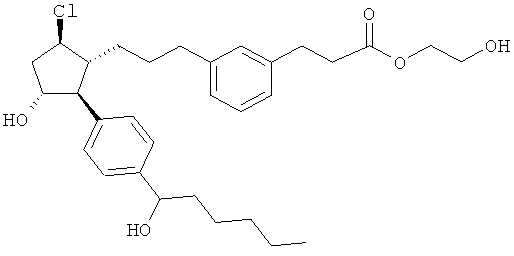
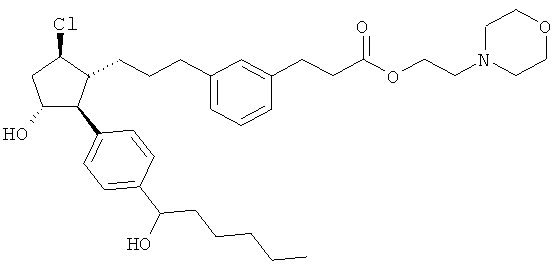
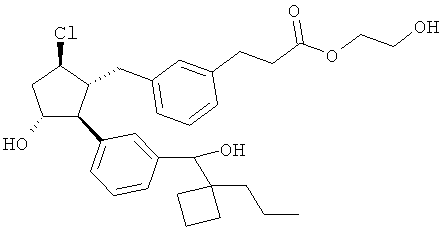
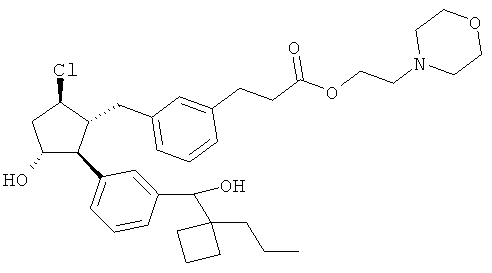
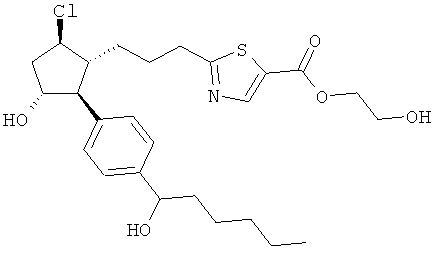
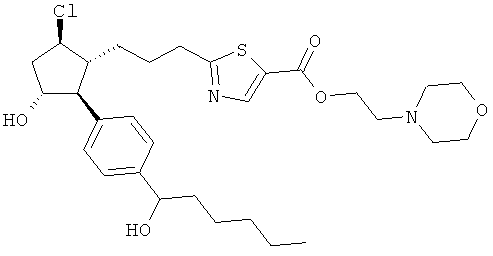
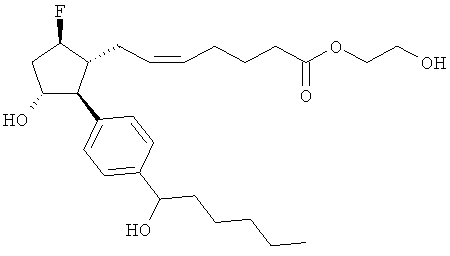
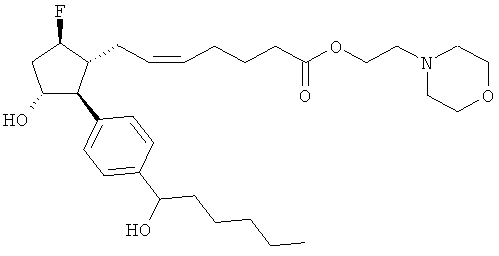
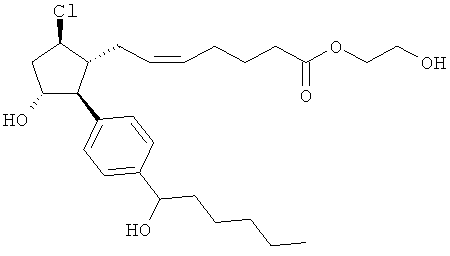
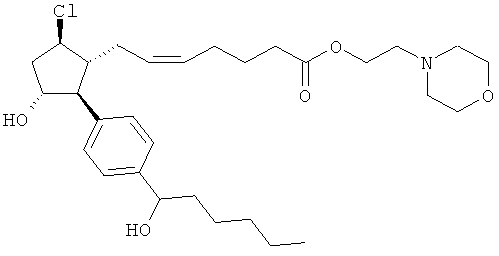
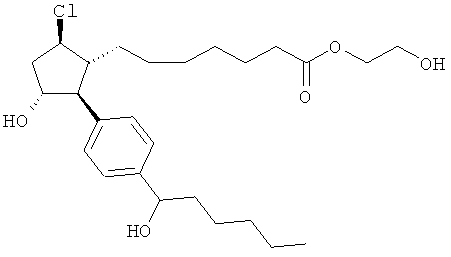
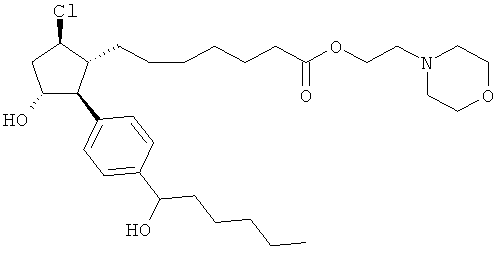
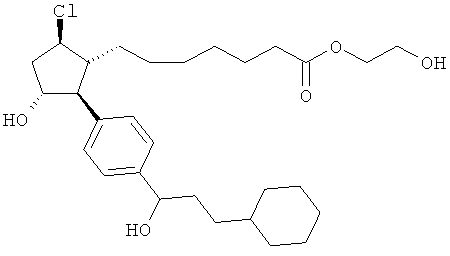
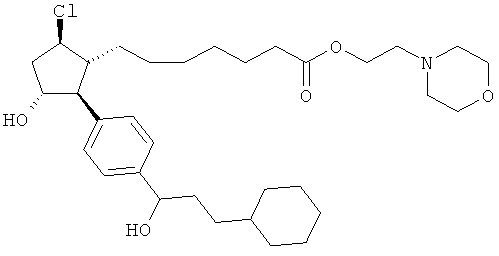
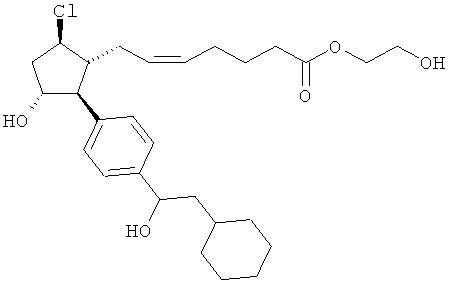
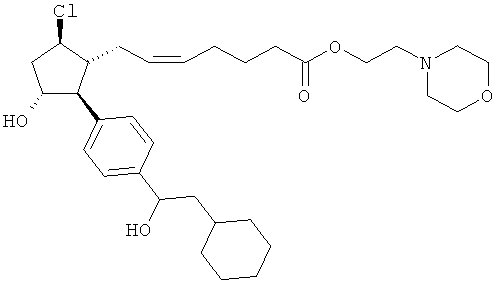
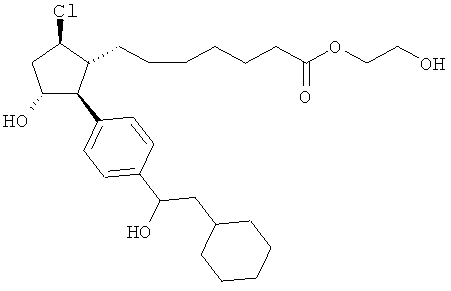
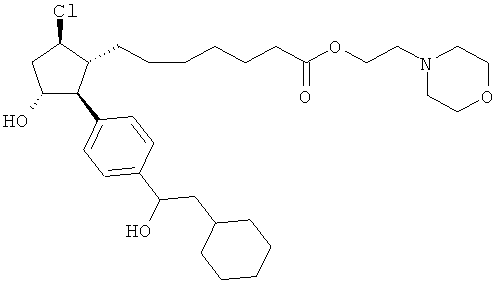
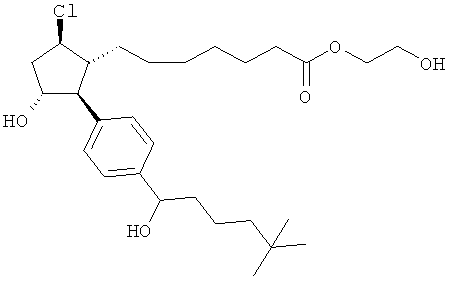
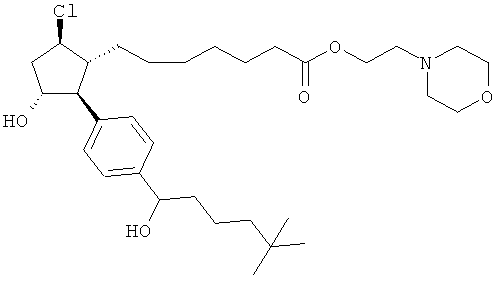
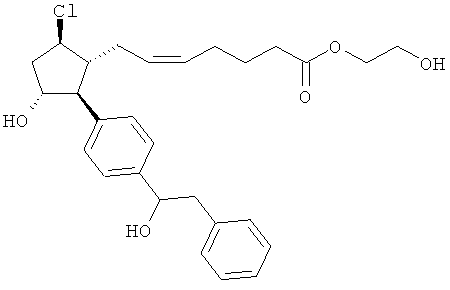
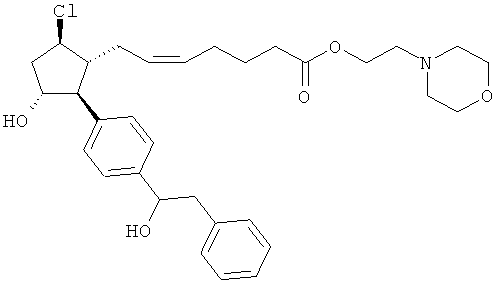
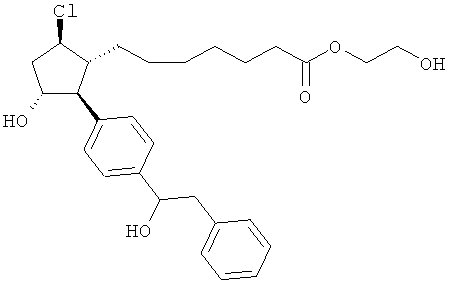
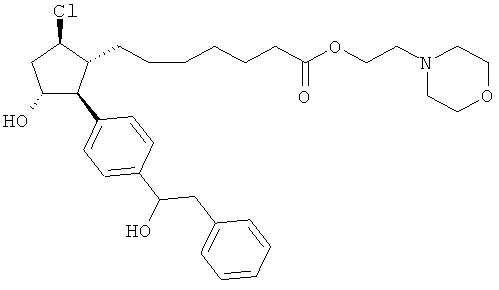
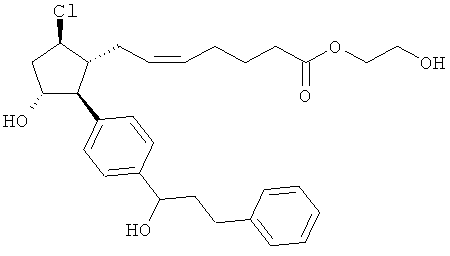
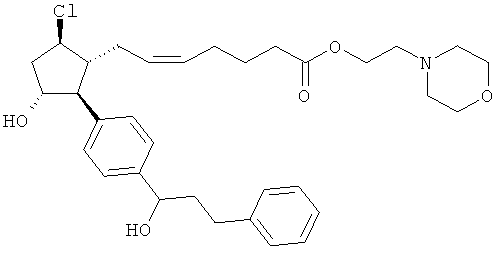
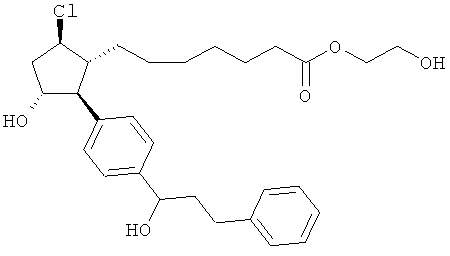
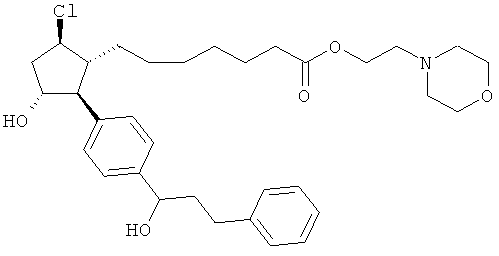
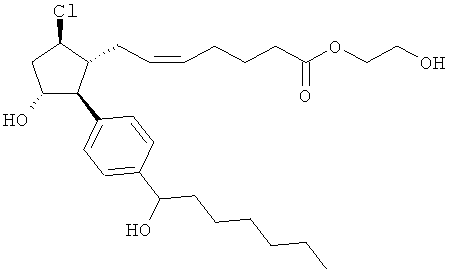
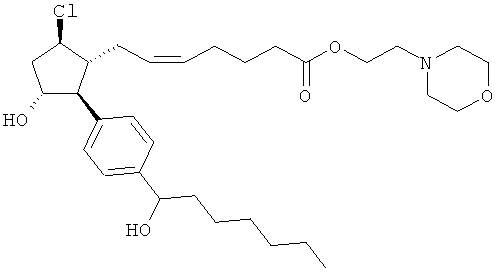
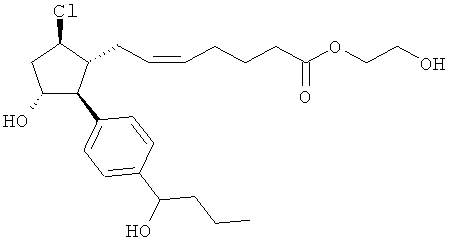
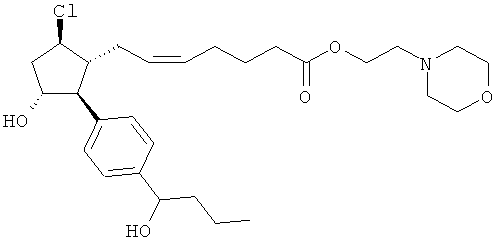
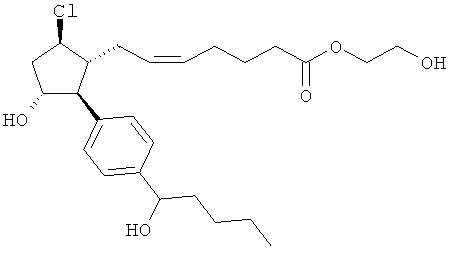
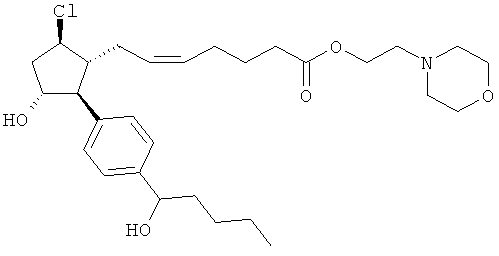
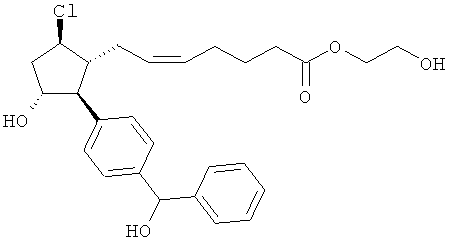
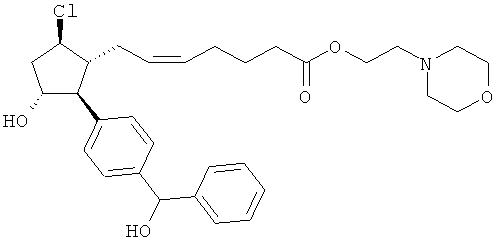
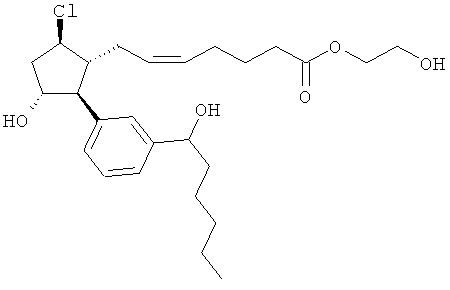
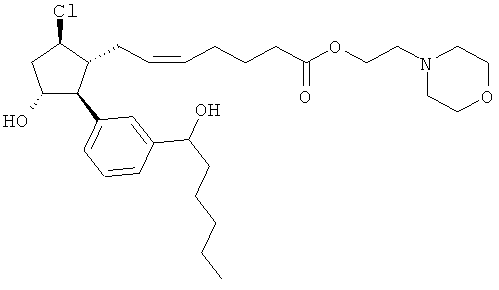
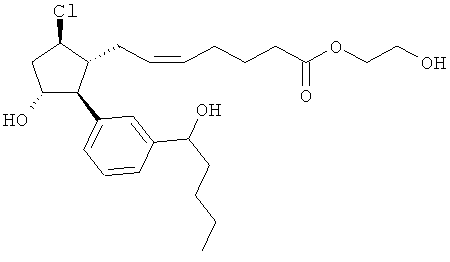
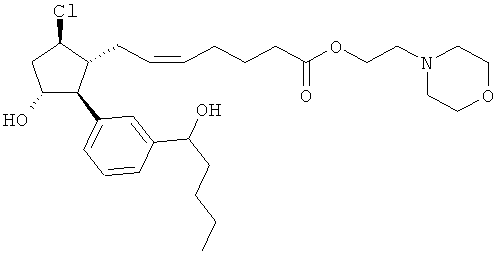
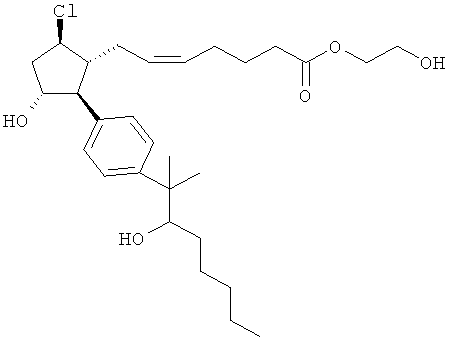
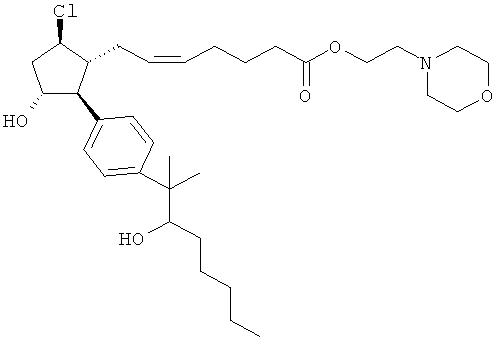
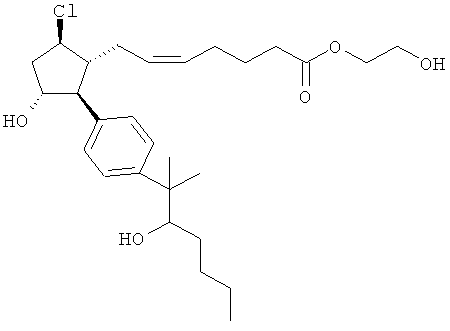
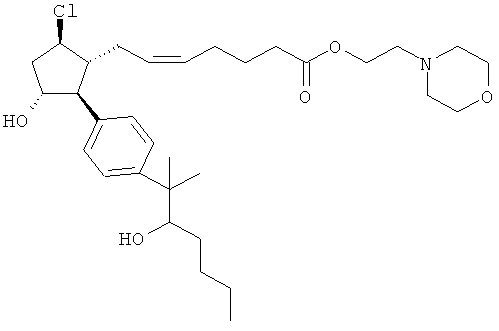
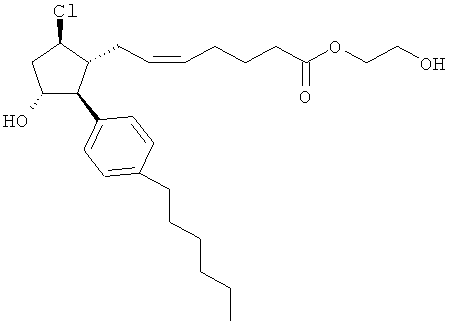
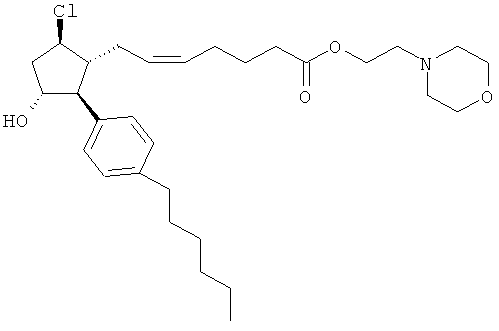
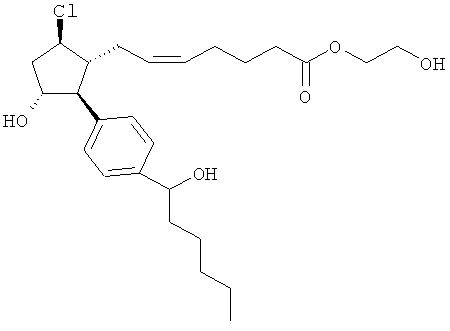
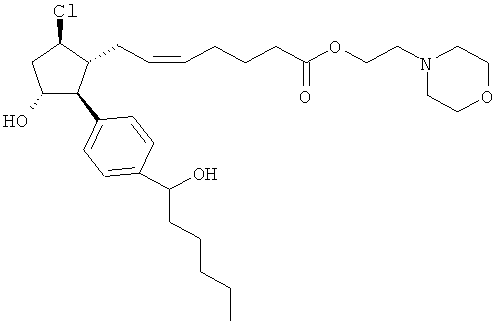
Одно воплощение представляет собой применение любого соединения, раскрытого в данном документе, включая таковые, раскрытые ранее, в производстве лекарственного препарата для лечения глаукомы или глазной гипертензии.
Другое воплощение представляет собой применение соединения, раскрытого в данном документе, включая таковые, раскрытые ранее, в производстве лекарственного препарата для лечения воспалительного заболевания кишечника.
Другое воплощение представляет собой способ, содержащий введение любого соединения, раскрытого в данном документе, включая таковые, раскрытые ранее, местно в глаз млекопитающего для лечения глаукомы или глазной гипертензии.
Другое воплощение представляет собой соединение, раскрытое в данном документе, включая таковые, раскрытые ранее, в производстве лекарственного препарата для лечения облысения.
Специалистам в данной области техники будет легко понять, что для введения или производства лекарственных препаратов, соединения, раскрытые в данном документе, могут быть смешаны с фармацевтически приемлемыми эксципиентами, которые сами по себе хорошо известны в данной области техники. В частности, для систематического введения лекарственного средства, оно может быть приготовлено в виде порошка, пилюли, таблетки или т.п., или в виде раствора, эмульсии, суспензии, аэрозоля, сиропа или эликсира, приемлемых для орального или парентерального введения или ингаляции.
Твердые лекарственные формы или лекарственные препараты, нетоксичные твердые носители включают, но не ограничены, фармацевтические категории маннита, лактозы, крахмала, стеарата магния, сахарина натрия, полиалкиленгликолей, талька, целлюлозы, глюкозы, сахарозы и карбоната магния. Твердые лекарственные формы могут быть непокрытыми или покрытыми посредством известных способов для замедления дезинтеграции и адсорбции в желудочно-кишечном тракте, и таким образом обеспечивают замедленное действие в течение длительного периода. Например, может быть использован материал, обеспечивающий временную задержку, такой как глицерилмоностеарат или глицерилдистеарат. Они также могут быть покрыты посредством способа, описанного в патентах США №4,256,108; 4,166,452 и 4,265,874 для формирования осмотических терапевтических таблеток для контролируемого высвобождения. Жидкие фармацевтически вводимые лекарственные формы могут, например, содержать раствор или суспензию одного или более полезных в настоящий момент соединений и дополнительные фармацевтические добавки в носителе таком как, например, воды, соляной раствор, водная декстроза, глицерол, этанол и т.п., таким образом, формируя раствор или суспензию. По желанию, вводимая фармацевтическая композиция может также содержать незначительные количества нетоксичных вспомогательных материалов, таких как увлажняющие или эмульгирующие вещества, pH буферные вещества и т.п. Типичными примерами таких вспомогательных веществ являются ацетат натрия, монолаурат сорбитана, триэтаноламин, ацетат натрия, триэтаноламинолеат и т.д. Действительные способы приготовления таких лекарственных форм известны или будут очевидны специалистам в данной области техники, например, см. Remington's Pharmaceutical Sciences, Mack Publishing Company, Easton, Pa., 16th Edition, 1980. Композиция вводимого препарата в любом случае содержит долю одного или более полезных в настоящий момент соединений в количестве эффективном для обеспечения желаемого терапевтического эффекта.
Парентеральное введение обычно осуществляют посредством инъекции подкожной, внутримышечной, либо внутривенной. Инъецируемый препарат может быть приготовлен в общепринятых формах либо в виде жидких растворов, либо суспензий, твердых форм приемлемых для растворения или суспендирования в жидкости перед инъекцией, или в виде эмульсий. Приемлемыми эксципиентами являются, например, вода, соляной раствор, декстроза, глицерол, этанол и т.п. Кроме того, по желанию, инъецируемые фармацевтические композиции для введения могут также содержать незначительные количества нетоксичных вспомогательных веществ, таких как увлажняющие или эмульгирующие вещества, pH буферные вещества и т.п.
Количество вводимого полезного в настоящий момент соединения или соединений зависит от желаемого терапевтического эффекта или эффектов, от конкретного млекопитающего, подлежащего лечению, от серьезности и природы состояния млекопитающего, от способа введения, от активности и фармакодинамики конкретного применяемого соединения или соединений и от решения лечащего врача. Терапевтически эффективная доза полезного в настоящий момент соединения или соединений может быть в диапазоне от приблизительно 0,5 или приблизительно 1 до приблизительно 100 мг/кг/день.
Офтальмологически приемлемой является жидкость, приготовленная так, что ее можно вводить местно в глаз. Должно быть обеспечено максимальное удобство настолько, насколько это возможно, хотя иногда факторы препарата, которые необходимо учитывать (например, стабильность) препарата могут неизбежно снижать оптимальное удобство. В случае, когда удобство не может быть максимизировано, жидкость должна быть приготовлена так, чтобы жидкость являлась приемлемой для пациента в случае местного глазного применения. Дополнительно, офтальмологически приемлемая жидкость должна быть либо упакована для однократного применения или должна содержать консервант для предотвращения загрязнения при многократном использовании.
Растворы и лекарственные препараты для офтальмологического применения часто готовят при помощи физиологического соляного раствора в качестве растворителя. Глазные растворы предпочтительно должны поддерживаться на достаточном уровне pH при помощи соответствующей буферной системы. Препараты также могут содержать общепринятые фармацевтически приемлемые консерванты, стабилизаторы и поверхностно-активные вещества.
Консерванты, которые могут применяться в фармацевтических композициях по настоящему изобретению, включают, но не ограничены, бензалконий хлорид, хлоробутанол, тимеросал, фенилртути ацетат и фенилртути нитрат. Полезными поверхностно-активными веществами являются, например Твин 80. Также, различные полезные растворители могут быть применены в офтальмологических препаратах по настоящему изобретению. Эти растворители включают, без ограничения, поливиниловый спирт, повидон, гидроксипропилметилцеллюлозу, полоксамеры, карбоксиметилцеллюлозу, гидроксиэтилцеллюлозу и очищенную воду.
При необходимости и удобстве могут быть добавлены добавки, регулирующие тоничность. Они включают, но не ограничены, соли, в частности хлорид натрия, хлорид калия, маннит и глицерин или любые другие пригодные офтальмологически приемлемые добавки, регулирующие тоничность.
Могут быть применены различные буферы и средства для подведения pH для того, чтобы конечный препарат являлся офтальмологически приемлемым. Соответственно, буферы включают ацетатные буферы, цитратные буферы, фосфатные буферы и боратные буферы. При необходимости для подведения pH этих препаратов могут быть применены кислоты и основания.
Таким же образом, офтальмологически приемлемый антиксидант для применения в настоящем изобретении включает, но не ограничен, метабисульфит натрия, тиосульфат натрия, ацетилцистеин, бутилированный гидроксианизол и бутилированный гидрокситолуол,
Другими вспомогательными компонентами, которые могут быть включены в офтальмологические препараты, являются хелатирующие вещества. Полезным хелатирующим веществом является динатрия ЭДТА (динатриевая соль этилендиаминтетрауксусной кислоты), хотя другие хелатирующие вещества также могут быть применены вместо или совместно с ним.
Вещества обычно применяют в следующих количествах:
Для местного применения используют крема, мази, гели, растворы или суспензии и т.д., содержащие соединение, раскрытое в данном документе. Местные препараты обычно могут состоять из фармацевтического носителя, сорастворителя, эмульгирующего вещества, вещества, способствующего проникновению, смеси консервантов и смягчающего вещества.
Действительная доза активного соединения по настоящему изобретению зависит от конкретного соединения и от подлежащего лечению состояния, выбор соответствующей дозы хорошо известен специалистам в данной области техники.
Соединения, раскрытые в данном документе, также полезны в сочетании с другими лекарственными средствами, применяемыми при лечении глаукомы или других состояний.
Для лечения глаукомы предусмотрено сочетание лечения со следующими классами лекарственных средств:
β-блокаторы (или β-адренергические антагонисты), включающие картеолол, левобунолол, метипаранолол, полугидрат тимолола, малеат тимолола, β1-селективные антагонисты, такие как бетаксолол и т.п. или их фармацевтически приемлемые соли или пролекарственные формы;
Адренергические агонисты, включающие
неселективные адренергические агонисты, такие как борат эпинефрина, гидрохлорид эпинефрина и дипевефрин и т.п. или их фармацевтически приемлемые соли или пролекарственные формы;
α2-селективные адренергические агонисты, такие как апраклонидин, бримонидин и т.п. или их фармацевтически приемлемые соли или пролекарственные формы;
Ингибиторы карбоангидразы, включающие ацетозаламид, дихлорфенамид, метазоламид, бринзоламид, дорзоламид и т.п. или их фармацевтически приемлемые соли или пролекарственные формы;
Холинергические агонисты, включающие
холинергические агонисты прямого действия, такие как карбахол, гидролорид пилокарпина, нитрат пилокарпина, пилокарпин и т.п.или их фармацевтически приемлемые соли или пролекарственные формы;
ингибиторы холинэстеразы, такие как демекарий, эхотиофат, физостигмин и т.п. или их фармацевтически приемлемые соли или пролекарственные формы;
Антагонисты глутамата и другие нейропротективные вещества, такие как блокаторы Са2+ каналов, такие как мемантин, амантадин, римантадин, нитроглицерин, декстрофан, детрометорфан, CGS-19755, дигидропиридины, верапамил, эмопамил, бензотиазепины, бепридил, дифенилбутилпипередины, дифенилпиперазины, НОЕ 166 и связанные с ним лекарственные средства, флуспирилен, элипродил, ифенпродил, СР-101,606, тибалозин, 2309 ВТ и 840S, флунаризин, никардипин, нифедимпин, нимодипин, бамидипин, верапамил, лидофлазин, лактат прениламина, амилорид и т.п.или их фармацевтически приемлемые соли или пролекарственные формы;
Простамиды, такие как биматопрост, или их фармацевтически приемлемые соли или пролекарственные формы; и
Простагландины, включающие травопрост, UFO-21, хлопростенол, флупростенол, 13,14-дигидрохлопростенол, изопропилунопростон, латанопрост и т.п.
Каннабиноиды, включающие агонисты СВ1, такие как WIN-55212-2 и СР-55940 и т.п., или их фармацевтически приемлемые соли или пролекарственные формы.
Для лечения заболеваний глаз, включающих глаукому, эти соединения могут быть введены местно, периокулярно, интраокулярно или посредством любого другого эффективного способа, известного в области техники.
Также эти соединения могут быть применены для лечения и предотвращения состояний, воздействующих на заднюю часть глаза, включая макулопатию/дегенерацию сетчатки, такую как не экссудативная возрастная макулярная дегенерация (ВМД), экссудативная возрастная макулярная дегенерация (ВМД), хороидальная неоваскуляризация, диабетическая ретинопатия, острая макулярная нейроретинопатия, центральная серозная хориопатия, кистозный макулярный отек, диабетический макулярный отек; увеит/ретинит/хороидит, такой как острая мультифокальная плакоидная пигментная эпителиопатия, болезнь Бехчета, дробьевидная ретинохороидопатия, инфекции (сифилис, болезнь Лайма, туберкулез, токсоплазмоз), интермедиарный увеит (pars planitis), мультифокальный хороидит, синдром множественных исчезающих белых пятен, глазной саркоидоз, задний склерит, серпигинозный хориоидит, субретинальный фиброз и увеитный синдром, синдром Вогт-Каянаги и Харада; васкулярные заболевания/экссудативные заболевания, такие как окклюзия артерии сетчатки, окклюзия центральной вены сетчатки, диссеминированная внутрисосудистая коагулопатия, окклюзия ветвей вены сетчатки, гипертензивные изменения глазного дна, глазной ишемический синдром, микроаневризма артерии сетчатки, болезнь Коутса, парафовеолярная телеангиэктазия, частичная окклюзия вены сетчатки, папиллофлебит, окклюзия центральной артерии сетчатки, окклюзия ветвей артерии сетчатки, заболевание сонной артерии, ангиит по типу заиндевелых веток, серповидно-клеточная ретинопатия и другие гемоглобинопатии, ангиоидные полосы сетчатки, наследственная экссудативная витреоретинопатия и болезнь Илза; травматические/хирургические состояния, такие как симпатическая офтальмия, увеитные заболевания сетчатки, отслоение сетчатки, травма, состояния, вызванные лазером, состояния, вызванные фотодинамической терапией, фотокоагуляция, гипоперфузия во время операции, радиационная ретинопатия и ретинопатия при трансплантации костного мозга; пролиферативные расстройства, такие как пролиферативная витреальная ретинопатия и эпиретинальные мембраны и пролиферативная диабетическая ретинопатия; инфекционные расстройства, такие как гистоплазмоз глаз, токсокароз глаз, синдром предполагаемого гистоплазмоза глаз (СПГГ), эндофтальмит, токсоплазмоз, заболевания сетчатки, ассоциированные с ВИЧ-инфекцией, хориоидальное заболевание, ассоциированное с ВИЧ-инфекцией, увеитное заболевание, ассоциированное с ВИЧ-инфекцией, вирусный ретинит, острый некроз сетчатки, прогрессирующий наружный некроз сетчатки, грибковые заболевания сетчатки, сифилис глаза, туберкулез глаза, диффузный односторонний подострый нейроретинит и миаз; генетические нарушения, такие как пигментный ретинит, системные расстройства с ассоциированной ретинальной дистрофией, врожденная постоянная ночная слепота, дистрофия колбочек, болезнь Штаргардта и желтопятнистая абиотрофия сетчатки, болезнь Беста, частичная дистрофия пигментного эпителия сетчатки, Х-сцепленный ретиношизис, дистрофия глазного дна Сорсби, умеренная концентрическая макулопатия, кристаллиновая дистрофия Биетти и эластическая псевдоксантома; разрывы сетчатки/отверстия, такие как отслоение сетчатки, макулярное отверстие и большой разрыв сетчатки; опухоли, такие как заболевания сетчатки, ассоциированные с опухолями, врожденная гипертрофия пигментного эпителия сетчатки, задняя увеальная меланома, хориоидальная гемангинома, хориоидальная остеома, хориоидальный метастаз, комбинированная гамартома сетчатки и пигментного эпителия сетчатки, ретинобластома, вазопролиферативные опухоли глазного дна, астроцитома сетчатки и внутриглазные лимфомы; и другие различные заболевания, воздействующие на заднюю часть глаза, такие как точечная внутренняя хориопатия, острая задняя мультифокальная плакоидная пигментная эпителиопатия, миопическая дегенерация сетчатки и острый пигментный эпителиит сетчатки. Предпочтительно, заболевание или состояние является пигментной дистрофией сетчатки, пролиферативной витреальной ретинопатией (ПВР), возрастной дегенерацией желтого пятна (ВДЖП), диабетической ретинопатией, диабетической эдемой желтого пятна, отслоением сетчатки, разрывом сетчатки, увеитом или цитомегаловирусным ретинитом.
Применения для стимуляции роста волос
В одном воплощении соединения, раскрытые в данном документе, могут быть полезны при лечении облысения и/или потери волос. Алопеция (облысение) представляет собой либо нехватку нормальных волос или ненормальные волосы и в первую очередь являются для людей косметической проблемой. Она представляет собой недостаток терминальных волос широкого диаметра, окрашенных волос, который легко увидеть. Однако, хотя у так называемых лысых людей, существует заметное отсутствие терминальных волос, их кожа содержит пушковый волос, представляющий собой тонкий неокрашенный волос, для обнаружения которого может потребоваться микроскопическое исследование. Такой пушковый волос является предшественником терминального волоса.
Соединения, раскрытые в данном документе, могут быть полезны для стимуляции, такой как переход пушковых волос к росту в виде терминальных волос, а также для повышения скорости роста терминальных волос. Полезность соединений, раскрытых в данном документе, для стимуляции роста волос описана ниже.
В курсе лечения пациентов, страдающих глаукомой, лечение может быть предназначено только для одного глаза. В течение курса ежедневного применения было обнаружено, что у пациента, лечившегося при помощи биматопроста, аналога простагландина, на глазу, подвергнутому лечению, развились ресницы, которые были длиннее, толще и объемнее, чем на глазу, который не лечили. При исследовании была обнаружена значительная разница. Ресницы на обработанном глазу были длиннее и были объемнее имели более густой внешний вид. Внешний вид ресниц на веках обработанных глаз оказался достаточно привлекательным, если придать им двусторонний эффект. В результате их ассиметричной природы длинные ресницы с одной стороны могут быть расценены как неприятные с косметической точки зрения. Исходя из ассиметричного эффекта, было выполнено общее исследование. Вскоре обнаружилось, что этот измененный внешний вид был не единственным показателем. Сравнение век пациентов, которые применяли биматопрост только на одном глазу, выявило у некоторых пациентов небольшие изменения ресничных волос и волос, примыкающих к области обработанной биматопростом. Конкретные отличия в различной степени могут быть выявлены в ресницах и прилегающих волосах всех пациентов, кто принимал лекарственное средство на односторонней основе в течение более чем 6 месяцев.
После того как внимание было сосредоточено на данном вопросе, у некоторых пациентов при макроскопическом исследовании были выявлены изменения ресниц. У пациентов со светлыми волосами и ресницами, различия с легкостью наблюдались только при помощи сильного увеличения и световых мощностях щелевой лампы биомикроскопа. Во время дополнительного исследования глаукомы внимание обычно незамедлительно сосредотачивалось на самом глазу. В результате требуемой высокой мощности увеличения единовременно наблюдали только один глаз и глаз наблюдали при достаточно высокой мощности, при которой ресницы были не в фокусе. При таких высоких мощностях маловероятно обнаружить любую ассиметрию ресниц между двумя глазами, за исключением систематического сравнения ресниц и прилегающих волос на глазных веках обоих глаз.
Наблюдаемые параметры, приводящие к заключению, что более сильный рост волос происходил в обработанных областях в результате введения аналога простогландина, были комплексными. Они включали повышенную длину ресниц, повышенное число ресниц вдоль нормальной линии, повышенную толщину и блеск ресниц, повышенные вспомогательные терминальные волосы, подобные ресницам в переходных областях, прилегающих к областям с нормальным ростом ресниц, повышенные вспомогательные терминальные волосы, подобные ресницам, в средней и боковой кантальной области, повышенную пигментацию ресниц, повышенное число, повышенную длину, а также повышенный блеск и толщину тонких волос на коже примыкающего глазного века и, наконец, повышенную нормальную изогнутость ресниц и терминальных волос, подобных ресницам. Таким образом, заключение, что рост волос стимулируется аналогами простогландина, такими как биматопрост, подтверждается не данными о различии в одном параметре, но основано на многих параметрах внешнего вида волос в обработанных областях по сравнению с контрольными областями у многих субъектов.
Соединения, раскрытые в данном документе, представляют собой аналоги простагландина и таким образом обладают активностями, сходными с таковыми биматопроста, обладают структурными сходствами и таким образом, как ожидается, стимулируют рост волос и превращение пушковых волос в терминальные. В одном воплощении, соединения, раскрытые в данном документе, и их пролекарственные формы могут быть полезны при стимуляции роста волос. Как употреблено в данном документе, рост волос включает волосы, ассоциированные с кожей черепа, бровями, глазными веками, бородой и другими областями кожи животных.
В одном воплощении соединение смешивают с дерматологически совместимым наполнителем или носителем. Наполнитель, который можно применять для приготовления композиций, описанных в данном документе, может включать, например, водные растворы, такие как, например, физиологические солевые растворы, масляные растворы или мази. Кроме того, наполнитель может содержать дерматологически совместимые консерванты, такие как, например, бензалконий хлорид, поверхностно-активные вещества, такие как полисорбат 80, липосомы или полимеры, например, метилцеллюлозу, поливиниловый спирт, поливинилпирролидон и гиалуроновую кислоту; они могут быть применены для повышения вязкости. Более того, также возможно применение растворимых или нерастворимых лекарственных включений при введении лекарственного средства.
В одном воплощении дерматологические композиции могут быть приготовлены для местного лечения с целью стимуляции роста волос, которые включают эффективные количества, стимулирующие рост волос, одного или более соединений, согласно вышеприведенному определению, и дерматологически совместимый носитель. Эффективные количества активных соединений могут быть определены одним из средних специалистов в данной области техники, но будут сильно зависеть от применяемого соединения, частоты применения и желаемого результата. Обычно соединение варьирует от приблизительно 0,0000001 до приблизительно 50 масс.% дерматологической композиции. Предпочтительно, соединение варьирует от приблизительно 0,001 до приблизительно 50 масс.% от общей массы дерматологической композиции, более предпочтительно от приблизительно 0,1 до приблизительно 30 масс.% композиции.
В одном воплощении использование настоящих соединений для стимуляции роста волос находит применение у млекопитающих видов, включая как человека, так и животных. У человека соединения, описанные в данном документе, могут быть применены, например, на коже черепа, бороде, голове, лобковой области, верхней губе, бровях и глазных веках. У животных для улучшения их меха, например, норки, соединения, описанные в данном документе, могут быть применены по всей поверхности тела для улучшения всего меха по коммерческим причинам. Способ также может быть применен по косметическим причинам у животных, например, применен на коже собак и кошек, имеющих плеши из-за чесотки или других заболеваний, вызывающих различную степень алопеции.
Фармацевтические композиции, предназначенные для стимуляции роста волос, включают фармацевтические композиции приемлемые для местного и локального воздействия. Термин «местный», как употреблено в данном документе, относится к применению соединения, как описано в данном документе, включенному в приемлемый фармацевтический носитель и примененному на участке истонченных волос или участке без волос для усиления локального воздействия. Таким образом, подобные местные композиции включают те фармацевтические формы, в которых соединение применяют внешне посредством прямого контакта с кожей, подлежащей лечению. Обычные фармацевтические формы для этой цели включают мази, линименты, крема, шампуни, лосьоны, пасты, желе, спреи, аэрозоли и т.п., и могут быть применены в виде пластырей или повязок в зависимости от подлежащей лечению части тела. Термин «мазь» включает препараты (включая крема), содержащие маслянистую, водорастворимую и эмульсионную основы, например, вазелин, ланолин, полиэтиленгликоли, а также их смеси.
Обычно соединения могут быть применены неоднократно в течение длительного периода времени местно на части тела, подлежащей лечению, например, на глазных веках, бровях или коже черепа. Предпочтительная схема приема обычно включает регулярное, например, ежедневное, введение в течение периода лечения по меньшей мере одного месяца, более предпочтительно по меньшей мере трех месяцев и наиболее предпочтительно по меньшей мере шести месяцев.
Для местного применения на глазных веках или бровях, активные соединения могут быть приготовлены в водных растворах, кремах, мазях или маслах, проявляющих физиологически приемлемые осмолярные свойства, посредством добавления фармацевтически приемлемых буферов и солей. Такие препараты могут содержать или не содержать, в зависимости от устройства, консерванты, такие как хлорид бензалкония, хлоргексидин, хлорбутанол, паргидроксибензойные кислоты и соли фенилртути, такие как нитрат, хлорид, ацетат и борат или антиоксиданты, а также добавки подобные ЭДТА (этилендиаминтетрауксусная кислота), сорбитолу, борной килоте и т.п.в качестве добавок. Более того, в частности водные растворы могут содержать вещества, повышающие вязкость, такие как полисахариды, например, метилцеллюлозу, мукополисахариды, например, гиалуроновую кислоту и хондроитинсудьфат, или полиспирты, например, поливиниловый спирт. Могут быть применены различные гели замедленного высвобождения и матрицы, а также растворимые или нерастворимые глазные включения, например, основанные на веществах, формирующих in situ гели. В зависимости от конкретной применяемой формы и соединения могут быть применены различные количества лекарственного средства и различные схемы приема. Как правило, ежедневное количество соединения для лечения глазного века может составлять от приблизительно 0,1 нг до приблизительно 100 мг на глазное веко.
Для местного применения на коже и коже черепа соединения могут быть успешно приготовлены при помощи мазей, кремов, линиментов или пластырей в качестве носителя активного вещества. Также эти препараты могут содержать или не содержать консерванты в зависимости от устройства и характера применения. Подобные консерванты включают таковые, упомянутые выше, и метил-, пропил- или бутил-парагидроксибензойную кислоту, бетаин, хлоргексидин, хлорид бензалкония и т.п.Также могут быть применены различные матрицы для доставки с замедленным высвобождением. Как правило, доза, применяемая на кожу черепа, находится в пределах от приблизительно 0,1 нг до приблизительно 100 мг в день, более предпочтительно от приблизительно 1 нг до приблизительно 10 мг в день и наиболее предпочтительно от приблизительно 10 нг до приблизительно 1 мг в день в зависимости от соединения и препарата. Для достижения ежедневного количества лекарственного вещества в зависимости от препарата соединение может быть введено однократно или несколько раз в день с или без антиоксидантов.
Данные соединения также могут быть полезны при лечении астмы.
Примеры
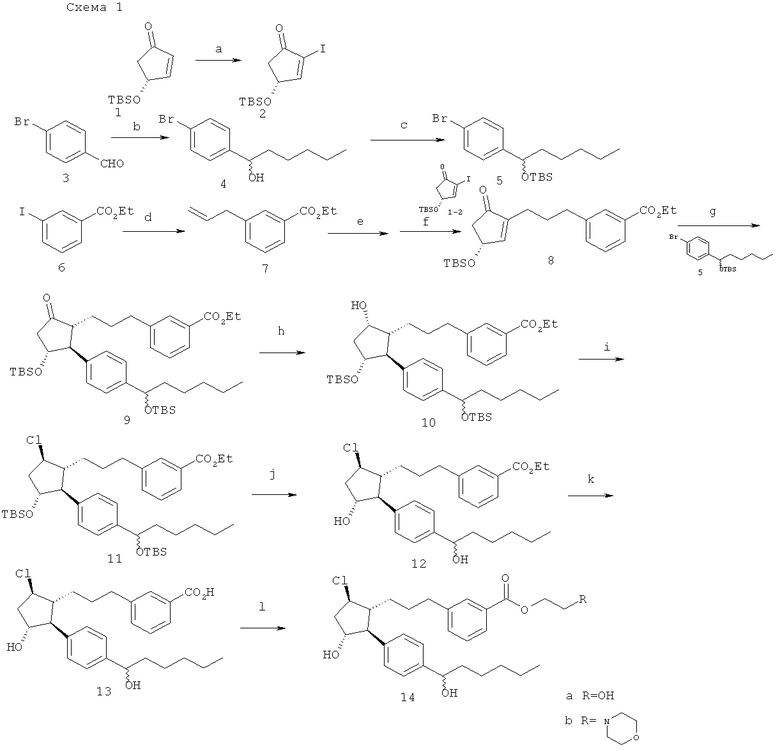
(a) I2, пиридин, CH2Cl2; (b) н-пентил MgBr; (с) TBSOTf, 2,6-лютидин, CH2Cl2; (d) изо-PrMgCl; катализатор CuCN, аллилбромид; (е) 9-BBN; (f) PdCl2 (dppf), K3PO4, ДМФА; (g) трет-BuLi; 2-тиенил CuCNLi; (h) L-селектрид; (i) MsCl, TEA; TBAC 40°C (j) HF-пиридин 0°C; (k) 1M LiOH, ТГФ; (I) 1. ClCO2Et, EtsN, CH2Cl2, 2. RCH2CH2OH.
(R)-4-(трет-бутил-диметил-силанилкси-)-2-иодо-циклопент-2-енон (2). Осуществляли способ сходный с описанным в A.G. Myers и P.S. Dragovich J. Am. Chem. Soc. 1993, 115,7021. Раствор енона 1 с температурой 0°С (3,163 г, 14,9 ммоль, Evotec OAI, 151 Milton Park, Abington, Oxon, OX 14 4SD, UK) и пиридин (5 мл) в дихлорметане (5 мл) обрабатывали при помощи раствора h (6,511 г, 25,7 ммоль) в пиридине (12 мл)/дихлорметане (12 мл). Реакционной смеси давали нагреться до комнатной температуры и через 2 ч добавляли 1М HCl (60 мл). Полученную смесь наливали в 100 мл HCl и затем экстрагировали при помощи дихлорметана (3×60 мл). Смешанный раствор дихлорметана промывали при помощи насыщенного раствора NaHSO3 и при помощи соляного раствора и затем сушили (Na2SO4), фильтровали и выпаривали. Очистка посредством флэш-хроматографии на силикагеле (5% этилацетат/гексаны) давала соединение 2 (4,600 г, 91%).
1-(4-бромо-Фенил)-гексан-1-ол (4). н-пентил MgBr (29 мл, 58 ммоль, 2 М/эфир) добавляли к 0°С раствору 4-бромобензальдегида (9,953 г, 54 ммоль) в ТГФ (100 мл). Через 1 ч реакцию останавливали посредством добавления 200 мл насыщенного раствора хлорида аммония. Полученную смесь экстрагировали при помощи этилацетата (3×100 мл), и смешанный раствор этилацетата сушили (Na2SO4), фильтровали и выпаривали. Очистка осадка посредством флэш-хроматографии на силикагеле давала соединение 4 (10,501 г, 76%).
[1-(4-бромо-фенил)-гексилокси1-трет-бутил-диметил-силан (5). TBSOTf (2,9 мл, 12,6 ммоль) добавляли к охлажденному на льду раствору 4 (3,017 г, 11,7 ммоль) и 2,6-лютидину (1,6 мл, 13,7 ммоль) в дихлорметане (30 мл). Реакционную смесь перемешивали в течение 2 ч при комнатной температуре и затем добавляли 100 мл насыщенного раствора бикарбоната натрия. Полученную смесь экстрагировали при помощи дихлорметана (30 мл) и слой дихлорметана промывали при помощи 1М HCl (2×50 мл) и соляного раствора (50 мл). Затем раствор дихлорметана сушили (MgSO4), фильтровали и выпаривали. Очистка осадка посредством флэш-хроматографии на силикагеле (гексаны) давала соединение 5 (3,843 г, 88%).
Этиловый эфир 3-аллил-бензойной кислоты (7). Раствор этил-3-иодобензоата (2,434 г, 8,8 ммоль) с температурой -45°С в 40 мл ТГФ обрабатывали при помощи изо-PrMgCl (4,8 мл, 9,6 ммоль, 2М/эфир). Через 1 ч добавляли аллилбромид (1,6 мл, 18,9 ммоль), а затем CuCN (79 мг, 0,88 ммоль). Реакцию перемешивали в течение 1 ч и затем останавливали посредством добавления 50 мл насыщенного раствора NH4Cl. Добавляли воду (30 мл) и полученную смесь экстрагировали при помощи этилацетата (3×50 мл). Смешанный раствор этилацетата высушивали (MgSO4), фильтровали и выпаривали. Очистка посредством флэш-хроматографии на силикагеле (5% этилацетат/гексаны → 10%) давала соединение 7 (1,145 г, 68%).
Этиловый эфир 3-{3-[(R)-3-(трет-бутил-диметил-силанилокси)-5-оксо-циклопент-1-енил]-пропил}-бензойной кислоты (8). Раствор соединения 7 (303 мг, 1,6 ммоль) в 0,5 мл ТГФ добавляли к раствору димера 9-BBN (393 мг, 1,6 ммоль) в 6 мл ТГФ. После 4 ч добавляли 0,1 мл воды. Раствор перемешивали в течение 20 мин и затем с помощью канюли переносили к смеси PdCl2 (dppf) (78 мг, 0,11 ммоль) и соединения 2 (387 мг, 2,0 ммоль) в ДМФА (3,2 мл). Добавляли K3PO4 (0,7 мл, 2,1 ммоль, 3М), и темный раствор перемешивали в течение 1,25 ч. Затем раствор вливали в 50 мл соляного раствора и полученную смесь экстрагировали при помощи этилацетата (2×30 мл). Смешанный раствор этилацетата высушивали (MgSO4), фильтровали и выпаривали. Очистка посредством флэш-хроматографии на силикагеле давала 292 мг (46%) енона 8.
1-8→→3-(3-{(1R,2S,3R,5R)-5-хлоро-3-гидрокси-2-[4-(1-гидроси-гексил)-фенил]-циклопентил}-пропил)-ензойная кислота (13). Последовательность действий, приводящая к соединению 13 была выполнена как показано на схеме 1 и как описано в патентной заявке США №11/009,298, зарегистрированной 10 декабря 2004 года (в настоящий момент, патент США №7,091,231, опубликованный 15 августа 2006 года), прямо включенной в данный документ посредством ссылки, фиг.5, 6.
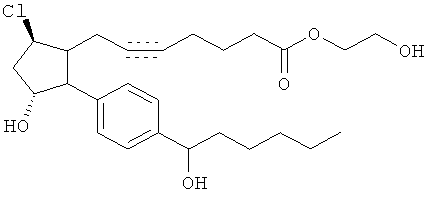
Соединение 14а. Триэтиламин и этилхлороформат добавляли последовательно к раствору соединения 13 в CH2Cl2 при комнатной температуре. Через 2,5 ч добавляли триэтиламин и этиленгликоль. После ночного перемешивания при комнатной температуре реакционную смесь разделяли между H2O и CH2Cl2. Фазы разделяли и водную фазу экстрагировали при помощи CH2Cl2 (2х). Смешанную органическую фазу промывали при помощи 1N HCl, затем сушили (MgSO4), фильтровали и концентрировали под вакуумом. Очистка осадка посредством флэш-хроматографии на колонках на силикогеле (10% CH3OH/CH2Cl2) давала соединение 14а.
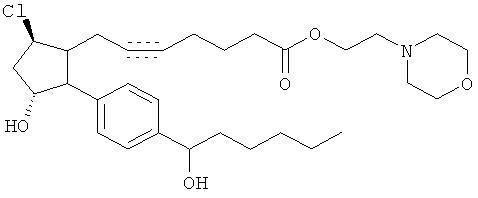
Соединение 14b. Триэтиламин и этилхлороформат добавляли последовательно к раствору соединения 13 в CH2Cl2 при комнатной температуре. Через 2,5 ч добавляли триэтиламин и 4-(2-гидроксиэтил)-морфин. После ночного перемешивания при комнатной температуре реакционную смесь разделяли между H2O и CH2Cl2. Фазы разделяли и водную фазу экстрагировали при помощи CH2Cl2 (2х). Смешанную органическую фазу промывали при помощи 1N HCl, затем сушили (Мд804), фильтровали и концентрировали под вакуумом. Очистка осадка посредством флэш-хроматографии на колонках на силикогеле (10% СН3ОН/CH2Cl2) давала соединение 14b.
Метиловый эфир 5-(3-{(1R,2S,3R,5R)-5-хлоро-3-гидрокси-2-[4-(1-гидрокси-гексил)-фенил]-циклопентил}-пропил)-тиофен-2-карбоновой кислоты. Указанное в заголовке соединение готовили при помощи способа аналогичного способу, описанному для 1-12, начиная с метилового эфира 5-бромо-тиофен-2-карбоновой кислоты, который готовили из 5-бромо-тиофен-2-карбоновой кислоты как указано далее: ацетилхлорид (6,87 мл, 96,6 ммоль) добавляли к раствору 5-бромо-тиофен-2-карбоновой кислоты (4,0 г, 19,3 ммоль) в метаноле (30 мл). Реакцию перемешивали в течение ночи и затем нагревали до отекания в течение 1,5 ч. Реакцию охлаждали до комнатной температуры и затем выпаривали. Осадок обрабатывали 120 мл насыщенного раствора бикарбоната натрия и полученную смесь экстрагировали при помощи дихлорметана (3×100 мл). Смешанный раствор дихлорметана сушили (Na2SO4), фильтровали и выпаривали для получения 3,57 г (84%) метилового эфира 5-бромо-тиофен-2-карбоновой кислоты.
5-(3-{(1R,2S,3R,5R)-5хлоро-3-гидрокси-2-[4-(1-гидрокси-гексил)-фенил1-циклопентил}-пропил)-тиофен-2-карбоновая кислота. Указанное в заголовке соединение готовили посредством гидролиза метилового эфира при помощи эстеразы кроличьей печени посредством способа, описанного заявке на патент США №11/009,298, зарегистрированной 10 декабря 2004 года (в настоящий момент, патент США №7,091,231, опубликованный 15 августа 2006 года).
Изопропиловый эфир 5-(3-f(1R,2S,3R,5R)-5-хлор-3-гидрокси-2-[4-(1-гидрокси-гексил)-фенил]-циклопентил}-пропил)-тиофен-2-карбоновой кислоты. Указанное в заголовке соединение готовили из соответствующей кислоты при помощи стандартного способа, описанного в заявке на патент США №11/009,298, зарегистрированной 10 декабря 2004 года (в настоящий момент, патент США №7,091,231, опубликованный 15 августа 2006 года).
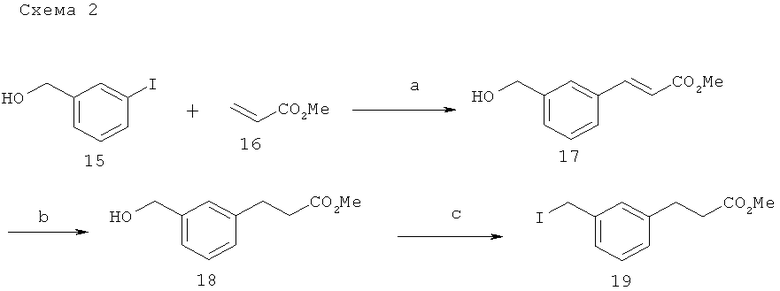
(a) Pd(OAc)2, EtNCHaCN 100°C; (b)H2, (Ph3P)3RhCl, EtOH; (с)Ph3P, I2, имидазол, CICH2CH2Cl.
Метиловый эфир (Е)-3-(3-гидроксиметил-фенил)-акриловой кислоты (17). Следовали способу, описанному в Reich, S.H. et.al. J. Med. Chem. 2000, 43, 1670. Pd(OAc)2 (8,2 мг, 0,037 ммоль) и триэтиламин (0,360 мл, 2,58 ммоль) добавляли к раствору 3-иодобензилового спирта 15 (0,27 мл, 2,13 ммоль) и метилакрилата 16 (0,220 мл, 2,44 ммоль) в CH3CN (4,5 мл). Реакционный сосуд запечатывали при помощи тефлоновой резьбовой крышки и нагревали при 100°С в течение 5 ч. На данном этапе реакционную смесь охлаждали до комнатной температуры и тубу заполняли более чем 0,22 мл метилакрилата, 11,7 г Pd(OAc)2 и 0,360 мл триэтиламина. Реакцию нагревали в течение ночи при 100°С и затем добавляли 10 мл насыщенного раствора хлорида аммония. Полученную смесь экстрагировали при помощи дихлорметана (3×40 мл) и смешанный раствор дихлорметана сушили (Na2SO4), фильтровали и выпаривали. Очистка посредством флэш-хроматографии на силикогеле (30% этилацетата/гексаны) давала 395 мг (97%) соединения 17.
Метиловый эфир 3-(3-гидроксиметил-фенил)-пропионовой кислоты (18). (Ph2P)3RhCl (11,5 мг, 0,012 ммоль) добавляли к раствору соединения 17 (25 мг, 0,13 ммоль) в 0,400 мл этанола. Реакцию перемешивали под действием 1 атм баллона с N2 в течение 20 ч и затем фильтровали через Целит. Выпаривание до сухости и очистка посредством флэш-хроматографии на силикогеле (30% этилацетата/гексаны) давали соединение 18 (21 мг, 82%).
Метиловый эфир 3-(3-иодометил-фенил)-пропионовой кислоты (19). Смесь Ph3P (36 мг, 0,14 ммоль), I2 (41 мг, 016 ммоль) и имидазола (10,5 мг, 0,15 ммоль) в 0,40 мл 1,2-дихлорэтана перемешивали в течение 15 мин. и затем раствор соединения 18 (20,5 мг, 0,11 ммоль) в 0,1 мл 1,2-дихлорэтана добавляли посредством канюли. Полученную смесь перемешивали в течение 1 ч и затем фильтровали посредством щелочного оксида алюминия, промывая этилацетатом. Фильтрат выпаривали и осадок очищали посредством флэш-хроматографии на силикагеледо получения соединения 19 (26 мг, 81%).
Метиловый эфир 3-[3-((1R,2S,3R)-3-(трет-бутил-диметил-силанилокси)-2-{4-[1-(трет-бутил-диметил-силанилокси)-гексил]-фенил}-5-оксо-цикпопентилметил)-фенил]-пропионовой кислоты (20). Раствор арилбромида 5 с температурой -78°С (759 мг, 2,0 ммоль) в ТГФ (3 мл) обрабатывали трет-бутиллитием (2,6 мл, 4,4 ммоль, 1,7М/пентан). Через 30 мин добавляли Me2Zn (1,1 мл, 2,2 ммоль, 2М/толуол) и полученный раствор перемешивали в течение 15 мин при 0°С и затем повторно охлаждали до -78°С. Раствор енона 1 (319 мг, 1,5 ммоль, Evotec OAI, 151 Milton Park, Abington, Oxon, OX 14 4SD, UK) в 1,7 мл ТГФ добавляли посредством шприцевого насоса в течение 1 ч. Полученную смесь перемешивали при -78°С в течение 2 ч и затем добавляли ГМФА (2,2 мл, 12,6 ммоль) с последующим добавлением раствора 19 (2,641 г, 8,7 ммоль) в ТГФ (1,6 мл). Реакцию перемешивали в течение ночи при -40°С и затем останавливали посредством добавления 40 мл насыщенного раствора хлорида аммония. Добавляли немного воды для растворения твердых веществ и полученную смесь экстрагировали при помощи этилацетата (3х30 мл). Смешанный раствор этилацетата сушили (MgSO4), фильтровали и выпаривали. Очистка посредством флэш-хроматографии на силикагеле (10% этилацетата/гексаны) давала указанный в заголовке кетон, контаминированный приблизительно 35% бензилиодида 19 (438 мг).
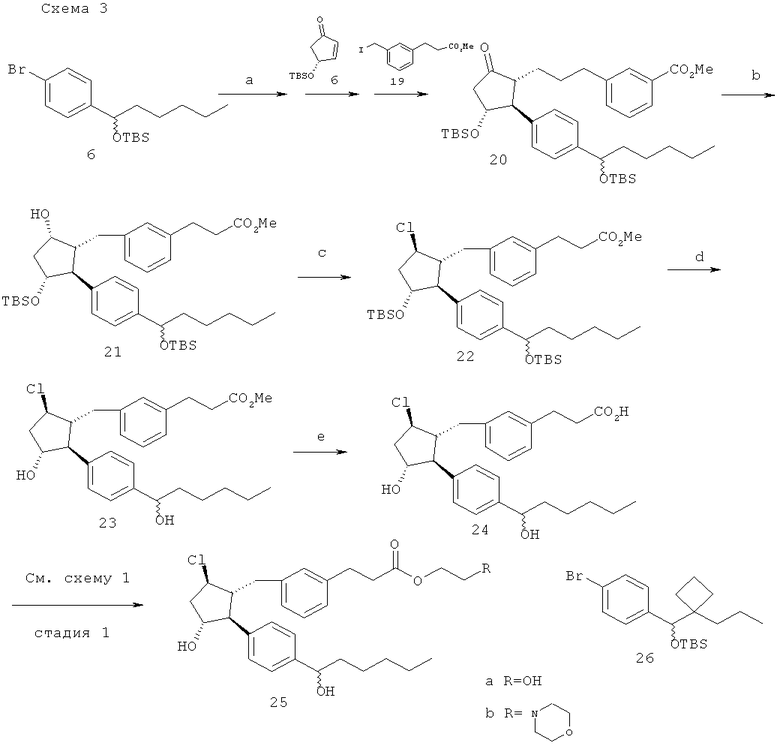
(а) трет-BuLi; Me2Zn; (b) L-селектрид; (c)MsCl, TEA, TBAC 40°C; (d) HF-пиридин; (е) водный LiOH.
Метиловый эфир 3-[3-((1R,2S,3R,5S)-3-(трет-бутил-диметил-силанилокси)-2-{4-[1-(трет-бутил-диметил-силанилокси)-гексил]-фенил}-5-гидрокси-циклопентилметил)-фенил]-пропионовой кислоты (21). Применяли стандартный способ с использование L-селектрида, описанный в заявке на патент США №11/009,298, зарегистрированной 10 декабря 2004 года (в настоящий момент, патент США №7,091,231, опубликованный 15 августа 2006 года), который давал 224 мг (22% енона 1-1) чистого соединения 21.
3-2→→3-(3-{(1R,2S,3R,5R)-5-хлоро-3-гидрокси-2-[4-(1-гидрокси-гексил)-фенил]-циклопентилметил}-фенил)-пропиновая кислота (24).
Последовательность действий выполняли как показано на схеме 3 при помощи стандартных способов, описанных в заявке на патент США №11/009,298, зарегистрированной 10 декабря 2004 года (в настоящий момент, патент США №7,091,231, опубликованный 15 августа 2006 года), сриг.6.
Метиловый эфир 3-[3-((1R,2S,3R,5R)-5-хлоро-3-гидрокси-2-{-3-[гидрокси-(1-пропил-циклобутил)-метил]-фенил}-циклопентилметил)-фенил]-пропионовой кислоты и 3-[3-((1R,2S,3R,5R)-5-хлоро-3-гидрокси-2-[3-Ггидрокси-(1-пропил-циклобутил)-метил]-фенил}-циклопентилметил)-фенил]-пропионовая кислота. Указанные в заголовке соединения получали сходно с 23/24, начиная с арилбромида 3-6 (приготовленного как описано в заявке на патент США №11/009,298, зарегистрированной 10 декабря 2004 года (в настоящий момент, патент США №7,091,231, опубликованный 15 августа 2006 года), фиг.1,4).
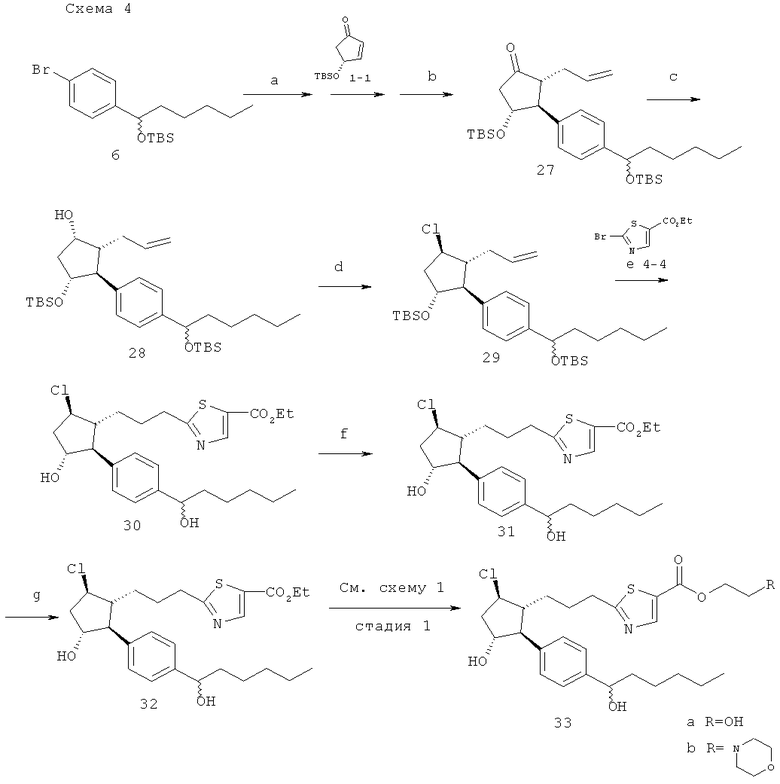
(а) трет-BuLi; Me2Zn; (b) аллилбромид, ГМФТА; (с) L-селектрид; (d) MsCl, TEA; TBAC 40°C; (e) 9-BBN; PdCl2 (dppf), K3PO4, ДМФА 50°C; (f) HF-пиридин 0°C; (g) водный LiOH, ТГФ.
(2R,3S,4R)-2-аллил-4-(трет-бутил-диметил-силанилокси)-3-{4-[1-(трет-бутил-диметил-силанилокси)-гексил]-фенил}-циклопентанон (27). Соединение 27 готовили при помощи способа аналогичного таковому, описанному для 20.
27→(1S,2R,3S,4R)-2-аллил-4-(трет-бутил-диметил-силанилокси)-3-{4-[1-(трет-бутил-диметил-силанилокси)-гексил]-фенил}-циклопентанол-(28)→1-[(1S,2R,3R,5R)-2-аллил-5-(трет-бутил-диметил-силанилокси)-3-хлоро-циклопентил]-4-[1-(трет-бутил-диметил-силанилокси)-гексил]-бензол (29). Последовательность действий была выполнена как описано в заявке на патент США №11/009,298, зарегистрированной 10 декабря 2004 года (в настоящий момент, патент США №7,091,231, опубликованный 15 августа 2006 года), сриг.6.
Этиловый эфир 2-[3-((1R,2S,3R,5R)-3-(трет-бутил-димети-силанилокси)-2-{4-[1-(трет-бутил-диметил-силанилокси)-гексил]-фенил}-5-хлоро-циклопентил)-пропил]-тиазол-5-карбоновой кислоты (31). Раствор соединения 29 (39 мг, 0,069 ммоль) в 0,2 мл ТГФ переносили при помощи канюли в смесь димера 9-BBN (17 мг, 0,07 ммоль) в 0,2 мл ТГФ, промывали при помощи 0,2 мл ТГФ. Реакцию помещали в 50°С масляную баню на 2,5 ч, охлаждали до комнатной температуры и добавляли H2O (10 мкл). Через 30 мин раствор при помощи канюли переносили к раствору этил-2-бромотиазол-5-карбоксилата 4-4 (15 мг, 0,063 ммоль) и PdCb (dppf) (5 мг, 0,007 ммоль) в ДМФА (0,2 мл). Добавляли K3PO4 (31 мкл, 0,09 ммоль, 3М), и раствор помещали в 50°C масляную баню. Реакцию перемешивали в течение ночи и затем разделяли между 15 мл этилацетата/15 мл воды (добавляли немного соляного раствора). В дальнейшем водный слой экстрагировали при помощи 15 мл этилацетата и смешанный раствор этилацетата сушили (MgSO4), фильтровали и выпаривали. Очистка посредством препаративной ТСХ на силикагеле (10% этилацетата/гексаны) давала соединение 31 (4 мг, 0,0057 ммоль, 8%).
31→этиловый эфир 2-(3-{(1R,2S,3R,5R)-5-хлор-3-гидрокси-2-[4-(1-гидрокси-гексил)-фенил]-циклопентил}-пропил)-тиазол-5-карбоновой кислоты (32)→2-(3-{(1R,2S,3R,5R)-5-хлоро-3-гидрокси-2-[4-(1-гидрокси-гексил)-фенил]-циклопентил}-пропил)-тиазол-5-карбоновя кислота (33). Последовательность действий выполняли как описано в заявке на патент США №11/009,298, зарегистрированной 10 декабря 2004 года (в настоящий момент, патент США №7,091,231, опубликованный 15 августа 2006 года), фиг.6.
Превращение 33 в 34а и 34b. Данную последовательность действий выполняли как описано на стадии 1 схемы 1.
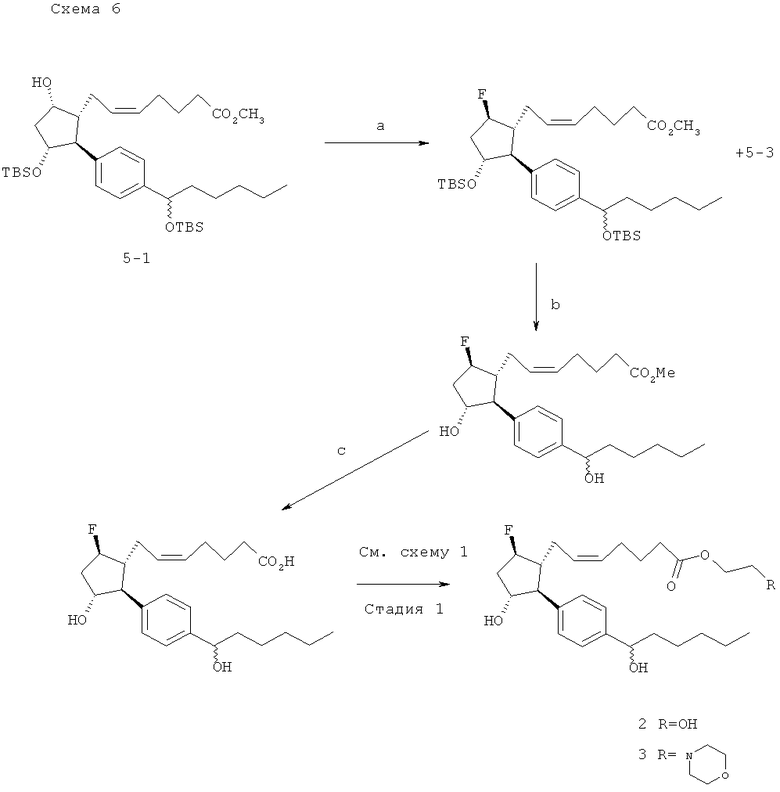
(a) MsCl, TEA; NaCN, ДМСО 80°; (b) HF-пиридин, 0°C; (с) водный LiOH, ТГФ.
Метиловый эфир (Z)-7-((1R,2S,3R,5R)-3-(трет-бутил-диметил-силанилокси)-2-{4-[1-(трет-бутил-диметил-силанилокси)-гексил1-фенил}-5-фторо-циклопентил)-гепта-5-еноевой кислоты (36). Раствор соединения 35 (109 мг, 0,17 ммоль) в 0,5 мл дихлорметана перемещали при помощи канюли к раствору -78°С раствору трифторида деоксофтор[бис(2-метоксиэтил)-аминосеры (34 мл, 0,18 ммоль) в 0,75 мл дихлорметана, промывая при помощи 0,25 мл дилорметана. Реакцию перемешивали в течение 2 ч при -78°С и затем останавливали посредством добавления 10 мл насыщенного NaHCO3. Смесь экстрагировали при помощи дихлорметана (3х15 мл) и смешанный раствор дихлорметана сушили (MgSO4), фильтровали и выпаривали. Очистка посредством флэш-хроматографии на силикагеле (1% этилацетата/гексаны → 2%) давала 25 мг (23%) соединения 37 и 53 мг неочищенного соединения 36.
Метиловый эфир (Z)-7-{(1R,2S,3R,5R)-5-Фторо-3-гидрокси-2-[4-(1-гидрокси-гексил)-фенил]-циклопентил}-гепта-5-еноевой кислоты (38). Следовали способу с использованием HF-пиридина, описанному в заявке на патент США №11/009,298, зарегистрированной 10 декабря 2004 года (в настоящий момент, патент США №7,091,231, опубликованный 15 августа 2006 года), который давал 30 мг неочищенного соединения 37 после флэш-хроматографии на силикагеле (40% этилацетат/гексаны). Дальнейшая очистка посредством препаративной ТСХ (35% этилацетат/гексаны) давала 7 мг чистого соединения 38.
(Z)-7-{(1R,2S,3R,5R)-5-Фторо-3-гидрокси-2-[4-(1-гидрокси-гексил)-фенил]-циклопентил}-гепта-5-еноевая кислота (39). Применяли описанный ранее способ с использованием LiOH (заявка на патент США №11/009,298, зарегистрированная 10 декабря 2004 года, в настоящий момент, патент США №7,091,231, опубликованный 15 августа 2006 года).
Превращение соединения 39 в 40а и 40b. Данную последовательность действий выполняли как описано на стадии 1 схемы 1.
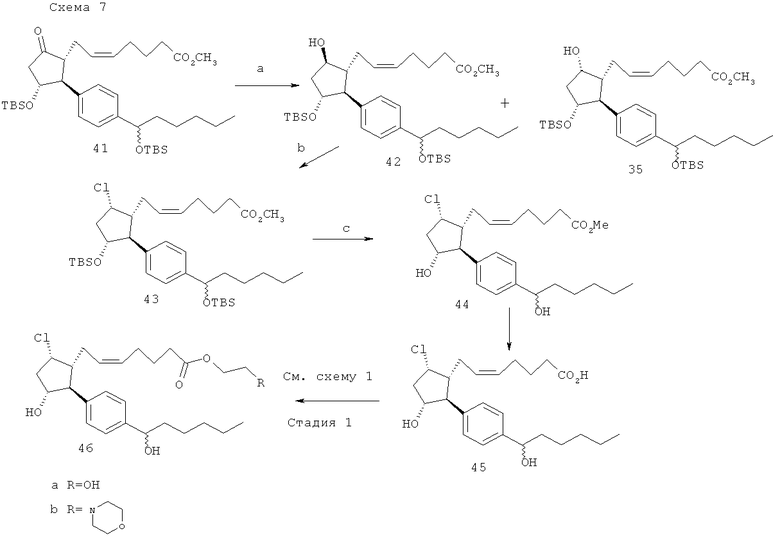
(a) NaBH4; (b) MsCl, TEA; TBAC 80°C; (c) HF-пиридин, 0°C; эстераза кроличьей печени.
Метиловый эфир (Z)-7-((1R,2S,3R,5S)-3-(трет-бутил-диметил-силанилокси)-2-{4-[1-(трет-бутил-диметил-силанилокси)-гексил]-фенил}-5-гидрокси-циклопентил)-гепта-5-еноевой кислоты (35) и метиловый эфир (Z)-7-((1R,2S,3R,5R)-3-(трет-бутил-диметил-силанилокси)-2-{4-[1-(трет-бутил-диметил-силанилокси)-гексил]-фенил}-5-гидрокси-циклопентил)-гепта-5-еноевой кислоты (42). NaBH4 (9 мг, 0,24 ммоль) добавляли к раствору метилового эфира (Z)-7-((1R,2S,3R)-3-(трет-бутил-диметил-силанилокси)-2-{4-[1-(трет-бутил-диметил-силанилокси)-гексил]-фенил}-5-оксо-циклопентил)-гепта-5-еноевой кислоты (41) (55 мг, 0,087 ммоль, приготовленной как описано в заявке на патент США №11/009,298, зарегистрированной 10 декабря 2004 года (в настоящий момент, патент США №7,091,231, опубликованный 15 августа 2006 года, фиг.5) в метаноле (0,5 мл). Через 20 мин добавляли 1М HCl (10 мл), и полученную смесь экстрагировали при помощи дихлорметана (3×10 мл). Смешанный раствор дихлорметана сушили (MgSO4), фильтровали и выпаривали. Очистка посредством флэш-хроматографии на силикагеле (10% этилацетат/гексаны → 15%) давала 27 мг (49%) соединения 42 и 16 мг (29%) соединения 35 наряду с 8 мг смешанной фракции.
Метиловый эфир (Z)-7-((1R,2S,3R,5S)-3-(трет-бутил-диметил-силанилокси)-2-{4-{1-(трет-бутил-диметил-силанилокси)-гексил]-фенил}-5-хлоро-циклопентил)-гепта-5-еноевой кислоты (43). Метансульфонилхлорид (15 мкл, 0,19 ммоль) и триэтиламин (30 мкл, 0,21 ммоль) добавляли к раствору соединения 42 (50 мг, 0,08 ммоль) в дихлорметане (0,3 мл). Через 1,5 ч добавляли насыщенный раствор бикарбоната натрия и полученную смесь экстрагировали при помощи дихлорметана (3×15 мл). Смешанный раствор дихлорметана выпаривали до получения сырого мезилата.
Сырой мезилат помещали в 0,7 мл толуола и добавляли (H-Bu)4NCl (246 мг, 0,90 ммоль). Смесь перемешивали при 80°C в течение 1 ч и затем фильтровали посредством силикагеля (20% этилацетат/гексаны) для получения соединения 43 (40 мг, 77%).
43→метиловый эфир (Z)-7-((1R,2S,3R,5S)-5-хлоро-3-гидрокси-2-[4-(1-гидрокси-гексил)-фенил]-циклопентил)-гепта-5-еноевой кислоты (44) → (Z)-7-((1R,2S,3R,5S)-5-хлоро-3-гидрокси-2-[4-[1-(гидрокси-гексил)-фенил1-циклопентил)-гепта-5-еноевая кислота (45). Данную последовательность действий выполняли как показано на схеме 7, следуя способам, описанным в заявке на патент США №11/009,298, зарегистрированной 10 декабря 2004 года (в настоящий момент, патент США №7,091,231, опубликованный 15 августа 2006 года).
Превращение соединения 45 в 46а и 46b. Данную последовательность действий выполняли как описано на стадии 1 схемы 1.
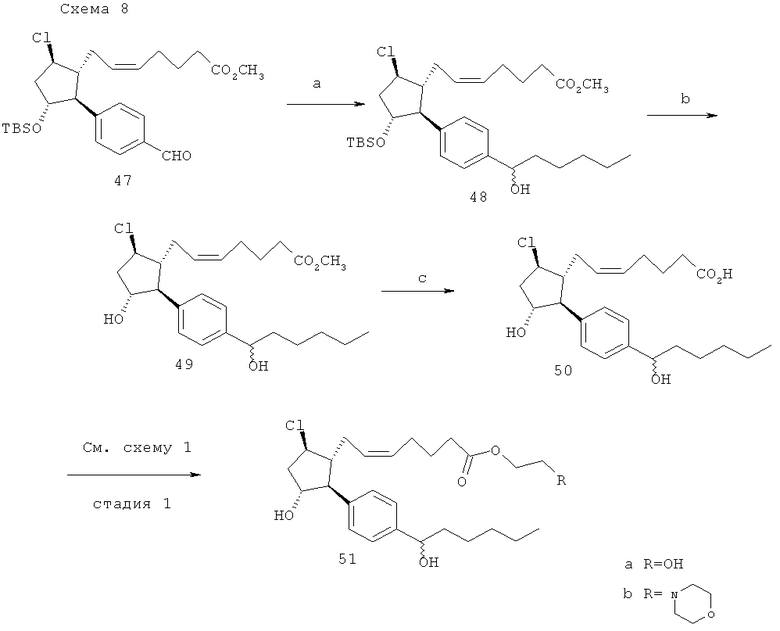
(а) н-пентил MgBr; (b) HF-пиридин 0°C; (с) 1М LiOH, ТГФ; (d) 2-иодопропан, DBU (ДБУ), ацетон.
(Z)-7-((1R,2S,3R,5R)-5-хлоро-3-гидрокси-2-[4-[1-(гидрокси-гексил)-фенил]-циклопентил)-гепта-5-еноевая кислота (50). Указанное в заголовке соединение готовили как показано на схеме 8, способом сходным с таковым, описанным в заявке на патент США №11/009,298, поданной 10 декабря 2004 года (в настоящий момент, патент США №7,091,231, опубликованный 15 августа 2006 года), фиг.9.
Изопропиловый эфир (Z)-7-((1R,2S,3R,5R)-5-хлоро-3-гидрокси-2-[4-[1-(гидрокси-гексил)-фенил]-циклопентил)-гепта-5-еноевой кислоты (51). Данное соединение готовили при помощи стандартного способа, описанного в заявке на патент США №11/009,298, поданной 10 декабря 2004 года (в настоящий момент, патент США №7,091,231, опубликованный 15 августа 2006 года).
Приготовление отдельных диастереомеров соединения 50. Отдельные диастереомеры отделяли посредством препаративной ВЭЖХ на стадии 48: приблизительно 5 мг образца/прогон; колонка Chiralcel OD semiprep (1×25 см), 2,4 мл/мин скорость потока, 10% изопропиловый спирт/гексаны; время задержки=17,6 мин и 23,8 мин. Затем отдельные диастериомеры отбирали порознь как показано на схеме 8 и как описано в заявке на патент США №11/009,298, зарегистрированной 10 декабря 2004 года (в настоящий момент, патент США №7,091,231, опубликованный 15 августа 2006 года).
Превращение соединения 50 в 51а и 51b. Данную последовательность действий выполняли как описано на стадии 1 схемы 1.
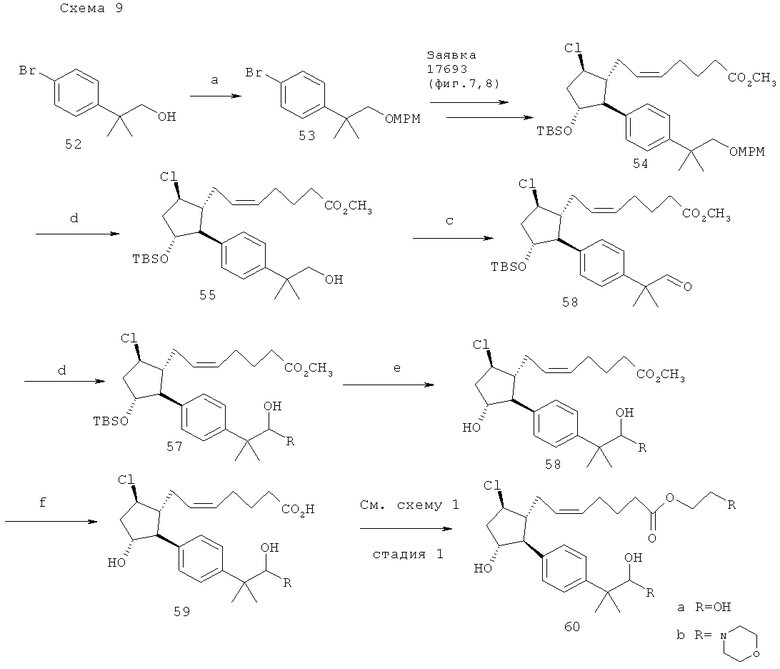
(а) 4-метоксибензилхлорид, NaH; (b) ДДХ (2,3-дихлоро-5,6-дициано-1,4-бензохинон); (с) ТРАР, NMO; (d) RMgX; (e) HF-пиридин 0°С; (f) 1M LiOH, ТГФ; (g) 2-иодопропан, ДБУ, ацетон.
(Z)-7-{(1R,2S,3R,5R)-5-хлоро-3-гидрокси-2-[4-(2-(гидрокси-1,1-диметил-гептил)-фенил]-циклопентил}-гепта-5-еноевая кислота (пункт 31. таблица 1) и (Z)-7-{(1R,2S,3R,5R)-5-хлоро-3-гидрокси-2-[4-(2-(гидрокси-1,1-диметил-гексил)-фенил]-циклопентил}-гепта-5-еноевая кислота. Соединения готовили как показано на схеме 9 при помощи способов аналогичных таковым, описанным в заявке на патент США №11/009,298, поданной 10 декабря 2004 года (в настоящий момент, патент США №7,091,231, опубликованный 15 августа 2006 года), фиг.7-9.
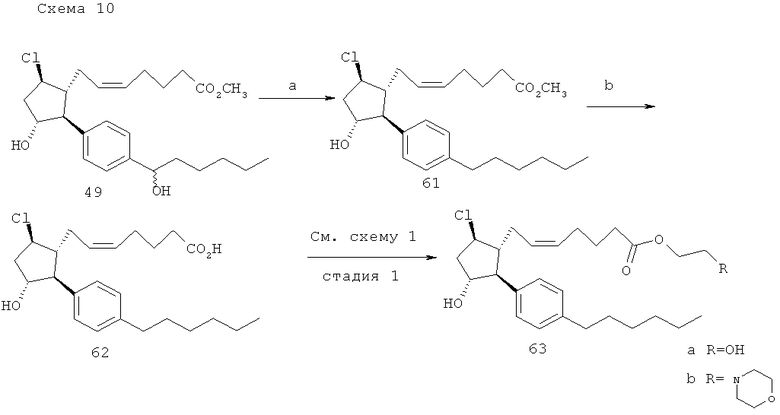
(a) Et3SiH, ТГФ, ClCH2CH2Cl; (b) водный LiOH, ТГФ.
Метиловый эфир (Z)-7-[(1R,2S,3R,5R)-5-хлоро-2-(4-гексил-Фенил)-3-гидрокси-циклопентил]-гепта-5-еноевой кислоты (61). Et3SiH (30 мкл, 0,19 ммоль), а затем ТФУК (трифторуксусная кислота) (90 мкл, 1,17 ммоль) добавляли к раствору соединения 49 (23 мг, 0,046 ммоль) в дихлорэтане (0,10 мл). После 15 мин реакцию останавливали посредством добавления 4 мл насыщенного раствора бикарбоната натрия. Полученную смесь экстрагировали при помощи дихлорметана (3×30 мл), и смешанный раствор дихлорметана сушили (Na2SO4), фильтровали и выпаривали. Очистка посредством флэш-хроматографии на силикагеле (10% этилацетат/гексаны → 15% → 20%) давала 21 мг (110%) соединения 61.
(Z)-7-[(1R,2S,3R,5R)-5-хлоро-2-(4-гексил-фенил)-3-гидрокси-циклопентил]-гепта-5-еноевая кислота (62). Указанное в заголовке соединение готовили стандартным способом с использованием LiOH, описанным в заявке на патент США №11/009,298, поданной 10 декабря 2004 года (в настоящий момент, патент США №7,091,231, опубликованный 15 августа 2006 года).
Превращение соединения 62 в 63а и 63b. Данную последовательность действий выполняли как описано на стадии 1 схемы 1.
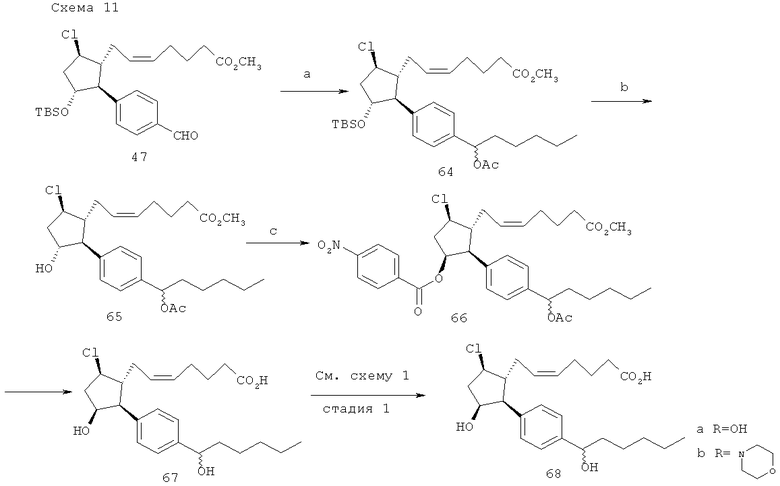
(а) н-пентил MgBr; EtOAc; (b) HF-пиридин 0°C; (с) Ph3P диизопропилазодикарбоскилат, 4-нитробензойная кислота, ТГФ; (d) 1M LiOH, ТГФ.
Метиловый эфир (Z)-7-[(1R,2S,3R,5R)-2-[4-(1-аиетокси-гексил)-фени]-3-(трет-бутил-диметил-силанилокси)-5-хлоро-циклопентил]-гепта-5-еноевой кислоты (64). Н-пентил MgBr (130 мкл, 0,26 ммоль) добавляли к 0°С раствору соединения 47 (114 мг, 0,24 ммоль) в ТГФ (0,9 мл). После 2,5 ч добавляли 1 мл этилацетата и реакционную смесь оставляли нагреваться до комнатной температуры. Через 30 мин при комнатной температуре добавляли 10 мл насыщенного раствора хлорида аммония и полученную смесь экстрагировали при помощи этилацетата (3×30 мл). Смешанный раствор этилацетата сушили (Na2S04), фильтровали и выпаривали. Очистка посредством флэш-хроматографии на сликагеле (10% этилацетет/гексаны) давала 113 мг (80%) соединения 64.
Метиловый эфир (Z)-7-{(1R,2S,3R,5R)-2-[4-(1-ацетокси-гексил)-фенил]-5-хлоро-3-гидрокси-циклопентил}-гепта-5-еноевой кислоты (65). Применяли стандартное снятие защитных групп HF-пиридином, описанное в заявке на патент США №11/009,298, зарегистрированной 10 декабря 2004 года (в настоящий момент, патент США №7,091,231, опубликованный 15 августа 2006 года).
4-нитробензойная кислота (1S,2S,3R,4R)-2-[4-(1-ацетокси-гексил)-фенил]-4-хлоро-3-((Z)-6-метоксикарбонил-гекс-2-енил)-циклопентиловый эфир (66). Диизопропилазодикарбоксилат (11 мкл, 0,057 ммоль) добавляли к смеси Ph3P (15,6 мг, 0,059 ммоль), 4-нитробензойной кислоты (8,3 мг, 0,050 ммоль) и соединения 65 (17 мг, 0,036 ммоль) в ТГФ (0,600 мл). Реакционную смесь перемешивали в течение ночи, и затем летучие вещества выпаривали под действием вакуума. Очистка осадка посредством флэш-хроматографии на силикагеле (30% этилацетат/гексаны) давала 10 мг (45%) соединения 66.
(Z)-7-{(1R,2S,3S,5R)-5-хлоро-3-гидрокси-244-(1-гидрокси-гексил)-фенил]-циклопентил}-гепта-5-еноевая кислота (67). Применяли стандартный способ гидролиза с использованием LiOH, описанный в заявке на патент США №11/009,298, поданной 10 декабря 2004 года (в настоящий момент, патент США №7,091,231, опубликованный 15 августа 2006 года).
Превращение соединения 67 в 68а и 68b. Данную последовательность действий выполняли как описано на стадии 1 схемы 1.
Примеры in vivo
Вышеупомянутые соединения испытывают in vivo для измерения их способности снижать внутриглазное давление. Соединение 14а испытывают на собаках с нормальным артериальным давлением. Внутриглазное давление (ВГД) снижается по сравнению с исходным уровнем. Также соединение испытывают на обезьянах с гипертонией, индуцированной лазером, ВГД снижается по сравнению с исходным уровнем.
Соединение 14b испытывают на собаках с нормальным артериальным давлением. Внутриглазное давление (ВГД) снижается по сравнению с исходным уровнем. Также соединение испытывают на обезьянах с гипертонией, индуцированной лазером, ВГД снижается по сравнению с исходным уровнем.
Соединение 25а испытывают на собаках с нормальным артериальным давлением. Внутриглазное давление (ВГД) снижается по сравнению с исходным уровнем. Также соединение испытывают на обезьянах с гипертонией, индуцированной лазером, ВГД снижается по сравнению с исходным уровнем.
Соединение 25b испытывают на собаках с нормальным артериальным давлением. Внутриглазное давление (ВГД) снижается по сравнению с исходным уровнем. Также соединение испытывают на обезьянах с гипертонией, индуцированной лазером, ВГД снижается по сравнению с исходным уровнем.
Соединение 34а испытывают на собаках с нормальным артериальным давлением. Внутриглазное давление (ВГД) снижается по сравнению с исходным уровнем. Также соединение испытывают на обезьянах с гипертонией, индуцированной лазером, ВГД снижается по сравнению с исходным уровнем.
Соединение 34b испытывают на собаках с нормальным артериальным давлением. Внутриглазное давление (ВГД) снижается по сравнению с исходным уровнем. Также соединение испытывают на обезьянах с гипертонией, индуцированной лазером, ВГД снижается по сравнению с исходным уровнем.
Соединение 40а испытывают на собаках с нормальным артериальным давлением. Внутриглазное давление (ВГД) снижается по сравнению с исходным уровнем. Также соединение испытывают на обезьянах с гипертонией, индуцированной лазером, ВГД снижается по сравнению с исходным уровнем.
Соединение 40b испытывают на собаках с нормальным артериальным давлением. Внутриглазное давление (ВГД) снижается по сравнению с исходным уровнем. Также соединение испытывают на обезьянах с гипертонией, индуцированной лазером, ВГД снижается по сравнению с исходным уровнем.
Соединение 46а испытывают на собаках с нормальным артериальным давлением. Внутриглазное давление (ВГД) снижается по сравнению с исходным уровнем. Также соединение испытывают на обезьянах с гипертонией, индуцированной лазером, ВГД снижается по сравнению с исходным уровнем.
Соединение 46b испытывают на собаках с нормальным артериальным давлением. Внутриглазное давление (ВГД) снижается по сравнению с исходным уровнем. Также соединение испытывают на обезьянах с гипертонией, индуцированной лазером, ВГД снижается по сравнению с исходным уровнем.
Соединение 51а испытывают на собаках с нормальным артериальным давлением. Внутриглазное давление (ВГД) снижается по сравнению с исходным уровнем. Также соединение испытывают на обезьянах с гипертонией, индуцированной лазером, ВГД снижается по сравнению с исходным уровнем.
Соединение 51b испытывают на собаках с нормальным артериальным давлением. Внутриглазное давление (ВГД) снижается по сравнению с исходным уровнем. Также соединение испытывают на обезьянах с гипертонией, индуцированной лазером, ВГД снижается по сравнению с исходным уровнем.
Соединение 60а испытывают на собаках с нормальным артериальным давлением. Внутриглазное давление (ВГД) снижается по сравнению с исходным уровнем. Также соединение испытывают на обезьянах с гипертонией, индуцированной лазером, ВГД снижается по сравнению с исходным уровнем.
Соединение 60b испытывают на собаках с нормальным артериальным давлением. Внутриглазное давление (ВГД) снижается по сравнению с исходным уровнем. Также соединение испытывают на обезьянах с гипертонией, индуцированной лазером, ВГД снижается по сравнению с исходным уровнем.
Соединение 63а испытывают на собаках с нормальным артериальным давлением. Внутриглазное давление (ВГД) снижается по сравнению с исходным уровнем. Также соединение испытывают на обезьянах с гипертонией, индуцированной лазером, ВГД снижается по сравнению с исходным уровнем.
Соединение 63b испытывают на собаках с нормальным артериальным давлением. Внутриглазное давление (ВГД) снижается по сравнению с исходным уровнем. Также соединение испытывают на обезьянах с гипертонией, индуцированной лазером, ВГД снижается по сравнению с исходным уровнем.
Соединение 68а испытывают на собаках с нормальным артериальным давлением. Внутриглазное давление (ВГД) снижается по сравнению с исходным уровнем. Также соединение испытывают на обезьянах с гипертонией, индуцированной лазером, ВГД снижается по сравнению с исходным уровнем.
Соединение 68b испытывают на собаках с нормальным артериальным давлением. Внутриглазное давление (ВГД) снижается по сравнению с исходным уровнем. Также соединение испытывают на обезьянах с гипертонией, индуцированной лазером, ВГД снижается по сравнению с исходным уровнем.
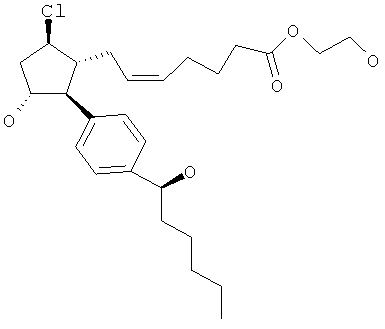
Ниже приведены результаты испытаний соединения по изобретению и показано его влияние на внутриглазное давление.
Лечение воспалительного заболевания кишечника может быть выполнено посредством введения больным млекопитающим соединений, описанных в данном документе. Воспалительное заболевание кишечника описывает различные заболевания, характеризующиеся воспалением кишечника, включая, но не ограничиваясь, язвенный колит и болезнь Крона. Лечение может быть выполнено посредством орального введения, суппозиторного или парентерального введения или какого-либо другого приемлемого метода.
Не ограничивая объем изобретения каким-либо образом, доставка соединений, раскрытых в данном документе, в толстый кишечник с помощью оральных лекарственных форм может быть выполнена любым из ряда способов, известных в данной области техники. Например, обзоры Chourasia и Jain в J Pharm Pharmaceut Sci 6 (1): 33-66, 2003 и Shareefet. al. (AAPS PharmSci 2003; 5 (2) Article 17) описывают ряд полезных способов. Не ограничивая объем изобретения каким-либо образом эти способы включают: 1) введение пролекарственной формы, включая пролекарственные формы, основанные на азо или углеводородах; 2) покрытие лекарственных средств или инкапсулирования или внедрения лекарственного средства в полимер, разработанный для доставки лекарственного средства в толстый кишечник; 3) доставка с замедленным временем высвобождения лекарственного средства;
4) применение биоадгезивных систем; и т.п.
Не ограничивая объем изобретения каким-либо образом посредством теории, полагают, что кишечная микрофлора способна к восстановительному расщеплению азо связи, превращая два атома азота в функциональные аминогруппы. Не ограничивая объем изобретения каким-либо образом, способ азо пролекарственной формы применяют для доставки 5-аминосалициловой кислоты в толстый кишечник людей в клинических исследованиях для лечения воспалительного заболевания кишечника. Кроме того, полагают, что бактерии нижних отделов кишечника также обладают ферментами, которые могут расщеплять гликозиды, глюкурониды, циклодекстрины, декстраны и другие углеводороды, и эфировые пролекарственные формы, полученные из этих углеводородов, показаны для селективной доставки исходного активного лекарственного средства в толстый кишечник. Например, исследования in vivo и in vitro на крысах и морских свинках при помощи пролекарственных форм дексаметазона, преднизолона, гидрокортизона и флудрокортизона подтверждают, что гликозидные коньюгаты могут быть полезны для доставки стероидов в толстый кишечник человека. Другие исследования in vivo подтвердили, что глюкуронидные, циклодекстриновые и декстрановые пролекарственные формы стероидов и нестероидных противовоспалительных лекарственных средств полезны для доставки этих лекарственных средств в нижние отделы желудочно-кишечного тракта. Показано, что амид салициловой кислоты и глутаминовая кислота полезны для доставки салициловой кислоты в толстый кишечник кролика и собаки.
Не оганичивая объем изобретения каким-либо образом, углеводородные полимеры, такие как амилаза, арабиногалактан, хитозан, хондроитинсульфат, декстран, гуаровая камедь, пектин, ксилин и т.п. или полимеры, содержащие азо-группы, могут быть применены для покрытия лекарственного средства, или лекарственное средство может пропитывать или быть введено в полимер. Полагают, что после орального применения полимеры остаются стабильными в верхних отделах желудочно-кишечного тракта, но разрушаются микрофлорой нижних отделов желудочно-кишечного тракта, таким образом, высвобождая лекарственное средство для лечения.
Также могут быть применены полимеры, чувствительные к pH, поскольку толстый кишечник обладает более высоким pH, чем верхние отделы желудочно-кишечного тракта. Такие полимеры коммерчески доступны. Например, Rohm Pharmaceuticals, Darmstadt, Germany в промышленном масштабе предлагает pH зависимые полимеры, основанные на метакрилате, и сополимеры, обладающие различными растворимостями при различных уровнях pH, исходя из числа свободных карбоксилатных групп в полимере под торговой маркой Eudragit®. Некоторые лекарственные формы Eudragit® в настоящее время применяют для доставки салсалазина для лечения язвенных колитов и болезни Крона. Также изучены системы высвобождения, биоадгезивные системы и другие системы доставки.
Предшествующее описание раскрывает в деталях определенные способы и композиции, которые могут быть применены для практического использования настоящего изобретения и представляют наилучший рассмотренный вариант. Однако, для специалиста в данной области техники очевидно, что дополнительные соединения с желаемыми фармакологическими свойствами могут быть приготовлены аналогичным образом, и что раскрытые соединения также могут быть получены из исходных соединений посредством различных химических реакций. Аналогично, различные фармацевтические композиции могут быть приготовлены и применены по существу с тем же результатом. Однако, таким образом, некоторые подробности вышеизложенного, возможно присутствующие в тексте, не следует рассматривать как ограничение полного объема рассматриваемого, точнее, границы настоящего изобретения определены только посредством объема правовой охраны прилагаемой формулы изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| ТЕРАПЕВТИЧЕСКИЕ СОЕДИНЕНИЯ | 2009 |
|
RU2500674C2 |
| ЗАМЕЩЕННЫЕ ЦИКЛОПЕНТАНЫ, ОБЛАДАЮЩИЕ ПРОСТАГЛАНДИНОВОЙ АКТИВНОСТЬЮ | 2009 |
|
RU2505530C2 |
| ЗАМЕЩЕННЫЕ ЦИКЛОПЕНТАНЫ, ОБЛАДАЮЩИЕ ПРОСТАГЛАНДИНОВОЙ АКТИВНОСТЬЮ | 2008 |
|
RU2481339C2 |
| АНАЛОГИ 12-АРИЛПРОСТАГЛАНДИНА | 2005 |
|
RU2439055C2 |
| ЗАМЕЩЕННЫЕ ГАММА-ЛАКТАМЫ В КАЧЕСТВЕ ТЕРАПЕВТИЧЕСКИХ АГЕНТОВ | 2009 |
|
RU2543379C2 |
| КОНЪЮГАТЫ И ПРОИЗВОДНЫЕ ПРОСТАГЛАНДИНА ДЛЯ ЛЕЧЕНИЯ ГЛАУКОМЫ И ВНУТРИГЛАЗНОЙ ГИПЕРТЕНЗИИ | 2015 |
|
RU2712221C2 |
| ЧАСТИЧНЫЕ И ПОЛНЫЕ АГОНИСТЫ АДЕНОЗИНОВЫХ РЕЦЕПТОРОВ A | 2003 |
|
RU2340623C2 |
| КОМБИНИРОВАННОЕ ЛЕЧЕНИЕ АГОНИСТОМ ТОЛЛ-ПОДОБНОГО РЕЦЕПТОРА (TLR7) И ИНГИБИТОРОМ СБОРКИ КАПСИДА ВИРУСА ГЕПАТИТА В | 2016 |
|
RU2718917C2 |
| СОЕДИНЕНИЯ И КОМПОЗИЦИИ, ПРИМЕНЯЕМЫЕ ДЛЯ ЛЕЧЕНИЯ РАССТРОЙСТВ, СВЯЗАННЫХ С NTRK | 2016 |
|
RU2744974C2 |
| ЗАМЕЩЕННЫЕ ПУРИНОВЫЕ И 7-ДЕАЗАПУРИНОВЫЕ СОЕДИНЕНИЯ | 2011 |
|
RU2606514C2 |
Изобретение относится к новому соединению формулы
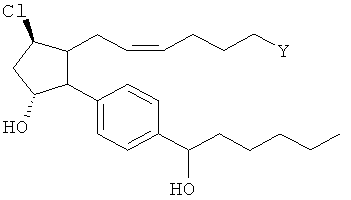
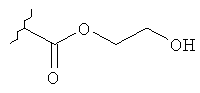
где Y представляет собой
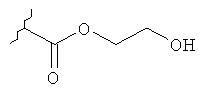 или
или 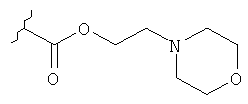
или его фармацевтически приемлемой соли. Указанное соединение применяют для лечения состояний глаз, заболеваний кишечника и облысения.
Соединение формулы
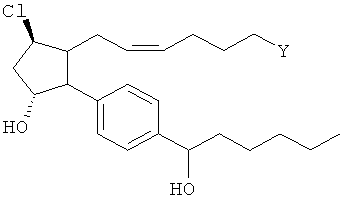
где Y представляет собой
 или
или 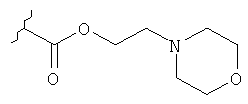 ;
;
или его фармацевтически приемлемая соль.
| Пломбировальные щипцы | 1923 |
|
SU2006A1 |
| Способ обработки целлюлозных материалов, с целью тонкого измельчения или переведения в коллоидальный раствор | 1923 |
|
SU2005A1 |
| Детонирующий шнур | 1957 |
|
SU116358A1 |
| Пресс для выдавливания из деревянных дисков заготовок для ниточных катушек | 1923 |
|
SU2007A1 |
| US 6410591 B1, 25.06.2002 | |||
| RU 2005129072 A, 27.02.2006 | |||
| WO 2005013928 A1, 17.02.2005. | |||
Авторы
Даты
2013-12-20—Публикация
2009-03-17—Подача