Изобретение относится к области нейробиологии и медицины, в частности к методам коррекции невралгических нарушений при заболеваниях и травмах ЦНС, и может быть использовано для частичного восстановления активности нейронных сетей после гибели части функционально значимых нейронов под действием стресс-факторов.
Разработка характеризующихся острым международным спросом методов коррекции невралгических нарушений представляет собой одно из наиболее актуальных направлений решения проблем ишемии головного мозга, составляющих центральную задачу мировой нейробиологии и медицины.
Однако известные наработки в области частичного восстановления функциональной активности значительно поврежденных нейронных сетей основаны на использовании трансплантации стволовых клеток (см., например, отечественное изобретение «Трансплантация нервных клеток для лечения нейродегенеративных состояний» по патенту РФ №2434636, А61K 35/12, А61Р 25/14, А61Р 25/28, C12N 5/07, 2011 и американское изобретение «Use of neural cells derived from human pluripotent stem cells for the treatment of neurodegenerative diseases» по заявке US №2014314721, A61K 67/0271, A61K 35/54, C12N 5/074, 2014) или векторных конструкций (см, например отечественное изобретение «Способ стимулирования восстановления периферической иннервации тканей с помощью векторных конструкций» по патенту РФ №2486918, А61K 48/00, 2013), характеризующихся достижением приемлемого результата при высоких ресурсных и денежных затратах вследствие сложности метода трансплантации стволовых клеток и разработки векторных конструкций.
Кроме того, применение стволовых клеток может вызывать побочные эффекты, приводящие к развитию онкологии, и характеризуется этическим ограничением перспективы использования эмбрионального материала (см., например, обзор: Павлович Е.Р. «Регенеративная медицина: плюсы и минусы применения клеточных технологий в медико-биологических исследованиях». - Сборник «Современные наукоемкие технологии». 2013, т. 2, с. 103).
Поэтому повышение эффективности частичного восстановления функциональной активности значительно пораженных нейронных сетей продолжает оставаться важной практической задачей прикладной нейробиологии, формирующей экспериментально-биологические предпосылки развития современной клиники в области тяжелых неврологических заболеваний, в том числе ишемии головного мозга.
Заявителем разработан новый, более эффективный, простой и доступный, а также биологически безопасный в сравнении с изложенными выше аналогами (в связи с принципиально иным путем реализации предлагаемого способа заявитель не выявил в известных источниках информации со сведениями о частичном восстановлении функциональной активности нейронных сетей в условиях отсутствия возможности спонтанного торможения дегенерации нервных клеток, ближайшего аналога-прототипа) способ частичного восстановления функциональной активности нейронных сетей с высокой степенью их поражения (в условиях, исключающих возможность спонтанной регенерации нервных клеток) за счет воздействия на них нейротрофическим фактором головного мозга в отдаленном посттравматическом периоде.
Кроме того, предлагаемый способ расширяет арсенал практических направлений осуществления актуальных методов коррекции невралгических нарушений при заболеваниях и травмах ЦНС.
Для этого в способе частичного восстановления функциональной активности нейронных сетей in vitro в условиях их значительного повреждения путем воздействия нейротрофином на поврежденную нейронную культуру, в качестве нейтротрофина используют нейротрофический фактор головного мозга, которым в отдаленный посттравматический период в течение 12 дней воздействуют на поврежденную культуру диссоциированных клеток гиппокампа при значительном повреждении не более 80% клеток указанной культуры в условиях, исключающих возможность спонтанной регенерации клеток культуры гиппокампа.
В случае повреждения диссоциированной культуры клеток гиппокампа в результате моделирования острой нормобарической гипоксии in vitro путем замены на 10 мин нормоксической культуральной среды на культуральную среду, подвергнутую в течение 10 мин вытеснению кислорода аргоном, с возвратом прежней культуральной среды, на шестой день постгипоксического периода начинают воздействие нейротрофическим фактором головного мозга в концентрации 1,0 нг/мл, которое осуществляют аппликацией в культуральную среду указанным фактором в течение 12 дней.
А в случае повреждения диссоциированной культуры клеток гиппокампа в результате моделирования глюкозной депривации in vitro путем замены на 120 мин нормоксической культуральной среды на культуральную среду, подготовленную без содержания глюкозы, пирувата и лактата, с возвратом прежней культуральной среды, на шестой день после моделирования глюкозной депривации начинают воздействие нейротрофическим фактором головного мозга в концентрации 1,0 нг/мл, которое осуществляют аппликацией в культуральную среду указанным фактором в течение 12 дней.
Известное в информационных источниках использование нейротрофического фактора головного мозга (BDNF) для коррекции нарушений, вызванных неврологическими расстройствами, не противоречит изобретательскому уровню предлагаемого способа в связи с тем, что в этих источниках BDNF (см., например, статью на англ. яз.: Thomas Beck, Dan Lindholm, Eero Castren and Andreas Wree «Brain-Derived Neurotrophic Factor Protects Against Ischemic Cell Damage in Rat Hippocampus». - Journal of Cerebral Blood Flowand Metabolism. 1994, V. 14, p. 689-692) применяется непосредственно в момент возникновения стресс-фактора с повышением жизнеспособности клеток в условиях возможности спонтанного торможения дегенерации нервных клеток (использование BDNF с возможностью частичного восстановления функциональной активности нейронных сетей in vitro в условиях их значительного повреждения в отдаленный посттравматический период в условиях, исключающих возможность спонтанной регенерации нервных клеток, в практике отечественной и зарубежной нейробиологии и информационных источниках заявителем не обнаружено).
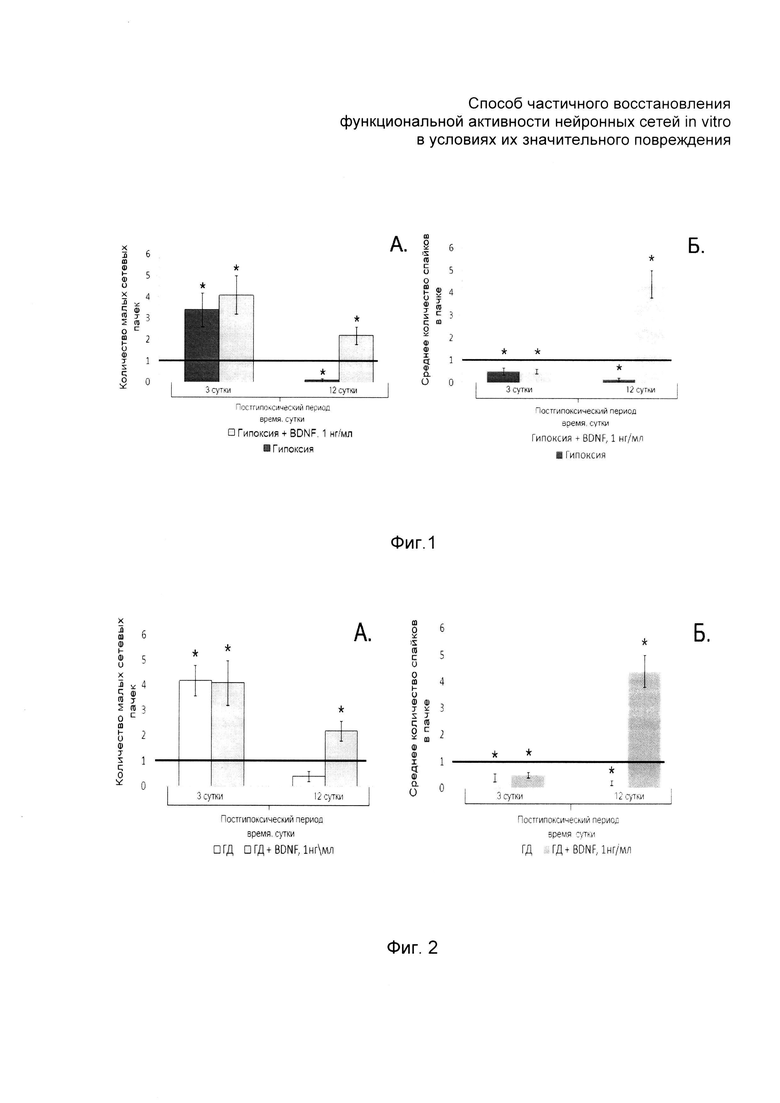
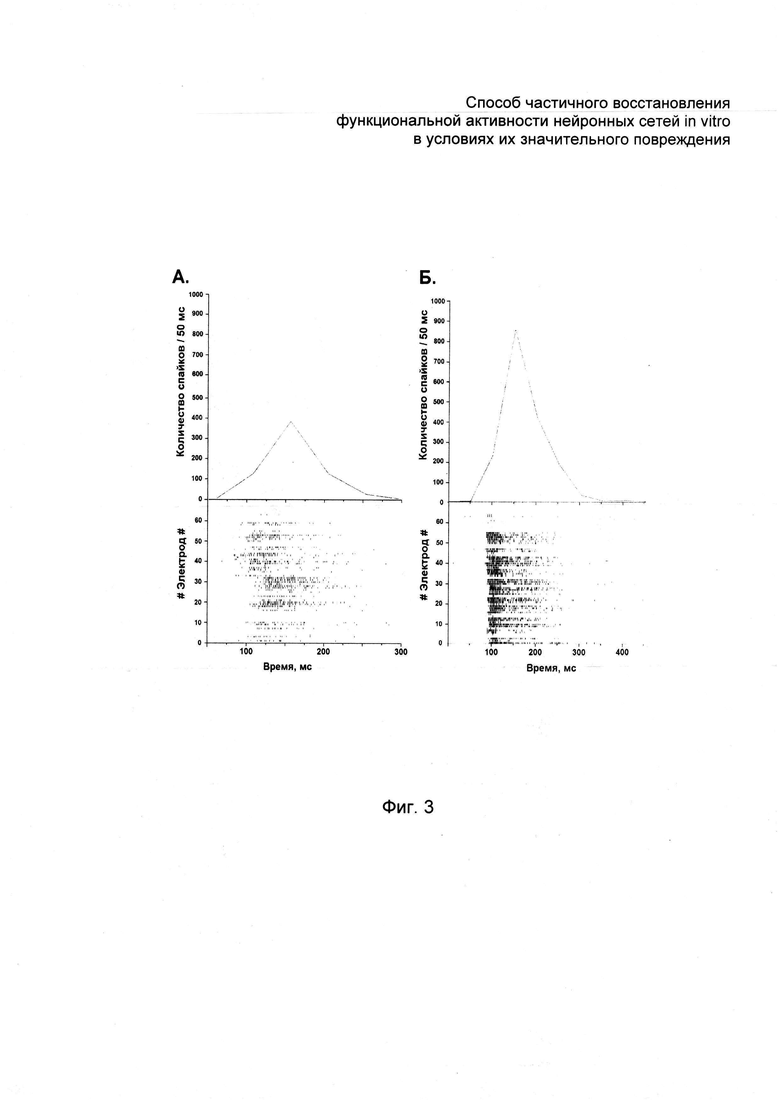
На фиг. 1 и 2 представлены экспериментальные гистограммы, отражающие восстановление функциональной активности функциональной активности значительно поврежденных нейронных сетей in vitro при воздействии на поврежденную диссоциированную культуру клеток гиппокампа в результате моделирования острой нормобарической гипоксии in vitro (фиг. 1) и на поврежденную диссоциированную культуру клеток гиппокампа в результате моделирования глюкозной депривации in vitro (фиг. 2) нейротрофическим фактором головного мозга и без его воздействия в зависимости от срока отдаленного посттравматического периода; на фиг. 3 - количество спайков в графическом виде и растровые диаграммы, отражающие структуру сетевой активности в зависимости от срока отдаленного посттравматического периода.
Предлагаемый способ осуществляют в соответствии со следующими примерами.
Пример 1. Стимуляция частичного восстановления функциональной активности нейронных сетей после моделирования острой нормобарической гипоксии in vitro.
Исследование проводилось на диссоциированных культурах клеток гиппокампа, полученных из эмбрионов мышей. Диссоциирование клеток достигалось путем обработки ткани гиппокампа 0,25% трипсином (Gipco, США). Клетки ресуспендировали в нейробазальной среде NeurobasalTM (Invitrogen, США) в комплексе с биоактивной добавкой В27 (Invitrogen), глутамином (Invitrogen), эмбриональной телячьей сывороткой («ПанЭко», Россия) и культивировали на мультиэлектродной матрице системы МЕА60 (Multichannel Systems, Германия), содержащей 60 микроэлектродов.
Предварительно матрицу стерилизовали УФ-облучением и обрабатывали полиэтиленимином (Sigma, США), служившим опорным субстратом для культивируемых клеток. Исходная плотность культуры на матрице составляла 9000 кл./мм2. Жизнеспособность культур поддерживалась в СО2-инкубаторе при температуре 35,5°С, в газовой смеси, содержащей и 5% СО2. Для количественной обработки и анализа полученных данных использовали набор программного обеспечения МС Rack™ (Multichannel Systems, Германия), а также пакет прикладных программ Matlab.
Моделирование гипоксии проводили на 14-й день культивирования путем замены культуральной среды на среду с низким содержанием кислорода на 10 мин. Вытеснение кислорода осуществлялось за счет насыщения культуральной среды инертным газом. Эксперимент проводили в герметичной камере, в которой воздух также был замещен на инертный газ (аргон).
На шестой день после моделирования нормобарической гипоксии (в отдаленный постгипоксический период, когда погибала основная часть клеток культуры и способность клеток к спонтанной регенерации невозможна) проводилась оценка основных показателей спонтанной биоэлектрической активности (количество малых сетевых пачек, количество спайков в малых сетевых пачках), данные значения были приняты за исходный уровень. Далее в опытные группы ежедневно, в одно и то же время, добавлялся нейротрофический фактор головного мозга. Регистрация спонтанной биоэлектрической активности проводилась ежедневно, до внесения указанного фактора в среду и продолжалась в течение 12 дней после начала аппликации.
При ежедневном введении нейротрофического фактора головного мозга (1 нг/мл) в течение 12 дней наблюдалось увеличение количества малых сетевых пачек (см. фиг. 1а) и достоверное (р<0,05) увеличение количества спайков в сетевой пачке импульсов (см. фиг. 1б).
Также наблюдается постепенное увеличение и стабилизация межпачечного интервала, достоверно (р<0,05) увеличивается количество спайков в сетевой пачке импульсов.
Структура сетевой пачки и распределение количества спайков внутри пачки становятся приближенными к исходным параметрам. Для сетевых пачек импульсов в нативном состоянии характерно преобладание спайков в начальный период возникновения пачки с последующим постепенным затуханием, тогда как в активности первичных культур клеток гиппокампа после моделирования гипоксии и глюкозной депривации возникают пачки с увеличенным количеством спайков в более поздний период возникновения сетевой пачки (см. фиг. 3а). Анализ структуры сетевых пачек показал, что при применении в течение 12 дней нейротрофического фактора головного мозга (1 нг/мл) (см. фиг. 3б) в активности первичных культур вновь преобладают пачки, характерные для интактных культур.
Исследование паттерна (времени возникновения первого спайка на электроде) спонтанной биоэлектрической активности показало, что введение BDNF (1 нг/мл) в течение 12 дней способствует сохранению и частичной репарации характерного патерна сетевой активности. Показано уменьшение среднего времени возникновения спайков, характерное для культур на поздних периодах развития in vitro.
Пример 2. Стимуляция частичного восстановления функциональной активности нейронных сетей после моделирования глюкозной депривации.
Культуры для данного исследования получали тем же образом, что описан в примере 1 настоящего описания изобретения. Моделирование условий глюкозной депривации проводили путем замены культуральной среды на среду, не содержащую глюкозу, пируват, лактат. В исследовании использовалась специально разработанная среда, соответсвующая по составу NeurobasalTM, но не содержащая перечисленных энергетических субстратов. Разработка среды осуществлялась по данным литературы и прописи Neurobasale Mediumlnvitrogen. Приготовление среды осуществлялось по заказу научно-исследовательским отделом ПанЭко (Россия).
Глюкозная депривация приводит к нарушениям функционирования нейронной сети в диссоциированных культурах гиппокампа, что обусловлено гибелью значимых для работы сети нейронов. На шестой день после моделирования глюкозной депривации, когда погибала основная часть клеток культуры и способность клеток к спонтанной регенерации невозможна, при ежедневном введении нейротрофического фактора головного мозга (1 нг/мл) в течение 12 дней наблюдалось увеличение количества малых сетевых пачек (см. фиг. 2а) и достоверное (р<0,05) увеличение количества спайков в сетевой пачке импульсов (см. фиг. 2б).
Анализ структуры сетевой пачки и распределения количества спайков внутри пачки по электродам (на фигурах не показаны) показал такой же результат, как в примере 1 (см. фиг. 3).
При анализе паттерна активации сетевых пачек так же зафиксированы изменения уже с первых дней применения нейротрофического фактора головного мозга (1 нг/мл).
При этом увеличивается количество электродов, на которых регистрируется спонтанная биоэлектрическая пачечная активность (с 23,65±12,54% на третьи сутки после моделирования стресс-факторов до 84,5±18,54% через 12 дней введения нейротрофического фактора головного мозга (1 нг/мл)) и увеличивается среднее время возникновения спайков в пачке.
В обоих примерах значительное повреждение клеток культуры гиппокампа фиксировалось в пределах интервала величин доли поврежденных клеток не более 80% (при превышении указанного порога эффект частичного восстановления функциональной активности нейронных сетей in vitro в условиях их значительного повреждения не достигался).
Выявленный экспериментально интервал величин доли поврежденных клеток (количественный показатель значительного повреждения - не более 80%) задает существенное условие достижения частичного восстановления функциональной активности нейронных сетей in vitro в условиях их значительного повреждения, не совпадающее по излагаемому смыслу с высокой (качественной) степенью значительного поражения, определяемой условиями, исключающими возможность спонтанной регенерации клеток культуры гиппокампа.
Таким образом предлагается новый, более эффективный, простой и доступный, а также биологически безопасный способ частичного восстановления функциональной активности нейронных сетей in vitro при значительном повреждении не более 80% клеток культуры гиппокампа с высокой степенью их поражения (в условиях, исключающих возможность спонтанной регенерации клеток культуры гиппокампа) за счет воздействия на них нейротрофическим фактором головного мозга в отдаленном посттравматическом периоде в результате применения в течение 12 дней указанного фактора в предпочтительной концентрации 1 нг/мл (и интервале допускаемых концентраций от 0,1 нг/мл до 10,0 нг/мл), приводящей к наибольшей степени частичного восстановления функциональной активности нейронных сетей in vitro (получая частичное восстановление функциональной активности диссоциированной культуры клеток гиппокампа с возрастанием активности в два раза в сравнении с контрольной группой без воздействия нейротрофическим фактором головного мозга).
| название | год | авторы | номер документа |
|---|---|---|---|
| ДОНЕКОПРИД КАК НЕЙРОПРОТЕКТОРНЫЙ АГЕНТ ПРИ ЛЕЧЕНИИ НЕЙРОДЕГЕНЕРАТИВНЫХ ЗАБОЛЕВАНИЙ | 2019 |
|
RU2800802C2 |
| Способ получения глиальных производных индуцированных плюрипотентных стволовых клеток с повышенной экспрессией BDNF для терапии ишемического инсульта | 2023 |
|
RU2829361C1 |
| СПОСОБ И УСТРОЙСТВО ДЛЯ ИНТЕГРАЦИИ НЕЙРОНАЛЬНЫХ КЛЕТОК В СФОРМИРОВАННУЮ НЕЙРОННУЮ СЕТЬ С НАПРАВЛЕННОЙ СВЯЗЬЮ IN VITRO | 2021 |
|
RU2814623C2 |
| СПОСОБ ОЦЕНКИ МОРФОФУНКЦИОНАЛЬНОГО СОСТОЯНИЯ ДИФЕРЕНЦИРОВАННЫХ В ДОФАМИНЕРГИЧЕСКИЕ НЕЙРОНЫ ИНДУЦИРОВАННЫХ ПЛЮРИПОТЕНТНЫХ СТВОЛОВЫХ КЛЕТОК БОЛЬНЫХ ПАРКИНСОНИЗМОМ | 2012 |
|
RU2501853C1 |
| Способ обучения биологической нейронной сети (в эксперименте) | 2016 |
|
RU2637391C1 |
| КОМПОЗИЦИЯ ДЛЯ НЕЙРОПРОТЕКЦИИ И СТИМУЛЯЦИИ НЕЙРОРЕГЕНЕРАЦИИ ГОЛОВНОГО МОЗГА ПОСЛЕ ПОВРЕЖДЕНИЯ, СРЕДСТВО НА ЕЕ ОСНОВЕ, СПОСОБ ЕГО ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2022 |
|
RU2803286C1 |
| ПОЛУЧЕНИЕ ГАМКергических НЕЙРОНОВ in vitro ИЗ ЭМБРИОНАЛЬНЫХ СТВОЛОВЫХ КЛЕТОК И ИХ ПРИМЕНЕНИЕ ПРИ ЛЕЧЕНИИ НЕВРОЛОГИЧЕСКИХ РАССТРОЙСТВ | 2004 |
|
RU2380410C2 |
| Способ хранения изолированных жизнеспособных эмбриональных клеток головного мозга | 2020 |
|
RU2746433C1 |
| Способ получения глиальных производных индуцированных плюрипотентных стволовых клеток с повышенной экспрессией NGF для терапии нейродегенеративных заболеваний | 2023 |
|
RU2829363C1 |
| Нейрофизиологическая модель нервной системы, обладающая свойствами реверберации, и способ ее создания | 2019 |
|
RU2723612C1 |
Изобретение относится к области медицины, а именно к нейробиологии, и может быть использовано для частичного восстановления активности нейронных сетей in vitro после гибели части функционально значимых нейронов под действием стресс-факторов. Для этого в отдаленном посттравматическом периоде в течение 12 дней на поврежденную нейронную культуру диссоциированных клеток гиппокампа при значительном повреждении не более 80% указанных клеток в условиях, исключающих возможность их спонтанной регенерации, воздействуют нейротрофическим фактором головного мозга. Способ позволяет частично восстановить функциональную активность нейронных сетей при его биологической безопасности, простоте и доступности. 2 з.п. ф-лы, 3 ил., 2 пр.
1. Способ частичного восстановления функциональной активности нейронных сетей in vitro в условиях их значительного повреждения путем воздействия нейротрофином на поврежденную нейронную культуру, характеризующийся тем, что в качестве нейротрофина используют нейротрофический фактор головного мозга, которым в отдаленный посттравматический период в течение 12 дней воздействуют на поврежденную культуру диссоциированных клеток гиппокампа при значительном повреждении не более 80% клеток указанной культуры в условиях, исключающих возможность спонтанной регенерации клеток культуры гиппокампа.
2. Способ по п. 1, отличающийся тем, что на поврежденную диссоциированную культуру клеток гиппокампа в результате моделирования острой нормобарической гипоксии in vitro путем замены на 10 мин нормоксической культуральной среды на культуральную среду, подвергнутую в течение 10 мин вытеснению кислорода аргоном, с возвратом прежней культуральной среды, на шестой день постгипоксического периода начинают воздействие нейротрофическим фактором головного мозга в концентрации 1,0 нг/мл, которое осуществляют аппликацией в культуральную среду указанным фактором в течение 12 дней.
3. Способ по п. 1, отличающийся тем, что на поврежденную диссоциированную культуру клеток гиппокампа в результате моделирования глюкозной депривации in vitro путем замены на 120 мин нормоксической культуральной среды на культуральную среду, подготовленную без содержания глюкозы, пирувата и лактата, с возвратом прежней культуральной среды, на шестой день после моделирования глюкозной депривации начинают воздействие нейротрофическим фактором головного мозга в концентрации 1,0 нг/мл, которое осуществляют аппликацией в культуральную среду указанным фактором в течение 12 дней.
| RU 24346366 C2, 27.11.2011 | |||
| US 2014314721 A1, 23.10.2014 | |||
| ЛИЩУК В.А | |||
| и др | |||
| Стволовые клетки: исследования и практика // Валеология, n.2, 2003 [он-лайн] [Найдено 2009.09.11] найдено из Интернет: http://valeo.edu.ru/data/joumal/issue.php?id=20032 | |||
| CASTILLO L | |||
| et al | |||
| "Characterization of proliferation and differentiation of EGF-responsive striatal and septal precursor cells" | |||
| Int J Dev Neurosci | |||
| Способ и приспособление для нагревания хлебопекарных камер | 1923 |
|
SU2003A1 |
Авторы
Даты
2016-08-10—Публикация
2015-07-01—Подача