Изобретение относится к биотехнологии и может быть использовано для получения рекомбинантного человеческого фолликуло-стимулирующего гормона.
Фолликуло-стимулирующий гормон (ФСГ) - гетеродимерный гормон, продуцируемый и секретируемый в кровоток аденогипофизом. ФСГ играет важную роль в репродуктивных процессах, таких как созревание фолликулов и овуляция. В комплексе с лютеинезирующим гормоном (ЛГ) ФСГ регулирует созревание яйцеклеток и сперматогенез. Белок входит в группу гликопротеиновых гормонов, включающую также лютеинезирующий гормон (ЛГ), хорионический гонадотропин (ХГ) и тиреотропный гормон (ТТГ). Димер ФСГ состоит из двух субъединиц - α (14 кД) и β (17 кД). α субъединица является общей для всех гормонов этой группы, а β - специфической для каждого гормона, и в основном определяющей его связывание с рецепторами и биологическую активность. Как и у большинства секретируемых белков, первичная аминокислотная последовательность каждой субъединицы включает сигнальную последовательность, которая впоследствии удаляется во время процессинга и секреции белка (Pierce JG, Parsons TF (1981), "Glycoprotein hormones: structure and function". Annu. Rev. Biochem., 50: 465-495). Обе субъединицы синтезируются в одних и тех же клетках, после чего подвергаются первичному N-гликозилированию по аспарагиновым остаткам в эндоплазматическом ретикулуме. α субъединица имеет 2 карбогидратные цепи, связанные с Asn 52 и Asn 78; β субъединица имеет 2 карбогидратные цепи, связанные с Asn 7 и Asn 24. Вторичные модификации карбогидратных цепей включают образование разветвленных структур на основе сиаловых кислот. Различные формы и степень сиалилирования карбогидратных цепей обусловливают наличие ряда гликоформ, создавая микрогетерогенность гормона (Fares F.A. et al. (1992). "Design of a long-acting follitropin agonist by fusing the C-terminal sequence of the chorionic gonadotropin beta subunit to the follitropin beta subunit". Proc Natl Acad Sci USA; 89(10): 4304-8). Гликозилированные α и β субъединицы связываются нековалентными связями и уже в форме димера секретируются клеткой. Гликозилирование играет большую роль в формировании димеров, образовании третичной и четвертичной структур белка и в секреции гормона клеткой. Степень гликозилирования и, в частности, сиалилирования определяет биологическую активность гормона в отношении клеток-мишеней и скорость клиренса (инактивации и выведения гормона из кровотока) (Ulloa-Aguirre A. et al. (1995). "Follicle-stimulating isohormones: characterization and physiological relevance". Endocr Rev.; 16(6): 765-87). Анализ изогормонов рекомбинантного ФСГ выявил зависимость in vivo биоактивности от изоэлектрической точки (pI). Изогормоны с pI в границах от 3 до 5 в 100-200 раз превышают по биологической активности изогормоны с pI от 5,5 до 6,0. (Mulders J.W. et al. (1997). "Prediction of the in vivo Biological Activity of Human Recombinant Follicle Stimulating Hormone Using Quantitative Isoelectric Focusing". Biologicals, 25(3): 269-81)
В клинике гормон используют для корректировки ановуляции, а также для вспомогательных репродуктивных методик. Существует 2 класса фармацевтических препаратов, содержащих ФСГ: полученные из мочи постменопаузальных женщин (менотропины, урофоллитропины) и полученные рекомбинантным путем. Мочевые препараты ФСГ содержат как следовые количества ЛГ, так и другие белки, не ассоциированные с гонадотропинами. (Bassett R. et al. (2005). "Comparative characterization of a commercial human chorionic gonadotrophin extracted from human urine with a commercial recombinant human chorionic gonadotrophin". Curr Med Res Opin.; 21(12): 1969-76).
Рекомбинантный человеческий ФСГ был разработан в середине 90-х годов (Howles С.М. et al. (1996). "Genetic engineering of human FSH". Hum Reprod Update; 2(2): 172-91) и сразу получил признание как имеющий преимущества перед менотропинами. Он отличается большей чистотой и отсутствием различных примесей, что обусловливает высокую воспроизводимость в производстве различных серий препарата (Horsman G. et al. (2000). "A biological, immunological and physico-chemical comparison of the current clinical batches of the recombinant FSH preparations Gonal-F and Puregon." Hum Reprod.; 15(9): 1898-902).
Известны две основные формы рекомбинантного человеческого ФСГ - Фоллитропин α и Фоллитропин β, продуцируемые и секретируемые в культуральную среду генетически модифицированными клетками яичника китайского хомячка СНО.
Известен способ создания эукриотических продуцентов рекомбинантных человеческих гетеродимерных гормонов, в том числе ФСГ, для получения Фоллитропина α (Chappel, S.C. et al. (1992). "Expression of human gonadotropins by rDNA methods." In "Humans in Gynecological Endocrinology", Parthenon Press, Carnforth, UK, 179-184; патент США US 5,240,832), основанный на создании двух плазмид, экспрессирущих α и β субъединицы ФСГ и котрансфекции данных плазмид в СНО dhfr-клетки. Первая плазмида содержит полноразмерный ген α (содержащий все экзоны и интроны) и ген dhfr как маркер для селекции и амплификации. Вторая плазмида содержит частичный ген β. Гены α и β клонируются из человеческой геномной библиотеки. Экспрессия генов субъединиц находится под контролем Металлотеонеинового промотора (МТ), не являющегося наиболее сильным для экспрессии белков. Дизайн плазмид основан на предпосылке, что интроны содержат энхансерные элементы, способствующие повышению экспрессии белка. Для получения продукта клетки-продуценты культивируются в биореакторе на микроносителях как адгезионная культура. При данном способе уровень секреции ФСГ клетками-продуцентами в среднем составляет 1 пкг/клетку в день, что соответствует 12,6 МЕ/106 клеток в день. Способ имеет ряд недостатков. Известно, что интроны могут содержать регуляторные элементы как положительно (enhancers), так и отрицательно (silencers) влияющие на экспрессию кодируемого белка, что может привести к снижению или полной потере его экспрессии. При описании данного способа не указывается, на протяжении скольких пассажей сохраняется продукция целевого белка.
Известен другой способ создания продуцента рекомбинантного человеческого ФСГ на основе СНО клеток, являющийся основой для создания Фоллитропина β (Olijve W. et al. (1996). "Molecular biology and biochemistry of human recombinant follicle stimulating hormone" Molecular Human Reproduction, 2(5), 371-382). Ген α субъединицы, включающий некоторые интроны, и кДНК (кодирующую ДНК) β субъединицы клонируют в вектор pKMS, созданный на основе вектора pBR327. Экспрессия генов находится под контролем раннего промотора SV40 и MT-II (металлотеонеиновый промотор), соответственно. Отбор клонов с высокой копийностью генов ФСГ производят при помощи котрансфекции вспомогательной селекционной плазмиды pAG60/MT2, содержащей ген металлотеонеина, обеспечивающей резистентность к тяжелым металлам, и дальнейшей селекции в присутствии Cd2+. Продуктивность линии-продуцента при культивировании в биореакторе на микроносителях составляет 8 МЕ/мл в день при плотности клеток 106/мл или 50-80 МЕ/мл в день при плотности 107/мл, что соответствует 5-8 МЕ/106 клеток в день. Данный способ обладает теми же недостатками, что и вышеописанный способ создания плазмид для экспрессии Фоллитропина α - выбор неоптимальных промоторов для экспрессии гетерологического белка, а также наличие возможных отрицательных элементов регуляции в присутствующих элементах интронов генов субъединиц ФСГ. Стабильность данной линии подтверждается интеграцией плазмиды в геном клеток-продуцентов с помощью флуоресцентной гибридизации in situ, однако, не указывается, на протяжении скольких пассажей сохраняется продукция ФСГ.
Известны способы повышения биологической активности рекомбинантного ФСГ за счет модификации последовательностей субъединиц. Модификации включают внесение мутаций в аминокислотную последовательность субъединиц, направленные на увеличение сайтов гликозилирования (заявки на патент США 2008/0280832А и 2005/0100289 A1) или добавление СТР (carboxy terminal peptide) β субъединицы человеческого хориотропного гормона (ХГ), обладающего дополнительными сайтами гликозилирования, к β-субъединице ФСГ (патенты США 5,538,835 и 5,585,345).
Известен наиболее близкий по техническому решению к заявленному изобретению способ создания продуцента ФСГ (заявка на патент США 2009/0291473 A1). При данном способе для экспрессии ФСГ кДНК субъединиц ФСГ клонируют в вектор pE-hygr. кДНК α субъединицы получают путем ПЦР из кДНК библиотеки человеческой плаценты, а кДНК β субъединицы из кДНК библиотеки человеческого гипофиза. Однако, данный способ обладает рядом недостатков: промотор EF-1, использованный для индукции экспрессии обеих субъединиц, является слабым промотором для экспрессии белков. Продуктивность данной линии, адаптированной к росту в суспензии в бессывороточной среде, не превышает 12 МЕ/106 клеток в день. Основной акцент в данной патентной заявке сделан на способе очистки конечного продукта, а не на создании оптимальной экспрессионной системы для увеличения продуктивности линии-продуцента. Стабильность продукции ФСГ линией-продуцентом в данной заявке не упоминается.
Задачей изобретения является создание стабильной линии клеток CHO-продуцента человеческого фолликуло-стимулирующего гормона (ФСГ) с повышенной продуктивностью не менее 1,5 мкг/106 клеток в день (что соответствует 18 МЕ/106 клеток в день).
Поставленная задача решается за счет клеточной линии huFSHIK - высокопродуктивной стабильной линии-продуцента рекомбинантного человеческого афолликуло-стимулирующего гормона, созданной на основе линии CHO K1 DXB11, геном которой содержит экспрессионную плазмиду pcDNA/FSHα, состоящую из - последовательности Козак длиной 9 п.о., синтетической последовательности, кодирующей полноразмерную α субъединицу человеческого ФСГ длиной 348 п.о., включающую сигнальный пептид, стоп кодон длиной 3 п.о., фрагмента плазмиды pcDNA-TOPO длиной 5407 п.о., содержащего промотор-энхансер цитомегаловируса (CMV), сигнал полиаденилирования тимидин киназы вируса простого герпеса (HSV ТК), ген устойчивости к антибиотику неомицин (neo), промотор и сигнал полиаденилирования вируса SV40; экспрессионную плазмиду pOptiVEC/FSHβ, состоящую из - последовательности Козак длиной 9 п.о., синтетической последовательности, кодирующей полноразмерную β субъединицу человеческого ФСГ, длиной 387 п.о., включающую сигнальный пептид, стоп кодон длиной 3 п.о., фрагмента плазмиды pOptiVEC-TOPO длиной 4402 п.о., содержащего промотор-энхансер цитомегаловируса (CMV), ген фактора устойчивости трансфецированных клеток к воздействию метотрексата - дигидрофолатредуктазы (DHFR) и регуляторные элементы для экспрессии DHFR - последовательность IRES вируса энцефаломиокардита (EMCV), обеспечивающую бицистронную экспрессию в животных клетках, сигнал полиаденилирования, ген устойчивости к антибиотику ампициллин и бактериальный промотор гена устойчивости к ампициллину.
Технический результат заявленной клеточной линии huFSHIK заключается в высокой продуктивности ФСГ, превышающей в 1.5 раза продуктивность известного продуцента, и стабильно секретирующей ФСГ в культуральную среду, не содержащую продуктов животного происхождения, на протяжении 30 пассажей; а также в оптимизации культивирования этой линии как в условиях монослойной, так и суспензионной культуры. Перечисленные свойства делают ее экономически выгодной для широкого применения в биофармацевтическом производстве для получения продукта при различных методах культивирования. Линия huFSHIK депонирована в Российской коллекции клеточных культур при Институте Цитологии РАН под номером РККК (П) 744Д.
Создание экспрессионных плазмид.
Феномен полиморфизма генов может привести к незначительным вариациям нуклеотидных последовательностей одного и того же гена у различных индивидуумов. В связи с этим клонирование терапевтических генов или кДНК из геномных или кДНК библиотек представляется не оптимальным. Проект " Consensus CDS" позволил собрать и обобщить большое количество данных о нуклеотидных последовательностях кДНК человеческих генов (http://www.ncbi.nlm.nih.gov/CCDS/CcdsBrowse.cgi). Аминокислотные последовательности, определенные по консенсусным последовательностям кДНК генов наиболее точно отражают реальные аминокислотные последовательности белков, которые могут присутствовать в подавляющем большинстве человеческого населения. Представляется наиболее целесообразным создавать рекомбинантные терапевтические белки именно на основе таких консенсусных аминокислотных последовательностей. Синтезированные гены оптимально подходят для осуществления этой цели. Небольшая молекулярная масса субъединиц ФСГ позволяет синтезировать последовательности их кДНК с большой точностью. Еще одним преимуществом синтетических генов является возможность оптимизации кодонов для оптимальной экспрессии белка в клетке-хозяине определенного вида.
В предлагаемом изобретении экспрессионные плазмидные ДНК создают с использованием нуклеотидных последовательностей, кодирующих α и β субъединицы ФСГ, синтезированных на основе консенсусных аминокислотных последовательностей с учетом оптимизации кодонов для повышенной экспрессии в млекопитающих.
1. Экспрессионная плазмида pcDNA/FSHα (Фиг.1) состоит из фрагмента ДНК, содержащего последовательность Козак длиной 9 п.о., синтетическую последовательность, кодирующую полноразмерную α субъединицу человеческого FSH длиной 348 п.о., включающую сигнальный пептид, стоп кодон длиной 3 п.о., и фрагмента плазмиды pcDNA-TOPO длиной 5407 п.о., содержащего
- регуляторные элементы, обеспечивающие экспрессию ФСГ: промотор-энхансер цитомегаловируса (CMV) и сигнал полиаденилирования тимидин киназы вируса простого герпеса (HSV ТК);
- ген устойчивости к антибиотику неомицин (neo) для селекции стабильных клеточных линий генетицином (G418), промотор и сигнал полиаденилирования вируса SV40 для его экспрессии;
- ген устойчивости к антибиотику ампициллин и бактериальный промотор гена устойчивости к ампициллину, позволяющие проводить препаративную наработку плазмиды в E.coli.
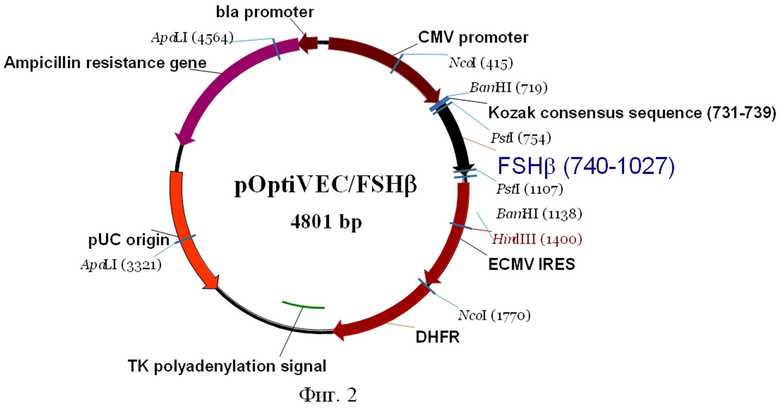
2. Экспрессионная плазмида pOptiVEC/FSHβ (Фиг.2) состоит из фрагмента ДНК, содержащего последовательность Козак длиной 9 п.о., синтетическую последовательность, кодирующую полноразмерную β субъединицу человеческого FSH, длиной 387 п.о., включающую сигнальный пептид, стоп кодон длиной 3 п.о., и фрагмента плазмиды pOptiVEC-TOPO длиной 4402 п.о., содержащего
- регуляторные элементы, обеспечивающие экспрессию ФСГ: промотор-энхансер цитомегаловируса (CMV);
- ген фактора устойчивости трансфецированных клеток к воздействию метотрексата - дигидрофолатредуктазы (DHFR) и регуляторные элементы для экспрессии DHFR - последовательность IRES вируса энцефаломиокардита (EMCV), обеспечивающую бицистронную экспрессию в животных клетках, и сигнал полиаденилирования;
- ген устойчивости к антибиотику ампициллин и бактериальный промотор гена устойчивости к ампициллину, позволяющие проводить препаративную наработку плазмиды в E.coli.
Получение клеточной линии huFSHIK, экспрессирующей человеческий ФСГ на основе линии клеток яичника китайского хомячка CHO K1 DXB11.
Исходным материалом для создания продуцента ФСГ является линия клеток яичников китайского хомячка CHO K1 DXB11, полученная из Российской коллекции клеточных культур (РККК) при Институте Цитологии РАН (Санкт-Петербург, Россия). Исходную линию культивируют в среде F12 с добавлением 10% FBS (эмбриональная телячья сыворотка) как адгезионную культуру при 37°C с 5% содержанием CO2. Пересев осуществляют 0.25% раствором трипсина каждые 2-3 дня с кратностью рассева 1:10 или 5×105 клеток на флакон с поверхностью 25 см2.
В клеточной линии CHO K1 DXB11 одна аллель гена dhfr делегирована, другая подверглась мутации с потерей функции. (Urlaub and Chasm 1980; Urlaub et al. 1983). Линия ауксотрофна по гипоксантину или аденину, глицину, тимидину и пролину.
Фермент дегидрофолатредуктаза (DHFR) катализирует редукцию 5, 6-дигидрофолата до 5, 6, 7, 8-тетрадегидрофолата, необходимого для синтеза ДНК. Клетки линии CHO K1 DXB11 не обладают активностью DHFR и растут только в среде с добавлением пуриновых предшественников гипоксантина и тимидина, пока они стабильно не трансфецированы вектором, содержащим ген dhfr.
Линию CHO K1 DXB11 адаптируют к росту в среде ДМЕМ с добавлением смеси антибиотиков и антимикотиков до конечной концентрации: 100 ед/мл пенициллина, 100 мкг/мл стрептомицина и 250 нг/мл амфотерицина B; 2 mM глутамина; 1:100 100-кратного раствора смеси заменимых аминокислот; добавки HT (содержащей гипоксантин и тимидин) до конечной концентрации: 100 мкМ гипоксантина и 16 мкМ тимидина. Линию тестируют на отсутствие активности DHFR (дегидрофолатредуктазы), то есть ауксотрофность по гипоксантину и тимидину: исключение добавки HT из среды приводит к постепенной остановке деления и последующей гибели клеток. Линию также проверяют на отсутствие микоплазменной контаминации окрашиванием флуоресцентными красителями ДНК DAPI и Hoechst.
Экспрессионные плазмиды pcDNA/FSHα и pOptiVEC/FSHβ котрансфецируют в клетки линии CHO K1 DXB11 методом липосомальной трансфекции. После двойной селекции в селекционной среде определенного химического состава не содержащей гипоксантина и тимидина с добавлением селекционного агента генетицин (G418, 600 мкг/мл) получают пул стабильно трансфецированных клеток. Дальнейшую амплификацию экспрессионных кассет осуществляют посредством культивирования клеток в присутствии возрастающих доз (50-100 нМ) метотрексата (МТХ). Полученный пул клеток, устойчивый к МТХ, клонируют методом лимитирующих разведении. Полученные из единичных клеток клоны анализируют методом иммуноферментного анализа. Выбирают 5-6 клонов с уровнем секреции ФСГ 0,6-1 мкг/мл (8-12 МЕ/мл). Из отобранных клонов выбирают клон с максимальным уровнем начальной продуктивности не менее 1 мкг/мл (12 МЕ/мл), стабильной экспрессией целевого белка на протяжении 30 пассажей, а также со способностью адаптироваться к росту и продукции ФСГ в суспензии. Клон размножают на ранних пассажах (3-5) и сохраняют методом криоконсервирования для последующего создания мастер банка.
Культуральные свойства
Клетки отобранного клона выращивают в среде ДМЕМ с добавлением 1:100 100х раствора антибиотики/антимикотики (А/А), 2 mM глутамина, 1:100 100х раствора заменимых аминокислот (Gibco), 10% диализованной FBS (Sigma), 100 нМ метотрексата (МТХ, Sigma) при 37, 5% CO2 как адгезионную культуру. Пересев монослоя осуществляют 0.25% раствором трипсина с кратностью 1:10 каждые 3-4 дня. Начальный фенотип K1, присущий родительской линии, подтверждают отсутствием роста в среде, не содержащей пролин. Подтверждают отсутствие грибов, бактерий и микоплазмы в культуре. Продукцию человеческого ФСГ определяют методами ИФА и иммуноблота.
Продукция ФСГ сохраняется на начальном уровне, по крайней мере, в течение 30 пассажей (3-х месяцев) при культивировании с МТХ (в селективных условиях) и, по крайней мере, в течение 15 пассажей (1.5 месяцев) без МТХ (в неселективных условиях), что указывает на высокую стабильность геномных копий целевых генов. Высокая стабильность позволяет сделать заключение о создании линии, потенциально применимой в фармацевтической промышленности для производства лекарственных форм ФСГ. Линия получает название huFSHIK.
Линию huFSHIK адаптируют к росту в суспензии в бессывороточных средах. Продуктивность суспензионной культуры составляет 1,5 мкг/106 клеток в день (18 МЕ/106 клеток в день), что в 1.5 раза превышает заявленную продуктивность известного аналога-продуцента ФСГ, описанного выше.
Криоконсервирование
Клетки замораживают в среде, содержащей 90% FBS и 10% DMSO в концентрации 2 млн/мл и хранят в жидком азоте. Размораживают быстрым оттаиванием пробирки в водяной бане при 37°C и последующим разбавлением клеток 5 мл нагретой среды. Через 24 часа после посева среду заменяют на свежую. Жизнеспособность после размораживания составляет 80% по окрашиванию трипановым синим.
Изобретение иллюстрируют графические материалы:
Фиг.1. Схема созданной плазмиды pcDNA/FSHα.
На фиг.1 показана схематическая карта экспрессионного вектора pcDNA/FSHα.
Обозначения:
Ampicillin (bla) resistance gene - ген устойчивости к ампициллину
bla promoter - бактериальный промотор гена устойчивости к ампициллину
FSHα - синтетическая последовательность, кодирующая α субъединицу FSH
CMV Promoter - конститутивный промотор цитомегаловируса, регулирующий экспрессию FSHα
Kozak - сайт связывания рибосом - последовательность Козак, оптимизирующая экспрессию FSHα
ТК polyA signal - сигнал полиаденилирования тимидин киназы вируса простого герпеса (HSV ТК)
Neomycin resistance gene - ген устойчивости к антибиотику неомицин (neo) для селекции стабильных клеточных линий генетицином (G418)
SV40 early promoter, SV40 polyA signal - регуляторные элементы для экспрессии гена neo
pUC origin - область начала репликации (ориджин) плазмид семейства pUC.
Фиг.2. Схема созданной плазмиды pOptiVEC/FSHβ.
На фиг.2 показана схематическая карта экспрессионного вектора pcDNA/FSHβ.
Обозначения:
Ampicillin (bla) resistance gene - ген устойчивости к ампициллину
bla promoter - бактериальный промотор гена устойчивости к ампициллину
FSHβ - синтетическая последовательность, кодирующая β субъединицу FSH
CMV Promoter - конститутивный промотор цитомегаловируса, регулирующий экспрессию FSHβ
Kozak - сайт связывания рибосом - последовательность Козак, оптимизирующая экспрессию FSHβ
ECMV IRES - сайт связывания рибосом - последовательность IRES
энцефаломиокардита, обеспечивающая бицистронную экспрессию в животных клетках.
DHFR (дигидрофолатредуктаза) - последовательность фактора устойчивости трансфицированных клеток к воздействию метотрексата
TK polyA signal - сигнал полиаденилирования
pUC origin - область начала репликации (ориджин) плазмид семейства pUC.
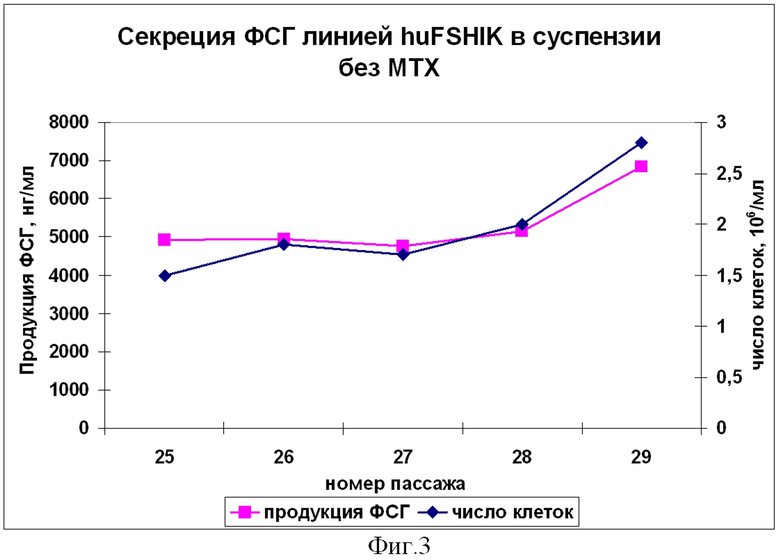
Фиг.3. Определение стабильности секреции ФСГ линией huFSHIK в суспензии в бессывороточной среде без МТХ методом ИФА. Проведено 29 пассажей: первые 17 с МТХ и последующие 11 без МТХ. На графике отображена продукция ФСГ в течение последних 5 пассажей без МТХ (пассажи 25-29) и соответствующие количества жизнеспособных клеток на 3-4 день культивирования при начальной посевной плотности 3×105/мл.
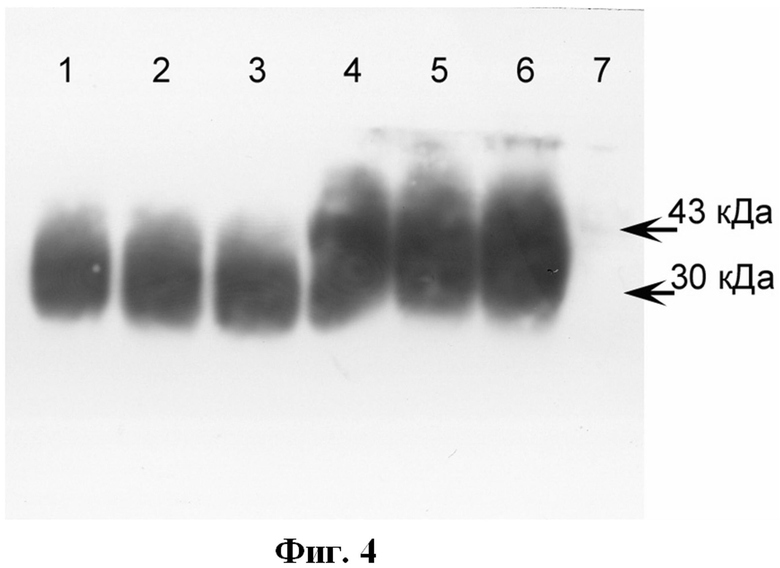
Фиг.4. Определение ФСГ в культуральной бессывороточной среде от клеточной линии huFSHIK антителами против β субъединицы ФСГ методом иммуноблота.
Стрелками указано положение белковых маркеров с электрофоретической подвижностью в районах 43 и 30 кДа.
Дорожки геля 1-3: культуральная среда от линии huFSHIK на пассажах 3, 15, 23 (восстанавливающие условия проведения электрофореза - с добавлением β-меркаптоэтанола, с нагреванием).
Дорожки геля 4-6: культуральная среда от линии huFSHIK на пассажах 3, 15, 23 (невосстанавливающие условия проведения электрофореза - без добавления бета-меркаптоэтанола, без нагревания).
Дорожка геля 7: культуральная среда от родительской линии CHO K1 DXB11.
Изобретение иллюстрируют примеры:
Пример 1. Получение плазмидной ДНК pcDNA/FSHα, кодирующей α субъединицу человеческого фолликуло-стимулирующего гормона.
Нуклеотидную последовательность для синтеза α субъединицы определяют на основе аминокислотной последовательности (Р01215, Gene Bank) полученной путем трансляции консенсус-CDS α - субъединицы человеческих гликопротеиновых гормонов (CCDS5007.1, Gene Bank) и обозначенной как SEQ ID3, путем оптимизации кодонов для экспрессии в млекопитающих. Результирующую нуклеотидную последовательность обозначают как SEQ ID1. Синтез олигонуклеотида производят на синтезаторе Applied Biosystems ABI 3900 (США). Полученный олигонуклеотид клонируют в промежуточный вектор pAL-TA (Евроген, Россия) методом TA клонирования (http://evrogen.ru/kit-user-manuals/pAL-TA.pdf). фрагмент результирующего вектора, содержащий SEQ ID1, амплифицируют методом ПЦР при следующих условиях:
95°C - 15'', 60°C - 15'', 72°C - 45'' в течение 20 циклов, используя 10 нг плазмидной ДНК pAL-TA (с целевой вставкой) в качестве матрицы, Tersus полимеразу (Евроген, Россия) и следующие праймеры:
Alpha-dir: 5'-GCCGCCACCATGGACTACTATAGGAAGTACGC и
Alpha-rev: 5'-GTTAGGACTTGTGATAGTAGCAGGTGCTAC.
Для оптимальной экспрессии перед инициирующим кодоном ATG в состав прямого праймера включают последовательность Kozak GCCGCCACC (M.Kozak, 1987). В состав обратного праймера в конце последовательности включают стоп кодон TTA для успешного окончания трансляции.
Продукт ПЦР субклонируют в TOPO сайты векторов pcDNA-TOPO и pOptiVEC-TOPO методом TA клонирования.
Результирующие векторы получают названия A31 и A04 соответственно.
Корректность нуклеотидной последовательности α субъединицы ФСГ в конечных векторах A31 и A04 подтверждают при помощи секвенирования на автоматическом секвенаторе ABI 3730 XL (США), используя CMVf праймер:
5'-CGCAAATGGGCGGTAGGCGTG-3'
В дальнейшем вектор A31, показавший лучшие результаты (в сочетании с вектором B04), по экспрессии целевого белка (70 нг/мл), чем комбинация A04 с B31 (40 нг/мл), получает окончательное название pcDNA/FSHα.
Плазмидную ДНК для клонирования и последующей трансфекции амплифицируют путем трансформации клеток E.coli XL I-Blue no протоколу, описанному на сайте фирмы Евроген, Россия (http://evrogen.ru/kit-user-manuals/Comp_Cells.pdf). ДНК для последующей трансфекции выделяют и очищают при помощи набора для выделения плазмидной ДНК Plasmid Miniprep (Евроген, Россия) по протоколу фирмы Евроген (http://evrogen.ru/products/P-DNA/P-DNA.shtml).
Полученная экспрессионная плазмидная ДНК pcDNA/FSHα кодирует α субъединицу человеческого ФСГ и имеет размер 5767 пар нуклеотидных оснований.
Пример 2. Получение плазмидной ДНК pOptiVEC/FSHR, кодирующей β субъединицу человеческого фолликуло-стимулирующего гормона.
Нуклеотидную последовательность для синтеза β субъединицы определяют на основе аминокислотной последовательности (P01225, Gene Bank) полученной путем трансляции консенсус-CDS β - субъединицы человеческого ФСГ (CCDS5007.1, Gene Bank) и обозначенной как SEQ ID4, путем оптимизации кодонов для экспрессии в млекопитающих. Результирующую нуклеотидную последовательность обозначают как SEQ ID2. Синтез олигонуклеотидов производят на синтезаторе Applied Biosystems ABI 3900. Полученный олигонуклеотид клонируют в промежуточный вектор pAL-TA (Евроген, Россия) методом TA клонирования (http://evrogen.ru/kit-user-manuals/pAL-TA.pdf). Фрагмент результирующего вектора, содержащий SEQ ID2, амплифицируют методом ПЦР при следующих условиях:
95°C - 15'', 60°C - 15'', 72°C - 45'' в течение 20 циклов, используя 10 нг плазмидной ДНК pAL-TA (с целевой вставкой) в качестве матрицы, Tersus полимеразу и следующие праймеры:
beta-dir 5'-GCCGCCACCATGAAAACCCTGCAGTTCTTTTTCCTG-3'
beta-rev 5'-GTTACTCCTTCATCTCGCCGAAGCTG-3'
Для оптимальной экспрессии перед инициирующим кодоном ATG в состав прямого праймера включают последовательность Kozak GCCGCCACC (M.Kozak, 1987). В состав обратного праймера в конце последовательности включают стоп кодон TTA для успешного окончания трансляции.
Продукт ПЦР субклонируют в TOPO сайты векторов pcDNA-TOPO и pOptiVEC-TOPO методом TA клонирования. Результирующие векторы получают названия B31 и B04 соответственно.
Корректность нуклеотидной последовательности β субъединицы ФСГ в конечных векторах B31 и B04 подтверждают при помощи секвенирования на автоматическом секвенаторе ABI 3730 XL, используя CMVf праймер:
5'-CGCAAATGGGCGGTAGGCGTG-3'
В дальнейшем вектор B04, показавший лучшие результаты (в сочетании с вектором А31), по экспрессии целевого белка (70 нг/мл), чем комбинация B31 с A04 (40 нг/мл), получает окончательное название pOptiVEC/FSHβ.
Плазмидную ДНК для клонирования и последующей трансфекции амплифицируют путем трансформации клеток E.coli XL1-Blue по протоколу описанному на сайте фирмы Евроген, Россия (http://evrogen.ru/kit-user-manuals/Comp_Cells.pdf). ДНК для последующей трансфекции выделяют и очищают при помощи набора для выделения плазмидной ДНК Plasmid Miniprep (Евроген, Россия) по протоколу фирмы Евроген (http://evrogen.ru/products/P-DNA/P-DNA.shtml).
Полученная экспрессионная плазмидная ДНК pOptiVEC/FSHβ кодирует В субъединицу человеческого ФСГ и имеет размер 4801 пар нуклеотидных оснований.
Пример 3. Котрансфекция клеток CHO K1 DXB11 генетическими конструкциями pcDNA/FSHα и pOptiVEC/FSHβ и получение пула клеток, стабильно экспрессирущих ФСГ, при помощи двойной селекции.
Перед началом трансфекции определяют концентрацию генетицина (G418), подходящую для селекции, то есть ту, при которой нетрансфецированные клетки погибают за 2 недели. Концентрацию 600 мкг/мл выбирают как оптимальную. Две комбинации векторов, каждая из которых содержит одну α субъединицу и одну β субъединицу котрансфецируют в линию DXB11: А31+B04 и A04+B31.
За день до трансфекции клетки рассеивают в концентрации 105 / 500 мкл ростовой среды ДМЕМ, содержащей 10% эмбриональной телячьей сыворотки, 2 mM глутамина, 1:100 100х раствора заменимых аминокислот, раствор смеси гипоксантина и тимидина (HT) в 24-луночные культуральные планшеты (добавки фирмы Invitrogen). На следующий день проводят трансфекцию клеток, достигших 90% конфлюэнтности, трансфекционным агентом Липофектамин™ 2000 (Invitrogen). 0.4 мкг первого вектора и 0.4 мкг второго вектора разводят в 100 мкл трансфекционной среды OPTIMEM (Invitrogen); отдельно, 50 мкл липофектамина разводят в 100 мкл трансфекционной среды OPTIMEM. Затем комплексы смешивают и после 20 - минутной инкубации при комнатной температуре добавляют к клеткам. На следующий день клетки рассеивают на культуральные флаконы в ростовой среде DMEM с добавлением 1:100 100х раствора антибиотики/антимикотики (Gibco). На следующий день (через 48 часов после трансфекции) среду заменяют на селекционную: DMEM с добавлением 10% диализованной FBS, 1:100 100х раствора антибиотики/антимикотики (A/A), 2 mM глутамина, 1:100 100х раствора заменимых аминокислот, 600 мкг/мл G418. Добавку HT из селекционной среды исключают. Двойную селекцию проводят в течение двух недель со сменой селекционной среды каждые 3 дня. В качестве отрицательного контроля используют ложную трансфекцию клеток трансфекционной смесью без вектора. Через 14 дней после начала селекции клетки отрицательного контроля, поддерживаемые в селекционной среде, погибают. Трансфецированные обеими комбинациями векторов клетки через неделю после начала селекции образовывают множество колоний, которые к 17-му дню дорастают до монослоя. Экспрессию ФСГ в пуле стабильно трансфецированных клеток определяют методом ИФА, описанным в примере 4.
Пример 4. Определение секретируемого ФСГ методом иммуноферментного анализа.
Концентрацию ФСГ, секретируемого в культуральную среду, определяют иммуноферментным методом (ИФА) при помощи набора фирмы Диатех-ЭМ (Россия). В данном наборе моноклональные антитела против β субъединицы человеческого ФСГ адсорбированы на поверхности лунок планшеты. Исследуемые образцы добавляют вместе с конъюгатом моноклональных антител против α субъединицы человеческих гликопротеиновых гормонов. Таким образом, положительную реакцию дают только гетеродимеры ФСГ. Пул клеток, стабильно экспрессирущих комбинацию векторов А31 (pcDNA/FSHα) и B04 (pOptiVEC/FSHβ) секретирует в среду ФСГ в концентрации 70 нг/мл. В нетрансфецированных клетках и пулах со стабильной экспрессией одного вектора pcDNA/FSHα или одного вектора pOptiVEC/FSHβ ФСГ не обнаруживают.
Пример 5. Генная амплификация целевых последовательностей метотрексатом.
Для повышения продуктивности клеток-продуцентов проводят генную амплификацию последовательностей, кодирующих α и β субъединицы ФСГ путем селекционного культивирования стабильно экспрессирующего ФСГ пула клеток в присутствии возрастающих концентраций МТХ (50 нМ, 100 нМ). Каждый шаг селекции осуществляют в течение 4 недель, и после каждого шага амплификации клетки размножают и подвергают криоконсервированию.
Получают пул клеток, устойчивых к МТХ в концентрации 100 нМ. Клетки пула подвергают субклонированию методом лимитирующих разведении в 96-луночных культуральных планшетах. Для дальнейшего анализа выбирают только те лунки, в которых выросла только одна колония из одной клетки.
Выбирают 5-6 клонов с продуктивностью не менее 12 МЕ/мл. Тестируют клоны на стабильность продукции ФСГ при регулярном пересеве клеток и отборе проб на продукцию каждые 3-4 дня. Измеряют секретируемый ФСГ методом ИФА. Выбирают клоны, у которых уровень продукции ФСГ сохраняется неизменным, по крайней мере, в течение 30 пассажей (3 месяцев) при культивировании с МТХ и, по крайней мере, в течение 15 пассажей (1.5 месяцев) без МТХ.
Пример 6. Подбор условий культивирования и продукции ФСГ стабильными клонами-продуцентами в бессывороточных средах.
Подбирают условия для культивирования и продукции ФСГ стабильными клонами в бессывороточных средах как в условиях монослойной культуры, так и после адаптации клеток к росту в суспензии.
Монослой выращивают в ростовой среде DMEM с 10% диализованной FBS в неселекционных условиях (без МТХ). По достижении 95% конфлюэнтности среду заменяют на одну из бессывороточных сред: ExCell ACF (Sigma, США), CD CHO (Sigma), CD OPTI CHO (Gibco), CDM4, SFM4, SFM4utility (Hyclone, США), содержащих 15 мМ HEPES и не содержащих МТХ, и в дальнейшем монослой инкубируют в плотно закрытых флаконах без доступа воздуха. Замену среды осуществляют каждые 3 дня в течение 2,5 месяцев. На протяжении этого периода продукция ФСГ поддерживается на уровне 2-4 мкг/мл (24-48 МЕ/мл). Такой уровень стабильности продукции целевого белка в неселективных условиях создает потенциал для использования этих культур в биофармацевтическом производстве в роллерных бутылях в условиях с минимальными требованиями, а именно в закрытой системе без поддержания определенного уровня CO2.
Стабильные клоны также адаптируют к росту в суспензии в бессывороточных средах. Для этого монослой снимают реагентом HyQTase (Hyclone) и клетки рассеивают по 5×105/мл в смеси среды ДМЕМ, содержащей 10% FBS, с бессывороточной средой в соотношении 1:1. Клетки культивируют в культуральных флаконах для суспензионных культур при постоянном перемешивании на качалке при 37° в условиях 5% CO2. Каждые 3 дня производят замену среды путем центрифугирования клеток при 1500 об/мин в течение 5 минут и ресуспендирования клеточного осадка в свежей среде. Адаптацию к росту в бессывороточных средах проводят постепенным уменьшением процента DMEM, содержащей 10% FBS, с 50% до 25% и затем до 12.5%, после чего клетки культивируют в чистой бессывороточной среде. Клетки считают адаптированными к суспензии, когда их жизнеспособность достигает 90%, и количество клеток возрастает с 5×105/мл в среднем до 2×106/мл за 3-4 дня; то есть время удвоения составляет 36-48 часов. Выбирают клон, способный переходить в суспензию в течение 6 пассажей со временем удвоения 36 часов и продукцией ФСГ не менее 1,5 мг/106 клеток в день, что соответствует 18 МЕ/106 клеток в день. После адаптации к суспензии плотность посева уменьшают до 3×105/мл. Стабильность секреции ФСГ в суспензии в течение первых 17 пассажей с МТХ и последующих 12 пассажей без МТХ подтверждают ИФА отобранных проб. Результаты ИФА проб, отобранных на последних 5 пассажах без МТХ (пассажи 25-29) показаны на Фиг.3. В среднем, уровень ФСГ составляет около 5 мкг/мл на 3-4 день культивирования, что при пересчете на 10 клеток в день составляет 2,046 мкг/мл и соответствует около 25 МЕ/106 клеток в день. Таким образом, получают высокопродуктивную клеточную линию, стабильно секретирующую рекомбинантный человеческий ФСГ в культуральную среду, не содержащую продуктов животного происхождения, как в монослое, гак и в суспензии. Линия получает название huFSHIK. Высокий потенциал роста линии как в условиях адгезионной, так и суспензионной культуры делает возможным ее широкое применение в биофармацевтическом производстве для получения продукта при различных методах культивирования.
Пример 7. Определение идентичности рекомбинантного ФСГ методом иммуноблота.
Идентичность ФСГ, секретируемого линией huFSHIK, и количественно определенного методом ИФА, подтверждают методом иммуноблота.
Электрофоретическое разделение белков из культуральной жидкости от линии huFSHIK осуществляют по стандартной методике Лэммли (Laemmli U.K., 1970). К 40 мкл, содержащим 200 нг ФСГ по результатам ИФА, добавляют 5-кратный буфер Лэммли. Для определения гетеродимерной формы ФСГ используют невосстанавливающие условия: образцы разводят в буфере Лэммли без добавления β-меркаптоэтанола, и образцы не нагревают. Для идентификации α и β субъединиц используют восстанавливающие условия: образцы разводят в буфере Лэммли с добавлением 500 мМ β-меркаптоэтанола и подвергают термической обработке при 95° в течение 5 мин. Разделение проводят в 12% ПААГ по стандартной методике при 60 В для концентрирования белков и при 100 В для их дальнейшего разделения. Перенос белков на нитроцеллюлозную мембрану (0.22 мкм, Millipore, США) осуществляют методом полусухого переноса при постоянном напряжении 20 В в течение 30 мин. Мембрану инкубируют с моноклональными антителами к α или β субъединице человеческого ФСГ (Sigma, США), и затем с вторичными анти-мышиными антителами, конъюгированными с пероксидазой (Jackson ImmunoResearch Laboratories, США). Детекцию белка осуществляют методом усиленной хемилюминесценции, используя систему ECL + (Amersham PharmaciaBiotech, Великобритания). В качестве отрицательного контроля используют кондиционированную культуральную среду от родительских клеток СНО К1 DXB11, не экспрессирующих ФСГ. Результаты представлены на Фиг.4.




Изобретение относится к области биотехнологии, биологии и медицины. Предложена клеточная линия huFSHIK - продуцент рекомбинантного человеческого фолликулостимулирующего гормона (ФСГ), секретируемого в культуральную жидкость. В суспензионной культуре линия секретирует ФСГ в концентрации 18 МЕ/106 клеток в день. Настоящее изобретение оптимизирует систему экспрессии ФСГ, что приводит к увеличению его продукции и повышению эффективности и экономичности производства ФСГ в медицинских целях. 4 ил., 7 пр.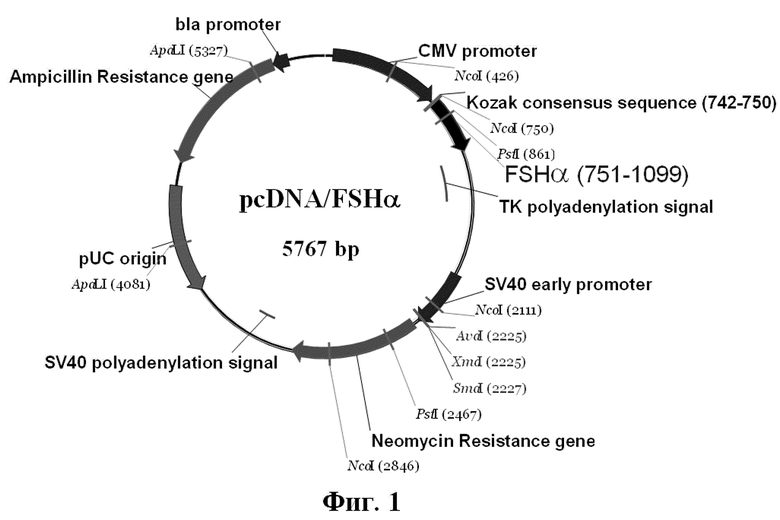
Клеточная линия huFSHIK - высокопродуктивная стабильная линия-продуцент рекомбинантного человеческого фолликуло-стимулирующего гормона, созданная на основе линии CHO K1 DXB11, геном которой содержит экспрессионную плазмиду pcDNA/FSHα, состоящую из последовательности Козак длиной 9 п.о., синтетической последовательности, кодирующей полноразмерную α субъединицу человеческого ФСГ, длиной 348 п.о., включающую сигнальный пептид, стоп кодон длиной 3 п.о., фрагмента плазмиды pcDNA-TOPO длиной 5407 п.о., содержащего промотор-энхансер цитомегаловируса (CMV), сигнал полиаденилирования тимидин киназы вируса простого герпеса (HSV TK), ген устойчивости к антибиотику неомицин (neo), промотор и сигнал полиаденилирования вируса SV40; экспрессионную плазмиду pOptiVEC/FSHβ, состоящую из последовательности Козак длиной 9 п.о., синтетической последовательности, кодирующей полноразмерную β субъединицу человеческого ФСГ, длиной 387 п.о., включающую сигнальный пептид, стоп-кодон длиной 3 п.о., фрагмента плазмиды pOptiVEC-TOPO длиной 4402 п.о., содержащего промотор-энхансер цитомегаловируса (CMV), ген фактора устойчивости трансфецированных клеток к воздействию метотрексата- дигидрофолатредуктазы (DHFR) и регуляторные элементы для экспрессии DHFR-последовательность IRES вируса энцефаломиокардита (EMCV), обеспечивающую бицистронную экспрессию в животных клетках, сигнал полиаденилирования, ген устойчивости к антибиотику ампициллин и бактериальный промотор гена устойчивости к ампициллину.
| RU 2008144290 A, 20.05.2010 | |||
| Штамм гибридных культивируемых клеток животных MUS мUSсULUS L.-продуцент моноклонального антитела, реагирующего с @ -субъединицей ХГЧ, ЛГЧ, ТТГЧ и ЛГ и ХГ лощади | 1990 |
|
SU1721090A1 |
Авторы
Даты
2013-12-27—Публикация
2012-02-22—Подача