Область, к которой относится изобретение.
Настоящее изобретение относится в целом к иммунологии и медицине и, более конкретно, к фармацевтическим композициям и способам модуляции активации эндотелиальных клеток и молекул клеточной адгезии, участвующих в иммунных реакциях врожденной и приобретенной иммунной системы, которые могут применяться при лечении инфекционных и неинфекционных состояний, расстройств и заболеваний.
Предпосылки создания изобретения.
При многих инфекционных состояниях и неинфекционных расстройствах и патологиях локализованное или системное воспаление наблюдается в качестве основного (основополагающего) признака. Воспаление является врожденным иммунным ответом и необходимой защитной реакцией на инфекцию, поражение ткани и травму. Главной задачей воспаления является предупреждение инфильтрации инфекционных агентов или локализация и ликвидация инфекции и заживление окружающих (соседних) тканей. Воспалительный ответ включает экссудативный и клеточный процессы. Экссудативный процесс включает движение жидкости, содержащей белки, такие как фибрин и иммуноглобулины, дилатацию кровеносных сосудов выше и сужение (констрикцию) кровеносных сосудов ниже места инфекции или поражения и повышенную капиллярную проницаемость в пораженной ткани, что приводит к общей утечке плазмы крови в ткань (отек). Клеточный процесс включает последовательность событий адгезии и активации для отдельных лейкоцитов, эндотелиальных и других типов клеток. Активация лейкоцитов и эндотелиальных клеток приводит к экстравазации лейкоцитов из сосудистой сети в инфицированную или пораженную ткань, где они ведут себя как фагоциты, удаляя бактерии и клеточный дебрис и вызывая дальнейший воспалительный или иммунный ответ. Если вредный агент сохраняется или если нарушена регуляция воспалительного или иммунного ответов, которая предупреждает иммунный гомеостаз в организме, может развиться хроническое или системное воспаление. Хроническое или системное воспаление приводит к непрерывной экстравазации лейкоцитов в ткани и высвобождению макрофагами токсинов (включая реактивные кислородные частицы), которые поражают ткани организма.
Синдром системного воспалительного ответа ("SIRS") возникает, когда воспаление оказывает вредное воздействие на сосудистый эндотелий и основные системы органов. Системное воспаление называют "сепсисом", если оно вызвано бактериями, вирусом, грибками или паразитами. Септический шок возникает, если сепсис или SIRS приводит к гипотензии, которая сохраняется, несмотря на реанимацию адекватной жидкостью. Кровотечение может также привести к симптомам, которые являются зеркальным отражением септического шока, таким как ишемия тканей, дисфункция органа и сосудистая недостаточность. Сепсис является основной причиной заболеваемости и смертности после травмы, включая сильное кровотечение и ожоги. Каждый год более чем у 750000 человек в Соединенных Штатах развивается тяжелый сепсис и более 215000 умирают от этого.
У пациента может быть высокая степень риска развития сепсиса или появления SIRS, если пациент очень молод (недоношенный новорожденный) или очень стар или у него наблюдается одно из нижеприведенных нарушений: раны, или поражения, или ожоги; опасное заболевание; тяжелая внебольничная (домашняя) пневмония; внутрибрюшинная хирургическая операция; менингит; хроническое заболевание (включая диабет, сердечную недостаточность, хроническую почечную недостаточность и хроническую обструктивную легочную болезнь); нарушенный иммунный статус (ВИЧ/СПИД, применение цитотоксических и иммуносупрессивных агентов, например, химиотерапии, радиационной терапии и стероидов); целлюлит; инфекция мочевыводящих путей; или прием алкоголя или добавление лекарства.
SIRS и сепсис представляют собой чрезмерно повышенные реакции на инфекцию и поражение. Эти повышенные реакции нарушают гомеостаз через неконтролируемый каскад воспаления, коагуляции и ослабленного фибринолиза, что вызывает системную вазодилатацию, которая приводит к пониженной перфузии органов и тканей и диссеминированному внутрисосудистому свертыванию крови (ДВС, DIC). Сильное кровотечение (геморрагия), сепсис и SIRS могут привести к глобальной тканевой гипоксии и поражению тканей, что ведет к шоку (гипотензии, несмотря на реанимацию (приведение в сознание) адекватной жидкостью) и синдрому полиорганной дисфункции ("MODS"), часто заканчиваясь смертью. Противоинфекционные агенты, реанимация (приведение в сознание) и поддерживающее лечение необязательно предотвращают дисфункцию сосудов микроваскуляторного русла или прогрессирование органной дисфункции, которая может сохраняться, несмотря на адекватную доставку кислорода.
SIRS и сепсис являются общими заболеваниями микроциркуляторного русла. Капиллярная дисфункция характеризуется пониженным кровотоком и усвоением кислорода, что приводит к тромбозу мелких сосудов и снижению функциональной плотности капилляров. Капиллярная дисфункция характеризуется также эндотелиальной дисфункцией, включая пониженный сосудистый тонус, повышенную проницаемость капилляров, эндотелиальный апоптоз и повышенную экспрессию молекул адгезии, что приводит в результате к повышенным лейкоцитарно-эндотелиальным взаимодействиям. Необходимыми для воспаления являются активация лейкоцитов и эндотелиальных клеток и взаимодействие таких клеток.
Эндотелиальные клетки участвуют в регуляции экстравазации лейкоцитов, продуцировании цитокинов и хемокинов, презентации антигенов, синтезе протеаз и внеклеточного матрикса, вазодилатации, сосудистой проницаемости и ангиогенезе. Находясь в начале воспалительного каскада, эндотелиальные клетки играют решающую роль в патофизиологии многих патологических состояний, расстройств (нарушений) и заболеваний, включая воспаление и врожденные и приобретенные иммунные реакции. Следовательно, эндотелиальные клетки являются важными мишенями для терапевтического вмешательства при расстройствах и заболеваниях, которые имеют признаки воспаления и/или иммунных реакций.
Адгезия и активация лейкоцитов осуществляются через каскад событий, включая захват эндотелиальными клетками, роллинг (прокатывание) вдоль эндотелиальной выстилки, медленный роллинг, плотную адгезию к поверхности эндотелиальных клеток и перемещение в пораженную ткань через внеклеточное пространство прилегающих эндотелиальных клеток. Роллинг осуществляется за счет низкоаффинного обратимого связывания общим классом молекул клеточной адгезии, известных как селектины, включая эндотелиальный селектин ("E-селектин"), тромбоцитарный селектин ("P-селектин") и лейкоцитарный селектин ("L-селектин"). Эндотелиальные клетки экспрессируют P-селектин и E-селектин. L-селектин экспрессируется на клеточной поверхности лейкоцитов и, помимо того, что он содействует лейкоцитарно-эндотелиальным взаимодействиям, он также способствует адгезии между лейкоцитами, тем самым повышая эффект взаимодействия отдельного лейкоцита с эндотелиальной клеткой.
Плотной адгезии между лейкоцитами и эндотелиальными клетками, высокой аффинности и практически стационарному соединению содействуют классы молекул адгезии лейкоцитов, известных как интегрины, и молекулы адгезии из суперсемейства иммуноглобулинов. Суперсемейство иммуноглобулинов включает, наряду с прочими, молекулы межклеточной адгезии ("ICAM", например, ICAM-1 и ICAM-2), сосудистую молекулу межклеточной адгезии - 1 ("VCAM"), молекулу адгезии нервных клеток ("NCAM") и различные соединительные молекулы адгезии ("JAM", например, JAM-A, JAM-B, JAM-C). Хотя молекулы адгезии обычно экспрессируются на поверхности клеток, они могут также существовать в виде молекул в растворе, обнаруживаемых в кровотоке и во внеклеточных жидкостях; повышенные концентрации растворимых молекул адгезии и экспрессия некоторых молекул адгезии были ассоциированы с определенными патологиями.
Цитокины играют главную роль в ограничении и контроле патогенных инфекций и регуляции воспаления и иммунных реакций. Гомеостаз между провоспалительными цитокинами и противовоспалительными цитокинами необходим для сохранения соответствующих воспалительных и иммунных реакций. Провоспалительные цитокины включают некоторые интерфероны ("ИФН", "IFN"), факторы некроза опухолей ("TNF") и некоторые интерлейкины ("IL"). При инфекции, поражении и/или повреждении клетки TNF секретируется лейкоцитами (главным образом, активированными макрофагами, активированными T-лимфоцитами, природными киллерными клетками, тучными клетками и базофилами), фибробластами, эндотелиальными клетками, астроцитами головного мозга и другими клетками. TNF промотирует продуцирование других провоспалительных цитокинов, включая, без ограничения, интерфероны (например, интерферон гамма, или "ИФН-γ" (IFN-γ) и различные интерлейкины (например, IL-1β, IL-1αR, IL-6 и IL-8). Аналогично, другие Провоспалительные цитокины могут стимулировать продуцирование TNF.
TNF и другие Провоспалительные цитокины также активируют клетки, что, среди прочего, повышает экспрессию молекул клеточной адгезии на поверхности клеток (рецепторы и лиганды на поверхности клетки) и стимулирует высвобождение фактора активации тромбоцитов, индуцируя прокоагулянтную активность на эндотелиальных клетках сосудов и повышая адгезию лейкоцитов. Увеличение молекул клеточной адгезии приводит к увеличению взаимодействия лейкоцитов с эндотелиальными клетками, роллинга, адгезии и экстравазации нейтрофилов, моноцитов, активированных T-хелперных и T-цитотоксических клеток и T- и B-клеток памяти в инфицированную или пораженную ткань. В ткани активация T- и B-клеток вызывает высвобождение антитела и комплемента. Молекулы клеточной адгезии, которые индуцируются TNF и другими провоспалительными цитокинами, включают, среди прочих, VCAM-1, ICAM-1 и E-селектин.
TNF и другие провоспалительные цитокины и их соответствующие рецепторы являются общепринятыми мишенями терапевтического вмешательства при инфекциях и воспалительных и иммунных нарушениях. Довольно большое число антицитокиновых препаратов в настоящее время проходит клинические испытания или предложено для клинического применения при лечении сепсиса, псориаза, ревматоидного артрита, анкилозирующего спондилоартрита, болезни Крона, воспалительного заболевания кишечника и язвенного колита. Моноклональное антитело к TNF-α, полностью человеческое антитело к TNF-α и поликлональное антитело к TNF были предложены в качестве возможных лекарственных средств для лечения одного или более патологических состояний, связанных с воспалением. См. патенты США 7012135, 6090382, 6509015 и 6193969.
Предполагают также, что помимо этого, другие вещества, оказывающие ингибирующее или антагонистическое действие на продуцирование или действие TNF или других провоспалительных цитокинов, и агонисты противовоспалительных цитокинов и их рецепторы должны быть эффективными терапевтическими агентами для лечения цитокин - опосредованных патологий. См., например, патенты США No.7034031 и 7018626. Полагают, что ингибиторы или антагонисты молекул клеточной адгезии являются подходящими мишенями для вмешательства, так как эти молекулы клеточной адгезии играют основную роль в развитии воспалительного и иммунного ответа. Однако, последние данные показывают, что применение антител к провоспалительным цитокинам или их рецепторам может вызывать повышенный риск серьезной инфекции и рака, возможно, вследствие того, что ингибирование или блокада антителом ограничивает способность пациента при необходимости вырабатывать воспалительный и иммунный ответ.
Поэтому существует потребность в терапевтической композиции для лечения патологических состояний, опосредуемых провоспалительными цитокинами, которые моделируют или ослабляют, но полностью не блокируют и не ингибируют эффект провоспалительных цитокинов. Было бы особенно полезно, чтобы терапевтическая композиция модулировала молекулы адгезии лейкоцитов и/или эндотелиальных клеток (например, ICAM-1, VCAM-1 и E-селектин), регуляцию которых можно индуцировать провоспалительными цитокинами или другими эндогенными веществами, которые промотируют реакцию воспалительного типа.
Настоящее изобретение нацелено на решение одной или более проблем, представленных выше, включая восполнение отсутствия фармацевтической композиции, которая эффективно модулирует экспрессию молекул клеточной адгезии в ответ на индукторы воспалительной реакции и поэтому может применяться для предупреждения или лечения одного или более воспалительных состояний, нарушений или заболеваний. Обсуждение в данном описании, относящееся к воспалительным патологическим состояниям, включает воспалительные состояния, ассоциированные с провоспалительными цитокинами или другими индукторами воспаления, их соответствующими рецепторами, и те состояния, которые ассоциированы с недостаточной экспрессией или регуляцией противовоспалительных цитокинов или их рецепторов или других веществ, которые могут принимать участие в модуляции провоспалительного или противовоспалительного ответов. Обсуждение в данном описании, касающееся патологических состояний, нарушений и заболеваний воспалительного типа, включает те состояния, нарушения и заболевания, которые связаны с повышенным продуцированием и/или высвобождением TNF, включая, но без ограничения, другие провоспалительные цитокины (например, IL-1 или IL-6), которые модулируются с помощью TNF или которые модулируют TNF. Например, ассоциированное с EL-1 болезненное состояние, при котором продуцирование или действие IL-1 усиливается в ответ на TNF, следует рассматривать как болезненное состояние, ассоциированное с TNF. Аналогично, патологическое состояние, ассоциированное с IL-1, при котором повышается экспрессия или высвобождение EL-1 и тем самым вызывается повышение TNF, следует также рассматривать как болезненное состояние, которое опосредуется или модулируется TNF.
Для целей раскрываемого в данном описании изобретения хронические и острые расстройства, заболевания, инфекции и поражения, которые характеризуются локализованными или системными воспалительными реакциями, и, следовательно, считаются ассоциированными с, или опосредованными или модулированными TNF, включают, без ограничения: (1) заболевания и расстройства (нарушения), включающие желудочно-кишечный тракт и связанные с ним ткани (такие как аппендицит, пептические язвы, язвы желудка и двенадцатиперстной кишки, перитонит, панкреатит, язвенный колит, псевдомембранозный колит, острый и ишемический колит, дивертикулит, периодонтальное заболевание, эпиглоттит, ахалазия, холангит, холецистит, глютеновая болезнь, гепатит, цирроз, воспалительное заболевание кишечника, болезнь Крона, энтерит и болезнь Виппла); (2) тяжелые геморрагические системные или локальные воспалительные заболевания и состояния (такие как сенная лихорадка, астма, аллергия, анафилактический шок, комплексное иммунное заболевание, ишемия органов, реперфузионное повреждение, некроз органов, геморрагический шок, сепсис, септический шок, септицемия, синдром системного воспалительного ответа (SIRS), синдром компенсаторного противовоспалительного ответа (CARS), синдром полиорганной дисфункции (MODS), полиорганная недостаточность (MOF), эндотоксический шок, кахексия, гиперпирексия, эозинофильная гранулема, гранулематоз и саркоидоз); (3) заболевания и патологические состояния, включающие мочеполовую систему и связанные с ней ткани (такие как самопроизвольные преждевременные роды, отслойка плаценты, привычный выкидыш, септический аборт, эпидидимит, вагинит, простатит, гломерулонефрит и уретрит); (4) заболевания и нарушения (расстройства), включающие дыхательную систему и связанные с ней ткани (такие как бронхит, эмфизема, ринит, муковиспидоз, пневмония, пульмонит, хроническая обструктивная болезнь легких (ХОБЛ, COPD), (острый) респираторный дистресс-синдром взрослых (ARDS), ультрамикроскопический вулканический силико-пневмокониоз, альвеолит, бронхиолит, фарингит, плеврит и синусит); (5) инфекцию и заболевания, вызванные инфицированном различными вирусами, бактериями, грибками, протозойными и многоклеточными паразитами (такими как вирусы гриппа, респираторные синцитиальные вирусы, вирусы иммунодефицита человека (ВИЧ), вирусы гепатита, герпес- вирусы, цитомегаловирус, менингит и аденовирус, грамположительные и грамотрицательные бактерии, бактерии туберкулеза, проказы); (6) дерматологические заболевания и состояния кожи (такие как псориаз, аллергический и острый дерматит, старческий кератоз, дерматомиозит, химический и другие ожоги, солнечный ожог, крапивница, папилломы (бородавки) и аллергические папулы); (7) заболевания и состояния, включающие кровеносную, лимфатическую и сердечно-сосудистую системы и связанные с этим ткани (такие как ишемия ткани или органа, реперфузионное повреждение, васкулит, лимфедема, ангиит, эндокардит, артериит, атеросклероз, тромбоз и тромбофилия, тромбофлебит, перикардит, застойная сердечная недостаточность, миокардит, ишемия миокарда, ишемический удар, узелковый периартериит, рестеноз, анемия, связанная с химиотерапией, и ревматическая лихорадка); (8) заболевания и патологические состояния, включающие центральную и периферическую нервную систему и связанные с ней ткани (такие как болезнь Альцгеймера, менингит, энцефалит, демиелинизирующие заболевания, рассеянный склероз, тяжелая псевдопаралитическая миастения, инфаркт головного мозга, эмболия сосудов мозга, синдром Гийена-Барре, неврит, невралгия, травма спинного мозга, травма головного мозга, паралич и увеит); (9) невропатическую боль и заболевания и патологические состояния костей, суставов, мышц и соединительных тканей (такие как различные артритиды (поражения кожи псориатического или подагрического характера) и артралгии, резорбция костной ткани, дегенерация мышц, анорексия, кахексия, остеопороз, остеомиелит, фасцит, болезнь Паджета, подагра, периодонтальное заболевание, ревматоидный артрит, остеоартрит, юношеский (ювенильный) хронический артрит (JCA), склеродермия, анкилозирующий спондилоартрит и синовит); (10) аутоиммунные и воспалительные патологические состояния и расстройства (нарушения) (такие как антифософлипидный синдром, тяжелая псевдопаралитическая миастения, тиреоидит, системная красная волчанка, синдром Гудпасчера, синдром Бехчета, отторжение аллотрансплантата, болезнь трансплантат - против - хозяина, синдром гапериммуноглобулинемии - D (HDDS), периодический синдром, ассоциированный с рецептором TNF (TRAPS), деструкция бета- клеток панкреатических островков, устойчивость к инсулину, диабет Типа I и Типа II, гестационный сахарный диабет (сахарный диабет беременных), резистентность к инсулину беременных, болезнь Бергера, синдром Райтера (Рейтера)); и (11) различные типы рака, опухоли и пролиферативные заболевания (такие как болезнь Ходжкина, множественная миелома, острый и хронический миелогенный лейкоз), метастазирование, рецидив раковых заболеваний и опухолей и поражение или травму, полученные в результате хирургического, химиотерапевтического лечения и лучевой терапии таких раковых заболеваний, опухолей и пролиферативных нарушений.
Сущность изобретения
У пациентов с сепсисом и SIRS наблюдается повышение K+ в плазме и соответствующее снижение внутриклеточного K+ и повышение внутриклеточного Na+ и воды. Эти симптомы сепсиса и SIRS наводят на мысль, что натрий-калий АТФ-аза (Na+/K+ АТФ-аза или "натриевый насос", "натриевая помпа") может принимать участие в воспалительных нарушениях. Природные ингибиторы натриевого насоса обнаружены в некоторых растениях и бесхвостых амфибиях (жабах), включая классы веществ, известных как карденолиды и буфадиенолиды (обычно называемые кардиотоническими стероидами, например, оуабаин, маринофугенин и дигиталис). Найдено, что некоторые вещества, сходные с экзогенными карденолидами и буфадиенолидами, встречаются в природе (будучи эндогенными) в организме млекопитающих, но функция (функции) этих эндогенных веществ еще не полностью выяснены. Сердечные гликозиды применяются для лечения нарушений деятельности сердца человека и имеют узкий терапевтический интервал. Поэтому разработаны антитела к различным карденолидам и буфадиенолидам, чтобы нейтрализовать опасную для жизни токсичность. Действие антител к карденолидам и буфадиенолидам заключается в предупреждении связывания этих веществ с натриевым насосом.
Неожиданно было найдено, что антитела против карденолидов и буфадиенолидов, применимы для модуляции действия провоспалительных цитокинов, таких как фактор некроза опухолей. Антитела по настоящему изобретению модулируют индуцируемую цитокинами экспрессию на поверхности клеток ICAM, VCAM и E-селектина, что является серьезным раздражением, в особенности для адгезии лейкоцитов к сосудистому эндотелию и трансмиграции лейкоцитов из сосудистой сети в ткань. Антитела также эффективно понижают активированную TNF экспрессию молекул клеточной адгезии в клетках. Следовательно, такие антитела можно использовать как для предупреждения, так и для лечения воспалительных патологических состояний, опосредованных цитокинами, в особенности состояний, опосредованных TNF.
Так как известно, что эндогенные ингибиторы натриевого насоса перекрестно реагируют с антителами к экзогенным карденолидам и буфалодиенолидам, предполагается также, что антитела, специфические к эндогенным ингибиторам натриевого насоса ("эндогенным факторам" или "EF", "ЭФ"), применимы для модуляции индуцированной цитокинами экспрессии молекул клеточной адгезии и поэтому могут применяться для предупреждения и лечения цитокин - опосредованных состояний, и антитела к EF включены в настоящее изобретение.
Соответственно, настоящее изобретение относится к композициям антител к дигоксину (по данному описанию) для модуляции или ослабления индуцированной цитокинами экспрессии молекул клеточной адгезии. Изобретение включает также способ модуляции или ослабления индуцированной цитокинами экспрессии молекул клеточной адгезии у пациента, заключающийся во введении нуждающемуся в этом пациенту композиции антитела к дигоксину. Другой аспект изобретения включает способ модуляции или ослабления индуцированной цитокинами экспрессии молекул адгезии эндотелиальных клеток у пациента ICAM, VCAM, P-селектина или E-селектина путем введения композиции антитела к дигоксину. Еще один аспект изобретения включает способ предупреждения или лечения патологического состояния или заболевания, при котором эндотелиальные клетки активируются провоспалительным цитокином, путем введения нуждающемуся в этом пациенту композиции антитела к дигоксину. Другие аспекты изобретения включают способы предупреждения и лечения патологических цитокин - опосредованных состояний (по данному описанию), путем введения нуждающемуся в этом пациенту композиции антитела к дигоксину.
Цитокины, включая TNF, при достаточных уровнях продуцирования и при соответствующей регуляции в организме, играют важную роль в жизненном цикле клетки, реакции клетки на внешнюю атаку и поддержании гомеостаза. Некоторые работы по изучению терапевтического применения антител против TNF и антител против рецепторов TNF показали, что такое терапевтическое применение вызывает вредные побочные эффекты и повышенный риск некоторых инфекций и патологий. Поэтому понятно, что целью данного изобретения является не полное ингибирование действия провоспалительных цитокинов (например, TNF, IL-6, IL-8 и т.д.) на молекулы клеточной адгезии, а замедление (регулирование) клеточного ответа на провоспалительные цитокины, восстановление баланса клеточного ответа между провоспалительными цитокинами и противовоспалительными (иммуносупрессивными) цитокинами в процессе иммунных ответов врожденной и приобретенной иммунной системы, и тем самым предупреждение или лечение опосредованных цитокинами инфекций, расстройств (нарушений), патологических состояний, заболеваний и патологий.
Вышеприведенные аспекты изобретения лишь иллюстрируют бесчисленные аспекты, ассоциированные с настоящим изобретением, и не должны рассматриваться в качестве каким-либо образом ограничивающих. Эти и другие аспекты, признаки и преимущества настоящего изобретения станут очевидными из нижеприведенного подробного изобретения в сочетании с Фигурами. Хотя в практике настоящего изобретения могут применяться методы и материалы, сходные с методами и материалами в данном описании или эквивалентные им, подходящие методы и материалы описаны ниже. Кроме того, материалы, методы и примеры являются лишь иллюстративными и никоим образом не претендуют на ограничение. Все публикации, патенты и патентные заявки, цитируемые в данном описании, вводятся в данное описание в качестве ссылки.
Краткое описание фигур
На Фиг.1 представлена схема, иллюстрирующая стадии способа лечения пациента, имеющего цитокин - опосредованное патологическое состояние.
На Фиг.2A представлена диаграмма, иллюстрирующая экспрессию молекулы межклеточной адгезии - 1 ("ICAM") в человеческих эндотелиальных клетках умбиликальной (пупочной) вены ("HUVEC"), индуцированных TNF-α.
На Фиг.2B представлена диаграмма, иллюстрирующая модуляцию индуцированной TNF-α экспрессии ICAM в HUVEC, которые были обработаны антителом к дигоксину перед экспозицией с TNF-α.
На Фиг.3A представлена диаграмма, иллюстрирующая экспрессию сосудистой молекулы межклеточной адгезии - 1 ("VCAM") в HUVEC, индуцированную TNF-α.
На Фиг.3B представлена диаграмма, иллюстрирующая модуляцию индуцированной TNF-α экспрессии VCAM в HUVEC, которые были обработаны антителом к дигоксину перед экспозицией с TNF-α.
На Фиг.4A представлена диаграмма, иллюстрирующая экспрессию сосудистой молекулы межклеточной адгезии E-селектина в HUVEC, индуцированную TNF-α.
На Фиг.4В представлена диаграмма, иллюстрирующая модуляцию индуцированной TNF-α экспрессии E-селектина в HUVEC, которые были обработаны антителом к дигоксину перед экспозицией с TNF-α.
На Фиг.5A представлена диаграмма, иллюстрирующая индуцированную TNF-α экспрессию ICAM и ослабление этой экспрессии, когда HUVEC затем обрабатывают антителом к дигоксину.
На Фиг.5B представлена диаграмма, иллюстрирующая индуцированную TNF-α экспрессию VCAM и ослабление этой экспрессии, когда HUVEC затем обрабатывают антителом к дигоксину.
На Фиг.6 представлена диаграмма, иллюстрирующая индуцированную TNF-α экспрессию E-селектина и ослабление этой экспрессии, когда HUVEC затем обрабатывают антителом к дигоксину.
На Фиг.7A приводится пример структуры агликона буфадиенолида.
На Фиг.7B приводится пример структуры агликона карденолида.
Подробное описание изобретения
Констатируется, что если контекст четко не диктует иного, формы единственного числа включают множественное число обозначаемого. Если не указано иначе, все технические и научные термины в данном описании имеют то же значение, которое обычно понимается специалистом в области техники, к которой относится данное изобретение. Хотя любые методы, приборы и материалы, сходные или эквивалентные методам, приборам и материалам по данному описанию, могут применяться при практическом использовании или испытании изобретения, предпочтительные методы, приборы и материалы представлены в данном описании.
I. Определения и сокращения. Нижеприведенные термины, применяемые в данном описании, имеют значения (определения), представленные ниже. Когда такие термины употребляются в контексте по определению ниже, тогда их можно применять в виде прилагаемого к такому термину сокращения.
"пациент" обозначает человека и других животных и предполагает охватывать любое животное или человека, на которых лечение с применением композиций и методов по настоящему изобретению может оказать благоприятное воздействие.
"натриевый насос" или "натрий/калий АТФ-аза" или "Na+/K+ АТФ-аза" означает натрий, калийзависимую аденозинтрифосфатазу, трансмембранный белок, который использует энергию, выделяющуюся при гидролизе аденозинтрифосфата ("АТФ") (АТФ→АДФ+PO4) для переноса ионов натрия и калия через клеточные мембраны в противоположных направлениях против их химического и электрического градиентов. Натриевый насос представляет собой основной переносчик, отвечающий за поддержание электрохимического градиента Na+ на другой стороне (поперек) клеточных мембран и играющий важную роль в регуляции объема клеток, величины pH цитоплазмы, Na+ - зависимого транспорта глюкозы и аминокислот и регуляции уровней Са2+ с помощью Na+/H+ и Na+/Ca+ ионообменных насосов.
"эндогенные факторы" или "F" означает факторы, продуцируемые в организме животных, которые вступают в перекрестную иммунологическую реакцию или иным образом связываются с антителами, специфическими, по меньшей мере, к одному эпитопу карденолида или буфадиенолида, или способными связываться с ними, ингибируя или ослабляя функцию Na+/K+ АТФ-азы. В некоторых случаях в данном описании EF могут также относиться к дигоксиноподобным веществам ("DLS"), дигоксиноподобным иммунореактивными веществам или факторам ("DLIS" или "DLIF") или эндогенным дигоксиноподобным веществам ("EDLF").
"карденолиды (и/или) буфадиенолиды" или "сердечные гликозиды" означают ингибиторы натриевого насоса, эндогенные для пациентов. Карденолиды и буфадиенолиды обычно называют кардиотоническими стероидами. Карденолиды и/или буфадиенолиды обычно содержат их агликоновые части, включая, без ограничения, дигиталис, гитоксигенин дигоксигенин, дигоксин, дигитоксигенин, дигитоксин, дигидродигоксин, строфантины, конваллатоксин, цимарин, ацетилстрофантидин, строфантидин, оуабагенин, оуабаин, дигидрооубаин, нерифолин, просцилларидин, просцилларидин A, цинобуфаген, цинобуфатолин, маринобуфагенин норбуфалин, буфанолид, буфалин и аналогичные соединения и их соответствующие изомеры, инотропы, конгенеры, варианты, производные, эквиваленты, предшественники и метаболиты и синтетические или сконструированные варианты или конструкции любого из вышеприведенных соединений.
"эндотелиальная активация" означает изменение фенотипа или функции эндотелиальной клетки в ответ на внешнее раздражение, включая, но без ограничения, экспрессию молекул, которые опосредуют адгезию и/или передачу сигнала лейкоцитов. Раздражители, о которых известно, что они индуцируют зависящие от активации функциональные изменения в человеческих эндотелиальных клетках, включают гуморальные агонисты, которые взаимодействуют с рецепторами клеточной поверхности, включают, но без ограничения, цитокины и плеотропные факторы передачи сигналов, такие как тромбин, бактериальный эндотоксин или липополисахарид (ЛПС, LPS) и другие продукты жизнедеятельности микробов, гемодинамическим регулируемым событием в гомеостатических физиологических сосудистых реакциях, или она может быть дисрегулируемой (недостаточно регулируемой) или нерегулируемой реакцией при патологических состояниях.
"синдром системного воспалительного ответа" или "SIRS" обозначает комплекс симптомов, которые возникают в результате системного воспаления, вне зависимости от причины. Клинические показатели SIRS включают присутствие более одного из нижеприведенных признаков: температура >100.4°F или <96.8°F (>38°C или <36°C); частота сердечных сокращений >90 ударов/мин; тахипноэ (частота дыхания >20 вдохов/мин.) или гипервентиляция (PaCO2 (парциальное давление углекислого газа в артериальной крови) <32 мм Hg); и число лимфоцитов >12000 клеток/мм2 или <4000 клеток/мм3, или присутствие >10% незрелых нейтрофилов. Системный воспалительный ответ, указывающий на диагноз SIRS, может быть связан как с инфекцией, так и с различными причинами неинфекционной этиологии, включая, без ограничения, геморрагию, ожоги, панкреатит, травму, тепловой удар и неоплазию.
"сепсис" означает SIRS, возникающий в результате инфекции (батериальной, вирусной, грибковой или паразитарной), или как периодически определяется Американской Коллегией врачей по заболеваниям грудной клетки/Обществом реаниматологов.
"тяжелый сепсис" означает сепсис, дополнительно сопровождающийся гиперперфузией органов, которая выражается в виде, по меньшей мере, одного признака дисфункции органа, такого как гипоксемия, олигурия, метаболический ацидоз или любая церебральная (нейрологическая) функция.
"септический шок" означает тяжелый сепсис, дополнительно сопровождающийся гипотензией, которая выражается систолическим артериальным давлением <90 мм Hg или необходимостью в фармацевтическом вмешательстве для поддержания артериального давления.
"полиорганный дисфункциональный синдром" ("MODS") означает наличие измененной функции двух или более органов у пациента с острым заболеванием, так что гомеостаз не может поддерживаться без вмешательства.
"цитокин" означает любой секретируемый гормон, пептид, полипептид, белок или другое вещество, которое влияет на функцию клетки и/или которое модулирует взаимодействия между клетками, участвующими в иммунной, воспалительной или гемопоэтической реакции. Цитокины включают, но без ограничения, монокины, лимфокины и хемокины, вне зависимости от клетки - источника цитокина. Например, монокином обычно называют цитокин, продуцируемый и секретируемый мононуклеарной клеткой, такой как макрофаг и/или моноцит. Однако, многие другие клетки также продуцируют монокины, такие как природные киллерные клетки, фибробласты, базофилы, нейтрофилы, эндотелиальные клетки, астроциты головного мозга, стромальные клетки костного мозга, эпидермальные кератиноциты и B-лимфоциты. Примеры цитокинов включают, но без ограничения, интерфероны (включая ИФН-α, ИФН-β, ИФН-γ и т.д.), интерлейкины (включая IL-1, IL-2, IL-4, IL-6, IL-8, IL-10, IL-12, IL-17, IL-18, IL-19 и т.д.), факторы некроза опухолей ("TNF", включая TNF-α и TNF-β и т.д.), гранулоцитарно-макрофагальный колониестимулирующий фактор ("GM-CSF"), нейтрофил - активирующий белок - 1 ("NAP-1"), нейтрофил - активирующий белок - 2 ("NAP-2"), GRO-α, GRO-β, GRO-γ, ENA-78, GCP-2, IP-10, MIG, PF4, RANTES, MIP-1α, MIP-2β, хемотаксические белки моноцитов (MCP-1, MCP-2, MCP-3 и т.д.), эотаксин, и включают неиммунологические цитокины, такие как C-реактивный белок, активированный белок C, эритропоэтин и тромбопоэтин. Иммунологические цитокины можно разделить на подгруппы: цитокины, которые стимулируют пролиферацию и функционирование хелперных Т-клеток типа 1 ("TH1-типа"), которые обычно являются провоспалительными (например, DL-1, ИФН-γ и т.д.), хелперных T-клеток типа 2 ("TH1-типа"), которые обычно являются противовоспалительными (например, IL-4, IL-10, IL-13, TGF-P и т.д.). Обычно цитокины, принадлежащие к одной из этих подгрупп склонны к ингибированию действия цитокинов, принадлежащих к другой подгруппе, модулируя действие друг друга и приводя к тому, что наблюдается тенденция к сбалансированному воспалительному и/или иммунному ответу. Неудачные попытки сохранить равновесие или способность модулировать воспалительный и иммунный ответ могут играть значительную роль в патогенезе воспалительных и иммунных патологических состояний и заболеваний. Для целей настоящего изобретения полагают, что провоспалительный цитокин представляет собой любую молекулу, гормон, пептид, полипептид, белок или другое вещество, или композиция одного или более веществ, которые прямо или косвенно влияют на активацию лейкоцита или эндотелиальной клетки.
"модулировать", "модулирование" или "модуляция", в том, что касается, без ограничения, гена, нуклеиновой кислоты, пептида, полипептида, белка, гормона или другого вещества, означают влиять на, регулировать, корректировать, смягчать, снижать или ингибировать экспрессию, транскрипцию, трансляцию, модификацию, расщепление, деградацию, аккумуляцию, транслокацию, рециклинг, высвобождение, авидность, аффинность или активность, или их растворимую или связанную форму, или присутствие в клетке, клеточной мембране, на поверхности клетки, во внеклеточной жидкости, матриксе, сыворотке или плазме.
"повышенный(ые) уровень (уровни)" означает повышенный уровень вещества в ткани или жидкости пациента, у которого наблюдается аномальное состояние, физиологическое состояние, расстройство, заболевание или патология, по сравнению с аналогичной или соответствующей тканью или жидкостью человека, у которого не наблюдается такое состояние, физиологический статус, расстройство или патология (например, содержащего базовый уровень вещества или уровень такого вещества, ассоциированный с гомеостазом).
Если специально не указано иначе, "TNF" означает фактор некроза опухолей альфа (ФНО-α, TNF-α, также известный как кахектин), или фактор некроза опухолей бета (ФНО-β, TNF-β, также известный как лимфотоксин), или и тот, и другой.
"ИФН" ("IFN") означает интерферон. Человеческие интерфероны типа I включают 13 различных альфа-изоформ (подтипов со слегка различными специфичностями)- ИФН-α (1, 2, 4, 5, 6, 7, 8, 10, 13, 14, 16, 17, 21) и единственную бета ("ИФН-β1), омега, ипсилон и каппа изоформу. Интерфероны типа II включают ИФН гамма (ИФН-γ) (EFN-γ). Интерферон типа III включает ИФН-лямбда (IFN-λ).
"цитокин - опосредованное состояние" означает все без исключения инфекции, физиологические состояния, патологические состояния, синдромы, расстройства (нарушения), заболевания и патологии, в которых TNF (ФНО) действует как провоспалительный агент, либо прямо, либо косвенно, и либо образуясь в результате повышенной экспрессии (транскрипции и/или трансляции), изменения модификации, аккумуляции, транслокации, высвобождения, деградации или рециклинга TNF, либо любым другим способом, включая, но без ограничения, модуляцию любого противовоспалительного цитокина или его рецепторов или метаболитов, или за счет действия любого цитокина (или его рецептора или метаболитов), который модулирует TNF, или за счет TNF, вызывающего транслокацию и высвобождение другого цитокина, или иным образом влияющего на экспрессию (транскрипцию и/или трансляцию), изменение модификации, аккумуляции, транслокации, высвобождении, деградации или рециклинга такого другого цитокина (или его соответствующих рецепторов или метаболитов), или за счет понижения экспрессии (транскрипции и/или трансляции), изменения модификации, аккумуляции, транслокации, высвобождения, деградации или рециклинга цитокина или рецептора цитокина, который регулирует, модулирует или ингибирует (полностью или частично) действие TNF. Например, но без ограничения, состояние, при котором IL-1 является компонентом, и продуцирование или действие его усиливается или он секретируется в ответ на TNF, надо, следовательно, рассматривать как цитокин - опосредованное состояние. Аналогично, состояние, ассоциированное с IL-1, который вызывает секрецию TNF, также следует рассматривать как цитокин - опосредованное состояние. "Цитокин - опосредованное состояние" включает, но без ограничения, следующие состояния: (1) заболевания и расстройства (нарушения), включающие желудочно-кишечный тракт и связанные с ним ткани (такие как аппендицит, пептические язвы, язвы желудка и двенадцатиперстной кишки, перитонит, панкреатит, язвенный колит, псевдомембранозный колит, острый и ишемический колит, дивертикулит, периодонтальное заболевание, эпиглоттит, ахалазия, холангит, холецистит, глютеновая болезнь, гепатит, цирроз, воспалительное заболевание кишечника, болезнь Крона. энтерит и болезнь Виппла); (2) тяжелые геморрагические и системные или локальные воспалительные заболевания и состояния (такие как астма, аллергия, анафилактический шок, комплексное иммунное заболевание, ишемия органов, реперфузионное повреждение, некроз органов, сенная лихорадка, геморрагический шок, сепсис, септический шок, септицемия, сепсис у новорожденных, синдром системного воспалительного ответа (SIRS), синдром компенсаторного противовоспалительного ответа (CARS), синдром полиорганной дисфункции (MODS), полиорганная недостаточность (MOF), эндотоксический шок, кахексия, гиперпирексия, эозинофильная гранулема, гранулематоз и саркоидоз); (3) заболевания и патологические состояния, включающие мочеполовую систему и связанные с ней ткани (такие как самопроизвольные преждевременные роды, отслойка плаценты, привычный выкидыш, септический аборт, эпидидимит, вагинит, простатит, гломерулонефрит и уретрит); (4) заболевания и нарушения (расстройства), включающие дыхательную систему и связанные с ней ткани (такие как бронхит, эмфизема, ринит, муковисцидоз, пневмония, пульмонит, хроническая обструктивная болезнь легких (ХОБЛ, COPD), (острый) респираторный дистресс-синдром взрослых (ARDS), ультрамикроскопический вулканический силико-пневмокониоз, альвеолит, бронхиолит, фарингит, плеврит и синусит); (5) инфекцию и заболевания, вызванные инфицированием различными вирусами, бактериями, грибками, протозойными и многоклеточными паразитами (такими как вирусы гриппа, респираторные синцитиальные вирусы, вирусы иммунодефицита человека (ВИЧ), вирусы гепатита, герпес-вирусы, цитомегаловирус, вирус менингита и аденовирус, грамположительные и грамотрицательные бактерии, бактерии туберкулеза, проказы); (6) дерматологические заболевания и состояния кожи (такие как псориаз, аллергический и острый дерматит, старческий кератоз, дерматомиозит, химический и другие ожоги, солнечный ожог, крапивница, папилломы (бородавки) и аллергические папулы); (7) заболевания и состояния, включающие кровеносную, лимфатическую и сердечнососудистую системы и связанные с этим ткани (такие как ишемия ткани или органа, реперфузионное повреждение, лимфедема, васкулит, ангиит, эндокардит, артериит, заболевание периферических сосудов, атеросклероз, тромбоз и тромбофилия, тромбофлебит, перикардит, застойная сердечная недостаточность, миокардит, ишемия или инфаркт миокарда, ишемический удар, узелковый периартериит, рестеноз, анемия, связанная с химиотерапией и ревматическая лихорадка); (8) заболевания и патологические состояния, включающие центральную и периферическую нервную систему и связанные с ней ткани (такие как болезнь Альцгеймера, менингит, энцефалит, демиелинизирующие заболевания, рассеянный склероз, тяжелая псевдопаралитическая миастения, инфаркт головного мозга, эмболия сосудов мозга, синдром Гийена-Барре, неврит, невралгия, травма спинного мозга, травма головного мозга, паралич и увеит); (9) невропатическую боль и заболевания и патологические состояния костей, суставов, мышц и соединительных тканей (такие как различные артритиды (поражения кожи псориатического или подагрического характера) и артралгии, резорбция костной ткани, дегенерация мышц, анорексия, кахексия, остеопороз, остеомиелит, фасцит, болезнь Паджета, подагра, периодонтальное заболевание, ревматоидный артрит, остеоартрит, юношеский (ювенильный) хронический артрит (JCA), склеродермия, анкилозирующий спондилоартрит и синовит); (10) другие аутоиммунные и воспалительные патологические состояния и расстройства (нарушения) (такие как антифософлипидный синдром, тяжелая псевдопаралитическая миастения, тиреоидит, системная красная волчанка, синдром Гудпасчера, синдром Бехчета, отторжение аллотрансплантата, болезнь трансплантат - против - хозяина, синдром гипериммуноглобулинемии - D (HDDS), периодический синдром, ассоциированный с рецептором TNF (TRAPS), деструкция бета- клеток панкреатических островков, устойчивость к инсулину, диабет Типа I и Типа II, гестационный сахарный диабет (сахарный диабет беременных), резистентность к инсулину беременных, болезнь Бергера, синдром Райтера (Рейтера)); и (11) различные типы рака, опухоли и пролиферативные заболевания (такие как болезнь Ходжкина, множественная миелома, острый и хронический миелогенный лейкоз), метастазирование, рецидив раковых заболеваний и опухолей и поражение или травму, полученные в результате хирургического, химиотерапевтического лечения и лучевой терапии таких раковых заболеваний, опухолей и пролиферативных нарушений.
"терапевтически эффективный" означает эффективный для лечения физиологического состояния, патологического состояния, расстройства, синдрома, инфекции, заболевания или патологии или любого их симптома. Термин "лечение" по данному описанию включает, без ограничения, предупреждение (профилактику), уменьшение тяжести, контроль, ограничение влияния, задержку начала, предупреждение прогрессирования, вызов регрессии, ослабление или уменьшение интенсивности одного или нескольких членов группы: причины, эффекты или физические или клинические показатели физиологического состояния, патологического состояния, расстройства, синдрома, инфекции, заболевания или патологии. Предпочтительно, чтобы терапевтически эффективная композиция не оказывала никакого нежелательного или заметного побочного действия на пациента, включая ухудшение любого состояния или симптома, или не вызывала никаких осложнений в такой степени, чтобы возникал риск того, что вредное побочное действие возобладает над пользой, которую должно принести лечение. Терапевтически эффективная композиция может улучшить или стабилизировать один или более медицинских показателей, которые в отсутствие композиции могли бы ухудшиться или проявиться в виде симптома или осложнения инфекции, патологического состояния, расстройства, синдрома, заболевания или патологии. После тщательного медицинского обследования нужная дозировка фармацевтически активного агента (ингредиента) или фармацевтической композиции, содержащей этот активный ингредиент, варьируется в зависимости от тяжести пролечиваемого состояния, продолжительности лечения, характера дополнительного лечения, пола, веса, возраста и физического состояния (здоровья или болезни) пациента, конкретного применяемого активного ингредиента и тому подобных факторов, более подробно обсуждаемых в данном описании. При установлении терапевтически эффективного количества для конкретной фармацевтической композиции или агента следует принимать во внимание эти риски, а также тот факт, что композиции по данному описанию обеспечивают фармацевтическую активность при пониженных уровнях доз. При употреблении в отношении композиции по настоящему изобретению "терапевтически эффективный" включает количество антитела дигоксина, которое эффективно модулирует или смягчает один или более эффектов TNF в клетках одного или более типов или в одной или более тканях и, тем самым, оказывает заданное терапевтическое воздействие на цитокин - опосредованное состояние. В частности, терапевтически эффективное количество антитела к дигоксину вызывает эффект модуляции или ослабления эндотелиальной активации под действием TNF, и, наиболее предпочтительно, модулирует или ослабляет воздействие TNF на экспрессию ICAM, VCAM, P-селектина или E-селектина на поверхности эндотелиальных клеток.
"другой терапевтический агент" или "другие терапевтические агенты" означает любое вещество или терапевтический агент (отличный от композиций, агентов и активных ингредиентов по настоящему изобретению), который использовался, используется в настоящее время, или о котором известно, что он применим, или который может быть разработан в будущем для применения при цитокин - опосредованном состоянии. Например, агенты, применимые для лечения цитокин - опосредованных состояний, включают, без ограничения: антитела, специфические к цитокинам или рецепторам цитокинов (например, инфликсимаб, энтерацепт, адалимумаб); нестероидные противовоспалительные агенты; кортикостероиды; антитела к молекулам клеточной адгезии (например, антитела, специфические к эпитопу ICAM, VCAM, E-селектина, P-селектина, интегринов, кадхеринов и т.п.); активированный белок С; агонисты цитокинов типа TH-2; агонисты цитокинов типа TH-1; и антибиотики, подходящие для одной или более бактериальных инфекций, которые, как знают или полагают, находятся в организме пациента. Такие другие терапевтические агенты можно вводить способом или методом и в количестве и в течение времени, которые обычно применяются для такого агента, одновременно или последовательно с соединением по настоящему изобретению.
"кортикостероид" означает любой природный или синтетический (полностью или частично) стероидный гормон, который может быть образован из холестерина и характеризуется гидрированной циклической системой циклопентанопергидрофенантрена, природного или циклического. Кортикостероиды могут обладать глюкокортикостероидной и/или минералокортикоидной активностью. Кортикостероиды включают, без ограничения, дексаметазон, бетаметазон, триамцинолон, триамцинолона ацетонид, триамцинолона диацетат, триамцинолона гексацетонид, беклометазона дипропионат, беклометазона дипропионат моногидрат, флуметазона пивалат, дифлоразона диацетат, флуоцинолона ацетонид, флуорометолон, флуорометолона ацетат, клобетазола пропионат, дезоксиметазон. флуоксиместерон, флупреднизолон, гидрокортизон, гидрокортизона ацетат, гидрокортизона натрия сукцинат, гидрокортизона ципионат, гидрокортизона пробутат, гидрокортизона валерат, кортизона ацетат, параметазона ацетат, метилпреднизолон, метилпреднизолона ацетат, метилпреднизолона натрия сукцинат, преднизолон, преднизолона ацетат, преднизолона натрия фосфат, преднизолона тебутат, клокортолона пивалат, дексаметазон-21-ацетат, бетаметазон-17-валерат, изофлупредон, 9-фторкортизон, 6-гидроксидексаметазон, дихлоризон, меклоризон, флупредиден, доксибетазол, галопредон, галометазон, клобетазон, дифлукортолон, изофлупредона ацетат, флуорогидроксиандростендион, флуметазон, дифлоразон, флуоцинолон, клобетазол, кортизон, парам етазон, клокортолон, преднизолона 21-гемисукцинат свободная кислота, преднизолона метасульфобензоат и триамцинолона ацетонид 21-пальмитат.
"композиция", как например, в фармацевтической композиции или терапевтически эффективной композиции, означает продукт, содержащий активный(ые) ингредиент(ы) и инертный(ые) и неактивный(ые) ингредиенты(ы) (включая фармацевтически приемлемые носители и эксципиенты), а также любой продукт, который получают, прямо или косвенно, в результате комбинации, комплексообразования или объединения любых двух или более ингредиентов, или в результате диссоциации одного или более ингредиентов, или в результате других типов реакций или взаимодействий одного или более ингредиентов. Соответственно, фармацевтические композиции по настоящему изобретению охватывают любую композицию, получающуюся при смешении антитела к дигоксину по настоящему изобретению, дополнительного (дополнительных) активного (активных) ингредиента (ингредиентов) и/или фармацевтически приемлемых носителей или эксципиентов.
"фармацевтически приемлемый" означает, что фармацевтически активный ингредиент и другие ингредиенты, применяемые в фармацевтических композициях по изобретению по данному описанию, пригодны для применения в контакте с клетками или тканями человека и других животных при отсутствии неспецифической токсичности, раздражения, аллергической реакции и т.п., сопоставимых с корректным соотношением польза/риск (а именно, с учетом общепризнанных возможных рисков для лекарства польза преобладает над такими рисками).
"носитель" или "эксципиент" означает твердый, полутвердый, жидкий, аэрозольный или газообразный наполнитель, разбавитель или инкапсулирующее вещество. Эти материалы общеизвестны специалистам в области фармацевтики. Ниже приводятся некоторые примеры веществ, которые могут служить в качестве фармацевтических носителей: сахара (в твердом виде или в виде водного раствора), такие как лактоза, глюкоза и сахароза; крахмалы, такие как кукурузный крахмал и картофельный крахмал; целлюлоза и ее производные, такие как натрий-карбоксиметилцеллюлоза, этилцеллюлоза и ацетат целлюлозы; порошок трагаканта; солод; желатин; тальк; стеариновая кислота; стеарат магния; сульфат кальция; растительные масла, такие как арахисовое масло, хлопковое масло, кунжутное масло, оливковое масло, кукурузное масло и масло какао; многоатомные спирты (полиолы), такие как пропиленгликоль, глицерин, сорбит, манит и полиэтиленгликоль; агар-агар; альгиновая кислота; апирогенная вода и стерильная вода для инъекций; изотонический физиологический раствор; и фосфатные буферные растворы, а также другие нетоксические совместимые вещества, используемые в фармацевтических композициях. Они могут представлять собой липосомы или носители лекарств, приготовленные из липидов или полимерных частиц, включая биодеградируемые полимеры, или применения в адресной (направленной) терапии, например, связывание с антителами. Также могут присутствовать увлажняющие агенты и смазки, такие как лаурилсульфат натрия, а также красители, вещества, придающие вкус и запах, вещества для таблетирования и консерванты. Подходящие носители и экспипиенты описаны в самом последнем издании A. Gennaro, Remington The Science and Practice of Pharmacy (ed. 20th, Lippincot & Williams 2000), классическом справочнике по фармацевтике. Носители и эксципиенты, особенно применимые по настоящему изобретению, подробнее обсуждаются ниже. Приготовление фармацевтической композиции из активных ингредиентов и носителей и эксципиентов можно осуществлять, используя любой метод или любые методы, известные в уровне техники.
"антиген" означает вещество или фрагмент вещества, которые способны связываться антителом, а также могут быть способны индуцировать в организме животного выработку антитела, которое селективно связывается с эпитопом этого антигена. Антиген может иметь одни эпитоп или более одного эпитопа. "Эпитоп" означает специфическую антигенную структуру, узнаваемую связывающим доменом. Эпитопы обычно состоят из химически активных групп молекул, таких как побочные цепи аминокислот или сахаров, и имеют особые характеристики трехмерной структуры, а также характерный заряд. Термин "антиген" по данному описанию означает также любой лиганд, который способен связываться (специфически или неспецифически) антителом, вне зависимости от того, выявляет такой лиганд или не выявляет иммунный ответ у пациента.
"антитело" или "антитела" означают иммуноглобулиновую, пептидную, полипептидную, белковую или другую молекулу либо природного происхождения, либо полностью синтетическую или генно-инженерную или сконструированную, имеющую CDR или связывающий домен или структуру, которая практически гомологична CDR или связывающему домену. Примерами антител являются изотипы иммуноглобулина и их изотипические подклассы; CDR, связывающие фрагменты и искусственно созданные мини-антитела (диатела, diabodies) (по определению ниже). Термин также включает производные, функциональные эквиваленты и гомологи антител, включая любой пептид, содержащий CDR или связывающий домен, вне зависимости от того, является ли антитело природным или полностью либо частично синтетическим или генно-инженерным, и вне зависимости от того, является ли антитело поликлональным, мноклональным, гуманизированным, химерным или полностью человеческим. Различные методы получения таких антител описаны в патенте США No.5225539, патенте США No.5693761, патенте США No.5869619, патенте США No.5821337, патенте США No.5859204, патенте США No.6946546, патенте США No.6939543, патенте США No.6926896, патенте США No.6924125, патенте США No.6893624 и патенте США No.6881557, каждый из этих патентов вводится в данное описание в качестве ссылки. Термины Fv, Fc, Fd, Fab, Fab' и F(ab')2 имеют свои обычные значения. См., например, Harlow et al., Antibodies a Laboratory Manual, Cold Spring Harbor Laboratory (1988).
Выражение "генно-инженерное антитело" обозначает тип измененного антитела, в молекуле которого участки вариабельных доменов легкой и/или тяжелой цепи выбранного акцепторного антитела заменены на аналогичные участки одного или более донорных антител, которые обладают специфичностью к выбранному эпитопу (например, без ограничения, химерного, полностью человеческого или гуманизированного антитела, в противоположность фрагменту антитела). Например, такие молекулы могут включать антитела, отличающиеся гуманизированной тяжелой цепью, ассоциированной с немодифицированной легкой цепью (или химерной легкой цепью), или наоборот. Генно-инженерные антитела могут также характеризоваться изменением нуклеотидных последовательностей, кодирующих каркасные области вариабельных доменов легкой и/или тяжелой цепи акцепторного антитела, чтобы сохранить специфичность связывания донорного антитела. Эти антитела могут включать замену одной или более областей CDR (предпочтительно, всех) акцепторного антитела на области CDR донорного антитела.
"химерное антитело" означает тип генно-инженерного антитела, которое содержит природную вариабельную область (или ее участок) донорного антитела, ассоциированную с константной областью акцепторного антитела.
"гуманизированное антитело" означает тип генно-инженерного антитела, содержащего области CDR донорного глобулина нечеловеческого происхождения, при этом остальные иммуноглобулиновые участки молекулы взяты из одного или более человеческих иммуноглобулинов. Кроме того, вспомогательные каркасные остатки можно изменять с целью сохранить аффинность связывания. См., например, Queen et al., Proc. Natl. Acad. Sci. USA. 86: 10029-10032 (1989).
Термин "диатела (мини-антитела, diabodies)" означает мультимеры полипептидов, причем каждый полипептид содержит первый домен, включающий связывающую область легкой цепи иммуноглобулина, и второй домен, содержащий связывающую область тяжелой цепи иммуноглобулина, два домена связаны (например, пептидным линкером), но не способны ассоциироваться друг с другом с образованием связывающего домена. Связывающие домены образуются за счет ассоциации первого домена одного полипептида в мультимере со вторым доменом другого полипептида в мультимере (см., например, опубликованная патентная заявка США 20050214860).
"гипервариабельная область" или "CDR" означает аминокислотные последовательности области, определяющей комплементарность, антитела, которые являются гипервариабльными областями тяжелой и/или легкой цепи иммуноглобулина. См., например, Kabat et al., Sequences of Proteins of Immunological Interest (4th Ed., U.S. Department of Health and Human Services, National Institute of Health, 1987). В вариабельной области тяжелой цепи природного иммуноглобулина содержится три CDR, или области CDR, и в вариабельной области легкой цепи природного иммуноглобулина содержится три CDR, или области CDR. Таким образом, CDR природного (не генно-инженерного) антитела по данному описанию относится ко всем трем CDR тяжелой цепи или ко всем трем CDR легкой цепи, или, при необходимости, ко всем трем областям CDR как тяжелой, так и легкой цепи. CDR предоставляют большинство контактных остатков для связывания антитела с антигеном или эпитопом.
"связывающий фрагмент" или "связывающие фрагменты" означает фрагмент или фрагменты целых антител (содержащих Fc и Fv области) и природные или синтетически созданные молекулы, которые содержат весь связывающий домен или его часть, специфические или неспецифические к лиганду или антигену или эпитопу антигена.
"связывающий домен" означает часть антитела или любого другого природного, синтетического, генно-инженерного антитела или конструированной молекулы, включая, без ограничения, белок-калицин, который связывается с частью лиганда или антигена или с целым лигандом или антигеном, или эпитопом антигена, и/или комплементарен части лиганда или антигена или целому лиганду или антигену, или эпитопу антигена.
"антитело к дигоксину" или "антитела к дигоксину" означает антитело или связывающий фрагмент, природное или целиком или частично синтетическое или генно-инженерное, которое реагирует иммунологически с, или иным образом связывается с (либо специфически, либо неспецифически), или содержит связывающий домен или CDR для (связывания с) дигиталисом, дигоксином, дигитоксином, дигитоксигенином, дигоксигенином, гитоксигенином или любым эндогенным дигоксиноподобным фактором (таким как описанный в опубликованной патентной заявке США 20050123999), или любым эпитопом на любом из них. Антитела к дигоксину включают антитела, специфические к любому карденолиду или буфадиенолиду, который способен связывать, по меньшей мере, один эпитоп дигиталиса, дигоксина, дигитоксина, дигитоксигенина, дигоксигенина, гитоксигенина или любого эндогенного дигоксиноподобного фактора. Например, и без ограничения, антитела к дигоксину включают антитела, специфические к дигоксину, оуабину, буфалину или маринобуфагенину, или к конъюгату любого из них. Антитела к дигоксину включают также белки - калинины, природные или полностью или частично синтетические или генно-инженерные, способные связывать дигиталис, дигоксин, дигитоксин, дигитоксигенин, дигоксигенин, гитоксигенин или его эпитоп. Надсемейство белков - калицинов характеризуется структурными мотивами, образующимися с помощью антипараллельных бета-складок аналогично CDR области иммуноглобулинов. Липокалины, белки, связывающие жирные кислоты ("FABP", "БСЖК"), и авидины являются представителями надсемейства белков - калицинов. Калицины представляют собой относительно малые секретируемые белки, которые, как полагают, участвуют в связывании и транспорте гидрофобных молекул. Специфичность связывания определяется конформацией и составляющими боковыми цепями кармана, созданного при скручивании (фолдинге) белка. In vitro многие липокалины могут связываться с высокой аффинностью с рядом гидрофобных молекул, обычно не встречающихся в природе. Это может являться характерной способностью этих белков - связывать молекулы, обладающие конкретными биохимическими и структурными свойствами. Калицин можно функционально разделить на "связывающий домен" и "нацеливающий домен". "Связывающий домен" функционирует, взаимодействуя с лигандами, тогда как "нацеливающий домен" обеспечивает специфичность при транспортировке связанного лиганда к определенному сайту. Известные липокалины включают: ретинолсвязывающий белок; пурпурин; белок, связывающий ретиноевую кислоту; 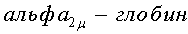 ; основной белок мочи; билинсвязывающий белок; альфа-крустацианин; белок беременных 14; бета-лактоглобин; нейтрофильный липокалин и белок хороидного сплетения; белок, связывающий душистые вещества; белок железы Эбнера; пробазин и афродизин. Очевидно, липокалины оказывают регуляторное воздействие на воспалительный каскад и защищают от чрезмерного поражения тканей. См. Fowler D, FEBS Letters 354^ 7-11 (1994); Fowler D, J. Molec. Recognition 8: 185-195 (1995; Fowler D, Biochem. J. 318: 1-14 (1996). Белки - калицины можно создать методами генной инженерии, чтобы получать специфичность к заданному лиганду, как описано у Schlehuber S and Skerra A, Biophysical Chemistry 96: 213-228 (2002), в патентной заявке США 20050106660 и патентных заявках РСТ WO 99/16873, WO 00/75308 (все они вводятся в данное описание в качестве ссылки). Как описано в вышеуказанных патентных заявках РСТ, билинсвязывающий белок липокалин создан методами генной инженерии для специфического связывания с дигоксигенином и, следовательно, подходит под определение "антитело к дигоксину".
; основной белок мочи; билинсвязывающий белок; альфа-крустацианин; белок беременных 14; бета-лактоглобин; нейтрофильный липокалин и белок хороидного сплетения; белок, связывающий душистые вещества; белок железы Эбнера; пробазин и афродизин. Очевидно, липокалины оказывают регуляторное воздействие на воспалительный каскад и защищают от чрезмерного поражения тканей. См. Fowler D, FEBS Letters 354^ 7-11 (1994); Fowler D, J. Molec. Recognition 8: 185-195 (1995; Fowler D, Biochem. J. 318: 1-14 (1996). Белки - калицины можно создать методами генной инженерии, чтобы получать специфичность к заданному лиганду, как описано у Schlehuber S and Skerra A, Biophysical Chemistry 96: 213-228 (2002), в патентной заявке США 20050106660 и патентных заявках РСТ WO 99/16873, WO 00/75308 (все они вводятся в данное описание в качестве ссылки). Как описано в вышеуказанных патентных заявках РСТ, билинсвязывающий белок липокалин создан методами генной инженерии для специфического связывания с дигоксигенином и, следовательно, подходит под определение "антитело к дигоксину".
"Дигоксин-связывающая емкость (способность)" означает количество дигоксина, которое может связываться данным количеством композиции антитела к дигоксину. Например, одна виала DIGIBIND® содержит 38 мг тотального антитела к дигоксину и способно связывать около 0.5 мг дигоксина, т.е. одна виала имеет дигоксин - связывающую емкость 0.5 мг или 0.013 мг связанного дигоксина на мг антитела (0.5 мг дигоксина ÷ 38 мг тотального антитела). Точно так же виала с препаратом по данному изобретению DIGEPAB® содержит 40 мг тотального антитела к дигоксину и способно связывать около 0.5 мг дигоксина и одна виала имеет дигоксин - связывающую емкость 0.5 мг или 0.0125 мг связанного дигоксина на мг антитела (0.5 мг дигоксина - 40 мг тотального антитела). Дигоксин - связывающая емкость антител, которые не являются специфическими к дигоксину, но тем не менее реагируют или связываются с дигоксином, можно определять как описано ниже.
"нейтрализующая доза", в отношении "антитела к дигоксину" или "антител к дигоксину", для лечения цитокин - опосредованного состояния означает композицию антитела к дигоксину, имеющего величину дигоксин - связывающей емкости, которую надо вводить для нейтрализации нормированного количества TNF пациента, как если бы TNF был эквивалентен дигоксину и дигоксин в сравнимых концентрациях считался ядовитым или токсическим и лечение антителами к дигоксину было бы оправданным. Например, если пациент с тяжелым сепсисом, вес 100 кг, циркулирующая концентрация TNF составляет 400 пг/мл (0.4 нг/мл), то нейтрализующую дозу DIGIBIND® (38 мг антитела; дигоксин - связывающей емкость виалы 0.5 мг), в соответствии с прилагаемым к продукту вкладышем, можно определить следующим образом: (0.4 нг/мл × 100 кг)/100=4 виалы × 38 мг антитела/виала=15.2 мг антитела. Специалист в данной области техники может легко определить нейтрализующие дозы DIGIBIND® и DIGIFAB®, используя информацию и инструкции во вкладыше для таких композиций.
"с низкой дозой, низкодозовый" по отношению к "антителу к дигоксину" или "антителам к дигоксину" для лечения цитокин - опосредованного состояния означает композицию антитела к дигоксину с дигоксин - связывающей емкостью, превышающей нейтрализующую дозу, но меньшей, чем дигоксин - связывающая емкость 0.005 мг на кг массы тела пациента. Неограничивающие примеры низкодозовых (с низкой дозой) композиций представлены ниже, в Таблицах I и II.
"с высокой дозой, высокодозовый" по отношению к "антителу к дигоксину" или "антителам к дигоксину" для лечения цитокин - опосредованного состояния означает композицию антитела к дигоксину с дигоксин - связывающей емкостью 0.005 мг или более на кг массы тела пациента. Предпочтительно, "высокодозовая" композиция имеет дигоксин - связывающую емкость, представленную в любой из Таблиц III, IV или V.
"мг" означает миллиграмм или миллиграммы.
"µg" или "мкг" означает микрограмм или микрограммы.
"nг" означает пикограмм.
"нг" означает нанограмм или нанограммы.
"кг" означает килограмм или килограммы.
"мл" означает миллилитр или миллилитры.
"Общее клиническое впечатление" или "CGI" обозначает клиническую оценку (1) тяжести состояния больного на момент оценки ("CGI-S"), и/или (2) улучшения состояния больного с момента предыдущей оценки или первичной оценки тяжести ("CGI-I"). CGI предназначено для документального подтверждения общего клинического впечатления общего состояния больного. См. Guy W., ECDEU Assessment Manual for Psychopharmacology - Revised, Rockville, Maryland, U.S. Dept. Health and Human Services [Publ No ADM 76-338] (1976, pgs. 218-222). Хотя предпочтительными являются шкала CGI-S и шкала CGI-I, описанные ниже, для целей изобретения можно использовать оригинальные шкалы Guy или любую модифицированную форму шкалы CGI-S и/или CGI-I.
II. Предполагаемая роль натриевого насоса
Na+/K+ АТФ-аза представляет собой убиквитарный мембраносвязанный белок, который поддерживает химический и электрический градиент вдоль клеточной мембраны, направляя Na+ из клетки, а K+ внутрь клетки за счет гидролиза АТФ до АДФ. Энергия, выделяемая Na+/K+ АТФ-азой, приводит в движение другие транспортные, которанспортные и обменные системы, содействует движению катионов, анионов, аминокислот и глюкозы через клеточную мембрану и поддерживает жизненные функции клетки, включая электрический потенциал на мембране в возбуждаемых клетках, регуляцию осмотического равновесия и объем клетки, и внутриклеточные концентрации Na2+ и Ca2+. Активность Na+/K+ АТФ-азы меняется как реакция на изменения клеточной среды, чтобы сохранять низкий уровень внутриклеточного Na+ и нормальный электрохимический градиент.
Любое вещество или физиологическое состояние, которое меняет нормальную активность Na+/K+ АТФ-азы, вызывает изменение внутриклеточного Na+ и Ca2+ и электрохимического градиента, что приводит к различным дисфункциям клеток. Na+/K+ АТФ-аза является единственным известным рецептором сердечных гликозидов, таких как дигиталис, оуабин и маринобуфагенин. Присутствие сайта связывания экзогенных сердечных гликозидов наводит на мысль о существовании эндогенных ингибиторов натриевого насоса и их влиянии на регуляцию активности Na+/K+ АТФ-азы, гомеостаз внутриклеточного иона натрия и кальция, и тем самым ингибиторы натриевого насоса могут регулировать различные клеточные функции. Утверждалось, что аномальная активность натриевого насоса вызывает патофизиологию различных заболеваний, включая сердечно-сосудистые, неврологические, почечные и метаболические нарушения.
Показано, что оуабин стимулирует экспрессию генов провоспалительных цитокинов (например, TNF и GM-CSF) в мышиных макрофагах и человеческих фибробластах. См. Ohmori Y., et al„ J. Cell Physiol. 148: 96-105; Tamura M., et al., (1985) J. Biol. Chem. 260: 9672-9677. Ингибирование оуабином Na+/K+ АТФ-азы стимулирует также экспрессию гена VCAM-1 и экспрессию iNos. Bereta J., et al, FEBS Letters 377: 21-25 (1995).
Известно кроме того, что ингибирование Na+/K+ АТФ-азы вызывает разделение монослоев и разрыв в точке соединения клетка с клеткой. Contrers RG, et al., J. Cell Sci. 112: 4223-4231 (1999). Na+/K+ АТФ-азная активность требуется для опосредуемой E-кадхерином адгезии клетки к клетке в почечных эпителиальных клетках и для поляризации, подвижности клеток и подавления инвазии в эти клетки. Rajaskekaran SA., et al., Mol. Biol. Cell 12: 270-295 (2001). Было высказано мнение, что уровень Na+/K+ АТФ-азной активности оказывает значительное влияние на клеточную адгезию за счет воздействия на внутриклеточный Ca2+. Belusa R, et al., Am J. Physiol Cell Physiol 282: 302-309 (2002).
Поэтому в данном описании высказано теоретическое положение, что один или более признаков воспалительного ответа, включая эндотелиальную активацию и сосудистую проницаемость, могут опосредоваться Na+/K+ АТФ-азой.
III. Ингибиторы натриевого насоса
Известно, что сердечные гликозиды (карденолиды и буфадиенолиды) специфически ингибируют Na+/K+ АТФ-азу. Они состоят из двух структурных элементов, углеводного (сахара, гликозид) и не-углеводного (агликон) стероидного фрагментов. Гликозидный фрагмент может незначительно влиять на аффинность связывания натриевого насоса, но может изменять биофармацевтические или фармакокинетические свойства сердечного гликозида. Известно, что агликоновые фрагменты карденолидов и буфадиенолидов являются ингибиторами натриевого насоса. Pullen MA, et al., J. Pharm and Exp. Therapeutics 310 (10): 319-325 (2004). Агликоны общего класса карденолидов и буфадиенолидов изображены на Фиг.7A и 7B.
Эндогенные ингибиторы натриевого насоса присутствуют у пациентов с минералокортикоидной гипертензией (первичный альдостеронизм и синдром эктопической продукции кортикотропина), гипертонической болезнью, травмой головного мозга и гипертензией при состояниях с увеличенным объемом плазмы, включая нормотензивную беременность и беременность, осложненную вызванной беременностью гипертензией (преэклампсия/эклампсия). Эти эндогенные факторы ингибируют активность натрий-калий АТФ-азы in vitro и перекрестно реагируют с антителами к экзогенным ингибиторам натриевого насоса, например, дигоксину и оуабину. Эндогенные факторы описаны под разными названиями как "эндоксин", "эндобаин", "дигоксин-подобный", "дигиталис-подобный", дигидроксидигоксин, "эндогенный оуабин", "оуабин-подобный", дигидрооуабин, "дигидрооуабин-подобный", "просцилларидин A-подобный", "эндогенный маринобуфагенин", "маринобуфагенин-подобный (МБГ-подобный)", "буфалин-подобный" и 19-норбуфалин. Известно, что in vitro ингибирование натриевого насоса эндогенными факторами можно обратить или предупредить, добавляя антитела к карденолидам и буфадиенолидам, в частности, иммунный Fab к дигоксину. Pullen MA, et al., J. Pharm and Exp. Therapeutics 310 (10): 319-325 (2004).
Дигиталис или его составляющие, дигоксин или дигитоксин, являются основными кардиотоническими стероидами, которые используются для лечения сердечной аритмии, сердечной недостаточности и застойной сердечной недостаточности. Дигоксин и дигитоксин имеют узкие терапевтические интервалы (1.0-1.9 нмоля/л) или сывороточная концентрация дигоксина около 0.8-1.5 нг/мл), а сверхдоза этих лекарств встречается редко. Сверхдозу дигоксина и опасную для жизни токсичность дигоксина лечат введением поликлонального иммунного Fab (овечьего). Полагают, что антитела нейтрализуют эффекты дигоксина или дигиталиса, так как связывающий домен антитела связывается с сердечным гликозидом, тем самым предупреждая ингибирование или регуляцию им экспрессии или функции Na+/K+ АТФ-азы. Если антитело является специфическим к сердечному гликозиду, это антитело связывается с сердечным гликозидом с высокой аффинностью, способствуя удалению сердечного гликозида из ткани и тому, что образующийся в результате комплекс антиген/антитело удаляется из организма.
IV. Общие сведения о терапевтических антителах.
Как далее указывается в данном описании, неожиданно было обнаружено, что антитела к дигоксину эффективно модулируют TNF-индуцированную экспрессию молекул клеточной адгезии в эндотелиальной клетке сосудов и, тем самым, могут применяться при лечении одного или более цитокин - опосредованного состояния. Антитела к дигоксину по настоящему изобретению можно приготовить как описано ниже.
Все природные цельные антитела имеют общую коровую структуру из двух идентичных легких цепей, каждая длиной около 24 килодальтон, и две идентичных тяжелых цепи длиной около 55-70 килодальтон. Одна легкая цепь связана с каждой тяжелой цепью, а две тяжелые цепи связаны друг с другом. Как легкие, так и тяжелые цепи содержат ряд повторяющихся гомологичных элементов (единиц), каждый длиной около 110 аминокислотных остатков, которые независимо скручиваются (фолдинг) в общий мотив, называемый иммуноглобулиновым (Ig) доменом. Все Ig домены содержат гипервариабельные области ("CDR"), специфические к антигену или эпитопу и связывающиеся с антигеном или эпитопом. В организме каждого индивидуума содержится 108-1010 различных по структуре молекул антител. Различие последовательностей антител обнаруживается преимущественно в трех коротких аминокислотных последовательностях а аминоконцевых концевых вариабельных доменах тяжелой и легкой цепей, называемых гипервариабельными областями, чтобы отличить их от более консервативных "каркасных областей", которые фланкируют каждый CDR в вариабельных областях легкой и тяжелой цепей.
Несмотря на общее сходство, молекулы антител можно разделить на отдельные классы и подклассы с учетом физико-химических характеристик, таких как размер, заряд и растворимость, и их поведения при связываниями с антигенами. У человека классы молекул антитела включают IgA, IgD, IgE, IgG и IgM. Говорят, что члены каждого класса относятся к одному изотипу. Изотипы IgA и IgG дополнительно подразделяются на подтипы, называемые IgA1, IgA2 и IgG1, IgG2, IgG3 и IgG4. Тяжелые цепи всех молекул антитела в изотипе имеют общие протяженные области с гомологичными аминокислотными последовательностями, но отличаются от антител, принадлежащих к другим изотипам. Тяжелые цепи "сконструированы" для всего изотипа молекулы антитела, например, IgA содержит "альфа", IgD содержит "дельта", IgE содержит "ипсилон", IgG содержит ""гамма" и IgM содержит "мю". IgG, IgE и IgD циркулируют в виде мономеров. IgA циркулирует в виде мономера, а молекулы, секретирующиеся через эпителий в слизистую оболочку в полости тела, представляют собой гомодимеры. Молекулы IgM образуют пентамеры.
Животных можно инокулировать антигеном, чтобы продуцировать антитела, специфические к антигену. Часто антиген связывают или конъюгируют с другой молекулой для повышения иммунного ответа. Конъюгат по данному описанию представляет собой любой пептид, полипептид, белок или небелковое вещество, связанные с антигеном, который применяется для выработки иммунного ответа у животного. Антитела, продуцированные в организме животного в ответ на инокуляцию антигеном, представляют собой различные неидентичные молекулы (поликлональные антитела), полученные при использовании различных В лимфоцитов, продуцирующих индивидуальное антитело. Поликлональное антитело представляет собой смешанную популяцию видов антител, каждое из которых узнает разный эпитоп на одном и том же антигене. При корректных условиях получения поликлональных антител у животного большинство антител в сыворотке животного узнает общие эпитопы на антигеном соединении, против которого животное было иммунизировано. Эта специфичность дополнительно повышается с помощью аффинной очистки с целью выбрать только те антитела, которые узнают представляющий антиген или эпитоп.
Моноклональное антитело представляет собой единичный вид антитела, в котором любая молекула антитела узнает один и тот же эпитоп, так как все антителопродуцирующие клетки получены из одной клеточной линии В-лимфоцитов. Метод гибридом включает слияние единичного В лимфоцита с бессмертной миеломной клеткой (обычно мышиной миеломы). Этот метод позволяет размножать единичную антителопродуцирующую клетку в продолжение неопределенного числа поколений, так что можно получать неограниченные количества идентичных по структуре антител со специфичностью к одному и тому же антигену или эпитопу (моноклональные антитела). Однако, для применения в терапии целью метода гибридом является понизить у людей иммунную реакцию, которая может возникнуть в результате введения моноклональных антител, вырабатываемых клеточной линией нечеловеческой гибридомы.
Были разработаны методы для замены константных доменов легкой и тяжелой цепей моноклонального антитела на аналогичные домены человеческого происхождения, оставляя вариабельные области чужого антитела интактными. Или же, "полностью человеческие" моноклональные антитела продуцируют в организме мышей, трансгенных по отношению к генам человеческого иммуноглобулина. Также были разработаны методы превращения вариабельных доменов моноклональных антител в "более человеческую" форму, методами рекомбинантной ДНК конструируя вариабельные домены антитела, содержащие аминокислотные последовательности как человека, так и грызунов. В "гуманизированных" моноклональных антителах только гипервариабельная область CDR получена из мышиных моноклональных антител, а каркасные области получают из человеческих аминокислотных последовательностей. Полагают, что замена аминокислотных последовательностей в антителе, которые характерны для грызунов, на аминокислотные последовательности, находящиеся в соответствующем положении человеческого антитела, уменьшит вероятность (вредной) побочной иммунной реакции при применении в терапии. Гибридомную или другую клетку, продуцирующую антитело, можно также подвергнуть генетической мутации или другим изменениям, которые могут, или не могут, изменить специфичность связывания антител, продуцируемых гибридомой.
Можно создать генно-инженерные антитела, используя моноклональные и другие антитела и метод рекомбинантной ДНК для получения других антител или химерных молекул, которые сохраняют специфичность к антигену или эпитопу оригинального антитела, т.е. молекула имеет связывающий домен. Такие методы могут включать введение ДНК, кодирующей вариабельную область иммуноглобулина или области CDR антитела, к генетическому материалу для каркасных областей, константных областей или для константных областей плюс каркасных областей отличного антитела. См., например, патенты США No.5091513 и 6881557, которые вводятся в данное описание данной ссылкой.
Эти связывающие фрагменты обладают специфичностью связывания (CDR) по отношению к антигену или эпитопу, но не содержат аминокислотных последовательностей в консервативной каркасной области, поэтому меньше вероятность того, что они вызывают иммунный ответ у пациента. Антигенсвязывающий фрагмент по настоящему изобретению, предпочтительно, имеет связывающий домен, предоставляемый одним или более вариабельных доменов антитела к дигоксину, и, наиболее предпочтительно, связывающий домен антитела к дигоксину содержит вариабельную область легкой цепи (VL) антитела к дигоксину и вариабельную область тяжелой цепи (VH) антитела к дигоксину.
Примеры связывающих фрагментов, пригодных для настоящего изобретения, включают, без исключения: (i) фрагмент "Fab", состоящий из VL, VH, CL и СН1 доменов; (ii) фрагмент "Fd", состоящий из VH и СН1 доменов; (iii) фрагмент "Fc", состоящий из VL и VH доменов единичного антитела; (iv) фрагмент "dAb", который состоит из VH домена; (v) выделенные CDR области; (vi) фрагменты F(ab')2, бивалентный фрагмент, содержащий два связанных фрагмента Fab; (vii) одноцепочечные Fv молекулы ("scFv"), в которых VH домен и VL домен связаны пептидным линкером, позволяющим двум доменам ассоциировать с образованием связывающего дома; (viii) биспецифические одноцепочечные Fv димеры (см. патент США No.5091513) и (ix) "диатела" (diabodies), мультивалентные или мультиспецифические фрагменты, созданные слиянием генов (опубликованная патентная заявка США 20050214860). Молекулы Fv, scFv или диател можно стабилизировать, вводя дисульфидные мостики, связывающие VH и VL домены. Можно также получать мини-антитела, содержащие scFv, связанный с СН3 доменом (Hu S., et al, Cancer Res., 56: 3055-3061 (1996)).
Известными способами, представленными в данном описании, можно создать поликлональные или моноклональные антитела, связывающие фрагменты и связывающие домены и CDR (включая генно-инженерные формы их всех), специфические к EF, карденолидам и буфадиенолидам и их агликонным частям, одному или более их соответствующих эпитопов, или конъюгатам всех описанных выше частиц, вне зависимости от того, выделены ли такие антигены или эпитопы из природных источников или являются синтетическими производными или вариантами природных соединений.
Антитела можно получать из любого источника, включая птиц и млекопитающих. Предпочтительно, антитела являются антителами овцы, мышиными антителами (например, мыши и крысы), антителами кролика, козы, морской свинки, верблюда, лошади или кур. Кроме того, новейшие технологии позволяют разрабатывать и проводить скрининг на человеческие антитела комбинаторных библиотек антител человека. Например, метод экспрессии антител к бактериофагу способствует продуцированию специфических антител без иммунизации животного, как описано в патенте США 6946546, который вводится в данное описание этой ссылкой. Эти методы подробнее описаны в: Marks, Bio/Technology 10: 779-783 (1992); Stemmer, Nature 370: 389-391 (1994); Gram et al., Proc. Nati Acad. Sci., USA, 89: 3576-3580 (1992); Barbas et al., Proc. Natl. Acad. Sci., USA, 91: 3809-3813 (1994); и Schier et al., J. Mol. Biol. 263: 551-567 (1996).
Методы получения поликлональных антител в различных видах животных, а также методы получения моноклональных антител различных типов, включая гуманизированные, химерные и полностью человеческие, хорошо известны в уровне техники и в высшей степени прогнозируемы. Кроме того, антитела к различным сердечным гликозидам, включая дигоксин, оуабин, буфалин и маринобуфагенин, имеются в продаже, а методы получения этих антител также хорошо известны предсказуемы. Например, в нижеприведенных патентах и патентных заявках США приводятся поясняющие описания таких методов, и эти патенты и патентные заявки вводятся в данное описание в качестве ссылок: опубликованные патентные заявки США No. 2004/0126828 и 2002/0172677; и патенты США No. 3817837; 3850752; 3939350; 3996345; 4196265; 4275149; 4277437; 4366241; 4469797; 4472509; 4606855; 4703003; 4742159; 4767720; 4816567; 4867973; 4938948; 4946778; 5021236; 5164296; 5196066; 5223409; 5403484; 5420253; 5565332; 5571698; 5627052; 5656434; 5770376; 5789208; 5821337; 5844091; 5858657; 5861155; 5871907; 5969108; 6054297; 6165464; 6365157; 6406867; 6709659; 6709873; 6753407; 6814965; 6849259; 6861572; 6875434 и 6891024. Все патенты, опубликованные патентные заявки и другие публикации, цитируемые в данном описании и в этих материалах, ссылками вводятся в данное описание.
Абсолютно ожидаемо, что антитела к специфическому EF (эндогенному фактору), карденолиду или буфадиенолиду будут обладать способностью нейтрализовать или воздействие сердечных гликозидов или противодействовать им вне зависимости от вида животного, моноклональной клеточной линии или другого источника антитела. Например, хотя антитело, используемое в разделе Биологические Примеры по настоящему описанию продуцировалось в овце, полагают, что в организме других животных, иммунизированных тем же самым или аналогичным карденолидом или буфадиенолидом, выработаются поликлональные антитела, эффективные для целей настоящего изобретения. Некоторые виды животных могут быть менее предпочтительны для получения терапевтических антител, так как более вероятно, что они вызывают аллергическую реакцию вследствие активации системы комплемента через "Fc" участок антитела. Однако, цельные антитела можно расщеплять ферментативно с образованием фрагмента "Fc" (связывающего комплемент) и связывающих фрагментов, имеющих связывающий домен или CDR. Удаление участка Fc уменьшает вероятность того, что антигенсвязывающий фрагмент выявит нежелательный иммунологический ответ и, следовательно, антитела без Fc могут быть предпочтительны для профилактического или терапевтического лечения. Как описано выше, антитела можно также создать таким образом, что они будут химерными, частично или полностью человеческими, с тем, чтобы уменьшить или исключить вредные иммунологические последствия от введения животному антитела, которое получено в другом виде или имеет последовательности другого вида.
Известно, что EF перекрестно реагируют антитела или иным образом связывают с этими антителами к экзогенным карденолидам и буфадиенолидам, хотя и менее специфическим образом. Кроме того, известно, что антитела к конкретному карденолиду или буфадиенолиду перекрестно реагируют с другими карденолидами и буфадиенолидами, хотя обычно менее специфическим образом. Так, полагают, что любое такое перекрестно-реактивное антитело будет способно нормализовать эффект неспецифического сердечного гликозида или EF или противодействовать ему. Например, известно, что антитело против маринобуфагенина проявляет представленную ниже перекрестную реактивность (выраженную в процентах) к различным кардиотоническим стероидам: маринобуфагенин (100%); оуабин (0.1%); дигоксин (1.0%); дигитоксин (3.0%); буфалин (1.0%); просциллардин (1.0%). Известно, что антитело против оуабина проявляет представленную ниже перекрестную реактивность к различным кардиотоническим стероидам: оуабин (100%); дигитоксин (7.4%); просциллардин (0.2%); маринобуфагенин (0.5%); буфалин (0.03%). Известно, что антитело против дигоксина проявляет представленную ниже перекрестную реактивность к различным кардиотоническим стероидам: дигоксин (100%); оуабин (0.4%); оубагенин (0.1%); маринобуфагенин (0.2%); буфалин (2.7%); цинобуфалин (4.3%); цинобуфагин (0.02%). Предполагается, что эти примеры иммунологической иммунореактивности никоим образом не ограничивают объем изобретения по данному описанию.
Если связывание или перекрестная реактивность неспецифического антитела приводит в результате к пониженной аффинности антиген - антитело или если EF, карденолид или буфадиенолид имеет биофармацевтические или фармакокинетические характеристики, которые отличаются от характеристик сердечного гликозида или EF, специфического к антителу, тогда для нейтрализации или противодействия эффектам неспецифического EF, карденолида или буфадиенолида потребуется большее количество антитела. Тем не менее, точно рассчитывают и знают, что in vitro антитела к специфическому карденолиду или буфадиенолиду будут способны нейтрализовать ингибирование натриевого насоса и противостоять этому ингибированию, вызванному отличным карденолидом или буфадиенолидом или одним или более EF. Рядовой специалист в данной области техники может разработать подходящие композиции антител и лекарственные схемы известными методами, учитывая уровень ингибирования натриевого насоса, перекрестную реактивность, связывающую аффинность или авидность, биофармацевтические и/или фармакокинетические свойства специфического EF, карденолида и буфадиенолида по сравнению с неспецифическим.
Для определения эффективной композиции антитела для нейтрализации отравления (интоксикации) экзогенным карденолидом или буфадиенолидом обычно требуется, среди прочего, определение (лекарственной) нагрузки на организм. Факторы, которые влияют на терапевтически эффективные композиции антитела, включают, среди прочего, известную или предполагаемую общую нагрузку антигена на организм, достигает ли он равновесного состояния, биодоступность (свободного и связанного белка), биофармацевтические и фармакокинетические свойства антигена (например, аффинность антигена к своему рецептору и биоактивность), вес или объем пациента, анамнез-функция печени и почек.
Вообще, когда антиген достигает равновесия в организме, концентрация антигена (связанного и несвязанного) в тканях и во внеклеточных жидкостях отражается в плазматической и сывороточной концентрации. Общая нагрузка экзогенного антигена на организм обычно равна равновесной сывороточной концентрации антигена, умноженной на кажущийся объем распределения (объем жидкости, требующийся для того, чтобы содержать антиген в организме в такой же концентрации, что и в плазме). Таким образом, композицию антитела, обычно требующаяся для нейтрализации общей нагрузки на организм, можно определить, исходя из связывающей емкости (способности) единицы (элементарного объема) и общей нагрузки антигена на организм.
V. Композиции антител к дигоксину
Неизвестно, чтобы провоспалительные цитокины (например, TNF) связывали натриевый насос и имели эпитопы, гомологичные натриевому насосу или любому карденолиду или буфадиенолиду. Поэтому не предполагали, что антитела к дигоксину способны модулировать или смягчать действие любого провоспалительного цитокина.
Неожиданно было найдено, что антитела к дигоксину эффективно модулируют и ослабляют экспрессию на поверхности клеток различных молекул клеточной адгезии, которые требуются для воспаления, в частности, для лейкоцитарно-эндотелиальной клеточной адгезии и трансмиграции лейкоцитов в ткани. Предполагается, что in vivo модуляция или ослабление действия TNF на экспрессию молекул клеточной адгезии будет вызывать соответствующий эффект уменьшения лейкоцитарно-эндотелиального взаимодействия (захват, роллинг и/или адгезию), тем самым снижая трансмиграцию лейкоцитов в ткань и уменьшая воспаление. Следовательно, полагают, что антитела к дигоксину могут применяться и могут быть терапевтически эффективны для лечения одного или более цитокин - опосредованных состояний.
Предполагалось, что можно дать пациенту антитела к дигоксину в терапевтически эффективном количестве для ослабления экспрессии молекул клеточной адгезии, которая индуцируется TNF, в соответствии со схемой на Фиг. 1. Аналогично, если до проявления клинических или физиологических симптомов инфекции или патологии определят, что пациент имеет предрасположенность к развитию или у него повышенный риск развития цитокин - опосредованного состояния, или повышенный риск появления повышенных уровней провоспалительного цитокина, терапевтически эффективное количество антитела к дигоксину можно вводить для профилактики для модуляции ожидаемого действия TNF на экспрессию молекул клеточной адгезии. Хотя в данном описании даются неограничивающие примеры, следует подчеркнуть, что настоящее изобретение не ограничивается какой-либо конкретной композицией, дозой или интервалом доз антител к дигоксину, или антителами к дигоксину какого-либо конкретного типа (например, поликлональными, моноклональными, химерными, генно-инженерными) или полученными из какого-либо конкретного источника или каких-либо конкретных источников (например, человеческими, овечьими, мышиными и т.д.).
Терапевтически эффективная композиция антитела к дигоксину модулирует или ослабляет TNF-индукцию экспрессию на поверхности клеток одной или более молекул клеточной адгезии, включая молекулы эндотелиальной клеточной адгезии, которые ведут себя как рецепторы к лейкоцитарным лигандам адгезии. Предпочтительно, терапевтически эффективная композиция антитела к дигоксину модулирует или ослабляет TNF-индуцированную экспрессию ICAM-1, VCAM-1, P-селектина или E-селектина на клеточной поверхности в одном или более типов клеток, тканей и/или органов, предпочтительно, в эндотелиальных клетках, и, наиболее предпочтительно, в эндотелиальных клетках сосудов.
Терапевтически эффективная композиция антитела к дигоксину может также повысить активность Na+/K+ АТФ-азы и/или облегчаемый Na+/K+ перенос иона или питательного вещества в одном или более типах клеток или тканей, и, наиболее предпочтительно, в клетках, тканях или органах, на которые оказывает негативное влияние цитокин - опосредованное состояние, такие как сосудистые эндотелиальные клетки и лейкоциты. Терапевтически эффективным количеством может также являться количество, повышающее экспрессию генов Na+/K+ АТФ-азы (например, повышающее матричную рибонуклеиновую кислоту (мРНК), соответствующую гену натриевого насоса, причем эти мРНК транскрибируются в полипептиды или белки, которые образуют натриевый насос), или повышающее транслокацию в клеточную мембрану, или понижающее Na+/K+ АТФ-азы деградацию или рециклинг в конкретных клетках, тканях или органах, на которые влияет цитокин - опосредованное состояние.
Терапевтически эффективная композиция антитела к дигоксину, при введении ее пациенту с симптомами цитокин - опосредованного состояния, предпочтительно, дает клинически благотворный эффект, а именно, облегчение, снижение интенсивности, уменьшение или ингибирование или улучшение одного или более симптомов конкретного цитокин - опосредованного состояния, или улучшение общего состояния пациента. Клинически благотворный эффект может привести к существенному изменению конкретного медицинского показателя по сравнению с базовой (нулевой) линией (т.е. до введения антитела к дигоксину) и, наиболее предпочтительно, к снижению CGI-S или к позитивному изменения CGI-I у пациента. Или же, терапевтически эффективное количество представляет собой количество, достаточное для стабилизации симптома цитокин - опосредованного состояния, так чтобы симптом не становился существенно хуже.
Показатели, которые можно оценивать или которые могут указывать на терапевтическую эффективность композиции антитела к дигоксину (или другого терапевтического агента), могут включать, без ограничения: GCI-S или GCI-I; частоту сердечных сокращений, дыхание (например, частоту или PaCO2), систолическое или диастолическое кровяное давление или среднее артериальное давление; перфузию ткани или органа; количество выделяемой мочи, уровни белка в моче (протеинурию) или клиренс креатинина; уровни сывороточного креатинина, лактатдегидрогеназы (LDH), печеночных ферментов (например, аланинаминотрансферазы или аспартатаминотрансферазы), билирубина или мочевинного азота (BUN) в крови; число лейкоцитов; число тромбоцитов; число эритроцитов или гемолиз; периферический отек, отек легкого, отек мозга или церебральную геморрагию; боль, неврологическую функцию и/или неврологическую восприимчивость, сознание, психическое состояние или неврологические отклонения, нарушения или расстройства; или любой другой медицинский показатель, который можно оценить применительно к конкретному цитокин - опосредованному состоянию.
Фармацевтические композиции по изобретению можно вводить любому животному, которое может чувствовать благотворное действие композиций по настоящему изобретению. Главными среди таких животных являются млекопитающие, например, люди, хотя не предполагается такое ограничение изобретения. Другие млекопитающие включают: животных из зоопарков, таких как шимпанзе, макаки, бабуины, человекообразные обезьяны, тигры, львы, медведи и т.п.; сельскохозяйственные животные, такие как коровы, овцы, свиньи, козы и т.п.; и домашние животные, такие как лошади, собаки, кошки и т.п.
Для терапевтического применения композиции антитела к дигоксину можно вводить в любой обычной лекарственной форме любым традиционным способом, все они хорошо известны в уровне техники. Композиции по изобретению можно вводить пациенту любым методом или комбинацией методов, включая, без ограничения, пероральный, топический, ингаляционный, внутривенный, интрасиновиальный, чресслизистый (например, назальный, вагинальный и т.д.), легочный, подкожный или интрадермальный или трансдермальный (инъекция, или инфузия, или пластырь), глазной, трансбуккальный (защечный), подъязычный, подоболочечный, внутримышечный или в виде депо-препарата пролонгированного действия, или другие способы, известные в уровне техники для введения антител, связывающих фрагментов, связывающих доменов, CDR, пептидов, кальциинов или веществ, созданных с применением любого из перечисленных.
Для любой формы или для любого метода введения, в особенности для чресслизистого, подкожного, интрадермального, трансдермального, внутримышечного или внутривенного введения (включая внутривенные болюсные инъекции или болюсные инфузии) композиции могут содержать фармацевтически приемлемые носители или эксципиенты, включая, без ограничения, глюкозу, декстрозу, физиологический солевой раствор, раствор Рингера или раствор Рингера-лактат, стерильную воду для инъекций, воду или другую фармацевтически приемлемые носители или эксципиенты. Предпочтительно, pH корректируют соответствующим образом, композиции разумно буферизуют и делают изотоническими и стерилизуют соответствующим методом (например, нагреванием, облучением или микрофильтрацией), который не наносит вреда ни одному компоненту композиции и который не делает композицию, или любой ее компонент, неэффективной (или неэффективным) или менее эффективной (или менее эффективным).
Для внутривенного введения нагрузочную дозу можно вводить внутривенной болюсной инъекцией или болюсной инфузией с последующей пролонгированной внутривенной инфузией композиции. Или же, можно вводить нагрузочную дозу с последующей болюсной дозой или можно применять комбинацию болюсных и пролонгированных инфузии. Аналогично, можно время от времени изменять непрерывную инфузию, чтобы за период времени вводить большие или меньшие количества антитела к дигоксину.
Композиции по изобретению можно вводить самостоятельно или в комбинации с адъювантами, которые повышают стабильность композиции, облегчают введение композиций, содержащих их в некоторых вариантах изобретения, обеспечивают повышенное растворение или повышенную диспергируемость, повышают активность, обеспечивают дополнительную терапию и т.п., включая другие активные ингредиенты или другие терапевтические агенты. Преимущественно в таких комбинированных лекарствах используются более низкие дозы других терапевтических агентов, тем самым избегают возможной токсичности и вредных побочных эффектов, возникающих, когда другие терапевтические агенты используются в виде монолекарств (монотерапия). Вышеописанные композиции антитела к дигоксину можно физически объединить с другими терапевтическими агентами или другими адьювантами в единую фармацевтическую композицию.
Эффективность вводимой композиции антитела к дигоксину может зависеть от ряда факторов, например: фармацевтических характеристик конкретного терапевтического агента и его способа и пути введения; типа пациента (например, человек, лошадь, собака и т.д.); физического состояния пациента, здоровья (включая наличие какого- либо заболевания, симптома или синдрома), пола, возраста и веса; предполагаемой продолжительности лечения; наличия факторов, предрасполагающих к любому заболеванию, симптому или синдрому; характера и степени симптомов и тяжести состояния, подлежащего лечению; реакции пациента на одну или более ранее вводимых доз антитела к дигоксину и/или других терапевтических агентов, или других соединений или композиций, вводимых одновременно; и частоты лечения антителом к дигоксину и другими подобными терапевтическими агентами, или соединениями или композициями, и ожидаемого эффекта.
Терапевтическая композиция содержит некоторое количество антитела к дигоксину, предпочтительно, по меньшей мере, нейтрализующую дозу антитела к дигоксину, более предпочтительно, представляет собой низкодозовую композицию антитела к дигоксину и, наиболее предпочтительно, высокодозовую композицию антитела к дигоксину. В одном варианте изобретения терапевтически эффективная композиция содержит антитело к дигоксину, достаточное для обеспечения, примерно, 0.001 мг - 500 мг дигоксинсвязывающей емкости на кг веса тела пациента. В другом варианте изобретения композиция содержит, примерно, 0.005-500 мг дигоксинсвязывающей емкости на кг веса тела пациента. В других вариантах изобретения композиция обеспечивает, примерно, 0.005-50 мг, или 0.01-1.0 мг дигоксинсвязывающей емкости на кг веса тела пациента или примерно, 0.01-0.5 мг дигоксинсвязывающей емкости на кг веса тела пациента.
Терапевтически эффективные композиции антитела к дигоксину специалист в данной области техники может легко определить, проверяя у пациента признаки отсутствия, стабилизации, облегчения состояния, уменьшения, ингибирования или улучшения одного или более показателей, симптомов или осложнений цитокино-посредованного состояния (например, показателей, описанных выше), и, соответственно, сохраняя, повышая или понижая количество антител к дигоксину и/или частоту или способ введения, определяемые клиницистом.
Антитела по настоящему изобретению можно получать любым из различных описанных выше способов (например, поликлональные, моноклональные, химерные, гуманизированные и другие генно-инженерные формы антител). Антитела к дигоксину, специфические к различным экзогенным карденолидам и буфадиенолидам, хорошо известны в уровне техники и имеются в продаже, включая, без ограничения, антитела к дигоксину, оуабину и маринобуфагенину.
Так как дигоксин и дигитоксин являются основными кардиотоническими стероидами, которые применяются в качестве терапевтических агентов, продукты антител для лечения передозировки дигоксина или дигитоксина хорошо известны в уровне техники и были специально одобрены для терапевтического применения в связи с возможностью опасного для жизни отравления (интоксикации) дигоксином и дигитоксином. В редких случаях антитела против дигоксина или дигитоксина (или их конъюгаты) используют "не по одобренным показаниям" для лечения жизнеопасной интоксикации другими экзогенными карденолидами или буфадиенолидами. Morbidity and Mortality Weekly Report 44 (46): 853-855, 861 (Nov.24, 1995); Eddleston, M. and Warrell, D.A., Q J Med. 92: 483-485 (1999); см. также Brabacher JR, Ravikumar PR et al., Chest 110: 1282-1288 (1996); Brabacher JR, Lachmanen D, et al., Toxicon 37: 931-942 (1999).
Композиции иммунного фрагмента Fab (овечьего) к дигоксину, эффективные для лечения опасной для жизни интоксикации дигоксином/дигитоксином, в настоящее время выпускаются фирмой GlaxoSmithKline в Соединенных Штатах под торговым названием DIGIBIND® и фирмой Protherics, Inc. под торговой маркой DIGIFAB™. Иммунные продукты Fab к дигоксину, эффективные для лечения опасной для жизни интоксикации дигоксином/дигитоксином, могут производиться и продаваться за пределами Соединенных Штатов под другими торговыми названиями. Клинические исследования по сравнению DIGIBIND® и DIGIFAB™ показывают, что эти продукты имеют одинаковую фармакокинетику, а доля пациентов, отвечающих на DIGIFAB™, аналогична и соответствует статистическим данным для DIGIBIND®.
DIGIBIND® представляет собой стерильный лиофилизированный порошок антигенсвязывающих фрагментов (Fab), получаемых из специфических антител против дигоксина, вырабатываемых у овец. Получение DIGIBIND® включает конъюгацию дигоксина в виде гаптена с человеческим альбумином. Овец иммунизируют этим материалом для получения антител, специфических к антигенной детерминанте молекулы дигоксина. Затем антитело расщепляют папаином и специфические к дигоксину Fab фрагменты антитела выделяют и очищают аффинной хроматографией. Эти фрагменты антитела имеют молекулярную массу около 46200 Да. В случае настоящего препарата DIGIBIND® одна виала связывает около 0.5 мг дигоксина (или дигитоксина) и содержит 38 мг дигоксин - специфических Fab фрагментов плюс 75 мг сорбита в качестве стабилизатора и 28 мг хлорида натрия. Виала не содержит консервантов. DIGIBIND® вводят внутривенной инъекцией после реконституции (восстановления) стерильной водой для инъекций (4 мл на виалу) при слабом перемешивании, получают прозрачный бесцветный примерно изоосмотический раствор. Восстановленный продукт следует применять сразу же или его можно хранить в холодильнике при температуре 2-8°C (36-46°F) не более 4 часов. Восстановленный продукт можно разводить стерильным изотоническим физиологическим солевым раствором до нужного объема.
DIGIFAB™ представляет собой стерильный очищенный лиофилизированный препарат иммунных Fab (одновалентных) фрагментов к дигоксину овечьего иммуноглобулина. Эти фрагменты получают из крови здоровых овец, иммунизированных производным дигоксина, дигоксин - дикарбоксиметоксиламином (DDMA), который содержит функционально важный фрагмент циклопентапергидрофенантрена лактонный цикл, связанный с гемоцианином фисурелла (лимфы улитки). Овцы не содержат патогенов и происходят из стад в Австралии, в которых отсутствуют прионы. Конечный продукт получают, выделяя иммуноглобулиновую фракцию овечьей сыворотки, расщепляя ее папаином и выделяя специфические к дигоксину фрагменты аффинной хроматографией. Эти фрагменты антитела имеют молекулярную массу около 46000 Да. В случае настоящего препарата DIGIFAB™ одна виала связывает около 0.5 мг дигоксина и содержит 40 мг дигоксин-специфических Fab фрагментов, около 75 мг маннита USP и около 2 мг ацетата натрия (буферизующий агент). Продукт не содержит консервантов и предполагается для внутривенного введения после восстановления с помощью 4 мл стерильной воды для инъекций USP. Восстановленный продукт можно добавлять к нужному объему 0.9% раствора хлорида натрия для инъекций.
DIGIBIND® и DIGIFAB™ не показаны в более легких случаях отравления (интоксикации) дигиталисом (дигоксином или дигитоксином), а предписываются только при опасном для жизни или потенциально опасном для жизни отравлении (интоксикации) дигоксином или дигитоксином. Хотя DIGIBIND® и DIGIFAB™ разработаны специально для лечения в случае жизнеопасной передозировки дигоксина, их с успехом используют также в случае чрезмерной дозы дигитоксина. Однако, так как человеческий опыт ограничен, а последствия многократного воздействия неизвестны, DIGIBIND® и DIGIFAB™ не показаны в более легких случаях отравления (интоксикации) дигиталисом. Клинические показания для утвержденного FDA применения DIGIBIND® и DIGIFAB™ не включает никаких состояний, кроме признанного опасного для жизни отравления дигоксином или дигитоксином. Для целей настоящего изобретения опасное для жизни (угрожающее жизни, жизнеопасное) отравление (иногда в данном описании говорится просто "отравление" (интоксикация) или "отравленный") экзогенными карденолидами и буфадиенолидами означает: (а) смертельные дозы 10 мг у ранее здоровых взрослых или 4 мг у ранее здоровых детей; (б) прием, в результате которого величина равновесной сывороточной концентрации составляет более 10 нг/мл; или (в) регулярный прием, в результате которого величины равновесных сывороточных концентраций составляют более 6 нг/мл у взрослых или более 4 мг/мл у детей. DIGIBIND® и DIGIFAB™ мешают проведению измерений в иммуноанализе дигиталиса. Так, стандартное определение концентрации сывороточного дигоксина (или "дигоксин") может быть клинически ложным до тех пор, пока антитело не будет удалено из организма. Композиция DIGIBIND® или DIGIFAB™ для лечения отравления зависит от количества нейтрализуемого дигоксина или дигитоксина.
Однако, цитокин - опосредованные состояния не вызываются отравлением экзогенными карденолидами или буфадиенолидами. Цитокин - опосредованные состояния ассоциированы с повышенными уровнями TNF и, таким образом, композиции и методы по настоящему изобретению обеспечивают, что терапевтически эффективные композиции антитела к дигоксину для лечения цитокин - опосредованных состояний можно определить исходя из концентрации цитокинов у пациента. Непосредственные измерения цитокинов в ткани или в жидкости организма можно осуществлять анализами, позволяющими обнаруживать провоспалительные цитокины, включая TNF, которые хорошо известны в уровне техники и имеются в продаже (например, иммуноанализы, выпускаемые Bioveris, Alpco Diagnostics, Neogen). Терапевтически эффективную композиции антител к дигоксину, предпочтительно, определяют на основании уровня TNF-α в сыворотке, плазме или ткани пациента.
Следует отметить, что циркулирующие (плазматические или сывороточные) уровни TNF у нормальных здоровых людей или у здоровых лабораторных животных оценивается, примерно, как 10 пг/мл, величина, которая может являться нижним пределом обнаружения наиболее чувствительными методами анализа TNF. Michie et al., New Eng. J. Med. 318: 1481-1486 (1988); Mathison et al., J. Clin. Invest. 81: 1925 (1988) и Waage et al., Lancet, 1: 355-357 (1987). Показано, что после экспозиции с липополисахаридом ("LPS"), бактериальным компонентом, ассоциированным с сепсисом, уровни TNF повышаются в 10-20 раз, примерно, до 400 пг/мл. Сывороточные уровни TNF коррелируют со смертельным результатом при инфекции грамотрицательными (LPS-содержащими) бактериями менингококка. Waage et al., Lancet, 1: 355-357 (1987). Помимо этого, аналогичное повышение TNF отмечается на моделях сепсиса человекообразных приматов и эти изменения прямо коррелируют со смертностью. Тгасеу et al., Nature, 330: 662-664, (1987). Таким образом, предполагается, что концентрация TNF (предпочтительно, концентрация TNF-α) в ткани или жидкости организма пациента послужит подходящей основой для выбора эффективной композиции антитела к дигоксину для терапевтических целей.
Композиции в объеме данного изобретения включают все композиции, в которые композиции антитела к дигоксину по настоящему изобретению входят в количестве, которое эффективно для достижения предполагаемой цели по описанию выше. Когда отдельному пациенту требуется вариант, определение оптимальных интервалов терапевтически эффективных количеств композиции антитела к дигоксину находится в компетенции специалиста в данной области техники.
Примеры терапевтически эффективных нейтрализующих низкодозовых и высокодозовых композиций антител к дигоксину приводятся в данном описании. Предпочтительно, композиции содержат количество антитела к дигоксину, достаточное для обеспечения 0.005 мг или более дигоксин - связывающей емкости на кг веса пациента (например, высоко дозовая композиция антитела к дигоксину). Терапевтически эффективные композиции для профилактики могут иметь также дигоксин - связывающую емкость 0.0005-0.005 мг на кг веса пациента (например, низкодозовая композиция антитела к дигоксину).
Примеры низкодозовых и высокодозовых фармацевтических композиций антител к дигоксину для людей с типичным весом описаны в Таблицах I, II, III, IV и V. Для человека или другого млекопитающего, вес которого менее 40 кг, соответствующую композицию можно определить, разделив вес пациента на 40 и умножив результат на дигоксин - связывающую емкость для пациента весом 40 кг в соответствии с Таблицами I-V. Для животных весом более 140 кг соответствующую композицию можно определить, разделив вес животного на 100 и умножив результат на дигоксин - связывающую емкость в интервале дигоксин - связывающих емкостей, приведенных в Таблицах I-V для пациента весом 100 кг. Например, если пациент весит 500 кг, а сывороточная концентрация TNF составляет 10 пг/мл, тогда соответствующая композиция антитела к дигоксину в соответствии с Таблицей IV: 500/100×4.0 мг дигоксин - связывающей емкости =20 мг дигоксин - связывающей емкости (или 40 виал либо DIGEBIND®, либо DIGIFAB™ в препаратах, описанных в примечаниях к Таблице V).
В Таблице I определены низкодозовые композиции антитела к дигоксину для лечения цитокин - опосредованных состояний в интервале циркулирующего TNF, который наблюдается у людей:
В Таблице II определяются низкодозовые композиции DIGIBIND® или DIGIFAB™ для лечения цитокин - опосредованных состояний в интервале циркулирующего TNF, наблюдаемом у людей:
В Таблице III определяются промежуточные дозы между Таблицами II и IV.
В Таблице V определяются высокодозовые композиции DIGIBIND® или DIGIFAB™, которые соответствуют композициям в Таблице IV.
Композиции в Таблицах I, II, III, IV и V лишь являются предпочтительными композициями, а композиции, которые могут быть терапевтически эффективными для пациента с каким-либо конкретным весом или для с любой концентрацией циркулирующего или локализованного цитокина (например, TNF) может иметь дигоксин - связывающую емкость больше или меньше указанных предпочтительных количеств. Что касается концентраций TNF, промежуточных между конкретными значениями, указанными в Таблицах I, II, III, IV и V, в большинстве случаев следует давать количество композиции, промежуточное между количествами для следующей более низкой и следующей более высокой концентрацией для пациента с данным весом. Аналогично, при весе пациентов, промежуточном между значениями, перечисленными в Таблицах I, II, III, IV и V, в большинстве случаев следует давать дозу для следующего самого большого веса для конкретной концентрации TNF. Однако, если можно получить промежуточное количество, промежуточное количество является предпочтительным. Например, если сывороточная концентрация TNF (определенная или предположительно имеющаяся, если исходить из тяжести одного или более симптомов и известных концентраций у других пациентов с аналогичными симптомами или расстройствами) равна 100 пг/мл для пациента весом 115 кг, следует вводить терапевтическую композицию, содержащую 9 виал DIGIBIND® или DIGIFAB™ (Таблица V).
Для препаратов антитела к дигоксину (т.е. стандартных доз), включающих, без ограничения, DIGIBIND® и DIGIFAB™, которые имеют дигоксин - связывающую емкость, большую или меньшую чем препараты DIGIBIND® и DIGIFAB™ в Таблице II или V (обычный препарат 0.5 мг дигоксин - связывающей емкости на виалу), композиции антитела следует корректировать, чтобы получить дигоксин - связывающую способность, эквивалентную дигоксин - связывающей способности композиций (# виал), описанных в Таблице II или V.
Предпочтительно получить концентрацию TNF в ткани или жидкости организма (предпочтительно, плазмы или сыворотки) перед начальным введением антитела к дигоксину. Хотя предпочтительно определить концентрацию TNF перед введение антитела к дигоксину, это не обязательно делать для определения терапевтически эффективной композиции. Если концентрацию TNF нельзя легко определить количественно, пациенту можно сначала дать композицию, соответствующую тяжести симптомов конкретного цитокин - опосредованного состояния. Обычно слабые симптомы сначала можно лечить композицией с терапевтической нейтрализующей дозой или с низкой дозой (низкодозовой композицией), например, в соответствии с Таблицей I или Таблицей II, или дозой, соответствующей пониженной концентрации цитокина (например, концентрации TNF 10 пг/мл или 25 пг/мл) из Таблицы III, IV или V. Обычно композиции для слабых симптомов и профилактического лечения выбирают сначала из композиций с нейтрализующей дозой или из нижнего интервала низкодозовых композиций из Таблиц I или II. При всех обстоятельствах в ходе лечения следует проводить мониторинг пациентов, контролируя улучшение, смягчение, уменьшение интенсивности, стабилизацию или ухудшение симптомов или осложнения. Если реакция пациента на композицию антитела к дигоксину клинически адекватна, по мнению лечащего врача, тогда композицию можно вводить повторно по мере необходимости, чтобы удержать заданную реакцию. Если адекватная реакция не достигается с помощью композиции, или если требуется более сильная реакция, тогда в процессе одного или более последующих введений следует дать композицию, содержащую большее количество активного ингредиента (дигоксин - связывающей емкости).
Более тяжелые симптомы сначала можно лечить количествами композиций в среднем интервале для веса пациентов в соответствии с Таблицами I-V. И снова, следует проводить мониторинг пациентов, обычными методами контролируя улучшение, смягчение, уменьшение интенсивности, стабилизацию или ухудшение симптомов или осложнений, так, чтобы композицию можно было корректировать (уменьшать или увеличивать количество активного ингредиента) в соответствии с решением лечащего врача. Только в качестве иллюстрации и без ограничения, пациенту, вес которого составляет 70 кг, с симптомами тяжелого сепсиса сначала можно ввести 3 виалы DIGIBIND® или DIGIFAB™, или антитела к дигоксину в виде другого препарата, имеющего около 1.5 мг дигоксин - связывающей емкости. В другом примере, если имеется септический шок, пациенту сначала можно вводить композицию из 4-6 виал DIGIBIND® или DIGIFAB™, или антитела к дигоксину в виде другого препарата или вида антитела, имеющие около 2.0-3.0 мг дигоксин - связывающей емкости.
Например, известно, что у пациентов с тяжелым сепсисом сывороточные концентрации TNF находятся в интервале 50-400 пг/мл, и для лечения тяжелого сепсиса у больных дозу можно выбирать из соответствующего интервала доз, описанных в Таблицах I-V. Для целей данного изобретения концентрацию TNF можно также выбирать с учетом концентраций, обычно присутствующих в организме пациентов, находящихся в цитокин - опосредованном состоянии, которое подвергается лечению. Наиболее предпочтительно, концентрацию TNF определяют с учетом известных сведений об интервале, обычно имеющемся в случае конкретного цитокин - опосредованного состояния, выбирают с учетом состояния пациента, факторов повышенного риска цитокин - опосредованного состояния и/или тяжести симптомов и/или осложнений у проходящего лечение пациента.
Хотя некоторые из примеров, приведенных в данном описании, являются специфическими по отношению к существующим препаратам DIGIBIND® или DIGIFAB™, следует подчеркнуть, что настоящее изобретение не ограничивается овечьим иммунным Fab к дигоксину, DIGIBIND® или DIGIFAB™, или любой конкретной маркой или любым конкретным препаратом антитела к дигоксину, но охватывает все антитела к дигоксину, включая антигенсвязывающие фрагменты и генно-инженерные антитела или конструированные молекулы, которые содержат CDR или связывающий домен. Кроме того, изобретение не ограничивается любой конкретной композицией (дозой) антитела к дигоксину, любым конкретным способом дозирования, или любой конкретной схемой лечения, или любым конкретным методом введения.
Композиции по изобретению содержат разовую дозу (для однократного применения). Разовая доза включает композицию, даваемую (а) исключительно для однократного приема, или (б) даваемую в виде аликвот при многократном приеме в течение некоторого периода времени, или (в) вводимую непрерывно в течение некоторого периода времени (например, непрерывная инфузия, с замедленным высвобождением или с высвобождением во времени трансдермальное введение, с замедленным высвобождением или с высвобождением во времени (пролонгированного действия) таблетки, или капсулы, или каплеты).
Предпочтительно, пациенту сначала дают терапевтическую композицию, содержащую самое низкое количество активного ингредиента (дигоксин - связывающей емкости), подходящую для пациента в соответствии с величинами доз по данному описанию или по клиническим показателям и по мнению рядового специалиста в данной области техники. Затем можно вводить одну или более новых композиций, содержащих большее или меньшее количество активного ингредиента, для достижения или сохранения заданного улучшения симптомов или осложнений пролечиваемого состояния. Однако, в ситуациях, когда симптомы или осложнения у больного потенциально угрожают жизни, предпочтительно вначале можно ввести терапевтическую композицию, имеющую большее количество активного ингредиента, предпочтительно, высокодозовую композицию антитела к дигоксину.
Антитело к дигоксину в композиции представляет собой любое антитело, связывающий фрагмент или любая молекула, имеющие связывающий домен, который иммунологически реагирует с или связывается с карденолидом, буфадиенолидом или EF, или, предпочтительно, антитело, связывающий фрагмент или связывающий домен, специфический к карденолиду или буфадиенолиду, включая, без ограничения, антитело против оуабина, антитело против маринобуфагенина, антитело против буфалина и антитело против дигоксина (например, DIGIBIND® или DIGIFAB™).
Методы количественного определения относительной перекрестной реактивности антитела в отношении различного антигена или эпитопа хорошо известны рядовым специалистам в данной области техники. См., например, Fedorova et al., Journal of Hypertension 23(4): 835-842 (2005) и приведенные там ссылки. Обычно, если известно, что антитело перекрестно реагирует с дигоксином, перекрестная реактивность является основой для приготовления композиции такого антитела для обеспечения дигоксинсвязывающей емкости в терапевтически эффективном количестве, как описано выше. Например, если рецептура антитела к маринобуфагенину имею 0.5 мг маринобуфагенин - связывающей емкости и перекрестную реактивность к дигоксину 10%, тогда та же самая композиция будет иметь, примерно, 0.05 мг дигоксин - связывающей емкости.
Композиция может состоять из цельного антитела к дигоксину, связывающих фрагментов, связывающих доменов, CDR или их комбинации. Антитело к дигоксину может быть поликлональным, моноклональным, химерным, гуманизированным или полностью гуманизированным, или другой формой генно-инженерного антитела. Антитело к дигоксину по изобретению можно получать из любого известного источника антител, включая, без ограничения, овцу, козу, лошадь, кур, кролика, мышь, клеточные линии млекопитающих, бактерии или дрожжи. Источник антитела к дигоксину, предпочтительно, относится к овцам (получается в овце, или получается или конструируется, полностью или частично, при использовании полипептидов, белков или нуклеиновых кислот овечьего происхождения). Предпочтительно, антитело к дигоксину представляет собой иммунный Fab к дигоксину и, наиболее предпочтительно, иммунный Fab к дигоксину (овечий).
Хотя предусматриваются вышеуказанные терапевтические композиции, могут использоваться отклонения или модификации. Кроме того, композиции просто определяют нейтрализующую дозу как дозу для начального лечения, также предполагается, что композиции, содержащие меньшие количества, промежуточные количества или большие количества дигоксин - связывающей емкости, чем композиции по данному описанию, включая композиции, приведенные в Таблицах I, II, III, IV и V, являются эффективными и также охватываются настоящим изобретением.
Некоторые варианты изобретения включают введение композиции антитела к дигоксину нуждающемуся в этом пациенту для лечения цитокин - опосредованного состояния. Предпочтительно, композицию вводят неоднократно при необходимости и в таких количествах, которые необходимы в этот момент. В некоторых вариантах изобретения композицию вводят по фиксированной (постоянной) схеме, например, с интервалами, измеряемыми в часах (например, каждые 2, 4, 6, 12 часов), ежедневно, еженедельно, каждые две недели, ежемесячно или между этими интервалами.
Дополнительные варианты изобретения включают способы лечения пациента, страдающего цитокин - опосредованным состоянием или подверженного цитокин - опосредованному состоянию, результатом которого является повышенная лейкоцитарная или эндотелиальная экспрессия молекул клеточной адгезии, последнюю можно модулировать введением композиции антитела к дигоксину.
В одном варианте изобретения композиции по настоящему изобретению применяют для лечения тяжелой геморрагии и системных или местных (локальных) воспалительных заболеваний и состояний, таких как геморрагический шок, сепсис, септический шок, септицемия, синдром системного воспалительного ответа (SIRS), синдром компенсаторного противовоспалительного ответа (CARS), синдром полиорганной дисфункции (MODS), полиорганная недостаточность (MOF), астма, аллергия, анафилактический шок, иммунное комплексное заболевание, ишемия органов, реперфузионное поражение, некроз органов, сенная лихорадка, эндотоксический шок, кахексия, гиперпирексия, эозинофильная гранулема, гранулематоз и саркоидоз.
В другом варианте изобретения композиции по настоящему изобретению могут применяться для лечения аутоиммунных и воспалительных состояний и расстройств, таких как антифософлипидный синдром, тяжелая псевдопаралитическая миастения, тиреоидит, системная красная волчанка, синдром Гудпасчера, синдром Бехчета, отторжение аллотрансплантата, болезнь трансплантат - против - хозяина, синдром гипериммуноглобулинемии - D (HIDS), периодический синдром, ассоциированный с рецептором TNF (TRAPS), деструкция бета-клеток панкреатических островков, устойчивость к инсулину, диабет Типа I и Типа II, гестационный сахарный диабет (сахарный диабет беременных), резистентность к инсулину беременных, болезнь Бергера, синдром Райтера (Рейтера).
В других вариантах изобретения композиции по настоящему изобретению могут применяться для лечения заболеваний и патологических состояний (расстройств), включающих кровеносную, лимфатическую и сердечно-сосудистую системы и связанные с этим ткани, такие как ишемия ткани или органа, реперфузионное повреждение (поражение), васкулит, лимфедема, ангиит, эндокардит, артериит, атеросклероз, тромбоз и тромбофилия, тромбофлебит, перикардит, застойная сердечная недостаточность, миокардит, ишемия миокарда, ишемический удар, узелковый периартериит, рестеноз, анемия, связанная с химиотерапией, и ревматическая лихорадка.
В других вариантах изобретения композиции по настоящему изобретению могут применяться для лечения заболеваний и патологических состояний (расстройств), включающих желудочно-кишечный тракт и связанные с ним ткани, такие как аппендицит, пептические язвы, язвы желудка и двенадцатиперстной кишки, перитонит, панкреатит, язвенный колит, псевдомембранозный колит, острый и ишемический колит, дивертикулит, периодонтальное заболевание, эпиглоттит, ахалазия, холангит, холецистит, глютеновая болезнь, гепатит, цирроз, воспалительное заболевание кишечника, болезнь Крона, энтерит и болезнь Виппла.
В других вариантах изобретения композиции по настоящему изобретению могут применяться для лечения заболеваний и патологических состояний (расстройств), включающих мочеполовую систему и связанные с ней ткани, такие как самопроизвольные преждевременные роды, отслойка плаценты, привычный выкидыш, септический аборт, эпидидимит, вагинит, простатит, гломерулонефрит и уретрит.
В других вариантах изобретения композиции по настоящему изобретению могут применяться для лечения заболеваний и патологических состояний (расстройств), включающих дыхательную систему и связанные с ней ткани, такие как бронхит, эмфизема, ринит, муковисцидоз, пневмония, пульмонит, хроническая обструктивная болезнь легких (ХОБЛ, COPD), (острый) респираторный дистресс-синдром взрослых (ARDS), ультрамикроскопический вулканический силико-пневмокониоз, альвеолит, бронхиолит, фарингит, плеврит и синусит.
В других вариантах изобретения композиции по настоящему изобретению могут применяться для лечения инфекций и заболеваний, вызванных инфицированием различными вирусами, бактериями, грибками, протозойными и многоклеточными паразитами, такими как вирус малярии (например, церебральная малярия), вирусы гриппа, респираторные синцитиальные вирусы, вирусы иммунодефицита человека (ВИЧ), вирусы гепатита, герпес-вирусы, цитомегаловирус, менингит и аденовирус, инфекции, вызванные грамположительными и грамотрицательными бактериями, бактериями туберкулеза и проказы.
В других вариантах изобретения композиции по настоящему изобретению могут также применяться для лечения дерматологических заболеваний и патологических состояний кожи, таких как псориаз, аллергический и острый дерматит, старческий кератоз, дерматомиозит, химический и другие ожоги, солнечный ожог, крапивница, папилломы (бородавки) и аллергические папулы.
В других вариантах изобретения композиции по настоящему изобретению могут применяться для лечения невропатической боли и заболеваний и патологических состояний (расстройств), включающих центральную и периферическую нервную систему и связанные с ней ткани, такие как болезнь Альцгеймера, менингит, энцефалит, демиелинизирующие заболевания, рассеянный склероз, тяжелая псевдопаралитическая миастения, инфаркт головного мозга, эмболия сосудов мозга, синдром Гийена-Барре, неврит, невралгия, травма спинного мозга, травма головного мозга, паралич и увеит.
В других вариантах изобретения композиции по настоящему изобретению могут применяться для лечения заболеваний и патологических состояний (расстройств) костей, суставов, мышц и соединительных тканей, такие как различные артритиды (поражения кожи псориатического или подагрического характера) и артралгии, резорбция костной ткани, дегенерация мышц, анорексия, кахексия, остеопороз, остеомиелит, фасцит, болезнь Паджета, подагра, периодонтальное заболевание, ревматоидный артрит, остеоартрит, юношеский (ювенильный) хронический артрит (JCA), склеродермия, анкилозирующий спондилоартрит и синовит.
В других вариантах изобретения композиции по настоящему изобретению могут также применяться для лечения заболеваний и патологических состояний (расстройств), включающих различные типы рака, опухоли и пролиферативные заболевания, такие как болезнь Ходжкина, множественная миелома, острый и хронический миелогенный лейкоз, метастазирование, рецидив раковых заболеваний и опухолей и поражение или травму, полученные в результате хирургического, химиотерапевтического лечения и лучевой терапии таких раковых заболеваний, опухолей и пролиферативных нарушений.
Так как наследственный (врожденный) и приобретенный (адаптивный) иммунные ответы имеют избыточные регуляторные механизмы, полагают, что ослабление или ингибирование одного механизма необязательно сможет дать достаточный терапевтический эффект. Поэтому некоторые варианты настоящего изобретения включают способы введения терапевтически эффективного количества композиции антитела к дигоксину и, по меньшей мере, одного другого терапевтического агента. Другой терапевтический агент может представлять собой любой терапевтический агент, который применялся, применяется в настоящее время или известно, или может стать известно, что он применим для лечения, уменьшения интенсивности или предупреждения состояния, инфекции, расстройства, заболевания или патологии, охватываемых настоящим изобретением. Более подробное описание терапевтических агентов специалисты в данной области техники могут найти в справочных руководствах, включая, но без ограничения. The Physician's Desk Reference и Goodman and Oilman "Pharmaceutical Basis of Therapeutics" (9th Ed. McGraw Hill, 1996).
Композицию антитела к дигоксину можно вводить с периодичностью, продолжительностью, концентрацией, способами введения и т.д., отличающимися от периодичности, длительности, концентрации и способов введения и т.д. другого терапевтического агента или для другого цитокин - опосредованного состояния. Например, композицию антитела к дигоксину можно вводить перед введением другого терапевтического агента, например, без ограничения, за 0.5, 1, 2, 3, 4, 5, 6, 8, 10, 12, 14, 16 или 18 часов, за 1, 2, 3, 4, 5 или 6 дней, за 1, 2, 3 или 4 недели до введения другого терапевтического агента. Композицию антитела к дигоксину можно вводить после введения другого терапевтического агента, например, через 0.5, 1, 2, 3, 4, 5, 6, 8,10, 12, 14, 16 или 18 часов, через 1, 2, 3, 4, 5 или 6 дней, через 1, 2, 3 или 4 недели после введения другого терапевтического агента.
Или же, композицию антитела к дигоксину и другой терапевтический агент вводят одновременно, но по различным схемам, например, композицию антитела к дигоксину вводят периодически в течение дня, тогда как другой терапевтический агент вводят ежедневно. Композицию антитела к дигоксину можно также вводить ежедневно, тогда как другой терапевтический агент вводят реже, например, раз в неделю, раз в две недели, раз в три недели или раз каждые четыре недели. Композицию антитела к дигоксину можно вводить менее часто, чем ежедневно (например, раз в неделю), тогда как другой терапевтический агент вводят периодически в течение дня, ежедневно, раз в неделю, раз в две недели, раз в три недели или раз каждые четыре недели. Также применимы любое другое периодическое введение антитела к дигоксину любой другой терапевтический агент.
Комбинация соединения по изобретению и одного или более терапевтических агентов может иметь аддитивную активность или аддитивный терапевтический эффект. Изобретение охватывает также синергические комбинации, эффективность которых выше, чем у аддитивных. Предпочтительно, такие комбинации также позволяют уменьшить нежелательные или вредные побочные эффекты или избежать их. В некоторых вариантах изобретения комбинированные лекарства, охватываемые данным изобретением, обеспечивают улучшенную общую терапию по сравнению с введением только композиции антитела к дигоксину или только любого другого терапевтического агента. В некоторых вариантах изобретения дозы имеющихся или экспериментальных других терапевтических агентов можно снижать или вводить реже, если давать в комбинации с композицией антитела к дигоксину по данному изобретению, что может повысить соблюдение пациентом режима терапии, тем самым улучшая лечение и уменьшая нежелательные и вредные побочные эффекты.
В одном или более вариантов изобретения другие терапевтические агенты можно также вводить совместно с или применять в комбинации с одним или более нестероидных противовоспалительных лекарств (НСПВС, NSAIDS), такие как пироксикам, напроксен, индометацин, ибупрофен и т.п.; СОХ-2 селективные ингибиторы, такие как рофекоксиб, который продается под названием виокс (Vioxx® от Merck & Company), и целекоксиб, выпускаемый под названием целебрекс (Celebrex® от Pfizer Inc.); COX-1 ингибиторы, такие как пироксикам, выпускаемый под названием фельден (Feldene® от Pfizer Inc.); иммунодепрессанты, такие как описанные в патенте США 7012060, кортикостероиды, циклоспорин, такролимус, рапамицин, метотрексат и т.п.; модификаторы биологического отклика, такие как антагонисты TNF или антагонисты TNF-рецепторов, например, адалимумаб, выпускаемый под названием Гумира (Humira® от Abbott Laboratories), этанерцепт, продажное название энбрель (Enbrel® от Wyeth-Ayerst), инфликсимаб, выпускаемый под названием ремикад (Remicade® от Centocor, Inc.), цитофаб (Cytofab™ (поликлональный Fab против TNF (овечий) от Protherics), IL-1 антагонисты, антитела против CD40, против CD28, IL-10, антиадгезивные молекулы и т.п., такие как тизабри (Tysabri® (от Biogen Idec and Elan Pharmaceuticals), дротрекогин альфа (рекомбинантный человеческий активированный Белок С), выпускаемый под названием ксигрис (Xigris®, Eli Lilly and Company), агонисты бета.2-рецептора (например, альбутерол), антагонисты рецепторов лейкотриенов (например, монтелукаст) и другие противотромботические или противовоспалительные агенты, такие как агенты, описанные в патентах США No. 7057022 и 7005413, ингибиторы р38 киназы, ингибиторы PDE4, ингибиторы ТАСЕ, антагонисты рецепторов хемокинов, талидомид, выпускаемый под маркой таломид (Thalomid®, Celgene Corporation) и другие низкомолекулярные ингибиторы продуцирования провоспалительных цитокинов, агенты, применяемые для лечения аутоиммунного заболевания (например, циклоспорин, такролимус, мофетил микофенолята); агенты, применяемые для лечения расстройств нервной системы (например, антихолинэстеразы, дофамин, леводопа, агонисты рецепторов серотонина (например, суматриптан, амантадин, донепезил, рилузол), агенты, применяемые для лечения ишемии/реперфузионного повреждения (например, нитроглицерин, нифедипин), агенты, применяемые для лечения желудочно-кишечных расстройств (например, неостигмин, метоклопрамид, сульфасалазин) и агенты, применяемые для лечения ARDS, сепсиса, SIRS, септического шока и геморрагического шока (например, описанные в патенте США 6193969 и в опубликованной патентной заявке США 2005/0187181).
Другие терапевтические агенты, в комбинации с которыми можно вводить или совместно с которыми можно применять композиции антител к дигоксину по настоящему изобретению, включают, без ограничения, анапрокс (Anaprox®, т.е. напроксен-натрий), арава (Arava®, т.е. лефлюномид), артротек (Arthrotec®, т.е. комбинация диклофенака и мизопростола), азульфидин (Azulfidine®, т.е. сульфасалазин), аспирин (т.е. ацетилсалициловая кислота), катафлам (Cataflam®, т.е. диклофенак), целестон (Celestone®), солюспан (Soluspan®) (т.е. бетаметазона ацетат и бетаметазона натрия фосфат), клинорил (Clinoril®, т.е. сулиндак), кортон ацетат (Cortone Acetate®, т.е. кортизона ацетат), купримин (Cuprimine®, т.е. пеницилламин), диапро (Daypro®, т.е. оксапрозин), декадрон (Decadron®, т.е. дексаметазон), депен (Depen®, т.е. пеницилламин), Depo-Medrol® (т.е. метилпреднизолона ацетат), дисальцид (Disalcid®, т.е. сальсалат), долобид (Dolobid®, т.е. дифлунисал), напросин (Naprosyn®, т.е. напроксен), генграф (Gengraf®, т.е. циклоспорин), гидрокортон (Hydrocortone®, т.е. гидрокортизон), имуран (Imuran®, т.е. азатиоприн), индоцин (Indocin®, т.е. индометацин), лодин (Lodine®, т.е. этодолак), мотрин (Motrin®, т.е. ибупрофин), миокризин (Myochrysine®, т.е. тиомалат золота натрия), налфон (Nalfon®, т.е. кальция фенопрофен), напрелан (Naprelan®, т.е. напроксен-натрий), неорал (Neoral®, т.е. циклоспорин), орудие (Orudis®, т.е. кетопрофен), оравил (Oravil®, т.е. кетопрофен), педиапред (Pediapred®, т.е. преднизолон), плаквентил (Plaquenil®, т.е. гидроксихлорокин), прелон (Prelone®, т.е. преднизолон), релафен (Relafen®, набуметон), солумедрол (Solu-Medrol®, т.е. метилпреднизолона натрия сукцинат), толектин (Tolectin®, т.е. толметин натрий), трилизат (Trilisate®, т.е. холина магния трисалицилат) и волтарен (Voltaren®, т.е. диклофенак). Они включают любой препарат вышеназванных терапевтических агентов. Дозы и лекарственные схемы для введения этих агентов хорошо известны в уровне техники.
Специалистам в данной области техники ясно, что введение других терапевтических агентов и/или других активных агентов, применяемых в комбинации с композициями по настоящему изобретению, можно варьировать в зависимости от подлежащего лечению цитокин - опосредованного состояния. Также в соответствии с опытом высококвалифицированного практикующего врача терапевтические протоколы (например, величину дозы, способы введения и количество приемов) можно изменять с учетом наблюдаемого действия вводимых агентов на пациентов и на основании наблюдаемого отклика цитокин - опосредованного состояния на вводимые агенты.
Хотя предусматриваются вышеуказанные композиции и комбинации, можно использовать девиации и модификации, и полагают, что изобретение включает композиции антитела к дигоксину для лечения цитокин - опосредованных состояний, которые имеют дигоксин- связывающую емкость, меньшую, чем указанная в примерах по данному описанию, большую, чем указанная в примерах по данному описанию, или промежуточную между значениями, указанными в примерах по данному описанию.
VIII. Биологические и прогнозные примеры. Далее способы по изобретению иллюстрируются с помощью нижеприведенных неограничивающих примеров.
Пупочные вены человека представляют собой доступный источник эндотелиальной ткани и эндотелиальных клеток (называемых в данном описании "HUVECs"), и пупочные вены человека и HUVECs являются подходящими моделями для изучения активации и дисфункции эндотелиальных клеток применительно к раскрываемому в данном описании изобретению. Полагают, что данные и прогнозные примеры, приведенные ниже, показывают, что антитела к дигоксину оказывают модулирующее или ослабляющее действие на более чем одну биологическую активность. В результате композиции антител к дигоксину можно применять для предупреждения или лечения более чем одного TNF - опосредованного состояния. Так как пути передачи сигналов в клетках аналогичны для многих цитокинов, полагают также, что композиции антител к дигоксину могут применяться для лечения воспалительных состояний, вызванных провоспалительными цитокинами (например, IL-1, IL-6, IL-8, IFN-γ (ИФН-γ) и т.д.) и другими эндогенными провоспалительными веществами.
Биологический пример No. 1.
Эндотелиальные клетки (ЕС) из пупочной вены здоровых беременных рожениц и культивируют как описано в Wang Y, Yang G and Lucas MJ, Expression of Thrombin Receptors in Endothelial Cells and Neutrophils from Normal and Preeclamptic Pregnancies, J. Clin. Endocrin. & Met. 87 (8): 3728-3724 (2002). Слитые до монослоя ЕС выращивают в 48-луночных планшетах для культур клеточных кластеров и обрабатывают TNF-α с концентрацией 1, 10 и 100 пг/мл в течение 2 часов (концентрация TNF-α при сепсисе находится в диапазоне 50-100 пг/мл). Активацию ЕС определяют непосредственно иммуноанализом для обнаружения ЕС-поверхностной экспрессии молекул клеточной адгезии ICAM, VCAM и E-селектина. Результаты выражают как среднее ±S.D. и анализируют дисперсионным анализом ANOVA. В качестве апостериорного теста применяют тест Стьюдента - Ньюмена - Кейлса (Student - Newman - Keuls). "P" уровень менее 0.05 считают статистически значимым. На Фигурах 2А, 3А и 4А иллюстрируется повышенная зависимая от дозы индукция TNF-α клеточно-поверхностной экспрессии ICAM, VCAM и E-селектина, соответственно. Когда ЕС предварительно обрабатывают антителом к дигоксину в течение одного (1) часа перед индукцией с помощью TNF-α, тогда модулируется экспрессия ICAM, VCAM и Е-селектина, как показано на Фигурах 2В, 3В и 4В, это наводит на мысль, что антитело к дигоксину оказывает защитное действие на ЕС. Кроме того, если ЕС обрабатывают антителом к дигоксину в течение одного (1) часа после индукции с помощью TNF-α, то антитело снижает индуцированную TNF-α экспрессию ICAM, VCAM и E-селектина, как показано, соответственно, на Фигурах 5А, 5В и 6.
Прогнозный биологический пример No.2:
Известно, что антитело к дигоксину восстанавливает Na+/K+ АТФ-азную активность на клеточных мембранах эритроцитов. Как показано в Биологическом примере No. 1, антитело к дигоксину уменьшает индуцированную TNF экспрессию молекул адгезии, это наводит на мысль, что измененная Na+/K+ АТФ-аза может способствовать активации эндотелиальных клеток при воспалительной и/или иммунной реакции. Для проверки такой возможности определяют Na+/K+ АТФ-азную активность в различных клетках, предпочтительно, эндотелиальных клетках и лейкоцитах нормальных контрольных (т.е. здоровых) пациентов и пациентов с выраженным цитокин - опосредованным состоянием (например, сепсисом, тяжелым ожогом или травмой, ВИЧ, церебральной малярией). Предполагается, что будет обнаружено влияние антитела к дигоксину на Na+/K+ АТФ-азную активность и что антитело к дигоксину уменьшить ингибирование Na+/K+ АТФ-азы в клетках пациентов с выраженными обусловленными воспалением или цитокин - опосредованными состояниями.
Животные модели (например, крысиная, мышиная и т.д.) сепсиса хорошо известна специалистам в данной области техники и любую такую модель можно использовать применительно к настоящему изобретению. Крысам (Wistar, самцы) вводят липополисахарид ("LPS") (20 нг/кг) и физиологический раствор (контроль) в бедренную вену и умерщвляют через 2, 12 и 24 часа после введения LPS. Из умерщвленных обработанных LPS и контрольных крыс выделяют эритроциты и эндотелиальные клетки и помешают в раствор буфера HEPES с 86Рубидием (Rb+), аналогом калия, на три часа. Na+/K+ АТФ-азную активность определяют по накоплению Rb. Na+/K+ АТФ-азная активность в обработанных LPS крысах значительно понижена по сравнению с контрольными.
Также оценивают влияние антитела к дигоксину на Na+/K+ АТФ-азную активность. Антитело к дигоксину (DIGDBIND® или DIGIFAB™ с 0.1 мг дигоксин - связывающей емкостью/кг) или обычный физиологический раствор (плацебо) вводят обработанным LPS крысам, примерно, через 24 часа после введения LPS. Группам крыс вводят антитело к дигоксину или плацебо-физиологический раствор и умерщвляют через 2, 6 и 12 часов после терапевтического вмешательства. Эндотелиальные клетки, лейкоциты и эритроциты выделяют из обработанных антителом к дигоксину и контрольных крыс и помещают в растворы буфера HEPES и Rb+. Определяют Na+/K+ АТФ-азную активность базовую (перед введением антитела к дигоксину или плацебо) и через 2, 6 и 12 час после введения по накоплению Rb+ (выражают как нмоли/час/106 клеток). Средняя Na+/K+ АТФ-азная активность повышается до нормальной контрольной как в образцах с антителом к дигоксину, так и в образцах, обработанных плацебо (что отражает утрату во времени действие LPS на активность натриевого насоса); однако, в случае образцов, обработанных плацебо, повышение активности более постепенное и незначительное. (См. ниже Таблицу VI).
Прогнозный биологический пример No.3:
Сепсис у мышей C57/BL вызывают внутривенной инъекцией 20 нг LPS на животное плюс 20 мг D-галактозамина на животное. Ингибирование сепсиса определяют как недопущение смертности в течение трех дней. Антитело к дигоксину (0.1 мг дигоксин - связывающей емкости/кг) вводят интраперитонеально (внутрибрюшинно) с нормальным физиологическим раствором за один (1) час до LPS-индукции. В течение трех дней у мышей, получивших плацебо, наблюдается смертность 100%. У мышей, получающих антитело к дигоксину, через три дня мониторинга наблюдается выживаемость 100%.
Прогнозный биологический пример No.4:
Проводят рандомизированное, двойное слепое, плацебо-контролируемое испытание во многих центрах. Регистрируют пациентов с системным воспалением (SIRS) и недостаточностью органа вследствие острой инфекции и назначают им внутривенную болюсную инфузию либо плацебо, либо иммунного Fab (овечьего) (.04 мг дигоксин - связывающая емкость на килограмм веса тела, с учетом предполагаемой сывороточной концентрации TNF-α 100 пг/мл) каждые шесть часов в течение в целом 96 часов. Предположительно ожидаемая в перспективе основная конечная точка - это смерть, вызванная любой причиной и определяемая через 28 дней после начала инфузии. У пациентов проверяют побочные эффекты, изменения показателей жизнедеятельности, лабораторных показателей и результаты микробиологических культур, и развитие нейтрализующих антител против иммунного Fab (овечьего) против дигоксина.
Обработке подвергают всего 100 рандомизированных пациентов (48 в группе плацебо и 52 в группе с иммунным Fab (овечьим) против дигоксина). Коэффициент смертности составляет 30.8% в группе плацебо и 24.7% в группе иммунного Fab (овечьего). На основании первичного перспективного анализа лечение иммунным Fab (овечьим) к дигоксину ассоциируют со снижением степени риска смерти на 6.1% (Р=0.005).
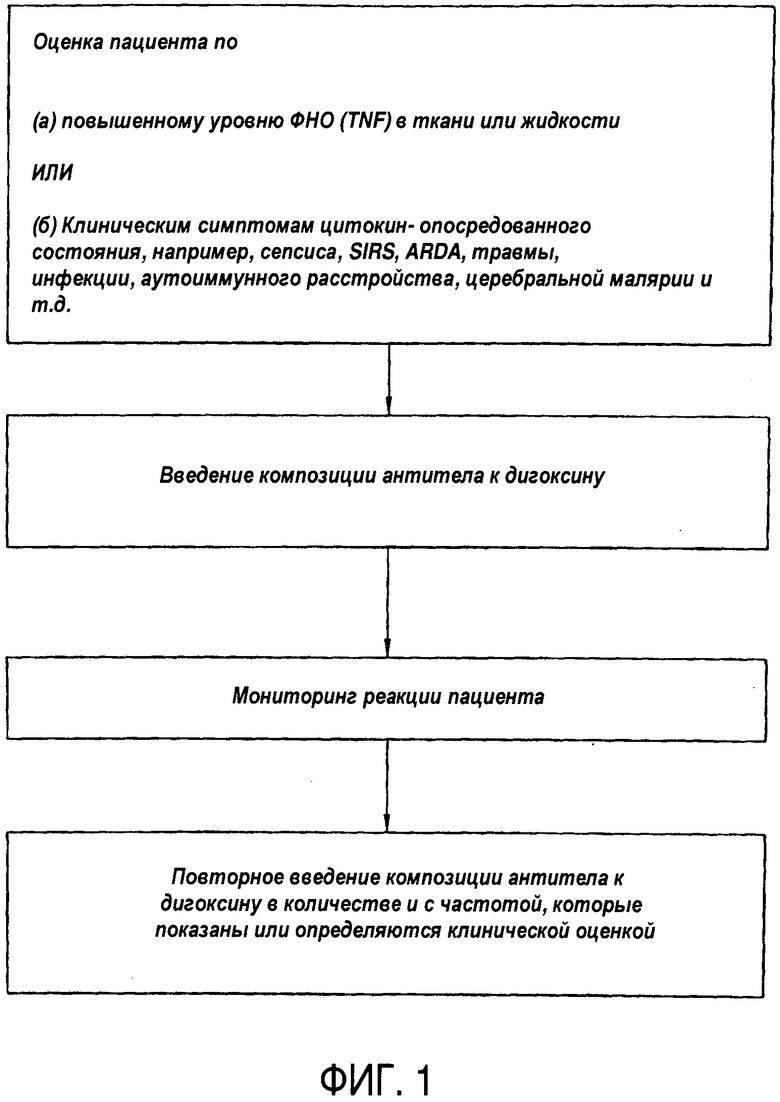
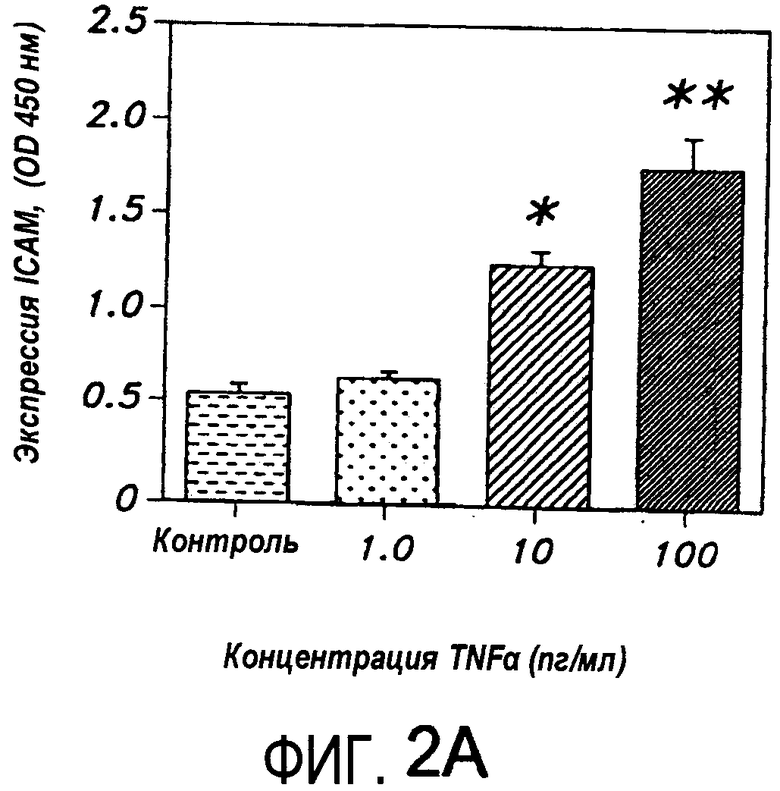
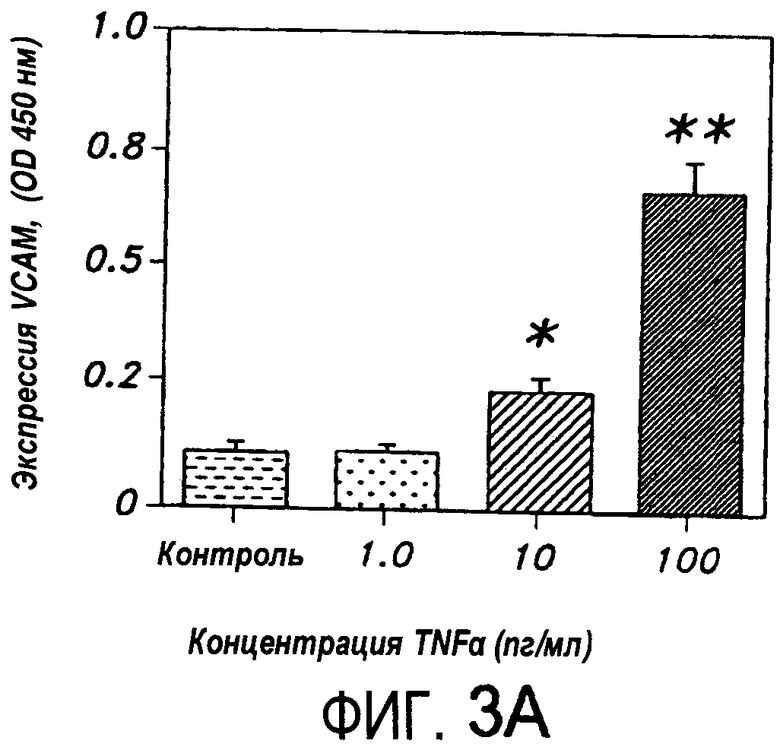
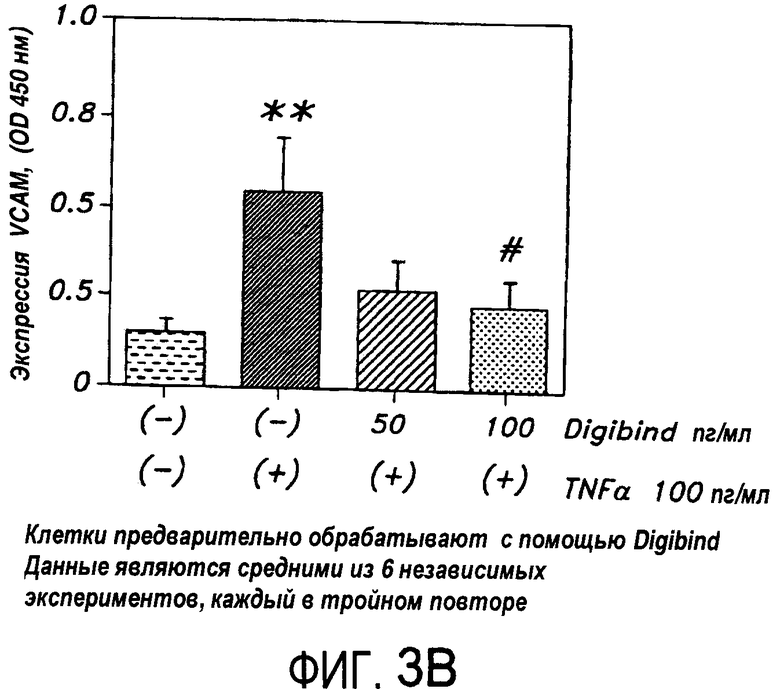
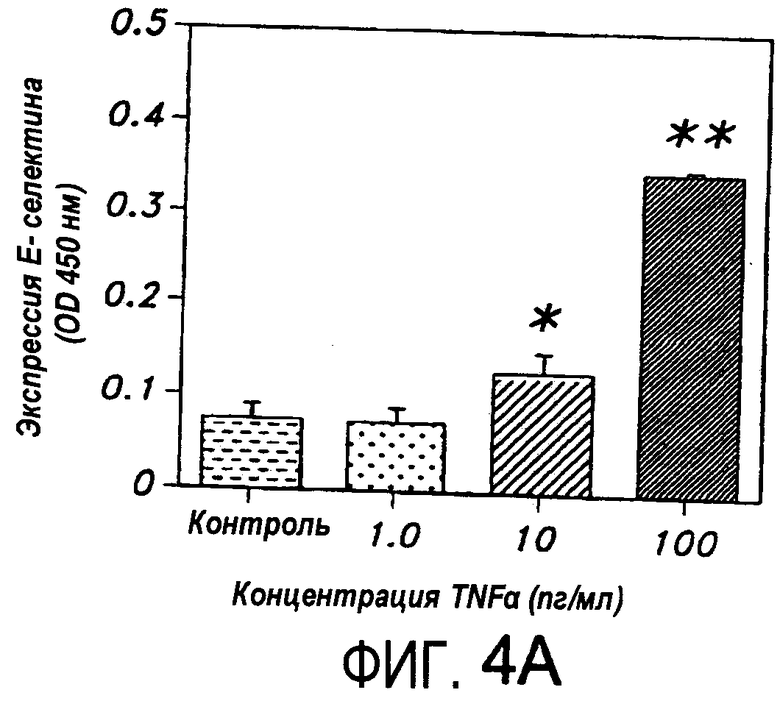
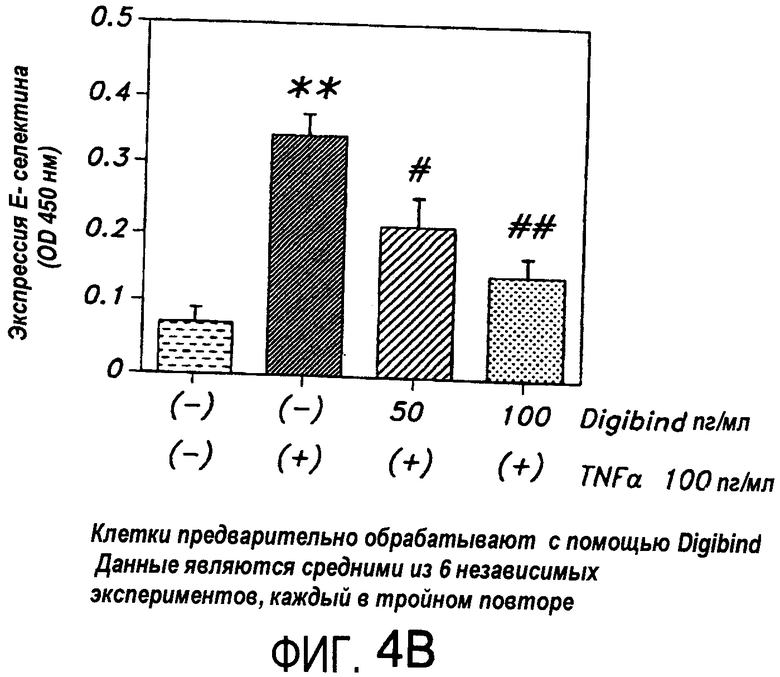
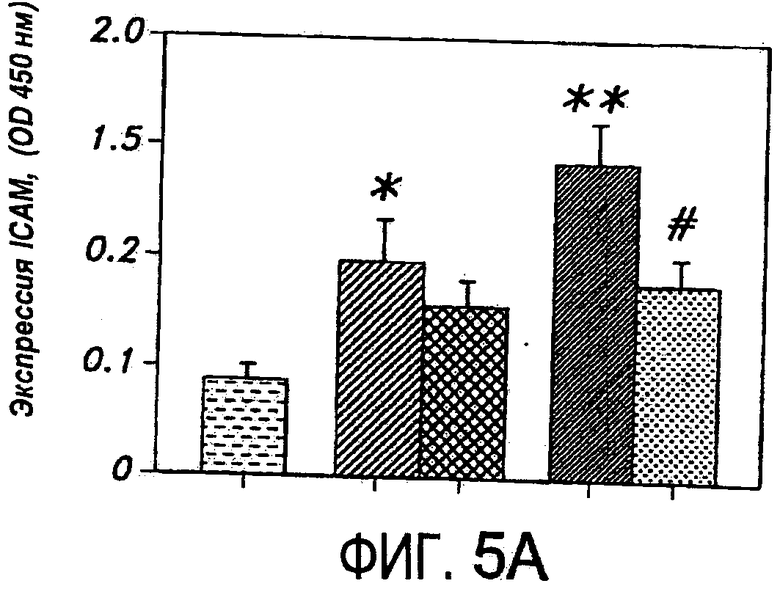
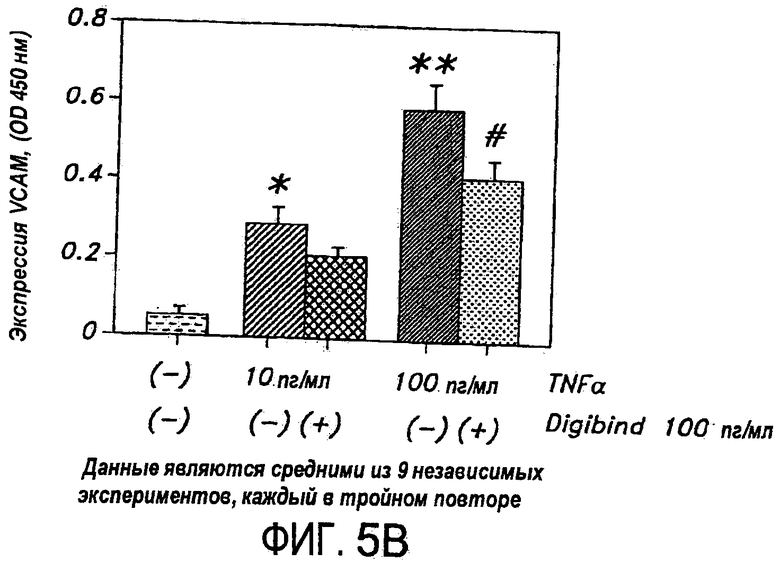
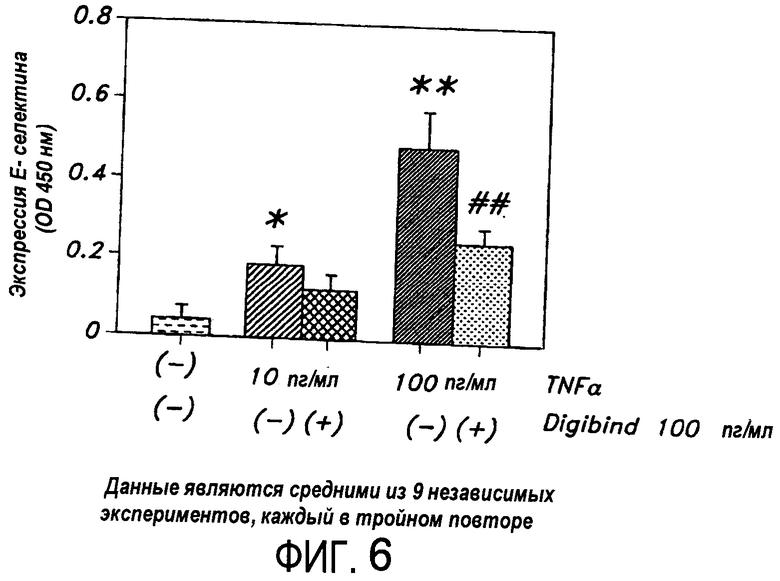
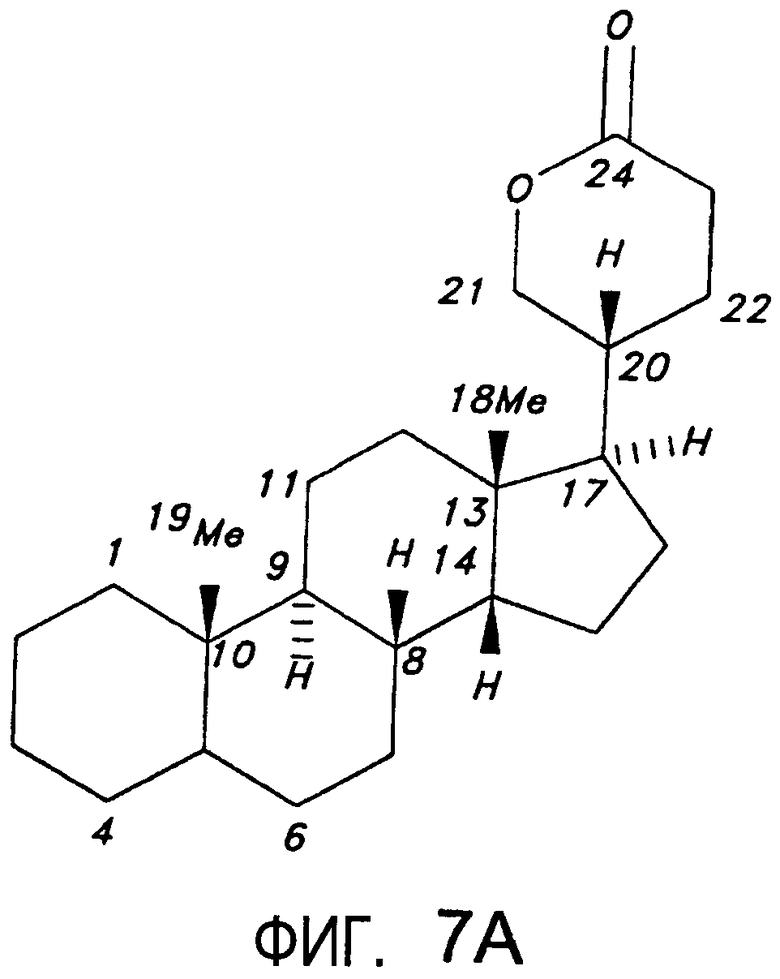
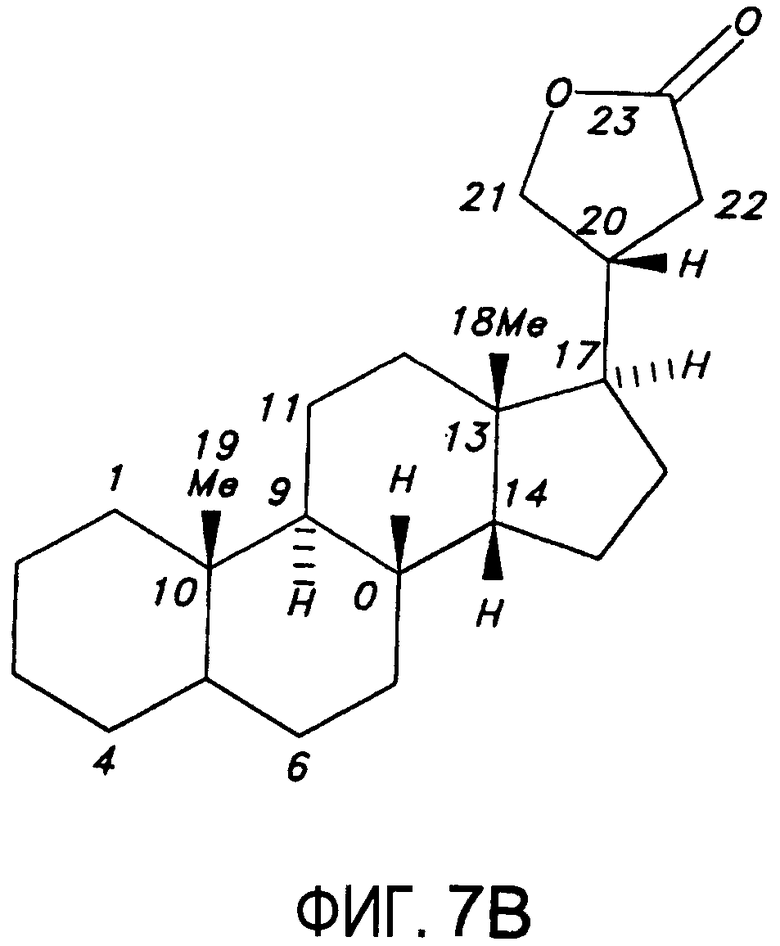
Предложенная группа изобретений относится к области иммунологии и медицины. Предложены композиции, содержащие антитело к дигоксину, для ослабления действия фактора некроза опухолей на молекулу клеточной адгезии и для ослабления индукции TNF экспрессии ICAM, VCAM и Е-селектина в эндотелиальной клетке. Предложен способ ослабления индуцированной цитокинами поверхностной экспрессии молекулы клеточной адгезии, включающий стадию контактирования клетки с композицией антитела к дигоксину. Предложенная группа изобретений обеспечивает эффективное ослабление индуцированной цитокином TNF-α поверхностной экспрессии молекул ICAM, VCAM и Е-селектина, за счет контактирования нуждающейся в этом клетки с композицией антитела к дигоксину. 3 н. и 2 з.п. ф-лы, 12 ил., 6 табл., 4 пр.
1. Способ ослабления индуцированной цитокинами поверхностной экспрессии молекулы клеточной адгезии, включающий стадию контактирования клетки с композицией антитела к дигоксину.
2. Способ по п.1, где данная клетка является эндотелиальной клеткой.
3. Способ по п.1, где молекула клеточной адгезии выбирается из группы, состоящей из ICAM, VCAM и Е-селектина.
4. Композиция для ослабления действия фактора некроза опухолей на молекулу клеточной адгезии, содержащая антитело к дигоксину.
5. Композиция для ослабления индукции TNF экспрессии ICAM, VCAM и Е-селектина в эндотелиальной клетке, содержащая антитело к дигоксину.
| БОРЩЕНКО И.А | |||
| и др | |||
| Некоторые аспекты патофизиологии травматического повреждения и регенерации спинного мозга | |||
| - Вопросы нейрохирургии, 2000, №2 [Найдено 12.05.2013] [он-лайн], Найдено из Интернет: <URL:http://sci-rus.com/pathology/pathophysiology.htm> | |||
| MENEZES J.C., DICHTCHEKENIAN V | |||
| Digoxin antibody prevents cerebral |
Авторы
Даты
2014-01-10—Публикация
2007-07-02—Подача