ОБЛАСТЬ И УРОВЕНЬ ТЕХНИКИ
Настоящее изобретение относится к молекулам гаптена и антителам, направленным против них, которые могут быть использованы для ингибирования активности металлопротеинов, таких как металлопротеазы, а также к способам, в которых используются эти антитела для лечения таких заболеваний, как метастазирующий рак, которые связаны с аномальной активностью металлопротеина.
Матриксные металлопротеины (ММП) являются основными ферментами, участвующими в ремоделировании внеклеточного матрикса (ВКМ). Эти ферменты способны разрушать различные компоненты соединительной ткани суставного хряща или базальных мембран.
Семейство генов ММП человека состоит по меньшей мере из 28 структурно родственных белков (см. ФИГ.1), которые имеют сходную общую сферическую топологию (ФИГ.2 и Боркакоти, 1998). Каждый ММП секретируется как неактивный латентный профермент. Домен каталитического цинка состоит приблизительно из 180 аминокислот, где высоко консервативная последовательность HE-GH-LGL-H дает три гистидиновых (т.е., Н) остатков, которые связаны с ионом металлического цинка Zn(2+). Четвертый участок связывания иона каталитического цинка в проферменте связан с цистеиновым остатком (Моргунова и др., 1999), на котором ферментная активация отсоединяется от активного участка (Ван-Варт и Биркедаль-Хансен, 1990). В результате этого, четвертый участок связывания в активированном ММП занимает молекула воды, которая также имеет водородную связь с консервативным глутаминовым остатком. Этот процесс облегчает гидролиз пептидной связи целевого субстрата с активированной молекулой воды.
Неконтролируемое разрушение соединительной ткани металлопротеазами является признаком многих патологических состояний, вероятно являющихся результатом чрезмерной активности ММП или несбалансированного соотношения между естественными тканевыми ингибиторами ММП (ТИМП) и ММП. ТИМП ингибируют ММП путем формирования стехиометрических комплексов с активным участком связывания цинка (Гомес и др, 1997; Генриет и др., 1999; Боде и др., 1999; Уилл и др., 1996). Когда уровни ТИМП недостаточны, прогрессирующая медленная деградация ВКМ может приводить к потере матрикса хрящевой ткани при ревматоидном артрите (Валаковиц и др., Arthritis Rheum, 35:35-42, 1992) и остеоартрите (Дин и др., J. Clin. Invest. 84:678-685, 1989) или деградации матрикса костной ткани при остеопорозе (Хилл и др., Biochem. J. 308:167-175, 1995). В других ситуациях, таких как застойная сердечная недостаточность, может происходить быстрая деградация ВКМ сердца (Армстронг и др., Canadian J. Cardiol. 10:214-220, 1994).
Кроме того, как известно, ММП играют некоторую роль в мейозе цитокинов и хемокинов, таких как галестин-3 (Очиенг Дж., Biochemistry, 1994 33(47):14109-14), плазминоген (Паттерсон, Б.К., JBC, 1997 272(46):28823-5), интерлейкина-8, активирующего соединительную ткань пептида III, тромбоцитарного фактора-4 (Ван ден Стеен, 2000 Blood. 2000 Oct 15; 96(8):2673-81.), проинтерлейкина-1β (Шенбек, 1998), цепи α рецептора интерлейкина-2 [Шю, Б.К., Хсю, С.М., Хо, X., Лиен, Х.К., Хуанг, С.К., Лин, Р.Х. «Новая роль металлопротеиназы в опосредованном раком подавлении иммунного ответа», Cancer Research (2001) 61, 237-242] и протрансформирующего фактора-β роста [TGF-β, Ю, К., Стаменкович, И. «Локализованная на поверхности клеток матриксная металлопротеиназа-9 протеолитически активирует TGF-beta и способствует инвазии и ангиогенезу опухоли», Genes Dev (2000) 14, 163-176].
Другие патологические состояния, которые также связаны с нерегулируемой активностью ММП, включают быстрое ремоделирование ВКМ метастатическими опухолевыми клетками. В таких состояниях активируемые ММП или выражены раковыми клетками или окружающими тканями. Существует достаточно доказательств того, что ММП вовлечены в рост и распространение опухолей (см., например, Дэвидсон и др., Chemistry & Industry, 258-261, 1997, и указанные в статье справочные материалы). В процессе метастазирования опухоли ММП используются для разрушения ВКМ, что позволяет раковым клеткам первичной опухоли вторгаться в соседние кровеносные сосуды, откуда они транспортируются в различные органы и создают вторичные опухоли. Инвазивный рост в этих вторичных местах опосредован ММП, которая разрушает ткань. Кроме того, активность ММП способствует инвазивному росту новых кровеносных сосудов, также называемому ангиогенезом, вследствие которого опухоли вырастают больше определенного размера. Было продемонстрировано, что среди членов семейства ММП секретированная ММП-9 человека, также известная как гелатиназа В, играет главные роли не только в катаболизме внеклеточного матрикса (ВКМ), но и в обработке белковых веществ, которые релевантны для неврологических заболеваний, таких как рассеянный склероз (PC) (Опденаккер, 2003). Недавние исследования показали, что ММП-9 играет критическую роль в содействии аутоиммунным заболеваниям путем расщепления предварительно обработанного коллагена типа II (Ван ден Стеен, 2004). Продуктами являются фрагменты коллагена типа II, которые являются оставшимися эпитопами, которые, как считается, генерируют аутоиммунные заболевания.
Учитывая большую роль ММП в физиологии и патологии человека, неудивительно, что делаются многочисленные попытки создать лекарства, которые ингибируют чрезмерную активность ММП.
Попытки разработки лекарств фокусируются на тех классах ингибиторов, которые содержат функциональную группу, координирующую ион цинка и этим деактивирующую целевую ММП. Одним таким классом ингибиторов являются гидроксаматные ингибиторы, небольшие пептидные аналоги фибриллярных коллагенов, которые специфически взаимодействуют двунаправленным образом через гидроксильный и карбонильный кислород гидроксамовой группы с ионом цинка в каталитическом сайте [Грамс и др., (1995), Biochem. 34:14012-14020; Боде и др., (1994), EMBO J., 13:1263-1269].
Ингибиторы ММП на основе гидроксамата обычно состоят или из углеродного остова (WO 95/29892, WO 97/24117, WO 97/49679 и ЕР 0780386), пептидильного остова (WO 90/05719, WO 93/20047, WO 95/09841 и WO 96/06074) или пептидомиметического остова [Шварц и др., Progr. Med. Chem., 29:271-334(1992); Расмуссен и др., Pharmacol. Ther., 75:69-75 (1997); Денис и др., Invest. New Drugs, 15:175-185 (1997)]. Альтернативно, они содержат сульфоамидосульфонильную группу, которая связана на одной стороне с фенильным кольцом, и сульфоамидоазот, который связан с гидроксаматной группой через цепь из одного - четырех атомов углерода (ЕР 0757984 А1).
Другими ингибиторами ММП на основе пептидов являются тиоловые амиды, которые имеют активность, ингибирующую коллагеназу (патент США 4,595,700), N-карбоксиалкилпроизводные, содержащие бифенилэтилглицин, которые ингибируют ММП-3, ММП-2 и коллагеназу (Дюретт и др., WO-9529689), производные лактама, которые ингибируют ММП, TNF-alpha и аггреканазу (см. патент США 6,495,699), и трициклические сульфонамидные соединения (см. патент США 6,492,422).
Хотя ингибиторы ММП на основе пептидов имеют явный терапевтический потенциал, их использование в клинической терапии ограничено. Гидроксаматы на основе пептида дороги в производстве и имеют низкую метаболическую стабильность и оральную биодоступность [например, батимастат (ВВ-94)]. Эти соединения быстро глюкуронизируются, окисляются до карбоновой кислоты и выводятся в желчь [Сингх и др., Bioorg. Med. Chem. Lett. 5: 337-342, 1995; Ходгсон, "Ремоделирование ММПИ", Biotechnology 13: 554-557, 1995)]. Кроме того, ингибиторы ММП на основе пептидов часто оказывают такие же или сходные на каждый из ферментов ММП. Например, ба-тимастат по сообщениям имеет значения IC50 приблизительно от 1 до 20 нмоль против каждой из ММП-1, ММП-2, ММП-3, ММП-7 и ММП-9 [Расмуссен и др., Pharmacol. Ther., 75(1): 69-75 (1997)]. Кроме того, использование нескольких гидроксаматных ингибиторов было связано с серьезными побочными эффектами, такими как мышцеске-летные проблемы от маримастата (ВВ-2516), широко распространенная язвенная сыпь от CGS27023A (Novartis) [Левитт и др., 2001, Clin. Cancer Res. 7: 1912-1922] и нарушения работы печени, анемия, боли в плечах и спине, тромбоцитопения, тошнота, усталость, диарея и тромбоз вен от BAY12-9566 (Bayer) [Хис и др., 2001, Cancer Chemother. Pharmacol. 48: 269-274]. Более того, клинические испытания фазы III на пациентах с развившимся раком, которым назначали маримастат, приномастат (AG 3340, Agouron) и Bay 12-9566, не продемонстрировали клинической эффективности в ингибировании метастаз (Цукер и др., 2000, Oncogene 19: 6642-50).
Другими ингибиторами ММП являются химически модифицированные немикробные тетрациклины (ХМТ), которые блокируют выражение нескольких ММП in vitro. Однако, было выявлено, что эффективность этих соединений in vivo является ограниченной, например, ингибитор ХМТ, доксициклин, снижал тканевые уровни ММП-1, но не ММП-2, 3, или 9 в атеросклерозных бляшках в сонной артерии у людей (Аксиса и др., 2002, Строук 33: 2858-2864).
Недавно разработан ингибитор механизма ММП, SB-3CT, который основан на рентгеновской кристаллографической информации об активном сайте ММП (Браун и др., 2000). Рентгенографические абсорбционные исследования показали, что связывание этой молекулы с каталитическим цинком реконструирует конформационную среду вокруг иона металла в активном сайте обратно до среды профермента [Кляйфельд и др., 2001, J Biol. Chem. 276: 17125-31]. Однако терапевтическую эффективности этого вещества еще предстоит определить.
Еще одним классом естественных ингибиторов являются моноклональные антитела. Несколько антител были выбраны против специфических пептидных последовательностей в каталитическом домене ММП-1 (Гальвез и др., 2001, J. Biol. Chem., 276: 37491-37500). Однако, хотя эти антитела могли ингибировать активность ММП in vitro, результаты, демонстрирующие эффективность таких тел in vivo еще не получены.
Как сказано выше, каталитический сайт ММП включает координированный ион металла, который становится доступным для связывания субстрата после ферментной активации (см. ФИГ.2а-с). Таким образом, идея заключается в том, что традиционные антитела, направленные на первичную аминокислотную последовательность фермента, не будут отличать активную форму от неактивной формы фермента и, следовательно, не будут являться мощными ингибиторами таких ферментов.
Авторы настоящего изобретения ранее демонстрировали, что антитела, которые распознают электронные и структурные детерминанты каталитического сайта ММП, являются ее мощными ингибиторами и, как таковые, могут использоваться для лечения заболеваний, связанных с несбалансированной активностью ММП (см. публикацию РСТ WO 2004/087042).
Таким образом, существует признанная необходимость и желание получить специфические гаптеновые соединения, которые имитируют электронные и структурные детерминанты каталитического сайта металлопротеинов, как специфические антитела, направленные против них.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Согласно одному аспекту настоящего изобретения предложено соединение, имеющее общую формулу (I):
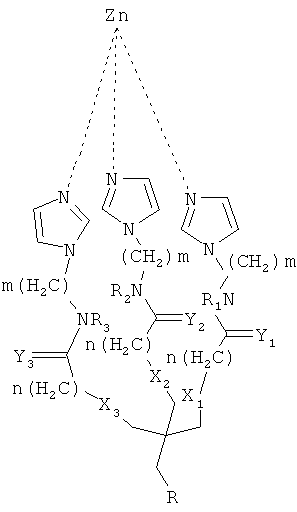
где:
m и n являются независимо целыми числами от 1 до 6;
X1-Х3 и Y1-Y3 являются независимо О или S;
R1-R3 независимо выбирают из группы, состоящей из водорода, алкила и циклоалкила; и R-(CH2)x-C(=O)NR'-(CH2)y-NR'R"
тогда как:
x и y являются независимо целыми числами от 1 до 6; и
R' и R" независимо выбирают из группы состоящей из водорода, алкила и циклоалкила.
Согласно другим признакам предпочтительных вариантов осуществления, описанных ниже, соединение имеет формулу (II):
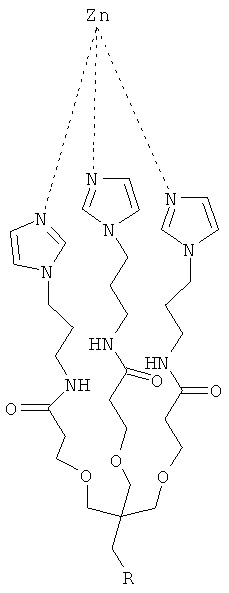
где R=-CH2-C(O)NH-CH2-CH2-NH2
Согласно другому аспекту настоящего изобретения предложено соединение, имеющее формулу (II):

где R=-CH2-C(=O)NH-CH2-CH2-NH2
Согласно еще одному аспекту настоящего изобретения предложено антитело, содержащее участок распознания антигенов, способный специфически связывать вышеуказанное соединение.
Согласно другим признакам указанных предпочтительных вариантов осуществления участок распознания антигенов содержит аминокислотную последовательность CDR, выбираемую из группы, состоящей из SEQ ID NO:7, 8, 9, 10, 11 и 12.
Согласно другим признакам указанных предпочтительных вариантов осуществления аминокислотная последовательность CDR кодируется последовательностью нуклеиновой кислоты, выбираемой из группы, состоящей из SEQ ID NO:13, 14, 15, 16, 17 и 18.
Согласно другим признакам указанных предпочтительных вариантов осуществления антитело способно ингибировать активность металлопротеина.
Согласно другим признакам указанных предпочтительных вариантов осуществления металлопротеином является матриксная металлопротеаза.
Согласно другим признакам указанных предпочтительных вариантов осуществления матриксной металлопротеазой является гелатиназа.
Согласно другим признакам указанных предпочтительных вариантов осуществления гелатиназу выбирают из группы из ММП-2 и ММП-9.
Согласно другому аспекту настоящего изобретения предложен способ производства ингибитора металлопротеинов, причем этот способ содержит создание антител, направленных на вышеуказанное соединение, этим создавая ингибитор металлопротеинов.
Согласно другим признакам указанных предпочтительных вариантов осуществления антителами являются поликлональные антитела.
Согласно другим признакам указанных предпочтительных вариантов осуществления антителами являются моноклональные антитела.
Согласно другому аспекту настоящего изобретения предложена фармацевтическая композиция, содержащая упомянутое антитело и фармацевтически приемлемый носитель.
Согласно другому аспекту настоящего изобретения предложен способ лечения заболевания, связанного с несбалансированной или аномальной активностью металлопротеинов у пациента, причем этот способ включает назначение пациенту терапевтически эффективного количества любого одного из антител по пунктам 4-10, посредством чего лечат заболевание, связанное с несбалансированной или аномальной активностью металлопротеинов у пациента.
Согласно другим признакам указанных предпочтительных вариантов осуществления заболеванием является воспалительное заболевание внутреннего органа.
Согласно другому аспекту настоящего изобретения предложен способ ингибирования активности матриксной металлопротеазы в клетке, причем способ включает контакт клетки с любым одним из антител по пунктам 4-10, этим ингибируя активность матриксной металлопротеазы в клетке.
Настоящее изобретение успешно преодолевает недостатки известных конфигураций путем предложения новой гаптеновой композиции, которую можно использовать для генерации антител, которые распознают электронные и структурные детерминанты каталитического сайта металлопротеинов.
Если не указано иное, все технические и научные термины в настоящем описании имеют такое же значение, которое обычно понимается средним специалистом в области настоящего изобретения. Хотя способы и материалы, подобные или эквивалентные описанным здесь, могут быть использованы при практическом осуществлении или тестировании настоящего изобретения, подходящие способы и материалы описаны ниже. В случае противоречия, главным является описание изобретения, включая определения. Кроме того, материалы, способы и примеры являются только иллюстративными, но не ограничивающими.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Далее изобретение описано, причем только для примера, со ссылками на прилагаемые чертежи. Теперь с конкретной ссылкой на подробные чертежи подчеркивается, что показанные детали приведены только для примера и для целей иллюстративного описания предпочтительных вариантов осуществления настоящего изобретения и представлены для предложения того, что считается наиболее подходящим и легко понятным описанием принципов и концептуальных аспектов изобретения. В этом отношении не делается попытки показать структурные детали изобретения более подробно чем необходимо для его фундаментального понимания, причем описание, взятое вместе с чертежами, делает очевидным для специалистов в данной области, как несколько форм изобретения могут быть осуществлены на практике. На чертежах:
ФИГ.1A-D - схемы молекулярной структуры Co/ZnTCPP - [мезо-Тетракис (4-карбоксифенил)-порфиринато] кобальт/цинк (II) (ФИГ.1А-В, Imisdp - [2-(2-миноэтилкарбомоил)-этоксиметил]-трис-[2-(N-(3-имидазол-1-ил-пропил))этоксиметил]метан, и консервативное сшивание цинка-протеина в сайте каталитического цинка в ММП.
ФИГ.1Е-Н - три пространственные схемы структур, показанных на ФИГ.1A-D. Отметьте, что ZnTCPP остается планарной конформацией, а СоТСРР имеет искаженную конформацию микроцикла. Заметно, что структура Imisdp в высокой степени аналогична ближайшей среде иона каталитического цинка в ММП-9, как показано на ФИГ.1G.
ФИГ.2А - структурное наложение трех пространственных вычисленных структур Imisdp (зеленые атомы углерода) и три консервативных гистидина в активном сайте ММП-9 (PDB код 1GKC, серые атомы углерода). Ион каталитического цинка показан как оранжевый шар, молекула воды показана как синий шар, азот окрашен синим, кислород окрашен красным.
ФИГ.2В - структурное наложение порфиринового кольца ZnTCPP (CSD-код AKICOM) (зеленые атомы углерода) и трех консервативных гистидинов в активном сайте ММП-9 (зеленые атомы углерода PDB-код 1GKC), ион каталитического цинка показан как оранжевый шар, азот окрашен синим.
ФИГ.3А-С - изображения вестерн блоттинга, показывающие способность IgG мыши - иммобилизированных агарозой моноклональных антител вытягивать рекомбинантный каталитический домен ММП-2 (ММП-2cat) или Pro-ММП-2 и Pro-ММП-9 из раствора. В каждом эксперименте использовали антитела 6С6, 13Е11 и 13Е15. ФИГ.3А - ММП-2cat (2 мкг) инкубировали с IgG антимыши - агарозой (контроль, дорожка 1) или моноклональным антителом против СоТСРР, ZnTCPP и Imisdp (10 мкг) - IgG антимыши - агарозой в течение 2 часов при 20°C, иммунопреципитаты (дорожки 2, 3, 5) центрифугировали и промывали три раза, отделяли на геле SDS/PAGE и визуализировали окрашиванием кумасси. ФИГ.3В - Pro-ММП-2, Pro-ММП-9 инкубировали с моноклональным антителами антимыши IgG - агарозой таким же порядком, что и в А. Иммунопреципитаты (дорожки 2, 4, 6 слева и 1, 3, 5 справа) и несвязанную фракцию (дорожки 1, 3, 5 слева и 2, 4, 6 справа) отделяли на геле SDS/PAGE и визуализировали окрашиванием кумасси. ФИГ.3С - кондиционированная среда клеток НТ1080, которые или прошли активацию АРМА (слева) или не проходили (справа), была иммуноосаждена с помощью моноклонального антитела против СоТСРР и проанализирована вестерн блоттингом с помощью антител, специфических против ММП-2.
ФИГ.4А-В - графики Лайнвивера-Берка ингибирования ММП-2 (А) и ММП-9 (В) с помощью моноклонального антитела против СоТСРР. Единицей скорости является мкмоль/с-1, и единицей субстрата является мкмоль-1. ФИГ.4А - концентрации моноклонального антитела составили: 6 (черные треугольники), 18 (черные квадраты), 24 (белые круги), and 0 мкмоль (белые квадраты). Концентрация ММП-2cat составила 200 нмоль. ФИГ.4В - Ингибирование полной длины ММП-9, активированной АРМА, концентрации моноклонального антитела составили 6 (белые квадраты), 12 (черные треугольники), 24 (белые квадраты) и 0 мкмоль (черные квадраты). Концентрация ММП-9 составила 20 нмоль. Модель ингибирования показывает, что моноклональное антитело против СоТСРР ведет себя как конкурентный ингибитор ММП-2 и ММП-9.
ФИГ.5 - график, показывающий ингибирование ММП-2 и ММП-9 с помощью моноклонального антитела против Imisdp. Каталитический домен ММП-9 (20 нмоль) (черные круги) или полная длина ММП-2, активированной АРМА (черные треугольники, 5 нмоль), был добавлен в смеси флуорогенного субстрата OCAcPLGLA2pr(Dnp)-AR-NH2 (10 мкмоль) в буферном растворе R, содержащем увеличивающиеся концентрации моноклонального антитела. Линии представляют выравнивания по методу наименьших квадратов к уравнению:
vi/vo=(Km+[S])/(Km(1+[I]/Ki)+[S]), используя программу Origin.
На ФИГ.6А показаны спектры К-края активных и ингибированных моноклональным антителом против СоТСРР форм ММП-2cat для цинка. Показаны нормализованные необработанные данные XAS по области K-края цинка для активного (точки) и комплекса ММП-2cat - моноклональное антитело (сплошная линия).
На ФИГ.6В показано краевое положение, в котором комплекс (сплошная линия) ММП-2cat - моноклональное антитело сдвигается в сторону более высокой энергии по отношению к активной ММП-2cat (точки).
На ФИГ.6С показаны результаты EXAFS для активной (черный) и ингибированной (зеленый) форм ММП-2cat. Эти результаты представлены в R-пространстве и трансформированы обратно в k-пространство.
ФИГ.7А-В - фотографии, показывающие способность моноклонального антитела против СоТСРР ингибировать активность гелатиназы на поверхности клетки. Представительные флуоресцентные микрофотографии клеток НТ1080, нанесенных на покровные стекла, покрытые DQ-желатином в присутствии или отсутствии 1 мкмоль моноклонального антитела 13Е11. Гелатинолитическую активность поверхности клетки оценивали как меру флуоресценции, испускаемой разлагаемым желатином. Необработанные клетки проявляли значительную активность гелатиназы на поверхности клетки, которая была значительно ингибирована в присутствии 1 мкмоль моноклонального антитела против СоТСРР. Окрашивание 4'-6-диамидино-2-фенилиндолом (DAPI), синего цвета, указывает местонахождение ядер клеток.
ФИГ.8 - схема, показывающая конфигурацию различных активных сайтов ММП (SI-карман).
ФИГ.9 - схема синтеза Imisdp.
На ФИГ.10 показаны аминокислотные последовательности антител настоящего изобретения с выделенными участками CDR.
ФИГ.11A-D - фотографии и модели, показывающие, что 6С6 связывает только активную конформацию ММП9 и ММП2.
ФИГ.11А: Детектирование активной ММП9, которая очищена вместе с 6С6 от асцитной жидкости мышей. Моноклональное антитело (10 мкг), очищенное от асцитной жидкости мышей, содержащей ММП9, было подвергнуто вестерн блоттингу (ВБ) с использованием коммерческого антитела к ММП9. Несвязанное моноклональное антитело IgG, которое было очищено таким же образом, служило в качестве отрицательного контроля (контроль моноклонального антитела). Человеческая Про-ММП9, очищенная от трансформированных клеток Hilla, служила в качестве маркера молекулярной массы для распознания активных видов. Очистку выполнили аффинной хроматографией с использованием гранул белка G, которые связывали моноклональное антитело через его постоянный домен, оставляя сайт связывания антигена свободным для взаимодействия с антигеном.
ФИГ.11В,С: 6С6 моноклональное антитело, иммобилизированное к гранулам белка А, анализировали на его способность вытягивать каталитический фрагмент ProММП2, ProММП9 или ММП2 (в отсутствии гемопексина и продоменов) из раствора. MAbs 6С6 (10 мкг), иммобилизированное к гранулам сефарозы белка А, инкубировали с каталитическим фрагментом ММП2 (1 мкг) - ФИГ.11В, ProММП9 - ФИГ.11С верх или ProММП2 (2 мкг) ФИГ.11C низ, в течение 2 часов при 20°C. Связанный гранулами комплекс моноклонального антитела отделили центрифугированием и промыли три раза, отделили на геле SDS/PAGE и визуализировали окрашиванием кумасси. Иммунопреципитаты (6С6) и несвязанные фракции отделили на геле SDS/PAGE и визуализировали окрашиванием кумасси. В качестве отрицательного контроля для неспецифического поглощения фермент инкубировали с гранулами сефарозы белка А.
ФИГ.11D: Трехмерная структура ММП2 без домена гемопексина с про доменом (внизу) и без продомена (вверху) показана в поверхностном представлении (PDB ID: 1CK7). Каталитический и фибронектиновый домены показаны цианом, и пропептид показан красным. Ион каталитического цинка показан как оранжевая сфера; он связан с тремя консервативными гистидинами, показанными как желтые стержни. Как показано, пропептидный домен стерильно блокирует активный сайт.
ФИГ.12А-В - графики и данные, относящиеся к механизму ингибирования ММП-9 с помощью моноклонального антитела 6С6.
ФИГ.12А: рекомбинантный каталитический фрагмент ММП-9 (без гемопексина и продомена) инкубировали с разными количествами моноклонального антитела. Остаточную ферментную активность измеряли после добавления флуорогенного пептидного субстрата (10 мкмоль). Ki оценивали путем подбора к уравнению конкурентного ингибирования (vi/vo=Km+[S]/(Km(1+I/Ki)+[S]) Km=9,14±0,8) (Вставка). Активную ММП-9 (при фиксированной концентрации 2 нмоль) предварительно инкубировали в течение 60 минут при 37°C в отсутствии (•) или присутствии 0,7 (■) или 2 мкмоль (О) моноклонального антитела в 100 ммоль NaCl, 10 ммоль CaCl2, 100 ммоль Трис рН 7,5. Затем добавили флуорогенный пептидный субстрат (Mca-Pro-Leu-Gly-Leu-Dpa-Ala-Arg-NH2) для получения конечных концентраций (S) в диапазоне 0-30 мкмоль, и начальную скорость гидролиза субстрата определяли путем измерения возрастающей флуоресценции. Значения видимых Km и Vmax были получены путем подбора экспериментальных данных к уравнению Микаэлиса-Ментена. Полученные значения использовали для реконструирования двойной обратной кривой Линвивера-Берка, где точки пересечения показывают конкурентное ингибирование ММП-9 с помощью 6С6.
ФИГ.12В: Разные ММП были предварительно инкубированы с изменяющимися количествами моноклонального антитела. Остаточную ферментную активность измеряли после добавления флуорогенного пептидного субстрата (10 мкмоль). Ki оценивали путем подбора к уравнению конкурентного ингибирования (vi/vo=Km+[S]/(Km(1+I/Ki)+[S]) Km=2.46±0,34 для полной длины ММП2, очищенной от клеток Hila, Km=16±1 для каталитического домена МТ1-ММП). Эффективное ингибирование 6С6 также детектировали с использованием полной длины ММП-2 и ММП-9 (данные не показаны).
ФИГ.13 - структурное наложение разных ММП, показывающее общую консервативную топологию активного сайта с изменениями, главным образом, в периферийных петлях. ММП9 (PDB 1GKC) - циан, ММП2 (PDB 1QIB) - ярко-красный, МТ1-ММП (PDB 1BUV) - оранжевый, ММП7 (PDB 1MMQ) - красный, ТАСЕ (PDB 2147) - желтый. Консервативные гистидины показаны как стержни, ион каталитического цинка - как оранжевый шар. Заметно, что общая топография периферийных петель ММП-2 и ММП-9 сходна. Это может объяснить селективность 6С6 к ММП-2 и ММП-9 в испытанной группе ферментов.
ФИГ.14А-С - флуоресцентные микрофотографии, иллюстрирующие, что 6С6 ингибирует активность гелатиназы на поверхности клеток. Представительные флуоресцентные микрофотографии (генерируемые прямым зимографическим анализом) клеток НТ1080, помещенных на покровные стекла, покрытые DQ-желатином, в отсутствии (ФИГ.14А) или присутствии (ФИГ.14В) 5 мкмоль моноклинального антитела или 15 мкмоль SB-3CT основанным на механизме наномолярным ингибитором гелатиназ (ФИГ.14С). Активность гелатиназы на поверхности клеток анализировали как меру флуоресценции, испускаемой разлагающимся желатином. Необработанные клетки показывали значительную активность гелатиназы на поверхности (зеленый цвет), которая значительно ингибировалась в присутствии моноклонального антитела.
ФИГ.15А-С - графики, иллюстрирующие воздействие 6С6-обработки на различные проявления острого колита, вызванного DSS, у мышей C57BL/6. Заболевание индуцировали 2%-м DSS в течение 5 суток. Лечение 6С6 в количестве 1,5 мг/мышь, назначали в виде ежедневной внутрибрюшинной инъекции, начиная с дня 0. ФИГ.15А: Клинический показатель оценивали путем ежедневного мониторинга DAI (т.е., объединенного показателя массы тела, ректального кровотечения и консистенции стула, по шкале от 0 до 4). Данные выражены как распределение точек среднего значения для каждого животного по дням 6-10. ФИГ.15В: Длина ободочной кишки. ФИГ.15С: Смертность. Представленные данные являются объединенными результатами из двух экспериментов, при 15 мышах в группе.*, значительный эффект по сравнению с мышами с колитом, не получавшими лечения (p<0,05).
ФИГ.16 - график результатов рентгеновской абсорбционной спектроскопии на К-крае цинка для активной ММП9 (черный) и ингибированного комплекса ММП9-6С6 (красный). Результаты представлены в форме радиального распределения от иона цинка. Краевое положение комплекса (красный) каталитического домена ММП-9 - моноклональное антитело сдвигается в сторону более высокой энергии по отношению к активной ММП-9 (вставка), указывая на связывание с ионом каталитического цинка. Структурный анализ данных рентгеновской спектроскопии показывает, что 6С6 прямо связывает ион цинка и формирует пятикоординатный комплекс цинка-белка. Заметно, что этот режим связывания аналогичен связыванию ТИМП в активном сайте ММП.
ОПИСАНИЕ ПРЕДПОЧТИТЕЛЬНЫХ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ
Настоящее изобретение относится к антителам и их фрагментам, которые можно использовать для ингибирования активности металлопротеинов. Специфически, антитела настоящего изобретения можно использовать для лечения заболеваний, связанных с несбалансированной активностью матриксной металлопротеазы, таких как рассеянный склероз, аутоиммунных заболеваний и метастатических раков.
Принципы и действие настоящего изобретения могут быть лучше поняты со ссылками на чертежи и соответствующие описания.
Перед тем, как подробно объяснить по меньшей мере один вариант осуществления, необходимо сказать, что изобретение не ограничено в применении подробностями, изложенными в последующем описании или Примерах. Изобретение может быть осуществлено на практике в других вариантах. Также необходимо понимать, что примененная здесь фразеология и терминология предназначена для целей описания и не должна рассматриваться как ограничивающая.
Матриксные металлопротеазы участвуют в многих биологических процессах, от разрастания и дифференциации клеток и ремоделирования внеклеточного матрикса (ВКМ) до васкуляризации и миграции клеток. Эти процессы требуют точного баланса между функциями матриксных металлопротеаз (ММП) и их природными тканевыми ингибиторами (ТИМП). Утрата этого баланса является признаком многочисленных патологических состояний, включая метастатические опухоли, невродегенеративные заболевания и остеоартрит.
Известны многие ингибиторы ММП, включая малые пептидные ингибиторы, такие как гидроксомат, немикробные тетрациклины и моноклональные антитела. Хотя первый ограничен высокой стоимостью производства, высокой скоростью распада, низкой оральной доступностью и отсутствием специфичности, ни один из последних не продемонстрировал терапевтическую эффективность in vivo.
Авторы настоящего изобретения ранее выявили, что антитела, которые распознают электронные и структурные детерминанты каталитического сайта металлоферментов, могут быть использованы в качестве их мощных ингибиторов. Использование гаптенов, имитирующих связанный с металлом каталитический сайт металлоферментов, в качестве иммуногенов позволило создать высоко эффективные терапевтические антитела, которые можно использовать для лечения клинических состояний, характеризующихся повышенной активностью металлопротеинов (см. WO2004/087042 авторов настоящего изобретения).
При осуществлении настоящего изобретения на практике авторы разработали новое гаптеновое соединение, которое достаточно точно имитирует локальную структуру и конформацию реактивного сайта цинка в ММП. Это соединение, [2-(2-миноэтилкарбомоил)-этоксиметил]-трис-[2-(N-(3-имидазол-1-ил-пропил))этоксиметил]метан, сокращенно Imisdp (см. ФИГ.1), может имитировать 4-координатную геометрию и силовое поле, сходное с индуцируемым ионом цинка на скоординированной трехгистидинной матрице и воде. Почти четырехугольная конформация сформирована тремя имидазольными основаниями и молекулой воды в качестве четвертого лиганда. На ФИГ.2А показано наложение сконструированной трехмерной модели соединения Imisdp на каталитический сайт ММП-9 (PDB 1GKC), который был модифицирован для того, чтобы представлять четырехугольную геометрию лигандов цинка. Модификации включают замену лиганда, присутствующего в рентгеновской структуре (гидроксаматный ингибитор), молекулой воды и оптимизацию полного фермента до локального минимума многослойным подходом QM/MM (см. материалы и способы). Существует высокое подобие между вычисленным расположением гистидинного цинка в ММП-9 и Imisdp в смысле расстояний ε-азота гистидинов от иона цинка (2,04+0,06 и 2,02, соответственно) и относительной ориентацией трех гистидинов по отношению к металлу.
Как проиллюстрировано ниже в описании и Примерах, авторы настоящего изобретения иммунизировали мышей препаратом Imisdp и провели их скрининг на антитело к ММП, перекрестно реагирующее с ММП-2 и ММП-9. Это антитело было названо 6С6 (см. ФИГ.10 и Примеры 1-2). Было выявлено, что 6С6 связывает ММП-2/9 и конкурентно ингибирует активность ММП-9, ММП-2 (Ki-диапазон 1 мкмоль - 5 мкмоль) и МТ1-ММП (Ki 15 мкмоль, см. таблицу 4 ниже). Связывание и ингибирование ММП-9 и ММП-2 было продемонстрировано in vitro и in situ с помощью биохимических и биофизических средств (см. Примеры 4-7 и 9). Что важно, 6С6 связывает только активированную форму ММП-9 и ММП-2 (см. Пример 3 и Пример 8). В этой форме фермента отсутствует продомен, который защищает комплекс каталитического цинка, находящегося в части фермента. Авторы показали, что антитела, созданные по настоящему способу, способны соединяться in vivo с ММП-9 (ФИГ.11А). Кроме того, авторы показали, что антитела настоящего изобретения имеют терапевтический потенциал для лечения воспалительного заболевания кишечника (Пример 10).
Эти данные поддерживают использование Imisdp в качестве важного реагента (платформы) для производства ингибиторов металлопротеинов, а также 6С6 и производных пептидов и пептидоимитаторов в качестве ценного терапевтического средства.
Эти результаты демонстрируют потенциал использования этих антител как платформы для разработки селективных пептидных ингибиторов для отдельных ММП посредством отображения бактериофагов и точечных мутаций моноклональных антител или их фрагментов.
Так, согласно одному аспекту настоящего изобретения предложено соединение, имеющее общую формулу (I):
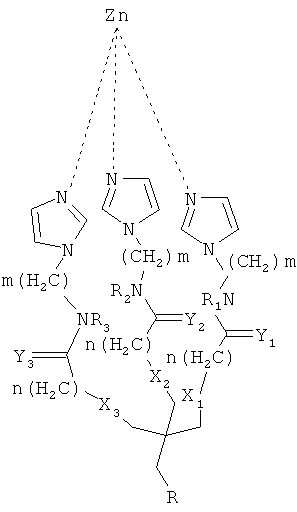
где:
m и n являются независимо целыми числами от 1 до 6;
X1-Х3 и Y1-Y3 являются независимо О или S;
R1-R3 независимо выбирают из группы, состоящей из водорода, алкила и циклоалкила; и R-(CH2)x-C(=O)NR'-(CH2)y-NR'R"
поскольку:
x и y являются независимо целыми числами от 1 до 6; и
R и R" независимо выбирают из группы состоящей из водорода, алкила и циклоалкила.
Согласно предпочтительному варианту осуществления этого аспекта настоящего изобретения, этим соединением является [2-(2-миноэтилкарбомоил)-этоксиметил]-трис-[2-(N-(3-имидазол-1-ил-пропил))-этоксиметил] метан, названное, Imisdp, которое имеет общую формулу (II):
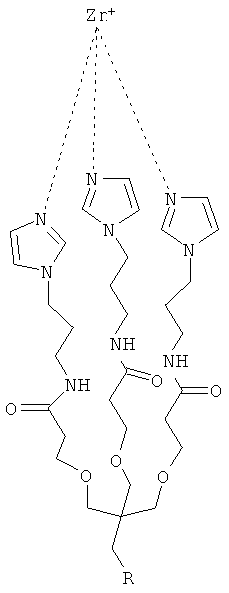
где R=-CH2-C(=O)NH-CH2-CH2-NH2
Синтез Imisdp описан в Примере 7.
Поскольку Imisdp имитирует локальную структуру и переходную конформацию реактивного сайта цинка в ММП-9 и ММП-2, его можно использовать для производства ингибиторов металлопротеинов.
Так, согласно одному аспекту настоящего изобретения предложен способ производства ингибитора металлопротеинов.
Способ осуществляют путем создания антител или фрагментов антител, направленных на вышеописанное соединение (т.е., Imisdp). Смотрите Примеры 1-2, а также раздел "Материалы и способы" в разделе «Примеры».
Термин "металлопротеин" настоящего изобретения относится к метало-связанному белку, в котором сайт связи с металлом образует часть каталитического домена фермента, который электронно и структурно напоминает таковой у Imisdp.
Металлопротеин данного аспекта настоящего изобретения предпочтительно является металлопротеазой - ММП (например, гелатиназой, такой как ММП-2 и ММП-9).
Будет понятно, что все члены семейства ММП воспринимаются как латентные ферменты, которые после активации преобразуются в активные ферменты, у которых ион металла в активном сайте доступен для связи с субстратом. Например, для объяснения активации ММП in vitro ранее была предложена «модель перехода цистеина». Модель перехода цистеина предполагает, что после активации сайт образования связи с латентным цинком преобразуется в сайт образования связи с каталитическим цинком путем диссоциации тиолового пропептида с (Cys) от атома цинка. Расщепление этого пропептида приводит к разрушению продоменной структуры фермента, и утрате защиты ионом каталитического цинка. Следовательно, ион металла и карман активного сайта доступны для связи с субстратом и гидролиза [Ван Варт и Биркедаль-Хансен (1990) Proc. Natl. Acad. Sci. USA 87, 5578-5582].
Антитела и фрагменты антител, созданные по настоящему изобретению, служат в качестве мощных ингибиторов ММП из-за их способности связывать ион металла и координирующие аминокислоты в сайте каталитического цинка, этим специфически ингибируя активную конформацию этих ферментов, которые непосредственно вовлечены в вышеуказанные патологические процессы.
Используемый здесь термин «антитело» относится к интактной молекуле антитела, и фраза «фрагмент антитела» относится к ее функциональному фрагменту, такому как Fab, F(ab')2 и Fv, которые способны устанавливать связь с макрофагами. Эти функциональные фрагменты антител имеют следующие определения: (i) Fab, фрагмент, который содержит моновалентный фрагмент молекулы антитела, устанавливающий связь с антигеном, может быть получен путем переваривания всего антитела с ферментом папаином для получения интактной легкой цепи и части одной тяжелой цепи; (ii) Fab', фрагмент молекулы антитела, который может быть получен путем обработки всего антитела пепсином с последующим восстановлением для получения интактной легкой цепи и части тяжелой цепи; два фрагмента Fab' могут быть получены из молекулы антитела; (iii) (Fab')2, фрагмент антитела, который может быть получен путем обработки всего антитела ферментом пепсином без последующего восстановления; F(ab')2 является димером двух фрагментов Fab', удерживаемых вместе двумя дисульфидными связями; (iv) Fv, определенный как полученный генной инженерией фрагмент, содержащий переменную область легкой цепи и переменную область тяжелой цепи, выраженных как две цепи; (v) однонитевое антитело («SCA»), молекула, полученная генной инженерией, содержащая переменную область легкой цепи и переменную область тяжелой цепи, связанных подходящим полипептидным линкером как генетически сплавленная молекула с одной цепью; и (vi) пептидное кодирование для одной определяющей комплементарность области (CDR).
Хорошо известны способы создания антител (т.е., моноклональных и поликлональных). Антитела могут быть созданы любым из известных способов, в которых может быть применена индукция для производства молекул антител in vivo, скринингом иммуноглобулиновых библиотек или панелей высоко специфических связывающих реагентов [Орланди Д.Р. и др. (1989) Proc. Natl. Acad. Sci. 86:3833-3837, Винтер Г. и др. (1991) Nature 349:293-299] или создания молекул моноклональных антител непрерывными линиями клеток в культуре. Они включают без ограничения способ гибридомы, способ гибридомы человеческих В-клеток и способ гибридомы Эпштейн-Бар вируса (EBV) [Колер Г., и др. (1975) Nature 256:495-497, Козбор Д., и др. (1985) J. Immunol. Methods 81:31-42, Коут Р.Дж. и др. (1983) Proc. Natl. Acad. Sci. 80:2026-2030, Коул С.П. и др. (1984) Mol. Cell. Biol. 62:109-120].
В тех случаях, когда соединения настоящего изобретения слишком малы для того, чтобы вызвать сильную иммуногенную реакцию, такие антигены (гаптены) могут быть соединены с антигенно-нейтральными носителями, такими как носители моллюскового гемоцианина (KLH) или сывороточного альбумина (например, бычьего сывороточного альбумина (БСА)) (см. патенты США 5,189,178 и 5,239,078 и Пример 2). Соединение с носителем может быть осуществлено с использованием хорошо известных способов. Например, может быть осуществлена прямая связь с аминогруппами после чего, по желанию, может быть выполнено восстановление образовавшейся иминосвязи. Как вариант, носитель может быть соединен с использованием конденсирующих агентов, таких как дификлогексилкарбодиимид или других веществ, дегидрирующих карбодиимид. Для осуществления связи также могут быть использованы линкерные соединения; гомобифункциональные и генеробифункциональные линкеры предлагает компания Pierce Chemical Company, Рокфорд, штат Иллинойс. Полученный иммуногенный комплекс затем может быть введен подходящим млекопитающим, таким как мыши, кролики и т.п. Подходящие протоколы включают повторную инъекцию иммуногена в присутствии адьювантов по графику, который ускоряет производство антител в сыворотке. Титры иммунной сыворотки можно легко измерить путем хорошо известных процедур иммунологического анализа.
Полученные антисыворотки можно использовать непосредственно, или можно получить моноклональные антитела, как сказано выше.
Фрагменты антител могут быть получены хорошо известными способами. (Смотрите, например, Харлоу и Лейн, «Антитела: Лабораторный справочник», Cold Spring Harbor Laboratory, Нью-Йорк, 1988, включенный в настоящий документ путем ссылки). Например, фрагменты антител согласно настоящему изобретению могут быть приготовлены путем протеолитического гидролиза антитела или путем экспрессии в Е.coli или клетках млекопитающих (например, в культуре клеток яичника китайского хомячка или в других системах экспрессии белков) ДНК, кодирующей фрагмент.
Как вариант, фрагменты антител могут быть получены путем переваривания целых антител пепсином или папаином известными способами. Например, фрагменты антител могут быть произведены ферментативным расщеплением антител с пепсином для получения фрагмента 5S, обозначаемого F(ab')2. Этот фрагмент может быть далее расщеплен с использованием тиолового восстанавливающего агента и, по желанию, блокирующей группы для сульфогидрильных групп, получаемых при расщеплении дисульфидных связей, для получения моновалентных фрагментов 3.5S Fab'. Как вариант, ферментативное расщепление с использованием пепсина дает два моновалентных фрагмента Fab' и фрагмент Fc. Эти способы описаны, например, Гольденбергом, в патентах США 4,036,945 и 4,331,647 и в указанных в них справочных материалах, причем эти патенты включены в настоящий документ в полном объеме путем ссылки. Смотрите также Портер P.P., Biochem. J., 73:119-126, 1959. Также могут быть использованы другие способы расщепления антител, такие как отделение тяжелых цепей для формирования моновалентных фрагментов легких-тяжелых цепей, дальнейшее расщепление фрагментов, или другие ферментные, химические или генетические способы, в которых фрагменты образуют связи с антигеном, который распознается интактным антителом.
Фрагменты Fv содержат связь цепей VH и VL. Эта связь может быть нековалентной, как описано Инбаром и др., Proc. Nat'l Acad. Sci. USA 69:2659-25 62, 1972. Как вариант, переменные цепи могут быть связаны межмолекулярной дисульфидной связью или сшиты химическими веществами, такими как глутаральдегид. Предпочтительно, фрагменты Fv содержат цепи VH и VL, соединенные пептидным линкером. Эти белки (sFv) с одной цепью, устанавливающие связь с антигеном, готовят путем конструирования структурного гена, содержащего последовательности ДНК, кодирующие домены VH и VL, соединенные олигонуклеотидом. Этот структурный ген вводят в вектор экспрессии, который после этого вводят в клетку-хозяин, например Е.coli. Рекомбинантные клетки-хозяева синтезируют одну полипептидную цепь с пептидом-линкером, связывающим два домена V. Способы производства sFv описаны, например, Уитлоу и Филпулой, Methods, 2:97-105, 1991; Бердом и др., Science 242:423-426, 1988; Пэком и др., Bio/Technology 11:1271-77, 1993; Ладнером и др., патент США 4,946,778.
Пептиды CDR («минимальные единицы распознавания») могут быть получены путем конструирования генов, кодирующих CDR соответствующего антитела. Такие гены готовят, например, путем цепной реакции полимеразы для синтеза переменной области из РНК клеток, производящих антитела. Смотрите, например, Лэррик и Фрай, «Методы», 2:106-10, 1991.
Будет понятно, что для лечения или диагностики людей предпочтительно использовать гуманизированные антитела. Гуманизированные формы нечеловеческих (например, мышиных) антител являются химерные молекулы иммуноглобулинов, их иммуноглобулиновые цепи или фрагменты (такие как Fv, Fab, Fab', F(ab')2 или другие последовательности антител, создающие связи с антигенами), которые содержат минимальную последовательность, полученную из нечеловеческого иммуноглобулина. Гуманизированные антитела включают человеческие иммуноглобулины (антитело-получатель), в котором остатки, образующие комплементарную определяющую область (CDR) получателя заменяются остатками от CDR нечеловеческих видов (донорное антитело), таких как мыши, крысы или кролики, имеющими желательную специфичность, сродство и способность. В некоторых случаях, остатки каркаса Fv человеческого иммуноглобулина заменяются соответствующими нечеловеческими остатками. Гуманизированные антитела также могут содержать остатки, которые не содержатся ни в антителе-получателе, ни в импортированных последовательностях CDR или каркаса. Гуманизированное антитело обычно будет содержать в сущности все по меньшей мере одного и типично двух переменных доменов, в которых все или в сущности все области CDR соответствуют таковым в нечеловеческом иммуноглобулине, и все или в сущности все области FR являются таковыми из консенсусной последовательности человеческого иммуноглобулина. Оптимально, гуманизированное антитело также будет включать по меньшей мере часть иммуноглобулиновой постоянной области (Fc), обычно таковую из человеческого иммуноглобулина [Джоунс и др., Nature, 321:522-525 (1986); Рихманн и др., Nature, 332:323-329 (1988); Преста, Curr. Op.Struct. Biol., 2:593-596 (1992)].
Способы гуманизации нечеловеческих антител хорошо известны. Гуманизированное антитело обычно имеет один или несколько аминокислотных остатков, введенных в него из источника, который не является человеком. Эти нечеловеческие аминокислотные остатки часто называют импортными остатками, которые обычно берут из импортного переменного домена. Гуманизация может быть в основном выполнена по способу Винтера и его коллег [Джоунси др., Nature, 321:522-525 (1986); Рихманн и др., Nature 332:323-327 (1988); Верхоуйен и др., Science, 239:1534-1536 (1988)] путем подстановки CDR грызунов или последовательностей CDR вместо соответствующих последовательностей человеческого антитела. Соответственно, такие гуманизированные антитела являются химерными антителами (патент США 4,816,567), в которых значительно меньший чем интактный человеческий переменный домен заменен соответствующей последовательностью из нечеловеческих видов. На практике гуманизированными антителами обычно являются человеческие антитела, в которых некоторые остатки CDR и возможно некоторые остатки FR заменены остатками из аналогичных сайтов антител грызунов.
Человеческие антитела также могут быть произведены различными известными способами, включая библиотеки фагов [Хоогенбоом и Винтер, J. Mol. Biol., 227:381 (1991); Маркс и др., J. Mol. Biol., 222:581 (1991)]. Способы Коула и др., Бернера и др. также могут использоваться для подготовки человеческих моноклональных антител (Коул и др., «Моноклональные антитела и раковая терапия», Alan R. Liss, p.77 (1985) и Бернер и др., J. Immunol., 147(1):86-95 (1991)]. Подобно этому, человеческие антитела могут быть изготовлены путем введения локусов человеческого иммуноглобулина в трансгенных животных, например, мышей, у которых эндогенные иммуноглобулиновые гены были частично или полностью деактивированы. После замены можно наблюдать производство человеческого антитела, которое очень напоминает во всех отношениях то, что происходит у человека, включая реаранжировку генов, сборку и спектр антител. Этот подход описан, например, в патентах США 5,545,807; 5,545,806; 5,569,825; 5,625,126; 5,633,425; 5,661,016 и в следующих научных публикациях: Маркс и др., Bio/Technology 10, 779-783 (1992); Лонберг и др., Nature 368 856-859 (1994); Моррисон, Nature 368 812-13 (1994); Фишвайлд и др., Nature Biotechnology 14, 845-51 (1996); Нойбергер, Nature Biotechnology 14, 826 (1996); Лонберг и Хусцар, Intern. Rev. Immunol. 13 65-93 (1995).
После получения антител они могут быть испытаны на ингибирующую металлопротеины активность. Соответствующие условия описаны у Найта и др., FEBS Letters 296(3):263-266(1992), Коустона и др., Anal. Biochem, 99:340-345 (1979), Коустона и др., Methods in Enzymology 80:771 et seq. (1981); Коустона и др., Biochem. J., 195:159-165 (1981), Вайнгартена и др., Biochem. Biophys. Res. Comm., 139:1184-1187 (1984) и в патентах США 4,743,587 и 5,240,958.
Как было сказано, используя вышеуказанную методологию, авторы настоящего изобретения смогли произвести антитело-ингибитор матриксной металлопротеазы (ММП) для ММП-2 и ММП-9, названное 6С6, последовательность которой представлена в SEQ ID NO:1. Последовательности CDR представлены в SEQ ID NO.7, 8, 9, 10, 11 и 12.
Так, настоящее изобретение предусматривает любую (поли)пептидную последовательность, которая содержит по меньшей мере одну из вышеуказанных последовательностей CDR, а также ее гомологи и фрагменты при сохранении ее ингибирующей металлопротеины активности (специфическое ингибирование каталитической активности металлопротеина). Примером такого полипептида является антитело (см. выше).
Используемый здесь термин «полипептид» включает в себя природные пептиды (продукты разложения, синтезированные пептиды или рекомбинантные пептиды) и пептидоимитаторы (обычно синтезированные пептиды),а также пептоиды и полупептоиды, которые являются аналогами пептидов, которые могут иметь, например, модификации, делающие пептиды более стабильными в организме или более способными проникать в клетки. Такие модификации включают без ограничения модификацию N-конца, модификацию С-конца, модификацию пептидной связи, включая без ограничения модификации остовов CH2-NH, CH2-S, CH2-S=O, O=C-NH, CH2-O, СН2-СН2, S=C-NH, CH=CH или CF=CH и модификацию остатков. Способы подготовки пептидоимитирующих соединений хорошо известны и определены, например, в публикации «Количественная разработка лекарств», К.А.Рамсден Гд., Chapter 17.2, F. Choplin Pergamon Press (1992), которая включена в настоящий документ в полном объеме путем ссылки. Дальнейшие подробности в этом отношении приведены ниже.
Пептидные связи (-CO-NH-) в пептиде могут быть заменены, например, N-метилированными связями (-N(CH3)-CO-), эфирными связями (-C(R)H-C-O-O-C(R)-N-), кетометиленовыми связями (-СО-СН2-), алкило-азотными связями (-NH-N(R)-CO-), где R является любым алкилом, например, метилом, углеродными связями (-CH2-NH-), гидроксиэтиленовыми связями (-СН(ОН)-СН2-), тиоамидными связями (-CS-NH-), олефиновьми двойными связями (-СН=СН-), ретроамидными связями (-NH-CO-), пептидными производными (-N(R)-CH2-CO-), где R является «нормальной» боковой цепью, естественно представленной на атоме углерода.
Эти модификации могут происходить на любой из связей вдоль пептидной цепи и даже на нескольких (2-3) одновременно.
Природные ароматические аминокислоты, Trp, Tyr и Phe, могут быть заменены на синтетическую неприродную кислоту, такую как фенилглицин, тик, нафтилаланин (нал), фенилизосерин, треонинол, производными Phe с кольцевым метилированием, галогенированными производными Phe или о-метил-Tyr.
В дополнение, пептиды настоящего изобретения могут также включать одну или несколько модифицированных аминокислот или один или несколько неаминокислотных мономеров (например, жирные кислоты, комплексные углеводы и т.д.).
Используемый в настоящем описании и в формуле изобретения термин «аминокислота» или «аминокислоты» включает в себя встречающиеся в природе аминокислоты; аминокислоты, часто модифицируемые после трансляции in vivo, включая, например, гидроксипролин, фосфосерин и фосфотреонин; и другие необычные аминокислоты, включая без ограничения 2-аминоадипиновую кислоту, гидроксилизин, изодесмозин, норвалин, норлейцин и орнитин. Кроме того, термин «аминокислота» включает D- и L-аминокислоты.
В таблицах 1 и 2 ниже перечислены встречающиеся в природе аминокислоты (таблица 1) и нетрадиционные или модифицированные аминокислоты (например, синтетические, таблица 2), которые могут использоваться с настоящим изобретением.
Пептиды с улучшенным сродством к соответствующей металлопротеазе или с усиленной биологической активностью могут быть созданы хорошо известными способами, включая отображение фагов и вычислительную биологию.
Пептиды настоящего изобретения могут быть синтезированы любыми способами, известными специалистам в области синтеза пептидов. Для синтеза твердофазных пептидов краткое описание многих способов можно найти в публикации: Стюарт, Дж. М. и Янг, Дж. Д. (1963), «Синтез твердофазных пептидов», W.H.Freeman Co. (Сан-Франциско); и Майенхофер, И. (1973). «Гормональные белки и пептиды», Т.2, стр.46, Academic Press (Нью-Йорк). Обзор классического синтеза в растворе смотрите в публикации: Шредер, Г. и Лупке, К. (1965). «Пептиды», Т.1, Academic Press (Нью-Йорк).
Рекомбинантные способы смотрите в справочных материалах, ниже.
Также рассматриваются последовательности нуклеиновых кислот, которые кодируют вышеописанные полипептидные последовательности (см. SEQ ID NO. 13, 14, 15,16,17 и 18).
Как сказано выше, одним конкретным видом использования антител настоящего изобретения является профилактика или лечение заболеваний, связанных с несбалансированной или аномальной активностью металлопротеинов, таких как металлопротеазы.
Примеры таких заболеваний включают без ограничения артриты, такие как остеоартрит (ОА), ревматоидный артрит (РА), спетический артрит, ревматизм мягких тканей, полихондрит и тендинит; метастатические опухоли, заболевания периодонта; изъязвление роговицы, вызванное, например, щелочью или другими ожогами, радиацией, витамином Е или ретиноидной недостаточностью; гломерулярные заболевания, такие как протеинурия, пузырчатый эпидермолиз; заболевания, связанные с резорбцией костей, такие как остеопороз, болезнь Педжета, гиперпаратироидизм и холестеатома; противозачаточные меры, препятствующие овуляции, или имплантация; ангиогенез, относящийся к росту опухоли или к неоваскуляризации, связанной с диабетической ретинопатией и дегенерацией желтого пятна; коронарный тромбоз, связанный с разрывом атеросклеротической бляшки; эмфизема легких, лечение ран и ВИЧ-инфекция.
Как проиллюстрировано в Примере 10, авторы настоящего изобретения показали, что антитела настоящего изобретения могут использоваться для лечения раздражения толстой кишки.
Воспалительные заболевания кишечника (ВЗК) являются серьезными нарушениями желудочно-кишечного тракта, характеризующимися воспалением кишечника и ремоделированием тканей, частота которых увеличивается и может привести к потере трудоспособности пациентов. Основные формы ВЗК, язвенный колит (ЯК) и болезнь Крона, являются хроническими возвратными состояниями, которые клинически характеризуются болями в животе, диареей, ректальным кровотечением и лихорадкой.
Так, согласно другому аспекту настоящего изобретения предложен способ ингибирования активности матриксной металлопротеазы у нуждающегося в этом объекта.
Предпочтительными индивидуальными объектами согласно настоящему изобретению являются животные, такие как млекопитающие (например, собаки, кошки, овцы, свиньи, лошади, коровы, приматы), предпочтительно, люди.
Способ включает предоставление объекту терапевтически эффективного количества ингибитора ММП настоящего изобретения (т.е., антитела или фрагментов антител, описанных выше).
Как более подробно сказано ниже, ингибитор ММП может быть предоставлен путем прямого введения (например, перорального или инъекцией) или может быть выражен из полинуклеотидной конструкции, доставляемой к целевым клеткам индивидуума.
Ингибиторы ММП настоящего изобретения могут быть предоставлены индивидууму как таковые или как часть фармацевтической композиции, в которой они смешаны с фармацевтически приемлемым носителем.
Используемый здесь термин «фармацевтическая композиция» относится к препарату из одного или нескольких активных ингредиентов, описанных здесь, с другими химическими компонентами, такими как физиологически подходящие носители и наполнители. Целью фармацевтической композиции является облегчение введения соединения в организм.
Используемый здесь термин «активный ингредиент» относится к препарату антитела, который отвечает за биологический эффект.
Используемые здесь фразы «физиологически приемлемый носитель» и «фармацевтически приемлемый носитель», которые могут использоваться одна вместо другой, относятся к носителю или разбавителю, который не вызывает значительного раздражения организма и не аннулирует биологическую активность и свойства вводимого соединения. В смысл этих фраз включен адъювант. Одним из ингредиентов, включаемых в фармацевтически приемлемый носитель, может быть, например, полиэтиленгликоль (ПЭГ), биосовместимый полимер с широким диапазоном растворимости в органических и водных средах (Муттер и др. (1979).
Используемый здесь термин «наполнитель» относится к инертному веществу, добавляемому в фармацевтическую композицию для дальнейшего облегчения введения активного ингредиента. Примеры, без ограничения, наполнителей включают карбонат кальция, фосфат кальция, различные сахара и крахмалы, производные целлюлозы, желатин, растительные масла и полиэтиленгликоли.
Приемы составления и введения лекарств можно найти в публикации «Фармацевтические науки Ремингтона», Mack Publishing Co., Истон, Пенсильвания, новейшее издание, которая включена в настоящий документ путем ссылки.
Подходящими путями введения могут быть, например, пероральный, ректальный, чрезслизистый, особенно трансназальный, кишечная или парэнтенальная доставка, включая внутримышечные, подкожные и интрамедуллярные инъекции, а также интратекальные, прямые интравентрикулярные, внутривенные, интраперитонеальные, интраназальные или интраокулярные инъекции.
Альтернативно, можно вводить препарат локально, а не системно, например, путем инъекции препарата непосредственно в конкретную область организма пациента.
Фармацевтические композиции настоящего изобретения могут быть изготовлены хорошо известными способами, например, посредством традиционного смешивания, растворения, гранулирования, изготовления драже, растирания в порошок, эмульгирования, инкапсулирования, захвата или лиофилизации.
Фармацевтические композиции для использования в соответствии с настоящим изобретением могут быть составлены традиционно с использованием одного или нескольких физиологически приемлемых носителей, содержащих наполнители и вспомогательные вещества, которые облегчают переработку активных ингредиентов в препараты, которые можно использовать в фармацевтических целях. Правильное составление зависит от выбранного пути введения.
Для инъекции активные ингредиенты изобретения могут быть приготовлены в водных растворах, предпочтительно в физиологически совместимых буферных растворах, таких как раствор Хэнка, раствор Рингера, или физиологический солевой раствор. Для чрезслизистого введения при составлении используются смачивающие реагенты, подходящие для прохождения через соответствующий барьер. Такие реагенты широко известны.
Для перорального введения соединения могут быть легко подготовлены путем объединения активных соединений с фармацевтически приемлемыми носителями, хорошо известными в этой области. Такие носители позволяют изготавливать соединения изобретения в форме таблеток, пилюль, драже, капсул, жидкостей, гелей, сиропов, кашиц, суспензий и т.д. для перорального использования пациентом. Фармацевтические препараты для перорального приема могут быть изготовлены с использованием твердого наполнителя, по выбору размалывания полученной смеси и обработки смеси гранул после добавления подходящих вспомогательных веществ, если они желательны, для получения таблеток или оболочек драже. Подходящими наполнителями в частности являются сахара, включая лактозу, сахарозу, маннитол или сорбитол; целлюлозные препараты, например, кукурузный крахмал, пшеничный крахмал, рисовый крахмал, картофельный крахмал, желатин, трагакантовая камедь, метилцеллюлоза, гидрокси-пропилметилцеллюлоза, натрийкарбоксиметилцеллюлоза; и/или физиологически приемлемые полимеры, такие как поливинилпирролидон (ПВП). По желанию, могут быть добавлены разрушающие вещества, такие как сшитый поливинилпирролидон, агар или альгиновая кислота или ее соль, например альгинат натрия.
Оболочки драже снабжают подходящими покрытиями. Для этой цели можно использовать концентрированные сахарные растворы, которые могут дополнительно содержать гуммиарабик, тальк, поливинилпирролидон, гель карбопола, полиэтиленгликоль, диоксид титана, растворы лаков и подходящие органические растворители или смеси растворителей. Красители или пигменты могут быть добавлены в таблетки или покрытия драже для идентификации или различения различных комбинаций доз активных соединений.
Фармацевтические композиции, которые можно использовать перорально, включают составные капсулы, изготовленные из желатина, а также мягкие герметичные капсулы, изготовленные из желатина и пластификатора, например глицерина или сорбитола. Составные капсулы могут содержать активные ингредиенты в смеси с наполнителем, например лактозой, связующими, например крахмалами, смазывающими веществами, например тальком или стеаратом магния, и, дополнительно, стабилизаторами. В мягких капсулах активные ингредиенты могут быть растворены или суспендированы в подходящих жидкостях, таких как жирными маслами, жидким парафином или жидкими полиэтиленгликолями. Кроме того, могут быть добавлены стабилизаторы. Все препараты для перорального приема должны иметь дозировку, подходящую для выбранного пути введения.
Для трансбуккального введения композиции могут иметь форму таблеток или пастилок, изготовленных традиционным способом.
Для введения путем назальной ингаляции активные ингредиенты согласно настоящему изобретению удобно изготавливать в форме аэрозольного спрея в герметичном контейнере или распылителе с использованием подходящего газа-вытеснителя, например, дихлордифторметана, трихлорфторметана, дихлортетрафторэтана или диоксида углерода. В случае аэрозоля единицу дозировки можно определять с помощью клапана, отмеряющего требуемое количество. Капсулы и их упаковки, например желатин для использования в автомате-дозаторе, могут быть изготовлены с порошковой смесью соединения и подходящей основы, например лактозы или крахмала.
Описанные здесь препараты могут быть изготовлены для парэнтерального введения, например, путем введения шарика или непрерывной инфузии. Составы для инъекции могут быть представлены в форме единицы дозировки, например, в ампулах или контейнерах, содержащих несколько доз, по желанию с добавлением консерванта. Композиции могут иметь форму суспензий, растворов или эмульсий в масляном или водном носителе и могут содержать суспендирующие, стабилизирующие и/или диспергирующие вещества.
Фармацевтические композиции для парэнтерального введения включают водные растворы активного препарата в водорастворимой форме. Кроме того, суспензии активных ингредиентов могут быть изготовлены в форме масляных или водных суспензий для инъекций. Подходящие липофильные растворители или носители включают жирные масла, такие как кунжутное масло, или синтетические эфиры жирных кислот, такие как этилолеат, триглицериды или липосомы.
Водные суспензии для инъекций могут содержать вещества, которые повышают вязкость суспензии, такие как натрийкарбоксиметилцеллюлоза, сорбитол или декстран. Дополнительно, суспензия может также содержать подходящие стабилизаторы или агенты, которые повышают растворимость активных ингредиентов, позволяя изготавливать растворы высокой концентрации.
Как вариант, активный ингредиент может быть в форме порошка для соединения перед использованием с подходящим носителем, например, стерильным раствором на основе непирогенной воды.
Препарат настоящего изобретения также может быть изготовлен в ректальных композициях, таких как свечи или клизмы, с использованием, например, традиционных основ свечей, таких как какао-масло или другие глицериды.
Фармацевтические композиции, подходящие для использования в контексте настоящего изобретения, включают композиции, в которых активные ингредиенты содержатся в количествах, эффективных для достижения намеченной цели. Более конкретно, терапевтически эффективное количество означает количество активных ингредиентов, эффективно предотвращающее, уменьшающее или устраняющее симптомы заболевания или способствующее выздоровлению пациента. Определение терапевтически эффективного количества хорошо известно специалистам в данной области.
Для любого препарата, используемого в способах изобретения, терапевтически эффективное количество или дозу можно первоначально определить анализами in vitro. Например, доза может быть опробована на моделях животных, и такую информацию можно использовать для более точного определения доз, подходящих для людей.
Токсичность и терапевтическая эффективность описанных здесь активных ингредиентов, могут быть определены стандартными фармацевтическими процедурами in vitro, на культурах клеток или экспериментальных животных. Данные, полученные от анализов in vitro на культурах клеток и при исследованиях на животных, могут быть использованы для разработки диапазона доз для использования людьми.
Дозировка может изменяться в зависимости от применяемой формы и пути введения. Точная композиция, путь введения и дозировка могут быть подобраны врачом с учетом состояния пациента. (См. например, Фингль и др., (1975) «Фармакологические основы клинической медицины», Г.1 стр.1).
В зависимости от сложности и реагирования состояния пациента доза может быть единичной или множественной, причем курс лечения длится от нескольких дней до нескольких недель до излечения или минимизации болезненного состояния.
Количество композиции для введения будет, конечно, зависеть от пациента, серьезности болезни, способа введения, мнения назначающего врача и т.д.
Композиции, включающие препарат настоящего изобретения, изготовленные с совместимым фармацевтическим носителем, также могут быть изготовлены, помещены в подходящий контейнер и помечены для лечения определенного состояния.
Композиции настоящего изобретения могут, по желанию, содержаться в упаковке или раздаточном устройстве, таком как набор, одобренный Управлением США по контролю за продуктами и лекарствами, который может содержать одну или несколько доз с активным ингредиентом. Упаковка может, например, содержать металлическую или пластиковую фольгу, т.е. иметь форму блистера. К упаковке или раздаточному устройству могут прилагаться инструкции по применению. К упаковке или раздаточному устройству также может прилагаться уведомление по форме, установленной государственным органом, регулирующим производство, использование или продажу фармацевтических средств, на котором должно быть указано, что государственный орган одобрил эту форму композиции для назначения людям или животным. Такое уведомление может иметь форму, одобренную Управлением США по контролю за продуктами и лекарствами для лекарств, отпускаемых по рецепту, или утвержденную форму для помещения в продукт.
Как сказано выше, ингибиторы-антитела настоящего изобретения могут быть выделены из конструкции нуклеиновой кислоты.
Будет понятно, что полинуклеотиды, кодирующие антитела настоящего изобретения предпочтительно кроме того кодируют сигнальный пептид, который допускает секрецию или прохождение антител в представляющее интерес субклеточное или внеклеточное место.
Например, когда целевым металлопротеином является ММП, секреторный сигнальный пептид предпочтительно связан в каркасе с сегментом антитела, кодирующим полинуклеотид.
Кроме того, станет понятно, что рекомбинантные однонитевые фрагменты Fv (ScFv) предпочтительно могут быть выделены из-за их значительно менее сложной структуры по сравнению с полными молекулами антител. Как сказано выше, ScFv являются белками, состоящими из полипептидных цепей VL и VH антител, синтезированных как одиночная цепь с карбоксильным концом VL, связанным пептидным ответвлением с N-концом VH. Способы рекомбинантного производства этих пептидов хорошо известны в данной области (см. Берд и др., Science 242:423-426 (1988); Хастон и др., Proc. Nat'l Acad. Sci. USA 85:5879-5883 (1988); и де-Круиф и др., J. Mol. Biol. 248:97-105 (1995)). Согласно вариантам осуществления данного аспекта настоящего изобретения, после иммунизации соединениями настоящего изобретения селезеночную мРНК берут у иммунизированного животного и используют для производства библиотеки кДНК в бактериофаге, который имеет фрагменты ScFv. Частицы фага затем просматривают для определения тех, которые специфически взаимодействуют и предпочтительно с активированной формой представляющего интерес металлопротеина. Из этих частиц фага выделяют сегменты ScFv и клонируют в экспрессионную конструкцию (см. патент США 5,800,814).
Конструкции нуклеиновой кислоты данного аспекта настоящего изобретения могут вводиться в целевые клетки индивидуального объекта (т.е., генная терапия in vivo).
Как вариант, конструкцию нуклеиновой кислоты вводят в подходящую клетку путем подходящего способа/средства доставки генов (трансфекцией, трансдукцией, гомологенной рекомбинацией и т.д.) и системой экспрессии при необходимости, и затем модифицированные клетки расширяют в культуре и возвращают пациенту (т.е., генная терапия ех vivo).
Для клеточной экспрессии антител или фрагментов антител настоящего изобретения, конструкция нуклеиновой кислоты настоящего изобретения кроме того включает по меньшей мере один действующий в цис-положении регуляторный элемент. Используемая здесь фраза «действующий в цис-положении регуляторный элемент» относится к полинуклеотидной последовательности, предпочтительно промотору, который связывает действующий извне регулятор и регулирует транскрипцию кодирующей последовательности, расположенной после него.
По данной методологии можно использовать любой доступный промотор. В предпочтительном варианте осуществления настоящего изобретения промотор, используемый конструкцией нуклеиновой кислоты настоящего изобретения, активный в трансформируемой специфической клеточной популяции. Примеры промоторов, специфических к типам клеток и/или специфических к тканям, включают такие как альбумин, который специфический к печени [Пинкерт и др., (1987) Genes Dev. 1:268-277], промоторы, специфические к лимфоидам [Калам и др., (1988) Adv. Immunol. 43:235-275]; в частности промоторы рецепторов Т-лимфоцитов [Уиното и др., (1989) EMBO J. 8:729-733] и иммуноглобулинов; [Банерий и др. (1983) Cell 33729-740], нейрон-специфические промоторы, такие как промотор нейрофиламентов [Бирн и др. (1989) Proc. Natl. Acad. Sci. USA 86:5473-5477], промоторы, специфические к поджелудочной железе [Эдлунх и др. (1985) Science 230:912-916] или промоторы, специфические к молочной железе, такие как промотор молочной сыворотки (Патент США 4,873,316 и опубликованная европейская заявка №264,166). Конструкция нуклеиновой кислоты настоящего изобретения может кроме того включать ген-усилитель, который может быть расположен рядом или на удалении от последовательности промотора и может функционировать для регулирования ее транскрипции.
Конструкции данной методологии предпочтительно кроме того включают подходящий выбираемый маркер и/или репликатор. Предпочтительно, используемая конструкция является челночным вектором, который может размножаться в Е.coli (когда конструкция содержит подходящий выбираемый маркер и репликатор) и является совместимым для размножения в клетках или интеграции в гене и выбранной ткани.
Конструкция согласно настоящему изобретению может быть, например, плазмидой, бакмидой, фагмидой, космидой, фагом, вирусом или искусственной хромосомой.
Предпочтительные в настоящее время способы переноса нуклеиновых кислот in vivo включают трансфекцию с вирусными или невирусными конструкциями, такими как аденовирус, лентивирус, вирус I простого герпеса или аденоассоциированный вирус (ААВ) и системы на базе липидов. Подходящими липидами для липидного переноса гена являются, например, DOTMA, DOPE и DC-Choi [Тонкинсон и др, Cancer Investigation, 14(1):54-65 (1996)]. Наиболее предпочтительными конструкциями для использования в генной терапии являются вирусы, наиболее предпочтительно аденовирусы, ААВ, лентивирусы или ретровирусы. Вирусная конструкция, такая как ретровирусная конструкция, включает по меньшей мере один промотор/усилитель транскрипции или элемент определения локуса или другие элементы, которые регулируют экспрессию генов другими средствами, такими как альтернативный сплайсинг, экспорт ядерной РНК или пост-трансляционная модификация мессенджера. Такие векторные конструкции также включают упаковочный сигнал, длинные концевые повторы (LTR-последовательности) или их части, а также сайты связывания праймеров положительных и отрицательных цепей, соответствующие используемому вирусу, если он уже не представлен в вирусной конструкции. Кроме того, такая конструкция обычно включает сигнальную последовательности для секреции пептида или антитела из клетки-хозяина, в которую она помещена. Предпочтительно, сигнальная последовательности для этой цели является сигнальной последовательностью млекопитающего. Дополнительно, конструкция также может включать сигнал, который направляет полиаденилирование, а также один или несколько сайтов рестрикции и последовательность конца трансляции. Для примера, такие конструкции будут обычно включать 5' LTR, сайт связывания тРНК, упаковочный сигнал, начало синтеза второй нити ДНК и 3' LTR или ее часть. Могут быть использованы и другие векторы, которые являются невирусными, такие как катионные липиды, полилизин и дендримеры.
Предпочтительные режимы для осуществления протоколов генной терапии представлены в публикациях Сомиа и Верма [(2000) Nature Reviews 1:91-99], Иснер (2002) «Генная терапия миокарда». Nature 415:234-239; Хай (2001) «Генная терапия: Перспектива-2001». Haemophilia 7:23-27; и Хаммонд и Маккирнан (2001) «Ангиогенная генная терапия при болезни сердца: обзор исследований на животных и клинических испытаний». 49:561-567.
Из-за способности антител настоящего изобретения дифференциально распознавать активированную форму металлопротеина (см. Пример 3), их можно использовать как мощные диагностические и прогнозные средства, например путем мониторинга активности ММП в биологической пробе [т.е., любой пробе из организма (сыворотки или плазмы), слюны, асцитных жидкостей, плевральных эффузий, мочи, образцов биопсии, изолированных клеток и/или препарата клеточных мембран]. Это имеет особое значение при оценке метастатических признаков раковых клеток, когда несбалансированная активация ММП облегчает проникновение опухоли. Подобно этому, антитела настоящего изобретения могут быть использованы при мониторинге терапевтической дозировки ингибиторов ММП. Для таких применений антитела настоящего изобретения предпочтительно метят каждой из любых радиоактивных, флуоресцентных, биологических или ферментативных меток, которые стандартно используют в данной области. Использование таких меток рассматривается в патентах США 3,817,837; 3,850,752; 3,939,350; 3,996,345; 4,277,437; 4,275,149 и 4,366,241.
Будет понятно, что такие способы детектирования также могут использоваться для быстрого скрининга новых ММП. Коротко, многочисленные биологические пробы можно вводить в контакт с антителами настоящего изобретения, где активированные ММП могут связываться с ними. Предпринимаются меры по использованию биологических проб, которые включают активированные ММП, такие как полученные из линий опухолевых клеток. Обычно радиоактивную метку используют для уменьшения объема пробы для анализа.
Как вариант, антитела настоящего изобретения могут использоваться для очистки активных металлоферментов от биологических проб.
В данной области известны многочисленные способы очистки белков. Например, антитела или фрагменты антител настоящего изобретения могут использоваться в аффинной хроматографии для изоляции металлоферментов. Можно подготовить колонки, где антитела связаны с твердым субстратом, например, частицами, такими как агароза, Сефадекс и т.п., и биологическая проба, такая как клеточный лизат, может быть пропущена через колонку, затем колонку промывают, после чего повышают концентрацию мягкого денатурирующего средства, посредством чего высвобождается очищенный металлофермент.
Антитела или их фрагменты, созданные согласно настоящему изобретению, могут быть включены в диагностический или терапевтический набор. Антитела или фрагменты антител могут быть упакованы в один или несколько контейнеров с соответствующими буферными растворами и консервантами и использоваться для диагностики или для направления лечения.
Так, антитела или их фрагменты могут быть смешаны в одном контейнере или помещены в индивидуальные контейнеры. Предпочтительно, контейнеры имеют этикетку. Подходящими контейнерами являются, например, бутыли, колбы, шприцы и пробирки. Контейнеры могут быть выполнены из разных материалов, таких как стекло или пластик.
Кроме того, также могут быть добавлены и другие добавки, такие как стабилизаторы, буферные растворы, блокаторы и т.д. Антитела в таких наборах могут также быть прикреплены к твердой основе, такой как шарики, матричному субстрату (например, чипам) и т.д. и использоваться для диагностических целей. Набор также может включать инструкции по определению, страдает ли проверяемый объект от, или имеет риск развития, некоторого состояния, нарушения или заболевания, связанного с экспрессией соответствующей ММП.
Другие цели, преимущества и новые признаки настоящего изобретения станут понятны среднему специалисту в данной области после изучения следующих Примеров, которые не должны восприниматься как ограничивающие. В дополнение, каждый из вариантов осуществления и аспектов настоящего изобретения, которые описаны выше и включены в формулу изобретения, имеет экспериментальную поддержку в последующих Примерах.
ПРИМЕРЫ
Теперь будут рассмотрены примеры, которые вместе с вышеприведенным описанием иллюстрируют изобретение неограничивающим образом.
В общем, используемая здесь номенклатура и лабораторные процедуры в настоящем изобретении включают молекулярные, биохимические, микробиологические и ДНК-рекомбинантные способы. Такие способы подробно объяснены в литературе. Смотрите, например, «Молекулярное клонирование: лабораторный справочник» Сэм-брук и др., (1989); «Текущие протоколы в молекулярной биологии», Тома I-III под ред. Осубела, Р. М., (1994); Осубел и др., «Текущие протоколы в молекулярной биологии», John Wiley & Sons, Балтимор, штат Мэриленд (1989); Пербал, «Практическое руководство по молекулярному клонированию», John Wiley & Sons, New York (1988); Уотсон и др., «Рекомбинантная ДНК», Scientific American Books, New York; Биррен и др. «Анализ генома: Серия лабораторных руководств», Т.1-4, Cold Spring Harbor Laboratory Press, New York (1998); методологии из патентов США 4,666,828; 4,683,202; 4,801,531; 5,192,659 и 5,272,057; «Клеточная биология: лабораторный справочник», Т I-III под ред. Целлиса, Дж. Э., (1994); «Текущие протоколы в иммунологии» Т. I-III под ред. Колиган Дж. Э., (1994); Стайте и др., «Базовая и клиническая иммунология» (8-е издание), Appleton & Lange, Hopwalk, CT (1994); Мишелл и Шииги, «Избранные методы в клеточной иммунологии», W. H. Freeman & Co., New York (1980); доступные иммуноанализы широко описаны в патентной и научной литературе, смотрите, например, патенты США 3,791,932; 3,839,153; 3,850,752; 3.850,578; 3,853,987; 3,867,517; 3,879,262; 3,901,654; 3,935,074; 3,984,533; 3,996,345; 4,034,074; 4,098,876; 4,879,219; 5,011,771 и 5,281,521; «Синтез олигонуклеотидов» под ред. Гейта, М. Дж., (1984);
«Гибридизация нуклеиновой кислоты» Хеймс, Б.Д. и Хиггинс С. Дж. (1985); «Транскрипция и трансляция» Хеймс, Б.Д. и Хиггинс С. Дж. (1984); «Культура клеток животных», под ред. Фрешни, Р.И., (1986); «Иммобилизованные клетки и ферменты», IRL Press, (1986); «Практическое руководство по молекулярному клонированною», Пербал, Б., (1984) и "Методы ферментологии», Т.1-317, Academic Press; «Протоколы ПЦР: Справочник по методам и применениям», Academic Press, San Diego, CA (1990); Маршак и др., «Стратегии очистки и определения характеристик белков - Лабораторный курс», CSHL Press (1996); которые все включены по ссылке, как если бы они были раскрыты здесь в полном объеме. Настоящий документ содержит и другие общие ссылки. Считается, что указанные в них процедуры хорошо известны в данной области и представлены для удобства читателя. Вся содержащаяся в них информация включена в настоящий документ путем ссылки.
Материалы и способы
Рекомбинантные ферменты - Каталитический домен ММП-2 (аминокислоты 110-467 из банка генов с номером доступа NP032636.1) был экспрессирован с промотором Т7 в клетках BL-21. Эти клетки были индуцированы 1 ммоль изопропил-П-Д-тиогалактопиранозида в течение 5 часов. Клеточный осадок был повторно суспендирована в 50 ммоль буферного раствора Трис, рН 8,0, 0,5 ммоль ЭДТК, 50 ммоль NaCl, 5% глицерина и 1% Тритон Х-100 в соотношении 1:25 с буферным раствором до первоначального объема культуры. Суспензию центрифугировали в течение 10 мин при 15000 об/мин и осадок растворили в 50 ммоль Трис, рН 8,0, 0,5 ммоль ЭДТК, 50 ммоль NaCI, 5% глицерина и 0,2% Саркосил, после чего провели инкубацию на льду в течение 30 мин. Надосадочную жидкость загрузили в колонку 5 мл с желатином-сефарозой (готовая, компания Amersham Biosciences), предварительно уравновесили и промыли диализным буферным раствором (50 ммоль Трис, рН 8,0, 50 ммоль NaCl, 5 ммоль CaCl2, 10 мкмоль ZnCl2, 0,02% Brij). Белок элюировали с помощью 50 ммоль Трис, рН 8,0, 1 моль NaCl, 5 ммоль CaCl2, 10 мкмоль ZnCl2, 0,02% Brij и 15% Me2SO [Розен, О., «Ингибирование ММП моноклональными антителами», 2001] и анализировали с использованием программы SDS-PAGE, и его каталитическую активность измерили по деградации флурогенного пептида [Найт, К. Дж., Ф. Уилленброк и Дж. Мерфи, «Новый пептид, помеченный кумарином, для чувствительных непрерывных анализов матриксных металлопротеиназ». FEBS Lett, 1992. 296(3): р.263-6].
Про-ММП-9 [с отсутствием шарнирной области и домена геморексина, прекурсор матриксной металлопротеиназы-9 (ММП-9) Alal-Gly424 |P14780|ММП9_HUMAN (ЕС 3.4.24.35)] был экспрессирован в Escherichia coli ER2566 в векторе экспрессии pTWIN и очищен до однородности от включений, как сказано выше [Бьорклунд, М., П. Хейккила и Э. Койвунен, «Пептидное ингибирование каталитической и некаталитической активности матриксной металлопротеиназы-9 блокирует миграцию и инвазию опухолевых клеток». J Biol Chem, 2004. 279(28): p.29589-97]. Прекурсор ММП-9 активировали 1 ммоль ацетата п-аминофенилртути (АРМА, компания ICN Biomedicals Inc., Огайо, США) и растворяли в 200 ммоль Трис в течение 30 мин при 37°C.
Человеческие рекомбинантные про-ММП-2 и про-ММП-9 экспрессировали в клетках HeLa S3, инфицированных соответствующими рекомбинантными вирусами коровьей оспы, и очистили до однородности, как сказано выше [Ольсон, М.В., Герваси, Д.К, Мобашери, С. и Фридман, Р. (1997) J. Biol. Chem. 272, 29975-29983; Фридман, Р., Фуерст, Т.Р., Берд, Р.Э., Хойхтя, М., Элкукт, Т.М., Краус, С., Комарек, Д., Лиотта, Л.А., Берман, М.Л. и Стетлер-Стивенсон, У. Дж. (1992) J. Biol. Chem. 267, 15398-15405].
Тетракарбоксифенилпорфирин Co(II)/Zn(II) (CoTCPP/ZnTCPP) - ZnTCPP синтезировали путем реакции ZnCl2 и ТСРР в N,N-диметилформамиде (ДМФ) как описано в публикации [Харада, А. и др., «Контроль фотоиндуцированного переноса электронов от цинка-порфирина к метилвиологену путем надмолекулярной формации между моноклональным антителом и цинком-порфирином». Photochem Photobiol, 1999. 70(3): p.298-302]. СоТСРР синтезировали путем реакции Со(ОАс)2-4H2O и ТСРР в ДМФ, как описано в публикации [Харада, А. и др., «Контроль фотоиндуцированного переноса электронов от цинка-порфирина к метилвиологену путем надмолекулярной формации между моноклональным антителом и цинком-порфирином»] и очистили.
Синтез Imisdp - Описан в Примере 7, ниже.
Соединение гаптена с белком - Гаптены (4 мг) активировали для соединения путем добавления 1,1'-карбонилдиимидазола в ДМФ (при молярном отношении 1:1) и инкубировали в течение 1 ч. Активированный гаптен в количестве 1-50 мкмоль добавили к 20 мг/мл БСА или моллюсковому гемоцианину (KLH) в 0,1-молярном карбонатном буферном растворе с рН 8. Раствор перемешивали при комнатной температуре в течение 3 ч и затем экстенсивно диализировали относительно фосфатно-солевого буферного раствора (PBS).
Иммунизация и слияние - каждый из адъювантов (KLH), соединенный с СоТСРР, ZnTCPP или Imisdp, использовали для иммунизации мышей BALB/c. Иммунизацию и последующее слияние с клеточной линией миеломы NSO выполняли по стандартным процедурам [Харлоу, Э. и Лейн, Д., «Использование антител: Лабораторное руководство - Мобильный протокол №I». 1998].
Скрининг антител
ИФА - Надосадочные жидкости растущих гибридом анализировали на антитела, реагирующие с ZnTCPP, CoTCPP или Imisdp, используя прямой ИФА, в котором соответствующие гаптен-БСА (3 мкг/мл фосфатно-солевого буферного раствора) нанесли на планшеты Nunc Maxisorp. Нанесенный слой выдержали при 4°C в течение ночи и инкубировали с антителами при 20°C в течение 1 ч. Связанное пероксидазой из корней хрена моноклональное антитело (mAb) для мышей (Sigma) использовали в качестве вторичного антитела, и 2,2'-азино-бис (3-этилбензтиазолин-6-сульфоновую кислоту, ABTS, Sigma) использовали в качестве субстрата. Фосфатно-солевой буферный раствор (PBS), содержащий 0,005 объ. % Tween 20 (PBST), использовали в качестве промывочного реагента. Буфером для растворения служил PBS. А602 регистрировали планшет-ридером SPECTRAFluor Plus (компания Tecan, Австрия). Для контроля надосадочные жидкости инкубировали с планшетами, покрытыми БСА, по такой же процедуре. Значения поглощательной способности выше 0,5 миллиоптической плотности считались положительными.
Конкурентный ИФА - Разбавленную в разной степени надосадочную жидкость гибридомы инкубировали с планшетами, покрытыми гаптеном-БСА, согласно вышеуказанным этапам.
Была подготовлена кривая титрации, и разбавление титра было определено на 50% от связывания.
Надосадочные жидкости, разбавленные до концентрации титра, предварительно инкубировали растворимыми соединениями ZnTCPP, CoTCPP или Imisdp в течение 30 мин и затем переносили на покрытые гаптеном микротитровальные планшеты после этапов, описанных выше. Оцененная константа диссоциации являлась концентрацией растворимого гаптена, требующейся для достижения 50% связывания.
Производство и очистка - Выбранные гибридомы были субклонированы дважды ограниченными разбавлениями, за чем последовало крупномасштабное производство асцитами опухолей, затравкой которых служил пристин (2,6,10,14 тетраметилпентадекан), вводимый мышам BALB/c. Моноклональные антитела очистили аффинной хроматографией на белке G сефарозы 4 (Amersham Biosciences). Асциты центрифугировали при 12000 g в течение 15 мин для удаления нерастворимых частиц и липида. Асциты в количестве 1 мл разбавили в 5 раз по объему, используя PBS, затем загрузили в колонку объемом 5 мл с белком G сефарозы. Пик элюирования анализировали SDS-PAGE.
Определение изотипа - Надосадочные жидкости культуры, полученные из клонированных гибридом, выраженных в колбах с культурой, использовали в качестве источника антитела. Изотип каждого антитела определяли с помощью набора для определения изотипа моноклонального антитела мыши (компания HyCult biotechnology b.v., Нидерланды).
Иммуноблоттинг очищенных антител - Очищенные антитела сепарировали в 8% SDS-полиакриламидном геле, перенесли на мембраны NC (Bio-Rad) и впоследствии подвергли иммуноблоттингу с использованием антитела к ММП-9 (Sigma). Козий IgG антимыши, конъюгированный пероксидазой корня хрена (Sigma), использовали в качестве вторичного антитела. Сигналы детектировали с использованием ECL (Pierce).
Анализ связывания с использованием очищенных белков - антитела (10 мкг) инкубировали гранулами агарозы IgG антимыши (Sigma) в течение ночи при 4°C в PBS. После промывки несвязанного антитела добавляли очищенную Про-ММП-2, Про-ММП-9, каталитический домен ММП-2, каталитический домен МТ1 или ТАСЕ (2 мкг), после чего инкубировали в течение 2 ч при комнатной температуре. Гранулы собрали центрифугированием и промыли 3 раза PBS. Белки, которые остались связанными с гранулами, элюировали буферным раствором SDS, фракционировали SDS-PAGE и детектировали путем окрашивания голубым кумасси.
Иммунопреципитация и вестерн блоттинг - Клетки НТ1080 посеяли в чашки Петри. После 80% слияния среда (DMEM, дополненная 10% FCS, заменимыми аминокислотами, пенициллином, стрептомицином, пируватом натрия и L-глутамином) была заменена на не содержащую сыворотки среду (без FCS). После еще 24 ч инкубации кондиционированную среду (КС) собрали со сросшихся клеток и сконцентрировали, используя Millipore Cemricon-10 (Бедфорд, Массачусетс). Концентрированные надосадочные жидкости использовали для иммунопреципитаций. КС инкубировали с анти-1 (СоТСРР) моноклональным антителом (mAb) (15 мкг/мл) в течение ночи при 4°С. Белок А Сефароза (CL-4B, Amersham Biosciences) добавили к пробам и перемешивали в течение 2 ч при комнатной температуре. Гранулы промыли 3 раза PBS, суспендировали в буферном растворе SDS и нагрели до 95°C за 3 мин. Иммунопреципитаты отобрали центрифугированием и подвергли SDS/PAGE. После отделения белки перенесли на нитроцеллюлозные (НЦ) мембраны и проверили антителом анти-ММП-2.
Для активации Про-ММП-2, произведенной клетками НТ1080, 1 ммоль 4-аминофенилртутьацетат (АРМА) добавили к концентрированной КС и инкубировали в течение 6 ч при 37°C. После активации КС диализовали (х3) против PBS при 4°C для удаления АРМА. Иммунопреципитацию с активированной средой выполнили так, как сказано выше.
Связывание с активной ММП-9, используя прямой ИФА - Каталитический домен ММП-9 (2 мкг/мл) иммобилизировали в лунках на микротитровальном планшете. Моноклональные антитела (1 мг/мл) добавили в лунки после процедуры, описанной для скрининга ИФА, антитело против ММП-9 (Sigma) служило в качестве положительного контроля и сродство IgG неродственной мыши, очищенное от асцитов, служило в качестве отрицательного контроля.
Кинетический анализ - Ферментативную активность ММП измеряли, как было описано раньше (Соломон, А. и др., «Выраженное отличие в электронных и химических свойствах между сайтами каталитического цинка фермента, преобразующего альфа-фактор некроза опухолей, и матриксных металлопротеиназ несмотря на их высокое структурное подобие». J Biol Chem, 2004. 279(30): стр.31646-54). Активность ММП-9, ММП-2 и МТ1-ММП измеряли путем мониторинга деградации флуорогенного пептида Mca-Pro-Leu-Gly-Leu-Dpa-Ala-Arg-NH2 при γех=340 нм и γem=390 нм, как описано Найтом и др. (FEBS Lett, 1992. 296(3): р.263-6), купленного в компании Calbiochem-Novabiochem AG. Стандартная смесь для анализов содержала 50 ммоль буферного раствора Трис, рН 7,5, 200 ммоль NaCl, 5 ммоль CaCl2, 20 мкмоль ZnCl2 и 0,05% Brij. Ферментативную активность ТАСЕ измеряли путем мониторинга деградации флуорогенного пептида QF-45 (Mca-Ser-Pro-Leu-Ala-Gln-Ala-Val-Arg-Ser-Ser-Ser-Arg-Lys(динитрофенил)-NH2), купленного в компании Calbiochem-Novabiochem AG.
Зимография in situ - Для локализации чистой желатинолитической активности ММП зимографией in situ DQ-желатин, помеченный флуоресцеина изотиоцианатом, который был интрамолекулярно блокирован (молекулярные пробники), использовали в качестве субстрата для деградации гелатиназами. Протеолиз гелатиназами дает расщепленные пептиды желатина - флуоресцеина изотиоцианата, и локализации этой флуоресценции оказывает сайты чистой желатинолитической активности. Коротко, клетки НТ1080 человеческой фибросаркомы (которые производят ММП-2, ММП-9 и МТ1-ММП) помещали на покровные стекла 12-ммоль. После инкубации в течение 24 ч клетки обработали 1 мкмоль антитела 13Е11 в течение 30 мин при 37°C. Необработанные клетки в этом эксперименте использовали в качестве отрицательного контроля. Клетки промыли PBS и затем инкубировали с буферным раствором для зимографии (0,05 моль Трис-HCl, 0,15 моль NaCl, 5 ммоль CaCl2 и 0,2 ммоль NaN3, рН 7,6, высокая концентрация азида фагоцитацию желатина и позволила получить желатинолитическую активности на поверхности клеток), содержащим 60 мкг/мл DQ-желатина при 37°C в течение ночи. Буферный раствор для зимографии содержал 1 мкмоль антитела против СоТСРР для обработанных клеток. В конце периода инкубации без фиксации или дальнейших промывок желатинолитическую активность ММП локализовали и сфотографировали с помощью флуоресцентного микроскопа, получая изображения цифровой камерой Spot.
ПРИМЕР 1
Конфирмационная мимикрия активного сайта цинка небольшими органометаллическими соединениями
Ион цинка в активном сайте ММП равномерно координируется тремя консервативными остатками гистидина. Во время активации зимогена и протеолиза субстрата координация цинка меняется с 4-координатной, четырехугольной геометрии, на некаталитических стадиях на 5-координатную, треугольную бипирамидальную [Олд, Д.С., «Сфера координации цинка в биохимических сайтах цинка». Biometals, 2001. 14(3-4); р.271-313] на каталитических стадиях. Консервативные гистидины поэтому могут принимать различные геометрии по отношению к иону цинка. Для выборки этих конформаций выбрали два соединения в качестве моделей для мимикрии среды цинка - Imisdp и Co/ZnTCPP (ФИГ.1). Соединение Imisdp (синтез изложен в Примере 7, ниже) может имитировать 4-координатную геометрию. В этом случае почти четырехугольная конформация формируется тремя имидазольными основаниями и молекулой воды в качестве четвертого лиганда.
На ФИГ.2А показано наложение сконструированной 3D-модели молекулы Imisdp на каталитический сайт ММП-9 (PDB 1GKC) [Роуселл, С. и др., «Структура кристалла человеческой ММП9 в комплексе с обратным ингибитором гидроксамата», J Mol Biol, 2002. 319(1): р.173-81], который был модифицирован для представления четырехугольной геометрии лигандов цинка. Модификации включали замену лиганда, присутствующего в рентгеновской структуре (ингибитора гидроксамата), на молекулу воды и оптимизацию всего фермента к локальному минимуму путем многослойного подхода QM/UM (см. материалы и способы). Существует высокое сходство между вычисленным фрагментом цинка гистидина в ММП-9 и Imisdp в смысле расстояний 6-азота гистидинов от иона цинка (2,04±0,06 и 2,02, соответственно) и относительной ориентацией трех гистидинов к металлу. Вторая молекула, -Zn/CoTCPP, имеет четыре имидазольных основания в координации с цинком или его аналогичным металлом кобальтом в копланарной конформации по отношению к иону металла [Стивене, Э.Д., «Электронная структура металлопорфиринов. 1. Экспериментальное распределение плотности электронов (мезо-тетрафенилпорфинато)кобальт (II)». J. Am. Chem. SOC, 1981. 103(17): p.5087-5095]. Эта конфигурация имитирует конформацию двух из трех гистидинов в 5-координатной, треугольной бипирамидальной геометрии, где металл почти копланарен двум гистидинам, которые формируют основание пирамиды. На ФИГ.2В показана структура кристалла ММП-9 (PDB 1GKC), где цинк координируется 5 лигандами (два дополнительных лиганда вносит ингибитор гидроксамата), ориентация двух гистидинов в основании пирамиды и их расстояния от иона цинка (2,2±0,02, 2,03±0,04 и 1,95 для ММП-9, ZnTCPP и СоТСРР, соответственно) сравнимы с молекулой Co/ZnTCPP.
ПРИМЕР 2
Создание и селекция моноклинальных антител
Моноклональные антитела против СоТСРР, ZnTCPP и Imisdp (ФИГ.1) были получены путем иммунизации мышей и селекции специфических антител скринингом ИФА с соответствующим соединением в качестве покрытого антигена. Три антитела были отобраны для широких исследований. Эти клоны были выбраны потому, что они обладали наилучшим сродством к иммунизирующему их гаптену на основании конкурентного ИФА-скрининга. Константы их связывания, в диапазоне 0,01-0,09 мкмоль, (таблица 3, ниже), характерны для mAbs с высоким сродством. Моноклональные антитела размножали как асциты в мышах и очищали гранулами белка G.
ПРИМЕР 3
Моноклональные антитела перекрестно реагируют с ММП-2 и ММП-9
Для определения, могут ли антитела против синтетических соединений, которые имитируют конформацию гистидина цинка в каталитическом сайте ММП, перекрестно реагируют с открытым фрагментом гистидина цинка в активных сайтах ММП-2 и ММП-9, моноклональные антитела сначала проверили на связывание ММП-9, используя прямой ИФА.
Три антитела связали каталитический домен ММП-9, прямо адсорбированный в лунки микротитровального планшета (коммерческое антитело против ММП-9 служило в качестве положительного контроля, и неродственное IgG служило в качестве отрицательного контроля). Интересно, что антитела, которые размножались как асциты в мышах и были очищены совместно с активной ММП-9, присутствовали в асцитной жидкости мышей. Вестерн иммуноблоттинг только очищенных антител с антителом против ММП-9 как первичным антителом показал чистый диапазон, соответствующий ожидаемой молекулярной массе приблизительно 82 а.е.м. для активной ММП-9. Так, антитела образовали комплекс in vivo с нативным ферментом.
Моноклональные антитела далее проанализировали на связывание ММП-2, используя иммуноаффинный анализ. Антитела инкубировали с каталитическим доменом ММП-2 (ММП-2cat) in vitro, после чего вытягивали с помощью гранул агарозы IgG анти-мышь. Как показано на ФИГ.3А, все антитела связали ММП-2cat.
Для установления того, что связывание происходит путем прямого взаимодействия с активным сайтом, антитела анализировали на их способность связывать Про-ММП-2 и Про-ММП-9. В латентных ферментах продоменная структура защищает каталитическое углубление. Поэтому блокирование активного сайта продоменной структурой должно предотвращать связывание антитела, при условии, что она распознает фрагмент цинка гистидина в активном сайте. В тех же условиях не было выявлено связывание с проферментами (ФИГ.3В). Этот режим связывания с активной ММП-2, но не с Про-ММП-2 был далее проверен среде in vivo на нативной ММП-2 полной длины, секретированной культурами клеток (НТ1080) человеческой фибросаркомы. Иммуно-преципитация среды, кондиционированной клетками НТ1080 с антителом против СоТСРР, после которой был выполнен вестерн иммуноблоттинг, показал связывание с активной ММП-2, но не с Про-ММП-2 (ФИГ.3С). Эти результаты демонстрируют, что все три антитела перекрестно реагируют с ММП-2 и ММП-9. Открытие углубления активного сайта имеет большое значение для связывания антител, подтверждая, что моноклональные антитела прямо взаимодействуют с активными сайтами ММП-2 и 9.
ПРИМЕР 4
Антитела против СоТСРР и Imisdp ингибируют ММП-2 и ММП-9 in-vitro
Антитела против Imisdp и СоТСРР ингибировали протеолитическую активность ММП-2 и ММП-9 в микромолярном диапазоне (ФИГ.5). Кинетический анализ ингибирования ММП антителами был выполнен в постоянном флуорометрическом анализе с гашеным флуоресцентным пептидным субстратом. Что удивительно, антитело против ZnTCPP не показало ингибирующего эффекта.
Для определения природы ингибирования антителами против СоТСРР провели эксперименты с использованием ферментов в присутствии или отсутствии антитела при различных концентрациях флуоресцентного пептидного субстрата. Данные, представленные на графике Лайнвивера-Берка, показанного на ФИГ.4А-В, характеризуют профиль конкурентного ингибирования при значениях Ki 13 мкмоль и 24 мкмоль для ММП-9 и ММП-2, соответственно. Профиль конкурентного ингибирования показал, что антитело связано с тем же сайтом, что и пептидный субстрат. Этот режим ингибирования далее подтверждает прямое взаимодействие с активным сайтом. Стоит отметить, что антитело против Imisdp показало зависящий от концентрации ингибирующий эффект, направленный на ММП-2 и ММП-9, предполагая конкурентное ингибирование, вычисленные значения Ki составили 5,8 мкмоль и 3 мкмоль для ММП-9 и ММП-2, соответственно (ФИГ.5). Поскольку антитела распознают сайт связывания ММП-2 и ММП-9, дальнейшая оптимизация интерфейсных комплементарностей между антителами и ММП, как структурная, так и электростатическая, достижима методами аффинного созревания (Поль Ж. Картье, Nature Reviews Immun. Vol.6 2006 343-357). Использование этого подхода может привести к высоко специфическим ингибиторам, которые будут пользоваться признаками специфичности, находящимися внутри или снаружи активного сайта.
ПРИМЕР 3
Зимография in situ
Для подтверждения ингибирующей активности антитела против СоТСРР на клеточном уровне, действие антитела исследовали на желатинолитической активности клеток НТ1080 человеческой фибросаркомы, которые конститутивно секретируют ММП-2 и 9, методом зимографии in situ. Для локализации желатинолитической активности ММП методом зимографии in situ желатин, помеченный флуоресцеином изотиоцианатом, который был погашен внутримолекулярно (DQ-желатин), использовали в качестве субстрата. Протеолиз гелатиназами дал отщепленные пептиды флуоресцеина изотиоцианата - желатина, и локализация этой флуоресценции указывает сайты чистой желатинолитической активности. Необработанные клетки НТ1080 человеческой фибросаркомы (ФИГ.7А) показали значительную желатинолитическую активность поверхности клеток. В присутствии 1 мкмоля антитела (ФИГ.7В), гелатиназа activity was reduced as compared to that observed in control cells. These results demonstrate that anti CoTCPP mAb inhibited ММП-2 nd ММП-9 at the cellular level.
ПРИМЕР 6
Селективность моноклональных антител настоящего изобретения
Селективность антител была проверена путем исследования связывающего и ингибирующего действия моноклональных антител против CoTCPP и Imisdp по отношению к ММП-14 (МТ1-ММП) и TNF-α-преобразующему ферменту (ТАСЕ), зависящей от цинка металлопротеиназы, относящейся к родственному семейству ADAM (дисинтегрин и металлопротеиназа) (ADAM-17). Ингибирующее действие по отношению к МТ1-ММП и ТАСЕ было проверено путем in-vitro анализа ферментативной активности флуоресценции с соответствующими пептидными субстратами. Моноклональное антитело против CoTCPP не показало ингибирующего действия по отношению к МТ1-ММП или ТАСЕ. Для определения того, связывает ли оно ТАСЕ и МТ1-ММП без последующего ингибирования, были выполнены иммуноаффинные эксперименты с очищенными ферментами, но связывания выявлено не было. В противоположность моноклональному антителу против CoTCPP, моноклональное антитело против Imisdp ингибировало МТ1-ММП при значении Ki 10 мкмоль, но не показало ингибирующего действия по отношению к ТАСЕ. Результаты представлены в таблице 4, ниже.
Среди членов семейства ММП и ТАСЕ существует высокое структурное сходство в активном сайте, конкретно, трехмерные структурные элементы, окружающие сайт связывания цинка, почти идентичны, вследствие необходимости вмещать каркас пептида субстратов и присутствия консервативного фрагмента EXXHXXGXXH связывания цинка [Соломон, А. и др., «Выраженное разнообразие электронных и химических свойств у сайтов каталитического цинка в ферменте, преобразующем альфа-фактор некроза опухоли, и матриксных металлопротеиназ, несмотря на их высокое структурное сходство». J Biol Chem, 2004. 279(30): p.31646-54; Лукацова, В. и др., «Сравнение сайтов связывания матриксных металлопротеиназ и фермента, преобразующего альфа-фактор некроза опухоли: последствия для селективности». J Med Chem, 2005. 48(7): р.2361-70]. Поэтому не ожидается, что селективность моноклональных антител к ММП основана исключительно на распознании консервативного фрагмента цинка гистидина. Однако, в отличие от синтетических ингибиторов с небольшой молекулярной массой, антитело, являющееся крупной молекулой белка, должно иметь ограниченный доступ к углублению в активном сайте, которое скрыто в каркасе белка. В частности, поскольку моноклональные антитела специфически взаимодействуют с ионом каталитического цинка, степень открытости иона цинка для раствора должна быть критической для связывания антителом. МТ1-ММП и в большей степени ТАСЕ отличаются глубоким SI-карманом, коррелированным с относительно скрытым ионом каталитического цинка, что показывают структуры их кристаллов. Различие в глубине активного сайта может являться причиной отсутствия ингибирующего действия антител по отношению к ТАСЕ. Эти результаты предполагают, что селективность может быть достигнута на основании степени открытости иона каталитического цинка. Еще одним важным фактором, который должен учитываться при сравнении ММП и ТАСЕ, являются различия в кармане активного сайта в смысле химии, такие как гидрофобность и полярность (см. ФИГ.8). Активный сайт ТАСЕ, например, значительно более полярный чем активные сайты большинства ММП. Соломон и др. продемонстрировали, что такое изменение полярности активного сайта прямо влияет на ориентацию имидазольных колец гистидина активного сайта по отношению к иону каталитического цинка [Соломон, А. и др., «Выраженное разнообразие электронных и химических свойств у сайтов каталитического цинка в ферменте, преобразующем альфа-фактор некроза опухоли, и матриксных металлопротеиназ, несмотря на их высокое структурное сходство». J Biol Chem, 2004. 279(30): р.31646-54].
Селективность антител против СоТСРР и Imisdp была далее проверена по их перекрестной реакционной способности с неродственными ферментами, зависящими от цинка - карбоновой ангидразой (КА) и спиртовой дегидрогеназой из brockii (TbADH). Подобно активной ММП, КА содержит ион цинка, который четырехугольно координирован с тремя остатками гистидина и молекулой воды, TbADH содержит ион каталитического цинка, который четырехугольно координирован с четырьмя разными аминокислотными остатками, гистидином, цистеином, аспартатом и глутаматом. Соответствующие эксперименты функционального ингибирования in vitro, а также сходные им-муноаффинные эксперименты были выполнены для исследования перекрестной реакционной способности с этими ферментами, но ни связывания, ни ингибирования не наблюдалось. Моноклональное антитело против СоТСРР также было проверено на его перекрестную реакционную способность с родственными физиологическими порфиринами, такими как группа Heme в миоглобине и гемоглобине и витамине. При конкурентном ИФА и иммуноаффинном анализе перекрестной реакционной способности выявлено не было.
Карбоновая ангидраза и спиртовая дегидрогеназа имеют достаточно скрытые активные сайты, подобно этому порфириновый компонент в миоглобине и гемоглобине не открыт.
Витамин В12 содержит металл в центре планерной имидазольной структуры, но осевые лиганды могут мешать связыванию моноклонального антитела. Все вместе эти результаты подтверждают, что моноклональное антитело против СоТСРР распознает относительно открытую конфигурацию металла-имидазола без вмешательства остатков, координирующих осевой металл.
ПРИМЕР 7
Синтез [2-(2-миноэтилкарбомоил)-этоксиметил]-трис-[2-(N-(3-имидазол-1-ил-пропил))-этоксиметил]метанцинка (II) (3), ФИГ.9
(i) Синтез тетра (2-пентахлоро-феноксикарбонил-этоксиметил)метана
Синтез пентахлорофено-замещенного тетра-активного сложного эфира проводили по процедуре Хайма Вейцманна и др., JACS 1996, 118, 12368-12375.
(а) Приготовление монозамещенного три-активного эфира: тетра-активный эфир (1) (1 г, 0,69 ммоль) и BocNHCH2CH2NH2 (100 мг, 0,62 ммоль) растворили в 20 мл сухого дихлорметана. Раствор перемешивали в течение ночи, поддерживая рН ~8 с помощью триэтиламина. Раствор сконцентрировали и очистили флеш-хроматографией с CHCl3 и этилацетатом (90:10) для получения (152 мг, выход 15%). 1H ЯМР 250 МГц (CDCl3) δ: 1,4 (s, 9Н, Boc); 2,4 (t, 2Н, J=6 Hz, -CH2-CH2-CONH); 2,9 (t, 6H, 3=6 Hz, -CH2-CHrCOOPCP); 3,2 (q, 2Н, J=6 Hz, -CONH-CH2-CH2-NHBoc); 3,31 (t, 2Н, J=6 Hz, -CONH-CH2-CH2-NHBOC); 3,38 (s, 2Н, -C-CH2-O-CH2-CH2-CONH-); 3,42 (s, 6H, -C-CH2-O-CH2-CH2-COOPCP); 3,61 (t, 2Н, J=6 Hz, -C-CH2-O-CH2-CH2-CONH-); 3,78 (t, 6H, J=6 Hz, -C-CH2-O-CH2-CH2-CONH-); 5,03 (t, 1H, NH); 6,7 (t, 1H, NH).
(b) Приготовление трис(имидазола): монозамещенный триактивный эфир (150 мг, 0,11 ммоль) и 1-(3-аминопропил)-имидазол (33 мкл, 0,39 ммоль) растворили в сухом ТГФ (20 мл) и перемешивали в течение ночи при комнатной температуре. Раствор белого цвета концентрировали и очистили колоночной хроматографией, используя диоксид кремния (0,063-0,200 ммоль) с CHCl3:метанолом (50-90%) для получения (45 мг, выход 44%). *Н ЯМР 250 МГц (CDCl3/MeOD) δ: 1,45 (s, 9H, Boc); 2,0 (m, 6H, J=6 Hz, -CONH-СН2-СН2-СН2-ими); 2,4 (t, 6H, J=6 Hz, -O-CHz-CHz-CONH-); 2,5 (t, 2H, J=6 Hz, -CH2-CH2-CONH-CH2-CH2-NHBoc); 3,0 (m, 8H, J=6 Hz, -CONH-CH2-CH2-CH2-ими, -CH2-CH2-CONH-CH2-CH2-NHBoc); 3,1 (t, 2H, J=6 Hz, -CONH-CH2-CH2-NHBoc); 3,4 (b, 8H, -C-CH2-O-CH2-CH2-CONH- CH2-CH2-NHBoc, -C-CH2-O-CH2-CH2-CONH-); 3,6 (m, 8H, J=6 Hz, -C-CH2-O-CH2-CH2-CONH-, -C-CH2-O-CH2-CH2-CONH- CH2-CH2-NHBoc,); 4,0 (t, 6H, J=6 Hz, -CONH-CH2-CH2-CH2-ими); 5,5 (t, 1H, NH); 6,98 (s, 3Н, Ими); 7,06 (s, 3Н, Ими); 7,32 (t, 3Н, NH); 7,57 (s, 3Н, Ими). ESI-PC: 910.87[M+Na]+, 925.98 [M+K]+.
(c) Приготовление трис(имидазола) со свободным амином (2): Трис (имидазол) (40 мг, 0,045 ммоль) растворили в 6 мл смеси дихлорметана и трифторуксусной кислоты (2:1) и перемешивали в течение часа. Реакционную смесь концентрировали и испаряли несколько раз с четыреххлористым углеродом и сушили под высоким вакуумом для удаления трифторуксусной кислоты из смеси, чтобы получить (30 мг, выход 85%, b). 'H ЯМР 250 МГц (CDCl3/MeOD) δ: 1,9 (m, 6H, J=6 Hz, -CONH-CH2-CH2-CH2-ими); 2,3 (m, 8H, J=6 Hz, -O-CH2-CH2-CONH-, -CH2-CH2-CONH-CH2-CH2-NH2); 2,9 (t, 2H, J=6 Hz, - CONH-CH2-CH2-CH2-ими); 3,0 (t, 2H, J=14 Hz, -CONH-CH2-CH2-NH2); 3,31 (t, 2H, J-6 Hz, -CH2-CH2-CONH-CH2-CH2-NH2); 3,4 (b, 8H, -C-CH2-O-CH2-CH2-CONH-CH2-CH2-NH2, -C-CH2-O-CH2-CH2-CONH-); 3,6 (m, 8H, J=6 Hz, -C-CH2-O-CH2-CH2-CONH-, -C-CH2-O-CH2-CH2-CONH- CH2-CH2-NH2); 4,0 (t, 6H, J=6 Hz, -CONH-CH2-СН2-СН2-ими); 7,26 (s, 3Н, Ими); 7,32 (s, 3Н, Ими); 8,82 (s, 3Н, Ими).
3. Приготовление комплекса трис(имидазол)-Zn(II) (3): Соединение 2 (30 мг, 0,038 ммоль) растворили в 1 мл метанола. К нему добавили 2-3 капли 1-нормального раствора NaOH и ZnCl2 (5 мг, 0,04 ммоль) и перемешивали в течение получаса. Осадок белого увета отфильтровали для получения (12 мг, выход 37%). *Н ЯМР 250 МГц (MeOD/D2O) δ: 1,8 (m, 6H, J=6 Hz, -CONH-СН2-СН2-СН2-ими); 2,4 (m, 8H, J=6 Hz, -O-CH2-CH2-CONH-, -CH2-CH2-CONH-CH2-CH2-NH2); 3,0 (t, 2H, J=6 Hz, -CONH-CH2-CH2-СН2-ими); 3,0 (t, 2H, J=6 Hz, -CONH-CH2-CH2-NH2); 3,31 (b, 2H, -CH2-CH2-CONH-CH2-CH2-NH2); 3,4 (b, 8H, -C-CH2-O-CH2-CH2-CONH-CH2-CH2-NH2, -C-CH2-O-CH2-CH2- CONH-); 3,6 (m, 8H, -C-CH2-O-CH2-CH2-CONH-, -С-CH2-О-CH2-СН2-CONH-CH2-CH2-NH2); 4,2 (b, 6H, -CONH-СН2-СН2-СН2-ими); 7,19 (s, 3Н, Ими); 7,28 (s, 3H, Ими); 8,55(s, 3Н, Ими). ESI-PC:852.09[M+1]+.

R=O-CH2-CH2-CONH-CH2-CH2-NH2
[2-(2-миноэтилкарбомоил)-этоксиметил]-трис-[2-(N-(3-имидазол-1-ил-пропил))-этоксиметил]метан.
ПРИМЕР 8
Перекрестная реакция 6С6 с каталитическими сайтами гелатиназ
Было выявлено, что некоторое количество 6С6 совместно с активной ММП-9 очистилось от асцитной жидкости. Присутствие детектируемых количеств ММП9 в асцитной опухоли, индуцированной в мышах для размножения моноклональных антител было выявлено вестерн иимуноблоттингом и зимографией желатина (данные не показаны). Комплекс ММП9-антитело был очищен от асцитной жидкости мышей с использованием аффинной хроматографии белка G (белок G связывается с постоянным доменом антитела, давая переменному домену свободу взаимодействия с антигеном). Как показано на ФИГ.11А, совместно очищенная ММП9 была выявлена вестерн иммуноблоттингом очищенного комплекса 6С6-ММП9 с использованием имеющегося в продаже антитела против ММП9. Был определен диапазон с молекулярной массой ~82 а.е.м., соответствующий активной ММП9 без продомена. Этот диапазон не был обнаружен в нерелевантном контроле моноклонального тела мыши, который был очищен и проанализирован таким же способом. Эти результаты показали, что 6С6 сформировал специфический комплекс in vivo с эндогенной активной ММП-9 мыши.
Для дальнейшей проверки на связывание с активной формой высоко гомологичного фермента ММП2 аналогичные эксперименты по иммунопреципитации были выполнены in vitro. 6C6 инкубировали с очищенным фрагментом ММП2 в молярном отношении 3:1. Анализ SDS-PAGE иммунопреципитатов сефарозы белка А выявил образование специфического комплекса 6С6 с активным каталитическим фрагментом ММП2 (ФИГ.11В). Только гранулы белка А не могли привести к иммунопреципитации ММП2. Далее, было проверено связывание с неактивными зимогенными (латентными) формами ММП2 и 9. Поскольку все ММП были произведены как неактивные зимогены, они имеют пропептиды N-конца приблизительно 80-90 аминокислоты, которые блокируют активные сайты [Боде, В. и К. Маскос, Biol Chem, 2003. 384(6): p.863-72] (ФИГ.11D). Эксперименты по иммунопреципитации про-ММП2 и 9 были выполнены таким же образом. Что важно, антитело не связывалось с латентным ферментом (ФИГ.11С). Антитело 6С6 связывалось только с активной конформацией фермента, в которой комплекс белка и цинка в активном сайте открыт раствору.
Эти результаты подтвердили, что антитело 6С6 полученной и проанализированное относительно бионеорганического гаптена, имитирующего активный сайт, перекрестно реагировало с активными сайтами белка ММП2 и 9. Очевидно, что гаптен треугольника цинка способен имитировать трехмерную структуру соответствующего эпитопа цинка-гистидина в нативном белке. Стоит отметить, что распознание этого минимального структурного эпитопа металла-белка достаточно для выявления способности к перекрестной реакции с нативным ферментом. Связывание только с активированными ферментами, но не с их латентной формой, в которой продомен блокировал доступ к белковому эпитопу каталитического цинка (ФИГ.11D), показали прямое взаимодействие 6С6 с сайтом каталитического цинка. Нативный ММП-9, связанный in vivo с 6С6 продемонстрировал, что это антитело может образовывать специфический комплекс с этим ферментом в комплексной белковой среде.
Отличие активированных видов ферментов от латентной формы является уникальным и ценным функциональным свойством 6С6. Эта активность уникальна для 6С6 в противоположность другим антителам против ММП9. Это происходит потому, что иммунизация белками обычно дает эпитопы, направленные к поверхностным петлям, тогда как каталитические аминокислоты главным образом скрыты внутри расщелины на поверхности фермента. Эта часть молекулы считается как имеющая низкую иммуногенность. Следовательно, нейтрализация моноклональных антител, полученных традиционными способами (относительно нативных белков или фрагментов белков) обычно взаимодействует с областями, смежными с активным сайтом, а не с каталитическими остатками активного сайта, и ингибирует по механизму стерического препятствия. Такте антитела обычно связываются с неактивным прекурсором, а также с активной формой. Данный подход к иммунизации имитирующего активный сайт гаптена может позволить производить антитела, которые распознают белковые остатки каталитического металла в ММП, что не может быть достигнуто традиционными подходами к иммунизации белков.
ПРИМЕР 9
6С6 селективно ингибирует гелатиназы in vitro и in situ
Для определения способности 6С6 ингибировать ферменты в отношении ММП9 и ММП2 были выполнены анализы ингибирования с использованием небольших флуорогенных пептидных субстратов (7 аминокислот), которые охватывают углубление гелатиназ в активном сайте. Начальные скорости реакций измерили для нескольких концентраций моноклонального антитела. 6С6 ингибировало каталитическую активность обоих ферментов (ФИГ.12А-В). Конкурентный механизм ингибирования определили путем анализа активности ММП9 в присутствии различных концентраций ингибирующего антитела как функцию концентрации субстрата. Данные, показанные на ФИГ.12А в форме двойного обратного графика Линвивера-Берка, демонстрируют профиль конкурентного ингибирования. Была получена подгонка данных ингибирования к уравнению конкурентных систем ингибирования, Ki 1±0,1 мкмоль и 1,4±0,16 мкмоль для ММП9 и 2, соответственно. Также определили, что 6С6 не расщеплялся ММП-9 после инкубации в течение ночи с ММП-9 в высокой концентрации (30 мкмоль), демонстрируя, что наблюдавшееся ингибирование ММП9 антителом 6С6 происходило не из-за расщепления конкурентного субстрата. Кинетический анализ ММП9 был взят как представительный механизм ингибирования антителом 6С6, так как он, по замыслу, должен распознавать тот же эпитоп в разных ММП. Ингибирующее действие было одинаковым для видов каталитических фрагментов ММП2 и 9, а также для форм ферментов полной длины гелатиназ. Более конкретно, каталитические фрагменты рекомбинантных ММП9 и ММП2, содержащие каталитический домен, а также домен фибронектина, но не домен гемопексина, а также рекомбинантное минимальное каталитическое звено ММП9, содержащее только каталитический домен и не содержащее домены фибронектина и гемопексина, были ингибированы сходным образом по всей длине (активированной р-аминофенилртутьацетатом (АРМА)) гелатиназ, очищенных от сред клеток HeLa S3, инфицированных рекомбинантным вирусом коровьей оспы, кодирующим кДНК полной длины человеческих про-ММП2 и 9, как сказано выше [Ольсон, М.У. и др., J Biol Chem, 2000. 275(4): p.2661-8]. Эти результаты подтвердили, что ингибирование опосредовано прямым взаимодействием с каталитическим доменом и не зависит от взаимодействия с доменами гемопексина или фибронектина. Профиль конкурентного ингибирования предоставил дальнейшее указание на прямое взаимодействие с сайтом каталитического цинка. Нерелевантное моноклональное антитело, приготовленное сходным образом, не мешало фотолитической активности фермента.
Так, наблюдавшееся ингибирование не происходило из-за микроколичеств совместно очищенных загрязнителей. Антитела для этих экспериментов были очищены от культуры ткани и не содержали детектируемые количества активной ММП9 в доле очищенного антитела.
Для изучения селективности 6С6 ее реакционную способность проверили в отношении различных подгрупп матриксных металлопротеиназ, включая матрилизин (ММП7), ММП мембранного типа (МТ1-ММП) и родственный дисинтегрин (ADAM) фермент преобразующий α-фактор некроза опухоли (ТАСЕ). Структуры ядер этих ферментов в высокой степени сходны, изменяясь главным образом в периферийных петлях. Более конкретно, клеточный каркас цинка-гистидина хорошо консервативен, показывая типичную спираль, за которой следует петля, которая служит в качестве клеточного каркаса для трех гистидинных остатков, которые координируют ион каталитического цинка (ФИГ.13).
Подобные анализы ингибирования были выполнены с подходящими флуорогенными пептидными субстратами. Интересно, что ни ММП-7, ни ТАСЕ не были ингибированы в любой измеримой степени после инкубации с 6С6 в концентрациях до 30 мкмоль, указывая на значительный уровень селективности в отношении гелатиназ. МТ1-ММП была ингибирована 6С6, в меньшей степени, с Ki 14,4±0,75 мкмоль. Интересно, что источник этой селективности нельзя объяснить на базе только конструкции антитела для распознания консервативного клеточного каркаса цинка-гистидина, поскольку структуры ядер, особенно в активном сайте, в высокой степени сходны. Изменения в последовательностях, главным образом в периферийных петлях, диктуют различия в степени открытости фрагмента цинка-гистидина, в форме активного сайта, и электростатика его поверхности может отвечать за эту селективную модель ингибирования.
6С6 также проверили на перекрестную реакционную способность с различными, зависящими от цинка металлопротеазами, карбоновой ангидразой и спиртовой дегидрогеназой. Аналогично ММП, карбоновая ангидраза (КА) имеет ион каталитического цинка, четырехугольно координированный с тремя лигандами гистидина и молекулой воды. Следовательно, несколько мощных ингибиторов небольшой молекулы ММП (типа сульфонированного гидроксамата аминокислоты) действуют также как эффективные ингибиторы КА и наоборот. Некоторые JV-гидроксисульфонамиды, изученные ранее как ингибиторы КА, также проявляют ингибирующие свойства к ММП [Скоццафава, А. и К.Т. Супуран, J Med Chem, 2000. 43(20): p.3677-87]. Активный сайт спиртовой дегидрогеназы от термофильных бактерий (TbADH) включает другой компонент цинка-белка, в котором цинк связан с гистидином, цистеином, аспартатом и глутаматом, расположенными в расщелине. Соответствующие эксперименты по функциональному ингибированию в присутствии антитела в концентрации до 30 мкмоль не показали ингибирующего действия в отношении обоих ферментов. Стоит отметить, что активный сайт КА, расположенный в центральной области 10-нитевого, перекрученного р-листа, состоит из расщелины конусной формы глубиной 15 ангстрем с четырехугольным ионом Zn2+ на дне расщелины. В отличие от ингибиторов малых молекул, ион цинка должен быть слишком глубоко скрыт для взаимодействия с антителом. Важно, что эти эксперименты далее демонстрируют селективный ингибирующий профиль 6С6.
В клеточной среде ингибирующее действие 6С6 в отношении гелатиназ было проверено зимографией in situ с использованием природного субстрата гелатиназ - желатина.
Клетки человеческой фибросаркомы, НТ1080, выращенные мембране, экспрессирующей культуру, связанные с МТ1-ММП и секретирующие ММП-2 и 9 [Джиамбернарди, Т.А. и др., Matrix Biol, 1998. 16(8): p.483-96] были наложены на желатин, сопряженный с флуоресцеином (DQ-желатин). Как показано на ФИГ.14А-С, необработанные клетки НТ1080 проявляли значительную желатинолитическую активность на поверхности клеток. Обработка моноклональным антителом в количестве 5 мкмоль значительно уменьшила поверхностную желатинолитическую активность, аналогично ингибированию, наблюдавшемуся у ингибитора гелатиназы на основе механизма, SB-3СТ. SB-3CT имеет аналогичный ингибирующий профиль, так как он ингибирует и гелатиназы, и МТ1-ММП (значения Ki - 28, 400, и 110 нм для ММП2, ММП9 и МТ1-ММП, соответственно).
Вкратце, 6С6 ингибировало и расщелину синтетического пептида in vitro, и природный макромолекулярный субстрат in situ. 6C6 показало конкурентный режим ингибирования в отношении ММП9, аналогично механизму ингибирования ТИМП. Конкурентный ингибирующий профиль является дальнейшим указанием прямого взаимодействия с компонентом каталитического цинка. Важно, что 6C6 показало селективный ингибирующий профиль в отношении гелатиназ. Источник этой селективности нельзя объяснить нацеленностью антитела на консервативный фрагмент цинка-гистидина. Эти результаты предполагают, что это антитело взаимодействует с дополнительными детерминантами на поверхности фермента, которые отвечают за наблюдавшуюся специфичность.
ПРИМЕР 10
Воздействие обработки моноклинальным антителом 6C6 на DSS-индуцированный колит у мышей
Растет количество доказательств того, что ММП вовлечены в ремоделирование и деструкцию тканей, связанные с несколькими воспалительными состояниями, включая воспалительное заболевание кишечника (ВЗК) [Баф, М.Д. и др., Gastroenterology, 1999. 117(4): р. 814-22; Хойшкель, Р.Б. и др., Gut, 2000. 47(1): р.57-62; Фон Лямпе, Б. и др., Gut, 2000. 47(1): р.63-73; Киркегаард, Т. и др., Gut, 2004. 53(5): р.701-9].
Поэтому авторы настоящего изобретения исследовали игибирующее действие 6C6 против гелатиназы in vivo на мышах с экспериментальной моделью воспалительного заболевания кишечника.
Для исследования ингибирующей активности 6C6 была изучена способность обработки моноклональным антителом улучшать состояние DSS-индуцированного острого колита. Конкретно, 2% DSS были введены высоко восприимчивому штамму мышей C57BL/6 на пять дней. Лечение с помощью 6C6 проводили ежедневно путем внутри-брюшинных инъекций в дозе 1,5 или 5 мг/мышь, начиная с дня индуцирования. У мышей, подвергнутых индуцированию 2% DSS, развились симптомы острого колита с диареей, ректальным кровотечением и серьезной потерей веса.
Влияние лечения моноклональным антителом на контролируемый ежедневно индекс активности заболевания (DAI) (объединенная оценка массы тела, кровотечения и консистенции стула) показано на ФИГ.15А. У мышей, получавших моноклональное антитело, активность заболевания была меньше чем у контрольной группы (значаще с дня 6). Дополнительным макроскопическим проявлением DSS-индуцированного колита является сокращение длины толстой кишки (ФИГ.15В). Так, 30% сокращение длины толстой кишки было обнаружено у необработанных мышей по сравнению с животными, ранее не использованными в экспериментах, через 11 дней после введения DSS. Напротив, только среднее сокращение на 22% или 16% было получено у мышей, получавших 6С6 в дозах 1,5 и 5 мг/мышь, соответственно. Защитные эффекты 6С6 также были также подтверждены коэффициентом смертности от заболевания. Коэффициент смертности 60% был выявлен у необработанных мышей через 11 дней после индуцирования, тогда как коэффициент смертности только 33% наблюдали у мышей, получавших 6С6 (ФИГ.15С). Так, лечение мышей C57BL/6 антителом 6С6 привело к повышению коэффициента выживаемости в дополнение к уменьшенным проявлениям DSS-индуцированного колита.
В общем, эти результаты продемонстрировали терапевтический потенциал 6С6 как ингибитора гелатиназы.
ПРИМЕР 11
Определение характеристик комплекса ММП9-6С6 рентгеновской абсорбционной спектроскопией
Для дальнейшего исследования различий между активной ММП9 и ингибированным комплексом ММП9-6С6 была выполнена рентгеновская абсорбционная спектроскопия. На ФИГ.16 показаны собранные данные по флуоресценции. Эти данные представлены в форме спектров преобразования Фурье для представления радиального распределения различных атомов в первой и второй координационных оболочках иона каталитического цинка в ММП9. Явное изменение в спектрах радиального распределения для свободного и ингибированного фермента можно наблюдать выше уровня шума. Эти спектральные изменения указывают, что локальная среда иона каталитического цинка претерпевает структурные изменения после связывания с 6С6. Наблюдавшееся отклонение в пространственном распределении и интенсивностях пиков спектральных признаков преобразования Фурье между активным и ингибированным ферментом недвусмысленно указывает, что локальная структура иона каталитического цинка изменяется после формирования комплекса антитела.
Понятно, что определенные признаки изобретения, которые для ясности описаны в контексте отдельных вариантов осуществления, могут также быть представлены в сочетании в одном варианте осуществления. И наоборот, различные признаки изобретения, которые для краткости описаны в контексте одного варианта осуществления, могут быть представлены по отдельности или в любом подходящем сочетании.
Хотя изобретение описано в связи с его конкретными вариантами осуществления, очевидно, что специалистам в данном области будут очевидны многие альтернативы, модификации и изменения. Соответственно, предполагается охватить все такие альтернативы, модификации и изменения, которые подпадают под смысл и широкий объем прилагаемой формулы изобретения. Все публикации, патенты и патентные заявки, упомянутые в данном описании, включены в него в полном объеме путем ссылки в том же объеме, как если бы каждая отдельная публикация, патент или патентная заявка была конкретно и индивидуально указана как включенная в настоящий документ путем ссылки. Дополнительно, цитирование или идентификация любой ссылки в настоящей заявке не должно истолковываться как допущение, что такая ссылка является уровнем техники по отношению к настоящему изобретению.
СПРАВОЧНЫЕ МАТЕРИАЛЫ (дополнительные материалы указаны в тексте)
1. Nagase, Н. и Woessner, J.F.Jr. (1999). Matrix metalloproteinases. Minireview. J. Biol. Chem. 274:21491-21494.
2. Bode, W., Fernandez-Catalan, C, Nagase, Н., and Maskos, K. (1999). Endoproteinase-protein inhibitor interactions. APMIS 107, 3-10.
3. Bode, W., Fernandez-Catalan, C, Tschesche, Н., Grams, F., Nagase, Н., and Maskos, K. (1999). Structural properties of matrix metalloproteinases. Cell. Mol. Life. Sci. 55, 639-652.
4. Borkakoti, N. (1998). Matrix metalloproteinases: variations on a theme. Prog. Biophys. Mol. Biol. 70, 73-94.
5. Brown, S., Bernardo, M.M., Li, Z.H., Kotra, L.P., Tanaka, Y., Fridman, R., and Mobashery, S. (2000). Potent и Selective Mechanism-Based Inhibition of Gelatinases. J. Am. Chem. Soc, 122, 6799-6800.
6. Fridman, R., Fuerst, Т.K., Bird, R.E., Hoyhtya, M., Oelkuct, M., Kraus, S., Komarek, D., Liotta, L.A., Berman, M.L., и Stetler-Stevenson, W.G. (1992). Domain structure of human 72-kDa гелатиназа/type IV collagenase. Characterization of proteolytic activity and identification of the tissue inhibitor of metalloproteinase-2 (TIMP-2) binding regions. J Biol. Chem. 267, 15398-405.
7. Gogly, В., Groult, N., Hornebeck, W., Godeau, G., и Pellat, B. (1998). Collagen Zymography as a Sensitive and Specific Technique for the Determination of Subpicogram Levels of Interstitial Collagenase. Anal. Biochem. 255, 211-216.
8. Gomez, D.E., Alonso, D.F., Yoshiji, Н., and Thorgeirsson, U.P. (1997). Tissue inhibitors of metalloproteinases: structure, regulation and biological functions. Eur. J. Cell. Biol. 74, 111-122.
9. Henriet, P., Blavier, L., и Declerck, Y.A. (1999). Tissue inhibitors of metalloproteinases (ТИМП) in invasion and proliferation. APMIS 107, 111-119.
10. Kleifeld, O., Kotra, L.P., Gervasi, D.C., Brown, S., Bernardo, M.M., Fridman, R., Mobashery, S., and Sagi, I. (2001). X-ray Absorption Studies of Human Matrix Metallo-proteinase-2 (MMP-2) Bound to a Highly Selective Mechanism-based Inhibitor. Comparison with the latent and active forms of the enzyme. J. Biol. Chem. 276, 17125-17131.
11. Korkhin, Y., Kalb (Gilboa), A.J., Peretz, M., Bogin, O., Burstein, Y., and Frolow, F. (1998). NADP-dependent Bacterial Alcohol Dehydrogenases: Crystal Structure, Co-factor-binding and Cofactor Specificity of the ADHs of Clostridium beijerinckii и Thermoanaerobacter brockii. J. Mol. Biol. 278, 967-981.
12. Morgunova, E., Tuuttila, A., Bergmann, U., Isupov, M., Lindqvist, Y., Schneider, G., and Tryggvason, K. (1999). Structure of Human Pro-Matrix Metalloproteinase-2: Activation Mechanism Revealed. Science 284, 1667-1670.
13. Bode, W., Femandez-Catalan, С, Tschesche, H., Grams, F., Nagase, H., and Maskos, K. (1999). Structural properties of matrix metalloproteinases. Cell. Mol. Life. Sci. 55, 639-652.
14. Netzel-Arnett, S., Mallya, S.K., Nagase, H., Birkedal-Hansen, H., and Van Wart, H.E. (1991). Continuously recording fluorescent assays optimized for five human matrix metalloproteinases. Anal. Biochem. 195, 86-92.
15. Rehr, J.J., Mustre de leon, J., Zabinsky, S.I., and Albers, R.C. (1991). J. Am. Chem. Soc. USA 113, 5135-5138.
16. Reponen, P., Sahlberg, C, Huhtala, P., Hurskainen, Т., Theslef F, L, and Tryggvason, K. (1992). Molecular cloning of murine 72-kDa type IV collagenase and its expression during mouse development. J. Biol. Chem. 267, 7856-7862.
17. Stem, E.A., Newville, M., Ravel, В., Yacoby, Y., and Haskel, D. (1995). The UWXAFS analysis package: philosophy и details. Physica В 208/209, 117-122.
18. Van Wart, H., and Birkedal-Hansen, H. (1990). The Cisteine Switch: A Principle of Regulation of Activity with Potential Applicability to the Entire Matrix Metalloproteinase Gene Family. Proc. Natl. Acad. Sci. USA 87, 5578-5582.
19. Will, H., Atkinson, SJ, Butler, G.S., Smith, В., and Murphy G. (1996). The soluble catalytic domain of membrane type 1 matrix metalloproteinase cleaves the pro-peptide of progelatinase A and initiates autoproteolytic activation. J. Biol. Chem. 271, 17119-17123.
20. Zabinsky, S.I., Rehr, J.J., Ankudinov, A., Albers, R.C., and Eller, M. J. (1995). Multiple-scattering calculations of x-ray-absorption spectra. Phys. Rev. В 52, 2995-3009.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРИМЕНЕНИЕ СЛИТОГО КОНСТРУКТА ТИМП-ГФИ И СПОСОБ ЛЕЧЕНИЯ ПОВРЕЖДЕНИЙ КОЖИ ДЛЯ ПРЕДОТВРАЩЕНИЯ ИЛИ ИНГИБИРОВАНИЯ ОБРАЗОВАНИЯ РУБЦА | 2006 |
|
RU2428479C2 |
| СПОСОБЫ ИНГИБИРОВАНИЯ АНГИОГЕНЕЗА И РОСТА ОПУХОЛЕЙ | 2001 |
|
RU2269339C2 |
| КОНЪЮГАТЫ АНТИТЕЛА С ЛЕКАРСТВЕННЫМ СРЕДСТВОМ | 2014 |
|
RU2669812C2 |
| АНТИТЕЛА, СВЯЗЫВАЮЩИЕСЯ С ЛИЗИЛОКСИДАЗОПОДОБНЫМ ФЕРМЕНТОМ-2 (LOXL2), И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2011 |
|
RU2549684C2 |
| ПРОИЗВОДНЫЕ ОПИОРФИННОГО ПЕПТИДА КАК ПОТЕНЦИАЛЬНЫЕ ИНГИБИТОРЫ ЭКТОПЕПТИДАЗ, УЧАСТВУЮЩИХ В ДЕГРАДАЦИИ ЭНКЕФАЛИНОВ | 2009 |
|
RU2542365C2 |
| СПОСОБЫ И ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ ДЛЯ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ, СВЯЗАННЫХ С ТУБУЛИН КАРБОКСИПЕПТИДАЗАМИ (TCP) | 2018 |
|
RU2812207C2 |
| СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ ЛЕЧЕНИЯ ФИБРОЗНЫХ ЗАБОЛЕВАНИЙ ЛЕГКИХ | 2010 |
|
RU2561672C2 |
| СПОСОБЫ И ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ ДЛЯ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ, СВЯЗАННЫХ С ТУБУЛИН КАРБОКСИПЕПТИДАЗАМИ (TCP) | 2018 |
|
RU2797200C1 |
| ПРОЛЕКАРСТВО, СОДЕРЖАЩЕЕ САМОРАСЩЕПЛЯЕМЫЙ ЛИНКЕР | 2014 |
|
RU2676324C2 |
| АНТИТЕЛА ПРОТИВ TENB2, СКОНСТРУИРОВАННЫЕ С ЦИСТЕИНОМ, И КОНЪЮГАТЫ АНТИТЕЛО - ЛЕКАРСТВЕННОЕ СРЕДСТВО | 2008 |
|
RU2505544C2 |
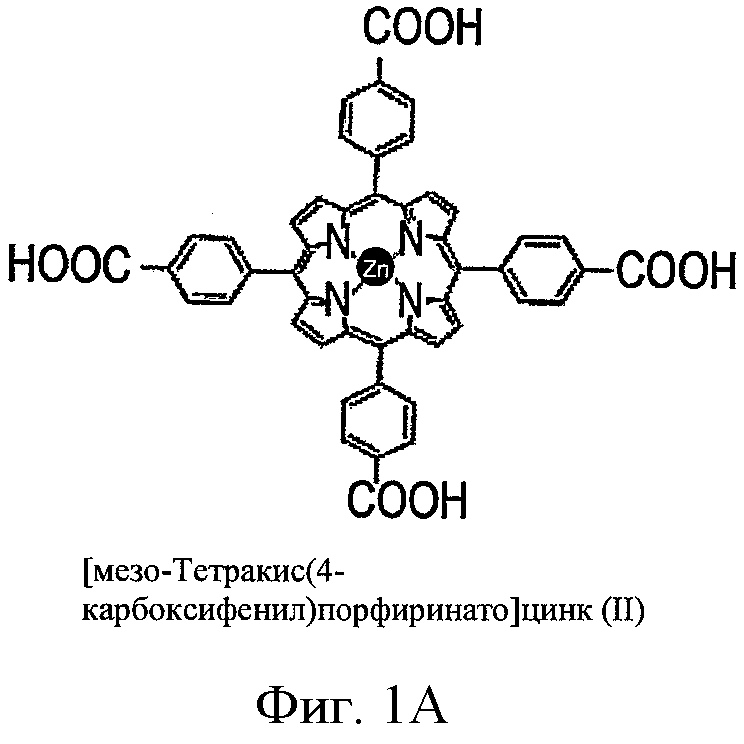
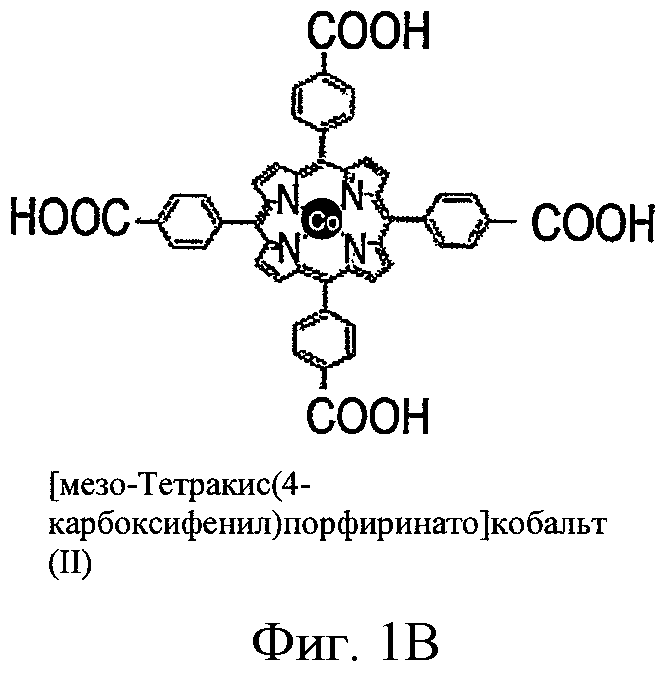
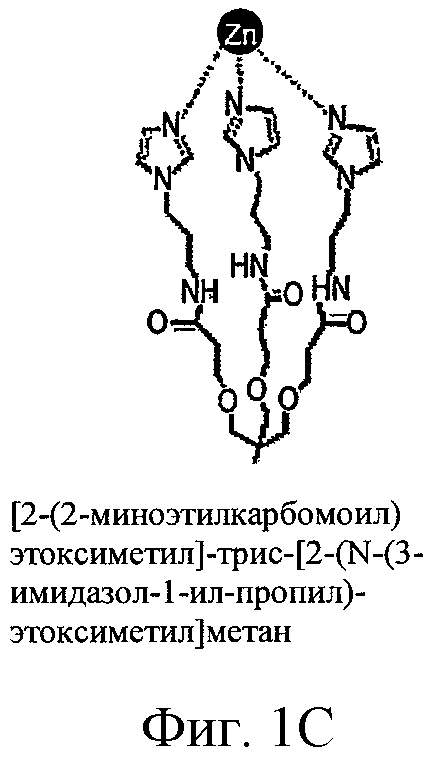
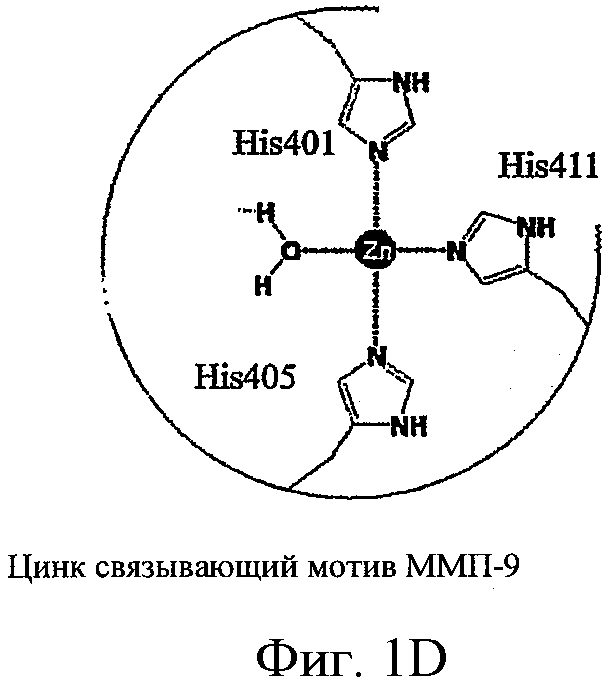
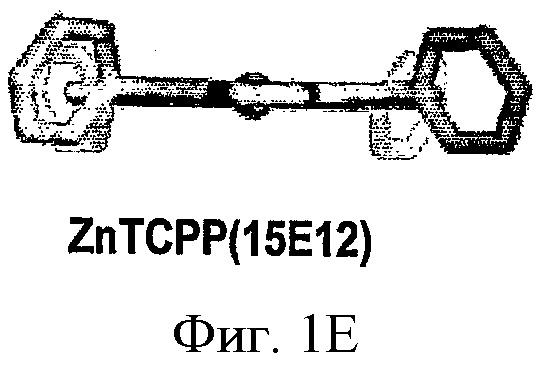
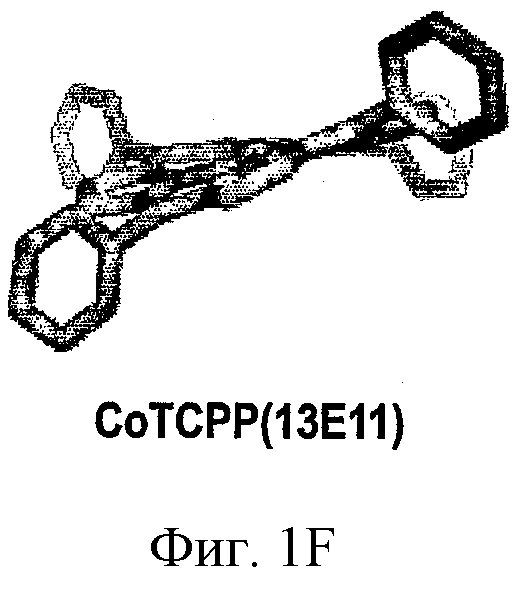
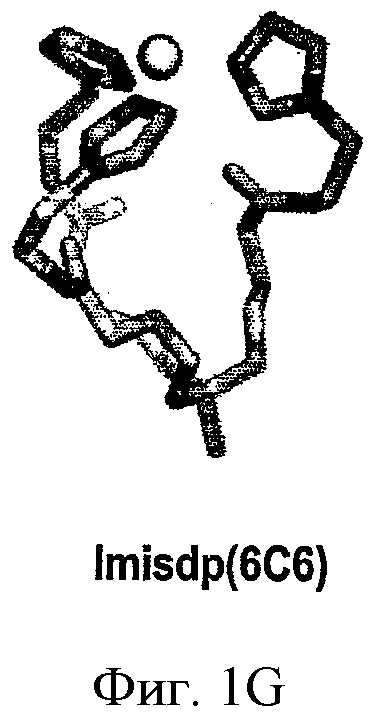
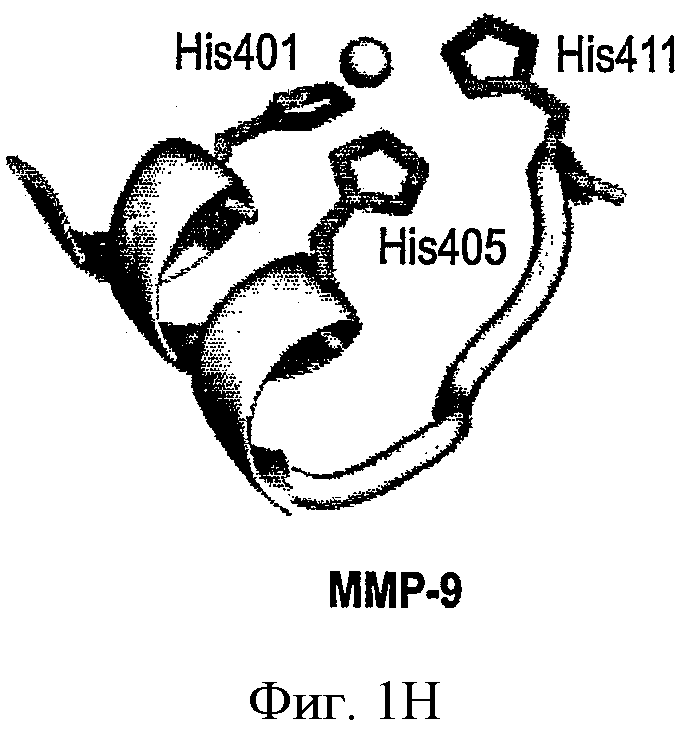
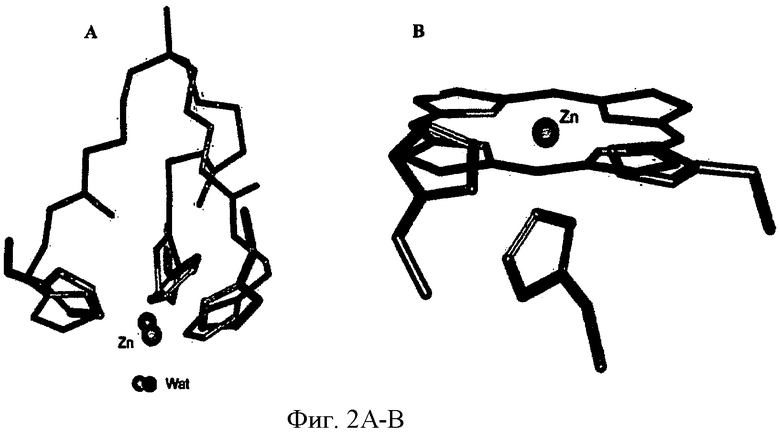
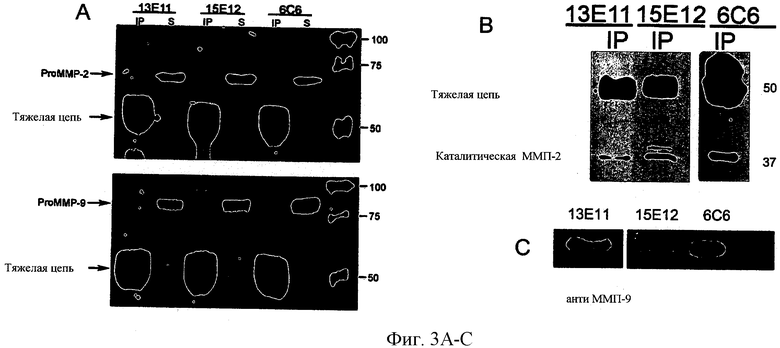
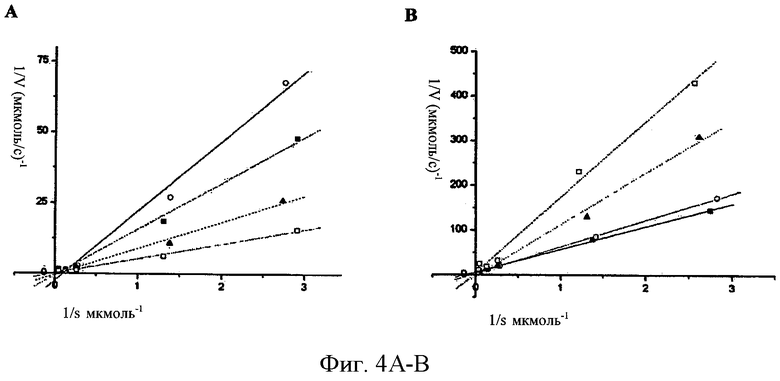
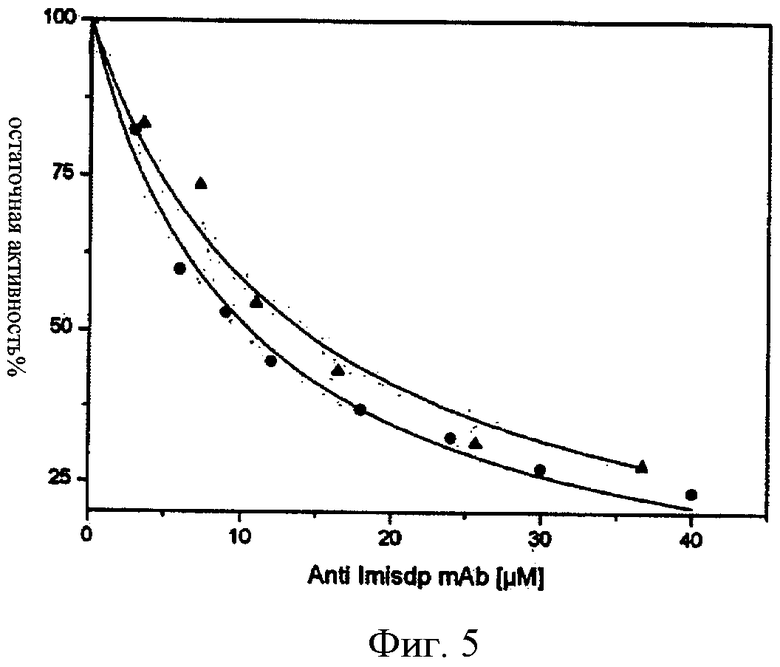
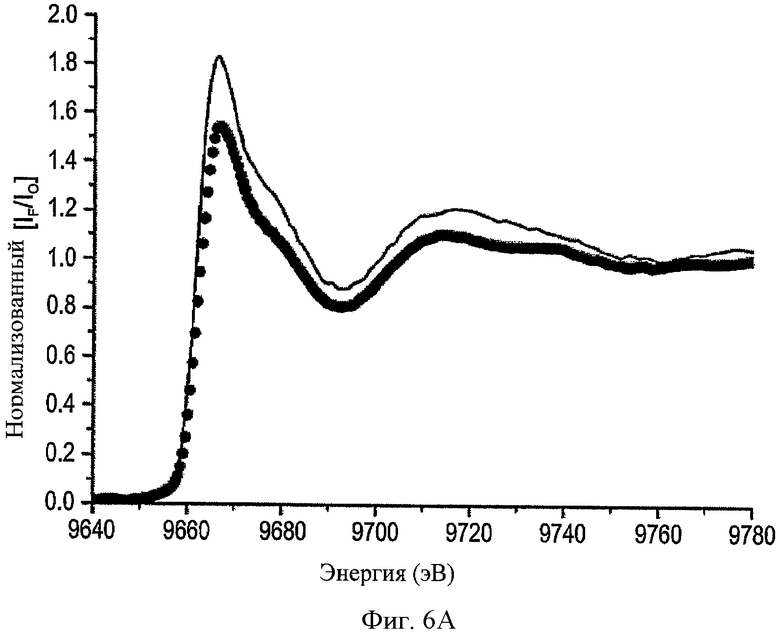
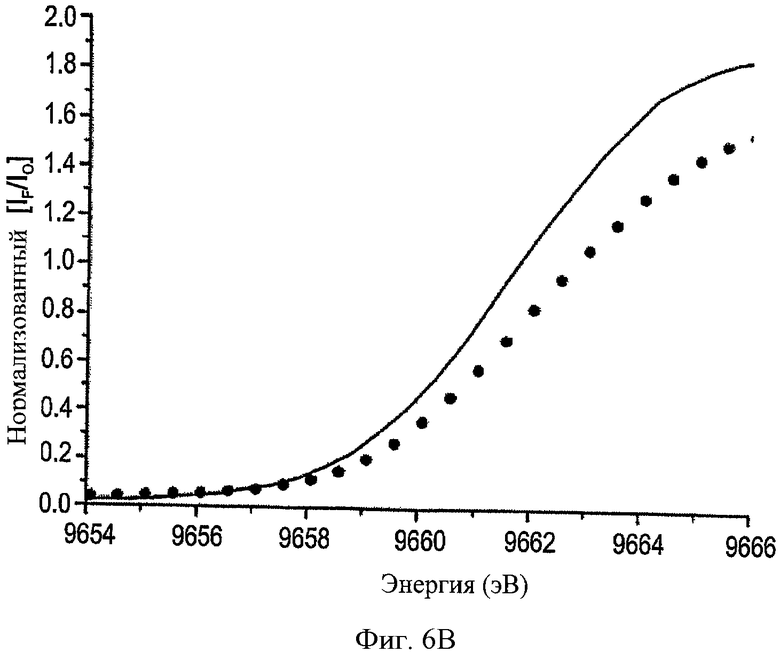
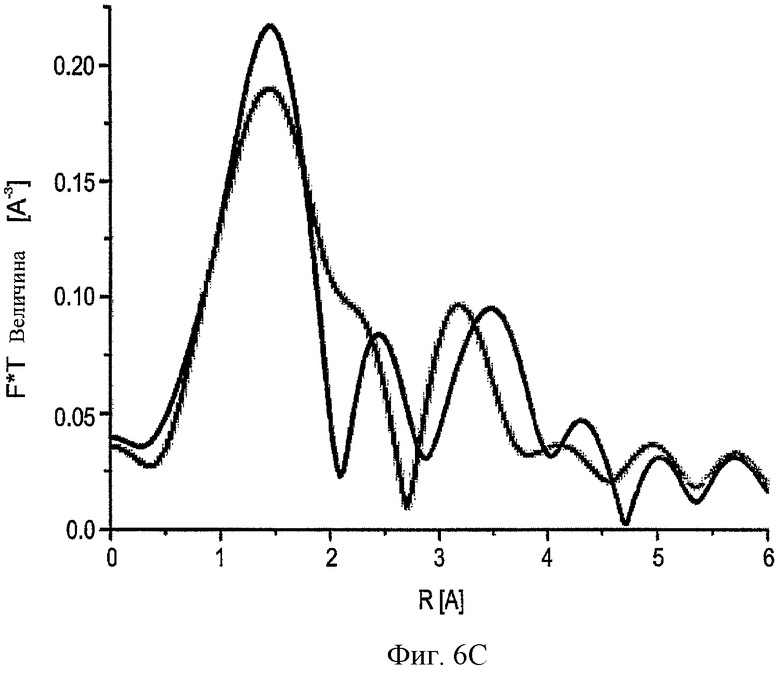

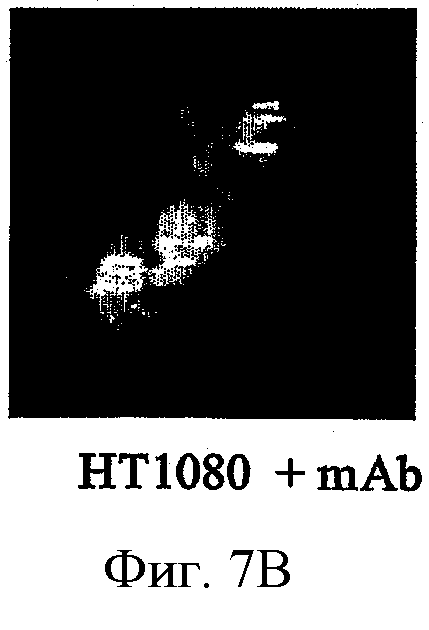
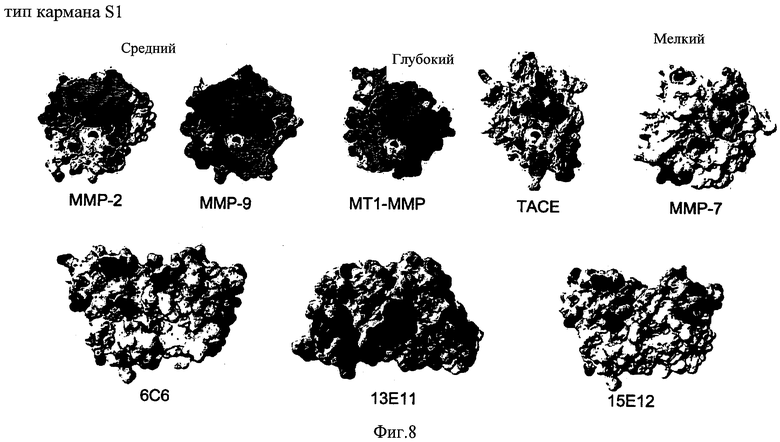
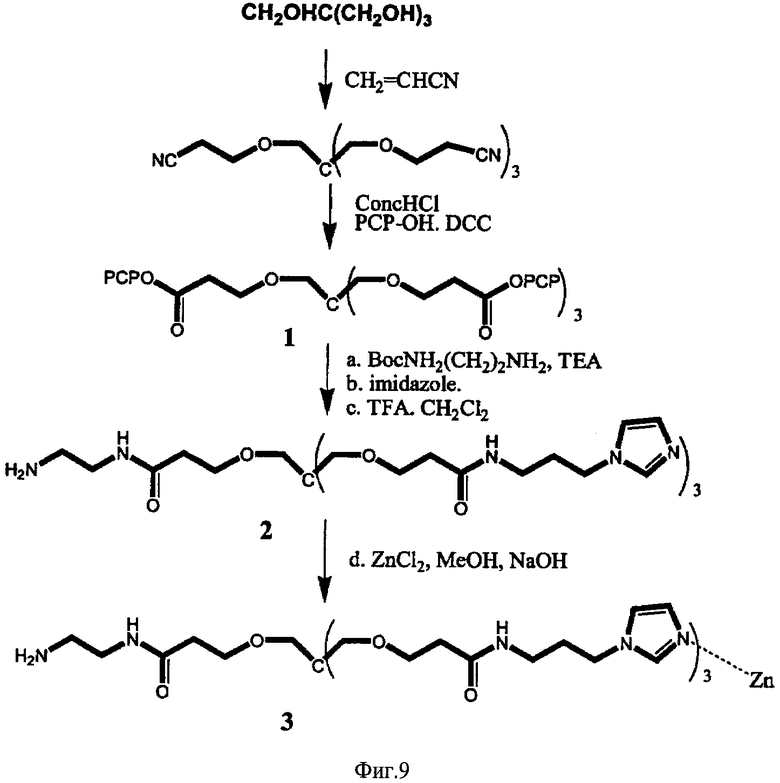

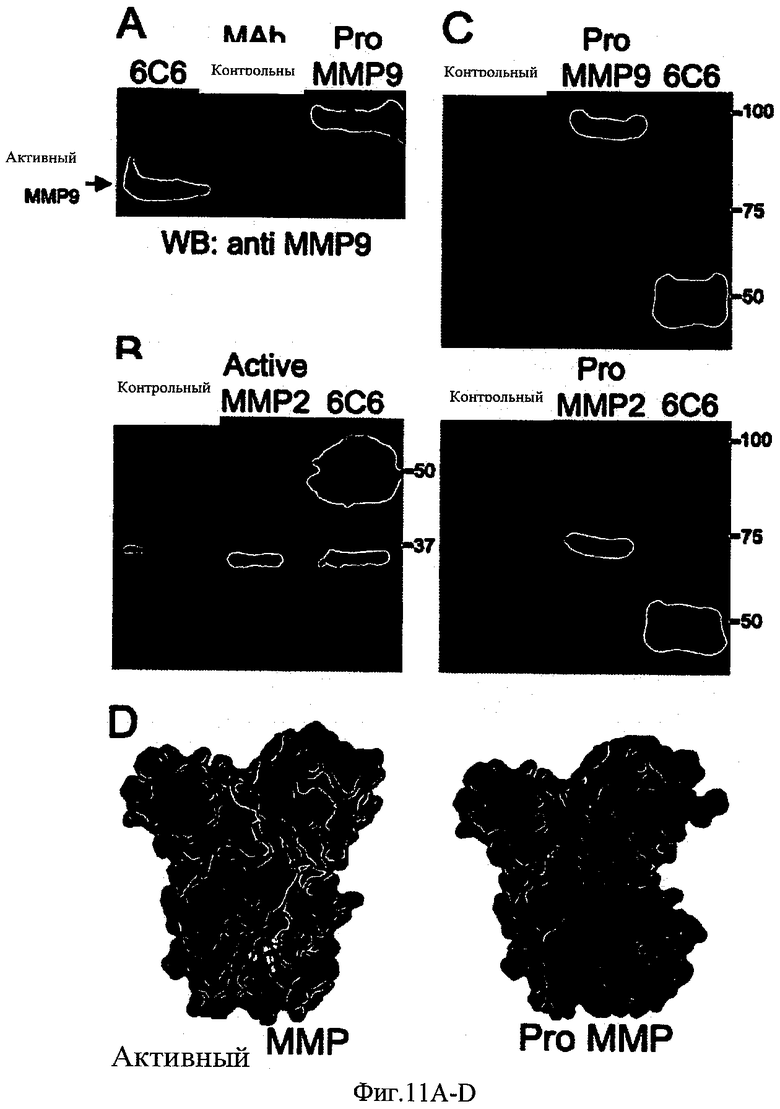
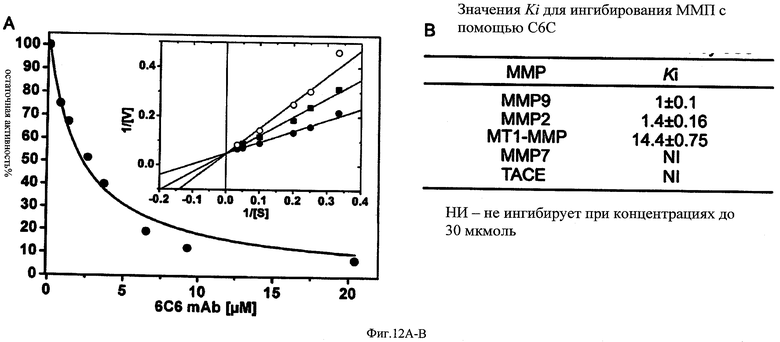
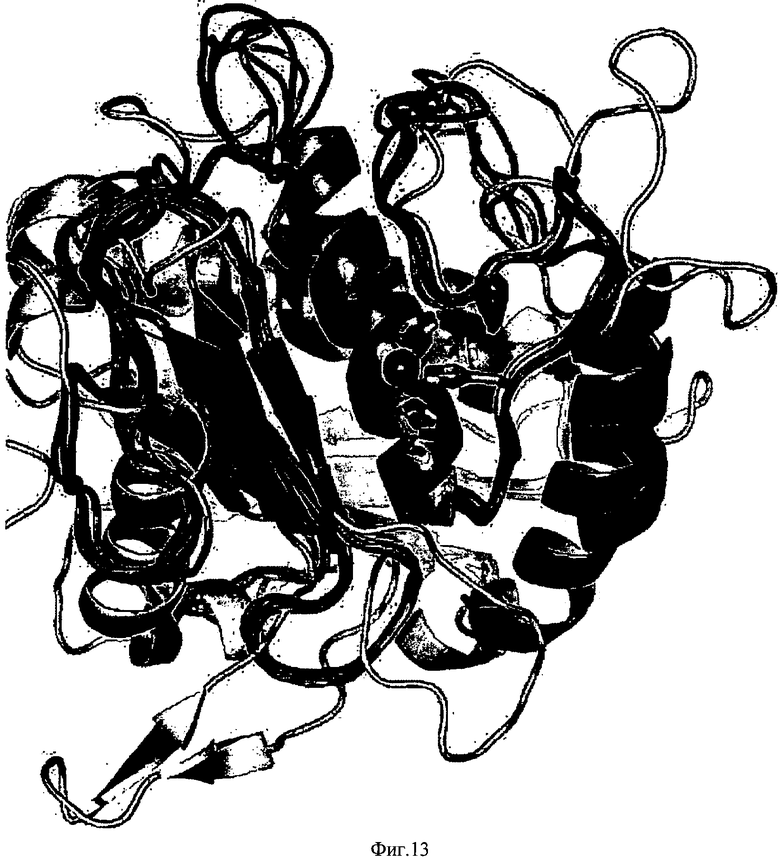

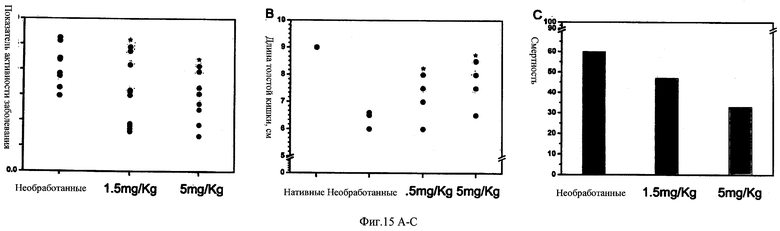
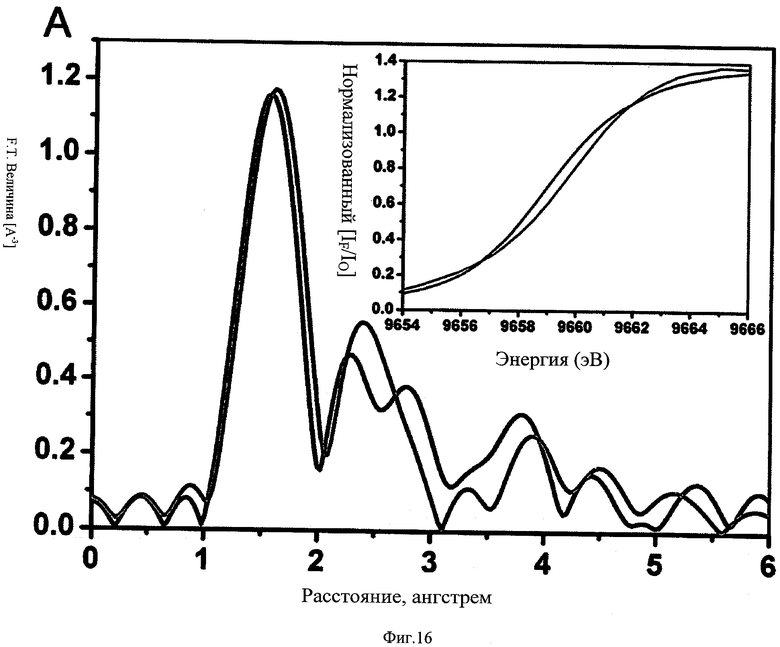
Настоящее изобретение относится к соединению, имеющему общую формулу (I):
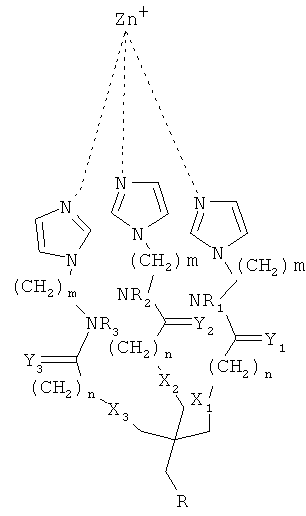
где m и n являются независимо целыми числами от 1 до 6; каждый из X1-X3 и Y1-Y3 является О; R1-R3 каждый независимо выбирают из группы, состоящей из водорода или алкила; и R является O-(CH2)x-C(=O)NR'-(CH2)y-NHR', причем: x и y каждый являются независимо целыми числами от 1 до 6; и R' выбирают из группы, состоящей из водорода и алкила. Также предложены антитело, содержащее область распознавания антигена, использование соединения, фармацевтическая композиция, применение антитела, способ ингибирования активности ММП-2 или ММП-9 в пробе и композиция для определения ММП-2 или ММП-9. Изобретение позволяет получить соединения, способные ингибировать активность ММП-2 и ММП-9. 7 н. и 4 з.п. ф-лы, 16 ил., 4 табл., 11 пр.
1. Соединение, имеющее общую формулу (I):
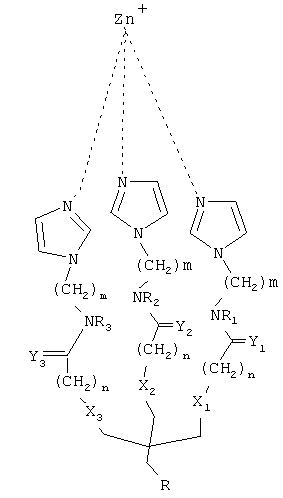
где m и n являются независимо целыми числами от 1 до 6;
каждый из X1-X3 и Y1-Y3 является О;
R1-R3 каждый независимо выбирают из группы, состоящей из водорода или алкила; и
R является O-(CH2)x-C(=O)NR'-(CH2)y-NHR',
причем x и y каждый являются независимо целыми числами от 1 до 6; и
R' выбирают из группы, состоящей из водорода и алкила.
2. Соединение по п.1, имеющее формулу (II):
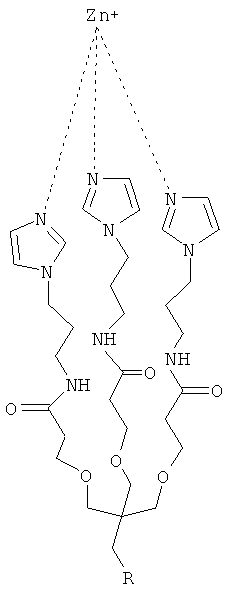
где R=O-CH2-C(=O)NH-CH2-CH2-NH2.
3. Антитело, содержащее область распознавания антигена, способную специфически связывать соединение по п.1 или 2 и получаемое с использованием соединения по п.2, причем соединение способно ингибировать активность ММП-2 и ММП-9 с константой ингибирования Ki менее 5 мкМ.
4. Антитело по п.3, которое содержит аминокислотные последовательности гипервариабельных областей, указанные в SEQ ID NO:7, 8, 9, 10, 11 и 12.
5. Использование соединения по п.1 или 2 для получения антитела, которое распознает ММП-2 и ММП-9.
6. Фармацевтическая композиция, содержащая терапевтическое количество антитела по п.3 или 4 и фармацевтически приемлемый носитель для лечения заболевания, связанной с несбалансированной и аномальной активностью ММП-2 или ММП-9.
7. Применение антитела по п.3 или 4 для приготовления медикамента для лечения заболевания, связанного с несбалансированной или аномальной активностью металлопротеинов.
8. Применение по п.7, где заболеванием является воспалительное заболевание кишечника.
9. Способ ингибирования активности ММП-2 или ММП-9 в пробе, причем способ включает контакт клетки in vitro с любым одним из антител по п.3 или 4, этим ингибируя активность матриксной активности ММП-2 или ММП-9 в пробе.
10. Антитела по п.3 или 4, прикрепленные к твердой подложке.
11. Композиция для определения ММП-2 или ММП-9, содержащая эффективное количество антитела по п.3 и буферный раствор.
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| СПОСОБ ПОЛУЧЕНИЯ МЕТАЛЛСОДЕРЖАЩИХ ПРОИЗВОДНЫХ БАКТЕРИОХЛОРОФИЛЛА, НОВЫЕ МЕТАЛЛИРОВАННЫЕ ПРОИЗВОДНЫЕ БАКТЕРИОХЛОРОФИЛЛА, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ | 1996 |
|
RU2193038C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ СТРОЕНИЯ ГОРНЫХ НАПЛАСТОВАНИЙ | 1926 |
|
SU7273A1 |
| MILER G.P | |||
| et al, Expanding the 43C9 class of catalytic antibodies using chain-shuffmg approach, Bioorg | |||
| Med | |||
| Chem., 1997, v.5(3), p.581-590. | |||
Авторы
Даты
2014-01-10—Публикация
2008-02-21—Подача