Эта заявка испрашивает преимущество приоритета Предварительной заявки США № 60/927692, поданной 4 мая 2007 года, содержание которой включено в своей полноте посредством ссылки.
ОБЛАСТЬ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к области техники, охватывающей очистку вирусов.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Вирусы, которые встречаются в природе, или их рекомбинантные версии применяют для вакцинации и в генной терапии. Для множества вирусов или подобных вирусам частиц является возможным безопасное и эффективное размножение в клетках хозяина. Некоторые публикации описывают очистку вирусов из клеток хозяина, главным образом заостряя внимание на применении специфических хроматографических матриц для очистки вируса от лизата клеток хозяина (см., например, патент США № 6008036). Другие способы, как описано, например, в Патенте США No. 6048537 используют непрерывное центрифугирование в градиенте концентрации сахарозы, которое предоставляет продукты с меньшей антигенной чистотой и требует дополнительных этапов очистки посредством центрифугирования. Также недостатком таких способов является агрегация антигенов, которая может приводить к потере вирусного антигена или ингибировать стадии инактивации вируса.
Агрегация вируса может также снижать выход хроматографических процессов, которые требуют затрат времени и являются дорогостоящими и сложными для адаптации к крупномасштабному производству. Следовательно, целью настоящего изобретения является предоставление способа для очистки вирусов, в частности из образцов клеток хозяина, который будет простым, но, тем не менее, эффективным в предоставлении всех фракций вирусных антигенов с высокой чистотой и со сниженной агрегацией вирусного антигена.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
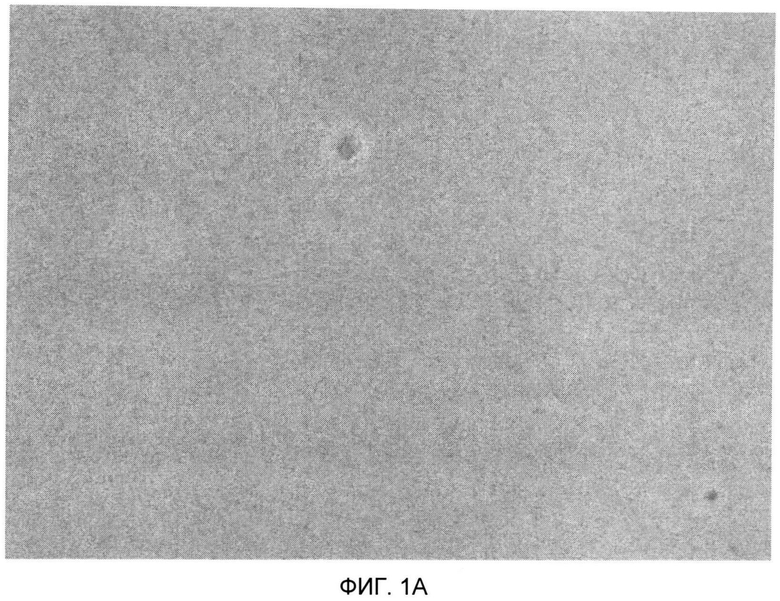
Фиг.1 - микрофотография ОМВП, очищенных с применением традиционной (Фиг.1А) и по данному изобретению (Фиг.1B) процедуры ультрацентрифугирования.
КРАТКОЕ ИЗЛОЖЕНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
Настоящее изобретение предоставляет способ очистки вируса или вирусного антигена, включающий в себя предоставление вирусного препарата и центрифугирование упомянутого препарата вируса в градиенте концентрации сахара, который определен первым слоем А с концентрацией сахарозы, равной от 34 до 50 мас.%, и вторым слоем В с концентрацией сахарозы, равной от 50 до 65 мас.% сахарозы, в водном буфере, в котором один компонент буфера имеет значение pKa от 6,0 до 9,4, и сбор упомянутого вируса или вирусного антигена из центрифугата, т.е. продукта процесса центрифугирования.
Одним аспектом изобретения является предоставление способа для очистки вируса или вирусного антигена. Способ включает в себя предоставление раствора, имеющего градиент концентрации сахара, установленный посредством центрифугирования, по меньшей мере, первого буферного раствора сахара и, по меньшей мере, второго буферного раствора сахара. Концентрация сахарозы в первом буферном растворе составляет от 35 до 50 мас.% или в некоторых вариантах осуществления, от 34 до 46 мас.%. Концентрация сахарозы второго буферного раствора сахара составляет от 50 до 65 мас.% или, в некоторых вариантах осуществления, от 50 до 60 мас.%. Как только установлен градиент концентрации сахара, препарат вируса добавляют к градиенту концентрации сахара. Вирусный препарат и градиент концентрации сахара затем центрифугируют для получения фракции пика, и фракция пика экстрагируется для получения вируса или вирусного антигена.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Во время очистки вируса или вирусного антигена вирус или вирусный антиген концентрируют посредством центрифугирования, делая возможным отделение от компонентов среды культуры клеток и/или клеток хозяина и компонентов клеток хозяина. Способ по данному изобретению может минимизировать агрегацию вируса и потерю вируса на стадии центрифугирования.
В способах изобретения первый раствор сахара в физиологическом буфере загружают, как правило, вертикально в аппарат для непрерывного центрифугирования для получения горизонтального слоя А раствора сахара, и затем второй раствор сахара с более высокой концентрацией в таком же или другом физиологическом буфере помещают в аппарат для получения горизонтального слоя В раствора сахара. Затем аппарат активируют, создавая градиент концентрации сахара, который является наиболее концентрированным на внешней стенке аппарата и который становится менее концентрированным по направлению к центру аппарата. Собранный из культуры клеток раствор, содержащий вирус, затем помещают в аппарат, и частицы вируса мигрируют до того положения в градиенте концентрации сахара, где их плотность эквивалентна плотности градиента. Когда сахар представляет собой сахарозу, обычный диапазон плотностей при доведении до равновесного состояния составляет 36-48 мас.% сахарозы. Как только аппарат останавливают, градиент перемещается в горизонтальное положение, и часть градиента, которая содержит частицы вируса (или «фракцию пика»), извлекают из аппарата.
Одним аспектом данного изобретения является неожиданное открытие, заключающееся в том, что с применением подхода двуслойного раствора объем фракции пика может быть увеличен по сравнению с традиционными способами, использующими водный раствор сахарозы с одной концентрацией для получения градиента концентраций сахарозы. Этот неожиданный эффект получают даже в тех случаях, если применяют сахарозу, и максимальная концентрация сахарозы в градиенте является такой же, как применяемая в общепринятом способе. Посредством оптимизации концентраций и количеств двух слоев раствора сахарозы А и В объем фракции пика может быть увеличен, например, в два раза. Этот повышенный объем фракции пика уменьшает агрегацию целых вирусных частиц или антигенов посредством снижения их относительных концентраций.
Процессы непрерывного ультрацентрифугирования пригодны для очистки препаратов вируса. Для создания градиентов концентрации посредством ультрацентрифугирования могут применяться растворы с высокой концентрацией сахара (например, сахарозы или сорбита) или соли (например, CsCl2 или NaBr). Однако растворы сахаров без каких-либо добавок имеют низкую концентрацию электролитов и не имеют буферной емкости. Таким образом, одним аспектом изобретения является осознание того факта, что препараты вирусов в растворах сахаров, таких как растворы сахарозы, имеют сильную тенденцию к образованию агрегатов, в зависимости от концентрации вирусных частиц, которые могут вызывать проблемы в дальнейшей обработке для получения вакцины. Способы по данному изобретению могут эффективно минимизировать эти проблемы с применением растворов сахаров (например, растворов сахарозы с концентрацией 55 мас.%) с добавлением соли в физиологических концентрациях (например, NaCl в концентрации приблизительно 4-8 г/кг) и с применением буфера (например, Tris, приблизительно 10-20 ммоль/кг, с последующим доведением pH до требуемых значений) для достижения физиологических значений электролитов и рН в градиенте. В некоторых вариантах осуществления для создания градиента концентраций в ультрацентрифуге применяют различные растворы сахаров. В качестве примера, 200 мл 55%-ного (мас.%) раствора и 800 мл 42%-ного (мас.%) раствора загружают в ультрацентрифугу. Меньшее количество раствора сахарозы с более высокой концентрацией обеспечивает то, что по окончании ультрацентрифугирования максимум концентрации сахарозы останется на уровне свыше 45%, а большее количество 42%-ной сахарозы приводит к более плавному градиенту в диапазоне приблизительно 40%, где обычно находится максимум пика вируса. С применением этих способов по данному изобретению объем фракции пика может быть повышен, и, следовательно, суспензия вирусных частиц разбавляется, что приводит к меньшей агрегации. Также с применением таких рецептур сахарозы модифицируют диффузию молекул или частиц в надосадок, который помещают в ультрацентрифугу, и градиент.
Например, было обнаружено, что градиент плотности, полученный с применением приблизительно 42%-ного и 55%-ного (мас.%) раствора сахарозы в 20 ммоль/кг буфера Tris, является особенно пригодным для вируса гриппа, но также может быть с легкостью адаптирован для других вирусов. Tris (трисгидроксиметиламинометан) является пригодным буфером для диапазонов рН от 6,5 до 9,7. Несмотря на то что в этом конкретном примере варианта осуществления изобретения применяется сахароза, могут быть применены другие сахара, пригодные для градиентного центрифугирования. Кроме того, могут быть применены другие буферные соединения, в частности органические буферные соединения, такие как амины. Предпочтительно, буфер имеет уровень рКа выше 6, 6,2, 6,4, 6,6, 6,8, 7,2, 7,4, 7,6, 7,8 или 8,0 и ниже 9,4, 9,2, 9,0, 8,8, 8,6, 8,4 или 8,2. Пригодные буферы содержат, например, HEPES (4-(2-гидроксиэтил)-1-пиперазинэтансульфоновая кислота), ACES (N-(2-ацетамидо)-2-аминоэтансульфоновая кислота), бис-трис-метан или -пропан, CAPS (N-циклогексил-3-аминопропансульфоновая кислота) или CAPSO, PIPES (пиперазин-N,N'-бис(2-этансульфоновая кислота)), фосфатный буфер или любой другой буфер, применяемый в области биохимии. Буфер предпочтительно является химически инертным по отношению к биомолекулам.
Процесс центрифугирования может приводить к получению фракции пика, в которой вирусные частицы диспергированы при физиологических условиях с учетом электролитов и рН. Концентрация всех вирусных антигенов во фракции пика может быть модифицирована посредством добавления различных количеств растворов сахаров с высокими и низкими концентрациями для определения градиента и, следовательно, объема фракции пика. Дополнительно объем пиковой фракции также повышают посредством добавления только соли и пригодного буфера (например, солевого раствора, забуференного Tris(TBS)), что приводит к значительно более высокому выходу антигена и белка. Этот эффект может происходить вследствие необъяснимо повышенной мобильности белков и вирусного антигена в градиенте концентрации сахара, содержащем физиологические концентрации соли и имеющем физиологический рН. Различные условия ультрацентрифугирования (например, с наличием или без предосветлителя и с различными гравитационными силами) ясно показали, что значительное повышение выхода продукта и пониженная агрегация вирусных частиц могут быть достигнуты посредством этих модификаций градиента концентрации сахарозы.
Предпочтительно добавленное количество электролитов составляет более чем 50 мОсмоль/кг, 100 мОсмоль/кг, 150 мОсмоль/кг, 200 мОсмоль/кг или 250 мОсмоль/кг и менее чем 500 мОсмоль/кг, 450 мОсмоль/кг, 400 мОсмоль/кг или 350 мОсмоль/кг, предпочтительно приблизительно 300 мОсмоль/кг. Следует заметить, что количество электролита рассчитывается как осмолярность водных растворов без коррекции фактора ван Хоффа. Кроме того, вклад вещества, образующего градиент (например, сахарозы), не учитывается для расчета. Например, осмолярность электролитов рассчитывается следующим образом: 8 г NaCl/кг/58,44 г/моль = 136,9 ммоль/кг × 2 (ион/моль) = 273,8 мОсмоль/кг + 20 мМ/кг TRIS × 2 ион/моль = 40 мОсмоль/кг; всего (NaCl+TRIS) 313,8 мОсмоль/кг. Значение рН может лежать в физиологическом диапазоне, предпочтительно от 5,5 до 9,5, более предпочтительно от 5,5 до 8,5, особенно предпочтительно выше 5,5, 6,0 6,5 или 7 и ниже 9,5, 9,0, 8,5, 8,0 или 7,5, в частности от 7,0 до 7,5 или от 7,0 до 7,4.
В особенно предпочтительном варианте осуществления сахар, применяемый для создания градиента плотности, представляет собой сахарозу. Однако это изобретение также рассматривает применение других сахаров, включая сахарные спирты, неограничивающим примером которых является сорбит. Кроме того, изобретение рассматривает применение гидрогенизованных сахаров, неразветвленных сахаров, модифицированных сахаров или любого другого сахара при условии, что сахар имеет растворимость в воде, достаточную для получения растворов с плотностями, определенными здесь. Комбинации сахаров (т.е. два или более сахаров) в одном и том же или в различных слоях могут также быть применены для получения градиентов, описанных здесь, при условии, что соответствующие растворы сахаров, которые составляют эти слои, имеют обозначенные здесь плотности.
В предпочтительных вариантах изобретения объем образующего градиент препарата составляет от 5% до 100%, предпочтительно более 5%, 10% 15%, 20%, 25%, 30%, 32%, 35%, 40%, 45% или 50% или менее 100%, 90%, 80%; 75%, 70%, 65%, 60%, 55%, 50%, 48%, 45%, 40%, 35%, 30% или 25% эффективного объема ротора ультрацентрифуги или устройства, применяющего к образцу центробежную силу. В других вариантах осуществления объем препарата, образующего градиент, составляет от 1% до 75% эффективного объема ротора ультрацентрифуги или устройства, применяющего к образцу центробежную силу.
В предпочтительных вариантах осуществления загрузка ротора, содержащего вещество, образующее градиент, выполняется в непрерывном или в ненепрерывном циклическом режиме (т.е. или непрерывное ультрацентрифугирование, или циклическое ультрацентрифугирование), где загруженный объем предпочтительно превышает свободный объем ротора (общий объем минус градиентный объем), предпочтительно, более, чем в 1, 2, 3, 5, 10, 20, 30, 40, 50, 60, 80 раз или менее, чем в 300, 250, 200, 150, 120, 100, 80 раз. В некоторых особенно предпочтительных вариантах осуществления применяется непрерывное ультрацентрифугирование.
В особенно предпочтительном варианте осуществления загруженный объем составляет от 20 л до 50 л при свободном объеме от 600 мл до 1000 мл (1600 мл роторного объема минус от 600 мл до 1000 мл свободного объема), что составляет приблизительно 20-80-кратное отношение. В еще одном варианте осуществления, загруженный объем составляет от 40 л до 100 л на свободный объем от 1200 мл до 2000 мл (3200 мл объема ротора минус от 1200 мл до 2000 мл его свободного объема, что дает приблизительно 20-80-кратное отношение).
Во время центрифугирования устанавливается постоянный градиент сахара. В дополнительном варианте осуществления собирают фракцию центрифугата с концентрацией сахарозы выше 24 (что эквивалентно приблизительно 1,10 кг/л), 26, 28, 30, 32, 34, 36, 38, 40, 42, 44 или 46 мас.% (что эквивалентно приблизительно 1,22 кг/л) и менее чем 66 (что эквивалентно приблизительно 1,32 кг/л), 63, 60, 58, 56, 54, 52, 50, 48, 46, 44 или 42 мас.% (что эквивалентно приблизительно 1,19 кг/л). Обычно вирусный продукт накапливается в этом интервале. Предпочтительно, фракцию центрифугата собирают в диапазоне концентраций сахарозы приблизительно от 30 до 54 мас.%, более предпочтительно от 36 до 48 мас.% сахарозы. Фракции, собранные из градиентов, образованных другими сахарами, могут иметь различные концентрации (мас.%), но эквивалентные плотности. Плотности собранной фракции могут составлять более 1,10 кг/л, 1,12 кг/л, 1,14 кг/л, 1,16 кг/л или 1,18 кг/л, 1,20 кг/л, 1,22 кг/л и менее 1,32 кг/л, 1,30 кг/л, 1,28 кг/л, 1,26 кг/л, 1,24 кг/л, 1,22 кг/л или 1,20 кг/л. В особенно предпочтительных вариантах осуществления плотности могут составлять от 1,13 до 1,25 кг/л, более предпочтительно, от 1,16 до 1,22 кг/л.
В некоторых вариантах осуществления концентрация буфера или компонента буфера (например, солевого раствора, забуференного TRIS) составляет от 2 ммоль/кг до 50 ммоль/кг, предпочтительно от 5 ммоль/кг до 40 ммоль/кг, от 10 ммоль/кг до 40 ммоль/кг, более предпочтительно от 10 ммоль/кг до 30 ммоль/кг, более предпочтительно от 18 ммоль/кг до 25 ммоль/кг и наиболее предпочтительно должна составлять 20 ммоль/кг. Буфер предпочтительно является водным с содержанием менее чем 5% смешиваемых с водой органических растворителей, более предпочтительно, менее чем 2% органических растворителей и наиболее предпочтительно не содержит органических растворителей. Буфер имеет концентрацию более чем 2 ммоль/кг, 5 ммоль/кг, 10 ммоль/кг, 12 ммоль/кг, 14 ммоль/кг, 15 ммоль/кг, 17 ммоль/кг, 18 ммоль/кг, 19 ммоль/кг или 20 ммоль/кг или менее чем 50 ммоль/кг, 40 ммоль/кг, 35 ммоль/кг, 30 ммоль/кг, 25 ммоль/кг, 23 ммоль/кг или 21 ммоль/кг.
Центрифугирование может быть выполнено предпочтительно со скоростью центрифугирования, по меньшей мере, 20000 g, более предпочтительно 30000 g, более предпочтительно 50000 g, более предпочтительно 70000 g, наиболее предпочтительно 90000 g, но в других вариантах осуществления скорость центрифугирования составляет менее чем 200000 g, менее чем 150000 g, менее чем 120000 g, менее чем 100000 g или менее чем 90000 g.
В особенно предпочтительных вариантах осуществления объемное отношение исходного слоя А к исходному слою В (т.е. перед внесением препарата вируса) составляет от 20:1 до 1:1, предпочтительно от 10:1 до 1,5:1, более предпочтительно от 8:1 до 2:1, еще более предпочтительно от 6:1 до 3:1 и наиболее предпочтительно 4:1. Отношение может составлять менее чем 20:1, 15:1, 10:1, 8:1, 5:1, 4:1, 3:1 или более чем 1:2, 1:1, 1,5:1, 2:1, 3:1 или 4:1.
В особенно предпочтительном варианте осуществления заполняющая центрифугу жидкость, содержащая сахар, является двухслойной (т.e. содержащей слои сахара А и В с различной концентрацией до добавления препарата вируса, ниже заполняющего слоя жидкости в ультрацентрифуге). Естественно, в процессе центрифугирования могут формироваться новые градиенты концентрации или градиенты плотности. Однако данное изобретение также рассматривает жидкости для центрифугирования, имеющие более чем два слоя. Например, в некоторых неограничивающих вариантах осуществления жидкость для центрифугирования состоит из 3, 4, 5, 6, 7 или даже 8 различных слоев. Каждый слой может иметь такой же буфер, как и другие слои, или буферы для каждого слоя могут быть выбраны независимо друг от друга.
В особенно предпочтительных вариантах осуществления способ получения не включает в себя стадию предварительного осветления. Однако при необходимости предварительное осветление может быть выполнено в камере для предварительного осветления аппарата для ультрацентрифугирования.
В дополнительных вариантах осуществления слой А содержит от 40 до 44 мас.% сахарозы, предпочтительно от 41 до 43 мас.% сахарозы. Концентрация сахарозы может составлять более 35 (приблизительно эквивалентно 1,15 кг/л), 36, 37, 38, 39, 40, 41% или 42 мас.% (приблизительно эквивалентно 1,19 кг/л) или менее 50 (приблизительно эквивалентно 1,23 кг/л), 49, 48, 47, 46, 45, 44, 43 или 42 мас.% (приблизительно эквивалентно 1,19 кг/л). Слой А, образованный другим сахаром, может иметь отличающуюся концентрацию в массовом отношении, но будет иметь плотность, которая входит в диапазоны плотностей, указанные здесь.
В некоторых вариантах осуществления слой В содержит раствор сахарозы, имеющий концентрацию от 50 до 65 мас.%, предпочтительно от 52 до 58 мас.% и более предпочтительно от 54 до 56 мас.%. Концентрация сахарозы (мас.%) может составлять более 50 (приблизительно эквивалентно 1,23 кг/л), 51, 52, 53, 54 или 55 (приблизительно эквивалентно 1,26 кг/л) или менее 66 (приблизительно эквивалентно 1,32 кг/л), 64, 62, 61, 60, 59, 58, 57%, 56 или 55 (приблизительно эквивалентно 1,26 кг/л). Слой В, образованный другими сахарами, может иметь отличающуюся концентрацию в массовом отношении, но будет иметь плотность, которая входит в диапазоны плотностей, определенные здесь.
В предпочтительном варианте осуществления настоящего изобретения вирус представляет собой ортомиксовирус, в частности вирус гриппа, предпочтительно выбранный из гриппа A и B. Неограничивающие примеры других вирусов, рассмотренные данным изобретением, включают вирусы, выбранные из группы семейств РНК-содержащих вирусов, таких как Reoviridae, Picornaviridae, Caliciviridae, Togaviridae, Arenaviridae, Retroviridae, Flaviviridae, Orthomyxoviridae, Paramyxoviridae, Bunyaviridae, Rhabdoviridae, Filoviridae, Coronaviridae, Astroviridae, Bornaviridae, и семейств ДНК-содержащих вирусов, таких как Adenoviridae, Papovaviridae, Parvoviridae, Herpesviridae, Poxviridae, Hepadnaviridae. В некоторых предпочтительных вариантах осуществления вирус выбирают из группы, состоящей из гриппа А/Panama/2007/99, A/New Caledonia/20/99 и B/Shangdong/7/97.
В некоторых вариантах осуществления изобретения вирусную массу получают из клеток, инокулированных вирусом. Вирус может быть получен в любых клетках, пригодных для получения вирусов. Предпочтительно, клетки представляют собой культуру или линию клеток животных. Источником таких клеток могут являться определенная ткань или эмбриональные клетки, такие как эмбриональные яйцеклетки. Животное предпочтительно является млекопитающим или птицей. В различных вариантах осуществления изобретения клетки представляют собой клетки птиц, собак, грызунов или приматов. В определенных вариантах осуществления клетки представляют собой эпителиальные клетки, в особенно предпочтительном варианте эпителиальные клетки почки, такие как клетки Vero африканской зеленой мартышки.
Вирусный продукт, внесенный в аппарат для ультрацентрифугирования, может представлять собой культуру клеток целиком или надосадок культуры клеток, полученный после отделения клеток и/или их частей от клеточной культуры. В некоторых вариантах осуществления изобретения клеткам в клеточной культуре дают возможность осесть в культуральном сосуде до удаления надосадка клеточной культуры. В других вариантах осуществления изобретения клетки могут быть лизированы посредством механических или химических способов, неограничивающие примеры которых включают лизис с применением гипо- или гипертонических растворов, обработку детергентами, обработку ультразвуком или механическое разрушение.
Предпочтительно вирус инактивируется или фрагментируется (например, как описано в WO 05/11800) до или после центрифугирования. Дополнительно вакцина из вируса может быть получена с применением способов, известных в данной области. Вакцина является иммуногенной композицией антигенного вещества, т.е. вируса (не вызывающего развитие инфекции), его оболочки, его частиц или его антигенов, которые могут быть применены для иммунизации животного, например, млекопитающего, такого как человек или птица.
Настоящее изобретение дополнительно проиллюстрировано следующими примерами, не будучи ими ограничено.
ПРИМЕРЫ
В процессе очистки антигена вируса гриппа моновалентный продукт (МВП) концентрируют посредством ультрацентрифугирования. Процедура центрифугирования в непрерывном потоке может быть применена для производства вирусной вакцины, растущей на клеточной культуре Vero, на основе градиента плотности сахарозы, образованного с применением 50%-ного (мас.%) раствора сахарозы в воде. Применяемая модель ротора центрифуги оснащена предосветлителем. Множество подходов к оптимизации ферментации, таких как изменение среды клеточной культуры Vero посредством применения соевого гидролизата или повышенной температуры на ранней фазе репликации вируса гриппа, приводили к более активному процессу, также, как и повышенному выходу антигена. Следовательно, оказалось, что градиент 50%-ного (мас.%) раствора сахарозы в воде не позволял достигать требуемого выхода препарата вследствие ограничения способности связывать антиген. Кроме того, ОМВП (очищенный МВП) вирусных штаммов New Caledonia, Panama и Shangdong показали неожиданную агрегацию антигена на этой конкретной стадии получения. Предпринимались некоторые попытки минимизировать агрегацию вируса и потерю вируса на этапе центрифугирования. Солевой раствор, забуференный TRIS, применялся вместо воды для растворения сахарозы для получения градиента. Кроме того, вводились модификации применения двух растворов, образующих градиент, с различными плотностями для повышения объема фракции пика. Дополнительно, ультрацентрифугирование без предосветлителя, но с повышенным ускорением, оказалось ценным средством для улучшения выхода продукта. Для подтверждения этой концепции были оценены результаты предыдущих очисток при стандартных (50%-ный раствор сахарозы в воде, с предосветлителем, при 20000 оборотов в минуту = 90000 g) и новых условиях (42% и 55%-ные растворы сахарозы (мас.%), 20 ммоль/кг TRIS, 8 г/кг NaCl, без предосветлителя при 35000 оборотов в минуту = 90000 g, со сбором ОМВП из 48%-36%-ной фракции сахарозы).
Пример 1: Материалы и способы
Применялись ультрацентрифуга с непрерывным потоком CC40S с ротором C40CTS (объем ротора 1600 мл) или ультрацентрифуга Alfa Wassermann RK6 с эквивалентным ротором. Растворы для градиента сахарозы загружали в ротор и затем повышали скорость вращения с 20000 до 35000 оборотов в минуту. После непрерывной загрузки инактивированным продуктом ротор промывают буфером для удаления остаточного белка, который не вошел в градиент. После промывания ротор замедляют и ультрацентрифугирование останавливают, позволяя градиенту переместиться из радиального в аксиальное направление ротора. Элюция и фракционирование выполняются в соответствии с концентрациями сахарозы. Детектор плотности типа Кориолис и детектор плотности UV 254 нм применяются для контроля концентрации сахарозы и белка.
В образцах очищенных инактивированных продуктов определяют общую концентрацию белка, антигены HA-SRD и Vero с применением ELISA в соответствии со стандартизированными процедурами для количественного определения выхода и очистки для экспериментов с ультрацентрифугированием.
Пример 2: Исходные эксперименты с градиентом сахарозы в TBS
Ряд мелкомасштабных опытов по очистке с продуктами моновалентного вируса A/Panama/2007/99 показали, что применение градиента сахарозы, полученного из смеси 50% по массе раствора сахарозы с 50% по массе забуференного Tris солевого раствора (20 ммоль/кг TRIS, 8 г/кг NaCl) (конечная концентрация 10 ммоль/кг TRIS, 4 г/кг NaCl), имело некоторые преимущества над стандартной системой сахароза/вода. Лабораторная ультрацентрифуга модели RK-6 применялась для очистки 25 литров и 50 литров аликвот МВП при различных условиях. Обзор набора параметров и результатов для серии опытов по очистке с применением систем сахароза/вода и сахароза/TBS (забуференный TRIS солевой раствор) представлены в Таблице 1.
Сравнение выхода антигена вируса гриппа A/Panama/2007/99 и вида ОМВП. Очищенный градиентом сахарозы вирус из экспериментов с ультрацентрифугированием с предосветлителем при 30000 g
Параметры
белок (мг/мг)
литр продукта)
вода
800 мл
TBS
800 мл
TBS
800 мл
Из Таблицы 1 можно заключить, что градиенты сахарозы в TBS имеют некоторые преимущества по сравнению со стандартными градиентами в системе сахароза/вода. Для опыта по очистке 1 мог быть достигнут выход 1,2 мг антигена на литр продукта, фракция антигена (ОМВП) показала непредвиденную агрегацию вируса. Эксперименты по очистке (опыт 2) с сахарозой в TBS давали повышенный выход антигена по сравнению с контрольным опытом 1. Для препаратов с TBS могло наблюдаться значительное снижение агрегированной фракции. Несмотря на то что градиент сахарозы в TBS имел некоторые преимущества по сравнению со стандарной системой (сахароза/вода), при более высоких загрузках градиента (50 литров по сравнению с 25 литрами) наблюдалась потеря выхода антигена (опыт 3).
В обоих случаях применения TBS вместо воды повышался объем пиковой фракции, который свидетельствует о более высокой диффузии между загруженным продуктом и градиентом, содержащим буферное вещество и другие электролиты.
Пример 3: Разработка двухэтапного градиента сахароза/TBS
Этот пример показывает примерный вариант осуществления, в котором градиент сахарозы был модифицирован для повышения объема пиковой фракции без изменения пределов фракционирования. Применялся градиент сахарозы со сниженной концентрацией 42 мас.%, который приводил к менее резкому градиенту сахарозы, элюированному из ультрацентрифуги. Для обеспечения достаточно высокой концентрации сахарозы в градиенте более концентрированный раствор сахарозы/TBS с концентрацией 50 мас.% был загружен после 42%-ного (мас.%) раствора, который, в качестве раствора с более высокой концентрацией, формировал «подушку» для предотвращения оседания антигена на стенке ротора. Таблица 2 показывает опыты очистки с применением такого двухступенчатого градиента с 900 мл менее концентрированного раствора сахарозы/TBS (42% мас. сахарозы, 11,7 ммоль/кг TRIS, 4,7 г/кг NaCl) и 100 мл более концентрированного раствора сахарозы/TBS (50% мас., 10 ммоль/кг TRIS, 4 г/кг NaCl), по сравнению с опытом по очистке с применением градиента, образованного только 50%-ным раствором сахарозы/TBS, примененных в различных объемах (а именно 600, 800 и 1000 мл). Тесты выполнялись с предосветлителем при 20000 оборотов в минуту (относительная центробежная сила приблизительно 30000 g).
Применение различных количеств и концентраций растворов сахарозы/TBS не влияли значительно на выход и чистоту вещества. Однако применение двухступенчатого градиента, созданного смесью 42 мас.%/50 мас.% сахарозы/TBS, приводило к значительному повышению объема пиковой фракции, что приводило к лучшим условиям очистки посредством снижения концентрации антигена для предотвращения перегрузки фракции пика.
Сравнение выхода продукта и антигенной чистоты инактивированных продуктов A/Panama/2007/99, очищенных посредством ультрацентрифугирования с различными количествами 50%-ного (мас.%) раствора сахарозы/TBS по сравнению с двухступенчатым градиентом сахарозы/TBS (с концентрацией 50 мас.%/42 мас.%)
Сахароза TBS 50% 100 мл
Пример 4: Применение более высоких относительных ускорений без предосветлителя
С целью повышения выхода антигена были изучены более высокие относительные ускорения для ультрацентрифугирования, однако при таких условиях можно было ожидать потерю вещества в предосветлителе. Роторы для ультрацентрифугирования могут быть использованы с применением или без предосветлителя, поэтому выполнялось сравнение 20000 оборотов в минуту (приблизительно 30000 g) с использованием предосветлителя и 35000 оборотов в минуту (приблизительно 90000 g) в двухступенчатом градиенте сахарозы/TBS (100 мл 50%-ной (мас.%) сахарозы, конечная концентрация 10 ммоль/кг TRIS, 4 г/кг NaCl и 900 мл 39%-ной (мас.%) сахарозы, конечная концентрация 12,2 ммоль/кг TRIS, 4,9 г/кг NaCl). Для оценки потенциальной потери антигена предосветлитель и стенка ротора были промыты буфером и исследовались на предмет потерь антигена. Результаты этого эксперимента показаны в Таблице 3. Выход антигена мог быть повышен более чем на 60% от 1,7 мг продукта HA-SRD/л до 2,8 мг продукта HA-SRD/л. Основная часть потерянного антигена могла быть извлечена из предосветлителя, тогда как только приблизительно 5% антигена было потеряно на стенке ротора ультрацентрифуги. Отношение SRD/белок только слегка уменьшалось посредством исключения предварительного осветления до загрузки продукта в градиент сахарозы/TBS.
Сравнение выхода и потерь продукта и антигенной чистоты посредством ультрацентрифугирования инактивированного продукта A/Panama/2007/99 с различными относительными центробежными силами с применением и без предосветлителя
параметры
литр продукта)
с предосвет-лителем
без предосвет-лителя
Пример 5: Модификация концентраций TRIS и NaCl в градиентах сахарозы
Исходные рецептуры были приготовлены посредством получения градиента 50%-ной (мас.%) сахарозы/TBS, смешиванием 50 мас.% сахарозы с 50 мас.% буфера TBS (20 ммоль/кг TRIS, 8 г/кг NaCl), что приводило к конечной концентрации 10 ммоль/кг TRIS и 4 г/кг NaCl. Вслед за этим были получены менее концентрированные рецептуры 42%-39%-ных растворов сахарозы/TBS с более высокими количествами TBS, что приводило к более низким концентрациям сахарозы, но соответственно более высоким концентрациям TRIS и NaCl (см. предыдущие примеры). Более концентрированные растворы, такие как, например, 55%-ный (мас.) раствор сахарозы в TBS, имели, следовательно, более низкие концентрации TRIS и NaCl.
Для стандартизации концентраций TRIS и NaCl в таких препаратах была составлена новая рецептура, в которой 42%-55%-ную (мас.%) сахарозу добавляют в контейнер для смешивания, также добавляют 20 ммоль/кг (2,42 г/кг) TRIS и 8 г/кг NaCl и дополняют водой до 100% массы. Такие препараты впоследствии имели значительно (приблизительно в 2 раза) более высокие концентрации TRIS и NaCl по сравнению с рецептурами, применяемыми в предыдущих примерах. Также рефрактометрические измерения таких рецептур показывали приблизительно на 2° (1°-3°) брикс более высокие результаты рефрактометрии, вследствие меньшего количества воды, которая замещалась посредством добавления TRIS и NaCl перед доведением до конечной массы 100%.
В эксперименте сравнивались две различные версии двухступенчатых градиентов сахарозы/TBS. Градиенты были получены посредством добавления 200 мл более концентрированного раствора сахарозы/TBS для получения более выраженной «подушки» сахарозы с высокой плотностью в градиенте, после загрузки 800 мл 42%-ной сахарозы/TBS.
Результаты для различных препаратов сахарозы/TBS в экспериментах с использованием ультрацентрифуги показаны в Таблице 4. При применении различных концентраций TRIS и NaCl не было замечено значительных различий по выходу или чистоте.
Сравнение выхода продукта и антигенной чистоты с применением ультрацентрифугирования инактивированного продукта A/Panama/2007/99 для различных препаратов сахарозы/TBS с различными концентрациями TRIS и NaCl
55% сахарозы в TBS (8,9 ммоль/кг TRIS/3,6 г/кг NaCl)
55% сахарозы в TBS (20 ммоль/кг TRIS/8 г/кг NaCl)
Пример 6: Вместимость ротора и исследование скорости потока загрузки
Различные объемы продукта трех различных штаммов были исследованы для оценки емкости оптимизированной процедуры ультрацентрифугирования и для исследования потенциальных ограничений увеличения масштаба в производстве, когда процедура ультрацентрифугирования должна быть применена к более высоким объемам продукта. Инактивированные продукты были загружены в объеме 15-17 л и 45-51 л в ротор объемом 1600 мл.
В этом эксперименте применялась такая же модифицированная версия двухступенчатого градиента сахарозы/TBS, как и в предыдущем примере 5. Сначала концентрация раствора с более высокой плотностью была повышена до 55 мас.%, и больший объем 200 мл был применен для создания в градиенте более выраженной «подушки» сахарозы с высокой плотностью, после загрузки 800 мл 42%-ной сахарозы/TBS. Конечная концентрация TRIS в градиенте была повышена до 20 ммоль/кг, и конечная концентрация NaCl была повышена до 8 г/кг в обоих растворах сахарозы/TBS. Условия ультрацентрифугирования были 35000 оборотов в минуту (90000 g) без предосветлителя, и фракционирование выполнялось в концентрации сахарозы от 48% до 36%.
Результаты экспериментов для исследования емкости показаны в Таблице 5.
При использовании градиента по данному изобретению и более высокой скорости центрифугирования без предосветлителя могли наблюдаться только незначительные различия в выходе приблизительно от 3% до 6% при различных объемах загрузки продукта. Это отличалось от ограниченной емкости, показанной в Примере 2/Таблице 1, где для штамма A/Panama/2007/99 увеличение объема продукта с 25 литров до 50 литров приводило к снижению выхода приблизительно на 30%. Этот улучшенный выход мог объясняться сочетанием увеличенных относительных ускорений и улучшением профиля градиента и объема фракции пика за счет двухступенчатого градиента сахарозы/TBS.
Сравнение выхода продукта и антигенной чистоты с применением ультрацентрифугирования с различными объемами загрузки
51 л
17 л
45 л
15 л
Пример 7: Сравнение предложенных в данном изобретении и традиционных процедур ультрацентрифугирования
Комбинированное применение
a) 90000 g (35000 оборотов в минуту) без предосветлителя (вместо 30000 g (20000 оборотов) с предосветлителем);
b) градиент сахарозы в TBS (вместо сахарозы в воде) с конечной концентрацией 20 ммоль/кг TRIS и 8 г/кг NaCl;
c) формирование такого градиента двумя различными концентрациями сахарозы (200 мл 55%-ной + 800 мл 42%-ной) для увеличения объема фракции пика (вместо 800 мл 50%-ной сахарозы) сравнивалось с предшествующей традиционной процедурой ультрацентрифугирования (Таблица 6).
Условия и параметры производственной и мелкомасштабной (версия в масштабе 1:2) процедуры очистки при стандартных (50%-ный раствор сахарозы в воде) и новых условиях
рование
вода
TBS 20 ммоль
200 мл 55%
Три сравнительных эксперимента были выполнены со штаммами 2002/2003 (а именно A/New Caledonia/20/99, A/Panama/2007/99 и B/Shangdong/7/97). Пределы фракционирования пика для этих трех опытов были определены в концентрации сахарозы от 48 до 36 мас.%. Результаты показаны в Примерах с 8 по 10.
Результаты опытов по очистке с применением вирусов гриппа New Caledonia, Panama и Shangdong при стандартных (50%-ная сахароза в воде) и модифицированных (градиент сахарозы/TBS) условиях сравнивались на основании параметров выхода и качества продукта.
Пример 8: Очистка штамма вируса гриппа A/New Caledonia/20/99
Эксперименты при условиях в соответствии со стандартной процедурой и новыми параметрами градиента сахарозы/TBS в соответствии с Таблицей 6 выполнялись с МВП New Caledonia. В Таблице 7 дано сравнение результатов опытов по очистке.
Сравнение выхода антигена А/New Caledonia/20/99, отношения HA/белок и загрязненности белком Vero. Вирус, очищенный с применением градиента сахарозы традиционным способом 2001/2002, по сравнению с модифицированным TBS градиентом
На основании данных в Таблице 7 можно заключить, что значительное улучшение процесса достигалось при условиях очистки с новым градиентом сахарозы/TBS для штамма вируса гриппа A/New Caledonia/20/99. Для этого конкретного штамма было продемонстрировано значительное повышение выхода вируса с 2,7 до 3,4 мг антигена на литр МВП. Качество вирусного антигена, измеренное как отношение HA/общий белок и отношение Vero-белок/HA, показывает, что это повышение доз на литр не подвергает риску качество антигена. Небольшое повышение отношения HA/общий белок с 0,41 до 0,60 достигалось с применением новых условий градиента сахарозы. Для отношения белок клетки хозяина/HA значительного различия не определялось. При условиях градиента сахарозы/TBS для продукции ОМВП агрегация штамма A/New Caledonia/20/99 была слегка снижена. Этот эффект мог быть подтвержден наблюдением под микроскопом (см., например, Фиг.1А и Фиг.1B). При 400-кратном увеличении ясно наблюдалось более сильное образование агрегатов при применении предыдущей версии градиента сахароза/вода (Фиг.1А), в то время как, несмотря на повышенный выход, фракция пика, полученная при оптимизированной процедуре ультрацентрифугирования, является, по-видимому, значительно более гомогенной (Фиг.1B).
Пример 9: Очистка штамма вируса гриппа A/Panama/2007/99
Эксперименты по очистке при условиях, соответствующих стандартной процедуре и новым параметрам градиента сахарозы/TBS в соответствии с Таблицей 6, выполнялись с МВП Panama. В Таблице 8 дано сравнение результатов опытов по очистке.
Сравнение выхода антигена A/Panama/2007/99, отношения HA/белок и загрязненности Vero-белком. Вирус, очищенный с применением градиента сахарозы стандартным способом по сравнению со способом по данному изобретению с TBS градиентом
На основании данных Таблицы 8 можно заключить, что с применением новых условий очистки с градиентом сахарозы/TBS для вируса гриппа штамма Panama достигалось значительное улучшение процесса. Для этого конкретного штамма с использованием новых условий градиента сахарозы/TBS было продемонстрировано значительное повышение выхода вируса с 2,0 до 5,5 мг антигена на литр МВП. Было достигнуто отношение HA/общий белок, составляющее 0,77, тогда как для ОМВП, полученного при стандартных условиях, рассчитанное отношение составляло 1,47. Вследствие того факта, что не наблюдалось значительного различия для отношения Vero-белок/HA для ОМВП, полученного с применением обеих процедур, допускается, что агрегация антигена Panama (как видно при сравнении микрофотографий ОМВП Panama (не показаны)) может являться причиной необычного отношения HA/общий белок, составляющего 1,47. Для обеих процедур очистки качество вирусного антигена, измеренное как отношение HA/общий белок и отношение Vero-белок/HA, являлось приемлемым. Но при условиях градиента сахарозы в TBS для получения ОМВП, агрегация штамма Panama могла быть существенно снижена с применением градиента сахароза/TBS.
Пример 10: Очистка штамма B/Shangdong/7/97
Эксперименты по очистке при условиях в соответствии со стандартной процедурой и новыми параметрами градиента сахарозы/TBS в соответствии с Таблицей 6 выполнялись с МВП Shangdong. В Таблице 9 дано сравнение результатов опытов по очистке.
Сравнение выхода антигена B/Shangdong/7/97, отношения HA/белок и загрязненности Vero-белком. Вирус, очищенный с применением градиента сахарозы стандартным способом по сравнению с новым способом с TBS градиентом
На основании данных, представленных в Таблице 9, можно заключить, что для вируса гриппа штамма B/Shangdong/7/97 достигалось значительное улучшение процесса с применением условий очистки по данному изобретению с градиентом сахарозы/TBS. Для этого конкретного штамма было продемонстрировано существенное повышение выхода вируса с 2,2 до 5,1 мг антигена на литр МВП. Сниженное отношение HA/общий белок, составляющее 0,34, для МВП, очищенного с применением сахарозы/TBS, лежит в нормативных пределах для ОМВП вируса гриппа. Дальнейшие улучшения фазы репликации вируса B/Shangdong/7/97 позволяют создать более подходящий процесс получения посредством изменения профиля дозирования трипсина. При условиях градиента сахарозы в TBS для получения ОМВП, агрегация штамма B/Shangdong/7/97 существенно снижалась, что подтверждено микрофотографиями (не показаны) ОМВП Shangdong, очищенных с применением стандартных условий по сравнению с условиями с использованием TBS.
В примерных крупномасштабных и мелкомасштабных экспериментах, предоставленных в данном описании, было продемонстрировано, что градиент сахарозы по данному изобретению делает возможной эффективную загрузку моновалентных продуктов. Имеется много преимуществ применения способов по данному изобретению, описанных здесь, включая: 1) повышенный, по меньшей мере, на 25% выход вируса, 2) зависимое от штамма отношение HA/общий белок, составляющее от 0,34 до 0,77, 3) зависимое от штамма содержание белка клетки хозяина, составляющее от 2% до 7% и 4) минимизированная агрегация вируса в сахарозной фракции пика (ОМВП).
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ПРЕПАРАТА, СОДЕРЖАЩЕГО ВИРУСНЫЕ АНТИГЕНЫ, И ПРИМЕНЕНИЕ ПРЕПАРАТА | 2008 |
|
RU2496519C2 |
| СПОСОБЫ ОЧИСТКИ АДЕНОАССОЦИИРОВАННЫХ ВИРУСОВ | 2017 |
|
RU2773406C2 |
| СПОСОБ ПОЛУЧЕНИЯ ИНАКТИВИРОВАННОЙ ВАКЦИНЫ ПРОТИВ ВИРУСА ГЕПАТИТА А | 2006 |
|
RU2314125C1 |
| ФУНКЦИОНАЛЬНО РЕКОНСТРУИРОВАННЫЕ ВИРУСНЫЕ МЕМБРАНЫ, СОДЕРЖАЩИЕ АДЪЮВАНТ | 2004 |
|
RU2348428C2 |
| Способ получения антигена вируса бешенства для серологической диагностики | 2018 |
|
RU2694836C1 |
| Способ получения антигена или антигенов для производства противогриппозной вакцины и вакцина на его основе | 2019 |
|
RU2710239C1 |
| Способ получения четырехвалентной вакцины для профилактики гриппа | 2020 |
|
RU2754398C1 |
| ДВУХСТАДИЙНЫЙ ТЕМПЕРАТУРНЫЙ ПРОФИЛЬ ДЛЯ КУЛЬТИВИРОВАНИЯ ВИРУСОВ | 2008 |
|
RU2476594C2 |
| СИНТЕТИЧЕСКИЕ МЕМБРАННЫЕ ВЕЗИКУЛЫ, СОДЕРЖАЩИЕ ФУНКЦИОНАЛЬНО АКТИВНЫЕ СЛИТЫЕ ПЕПТИДЫ КАК СИСТЕМЫ ДЛЯ ВВЕДЕНИЯ ЛЕКАРСТВЕННЫХ СРЕДСТВ, СПОСОБ ИЗ ПОЛУЧЕНИЯ, ПРИМЕНЕНИЕ ДЛЯ ИЗГОТОВЛЕНИЯ ЛЕКАРСТВЕННЫХ СРЕДСТВ ПРОТИВ СПИДА | 1992 |
|
RU2125868C1 |
| ВАКЦИНА ДЛЯ ИММУНИЗАЦИИ ПРОТИВ ВИРУСНОЙ ИНФЕКЦИИ | 1995 |
|
RU2150294C1 |

Группа изобретений относится к области биотехнологии. Предложены способы очистки инактивированного вируса или фрагментированного вируса (варианты). Способы включают добавление препарата вируса к градиенту сахара и последующее центрифугирование для получения пиковой фракции. Затем осуществляют экстракцию пиковой фракции для получения очищенного вируса. При этом градиент сахара получают путем непрерывного ультрацентрифугирования первого и второго буферного раствора сахара. Причем первый буферный раствор сахара включает первый физиологический буфер, а второй буферный раствор сахара включает второй физиологический буфер, который является тем же или отличным от первого физиологического буфера. В одном варианте концентрация сахара в первом буферном растворе эквивалентна концентрации сахарозы от 35 до 50 мас.%, а концентрация сахара во втором буферном растворе эквивалентна концентрации сахарозы от 50 до 65 мас.%. При этом второй буферный раствор сахара имеет более высокую плотность, чем первый. В другом варианте способа плотность первого буферного раствора сахара составляет от 1,15 кг/л до 1,23 кг/л, а плотность второго - от 1,23 кг/л до 1,32 кг/л. Способы приводят к повышенному на 25% выходу вируса и минимизируют агрегацию вируса в сахарозной фракции пика. 2 н. и 24 з.п. ф-лы, 1 ил., 9 табл., 10 пр.
1. Способ очистки инактивированного вируса или фрагментированного вируса, включающий
получение образующего градиент раствора, содержащего градиент сахара, посредством непрерывного центрифугирования в ультрацентрифуге по меньшей мере первого буферного раствора сахара и по меньшей мере второго буферного раствора сахара,
причем первый буферный раствор сахара включает первый физиологический буфер, и
причем второй буферный раствор сахара включает второй физиологический буфер, который является тем же или отличным от первого физиологического буфера;
в котором концентрация сахара в первом буферном растворе эквивалентна концентрации сахарозы от 35 до 50 мас.% и концентрация сахара во втором буферном растворе эквивалентна концентрации сахарозы от 50 до 65 мас.% и в котором второй буферный раствор сахара имеет более высокую плотность, чем первый буферный раствор сахара;
добавление препарата инактивированного вируса или фрагментированного вируса к градиенту сахара,
центрифугирование препарата инактивированного вируса или фрагментированного вируса и градиента сахара для получения пиковой фракции и
экстракцию пиковой фракции для получения инактивированного вируса или фрагментированного вируса.
2. Способ по п.1, в котором объем образующего градиент раствора составляет от 5% до 100% объема ротора ультрацентрифуги.
3. Способ по п.1, в котором фракция пика имеет плотность от 1,13 кг/л до 1,25 кг/л.
4. Способ по п.1, в котором собирают фракцию пика с концентрацией сахара, эквивалентной от 30 до 54 мас.% сахарозы.
5. Способ по п.1, в котором по меньшей мере один из указанных буферов имеет концентрацию от 5 мМ до 50 мМ.
6. Способ по п.5, в котором указанный по меньшей мере один буфер имеет концентрацию от 15 мМ до 30 мМ.
7. Способ по п.6, в котором указанный по меньшей мере один буфер имеет концентрацию от 18 мМ до 25 мМ.
8. Способ по п.1, в котором стадию центрифугирования вирусного препарата выполняют с относительным ускорением по меньшей мере 20000 g.
9. Способ по п.8, в котором указанное относительное ускорение составляет по меньшей мере 30000 g.
10. Способ по п.9, в котором указанное относительное ускорение составляет по меньшей мере 90000 g.
11. Способ по п.1, в котором отношение объемов указанного первого буферного раствора сахара к указанному второму буферному раствору сахара составляет от 20:1 до 1:1.
12. Способ по п.11, в котором указанное отношение объемов составляет от 10:1 до 1,5:1.
13. Способ по п.12, в котором указанное отношение объемов составляет от 8:1 до 2:1.
14. Способ по п.13, в котором указанное отношение объемов составляет от 6:1 до 3:1.
15. Способ по п.1, в котором указанный раствор, содержащий градиент концентрации сахара, включает в себя два слоя.
16. Способ по п.1, в котором указанный препарат инактивированного вируса или фрагментированного вируса не содержит предосветлитель.
17. Способ по п.1, в котором указанный по меньшей мере первый буферный раствор содержит сахар в диапазоне концентраций от 40 до 44 мас.% эквивалента сахарозы.
18. Способ по п.17, в котором указанный по меньшей мере первый буферный раствор содержит сахар в диапазоне концентраций от 41 до 43 мас.% эквивалента сахарозы.
19. Способ по п.1, в котором указанный по меньшей мере второй буферный раствор содержит сахар в диапазоне концентраций от 52 до 58 мас.% эквивалента сахарозы.
20. Способ по п.19, в котором указанный по меньшей мере первый буферный раствор содержит сахар в диапазоне концентраций от 54 до 56 мас.% эквивалента сахарозы.
21. Способ по п.1, в котором указанный препарат инактивированного вируса или фрагментированного вируса получен из ортомиксовируса.
22. Способ по п.21, в котором указанный препарат инактивированного вируса или фрагментированного вируса получен из вируса гриппа.
23. Способ по п.1, в котором по меньшей мере один физиологический буфер представляет собой аминный буфер.
24. Способ по п.1, в котором по меньшей мере один физиологический буфер представляет собой буфер TRIS.
25. Способ по п.1, в котором физиологический буфер представляет собой забуференный TRIS солевой раствор.
26. Способ очистки инактивированного вируса или фрагментированного вируса, включающий
получение образующего градиент раствора, содержащего градиент сахара, посредством непрерывного центрифугирования в ультрацентрифуге по меньшей мере первого буферного раствора сахара и по меньшей мере второго буферного раствора сахара,
в котором плотность первого буферного раствора составляет от 1,15 кг/л до 1,23 кг/л и плотность второго буферного раствора составляет от 1,23 кг/л до 1,32 кг/л;
добавление препарата инактивированного вируса или фрагментированного вируса к градиенту сахара,
центрифугирование препарата инактивированного вируса или фрагментированного вируса и градиента сахара для получения фракции пика и
экстракцию фракции пика для получения инактивированного вируса или фрагментированного вируса.
| US 4217418 A, 12.08.1982 | |||
| ZWERNER R.K | |||
| ET AL: "Harvesting the products of cell growth", Methods in Enzymology, Academic Press INC, San Diego, CA, US, vol | |||
| Способ окисления боковых цепей ароматических углеводородов и их производных в кислоты и альдегиды | 1921 |
|
SU58A1 |
| KRETZSCHMAR E | |||
| ET AL: "Membrane association of influenza virus matrix protein does not require specific hydrophobic domains of the viral glycoproteins", Virology, | |||
Авторы
Даты
2014-01-10—Публикация
2008-04-30—Подача