ОБЛАСТЬ ИЗОБРЕТЕНИЯ
[001] Согласно настоящему изобретению предложены композиции для перорального введения белков, состоящие из белка и по меньшей мере двух ингибиторов протеаз, а также способ их введения.
УРОВЕНЬ ТЕХНИКИ
[002] Благодаря достижениям биотехнологии, доступность биологически активных пептидов для фармацевтической промышленности значительно возросла. Тем не менее, ограничивающим фактором при разработке лекарственных средств на основе пептидов является их относительная неэффективность при пероральном приеме. Почти все лекарственные средства на основе пептидов вводят парентерально, несмотря на то, что парентеральное введение лекарственных средств на основе пептидов часто связано с низкой комплаентностью пациента.
[003] Инсулин представляет собой препарат, используемый для лечения пациентов, страдающих диабетом, и является единственным средством лечения инсулинозависимого сахарного диабета. Сахарный диабет характеризуется патологическим состоянием абсолютного или относительного недостатка инсулина, ведущего к гипергликемии, и представляет собой одну из основных угроз здоровью человека в 21 веке. Предполагают, что мировая численность страдающих диабетом людей возрастет до 220 миллионов в 2010 году и до 300 миллионов в 2025 году. Причиной диабета первого типа является в первую очередь неспособность поджелудочной железы вырабатывать инсулин. Диабет второго типа связан с недостаточной восприимчивостью организма к действию инсулина.
[004] Приблизительно 20-30% всех диабетиков используют ежедневные инъекции инсулина для поддержания уровня глюкозы. По подсчетам 10% всех диабетиков полностью зависимы от инъекций инсулина.
[005] В настоящее время, единственный путь введения инсулина - это инъекция. Ежедневная инъекция инсулина является причиной значительных страданий для пациентов. Известны случаи таких побочных эффектов, как липодистрофия в месте инъекции, липоатрофия, липогипертрофия и случайная гипогликемия. Кроме того, подкожное введение инсулина обычно не приводит к длительной тонкой регуляции метаболизма, которая в норме происходит под влиянием инсулина, секретируемого из поджелудочной железы непосредственно в печень через воротную вену.
[006] Настоящее изобретение связано с необходимостью поиска альтернативного решения для проблемы введения инсулина.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[007] Согласно одному из вариантов реализации данного изобретения предложена композиция, содержащая белок или комбинацию белков с молекулярной массой до 100000 дальтон, первый ингибитор протеазы и второй ингибитор протеазы.
[008] Согласно другому варианту реализации настоящего изобретения предложен способ перорального введения белка с молекулярной массой до 100000 дальтон субъекту, при котором значительная часть белка сохраняет свою активность после абсорбции через слизистый барьер кишечника субъекта, включающий пероральное введение субъекту фармацевтической композиции, содержащей указанный белок, первый ингибитор протеазы и второй ингибитор протеазы.
[009] Согласно другому варианту реализации настоящего изобретения предложен способ лечения сахарного диабета у субъекта, включающий пероральное введение субъекту фармацевтической композиции, содержащей инсулин, экзенатид (Exenatide) или их комбинацию, первый ингибитор протеазы и второй ингибитор протеазы, что таким образом обеспечивает лечение сахарного диабета.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
[0010] Фиг.1. представляет собой ряд столбчатых диаграмм, показывающих изменения уровня глюкозы в крови после лечения лекарственными формами согласно настоящему изобретению.
[0011] На Фиг.1A-C показано, что уровни глюкозы в крови значительно снижены у людей, принимавших лекарственную форму (3) (8 мг инсулина, 150 мг EDTA, 150000 КИЕ апротинина, 125 мг SBTI в 1 мл рыбьего жира в капсуле из мягкого геля (SwissCup)).
[0012] На Фиг.1.D-F показано, что общий инсулин крови был значительно выше особенно между 220-300 минутами у людей, принимавших лекарственную форму (3).
[0013] На Фиг.1.G-I показано, что уровни С-пептида в крови были значительно снижены у людей, принимавших лекарственную форму (3).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0014] Согласно настоящему изобретению предложены композиции и способы, включающие белок и по меньшей мере два ингибитора протеаз. Согласно другому варианту реализации настоящего изобретения предложены композиции и способы, включающие белок, первый ингибитор протеазы и второй ингибитор протеазы. Согласно другому варианту реализации настоящего изобретения предложены композиции и способы, включающие белок с молекулярной массой до 100000 дальтон, первый ингибитор протеазы и второй ингибитор протеазы.
[0015] В другом варианте реализации указанный белок согласно настоящему изобретению имеет молекулярную массу 1000-5000 дальтон. В другом варианте реализации белок согласно настоящему изобретению имеет молекулярную массу 10000-20000 дальтон. В другом варианте реализации белок согласно настоящему изобретению имеет молекулярную массу 20000-30000 дальтон. В другом варианте реализации белок согласно настоящему изобретению имеет молекулярную массу 40000-50000 дальтон. В другом варианте реализации белок согласно настоящему изобретению имеет молекулярную массу 50000-60000 дальтон. В другом варианте реализации белок согласно настоящему изобретению имеет молекулярную массу 60000-70000 дальтон. В другом варианте реализации белок согласно настоящему изобретению имеет молекулярную массу 70000-80000 дальтон. В другом варианте реализации белок согласно настоящему изобретению имеет молекулярную массу 80000-90000 дальтон. В другом варианте реализации белок согласно настоящему изобретению имеет молекулярную массу 100000-150000 дальтон. В другом варианте реализации белок согласно настоящему изобретению имеет молекулярную массу 1000-5000 дальтон.
[0016] В другом варианте реализации настоящего изобретения указанный белок имеет молекулярную массу (MW) 1-50 килодальтон (кДа). В другом варианте реализации MW составляет 1-45 кДа. В другом варианте реализации MW составляет 1-40 кДа. В другом варианте реализации MW составляет 1-35 кДа. В другом варианте реализации MW составляет 1-30 кДа. В другом варианте реализации MW составляет 1-25 кДа. В другом варианте реализации MW составляет 1-20 кДа. В другом варианте реализации MW составляет 10-50 кДа. В другом варианте реализации MW составляет 15-50 кДа. В другом варианте реализации MW составляет 10-50 кДа. В другом варианте реализации MW составляет 15-50 кДа. В другом варианте реализации MW составляет 20-50 кДа. В другом варианте реализации MW составляет 25-50 кДа. В другом варианте реализации MW составляет 30-50 кДа. В другом варианте реализации MW составляет 35-50 кДа. В другом варианте реализации MW составляет 1-100 кДа. В другом варианте реализации MW составляет 1-90 кДа. В другом варианте реализации MW составляет 1-80 кДа. В другом варианте реализации MW составляет 1-70 кДа. В другом варианте реализации MW составляет 1-60 кДа. В другом варианте реализации MW составляет 10-100 кДа. В другом варианте реализации MW составляет 15-100 кДа. В другом варианте реализации MW составляет 20-100 кДа. В другом варианте реализации MW составляет 25-100 кДа. В другом варианте реализации MW составляет 30-100 кДа. В другом варианте реализации MW составляет 10-80 кДа. В другом варианте реализации MW составляет 15-80 кДа. В другом варианте реализации MW составляет 20-80 кДа. В другом варианте реализации MW составляет 25-80 кДа. В другом варианте реализации MW составляет 30-80 кДа. Каждая из указанных возможностей представляет собой отдельный вариант реализации настоящего изобретения.
[0017] В другом варианте реализации настоящего изобретения MW составляет менее 20 кДа. В другом варианте реализации MW составляет менее 25 кДа. В другом варианте реализации MW составляет менее 30 кДа. В другом варианте реализации MW составляет менее 35 кДа. В другом варианте реализации MW составляет менее 40 кДа. В другом варианте реализации MW составляет менее 45 кДа. В другом варианте реализации MW составляет менее 50 кДа. В другом варианте MW составляет менее 55 кДа. В другом варианте реализации MW составляет менее 60 кДа. В другом варианте реализации MW составляет менее 65 кДа. В другом варианте реализации MW составляет менее 70 кДа. В другом варианте реализации MW составляет менее 75 кДа. В другом варианте реализации MW составляет менее 80 кДа. В другом варианте реализации MW составляет менее 85 кДа. В другом варианте реализации MW составляет менее 90 кДа. В другом варианте реализации MW составляет менее 95 кДа. В другом варианте реализации MW составляет менее 100 кДа.
[0018] В другом варианте реализации указанный белок согласно настоящему изобретению представляет собой инсулин. В одном из вариантов реализации инсулин, используемый в способах и композициях, согласно настоящему изобретению представляет собой инсулин человека. В другом варианте реализации инсулин представляет собой рекомбинантный инсулин. В другом варианте реализации инсулин представляет собой рекомбинантный инсулин человека. В другом варианте реализации инсулин представляет собой инсулин быка. В другом варианте реализации инсулин представляет собой инсулин свиньи. В другом варианте реализации инсулин представляет собой инсулин кита. В другом варианте реализации инсулин представляет собой комплекс инсулина и металла (например, цинковый комплекс инсулина, протамин-цинковый комплекс инсулина или глобин-цинк-инсулин).
[0019] В другом варианте реализации настоящего изобретения инсулин представляет собой инсулин Регуляр. В другом варианте реализации инсулин представляет собой быстродействующий инсулин. В другом варианте реализации инсулин представляет собой инсулин Ленте. В другом варианте реализации инсулин представляет собой инсулин Семиленте. В другом варианте реализации инсулин представляет собой инсулин Ультраленте. В другом варианте реализации инсулин представляет собой инсулин NPH. В другом варианте инсулин представляет собой инсулин Гларгин. В другом варианте реализации инсулин представляет собой инсулин Лизпро. В другом варианте реализации инсулин представляет собой инсулин Аспарт. В другом варианте реализации инсулин представляет собой комбинацию двух или более вариантов инсулина, указанных выше. В другом варианте реализации инсулин представляет собой любой из типов инсулина известных в данной области техники. Каждая из указанных возможностей представляет собой отдельный вариант реализации настоящего изобретения.
[0020] В одном из вариантов реализации настоящего изобретения количество инсулина, используемого в способах и композициях согласно настоящему изобретению, составляет для человека 0,5-3 единиц (ед.). В одном из вариантов реализации указанные единицы, используемые для дозирования инсулина в способах и композициях согласно настоящему изобретению, представляют собой единицы инсулина USP. В одном из вариантов единицы, используемые для дозирования инсулина, представляют собой миллиграммы. В другом варианте реализации одна международная единица (ME) инсулина эквивалентна 45,5 мг инсулина.
[0021] В другом варианте реализации настоящего изобретения указанное количество инсулина составляет 0,1-1 ед./кг. В другом варианте реализации указанное количество составляет 0,3-1 ед./кг. В другом варианте реализации указанное количество составляет 0,3-1 ед./кг. В другом варианте реализации указанное количество составляет 0,5-1 ед./кг. В другом варианте реализации указанное количество составляет 0,1-2 ед./кг. В другом варианте реализации указанное количество составляет 0,2-2 ед./кг. В другом варианте реализации указанное количество составляет 0,3-2 ед./кг. В другом варианте реализации указанное количество составляет 0,5-2 ед./кг. В другом варианте реализации указанное количество составляет 0,7-2 ед./кг. В другом варианте реализации указанное количество составляет 1-2 ед./кг. В другом варианте указанное количество составляет 1,2-2 ед./кг. В другом варианте реализации указанное количество составляет 1-1,2 ед./кг. В другом варианте реализации указанное количество составляет 1-1,5 ед./кг. В другом варианте реализации указанное количество составляет 1-2,5 ед./кг. В другом варианте реализации указанное количество составляет 1-3 ед./кг. В другом варианте реализации указанное количество составляет 2-3 ед./кг. В другом варианте реализации указанное количество составляет 1-5 ед./кг. В другом варианте реализации указанное количество составляет 2-5 ед./кг. В другом варианте реализации указанное количество составляет 3-5 ед./кг.
[0022] В другом варианте реализации настоящего изобретения указанное количество инсулина составляет 0,1 ед./кг. В другом варианте реализации указанное количество составляет 0,2 ед./кг. В другом варианте реализации указанное количество составляет 0,3 ед./кг. В другом варианте реализации указанное количество составляет 0,4 ед./кг. В другом варианте реализации указанное количество составляет 0,5 ед./кг. В другом варианте реализации указанное количество составляет 0,6 ед./кг. В другом варианте реализации указанное количество составляет 0,8 ед./кг. В другом варианте реализации указанное количество составляет 1 ед./кг. В другом варианте реализации указанное количество составляет 1,2 ед./кг. В другом варианте реализации указанное количество составляет 1,4 ед./кг. В другом варианте реализации указанное количество составляет 1,6 ед./кг. В другом варианте у реализации казанное количество составляет 1,8 ед./кг. В другом варианте указанное количество составляет 2 ед./кг. В другом варианте реализации указанное количество составляет 2,2 ед./кг. В другом варианте реализации указанное количество составляет 2,5 ед./кг. В другом варианте реализации указанное количество составляет 3 ед./кг.
[0023] В другом варианте реализации настоящего изобретения указанное количество инсулина составляет 1-10 ед. В другом варианте реализации указанное количество составляет 2-10 ед. В другом варианте реализации указанное количество составляет 3-10 ед. В другом варианте реализации указанное количество составляет 5-10 ед. В другом варианте реализации указанное количество составляет 1-20 ед. В другом варианте реализации указанное количество составляет 2-20 ед. В другом варианте реализации указанное количество составляет 3-20 ед. В другом варианте реализации указанное количество составляет 5-20 ед. В другом варианте реализации указанное количество составляет 7-20 ед. В другом варианте реализации указанное количество составляет 10-20 ед. В другом варианте реализации указанное количество составляет 12-20 ед. В другом варианте реализации указанное количество составляет 10-12 ед. В другом варианте реализации указанное количество составляет 10-15 ед. В другом варианте реализации указанное количество составляет 10-25 ед. В другом варианте реализации указанное количество составляет 10-30 ед. В другом варианте реализации указанное количество составляет 20-30 ед. В другом варианте реализации указанное количество составляет 10-50 ед. В другом варианте реализации указанное количество составляет 20-50 ед. В другом варианте реализации указанное количество составляет 30-50 ед. В другом варианте реализации указанное количество составляет 20-100 ед. В другом варианте реализации указанное количество составляет 30-100 ед. В другом варианте реализации указанное количество составляет 100-150 ед. В другом варианте реализации указанное количество составляет 100-250 ед. В другом варианте реализации указанное количество составляет 100-300 ед. В другом варианте реализации указанное количество составляет 200-300 ед. В другом варианте реализации указанное количество составляет 100-500 ед. В другом варианте указанное количество составляет 200-500 ед. В другом варианте реализации указанное количество составляет 300-500 ед. В другом варианте реализации указанное количество составляет 200-1000 ед. В другом варианте реализации указанное количество составляет 300-1000 ед.
[0024] Согласно другому варианту реализации настоящего изобретения указанное количество инсулина составляет 1 ед. В другом варианте реализации указанное количество составляет 2 ед. В другом варианте реализации указанное количество составляет 3 ед. В другом варианте реализации указанное количество составляет 4 ед. В другом варианте реализации указанное количество составляет 5 ед. В другом варианте реализации указанное количество составляет 6 ед. В другом варианте реализации указанное количество составляет 8 ед. В другом варианте реализации указанное количество составляет 10 ед. В другом варианте реализации указанное количество составляет 12 ед. В другом варианте реализации указанное количество составляет 14 ед. В другом варианте реализации указанное количество составляет 16 ед. В другом варианте реализации указанное количество составляет 18 ед. В другом варианте реализации указанное количество составляет 20 ед. В другом варианте реализации указанное количество составляет 22 ед. В другом варианте реализации указанное количество составляет 25 ед. В другом варианте реализации указанное количество составляет 30 ед. В другом варианте реализации указанное количество составляет 50 ед. В другом варианте реализации указанное количество составляет 80 ед. В другом варианте реализации указанное количество составляет 100 ед. В другом варианте реализации указанное количество составляет 120 ед. В другом варианте реализации указанное количество составляет 140 ед. В другом варианте реализации указанное количество составляет 160 ед. В другом варианте реализации указанное количество составляет 180 ед. В другом варианте реализации указанное количество составляет 200 ед. В другом варианте реализации указанное количество составляет 300 ед. В другом варианте реализации указанное количество составляет 500 ед.
[0025] Согласно другому варианту реализации настоящего изобретения указанный белок представляет собой экзенатид. В другом варианте реализации пероральные лекарственные формы согласно настоящему изобретению предохраняют экзенатид от разрушения в желудке. В другом варианте реализации лекарственная форма экзенатида согласно данному изобретению контролирует уровень сахара в крови. В другом варианте реализации лекарственная форма экзенатида согласно данному изобретению крови способствует контролю уровня сахара в крови. В другом варианте реализации лекарственная форма экзенатида согласно данному изобретению индуцирует выработку инсулина поджелудочной железой. В другом варианте реализации лекарственную форму экзенатида согласно данному изобретению применяют для лечения диабета второго типа (инсулиннезависимого). В другом варианте реализации лекарственную форму экзенатида согласно данному изобретению применяют совместно с другими противодиабетическими препаратами.
[0026] В другом варианте реализации настоящего изобретения количество экзенатида в лекарственной форме согласно данной заявке составляет от 10 мкг до 1 мг. В другом варианте реализации количество экзенатида в лекарственной форме согласно данной заявке составляет от 10 мкг до 25 мкг. В другом варианте реализации количество экзенатида в лекарственной форме согласно данной заявке составляет от 25 мкг до 50 мкг. В другом варианте реализации количество экзенатида в лекарственной форме согласно данной заявке составляет от 50 мкг до 60 мкг. В другом варианте реализации количество экзенатида в лекарственной форме согласно данной заявке составляет от 60 мкг до 70 мкг. В другом варианте реализации количество экзенатида в лекарственной форме согласно данной заявке составляет от 70 мкг до 80 мкг. В другом варианте реализации количество экзенатида в лекарственной форме согласно данной заявке составляет от 80 мкг до 90 мкг. В другом варианте реализации количество экзенатида в лекарственной форме согласно данной заявке составляет от 90 мкг до 100 мкг. В другом варианте реализации количество экзенатида в лекарственной форме согласно данной заявке составляет от 100 мкг до 110 мкг. В другом варианте реализации количество экзенатида в лекарственной форме согласно данной заявке составляет от 110 мкг до 125 мкг. В другом варианте реализации количество экзенатида в лекарственной форме согласно данной заявке составляет от 125 мкг до 150 мкг. В другом варианте реализации количество экзенатида в лекарственной форме согласно данной заявке составляет от 150 мкг до 175 мкг. В другом варианте реализации количество экзенатида в лекарственной форме согласно данной заявке составляет от 175 мкг до 200 мкг. В другом варианте реализации количество экзенатида в лекарственной форме согласно данной заявке составляет от 200 мкг до 220 мкг. В другом варианте реализации количество экзенатида в лекарственной форме согласно данной заявке составляет от 220 мкг до 240 мкг. В другом варианте реализации количество экзенатида в лекарственной форме согласно данной заявке составляет от 240 мкг до 260 мкг. В другом варианте реализации количество экзенатида в лекарственной форме согласно данной заявке составляет от 260 мкг до 300 мкг.
[0027] В другом варианте реализации настоящего изобретения количество экзенатида в лекарственной форме согласно данной заявке составляет от 300 мкг до 350 мкг. В другом варианте реализации количество экзенатида в лекарственной форме согласно данной заявке составляет от 350 мкг до 400 мкг. В другом варианте реализации количество экзенатида в лекарственной форме согласно данной заявке составляет от 400 мкг до 450 мкг. В другом варианте реализации количество экзенатида в лекарственной форме согласно данной заявке составляет от 450 мкг до 500 мкг. В другом варианте реализации количество экзенатида в лекарственной форме согласно данной заявке составляет от 550 мкг до 600 мкг. В другом варианте реализации количество экзенатида в лекарственной форме согласно данной заявке составляет от 600 мкг до 700 мкг. В другом варианте реализации количество экзенатида в лекарственной форме согласно данной заявке составляет от 700 мкг до 800 мкг. В другом варианте реализации количество экзенатида в лекарственной форме согласно данной заявке составляет от 800 мкг до 900 мкг. В другом варианте реализации количество экзенатида в лекарственной форме согласно данной заявке составляет от 900 мкг до 1 мг.
[0028] В другом варианте реализации настоящего изобретения лекарственную форму, содержащую экзенатид, согласно данной заявке принимают 1 раз в день. В другом варианте реализации лекарственную форму, содержащую экзенатид, согласно данной заявке принимают 2 раза в день. В другом варианте реализации лекарственную форму, содержащую экзенатид, согласно данной заявке принимают 3 раза в день. В другом варианте реализации лекарственную форму, содержащую экзенатид, согласно данной заявке принимают 4 раза в день. В другом варианте реализации лекарственную форму, содержащую экзенатид, согласно данной заявке принимают 5 раз в день. В другом варианте реализации дозировку лекарственной формы, содержащей экзенатид, согласно данной заявке определяет специалист. В другом варианте реализации ежедневную дозу лекарственной формы, содержащей экзенатид, согласно данной заявке определяет специалист. В другом варианте реализации ежедневный режим дозирования лекарственной формы, содержащей экзенатид, согласно данной заявке определяет специалист.
[0029] В другом варианте реализации настоящего изобретения лекарственную форму, содержащую экзенатид, согласно данной заявке принимают по меньшей мере за 15 минут до еды. В другом варианте реализации лекарственную форму, содержащую экзенатид, согласно данной заявке принимают по меньшей мере за 30 минут до еды. В другом варианте реализации лекарственную форму, содержащую экзенатид, согласно данной заявке принимают по меньшей мере за 45 минут до еды. В другом варианте реализации лекарственную форму, содержащую экзенатид, согласно данной заявке принимают по меньшей мере за 60 минут до еды. В другом варианте реализации лекарственную форму, содержащую экзенатид, согласно данной заявке принимают по меньшей мере за 75 минут до еды. В другом варианте реализации лекарственную форму, содержащую экзенатид, согласно данной заявке принимают по меньшей мере за 90 минут до еды. В другом варианте реализации лекарственную форму, содержащую экзенатид, согласно данной заявке принимают по меньшей мере за 100 минут до еды. В другом варианте реализации лекарственную форму, содержащую экзенатид, согласно данной заявке принимают по меньшей мере за 120 минут до еды. В другом варианте реализации лекарственную форму, содержащую экзенатид, согласно данной заявке принимают по меньшей мере за 150 минут до еды. В другом варианте реализации лекарственную форму, содержащую экзенатид, согласно данной заявке принимают по меньшей мере за 180 минут до еды.
[0030] В другом варианте реализации настоящего изобретения лекарственная форма, содержащая экзенатид, согласно данной заявке уменьшает побочные эффекты, связанные с применением инъекционной лекарственной формой, содержащей экзенатид. В другом варианте реализации лекарственная форма, содержащая экзенатид, согласно данной заявке уменьшает тошноту, которая представляет собой побочный эффект, связанный с применением инъекционной лекарственной формы, содержащей экзенатид. В другом варианте реализации лекарственная форма, содержащая экзенатид, согласно данной заявке не вызывает тошноту, которая представляет собой побочный эффект, связанный с инъекционной лекарственной формой, содержащей экзенатид.
[0031] Согласно данной заявке ингибиторы протеаз предохраняют белок согласно настоящему изобретению от расщепления. Согласно другому варианту реализации, указанные ингибиторы протеаз предохраняют от расщепления инсулин согласно настоящему изобретению. Согласно другому варианту реализации настоящего изобретения, ингибиторы протеаз способствуют абсорбции белка в кишечнике субъекта. Согласно другому варианту реализации настоящего изобретения, ингибиторы протеаз способствуют абсорбции инсулина в кишечнике субъекта.
[0032] В другом варианте реализации настоящего изобретения предложено применение более чем двух ингибиторов протеаз в рамках одной композиции или способа. Согласно другому варианту реализации настоящего изобретения, указанные первый и второй ингибиторы протеаз представляют собой серпины. Другой вариант реализации настоящего изобретения предполагает, что серпины представляют собой ингибиторы трипсина. Другой вариант реализации настоящего изобретения предполагает, что указанные первый и второй ингибиторы протеаз представляют собой серпины, такие как, но не ограничиваясь перечисленными: альфа-1-антитрипсин, родственный антитрипсину белок, альфа-1-антихимотрипсин, каллистатин, ингибитор С-белка, кортизол-связывающий глобулин, тироксин-связывающий глобулин, ангиотензиноген, центерин, родственный Z-белку ингибитор протеазы, васпин, моноцитарно-нейтрофильный ингибитор эластазы, ингибитор-2 активатора плазминогена, антиген-1 чешуйчатой клеточной карциномы (SCCA-1), антиген-2 чешуйчатой клеточной карциномы (SCCA-2), маспин, PI-6, мегзин, PI-8, PI-9, бомапин, юкопин, хурпин/хедпин, антитромбин, кофактор II гепарина, ингибитор-1 активатора плазминогена, нексин глиального происхождения/Protease nexin I, фактор из пигментного эпителия (Pigment epithelium derived factor), альфа-2-антиплазмин, ингибитор С1 компонента комплемента, 47 кДа белок теплового шока (HSP47), нейросерпин или pancpin.
[0033] Согласно другому варианту реализации настоящего изобретения, указанные первый и второй ингибиторы протеаз представляют собой ингибиторы трипсина, такие как, но не ограничиваясь перечисленными: ингибитор трипсина из бобов Лимы, апротинин, ингибитор трипсина из бобов сои (SBTI) или овомукоид. Согласно другому варианту реализации настоящего изобретения, указанные первый и второй ингибиторы протеаз представляют собой ингибитор трипсина из бобов и апротинин. Другой вариант реализации настоящего изобретения предполагает, что указанные первый и второй ингибиторы протеаз представляют собой ингибитор трипсина из Бобов Лимы и ингибитор трипсина из бобов сои (SBTI). Другой вариант реализации настоящего изобретения предполагает, что указанные первый и второй ингибиторы протеаз представляют собой ингибитор трипсина из бобов Лимы и овомукоид. Другой вариант реализации настоящего изобретения предполагает, что указанные первый и второй ингибиторы протеаз представляют собой апротинин и ингибитор трипсина из бобов сои (SBTI). Другой вариант реализации настоящего изобретения предполагает, что указанные первый и второй ингибиторы протеаз представляют собой апротинин и овомукоид. Другой вариант реализации настоящего изобретения предполагает, что указанные первый и второй ингибиторы протеаз представляют собой ингибитор трипсина из бобов сои (SBTI) и овомукоид. Другой вариант реализации настоящего изобретения предполагает, что первый ингибитор протеазы представляет собой ингибитор Кунитц (kunitz). Другой вариант реализации настоящего изобретения предполагает, что второй ингибитор протеазы представляет собой kunitz. Другой вариант реализации настоящего изобретения предполагает, что первый ингибитор протеазы представляет собой ингибитор протеазы Бауман-Бирка (BBI). Другой вариант реализации настоящего изобретения предполагает, что второй ингибитор протеазы представляет собой ингибитор протеазы Бауман-Бирка (BBI).
[0034] Согласно другому варианту реализации настоящего изобретения, указанный первый ингибитор протеазы представляет собой серпин, а указанный второй ингибитор протеазы представляет собой ингибитор цистеиновой протеазы. Другой вариант реализации настоящего изобретения предполагает, что ингибитор цистеиновой протеазы согласно данному изобретению включает в том числе: цистатин, цистатины типа 1 (или стефины), цистатины типа 2, цистатины человека С, D, S, SN и SA, цистатин E/M, цистатин F, цистатины типа 3 или кининогены.
[0035] Согласно другому варианту реализации настоящего изобретения, указанный первый ингибитор протеазы представляет собой серпин, а указанный второй ингибитор протеазы представляет собой ингибитор треониновой протеазы. Согласно другому варианту реализации настоящего изобретения, ингибитор треониновой протеазы согласно данному изобретению включает в том числе: бортезомиб (Bortezomib), MLN-519, ER-807446 и ТМС-95А.
[0036] Согласно другому варианту реализации настоящего изобретения, указанный первый ингибитор протеазы представляет собой серпин, а указанный второй ингибитор протеазы представляет собой ингибитор аспартат-протеазы. Согласно другому варианту реализации настоящего изобретения, ингибитор аспартат-протеазы согласно данному изобретению включает в том числе: α2-макроглобулин, пепстатин А, ингибитор аспартат-протеазы 11, ингибитор аспартат-протеазы 1, ингибитор аспартат-протеазы 2, ингибитор аспартат-протеазы 3, ингибитор аспартат-протеазы 4, ингибитор аспартат-протеазы 5, ингибитор аспартат- протеазы 6, ингибитор аспартат-протеазы 7, ингибитор аспартат-протеазы 8, ингибитор аспартат-протеазы 9, ингибитор пепсина Dit33, ингибитор аспартиловой протеазы или ингибитор 3 Протеазы А.
[0037] Согласно другому варианту реализации настоящего изобретения, указанный первый ингибитор протеазы представляет собой серпин, а указанный второй ингибитор протеазы представляет собой ингибитор металлопротеазы. Согласно другому варианту реализации настоящего изобретения, ингибитор металлопротеазы согласно данному изобретению включает в том числе: ингибиторный пептид ангиотензин-1-превращающего фермента, антигеморрагический фактор BJ46a, бета-казеин, ингибитор протеиназы, обозначаемый CeKI, ингибитор протеазы DM43 из яда животных, ингибитор карбоксипептидазы A, smpI, IMPI, щелочную протеиназу, inh, латексин, ингибитор карбоксипептидазы, антигеморрагический фактор HSF, Testican-3, SPOCK3, TIMP1, ингибитор 1 металлопротеиназы, ингибитор 2 металлопротеиназы, TIMP2, ингибитор 3 металлопротеиназы, TIMP3, ингибитор 4 металлопротеиназы, TIMP4, предполагаемый ингибитор металлопротеиназы, обозначаемый tag-225, тканевой ингибитор металлопротеиназы, WAP, kazal, иммуноглобулин или kunitz и белок 1, содержащий NTR домен.
[0038] Согласно другому варианту реализации настоящего изобретения, указанный первый ингибитор протеазы представляет собой ингибитор цистеиновой протеазы, а указанный второй ингибитор протеазы представляет собой ингибитор металлопротеазы. Согласно другому варианту реализации настоящего изобретения, указанный первый ингибитор протеазы представляет собой ингибитор цистеиновой протеазы, а указанный второй ингибитор протеазы представляет собой ингибитор трипсина. Согласно другому варианту реализации настоящего изобретения, указанный первый ингибитор протеазы представляет собой ингибитор цистеиновой протеазы, а указанный второй ингибитор протеазы представляет собой ингибитор треониновой протеазы. Согласно другому варианту реализации настоящего изобретения, указанный первый ингибитор протеазы представляет собой ингибитор цистеиновой протеазы, а указанный второй ингибитор протеазы представляет собой ингибитор аспартат-протеазы. Согласно другому варианту реализации настоящего изобретения, указанный первый ингибитор протеазы представляет собой ингибитор цистеиновой протеазы, а указанный второй ингибитор протеазы представляет собой ингибитор металлопротеазы. Согласно другому варианту реализации настоящего изобретения, указанный первый ингибитор протеазы представляет собой ингибитор трипсина, а указанный второй ингибитор протеазы представляет собой ингибитор металлопротеазы. Согласно другому варианту реализации настоящего изобретения, что указанный первый ингибитор протеазы представляет собой ингибитор трипсина, а указанный второй ингибитор протеазы представляет собой ингибитор треониновой протеазы. Согласно другому варианту реализации настоящего изобретения, указанный первый ингибитор протеазы представляет собой ингибитор трипсина, а указанный второй ингибитор протеазы представляет собой ингибитор треониновой протеазы. Согласно другому варианту реализации настоящего изобретения, указанный первый ингибитор протеазы представляет собой ингибитор трипсина, а указанный второй ингибитор протеазы представляет собой ингибитор аспартат-протеазы. Согласно другому варианту реализации настоящего изобретения, указанный первый ингибитор протеазы представляет собой ингибитор трипсина, а указанный второй ингибитор протеазы представляет собой ингибитор металлопротеазы. Другой вариант реализации настоящего изобретения предполагает, что указанный первый ингибитор протеазы представляет собой ингибитор аспартат-протеазы, а указанный второй ингибитор протеазы представляет собой ингибитор металлопротеазы. Другой вариант реализации настоящего изобретения предполагает, что указанный первый ингибитор протеазы представляет собой ингибитор аспартат-протеазы, а указанный второй ингибитор протеазы представляет собой ингибитор треониновой протеазы. Другой вариант реализации настоящего изобретения предполагает, что указанный первый ингибитор протеазы представляет собой ингибитор аспартат-протеазы, а указанный второй ингибитор протеазы представляет собой ингибитор металлопротеазы.
[0039] Согласно другому варианту реализации настоящего изобретения, указанный первый ингибитор протеазы представляет собой ингибитор цистеиновой протеазы. Другой вариант реализации настоящего изобретения предполагает, что указанный первый ингибитор протеазы представляет собой ингибитор металлопротеазы. Другой вариант реализации настоящего изобретения предполагает, что указанный первый ингибитор протеазы представляет собой ингибитор трипсина. Другой вариант реализации настоящего изобретения предполагает, что указанный первый ингибитор протеазы представляет собой ингибитор треониновой протеазы. Другой вариант реализации настоящего изобретения предполагает, что указанный первый ингибитор протеазы представляет собой ингибитор аспартат-протеазы. Другой вариант реализации настоящего изобретения предполагает, что указанный первый ингибитор протеазы представляет собой ингибитор металлопротеазы. Другой вариант реализации настоящего изобретения предполагает, что указанный второй ингибитор протеазы представляет собой ингибитор трипсина. Другой вариант реализации настоящего изобретения предполагает, что указанный второй ингибитор протеазы представляет собой ингибитор металлопротеазы. Другой вариант реализации настоящего изобретения предполагает, что указанный второй ингибитор протеазы представляет собой ингибитор аспартат-протеазы.
[0040] В некоторых вариантах реализации настоящего изобретения указанные ингибиторы протеаз включают "суицидный" ингибитор, ингибитор переходного состояния или хелатирующие агенты. В некоторых вариантах реализации указанные первый и второй ингибиторы протеаз согласно настоящему изобретению включают любую комбинацию двух различных ингибиторов протеаз, таких как, но не ограничиваясь перечисленными: AEBSF-HCl, эпсилон-аминокапроновая кислота, альфа-1-антихимотрипсин, антипаин, антитромбин III, альфа-1-антитрипсин ([альфа] 1-ингибитор протеиназы), APMSF-HCl (4-амидинофенил-метан сульфонил-фторид), спротинин, бензамидин-HCl, химостатин, DFP (диизопропилфторфосфат), лейпептин, PEFABLOC® SC (4-(2-аминоэтил)-бензолсульфонилфторида гидрохлорид), PMSF (фенилметил сульфонил-фторид), TLCK (1-хлор-3-тозиламидо-7-амино-2-гептанон HCl), ТРСК (1-хлор-3-тозиламидо-4-фенил-2-бутанон), овомукоид, ингибитор трипсина из бобов сои, апротинин, пентамидина изетионат, пепстатин, гуанидий, альфа-2-макроглобулин, хелатирующий агент цинка, йодацетат, цинк. Каждая из указанных возможностей представляет собой отдельный вариант реализации настоящего изобретения.
[0041] В другом варианте реализации настоящего изобретения лекарственная форма, содержащая описанную выше комбинацию ингибиторов протеаз, содержит апротинин и BBI. В другом варианте реализации лекарственная форма, содержащая описанную выше комбинацию ингибиторов протеаз, содержит апротинин и kunitz. В другом варианте реализации лекарственная форма, содержащая описанную выше комбинацию ингибиторов протеаз, содержит BBI и kunitz. В другом варианте реализации лекарственная форма, содержащая описанную выше комбинацию ингибиторов протеаз согласно вышеуказанному, содержит SBTI и BBI. В другом варианте реализации лекарственная форма, содержащая описанную выше комбинацию ингибиторов протеаз, содержит kunitz и SBTI.
[0042] В другом варианте реализации настоящего изобретения количество указанных первого или второго ингибитора протеазы, которые применяют в способах и композициях согласно настоящему изобретению, составляет 0,1 мг на лекарственную форму. В другом варианте реализации указанное количество ингибитора протеазы составляет 0,2 мг на лекарственную форму. В другом варианте реализации указанное количество составляет 0,3 мг на лекарственную форму. В другом варианте реализации указанное количество составляет 0,4 мг на лекарственную форму. В другом варианте реализации указанное количество составляет 0,6 мг на лекарственную форму. В другом варианте реализации указанное количество составляет 0,8 мг на лекарственную форму. В другом варианте реализации указанное количество составляет 1 мг на лекарственную форму. В другом варианте реализации указанное количество составляет 1,5 мг на лекарственную форму. В другом варианте реализации указанное количество составляет 2 мг на лекарственную форму. В другом варианте реализации указанное количество составляет 2,5 мг на лекарственную форму. В другом варианте реализации указанное количество составляет 3 мг на лекарственную форму. В другом варианте реализации указанное количество составляет 5 мг на лекарственную форму. В другом варианте реализации указанное количество составляет 10 мг на лекарственную форму. В другом варианте реализации указанное количество составляет 12 мг на лекарственную форму. В другом варианте реализации указанное количество составляет 15 мг на лекарственную форму. В другом варианте реализации указанное количество составляет 20 мг на лекарственную форму. В другом варианте реализации указанное количество составляет 30 мг на лекарственную форму. В другом варианте реализации указанное количество составляет 50 мг на лекарственную форму. В другом варианте реализации указанное количество составляет 70 мг на лекарственную форму. В другом варианте реализации указанное количество составляет 100 мг на лекарственную форму.
[0043] В другом варианте реализации настоящего изобретения указанное количество первого или второго ингибитора протеазы составляет 0,1-1 мг на лекарственную форму. В другом варианте реализации указанное количество ингибитора протеазы составляет 0,2-1 мг на лекарственную форму. В другом варианте реализации указанное количество составляет 0,5-1 мг на лекарственную форму. В другом варианте реализации указанное количество составляет 0,1-2 мг на лекарственную форму. В другом варианте реализации указанное количество составляет 0,2-2 мг на лекарственную форму. В другом варианте реализации указанное количество составляет 0,3-2 мг на лекарственную форму. В другом варианте реализации указанное количество составляет 0,5-2 мг на лекарственную форму. В другом варианте реализации указанное количество составляет 1-2 мг на лекарственную форму. В другом варианте реализации указанное количество составляет 1-10 мг лекарственную форму. В другом варианте реализации указанное количество составляет 2-10 мг на лекарственную форму. В другом варианте реализации указанное количество составляет 3-10 мг на лекарственную форму. В другом варианте реализации указанное количество составляет 5-10 мг на лекарственную форму. В другом варианте реализации указанное количество составляет 1-20 мг на лекарственную форму. В другом варианте реализации указанное количество составляет 2-20 мг на лекарственную форму. В другом варианте реализации указанное количество составляет 3-20 мг на лекарственную форму. В другом варианте реализации указанное количество составляет 5-20 мг на лекарственную форму. В другом варианте реализации указанное количество составляет 10-20 мг на лекарственную форму. В другом варианте реализации указанное количество составляет 10-100 мг на лекарственную форму. В другом варианте реализации указанное количество составляет 20-100 мг на лекарственную форму. В другом варианте реализации указанное количество составляет 30-100 мг на лекарственную форму. В другом варианте реализации указанное количество составляет 50-100 мг на лекарственную форму. В другом варианте реализации указанное количество составляет 10-200 мг на лекарственную форму. В другом варианте реализации указанное количество составляет 20-200 мг на лекарственную форму. В другом варианте реализации указанное количество составляет 30-200 мг на лекарственную форму. В другом варианте реализации указанное количество составляет 50-200 мг на лекарственную форму. В другом варианте реализации указанное количество составляет 100-200 мг на лекарственную форму.
[0044] В другом варианте реализации настоящего изобретения количество первого или второго ингибитора протеазы, которые применяют в способах и композициях согласно настоящему изобретению, составляет 1000 КИЕ (калликреин инактивирующих единиц) на таблетку. В другом варианте реализации указанное количество составляет 10 КИЕ на лекарственную форму. В другом варианте реализации указанное количество составляет 12 КИЕ на лекарственную форму. В другом варианте реализации указанное количество составляет 20 КИЕ на лекарственную форму. В другом варианте реализации указанное количество составляет 30 КИЕ на лекарственную форму. В другом варианте реализации указанное количество составляет 40 КИЕ на лекарственную форму. В другом варианте реализации указанное количество составляет 50 КИЕ на лекарственную форму. В другом варианте реализации указанное количество составляет 70 КИЕ на лекарственную форму. В другом варианте реализации указанное количество составляет 100 КИЕ на лекарственную форму. В другом варианте реализации указанное количество составляет 150 КИЕ на лекарственную форму. В другом варианте реализации указанное количество составляет 200 КИЕ на лекарственную форму. В другом варианте реализации указанное количество составляет 300 КИЕ на лекарственную форму. В другом варианте реализации указанное количество составляет 500 КИЕ на лекарственную форму. В другом варианте реализации указанное количество составляет 700 КИЕ на лекарственную форму. В другом варианте реализации указанное количество составляет 1500 КИЕ на лекарственную форму. В другом варианте реализации указанное количество составляет 3000 КИЕ на лекарственную форму. В другом варианте реализации указанное количество составляет 4000 КИЕ на лекарственную форму. В другом варианте реализации указанное количество составляет 5000 КИЕ на лекарственную форму. Каждое указанное количество первого или второго ингибитора протеазы представляет собой отдельный вариант реализации настоящего изобретения.
[0045] В некоторых вариантах реализации настоящего изобретения омега-3 жирная кислота может быть получена из растительных источников, таких как семена чиа, периллы, льна, грецкого ореха, перслейна, брусники, облепихи и конопли. В некоторых вариантах омега-3 жирные кислоты могут также быть получены из плодов пальмы асаи. В другом варианте реализации омега-3 жирную кислоту обеспечивают в форме синтетической омега-3 жирной кислоты. В одном из вариантов реализации омега-3 жирная кислота, используемая в способах и композициях согласно настоящему изобретению, предложена для композиции в форме рыбьего жира. В другом варианте реализации омега-3 жирную кислоту обеспечивают в форме масла канолы. В другом варианте реализации омега-3 жирную кислоту обеспечивают в форме масла семян льна. В другом варианте реализации омега-3 жирную кислоту обеспечивают в форме любого другого источника богатого омега-3 жирной кислотой известного в данной отрасли. В другом варианте реализации омега-3 жирную кислоту обеспечивают в форме синтетической омега-3 жирной кислоты. Каждая форма омега-3 жирных кислот представляет собой отдельный вариант реализации настоящего изобретения.
[0046] В другом варианте реализации реализации омега-3 жирная кислота, которую применяют в способах и композициях согласно настоящему изобретению, представляет собой омега-3 полиненасыщенную жирную кислоту. В другом варианте реализации омега-3 жирная кислота представляет собой DHA, омега-3 полиненасыщенную жирную кислоту, состоящую из 22-х атомов углерода, называемую также 4,7,10,13,16,19-докосагексаеновой кислотой. В другом варианте реализации омега-3 жирная кислота представляет собой α-линоленовую кислоту (9,12,15-октадекатриеновую кислоту). В другом варианте реализации омега-3 жирная кислота представляет собой стеаридоновую кислоту (6,9,12,15-октадекатетраеновую кислоту). В другом варианте реализации омега-3 жирная кислота представляет собой эйкозатриеновую кислоту (ЕТА; 11,14,17-эйкозатриеновую кислоту). В другом варианте реализации омега-3 жирная кислота представляет собой эйкозатетраеновую кислоту (8,11,14,17-эйкозатетраеновую кислоту). В одном из вариантов омега-3 жирная кислота представляет собой эйкозапентаеновую кислоту (ЕРА; 5,8,11,14,17-эйкозапентаеновую кислоту). В другом варианте реализации омега-3 жирная кислота представляет собой эйкозагексаеновую кислоту (обозначаемую также "ЕРА"; 5,7,9,11,14,17-эйкозагексаеновую кислоту). В другом варианте реализации омега-3 жирная кислота представляет собой докосапентаеновую кислоту (DPA; 7,10,13,16,19-докосапентаеновую кислоту). В другом варианте реализации омега-3 жирная кислота представляет собой тетракосагексаеновую кислоту (6,9,12,15,18,21-тетракосагексаеновую кислоту). В другом варианте реализации омега-3 жирная кислота представляет собой любую другую омега-3 жирную кислоту известную в данной отрасли. Каждая форма омега-3 жирной кислоты представляет собой отдельный вариант реализации настоящего изобретения.
[0047] В другом варианте реализации композиции согласно настоящему изобретению дополнительно содержат вещество, которое увеличивает абсорбцию белка согласно данному изобретению через слизистый барьер кишечника. В другом варианте реализации композиции согласно настоящему изобретению дополнительно содержат вещество, которое увеличивает абсорбцию инсулина через слизистый барьер кишечника. В другом варианте реализации композиции согласно настоящему изобретению дополнительно содержат вещество, которое увеличивает абсорбцию экзенатида через слизистый барьер кишечника. В другом варианте реализации композиции согласно настоящему изобретению дополнительно содержат вещество, которое уменьшает разрушение экзенатида в системе пищеварения. В другом варианте реализации композиции согласно настоящему изобретению дополнительно содержат вещество, которое уменьшает деградацию экзенатида в желудке. В другом варианте реализации композиции согласно настоящему изобретению дополнительно содержат вещество, которое уменьшает деградацию экзенатида в кишечнике. Такое вещество согласно данной заявке называют "энхансер". Согласно данной заявке энхансеры при использовании совместно с омега-3 жирными кислотами или ингибиторами протеаз увеличивают способность белка к абсорбции в кишечнике. Согласно данной заявке энхансеры при использовании совместно с омега-3 жирными кислотами и/или ингибиторами протеаз увеличивают способность инсулина к абсорбции в кишечнике. Согласно данной заявке энхансеры при использовании совместно с омега-3 жирными кислотами и/или ингибиторами протеаз увеличивают способность экзенатида к абсорбции в кишечнике.
[0048] В одном из вариантов реализации настоящего изобретения указанный энхансер представляет собой дидеканоилфосфатидилхолин (DDPC). В одном из вариантов указанный энхансер представляет собой хелатирующий агент, такие как этилендиаминтетрауксусная кислота (EDTA) или эгтазовая, этиленгликольтетрауксусная кислота (EGTA). В другом варианте реализации EDTA представляет собой натрий-EDTA. В некоторых вариантах указанный энхансер представляет собой донор NO. В некоторых вариантах энхансер представляет собой желчную кислоту, желчную кислоту, конъюгированную с глицином, или соль щелочного металла желчной кислоты. В одном из вариантов реализации увеличение абсорбции достигают путем использования комбинации α-галактозидазы и β-мананазы. В некоторых вариантах указанный энхансер представляет собой жирную кислоту, такую как натриевая соль капроновой кислоты. В одном из вариантов реализации указанный энхансер представляет собой гликохолат натрия. В одном из вариантов реализации энхансер представляет собой салицилат натрия. В одном из вариантов реализации энхансер представляет собой n-додецил-β-D-мальтопиранозид. В некоторых вариантах энхансерами абсорбции служат ПАВ. В одном из вариантов реализации энхансерэнхансер представляет собой хитозан, такой как N,N,N-триметил-хитозан хлорид (ТМС).
[0049] В одном из вариантов донор NO согласно настоящему изобретению включает в том числе 3-(2-гидрокси-1-(1-метиэтил)-2-нитрозогидразино)-1-пропанамин, N-этил-2-(l-этил-гидрокси-2-нитрозогидразино)-этанамин или S-нитрозо-N-ацетилпеницилламин.
[0050] В другом варианте реализации настоящего изобретения указанная желчная кислота представляет собой холевую кислоту. В другом варианте реализации желчная кислота представляет собой таурохолевую кислоту. В другом варианте реализации желчная кислота представляет собой гликохолевую кислоту. В другом варианте реализации желчная кислота представляет собой гликогенохолевую кислоту. В другом варианте реализации желчная кислота представляет собой 3 бета-моногидроксихолевую кислоту. В другом варианте реализации желчная кислота представляет собой литохолевую кислоту. В другом варианте реализации желчная кислота представляет собой 5 бета-холановую кислоту. В другом варианте реализации желчная кислота представляет собой 3,12-диол-7-он-5 бета-холановую кислоту. В другом варианте реализации желчная кислота представляет собой 3 альфа-гидрокси-12-кетохолевую кислоту. В другом варианте реализации желчная кислота представляет собой 3 бета-гидрокси-12-кетохолевую кислоту. В другом варианте реализации желчная кислота представляет собой 12 альфа-3 бета-дигидрохолевую кислоту. В другом варианте реализации указанная желчная кислота представляет собой урсодезоксихолевую кислоту.
[0051] В одном из вариантов реализации настоящего изобретения указанный энхансер представляет собой неионное ПАВ. В одном из вариантов реализации энхансер представляет собой неионное ПАВ на основе эфира полиоксиэтилена (например, имеющего значение гидрофильно-липофильного баланса (HLB) от 6 до 19, и у которого среднее число звеньев полиоксиэтилена варьирует от 4 до 30). В другом варианте реализации энхансер представляет собой анионное ПАВ. В другом варианте реализации энхансер представляет собой катионное ПАВ. В другом варианте реализации энхансер представляет собой ПАВ со свойствами амфолита. В одном из вариантов в качестве энхансеров абсорбции служат цвиттерионные ПАВ, такие как ацилкарнитины.
[0052] В другом варианте реализации настоящего изобретения количество указанного энхансера, используемого в способах и композициях согласно настоящему изобретению, составляет 0,1 мг на лекарственную форму. В другом варианте реализации количество энхансера составляет 0,2 мг на лекарственную форму. В другом варианте реализации указанное количество составляет 0,3 мг на лекарственную форму. В другом варианте реализации указанное количество составляет 0,4 мг на лекарственную форму. В другом варианте реализации указанное количество составляет 0,6 мг на лекарственную форму. В другом варианте реализации указанное количество составляет 0,8 мг на лекарственную форму. В другом варианте реализации указанное количество составляет 1 мг на лекарственную форму. В другом варианте реализации указанное количество составляет 1,5 мг на лекарственную форму. В другом варианте реализации указанное количество составляет 2 мг на лекарственную форму. В другом варианте реализации указанное количество составляет 2,5 мг на лекарственную форму. В другом варианте реализации указанное количество составляет 3 мг на лекарственную форму. В другом варианте реализации указанное количество составляет 5 мг на лекарственную форму. В другом варианте реализации указанное количество составляет 7 мг на лекарственную форму. В другом варианте реализации указанное количество составляет 10 мг на лекарственную форму. В другом варианте реализации указанное количество составляет 12 мг на лекарственную форму. В другом варианте реализации указанное количество составляет 15 мг на лекарственную форму. В другом варианте реализации указанное количество составляет 20 мг на лекарственную форму. В другом варианте реализации указанное количество составляет 30 мг на лекарственную форму. В другом варианте реализации указанное количество составляет 50 мг на лекарственную форму. В другом варианте реализации указанное количество составляет 70 мг на лекарственную форму. В другом варианте реализации указанное количество составляет 100 мг на лекарственную форму.
[0053] В другом варианте реализации настоящего изобретения указанное количество энхансера составляет 0,1-1 мг на лекарственную форму. В другом варианте реализации количество энхансера составляет 0,2-1 мг на лекарственную форму. В другом варианте реализации указанное количество составляет 0,3-1 мг на лекарственную форму. В другом варианте реализации указанное количество составляет 0,1-2 мг на лекарственную форму. В другом варианте реализации указанное количество составляет 0,2-2 мг на лекарственную форму. В другом варианте реализации указанное количество составляет 0,3-2 мг на лекарственную форму. В другом варианте реализации указанное количество составляет 0,5-1 мг на лекарственную форму. В другом варианте реализации указанное количество составляет 1-10 мг на лекарственную форму. В другом варианте реализации указанное количество составляет 2-10 мг на лекарственную форму. В другом варианте реализации указанное количество составляет 3-10 мг на лекарственную форму. В другом варианте реализации указанное количество составляет 5-10 мг на лекарственную форму. В другом варианте реализации указанное количество составляет 1-20 мг на лекарственную форму. В другом варианте реализации указанное количество составляет 2-20 мг на лекарственную форму. В другом варианте реализации указанное количество составляет 3-20 мг на лекарственную форму. В другом варианте реализации указанное количество составляет 5-20 мг на лекарственную форму. В другом варианте реализации указанное количество составляет 10-20 мг на лекарственную форму. В другом варианте реализации указанное количество составляет 10-100 мг на лекарственную форму. В другом варианте реализации указанное количество составляет 20-100 мг на лекарственную форму. В другом варианте реализации указанное количество составляет 30-100 мг на лекарственную форму. В другом варианте реализации указанное количество составляет 50-100 мг на лекарственную форму. В другом варианте реализации указанное количество составляет 10-200 мг на лекарственную форму. В другом варианте реализации указанное количество составляет 20-200 мг на лекарственную форму. В другом варианте реализации указанное количество составляет 30-200 мг на лекарственную форму. В другом варианте реализации указанное количество составляет 50-200 мг на лекарственную форму. В другом варианте реализации указанное количество составляет 100-200 мг на лекарственную форму. Каждый тип и количество энхансера представляют собой отдельный вариант реализации настоящего изобретения.
[0054] В другом варианте реализации реализации, композиции согласно настоящему изобретению дополнительно содержат оболочку, которая ингибирует переваривание композиции в желудке субъекта. В одном из вариантов реализации указанная оболочка ингибирует переваривание композиции в желудке субъекта. В одном из вариантов реализации лекарственные формы, покрытые оболочкой, согласно настоящему изобретению высвобождают лекарственное средство, когда значение pH смещается к щелочному диапазону значений. В одном из вариантов реализации настоящего изобретения указанная оболочка состоит из одного слоя, согласно другим вариантам оболочка является многослойной. В одном из вариантов реализации указанная оболочка представляет собой биоадгезивный полимер, который избирательно связывается со слизистой оболочкой кишечника и, таким образом, способствует высвобождению лекарственного средства в месте связывания. В одном из вариантов реализации указанная кишечно-растворимая оболочка представляет собой кишечно-растворимую оболочку, имеющую вид пленки. Согласно некоторым вариантам реализации настоящего изобретения оболочка состоит из биоразлагаемого полисахарида, хитозана, aquateric, водного 30%-го коллоидного раствора полимера этилцеллюлозы (ECD), азополимера, фталата ацетата целлюлозы, тримеллиата ацетата целлюлозы, фталата гидроксипропилметилцеллюлозы, желатина, фталата поливинилацетата, гидрогеля, «Пулсинкап» (pulsincap) или их комбинации. В одном из вариантов реализации pH-чувствительную оболочку будут применять в соответствии с необходимым местом и/или профилем высвобождения согласно знаниям специалистов в данной отрасли.
[0055] В одном из вариантов реализации настоящего изобретения указанная оболочка представляет собой кишечно-растворимую оболочку. Способы нанесения кишечно-растворимой оболочки хорошо известны в данной отрасли и описаны, например в Siepmann F, Siepmann J et al, Blends of aqueous polymer dispersions used for pellet coating: importance of the particle size. J Control Release 2005; 105(3): 226-39; и Huyghebaert N, Vermeire A, Remon JP. In vitro evaluation of coating polymers for enteric coating and human ileal targeting. Int J Pharm 2005; 298(1): 26-37. Каждый способ представляет собой отдельный вариант реализации настоящего изобретения.
[0056] В другом варианте реализации настоящего изобретения в качестве кишечно-растворимой оболочки применяют Eudragit®, который представляет собой акриловый полимер. Применение акриловых полимеров в качестве оболочек фармацевтических препаратов хорошо известно в данной отрасли. Было показано, что акриловые полимеры Eudragit безопасны, они не абсорбируются и не подвергаются метаболизму в организме, а скорее просто элиминируются.
[0057] В другом варианте реализации настоящего изобретения указанная оболочка представляет собой оболочку из желатина. В другом варианте реализации для предохранения инсулина от разрушения в желудке применяют микроинкапсуляцию. В другом варианте реализации оболочка представляет собой оболочку из желатина. В другом варианте реализации для предохранения экзенатида от разрушения в желудке применяют микроинкапсуляцию. Способы нанесения оболочки из желатина и микроинкапсуляции хорошо известны в данной отрасли. Каждый способ представляет собой отдельный вариант реализации настоящего изобретения.
[0058] В другом варианте реализации настоящего изобретения указанная оболочка представляет собой оболочку в виде пленки. В другом варианте реализации указанная оболочка состоит из этилцеллюлозы. В другом варианте реализации указанная оболочка состоит из водного коллоидного раствора этилцеллюлозы, например, гидроксипропилметилцеллюлозы (НРМС) Е15. В другом варианте реализации указанная оболочка представляет собой устойчивую в желудке оболочку, например, состоящую из полимера, содержащего карбоксильные группы в качестве функциональных фрагментов. В другом варианте реализации указанная оболочка представляет собой монолитную матрицу. В другом варианте реализации указанная оболочка состоит из эфира целлюлозы (например, гипромеллозы (НРМС)). Каждый тип оболочки представляет собой отдельный вариант реализации настоящего изобретения.
[0059] В одном из вариантов реализации настоящего изобретения указанный белок представляет собой рекомбинантный белок. В одном из вариантов белок представляет собой инсулин. В другом варианте реализации указанный белок представляет собой глюкагон. В другом варианте реализации белок представляет собой гамма-интерферон. В другом варианте реализации указанный белок представляет собой альфа-интерферон. В другом варианте реализации указанный белок представляет собой гормон роста. В другом варианте реализации указанный белок представляет собой эритропоэтин. В другом варианте реализации указанный белок представляет собой экзенатид. В другом варианте реализации указанный белок представляет собой глюкагон. В другом варианте реализации указанный белок представляет собой гранулоцитарный колониестимулирующий фактор (G-CSF). В другом варианте реализации указанный белок представляет собой глюкагон. В другом варианте реализации указанный белок представляет собой любой другой белок известный в данной отрасли.
[0060] В другом варианте реализации настоящего изобретения указанный белок представляет собой гормон роста. В одном из вариантов реализации указанный гормон роста представляет собой соматотропин. В другом варианте реализации указанный гормон роста представляет собой инсулиноподобный ростовой фактор I (ИРФ-I). В другом варианте реализации гормон роста представляет собой любой другой гормон роста известный в данной отрасли.
[0061] Молекулярные массы некоторых упомянутых выше белков составляют: инсулин-6 килодальтон (кДа); глюкагон - 3,5 кДа; интерферон - 28 кДа; гормон роста - 21,5-47 кДа; сывороточный альбумин человека - 69 кДа; эритропоэтин - 34 кДа; G-CSF - 30-34 кДа. Таким образом, в одном из вариантов реализации молекулярная масса указанных белков является подходящей для введения способами согласно настоящему изобретению.
[0062] В другом варианте реализации способы и композиции согласно настоящему изобретению применяют для введения сывороточного альбумина человека. Сывороточный альбумин человека согласно одному из вариантов реализации настоящего изобретения не рассматривают в качестве фармацевтически активного компонента; тем не менее, он может быть использован в контексте настоящего изобретения в качестве терапевтически весьма подходящего носителя для активного компонента. Каждый тип белка представляет собой отдельный вариант реализации настоящего изобретения.
[0063] В одном из вариантов реализации настоящего изобретения указанный белок представляет собой фермент. В некоторых вариантах белок представляет собой лиганд рецептора, транспортный или запасной белок.
[0064] В некоторых вариантах реализации настоящего изобретения указанный фермент представляет собой оксидоредуктазу, трансферазу, гидролазу, лиазу, изомеразу или лигазу. В некоторых вариантах реализации настоящего изобретения оксидоредуктазы действуют на альдегидную или оксо группу донора, на СН-СН группу донора, на CH-NH(2) группу доноров, на CH-NH группу доноров, на NADH или NADPH, на СН-ОН группу доноров, на соединения азота в качестве доноров, на сульфогруппу доноров, на гемовую группу доноров, на дифенолы и родственные вещества в качестве доноров, на пероксид в качестве акцептора, на водород в качестве донора, на единичные доноры с введением молекулярного кислорода, на спаренные доноры, на супероксид в качестве акцептора с окислением ионов металла, на СИ или СН(2) группы, на железо-серные белки в качестве доноров, на восстановленный флаводоксин в качестве донора, на фосфор или мышьяк, присутствующие в донорах, или на x-H и y-H с образованием x-y связи.
[0065] В некоторых вариантах реализации настоящего изобретения трансферазы представляют собой ацилтрансферазы или гликозилтрансферазы. В некоторых вариантах реализации трансферазы переносят остатки альдегида или кетона. В некоторых вариантах реализации трансферазы переносят алкильные или арильные группы, за исключением метильных групп. В некоторых вариантах реализации трансферазы переносят группы, содержащие азот, фосфор, серу или селен.
[0066] В некоторых вариантах реализации настоящего изобретения гидролазы представляют собой гликозилазы или действуют на эфирные связи, на пептидные связи, на связи углерод-азот отличные от пептидных, на ангидриды кислот, на связи углерод-углерод, на связи галогенов, на связи фосфор-азот, на связи сера-азот, на связи углерод-фосфор, на связи сера-сера или на связи углерод-сера.
[0067] В некоторых вариантах реализации настоящего изобретения лиазы представляют собой углерод-углеродные лиазы, углерод-кислородные лиазы, углерод-азотные лиазы, углерод-серные лиазы, углерод-галогеновые лиазы, фосфор-кислородные лиазы или другие лиазы.
[0068] В некоторых вариантах реализации настоящего изобретения изомеразы представляют собой рацемазы или эпимеразы, цис-транс-изомеразы, внутримолекулярные оксидоредуктазы, внутримолекулярные трансферазы, внутримолекулярные лиазы или другие изомеразы.
[0069] В некоторых вариантах реализации настоящего изобретения лигазы формируют связи углерод сера, связи углерод-азот, связи углерод-углерод, фосфорноэфирные связи или связи азот-металл.
[0070] В некоторых вариантах реализации настоящего изобретения транспортные белки представляют собой аннексины, АТФ-связывающие кассетные транспортеры, гемоглобин, АТФазы, кальциевые каналы, калиевые каналы, натриевые каналы или носители растворенных веществ.
[0071] В некоторых вариантах реализации настоящего изобретения запасные белки включают, в том числе альбумины, лактоглобулины, казеин, овомуцин, ферритин, фосвитин, лактоферрин или вителлогенин. В одном из вариантов альбумины включают в том числе, авидин, овальбумин, сывороточный альбумин, парвальбумин, с-реактивный белок, преальбумин, кональбумин, рицин, лактальбумин, метгемальбумин или транстиретин.
[0072] В некоторых вариантах реализации настоящего изобретения структурные белки включают, в том числе амилоид, коллаген, эластин или фибриллин.
[0073] В некоторых вариантах реализации настоящего изобретения указанный белок представляет собой вирусный белок, бактериальный белок, белок беспозвоночного или белок позвоночного. В некоторых вариантах реализации указанный белок представляет собой рекомбинантный белок. В одном из вариантов реализации указанный белок представляет собой рекомбинантный белок. В одном из вариантов реализации указанный рекомбинантный белок представляет собой рекомбинантный белок человека.
[0074] Согласно одному из вариантов реализации настоящего изобретения предложена композиция, содержащая белок инсулина и по меньшей мере два ингибитора протеаз. Согласно одному из вариантов реализации настоящего изобретения предложена композиция, содержащая экзенатид и по меньшей мере два ингибитора протеаз. Согласно одному из вариантов реализации настоящего изобретения предложена композиция, содержащая белок инсулина и два ингибитора протеаз. Согласно одному из вариантов реализации настоящего изобретения предложена композиция, содержащая экзенатид и два ингибитора протеаз. Согласно одному из вариантов реализации настоящего изобретения предложена композиция, содержащая экзенатид и 3 ингибитора протеаз. Согласно одному из вариантов реализации настоящего изобретения предложена композиция, содержащая белок инсулина и 4 ингибитора протеаз. Согласно одному из вариантов реализации настоящего изобретения предложена композиция, содержащая экзенатид и 4 ингибитора протеаз. Согласно одному из вариантов реализации настоящего изобретения предложена композиция, содержащая белок инсулина и 5 ингибиторов протеаз. Согласно одному из вариантов реализации настоящего изобретения предложена композиция, содержащая экзенатид и 5 ингибиторов протеаз. Согласно одному из вариантов реализации настоящего изобретения предложена композиция, содержащая белок инсулина и по меньшей мере 5 ингибитора протеаз. Согласно одному из вариантов реализации настоящего изобретения предложена композиция, содержащая белок инсулина и по меньшей мере 7 ингибиторов протеаз. Согласно одному из вариантов реализации настоящего изобретения предложена композиция, содержащая белок инсулина и по меньшей мере 10 ингибиторов протеаз.
[0075] В другом варианте реализации настоящего изобретения предложена композиция, содержащая активный белок согласно настоящему изобретению, по меньшей мере два ингибитора протеаз и омега-3 жирную кислоту. В другом варианте реализации настоящего изобретения предложена композиция, содержащая активный белок согласно данному изобретению, по меньшей мере два ингибитора протеаз, EDTA или ее соль (такую как Na-EDTA) и омега-3 жирную кислоту.
[0076] Другой вариант реализации настоящего изобретения предполагает, что применение двух ингибиторов протеаз в одной композиции для перорального применения, существенным и неожиданным образом увеличивает биодоступность белка согласно данному изобретению. Другой вариант реализации настоящего изобретения предполагает, что применение двух ингибиторов протеаз в одной композиции пероральной, существенным и неожиданным образом увеличивает биодоступность инсулина. Другой вариант реализации настоящего изобретения предполагает, что применение двух ингибиторов протеаз в одной пероральной композиции, существенным и неожиданным образом увеличивает биодоступность экзенатида. Другой вариант реализации настоящего изобретения предполагает, что применение двух серпинов в одной пероральной композиции, существенным и неожиданным образом увеличивает биодоступность белка согласно данному изобретению. Другой вариант реализации настоящего изобретения предполагает, что применение двух ингибиторов протеаз в одной пероральной композиции, существенным и неожиданным образом увеличивает биодоступность белка согласно данному изобретению. Другой вариант реализации настоящего изобретения предполагает, что применение двух серпинов в одной пероральной композиции, существенным и неожиданным образом увеличивает биодоступность инсулина. Другой вариант реализации настоящего изобретения предполагает, что применение двух серпинов в одной пероральной композиции, существенным и неожиданным образом увеличивает биодоступность экзенатида. Другой вариант реализации настоящего изобретения предполагает, что применение двух ингибиторов трипсина в одной пероральной композиции, существенным и неожиданным образом увеличивает биодоступность белка согласно данному изобретению. Другой вариант реализации настоящего изобретения предполагает, что применение двух ингибиторов трипсина в одной пероральной композиции, существенным и неожиданным образом увеличивает биодоступность инсулина. Другой вариант реализации настоящего изобретения предполагает, что применение двух ингибиторов трипсина в одной пероральной композиции, существенным и неожиданным образом увеличивает биодоступность экзенатида. Другой вариант реализации настоящего изобретения предполагает, что применение SBTI и апротинина в одной пероральной композиции, существенным и неожиданным образом увеличивает биодоступность белка согласно данному изобретению. Другой вариант реализации настоящего изобретения предполагает, что применение SBTI и апротинина в одной пероральной композиции, существенным и неожиданным образом увеличивает биодоступность инсулина. Другой вариант реализации настоящего изобретения предполагает, что применение SBTI и апротинина в одной пероральной композиции, существенным и неожиданным образом увеличивает биодоступность экзенатида.
[0077] Другой вариант реализации настоящего изобретения предполагает, что применение серпина и ингибитора цистеиновой протеазы в одной пероральной композиции, существенным и неожиданным образом увеличивает биодоступность белка согласно данному изобретению. Другой вариант реализации настоящего изобретения предполагает, что применение серпина и ингибитора цистеиновой протеазы в одной пероральной композиции, существенным и неожиданным образом увеличивает биодоступность инсулина. Другой вариант реализации настоящего изобретения предполагает, что применение серпина и ингибитора цистеиновой протеазы в одной пероральной композиции, существенным и неожиданным образом увеличивает биодоступность экзенатида. Другой вариант реализации настоящего изобретения предполагает, что применение серпина и ингибитора треониновой протеазы в одной пероральной композиции, существенным и неожиданным образом увеличивает биодоступность белка согласно данному изобретению. Другой вариант реализации настоящего изобретения предполагает, что применение серпина и ингибитора треониновой протеазы в одной пероральной композиции, существенным и неожиданным образом увеличивает биодоступность инсулина. Другой вариант реализации настоящего изобретения предполагает, что применение серпина и ингибитора треониновой протеазы в одной пероральной композиции, существенным и неожиданным образом увеличивает биодоступность экзенатида. Другой вариант реализации настоящего изобретения предполагает, что применение серпина и ингибитора металлопротеазы в одной пероральной композиции, существенным и неожиданным образом увеличивает биодоступность белка согласно данному изобретению. Другой вариант реализации настоящего изобретения предполагает, что применение серпина и ингибитора металлопротеазы в одной пероральной композиции, существенным и неожиданным образом увеличивает биодоступность инсулина. Другой вариант реализации настоящего изобретения предполагает, что применение серпина и ингибитора металлопротеазы в одной пероральной композиции, существенным и неожиданным образом увеличивает биодоступность экзенатида. Другой вариант реализации настоящего изобретения предполагает, что применение серпина и ингибитора аспартат-протеазы в одной пероральной композиции, существенным и неожиданным образом увеличивает биодоступность белка согласно данному изобретению. Другой вариант реализации настоящего изобретения предполагает, что применение серпина и ингибитора аспартат-протеазы в одной пероральной композиции, существенным и неожиданным образом увеличивает биодоступность инсулина. Другой вариант реализации настоящего изобретения предполагает, что применение серпина и ингибитора аспартат-протеазы в одной пероральной композиции, существенным и неожиданным образом увеличивает биодоступность экзенатида.
[0078] Другой вариант реализации настоящего изобретения предполагает, что применение двух ингибиторов протеаз в одной пероральной композиции, существенным и неожиданным образом увеличивает биодоступность белка согласно данному изобретению. Другой вариант реализации настоящего изобретения предполагает, что применение двух ингибиторов протеаз в одной пероральной композиции, существенным и неожиданным образом увеличивает биодоступность инсулина. Другой вариант реализации настоящего изобретения предполагает, что применение двух ингибиторов протеаз в одной пероральной композиции, существенным и неожиданным образом увеличивает биодоступность экзенатида. Другой вариант реализации настоящего изобретения предполагает, что применение двух ингибиторов протеаз в одной пероральной композиции, существенным и неожиданным образом увеличивает биодоступность инсулина у человека. Другой вариант реализации настоящего изобретения предполагает, что применение двух ингибиторов протеаз в одной пероральной композиции, существенным и неожиданным образом увеличивает биодоступность экзенатида у человека. Другой вариант реализации настоящего изобретения предполагает, что применение двух ингибиторов протеаз в одной пероральной композиции, существенным и неожиданным образом увеличивает биодоступность белка согласно данному изобретению у человека.
[0079] Другой вариант реализации настоящего изобретения предполагает, что применение двух ингибиторов протеаз в одной пероральной композиции, существенным и неожиданным образом увеличивает биодоступность инсулина у человека по меньшей мере на 10%. Другой вариант реализации настоящего изобретения предполагает, что применение двух ингибиторов протеаз в одной пероральной композиции, существенным и неожиданным образом увеличивает биодоступность экзенатида у человека по меньшей мере на 10%. Другой вариант реализации настоящего изобретения предполагает, что применение двух ингибиторов протеаз в одной пероральной композиции, существенным и неожиданным образом увеличивает биодоступность инсулина у человека по меньшей мере на 20%. Другой вариант реализации настоящего изобретения предполагает, что применение двух ингибиторов протеаз в одной пероральной композиции, существенным и неожиданным образом увеличивает биодоступность экзенатида у человека по меньшей мере на 20%. Другой вариант реализации настоящего изобретения предполагает, что применение двух ингибиторов протеаз в одной пероральной композиции, существенным и неожиданным образом увеличивает биодоступность инсулина у человека по меньшей мере на 30%. Другой вариант реализации настоящего изобретения предполагает, что применение двух ингибиторов протеаз в одной пероральной композиции, существенным и неожиданным образом увеличивает биодоступность экзенатида у человека по меньшей мере на 30%. Другой вариант реализации настоящего изобретения предполагает, что применение двух ингибиторов протеаз в одной пероральной композиции, существенным и неожиданным образом увеличивает биодоступность инсулина у человека по меньшей мере на 40%. Другой вариант реализации настоящего изобретения предполагает, что применение двух ингибиторов протеаз в одной пероральной композиции, существенным и неожиданным образом увеличивает биодоступность экзенатида у человека по меньшей мере на 40%. Другой вариант реализации настоящего изобретения предполагает, что применение двух ингибиторов протеаз в одной пероральной композиции, существенным и неожиданным образом увеличивает биодоступность инсулина у человека по меньшей мере на 50%. Другой вариант реализации настоящего изобретения предполагает, что применение двух ингибиторов протеаз в одной пероральной композиции, существенным и неожиданным образом увеличивает биодоступность экзенатида у человека по меньшей мере на 50%. Другой вариант реализации настоящего изобретения предполагает, что применение двух ингибиторов протеаз в одной пероральной композиции, существенным и неожиданным образом увеличивает биодоступность инсулина у человека по меньшей мере на 60%. Другой вариант реализации настоящего изобретения предполагает, что применение двух ингибиторов протеаз в одной пероральной композиции, существенным и неожиданным образом увеличивает биодоступность экзенатида у человека по меньшей мере на 60%. Другой вариант реализации настоящего изобретения предполагает, что применение двух ингибиторов протеаз в одной пероральной композиции, существенным и неожиданным образом увеличивает биодоступность инсулина у человека по меньшей мере на 70%. Другой вариант реализации настоящего изобретения предполагает, что применение двух ингибиторов протеаз в одной пероральной композиции, существенным и неожиданным образом увеличивает биодоступность экзенатида у человека по меньшей мере на 70%. Другой вариант реализации настоящего изобретения предполагает, что применение двух ингибиторов протеаз в одной пероральной композиции, существенным и неожиданным образом увеличивает биодоступность инсулина у человека по меньшей мере на 80%. Другой вариант реализации настоящего изобретения предполагает, что применение двух ингибиторов протеаз в одной пероральной композиции, существенным и неожиданным образом увеличивает биодоступность экзенатида у человека по меньшей мере на 80%. Другой вариант реализации настоящего изобретения предполагает, что применение двух ингибиторов протеаз в одной пероральной композиции, существенным и неожиданным образом увеличивает биодоступность инсулина у человека по меньшей мере на 90%. Другой вариант реализации настоящего изобретения предполагает, что применение двух ингибиторов протеаз в одной пероральной композиции, существенным и неожиданным образом увеличивает биодоступность экзенатида у человека по меньшей мере на 90%. Другой вариант реализации настоящего изобретения предполагает, что применение двух ингибиторов протеаз в одной пероральной композиции, существенным и неожиданным образом увеличивает биодоступность инсулина у человека по меньшей мере на 100%. Другой вариант реализации настоящего изобретения предполагает, что применение двух ингибиторов протеаз в одной пероральной композиции, существенным и неожиданным образом увеличивает биодоступность экзенатида у человека по меньшей мере на 100%.
[0080] Другой вариант реализации настоящего изобретения предполагает, что применение апротинина и SBTI в одной пероральной композиции, существенным и неожиданным образом увеличивает биодоступность инсулина у человека по меньшей мере на 10%. Другой вариант реализации настоящего изобретения предполагает, что применение апротинина и SBTI в одной пероральной композиции, существенным и неожиданным образом увеличивает биодоступность инсулина у человека по меньшей мере на 20%. Другой вариант реализации настоящего изобретения предполагает, что применение апротинина и SBTI в одной пероральной композиции, существенным и неожиданным образом увеличивает биодоступность инсулина у человека по меньшей мере на 30%. Другой вариант реализации настоящего изобретения предполагает, что применение апротинина и SBTI в одной пероральной композиции, существенным и неожиданным образом увеличивает биодоступность инсулина у человека по меньшей мере на 40%. Другой вариант реализации настоящего изобретения предполагает, что применение апротинина и SBTI в одной пероральной композиции, существенным и неожиданным образом увеличивает биодоступность инсулина у человека по меньшей мере на 50%. Другой вариант реализации настоящего изобретения предполагает, что применение апротинина и SBTI в одной пероральной композиции, существенным и неожиданным образом увеличивает биодоступность инсулина у человека по меньшей мере на 60%. Другой вариант реализации настоящего изобретения предполагает, что применение апротинина и SBTI в одной пероральной композиции, существенным и неожиданным образом увеличивает биодоступность инсулина у человека по меньшей мере на 70%. Другой вариант реализации настоящего изобретения предполагает, что применение апротинина и SBTI в одной пероральной композиции, существенным и неожиданным образом увеличивает биодоступность инсулина у человека по меньшей мере на 80%. Другой вариант реализации настоящего изобретения предполагает, что применение апротинина и SBTI в одной пероральной композиции, существенным и неожиданным образом увеличивает биодоступность инсулина у человека по меньшей мере на 90%. Другой вариант реализации настоящего изобретения предполагает, что применение апротинина и SBTI в одной пероральной композиции, существенным и неожиданным образом увеличивает биодоступность инсулина у человека по меньшей мере на 100%.
[0081] Другой вариант реализации настоящего изобретения предполагает, что применение апротинина и SBTI в одной пероральной композиции, существенным и неожиданным образом увеличивает биодоступность экзенатида у человека по меньшей мере на 10%. Другой вариант реализации настоящего изобретения предполагает, что применение апротинина и SBTI в одной пероральной композиции, существенным и неожиданным образом увеличивает биодоступность экзенатида у человека по меньшей мере на 20%. Другой вариант реализации настоящего изобретения предполагает, что применение апротинина и SBTI в одной пероральной композиции, существенным и неожиданным образом увеличивает биодоступность экзенатида у человека по меньшей мере на 30%. Другой вариант реализации настоящего изобретения предполагает, что применение апротинина и SBTI в одной пероральной композиции, существенным и неожиданным образом увеличивает биодоступность экзенатида у человека по меньшей мере на 40%. Другой вариант реализации настоящего изобретения предполагает, что применение апротинина и SBTI в одной пероральной композиции, существенным и неожиданным образом увеличивает биодоступность экзенатида у человека по меньшей мере на 50%. Другой вариант реализации настоящего изобретения предполагает, что применение апротинина и SBTI в одной пероральной композиции, существенным и неожиданным образом увеличивает биодоступность экзенатида у человека по меньшей мере на 60%. Другой вариант реализации настоящего изобретения предполагает, что применение апротинина и SBTI в одной пероральной композиции, существенным и неожиданным образом увеличивает биодоступность экзенатида у человека по меньшей мере на 70%. Другой вариант реализации настоящего изобретения предполагает, что применение апротинина и SBTI в одной пероральной композиции, существенным и неожиданным образом увеличивает биодоступность экзенатида у человека по меньшей мере на 80%. Другой вариант реализации настоящего изобретения предполагает, что применение апротинина и SBTI в одной пероральной композиции, существенным и неожиданным образом увеличивает биодоступность экзенатида у человека по меньшей мере на 90%. Другой вариант реализации настоящего изобретения предполагает, что применение апротинина и SBTI в одной пероральной композиции, существенным и неожиданным образом увеличивает биодоступность экзенатида у человека по меньшей мере на 100%.
[0082] Другой вариант реализации настоящего изобретения предполагает, что применение двух ингибиторов протеаз в одной пероральной композиции, существенным и неожиданным образом увеличивает биодоступность белка согласно настоящему изобретению у человека по меньшей мере на 10%. Другой вариант реализации настоящего изобретения предполагает, что применение двух ингибиторов протеаз в одной пероральной композиции, существенным и неожиданным образом увеличивает биодоступность белка согласно данному изобретению у человека по меньшей мере на 20%. Другой вариант реализации настоящего изобретения предполагает, что применение двух ингибиторов протеаз в одной пероральной композиции, существенным и неожиданным образом увеличивает биодоступность белка согласно данному изобретению у человека по меньшей мере на 30%. Другой вариант реализации настоящего изобретения предполагает, что применение двух ингибиторов протеаз в одной пероральной композиции, существенным и неожиданным образом увеличивает биодоступность белка согласно данному изобретению у человека по меньшей мере на 40%. Другой вариант реализации настоящего изобретения предполагает, что применение двух ингибиторов протеаз в одной пероральной композиции, существенным и неожиданным образом увеличивает биодоступность белка согласно данному изобретению у человека по меньшей мере на 50%. Другой вариант реализации настоящего изобретения предполагает, что применение двух ингибиторов протеаз в одной пероральной композиции, существенным и неожиданным образом увеличивает биодоступность белка согласно данному изобретению у человека по меньшей мере на 60%. Другой вариант реализации настоящего изобретения предполагает, что применение двух ингибиторов протеаз в одной пероральной композиции, существенным и неожиданным образом увеличивает биодоступность белка согласно данному изобретению у человека по меньшей мере на 70%. Другой вариант реализации настоящего изобретения предполагает, что применение двух ингибиторов протеаз в одной пероральной композиции, существенным и неожиданным образом увеличивает биодоступность белка согласно данному изобретению у человека по меньшей мере на 80%. Другой вариант реализации настоящего изобретения предполагает, что применение двух ингибиторов протеаз в одной пероральной композиции, существенным и неожиданным образом увеличивает биодоступность белка согласно данному изобретению у человека по меньшей мере на 90%. Другой вариант реализации настоящего изобретения предполагает, что применение двух ингибиторов протеаз в одной пероральной композиции, существенным и неожиданным образом увеличивает биодоступность белка согласно данному изобретению у человека по меньшей мере на 100%.
[0083] Другой вариант реализации настоящего изобретения дополнительно предполагает применение лекарственных форм замедленного высвобождения (например, микроинкапсулированных форм замедленного высвобождения), которые позволяют уменьшить частоту введения лекарственного средства до одного или двух раз в день. В другом варианте реализации настоящего изобретения дозировку инсулина повышают соответственно уменьшению частоты введения. В другом варианте реализации дозировку экзенатида повышают соответственно уменьшению частоты введения. Каждый тип оболочки, лекарственной формы и т.д., которые ингибируют переваривание композиции в желудке, представляет собой отдельный вариант реализации настоящего изобретения.
[0084] Способы измерения уровня инсулина хорошо известны в данной области знания. В одном из вариантов реализации настоящего изобретения уровень рекомбинантного инсулина измеряют с помощью набора для радио-иммунологического анализа (РИА) инсулина человека, например набора, производимого Linco Research Inc, (St.Charles, Missouri). В другом варианте реализации также измеряют уровень С-пептида для определения относительного вклада эндогенного и экзогенного инсулина в наблюдаемое повышение уровней инсулина. В другом варианте реализации применяют наборы ELISA для измерения содержания инсулина. В другом варианте реализации уровень инсулина измеряют любым другим способом известным в данной отрасли. Каждая возможность представляет собой отдельный вариант реализации настоящего изобретения.
[0085] В другом варианте реализации настоящего изобретения применяют лекарственные формы, состоящие из множества частиц для ингибирования переваривания композиции в желудке. В другом варианте реализации применяют лекарственные формы, состоящие из множества частиц для ингибирования переваривания композиции в желудке. Другой вариант реализации настоящего изобретения включает введение отдельных лекарственных форм, отличающихся тем, что каждый ингибитор протеазы находится в отдельной лекарственной форме, а белок находится в дополнительной лекарственной форме. Другой вариант реализации настоящего изобретения включает введение отдельных лекарственных форм, отличающихся тем, что два ингибитора протеазы находятся в одной лекарственной форме, а белок находится в дополнительной лекарственной форме.
[0086] Согласно другому варианту реализации настоящего изобретения предложен способ перорального введения белка, обладающего ферментативной активностью, субъекту, при котором значительная часть указанного белка сохраняет ферментативную активность после абсорбции через слизистый барьер кишечника указанного субъекта, включающий пероральное введение указанному субъекту фармацевтической композиции, содержащей белок и по меньшей мере два ингибитора протеаз, что таким образом обеспечивает пероральное введение белка, обладающего ферментативной активностью, указанному субъекту. Согласно другому варианту реализации настоящего изобретения предложен способ перорального введения белка, обладающего ферментативной активностью, субъекту, при котором значительная часть указанного белка сохраняет ферментативную активность после абсорбции через слизистый барьер кишечника субъекта, включающий пероральное введение указанному субъекту фармацевтической композиции, содержащей белок и по меньшей мере два ингибитора протеаз, что таким образом обеспечивает пероральное введение белка, обладающего ферментативной активностью, человеку. Согласно другому варианту реализации настоящего изобретения предложен способ перорального введения инсулина субъекту, при котором значительная часть инсулина сохраняет свою активность после абсорбции через слизистый барьер кишечника указанного субъекта, включающий пероральное введение указанному субъекту фармацевтической композиции, содержащей инсулин и по меньшей мере два ингибитора протеаз, что таким образом обеспечивает пероральное введение белка, обладающего ферментативной активностью, субъекту. Согласно другому варианту реализации настоящего изобретения предложен способ перорального введения экзенатида субъекту, при котором посредством значительная часть экзенатида сохраняет свою активность после абсорбции через слизистый барьер кишечника указанного субъекта, включающий пероральное введение указному субъекту фармацевтической композиции, содержащей экзенатид и по меньшей мере два ингибитора протеаз, что таким образом обеспечивает пероральное введение белка, обладающего ферментативной активностью, субъекту
[0087] Согласно другому варианту реализации настоящего изобретения предложен способ перорального введения белка, обладающего ферментативной активностью, субъекту, при котором значительная часть белка сохраняет ферментативную активность после абсорбции через слизистый барьер кишечника субъекта, включающий пероральное введение указанному субъекту фармацевтической композиции, содержащей белок, по меньшей мере два ингибитора протеаз и омега-3 жирную кислоту, что таким образом обеспечивает пероральное введение белка, обладающего ферментативной активностью, субъекту. Согласно другому варианту реализации настоящего изобретения предложен способ перорального введения белка, обладающего ферментативной активностью, субъекту, при котором значительная часть белка сохраняет ферментативную активность после абсорбции через слизистый барьер кишечника субъекта, включающий пероральное введение указанному субъекту фармацевтической композиции, содержащей белок, по меньшей мере два ингибитора протеаз и омега-3 жирную кислоту, что таким образом обеспечивает пероральное введение белка, обладающего ферментативной активностью, человеку. Согласно другому варианту реализации настоящего изобретения предложен способ перорального введения инсулина субъекту, при котором значительная часть инсулина сохраняет свою активность после абсорбции через слизистый барьер кишечника субъекта, включающий пероральное введение указанному субъекту фармацевтической композиции, содержащей инсулин, по меньшей мере два ингибитора протеаз и омега-3 жирную кислоту, что таким образом обеспечивает пероральное введение белка, обладающего ферментативной активностью, субъекту. Согласно другому варианту реализации настоящего изобретения предложен способ перорального введения экзенатида субъекту, при котором значительная часть экзенатида сохраняет свою активность после абсорбции через слизистый барьер кишечника субъекта, включающий пероральное введение указанному субъекту фармацевтической композиции, содержащей экзенатид, по меньшей мере два ингибитора протеаз и омега-3 жирную кислоту, что таким образом обеспечивает пероральное введение белка, обладающего ферментативной активностью, субъекту.
[0088] Согласно другому варианту реализации настоящего изобретения предложен способ перорального введения белка, обладающего ферментативной активностью, субъекту, при котором значительная часть белка сохраняет ферментативную активность после абсорбции через слизистый барьер кишечника субъекта, включающий пероральное введение указанному субъекту фармацевтической композиции, содержащей белок, по меньшей мере два ингибитора протеаз, омега-3 жирную кислоту и Na-EDTA, что таким образом обеспечивает пероральное введение белка, обладающего ферментативной активностью, субъекту. Согласно другому варианту реализации настоящего изобретения предложен способ перорального введения белка, обладающего ферментативной активностью, субъекту, при котором значительная часть указанного белка сохраняет ферментативную активность после абсорбции через слизистый барьер кишечника субъекта, включающий пероральное введение указанному субъекту фармацевтической композиции, содержащей белок, по меньшей мере два ингибитора протеаз, омега-3 жирную кислоту и Na-EDTA, что таким образом обеспечивает пероральное введение белка, обладающего ферментативной активностью, человеку. Согласно другому варианту реализации настоящего изобретения предложен способ перорального введения инсулина субъекту, при котором значительная часть инсулина сохраняет свою активность после абсорбции через слизистый барьер кишечника субъекта, включающий пероральное введение указанному субъекту фармацевтической композиции, содержащей инсулин, по меньшей мере два ингибитора протеаз, омега-3 жирную кислоту и Na-EDTA, что таким образом обеспечивает пероральное введение белка, обладающего ферментативной активностью, субъекту. Согласно другому варианту реализации настоящего изобретения предложен способ перорального введения экзенатида субъекту, при котором значительная часть экзенатида сохраняет свою активность после абсорбции через слизистый барьер кишечника субъекта, включающий пероральное введение указанному субъекту фармацевтической композиции, содержащей экзенатид, по меньшей мере два ингибитора протеаз, омега-3 жирную кислоту и Na-EDTA, что таким образом обеспечивает пероральное введение белка, обладающего ферментативной активностью, субъекту.
[0089] Согласно другому варианту реализации настоящего изобретения предложен способ перорального введения белка, обладающего ферментативной активностью, субъекту, при котором значительная часть белка сохраняет ферментативную активность после абсорбции через слизистый барьер кишечника субъекта, включающий пероральное введение указанному субъекту фармацевтической композиции, содержащей белок, по меньшей мере два ингибитора протеаз и Na-EDTA, что таким образом обеспечивает пероральное введение белка, обладающего ферментативной активностью, субъекту. Согласно другому варианту реализации настоящего изобретения предложен способ перорального введения белка, обладающего ферментативной активностью, субъекту, при котором значительная часть белка сохраняет ферментативную активность после абсорбции через слизистый барьер кишечника субъекта, включающий пероральное введение указанному субъекту фармацевтической композиции, содержащей белок, по меньшей мере два ингибитора протеаз и Na-EDTA, что таким образом обеспечивает пероральное введение белка, обладающего ферментативной активностью, человеку. Согласно другому варианту реализации настоящего изобретения предложен способ перорального введения инсулина субъекту, при котором значительная часть инсулина сохраняет свою активность после абсорбции через слизистый барьер кишечника субъекта, включающий пероральное введение указанному субъекту фармацевтической композиции, содержащей инсулин, по меньшей мере два ингибитора протеаз и Na-EDTA, что таким образом обеспечивает пероральное введение белка, обладающего ферментативной активностью, субъекту. Согласно другому варианту реализации настоящего изобретения предложен способ перорального введения экзенатида субъекту, при котором значительная часть экзенатида сохраняет свою активность после абсорбции через слизистый барьер кишечника субъекта, включающий пероральное введение указанному субъекту фармацевтической композиции, содержащей экзенатид, по меньшей мере два ингибитора протеаз и Na-EDTA, что таким образом обеспечивает пероральное введение белка, обладающего ферментативной активностью, субъекту.
[0090] Согласно другому варианту реализации настоящего изобретения предложен способ лечения сахарного диабета у человека, включающий пероральное введение пациенту фармацевтической композиции, содержащей инсулин и по меньшей мере два ингибитора протеаз, с осуществлением лечения сахарного диабета. Согласно другому варианту реализации настоящего изобретения предложен способ лечения сахарного диабета у человека, включающий пероральное введение пациенту фармацевтической композиции, содержащей инсулин и по меньшей мере два ингибитора протеаз, с осуществлением лечения сахарного диабета.
[0091] Согласно другому варианту реализации настоящего изобретения предложен способ лечения сахарного диабета у человека, включающий пероральное введение пациенту фармацевтической композиции, содержащей инсулин, омега-3 жирную кислоту и по меньшей мере два ингибитора протеаз, что таким образом обеспечивает лечение сахарного диабета. Согласно другому варианту реализации настоящего изобретения предложен способ лечения сахарного диабета у человека, включающий введение пероральное пациенту фармацевтической композиции, содержащей инсулин, омега-3 жирную кислоту и по меньшей мере два ингибитора протеаз, что таким образом обеспечивает лечение сахарного диабета.
[0092] Согласно другому варианту реализации настоящего изобретения предложен способ лечения сахарного диабета у человека, включающий пероральное введение пациенту фармацевтической композиции, содержащей инсулин, Na-EDTA, омега-3 жирную кислоту и по меньшей мере два ингибитора протеаз, что таким образом обеспечивает лечение сахарного диабета. Согласно другому варианту реализации настоящего изобретения предложен способ лечения сахарного диабета у человека, включающий пероральное введение пациенту фармацевтической композиции, содержащей инсулин, Na-EDTA, омега-3 жирную кислоту и по меньшей мере два ингибитора протеаз, что таким образом обеспечивает лечение сахарного диабета.
[0093] Согласно другому варианту реализации настоящего изобретения предложен способ лечения сахарного диабета у человека, включающий пероральное введение пациенту фармацевтической композиции, содержащей экзенатид и по меньшей мере два ингибитора протеаз, что таким образом обеспечивает лечение сахарного диабета. Согласно другому варианту реализации настоящего изобретения предложен способ лечения сахарного диабета у человека, включающий пероральное введение пациенту фармацевтической композиции, содержащей экзенатид и по меньшей мере два ингибитора протеаз, что таким образом обеспечивает лечение сахарного диабета.
[0094] Согласно другому варианту реализации настоящего изобретения предложен способ лечения сахарного диабета у человека, включающий пероральное введение пациенту фармацевтической композиции, содержащей экзенатид, омега-3 жирную кислоту и по меньшей мере два ингибитора протеаз, что таким образом обеспечивает лечение сахарного диабета. Согласно другому варианту реализации настоящего изобретения предложен способ лечения сахарного диабета у человека, включающий пероральное введение пациенту фармацевтической композиции, содержащей экзенатид, омега-3 жирную кислоту и по меньшей мере два ингибитора протеаз, что таким образом обеспечивает лечение сахарного диабета.
[0095] Согласно другому варианту реализации настоящего изобретения предложен способ лечения сахарного диабета у человека, включающий пероральное введение пациенту фармацевтической композиции, содержащей экзенатид, Na-EDTA, омега-3 жирную кислоту и по меньшей мере два ингибитора протеаз, что таким образом обеспечивает лечение сахарного диабета. Согласно другому варианту реализации настоящего изобретения предложен способ лечения сахарного диабета у человека, включающий пероральное введение пациенту фармацевтической композиции, содержащей экзенатид, Na-EDTA, омега-3 жирную кислоту и по меньшей мере два ингибитора протеаз, что таким образом обеспечивает лечение сахарного диабета.
[0096] В одном из вариантов реализации настоящего изобретения сахарный диабет представляет собой диабет первого типа. В другом варианте реализации сахарный диабет представляет собой диабет второго типа. В другом варианте реализации сахарный диабет представляет собой инсулинозависимый диабет. В другом варианте реализации сахарный диабет представляет собой инсулиннезависимый диабет. В другом варианте реализации сахарный диабет представляет собой любой другой тип диабета известный в данной отрасли. Каждая возможность представляет собой отдельный вариант реализации настоящего изобретения
[0097] В одном из вариантов реализации настоящего изобретения композицию, содержащую инсулин, вводят три раза в день. В другом варианте реализации указанную композицию вводят два раза в день. В другом варианте реализации указанную композицию вводят четыре раза в день. В другом варианте реализации указанную композицию вводят один раз в день. В другом варианте реализации указанную композицию вводят более четырех раз в день. Каждая возможность представляет собой отдельный вариант реализации настоящего изобретения.
[0098] В различных вариантах реализации любого из способов согласно настоящему изобретению можно использовать любые композиции согласно настоящему изобретению.
[0099] Согласно другому варианту реализации настоящего изобретения предложена композиция для перорального введения инсулина, содержащая белок инсулина и по меньшей мере два ингибитора протеаз, в которой значительная часть инсулина сохраняет ферментативную активность после абсорбции через слизистый барьер кишечника у человека. Согласно другому варианту реализации настоящего изобретения предложена композиция для перорального введения экзенатида, содержащая экзенатид и по меньшей мере два ингибитора протеаз, в которой значительная часть экзенатида сохраняет ферментативную активность после абсорбции через слизистый барьер кишечника у человека. Согласно одному из вариантов реализации настоящего изобретения предложена композиция для перорального введения белка, содержащая белок и по меньшей мере два ингибитора протеаз, в которой значительная часть белка сохраняет ферментативную активность после абсорбции через слизистый барьер кишечника у человека.
[00100] В одном из вариантов реализации настоящего изобретения предложено применение белка и по меньшей мере двух ингибиторов протеаз в производстве препарата для перорального введения белка, обладающего ферментативной активностью, субъекту, при котором значительная часть белка сохраняет ферментативную активность после абсорбции через слизистый барьер кишечника субъекта. В одном из вариантов реализации настоящего изобретения предложено применение белка, по меньшей мере двух ингибиторов протеаз и омега-3 жирной кислоты в производстве препарата для перорального введения белка, обладающего ферментативной активностью, субъекту, при котором значительная часть белка сохраняет ферментативную активность после абсорбции через слизистый барьер кишечника субъекта. В одном из вариантов реализации настоящего изобретения предложено применение белка, по меньшей мере двух ингибиторов протеаз, Na-EDTA и омега-3 жирной кислоты в производстве препарата для перорального введения белка, обладающего ферментативной активностью, субъекту, при котором значительная часть белка сохраняет ферментативную активность после абсорбции через слизистый барьер кишечника субъекта.
[00101] В одном из вариантов реализации настоящего изобретения предложено применение белка инсулина и по меньшей мере двух ингибиторов протеаз в производстве препарата для лечения сахарного диабета у субъекта. В одном из вариантов реализации настоящего изобретения предложено применение белка инсулина, по меньшей мере двух ингибиторов протеаз и омега-3 жирной кислоты в производстве препарата для лечения сахарного диабета у субъекта. В одном из вариантов реализации настоящего изобретения предложено применение белка инсулина, по меньшей мере двух ингибиторов протеаз, Na-EDTA и омега-3 жирной кислоты в производстве препарата для лечения сахарного диабета у субъекта.
[00102] В одном из вариантов реализации настоящего изобретения предложено применение белка экзенатида и по меньшей мере двух ингибиторов протеаз в производстве препарата для лечения сахарного диабета у субъекта. В одном из вариантов реализации настоящего изобретения предложено применение белка экзенатида, по меньшей мере двух ингибиторов протеаз и омега-3 жирной кислоты в производстве препарата для лечения сахарного диабета у субъекта. В одном из вариантов реализации настоящего изобретения предложено применение белка экзенатида, по меньшей мере двух ингибиторов протеаз, Na-EDTA и омега-3 жирной кислоты в производстве препарата для лечения сахарного диабета у субъекта.
[00103] В одном из вариантов реализации способы и композиции согласно настоящему изобретению имеют преимущество, которое заключается в более близкой имитации физиологической секреции инсулина поджелудочной железой. При секреции инсулина в воротную вену печень подвергается воздействию более высоких концентраций инсулина, чем периферические ткани. Аналогично, инсулин, введенный в соответствии с настоящим изобретением достигает кишечника и абсорбируется в организме через кишечник и через воротную систему попадает в печень. Указанный путь абсорбции, таким образом, сходен с физиологической секрецией инсулина поджелудочной железой, что делает возможным, в данном варианте реализации, тонкий контроль уровня глюкозы крови и метаболической активности печени и периферических органов, контролируемых инсулином. Напротив, когда инсулин вводят пациентам, страдающим диабетом с недостаточностью инсулина, через периферическую венозную систему, концентрация инсулина в воротной вене сходна с таковой в периферической циркуляции, что приводит к гипоинсулинемии в воротной вене и гиперинсулинемии в периферической венозной системе. Это ведет, в одном из вариантов, к патологическому паттерну утилизации глюкозы.
[00104] В другом варианте реализации настоящего изобретения разные компоненты композиций согласно настоящему изобретению абсорбируются с различными скоростями из просвета кишечника в кровоток. Абсорбция желчной кислоты, в одном из вариантов, происходит значительно быстрее, чем абсорбция инсулина.
[00105] По указанной причине, в другом варианте реализации настоящего изобретения схема приема лекарственного средства включает прием двух таблеток в разделенные моменты времени, например, вторую таблетку, содержащую более высокую концентрацию энхансера, принимают через определенный временной интервал (например, 30 минут) после первой таблетки. В другом варианте реализации некоторые из компонентов подвергают микроинкапсуляции для улучшения абсорбции инсулина в систему кровообращения. В другом варианте реализации некоторые из компонентов подвергают микроинкапсуляции для улучшения абсорбции экзенатида в систему кровообращения.
[00106] В одном из вариантов реализации протокол лечения согласно настоящему изобретению представляет собой терапевтический протокол. В другом варианте реализации протокол лечения согласно настоящему изобретению представляет собой профилактический протокол. Каждая из указанных возможностей представляет собой отдельный вариант реализации настоящего изобретения
[00107] В другом варианте реализации твердые носители/разбавители для применения в способах и композициях согласно настоящему изобретению включают, но не ограничиваются перечисленным: камедь, крахмал (например, крахмал из кукурузы, прежелатинизированный крахмал), сахар (например, лактозу, маннит, сахарозу, декстрозу), целлюлозный материал (например, микрокристаллическую целлюлозу), акрилат (например, полиметилакрилат), карбонат кальция, оксид магния, тальк или их смеси.
[00108] В другом варианте реализации настоящего изобретения композиции дополнительно содержат связывающие вещества (например, гуммиарабик, кукурузный крахмал, желатин, карбомер, этилцеллюлозу, гуаровую камедь, гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу, провидон), разрыхляющие агенты (например, кукурузный крахмал, картофельный крахмал, альгиновую кислоту, диоксид силикона, натрий кроскармилозу, кросповидон, гуаровую камедь, гликолят крахмал-натрия), буферы (например, Tris-HCl, ацетатный, фосфатный) для различных значений pH и ионной силы, добавки для предотвращения абсорбции на поверхностях, такие как альбумин или желатин, детергенты (например, Tween 20, Tween 80, Pluronic F68, соли желчных кислот), ингибиторы протеаз, ПАВ (например, лаурилсульфат натрия), усилители проникающей способности, растворяющие агенты (например, глицерин, полиэтиленглицерин), антиоксиданты (например, аскорбиновую кислоту, метабисульфит натрия, бутилированный гидроксианизол), стабилизаторы (например, гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу), повышающие вязкость агенты (например, карбомер, коллоидный диоксид силикона, этил целлюлозу, гуаровую камедь), подсластители, модификаторы вкуса (например, аспартам, лимонную кислоту), консерванты (например, тимерозал, бензиловый спирт, парабены), вещества скольжения (например, стеариновую кислоту, полиэтиленгликоль, лаурилсульфат натрия), усилители текучести (flow-aids) (например, коллоидный диоксид силикона), пластификаторы (например, диэтилфталат, триэтилцитрат), эмульгаторы (например, карбомер, гидроксипропилцеллюлозу, лаурилсульфат натрия), полимерные оболочки (например, полоксамеры или полоксамины), агенты для формирования оболочек и пленок (например, этилцеллюлозу, акрилаты, полиметакрилаты) и/или адъюванты. Каждое из вышеперечисленных вспомогательных веществ представляет собой отдельный вариант реализации настоящего изобретения.
[00109] В некоторых вариантах реализации лекарственные формы согласно настоящему изобретению готовят таким образом, чтобы добиться немедленного профиля высвобождения, длительного профиля высвобождения или пролонгированного профиля высвобождения. В некоторых вариантах реализации настоящего изобретения необходимого профиля высвобождения композиции достигают, используя определенные вспомогательные вещества, которые служат, например, в качестве связывающих веществ, разрыхлителей, наполнителей или материалов оболочки. В одном из вариантов композиция будет приготовлена так, чтобы добиться особого профиля высвобождения, согласно знаниям специалистов в данной отрасли.
[00110] В одном из вариантов реализации настоящего изобретения композицию готовят в виде лекарственную форму для перорального применения. В одном из вариантов композиция представляет собой твердую лекарственную форму для перорального применения, включающую таблетки, жевательные таблетки или капсулы. В одном из вариантов реализации указанные капсулы представляют собой мягкие желатиновые капсулы. В другом варианте реализации указанные капсулы согласно данной заявке представляют собой капсулы с жесткой оболочкой. В другом варианте реализации капсулы согласно данной заявке представляют собой капсулы с мягкой оболочкой. В другом варианте реализации капсулы согласно данной заявке изготовлены из желатина. В другом варианте реализации капсулы согласно данной заявке изготовлены из гелеобразующих веществ растительного происхождения типа каррагинанов и модифицированных форм крахмала и целлюлозы.
[00111] В других вариантах реализации, оболочки, обеспечивающие контролируемое или замедленное высвобождение лекарственного средства, использованные в способах и композициях согласно настоящему изобретению, включают лекарственную форму в липофильных депо (например, жирных кислотах, восках, маслах).
[00112] Композиции, согласно другому варианту реализации настоящего изобретения, также предполагают включение активного материала внутрь или на внешнюю поверхность составных препаратов из полимерных соединений, таких как полилактат, полигликолят, гидрогели и т.д. или на поверхность липосом, микроэмульсий, мицелл, однослойных или многослойных везикул, теней эритроцитов или сферопластов. Такие композиции будут влиять на физическое состояние, растворимость, стабильность, скорость высвобождения in vivo и скорость клиренса in vivo. В другом варианте реализации составные композиции активных ингредиентов покрыты оболочкой из полимеров (например, полоксамеров или полоксаминов).
[00113] В другом варианте реализации настоящего изобретения композиции, содержащие инсулин и омега-3 жирную кислоту, вводят в везикуле, например, в липосоме (см. Langer, Science 249: 1527-1533 (1990); Treat et al., в Liposomes in the Therapy of Infectious Disease and Cancer, Lopez-Berestein and Fidler (eds.), Liss, New York, pp.353-365 (1989); Lopez-Berestein, ibid., pp.317-327; см. в основном ibid). В другом варианте реализации настоящего изобретения композиции, содержащие экзенатид и омега-3 жирную кислоту, вводят в везикуле, например, в липосоме (см. Langer, Science 249: 1527-1533 (1990); Treat et al., в Liposomes in the Therapy of Infectious Disease and Cancer, Lopez-Berestein and Fidler (eds.), Liss, New York, pp.353-365 (1989); Lopez-Berestein, ibid., pp.317-327; см. в основном ibid).
[00114] Приготовление фармацевтических композиций, которые содержат активный компонент, например, путем смешивания, гранулирования или с помощью методов получения таблеток, хорошо разработано в данной отрасли. Обладающий лечебной активностью ингредиент часто смешивают со вспомогательными веществами, которые фармацевтически приемлемы и совместимы с активным ингредиентом. Для перорального введения, активные ингредиенты композиций согласно настоящему изобретению смешивают с добавками обычными для этих целей, такими как носители, стабилизаторы или инертные разбавители\дилюэнты и преобразуют традиционными способами в подходящие для введения формы, такие как таблетки, таблетки, покрытые оболочкой, жесткие или мягкие желатиновые капсулы, водные, спиртовые или масляные растворы.
[00115] Каждые из вышеуказанных добавок, вспомогательных веществ, препаратов и способов введения представляют отдельный вариант реализации настоящего изобретения.
[00116] В одном из вариантов реализации настоящего изобретения термин "лечение" относится собственно к лечению заболевания. В другом варианте реализации "лечение" относится к профилактике заболевания. В другом варианте реализации "лечение" относится к снижению уровня заболеваемости. В другом варианте реализации "лечение" относится к уменьшению проявлений симптомов заболевания. В другом варианте реализации "лечение" относится к инициации ремиссии. В другом варианте реализации "лечение" относится к замедлению прогрессирования заболевания.
РАЗДЕЛ ПОДРОБНОГО ОПИСАНИЯ ЭКСПЕРИМЕНТОВ
ПРИМЕР 1: КАПСУЛЫ, СОДЕРЖАЩИЕ БЕЛОК И КОМБИНАЦИЮ ИНГИБИТОРОВ ПРОТЕАЗ
МАТЕРИАЛЫ И ЭКСПЕРИМЕНТАЛЬНЫЕ МЕТОДЫ
Лекарственная форма
[00117] За 4 дня перед применением были приготовлены лекарственные формы, содержащие: (1) 8 мг инсулина, 150 мг EDTA, 125 мг SBTI в 1 мл рыбьего жира в капсуле из мягкого геля (SwissCup), (2) 8 мг инсулина, 150 мг EDTA, 150000 КИЕ апротинина в 1 мл рыбьего жира в капсуле из мягкого геля (SwissCup), (3) 8 мг инсулина, 150 мг EDTA, 150000 КИЕ апротинина, 125 мг SBTI в 1 мл рыбьего жира в капсуле из мягкого геля (SwissCup).
Лекарственные формы до применения хранили в холодильнике (4°C).
РЕЗУЛЬТАТЫ
[00118] В следующем эксперименте лекарственные формы согласно разделу "Лекарственная форма" были перорально приняты здоровыми людьми. Как представлено на Фиг.1, уровни глюкозы в крови были значительно снижены и более стабильны у людей, получивших лекарственную форму (3) (8 мг инсулина, 150 мг EDTA, 150000 КИЕ апротинина, 125 мг SBTI в 1 мл рыбьего жира в капсуле из мягкого геля (SwissCup)). Данные результаты свидетельствуют также, что два ингибитора протеаз в лекарственной форме (3) оказывали синергетическое действие в отношении снижения уровней глюкозы крови.
[00119] Следует подчеркнуть, что не наблюдалось различий в снижении уровней глюкозы крови в предшествующих экспериментах на собаках, которым вводили те же лекарственные формы, содержащие одиночный ингибитор протеазы (лекарственные формы 1 или 2, SBTI или апротинин) или лекарственную форму, которая содержит и SBTI, и апротинин (лекарственная форма 3). Таким образом, указанные результаты относительно снижения уровней глюкозы крови под воздействием инсулина и комбинации ингибиторов протеаз оказались неожиданными.
[00120] Более того, как представлено на Фиг.1D-F, общий инсулин крови был значительно выше особенно между 220-300 минутами у людей, получавших лекарственную форму (3) (8 мг инсулина, 150 мг EDTA, 150000 КИЕ апротинина, 125 мг SBTI в 1 мл рыбьего жира в капсуле из мягкого геля (SwissCup)). Данные результаты свидетельствуют также, что два ингибитора протеаз в лекарственной форме (3) оказывали синергетическое действие в отношении поддержания стабильных уровней инсулина.
[00121] Как представлено на Фиг.1G-I, уровни С-пептида в крови были значительно снижены у людей, получавших лекарственную форму (3) (8 мг инсулина, 150 мг EDTA, 150000 КИЕ апротинина, 125 мг SBTI в 1 мл рыбьего жира в капсуле из мягкого геля (SwissCup)). Данные результаты свидетельствуют также, что два ингибитора протеаз в лекарственной форме (3) оказывали синергетическое действие в отношении снижения уровней С-пептида крови.
[00122] В аналогичных экспериментах у здоровых людей было обнаружено, что лекарственные формы, содержащие: (1) 150 мг EDTA, 24 мг апротинина, 75 мг BBI и 10 мг инсулина; (2) 150 мг EDTA, 24 мг апротинина, 75 мг kunitz, 12 мг инсулина; и (3) 150 мг EDTA, 24 мг апротинина, 75 мг SBTI и 8 мг инсулина являются эффективными в отношении снижения уровней глюкозы крови и поддержания достаточных уровней инсулина крови на протяжении более 3-х часов после приема пищи.
[00123] Следует подчеркнуть, что не наблюдалось различий в снижении уровней С-пептида крови в предшествующем эксперименте на собаках, которым вводили те же лекарственные формы, содержащие одиночный ингибитор протеазы (лекарственные формы 1 или 2, SBTI или апротинин) или лекарственную форму, которая содержит и SBTI, и апротинин (лекарственная форма 3). Таким образом, указанные результаты относительно снижения уровней С-пептида крови под воздействием инсулина и комбинации ингибиторов протеаз оказались неожиданными.
[00124] Вышеописанные лекарственные формы также активны с количеством рыбьего жира 0,5 мл как у собак, так и у людей. Собаки не реагируют на апротинин. Поэтому у собак снижение уровней глюкозы крови под действием одного SBTI было эквивалентно снижению уровней глюкозы крови под действием и апротинина, и SBTI. Более того, лекарственная форма, содержащая инсулин и апротинин, но не SBTI, не снижала глюкозу крови у собак.
ПРИМЕР 2: ОПТИМИЗАЦИЯ ИСТОЧНИКА ОМЕГА-3 ЖИРНЫХ КИСЛОТ
[00125] Различные омега-3 жирные кислоты или источники омега-3 жирных кислот (например, перечисленные выше в данном описании) сравнивали по их способности предохранять инсулин после перорального введения в способах и композициях согласно настоящему изобретению. Таблетки или капсулы инсулина были приготовлены согласно вышеуказанным Примерам, за исключением того, что инсулин растворяли в другом источнике омега-3 жирных кислот, а не в рыбьем жире. Самый эффективный источник омега-3 жирных кислот использовали в последующих Примерах.
ПРИМЕР 3: ОПТИМИЗАЦИЯ ИНГИБИТОРОВ ПРОТЕАЗ
[00126] Различные ингибиторы протеаз (или нетоксичные, или имеющие приемлемую степень токсичности; например, перечисленные выше в данном описании) сравнивали по их способности предохранять инсулин после перорального введения в способах и композициях согласно настоящему изобретению. Таблетки или капсулы инсулина и/или экзенатида были приготовлены согласно вышеуказанным Примерам, за исключением того, что SBTI и/или апротинин заменяли другими ингибиторами протеаз. Количество ингибиторов протеаз также изменяли для определения их оптимального количества. Самые эффективные ингибиторы протеаз/количества ингибиторов протеаз использовали в последующих Примерах.
ПРИМЕР 4: ОПТИМИЗАЦИЯ ЭНХАНСЕРА
[00127] Различные энхансеры (например, перечисленные выше в данном описании) сравнивали по их способности улучшать абсорбцию инсулина после перорального введения в способах и композициях согласно настоящему изобретению. Таблетки или капсулы инсулина были приготовлены согласно вышеуказанным Примерам, за исключением того, что EDTA заменяли другими энхансерами. Количественное содержание энхансеров также изменяли для определения их оптимального содержания. Самый эффективный энхансер/количество энхансера использовали в последующих экспериментах.
ПРИМЕР 5: ОПТИМИЗАЦИЯ ТИПА И КОЛИЧЕСТВЕННОГО СОДЕРЖАНИЯ ИНСУЛИНА
[00128] Различные типы и количества инсулина (например, перечисленные выше в данном описании) сравнивали по их способности регулировать сахар крови в способах и композициях согласно настоящему изобретению. Таблетки или капсулы инсулина были приготовлены согласно вышеуказанным Примерам, за исключением того, что изменяли тип и количество инсулина. Самый эффективный тип/количество инсулина использовали в клинических испытаниях.
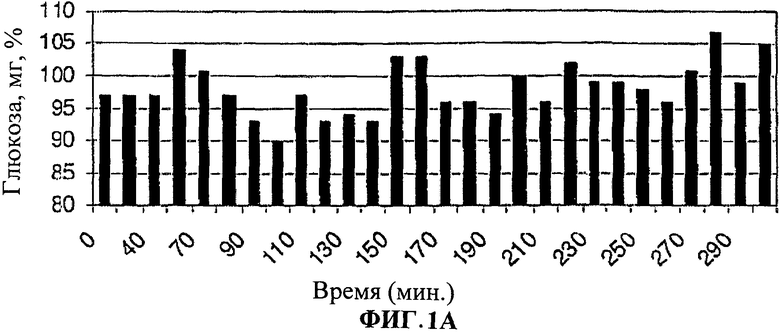
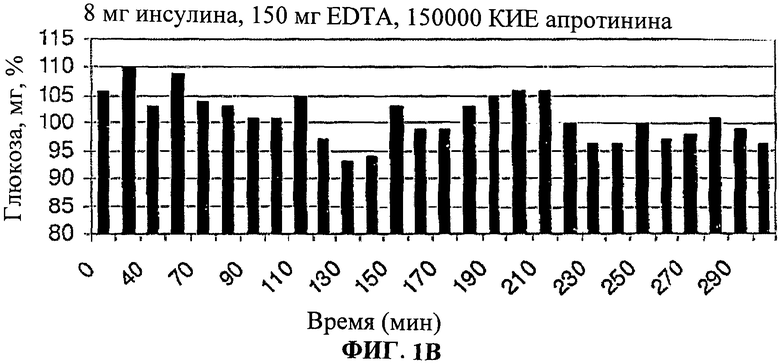
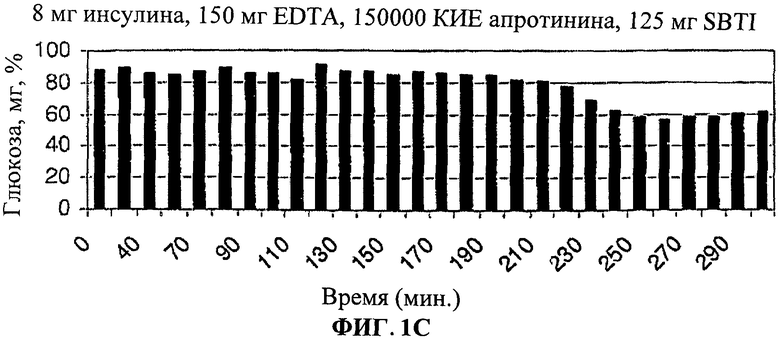
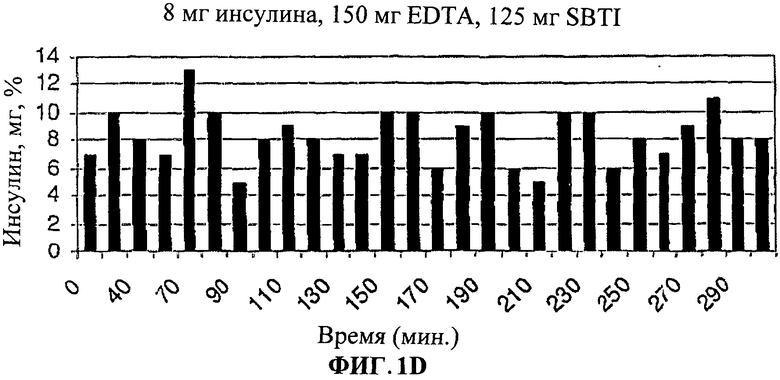
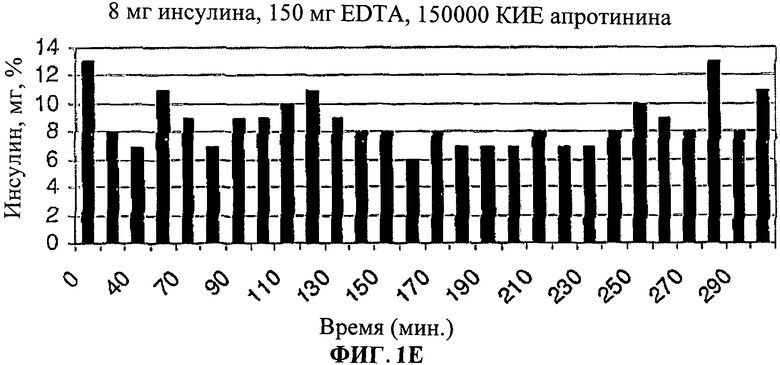
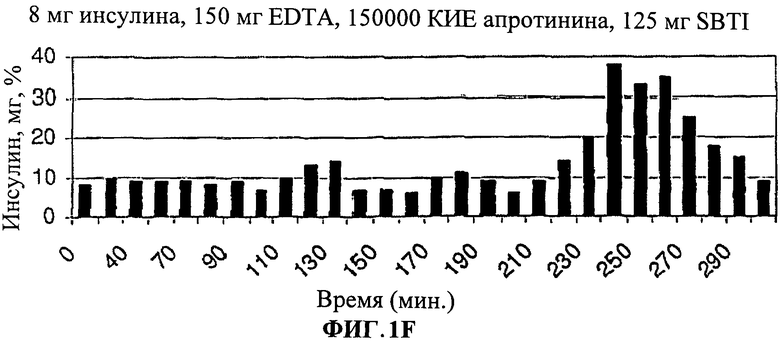
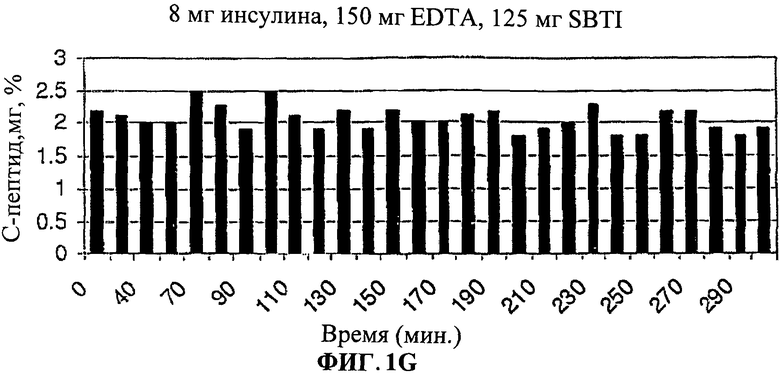
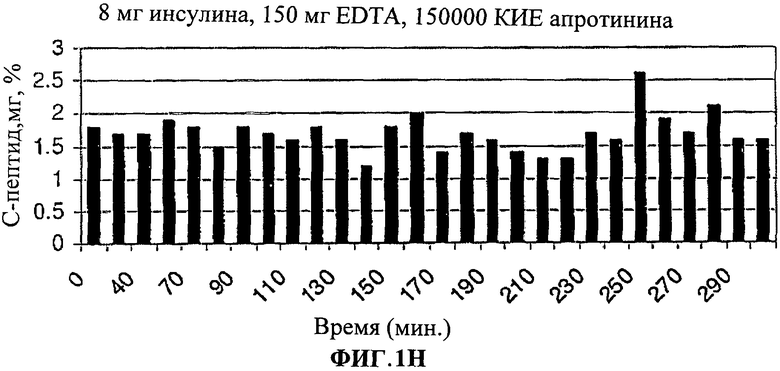
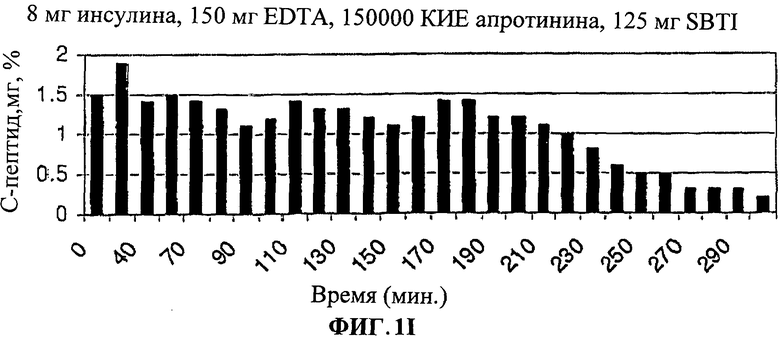
Группа изобретений относится к области биотехнологии. Пероральная фармацевтическая композиция для перорального введения белка субъекту содержит белок с молекулярной массой до 100000 дальтон, первый ингибитор протеазы и второй ингибитор протеазы. Причем указанный первый ингибитор протеазы представляет собой апротинин, а второй ингибитор протеазы выбран из группы, состоящей из ингибитора трипсина из бобов сои (SBTI) и ингибитора протеазы Бауман-Бирка (BBI). Использование данной композиции обеспечивает повышенную биодоступность и абсорбцию перорально вводимого белка. 2 н. и 17 з.п. ф-лы, 9 ил., 5 пр.
1. Пероральная фармацевтическая композиция для перорального введения белка субъекту, содержащая белок с молекулярной массой до 100000 Да, первый ингибитор протеазы и второй ингибитор протеазы, причем указанный первый ингибитор протеазы представляет собой апротинин, а второй ингибитор протеазы выбран из группы, состоящей из ингибитора трипсина из бобов сои (SBTI) и ингибитора протеазы Бауман-Бирка (BBI).
2. Фармацевтическая композиция для перорального введения по п.1, отличающаяся тем, что указанный белок имеет молекулярную массу от 1 до 50 кДа.
3. Фармацевтическая композиция для перорального введения по п.1, отличающаяся тем, что указанный белок представляет собой фермент.
4. Фармацевтическая композиция для перорального введения по п.1, отличающаяся тем, что указанный белок представляет собой инсулин.
5. Фармацевтическая композиция для перорального введения по п.1, отличающаяся тем, что указанный белок представляет собой экзенатид.
6. Фармацевтическая композиция для перорального введения по п.1, отличающаяся тем, что указанный белок выбран из группы, состоящей из глюкагона, гамма-интерферона, альфа-интерферона, гормона роста, эритропоэтина и гранулоцитарного колониестимулирующего фактора (G-CSF).
7. Фармацевтическая композиция для перорального введения по п.1, отличающаяся тем, что указанный белок выбран из группы, состоящей из лиганда рецептора, транспортного белка и запасного белка.
8. Фармацевтическая композиция для перорального введения по п.1, отличающаяся тем, что указанный белок представляет собой рекомбинантный белок.
9. Фармацевтическая композиция для перорального введения по п.1, дополнительно содержащая омега-3 жирную кислоту.
10. Фармацевтическая композиция для перорального введения по п.9, отличающаяся тем, что указанная омега-3 жирная кислота получена из рыбьего жира.
11. Фармацевтическая композиция для перорального введения по п.1, дополнительно содержащая вещество, которое увеличивает абсорбцию указанного белка через слизистый барьер кишечника.
12. Фармацевтическая композиция для перорального введения по п.11, отличающаяся тем, что указанное вещество представляет собой EDTA или ее соль.
13. Фармацевтическая композиция для перорального введения по п.11, отличающаяся тем, что указанное вещество представляет собой желчную кислоту или соль указанной кислоты со щелочным металлом.
14. Фармацевтическая композиция для перорального введения по п.1, дополнительно содержащая оболочку, которая ингибирует переваривание указанной фармацевтической композиции для перорального введения в желудке субъекта.
15. Фармацевтическая композиция для перорального введения по п.14, отличающаяся тем, что указанная оболочка представляет собой кишечно-растворимую оболочку или желатиновую оболочку.
16. Фармацевтическая композиция для пероралыюго введения по п.4 или 5 для лечения сахарного диабета у субъекта.
17. Фармацевтическая композиция для перорального введения по п.16, отличающаяся тем, что указанный инсулин или экзенатид представляет собой рекомбинантный инсулин или экзенатид.
18. Способ перорального введения белка с молекулярной массой до 100000 Да животному, отличному от человека, включающий пероральное введение указанному животному фармацевтической композиции для перорального введения по любому из пп.1-15 с обеспечением перорального введения белка с молекулярной массой до 100000 Да животному, отличному от человека.
19. Способ по п.18, отличающийся тем, что указанный белок представляет собой рекомбинантный белок.
| Пресс для выдавливания из деревянных дисков заготовок для ниточных катушек | 1923 |
|
SU2007A1 |
| Пломбировальные щипцы | 1923 |
|
SU2006A1 |
| Пломбировальные щипцы | 1923 |
|
SU2006A1 |
| ФАРМАЦЕВТИЧЕСКИЙ СОСТАВ, СПОСОБ ЕГО ПОЛУЧЕНИЯ И СПОСОБ УВЕЛИЧЕНИЯ БИОЛОГИЧЕСКОЙ ДОСТУПНОСТИ АКТИВНОГО ВЕЩЕСТВА С ИСПОЛЬЗОВАНИЕМ ДАННОГО СОСТАВА | 1991 |
|
RU2104715C1 |
| ZIV E et al | |||
| Oral administration of insulin solid form to nondiabetic and diabetic dogs, J Pharm | |||
| Sci., 1994, abstract. | |||
Авторы
Даты
2014-01-20—Публикация
2009-02-26—Подача