Область техники, к которой относится изобретение
Настоящее изобретение относится к микробиологической промышленности, в частности к способу получения пирролохинолинохинона (PQQ) с использованием бактерии, принадлежащей к роду Methylobacterium или Hyphomicrobium, модифицированной таким образом, что в указанной бактерии усилена экспрессия кластера генов pqq и/или гена(ов), кодирующего(их) предшественник для биосинтеза PQQ.
Уровень техники
Пирролохинолинохинон (PQQ) является кофактором для некоторых бактериальных дегидрогеназ, включая глюкозодегидрогеназу и метанолдегидрогеназу, локализованные в периплазме грамотрицательных бактерий, при культивировании которых он может накапливаться во внешней среде. Все штаммы-продуценты PQQ имеют PQQ-зависимые хинопротеины.
Известен способ продукции PQQ с использованием бактерий, принадлежащих к родам Achromobacter, Methylobacillus, Methylomonas, Methanomonas, Protaminobacter, Methylobacterium, Protomonas, Mycoplana, Ancyclobacter, Microcyclus, Hyphomicrobium, Xanthobacter, Thiobacillus, Alteromonas, Methylophaga, и некоторых видов рода Pseudomonas путем культивирования вышеперечисленных бактерий в среде, содержащей метанол и/или метиламин в качестве источника углерода (ЕР 0206471 В1).
Гены, участвующие в процессе биосинтеза PQQ, охарактеризованы для некоторых бактерий, включая Klebsiella pneumoniae, Acinetobacter calcoaceticus, Methylobacterium extorquens и Gluconobacter oxydans. Для биосинтеза PQQ бактерией К. pneumoniae необходимы шесть генов, М. extorquens (AM1) - семь генов, и только четыре гена необходимы бактерии A. calcoaceticus. Гены pqqA из различных видов кодируют небольшие белки размером от 23 до 29 аминокислот, которые содержат консервативные остатки глутамата и тирозина. PQQ образуется именно из этих консервативных аминокислот - глутамата и тирозина, - содержащихся в белке-предшественнике PqqA. PQQ синтезируется, предположительно, в результате пяти последовательных реакций (Puehringer et al. BMC Biochemistry (2008), 9:8 doi:10.1186/1471-2091-9-8). Некоторые белки, вовлеченные в биосинтез PQQ, функционально охарактеризованы.
Белок PqqB, предположительно, вовлечен в транспорт PQQ в периплазму. Было показано, что удаление PqqB способствует лишь незначительному накоплению PQQ в цитозоле, при этом PQQ в периплазме не накапливается (Velterop et al., Journal of bacteriology (1995) 177(17):5088-5098). Белок PqqC представляет собой оксидазу, катализирующую конечную стадию образования PQQ. Функция белка PqqD не известна. Недавно в К. pneumoniae было установлено взаимодействие белка PqqD с SAM белка PqqE (Wecksler et al., Chem Commun (2010) 46(37):7031-7033).
На основании анализа сиквенса и гомологии предполагается, что PqqE распознает PqqA-белок, образуя связи с атомами углерода глутамата и тирозина белка PqqA, обеспечивая, таким образом, взаимодействие белка PqqF с модифицированным PqqA. PqqF катализирует отщепление дипептида глутамат-тирозин от PqqA (Puehringer et al., BMC Biochemistry (2008) 9:8 doi:10.1186/1471-2091-9-8).
Было продемонстрировано, что в бактерии Escherichia coli, которая не способна синтезировать PQQ, биосинтез PQQ возможен при экспрессии кластера генов pqq из А. calcoaceticus (Goosen et al., J Bacteriol (1989) 171:447-455), К. pneumoniae (Meulenberg et al., FEMS Microbiol Lett (1990) 71:337-344), и G. oxydans (Yang et al., Journal of Industrial Microbiology & Biotechnology (2010) 37(6):575-580). Также описан положительный эффект влияния копийности генов pqq на продукцию PQQ в Methylobacterium extorquens AM1 (Wu et al., (1999) 45(6):869-872). Удаление гена тхbМ и кластера генов pqqABC/DE в М. extorquens AM1 приводило к прекращению накопления PQQ. Такой мутант, содержащий делецию, после введения плазмиды, несущей ген mxbM и кластер генов pqqABC/DE, был способен накапливать PQQ в количествах больших, чем штамм дикого типа. Вероятно, подобный эффект обусловлен повышенным содержанием копий генов pqq (Toyama et al., Microbiology (1998) 144:183-191).
Несмотря на вышесказанное, в настоящее время нет данных по усилению экспрессии кластера генов pqq в бактерии, принадлежащей к роду Hyphomicrobium, и по усилению экспрессии дополнительного гена(ов) pqqA, кодирующего(их) предшественник биосинтеза PQQ в бактерии рода Methylobacterium или Hyphomicrobium с целью получения PQQ.
Раскрытие изобретения
Цели настоящего изобретения состоят в предоставлении способов получения пирролохинолинохинона (PQQ) при помощи бактерии, принадлежащей к роду Methylobacterium или Hyphomicrobium.
Вышеуказанные цели были достигнуты благодаря обнаружению того факта, что повышенная экспрессия кластера генов pqq и гена(ов), кодирующих белки, гомологичные PqqA, может приводить к увеличению продукции PQQ.
Целью настоящего изобретения является предоставление способа получения PQQ, заключающегося в выращивании в питательной среде бактерии, принадлежащей к роду Hyphomicrobium, и выделении указанного вещества PQQ из культуральной жидкости, при этом указанная бактерия модифицирована таким образом, что экспрессия кластера генов pqq усилена.
Также целью настоящего изобретения является предоставление описанного выше способа, при этом указанный кластер генов pqq представляет собой оперон pqqABC/DE из Methylobacterium extorquens.
Также целью настоящего изобретения является предоставление описанного выше способа, при этом указанный оперон pqqABC/DE содержит ДНК-фрагменты, представленные нуклеотидными последовательностями SEQ ID NO: 1, SEQ ID NO: 3, SEQ ID NO: 5 и SEQ ID NO: 7.
Также целью настоящего изобретения является предоставление описанного выше способа, при этом кластер генов pqq представляет собой кластер генов pqqABCDE из Hyphomicrobium denitrificans.
Также целью настоящего изобретения является предоставление описанного выше способа, при этом указанный кластер генов pqqABCDE содержит ДНК-фрагменты, представленные нуклеотидными последовательностями SEQ ID NO: 14, SEQ ID NO: 16, SEQ ID NO: 18, SEQ ID NO: 20, и SEQ ID NO: 22.
Также целью настоящего изобретения является предоставление описанного выше способа, при этом экспрессия указанного кластера генов усилена путем увеличения числа копий указанного кластера генов pqq.
Также целью настоящего изобретения является предоставление описанного выше способа, при этом увеличение числа копий указанного кластера генов достигается путем введения в бактерию плазмиды, содержащей указанный кластер генов.
Также целью настоящего изобретения является предоставление описанного выше способа, при этом указанная бактерия представляет собой Hyphomicrobium denitrificans.
Также целью настоящего изобретения является предоставление описанного выше способа, при этом указанная питательная среда содержит метанол в качестве источника углерода.
Целью настоящего изобретения является предоставление способа получения PQQ, заключающегося в выращивании бактерии, принадлежащей к роду Methylobacterium или Hyphomicrobium, обладающей усиленной экспрессией кластера генов pqq, и выделении указанного вещества PQQ из культуральной жидкости, при этом указанная бактерия далее модифицирована таким образом, что экспрессия pqqA-подобного(ых) гена(ов) усилена.
Также целью настоящего изобретения является предоставление описанного выше способа, при этом указанный кластер генов pqq представляет собой оперон pqqABC/DE из Methylobacterium extorquens.
Также целью настоящего изобретения является предоставление описанного выше способа, при этом указанный оперон pqqABC/DE содержит ДНК-фрагменты, представленные нуклеотидными последовательностями SEQ ID NO: 1, SEQ ID NO: 3, SEQ ID NO: 5 и SEQ ID NO: 7.
Также целью настоящего изобретения является предоставление описанного выше способа, при этом указанный кластер генов pqq представляет собой кластер генов pqqABCDE из Hyphomicrobium denitrificans.
Также целью настоящего изобретения является предоставление описанного выше способа, при этом указанный кластер генов pqqABCDE содержит ДНК-фрагменты, представленные нуклеотидными последовательностями SEQ ID NO: 14, SEQ ID NO: 16, SEQ ID NO: 18, SEQ ID NO: 20 и SEQ ID NO: 22.
Также целью настоящего изобретения является предоставление описанного выше способа, при этом pqqA-подобный ген выбран из группы, состоящей из:
- ДНК-фрагмента, который кодирует белок, имеющий аминокислотную последовательность SEQ ID NO: 2;
ДНК-фрагмента, который кодирует белок, имеющий аминокислотную последовательность, которая содержит замену, делецию, вставку, добавление или инверсию одного или нескольких аминокислотных остатков в аминокислотной последовательности SEQ ID NO: 2, и имеющего функцию предшественника PQQ;
- ДНК-фрагмента, который кодирует белок, имеющий аминокислотную последовательность SEQ ID NO: 11;
- ДНК-фрагмента, который кодирует белок, имеющий аминокислотную последовательность, которая содержит замену, делецию, вставку, добавление или инверсию одного или нескольких аминокислотных остатков в аминокислотной последовательности SEQ ID NO: 11, и имеющего функцию предшественника PQQ;
- ДНК-фрагмента, который кодирует белок, имеющий аминокислотную последовательность SEQ ID NO: 13;
- ДНК-фрагмента, который кодирует белок, имеющий аминокислотную последовательность, которая содержит замену, делецию, вставку, добавление или инверсию одного или нескольких аминокислотных остатков в аминокислотной последовательности SEQ ID NO: 13, и имеющего функцию предшественника PQQ;
- ДНК-фрагмента, который кодирует белок, имеющий аминокислотную последовательность SEQ ID NO: 15;
- ДНК-фрагмента, который кодирует белок, имеющий аминокислотную последовательность, которая содержит замену, делецию, вставку, добавление или инверсию одного или нескольких аминокислотных остатков в аминокислотной последовательности SEQ ID NO: 15, и имеющего функцию предшественника PQQ;
- ДНК-фрагмента, который кодирует белок, имеющий аминокислотную последовательность SEQ ID NO: 26;
- ДНК-фрагмента, который кодирует белок, имеющий аминокислотную последовательность, которая содержит замену, делецию, вставку, добавление или инверсию одного или нескольких аминокислотных остатков в аминокислотной последовательности SEQ ID NO: 26, и имеющего функцию предшественника PQQ;
- ДНК-фрагмента, который кодирует белок, имеющий аминокислотную последовательность SEQ ID NO: 28;
- ДНК-фрагмента, который кодирует белок, имеющий аминокислотную последовательность, которая содержит замену, делецию, вставку, добавление или инверсию одного или нескольких аминокислотных остатков в аминокислотной последовательности SEQ ID NO: 28, и имеющего функцию предшественника PQQ;
- или их комбинации.
Также целью настоящего изобретения является предоставление описанного выше способа, при этом экспрессия указанного кластера генов или гена(ов) усилена путем увеличения числа копий указанных кластера генов или гена(ов).
Также целью настоящего изобретения является предоставление описанного выше способа, при этом увеличение числа копий указанного кластера генов или гена(ов) достигается путем введения в бактерию плазмиды, содержащей указанный кластер генов или ген(ы).
Также целью настоящего изобретения является предоставление описанного выше способа, при этом указанная бактерия представляет собой Hyphomicrobium denitrificans.
Также целью настоящего изобретения является предоставление описанного выше способа, при этом указанная бактерия представляет собой Methylobacterium extorquens.
Также целью настоящего изобретения является предоставление описанного выше способа, при этом указанная питательная среда содержит метанол в качестве источника углерода.
Настоящее изобретение более подробно будет описано ниже со ссылкой на последующие, но не ограничивающие настоящее изобретение Примеры.
Фигуры и их краткое описание
На Фигуре 1 изображены кластеры генов биосинтеза PQQ в различных штаммах. На Фигуре 2 изображено выравнивание последовательностей белков, гомологичных PqqA, из различных микроорганизмов.
На Фигуре 3 изображена карта плазмиды рНТ1.
На Фигуре 4 изображена карта плазмиды рСМ110.
На Фигуре 5 изображена карта плазмиды pPQQ1 (pCMpmxafABCDE).
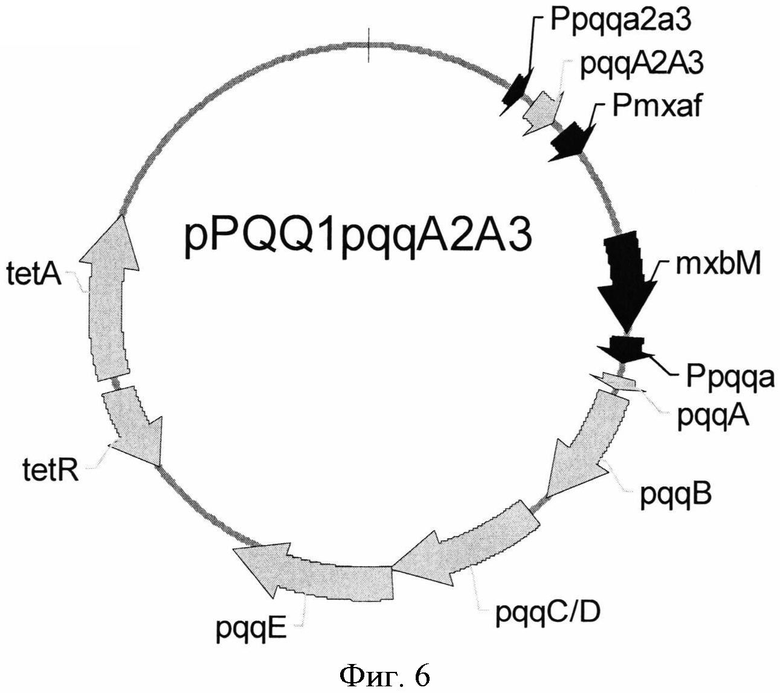
На Фигуре 6 изображена карта плазмиды pPQQ1pqqA2A3.
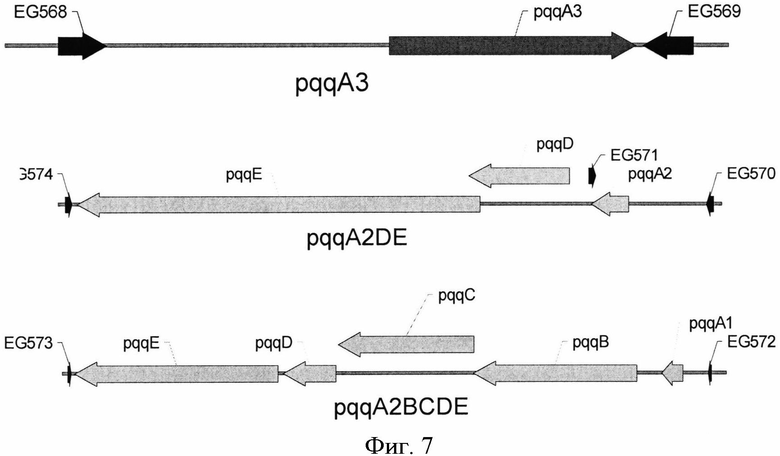
На Фигуре 7 изображена генетическая организация генов pqq на хромосоме H.denitrificans. Позиции праймеров, использованных для ПЦР-амплификации, показаны черными стрелками.
На Фигуре 8 изображено конструирование плазмиды pHABCDE.
На Фигуре 9 изображено конструирование плазмиды рНАВСОЕА3.
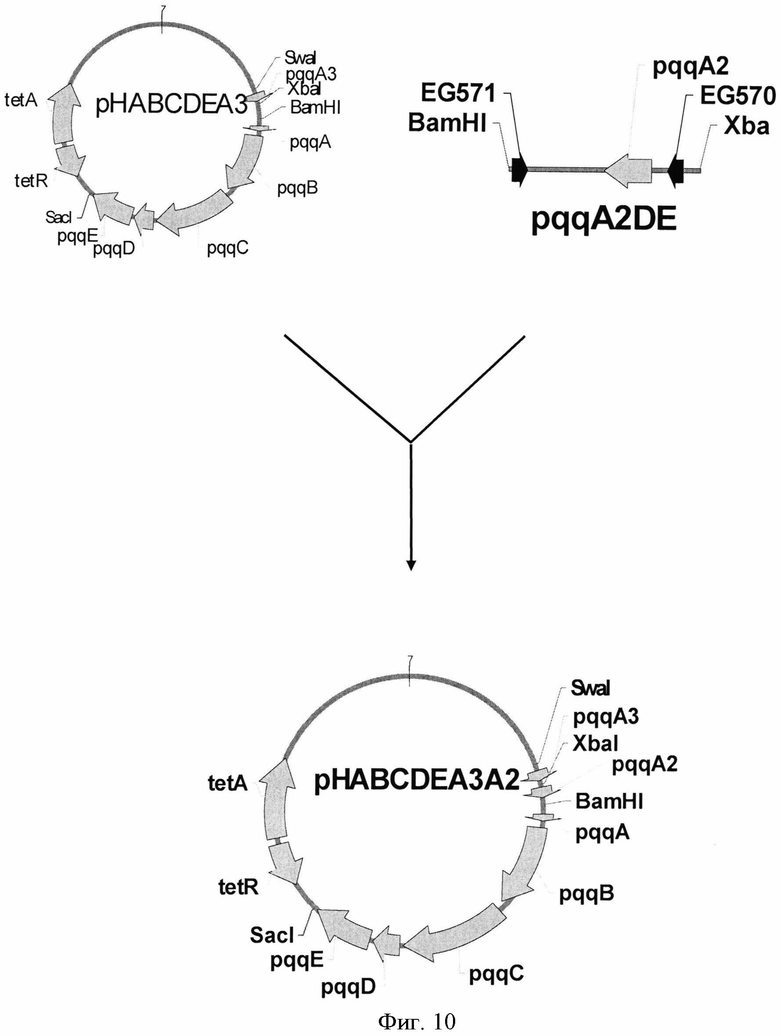
На Фигуре 10 изображено конструирование плазмиды pHABCDEA3A2.
Наилучший способ осуществления настоящего изобретения
1. Бактерия согласно настоящему изобретению
Бактерией согласно настоящему изобретению может быть бактерия-продуцент PQQ, при этом бактерия модифицирована таким образом, что экспрессия генов, вовлеченных в биосинтез PQQ, усилена.
Термин «бактерия-продуцент PQQ» может означать бактерию, которая способна к продукции и экскреции PQQ в среду, когда бактерия выращивается в среде. Термин «бактерия-продуцент PQQ» также может означать бактерию, которая способна производить и вызывать накопление PQQ в культуральной жидкости в количествах больших, чем природный или родительский штамм, например Methylobacterium, такой как штамм М. extorquens AM1, или Hyphomicrobium, такой как штамм Н. denitrificans АТСС51888. Термин «бактерия-продуцент PQQ» также может означать микроорганизм, способный накапливать в среде целевой продукт PQQ: в одном примере - в концентрации не менее 0,3 мг/л, в другом примере - не менее 1,0 мг/л.
Термин «бактерия, принадлежащая к роду Methylobacterium)) может означать, что бактерия относится к роду Methylobacterium в соответствии с классификацией, известной специалисту в области микробиологии. Более конкретно, могут быть использованы бактерии, классифицируемые как принадлежащие к роду Methylobacterium в соответствии с таксономией, используемой в базе данных NCBI (National Center for Biotechnology Information) (http://www.ncbi.nlm.nih.gov/Taxonomy/Browser/wwwtax.cgi). В качестве примеров бактерии, принадлежащей к роду Methylobacterium, можно привести, но не ограничиться этим, виды Methylobacterium extorquens (M. extorquens), Methylobacterium chloromethanicum, Methylobacterium mesophilicum, Methylobacterium nodulans, Methylobacterium organophilum, Methylobacterium oryzae, Methylobacterium podarium, Methylobacterium populi, Methylobacterium radiotolerans, Methylobacterium rhodesianum, Methylobacterium variabile, Methylobacterium sp.и т.д. Согласно современной таксономии род Protomonas отнесен к роду Methylobacterium (Bousfield et al., Int J Syst Bacteriol (1985) 35:209). Виды Pseudomonas rhodos, Pseudomonas radiora и Pseudomonas mesophilica были также отнесены к роду Methylobacterium (Green et al., Int J Syst Bacteriol (1983) 33:875-877).
Термин "бактерия, принадлежащая к роду Hyphomicrobium" может означать, что бактерия относится к роду Hyphomicrobium в соответствии с классификацией, известной специалисту в области микробиологии, хотя бактерия особым образом не ограничена. Более конкретно, могут быть использованы бактерии, классифицируемые как принадлежащие к роду Hyphomicrobium в соответствии с таксономией, используемой в базе данных NCBI (National Center for Biotechnology Information) (http://www.ncbi.nlm.nih.gov/Taxonomy/Browser/wwwtax.cgi). В качестве примеров бактерии, принадлежащей к роду Hyphomicrobium, можно привести, но не ограничиться этим, виды Hyphomicrobium denitrificans (H. denitrificans), Hyphomicrobium aestuarii, Hyphomicrobium chloromethanicum, Hyphomicrobium denitrificans, Hyphomicrobium facile, Hyphomicrobium methylovorum, Hyphomicrobium vulgare, Hyphomicrobium sp.и т.д.
В качестве примеров бактерий-продуцентов PQQ и родительских штаммов, которые могут быть использованы для создания бактерий-продуцентов PQQ, можно привести, но не ограничиться этим, бактериальные штаммы, которые изначально способны производить PQQ. Например, родительские штаммы, которые могут быть использованы для создания бактерий-продуцентов PQQ, могут включать, но не ограничиваться этим, штаммы, принадлежащие к роду Methylobacterium, такие как: М. mesophilicum АТСС 29983 - розово-окрашенная бактерия, использующая L(-)-арабинозу, D(-)-галактозу, D(-)-глюкозу, глицерин, натрия цитрат, натрия глутамат, натрия малат, натрия малонат, натрия пируват и натрия сукцинат в качестве единственного источника углерода (Austin et al., Int J Syst Bacteriol (1979) 29:373-378); М. extorquens AM1 - М. extorquens АТСС 43645 (DSM 1337, JCM 2802) и М. extorquens АТСС 14718 (DSM 1338, JCM 2805) (Urakami et al., Int J Syst Bacteriol (1984) 34(2): 188-201); М. rhodesianum JCM 2808 (АТСС 21612) и М. rhodesianum JCM 2809 (АТСС 21613) (Green et al., Int J Syst Bacteriol (1988) 38:124-127).
В качестве примеров родительских штаммов, принадлежащих к роду Hyphomicrobium, можно привести штаммы H. variable NCIB 10517 (US 3989594 (А)); H. vulgare NCIB 9698 (Skerman et al., Int J Syst Bacteriol (1980) 30:225-420), H. methylovorum IFO 14180 (АТСС 35216) (Izumi et al., J Ferment Technol (1982) 60:371-375); и Hyphomicrobium sp.DSM 1869 (АТСС 51888), использующие метанол, монометиламин, диметиламин, триметиламин, пектин и ацетат в качестве единственного источника углерода, и обладающие способностью утилизировать формиат и этанол (Urakami et al., Int J Syst Bacteriol (1995) 45:528-532).
Термин «усиление экспрессии кластера генов и/или ген(ов)» может означать, что экспрессия кластера генов и/или ген(ов) выше, чем то же в немодифицированном штамме, например в штамме дикого типа. В качестве примера подобной модификации можно привести увеличение числа копий экспрессируемого кластера генов или гена в расчете на одну клетку, увеличение уровня экспрессии кластера генов или гена и т.д. Число копий экспрессируемого кластера генов или гена измеряется, например, путем разрезания хромосомальной ДНК с последующим блоттингом по Саузерну, используя зонд, выбранный исходя из нуклеотидной последовательности гена, метод флуоресцентной гибридизации in situ (FISH) и подобное. Уровень экспрессии кластера генов или гена может быть измерен при помощи многих известных методов, например нозерн-блоттинга, количественной ОТ-ПЦР и подобного.
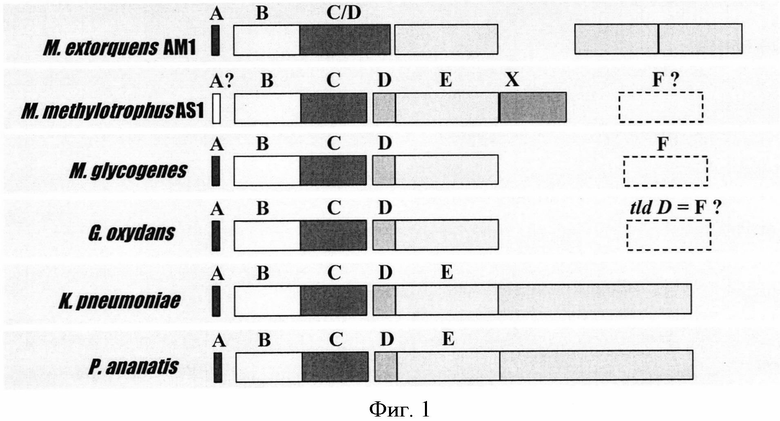
Термин «кластер генов pqq» может означать кластер генов или оперон, который кодирует белки, участвующие в биосинтезе PQQ. В настоящее время известны, например, нуклеотидные последовательности оперона pqqADCDEF из Klebsiella pneumoniae, кластера pqqADCDE из Acinetobacter calcoaceticus, кластера pqqADC/DE и pqqEF из Methylobacterium extorquens и кластера pqqADCDEF из Gluconobacter oxydans. Структуры кластера генов pqq из различных микроорганизмов схематически изображены на Фиг.1.
Известны гены, кодирующие белки, участвующие в биосинтезе PQQ в М. extorquens. М. extorquens содержит оперон pqqABC/DE, в котором гены pqqC и pqqD слиты, в то время как гены pqqFG образуют оперон с тремя другими генами (Zhang et al., Microbiology (2003) 149:1033-1040). Оперон pqqABC/DE экспрессируется под контролем промотора, расположенного перед геном pqqA.
Термин «оперон pqqABC/DE из Methylobacterium extorquens» может означать нуклеотидную последовательность, которая включает следующие структурные гены: pqqA, pqqB, pqqCD и pqqE, которые кодируют белки биосинтеза PQQ.
Ген pqqA кодирует белок-предшественник PqqA биосинтеза PQQ. Ген pqqA (нуклеотиды, комплементарные нуклеотидам в положении с 1825146 по 1825235, GenBank, инвентарный номер NC_012808.1; gi: 240136783) расположен между геном тхbМ и геном pqqB на хромосоме штамма М. extorquens AM1. Нуклеотидная последовательность гена pqqA и аминокислотная последовательность белка PqqA, кодируемого геном pqqA, приведены в SEQ ID NO: 1 и SEQ ID NO: 2 соответственно.
Ген pqqB кодирует белок PqqB биосинтеза PQQ, функция которого неизвестна. Ген pqqB (нуклеотиды, комплементарные нуклеотидам в положении с 1824199 по 1824891, GenBank, инвентарный номер NC_012808.1; gi: 240136783) расположен между геном pqqA и геном pqqCD на хромосоме штамма М. extorquens AM1. Нуклеотидная последовательность гена pqqB и аминокислотная последовательность белка PqqB, кодируемого геном pqqB, приведены в SEQ ID NO: 3 и SEQ ID NO: 4соответственно.
Ген pqqCD кодирует бифункциональный кофермент, белок PqqCD биосинтеза PQQ. Ген pqqCD (нуклеотиды, комплементарные нуклеотидам в положении с 1822914 по 1824032, GenBank, инвентарный номер NC_012808.1; gi: 240136783) расположен между геном pqqB и геном pqqE на хромосоме штамма М. extorquens AM1. Нуклеотидная последовательность гена pqqCD и аминокислотная последовательность слитого белка PqqCD, кодируемого геном pqqCD, приведены в SEQ ID NO: 5 и SEQ ID NO: 6соответственно.
Ген pqqE кодирует белок PqqE биосинтеза PQQ, функция которого неизвестна. Ген pqqE (нуклеотиды, комплементарные нуклеотидам в положении с 1821763 по 1822887, GenBank, инвентарный номер NC_012808.1; gi: 240136783) расположен после гена pqqCD на хромосоме штамма М. extorquens AM1. Нуклеотидная последовательность гена pqqE и аминокислотная последовательность белка PqqE, кодируемого геном pqqE, приведены в SEQ ID NO: 7 и SEQ ID NO: 8соответственно.
Нуклеотидная последовательность оперона pqqABC/DE из штамма М. extorquens AM1 приведена в SEQ ID NO: 9.
Недавно были опубликованы нуклеотидные последовательности полных геномов нескольких метилотрофных бактерий (Chistoserdova et al., J Bacteriol (2003) 185:2980-2987, Vuilleumier et al., (2009) PLoS ONE 4:1-14). Анализ доступных геномов позволил обнаружить присутствие дополнительных копий гена pqqA вне кластера pqqABCDE. Как было описано, в М. extorquens AM1 вторая и третья копии расположены в тандеме и, вероятно, экспрессируются под контролем общего промотора. Согласно настоящему изобретению одна из копий гена pqqA, расположенная между геном serS, ориентированным в противоположном направлении относительно копий генов pqqA, и другой копией гена pqqA на хромосоме М. extorquens AM1 (нуклеотиды в позиции с 4753498 по 4753587: GenBank, инвентарный номер NC_012808.1; gi: 240136783), была названа как ген pqqA2. Нуклеотидная последовательность гена pqqA2 и аминокислотная последовательность белка PqqA2, кодируемого геном pqqA2, приведены в SEQ ID NO: 10 и SEQ ID NO: 11соответственно. Далее, согласно настоящему изобретению другая копия гена pqqA, расположенная между геном pqqA2 и геном МехАМ1_МЕТА1р4630, ориентированном в противоположном направлении относительно гена ppqA2 на хромосоме M. extorquens AM1 (нуклеотиды в позиции с 4753650 to 4753739: GenBank, инвентарный номер NC_012808.1; gi: 240136783), была названа как ген pqqA3. Нуклеотидная последовательность гена pqqA3 и аминокислотная последовательность белка PqqA3, кодируемого геном pqqA3, приведены в SEQ ID NO: 12 и SEQ ID NO: 13соответственно.
Уровень гомологии между белками PqqA, PqqA2 и PqqA3 очень высок (Фиг.2). Более того, при исследовании известных последовательностей геномов пяти бактерий рода Methylobacterium было обнаружено, что M. chloromethanicum СМ4, M. populi BJ001 и M. radiotolerans JCM2831 имеют ту же организацию генов pqqA, что и M. extorquens AM1., M. extorquens DM4 содержит дополнительную копию гена pqqA, находящегося перед опероном pqqABC/DE., a Methylobacterium sp.4-46 и M. nodulans ORS2060 содержат две копии гена pqqA, находящиеся в начале кластера pqqABCDE. Компьютерный анализ генома Hyphomicrobium denitrificans ATCC51888 позволил выявить три копии гена pqqA, расположенные в различных локусах: первая копия гена pqqA (ORF Hden_1488), названная согласно настоящему изобретению как ген pqqA, расположена в предсказанном кластере генов pqqABCDE; вторая копия (ORF Hden_0553), названная согласно настоящему изобретению как ген pqqA2, расположена в предсказанном кластере генов pqqADE; и третья копия (ORF Hden_1488), названная согласно настоящему изобретению как ген pqqA3, расположена отдельно (Фиг.7).
Термин «кластер генов pqqABCDE из Hyphomicrobium denitrificans» может означать нуклеотидную последовательность, которая включает следующие ОРС (ОРС - открытая рамка считывания), кодирующие предполагаемые белки биосинтеза PQQ: предполагаемый ген pqqA (Hden_1488), предполагаемый ген pqqB (Hden_1487), предполагаемый ген pqqC (Hden_1486), предполагаемый ген pqqD (Hden_1485) и предполагаемый ген pqqE (Hden_1484). Нуклеотидная последовательность гена pqqA из Н. denitrificans и аминокислотная последовательность предполагаемого белка PqqA, кодируемого геном pqqA, приведены в SEQ ID NO: 14 и SEQ ID NO: 15соответственно. Нуклеотидная последовательность гена pqqB из Н. denitrificans и аминокислотная последовательность предполагаемого белка PqqB, кодируемого геном pqqB, приведены в SEQ ID NO: 16 и SEQ ID NO: 17соответственно. Нуклеотидная последовательность гена pqqC из H. denitrificans и аминокислотная последовательность предполагаемого белка PqqC, кодируемого геном pqqC, приведены в SEQ ID NO: 18 и SEQ ID NO: 19соответственно. Нуклеотидная последовательность гена pqqD из H. denitrificans и аминокислотная последовательность предполагаемого белка PqqD, кодируемого геном pqqD, приведены в SEQ ID NO: 20 и SEQ ID NO: 21соответственно. Нуклеотидная последовательность гена pqqE из H. denitrificans и аминокислотная последовательность предполагаемого белка PqqE, кодируемого геном pqqE, приведены в SEQ ID NO: 22 и SEQ ID NO: 23соответственно. Нуклеотидная последовательность кластера генов pqqABCDE из H. denitrificans ATCC51888 приведена в SEQ ID NO: 24.
Ген pqqA2 (синоним: Hden_0553) кодирует предсказанный белок PqqA. Ген pqqA2 (нуклеотиды, комплементарные нуклеотидам в положении с 585973 по 586080; GenBank, инвентарный номер NC_014313.1; gi: 300021538) расположен между геном Hden_0552 и геном Hden_0554 на хромосоме штамма H. denitrificans ATCC51888. Нуклеотидная последовательность гена pqqA2 и аминокислотная последовательность предполагаемого белка PqqA2, кодируемого геном pqqA2, приведены в SEQ ID NO: 25 и SEQ ID NO: 26соответственно.
Ген pqqA3 (синоним: Hden_2110) кодирует предсказанный белок PqqA. Ген pqqA3 (нуклеотиды, комплементарные нуклеотидам в положении с 2160533 по 2160432; GenBank, инвентарный номер NC_014313.1; gi: 300021538) расположен между геном Hden_2109 и геном Hden_2 111, оба ориентированы в противоположных направлениях, на хромосоме штамма H. denitrificans ATCC51888. Нуклеотидная последовательность гена pqqA3 и аминокислотная последовательность предполагаемого белка PqqA3, кодируемого геном pqqA3, приведены в SEQ ID NO: 27 и SEQ ID NO: 28соответственно.
Термин «рpqA-подобный ген» может означать, что ген расположен в бактериальном геноме и кодирует предшественник биосинтеза PQQ. Согласно настоящему изобретению каждый из вышеописанных генов pqqA, pqqA2 и pqqA3 из М. extorquens AM1, равно как и гены pqqA, pqqA2 HpqqA3 из H. denitrificans ATCC51888, могут быть названы «pqqA-подобный ген». Наличие pqqA-подобного гена в бактериальном геноме может быть определено путем анализа сиквенса генома в дополнение к базам данных, содержащих информацию об аннотированных генах pqqA из различных микроорганизмов. Могут быть использованы pqqA-подобные гены из широкого спектра микроорганизмов. Примеры бактерии, содержащей в геноме pqqA-подобный ген, не ограничиваются вышеупомянутым примером относительно метилотрофов. В качестве примеров бактерии, содержащей в геноме pqqA-подобный ген, можно привести Methylococcus capsulatus Bath, Colwellia psychrerythraea 34H, Gluconobacter oxydans 621H, Methylobacillus flagellatus KT, Dinoroseobacter shibae DFL 12, Leptothrix cholodnii SP-6, Erwinia amylovora ATCC 49946, Acinetobacter sp.RUH2624, Saccharopolyspora erythraeaNRRL23338, Bradyrhizobium sp.ORS278, Bradyrhizobium sp.BTAi1/ATCC BAA-1182, Ralstonia pickettii 12J, Pseudomonas fluorescensa и т.д. Некоторые бактерии содержат в геноме множественные копии pqqA-подобного гена, например Methylotenera mobilis JLW8, Methylovorus sp.SIP3-4, Methylobacterium extorquens DM4 и Methylobacterium sp.4-46.
Ввиду того, что могут быть некоторые различия в последовательностях ДНК между родами и штаммами, нуклеотидные последовательности кластера генов и гена(ов), экспрессия которых усилена, не ограничены нуклеотидными последовательностями генов, приведенных в SEQ ID NO: 1, SEQ ID NO: 3, SEQ ID NO: 5, SEQ ID NO: 7, SEQ ID NO: 10, SEQ ID NO: 12, SEQ ID NO: 14, SEQ ID NO: 16, SEQ ID NO: 18, SEQ ID NO: 20, SEQ ID NO: 22, SEQ ID NO: 25, SEQ ID NO: 27, но могут включать гены, гомологичные SEQ ID NO: 1, SEQ ID NO: 3, SEQ ID NO: 5, SEQ ID NO: 7, SEQ ID NO: 10, SEQ ID NO: 12, SEQ ID NO: 14, SEQ ID NO: 16, SEQ ID NO: 18, SEQ ID NO: 20, SEQ ID NO: 22, SEQ ID NO: 25, SEQ ID No: 27. Следовательно, варианты белков, кодируемые генами, могут иметь типичную гомологию, не менее чем 80%, не менее чем 90% или не менее чем 95% по отношению к целой аминокислотной последовательности, приведенной в SEQ ID No: 1, SEQ ID NO: 3, SEQ ID NO: 5, SEQ ID NO: 7, SEQ ID NO: 10, SEQ ID NO: 12, SEQ ID NO:
14, SEQ ID NO: 16, SEQ ID NO: 18, SEQ ID NO: 20, SEQ ID NO: 22, SEQ ID NO: 25, SEQ ID NO: 27, при условии, что активность или функция соответствующего белка сохранена.
Термин «вариант белка», используемый в настоящем изобретении, означает белок, который содержит изменения в последовательности, которыми могут быть делеции, вставки, добавления или замены аминокислотных остатков. Количество изменений в вариантах белков может зависеть от вида или положения аминокислотного остатка в третичной структуре белка. Оно может быть от 1 до 30, предпочтительно от 1 до 15, более предпочтительно от 1 до 5 в SEQ ID NO: 2, SEQ ID NO; 4, SEQ ID NO: 6, SEQ ID NO: 8, SEQ ID NO: 11, SEQ ID NO: 13, SEQ ID NO: 15, SEQ ID NO: 17, SEQ ID NO: 19, SEQ ID NO: 21, SEQ ID NO: 23, SEQ ID NO: 26 или SEQ ID NO: 28. В вариантах белков подобные изменения могут быть в областях, некритичных для функции белка, так как некоторые аминокислоты в высокой степени гомологичны другим, так что третичная структура не изменяется. Выравнивание последовательностей белков, гомологичных PqqA, из различных микроорганизмов приведено на Фиг.2.
Известно, что PqqA-пептиды из различных микроорганизмов включают два консервативных аминокислотных остатка - глутамат и тирозин, которые разделены тремя аминокислотными остатками (мотив E-X-X-X-Y). Изменения в вариантах белков могут быть в неконсервативных областях.
Термин «белок, имеющий функцию предшественника PQQ» может означать, что этот белок может участвовать в биосинтезе PQQ в качестве предшественника PQQ; более точно, этот белок может иметь третичную структуру, которая достаточна для того, чтобы белок был распознанным и использованным в качестве субстрата белками биосинтеза PQQ с последующим превращением в PQQ.
Гомология между двумя аминокислотыми последовательностями может быть определена с использованием известных методов, например компьютерной программы BLAST 2.0, которая считает три параметра: число аминокислотных остатков, идентичность и сходство.
Делеции, вставки, добавления или замены одного или нескольких аминокислотных остатков должны представлять консервативную(ые) мутацию(и), чтобы сохранить активность и функцию.
Типичной консервативной мутацией является консервативная замена. В качестве примеров консервативной замены можно привести замену Ser или Thr на Аlа, замену Gln, His или Lys на Arg, замену Glu, Gln, Lys, His или Asp на Asn, замену Asn, Glu или Gln на Asp, замену Ser или Аlа на Cys, замену Asn, Glu, Lys, His, Asp или Arg на Gln, замену Asn, Gln, Lys или Asp на Glu, замену Pro на Gly, замену Asn, Lys, Gln, Arg или Tyr на His, замену Leu, Met, Val или Phe на Ile, замену Ile, Met, Val или Phe на Leu, замену Asn, Glu, Gln, His или Arg на Lys, замену Ile, Leu, Val или Phe на Met, замену Trp, Tyr, Met, Ile или Leu на Phe, замену Thr или Аlа на Ser, замену Ser или Аlа на Thr, замену Phe или Tyr на Trp, замену His, Phe или Trp на Tyr и замену Met, Ile или Leu на Val.
Следовательно, кластер генов и ген(ы) могут быть вариантами, если они гибридизуются в жестких условиях с нуклеотидной последовательностью, приведенной в Перечне последовательностей под номерами SEQ ID NO: 1, SEQ ID NO: 3, SEQ ID NO: 5, SEQ ID NO: 7, SEQ ID NO: 10, SEQ ID NO: 12, SEQ ID NO: 14, SEQ ID NO: 16, SEQ ID NO: 18, SEQ ID NO: 20, SEQ ID NO: 22, SEQ ID NO: 25, SEQ ID No: 27, или с зондом, который может быть синтезирован на основе указанной нуклеотидной последовательности, при условии, что до инактивации он кодирует функциональный белок. Под «жесткими условиями» понимаются такие условия, в которых образуются специфические гибриды, например гибриды, имеющие гомологию не менее 60%, 70%, 80%, 90% или 95%, и в которых не образуются неспецифические гибриды, например гибриды, имеющие гомологию меньшую, чем указанно выше.
Практическим примером жестких условий является однократная отмывка, предпочтительно двух- или трехкратная, при концентрации солей 1×SSC, 0.1% SDS, предпочтительно 0.1×SSC, 0.1% SDS, при 60°С. Продолжительность отмывки зависит от типа используемой для блоттинга мембраны и, как правило, такова, как рекомендовано производителем. Например, рекомендуемая продолжительность отмывки для нейлоновой мембраны Hybond™ N+(Amersham) при строгих условиях составляет 15 минут. Предпочтительна двух- и трехкратная отмывка. Длина зонда может быть выбрана в зависимости от условий гибридизации, в данном конкретном случае она может быть около 100-1000 п.н.
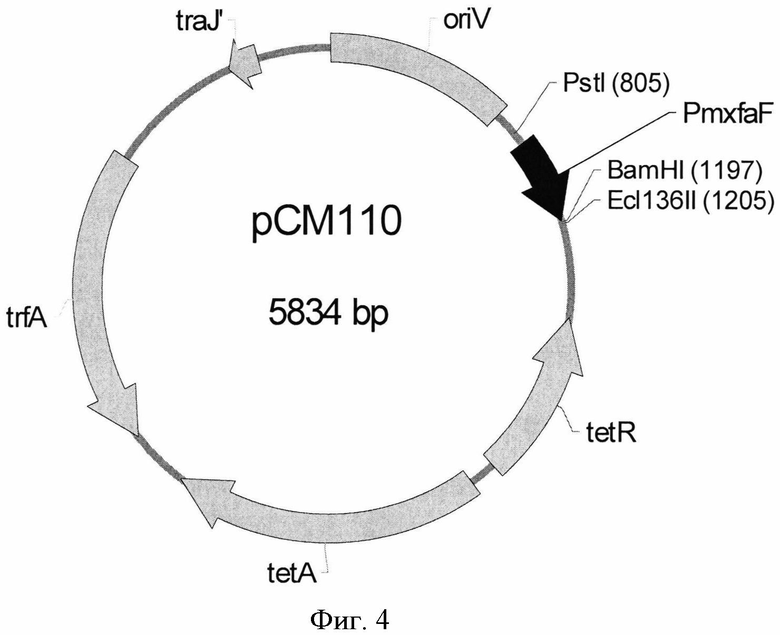
К способам, которые могут быть использованы для усиления экспрессии кластера генов и/или гена(ов), относятся увеличение копийности кластера генов и/или гена(ов) и введение кластера генов и/или гена(ов) в вектор, который позволяет увеличить число копий кластера генов и/или гена(ов) в бактерии рода Methylobacterium или Hyphomicrobium. В качестве примеров таких векторов можно привести, но не ограничиться этим, векторы с широким кругом хозяев (broad-host-range vectors), например pCM110, pRK.310, pVK101, pBBR122, pBHR1 и подобные.
Усиление экспрессии кластера генов и/или гена(ов) может также быть достигнуто путем введения множества копий гена в бактериальную хромосому, например, методом гомологичной рекомбинации, Mu интеграции и т.п. Например, один акт Mu интеграции позволяет ввести в бактериальную хромосому до 3 копий гена.
Число копий кластера генов и/или гена(ов) также может быть увеличено путем введения множества копий кластера генов и/или гена(ов) в хромосомную ДНК бактерии. Для введения множества копий кластера генов и/или гена(ов) в бактериальную хромосому может быть выполнена гомологичная рекомбинация с использованием в качестве целевых последовательностей те, которые присутствуют в хромосоме во множестве копий. Последовательности с множеством копий в хромосомной ДНК включают, но не ограничиваются ими, повторяющиеся ДНК или инвертированные повторы, присутствующие на концах мобильных элементов. Также возможно включить кластер генов и/или ген(ы) в состав транспозона и обеспечить его перенос для введения множества копий кластера генов и/или гена(ов) в хромосомную ДНК.
Усиление экспрессии кластера генов и/или гена(ов) также может быть достигнуто путем подстановки фрагмента ДНК под контроль сильного промотора. Примерами сильных промоторов являются lac промотор, trp промотор, trc промотор, pr или pl промоторы фага λ. Могут использоваться сильные промоторы, обеспечивающие высокий уровень экспрессии генов в бактерии, принадлежащей к роду Hyphomicrobium или Methylobacterium, особенно промотор метанолдегидрогеназы PmxaF, который известен как сильный метанол-индуцируемый промотор в Methylobacterium. Использование сильного промотора можно сочетать с увеличением копий кластера генов и/или гена(ов).
С другой стороны, действие промотора может быть усилено, например, введением в промотор мутации, ведущей к увеличению уровня транскрипции локализованного за промотором кластера генов и/или гена(ов). Кроме того, известно, что замена нескольких нуклеотидов в области между сайтом связывания рибосомы (ribosome binding site - RBS) и стартовым кодоном, особенно в последовательности непосредственно перед стартовым кодоном, существенно влияет на трансляционную способность мРНК. Например, обнаружен 20-кратный разброс в уровне экспрессии в зависимости от природы трех нуклеотидов, предшествующих стартовому кодону (Gold et al., Annu Rev Microbiol (1981) 35:365-403; Hui et al, EMBO J (1984) 3:623-629).
Кроме того, возможно ввести нуклеотидную замену в область промотора кластера генов и/или гена(ов) на бактериальной хромосоме, результатом чего является усиление функции промотора.
Методы приготовления плазмидной ДНК, рестрикции и лигирования ДНК, трансформации, выбора нуклеотидов в качестве праймера и т.п. могут быть обычными методами, известными специалисту в этой области. Эти методы описаны, например, в Sambrook, J., Fritsch, E.F, and Maniatis, Т., "Molecular Cloning: A Laboratory Manual, Second Edition", Cold Spring Harbor Laboratory Press (1989).
2. Способ
Способом согласно настоящему изобретению является способ получения PQQ, включающий стадии выращивания бактерии согласно настоящему изобретению в питательной среде с целью продукции и накопления PQQ в питательной среде, и выделения PQQ из культуральной жидкости.
Выращивание, выделение и очистка PQQ от культуральной или подобной ей жидкости может быть осуществлена способом, подобным традиционным способам ферментации, в которых PQQ продуцируется с использованием бактерии.
Питательная среда, используемая для выращивания, может быть как синтетической, так и натуральной, при условии, что указанная среда содержит источники углерода, азота, минеральные добавки и, если необходимо, соответствующее количество питательных добавок, необходимых для роста микроорганизмов. В качестве источника углерода могут использоваться различные углеводы, такие как глюкоза или сахароза, различные органические кислоты, спирты, такие как метанол, этанол и глицерин. Метанол более предпочтителен. В качестве источника азота могут использоваться различные неорганические соли аммония, такие как аммиак и сульфат аммония, другие соединения азота, такие как амины, природные источники азота, такие как пептон, гидролизат соевых бобов, ферментолизат микроорганизмов. В качестве источника серы могут быть сульфат аммония, сульфат магния, сульфат железа, сульфат марганца и другие соединения серы. В качестве минеральных добавок могут использоваться фосфат калия, хлорид натрия, хлорид кальция и подобные им соединения. В качестве витаминов могут использоваться тиамин, дрожжевой экстракт и т.п.
Выращивание может осуществляться в аэробных условиях, таких как перемешивание культуральной жидкости на качалке, взбалтывание с аэрацией, при температуре в пределах от 20 до 40°С, или в пределах от 25 до 37°С в другом примере. рН среды поддерживают в пределах от 5 до 9, или от 6 до 8 в другом примере. рН среды может регулироваться аммиаком, карбонатом кальция, различными кислотами, основаниями и буферными растворами. Обычно выращивание в течение от 1 до 5 дней приводит к накоплению целевой PQQ в культуральной среде.
После выращивания твердые остатки, такие как клетки, могут быть удалены из культуральной жидкости методом центрифугирования или фильтрацией через мембрану, а затем PQQ может быть выделена и очищена методами ионообменной хроматографии, концентрирования и/или кристаллизации.
Примеры осуществления настоящего изобретения
Пример 1: Конструирование плазмид, содержащих гены биосинтеза PQQ из М. extorquens
1. Конструирование плазмиды pPQQ1
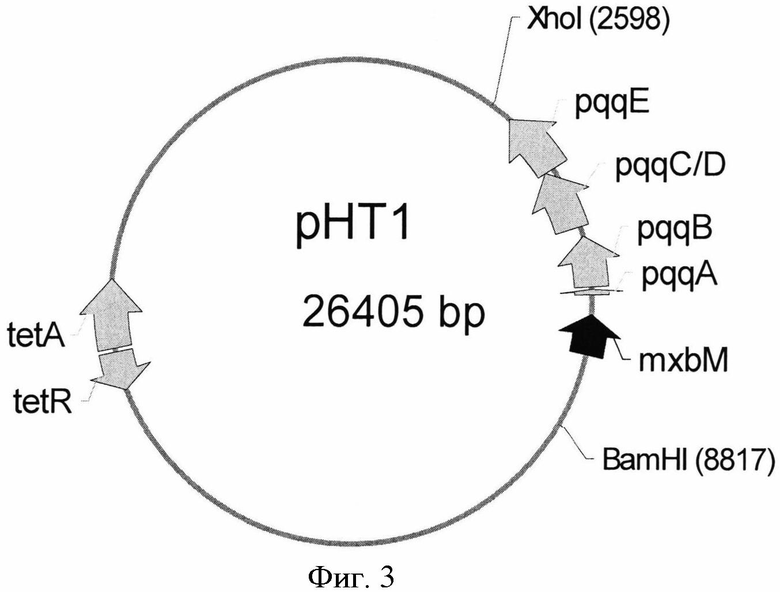
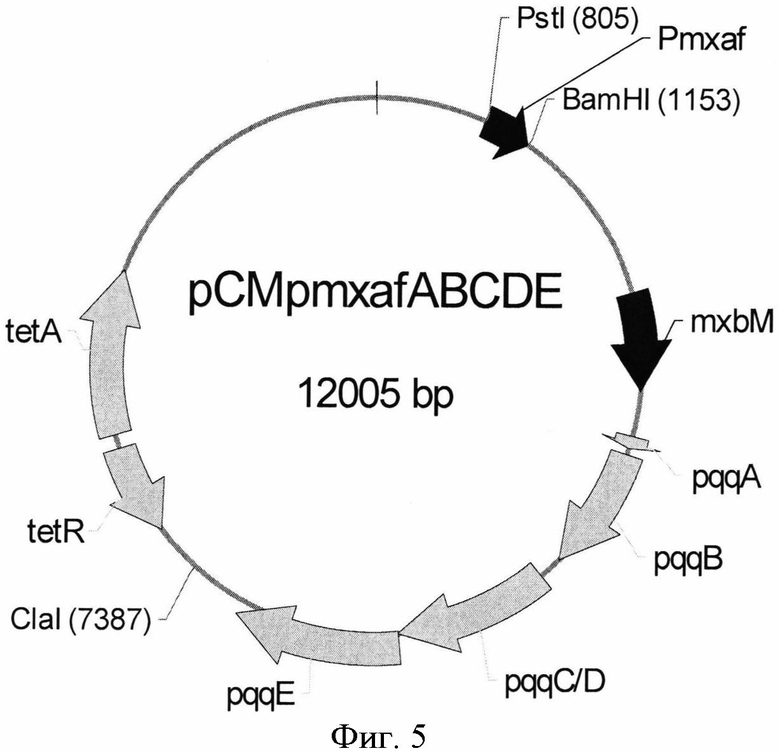
Плазмида pPQQ1 была сконструирована для сверхэкспрессии оперона pqqABC/DE из М. extorquens AM1 (Фиг.5). Для этого плазмида рНТ1 (Фиг.3; Toyama et al.,. Microbiology (1998) 144:183-91) была обработана последовательно рестриктазами ВатHI и Xhol и фрагментом Кленова ДНК-полимеразы I. Затем фрагмент BamHI-XhoI с тупыми концами (6,2 т.п.н.), содержащий оперон pqqABC/DE и ген тхbМ, кодирующий позитивный регулятор генов pqq из М. extorquens, был клонирован в область между сайтами BamHI-Есl136II вектора рСМ110 (Фиг.4, GenBank, инвертарный номер для этого вектора AF327718), дав плазмиду pQQ1 (Фиг.5). Штамм Е, coli TG1 был трансформирован лигазной смесью, и плазмидная ДНК была выделена из клонов, отобранных на чашках со средой LB с добавлением тетрациклина (10 µg/ml). Плазмиды с нужной структурой были отобраны по результатам рестрикционного анализа. Такие плазмиды были названы как pPQQ1.
Для того чтобы проверить, влияет ли сверхэкспрессия гена тхbМ на продукцию PQQ, была сконструирована вторая плазмида pPQQ2, не содержащая промотор PmxaF. Промотор PmxaF был удален следующим образом: плазмида pPQQ1 была обработана рестриктазами BamHI и PstI и продукт, концы которого были затуплены, был лигирован сам на себя. Полученная плазмида содержала оперон pqqABC/DE, экспрессирующийся под контролем природного промотора, находящегося на плазмиде перед геном тхbМ. Конструирование штаммов М. extorquens/pPQQ1 и М. extorquens/pPQQ2 и анализ количества продуцируемого PQQ были проведены, как описано в Примере 6. Штаммы М. extorquens/pPQQ1 и М. extorquens/pPQQ2 накапливали PQQ в примерно одинаковых количествах (Табл. 5). Таким образом, согласно полученным данным усиление экспрессии гена тхbМ не влияет в значительной степени на увеличение продукции PQQ штаммом с усиленной экспрессией генов pqq. Плазмида pPQQ1 была использована в последующих опытах.
2. Конструирование плазмиды pPQQ1 pqqA2A3
Плазмида pPQQl pqqA2A3 была сконструирована для сверхэкспрессии оперона pqqABC/DE и двух копий гена pqqA - гена pqqA2 и генаpqqA3 - из М. extorquens AM1. С этой целью с помощью ПЦР-праймеров EG539 (SEQ ID NO: 29) и EG540 (SEQ ID NO: 30) был синтезирован ДНК-фрагмент, содержащий гены pqqA2 и pqqA3 под собственным промотором. В качестве матрицы использовали хромосомную ДНК, выделенную из М. extorquens AM1. Температурные условия были следующие: начальная денатурация ДНК в течение 5 мин при 95°С; затем 30 циклов: денатурация при 95°С в течение 30 сек, отжиг при 57°С в течение 30 сек и элонгация при 72°С в течение 2 мин; конечная элонгация в течение 5 мин при 72°С. Амплифицированный ДНК-фрагмент длиной 1,1 т.п.н. после электрофореза в агарозе вырезали из геля и очищали при помощи QIAquick Gel Extraction Kit (QIAGEN). Фрагмент обрабатывали рестриктазой PstI и клонировали по сайтам Swal и РstI плазмиды pPQQ1, получив, таким образом, плазмиду pPQQ1pqqA2A3 (Фиг.6). Штамм Е. coli TG1 был трансформирован лигазной смесью и плазмидная ДНК была выделена из клонов, отобранных на чашках со средой LB с добавлением тетрациклина (10 µg/ml). Плазмиды с нужной структурой были обнаружены в результе рестрикционного анализа и названы pPQQ1pqqA2A3.
Пример 2: Конструирование плазмид, содержащих гены биосинтеза PQQ из Hyphomicrobium denitrificans
1. Конструирование плазмиды pHABCDE
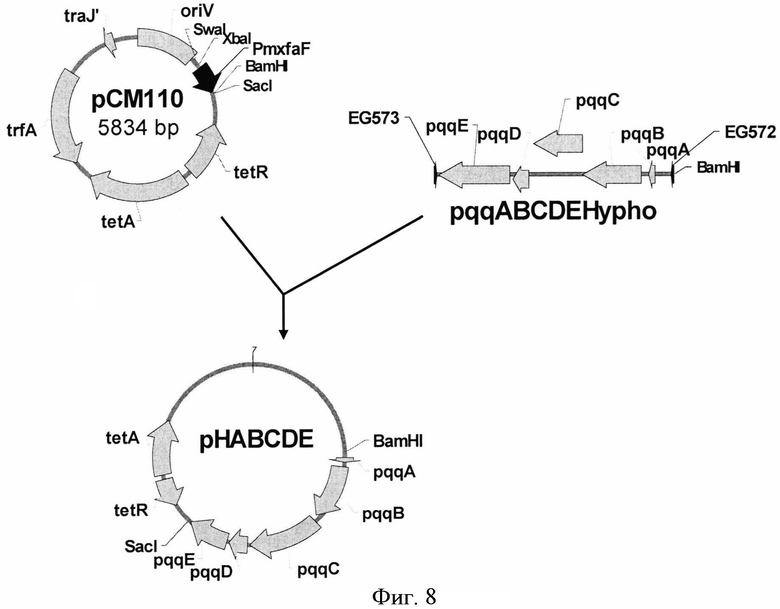
Плазмида pHABCDE была сконструирована для сверхэкспрессии кластера генов pqqABCDE из Н. denitrificans ATCC51888 (DSM1869) (штамм был получен из Коллекции микроорганизмов и культур клеток, Германия (DSMZ)). С этой целью с помощью ПЦР-праймеров EG572 (SEQ ID NO: 35) и EG573 (SEQ ID NO: 36) был синтезирован ДНК-фрагмент, содержащий кластер генов pqqABCDE. В качестве матрицы использовали хромосомную ДНК, выделенную из H. denitrificans ATCC51888. Температурные условия были следующие: начальная денатурация ДНК в течение 5 мин при 95°С; затем 30 циклов: денатурация при 95°С в течение 30 сек, отжиг при 57°С в течение 30 сек и элонгация при 72°С в течение 2 мин; конечная элонгация в течение 5 мин при 72°С. Амплифицированный ДНК-фрагмент длиной 3,7 т.п.н. после электрофореза в агарозе вырезали из геля и очищали при помощи QIAquick Gel Extraction Kit (QIAGEN). Фрагмент обрабатывали рестриктазами BamHI and SacI и лигировали в плазмиду рСМ110, обработанную теми же эндонуклеазами, получив, таким образом, плазмиду pHABCDE (Фиг.8). Штамм Е. coli TG1 был трансформирован лигазной смесью и плазмидная ДНК была выделена из клонов, отобранных на чашках со средой LB с добавлением тетрациклина (10 µg/ml). Плазмиды с нужной структурой были обнаружены в результе рестрикционного анализа и названы pHABCDE.
2. Конструирование плазмиды pHABCDEA3
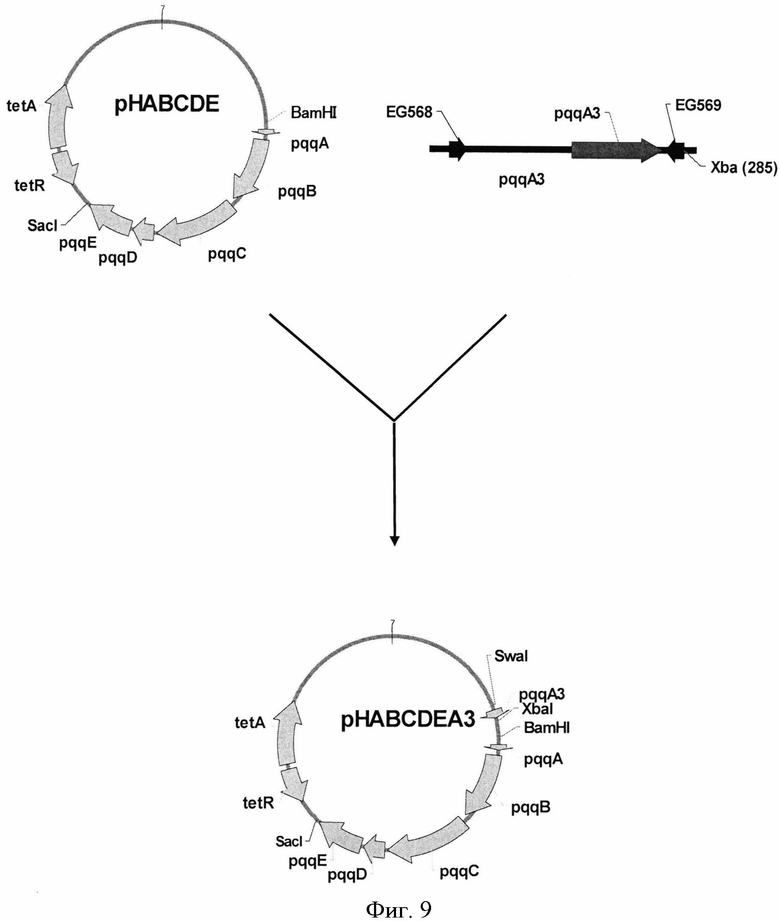
Плазмида pHABCDEA3 была сконструирована для сверхэкспрессии кластера генов pqqABCDE и гена pqqA3 из H. denitrificans ATCC51888. С этой целью с помощью ПЦР-праймеров EG568 (SEQ ID NO: 31) и EG569 (SEQ ID NO: 32) был синтезирован ДНК-фрагмент, содержащий ген pqqA3. В качестве матрицы использовали хромосомную ДНК, выделенную из Н. denitrificans ATCC51888. Температурные условия были следующие: начальная денатурация ДНК в течение 5 мин при 95°С; затем 30 циклов: денатурация при 95°С в течение 30 сек, отжиг при 57°С в течение 30 сек и элонгация при 72°С в течение 2 мин; конечная элонгация в течение 5 мин при 72°С. Амплифицированный ДНК-фрагмент длиной 0,27 т.п.н. после электрофореза в агарозе вырезали из геля и очищали при помощи QIAquick Gel Extraction Kit (QIAGEN) Фрагмент обрабатывали рестриктазой XbaI и клонировали по сайтам XbaI и SwaI плазмиды pHABCDE, получив, таким образом, плазмиду pHABCDEA3 (Фиг.9). Штамм Е. coli TG1 был трансформирован лигазной смесью и плазмидная ДНК была выделена из клонов, отобранных на чашках со средой LB с добавлением тетрациклина (10 µg/ml). Плазмиды с нужной структурой были обнаружены в результе рестрикционного анализа и названы pHABCDE.
3. Конструирование плазмиды pHABCDEA2A3
Плазмида pHABCDEA2A3 была сконструирована для сверхэкспрессии генов pqqA2 и pqqA3 из Н. denitrificans в дополнение к кластеру генов pqqABCDE. С этой целью с помощью ПЦР-праймеров EG570 (SEQ ID NO: 33) и EG571 (SEQ ID NO: 34) был синтезирован ДНК-фрагмент, содержащий гены pqqA2 и pqqA3. В качестве матрицы использовали хромосомную ДНК, выделенную из H. denitrificans ATCC51888. Температурные условия были следующие: начальная денатурация ДНК в течение 5 мин при 95°С; затем 30 циклов: денатурация при 95°С в течение 30 сек, отжиг при 57°С в течение 30 сек и элонгация при 72°С в течение 2 мин; конечная элонгация в течение 5 мин при 72°С. Амплифицированный ДНК-фрагмент длиной 0,36 т.п.н. после электрофореза в агарозе вырезали из геля и очищали при помощи QIAquick Gel Extraction Kit (QIAGEN). Фрагмент обрабатывали рестриктазами XbaI и BamHI и клонировали по сайтам XbaI и BamHI плазмиды рНАВСВЕА3, получив, таким образом, плазмиду pHABCDEA2A3 (Фиг.10). Штамм Е. coli TG1 был трансформирован лигазной смесью и плазмидная ДНК была выделена из клонов, отобранных на чашках со средой LB с добавлением тетрациклина (10 µg/ml). Плазмиды с нужной структурой были обнаружены в результе рестрикционного анализа и названы pHABCDEA2A3.
Пример 3: Продукция PQQ штаммами М. extorquens AM1/pPQQ1 и AM1/pPQQ1pqqA2A3
С целью выяснить влияние повышенной экспрессии генов pqqA2 и pqqA3 и оперона pqqABC/DE из М. extorquens AM1 на продукцию PQQ, плазмиды pPQQ1 и pPQQ1pqqA2A3 были перенесены в штамм-продуцент PQQ M.extorquens AM1 при помощи скрещивания, используя в качестве донора штамм Е. coli S17-1, содержащий соответствующие плазмиды, как описано Абалакиной с соавт.(Abalakina et al., Appl Microbiol Biotechnol (2008) 81(1): 191-200). Штаммы М. extorquens выращивали в среде Hypho (Harder at al., J Gen Microbiol (1973) 78:155-163), содержащей 1% метанола и раствор витаминов (10 мл/л), имеющий следующий состав: биотин 2,0 мг/л, фолиевая кислота 2,0 мг/л, тиамин гидрохлорид 5,0 мг/л, пантотенат кальция 5,0 мг/л, витамин В 12 0,1 мг/л, рибофлавин 5,0 мг/л и никотинамид 5,0 мг/л.
Полученные штаммы М. extorquens AM1/pPQQ1 и AM1/pPQQ1pqqA2A3, а также контрольный штамм AM1 были раздельно выращены в течение 60 ч на чашках со средой Hypho (как описано выше). Затем одна петля клеток каждой культуры, собранная с 1/8 чашки, была перенесена в 5 мл среды Hypho в пробирках 20×200 мм, и клетки выращивали при 30°С в течение 72 ч на роторной качалке при 240 об/мин. Для поддержания плазмиды добавляли тетрациклин (10 мкг/мл) во время выращивания.
После выращивания количество накопленного в среде PQQ определяли методом ВЭЖХ в следующих условиях: колонка: Inertsil ODS-3 (4 мкм, 150 мм × 4.6 мм I.D); растворители: (А) СН3ОН, (В) 15 мМ раствор ТБА, градиент А/В=50/50 (об./об.); скорость потока: 1.0 мл/мин; температура колонки: 40°С; измерение УФ-поглощения при 250 нм или флуоресценции при Ех 360 нм и Em 455 нм; объем вкола: 5 мкл. Раствор ТБА: раствор фосфата тетрабутиламмония (4.8 г) в воде (1 л), рН 3.5 установлен фосфатным буфером.
Результаты ферментации в пробирках приведены в Таблице 1 и Таблице 2. Как следует из Таблицы 1, штамм М. extorquens AM1/pPQQ1 с повышенной экспрессией оперона pqqABC/DE из М. extorquens AM1 накапливал в 8 раз больше PQQ по сравнению с родительским штаммом AM1. Как следует из Таблицы 2, штамм М. extorquens AM1/pPQQ1pqqA2A3 с повышенной экспрессией генов pqqA2 и pqqA3 наряду с опероном pqqABC/DE обладал двукратным увеличением продукции PQQ по сравнению со штаммом М extorquens AM1/pPQQ1.
Пример 4: Продукция PQQ штаммами H. denitrificans ATCC51888/pHABCDE, ATCC51888/pHABCDEA3 и ATCC51888/pHABCDEA2A3
С целью выяснить влияние повышенной экспрессии генов pqqA2 и pqqA3 и кластера генов pqqABCDE из H. denitrificans на продукцию PQQ, плазмиды pHABCDE, pHABCDEA3 и pHABCDEA2A3 были перенесены в штамм Н. denitrificans ATCC51888 при помощи скрещивания, используя в качестве донора штамм Е. coli S17-1, содержащий соответствующие плазмиды, как описано Абалакиной с соавт. (Abalakina et al., Appl Microbiol Biotechnol (2008) 81(1): 191-200). Штаммы Н. denitrificans выращивали в среде В (Urakami et al., Applied And Environmental Microbiology (1992) 58(12):3970-3976), содержащей 1% метанола.
Полученные штаммы Н. denitrificans strains ATCC51888/pHABCDE, ATCC51888/pHABCDEA3 и ATCC51888/pHABCDEA2A3, а также контрольный штамм ATCC51888 были раздельно выращены в течение 60 ч на чашках со средой В (как описано выше). Затем одна петля клеток каждой культуры, собранная с 1/8 чашки, была перенесена в 5 мл среды В в пробирках 20×200 мм, и клетки выращивали при 30°С в течение 72 ч на роторной качалке при 240 об/мин. Для поддержания плазмиды добавляли тетрациклин (10 мкг/мл) во время выращивания.
После выращивания количество накопленного в среде PQQ определяли методом ВЭЖХ как описано выше.
Результаты ферментации в пробирках приведены в Таблице 3. Как следует из Таблицы 3, штамм Н. denitrificans ATCC51888/pHABCDE с повышенной экспрессией кластера генов pqqABCDE из Н. denitrificans накапливал большее количество PQQ по сравнению с родительским штаммом ATCC51888. Штамм Н. denitrificans ATCC51888/pHABCDEA3 с повышенной экспрессией гена pqqA3 из Н. denitrificans также накапливал большее количество PQQ по сравнению с родительским штаммом ATCC51888 и штаммом ATCC51888/pHABCDE. Штамм H. denitrificans ATCC51888/pHABCDEA2A3 с повышенной экспрессией генов pqqA2 и pqqA3 наряду с кластером генов pqqABCDE накапливал PQQ в наибольшей степени.
Пример 5: Продукция PQQ штаммами H. denitrificans ATCC51888/pPQQ1 и ATCC51888/pPQQ1pqqA2A3
С целью выяснить влияние повышенной экспрессии генов pqqA2 и pqqA3 и оперона pqqABC/DE из М. extorquens AM1 на продукцию PQQ штаммами Н. denitrificans, плазмиды pPQQ1 и pPQQ1pqqA2A3 были перенесены в штамм Н. denitrificans ATCC51888 при помощи скрещивания, используя в качестве донора штамм Е. соli S17-1, содержащий соответствующие плазмиды, как описано Абалакиной с соавт.(Abalakina et al., Appl Microbiol Biotechnol (2008) 81(1):191-200). Штаммы Н. denitrificans выращивали в среде В (Urakami et al., Applied And Environmental Microbiology (1992) 58(12):3970-3976), содержащей 1% метанола.
Полученные штаммы Н. denitrificans ATCC51888/pPQQ1 и ATCC51888/pPQQ1pqqA2A3 были раздельно выращены в течение 60 ч на чашках со средой В (как описано выше). Затем одна петля клеток каждой культуры, собранная с 1/8 чашки, была перенесена в 5 мл среды В в пробирках 20×200 мм, и клетки выращивали при 30°С в течение 72 ч на роторной качалке при 240 об/мин. Для поддержания плазмиды добавляли тетрациклин (10 мкг/мл) во время выращивания.
После выращивания количество накопленного в среде PQQ определяли методом ВЭЖХ как описано выше.
Результаты ферментации в пробирках приведены в Таблице 4. Как следует из Таблицы 4, штамм Н. denitrificans ATCC51888/pPQQ1 с повышенной экспрессией оперона pqqABC/DE из М. extorquens AM1 накапливал большее количество PQQ по сравнению с родительским штаммом Н. denitrificans ATCC51888. Штамм Н. denitrificans ATCC51888/pPQQ1pqqA2A3 с повышенной экспрессией генов pqqA2 и pqqA3 из M.extorquens AM1 наряду с опероном pqqABC/DE накапливал PQQ в большей степени по сравнению с родительским штаммом и штаммом ATCC51888/pPQQ1.
Хотя указанное изобретение описано в деталях со ссылкой на наилучший способ осуществления изобретения, для специалиста в указанной области техники очевидно, что могут быть совершены различные изменения и произведены эквивалентные замены, и такие изменения и замены не выходят за рамки настоящего изобретения. Каждому из упомянутых выше документов соответствует ссылка, и все цитируемые документы являются частью описания настоящего изобретения.





































Изобретение относится к биотехнологии и представляет собой способ получения пирролохинолинохинона (PQQ) с использованием бактерии, принадлежащей к роду Methylobacterium или Hyphomicrobium. Указанные бактерии модифицированы таким образом, что в указанной бактерии усилена экспрессия кластера генов pqq. Дополнительно бактерия может быть также модифицирована таким образом, что экспрессия pqqA-подобного(ых) ген(а)ов усилена. Изобретение позволяет получать пирролохинолинохинон с высокой степенью эффективности. 2 н. и 18 з.п. ф-лы, 10 ил., 5 табл., 5 пр.
1. Способ получения пирролохинолинохинона (PQQ), включающий:
А) выращивание в питательной среде бактерии, принадлежащей к роду Hyphomicrobium, и
Б) выделение указанного вещества PQQ из культуральной жидкости, отличающийся тем, что указанная бактерия модифицирована таким образом, что экспрессия кластера генов pqq усилена.
2. Способ по п.1, отличающийся тем, что кластер генов pqq представляет собой оперон pqqABC/DE из Methylobacterium extorquens.
3. Способ по п.2, отличающийся тем, что оперон pqqABC/DE включает ДНК-фрагменты, представленные нуклеотидными последовательностями SEQ ID NO: 1, SEQ ID NO: 3, SEQ ID NO: 5 и SEQ ID NO: 7.
4. Способ по п.1, отличающийся тем, что кластер генов pqq представляет собой кластер генов pqqABCDE из Hyphomicrobium denitrificans.
5. Способ по п.4, отличающийся тем, что кластер генов pqqABCDE содержит ДНК-фрагменты, представленные нуклеотидными последовательностями SEQ ID NO: 14, SEQ ID NO: 16, SEQ ID NO: 18, SEQ ID NO: 20 и SEQ ID NO: 22.
6. Способ по п.1, отличающийся тем, что экспрессия указанного кластера генов усилена путем увеличения числа копий указанного кластера генов pqq.
7. Способ по п.6, отличающийся тем, что увеличение числа копий достигается путем введения в бактерию плазмиды, содержащей указанный кластер генов.
8. Способ по п.1, отличающийся тем, что указанная бактерия представляет собой Hyphomicrobium denitrificans.
9. Способ по п.1, отличающийся тем, что питательная среда содержит метанол в качестве источника углерода.
10. Способ получения пирролохинолинохинона (PQQ), включающий:
А) выращивание в питательной среде бактерии, принадлежащей к роду Methylobacterium или Hyphomicrobium, отличающейся тем, что указанная бактерия модифицирована таким образом, что экспрессия кластера генов pqq усилена, и
Б) выделение указанного вещества PQQ из культуральной жидкости, отличающийся тем, что указанная бактерия далее модифицирована таким образом, что экспрессия pqqA-подобного(ых) гена(ов) усилена.
11. Способ по п.10, отличающийся тем, что кластер генов pqq представляет собой оперон pqqABC/DE из Methylobacterium extorquens.
12. Способ по п.11, отличающийся тем, что оперон pqqABC/DE содержит ДНК-фрагменты, представленные нуклеотидными последовательностями SEQ IDNO: 1, SEQ ID NO: 3, SEQ ID NO: 5 и SEQ ID NO: 7.
13. Способ по п.10, отличающийся тем, что кластер генов pqq представляет собой кластер генов pqqABCDE из Hyphomicrobium denitrificans.
14. Способ по п.13, отличающийся тем, что кластер генов pqqABCDE содержит ДНК-фрагменты, представленные нуклеотидными последовательностями SEQ ID NO: 14, SEQ ID NO: 16, SEQ ID NO: 18, SEQ ID NO: 20 и SEQ ID NO: 22.
15. Способ по п.11, отличающийся тем, что pqqA-подобный ген выбран из группы, состоящей из:
- ДНК-фрагмента, который кодирует белок, имеющий аминокислотную последовательность SEQ ID NO: 2;
- ДНК-фрагмента, который кодирует белок, имеющий аминокислотную последовательность, которая содержит замену, делецию, вставку, добавление или инверсию одного или нескольких аминокислотных остатков в аминокислотной последовательности SEQ ID NO: 2, и имеющего функцию предшественника PQQ;
- ДНК-фрагмента, который кодирует белок, имеющий аминокислотную последовательность SEQ ID NO: 11;
- ДНК-фрагмента, который кодирует белок, имеющий аминокислотную последовательность, которая содержит замену, делецию, вставку, добавление или инверсию одного или нескольких аминокислотных остатков в аминокислотной последовательности SEQ ID NO: 11, и имеющего функцию предшественника PQQ;
- ДНК-фрагмента, который кодирует белок, имеющий аминокислотную последовательность SEQ ID NO:13;
- ДНК-фрагмента, который кодирует белок, имеющий аминокислотную последовательность, которая содержит замену, делецию, вставку, добавление или инверсию одного или нескольких аминокислотных остатков в аминокислотной последовательности SEQ ID NO: 13, и имеющего функцию предшественника PQQ;
- ДНК-фрагмента, который кодирует белок, имеющий аминокислотную последовательность SEQ ID NO: 15;
- ДНК-фрагмента, который кодирует белок, имеющий аминокислотную последовательность, которая содержит замену, делецию, вставку, добавление или инверсию одного или нескольких аминокислотных остатков в аминокислотной последовательности SEQ ID NO: 15, и имеющего функцию предшественника PQQ;
- ДНК-фрагмента, который кодирует белок, имеющий аминокислотную последовательность SEQ ID NO: 26;
- ДНК-фрагмента, который кодирует белок, имеющий аминокислотную последовательность, которая содержит замену, делецию, вставку, добавление или инверсию одного или нескольких аминокислотных остатков в аминокислотной последовательности SEQ ID NO: 26, и имеющего функцию предшественника PQQ;
- ДНК-фрагмента, который кодирует белок, имеющий аминокислотную последовательность SEQ ID NO: 28;
- ДНК-фрагмента, который кодирует белок, имеющий аминокислотную последовательность, которая содержит замену, делецию, вставку, добавление или инверсию одного или нескольких аминокислотных остатков в аминокислотной последовательности SEQ ID NO: 28, и имеющего функцию предшественника PQQ;
- или их комбинации.
16. Способ по п.10, отличающийся тем, что экспрессия указанного кластера генов или гена(ов) усилена путем увеличения числа копий указанных кластера генов или гена(ов).
17. Способ по п.16, отличающийся тем, что увеличение числа копий достигается путем введения в бактерию плазмиды, содержащей указанный кластер генов или ген(ы).
18. Способ по п.10, отличающийся тем, что указанная бактерия представляет собой Hyphomicrobium denitrificans.
19. Способ по п.10, отличающийся тем, что указанная бактерия представляет собой Methylobacterium extorquens.
20. Способ по п.10, отличающийся тем, что питательная среда содержит метанол в качестве источника углерода.
| HOELSCHER T | |||
| ПОРТСИГАР С ПРИСПОСОБЛЕНИЕМ ДЛЯ СКРУЧИВАНИЯ ПАПИРОС | 1922 |
|
SU621A1 |
| Поршень для воздушных тормозов с сжатым воздухом | 1921 |
|
SU188A1 |
| Выбрасывающий ячеистый аппарат для рядовых сеялок | 1922 |
|
SU21A1 |
| URAKAMI T | |||
| ET AL: "Production of pyrroloquinoline quinone by using methanol-utilizing bacteria", APPLIED AND ENVIRONMENTAL | |||
Авторы
Даты
2014-01-20—Публикация
2011-03-03—Подача