Область техники, к которой относится изобретение
Настоящее изобретение относится к новому соединению, представляющему собой пигмент растения, конкретно розы, которая лишена способности производить дельфинидин путем генетической рекомбинации, и к такому растению, как роза, которая содержит этот пигмент и его части. Дополнительно, настоящее изобретение относится к способу изменения окраски цветов растения с применением этого соединения.
Уровень техники
Розы являются важными растениями в качестве срезанных цветов и их цвет детально исследован. Например, известны примеры пигментов на основе антоциана, включающие цианидин-3,5-диглюкозид, пеларгонидин-3,5-диглюкозид, цианидин-3-глюкозид, пеларгонидин-3-глюкозид, пеонидин-3,5-диглюкозид и пеонидин-3-глюкозид. Пути биосинтеза антоцианов, включающих эти пигменты, известны.
Дополнительно, розы, экспрессирующие ген флавоноид-3',5'-гидроксилазы благодаря генетической рекомбинации (ссылка на патентные документы 1 и 2), продуцируют дельфинидин (называемый также дельфинидин-3,5-диглюкозидом). Полагают, что в этом случае реакция гидроксилирования по положению 5' в кольце В флавоноида происходит на стадии флаванона или дигидрофлавонола. Поскольку флавоноид-3',5'-гидроксилаза представляет собой род цитохрома Р450, присутствующего в эндоплазматическом ретикулуме, считается, что это гидроксилирование происходит в эндоплазматическом ретикулуме. В связи с отсутствием последовательности, например, -сигнального пептида и поскольку ферменты, например, антоцианиидингликозилтрансфераза, катализирующие реакции биосинтеза антоцианов, являются растворимыми белками, они присутствуют в клеточной цитоплазме. Антоцианы переносятся в вакуоли с помощью помп (мембранных переносчиков) после гликозилирования.
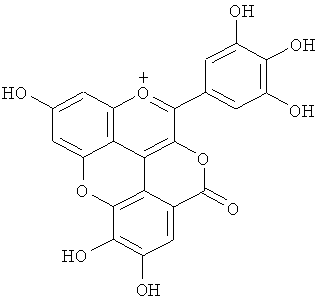
С другой стороны показано, что соединения розацианины (см. фигуру 1) присутствуют, по меньшей мере, в некоторых розах и структуры розацианинов, таких как розацианин А1, розацианин В и розацианин А2, определены (см, например, патентный документ 3 или непатентный документ 1):
Поскольку розацианины включают скелет цианидина в части своей структуры, имеется вероятность того, что они синтезируются на основе цианидина, общего с цианидином предшественника или аналога цианидина. Однако, поскольку это предположение остается спекуляцией, следует еще ясно определить, какой тип соединения на самом деле является предшественником и какие применяются типы путей синтеза.
С другой стороны, дельфинидин синтезируется вместо части цианидина в розах, у которых ген флавоноид-3',5'-гидроксилазы экспрессируется в результате генетической рекомбинации, как описано ранее. Если вышеупомянутая гипотеза относительно путей синтеза розацианина, а именно то, что розацианин синтезируется с применением цианидина в качестве предшественника, верна, то розацианин не синтезировался бы у этих генетически модифицированных роз, у которых цианидин, служащий предшественником, практически отсутствует.
Когда авторы настоящего изобретения проводили анализ для получения данных относительно синтеза розацианина с применением вышеупомянутых генетически модифицированных роз, которые вряд ли содержат сколько-нибудь цианидина или имеют значительно пониженное содержание цианидина по сравнению с хозяином, как описано в патентных документах 1 или 2, в противоположность ожиданиям было обнаружено наличие нового соединения с химической структурой, явно отличной от таковой розацианинов, унаследованных розами. Более того, ясно определено, что это новое соединение уникальным образом присутствует в розах, у которых ген флавоноид-3',5'-гидроксилазы экспрессируется благодаря генетической рекомбинации, что завершает настоящее изобретение.
Аналоги
Патентные документы
Патентный документ 1: международная публикация WO 2004/020637
Патентный документ 2: международная публикация WO 2005/017147
Патентный документ 3: Японская патентная публикация (Kokai) No. 2002-201372
Документы, не относящиеся к патентам
Непатентный документ 1: Tetrahedron, 62, 2006, 9661-9670
Раскрытие изобретения
Задачи изобретения
Объектом настоящего изобретения является новое соединение, представляющее собой пигмент растений, и конкретно, розы, лишенные способности продуцировать дельфинидин путем генетической рекомбинации, и растение, такое как роза, содержащая это пигмент, и его части. Дополнительно объектом настоящего изобретения является способ изменения окраски цветов растения с применением этого соединения.
Подходы к решению задач
Настоящее изобретение описано ниже.
(1) Соединение общей формулы (I)
(химическая формула 1)
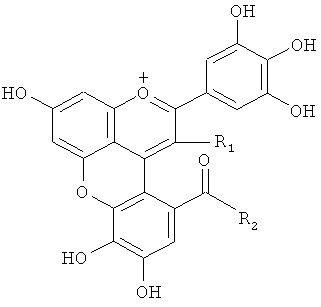
где R1 представляет следующую группу:
(химическая формула 2)
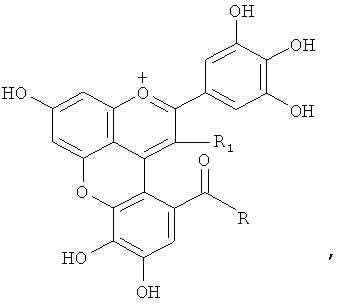
и R2 представляет -ОН или R1 и R2 вместе образуют -О-, или R1 представляет следующую группу:
(химическая формула 3)

и R2 представляет -ОН, предоставленный таким образом, что связь (волнистая линия) гидроксильной группы в положении 1 глюкозы в R1 проявляет таутомерию с α-формой и β-формой.
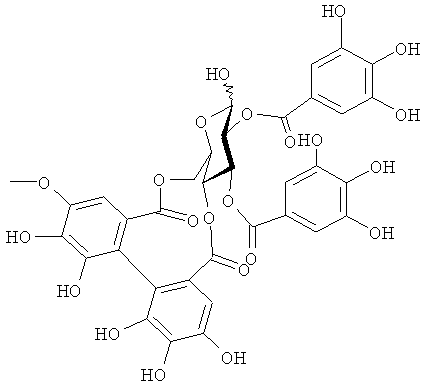
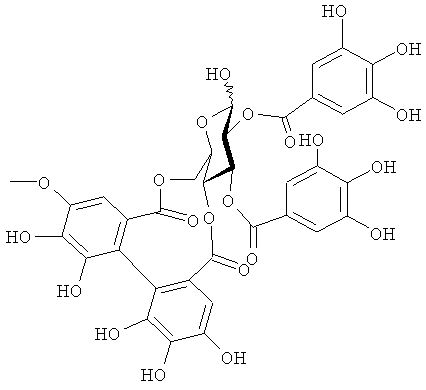
(2) Соединение следующей формулы:
(химическая формула 4)

(3) Соединение следующей формулы:
(химическая формула 5)

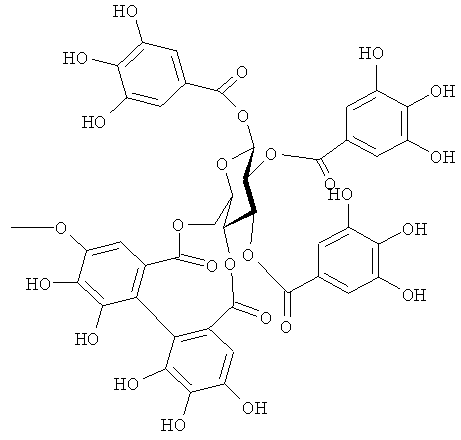
(4) Соединение следующей формулы:
(химическая формула 6)

(5) Растение, содержащее соединение, описанное в любом из п.п.1-4 выше, отличающееся тем, что растение не содержит этого соединения от природы.
(6) Растение по п.5 выше, являющееся представителем семейства Rosaceae.
(7) Растение по п.6 выше, где растение, являющееся представителем семейства Rosaceae, представляет собой растение семейства Rosaceae, рода Rosa.
(8) Растение по п.7 выше, где растение семейства Rosaceae, рода. Rosa представляет собой розу.
(9) Часть растения по любому из пунктов 5-8 выше.
(10) Часть растения по п.9 выше, представляющая собой срезанный цветок.
(11) Продукт обработки срезанного цветка, который применяет срезанный цветок по п.10 выше.
(12) Способ изменения окраски цветка растения с применением соединения по любому из пп.1-4 выше.
(13) Способ по п.12 выше, где растение является представителем семейства Rosaceae.
(14) Способ по п.13 выше, где растение, являющееся представителем семейства Rosaceae, представляет собой растение семейства Rosaceae, рода Rosa.
(15) Способ по п.14 выше, где растение семейства Rosaceae рода Rosa представляет собой розу.
Эффекты изобретения
Согласно настоящему изобретению новый пигмент, присутствующий в лепестках голубой розы, экстрагирован, выделен и очищен и определена его химическая структура. Это основано на исследовании, включающем генетически измененный цвет розы и создание нового растения семейства Rosaceae. Дополнительно, новый пигмент согласно настоящему изобретению можно применять, например, для улучшения цвета срезанных цветов путем абсорбции в розу или другой срезанный цветок и можно также применять для окрашивания пищи и напитков, например, в качестве природного растительного пигмента.
Краткое описание фигур
На фигуре 1 показаны химические структурные формулы цианидина, дельфинидина и розацианина.
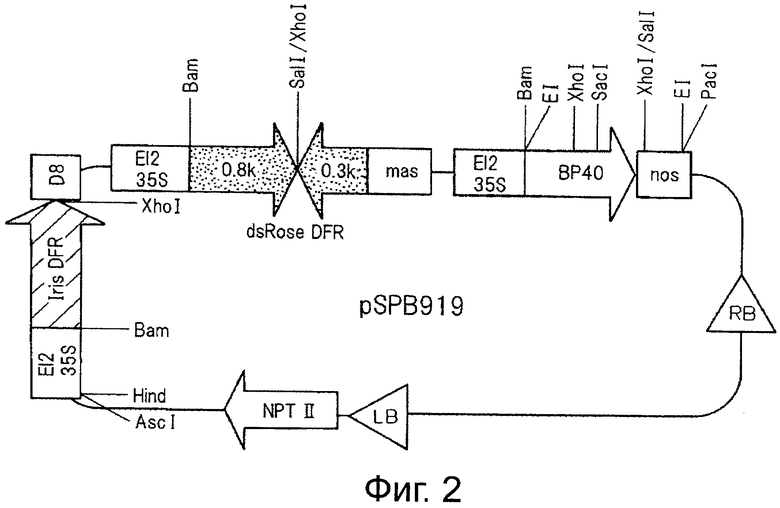
На фигуре 2 показана структура плазмиды pSPB919, трансфицированной в розово-лиловые (mauve) розы варианта «лаванда».
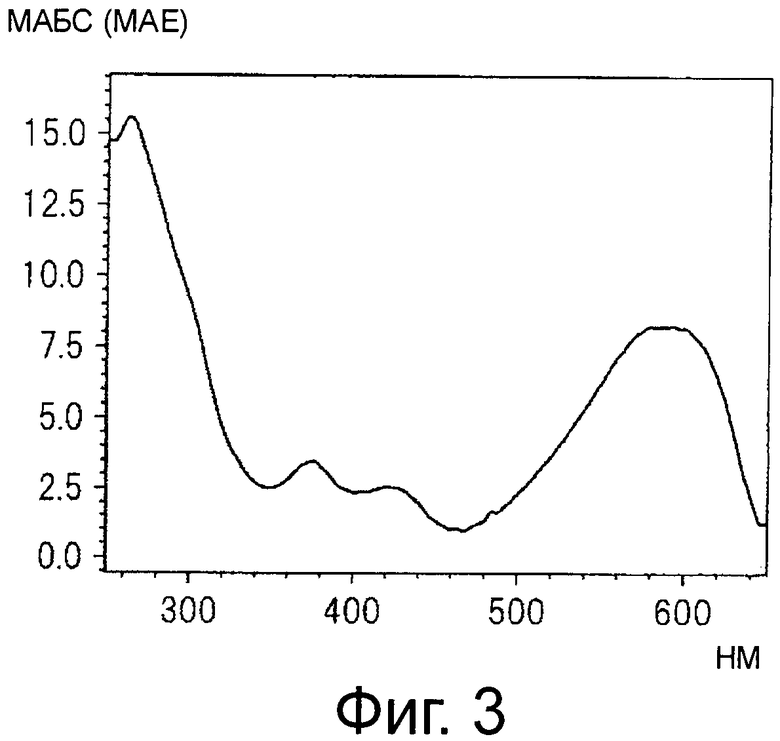
На фигуре 3 приведен спектр поглощения в видимом свете и ультрафиолете синего пигмента (1) в 30% ацетонитриле и 0,5% ТФУ.
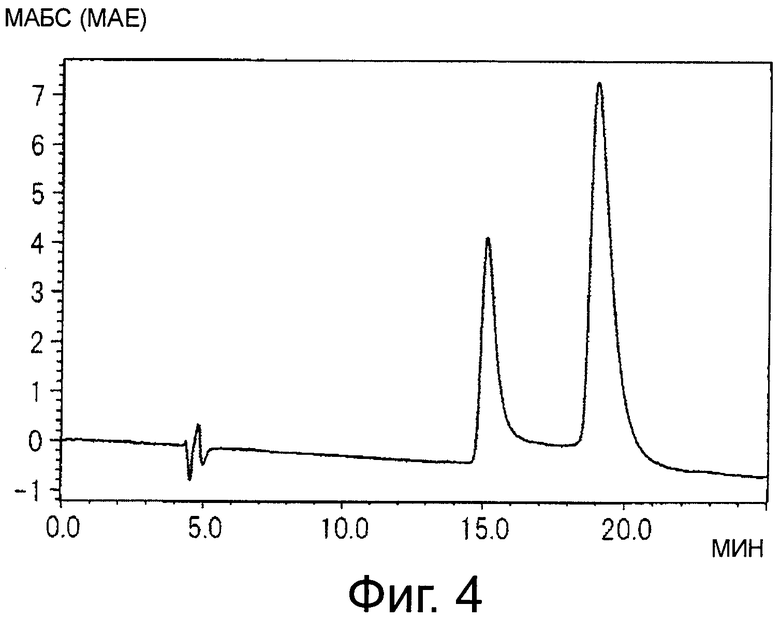
На фигуре 4 показана хроматограмма, полученная при анализе синего пигмента (1) с помощью HPLC, где два пика наблюдаются в результате того, что гидроксильная группа в положении 1 глюкозы проявляет таутомерию между α-формой и β-формой.
На фигуре 5 приведен спектр поглощения в видимом свете и ультрафиолете красного пигмента (2) в 30% ацетонитриле и 0,5% ТФУ.
На фигуре 6 показана хроматограмма, полученная при анализе красного пигмента (2) с помощью HPLC.
На фигуре 7 приведен спектр поглощения в видимом свете и ультрафиолете синего пигмента (3) в 30% ацетонитриле и 0,5% ТФУ.
На фигуре 8 приведена химическая структурная формула синего пигмента (1), где связь (волнистая линия) гидроксильной группы в положении 1 глюкозы в R1 проявляет таутомерию между α-формой и β-формой.
На фигуре 9 приведена химическая структурная формула красного пигмента (2).
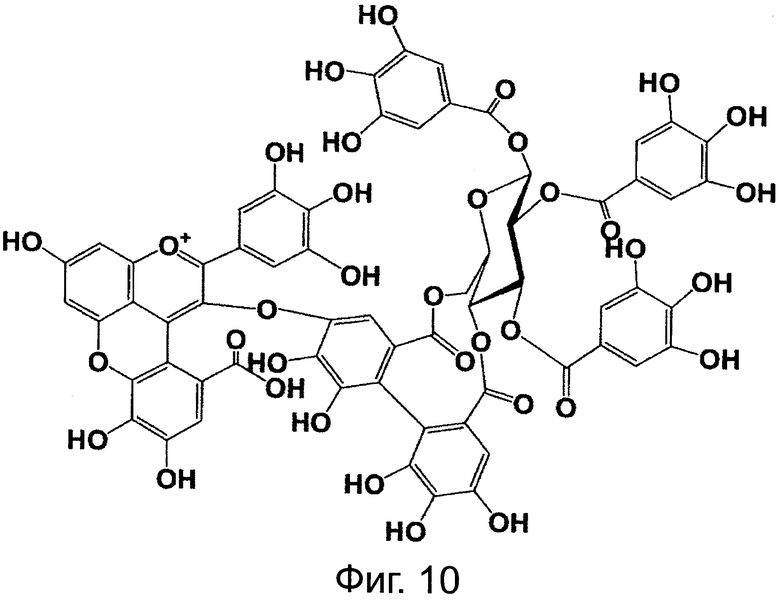
На фигуре 10 приведена химическая структурная формула синего пигмента (3).
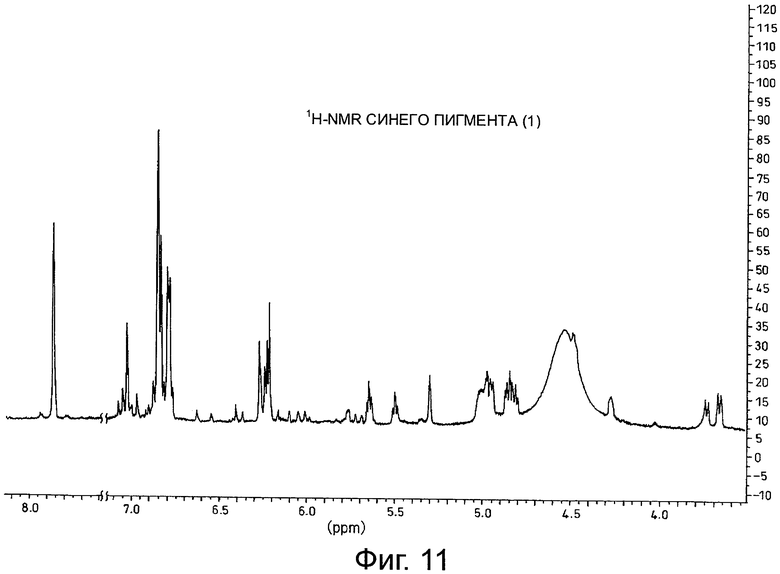
На фигуре 11 приведен 1H-NMR спектр синего пигмента (1), показанного на фигуре 8.
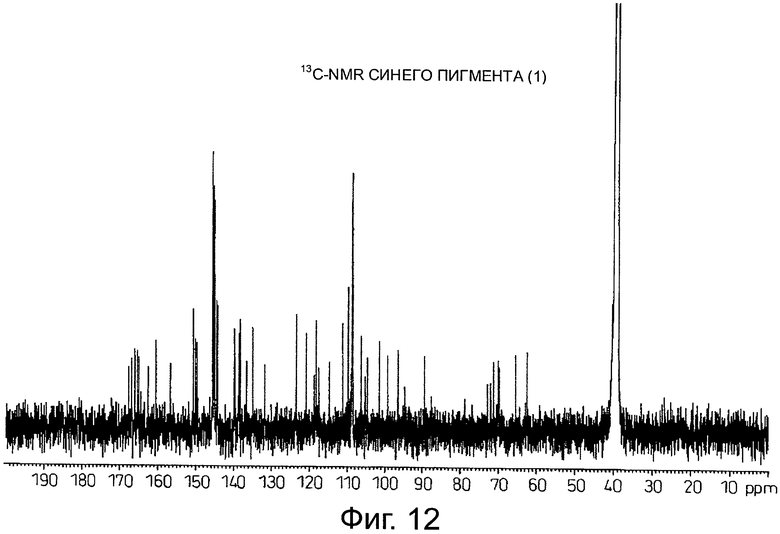
На фигуре 12 приведен 13C-NMR спектр синего пигмента (1), показанного на фигуре 8.
На фигуре 13 приведен 1H-NMR спектр красного пигмента (1), показанного на фигуре 9.
На фигуре 14 показана структура плазмиды pSPB130, трансфицированной в розово-лиловую розу варианта "WKS82".
Осуществление изобретения
Новый пигмент согласно настоящему изобретению имеет структуру, в которой одна гидроксильная группа дополнительно добавлена к кольцу В известного вещества в форме розацианина А1, розацианина В и розацианина А2 (у которых число гидроксильных групп в кольце В равно 2). То есть можно сказать, что новый синий пигмент согласно настоящему изобретению является новым соединением, включающим часть структуры синего пигмента дельфинидина, который является известным веществом, присутствие которого в голубых розах подтверждено (у которого число гидроксильных групп в кольце В равно 3).
Как описано в патентных документах 1 или 2, синий пигмент, не присутствующий в обычных вариантах роз (имеющий три гидроксильные группы в кольце В), присутствует в голубой розе благодаря функции «голубого» гена (флавоноид-3',5'-гидроксилазы). В настоящее время соединения структуры, в которой одна гидроксильная группа дополнительно добавлена в кольцо В известных веществ в форме розацианина А1, розацианина В и розацианина А2 (у которого число гидроксильных групп в кольце В равно 2), выделены и очищены в качестве синих пигментов, они идентифицированы с помощью TOF-MS (масс-спектрометрии) и NMR (ЯМР) и их структуры определены.
Три типа соединений согласно настоящему изобретению представляют собой соединение, характеризующееся параметрами, показанными на фигурах 3, 4, 11 и/или 12, соответственно, соединение, характеризующееся параметрами, показанными на фигурах 5, 6, 9 и/или 13, соответственно, или соединение, характеризующееся параметрами, приведенными на фигуре 7.
В связи с дополнительным усилением эффекта улучшения растворимости благодаря наличию трех гидроксильных групп в результате дополнительного добавления гидроксильной группы в кольцо В считается, что антоцианы, например, розацианины с большим молекулярным весов, чем у цианидина, являются более действенными пигментами в смысле переноса в вакуоли клеток лепестков цветов и проявления синего цвета. Дополнительно, розацианины характеризуются как преобладающие по сравнению с обычными пигментами в плане синтеза в организме растения. Дополнительно, настоящее изобретение предоставляет растение, содержащее соединение, показанное на фигурах 8-10. Однако растение от природы не содержит соединения или соединение не присутствует в лепестках его цветов в различимом количестве. Дополнительно, настоящее изобретение предоставляет способ изменения окраски цветов растения с применением соединения, показанного на фигурах 8-10. Например, соединение согласно настоящему изобретению можно получить только путем трансфекции гена фермента, включенного в синтез соединения согласно настоящему изобретению, в растение мишень с помощью техники генной инженерии и затем синтеза различимого предписанного количества соединения в лепестках цветов растения. Альтернативно, поскольку соединение согласно настоящему изобретению можно также получить физическим путем, например, путем прямой абсорбции соединения согласно настоящему изобретению растением, способ, согласно которому растение-мишень содержит соединение, не ограничен.
Организм растения согласно настоящему изобретению содержит соединение, показанное на фигурах 8-10, в лепестках своих цветов. Хотя нет конкретного ограничения относительно количества соединения в лепестках цветов организма растения, предпочтительно оно составляет 0,00001 мг/г или более относительно сырого веса цветочных лепестков. Нижний предел содержания соединения более предпочтительно составляет 0,0001 мг/г или более, еще более предпочтительно 0,0007 мг/г или более. Верхний предел содержания соединения составляет предпочтительно 1 мг/г или менее, более предпочтительно 0,5 мг/г или менее и еще более предпочтительно 0,13 мг/г или менее.
Примеры растений мишеней включают, не ограничиваясь этим, розы, хризантемы, гвоздики, львиный зев, цикламены, орхидеи, горечавку прерий, фрезии, герберу, гладиолусы, качим метельчатый, каланхоэ, лилии, пеларгонии, герани, петунии, торении, тюльпаны, рис, ячмень, пшеницу, рапс, картофель, помидоры, тополь, бананы, эвкалипт, сладкий картофель, сою, альфальфа, люпины, кукурузу и цветную капусту.
Предпочтительные примеры растений мишеней включают растения семейства Rosaceae, более предпочтительно растения семейства Rosaceae рода Rosa и еще более предпочтительно розы, где в качестве примера выступает Rosa hybrida. Настоящее изобретение относится к частям вышеупомянутых растений и конкретно к срезанным цветам и продуктам переработки цветов с применением срезанных цветов. В данном случае продукты переработки срезанных цветов включают, не ограничиваясь этим, прессованные цветы, консервированные цветы, засушенные цветы и заключенные в носитель (матрицу) продукты с применением таких срезанных цветов.
ПРИМЕРЫ
Ниже предоставлено более детальное объяснение настоящего изобретения с помощью примеров.
Пример 1. Выделение и очистка пигментного соединения
Пигментное соединение согласно настоящему изобретению очищают и изолируют с применением голубой розы в качестве источника для проведения экстракции.
Получение лавандового варианта, трансфицированного плазмидой pSPB919
Голубую розу получают для применения в качестве источника для проведения экстракции. Лавандовый вариант, трансфицированный плазмидой pSPB919, получают по способу, описанному ниже.
РНК получают из лепестков срезанных цветов голубого ириса и далее из РНК получают поли-А РНК. Библиотеку кДНК (cDNA) получают из этой поли-А РНК с применением λZAPII (Stratagene) в качестве вектора с помощью набора для получения библиотек cDNA (Stratagene) по способу, рекомендованному производителем. Фрагмент гена DRF из ириса получают по способу, описанному для получения фрагмента DFR из японской горечавки (Tanaka, et al., Plant Cell Physiol., 37, 711-716, 1996).
Полученный фрагмент ДНК размером примерно 400 bp (пар оснований) выделяют с помощью GeneClean со способу, рекомендованному производителем, и суб-клонируют в pCR-TOPO. После определения его нуклеотидной последовательности обнаружено, что последовательность гомологична гену DFR розы. Библиотеку кДНК ириса подвергают скринингу с применением этого фрагмента ДНК для получения кДНК DFR ириса, соответствующего полной длине аминокислотной последовательности. Затем определяют полную нуклеотидную последовательность кДНК, содержащуюся в клоне, названном pSPB906 (см SEQ ID NO. 9 и SEQ ID NO. 10 патентного документа 2 для нуклеотидной последовательности и аминокислотной последовательности).
Далее фрагмент размером примерно 3,9 kb, полученный путем обработки pSPB580 рестриктазами BamHI и XhoI, и фрагмент ДНК размером примерно 1,5 kb, полученный путем обработки pSPB906 с помощью BamHI и XhoI, лигируют и полученную плазмиду называют pSPB909.
Транскрипцию двухцепочечной РНК с кДНК DFR розы проводят в растениях по следующему способу. Фрагмент ДНК размером примерно 3,5 kb (содержащий промотор Mac1, кДНК DFR розы и терминатор mas), полученный путем частичного расщепления pCGP1364 (Tanaka, et al., Plant Cell Physiol., 36, 1023-1031, 1995) с помощью PstI, вводят в PstI участок pUC19 (Yanisch-Perron, С. et al., Gene, 33, 103-119, 1985) и часть полученной плазмиды, у которой HindIII участок pUC19 находится близко к промотору MacI, называют pCGP 1394.
Затем фрагмент ДНК размером примерно 1,4 kb, полученный путем обработки pCGP1394 с помощью HindIII и SacII, фрагмент ДНК размером примерно 1,9 полученный путем обработки pCGP1394 с помощью PstI с последующим получением тупых концов и дополнительной обработкой рестриктазой SacI, и фрагмент бинарного вектора, полученный путем обработки pBinPLUS рестриктазой SacI с последующим получением тупых концов и дополнительной обработкой рестриктазой HindIII, лигируют с получением pSPB185. pSPB185 далее обрабатывают XbaI, получают тупые концы и лигируют с линкером SalI для получения pSPB521. Фрагмент ДНК размером примерно 700 bp DNA, полученный путем обработки pUE6 с помощью HindIII и BamHI, фрагмент ДНК бинарного вектора, полученный путем обработки pSPB521 ректриктазами HindIII и SacI, фрагмент ДНК гена GUS, полученный путем обработки рЕ2113 с помощью BamHI и SacI, лигируют с получением pSPB528.
pSPB528 представляет собой бинарный вектор, способный вставлять структурный ген между вирусом мозаики цветной капусты 35S, имеющим энхансер (enhancer), и терминатором маннопинсинтазы для экспрессии в растениях. Дополнительно, поскольку это укорачивает последовательность 5'-нетранслируемого района кДНК DFR розы, содержащегося в pCGP645, pCGP645 получают путем обработки pCGP645 рестриктазами SmaI и PvuI с последующим получением тупых концов и лигированием.
Последовательность с 5'-конца кДНК DFR розы получают путем амплификации с помощью ПЦР с применением pCGP645 в качестве матриц и с помощью анти-смыслового праймера и смыслового праймера RDF310 (см SEQ ID NO. 19 патентного документа 2) в качестве праймеров и последующего клонирования в pCR-TOPO. Нуклеотидную последовательность ДНК определяют и подтверждают отсутствие ошибок в результате ПЦР. Продукт называется pSPB569. Дополнительно, получают последовательность другой длины с 5'-стороны кДНК DFR розы путем амплификации с помощью ПЦР с применением pCGP645 в качестве матриц и с помощью анти-смыслового праймера и смыслового праймера RDF830 (см. SEQ ID NO. 20 патентного документа 2) в качестве праймеров с последующим клонированием в pCR-TOPO. Нуклеотидную последовательность ДНК определяют и подтверждают отсутствие ошибок в результате ПЦР.
Продукт называют pSPB570. Фрагмент ДНК бинарного вектора, полученный путем обработки pSPB528 рестриктазами BamHI и SacI, фрагмент ДНК размером примерно 0,3 kb, полученный путем обработки pSPB569 рестриктазами SacI и XhoI, и фрагмент ДНК, полученный путем обработки pSPB570 с помощью BamHI и SalI, лигируют с получением pSPB572. Этот вектор создан для осуществления транскрипции двухцепочечной РНК на кДНК DFR розы в растении.
pUE6 обрабатывают рестриктазой SacI и получают тупые концы с последующей вставкой линкера SalI для получения pUE8. Фрагмент ДНК, полученный путем обработки pUE8 ректриктазами HindIII и EcoRI, лигируют в HindIII и EcoRI участки pBinPLUS для (получения) pSPB189. Фрагмент ДНК размером примерно 3,7 kb, полученный путем обработки pSPB189 ректриктазами BamHI и SalI, и фрагмент ДНК размером примерно 1,8 kb, полученный путем полной обработки pCGP1961 с помощью BamHI и дополнительной частичной обработки с помощью XhoI, лигируют для получения pSPB567. После обработки pSPB572 с помощью Pad и дефосфорилирования фрагмент ДНК размером примерно 2,8 kb, полученный путем обработки pSPB567 с помощью Pad, лигируют и отбирают плазмиду, в которой транскрипция идет в том же направлении, что и для nptII гена и полученного из анютиных глазок F3'5'H#40, которую называют pSPB905.
После обработки pSPB905 ректриктазой AscI и дефосфорилирования фрагмент ДНК размером примерно 2,5 kb, полученный путем обработки pSPB909 ректриктазой AscI, лигируют для получения плазмиды, в которой транскрипция гена DFR из ириса происходит в том же направлении, что и гена nptII, и такую плазмиду называют pSPB919 (см. фигуру 2). Ожидается, что с этой плазмиды идет транскрипция гена DFR, полученного из ириса, и гена F3'5'H#40, полученного из анютиных глазок, в розе и осуществляется контроль экспрессии гена DFR розы путем транскрипции двухцепочечной РНК. Эту плазмиду трансфицируют в Agrobacterium tumefaciens штамм Ag10.
pSPB919 (см фигуру 2) трансфицируют в розово-лиловую розу, вариант «лаванда» путем инфицирования Agrobacterium для получения трансгенного растения. Трансформированные клетки пигментных соединений затем регенерируют для получения трансгенного растения в виде голубой розы (вариант лаванда, трансфицированный плазмидой pSPB919) и ему дают зацвести.
Экстракция, выделение, очистка и идентификация пигментных соединений
Пигментные соединения очищают из 230 г цветочных лепестков голубой розы, полученной по способу, описанному выше (вариант лаванда, трансфицированный плазмидой pSPB919) по способу, описанному ниже.
230 г цветочных лепестков замораживают и измельчают в жидком азоте с помощью гомогенизатора, вслед за чем добавляют 1 л 50% ацетонитрила, содержащего 0,5% ТФУ, и вымачивают в течение ночи. Фильтрат, полученный путем фильтрации через диатомовую землю, концентрируют до примерно 2/5 исходного объема с помощью роторного испарителя.
Этот концентрированный экстракт наносят на 400 мл абсорбционной смолы НР-20 (Mitsubishi Chemical). После промывки 800 мл воды экстракт последовательно элюируют с помощью 1 л 20% ацетонитрила с 0,1% ТФУ и 60% ацетонитрила с 0,1% ТФУ. Фракции, содержащие синий пигмент, элюируются с 60% ацетонитрилом.
Эту фракцию затем очищают с помощью препаративной HPLC. Применяют колонку Develosil ODS-UG (Nomura Chemical, 5 см диаметром ×50 см), подвижная фаза состоит из воды (раствор А) и 50% ацетонитрила с 0,5% ТФУ (раствор В), скорость тока составляет 32 мл/мин, применяют линейный градиент концентрации, включающий 30% В (держат в течение 30 мин), увеличение от 30% В до 100% В (50 мин) и затем поддержание при 100% В в течение 20 мин. Детектирование проводят при 260 нм. Фракцию, содержащую синий пигмент, которая элюируется от 67 мин до 82 мин, собирают и лиофилизуют. Хроматографию повторяют дважды.
1,2 г лиофилизованного продукта наносят на колонку Sephadex LH-20 (Pharmacia) (1,2 л), уравновешенную 50% ацетонитрилом. После элюции 2,5 л 50% ацетонитрила элюируют фракцию, содержащую синий пигмент, с помощью дополнительных 2,5 л 50% ацетонитрила, ее собирают и лиофилизуют.
Снова проводят препаративную HPLC с применением полученного лиофилизованного продукта.
Применяют колонку YMC Pack Polymer CI8 (YMC, 2 см в диаметре ×30 см) и подвижную фазу, состоящую из 0,5% ТФУ в воде (раствор А) и 0,5% ТФУ в 50% ацетонитриле (раствор В), скорость тока составляет 6 мл/мин; хроматографию проводят с применением следующего градиента концентрации: 65% В (держат в течение 30 мин), увеличение от 65% В до 90% В (20 мин) и затем держат при 90% В в течение 30 мин. Детектирование проводят при 260 нм. Красный пигмент (2), который элюируется от 50 до 52 мин, синий пигмент (1), который элюируется от 60 до 65 мин, и синий пигмент (3), который элюируется от 65 до 73 мин, собирают и лиофилизуют. Хроматографию повторяют в общем три раза.
Лиофилизованный продукт, синий пигмент (1), красный пигмент (2) и синий пигмент (3), полученные по способу, описанному выше, рассматривают визуально на оттенок цвета. В результате они демонстрируют глубокий синий, глубокий красный и глубокий синий цвет, соответственно.
При измерении содержания в цветочных лепестках синего пигмента (1) обнаружено, что его содержание находится в интервале от 0,0007 мг/г до 0,13 мг/г сырого веса цветочных лепестков.
Пример 2. Структурный анализ пигментных соединений путем инструментального анализа
Синий пигмент (1), красный пигмент (2) и синий пигмент (3) анализируют с помощью различных приборов (инструментальных подходов) с применением повторно очищенных образцов при необходимости.
Синий пигмент (1), красный пигмент (2) и синий пигмент (3) анализируют с помощью HPLC и их спектры поглощения от 650 до 250 нм в 30% ацетонитриле с 0,5% ТФУ регистрируют с помощью детектора с фотодиодной матрицей (см фигуры 3, 5 и 7).
HPLC проводят с применением колонки Shodex Asahipak ODP50 (Showa Denko, 4,6 мм в диаметре ×25 см) и изократического раствора подвижной фазы, содержащего 30% ацетонитрил и 0,5% ТФУ, при скорости тока 0,6 мл/мин. Детектирование проводят путем регистрации спектра поглощения от 650 нм до 250 нм с помощью детектора с фотодиодной матрицей (SPDM10Avp, Shimadzu) и мониторинга хроматограммы при 560 нм.
Результаты суммированы ниже (см время удержания (R.T.) на фигурах 4, и 6).
Синий пигмент (1) λmax 593 нм R.T. 14,6 и 18,5 мин*
Красный пигмент (2) λmax 535 нм R.T. 8,9 мин
Синий пигмент (3) λmax 594 нм R.T. 21, мин
* - синий пигмент (1) проявляет два пика в результате того, что гидроксильная группа в положении 1 глюкозы демонстрирует таутомерию с α-формой и β-формой.
Проводят масс-спектрометрический анализ (TOF-MS) синего пигмента (1), красного пигмент (2) и синего пигмента (3).
Масс-спектрометрию (МС) проводят путем измерения в режиме положительного напряжения (positive V mode) с помощью Q-TOF Premier (Micromass, U.K.), снабженного источником ионов Z-spray. МС проводят с применением напряжения в пучке (cone voltage) 60 В и капиллярного напряжения 3 кВ, калибровку по массе проводят с помощью lock spray и в качестве стандарта применяют лейцин-энкефалин (m/z: 556.2771 [М+Н]+).
В результате (1) характеризуется m/z=1221.1352 [М]+, красный пигмент (2) характеризуется m/z=435.0380 [М]+ и синий пигмент (3) характеризуется m/z=1373.1442 [М]+, что хорошо согласуется с молекулярными формулами С56Н37О32 (погрешность +6.9 ppm), C22H11O10 (погрешность +6.4 ppm) и С63Н41О36 (погрешность +4.6 ppm), соответственно.
Спектры поглощения синего пигмента (1), красного пигмента (2) и синего пигмента (3) в 30% ацетонитриле с 0,5% ТФУ показаны на фигурах 3, 5 и 7, соответственно.
Максимумы поглощения в видимом диапазоне синего пигмента (1) и синего пигмента (3) сдвинуты в сторону больших длин волн по сравнению с максимумом поглощения соединения формулы (II), описанного в примере 1 патентного документа 3.
Соединение формулы (II) патентного документа 3 демонстрирует синий цвет, как описано в патентном документе 3. Однако, поскольку полученные максимумы поглощения в видимом диапазоне синего пигмента (1) и синего пигмента (3) располагаются при больших длинах волн, чем максимум поглощения соединения формулы (II), описанного в патентном документе 3, они проявляют более глубокий синий цвет, чем соединение формулы (II). Соответственно, синий пигмент (1) и синий пигмент (3), впервые открытые в настоящем изобретении, ясно определяются как более эффективные для придании темно-синего цвета растениям. Когда определяют молекулярный вес синего пигмента (1) с помощью TOF-MS, получают значение m/z=1221.13 [М]+, что на 16 единиц массы больше молекулярного веса 1205 соединения формулы (II), описанного в примере 1 патентного документа 3. Это указывает, что пигментное соединение с молекулярным весом на 16 единиц массы выше, чем у известного пигментного соединения патентного документа 3, содержится в лавандовой разновидности, трансфицированной плазмидой pSPB919, описанной в патентном документие 2. Поскольку увеличение молекулярного веса, обусловленное реакцией гидроксилирования с помощью флавоноид-3',5'-гидроксилазы, представляет собой увеличение на 16 единиц массы, возникающее в результате добавления одного атома кислорода, полагают, что синий пигмент (1) имеет на один атом кислорода больше, чем соединение формулы (II), описанное в примере 1 патентного документа 3. Поскольку флавоноид-3',5'-гидроксилаза специфично катализирует гидролиз В кольца флавоноидов, сделано заключение, что соединение, идентифицированное в данной заявке, не является розацианином А1-гликозидом, описанным в непатентном документе 1, а скорее представляет собой соединение с частичной структурой дельфинидина, который имеет три гидроксильные группы в кольце В. А именно, сделано заключение, что структуры синего пигмента (1), красного пигмента (2) и синего пигмента (3) представляют собой структуры, приведенные на фигурах 8, 9 и 10, соответственно.
Дополнительно, каждое из соединений исследуют с помощью ЯМР. Соединения растворяют в диметсульфоксиде DMSO-d6 (((CD3)2SO)), содержащем 1% DCl (хлористого дейтерия), и остаточные пики 1Н и 13С при δ2.50 и δ39.43 применяют в качестве внутренних стандартов. Измеряемые параметры, включающие 1H-NMR, 1H{13C}-HSQC, 1Н{13С}-НМВС, TOCSY, DQF-COSY и ROE, регистрируют с помощью спектрометра DMX-750 (Bruker Biospin, Germany). В результате получают структуры, приведенные на фигурах 8, 9 и 10, для синего пигмента (1), красного пигмента (2) и синего пигмента (3), соответственно.
Результаты анализа с помощью 1H-NMR синего пигмента (1) показаны на фигуре 11, тогда как результаты анализа с помощью 13C-NMR показаны на фигуре 12.
В случае синего пигмента (1), сигналы 1H-NMR наблюдаются при δ3.67 (1H, d12, Glc-6α), δ4.48 (1H, dd2,9, Glc-5δ), δ4.84 (1H, t9, Glc-4α), δ4.94 (1H, dd2,9, Glc-2α), δ4.99 (1Hdd2, 12, Glc-6α), δ5.30 (1H, d2, Glc-1α), δ5.64 (1H, t9, Glc-3α), δ6.22 (1H, s, HHDP), δ6.27 (1H, s, HHDP), δ6.77 (2H, s, gallate-2,6), δ6.79 (1H, s, D-3''), δ6.83 (1H, d2, A-6), δ6.85 (2H, s, gallate-2,6), δ7.03 (1H, d2, A-8) и δ7.87 (2H, s, B-2',6'). HHDP представляет собой сокращение для гексагидроксидифеноила. Дополнительно, гидроксильная группа в положении 1 сахара наблюдается в виде минорного сигнала среди сигналов β-типа глюкозы.
Результаты анализа 1H-NMR красного пигмента (2) показаны на фигуре 13.
В случае красного пигмента (2), сигналы 'H-NMR наблюдаются при δ7.32 (1H, d1.5, A-6), δ7.40 (1H, d1.5, A-8), δ7.68 (2H, s, B-2', 6') и δ7.92 (1H, s, D-3'').
Пример 3. Подтверждение (присутствия) пигментных соединений в различных вариантах голубой розы
Присутствие соединений согласно настоящему изобретению подтверждается для различных вариантов голубой розы, отличных от такового из примера 1.
Получение варианта "WKS82", трансфицированного плазмидой pSPB130
Вариант "WKS82", трансфицированный плазмидой pSPB130, получают по способу, описанному ниже.
Антоцианы можно стабилизировать и придать им синий цвет путем модификации с помощью ароматической ацильной группы (см например, WO 96/25500). Проводят следующий эксперимент с целью получения ацилированного антоциана типа дельфинидина.
РНК получают из цветочных лепестков торении варианта «летняя волна» и далее из этой РНК получают поли-А РНК. Из этой поли-А РНК получают библиотеку кДНК с применением λZAPII (Stratagene) в качестве вектора с помощью набора для направленного получения библиотек (Stratagene) по способу, рекомендованному производителем. Поскольку основной антоциан торении имеет глюкозу в положении 5, модифицированную ароматической ацильной группой (Suzuki, et al., Molecular Breeding, 6, 239-246, 2000), антоцианинацилтрансфераза экспрессируется в цветочных лепестках торении.
Антоцианинацилтрансфераза имеет специфичную аминокислотную последовательность и ген антоцианинацилтрансферазы можно получить с применением синтетической ДНК, соответствующей ему, в качестве праймера (WO 96/25500). Более конкретно, ПЦР проводят в условиях, рекомендованных производителем, с применением 10 нг одноцепочечной кДНК, синтезированной при получении библиотеки кДНК из торении, в качестве матрицы, с применением 100 нг праймера АТС (см SEQ ID NO. 17 патентного документа 2) и 100 нг олиго-dT праймера (см SEQ ID NO. 18 патентного документа 2) в качестве праймеров и с применением Taq полимеразы (Takara, Japan).
ПЦР проводят за 25 циклов, состоящих из 1 мин при 95°С, 1 мин при 55°С и 1 мин при 72°С. Полученный фрагмент ДНК размеров примерно 400 bp выделяют с помощью GeneClean II (Bio 101 Inc.) по способу, рекомендованному производителем, и суб-клонируют в pCR-TOPO. После определения его нуклеотидной последовательности обнаружено, что последовательность гомологична таковой гена ацилтрансферазы японской горечавки (Fujiwara, et al., Plant J., 16, 421-431, 1998). Далее определяют нуклеотидную последовательность по способу с маркированными красителем праймерами (Applied Biosystems) с помощью установки Sequencer 310 или 377 (Applied Biosystems).
Этот фрагмент ДНК метят с помощью набора для определения метки DIG (Nippon Roche) и проводят скрининг библиотеки кДНК из торении с применением способа гибридизации бляшек, как описано производителем. Двенадцать из полученных клонов, проявляющих положительные сигналы, отбирают случайным образом и из клонов выделяют плазмиды с последующим определением нуклеотидной последовательности. Эти последовательности демонстрируют предпочтительную гомологию с геном антоцианинацилтрансферазы. Среди этих клонов полную нуклеотидную последовательность определяют для кДНК, содержащейся в клоне, называемом рТАТ7 (см SEQ ID NO. 7 патентного документа 2 для нуклеотидной последовательности и SEQ ID NO. 8 патентного документа 2 для аминокислотной последовательности).
pBE2113-GUS (Mitsuhara, et al, Plant Veil. Physiol., 37, 45-59, 1996) обрабатывают рестриктазой SacI с последующим получением тупых концов и вставкой линкера 8 bp XhoI. Фрагмент ДНК размеров примерно 1,7 kb, полученный путем обработки рТАТ7 рестриктазами BamHI и XhoI, вставляют в участки BamHI и XhoI этой плазмиды для получения pSPB120. pSPB120' получают путем обработки pSBP120 рестриктазами SanBI и BamHI с последующим получением тупых концов и лигированием. С другой стороны, плазмиду pCGP1961, содержащую полученную из анютиных глазок кДНК F3'5'H#40, полностью обрабатывают с помощью BamHI и затем частично обрабатывают с помощью XhoI, полученный фрагмент ДНК размеров примерно 1,8 kb DNA выделяют и лигируют с pUE5H, обработанной рестриктазами BamHI XhoI, и полученную плазмиду называют pUEBP40.
pUEBP40' получают путем обработки pEUBP40 с помощью SnaBI и BamHI с последующим получением тупых концов и лигированием. pUEBP40' частично обрабатывают с помощью HindIII и полученный фрагмент ДНК размеров примерно 2,7 kb DNA выделяют и лигируют с фрагментом ДНК, полученным путем частичной обработки pSPB120' с помощью HindIII. Среди полученных плазмид бинарный вектор, в котором ген неомицинфосфотрансферазы, ген F3'5'H#40, выделенный из анютиных глазок, и выделенный из торени ген 5АТ лигированы в таком порядке от правой границы бинарного вектора, называют pSPB130 (см фигуру 12). Эта плазмида создана для конститутивной экспрессии выделенного из анютиных глазок гена F3'5'H#40 и выделенного из торении гена 5АТ в растениях и специфичной транскрипции генов в цветочных лепестках. Эту плазмиду трансфицируют в Agrobacterium tumefaciens штамм Ag10. В результате инфицирования этим штаммом Agrobacterium pSPB130 (фиг.12) трансфицирует разновидность розово-лиловых роз "WKS82" с получением трансформированного растения. Трансформированные клетки затем регенерируют с получением рекомбинантного растения в виде голубой розы (вариант "WKS82", трансфицированный плазмидой pSPB130) и дают ему зацвести.
Экстракция, выделение, очистка и идентификация пигментных соединений
Экстракцию, выделение и очистку проводят с применением 230 г цветочных лепестков голубой розы, полученных по способу, описанному выше (вариант "WKS82", трансфицированный плазмидой pSPB130) по тому же способу, как описано в примере 1, для получения синего пигмента (1), красного пигмента (2) и синего пигмента (3).
Синий пигмент (1), красный пигмент (2) и синий пигмент (3) оценивают визуально на оттенок цвета. В результате они демонстрируют глубокий синий, глубокий красный и глубокий синий цвет, соответственно.
Дополнительно, с помощью масс-спектрометрии LC-TOF-MS подтверждают, что синий пигмент (1), красный пигмент (2) и синий пигмент (3), соответственно, представляют собой те же пигментные соединения, что и пигментные соединения, описанные в примере 1.
Промышленное применение
Согласно настоящему изобретению новый пигмент, присутствующий в цветочных лепестках голубых роз, экстрагирован, выделен и очищен и его химическая структура определена. Соединение впервые открытое в настоящем изобретении проявляет более синий цвет, чем розацианины, присутствующие, как известно, в обычных розах розово-лилового цвета. Соответственно, окраска цветов растения может быть изменена с помощью этого соединения, открытого в настоящем изобретении. Альтернативно, это соединение можно также применять для окрашивания пищи и напитков, например, с помощью растительного пигмента.








Настоящее изобретение относится к новому соединению, представляющему собой пигмент растения, которое относится к семейству Rosaceae рода Rosa, конкретно розе. Это новое соединение, содержащееся в голубой розе, способно изменять окраску цвета растения и имеет химическую структуру, представленную общей формулой (I), указанную ниже, где R1 представляет группу, как указано в п.1, и R2 представляет -ОН или R1 и R2 вместе образуют -O-. Также раскрыто, что изменение цвета происходит именно в важной части растения - в срезанном цветке, 6 н. и 1 з.п. ф-лы, 3 пр., 14 ил.
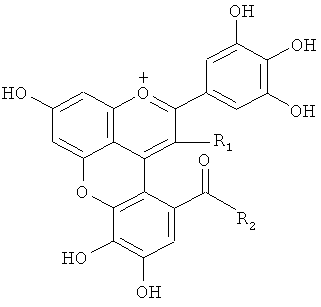
1. Соединение следующей общей формулы (I)
где R1 представляет следующую группу:
(химическая формула 2)
и R2 представляет -ОН или R1 и R2 вместе образуют -O-, или R1 представляет следующую группу:
и R2 представляет -ОН, предоставленный таким образом, что связь (волнистая линия) гидроксильной группы в положении 1 глюкозы в R1 проявляет таутомерию между α-формой и β-формой.
2. Соединение следующей формулы:
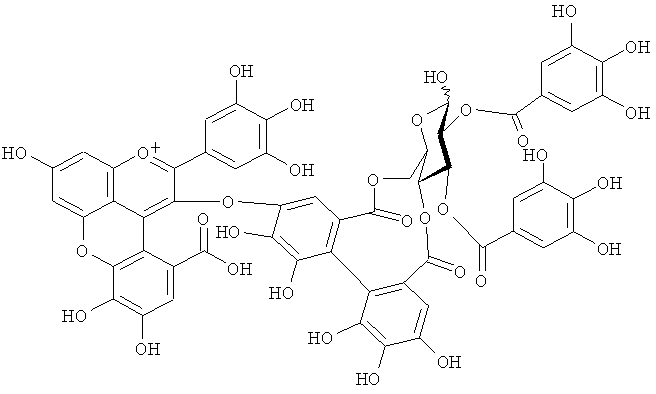
3. Соединение следующей формулы:
4. Соединение следующей формулы:

5. Растение семейства Rosaceae, рода Rosa, содержащее соединение по любому из пп.1-4.
6. Растение по п.5, отличающееся тем, что оно представляет собой розу.
7. Срезанный цветок растения по п.5 или 6.
| JP 2002201372 A, 19.07.2002 | |||
| Способ приготовления мыла | 1923 |
|
SU2004A1 |
| Способ диагностики характера течения ревматоидного артрита | 1987 |
|
SU1652916A1 |
| Fukui Y | |||
| Et al, "Two novel blue pigments with ellagitannin moiety, rosacyanins A1 and A2, isolated from the petals of Rosa hybrida", Tetrahedron, 2006, n.62, p.9661-9670 | |||
| Станок для изготовления деревянных ниточных катушек из цилиндрических, снабженных осевым отверстием, заготовок | 1923 |
|
SU2008A1 |
| Станок для изготовления деревянных ниточных катушек из цилиндрических, снабженных осевым отверстием, заготовок | 1923 |
|
SU2008A1 |
| Пресс для выдавливания из деревянных дисков заготовок для ниточных катушек | 1923 |
|
SU2007A1 |
| Станок для изготовления деревянных ниточных катушек из цилиндрических, снабженных осевым отверстием, заготовок | 1923 |
|
SU2008A1 |
| РОЗА, СОДЕРЖАЩАЯ ФЛАВОН И МАЛЬДИВИН, И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2008 |
|
RU2463348C2 |
Авторы
Даты
2014-02-20—Публикация
2010-03-25—Подача