ОБЛАСТЬ ТЕХНИКИ
Данная заявка испрашивает приоритет по отношению к японской патентной заявке № 2007-160042 (поданной 18 июня 2007).
Настоящее изобретение относится к новым генам глицерин-3-фосфатацилтрансферазы.
ПРЕДПОСЫЛКИ ИЗОБРЕТЕНИЯ
Жирные кислоты являются важными компонентами липидов, таких как фосфолипиды и триацилглицерины. Жирные кислоты, содержащие две или более ненасыщенных связи, вместе обозначаются как полиненасыщенные жирные кислоты (ПНЖК) и, как известно, включают арахидоновую кислоту, дигомо-γ-линоленовую кислоту, эйкозапентаеновую кислоту и докозагексаеновую кислоту. Сообщалось о различных физиологических активностях этих жирных кислот (непатентный документ 1). Вероятно, эти полиненасыщенные жирные кислоты обладают применениями в различных областях, но некоторые из них не могут быть синтезированы в организме животного. Таким образом, были разработаны микробиологические технологии для получения полиненасыщенных жирных кислот посредством культивирования различных микроорганизмов. Также предпринимались другие попытки для синтеза полиненасыщенных жирных кислот в растениях. В этих случаях известно, что полиненасыщенные жирные кислоты накапливаются, например, в виде компонентов запасных липидов, таких как триацилглицерины в клетках микроорганизмов или семенах растений.
Более конкретно, триацилглицерины синтезируются in vivo следующим образом. А именно, глицерин-3-фосфат ацилируется глицерин-3-фосфатацилтрансферазой для образования лизофосфатидной кислоты, которая затем дополнительно ацилируется ацилтрансферазой лизофосфатидной кислоты для образования фосфатидной кислоты. В свою очередь, эта фосфатидная кислота дефосфорилируется кислой фосфатидной фосфатазой для образования диацилглицерина, который затем ацилируется диацилглицеринацилтрансферазой для образования триацилглицерина. Также известно, что другие ферменты, такие как ацилКоА:холестерин ацилтрансфераза и лизофосфатидилхолинацилтрансфераза, косвенно вовлечены в биосинтез триацилглицеринов.
Известно, что в вышеуказанном метаболическом пути биосинтеза триацилглицерина или в метаболических путях биосинтеза фосфолипидов реакция, в которой глицерин-3-фосфат ацилируется для образования лизофосфатидной кислоты, опосредована глицерин-3-фосфатацилтрансферазой (в дальнейшем также обозначаемой как «ГФАТ»; EC 2.3.1.15).
До сих пор сообщается о генах ГФАТ в некоторых организмах. Относительно генов ГФАТ млекопитающих, было клонировано два типа генов: микросомальный (мембраносвязанный) и митохондриальный (мембраносвязанный) гены ГФАТ (непатентный документ 2). Также относительно генов ГФАТ растений, было клонировано три типа генов: микросомальный (мембраносвязанный), митохондриальный (мембраносвязанный) и хлоропластный (свободный) гены ГФАТ (непатентный документ 3). Кроме того, относительно генов ГФАТ, полученных из грибка Saccharomyces cerevisiae, было клонировано два типа генов: микросомальный (мембраносвязанный) GPT2 (GAT1) и SCT1 (GAT2) гены (непатентный документ 4). Для этих генов грибков было показано, что GPT2 обладает способностью использовать в качестве субстрата широкий диапазон жирных кислот, простирающийся от пальмитиновой кислоты (16:0) до олеиновой кислоты (18:1), тогда как SCT1 обладает высокой избирательностью в использовании C16 жирных кислот (например, пальмитиновой кислоты (16:0), пальмитолеиновой кислоты (16:1)) в качестве субстрата (непатентный документ 4). Кроме того, гены ГФАТ также были клонированы из многих других организмов.
Сообщения также касаются ГФАТ, полученных из микроорганизмов рода Mortierella, которые являются липидопродуцирующими грибками. Что касается ГФАТ, полученной из Mortierella ramanniana, была выделена микросомальная ГФАТ и было обнаружено, что она использует олеиновую кислоту (18:1) в качестве донора ацила с 5,4-кратной избирательностью по сравнению с пальмитиновой кислотой (16:0) (непатентный документ 5). Что касается ГФАТ, полученной из Mortierella alpina (в последствии также обозначаемой как «M. alpina»), сообщалось, что микросомальная фракция этого грибка обладает глицерин-3-фосфатацилтрансферазной активностью (непатентный документ 6). Кроме того, было обнаружено, что в реакциях с различными ацил-коферментами А in vitro, ГФАТ, присутствующая в микросомах M. alpina (которая находится в мембраносвязанном состоянии), используется широкий диапазон ПНЖК, включая олеиновую кислоту (18:1), линолевую кислоту (18:2), дигомо-γ-линоленовую кислоту (ДГЛК) (20:3) и арахидоновую кислоту (20:4) в качестве субстрата при сохранении высокой активности (патентный документ 1). Кроме того, при экспрессии в Yarrowia lipolytica, трансформированной так, чтобы сделать возможным биосинтез вплоть до эйкозапентаеновой кислоты (ЭПК), было обнаружено, что ГФАТ, клонированная из M. alpina (ATCC #16266), обеспечивает более высокую долю дигомо-γ-линоленовой кислоты (ДГЛК) (20:3) и более низкую долю олеиновой кислоты (18:1) среди всех жирных кислот. Этот результат указывает на то, что ПНЖК с более длинной цепью и большей степенью ненасыщенности используются более избирательно (патентный документ 2).
Патентный документ 1: Международная публикация № WO2004/087902
Патентный документ 2: Публикация патента США № 2006/0094091
Непатентный документ 1: Lipids, 39, 1147 (2004)
Непатентный документ 2: Biochimica et Biophysica Acta, 1348, 17-26, 1997
Непатентный документ 3: Biochimica et Biophysica Acta, 1348, 10-16, 1997
Непатентный документ 4: The Journal of Biological Chemistry, 276 (45), 41710 41716, 2001
Непатентный документ 5: The Biochemical Journal, 355, 315-322, 2001
Непатентный документ 6: Biochemical Society Transactions, 28, 707-709, 2000
ОПИСАНИЕ ИЗОБРЕТЕНИЯ
ПРОБЛЕМЫ, РЕШАЕМЫЕ С ПОМОЩЬЮ ИЗОБРЕТЕНИЯ
Однако даже если гены ГФАТ, о которых ранее сообщалось, введены и экспрессируются в клетках-хозяевах, композиции жирных кислот, синтезируемые организмами-хозяинами, ограничиваются субстратной специфичностью экспрессируемых ферментов. По этой причине существует необходимость устанавливать новые гены, которые делают возможным синтез композиции жирных кислот, в которых доля жирных кислот отличается от тех, о которых сообщалось ранее.
СРЕДСТВА РЕШЕНИЯ ПРОБЛЕМ
Цель настоящего изобретения состоит в предоставлении белка или нуклеиновой кислоты, которая делает возможным синтез жиров и масел с желаемой долей жирных кислот и/или обогащение желаемых жирных кислот посредством введения или экспрессии в клетках-хозяевах.
Для достижения вышеуказанной цели изобретатели настоящего изобретения выполнили экстенсивные и интенсивные исследования. Сначала, на липидопродуцирующем грибке, Mortierella alpina, был выполнен анализ маркёрных экспрессируемых последовательностей, чтобы получить последовательности, обладающие высоким сходством с известными генами ГФАТ. Для получения полной открытой рамки считывания (ORF), кодирующей ГФАТ, гены дополнительно клонировали с помощью скрининга библиотеки кДНК или ПЦР. В результате попыток ввести эти гены в высокопролиферативные клетки-хозяева (например, клетки дрожжей) чтобы таким образом синтезировать желаемые композиции жирных кислот, изобретатели преуспели в клонировании гена, относящегося к новой ГФАТ с отличающейся субстратной специфичностью, которая делает возможным синтез композиции жирных кислот, отличающейся от таковых, синтезируемых организмами-хозяинами, экспрессирующим традиционные ГФАТ. Это привело к выполнению настоящего изобретения. Конкретно, настоящее изобретение представляет собой следующее.
(1) Нуклеиновая кислота, содержащая нуклеотидную последовательность, показанную ниже в любом из пунктов с (a) до (e):
(a) нуклеотидная последовательность, которая кодирует белок, состоящий из аминокислотной последовательности с делециями, заменами или вставками одной или нескольких аминокислот в аминокислотную последовательность, показанную в SEQ ID № 2 и обладающую глицерин-3-фосфатацилтрансферазной активностью;
(b) нуклеотидная последовательность, которая является гибридизуемой при строгих условиях с нуклеиновой кислотой, состоящей из нуклеотидной последовательности, комплементарной нуклеотидной последовательности, состоящей из SEQ ID № 4, и которая кодирует белок, обладающий глицерин-3-фосфатацилтрансферазной активностью;
(c) нуклеотидная последовательность, которая состоит из нуклеотидной последовательности, обладающей сходством в 70% или более с нуклеотидной последовательностью, состоящей из SEQ ID № 4, и которая кодирует белок, обладающий глицерин-3-фосфатацилтрансферазной активностью;
(d) нуклеотидная последовательность, которая кодирует аминокислотную последовательность, обладающую сходством в 70% или более с аминокислотной последовательностью, состоящей из SEQ ID № 2, и которая кодирует белок, обладающий глицерин-3-фосфатацилтрансферазной активностью; или
(e) нуклеотидная последовательность, которая является гибридизуемой при строгих условиях с нуклеиновой кислотой, состоящей из нуклеотидной последовательности, комплементарной нуклеотидной последовательности, кодирующей белок, состоящий из аминокислотной последовательности, показанной в SEQ ID № 2, и которая кодирует белок, обладающий глицерин-3-фосфатацилтрансферазной активностью.
(2) Нуклеиновая кислота согласно вышеприведенному (1), которая содержит нуклеотидную последовательность, показанную ниже в любом из пунктов с (a) до (c):
(a) нуклеотидная последовательность, которая кодирует белок, состоящий из аминокислотной последовательности с делецией, заменой или вставкой от 1 до 10 аминокислот в аминокислотную последовательность, показанную в SEQ ID № 2, и обладающий глицерин-3-фосфатацилтрансферазной активностью;
(b) нуклеотидная последовательность, которая является гибридизуемой в условиях 2× SSC при 50°C с нуклеиновой кислотой, состоящей из нуклеотидной последовательности, комплементарной нуклеотидной последовательности, состоящей из SEQ ID № 4, и которая кодирует белок, обладающий глицерин-3-фосфатацилтрансферазной активностью; или
(c) нуклеотидная последовательность, которая кодирует аминокислотную последовательность, обладающую сходством в 90% или более с аминокислотной последовательностью, состоящей из SEQ ID № 2, и которая кодирует белок, обладающий глицерин-3-фосфатацилтрансферазной активностью.
(3) Нуклеиновая кислота, содержащая нуклеотидную последовательность, показанную ниже в любом из пунктов с (a) до (c) или ее фрагмент:
(a) нуклеотидная последовательность, показанная в SEQ ID № 4;
(b) нуклеотидная последовательность, кодирующая белок, состоящий из аминокислотной последовательности, показанной в SEQ ID № 2; или
(c) нуклеотидная последовательность, показанная в SEQ ID № 1.
(4) Нуклеиновая кислота, содержащая нуклеотидную последовательность, показанную ниже в любом из пунктов с (a) до (e):
(a) нуклеотидная последовательность, которая кодирует следующий белок:
белок, который состоит из аминокислотной последовательности с делецией, заменой или вставкой одной или нескольких аминокислот в аминокислотную последовательность, показанную в SEQ ID № 2, и который обладает способностью давать долю жирных кислот, обеспечивающей более высокую степень, по меньшей мере, одного или нескольких из показанных ниже пунктов с i) до v) в доле жирных кислот организма-хозяина, экспрессирующего белок, чем в доле жирных кислот организма-хозяина, не экспрессирующего белок:
i) содержание олеиновой кислоты;
ii) отношение содержания олеиновой кислоты к содержанию пальмитиновой кислоты;
iii) отношение общего содержания стеариновой кислоты и олеиновой кислоты к содержанию пальмитиновой кислоты;
iv) отношение содержания C18 жирной кислоты к содержанию C16 жирной кислоты; и
v) степень содержания арахидоновой кислоты и/или дигомо-γ-линоленовой кислоты;
(b) нуклеотидная последовательность, которая является гибридизуемой при строгих условиях с нуклеиновой кислотой, состоящей из нуклеотидной последовательности, комплементарной нуклеотидной последовательности, состоящей из SEQ ID № 4, и которая кодирует следующий белок:
белок, который обладает способностью давать долю жирных кислот, обеспечивающей более высокую степень, по меньшей мере, одного или нескольких из показанных ниже пунктов с i) до v) в доле жирных кислот организма-хозяина, экспрессирующего белок, чем в доле жирных кислот организма-хозяина, не экспрессирующего белок:
i) содержание олеиновой кислоты;
ii) отношение содержания олеиновой кислоты к содержанию пальмитиновой кислоты;
iii) отношение общего содержания стеариновой кислоты и олеиновой кислоты к содержанию пальмитиновой кислоты;
iv) отношение содержания C18 жирной кислоты к содержанию C16 жирной кислоты; и
v) степень содержания арахидоновой кислоты и/или дигомо-γ-линоленовой кислоты;
(c) нуклеотидная последовательность, которая состоит из нуклеотидной последовательности, обладающей сходством в 70% или более с нуклеотидной последовательностью, состоящей из SEQ ID № 4, и которая кодирует следующий белок:
белок, который обладает способностью давать долю жирных кислот, обеспечивающей более высокую степень, по меньшей мере, одного или нескольких из показанных ниже пунктов с i) до v) в доле жирных кислот организма-хозяина, экспрессирующего белок, чем в доле жирных кислот организма-хозяина, не экспрессирующего белок:
i) содержание олеиновой кислоты;
ii) отношение содержания олеиновой кислоты к содержанию пальмитиновой кислоты;
iii) отношение общего содержания стеариновой кислоты и олеиновой кислоты к содержанию пальмитиновой кислоты;
iv) отношение содержания C18 жирной кислоты к содержанию C16 жирной кислоты; и
v) степень содержания арахидоновой кислоты и/или дигомо-γ-линоленовой кислоты;
(d) нуклеотидная последовательность, которая кодирует следующий белок:
белок, который состоит из аминокислотной последовательности, обладающей сходством в 70% или более с аминокислотной последовательностью, состоящей из SEQ ID № 2, и который обладает способностью давать долю жирных кислот, обеспечивающей более высокую степень, по меньшей мере, одного или нескольких из показанных ниже пунктов с i) до v) в доле жирных кислот организма-хозяина, экспрессирующего белок, чем в доле жирных кислот организма-хозяина, не экспрессирующего белок:
i) содержание олеиновой кислоты;
ii) отношение содержания олеиновой кислоты к содержанию пальмитиновой кислоты;
iii) отношение общего содержания стеариновой кислоты и олеиновой кислоты к содержанию пальмитиновой кислоты;
iv) отношение содержания C18 жирной кислоты к содержанию C16 жирной кислоты; и
v) степень содержания арахидоновой кислоты и/или дигомо-γ-линоленовой кислоты; или
(e) нуклеотидная последовательность, которая является гибридизуемой при строгих условиях с нуклеиновой кислотой, состоящей из нуклеотидной последовательности, комплементарной нуклеотидной последовательности, кодирующей белок, состоящий из аминокислотной последовательности, показанной в SEQ ID № 2, и которая кодирует следующий белок:
белок, который обладает способностью давать долю жирных кислот, обеспечивающей более высокую степень, по меньшей мере, одного или нескольких из показанных ниже пунктов с i) до v) в доле жирных кислот организма-хозяина, экспрессирующего белок, чем в доле жирных кислот организма-хозяина, не экспрессирующего белок:
i) содержание олеиновой кислоты;
ii) отношение содержания олеиновой кислоты к содержанию пальмитиновой кислоты;
iii) отношение общего содержания стеариновой кислоты и олеиновой кислоты к содержанию пальмитиновой кислоты;
iv) отношение содержания C18 жирной кислоты к содержанию C16 жирной кислоты; и
v) степень содержания арахидоновой кислоты и/или дигомо-γ-линоленовой кислоты.
(5) Нуклеиновая кислота согласно вышеприведенному (4), которая содержит нуклеотидную последовательность, показанную ниже в любом из пунктов с (a) до (c):
(a) нуклеотидная последовательность, которая кодирует следующий белок:
белок, который состоит из аминокислотной последовательности с делецией, заменой или вставкой от 1 до 10 аминокислот в аминокислотную последовательность, показанную в SEQ ID № 2, и который обладает способностью давать долю жирных кислот, обеспечивающей более высокую степень, по меньшей мере, одного или нескольких из показанных ниже пунктов с i) до v) в доле жирных кислот организма-хозяина, экспрессирующего белок, чем в доле жирных кислот организма-хозяина, не экспрессирующего белок:
i) содержание олеиновой кислоты;
ii) отношение содержания олеиновой кислоты к содержанию пальмитиновой кислоты;
iii) отношение общего содержания стеариновой кислоты и олеиновой кислоты к содержанию пальмитиновой кислоты;
iv) отношение содержания C18 жирной кислоты к содержанию C16 жирной кислоты; и
v) степень содержания арахидоновой кислоты и/или дигомо-γ-линоленовой кислоты;
(b) нуклеотидная последовательность, которая является гибридизуемой в условиях 2× SSC при 50°C с нуклеиновой кислотой, состоящей из нуклеотидной последовательности, комплементарной нуклеотидной последовательности, состоящей из SEQ ID № 4, и которая кодирует следующий белок:
белок, который обладает способностью давать долю жирных кислот, обеспечивающей более высокую степень, по меньшей мере, одного или нескольких из показанных ниже пунктов с i) до v) в доле жирных кислот организма-хозяина, экспрессирующего белок, чем в доле жирных кислот организма-хозяина, не экспрессирующего белок:
i) содержание олеиновой кислоты;
ii) отношение содержания олеиновой кислоты к содержанию пальмитиновой кислоты;
iii) отношение общего содержания стеариновой кислоты и олеиновой кислоты к содержанию пальмитиновой кислоты;
iv) отношение содержания C18 жирной кислоты к содержанию C16 жирной кислоты; и
v) степень содержания арахидоновой кислоты и/или дигомо-γ-линоленовой кислоты; или
(c) нуклеотидная последовательность, которая кодирует следующий белок:
белок, который состоит из аминокислотной последовательности, обладающей сходством в 90% или более с аминокислотной последовательностью, состоящей из SEQ ID № 2 и который обладает способностью давать долю жирных кислот, обеспечивающей более высокую степень, по меньшей мере, одного или нескольких из показанных ниже пунктов с i) до v) в доле жирных кислот организма-хозяина, экспрессирующего белок, чем в доле жирных кислот организма-хозяина, не экспрессирующего белок:
i) содержание олеиновой кислоты;
ii) отношение содержания олеиновой кислоты к содержанию пальмитиновой кислоты;
iii) отношение общего содержания стеариновой кислоты и олеиновой кислоты к содержанию пальмитиновой кислоты;
iv) отношение содержания C18 жирной кислоты к содержанию C16 жирной кислоты; и
v) степень содержания арахидоновой кислоты и/или дигомо-γ-линоленовой кислоты.
(6) Белок, показанный ниже в пунктах (a) или (b):
(a) белок, который состоит из аминокислотной последовательности с делецией, заменой или вставкой одной или нескольких аминокислот в SEQ ID № 2, и который обладает глицерин-3-фосфатацилтрансферазной активностью; или
(b) белок, который состоит из аминокислотной последовательности, обладающей сходством в 70% или более с аминокислотной последовательностью, состоящей из SEQ ID № 2, и который обладает глицерин-3-фосфатацилтрансферазной активностью.
(7) Белок, показанный ниже в пунктах (a) или (b):
(a) белок, который состоит из аминокислотной последовательности с делецией, заменой или вставкой одной или нескольких аминокислот в SEQ ID № 2 и который обладает способностью давать долю жирных кислот, обеспечивающей более высокую степень, по меньшей мере, одного или нескольких из показанных ниже пунктов с i) до v) в доле жирных кислот организма-хозяина, экспрессирующего белок, состоящий из аминокислотной последовательности, чем в доле жирных кислот организма-хозяина, не экспрессирующего белок:
i) содержание олеиновой кислоты;
ii) отношение содержания олеиновой кислоты к содержанию пальмитиновой кислоты;
iii) отношение общего содержания стеариновой кислоты и олеиновой кислоты к содержанию пальмитиновой кислоты;
iv) отношение содержания C18 жирной кислоты к содержанию C16 жирной кислоты; и
v) степень содержания арахидоновой кислоты и/или дигомо-γ-линоленовой кислоты; или
(b) белок, который состоит из аминокислотной последовательности, обладающей сходством в 70% или более с аминокислотной последовательностью, состоящей из SEQ ID № 2, и который обладает способностью давать долю жирных кислот, обеспечивающей более высокую степень, по меньшей мере, одного или нескольких из показанных ниже пунктов с i) до v) в доле жирных кислот организма-хозяина, экспрессирующего белок, состоящий из аминокислотной последовательности, чем в доле жирных кислот организма-хозяина, не экспрессирующего белок:
i) содержание олеиновой кислоты;
ii) отношение содержания олеиновой кислоты к содержанию пальмитиновой кислоты;
iii) отношение общего содержания стеариновой кислоты и олеиновой кислоты к содержанию пальмитиновой кислоты;
iv) отношение содержания C18 жирной кислоты к содержанию C16 жирной кислоты; и
v) степень содержания арахидоновой кислоты и/или дигомо-γ-линоленовой кислоты.
(8) Белок, состоящий из аминокислотной последовательности, показанной в SEQ ID № 2.
(9) Рекомбинантный вектор, содержащий нуклеиновую кислоту согласно любому из приведенных выше пунктов с (1) до (5).
(10) Трансформант, трансформированный рекомбинантным вектором согласно вышеприведенному (9).
(11) Композиции жирных кислот, полученные посредством культивирования трансформанта согласно вышеприведенному (10), где, по меньшей мере, один или несколько из показанных ниже пунктов с i) до v) больше в доле жирных кислот в композиции жирных кислот, чем в культивированном продукте, полученном посредством культивирования организма-хозяина, который не трансформирован рекомбинантным вектором согласно вышеприведенному (9):
i) содержание олеиновой кислоты;
ii) отношение содержания олеиновой кислоты к содержанию пальмитиновой кислоты;
iii) отношение общего содержания стеариновой кислоты и олеиновой кислоты к содержанию пальмитиновой кислоты;
iv) отношение содержания C18 жирной кислоты к содержанию C16 жирной кислоты; и
v) степень содержания арахидоновой кислоты и/или дигомо-γ-линоленовой кислоты.
(12) Способ получения композиции жирных кислот, который содержит сбор композиции жирных кислот согласно вышеприведенному (11) из культивированного продукта, полученного посредством культивирования трансформанта согласно вышеприведенному (10).
(13) Пищевой продукт, содержащий композицию жирных кислот согласно вышеприведенному (11).
ПРЕИМУЩЕСТВА ИЗОБРЕТЕНИЯ
ГФАТ по настоящему изобретению обладает субстратной специфичностью, отличающейся от субстратной специфичности традиционных ГФАТ, и позволяет организму-хозяину синтезировать композицию жирных кислот, в которых доля жирных кислот отличается от доли жирных кислот в композиции жирных кислот, синтезируемой организмами-хозяинами, экспрессирующим традиционные ГФАТ. В результате ГФАТ по настоящему изобретению делает возможным предоставление липидов, обладающих желаемыми свойствами и эффектами, и пригодны для применения в пищевых продуктах, косметике, фармацевтике, мылах и т.д.
Кроме того, ГФАТ по настоящему изобретению делает возможным улучшение способности синтезировать жирные кислоты и запасные липиды, и таким образом является предпочтительной в качестве средства для улучшения производительности синтеза полиненасыщенных жирных кислот в микроорганизмах и растениях.
КРАТКОЕ ОПИСАНИЕ РИСУНКОВ
На фигуре 1 показана последовательность кДНК (SEQ ID № 1) ГФАТ2 по настоящему изобретению, наряду с ее расшифрованной аминокислотной последовательностью (SEQ ID № 2). На фигуре «*» обозначает аминокислотный остаток, который кажется важным для ГФАТ активности, и «+» обозначает аминокислотный остаток, который кажется важным для связывания с глицерин-3-фосфатом.
ЛУЧШИЙ ВАРИАНТ ВЫПОЛНЕНИЯ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к новым генам глицерин-3-фосфатацилтрансферазы, полученной из рода Mortierella, отличающейся ацилированием глицерин-3-фосфата для образования лизофосфатидной кислоты.
Глицерин-3-фосфатацилтрансфераза (ГФАТ) в настоящем изобретении представляет собой фермент, который катализирует реакцию, в которой глицерин-3-фосфат ацилируется для образования лизофосфатидной кислоты. Донором ацила, как правило, является ацилКоА, но не ограничивается им. Акцептором ацила в реакции переноса ацила, катализируемой белком по настоящему изобретению, является глицерин-3-фосфат, но не ограничивается им.
Нуклеиновые кислоты по настоящему изобретению, кодирующие глицерин-3-фосфатацилтрансферазу
Глицерин-3-фосфатацилтрансфераза (ГФАТ) в настоящем изобретении относится к ГФАТ2. Соответствие между кДНК, кодирующими последовательностями, открытыми рамками считывания и аминокислотными последовательностями нуклеиновой кислоты, кодирующей ГФАТ2, объединены далее в таблице 1.
То есть, последовательности, относящиеся к ГФАТ2 по настоящему изобретению, включают SEQ ID № 2 (аминокислотная последовательность ГФАТ2), SEQ ID № 4 (последовательность, представляющая участок открытой рамки считывания в ГФАТ2), SEQ ID № 3 (последовательность, представляющая участок кодирующей последовательности в ГФАТ2) и SEQ ID № 1 (нуклеотидная последовательность кДНК для ГФАТ2). Среди них SEQ ID № 3 соответствует нуклеотидам 113-1891 в SEQ ID № 1, тогда как SEQ ID № 4 соответствует нуклеотидам 113-1888 в SEQ ID № 1 или нуклеотидам 1-1776 в SEQ ID № 3.
Нуклеиновые кислоты по настоящему изобретению охватывают одноцепочечные и двухцепочечные ДНК, а также комплементарную им РНК, которая или может встречаться в природе или быть изготовлена искусственным образом. ДНК включают в качестве неограничивающих примеров, геномные ДНК, кДНК, соответствующие геномным ДНК, химически синтезированную ДНК, ПЦР-амплифицированную ДНК, а также их сочетания и гибриды ДНК/РНК.
Предпочтительные варианты осуществления нуклеиновых кислот по настоящему изобретению включают (a) нуклеотидную последовательность, показанную в SEQ ID № 4, (b) нуклеотидную последовательность, кодирующую белок, состоящий из аминокислотной последовательности, показанной в SEQ ID № 2, и (c) нуклеотидную последовательность, показанную в SEQ ID № 1.
Вышеприведенная нуклеотидная последовательность, показанная в SEQ ID № 4, нуклеотидная последовательность, кодирующая белок, состоящий из аминокислотной последовательности, показанной в SEQ ID № 2, и нуклеотидная последовательность, показанная в SEQ ID № 1, представляют собой то, что показано в таблице 1.
Для получения этих нуклеотидных последовательностей данные нуклеотидных последовательностей маркёрных экспрессируемых последовательностей или геномных ДНК из организмов, обладающих ГФАТ активностью, можно использовать для поиска нуклеотидной последовательности, кодирующей белок, обладающий высоким сходством с известными белками, обладающими ГФАТ активностью. Предпочтительные организмы, обладающие ГФАТ активностью представляют собой липидопродуцирующие грибки, включая, в качестве неограничивающих примеров, M. alpina.
Для анализа маркёрных экспрессируемых последовательностей сначала подготавливают библиотеку кДНК. В отношении способов подготовки библиотеки кДНК можно дать ссылку на «Molecular Cloning, A Laboratory Manual 3rd ed.» (Cold Spring Harbor Press (2001)). Альтернативно можно использовать коммерчески доступный набор для подготовки библиотеки кДНК. В качестве примера, способы подготовки библиотеки кДНК, пригодные для настоящего изобретения, представляют собой следующее. Конкретно, соответствующий штамм M. alpina, липидопродуцирующего грибка, инокулируют в соответствующую среду и предварительно культивируют в течение соответствующего периода. Условия культивирования, подходящие для этого предварительного культивирования, включают, например, среду, состоящую из 1,8% глюкозы, 1% дрожжевого экстракта и pH 6,0, период культивирования 3 дня и температура культивирования 28°C. Затем предварительно культивированный продукт подвергают основному культивирование при соответствующих условиях. Состав среды, пригодной для основного культивирования, может быть, например, 1,8% глюкозы, 1% порошка соевых бобов, 0,1% оливкового масла, 0,01% Adekanol, 0,3% KH2PO4, 0,1% Na2SO4, 0,05% CaCl2∙2H2O, 0,05% MgCl2∙6H2O и pH 6,0. Условия культивирования, пригодные для основного культивирования могут быть, например, аэробной культурой с постоянным перемешиванием при 300 об/мин, 1 vvm, 26°C в течение 8 дней. Соответствующее количество глюкозы может быть добавлено в ходе культивирования. Образцы культивированного продукта забирают в соответствующие моменты времени в ходе основного культивирования, из которых затем собирают клетки для подготовки общей РНК. Для подготовки общей РНК возможно использование любых известных способов, таких как способ с гуанидингидрохлоридом/CsCl. Полученная общая РНК может быть обработана коммерчески доступным набором для очистки поли(A)+РНК. Дополнительно, библиотека кДНК может быть подготовлена с помощью коммерчески доступного набора. Затем для любого клона из подготовленной таким образом библиотеки кДНК определяют его нуклеотидную последовательность посредством применения праймеров, которые предусмотрены в векторе, чтобы сделать возможным определение нуклеотидной последовательности вставки. В результате, могут быть получены маркёрные экспрессируемые последовательности. Например, когда ZAP cDNA GigapackIII Gold Cloning Kit (Stratagene) используется для подготовки библиотеки кДНК, может быть выполнено прямое клонирование.
При сравнении нуклеотидных последовательностей их открытых рамок считывания, ген ГФАТ2 по настоящему изобретению и известный ген ГФАТ1, выделенный из M. alpina (ATCC #16266), обладают сходством 42,0%. Следует отметить, что при анализе с помощью BLASTX, ген ГФАТ2 по настоящему изобретению обладает сходством 36,9% с нуклеотидной последовательностью, кодирующей предполагаемую белковую последовательность, выделенную из Aspergillus nidulans, похожую на 1-ацил-sn-глицерин-3-фосфатацилтрансферазу (инвентарный номер GB EAA62242), обладающую наименьшим E-value (т.е., указывающим на наилучшее сходство) и обладающую сходством 36,6% с нуклеотидной последовательностью, кодирующей полученную из Saccharomyces cerevisiae глицерин-3-фосфатацилтрансферазу Sct1p (инвентарный номер GB CAC85390), указывая на самое высокое сходство среди белков с установленной функцией.
Также идентичность аминокислотных последовательностей между ГФАТ2 по настоящему изобретению и известной ГФАТ1, выделенной из M. alpina (ATCC #16266), составляет 15,7%. Следует отметить, что при анализе с помощью BLASTX, ген ГФАТ2 по настоящему изобретению обладает сходством 17,0% с выделенной из Aspergillus nidulans 1-ацил-sn-глицерин-3-фосфатацилтрансфераза-подобной предполагаемой белковой последовательностью (инвентарный номер GB EAA62242), обладающей наименьшим E-value (т.е., указывающим на наилучшее сходство), и обладает сходством 15,0% с выделенной из Saccharomyces cerevisiae глицерин-3-фосфатацилтрансферазой Sct1p (инвентарный номер GB CAC85390), указывая на наивысшее сходство среди белков с установленной функцией.
Настоящее изобретение также охватывает нуклеиновые кислоты, функционально эквивалентные нуклеиновой кислоте, содержащей вышеупомянутую нуклеотидную последовательность, показанную в SEQ ID № 4 (в дальнейшем также обозначаемую как «нуклеотидная последовательность по настоящему изобретению») или нуклеотидную последовательность, кодирующую белок, состоящий из аминокислотной последовательности, показанной в SEQ ID № 2 (в дальнейшем также обозначаемую как «аминокислотная последовательность по настоящему изобретению»). Фраза «функционально эквивалентный» предназначена для того, чтобы обозначать, что белок, кодируемый нуклеотидной последовательностью по настоящему изобретению или белок, состоящий из аминокислотной последовательности по настоящему изобретению обладает ГФАТ активностью. В дополнение к этой ГФАТ активности, белок, кодируемый нуклеотидной последовательностью по настоящему изобретению, или белок, состоящий из аминокислотной последовательности по настоящему изобретению, может обладать способностью давать долю жирных кислот, обеспечивающей более высокую степень, по меньшей мере, одного или нескольких пунктов из:
i) содержание олеиновой кислоты;
ii) отношение содержания олеиновой кислоты к содержанию пальмитиновой кислоты;
iii) отношение общего содержания стеариновой кислоты и олеиновой кислоты к содержанию пальмитиновой кислоты;
iv) отношение содержания C18 жирной кислоты к содержанию C16 жирной кислоты; и
v) степень содержания арахидоновой кислоты и/или дигомо-γ-линоленовой кислоты
в доле жирных кислот организма-хозяина, экспрессирующего белок, чем в доле жирных кислот организма-хозяина, не экспрессирующего белок (такой белок в дальнейшем также обозначается как «белок, обладающий способностью давать долю жирных кислот ГФАТ в настоящем изобретении»).
Конкретный пример представляет собой нуклеиновую кислоту, содержащую нуклеотидную последовательность, кодирующую белок, обладающий способностью давать долю жирных кислот, удовлетворяющую, по меньшей мере, одному или нескольким из следующих пунктов:
i) содержание олеиновой кислоты составляет 47% или более, предпочтительно 48% или более, 49% или более, 50% или более, 51% или более;
ii) отношение содержания олеиновой кислоты к содержанию пальмитиновой кислоты составляет 8,0 или более, предпочтительно 9,0 или более, 10,0 или более, 10,5 или более;
iii) отношение общего содержания стеариновой кислоты и олеиновой кислоты к содержанию пальмитиновой кислоты составляет 8,5 или более, предпочтительно 9,0 или более, 10,0 или более, 11,0 или более, 11,5 или более;
iv) отношение содержания C18 жирной кислоты к содержанию C16 жирной кислоты составляет 1,2 или более, предпочтительно 1,3 или более, 1,4 или более; и
v) содержание арахидоновой кислоты составляет 0,47 или более, предпочтительно 0,50 или более, 0,55 или более, 0,60 или более, и/или содержание дигомо-γ-линоленовой кислоты составляет 0,34 или более, предпочтительно 0,40 или более, 0,50 или более, 0,55 или более,
когда вышеупомянутая нуклеотидная последовательность по настоящему изобретению встроена в экспрессирующий вектор pYE22m (Biosci. Biotech. Biochem., 59, 1221-1228, 1995) и трансформирована в дрожжевой организм-хозяин, штамм EH13-15 Saccharomyces cerevisiae (Appl. Microbiol. Biotechnol., 30, 515 520, 1989), и полученный трансформант культивируют, чтобы собрать клетки, которые затем анализируют на жирные кислоты посредством процедур, описанных в нижеприведенном примере 6. Более предпочтительной является нуклеиновая кислота, содержащая нуклеотидную последовательность, кодирующую белок, обладающий как ГФАТ активностью, так и вышеуказанной способностью давать долю жирных кислот ГФАТ в настоящем изобретении.
Одной из отличительных особенностей композиции жирных кислот по настоящему изобретению является высокое содержание арахидоновой кислоты. Арахидоновая кислота, субстанция, представленная химической формулой C20H32O2 и обладающая молекулярной массой 304,47, представляет собой карбоновую кислоту, содержащую 20 атомов углерода и 4 двойные связи ([20:4(n-6)]) и классифицированную как член семейства (n-6). Арахидоновая кислота присутствует в виде важных фосфолипидов (особенно фосфатидилэтаноламин, фосфатидилхолин, фосфатидилинозитол) в клеточных мембранах животных и в избытке содержится в мозге. Кроме того, арахидоновая кислота служит в качестве стартового материала для семейства эйкозаноидов (например, простагландин, тромбоксан, лейкотриен), порождаемых каскадом арахидоновой кислоты, и также является важной в качестве вторичного мессенджера в межклеточной передаче сигналов. С другой стороны, арахидоновая кислота синтезируется из линолевой кислоты в организме животных. Однако, в зависимости от их вида и возраста, некоторые животные не задействуют эту функцию в достаточной мере для синтеза требуемого количества арахидоновой кислоты или не обладают функцией синтеза арахидоновой кислоты. Таким образом, арахидоновую кислоту нужно получать из пищевых источников и можно рассматривать в качестве незаменимой жирной кислоты.
В качестве примера, содержание арахидоновой кислоты в композиции жирных кислот по настоящему изобретению может быть измерено следующим образом. Конкретно, плазмиду для ГФАТ2 по настоящему изобретению встраивают в вектор, такой как pDuraSC или pDura5MCS, как описано в примере 8, и трансформируют в штамм M. alpina. Полученному трансформанту позволяют экспрессировать и культивируют согласно процедурам, описанным в примере 8. Полученные таким образом культивированные клетки используют для измерения содержания жирных кислот в клетках и/или содержания арахидоновой кислоты в среде, и т.д. Например, для анализа содержания арахидоновой кислоты и т.д. жирные кислоты в полученных культивированных клетках выделяют в соответствующих метиловых эфирах жирных кислот с помощью способа с соляной кислотой/метанолом, и затем экстрагируют гексаном. После очистки от гексана, жирные кислоты анализируют газовой хроматографией. В соответствии с этим анализом было обнаружено, что M. alpina, трансформированная с помощью ГФАТ2 по настоящему изобретению, проявляет не только высокое содержание жирных кислот в клетках, но также интенсивный синтез арахидоновой кислоты, определяемой в среде. Таким образом, композиции жирных кислот по настоящему изобретению, обладающие высоким содержанием арахидоновой кислоты, являются предпочтительными, так как они делают возможным эффективное поступление арахидоновой кислоты.
Другой отличительной особенностью композиции жирных кислот по настоящему изобретению является высокое содержание дигомо-γ-линоленовой кислоты. Дигомо-γ-линоленовая кислота (ДГЛК), субстанция, изображаемая химической формулой C20H34O2 и обладающая молекулярной массой 306,48, представляет собой карбоновую кислоту, содержащую 20 атомов углерода и 3 двойные связи ([20:3(n-6)]) и классифицированную в качестве члена семейства (n-6). ДГЛК получают посредством элонгации γ-линоленовой кислоты (18:3(n-6)). При добавлении в ДГЛК одной дополнительной двойной связи получается арахидоновая кислота.
Такие нуклеиновые кислоты, которые функционально эквивалентны нуклеиновым кислотам по настоящему изобретению, включают нуклеиновую кислоту, содержащую нуклеотидную последовательность, показанную в любом из нижеприведенных пунктов с (a) до (e). Следует отметить, что при использовании для описания перечисленных ниже нуклеотидных последовательностей фраза «вышеуказанная активность по настоящему изобретению» предназначена для обозначения определенной выше «ГФАТ активности и/или способности давать долю жирных кислот ГФАТ в настоящем изобретении».
(a) Нуклеотидная последовательность, которая кодирует белок, состоящий из аминокислотной последовательности с делецией, заменой или вставкой одной или нескольких аминокислот в аминокислотную последовательность, показанную в SEQ ID № 2, и обладающую вышеуказанной активностью по настоящему изобретению.
Нуклеотидные последовательности, содержащиеся в нуклеиновых кислотах по настоящему изобретению, включают нуклеотидную последовательность, которая кодирует белок, состоящий из аминокислотной последовательности с делецией, заменой или вставкой одной или нескольких аминокислот в аминокислотную последовательность, показанную в SEQ ID № 2, и обладающую вышеуказанной активностью по настоящему изобретению.
Более конкретно, она представляет собой нуклеотидную последовательность, которая кодирует белок, состоящий из:
(i) аминокислотной последовательности с делецией одной или нескольких (предпочтительно, одной или нескольких (например, 1-180, 1-150, 1-100, 1-50, 1-30, 1-25, 1 20, 1-15, 1-10, более предпочтительно 1-5)) аминокислот в аминокислотной последовательности, показанной в SEQ ID № 2;
(ii) аминокислотной последовательности с заменой других аминокислот на одну или несколько (предпочтительно, одну или несколько (например, 1-180, 1-150, 1-100, 1-50, 1-30, 1-25, 1-20, 1-15, 1-10, более предпочтительно 1-5)) аминокислот в аминокислотной последовательности, показанной в SEQ ID № 2;
(iii) аминокислотная последовательность со вставкой другой одной или нескольких (предпочтительно, одной или нескольких (например, 1-180, 1-150, 1-100, 1-50, 1-30, 1-25, 1-20, 1-15, 1-10, более предпочтительно 1-5)) аминокислот в аминокислотную последовательность, показанную в SEQ ID № 2; или
(iv) аминокислотная последовательность с любым сочетанием вышеуказанных пунктов с (i) до (iii),
и обладающий вышеуказанной активностью по настоящему изобретению.
Среди вышеуказанных модификаций, предпочтительна консервативная замена, что обозначает замещение определенного аминокислотного остатка другим остатком, обладающим сходными физическими и химическими характеристиками. Она может представлять собой любую замену до тех пор, пока она существенно не изменяет структурные особенности исходной последовательности. Например, возможна любая замена до тех пор, пока замененные аминокислоты не нарушают спираль, присутствующую в исходной последовательности или не нарушают любой другой тип вторичной структуры, отличающий исходную последовательность.
Консервативная замена, как правило, вводится с помощью синтеза в биологических системах или химического пептидного синтеза, предпочтительно с помощью химического пептидного синтеза. В этом случае, заместители могут включать искусственные аминокислотные остатки, а также пептидомиметики, и перевернутые или инвертированные формы аминокислотных последовательностей, в которых незамещенные участки повернуты или инвертированы.
Аминокислотные остатки классифицированы и перечислены ниже, но без ограничений, в следующих группах взаимно заместимых членов:
Группа A: лейцин, изолейцин, норлейцин, валин, норвалин, аланин, 2-аминобутаноевая кислота, метионин, O-метилсерин, t-бутилглицин, t-бутилаланин и циклогексилаланин;
Группа B: аспарагиновая кислота, глутаминовая кислота, изоаспарагиновая кислота, изоглутаминовая кислота, 2-аминоадипиновая кислота и 2-аминосубериновая кислота;
Группа C: аспарагин и глутамин;
Группа D: лизин, аргинин, орнитин, 2,4-диаминобутаноевая кислота и 2,3-диаминопропионовая кислота;
Группа E: пролин, 3-гидроксипролин и 4-гидроксипролин;
Группа F: серин, треонин и гомосерин; и
Группа G: фенилаланин и тирозин.
Неконсервативная замена может затрагивать изменение члена одного из вышеуказанных классов на член из другого класса. В этом случае, с целью сохранения биологических функций белков по настоящему изобретению, предпочтительно учитывать гидропатический индекс аминокислот (Kyte et al., J. Mol. Biol., 157:105-131(1982)).
В случае неконсервативной замены, замены аминокислот также могут быть выполнены на основании гидрофильности.
В описании и рисунках настоящей заявки, нуклеотиды, аминокислоты и их сокращения находятся в соответствии с IUPAC-IUB Commission on Biochemical Nomenclature или соответствуют традиционно используемым в данной области, например, как описано в Immunology--A Synthesis (second edition, edited by E.S. Golub and D.R. Gren, Sinauer Associates, Sunderland, Massachusetts (1991)). Кроме того, подразумевается, что аминокислоты, которые могут обладать оптическими изомерами, обозначают свои L-изомеры, если не указано иначе.
Стереоизомеры (например, D-аминокислоты) вышеуказанных аминокислот, искусственных аминокислот, таких как α,α-дизамещенные аминокислоты, N-алкиламинокислоты, молочная кислота и другие нестандартные аминокислоты также могут быть членами, замещающими белки по настоящему изобретению.
Следует отметить, что в использованном здесь способе записи белков направление влево представляет собой амино-концевое направление и направление вправо представляет собой карбокси-концевое направление, в соответствии со стандартным применением и правилами.
Подобным образом, если не указано иначе, левый конец одноцепочечной полинуклеотидной последовательности представляет собой 5'-конец и направление двухцепочечной полинуклеотидной последовательности влево обозначается как 5'-направление.
Специалисты в данной области будут способны разработать и подготовить соответствующие мутанты белков, описываемых в настоящем документе с применением известных в данной области способов. Например, при нацеливании на участок, который выглядит менее важным для биологической активности белка по настоящему изобретению, возможно идентифицировать подходящий участок в белковой молекуле, структура которого может быть изменена без ослабления биологической активности белка по настоящему изобретению. Также возможно идентифицировать остатки или участки в молекуле, которые являются консервативными для сходных белков. Кроме того, также возможно введение консервативных аминокислотных замен в участок, который выглядит важным для биологической активности или структуры белка по настоящему изобретению, без уменьшения биологической активности и без негативного воздействия на полипептидную структуру белка. В частности, в настоящем изобретении на фигуре 1 двойной линией подчеркнута аминокислотная последовательность ГФАТ по настоящему изобретению в остатках 87-93, содержащая мотив, который схож с консенсусным мотивом «HXXXXD (HX4D)» (J. Bacteriology, 180, 1425-1430, 1998), который является ключевым для глицеролипидацилтрансферазы (консервативные остатки гистидина и аспарагиновой кислоты обозначены *). В вышеуказанном консенсусном мотиве X обозначает любой аминокислотный остаток. Этот мотив также будет важен для ГФАТ по настоящему изобретению для сохранения ГФАТ активности. Также остатки 87, 93 и 172 в аминокислотной последовательности ГФАТ по настоящему изобретению, которые обозначены * на фигуре 1, будут важны для активности ГФАТ по настоящему изобретению. Кроме того, остатки 138 и 174 будут важны для связывания ГФАТ по настоящему изобретению с глицерин-3-фосфатом. Таким образом, мутанты по настоящему изобретению не ограничены, во всяком случае до тех пор, пока вышеуказанных консенсусный мотив и вышеуказанные остатки остаются консервативными.
Специалисты в данной области будут способны провести так называемое структурно-функциональное исследование, с помощью которого идентифицируют остатки в белке по настоящему изобретению и в сходных с ним пептидах, которые являются важными для биологической активности или структуры и сравнить аминокислотные остатки этих двух пептидов, таким образом предсказывая, какие остатки в белке, сходном с белком по настоящему изобретению, являются аминокислотными остатками, соответствующим аминокислотным остаткам, важным для биологической активности или структуры. Кроме того, химически похожие замены аминокислот могут быть выбраны для предсказанных таким образом аминокислотных остатков для того, чтобы таким образом выбрать мутант, который сохраняет биологическую активность белка по настоящему изобретению. Также специалисты в данной области будут способны анализировать трехмерную структуру и аминокислотную последовательность этого мутантного белка. Полученные таким образом результаты анализа в дальнейшем могут быть использованы для предсказания выравнивания аминокислотных остатков относительно трехмерной структуры белка. Так как аминокислотные остатки, для которых предсказано, что они должны находиться на поверхности белка, могут быть вовлечены в важные взаимодействия с другими молекулами, на основании результатов анализа специалисты в данной области будут способны подготовить мутант, который вызывает изменения в этих аминокислотных остатках, для которых предсказано, что они должны находиться на поверхности белка, как указано выше. Кроме того, специалисты в данной области также будут способны подготовить мутант, обладающий одной заменой аминокислоты для любого из аминокислотных остатков, составляющих белок по настоящему изобретению. Эти мутанты могут быть проскринированы с помощью любого известного теста для того, чтобы собрать информацию об отдельных мутантах, которая в свою очередь позволит оценить полезность отдельных аминокислотных остатков, составляющих белок по настоящему изобретению при выполнении сравнения со следующим случаем, в котором мутант, обладающий заменой конкретного аминокислотного остатка проявляет более низкую биологическую активность, чем биологическая активность белка по настоящему изобретению, в котором такой мутант не проявляет биологическую активность или в котором такой мутант образует неподходящую активность, подавляющую биологическую активность белка по настоящему изобретению. Кроме того, на основании информации, собранной в таких рутинных экспериментах, специалисты в данной области могут быстро анализировать замены аминокислот, нежелательные для мутантов белка по настоящему изобретению или по отдельности или в сочетании с другими мутациями.
Как описано выше, белок, состоящий из аминокислотной последовательности с делецией, заменой или вставкой одной или нескольких аминокислот в аминокислотную последовательность, показанную в SEQ ID № 2, может быть подготовлен согласно со способами, такими как сайт-специфический мутагенез, как описано в «Molecular Cloning, A Laboratory Manual 3rd ed.» (Cold Spring Harbor Press (2001)), «Current Protocols in Molecular Biology» (John Wiley & Sons (1987-1997), Kunkel (1985) Proc. Natl. Acad. Sci. USA 82: 488 92, and Kunkel (1988) Method. Enzymol. 85: 2763-6. Подготовка мутанта с такой мутацией, включающей аминокислотную делецию, замену или вставку, может быть выполнена, например, посредством известных процедур, таких как способ Кюнкеля или дуплексный способ с разрывами с использованием набора для введения мутаций, основанного на сайт-направленном мутагенезе, такого как QuikChangeTM Site-Directed Mutagenesis Kit (Stratagene), GeneTailorTM Site-Directed Mutagenesis System (Invitrogen) или TaKaRa Site-Directed Mutagenesis System (например, Mutan-K, Mutan-Super Express Km; Takara Bio Inc., Japan).
Способы, делающие возможной делецию, замену или вставку одной или нескольких аминокислот в аминокислотные последовательности белков при сохранении их активности включают сайт-направленный мутагенез, указанный выше, а также другие способы, такие как способы обработки гена мутагеном и способы, в которых ген селективно расщепляется для удаления, замены или добавления выбранного нуклеотида или нуклеотидов, и затем лигируется.
Предпочтительная нуклеотидная последовательность, содержащаяся в нуклеиновых кислотах по настоящему изобретению, представляет собой нуклеотидную последовательность, которая кодирует белок, состоящий из аминокислотной последовательности с делецией, заменой или вставкой от 1 до 10 аминокислот в аминокислотную последовательность, показанную в SEQ ID № 2, и обладающий ГФАТ активностью.
Кроме того, нуклеотидные последовательности, содержащиеся в нуклеиновых кислотах по настоящему изобретению, также содержат нуклеотидную последовательность, которая кодирует белок, состоящий из аминокислотной последовательности с делецией, заменой или вставкой от 1 до 10 аминокислот в SEQ ID № 2 и обладающий вышеуказанной активностью по настоящему изобретению.
Не существует ограничений числа или мест аминокислотных мутаций или модификаций в белке по настоящему изобретению до тех пор, пока полученный мутант сохраняет ГФАТ активность или способность давать долю жирных кислот ГФАТ в настоящем изобретении.
ГФАТ активность в настоящем изобретении или способность давать долю жирных кислот ГФАТ в настоящем изобретении может быть измерена известным образом. Например, можно дать ссылку на следующий документ: Biochem. J., 355, 315-322, 2001.
В качестве примера, «ГФАТ активность» в настоящем изобретении может быть измерена следующим образом. Микросомальную фракцию готовят из клеток, трансформированных для экспрессии ГФАТ по настоящему изобретению, как описано, например, в J. Bacteriology, 173, 2026-2034 (1991). Затем к реакционному раствору, содержащему 0,44 мМ глицерин-3-фосфата, 0,36 мМ ацил-КоA, 0,5 мМ DTT, 1 мг/мл BSA и 2 мМ MgCl2 в 50 мМ трис-HCl (pH 7,5), добавляют вышеуказанную микросомальную фракцию и проводят реакцию при 28°C в течение соответствующего периода. Для того, чтобы остановить реакцию добавляют хлороформ:метанол, а затем проводят экстракцию липидов. Полученные липиды фракционируют с помощью тонкослойной хроматографии или других способов, при помощи чего может быть измерено количество образовавшейся лизофосфатидной кислоты.
Так же, в качестве примера, «способность давать долю жирных кислот ГФАТ» в настоящем изобретении может быть измерена следующим образом. Для приготовления композиции жирных кислот к лиофилизированным клеткам, полученным способом по настоящему изобретению, добавляют хлороформ:метанол, доведенный до соответствующего соотношения, и перемешивают, после чего нагревают в течение соответствующего периода. Далее для отделения клеток проводят центрифугирование и собирают растворитель. Эту процедуру повторяют несколько раз. Затем липиды высушивают соответствующим образом, и растворитель, такой как хлороформ, добавляют для растворения липидов. Соответствующую аликвоту этого образца обрабатывают способом с соляной кислотой/метанолом, чтобы извлечь жирные кислоты из клеток в виде соответствующих метиловых эфиров, и затем экстрагируют гексаном. После очистки от гексана, жирные кислоты анализируют газовой хроматографией.
(b) Нуклеотидная последовательность, которая является гибридизуемой при строгих условиях с нуклеиновой кислотой, состоящей из нуклеотидной последовательности, комплементарной нуклеотидной последовательности, состоящей из SEQ ID № 4, и которая кодирует белок, обладающий вышеуказанной активностью по настоящему изобретению.
Нуклеотидные последовательности, содержащиеся в нуклеиновых кислотах по настоящему изобретению включают нуклеотидную последовательность, которая является гибридизуемой при строгих условиях с нуклеиновой кислотой, состоящей из нуклеотидной последовательности, комплементарной нуклеотидной последовательности, состоящей из SEQ ID № 4, и которая кодирует белок, обладающий вышеуказанной активностью по настоящему изобретению. SEQ ID № 4 и ГФАТ активность представляют собой то, что описано выше.
Для получения вышеуказанной нуклеотидной последовательности может быть изготовлен зонд из соответствующего фрагмента способом, известным специалистам в данной области, и этот зонд можно использовать в известных способах гибридизации, таких как гибридизация колоний, гибридизация бляшек или саузерн-блоттинг для получения нуклеотидной последовательности из библиотеки кДНК, геномной библиотеки или тому подобного.
В отношении подробных процедур для способов гибридизации можно дать ссылку на «Molecular Cloning, A Laboratory Manual 3rd ed.» (Cold Spring Harbor Press (2001); особенно разделы 6-7), «Current Protocols in Molecular Biology» (John Wiley & Sons (1987-1997); особенно разделы 6,3-6,4), «DNA Cloning 1: Core Techniques, A Practical Approach 2nd ed.» (Oxford University (1995); особенно раздел 2.10 для условий гибридизации).
Сила гибридизации в основном определяется условиями гибридизации, более предпочтительно условиями гибридизации и условиями отмывки. Подразумевается, что термин «строгие условия» как применяют в настоящем документе включает умеренно или крайне строгие условия.
Более конкретно, умеренно строгие условия включают, например, условия гибридизации от 1× SSC до 6× SSC при от 42°C до 55°C, более предпочтительно от 1× SSC до 3× SSC при от 45°C до 50°C, и наиболее предпочтительно 2× SSC при 50°C. В определенных случаях, например, в которых раствор для гибридизации содержит приблизительно 50% формамида, температура которого на 5-15°C ниже, чем используемая вышеуказанная температура. Условия отмывки могут представлять собой от 0,5× SSC до 6× SSC при от 40°C до 60°C. В ходе гибридизации и отмывки обычно могут добавлять от 0,05% до 0,2% SDS, предпочтительно приблизительно 0,1% SDS.
Крайне строгие (очень строгие) условия включают гибридизацию и/или отмывку при более высокой температуре и/или более низкой концентрации соли, по сравнению с умеренно строгими условиями. Например, условия гибридизации могут представлять собой от 0,1× SSC до 2× SSC при от 55°C до 65°C, более предпочтительно от 0,1× SSC до 1× SSC при от 60°C до 65°C, и наиболее предпочтительно 0,2× SSC при 63°C. Условия отмывки могут представлять собой от 0,2× SSC до 2× SSC при от 50°C до 68°C, и более предпочтительно 0,2× SSC при от 60°C до 65°C.
В частности, условия гибридизации, использованные в настоящем изобретении включают в качестве неограничивающих примеров, прегибридизацию в 5× SSC, 1% SDS, 50 мМ трис-HCl (pH 7,5) и 50% формамиде при 42°C, инкубацию в течение ночи при 42°C в присутствие зонда для образования гибридов, и последующие три отмывки в 0,2× SSC, 0,1% SDS при 65°C в течение 20 минут.
Также возможно использование коммерчески доступного набора для гибридизации, в котором в качестве зонда используется радиоактивное вещество. Конкретные примеры включают гибридизацию с DIG nucleic acid detection kit (Roche Diagnostics) или с ECL direct labeling & detection system (Amersham).
Предпочтительная нуклеотидная последовательность, относящаяся к настоящему изобретению, представляет собой нуклеотидную последовательность, которая является гибридизуемой в условиях 2× SSC при 50°C с нуклеиновой кислотой, состоящей из нуклеотидной последовательности, комплементарной нуклеотидной последовательности, состоящей из SEQ ID № 4, и которая кодирует белок, обладающий ГФАТ активностью.
(c) Нуклеотидная последовательность, которая состоит из нуклеотидной последовательности, обладающей сходством в 70% или более с нуклеотидной последовательностью, состоящей из SEQ ID № 4, и которая кодирует белок, обладающий вышеуказанной активностью по настоящему изобретению.
Нуклеотидные последовательности, содержащиеся в нуклеиновых кислотах по настоящему изобретению, содержат нуклеотидную последовательность, которая состоит из нуклеотидной последовательности, обладающей сходством, по меньшей мере, в 70% или более с последовательностью нуклеиновой кислоты, показанной в SEQ ID № 4, и которая кодирует белок, обладающий вышеуказанной активностью по настоящему изобретению.
Предпочтительные примеры включают нуклеиновые кислоты, содержащие нуклеотидную последовательность, которая обладает сходством, по меньшей мере, в 75%, более предпочтительно в 80% (например, 85% или более, даже более предпочтительно 90% или более, более конкретно 95%, 98% или 99%) с последовательностью нуклеиновой кислоты, показанной в SEQ ID № 4, и которая кодирует белок, обладающий вышеуказанной активностью по настоящему изобретению.
Процент сходства между двумя последовательностями нуклеиновой кислоты может быть определен посредством визуального контроля и математических вычислений, или более предпочтительно с использованием компьютерной программы для сравнения информации о последовательности двух нуклеиновых кислот. Компьютерные программы для сравнения последовательностей включают, например, программу BLASTN (Altschul et al. (1990) J. Mol. Biol. 215: 403-10) версия 2.2.7, доступную для использования через веб-сайт Национальной медицинской библиотеки: http://www.ncbi.nlm.nih.gov/blast/bl2seq/bls.html, или алгоритм WU BLAST 2.0. Стандартные настройки параметров по умолчанию WU-BLAST 2.0 описаны на следующем сайте в интернете: http://blast.wustl.edu.
(d) Нуклеотидная последовательность, которая кодирует аминокислотную последовательность, обладающую сходством в 70% или более с аминокислотной последовательностью, состоящей из SEQ ID № 2 и которая кодирует белок, обладающий вышеуказанной активностью по настоящему изобретению.
Нуклеотидные последовательности, содержащиеся в нуклеиновых кислотах по настоящему изобретению, включают нуклеотидную последовательность, которая кодирует аминокислотную последовательность, обладающую сходством в 70% или более с аминокислотной последовательностью, состоящей из SEQ ID № 2, и которая кодирует белок, обладающий вышеуказанной активностью по настоящему изобретению. Белки, кодируемые нуклеиновыми кислотами по настоящему изобретению также могут быть белками, обладающими сходством с аминокислотной последовательностью ГФАТ2 до тех пор, пока они функционально эквивалентны белкам, обладающим вышеуказанной активностью по настоящему изобретению.
Конкретные примеры включают аминокислотные последовательности, обладающие сходством в 75% или более, предпочтительно 80% или более, более предпочтительно 85%, даже более предпочтительно 90% (например, 95%, более конкретно 98%) с аминокислотной последовательностью, показанной в SEQ ID № 2.
Предпочтительная нуклеотидная последовательность, содержащаяся в нуклеиновых кислотах по настоящему изобретению, представляет собой нуклеотидную последовательность, которая кодирует аминокислотную последовательность, обладающую сходством в 90% или более с аминокислотной последовательностью, состоящей из SEQ ID № 2, и которая кодирует белок, обладающий вышеуказанной активностью по настоящему изобретению. Более предпочтительна нуклеотидная последовательность, которая кодирует аминокислотную последовательность, обладающую сходством в 95% или более с аминокислотной последовательностью, состоящей из SEQ ID № 2, и которая кодирует белок, обладающий вышеуказанной активностью по настоящему изобретению.
Процент сходства между двумя аминокислотными последовательностями может быть определен с помощью визуального контроля и математических вычислений. Альтернативно, процент сходства может быть определен с использованием компьютерной программы. Примеры такой компьютерной программы включают BLAST, FASTA (Altschul et al., J. Mol. Biol., 215:403-410 (1990)) и ClustalW. В частности, различные условия (параметры) для поиска сходства с помощью программы BLAST описаны Altschul et al. (Nucl. Acids. Res., 25, p.3389-3402, 1997) и общедоступны через веб-сайт Национального центра биотехнологической информации (NCBI) или Японский банк данных ДНК (DDBJ) (BLAST Manual, Altschul et al., NCB/NLM/NIH Bethesda, MD 20894; Altschul et al.). Также возможно использование программы, например, программного обеспечения для обработки генетической информации GENETYX вер.7 (Genetyx Corporation, Japan), DINASIS Pro (Hitachisoft, Japan) или Vector NTI (Infomax) для определения процента сходства.
Определенные схемы выравнивания для построения выравнивания аминокислотных последовательностей также могут привести к совпадению отдельного короткого участка последовательностей, и также возможно обнаружение участка с очень высоким сходством последовательности в таком маленьком выровненном участке даже когда отсутствует значимое родство между использованными полноразмерными последовательностями. Кроме того, алгоритм BLAST использует BLOSUM62 матрицу замен аминокислот, и необязательные параметры, которые можно использовать, представляют собой следующие: (A) добавление фильтра для маскирования сегментов запросной последовательности, которые обладают низкой структурной сложностью (которая определяется с помощью программы SEG авторов Wootton и Federhen (Computers and Chemistry, 1993); также смотри Wootton и Federhen, 1996, «Analysis of compositionally biased regions in sequence databases,» Methods Enzymol., 266: 554-71), или сегментов, состоящих из внутренних повторов с коротким периодом (которые определяются программой XNU авторов Claverie и States (Computers and Chemistry, 1993)), и (B) пороговое значение статистической значимости для сообщения совпадений с последовательностями из базы данных, или E-score (ожидаемая вероятность совпадений, обнаруженных исключительно случайно, в соответствии со стохастической моделью Karlin и Altschul, 1990; если статистическая значимость, приписываемая совпадению, больше, чем это пороговое значение E-score, то о совпадении не будет сообщено).
(e) Нуклеотидная последовательность, которая является гибридизуемой при строгих условиях с нуклеиновой кислотой, состоящей из нуклеотидной последовательности, комплементарной нуклеотидной последовательности, кодирующей белок, состоящий из аминокислотной последовательности, показанной в SEQ ID № 2, и которая кодирует белок, обладающий вышеуказанной активностью по настоящему изобретению.
Нуклеотидные последовательности, содержащиеся в нуклеиновых кислотах по настоящему изобретению, включают нуклеотидную последовательность, которая является гибридизуемой при строгих условиях с нуклеиновой кислотой, состоящей из нуклеотидной последовательности, комплементарной нуклеотидной последовательности, кодирующей белок, состоящий из аминокислотной последовательности, показанной в SEQ ID № 2 и которая кодирует белок, обладающий вышеуказанной активностью по настоящему изобретению.
Такой белок, состоящий из аминокислотной последовательности, показанной в SEQ ID № 2, и условия гибридизации представляют собой то, что описано выше. Нуклеотидные последовательности, содержащиеся в нуклеиновых кислотах по настоящему изобретению, включают нуклеотидную последовательность, которая является гибридизуемой при строгих условиях с нуклеиновой кислотой, состоящей из нуклеотидной последовательности, комплементарной нуклеотидной последовательности, кодирующей белок, состоящий из аминокислотной последовательности, показанной в SEQ ID № 2, и которая кодирует белок, обладающий вышеуказанной активностью по настоящему изобретению.
Нуклеиновые кислоты по настоящему изобретению также включают нуклеиновую кислоту, которая содержит нуклеотидную последовательность с делецией, заменой или вставкой одного или нескольких нуклеотидов в нуклеотидной последовательности, состоящей из SEQ ID № 4, и кодирует белок, обладающий вышеуказанной активностью по настоящему изобретению. Более конкретно, также возможно использование нуклеиновой кислоты, которая содержит нуклеотидную последовательность, выбранную из:
(i) нуклеотидная последовательность с делецией одной или нескольких (предпочтительно, одного или нескольких (например, 1-540, 1-500, 1-400, 1-300, 1-200, 1-150, 1-100, 1-50, 1-30, 1-25, 1-20, 1-15, 1-10, более предпочтительно 1-5)) нуклеотидов в нуклеотидной последовательности, показанной в SEQ ID № 4;
(ii) нуклеотидной последовательности с заменой других нуклеотидов на один или несколько (предпочтительно, один или несколько (например, 1-540, 1-500, 1-400, 1-300, 1-200, 1-150, 1-100, 1-50, 1-30, 1-25, 1-20, 1 15, 1-10, более предпочтительно 1-5)) нуклеотидов в нуклеотидной последовательности, показанной в SEQ ID № 4;
(iii) нуклеотидной последовательности со вставкой другого одного или нескольких (предпочтительно, одного или нескольких (например, 1-540, 1-500, 1-400, 1-300, 1-200, 1-150, 1-100, 1-50, 1-30, 1-25, 1-20, 1-15, 1-10, более предпочтительно 1-5)) нуклеотидов в нуклеотидную последовательность, показанную в SEQ ID № 4; или
(iv) нуклеотидной последовательности с любым сочетанием вышеуказанных пунктов с (i) до (iii),
и кодирующую белок, обладающий вышеуказанной активностью по настоящему изобретению.
Предпочтительные варианты осуществления для нуклеиновых кислот по настоящему изобретению также включают нуклеиновую кислоту, содержащую нуклеотидную последовательность, показанную в любом из нижеприведенных пунктов с (a) до (c), или ее фрагмент:
(a) нуклеотидная последовательность, показанная в SEQ ID № 4;
(b) нуклеотидная последовательность, кодирующая белок, состоящий из аминокислотной последовательности, показанной в SEQ ID № 2; или
(c) нуклеотидная последовательность, показанная в SEQ ID № 1.
Вышеуказанная (a) нуклеотидная последовательность, показанная в SEQ ID № 4, (b) нуклеотидная последовательность, кодирующая белок, состоящий из аминокислотной последовательности, показанной в SEQ ID № 2, и (c) нуклеотидная последовательность, показанная в SEQ ID № 1 представляют собой то, что показано в таблице 1. Фрагменты этих последовательностей могут или встречаться в природе или быть изготовленными искусственно, включая участки, содержащиеся в вышеуказанных нуклеотидных последовательностях, т.е. открытые рамки считывания, кодирующие последовательности, биологически активный участок, участок, используемый в качестве праймера, как будет описано позже, и участок, который может служить в качестве зонда.
Белки глицерин-3-фосфатацилтрансферазы по настоящему изобретению
Белки по настоящему изобретению, которые или могут встречаться в природе или могут быть искусственно изготовленными, включают белок, состоящий из аминокислотной последовательности, показанной в SEQ ID № 2, и белки, функционально эквивалентные этому белку. Такой белок, состоящий из аминокислотной последовательности, показанной в SEQ ID № 2, представляет собой то, что описано выше. «Функционально эквивалентные белки» предназначены для обозначения белков, обладающих «вышеуказанной активностью по настоящему изобретению», как объясняется в разделе «Нуклеиновые кислоты по настоящему изобретению, кодирующие глицерин-3-фосфатацилтрансферазу», описанном выше.
В настоящем изобретении, белки, функционально эквивалентные белку, состоящему из аминокислотной последовательности, показанной в SEQ ID № 2, включают белок, показанный ниже в пунктах (a) или (b):
(a) белок, который состоит из аминокислотной последовательности с делецией, заменой или вставкой одной или нескольких аминокислот в SEQ ID № 2, и который обладает вышеуказанной активностью по настоящему изобретению; или
(b) белок, который состоит из аминокислотной последовательности, обладающей сходством в 70% или более с аминокислотной последовательностью, состоящей из SEQ ID № 2, и который обладает вышеуказанной активностью по настоящему изобретению.
Среди вышеуказанных, аминокислотная последовательность с делецией, заменой или вставкой одной или нескольких аминокислот в SEQ ID № 2 или аминокислотная последовательность, обладающая сходством в 70% или более с аминокислотной последовательностью, состоящей из SEQ ID № 2, представляет собой то, что объяснено в разделе «Нуклеиновые кислоты по настоящему изобретению, кодирующие глицерин-3-фосфатацилтрансферазу», описанном выше. Фраза «белок, который обладает вышеуказанной активностью по настоящему изобретению» также предназначена для того, чтобы включать мутанты белка, кодируемого нуклеиновой кислотой, содержащей нуклеотидную последовательность SEQ ID № 4, или мутантные белки с различными модификациями, таким как замена, делеция или вставка одной или нескольких аминокислот в аминокислотную последовательность, показанную в SEQ ID № 2, а также их модифицированные белки, чьи аминокислотные боковые цепи или им подобные модифицированы, и их слитные белки с другими белками, до тех пор, пока эти белки обладают ГФАТ активностью и/или способностью давать долю жирных кислот ГФАТ в настоящем изобретении.
Белки по настоящему изобретению также могут быть изготовлены искусственным образом технологиями химического синтеза, такими как способ с Fmoc (способ с флуоренилметилоксикарбонилом) и способ с tBoc (способ с t-бутилоксикарбонилом). Кроме того, синтезаторы пептидов, доступные у Advanced ChemTech, Perkin Elmer, Pharmacia, Protein Technology Instrument, Synthecell Vega, PerSeptive, Shimadzu Corporation (Japan) или других производителей можно использовать для химического синтеза.
Клонирование ГФАТ нуклеиновых кислот
ГФАТ нуклеиновые кислоты по настоящему изобретению могут быть клонированы, например, посредством скрининга через библиотеку кДНК с использованием соответствующего зонда. Также они могут быть клонированы посредством ПЦР-амплификации с соответствующими праймерами и последующего лигирования в соответствующий вектор. Полученные таким образом клоны дополнительно могут быть субклонированы в другой вектор.
Например, возможно использование коммерчески доступных плазмидных векторов, включая pBlue-ScriptTM SK(+) (Stratagene), pGEM-T (Promega), pAmp (TM: Gibco-BRL), p-Direct (Clontech) и pCR2.1-TOPO (Invitrogen). В случае использования ПЦР-амплификации, праймеры могут представлять собой любые участки нуклеотидной последовательности, показанной, например, в SEQ ID № 1. В качестве примера, возможно использование следующих праймеров из SEQ ID № 1:
E-1: 5'-CTGACTACCAAAACCAGCTGGACTTC-3' (SEQ ID № 6) в качестве 3'-5' праймера; и
E-2: 5'-GGCAATTTCATCCAAGTTGTCCTCC-3' (SEQ ID № 7) в качестве 5'-3' праймера. Затем выполняют ПЦР с кДНК, полученной из клеток M. alpina с вышеуказанными праймерами и ДНК-полимеразой или подобной. Хотя эта процедура может быть быстро выполнена специалистами в данной области в соответствии, например, с «Molecular Cloning, A Laboratory Manual 3rd ed.» (Cold Spring Harbor Press (2001)), в качестве примера, в настоящем изобретении могут быть установлены следующие условия ПЦР:
Температура денатурации: 90-95°C.
Температура отжига: 40-60°C.
Температура элонгации: 60-75°C.
Количество циклов: 10 или более циклов.
Полученные ПЦР-продукты могут быть очищены известным образом, например, с использованием набора (например, GENECLEAN (Funakoshi Co., Ltd., Japan), QIAquick PCR purification Kits (QIAGEN), ExoSAP-IT (GE Healthcare Bio-Sciences)), DEAE-целлюлозного фильтра или диализной трубки. В случае использования агарозного геля, ПЦР-продукты подвергают электрофорезу в агарозном геле и фрагменты нуклеиновых кислот вырезают из агарозного геля, затем очищают с помощью GENECLEAN (Funakoshi Co., Ltd., Japan) или QIAquick Gel extraction Kits (QIAGEN) или способом замораживания-сдавливания и т.д.
Для клонированных нуклеиновых кислот могут быть определены их нуклеотидные последовательности с помощью нуклеотидного секвенатора.
Конструкция вектора для экспрессии ГФАТ и подготовки трансформанта
Настоящее изобретение также относится к рекомбинантному вектору, содержащему нуклеиновую кислоту, кодирующую ГФАТ2 по настоящему изобретению. Настоящее изобретение дополнительно относится к трансформанту, траснформированному вышеуказанным рекомбинантным вектором.
Такой рекомбинантный вектор и трансформант могут быть получены следующим образом. А именно, плазмиду, несущую нуклеиновую кислоту, кодирующую ГФАТ по настоящему изобретению, расщепляют рестриктазами. Примеры доступных для использования рестриктаз включают в качестве неограничивающих примеров, EcoRI, KpnI, BamHI и SalI. За этим расщеплением может следовать затупление липких концов T4 полимеразой. Расщепленный фрагмент нуклеиновой кислоты очищают электрофорезом в агарозном геле. Этот фрагмент нуклеиновой кислоты может быть встроен в экспрессирующий вектор известным образом для получения вектора для экспрессии ГФАТ. Этот экспрессирующий вектор вводят в организм-хозяина для подготовки трансформанта, который затем предоставляется для экспрессии желаемого белка.
В этом случае тип экспрессирующего вектора и тип организма-хозяина не ограничиваются ничем до тех пор, пока они делают возможной экспрессию желаемого белка. Примеры организма-хозяина включают грибы, бактерии, растения, животные или их клетки. Грибы включают мицелиарные грибы, такие как липидопродуцирующий M. alpina, и штаммы дрожжей, таких как Saccharomyces cerevisiae. Бактерии включают Escherichia coli (E. coli) и Bacillus subtilis. Так же, растения включают масличные растения, такие как семена рапса, соевые бобы, хлопок, сафлор красильный и лен.
В качестве липидопродуцирующих штаммов, можно использовать, например, те что найдены в MYCOTAXON, Vol. XLIV, NO. 2, pp. 257-265 (1992). Конкретные примеры включают микроорганизмы, принадлежащие к роду Mortierella, что иллюстрируется микроорганизмами, принадлежащими к подроду Mortierella, такими как Mortierella elongata IFO8570, Mortierella exigua IFO8571, Mortierella hygrophila IFO5941, Mortierella alpina IFO8568, ATCC16266, ATCC32221, ATCC42430, CBS 219.35, CBS224.37, CBS250.53, CBS343.66, CBS527.72, CBS528.72, CBS529.72, CBS608.70, CBS754.68, а также микроорганизмами, принадлежащими к подроду Micromucor например, Mortierella промоторы гена CBS194.28, IFO6336, IFO7824, IFO7873, IFO7874, IFO8286, IFO8308, IFO7884, Mortierella nana IFO8190, Mortierella ramanniana IFO5426, IFO8186, CBS112.08, CBS212.72, IFO7825, IFO8184, IFO8185, IFO8287, Mortierella vinacea CBS236.82. Особенно предпочтительным является Mortierella alpina.
Когда гриб используется в качестве организма-хозяина, желательно, чтобы нуклеиновая кислота по настоящему изобретению самореплицировалась в организме-хозяине или обладала структурой, встраиваемой в хромосому гриба. В тоже время, предпочтительно, чтобы она дополнительно содержала промоторы и терминатор. Когда M. alpina используют в качестве организма-хозяина, примеры экспрессирующего вектора включают pD4, pDuraSC и pDura5. Любые промоторы можно использовать до тех пор, пока они позволяют экспрессию в организме-хозяине, и примеры включают промоторы, полученные из M. alpina, например, промоторы гена histonH4.1, промоторы гена ГАФДГ (глицеральдегид-3-фосфатдегидрогеназа) и промоторы гена TEF (фактор элонгации трансляции).
Способы встраивания рекомбинантного вектора в мицелиальные грибы (например, M. alpina) включают электропорацию, способы с доставкой сферопластов и частиц, а также прямую микроинъекцию ДНК в ядра. В случае использования ауксотрофного штамма организма-хозяина, штаммы, растущие на селективной среде с недостатком питательных веществ, необходимых штамму организма-хозяина, могут быть отобраны для получения таким образом трансформированных штаммов. Альтернативно, в случае, когда для трансформации используется маркерный ген устойчивости к лекарственному средству, культивирование может осуществляться с селективной средой, содержащей лекарственное средство для получения таким образом клонированных клеток, устойчивых к лекарственному средству.
Когда дрожжи используются в качестве организма-хозяина, примеры экспрессирующего вектора включают pYE22m. Альтернативно, также можно использовать коммерчески доступные дрожжевые экспрессирующие векторы, такие как pYES (Invitrogen) и pESC (STRATAGENE). Дрожжевые организмы-хозяины, подходящие для настоящего изобретения, включают в качестве неограничивающих примеров штамм EH13-15 Saccharomyces cerevisiae (trp1, MATa). Примеры промоторов, доступных для использования, включают промоторы, полученные из дрожжей или подобные, такие как промоторы ГАФДГ, промоторы gal1 и промоторы gal10.
Способы введения рекомбинантного вектора в дрожжевые клетки включают способы с ацетатом лития, со сферопластами и электропорацию, а также декстран-опосредованную трансфекцию, преципитацию фосфатом кальция, полибрен-опосредованную трансфекцию, слияние протопластов, включение полинуклеотида(ов) в липосомы и прямую микроинъекцию ДНК в ядра.
Когда бактерии, такие как E. coli, используются в качестве организма-хозяина, примеры экспрессирующего вектора включают pGEX и pUC18, доступные в Pharmacia. Примеры промоторов, доступных для использования, включают промоторы, полученные из E. coli, фага или подобного, такие как промоторы trp, промоторы lac, промоторы PL и промоторы PR. Способы введения рекомбинантного вектора в бактерию включают электропорацию и способ с хлоридом кальция.
Способ по настоящему изобретению для получения композиции жирных кислот
Настоящее изобретение относится к способу получения композиции жирных кислот из вышеуказанного трансформанта, т.е., способ получения композиции жирных кислот из культивированного продукта, полученного культивированием вышеуказанного трансформанта, более конкретно это описано ниже. Однако способ по настоящему изобретению не ограничивается нижеследующим и может быть выполнен любым другим широко известным образом.
Для культуры организмов, трансформированных для экспрессии ГФАТ, можно использовать любую среду до тех пор, пока она представляет собой культуральный раствор (среду), обладающий соответствующим pH и осмотическим давлением, а также содержащий питательные вещества, необходимые для роста каждого организма-хозяина, микроэлементы и биоматериалы, такие как сера или антибиотики. Например, в случае дрожжевых клеток, трансформированных для экспрессии ГФАТ можно использовать среду SC-Trp, среду YPD, среду YPD5 или подобную, не ограничиваясь ими. Подробный состав среды приведен для среды SC-Trp: 6,7 г дрожжевой азотной основы без аминокислот (DIFCO), 20 г глюкозы и 1,3 г порошка аминокислот (смесь из 1,25 г аденинсульфата, 0,6 г аргинина, 3 г аспарагиновой кислоты, 3 г глутаминовой кислоты, 0,6 г гистидина, 1,8 г лейцина, 0,9 г лизина, 0,6 г метионина, 1,5 г фенилаланина, 11,25 г серина, 0,9 г тирозина, 4,5 г валина, 6 г треонина и 0,6 г урацила) на литр среды.
Можно использовать любые условия культивирования до тех пор, пока они пригодны для роста организма-хозяина и адекватны для поддержания синтезированного фермента в стабильном состоянии. Более конкретно, могут быть подобраны индивидуальные условия, включая анаэробную степень, период культивирования, температуру, влажность, статическую культуру или перемешиваемую культуру. Культивирование может быть выполнено при тех же условиях (одностадийное культивирование) или посредством так называемого двухстадийного или трехстадийного культивирования с использованием двух или более различных условий культивирования. Для крупномасштабного культивирования двухстадийное или многостадийное культивирование является предпочтительным из-за его высокой культуральной эффективности.
Для объяснения подробных процедур для способа по настоящему изобретению для получения композиции жирных кислот, в качестве примера будет приведен пример двухстадийной культуры, в которой дрожжи используются в качестве организма-хозяина. А именно, на стадии предварительного культивирования вышеуказанные полученные колонии инокулируют в любую описанную выше среду (например, среду SC-Trp) и культивируют с перемешиванием при 30°C в течение 2 дней. Затем на стадии основного культивирования предкультуральный раствор (500 мкл) добавляют к 10 мл среды YPD5 (2% дрожжевого экстракта, 1% полипептона, 5% глюкозы) и культивируют с перемешиванием при 30°C в течение 2 дней.
Композиции жирных кислот по настоящему изобретению
Настоящее изобретение также относится к композиции жирных кислот, которая представляет собой набор из одной или нескольких жирных кислот в клетках, экспрессирующих ГФАТ2 по настоящему изобретению. Жирные кислоты могут представлять собой свободные жирные кислоты или могут представлять собой триглицериды, фосфолипиды или тому подобное. В частности, композиции жирных кислот по настоящему изобретению отличаются наличием доли жирных кислот, обеспечивающей высокую степень, по меньшей мере, одного или нескольких пунктов из:
i) содержание олеиновой кислоты;
ii) отношение содержания олеиновой кислоты к содержанию пальмитиновой кислоты;
iii) отношение общего содержания стеариновой кислоты и олеиновой кислоты к содержанию пальмитиновой кислоты; и
iv) отношение содержания C18 жирной кислоты к содержанию C16 жирной кислоты
при сравнении с культуральным продуктом, полученным посредством культивирования организма-хозяина, который не трансформирован рекомбинантным вектором по настоящему изобретению. Фраза «организм-хозяин, который не трансформирован рекомбинантным вектором по настоящему изобретению» как применяют в настоящем документе предназначена для обозначения, например, организма-хозяина, трансформированного пустым вектором, не несущим нуклеиновые кислоты, описанные в разделе «Нуклеиновые кислоты по настоящему изобретению, кодирующие глицерин-3-фосфатацилтрансферазу».
Жирные кислоты, содержащиеся в композиции жирных кислот по настоящему изобретению относятся к линейным или разветвленным монокарбоновым кислотам углеводородов с длинной цепью, включая в качестве неограничивающих примеров, миристиновую кислоту (тетрадекановую кислоту) (14:0), миристолеиновую кислоту (тетрадеценовую кислоту) (14:1), пальмитиновую кислоту (гексадекановую кислоту) (16:0), пальмитолеиновую кислоту (9-гексадеценовую кислоту) (16:1), стеариновую кислоту (октадекановую кислоту) (18:0), олеиновую кислоту (цис-9-октадеценовую кислоту) (18:1(9)), вакценовую кислоту (11-октадеценовую кислоту) (18:1(11)), линолевую кислоту (цис,цис-9,12 октадекадиеновую кислоту) (18:2(9,12)), α-линоленовую кислоту (9,12,15-октадекатриеновую кислоту) (18:3(9,12,15)), γ-линоленовую кислоту (6,9,12-октадекатриеновую кислоту) (18:3(6,9,12)), стеаридоновую кислоту (6,9,12,15-октадекатетраеновую кислоту) (18:4(6,9,12,15)), арахидоновую кислоту (икосаноевую кислоту) (20:0), (8,11-икосадиеновую кислоту) (20:2(8,11)), мид кислоту (5,8,11-икосатриеновую кислоту) (20:3(5,8,11)), дигомо-γ-линоленовую кислоту (8,11,14-икосатриеновую кислоту) (20:3(8,11,14)), арахидоновую кислоту (5,8,11,14-икосатетраеновую кислоту) (20:4(5,8,11,14)), эйкозатетраеновую кислоту (5,11,14,17-икосатетраеновую кислоту) (20:4(5,11,14,17)), эйкозапентаеновую кислоту (5,8,11,14,17-икосапентаеновую кислоту) (20:5(5,8,11,14,17)), бегеновую кислоту (докозановую кислоту) (22:0), (7,10,13,16-докозатетраеновую кислоту) (22:4(7,10,13,16)), (4,7,13,16,19-докозапентаеновую кислоту) (22:5(4,7,13,16,19)), (4,7,10,13,16-докозапентаеновую кислоту) (22:5(4,7,10,13,16)), (4,7,10,13,16,19-докозагексаеновую кислоту) (22:6(4,7,10,13,16,19)), лигноцериновую кислоту (тетрадокозаноевую кислоту) (24:0), ацетэруковую кислоту (цис-15-тетрадокозаноевую кислоту) (24:1) и церотовую кислоту (гексадокозаноевую кислоту) (26:0). Следует отметить, что вышеуказанные названия веществ представляют собой общепринятые названия, определенные по биохимической номенклатуре IUPAC, и их систематические называния даны в скобках наряду с номерами, обозначающими количество атомов углерода и положение двойных связей.
Композиции жирных кислот по настоящему изобретению могут состоять из любого типа и любого количества жирных кислот до тех пор, пока они представляют собой сочетание из одной или нескольких жирных кислот, выбранных из перечисленных выше жирных кислот.
Получены ли такие композиции жирных кислот по настоящему изобретению, т.е., экспрессируется ли ГФАТ2 по настоящему изобретению, это может быть подтверждено широко известным способом, например, по изменению доли жирных кислот при экспрессии ГФАТ в дрожжевых клетках. А именно, к лиофилизированным клеткам, полученным вышеуказанным способом по настоящему изобретению для получения композиции жирных кислот, добавляют хлороформ:метанол, доведенные до соответствующего соотношения, и перемешивают, а затем нагревают в течение соответствующего периода. Затем выполняют центрифугирования для отделения клеток и сбора растворителя. Эту процедуру повторяют несколько раз. Затем липиды высушивают соответствующим образом и для растворения этих липидов добавляют растворитель, такой как хлороформ. Соответствующую аликвоту этого образца обрабатывают способом с соляной кислотой/метанолом для выделения жирных кислот в клетках в соответствующих метиловых эфирах, с последующей экстрагированием гексаном. После очистки от гексана, жирные кислоты анализируют с помощью газовой хроматографии.
В результате, если получены композиции жирных кислот, обладающие вышеуказанной долей жирных кислот, можно установить, что были получены композиции жирных кислот по настоящему изобретению. Следует отметить, что ГФАТ по настоящему изобретению дает долю жирных кислот, отличающуюся от доли композиции жирных кислот известной ГФАТ, указывая на то, что ГФАТ по настоящему изобретению обладает субстратной специфичностью, отличной от субстратной специфичности известных ГФАТ.
Пища или другие продукты, содержащие композиции жирных кислот по настоящему изобретению
Настоящее изобретение также относится к пищевому продукту, содержащему вышеуказанные композиции жирных кислот. Композиции жирных кислот по настоящему изобретению можно использовать стандартным образом для целей, таких как производство пищевых продуктов, содержащих жиры и масла, а также производство промышленных исходных материалов (промышленных исходных материалов для косметических средств, фармацевтики (например, наружные препараты для кожи), мыла и т.д.). Косметические средства (косметические композиции) или фармацевтические средства (фармацевтические композиции) могут быть включены в любую лекарственную форму, включая в качестве неограничивающих примеров, растворы, пасты, гели, сухое вещество или порошки. Также, возможные формы пищевых продуктов включают фармацевтические составы, такие как капсулы, а также бакалейные товары, такие как обыкновенная жидкая пища, полурасщепленное усиленной питание, питание элементными смесями, питьевые препараты или энтеральные препараты питательных веществ, которые содержат композиции жирных кислот по настоящему изобретению с примесями белков, сахаров, жиров, микроэлементов, витаминов, эмульгаторов, ароматизаторов и т.д.
Кроме того, примеры пищевого продукта по настоящему изобретению включают в качестве неограничивающих примеров, алиментарные добавки к пище, здоровую пищу, функциональные продукты питания, детское питание, модифицированное молоко для грудных детей, модифицированное молоко для недоношенных грудных детей и гериатрические продукты питания. Термин «продукт питания» или «пищевой продукт» используется здесь в качестве родового названия для съедобных материалов в форме сухих веществ, жидкостей, растворов и их смесей.
Термин «алиментарные добавки к пище» относится к пищевым продуктам, обогащенным определенными пищевыми ингредиентами. Термин «здоровая пища» относится к пищевым продуктам, которые являются целебными или полезны для здоровья, и охватывает алиментарные добавки к пище, натуральные пищевые продукты и диетические продукты. Термин «функциональные продукты питания» относится к пищевым продуктам подзаряженными пищевыми ингредиентами, которые способствуют функциям управления организмом. Функциональные продукты питания являются синонимом для продуктов питания для определенного употребления, полезного для здоровья. Термин «детское питание» относится к пищевым продуктам, которые дают детям приблизительно до 6 летнего возраста. Термин «гериатрические продукты питания» относится к пищевым продуктам, обработанным для облегчения переваривания и всасывания по сравнению с необработанными пищевыми продуктами. Термин «модифицированное молоко для грудных детей» относится к модифицированному молоку, которое дают детям приблизительно до одного года. Термин «модифицированное молоко для недоношенных грудных детей» относится к модифицированному молоку, которое дают недоношенным грудным детям приблизительно до 6 месяцев после рождения.
Эти пищевые продукты включают натуральные пищевые продукты (обработанные жирами и маслами), такие как мясо, рыба и орехи; пищевые продукты с добавками жиров и масел в ходе приготовления (например, китайская кухня, китайская лапша, супы); пищевые продукты, приготовленные с использованием жиров и масел в качестве нагретой среды (например, темпура (рыба и овощи во фритюре), продукты питания во фритюре, жаренный соевый творог, китайский жаренный рис, пончики, японское жаренное песочное печенье (каринто)); продукты питания на жировой и масляной основе или обработанные продукты питания с добавлением жиров и масел в процессе приготовления (например, масло, маргарин, майонез, украшения, шоколад, лапша мгновенного приготовления, карамель, бисквиты, печенья, пирожные, мороженое); и продукты питания, орошаемые или покрываемые жирами и маслами после приготовления (например, рисовые крекеры, твердые бисквиты, хлеб со сладкой ореховой пастой). Однако пищевой продукт по настоящему изобретению не ограничивается продуктами питания, содержащими жиры и масла, и другие примеры включают сельскохозяйственные продукты питания, такие как хлебобулочные изделия, лапшу, вареный рис, сладости (например, конфеты, жевательные резинки, жевательные шарики, таблетки, японские сладости), соевый творог и продукты его обработки; продукты брожения, такие как японское рисовое вино (сакэ), лекарственные напитки, сладкий кулинарных херес (мирин), уксус, соевый соус и мисо (соевая лапша); пищевые продукты животноводства, такие как йогурт, ветчина, бекон и сосиски; дары моря, такие как рыбный брикет (камабоко), рыбный брикет во фритюре (агетен) и пышные рыбные брикеты (ханпен); а также фруктовые напитки, безалкогольные напитки, спортивные напитки, алкогольные напитки и чай.
Способ оценки и отбора штаммов с использованием нуклеиновой кислоты, кодирующей ГФАТ, или белка ГФАТ по настоящему изобретению
Настоящее изобретение также относится к способу оценки и отбора липидопродуцирующего штамма с использованием нуклеиновой кислоты, кодирующей ГФАТ, или белок ГФАТ по настоящему изобретению. Подробности приведены ниже.
(1) Способ оценки
Один из вариантов осуществления настоящего изобретения представляет собой способ оценки липидопродуцирующего штамма с использованием ГФАТ-кодирующей нуклеиновой кислоты или белка ГФАТ по настоящему изобретению. В качестве первого примера для вышеуказанного способа оценки по настоящему изобретению, тестируемые липидопродуцирующие штаммы оценивают на вышеуказанную активность по настоящему изобретению с использованием праймеров или зондов, разработанных на основе нуклеотидной последовательности по настоящему изобретению. Основные процедуры для такой оценки известны и могут быть найдены, например, в международной публикации патента № WO01/040514 или JP 8-205900 A. Краткое объяснение этой оценки будет дано ниже.
Сначала подготавливают геном тестового штамма. Для подготовки генома возможно использование любого известного способа, такого как способ Херефора или способ с ацетатом калия (смотри, например, Methods in Yeast Genetics, Cold Spring Harbor Laboratory Press, p130 (1990)).
Праймеры или зонды разработаны на основе нуклеотидной последовательности по настоящему изобретению, предпочтительно SEQ ID № 4. Эти праймеры или зонды могут представлять собой любые участки нуклеотидной последовательности по настоящему изобретению, и для их разработки можно использовать известные процедуры. Количество нуклеотидов в полинуклеотиде, используемом в качестве праймера, как правило, составляет 10 нуклеотидов или более, предпочтительно от 15 до 25 нуклеотидов. Так же количество нуклеотидов, соответствующих участку, фланкируемому праймерами, как правило, составляет от 300 до 2000 нуклеотидов.
Вышеуказанные подготовленные праймеры или зонды используют для проверки того, содержит ли геном вышеуказанного тестируемого штамма последовательность, характерную для нуклеотидной последовательности по настоящему изобретению. Последовательность, характерная для нуклеотидной последовательности по настоящему изобретению, может быть обнаружена с использованием известных процедур. Например, полинуклеотид, содержащий часть или полную последовательность, характерную для нуклеотидной последовательности по настоящему изобретению, или полинуклеотид, содержащий нуклеотидную последовательность, комплементарную вышеуказанной нуклеотидной последовательности, используется в качестве одного праймера, и полинуклеотид, содержащий часть или полную последовательность, расположенную выше или ниже этой последовательности, или полинуклеотид, содержащий нуклеотидную последовательность, комплементарную вышеуказанной нуклеотидной последовательности, используется в качестве другого праймера для амплификации нуклеиновых кислот из тестируемого штамма с помощью ПЦР или других способов с последующим определением присутствия или отсутствия продуктов амплификации, молекулярной массы продуктов амплификации и т.д.
Условия ПЦР, пригодные для способа по настоящему изобретению никак не ограничены и, в качестве примера, могут быть установлены следующие условия:
Температура денатурации: 90-95°C.
Температура отжига: 40-60°C.
Температура элонгации: 60-75°C.
Количество циклов: 10 циклов или более.
Полученные продукты реакции могут быть разделены электрофорезом в агарозном геле или подобным для определения молекулярной массы продуктов амплификации. Затем проверяют, обладает ли каждый продукт амплификации достаточной молекулярной массой, чтобы покрыть молекулу нуклеиновой кислоты, соответствующую участку, характерному для нуклеотидной последовательности по настоящему изобретению, посредством чего может быть предсказана или оценена вышеуказанная активность по настоящему изобретению. Кроме того, если вышеуказанные продукты амплификации анализируют на их нуклеотидные последовательности, как описано выше, вышеуказанная активность по настоящему изобретению может быть предсказана или оценена с большей точностью. Следует отметить, что процедуры для оценки вышеуказанной активности по настоящему изобретению представляют собой то, как это описано выше.
В качестве другого примера вышеуказанного способа оценки по настоящему изобретению, тестируемый штамм культивируют и измеряют уровень экспрессии ГФАТ, кодируемой нуклеотидной последовательностью по настоящему изобретению (например, SEQ ID № 4), посредством чего у тестируемого штамма можно оценить вышеуказанную активность по настоящему изобретению. Следует отметить, что уровень экспрессии ГФАТ может быть измерен посредством культивирования тестируемого штамма при соответствующих условиях и определения количества мРНК или белка ГФАТ. Определение количества мРНК или белка может быть выполнено посредством использования известных процедур, например, нозерн-гибридизация или количественный RT-ПЦР для определения количества мРНК и вестерн-блоттинг для определения количества белка (Current Protocols in Molecular Biology, John Wiley & Sons 1994 2003). Для оценки вышеуказанной активности, также возможно измерение доли жирных кислот в композиции жирных кислот, синтезируемой ГФАТ по настоящему изобретению. Процедуры измерения доли жирных кислот в композиции жирных кислот описаны выше.
(2) Способ отбора
Другой вариант осуществления настоящего изобретения представляет собой способ для отбора липидопродуцирующиего штамма с использованием ГФАТ-кодирующей нуклеиновой кислоты или белка ГФАТ по настоящему изобретению. В качестве примера для вышеуказанного способа отбора по настоящему изобретению, тестируемые штаммы культивируют и измеряют уровень экспрессии ГФАТ, кодируемой нуклеотидной последовательностью по настоящему изобретению (например, SEQ ID № 4) для отбора штамма с желаемым уровнем экспрессии, посредством чего может быть отобран штамм, обладающий желаемой активностью. Альтернативно, предварительно определяют типовой штамм и этот типовой штамм и тестируемые штаммы культивируют по отдельности и измеряют вышеуказанный уровень экспрессии, после чего сравнивают уровень экспрессии между типовым штаммом и каждым тестируемым штаммом, посредством чего может быть отобран желаемый штамм. Более конкретно, например, типовой штамм и тестируемые штаммы культивируют при соответствующих условиях и измеряют их уровни экспрессии для того, чтобы выбрать тестируемый штамм, проявляющий более высокую или более низкую экспрессию, чем типовой штамм, посредством чего может быть отобран штамм, обладающий желаемой активностью. Примеры желаемой активности включают уровень экспрессии ГФАТ и долю жирных кислот в композиции жирных кислот, синтезируемых ГФАТ, которые могут быть измерены как описано выше.
В качестве другого примера для вышеуказанного способа отбора по настоящему изобретению, тестируемые штаммы культивируют для отбора штамма, в котором вышеуказанная активность по настоящему изобретению является высокой или низкой, посредством чего может быть отобран штамм, обладающий желаемой активностью. Примеры желаемой активности включают уровень экспрессии ГФАТ и долю жирных кислот смеси жирных кислот, синтезируемых ГФАТ, которые могут быть измерены, как описано выше.
Примеры тестируемого штамма или типового штамма, доступных для использования, включают в качестве неограничивающих примеров, штамм, трансформированный вышеуказанным вектором по настоящему изобретению, штамм, модифицированный для подавления экспрессии вышеуказанной нуклеиновой кислоты по настоящему изобретению, штамм, модифицированный мутагенезом, и штамм, обладающий природной мутацией(ями). Следует отметить, что ГФАТ активность в настоящем изобретении и способность давать долю жирных кислот ГФАТ в настоящем изобретении могут быть измерены, например, посредством процедур, описанных в разделах «Нуклеиновые кислоты по настоящему изобретению, кодирующие глицерин-3-фосфатацилтрансферазу» и «Композиции жирных кислот по настоящему изобретению». Мутагенез может быть выполнен, но без ограничений, с помощью физических способов, включая ультрафиолетовое или радиоактивное излучение, или химических способов, включая обработку средством, таким как ЭМС (этилметансульфонат) или N-метил-N-нитрозогуанидин (смотри, например, Yasuji Oshima ed., Biochemistry Experiments vol. 39, Experimental Protocols for Yeast Molecular Genetics, pp. 67-75, Japan Scientific Societies Press).
Штаммы, использованные в настоящем изобретении в качестве типового и тестируемого штаммов, включают в качестве неограничивающих примеров вышеуказанные липидопродуцирующие штаммы или дрожжевые штаммы. Более конкретно, типовой штамм или тестируемый штамм может представлять собой сочетание любых штаммов, принадлежащих к различным родам или вида, и один или несколько тестируемых штаммов можно использовать одновременно.
Теперь настоящее изобретение будет описано более подробно с помощью следующих примеров, которые не предназначены для ограничения объема изобретения.
Пример 1
(1) Анализ маркёрных экспрессируемых последовательностей
Штамм 1S-4 M. alpina инокулировали в 100 мл среды (1,8% глюкозы, 1% дрожжевого экстртакта, pH 6,0) и предварительно культивировали в течение 3 дней при 28°C. В 10 литровый сосуд для культивирования (Able Co., Tokyo) поместили 5 л среды (1,8% глюкозы, 1% порошка из соевых бобов, 0,1% оливкового масла, 0,01% Adekanol, 0,3% KH2PO4, 0,1% Na2SO4, 0,05% CaCl2∙2H2O, 0,05% MgCl2∙6H2O, pH 6,0) и инокулировали всем предварительно культивированным продуктом, затем начали аэробное культивирование с постоянным перемешиванием в условиях 300 об/мин, кратность обмена 1 и 26°C в течение 8 дней. В 1, 2 и 3 день культивирования добавляли глюкозу в количестве, соответствующем 2%, 2% и 1,5%, соответственно. Клетки собирали на каждой стадии культивирования (день 1, 2, 3, 6 или 8) для подготовки общей РНК способом с гуанидингидрохлоридом/CsCl. Используя Oligotex-dT30<Super>mRNA Purification Kit (Takara Bio Inc., Japan), поли(A)+РНК очистили от остальной РНК. Для каждой стадии подготовили библиотеку кДНК с помощью ZAP-cDNA Synthesis Kit (Stratagene), с последующим анализом последовательности за один проход от 5'-конца кДНК (8000 клонов ×5 стадий). Полученные последовательности кластеризовали. В результате было получено около 5000 последовательностей.
(2) Поиск гомологов гена ГФАТ
Нуклеотидные последовательности, полученные из анализа маркёрных экспрессируемых последовательностей, сравнивали с аминокислотными последовательностями, зарегистрированными в GENBANK с помощью программы поиска гомологии, BLASTX, чтобы получить гомологи гена ГФАТ. В результате была найдена одна гомологичная последовательность ГФАТ (SEQ ID № 5).
Белок, показавший самое высокое сходство в процессе вышеуказанного поиска, был глицерин-3-фосфатацилтрансферазой Sct1p (которая представляет собой белок, кодируемый YBL011w), полученной из S. Cerevisiae.
Гомолог ГФАТ из M. alpina уже был показан в публикации патента США № US2006/0094091. Когда эту известную, полученную из M. alpina, последовательность (в дальнейшем, обозначаемую как ГФАТ1) сравнили с вышеуказанной полученной последовательностью, ГФАТ1 не обладала значительным сходством с SEQ ID № 5. Таким образом, похоже, что SEQ ID № 5 представляет собой маркёрные экспрессируемые последовательности другого гомолога, отличного от известной ГФАТ M. alpina, и этот гомолог ГФАТ обозначили как ГФАТ2.
Пример 2
(1) Клонирование гомологов ГФАТ
SEQ ID № 5 не содержит кодирующих последовательностей, которые выглядели бы кодирующими последовательностями гомолога ГФАТ. Таким образом, для клонирования кДНК, кодирующей весь ген целиком, были подготовлены следующие праймеры, основанные на SEQ ID № 5.
Разработанные праймеры, основанные на SEQ ID № 5:
Праймер E-1: CTGACTACCAAAACCAGCTGGACTTC (SEQ ID № 6)
Праймер E-2: GGCAATTTCATCCAAGTTGTCCTCC (SEQ ID № 7)
Используя эту пару праймеров, провели ПЦР с ExTaq (Takara Bio Inc., Japan) с использованием библиотеки кДНК на 8 день, содержащей маркёрные экспрессируемые последовательности, составляющие SEQ ID № 5 в качестве матрицы. Полученные фрагменты ДНК TA-клонировали с помощью TOPO-TA cloning Kit (Invitrogen Corporation) для определения нуклеотидной последовательности вставки.
Результаты подтвердили, что клонированный фрагмент ДНК содержит нуклеотидную последовательность, покрывающую нуклеотиды 5-243 из SEQ ID № 5. Эту плазмиду обозначили как pCR-E-P. Затем эту плазмиду использовали в качестве матрицы для выполнения ПЦР с вышеуказанными праймерами. В ПЦР использовали ExTaq (Takara Bio Inc., Japan), но присоединенную смесь dNTP заменили на смесь для мечения ПЦР (Roche Diagnostics) для дигоксигенинового (DIG) мечения амплифицируемой ДНК, таким образом, подготовили зонд для использования в скрининге библиотеки кДНК. Этот зонд использовали для скрининга библиотеки кДНК, из которой посредством анализа маркёрных экспрессируемых последовательностей были получены маркёрные экспрессируемые последовательности, составляющие SEQ ID № 5.
Были установлены следующие условия гибридизации.
Буфер: 5× SSC, 1% SDS, 50 мМ трис-HCl (pH 7,5), 50% формамида
Температура: 42°C (в течение ночи)
Отмывка: в 0,2× SSC, 0,1% SDS при 65°C в течение 20 минут (повторяли три раза)
Обнаружение выполнили посредством применения DIG nucleic acid detection kit (Roche Diagnostics). Из фаговых клонов, полученных скринингом, плазмиду вырезали посредством вырезания in vivo для получения плазмидной ДНК.
Интересующая нуклеотидная последовательность из клона, полученного скринингом кДНК, содержащего SEQ ID № 5, показана в SEQ ID № 1. SEQ ID № 1 содержит кодирующую последовательность в 1779 п.о. между позициями 113 и 1891, таким образом, подсказывая, что была получена последовательность, кодирующая полноразмерный гомолог ГФАТ (ГФАТ2). Установленная аминокислотная последовательность белка, кодируемого этим геном, показана в SEQ ID № 2. Плазмиду, содержащую SEQ ID № 1, обозначили как pB-GPAT2.
С другой стороны, для клонирования ГФАТ1, полученной из штамма 1S-4 M. alpina, были подготовлены следующие праймеры на основании открытой рамки считывания последовательности гомолога ГФАТ, показанной в SEQ ID № 1 публикации патента США № 2006/0094091.
Праймер ГФАТ1-1 ggatccatggcccttcagatctacga (SEQ ID № 8)
Праймер ГФАТ1-2 gtcgacctaaatgtcttttgacttggc (SEQ ID № 9)
Подчеркнутые участки в вышеуказанных праймерах представляют собой сайты узнавания рестриктаз, которые были добавлены.
Используя эти праймеры, ПЦР провели с KOD-Plus- (Toyobo Co., Ltd., Japan) используя библиотеку кДНК в качестве матрицы. Амплифицированные фрагменты субклонировали в pCR4 Blunt-TOPO (Invitrogen) и подтвердили их нуклеотидные последовательности. Клон, который выглядел обладающим правильной нуклеотидной последовательностью этого гена, обозначили как pCR4-GPAT1. Таким образом клонированная кДНК нуклеотидная последовательность ГФАТ1, полученной из штамма 1S-4 M. alpina, показана в SEQ ID № 10, и установленная аминокислотная последовательность ГФАТ1, кодируемая этой кДНК, показана в SEQ ID № 11.
(2) Анализ последовательности
Полученную таким образом кДНК последовательность гомолога ГФАТ, выделенного из M. alpina, (ГФАТ2) подвергли сравнению с помощью BLASTX для поиска гомологии с аминокислотными последовательностями, зарегистрированными в GENEBANK. В результате, аминокислотная последовательность, обладающая самым низким E-value, т.е., обладающая самым большим сходством с последовательностью этого гомолога, представляла собой последовательность предполагаемого 1-ацил-sn-глицерин-3-фосфатацилтрансфераза-подобного белка, выделенного из Aspergillus nidulans (инвентарный номер GB EAA62242). Среди белков с установленными функциями, белком, показавшим наибольшее сходство, была глицерин-3-фосфатацилтрансфераза Sct1p, выделенная из Saccharomyces cerevisiae (инвентарный номер GB CAC85390). Вышеуказанные последовательности, обладающие самым высоким сходством, анализировали с помощью clustalW для определения их сходства с открытой рамкой считывания этой гомологичной последовательности на уровне нуклеотидной и аминокислотной последовательности. В результате, было обнаружено, что они обладают сходством 36,9% и 36,6% на уровне нуклеотидной последовательности и 17,0% и 15,0% на уровне аминокислотной последовательности, соответственно.
Ни клонированная нуклеотидная последовательность SEQ ID № 1, ни ее установленная аминокислотная последовательность SEQ ID № 2 не обладали значимо большим сходством с известными нуклеотидными последовательностями и аминокислотными последовательностями, таким образом, подсказывая, что клонированная нуклеотидная последовательность и ее установленная аминокислотная последовательность являются новой ГФАТ, выделенной из M. alpina.
В отличие от этого, вышеуказанную клонированную ГФАТ1, выделенную из штамма 1S-4 M. alpina (чья кДНК и установленная аминокислотная последовательность показаны в SEQ ID №№ 10 и 11, соответственно) сравнили с ГФАТ1, выделенной из M. alpina (ATCC #16266) (публикация патента США № 2006/0094091), что подтвердило сходство в 90,4% на уровне нуклеотидной последовательности и 97,9% на уровне аминокислотной последовательности.
Пример 3
Конструкция дрожжевого экспрессирующего вектора
Для экспрессии ГФАТ2 в дрожжевых клетках, сконструировали следующий дрожжевой экспрессирующий вектор. А именно, плазмиду pB-GPAT2 расщепили рестриктазой KpnI и затем частично расщепили рестриктазой SacI для получения фрагмента ДНК приблизительно в 2 т.п.н. Этот фрагмент ДНК вставили в сайт SacI-KpnI дрожжевого экспрессирующего вектора pYE22m (Biosci. Biotech. Biochem., 59, 1221-1228, 1995) для создания плазмиды pYE-MAGPAT2.
С другой стороны, для экспрессии ГФАТ1 в дрожжевых клетках, сконструировали следующий дрожжевой экспрессирующий вектор. Плазмиду pCR4-GPAT1 расщепили рестриктазами BamHI и SalI для получения фрагмента ДНК приблизительно в 2,2 т.п.н. Этот фрагмент ДНК вставили в сайт BamHI-SalI дрожжевого экспрессирующего вектора pYE22m (Biosci. Biotech. Biochem., 59, 1221-1228, 1995) для создания плазмиды pYE-MAGPAT1.
Пример 4
Трансформация дрожжей
Плазмиду pYE22m, pYE-MAGPAT1 или pYE-MAGPAT2 использовали для трансформации штамма EH13-15 дрожжей Saccharomyces cerevisiae (trp1, MATα) (Appl. Microbiol. Biotechnol., 30, 515-520, 1989) способом с ацетатом лития. Трансформированные штаммы проверяли на способность расти на SC-Trp агаровой среде (2% агара), содержащей на литр 6,7 г дрожжевой азотной основы без аминокислот (DIFCO), 20 г глюкозы и 1,3 г порошка аминокислот (смесь из 1,25 г аденинсульфата, 0,6 г аргинина, 3 г аспарагиновой кислоты, 3 г глутаминовой кислоты, 0,6 г гистидина, 1,8 г лейцина, 0,9 г лизина, 0,6 г метионина, 1,5 г фенилаланина, 11,25 г серина, 0,9 г тирозина, 4,5 г валина, 6 г треонина и 0,6 г урацила).
Пример 5
Культура дрожжей
Среди трансформированных штаммов, полученных с каждым дрожжевым экспрессирующим вектором, были выбраны любые два штамма (штаммы c-1 и c-2, штаммы ГФАТ1-1 и ГФАТ1-2, или штаммы ГФАТ2-1 и ГФАТ2-2) и культивировались при следующих условиях.
А именно, на стадии предварительного культивирования, петлю для посева каждого дрожжевого штамма инокулировали с чашки в SC-Trp среду (10 мл) и культивировали при перемешивании при 30°C в течение 2 дней. На стадии основного культивирования, предварительно культивированный раствор (500 мкл) добавляют в 10 мл YPD5 (2% дрожжевого экстртакта, 1% полипептона, 5% глюкозы) среду культивировали при перемешивании при 30°C втечение 2 дней.
Пример 6
Анализ жирных кислот дрожжевых штаммов
Каждый из растворов культивированных дрожжей центрифугировали для того, чтобы собрать клетки. После отмывки 10 мл стерилизованной воды, снова собрали клетки посредством центрифугирования и лиофилизировали. К лиофилизированным клеткам добавили хлороформ:метанол (2:1, 4 мл) и энергично перемешали, после чего инкубировали при 70°C в течение 1 часа. Клетки отделили посредством центрифугирования для того, чтобы собрать растворитель. К оставшимся клеткам снова добавили хлороформ:метанол (2:1, 4 мл), и повторили ту же процедуру для того, чтобы собрать растворитель. После того, как липиды высушили с помощью SpeedVac, для растворения липидов добавили 2 мл хлороформа. 200 мкл этого образца обработали способом с соляной кислотой/метанолом для выделения жирных кислот в клетках в соответствующих метиловых эфирах, с последующей экстракцией гексаном. После очистки от гексана, жирные кислоты анализировали с помощью газовой хроматографии.
Полученные результаты приведены в таблице 2.
Таблица 2 Доля жирных кислот трансформированных штаммов (организм-хозяин: EH13 15)
(16:0+16:1)
Дрожжевые штаммы, трансформированные двумя гомологами ГФАТ, выделенными из M. alpina, и контрольные дрожжевые штаммы сравнивали по их доле жирных кислот. В доле жирных кислот ГФАТ1-трансформированных дрожжей, процентное содержание пальмитиновой кислоты увеличено, но содержание пальмитолеиновой кислоты снижено по сравнению с контрольными штаммами. Стеариновая кислота и олеиновая кислота обладали таким же процентным содержанием, как в контрольных штаммах. Таким образом, отношение содержания пальмитолеиновой кислоты к содержанию пальмитиновой кислоты, отношение содержания олеиновой кислоты к содержанию пальмитиновой кислоты и отношение общего содержания стеариновой кислоты и олеиновой кислоты к содержанию пальмитиновой кислоты были ниже таковых у контрольных штаммов.
В отличие от этого, в ГФАТ2-трансформированных дрожжах, процентное содержание олеиновой кислоты увеличено на 10% или более по сравнению с контрольными штаммами. Процентные содержания пальмитиновой кислоты и пальмитолеиновой кислоты увеличены при сравнении с контрольными штаммами, тогда как отношение содержания пальмитолеиновой кислоты к содержанию пальмитиновой кислоты увеличено незначительно при сравнении с контрольными штаммами. Кроме того, в ГФАТ2-трансформированных дрожжах отношение содержания олеиновой кислоты к содержанию пальмитиновой кислоты и отношение общего содержания стеариновой кислоты и олеиновой кислоты к содержанию пальмитиновой кислоты увеличены по сравнению с контрольными штаммами. Более того, в ГФАТ2-трансформированных дрожжах, отношение C18 жирных кислот к C16 жирным кислотам увеличено, указывая на то, что синтезировались жирные кислоты с более длинной цепью.
Эти результаты указывают на то, что два гомолога ГФАТ, выделенные из M. alpina, обладают различной специфичностью к их субстратной ацильной группе, и таким образом дрожжевые штаммы, трансформированные этими генами, давали доли жирных кислот, отличающиеся от гомолога к гомологу. Результаты также указывают на то, что возможно выведение организмов с желаемой долей жирных кислот при подборе вышеуказанных гомологов, соответствующих заданной цели.
Пример 7
Анализ экспрессии в дрожжевых штаммах, продуцирующих арахидоновую кислоту
(1) Выведение дрожжевых штаммов, продуцирующих арахидоновую кислоту
Чтобы вывести дрожжевые (Saccharomyces cerevisiae) штаммы, продуцирующие арахидоновую кислоту, были созданы следующие плазмиды.
Сначала кДНК, выделенную из штамма 1S-4 M. alpina, использовали в качестве матрицы для проведения ПЦР с ExTaq с использованием набора праймеров из ∆12-f и ∆12-r, ∆6-f и ∆6-r, GLELO-f и GLELO-r или ∆5-f и ∆5-r для того, чтобы таким образом амплифицировать ген десатуразы ∆12 жирных кислот, ген десатуразы ∆6 жирных кислот, ген GLELO элонгазы жирных кислот или ген десатуразы ∆5 жирных кислот в штамме 1S-4 M. alpina.
∆12-f: TCTAGAATGGCACCTCCCAACACTATTG (SEQ ID № 12)
∆12-r: AAGCTTTTACTTCTTGAAAAAGACCACGTC (SEQ ID № 13)
∆6-f: TCTAGAATGGCTGCTGCTCCCAGTGTGAG (SEQ ID № 14)
∆6-r: AAGCTTTTACTGTGCCTTGCCCATCTTGG (SEQ ID № 15)
GLELO-f: TCTAGAATGGAGTCGATTGCGCAATTCC (SEQ ID № 16)
GLELO-r: GAGCTCTTACTGCAACTTCCTTGCCTTCTC (SEQ ID № 17)
∆5-f: TCTAGAATGGGTGCGGACACAGGAAAAACC (SEQ ID № 18)
∆5-r: AAGCTTTTACTCTTCCTTGGGACGAAGACC (SEQ ID № 19)
Эти гены клонировали с помощью TOPO-TA-cloning Kit. Были установлены нуклеотидные последовательности клонов, и те, которые содержат нуклеотидные последовательности из SEQ ID №№ 20-23 были обозначены как плазмиды pCR-MA∆12DS (содержит нуклеотидную последовательность из SEQ ID № 20), pCR-MA∆6DS (содержит нуклеотидную последовательность из SEQ ID № 21), pCR-MAGLELO (содержит нуклеотидную последовательность из SEQ ID № 22) и pCR- MA∆5DS (содержит нуклеотидную последовательность из SEQ ID № 23), соответственно.
С другой стороны, фрагмент ДНК приблизительно 1,2 т.п.н., расщепленный с помощью HindIII и полученный из плазмиды pURA34 (JP 2001 120276 A), вставили в сайт HindIII вектора pUC18, который был расщеплен рестриктазами EcoRI и SphI, с последующим затуплением липких концов и самолигированием. Клон, в котором сайт EcoRI вектора был на 5'-стороне от URA3, обозначили как pUC-URA3. Так же, фрагмент ДНК приблизительно 2,2 т.п.н., расщепленный с помощью SalI и XhoI и полученный из YEp13, вставили в сайт SalI вектора pUC18, и клон, в котором сайт EcoRI вектора был на 5'-стороне от LUE2, обозначили как pUC-LEU2.
Затем плазмиду pCR-MA∆12DS расщепили рестриктазой HindIII и после затупления липких концов дополнительно обработали рестриктазой XbaI для получения фрагмента ДНК приблизительно 1,2 т.п.о., тогда как вектор pESC-URA (Stratagene) обработали рестриктазой SacI и, после затупления липких концов, дополнительно обработали рестриктазой SpeI для получения фрагмента ДНК приблизительно 6,6 т.п.о. Эти фрагменты ДНК лигировали для получения плазмиды pESC-U-∆12. Плазмиду pCR-MA∆6DS расщепили рестриктазой XbaI и, после затупления липких концов, дополнительно обработали рестриктазой HindIII для получения фрагмента ДНК приблизительно 1,6 т.п.о., тогда как плазмиду pESC-U-∆12 расщепили рестриктазой SalI и, после затупления липких концов, дополнительно обработали рестриктазой HindIII для получения фрагмента ДНК приблизительно 8 т.п.о. Эти фрагменты ДНК лигировали для получения плазмиды pESC-U-∆12:∆6. Эту плазмиду частично обработали рестриктазой PvuII, и полученный фрагмент приблизительно 4,2 т.п.н. вставили в pUC-URA3 в сайт SmaI для получения плазмиды Puc-URA-∆12: ∆6.
Также плазмиду pCR-MAGLELO обработали рестриктазами XbaI и SacI для получения фрагмента ДНК приблизительно 0,95 т.п.о., тогда как pESC-LEU (Stratagene) обработали рестриктазами XbaI и SacI для получения фрагмента ДНК приблизительно 7,7 т.п.о. Эти фрагменты ДНК лигировали, чтобы получить плазмиду pESC-L-GLELO. Плазмиду pCR-MA∆5DS обработали рестриктазой XbaI и, после затупления липких концов, дополнительно обработали рестриктазой HindIII для получения фрагмента ДНК приблизительно 1,3 т.п.о., тогда как плазмиду pESC-L-GLELO обработали рестриктазой ApaI и, после затупления липких концов, дополнительно обработали рестриктазой HindIII для получения фрагмента ДНК приблизительно 8,7 т.п.о. Эти фрагменты ДНК лигировали для получения плазмиды pESC-L-GLELO:∆5. Эту плазмиду обработали рестриктазой PvuII, и полученный фрагмент приблизительно 3,2 т.п.н. вставили в pUC-LEU2 в сайт SmaI для получения плазмиды pUC-LEU-GLELO:∆5. Штамм YPH499 S. cerevisiae (Stratagene) совместно трансформировали плазмидой pUC-URA-∆12:∆6 и плазмидой pUC-LEU-GLELO:∆5. Трансформированные штаммы проверяли на способность расти на SC-Leu,Ura агаровой среде (2% агара), содержащей на литр 6,7 г дрожжевой азотной основы без аминокислот (DIFCO), 20 г глюкозы и 1,3 г аминокислотного порошка (смесь из 1,25 г аденинсулфата, 0,6 г аргинина, 3 г аспарагиновой кислоты, 3 г глутаминовой кислоты, 0,6 г гистидина, 0,9 г лизина, 0,6 г метионина, 1,5 г фенилаланина, 11,25 г серина, 0,9 г тирозина, 4,5 г валина, 6 г треонина и 1,2 г триптофана). Среди полученных таким образом штаммов, любой штамм был обозначен как штамм ARA3-1.
(2) Получение и анализ трансформированных штаммов дрожжей, продуцирующих арахидоновую кислоту
Штамм ARA3-1 трансформировали соответственно плазмидами pYE22m, pYE-MAGPAT1 и pYE-MAGPAT2. Трансформированные штаммы проверяли на способность расти в SC-Trp,Leu,Ura агаровой среде (2% агара), содержащей на литр 6,7 г дрожжевой азотной основы без аминокислот (DIFCO), 20 г глюкозы и 1,3 г аминокислотного порошка (смесь из 1,25 г аденинсульфата, 0,6 г аргинина, 3 г аспарагиновой кислоты, 3 г глутаминовой кислоты, 0,6 г гистидина, 0,9 г лизина, 0,6 г метионина, 1,5 г фенилаланина, 11,25 г серина, 0,9 г тирозина, 4,5 г валина и 6 г треонина). Среди трансформированных таким образом штаммов, для каждой плазмиды выбрали любые 4 штамма.
Каждый из этих штаммов культивировали при 30°C в течение 1 дня в вышеуказанной SC-Trp,Leu,Ura жидкой среде (10 мл), 1 мл которой затем культивировали при 15°C в течение 7 дней в SG Trp,Leu,Ura жидкой среде (10 мл), содержащей на литр 6,7 г дрожжевой азотной основы без аминокислот (DIFCO), 20 г галактозы и 1,3 г аминокислотного порошка (смесь из 1,25 г аденинсульфата, 0,6 г аргинина, 3 г аспарагиновой кислоты, 3 г глутаминовой кислоты, 0,6 г гистидина, 0,9 г лизина, 0,6 г метионина, 1,5 г фенилаланина, 11,25 г серина, 0,9 г тирозина, 4,5 г валина и 6 г треонина), с последующим анализом жирных кислот в клетках. Таблицы 3 и 4 показывают долю жирных кислот в клетках и содержание жира и масла в клетках, соответственно.
В случае, когда ГФАТ2, выделенная из M. alpina, экспрессировалась в продуцирующих арахидоновую кислоту дрожжевых клетках, доли ПНЖК, включая ДГЛК и арахидоновую кислоту, были увеличены по сравнению с контролем. Внутриклеточное содержание жирных кислот также было увеличено.
Пример 8
Конструкция вектора для экспрессии M. alpina
Для экспрессии M. alpina использовали вектор pDuraSC, который делает возможной экспрессию желаемого гена из промоторов ГАФДГ, и вектор pDuraMCS, который делает возможной экспрессию желаемого гена из промоторов гистонов.
Для экспрессии ГФАТ2 в клетках M. alpina, создали следующие векторы. Плазмиду pB-GPAT2 обработали рестриктазой PstI и затем частично обработали рестриктазой XhoI. Среди полученных фрагментов ДНК, фрагмент приблизительно 1,7 т.п.н. был вырезан и вставлен между сайтами PstI и XhoI в сайт множественного клонирования вектора pDuraSC или pDura5MCS. Полученные конструкции обозначили как плазмиды pDuraSC-GPAT2 и pDura5MCS- GPAT 2, соответственно.
Получение трансформированных штаммов M. alpina
Урацил-ауксотрофный штамм Dura-3, выделенный из M. alpina, как описано в патентном документе (WO2005/019437 обозначенном «Method of Breeding Lipid-Producing Fungus»), использовали в качестве организма-хозяина и трансформировали этими плазмидами с помощью способа доставки частиц. Для скрининга трансформированных штаммов использовали SC агаровую среду (0,5% дрожжевой азотной основы без аминокислот и сульфата аммония (Difco), 0,17% сульфата аммония, 2% глюкозы, 0,002% аденина, 0,003% тирозина, 0,0001% метионина, 0,0002% аргинина, 0,0002% гистидина, 0,0004% лизина, 0,0004% триптофана, 0,0005% треонина, 0,0006% изолейцина, 0,0006% лейцина, 0,0006% фенилаланина и 2% агара).
Оценка трансформантов M. alpina
Каждый из полученных трансформированных штаммов инокулировали в 4 мл GY среды (2% глюкозы, 1% дрожжевого экстртакта) и культивировали при перемешивании при 28°C в течение 3 или 4 дней. Клетки собирали фильтрованием, и РНК выделяли с помощью RNeasy plant kit (QIAGEN). Для синтеза кДНК была использована система SuperScript First-Strand для RT-ПЦР (Invitrogen). Для подтверждения экспрессии введенной конструкции и общей экспрессии для каждого гена, RT-ПЦР проводили со следующими наборами праймеров.
Штаммы, трансформированные плазмидой pDuraSC-GPAT2
Праймеры, использованные для подтверждения экспрессии введенной конструкции:
MaGAPDHpfw: CACACCACACATTCAACATC (SEQ ID № 24); и
E2: GGCAATTTCATCCAAGTTGTCCTCC (SEQ ID № 25)
Праймеры, использованные для подтверждения общей экспрессии ГФАТ2:
E1: CTGACTACCAAAACCAGCTGGACTTC (SEQ ID № 26); и
E2
Штаммы, трансформированные плазмидой pDura5MCS-GPAT2
Праймеры, использованные для подтверждения экспрессии введенной конструкции:
PD4P: CGCATCCCGCAAACACACAC (SEQ ID № 27) и праймер E2,
Праймеры, использованные для подтверждения общей экспрессии ГФАТ2:
Праймеры E1 и E2
На основании результатов вышеуказанной RT-ПЦР были отобраны трансформанты, проявляющие высокий уровень экспрессии, как экспрессии из введенной конструкции, так и общей экспрессии: штаммы Gp-GPAT2-30 и Hp-GPAT2-9 из штаммов, трансформированных плазмидами pDuraSC-GPAT2 и pDura5MCS-GPAT2, соответственно.
Каждый из этих штаммов был инокулирован в GY среду (4 мл) и культивировался при перемешивании при 28°C при 125 об/мин. На 3 день культивирования, добавили 20% глюкозы (400 мл) и продолжили культивирование. Альтернативно, на 6 день культивирования все клетки собрали фильтрованием и лиофилизировали. Часть (приблизительно 10-20 мг) высушенных клеток обработали способом с соляной кислотой/метанолом для выделения жирных кислот в клетках в соответствующих метиловых эфирах, с последующей экстракцией гексаном. После очистки от гексана, жирные кислоты анализировали с помощью газовой хроматографии. Внутриклеточное содержание жирных кислот и синтез арахидоновой кислоты в среде суммированы в таблицах 5 и 6, соответственно.
Как показано выше, высокая экспрессия гена ГФАТ2 в M. alpina позволяет увеличить как внутриклеточное содержание жирных кислот, так и синтез арахидоновой кислоты в среде.
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ НА ЕСТЕСТВЕННОМ ЯЗЫКЕ
SEQ ID № 6: праймер
SEQ ID № 7: праймер
SEQ ID № 8: праймер
SEQ ID № 9: праймер
SEQ ID № 12: праймер
SEQ ID № 13: праймер
SEQ ID № 14: праймер
SEQ ID № 15: праймер
SEQ ID № 16: праймер
SEQ ID № 17: праймер
SEQ ID № 18: праймер
SEQ ID № 19: праймер
SEQ ID № 24: праймер
SEQ ID № 25: праймер
SEQ ID № 26: праймер
SEQ ID № 27: праймер
| название | год | авторы | номер документа |
|---|---|---|---|
| НОВЫЕ ГЕНЫ АЦИЛТРАНСФЕРАЗЫ ЛИЗОФОСФАТИДНОЙ КИСЛОТЫ | 2008 |
|
RU2507263C2 |
| ГОМОЛОГИ ФОСФАТАЗЫ ФОСФАТИДНОЙ КИСЛОТЫ И ИХ ПРИМЕНЕНИЕ | 2008 |
|
RU2507264C2 |
| НОВАЯ АЦЕТИЛ-COA-КАРБОКСИЛАЗА | 2010 |
|
RU2551779C2 |
| КОМПОЗИЦИИ ЖИРНЫХ КИСЛОТ, ИМЕЮЩИЕ НОВУЮ ПРОПОРЦИЮ ЖИРНЫХ КИСЛОТ | 2008 |
|
RU2496881C2 |
| НОВАЯ ЛИЗОФОСФОЛИПИД-АЦИЛТРАНСФЕРАЗА | 2010 |
|
RU2534559C2 |
| ГЛИЦЕРОЛ-3-ФОСФАТАЦИЛТРАНСФЕРАЗА | 2010 |
|
RU2499835C1 |
| ГОМОЛОГ ГЛИЦЕРОЛ-3-ФОСФАТ-АЦИЛТРАНСФЕРАЗЫ И ЕГО ИСПОЛЬЗОВАНИЕ | 2011 |
|
RU2545375C2 |
| НУКЛЕИНОВАЯЯ КИСЛОТА, ОБЛАДАЮЩАЯ АКТИВНОСТЬЮ ГЕНА ФОСФАТАЗЫ ФОСФАТИДНОЙ КИСЛОТЫ (ВАРИАНТЫ), БЕЛОК, РЕКОМБИНАНТНЫЙ ВЕКТОР, ТРАНСФОРМАНТ И СПОСОБ ПОЛУЧЕНИЯ КОМПОЗИЦИИ ЖИРНОЙ КИСЛОТЫ | 2010 |
|
RU2528875C2 |
| ГЕН ФОСФАТАЗЫ ФОСФАТИДНОЙ КИСЛОТЫ | 2012 |
|
RU2625025C2 |
| НОВЫЕ ГЕНЫ АТФ:ЦИТРАТЛИАЗЫ | 2008 |
|
RU2534560C2 |












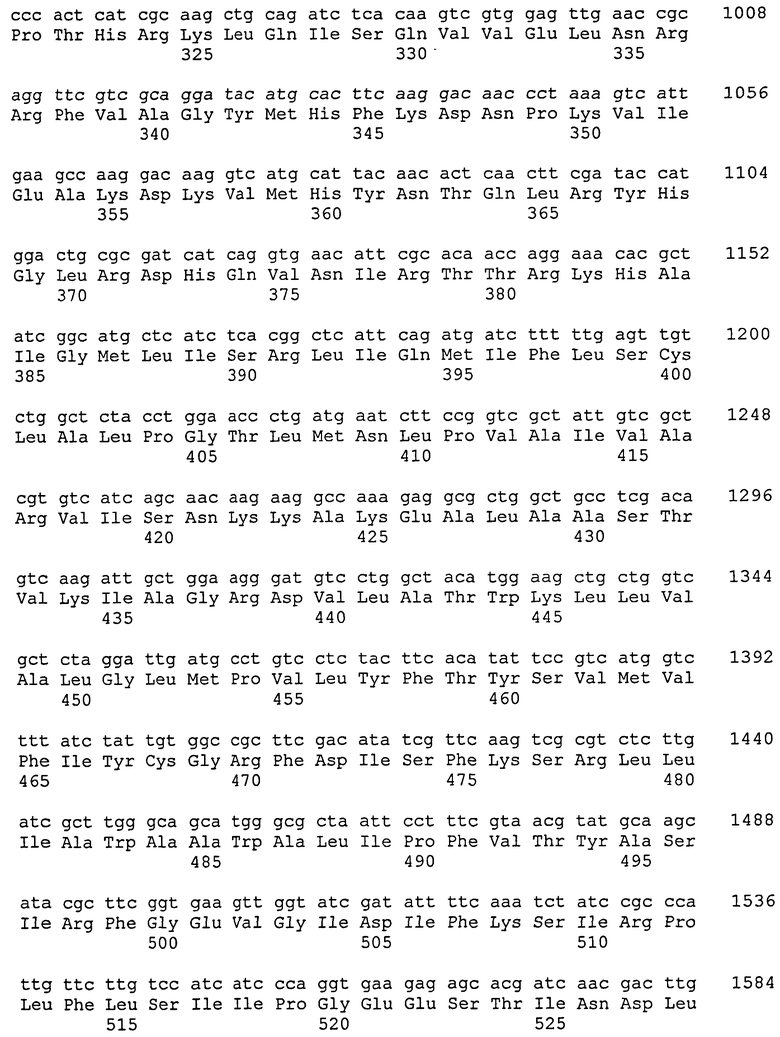
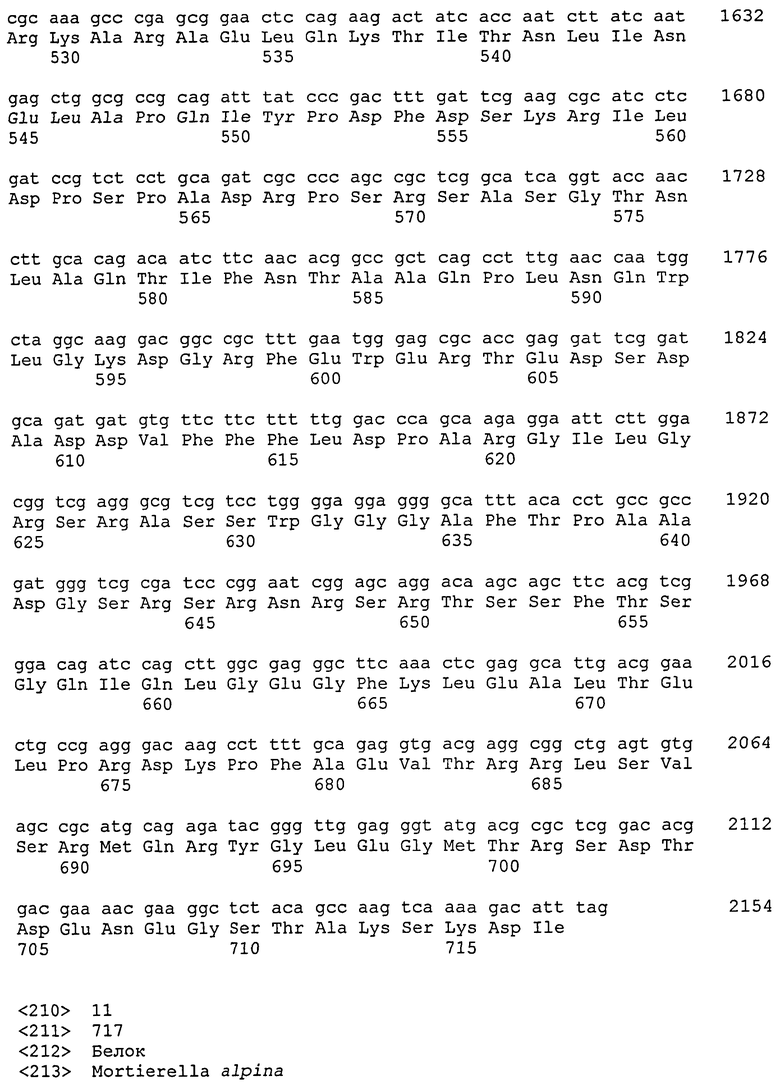







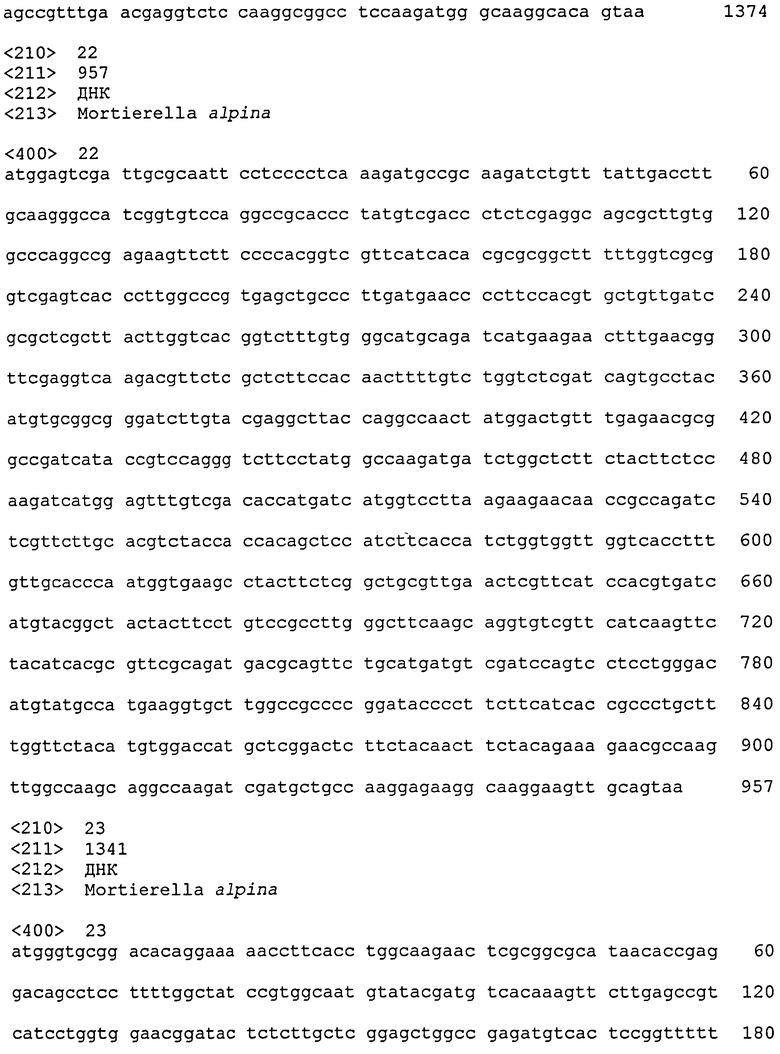



Настоящее изобретение относится к области молекулярной биологии и генной инженерии и может быть использовано в процессе синтеза жирных кислот. Из штамма липидпродуцирующего грибка Mortierella alpina получен новый ген, кодирующий фермент глицерин-3-фосфатацилтрансферазы; определена его полная нуклеотидная последовательность, а также ее часть, кодирующая зрелый белок; выведена аминокислотная последовательность нового фермента. Путем трансформации штаммов Mortierella и дрожжевых штаммов кодирующей фермент нуклеотидной последовательностью получены трансформанты с измененным в сравнении с организмом-хозяином долевым соотношением жирных кислот. 4 н.п. ф-лы, 6 табл., 1 ил., 8 пр.
1. Нуклеиновая кислота, которая кодирует белок, обладающий глицерин-3-фосфатацилтрансферазной активностью, характеризующаяся нуклеотидной последовательностью, показанной в любом из нижеприведенных пунктов (а)-(с):
(a) нуклеотидная последовательность, показанная в SEQ ID №4;
(b) нуклеотидная последовательность, кодирующая белок, состоящий из аминокислотной последовательности, показанной в SEQ ID №2; или
(c) нуклеотидная последовательность, показанная в SEQ ID №1.
2. Белок, который обладает глицерин-3-фосфатацилтрансферазной активностью, состоящий из аминокислотной последовательности, показанной в SEQ ID №2.
3. Рекомбинантный вектор для экспрессии глицерин-3-фосфатацилтрансферазы, содержащий нуклеиновую кислоту по п.1.
4. Трансформант для продуцирования глицерин-3-фосфатацилтрансферазы, трансформированный рекомбинантным вектором по п.3.
| ZHENG et al | |||
| J.Biol | |||
| Chem | |||
| Перекатываемый затвор для водоемов | 1922 |
|
SU2001A1 |
| MISHRA S | |||
| et al | |||
| Biochem | |||
| J | |||
| Перекатываемый затвор для водоемов | 1922 |
|
SU2001A1 |
| ZAREMBERG et al | |||
| J | |||
| Biol | |||
| Chem | |||
| Топчак-трактор для канатной вспашки | 1923 |
|
SU2002A1 |
| Информационно-аналитический журнал «Мембраны» | |||
| Перекатываемый затвор для водоемов | 1922 |
|
SU2001A1 |
Авторы
Даты
2013-06-20—Публикация
2008-06-12—Подача