Изобретение относится к синтетическим сорбентам и может быть использовано в ядерной энергетике и химико-металлургической промышленности при очистке жидких радиоактивных отходов и сточных вод от радионуклидов, в частности ионов цезия. Кроме того, сорбент может быть использован для детоксикации организмов животных и человека при радиохимическом заражении.
Известны способы получения сорбентов для извлечения цезия и стронция из жидких радиоактивных отходов и для очистки сточных вод от ионов аммония, цветных и тяжелых металлов включающие синтез цеолитов из летучей золы от сжигания каменного угля включающие взаимодействие летучей золы с раствором гидроксида натрия или калия в гидротермальных условиях (см. GB №2339774, JP №№03-45512, 03-40915, а также работы Hollman G.G., Steenbruggen G., Janssen-Jurkovicova M. A two-step process for the synthesis of zeolites from coal fly ash / Fuel 78 (1999) 1225, Steenbruggen G., Hollman G.G. The synthesis of zeolites from fly ash and the properties of the zeolite products / J. Geochem. Exploration 62 (1998) 305, Querol X., Umana J.C., Plana F., et al. Synthesis of zeolites from fly ash at pilot plant scale. Examples of potential applications / Fuel 80 (2001) 857 и др.).
При этом из одного и того же исходного сырья в зависимости от молярности активирующего раствора, соотношения летучая зола/активирующий раствор, температуры, давления и времени реакции получают около 13 типов цеолитов с содержанием целевого компонента 20-75%, среди которых наиболее открытой структурой и оптимальными катионообменными свойствами обладают цеолиты NaA, NaX и NaPl. Существенным недостатком этих способов является использование алюмосиликатного сырья переменного химического и минерально-фазового состава, что приводит к невоспроизводимым результатам и загрязнению целевых продуктов железом. Кроме того, цеолиты, полученные из летучей золы, обычно представляют собой высокодисперсный материал с размерами гранул от 1 до 5 мкм, что требует его дополнительного формования со связующим материалом.
Известен также способ получения сорбента цезия, включающий синтез аналога природного алюмосиликата, для чего, алюмосодержащий и кремнийсодержащий материалы подвергают обработке в присутствии раствора гидроксида щелочного металла (см. RU №2214858, B01J 20/18, G21F 9/12, C01B 39/02, 2002).
В качестве исходного сырья для синтеза цеолитов используют ценосферы, выделенные из летучих зол от сжигания каменного угля. Ценосферы смешивают с раствором NaOH с концентрацией 1-3 M и выдерживают при 80-100°C в течение 32-72 часов в статических условиях или при перемешивании. Ценосферы, или полые алюмосиликатные микросферы, являются одной из разновидностей микросферических стеклокристаллических компонентов летучих зол тепловых электростанций, отличающихся от остальной массы золы низкой плотностью (менее 1,0 г/см3), более крупными размерами сферических гранул (50-400 мкм).
К недостаткам заявленного способа относится длительность и многооперационность этапа подготовки сырья (предварительно состав ценосфер стабилизируют путем их разделения по размеру, плотности и магнитным свойствам) поскольку валовый химический состав ценосфер, образующихся при сжигании углей разных бассейнов варьирует в широком диапазоне (мас.%): SiO2 - 53-64,7; АlО3 - 20-35,7; Fе2О3 - 1,54-6,37; FeO - 0,57-5,09; CaO - 0,11-4,89; MgO - 0,01-2,64; MnO - 0,03-0,06; К2О - 0,44-7,18; Na2O - 0,4-1,36; P2O5 - 0,07-0,75; SO3 - 0,06-2,46; п.п.п.- 0,22-10,86. Таким образом имеет место продолжительность процесса получения сорбента и нестабильность параметров получаемого сорбента, кроме того, сорбционная емкость сорбента также достаточно ограничена (порядка 2 мг-экв/г сорбента). Кроме того, ценосферы составляют не более 1,5% от объема летучей золы, что не позволяет рассматривать этот материал в качестве надежного источника сырья.
Задачей предлагаемого способа является повышение сорбционной емкости сорбента и упрощение технологии его получения.
Технический результат, получаемый при решении поставленной задачи выражается в обеспечении возможности повышение сорбционной емкости сорбента. Кроме того, повышается стабильность рабочих параметров сорбента, расширяется сырьевая база для его производства. Обеспечивается возможность использования для детоксикации организмов животных и человека при радиохимическом заражении. Кроме того, упрощается технология получения сорбента и снижается продолжительность процесса синтеза.
Для решения поставленной задачи способ получения сорбента цезия в виде частиц аналога природного микроклина, заключающийся в том, что смешивают мелкодисперсный кремнезем с водным раствором гидрооксида калия, смесь подвергают гидротермальной обработке при температуре не менее 120°C в течение 2-3 часов, производят фильтрацию, к фильтрату добавляют раствор соли алюминия, имеющей анион кислоты более сильной чем поликремневая кислота, перемешивают реакционную смесь, выдерживают в течение 10-180 минут до обеспечения нейтрального pH, отделяют образовавшийся осадок, подвергают его промывке и обезвоживанию, при этом исходные компоненты смешивают в соотношении, обеспечивающем получение материала с формулой KAlSi3O8 в пересчете на безводный материал. Кроме того, обезвоживание осадка включает его центрифугирование и/или сушку при температуре 95-105°C. Кроме того, аналог природного микроклина получают с крупностью частиц размером, предпочтительно 10-20 нм.
Сопоставительный анализ признаков заявленного решения с признаками прототипа и аналогов свидетельствует о соответствии заявленного решения критерию "новизна".
Признаки формулы изобретения обеспечивают решение комплекса функциональных задач.
Признаки указывающие на «…получения сорбента цезия в виде частиц аналога природного микроклина…», обеспечивают синтез калийсодержащего силиката, что с учетом высокого химического сродства ионов цезия к ионам калия обеспечивает высокую сорбционную емкость сорбента по цезию. Синтезированный сорбент относится к солеобразным каркасным соединениям, механизм сорбции которых основан на катионном обмене ионов калия на ионы цезия.
Признаки «…смешивают мелкодисперсный кремнезем с водным раствором гидрооксида калия, смесь подвергают гидротермальной обработке при температуре не менее 120°C в течение 2-3 часов…» обеспечивают получение из мелкодисперсного кремнезема аморфного кремнезема и, в итоге возможность, получения промежуточного продукта - продукта реакции между аморфным кремнеземом и гидрооксидом калия.
Признаки, указывающие, что продукт гидротермальной обработки смеси мелкодисперсного кремнезема с гидрооксидом калия фильтруют, к фильтрату добавляют раствор соли алюминия, имеющей анион кислоты более сильной чем поликремневая кислота», обеспечивают получение нанодисперсного аналога природного алюмосиликата - микроклина (материала с формулой KAlSi3O8 в пересчете на безводный материал). Кроме того, обеспечивается возможность варьирования сырьевой базой при получении сорбента. Причем температурное воздействие на реакционную смесь на этой стадии вообще не является необходимым, поскольку реакция на заключительном этапе может осуществляться при комнатной температуре.
Признаки, указывающие, что «перемешивают реакционную смесь, выдерживают в течение 10-180 минут до обеспечения нейтрального pH,» задают основной критерий продолжительности реакционного процесса, определяющий факт получения нанодисперсного сорбента - аналога микроклина.
Признаки, указывающие, что «отделяют образовавшийся осадок, подвергают его промывке и обезвоживанию», обеспечивают получение сорбента в порошковой форме, оптимальной для хранения и повышают эффективность работы сорбента за счет удаления солей калия (кроме целевого продукта).
Признаки, указывающие, что исходные компоненты смешивают в соотношении, обеспечивающем получение материала с формулой KAlSi3O8 в пересчете на безводный материал» обеспечивают максимально эффективное и полное использование реагента и позволяют минимизировать затраты материалов, времени и энергии на, отмывку осадка от солей калия.
Признаки второго пункта формулы обеспечивают возможность эффективного обезвоживания готового продукта.
Признаки третьего пункта формулы обеспечивают высокую дисперсность сорбента, что обеспечивает высокую скорость его «срабатывания» фактически за период времени необходимый для равномерного распределения сорбента по всем точкам объема раствора, кроме того, позволяет сократить по времени технологический цикл производства сорбента.
Заявленный способ иллюстрируется графическими материалами, где на фиг.1 показаны графики инфракрасных спектров синтезированного сорбента; на фиг.2 показана ренгенограмма образца сорбента после отжига 1100°C; на фиг.3 показана термограмма синтезированного сорбента; на фиг.4-5, даны изображения образца синтезированного сорбента, полученные методом сканирующей просвечивающей микроскопии при различных увеличениях; на фиг.6-7, даны изображения образца синтезированного сорбента, полученные методом электронной сканирующей микроскопии при различных увеличениях; на фиг.8 показан энергодисперсионный спектр образца синтезированного сорбента после сорбции ионов цезия; на фиг.9 показана изотерма сорбции ионов цезия из водного раствора карбоната цезия.
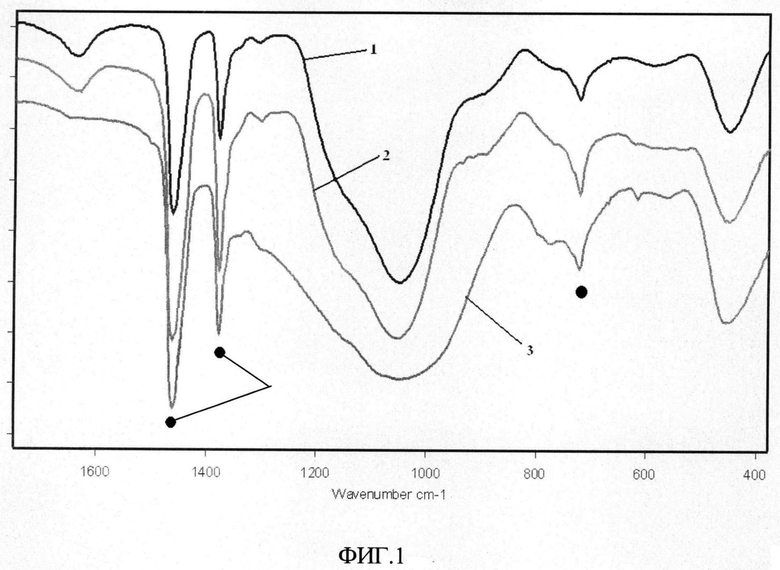
На чертежах показаны графики инфракрасных спектров синтезированного сорбента 1, 2, 3, соответственно исходного образца, образца после сорбции ионов цезия и - после отжига исходного образца до 1100°C, 4 - пики, относящиеся к вазелиновому маслу.
В качестве реагентов для получения синтетического сорбента были использованы реактивы гидроокись калия ГОСТ 2463-80 ХЧ изготовитель Франция и мелкодисперсный кремнезем (Микрокремнезем конденсированный - ТУ 5743-048-02495332-96) марки МКУ-85. Кроме того используют растворимую алюмосодержащую соль кислоты более сильной чем поликремневая.
Раствор растворимой алюмосодержащей соли кислоты более сильной чем поликремневая готовили из расчета получения ее концентрации, как минимум в 2 раза ниже концентрации насыщенных растворов.
Раствор KOH готовили из расчета 4 грамм моля реактива на 0,5 литра дистиллированной воды.
Далее готовили суспензию KOH и кремнезема, для чего в реакционный сосуд вводили раствор KOH и навеску кремнезема, таким образом, в объем, содержащий 0,5 литра дистиллированной воды и 4 грамм·моля KOH добавляли мелкодисперсный кремнезем, из расчета, чтобы его количество в пересчете на чистый диоксид кремния составляло 3 грамм·моля.
Далее реакционный сосуд вводили в автоклав и названную смесь известным образом подвергали гидротермальной обработке в течение около 2-3 часов, при температуре не менее 120°C. Чем выше температура процесса и выше дисперсность кремнезема, тем процесс менее продолжителен.
По завершению этого процесса из автоклавированной смеси образуются растворимые формы силиката калия с отношением K2O к SiO2 как 2:3. Далее этот раствор фильтруют известным образом, убирая из него взвесь балластных материалов - примесей, присутствующих в кремнеземе.
Затем фильтрат - продукт вышеназванной реакции смешивают, перемешивая с раствором алюмосодержащей растворимой соли кислоты более сильной, чем поликремневая и выдерживают при комнатной температуре до получения нейтрального pH (не более 4 часов). Затем, известным образом (фильтрацией) отделяют осадок, отмывают дистиллированной водой от солей калия с последующим его обезвоживанием (центрифугированием и/или сушкой при температуре 95-105°C).
Соотношение компонентов при синтезе принимают из расчета получения материала с формулой KAlSi3O8 в пересчете на безводный материал.
Пример 1. Для синтеза сорбента - аналога природного микроклина, в качестве растворимой алюмосодержащей соли кислоты более сильной чем поликремневая, используют Al2(SO4)3 18H2O, марки Ч ГОСТ 3758-75. Остальные компоненты соответствуют вышеописанным. Их соотношение при синтезе принимают из расчета получения материала с формулой KAlSi3O8 в пересчете на безводный материал. Этап получения раствора силиката калия с отношением K2O к SiO2 как 2:3 соответствует вышеописанному.
Таким образом процесс синтеза сорбента протекает по формуле:
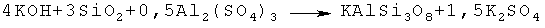
Раствор Al2(SO4)3·18H2O готовили из расчета 0,5 моля Al2(SO4)3 на объем дистиллированной воды в котором концентрация солей, как минимум в 2 раза ниже концентрации насыщенных растворов. Процесс его приготовления осуществляют при комнатной температуре.
Затем фильтрат - продукт первого этапа (растворимые формы силиката калия с отношением K2O к SiO2 как 2:3) смешивают (перемешивая), с раствором Al2(SO4)3 и выдерживают (порядка 10 минут) при комнатной температуре до получения нейтрального pH. Затем, фильтрацией отделяют осадок, известным образом отмывают дистиллированной водой от солей калия и обезвоживают (центрифугированием и последующей сушкой при температуре 95°C).
В результате получают сорбент с частицами крупностью 6-10 нм.
Пример 2. Процесс синтеза сорбента осуществляют также как в примере 1, но продукт первого этапа в смеси с раствором Al2(SO4)3 выдерживают 120 минут, что позволяет получить сорбент с частицами крупностью 12-22 нм.
Пример 3. Процесс синтеза сорбента осуществляют также как в примере 1, но продукт первого этапа в смеси с раствором Al2(SO4)3 выдерживают 180 минут, что позволяет получить сорбент с частицами крупностью 25-40 нм.
Пример 4. Для синтеза сорбента - аналога природного микроклина, в качестве растворимой алюмосодержащей соли кислоты более сильной чем поликремневая, используют Al(NO3)3 9H2O, ГОСТ 3757-75. Остальные компоненты соответствуют вышеописанным. Этап получения раствора аморфного кремнезема в гидрооксиде калия с отношением K2O к SiO2 как 2:3 соответствует вышеописанному. Таким образом процесс синтеза сорбента протекает по формуле:
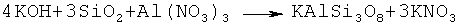
Раствор Al(NO3)3 9H2O готовили из расчета 1 моля Al(NO3)3 на объем дистиллированной воды в котором концентрация солей, как минимум в 2 раза ниже концентрации насыщенных растворов. Процесс его * приготовления осуществляют при комнатной температуре.
Затем фильтрат - продукт первого этапа (растворимые формы силиката калия с отношением K2O к SiO2 как 2:3) смешивают (перемешивая), с раствором Al(NO3)3 и выдерживают (порядка 10 минут) при комнатной температуре до получения нейтрального pH. Затем, фильтрацией отделяют осадок, известным образом отмывают дистиллированной водой от солей калия и обезвоживают (центрифугированием и последующей сушкой при температуре 95°C). В результате получают сорбент с частицами крупностью до 10 нм.
Пример 5. Процесс синтеза сорбента осуществляют также, как в примере 4, но продукт первого этапа в смеси с раствором Al(NO3)3 выдерживают 180 минут, что позволяет получить сорбент с частицами крупностью 25-40 нм.
Пример 6. Для синтеза сорбента - аналога природного микроклина, в качестве растворимой алюмосодержащей соли кислоты более сильной чем поликремневая, используют алюмокалиевые квасцы - AlK (SO4)2·12H2O, ГОСТ 4329-77. Остальные компоненты соответствуют вышеописанным. Этап получения раствора аморфного кремнезема в гидрооксиде калия с отношением K2O к SiO2 как 2:3 соответствует вышеописанному. Таким образом процесс синтеза сорбента протекает по формуле:
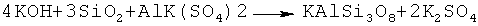
Раствор AlK(SO4)2·12H2O готовили при комнатной температуре из расчета 1 моля AlK(SO4)2·на объем дистиллированной воды в котором концентрация солей, как минимум в двое ниже концентрации насыщенных растворов.
Затем фильтрат - продукт первого этапа (растворимые формы силиката калия с отношением K2O к SiO2 как 2:3) смешивают (перемешивая), с раствором AlK (SO4)2 и выдерживают (порядка 10 минут) при комнатной температуре до получения нейтрального pH. Затем, фильтрацией отделяют осадок, известным образом отмывают дистиллированной водой от солей калия и обезвоживают (центрифугированием и последующей сушкой при температуре 95°C). В результате получают сорбент с частицами крупностью до 10 нм.
Пример 7. Процесс синтеза сорбента осуществляют также, как в примере 4, но продукт первого этапа в смеси с раствором AlK(SO4)2 выдерживают 180 минут, что позволяет получить сорбент с частицами - крупностью 30-40 нм.
Приведенные примеры не исчерпывают возможных вариантов реализации способа, а иллюстрируют возможность релизации признака, указывающего на использование «растворимой алюмосодержащей соли кислоты более сильной чем поликремневая» и возможность получения сорбента с частицами разной крупности.
Элементный анализ синтезированного сорбента выполнен с использованием метода рентгенофлюоресцентного анализа на энергодисперсионном рентгенофлюоресцентном спектрометре Shimadzu EDX-800-HS (Япония). Порошок сорбента смешивали с мелкодисперсным тефлоном (2:1 по весу), смесь прессовали при давлении 5000 кг., диаметр таблетки 20 мм. Содержание химических элементов в образце без учета кислорода в %: Si - 48,22; Fe - 0,10; K - 34,91; Al - 16,34; Ti - 0,307; S - 0,108. Содержание KAlSi3O8 в образце по расчетным данным составляет 99,72%.
Удельную поверхность сорбента (SУД) измеряли методом низкотемпературной адсорбции N2 с использованием прибора Сорбометр-М (производство ЗАО КАТАКОН, Новосибирск). SУД равна 105-110 м2/г.
Инфракрасные-спектры (далее - ИК-спектры) образцов снимали в области 400-4000 см-1 на Фурье-спектрометре Shimadzu FTIR Prestige-21 при комнатной температуре в вазелиновом масле (рис.1). Фиксируется размытая полоса в области 850-1300 см-1 и полосы при 457 и 561 см-1. Широкая полоса с максимумом при 1048 см-1 характерна для валентных колебаний открытых и циклических цепей тетраэдров кремнекислородных каркасов Si-O-Si. Низкочастотные полосы 457 см-1 и 561 см-1 характерны для деформационных колебаний Si-O-Si. Для связи Si-O-Al должны быть полосы в области 900-1000 см-1 и в этом же интервале частот проявляются связи Si-OH. Различие в ИК-спектрах образцов сорбента с цезием после сорбции с исходными незначительно.
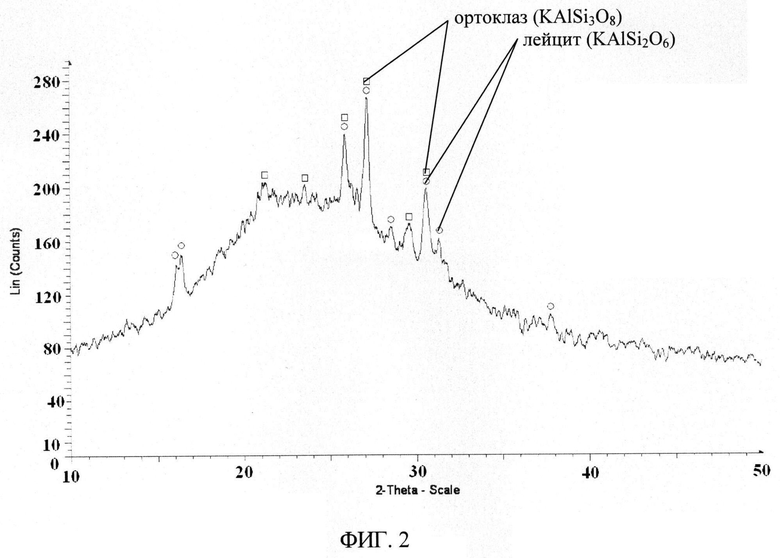
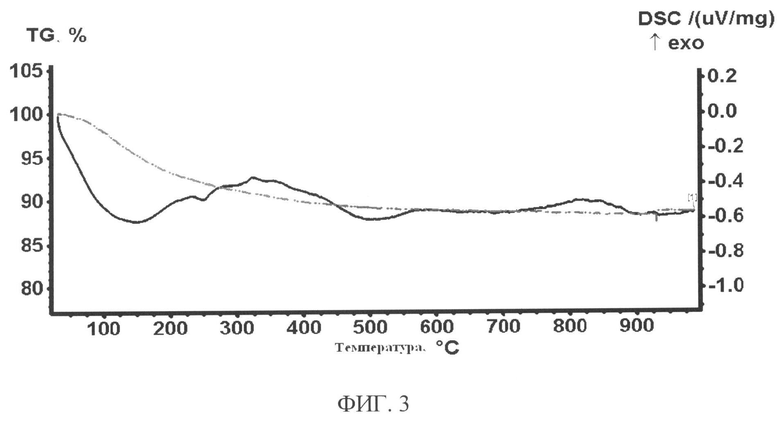
Рентгенограммы сорбента снимали на автоматическом дифрактометре D8 ADVANCE с вращением образца в Cu K. - излучении. Рентгенофазовый анализ (РФА) проводили с использованием программы поиска EVA с банком порошковых данных PDF-2. На рентгенограммах образцов исходного и отожженного при 1100°C в течении двух часов регистрируется размытый пик, характерный для аморфных веществ в диапазоне углов 15-35 фиг.2. Для отожженного образца на фоне размытого пика регистрируются пики, отнесенные к минералам лейциту (KAlSi2O8) и ортоклазу (KAlSi3O8). Ортоклаз при температуре 1150°C разрушается с образованием лейцита и кремнезема. Для рентгеноаморфного исходного образца, по-видимому, этот процесс происходит при более низких температурах или это связано с точностью определения температуры отжига. Если судить по термограмме образца сорбента, снятой на приборе совмещенного термического анализа STA-449-C NETZSH в атмосфере аргона со скоростью 1 О/мин до 1000°C - фиг.3, в диапазоне температур 20-500°C потеря массы образца составляет (8-10)% и это связано с удалением воды, что подтверждается данными по ИК-спектрам. Исходя из данных по элементному составу, ИК-спектрам, термического анализа для синтезированного сорбента следует предложить формулу KAlSi3O8 ~ H2O.
Для определения сорбционных характеристик сорбента были приготовлены водные растворы карбоната цезия с концентрациями ионов Cs+ от 0,05-30 ммоль/л. В серию пробирок помещали навески сорбента по 50 мг, заливали их 20 мл водного раствора карбоната цезия различной концентрации (Т:Ж=1:400) и встряхивали в течение 3 часов. В качестве контрольного опыта навеску сорбента помещали в пробирку с дистиллированной водой и перемешивали параллельно с исследуемыми пробами. Проведены измерения pH растворов до и после сорбции (табл.1).
В образцах сорбента исходных и после сорбции определяли элементный состав на энергодисперсионном спектрометре Therma Scientific. Исследование морфологии синтезированного сорбента проводили на электронном сканирующем микроскопе высокого разрешения Hitachi S 5500 снабженном приставкой для сканирующей просвечивающей микроскопии.
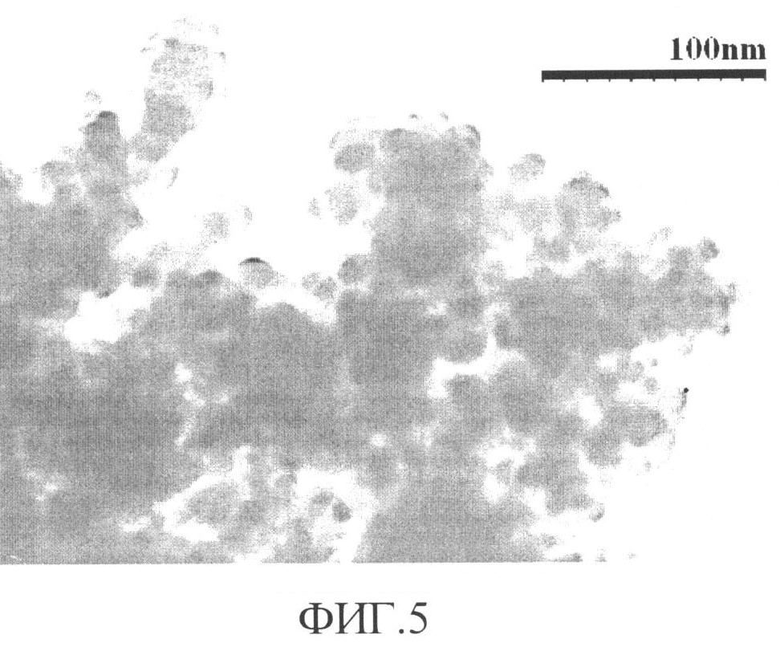
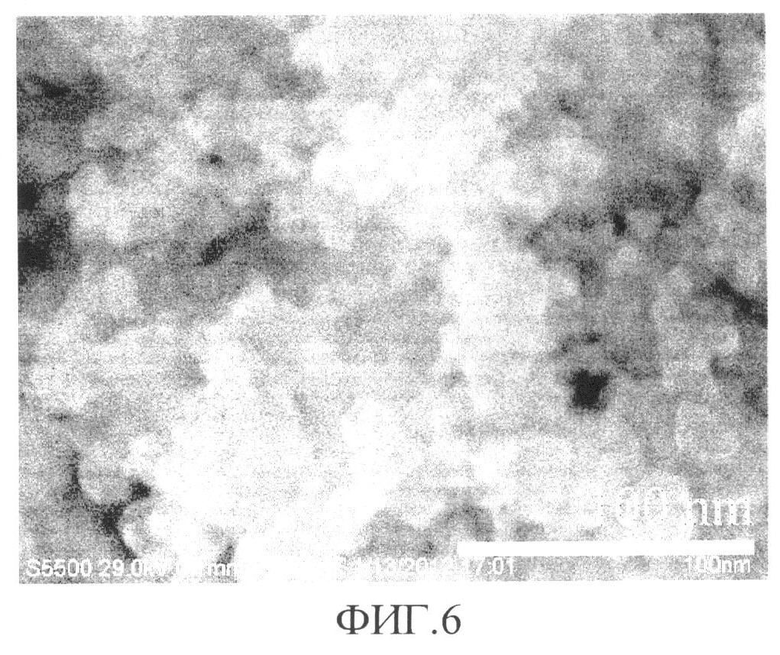
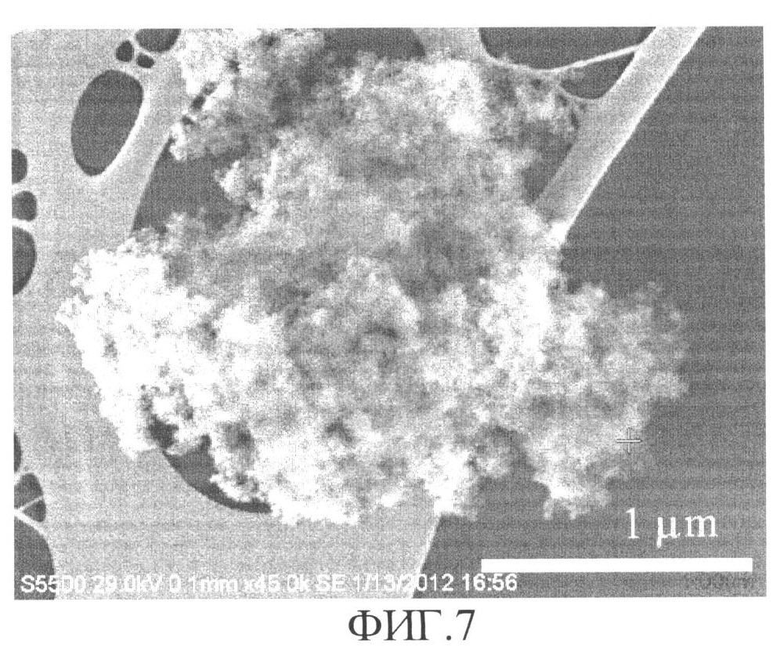
Установлено, что синтезированный сорбент состоит из агломератов сфероподобных наночастиц диаметром 10-20 нм (фиг.4). Поперечные размеры агломератов в пределах 50 нм (фиг.5). Сорбент имеет многоуровневое пористое строение с размерами пор от 1 (фиг.6) до 100 нм (фиг.4 и фиг.7) Наночастицы имеют блочное строение с размером блоков около 1 нм, (фиг.4). Такое строение сорбента способствует формированию большой активной поверхности для прохождения процессов сорбции.
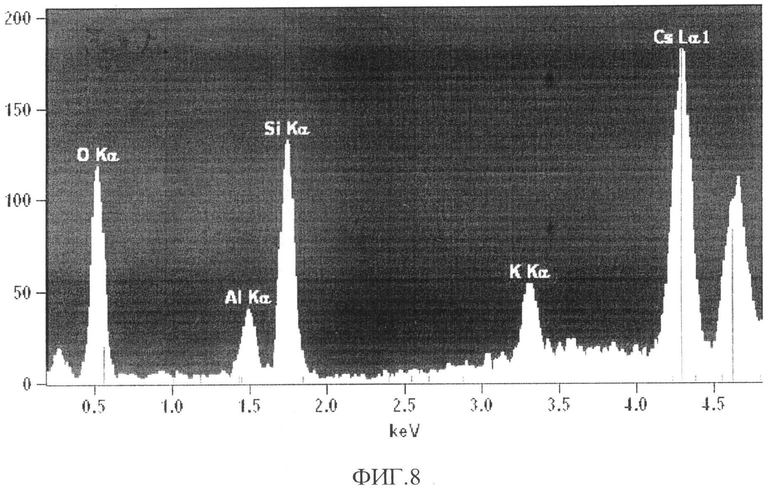
В образцах сорбента после сорбции концентрация ионов цезия достигает 60% (фиг.8, табл.2). Содержание элементов в образце сорбента после сорбции из водного раствора с концентрацией Cs+ 28,5 ммоль/л дано в табл.2.
Если исходить только из элементного анализа исходного образца, t состав которого соответствует минералу микроклину (KAlSi3O8), то при 100% замещении ионов калия на ионы цезия максимальная сорбционная емкость сорбента должна быть в пределах 3,5 ммоль/г (465 мг/г).
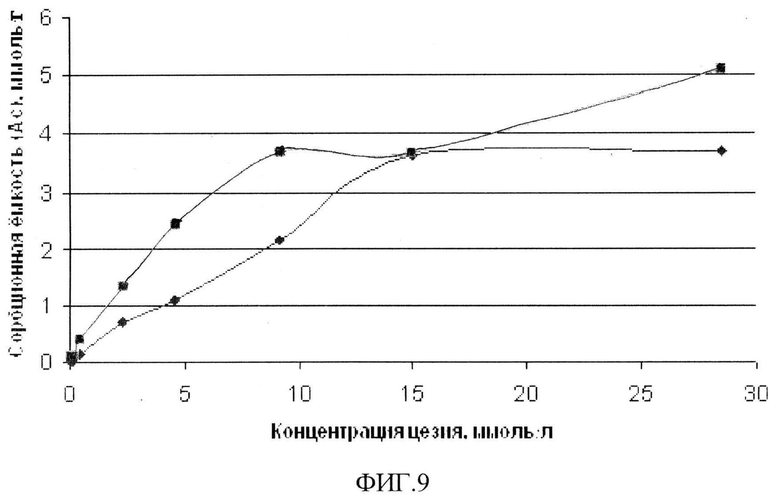
В табл.3 представлены экспериментальные данные по сорбции сорбентом ионов цезия из водных растворов карбоната цезия с различной концентрацией. Из изотермы сорбции (фиг.9) следует, что предельное значение сорбционной емкости Ам сорбента равно ~3,6 ммоль/г.
Для определения кинетических параметров процесса сорбции сорбента были приготовлены пробирки с объемом раствора цезия по 20 мл с начальной концентрацией 36,43 мг/л (0,2739 м моль/л) с массой сорбента по 0,05 г (Т:Ж=1:400), время встряхивания: 15; 30; 60; 120 минут Определены концентрации ионов цезия после сорбции. Как следует из экспериментальных данных через 15 минут сорбции из раствора извлекается более 96% ионов цезия, а за 120 минут - до 97,5%.
Т.к. процесс сорбции происходит довольно быстро и при выбранном соотношении твердое:жидкое (Т:Ж) как 1:400, и исходной концентрации ионов цезия в растворе равной 0,2739 ммоль/л через 15 минут из раствора извлекается более 90% цезия, был проведен эксперимент с начальной концентрацией цезия в растворе равной 0,83 ммоль/л, а время сорбции сокращено до 1, 2 и 3 минут. Через минуту сорбции (не учитывая время фильтрации, которое составляет несколько минут) из раствора извлекается более 86% цезия.
В табл.4 представлены данные по коэффициенту межфазного распределения (Kd) и степени извлечения цезия при различном соотношении Т:Ж из растворов с исходной концентрацией ионов цезия 0,25 ммоль/л.
Условия проведения экспериментов: время встряхивания водных растворов 3 часа, фильтрация через бумажный фильтр синяя лента. Как следует из полученных данных максимальное значение Kd более 105.
Из полученных экспериментальных данных следует, что синтезированное рентгеноаморфное вещество с наноразмерными, сфероподобными частицами диаметром 10-20 нм является высокоэффективным сорбентом ионов цезия с высокой сорбционной емкостью Ам~3,6 ммоль/г из растворов солей этого элемента в дистилляте и может быть использовано не только для извлечения ионов цезия из водных растворов, но и для детоксикации живых организмов при радиохимическом заражении.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ СОРБЕНТА ЦЕЗИЯ | 2012 |
|
RU2516639C2 |
| Способ получения наноструктурированного рентгеноаморфного сорбента цезия | 2023 |
|
RU2831541C1 |
| Способ получения магнитного композиционного сорбента | 2022 |
|
RU2826365C2 |
| Фильтрующий материал для очистки воды от радионуклидов и способ его получения | 2021 |
|
RU2777359C1 |
| Способ получения алюмосиликатного сорбента | 2022 |
|
RU2825254C2 |
| Способ получения барийсодержащего алюмосиликатного сорбента с использованием растительного сырья | 2022 |
|
RU2787778C1 |
| СПОСОБ ПОЛУЧЕНИЯ СОРБЕНТА НА ОСНОВЕ МИКРОСФЕР ЗОЛ-УНОСА ДЛЯ ОЧИСТКИ ЖИДКИХ РАДИОАКТИВНЫХ ОТХОДОВ (ВАРИАНТЫ) | 2012 |
|
RU2501603C1 |
| Сорбент для извлечения ионов переходных металлов из растворов и хроматографии | 1987 |
|
SU1437776A1 |
| Способ получения сорбента для извлечения ионов металлов из растворов | 1988 |
|
SU1590096A1 |
| Способ получения сорбента для извлечения ионов цезия | 2018 |
|
RU2701530C1 |

Изобретение относится к получению сорбентов, используемых для детоксикации организмов животных и человека при радиохимическом заражении цезием. Смешивают мелкодисперсный кремнезем с водным раствором гидрооксида калия и смесь подвергают гидротермальной обработке при температуре не менее 120°C в течение 2-3 часов. После фильтрования к фильтрату добавляют раствор соли алюминия, которая имеет анион кислоты более сильной, чем поликремневая кислота. Указанные выше исходные компоненты берут в соотношении, обеспечивающем получение материала с формулой KAlSi3O8. Реакционную смесь выдерживают в течение 10-180 минут до обеспечения нейтрального pH. Образовавшийся осадок подвергают промывке и обезвоживанию. Изобретение обеспечивает получение сорбента с высокой емкостью и стабильными рабочими параметрами. 2 з.п. ф-лы, 9 ил., 4 табл., 6 пр.
1. Способ получения сорбента цезия в виде частиц аналога природного микроклина, заключающийся в том, что смешивают мелкодисперсный кремнезем с водным раствором гидрооксида калия, смесь подвергают гидротермальной обработке при температуре не менее 120°C в течение 2-3 ч, производят фильтрацию, к фильтрату добавляют раствор соли алюминия, имеющей анион кислоты более сильной, чем поликремневая кислота, перемешивают реакционную смесь, выдерживают в течение 10-180 мин до обеспечения нейтрального pH, отделяют образовавшийся осадок, подвергают его промывке и обезвоживанию, при этом исходные компоненты смешивают в соотношении, обеспечивающем получение материала с формулой KAlSi3O8 в пересчете на безводный материал.
2. Способ по п.1, отличающийся тем, что обезвоживание осадка включает его центрифугирование и/или сушку при температуре 95-105°C.
3. Способ по п.1, отличающийся тем, что аналог природного микроклина получают с крупностью частиц размером предпочтительно 10-20 нм.
| УСТРОЙСТВО ДЛЯ РЕГУЛИРОВАНИЯ ВОДОПОТРЕБЛЕНИЯ | 2001 |
|
RU2218558C2 |
| ЩИТОВОЙ ДЛЯ ВОДОЕМОВ ЗАТВОР | 1922 |
|
SU2000A1 |
| КОВАЛЬСКИЙ A.M | |||
| Термодинамические свойства твердых растворов Sr,Ba,Rb-содержащих полевых шпатов: экспериментальное исследование и прикладные аспекты: Автореферат дисс | |||
| на соиск | |||
| уч | |||
| степ | |||
| канд | |||
| геол.-мин | |||
| наук | |||
| - М., 2002 | |||
| АРАНСИБИЯ ЛЬЯНО НОРМАН ЭДУАРДО | |||
| Геокерамические матрицы для | |||
Авторы
Даты
2014-03-27—Публикация
2012-09-06—Подача