ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к области биотехнологии, конкретно касается получения стероидного соединения андроста-4,9(11)-диен-3,17-диона из фитостерина и может быть использовано в биотехнологической и химико-фармацевтической отраслях промышленности для производства стероидных препаратов.
УРОВЕНЬ ТЕХНИКИ
Андроста-4,9(11)-диен-3,17-дион (Δ9(11)-АД, 9(11)-дегидроандростендион, CAS 1035-69-4) является ключевым соединением в синтезе кортикостероидных препаратов из стеринов, например таких, как гидрокортизон, преднизолон, а также их 9-галоид-производных (например, кортинеф, 9-фторпреднизолон и т.п.), и препаратов, имеющих также заместители при С16, в частности, алкильные группы и гидроксильные группы (например, триамцинолон, дексаметазон, бетаметазон, мометазон и т.п.) [V. vanRheenen, K.P. Shepard, J. Org. Chem., 1979, 44(9), 1582-1584]. Кроме того, Δ9(11)-АД может быть использован в качестве исходного субстрата в синтезе андрогенного препарата фтороксиместерона (11β-гидрокси-9α-фтор-17α-метилтестостерон, CAS 76-43-7) [CN 102040639, 2011], применяемого для лечения, например, себореи [MXNL05000077, 2007], рака молочной железы [WO 0040230, 2000].
Способы получения Δ9(11)-АД известны.
Так, описан способ полного синтеза Δ9(11)-АД, исходя из (1S, 7aS)-1-t-бутокси-7a-метил-5,6,7,7a-тетрагидроиндан-5-она [U. Eder, G. Sauer, G. Haffer, J. Ruppert, R.Wiechert, A. Furst, and W. Meier. Helvetica Chimica Acta, 1976, 59(4), 999-1005]. Недостатком этого метода является многостадийность, низкий выход продукта (27,8%), применение хроматографической очистки интермедиатов и продукта, использование дорогостоящих реагентов, а также реагентов, применение которых в промышленном производстве представляет серьезную опасность.

Кроме этого известны методы получения Δ9(11)-АД дегидратацией стероидных спиртов, конкретно производных андрост-4-ен-3,17-диона (АД), содержащих гидроксильную группу при атоме С9 или С11 (в 11α- или 11β-конфигурации). Следует отметить, что в мультистадийных синтезах стероидных препаратов модификацией 17-кетогруппы гидроксилсодержащих производных АД предварительно проводят дегидратацию гидроксильной группы с образованием Δ9(11)-АД, у которого 9,11-двойная связь более стабильна в условиях последующих реакций, чем гидроксильная группа при С11. Так, например, в синтезе фтороксиместерона на первом этапе получают Δ9(11)-АД дегидратацией 11α-гидроксиандрост-4-ен-3,17-диона [CN 102040639, 2011].
Известны способы получения Δ9(11)-АД дегидратацией 11β-гидроксиандрост-4-ен-3,17-диона: в условиях кетализации [Q. Zhao, Zh. Li. Synthetic Communications, 1993, 23(10), 1473-1478], действием N,N′-тионилдиимидазола в тетрагидрофуране [S. Solyom, K. Szilágyi, L. Toldy. Journal für Praktische Chemie, 1988, 330 (2), 309-312] или SO2 в пиридине [GB1081307, 1967, пример 2]. Однако выход Δ9(11)-АД не превышает 45-50% в двух первых и 77,3% в последнем варианте.
В синтезе кортикостероидной цепи на основе 17-кетогруппы 9α-гидроксиандрост-4-ен-3,17-диона (9-ОН-АД) дегидратацию 9α-гидроксигруппы обычно проводят также на первом этапе [J.G. Reid, T. Debiak-Krook, Tetrahedron Lett., 1990, 31(26), 3669-3672], так как образующийся Δ9(11)-АД более стабилен в дальнейшем синтезе. Это позволяет избежать на следующих стадиях синтеза возможных перегруппировок с участием третичной гидроксильной группы при С9, особенно перегруппировок в кольце А [L.Chinn, R. Dodson, J. Org. Chem., 1959, 24 (6), 879].
9-ОН-АД является промежуточным соединением в синтезе Δ9(11)-АД из природных стеринов (холестерина или фитостерина). Слово «фитостерин» обозначает стерины растительного происхождения (β-ситостерин, кампестерин, стигмастерин и др.) или их смеси.
9-ОН-АД получают из фитостерина микробиологической трансформацией методами и культурами микроорганизмов, описанными в литературных источниках.
9-ОН-АД может быть получен двухстадийным биотехнологическим процессом, включающим стадию трансформации стеринов в АД и стадию 9α-гидроксилирования выделенного АД с применением известных методов ([C. Perez, A. Falero, L.H. Duc, et al., J. Ind. Microbiol. Biotechnol., 2006, 33(8), 719-723; Н.В. Родина, М.А. Молчанова,
Н.Е. Войшвилло, В.А. Андрюшина, Т.С. Стыценко, Прикл. биохим. микробиол., http://elibrary.ru/issues.asp?id=7955&jyear=2008&selid=439695, http://elibrary.ru/issues.asp?id=7955&volume=44&selid=439695(1), 56-62] и [GB862701, 1961; US3065146, 1962; US4397947, 1983; B. Angelova, P. Fernandes, A. Cruz, H.M. Pinheiro, S. Mutafova and J.M.S. Cabra, Enzym. Microb. Tech., 2005, 37(7), 718-722; Н.В. Родина, В.А. Андрюшина, Т.С. Стыценко, Т.П. Турова, Р.В. Баслеров, А.Н. Пантелеева, Н.Е. Войшвилло, Прикл. биохим. микробиол., http://elibrary.ru/issues.asp?id=7955&jyear=2008&selid=439695, http://elibrary.ru/issues.asp?id=7955&volume=44&selid=439695(4), 439-445; RU2351645, 2009] соответственно).

где R=C2H5 - β-ситостерин; R=CH3 - кампестерин; R=C2H5 и ∆22(23) - стигмастерин)
Также известен одностадийный двухступенчатый микробиологический процесс, состоящий в последовательном использовании стеринтрансформирующего штамма и 9α-гидроксилирующей культуры без выделения промежуточно-образованного продукта деградации боковой цепи - андростендиона (АД) - из культуральной жидкости [B.А. Андрюшина, Н.В. Родина, Т.С. Стыценко, Лью Дук Хи,
А.В. Дружинина, В.В. Ядерец, Н.Е. Войшвилло, Прикл. биохим. микробиол., 2011, 47(3), 297-301].
Известны одностадийные методы микробиологической трансформации фитостерина в 9-ОН-АД [M .G. Wovcha, F. J. Antosz, J. C. Knight, L. A. Kominek, and
T. R. Pyke, Biochim. Biophs. Acta, 1978, 539, 308; US4035236, 1977; US4175006, 1979; US4397946, 1983; DD298278, 1992; DD298279, 1992; RU2077590, 1997; M.V. Donova, S.A. Gulevskaya, D.V., Dovbnya, I.F. Puntus, Appl. Microbiol. Biotechnol., 2005, 67(5), 671-678; M.V. Donova, D.V., Dovbnya, G.V. Sukhodolskaya, S.M. Khomutov V.M. Nikolayeva, I. Kwon, K. Han, J. Chem. Technol. Biotechnol., 2005, 80, 55-60 и др.].
Известно, что эффективность микробиологического способа получения 9-ОН-АД трансформацией стеринов зависит также и от эффективности метода извлечения 9-ОН-АД из культуральной жидкости. Обычно степень извлечения продукта трансформации составляет от 70 до 90%.
Например, известен способ [US 4035236, 1977], согласно которому трансформацию фитостерина в 9-ОН-АД проводят клетками бактерий Mycobacterium fortuitum NRRL B-8119 с нагрузкой исходного субстрата 10 г/л. Клетки культуры после проведения трансформации отделяют, экстрагируют растворителем (смешиваемым или несмешиваемым с водой). Культуральную жидкость, свободную от клеток, экстрагируют несмешиваемым с водой органическим растворителем, например хлористым метиленом (пример 2). Экстракт фильтруют через кизельгур и упаривают в вакууме досуха. Остаток растворяют в смеси метанола и хлороформа, концентрируют в токе азота на паровой бане до начала кристаллизации. После охлаждения остатка до комнатной температуры осадок нетрансформированного стерина отфильтровывают (например, ситостерина, пример 2). Из супернатанта после упаривания растворителя получают круд 9-ОН-АД, в котором присутствуют следы примеси 17-гидрокси-производного. Дополнительное количество 9-ОН-АД может быть получено из маточного раствора дополнительной обработкой.
Также известен способ получения 9-ОН-АД из фитостерина [GB 2197869, 1988] с нагрузкой субстрата 20 г/л, согласно которому клетки бактерий после ферментации отделяют, продукт смывают с клеток метанолом. Дополнительное количество 9-ОН-АД извлекают из надосадочной жидкости экстракцией после отделения продуктов неполного окисления боковой цепи стеринов. Очистку 9-ОН-АД проводят хроматографированием на колонке с силикагелем. Из 15,1 г круда 9-ОН-АД получают всего 5,7 г очищенного продукта.
Известен метод селективного выделения, очистки и разделения моногидроксилированных 3,17-дикетостероидных соединений из раствора, полученного микробиологическим способом, содержащего смесь стероидных соединений, путем экстракции, очистки и селективной кристаллизации [WO 2008032131, 2008]. В примере 4 описано выделение 9-ОН-АД, полученного биотрансформацией β-ситостерина культурой Mycobacterium fortuitum NRRL B-8119 с нагрузкой исходного субстрата 30 г/л в условиях патента [US 40635236, 1977]. При этом согласно ВЭЖХ анализу, содержание 9-ОН-АД в культуральной жидкости по окончании трансформации составляет 12 г/л: 1,5 г/л из этого количества находится в жидкой фазе, а остальное - на поверхности отфильтрованной биомассы. После раздельного извлечения продукта из биомассы и экстракции из надосадочной жидкости, последующей очистки и кристаллизации, 9-ОН-АД получен с содержанием основного вещества 95,6% и выходом 92%, считая на содержание в культуральной жидкости (степень извлечения, таким образом, 88%).
Известен способ получения и выделения 9-ОН-АД [DD 298279, 1992], заключающийся в проведении микробиологической трансформации стеринов культурой Mycobacterium vaccae ZIMET 11053 с нагрузкой 10 г/л в присутствии адсорбционного полимера (сополимера дивинилбензола и этилстирола).
Кроме этого описан аналогичный способ выделения 9-OH-АД из культуральной жидкости, полученной при трансформации ситостерина клетками Mycobacterium sp. 207 при нагрузке субстрата 5 г/л в присутствии синтетической смолы, являющейся модифицированным сополимером этилстирола и дивинилбензола (Porolas)
[Е.А. Борман, Ю.А. Редикюльцев, К.А. Кощеенко, А.М. Турута, А.В. Камерницкий, Прикл. Биохим. Микробиол., 1992, 28 (4), 551-56]. Способ предусматривает отделение смолы с адсорбированным продуктом, промывку, элюирование 9-ОН-АД этилацетатом, упаривание и кристаллизацию. Выход на стадии выделения - около 70%.
Так как ферментация проходит в присутствии адсорбента, основным недостатком этих методов получения 9-ОН-АД из стеринов является необходимость использования специального оборудования для предотвращения разрушения смолы при перемешивании и обеспечения эффективного массообмена между полимерной смолой и стероидным продуктом. Это ограничивает масштабирование и практическое использование подобных процессов.
Из вышеизложенного очевидно, что способы извлечения 9-ОН-АД из ферментационной среды сложны, многоступенчаты и не обходятся без существенных потерь основного вещества.
Способы получения Δ9(11)-АД дегидратацией 9-ОН-АД известны. Особенностью дегидратации 9-ОН-АД является возможность образования нежелательного изомера андроста-4,8(9)-диен-3,17-диона (Δ8(9)-АД).

При этом изомерные ∆9(11)- и ∆8(9)-олефины имеют одинаковое значение Rf на ТСХ и не могут быть разделены кристаллизацией. Определение примеси ∆8(9)-изомера может быть проведено, например, спектроскопически (1Н ЯМР, 13С ЯМР) [EP 0253415, 1988; EP 0294911, 1988] или хроматографически (ВЭЖХ [EP 0253415, 1988; EP 0294911, 1988] , ГЖХ [US 4102907, 1978]).
В качестве дегидратирующего агента используют минеральные и органические кислоты, ангидриды и хлорангидриды минеральных и органических кислот, а также другие реагенты.
Реакция дегидратации 9-ОН-АД с образованием ∆9(11)-АД может быть проведена или в среде дегидратирующего агента без использования растворителя, или в среде органического растворителя.
Сочетанием существенных признаков по заявляемому изобретению является проведение реакции дегидратации 9-ОН-АД с образованием ∆9(11)-АД в среде инертного апротонного органического растворителя, конкретно, в среде ароматического углеводорода (например, бензола, толуола) или хлорсодержащего углеводорода (например, дихлорметана, дихлорэтана, хлороформа), с применением в качестве дегидратирующего агента минеральной кислоты, в том числе содержащей воду, конкретно, ортофосфорной или хлорной кислоты.
Известны способы проведения дегидратации 9-ОН-АД с образованием ∆9(11)-АД в среде органического растворителя. При этом известно, что в качестве среды могут быть использованы хлорсодержащие углеводороды, ароматические углеводороды, циклические эфиры, органические основания.
Известен способ проведения дегидратации 9-ОН-АД в среде циклического эфира, в частности тетрагидрофурана (ТГФ).
Так, известно проведение дегидратации 9-ОН-АД действием N,N1-тионил-диимидазола, образующегося из тионилхлорида и имидазола, в среде ТГФ [S. Solyom, K. Szilágyi, L. Toldy, Journal für Praktische Chemie, 1988, 330(2), 309-312]. Продукт получают с выходом 93%. Однако реакция проходит неселективно: образуется смесь изомеров Δ9(11)-АД и Δ8(9)-АД в соотношении 69:31. Причем на их соотношение, как отмечено авторами, не влияет изменение ни температурного режима, ни природы растворителя.
Известны способы проведения дегидратации 9-ОН-АД с образованием ∆9(11)-АД в среде органического основания.
В статье [C.G. Bergstrom, R.T. Nicholson, R.M. Dodson, J. Org. Chem., 1963, 28(10), 2633-2640] описан способ получения ∆9(11)-АД из 9-ОН-АД действием реагента, образованного из HF и пиридина, содержащего 30% пиридина. Однако в этих условиях происходит образование равновесной смеси, содержащей 9α-фтор-андростендион (9α-фтор-АД).

Другой известный способ получения ∆9(11)-АД - обработка 9-гидроксистероидов, включая и 9-ОН-АД, эквимолярным количеством тионилхлорида в среде органического основания (например, пиридина и триэтиламина) [US 3065146, 1962]. Однако заявлена лишь возможность получения ∆9(11)-АД в общем виде (пример 7) без указания выхода и качества продукта. Использование этих условий, как отмечено в работе [V. VanRheenen, K. P. Shephard, J. Org. Chem., 1979, 44 (9), 1582-1584], не позволяет провести отщепление гидроксильной группы у 9-ОН-АД региоселективно: образуется смесь изомерных продуктов ∆9(11)-АД и ∆8(9)-АД. Так, в патенте [US 4102907, 1978] описано получение ∆9(11)-АД из 9-ОН-АД действием тионилхлорида в среде пиридина (0-5°С, 2 мин). Показано, что в этих условиях происходит образование смеси ∆9(11)-АД и ∆8(9)-АД с содержанием 43,4-55,5% и 43,7-56% соответственно по данным ГЖХ анализа [Preparation 1 - 3]. Неудовлетворительный результат дает использование для дегидратации смеси брома и SO2 в среде пиридина [US 4102907, 1978. Preparation 4 - 5]. Продуктом является смесь ∆9(11)-АД и ∆8(9)-АД с содержанием 50-64,4% и 43,7-50% соответственно по данным ГЖХ анализа.
Известен способ получения ∆9(11)-АД [US 4102907, 1978, п.25 формулы, пример 1] двухстадийным синтезом, включающим 1) сульфинилирование 9α-гидрокси- андростендиона действием фенилсульфинилхлорида с образованием 9-фенилсульфината 9α-гидроксиандростендиона и 2) десульфинилирование 9-фенилсульфината 9α-гидроксиандростендиона нагреванием до 40°С в присутствии силикагеля и п-метил-фенилсульфоновой кислоты (п-толуолсульфокислоты, п-ТСК).
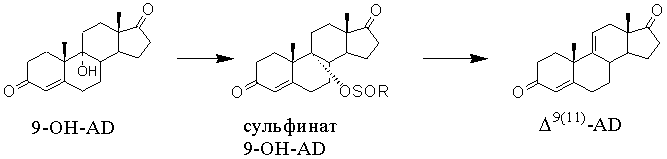
Получение сульфинатного эфира 9-ОН-АД проводят в среде пиридина (10-20ºС), последующее десульфинилирование - в среде хлороформа при температуре кипения в присутствии силикагеля и п-ТСК. При этом максимальный достигаемый выход ∆9(11)-АД с температурой плавления от 191 до 201°С не превышает 91,78%, а содержание побочного ∆8(9)-АД не указано.
Известен способ получения ∆9(11)-АД [US 3005834, 1961, п.6 формулы], который включает контактирование 9-ОН-АД, 11α-гидрокси-АД и 11β-гидрокси-АД в безводных условиях в присутствии пиридина с 1) N-бромацетамидом и 2) безводным диоксидом серы, причем диоксид серы добавляют до полного окисления гидроксильной группы с образованием ∆9(11)-АД. Однако, несмотря на упоминание 9-ОН-АД как исходного соединения в реакции дегидратации с образованием ∆9(11)-АД, пример его использования отсутствует. Поэтому невозможно оценить эффективность этого метода в применении к 9-ОН-АД.
Известны способы проведения дегидратации 9-ОН-АД в среде ароматических углеводородов.
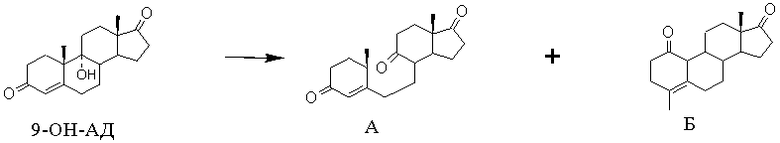
Так, описан способ использования п-толуолсульфокислоты в среде сухого бензола для дегидратации 9-ОН-АД [C.G. Bergstrom and R.M.Dodson, Chem.and Ind., 1961, 1530]. Однако вместо ожидаемого ∆9(11)-АД авторами была получена смесь, содержащая 9,10-секоандрост-4-ен-3,9,17-трион (А) и 9α-гидрокси-4-метилэстр-4-ен-1,17-дион (Б).
Известен способ получения 9(11)-дегидроандростанов дегидратацией соответствующего 9α-гидроксиандростана, характеризующийся тем, что дегидратацию проводят в присутствии ароматической сульфокислоты и силикагеля [EP 0253415, 1988]. Реакцию проводят в среде ароматического углеводорода при температуре кипения раствора стероида, при этом в качестве ароматической сульфокислоты может быть использована п-ТСК или нафталенсульфоновая кислота. Способ характеризуется тем, что предварительно получают адсорбат сульфокислоты (например, адсорбат моногидрата п-ТСК) на силикагеле хроматографического качества. Существенными недостатками этого способа является использование значительного количества силикагеля (более 10-кратного к весу исходного субстрата) и низкий выход продукта: достигаемый максимальный выход ∆9(11)-АД не превышает 65,8%.
Способ получения 9(11)-дегидростероидов рядов андростана и прегнана дегидратацией соответствующего 9α-гидроксистероида описан в патенте [EP0294911, 1988]. Способ характеризуется тем, что дегидратацию проводят в среде инертного органического растворителя в присутствии кислоты Льюиса, выбранной из группы, содержащей хлорид железа, трифторид бора или их комплексы, пентахлорид сурьмы, тетрахлорид титана и смеси этих соединений с силикагелем. Так, пример 1 описывает получение ∆9(11)-АД из 9-ОН-АД указанным способом в среде безводного бензола при температуре кипения действием реагента, образованного из хлорида железа и силикагеля. Продукт не содержит примеси ∆8(9)-АД. Недостатками этого способа являются использование хроматографического способа очистки и низкий выход полученного ∆9(11)-АД (из 0,4 г 9-ОН-АД авторы получили 0,16 г ∆9(11)-АД, что соответствует молярному выходу 42,6%). Пример 3 описывает проведение реакции дегидратации 9-ОН-АД в среде хлористого метилена при комнатной температуре действием пентахлорида сурьмы. Основными недостатками этого варианта являются использование токсичного реагента, крайне низкий выход ∆9(11)-АД (из 604 мг 9-ОН-АД получено 139 мг ∆9(11)-АД, что соответствует молярному выходу 24,5%). Лучший результат получен при использовании комплексов трехфтористого бора в среде бензола (эфирата трехфтористого бора в примере 4 при температуре кипения, комплекса трехфтористого бора с метанолом при комнатной температуре в примере 5 и комплекса трехфтористого бора с уксусной кислотой при температуре кипения в примере 6). Из 3,02 г 9-ОН-АД (пример 4) получено 2,3 г ∆9(11)-АД, что соответствует молярному выходу 81%. При этом температура плавления полученного ∆9(11)-АД составляет 204-205,5°С, что подтверждает чистоту продукта. Выход ∆9(11)-АД в примере 5 составил 92,4%, однако содержание основного вещества - всего 89,5%. Выход ∆9(11)-АД в примере 6 составил 97,5%. Авторами отмечено, что наличие ∆8(9)-изомера не было детектировано (по данным ВЭЖХ). Общим недостатком вариантов, описанных в примерах 4-6, является использование опасного реагента трехфтористого бора, обладающего чрезвычайно высокой коррозионной агрессивностью и токсичностью.
Известен способ получения ∆9(11)-АД дегидратацией 9-ОН-АД хлорсульфоновой кислотой в среде хлорсодержащего углеводорода, конкретно хлористого метилена [US 4127596, 1978, примеры 1-8]. Недостатком способа является то, что хлорсульфоновая кислота, которая должна утилизировать воду, образующуюся при дегидратации 9-гидроксигруппы, тем самым катализируя процесс, реагирует также с водой, которая может присутствовать в органическом растворителе. Кроме того, для предотвращения деструкции 9-ОН-АД или ∆9(11)-АД реакцию проводят при низких температурах (конкретно при температуре от минус 20 до 5°С). Выход ∆9(11)-АД составляет 85% (в примере 1) и ~ 95% (в примерах 2- 7). При проведении реакции при температуре 20-27°С выход ∆9(11)-АД падает до 84,4% (пример 8).
Одним из существенных признаков по настоящему изобретению является использование в качестве дегидратирующего агента минеральной кислоты, в том числе содержащей воду, более конкретно, ортофосфорной или хлорной кислоты.
Известен способ получения ∆9(11)-стероидов ряда андростана, в том числе и ∆9(11)-АД, реакцией 9α-гидроксистероида (в частности, 9-ОН-АД) с неароматической кислородсодержашей кислотой с pKa ≤1,0 [US4127596, 1978]. При этом кислота выбрана из группы: хлорсульфоновая, серная, фосфорная, метансульфоновая, перхлорная и трифторуксусная. Реакцию проводят в среде кислородсодержащей кислоты. Так, например, при использовании водной серной кислоты (смесь 3 частей воды и 7 частей 70% серной кислоты, что соответствует ~55%) получают ∆9(11)-АД с выходом 97,4%. Однако продолжительность реакции не указана, при этом продукт содержит до 1% побочного ∆8(9)-АД. Примеры 12-15 описывают использование метансульфоновой кислоты (МСК). Показано, что наибольший выход ∆9(11)-АД получают при проведении реакции без добавления воды (пример 13, выход 95,6%, продолжительность реакции 80 мин при 25°С). Проведение реакции в среде смеси МСК и воды с увеличением содержания воды увеличивается продолжительность процесса и падает выход ∆9(11)-АД, причем появляется необходимость проведения реакции при более высокой температуре. Так, при объемном соотношении МСК и воды 4:1 продолжительность процесса при 31-39°С составляет 5 ч, выход ∆9(11)-АД - 87,2%, т.пл. 198,5-201°С (пример 12); при объемном соотношении МСК и воды 1:1 продолжительность процесса при температуре от 100 до 60°С составляет 2 ч, выход круда ∆9(11)-АД с т.пл. 170-175°С составляет 75,9% (пример 15), а при объемном соотношении МСК и воды 2:3 продолжительность процесса при 68°С составляет 6 ч, а выход ∆9(11)-АД с т.пл. 186-195°С составляет всего 55,7% (пример 14). Таким образом, недостатком применения МСК является большая продолжительность процесса и значительное снижение выхода и качества ∆9(11)-АД в присутствии воды и при увеличении температуры проведения процесса выше комнатной.
Также известен способ получения ∆9(11)-АД из 9-ОН-АД дегидратацией с полифосфорной кислотой [HUT36138, 1985]. Реакцию проводят в среде полифосфорной кислоты в течение 2 ч 20 мин при температуре 40°С, причем используют ~3-кратное объемное количество кислоты на 1 весовую часть 9-ОН-АД. По окончании реакции реакционную массу разбавляют водой, осадок отфильтровывают. Продукт получен с выходом 98,46% и т.пл. 199-201ºС.
Общим недостатком методов дегидратации в среде дегидратирующего агента, особенно в присутствии воды, является использование большого избытка дегидратирующего агента, большая продолжительность реакции, а также в большинстве случаев необходимость применения колоночной хроматографии для очистки продукта, и как следствие или низкий выход, или неудовлетворительное качество.
Наиболее близким аналогом (прототипом) по одному из существенных признаков заявляемого изобретения, каковым является природа использованного дегидратирующего агента, а именно использование минеральной кислоты, в том числе содержащей воду, более конкретно использование ортофосфорной кислоты или хлорной кислот, является способ получения ∆9(11)-стероидов ряда андростана, в том числе и ∆9(11)-АД, реакцией 9α-гидроксистероида (в частности, 9-ОН-АД) с неароматической кислородсодержащей кислотой с pKa ≤1,0 [US 4127596, 1978, примеры 10-11 и пример 16 соответственно (переиздан как USRE 33364, 1990].
Пример 11 прототипа [US 4127596, 1978] описывает получение ∆9(11)-АД реакцией 9-ОН-АД с 85% фосфорной кислотой, причем фосфорная кислота одновременно служит и дегидратирующим агентом, и средой для проведения реакции. На 1 моль 9-ОН-АД использовано 12,2 моля 85% фосфорной кислоты. Реакционную массу перемешивают при температуре 45-55°С в течение 24 ч. Затем разбавляют водой втрое, осадок отфильтровывают. Получают ∆9(11)-АД с молярным выходом 95,1%. Содержание ∆9(11)-АД в образце не указано. Однако температура плавления полученного продукта всего 193-195°С, что является показателем низкого содержания основного вещества и, вероятно, связано с продолжительным нагреванием реакционной массы. Для специалистов, работающих в области синтеза стероидных соединений, очевидно, что температура плавления является важной характеристикой чистоты стероидных соединений. Известно, что температура плавления ∆9(11)-АД, практически не содержащего примеси, находится в диапазоне от 203 до 206°С (например, 204-205,5°С [EP0294911, 1988]). Кроме этого другим существенным недостатком описанного метода является большая продолжительность процесса. Значительное разбавление реакционной массы фосфорной кислотой (до 73-кратного к исходному стероиду) позволяет сократить продолжительность реакции с 24 ч до 7,5 ч при температуре 35-48°С и получить ∆9(11)-АД с выходом 96,2% [US 4127596, 1978, пример 10]. Хотя температура плавления продукта повышается до 197-201°С, ГЖХ анализ показывает наличие 1% побочного ∆8(9)-АД. Недостатком этого варианта способа является использование большого количества дегидратирующего агента и большая продолжительность процесса.
Пример 16 прототипа [US 4127596, 1978] описывает получение ∆9(11)-АД реакцией 9-ОН-АД с использованием разбавленной хлорной кислоты, причем хлорная кислота одновременно служит и дегидратирующим агентом, и средой для проведения реакции. Реакцию проводят в среде ~28% водной хлорной кислоты (среда представляет собой смесь 5 мл воды и 2 мл 70% хлорной кислоты), причем на 1 моль 9-ОН-АД используют 23,2 моля хлорной кислоты. Метод является крайне неэффективным, так как помимо большой продолжительности процесса (66 ч) при температуре 54°С молярный выход ∆9(11)-АД составляет всего 69,6%.
Общими недостатками способов получения ∆9(11)-АД с применением минеральных кислот, в том числе содержащих воду, использованных при этом в качестве растворяющей среды, в частности, 85% фосфорной кислоты и 28% хлорной кислоты, являются:
• Большое количество минеральной кислоты (до 73-кратного к весу исходного стероида);
• Большая продолжительность реакции (от 7,5 ч до 24 ч для 86% фосфорной кислоты и 66 ч для 28% хлорной кислоты);
• Низкий выход продукта (69,6% при использовании хлорной кислоты).
Таким образом, анализ методов дегидратации 9-ОН-АД, известных из доступных литературных источников, показывает, что при проведении реакции в среде органического растворителя, в частности, в среде ароматического углеводорода или хлорсодержащего углеводорода, использование минеральных кислот, в том числе содержащих воду, неизвестно. Описано проведение реакции органическими кислотами или их производными, ангидридами или хлорангидридами минеральных кислот, при этом наличие безводной среды является условием проведения реакции, обеспечивающем положительный результат. Как следует из уровня техники, использование минеральных кислот, в том числе содержащих воду, для получения ∆9(11)-АД возможно и известно в процессах дегидратации 9-ОН-АД без применения органического растворителя, однако эти методы имеют существенные недостатки и полученные результаты нельзя считать удовлетворительными.
В доступных литературных источниках отсутствует информация о проведении реакции дегидратации 9-ОН-АД с образованием ∆9(11)-АД с использованием в качестве дегидратирующего агента минеральных кислот, в том числе содержащих воду, в среде апротонного органического растворителя.
Кроме того, в доступных литературных источниках также отсутствует информация об интенсификации процесса дегидратации удалением избыточной воды в течение реакции дегидратации, например, методом азеотропной отгонки.
Кроме того, в доступных литературных источниках отсутствует информация о возможности получения ∆9(11)-АД из фитостерина через образование 9-ОН-АД без выделения последнего. Известные методы, например, описанные выше [US 4035236, 1977; GB 2197869, 1988], предусматривают трансформацию фитостерина с выделением кристаллического 9-ОН-АД. Другие известные методы получения ∆9(11)-АД предусматривают введение в реакцию дегидратации кристаллического 9-ОН-АД.
Кроме того, в доступных литературных источниках отсутствует информация о возможности проведения реакции дегидратации 9-ОН-АД с образованием ∆9(11)-АД в экстракте культуральной жидкости, содержащей 9-ОН-АД и полученной в результате микробиологической трансформации стеринов.
РАСКРЫТИЕ ИЗОБРЕТЕНИЯ
Целью настоящего изобретения является упрощение и удешевление технологии получения ∆9(11)-АД из фитостерина.
Сущностью изобретения является совмещение двух стадий синтеза ∆9(11)-АД из фитостерина - биотехнологической стадии, а именно микробиологической трансформации фитостерина с образованием 9-ОН-АД, и химической стадии дегидратации 9-ОН-АД - в один производственно-технологический процесс, осуществляемый без выделения промежуточного 9-ОН-АД из экстракта осветленной культуральной жидкости.
Подобное техническое решение не известно из уровня техники. Реализовано нами впервые.
Технический результат настоящего изобретения обеспечивается совокупностью существенных признаков, каковыми являются:
• Проведение дегидратации 9-ОН-АД, полученного из фитостерина микробиологической трансформацией, в экстракте культуральной жидкости, из которой предварительно удалены бактериальные клетки штамма-трансформанта;
• Использование для экстракции ∆9(11)-АД органических растворителей, а именно ароматических углеводородов или хлорорганических углеводородов;
• Использование в качестве дегидратирующего агента минеральных кислот, в том числе содержащих воду, более конкретно, ортофосфорной кислоты или хлорной кислоты;
• Удаление воды из реакционной массы в процессе реакции, например, азеотропной отгонкой.
Предлагаемое техническое решение является новым (не известно из уровня техники), явным образом не следует из уровня техники, промышленно применимо.
Техническим результатом предлагаемого технического решения являются:
• Оптимизация и упрощение метода получения ∆9(11)-АД из фитостерина за счет совмещения двух стадий синтеза ∆9(11)-АД из фитостерина - биотехнологической стадии, а именно микробиологической трансформации фитостерина с образованием 9-ОН-АД, и химической стадии дегидратации 9-ОН-АД - в один производственно-технологический процесс, осуществляемый без выделения промежуточного 9-ОН-АД из экстракта осветленной культуральной жидкости;
• Сокращение числа технологических операций на этапе биотехнологического процесса получения 9-ОН-АД из фитостерина, а именно исключение из технологического процесса следующих операций: упаривание экстракта, кристаллизация 9-ОН-АД, фильтрация осадка технического 9-ОН-АД, сушка технического 9-ОН-АД, очистка технического 9-ОН-АД (включает операции кристаллизации/перекристаллизации, фильтрации, сушки);
• Полное исключение потерь 9-ОН-АД на операциях его выделения, описанных выше (от 10 до 30% основного вещества), включая механические потери и потери основного вещества в маточных растворах;
• Проведение реакции дегидратации в экстракте без потери эффективности по сравнению с дегидратацией кристаллического 9-ОН-АД в среде органического растворителя;
• Сокращение продолжительности реакции дегидратации 9-ОН-АД, сокращение количества дегидратирующего агента и тем самым повышение выхода и качества ∆9(11)-АД,
• Сокращение продолжительности производственного процесса и тем самым энергетических затрат;
• Сокращение материальных затрат.
Техническая задача, на решение которой направлено заявляемое изобретение, заключается в упрощении и повышении эффективности процесса получения ∆9(11)-АД из фитостерина через образование промежуточного 9-ОН-АД за счет полного исключения потерь 9-ОН-АД, увеличения выхода целевого продукта ∆9(11)-АД из фитостерина путем практически полного исключения образования побочного продукта ∆8(9)-АД на этапе дегидратации 9-ОН-АД и получении ∆9(11)-АД из фитостерина способом, лишенным вышеуказанных недостатков.
Осуществление двух сложных процессов в одну технологическую стадию определяют перспективность использования способа по предлагаемому изобретению для получения ∆9(11)-АД из фитостерина.
Техническая задача получения андроста-4,9(11)-диен-3,17-диона из фитостерина с использованием в качестве промежуточного соединения 9α-гидроксиандрост-4-ен-3,17-диона, полученного микробиологической трансформацией, решается способом получения андроста-4,9(11)-диен-3,17-диона формулы (I)

из фитостерина общей формулы (II),

где R=C2H5 - β-ситостерин; R=CH3 - кампестерин; R=C2H5 и ∆22(23) - стигмастерин, R=CH3 и ∆22(23) - брассикастерин,
включающим микробиологическое окислительное элиминирование боковой цепи с образованием 9α-гидроксиандрост-4-ен-3,17-диона формулы (III),

отделение биомассы, экстракцию 9α-гидроксиандрост-4-ен-3,17-диона (III) из осветленной культуральной жидкости и последующую дегидратацию 9α-гидрокси-группы дегидратирующим агентом, отличающимся тем, что дегидратацию 9α-гидроксигруппы осуществляют в экстракте культуральной жидкости, а в качестве дегидратирующего агента используют минеральные кислоты, в том числе содержащие воду, причем удаление избыточной воды может быть проведено в процессе реакции дегидратации. Проведение реакции дегидратации 9-ОН-АД, полученного микробиологической трансформацией из фитостерина, без выделения его из экстракта культуральной жидкости ранее в литературных источниках не описано.
Таким образом, сущность заявленного изобретения, в которое входит получение 9-ОН-АД из фитостерина и далее ∆9(11)-АД с его использованием, заключается в том, что фитостерин сначала подвергают микробиологической трансформации культурой рода Mycobacterium с образованием 9-ОН-АД, затем 9-ОН-АД экстрагируют из предварительно осветленной культуральной жидкости апротонным органическим растворителем с последующим проведением реакции дегидратации в полученном экстракте, для чего в экстракт добавляют минеральную кислоту, в том числе содержащую воду, причем избыточное количество воды может быть удалено в процессе реакции, например, азеотропной отгонкой.
При этом микробиологическую трансформацию фитостерина с целью получения 9-ОН-АД осуществляют с использованием клеток бактерий Mycobacterium sp. ВКМ Ac-1817Д.
Кроме того, в качестве апротонного органического растворителя используют ароматический углеводород (например, бензол или толуол) или хлорсодержащий углеводород (например, дихлорметан, или хлороформ, или дихлорэтан).
Кроме того, концентрация фитостерина при проведении микробиологической трансформации составляет от 4 до 20 г/л.
Преимущества заявляемого способа состоят в следующем:
• Отсутствие необходимости извлечения из экстракта, кристаллизации и очистки 9-ОН-АД; отсутствие потерь 9-ОН-АД, имеющих место на этих операциях;
• Высокая региоселективность реакции дегидратации. Степень превращения 9-ОН-АД в ∆9(11)-АД 98-100% (по данным ВЭЖХ анализа); степень извлечения ∆9(11)-АД 96-98%.
• Общий выход ∆9(11)-АД из фитостерина достигает 71%.
Способ по настоящему изобретению позволяет проводить процесс дегидратации 9-ОН-АД:
• с минимальным количеством дегидратирующего агента, а именно от 1,6 до 9 моль на 1 моль 9-ОН-АД, в экстракте культуральной жидкости;
• без использования опасных и дорогостоящих дегидратирующих агентов, таких как ангидриды и хлорангидриды минеральных и органических кислот, комплексы трехфтористого бора;
• без использования дорогих безводных органических растворителей;
• Способ может быть реализован на стандартном технологическом оборудовании.
ОСУЩЕСТВЛЕНИЕ ИЗОБРЕТЕНИЯ
Получение андроста-4,9(11)-диен-3,17-диона формулы (I) из фитостерина формулы (II) осуществляется по схеме, изображенной на рисунке 1.
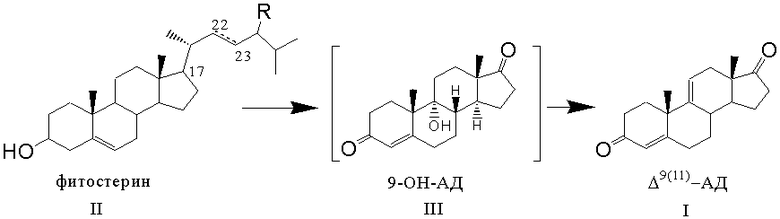
Рисунок 1- Синтез Δ9(11)-АД (I) из фитостерина (II) через 9-ОН-АД (III) заявляемым способом, где R=C2H5 - β-ситостерин; R=CH3 - кампестерин; R=C2H5 и ∆22(23) - стигмастерин, R=CH3 и ∆22(23) - брассикастерин
Ниже приводится в качестве примера подробное описание сущности изобретения.
Фитостерин общей формулы (II),
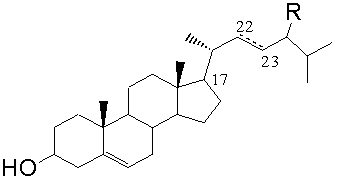
где R=C2H5 - β-ситостерин; R=CH3 - кампестерин; R=C2H5 и ∆22(23) - стигмастерин, R=CH3 и ∆22(23) - брассикастерин,
подвергают микробиологическому окислительному элиминированию боковой цепи при атоме С17 с одновременным образованием Δ4-3-кетосистемы и 9α-гидроксилированием культурой бактериальных клеток рода Mycobacterium (предпочтительно клеток бактерий Mycobacterium sp. ВКМ Ac-1817Д), при этом нагрузка исходного субстрата составляет от 4 до 20 г/л, а продолжительность ферментации - от 72 до 144 часов; процесс проводят в водной среде с селективностью превращения в 9α-гидроксиандрост-4-ен-3,17-дион (III) до 72%, после чего клетки штамма-трансформанта отделяют. 9α-Гидроксиандрост-4-ен-3,17-дион (III) экстрагируют из полученной осветленной культуральной жидкости, практически не содержащей фитостерин, органическим растворителем (ароматическим углеводородом или хлорсодержащим углеводородом) и без выделения из экстракта подвергают взаимодействию с дегидратирующим агентом с образованием андроста-4,9(11)-диен-3,17-диона (I), для чего в полученный экстракт добавляют минеральную кислоту.
Анализ продуктов микробиологической трансформации проводят методом тонкослойной хроматографии (ТСХ) и ВЭЖХ. Определение содержания продуктов методом ВЭЖХ проводят на хроматографе Agilent 1200 (США) с предколонкой Symmetry C18, 5 мкм, 3,9x20 мм и колонкой Symmetry C18, 5 мкм, 4,6x250 мм (Waters, США) в системе с подвижной фазой (%): ацетонитрил - 52, уксусная кислота - 0,01 и вода -47,99; при скорости потока 1 мл/мин, температуре 50°С, с детекцией пиков по оптической абсорбции при 240 нм; с расчетом концентраций по методу внешнего стандарта. Типичные времена удержания: для 9-ОН-АД 4,27 мин и для Δ9(11)-АД 8,25 мин.
Выделение 9-ОН-АД (III) из осветленной культуральной жидкости может быть осуществлено экстракцией несмешивающимся с водой растворителем после предварительного отделения биомассы от водной фазы. Для извлечения стероида может быть также применен, например, сорбционный способ извлечения, а также любой другой эффективный метод. Селективность образования 9α-гидроксиандрост-4-ен-3,17-диона (III) на стадии микробиологического окисления фитостерина (II) составляет 68-72%. Селективность образования Δ9(11)-АД (I) на стадии дегидратации составляет 98-100%. Степень извлечения кристаллического Δ9(11)-АД из круда составляет 96-98%.
Общий выход Δ9(11)-АД (I) из фитостерина достигает 71%.
Заявленное изобретение иллюстрируется следующими примерами, не ограничивающими его.
Для трансформации может быть использован соевый фитостерин с содержанием трансформируемых стеринов от 90 до 100%. При осуществлении изобретения-способа получения андроста-4,9(11)-диен-3,17-диона в описанном ниже примере использован фитостерин с содержанием трансформируемых стеринов 95,47%, в том числе (%): β-ситостерин - 42,39; кампестерин - 23,48; стигмастерин - 26,08; брассикастерин - 3,52.
Микробиологическое окисление фитостерина при осуществлении изобретения-способа получения андроста-4,9(11)-диен-3,17-диона может быть осуществлено клетками бактерий рода Mycobacterium, конкретно Mycobacterium sp. ВКМ Ac-1817Д.
В качестве органического растворителя при осуществлении изобретения-способа получения андроста-4,9(11)-диен-3,17-диона на операции экстракции 9-ОН-АД и последующей дегидратации могут быть использован ароматический углеводород (например, бензол или толуол) или хлорсодержащий углеводород (например, дихлорметан, или хлороформ, или дихлорэтан).
В качестве дегидратирующего агента на операции дегидратации 9-ОН-АД могут быть использованы минеральные кислоты, в том числе содержащие воду, например, хлорная кислота с содержанием воды до 43%, или ортофосфорная кислота с содержанием воды до 15%, или ортофосфорная кислота с содержанием до 50% пирофосфорной кислоты.
Интенсификация процесса дегидратации при осуществлении изобретения-способа получения андроста-4,9(11)-диен-3,17-диона удалением избыточной воды в течение реакции дегидратации может быть проведена, например, методом азеотропной отгонки или проведением реакции в присутствии эффективного количества пирофосфорной кислоты, которая, реагируя с водой, превращается в условиях проведения реакции в ортофосфорную кислоту.
В таблице 1 представлены результаты дегидратации 9α-гидроксиандрост-4-ен-3,17-диона с образованием ∆9(11)-АД в экстракте осветленной культуральной жидкости в условиях по заявляемому способу и способами, описанными в литературных источниках.
Примеры
Пример 1 Получение андроста-4,9(11)-диен-3,17-диона (I)
А) Выращивание инокулята
Бактерии Mycobacterium sp. ВКМ Ac-1817Д культивируют в шейкере-термостате в течение 25 ч при температуре 30°C и частоте встряхивания 220 об/мин в качалочных колбах вместимостью 750 мл, содержащих по 100 мл жидкой питательной среды следующего состава (г/л): дрожжевой экстракт сухой - 10; (NH3)2HPO4 - 1,5; KH2PO4 - 0,5; K2HPO4 x 3H2O - 0,5; глицерин - 10; полиэтиленгликоль сорбит моноолеат - 3,0; MgSO4 x 7H2O - 0,2; FeSO4 x 7H2O - 0,005; ZnSO4 x 7H2O - 0,002; вода дистиллированная - до 1 л, pH 6,8 - 7,2.
Б) Проведение трансформации
Полученный посевной материал вносят в среду для трансформации в количестве 10% (по объему). Микробиологическую трансформацию фитостерина осуществляют в шейкере-термостате в течение 72 часов при температуре 30°C и частоте встряхивания 220 об/мин в качалочных колбах вместимостью 750 мл, содержащих по 100 мл среды для трансформации следующего состава (г/л): KH2PO4 - 0,8; K2HPO4 x 3H2O - 4,2; (NH3)2SO4 - 3,0; глицерин - 5,0; карбамид - 0,13; MgSO4 x 7H2O - 0,2; FeSO4 x 7H2O - 0,01; ZnSO4 x 7H2O - 0,002; полиэтиленгликоль сорбит моноолеат - 1,0; фитостерин (в расчете на трансформируемые стерины) - 4,0; вода дистиллированная - до 1 л, pH 6,8 - 7,2. После стерилизации среды фитостерин гомогенизируют ультразвуком (42 кГц, 100 Вт) в течение 2 минут.
В) Получение экстракта
По окончании трансформации культуральную жидкость центрифугируют при
10 000 g в течение 40 мин при температуре 20-25°C. Получают осветленную культуральную жидкость (надосадочную жидкость), содержащую 9-ОН-АД (селективность трансформации 71,48%).
9-ОН-АД экстрагируют из надосадочной жидкости органическим растворителем. Получают экстракт, содержащий 9-ОН-АД (далее экстракт).
Г) Проведение реакции дегидратации
Вариант 1. Экстракт помещают в колбу, снабженную обратным холодильником. К экстракту добавляют минеральную кислоту. Реакционную массу нагревают до кипения и выдерживают при перемешивании до окончания реакции. Затем смесь охлаждают до комнатной температуры и добавляют 5% водный раствор NaCl. Органический слой отделяют, водный слой экстрагируют тем же растворителем. Объединенные органические фазы промывают 5% раствором NaCl до нейтральной реакции и водой, затем сушат Na2SO4 и упаривают в вакууме досуха. Получают круд, содержащий ∆9(11)-АД и не содержащий 9-ОН-АД по данным ВЭЖХ анализа.
Вариант 2 (с азеотропной отгонкой воды). Экстракт помещают в колбу, снабженную насадкой Дина-Старка и обратным холодильником. Затем к экстракту добавляют минеральную кислоту. Реакционную массу нагревают до кипения и выдерживают при перемешивании до окончания реакции, собирая выделяющуюся воду в насадку. Затем смесь охлаждают до комнатной температуры. Обработку реакционной массы проводят, как описано в предыдущем варианте.
Селективность реакции дегидратации оценивают по данным ВЭЖХ анализа исходного экстракта (определение содержания 9-ОН-АД) и круда (содержание ∆9(11)-АД).
После выделения из круда получают ∆9(11)-АД с температурой плавления от 203,5 до 206,5ºC и степенью извлечения 96-98%.
Спектр ЯМР 1H (δ, м.д.; CDCl3): 5,75 (д, J = 1,8 Гц, 1H, 4-CH); 5,55 (м, 1H, 11-CH); 1,35 (с, 3H, 19-CH 3); 0,87 (с, 3H, 18-CH 3).
Спектр ЯМР 13С (δ, м.д.; CDCl3): 221,0 (17-C(O)); 199,0 (3-C(O)); 168,9 (5-C); 145,1 (9-C); 124,2 (4-CH); 118,1 (11-CH); 48,0; 45,8; 41,1 36,8; 36,2; 34,2; 33,8; 33,4; 32,6; 31,1; 26,2; 22,6; 13,9 (19-СН 3).
Таблица 1
∆9(11)-АД, %
(степень извлечения,%)
12,2
24 ч
73v/1w
7,5 ч
1,6
1 ч 25 мин
1,6
1 ч 10 мин
1,6
30 мин
8,9
(78 °С), 30 мин
1,6
5 мин
1,6
40 мин
5,4
1 ч 40 мин
99,48
HUT36138
3v/1w
2 ч 20 мин
1,83
10 мин
23,2
66 ч
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ 11БЕТА, 17АЛЬФА, 21-ТРИГИДРОКСИ-16АЛЬФА-МЕТИЛ-9АЛЬФА-ФТОРПРЕГНА-1,4-ДИЕН-3,20-ДИОНА (ДЕКСАМЕТАЗОНА) ИЗ ФИТОСТЕРИНА | 2013 |
|
RU2532902C1 |
| МИКРОБИОЛОГИЧЕСКИЙ СПОСОБ ПОЛУЧЕНИЯ 1,2-ДЕГИДРИРОВАННЫХ ПРОИЗВОДНЫХ Δ-3-КЕТОСТЕРОИДОВ РЯДА АНДРОСТАНА В ВОДНО-ОРГАНИЧЕСКИХ СРЕДАХ | 2010 |
|
RU2447154C1 |
| СПОСОБ ПОЛУЧЕНИЯ АНДРОСТА-1,4-ДИЕН-3,17-ДИОНА ИЗ СТЕРИНОВ РАСТИТЕЛЬНОГО И ЖИВОТНОГО ПРОИСХОЖДЕНИЯ | 2005 |
|
RU2297455C2 |
| СПОСОБ ПОЛУЧЕНИЯ 6-МЕТИЛЕНАНДРОСТ-4-ЕН-3,17-ДИОНА ИЗ АНДРОСТ-4-ЕН-3,17-ДИОНА, СПОСОБ ПОЛУЧЕНИЯ 6-МЕТИЛЕНАНДРОСТА-1,4-ДИЕН-3,17-ДИОНА (ЭКСЕМЕСТАНА) С ИСПОЛЬЗОВАНИЕМ ПОЛУЧЕННОГО 6-МЕТИЛЕНАНДРОСТ-4-ЕН-3,17-ДИОНА | 2010 |
|
RU2425052C1 |
| ШТАММ БАКТЕРИЙ MYCOBACTERIUM NEOAURUM И СПОСОБ ЕГО ИСПОЛЬЗОВАНИЯ ДЛЯ ПОЛУЧЕНИЯ АНДРОСТ-4-ЕН-3,17-ДИОНА ИЗ СТЕРИНОВ РАСТИТЕЛЬНОГО И ЖИВОТНОГО ПРОИСХОЖДЕНИЯ | 2001 |
|
RU2231553C2 |
| СПОСОБ ПОЛУЧЕНИЯ АНДРОСТ-4-ЕН-3,17-ДИОНА ИЗ СТЕРИНОВ РАСТИТЕЛЬНОГО И ЖИВОТНОГО ПРОИСХОЖДЕНИЯ ИЛИ ИХ ПРОИЗВОДНЫХ | 1998 |
|
RU2205224C2 |
| ШТАММ Rhodococcus erythropolis ВКПМ Ac-1740 ДЛЯ ПОЛУЧЕНИЯ 9 АЛЬФА-ГИДРОКСИСТЕРОИДОВ | 2007 |
|
RU2351645C1 |
| СПОСОБ КОНСТРУИРОВАНИЯ ГЕНЕТИЧЕСКИ МОДИФИЦИРОВАННОГО ШТАММА МИКРООРГАНИЗМА | 2000 |
|
RU2268935C2 |
| Способ получения 9 @ -гидроксиандрост-4-ен-3,17-диона | 1983 |
|
SU1694644A1 |
| РЕКОМБИНАНТНЫЕ МИКОБАКТЕРИАЛЬНЫЕ ШТАММЫ-ПРОДУЦЕНТЫ И ИХ ИСПОЛЬЗОВАНИЕ ДЛЯ ПОЛУЧЕНИЯ 22-ФУНКЦИОНАЛИЗИРОВАННЫХ СТЕРОИДОВ | 2019 |
|
RU2767610C2 |
Изобретение относится к биотехнологии. Предложен способ получения андроста-4,9(11)-диен-3,17-диона из фитостерина. Проводят микробиологическое окислительное элиминирование боковой цепи при атоме С17 с образованием 9α-гидроксиандрост-4-ен-3,17-диона. Отделяют биомассу. Экстрагируют 9α-гидроксиандрост-4-ен-3,17-дион из осветленной культуральной жидкости апротонным органическим растворителем, выбранным из ароматических углеводородов или хлорорганических углеводородов. Затем проводят реакцию дегидратации 9α-гидроксигруппы 9α-гидроксиандрост-4-ен-3,17-диона в полученном экстракте. В качестве дегидратирующего агента используют минеральную кислоту, содержащую воду и выбранную из группы, включающей ортофосфорную, пирофосфорную и хлорную кислоты. Минеральную кислоту используют в количестве от 1 до 10 моль на 1 моль 9α-гидроксиандрост-4-ен-3,17-диона. В процессе реакции дегидратации проводят удаление избыточной воды либо в присутствии эффективного количества пирофосфорной кислоты, либо азеотропной отгонкой. Изобретение позволяет интенсифицировать процесс дегидратации при использовании меньшего количества минеральной кислоты и исключить образование побочного продукта. 10 з.п. ф-лы, 1 табл., 1 пр.
1. Способ получения андроста-4,9(11)-диен-3,17-диона формулы (I)
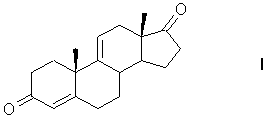
из фитостерина общей формулы (II),

где R=C2H5 - β-ситостерин; R=CH3 - кампестерин; R=C2H5 и ∆22(23) - стигмастерин; R=CH3 и ∆22(23) - брассикастерин,
включающий микробиологическое окислительное элиминирование боковой цепи при атоме С17 с образованием 9α-гидроксиандрост-4-ен-3,17-диона формулы (III),

отделение биомассы, экстракцию 9α-гидроксиандрост-4-ен-3,17-диона (III) из осветленной культуральной жидкости и последующую дегидратацию 9α-гидрокси-группы дегидратирующим агентом, отличающийся тем, что соединение (III) экстрагируют из осветленной культуральной жидкости апротонным органическим растворителем, выбранным из ароматических углеводородов или хлорорганических углеводородов, с последующим проведением реакции дегидратации 9α-гидроксигруппы соединения (III) в полученном экстракте, при этом в качестве дегидратирующего агента используют минеральную кислоту, в том числе содержащую воду и выбранную из группы, включающей ортофосфорную, пирофосфорную и хлорную кислоту, причем удаление избыточной воды проводят в процессе реакции дегидратации.
2. Способ по п.1, отличающийся тем, что для трансформации используют соевый фитостерин с содержанием трансформируемых стеринов от 90 до 100%.
3. Способ по п.1, отличающийся тем, что микробиологическую трансформацию фитостерина проводят клетками бактерии Mycobacterium sp. ВКМ Ac-1817Д.
4. Способ по п.1, отличающийся тем, что в качестве ароматического углеводорода используют бензол или толуол.
5. Способ по п.1, отличающийся тем, что в качестве хлорсодержащего углеводорода используют дихлорметан, или хлороформ, или дихлорэтан.
6. Способ по п.1, отличающийся тем, что удаление избыточной воды может быть проведено в процессе реакции дегидратации азеотропной отгонкой.
7. Способ по п.1, отличающийся тем, что удаление избыточной воды может быть проведено в процессе реакции дегидратации в присутствии эффективного количества пирофосфорной кислоты.
8. Способ по п.6, отличающийся тем, что используют минеральную кислоту в количестве от 1 до 10 моль на 1 моль 9α-гидроксиандрост-4-ен-3,17-диона, предпочтительно от 2 до 5 моль на 1 моль 9α-гидроксиандрост-4-ен-3,17-диона.
9. Способ по п.6, отличающийся тем, что в качестве минеральной кислоты используют 85% ортофосфорную кислоту.
10. Способ по п.6, отличающийся тем, что в качестве минеральной кислоты используют 57% хлорную кислоту.
11. Способ по п.1, отличающийся тем, что в качестве дегидратирующего агента используют ортофосфорную кислоту, содержащую до 50% пирофосфорной кислоты.
| US4127596 A, 28.11.1978 | |||
| DONOVA M | |||
| V | |||
| ET AL | |||
| "Microbial conversion of sterol-containing soybean oil production waste", Journal of Chemical Technology and Biotechnology, 2005, v.88, pp | |||
| Устройство двукратного усилителя с катодными лампами | 1920 |
|
SU55A1 |
| US 4444884 A, 24.04.1984 | |||
| US3065146 A, 20.11.1962 | |||
| EGOROVA O | |||
| V | |||
| ET AL | |||
| "Production of androstenedione using mutants of Mycobacterium sp.", Journal of | |||
Авторы
Даты
2014-04-10—Публикация
2012-11-16—Подача