Область техники
Настоящее изобретение относится к области биотехнологии, а также к генетике и молекулярной биологии, конкретно к клеткам живых бактериальных культур, включая рекомбинантные, и касается создания и применения новых рекомбинантных штаммов микобактерий для биотрансформации стеринов в стероидные соединения, функционализированные по положению С-22 кислород-содержащей замещающей группой.
Уровень техники
В основе современных производств прекурсоров синтетических стероидных гормонов лежит микробиологическая трансформация природных стеринов. Наиболее доступным и экономически выгодным сырьем для таких производств является Фитостерин. Фитостерин представляет собой смесь растительных стеринов с углеродным скелетом, состоящим из 28-29 атомов углерода, получаемую из таллового или масличного сырья.
Возможность биотехнологического превращения стеринов в стероидные прекурсоры обусловлена функционированием модифицированных (частично заблокированных) биохимических путей окислительной деградации стеринов. Способностью активно окислять стерины обладают представители многих таксонов прокариот, однако наибольшее количество известных непатогенных промышленно значимых штаммов относятся к типу Actinobacteria и принадлежат к родам Rhodococcus и, в особенности Mycolicibacterium (бывший ранее Mycobacterium).
Для получения штаммов-продуцентов стероидных прекурсоров, как правило, применяют многократный статистический мутагенез природных штаммов (химический, ультрафиолетовый, транспозонный) с промежуточной селекцией активных клонов [1, 2]. Интенсивное развитие геномики, молекулярной биологии и методов генной инженерии актинобактерий, происходящее в течение последнего десятилетия создало базу для конструирования рекомбинантных штаммов-продуцентов стероидных прекурсоров методами направленного мутагенеза и метаболической инженерии [3, 4, 5].
Традиционные стероидные прекурсоры с полностью окисленной алифатической боковой цепью стеринов при С-17 (3,17-дикетостероиды ряда андростана, такие как соединение IV и соединение V, см Фиг. 1), являются крупнотоннажным продуктом биотехнологических производств и основой промышленных синтезов всех групп стероидных гормонов. Вместе с тем, их использование как стартового материала делает получение синтетических гормонов ряда прегнана недостаточно эффективным в связи с необходимостью частичной реконструкции боковой цепи при С-17. Актуальной задачей является разработка эффективных способов одностадийного биотехнологического получения «продвинутых» прекурсоров с короткой боковой цепью, несущей кислородсодержащую группу в положении С-22, которые могут быть использованы для производства кортикостероидов, прогестагенов и ряда производных витамина D3 с большей эффективностью.
Из уровня техники известны различные способы улучшения эффективности биотрансформации стеринов в традиционные стероидные прекурсоры (соединение IV и его аналоги) микобактериальными штаммами-продуцентами, которые могут включать специальные способы диспергирования субстрата биотрансформации [6], введение в состав среды биотрансформации различных соединений, увеличивающих биодоступность субстрата, таких как дисперсии или эмульсии несмешивающихся с водой липофильных фаз (растительные масла, синтетические масла и полимеры) [7], эмульсии термодинамически неустойчивых мицеллярных систем [8], водорастворимых комплексообразующих агентов (натуральные и модифицированные циклодекстрины), и др. [9-12].
Известны штаммы-продуценты и способы биотехнологического получения С-22 стероидных спиртов, таких как соединение II, его 1,2-дегидро аналога (VI) и/или 17,20-дегидро аналогов [13-15], а также метиловых эфиров соответствующих С-22 карбоксильных кислот [16].
Стероидные С-22 прекурсоры, могут быть конвертированы в стероидные гормоны ряда прегнана в реакциях химического декарбоксилирования. Для конвертации С-22 стероидных спиртов в производные гормоны ряда прегнана, необходимо предварительное окисление C-22-гидроксигруппы до карбонильной группы или карбоксильной групп. Таким образом, наличие доступного стероидного прекурсора уже несущего карбонильную группу в положении С-22 может предоставить дополнительное преимущество в синтезе гормонов ряда прегнана. Так 9α-гидрокси-17,20-дегидро-20-карбокси- аналог соединения VI может быть превращен в две или в одну стадию в 9α-гидрокси-прогестерон; другие способы химического декарбоксилирования таких соединений позволяют получать соответствующие 16-дегидро-20-оксо-прегнаны или 17α-гидрокси-20-оксо-прегнаны [17-19]. Также наличие карбонильной группы в положении С-22 может быть полезным для синтеза других стероидных гормонов и производных витамина D3, несущих различные замещающие группы при С-17.
Известно, что соединение I встречается в природе и в незначительных количествах содержится в кожных покровах некоторых морских беспозвоночных, выполняя, предположительно, защитную функцию [20].
Известны способы получения соединения I в многостадийном химическом синтезе из хлороорганического стероидного прекурсора (получаемого, в свою очередь, из очищенного стигмастерина) [21], а также в 4-х стадийном химическом синтезе с выходом 63% из очищенного стигмастерина [20]. Недостатками данных способов является необходимость использования в качестве сырья индивидуального очищенного стерина, содержащего в структуре двойную связь при С-22, многостадийность синтеза и необходимость использования токсичных взрывоопасных реагентов, что снижает эффективность и затрудняет промышленную реализацию способов.
Известны способы получения и очистки соединения VII (являющегося 1,2-дегидроаналогом соединения I) биотрансформацией холестерина мутантным штаммом Mycobacterium ССМ 3528, при этом соединение I образуется в качестве минорного продукта [22, 23]. Недостатками данного способа является крайне низкая продуктивность (по соединению I) и необходимость использования в качестве сырья ограниченно доступного и дорогостоящего животного стерина.
Наиболее близким аналогом предлагаемого способа является способ получения соединений VII и I биотрансформацией стеринов мутантными штаммами Mycobacterium parafortuitum complex MCI 1412, MCI 1414, и некоторыми другими штаммами микобактерий, при этом основным продуктом биотрансформации является соединение VII, а соединение I образуется в незначительных количествах [24]. Особенностями данного способа является то, что наибольший выход VII обеспечивали введением в среду ряда питательных добавок, таких как глюкоза, клетки дрожжей, соевая паста, мясной пептон и др., а также 10 г/л триглицеридов (рапсового масла) и использованием холестерина в качестве субстрата биоконверсии. При этом в экстракте культуральной жидкости получали 2,69-2,8 г соединения VII и только 0,1-0,14 г соединения I из 8-10 г холестерина. При использовании в качестве субстрата биотрансформации смеси растительных стеринов, продуктивность снижалась (до 0,75 г соединения VII и 0,05 г соединения I из 8 г субстрата). Недостатками данного способа является крайне низкая продуктивность (по соединению I), низкая эффективность конверсии в целевые продукты более доступных растительных стеринов, а также трудоемкий и не масштабируемый для целей промышленного производства способ выделения и очистки продуктов с использованием препаративной тонкослойной хроматографии.
Использование производных ЦД для солюбилизации и увеличения эффективности биотрансформации стериновых субстратов биотрансформации при получении 3,17-дикетостероидов известно из патентной и научной литературы [9-12]. Преимуществом предлагаемого способа является введение различных водорастворимых производных 0-циклодекстрина с целью изменения селективности биотрансформации фитостерина в различные C-22-функционализированные стероидные продукты, а именно увеличение относительного выхода I в присутствии статистически гидроксипропилированного β-циклодекстрина (СГПЦД) или увеличение относительного выхода II в присутствии статистически метилированного β-циклодекстрина (СМЦД).
Из уровня техники известен способ выделения и очистки стероидных соединений с кислород-содержащими группами (гидрокси- или оксо-) в положении С-3, включающий экстракцию стероидов из культуральных жидкостей органическими растворителями (метилбутил- или метиламил-кетоновыми), преципитацию стероидов из полученных экстрактов бромидом кальция, отделением осадка и его последующим разрушением путем обработки водой [25]. Способ обеспечивает выделение стероидных соединений посредством образования нерастворимых аддуктов, однако, недостатком данного способа является то, что он не предусматривает селективного отделения первичных стероидных спиртов с 3-оксо-структурой от стероидных соединений, имеющих иную комбинацию заместителей.
Из уровня техники известно, что ген fadA5 является одним из ключевых генов стероидного катаболизма актинобактерий и кодирует β-кетоацил-КоА-тиолазу. Направленный мутагенез гена fadA5 у Mycobacterium tuberculosis H37Rv приводил к утрате штаммом вирулентности и способности конвертировать холестерин в соединения IV и V [26]. Нокаут гена fadA5 у штамма Mycobacterium neoaurum АТСС 25795 приводил к некоторому повышению продукции соединений II и VI из фитостерина [5]. Инактивация у того же штамма бифункционального гена hsd4A (гомологичного генам семейства fabG), приводила к значительному увеличению продукции структурных аналогов соединения II (стероидных первичных С-22 спиртов) [5], особенно в комбинации с инженерией, направленной на повышение экспрессии гена fadA5 и инактивации генов стероидных 1,2-дегидрогеназ kstD (до 18-49%, мольный выход) [27]. Недостатком комбинаций данных способов и объектов мутагенеза является отсутствие среди продуктов биотрансформации стеринов сконструированными штаммами 22-оксо-функционализированных продуктов.
Целью заявляемого изобретения является разработка рекомбинантных микобактериальных штаммов-продуцентов и биотехнологического способа получения стероидных прекурсоров, несущих кислород-содержащую группу в положении С-22 стероидной молекулы из стеринов.
Технический результат состоит в том, что заявленное изобретение позволяет повысить эффективность биотехнологического способа получения и селективного способа выделения и очистки данных стероидных прекурсоров за счет применения новых рекомбинантных микобактериальных штаммов-продуцентов, способных конвертировать стерины (III) в 24-норхол-4-ен-3,22-дион (I) и 20-гидроксиметил-прегн-4-ен-3-он (II).
Сущность изобретения.
Одним из предметов настоящего изобретения является рекомбинантный штамм Mycolicibacterium neoaurum ВКМ Ac-2846D, полученный введением направленной делеции в ключевом гене стероидного катаболизма, способный трансформировать стерины в 24-норхол-4-ен-3,22-дион и 20-гидроксиметил-прегн-4-ен-3-он и их 1-дегидроаналоги. Данный штамм получен введением маркированной направленной делеции в ключевом гене стероидного катаболизма fadA5 входящего в геномную ДНК родительского штамма Mycolicibacterium neoaurum ВКМ Ac-1815D с нуклеотидной последовательностью SEQ ID №1, что обеспечивает возможность ее замещения на нуклеотидную последовательность SEQ ID №4.
Другим предметом настоящего изобретения является рекомбинантный штамм Mycolicibacterium neoaurum ВКМ Ac-2847D, полученный введением направленной делеции в ключевом гене стероидного катаболизма, способный трансформировать стерины в 24-норхол-4-ен-3,22-дион и 20-гидроксиметил-прегн-4-ен-3-он без примеси их 1-дегидроаналогов. Данный штамм получен введением направленной делеции в ключевом гене стероидного катаболизма fadA5, входящего в геномную ДНК родительского штамма Mycolicibacterium neoaurum NRRL В-3805 с нуклеотидной последовательностью SEQ ID №1, что обеспечивает возможность ее замещения на нуклеотидную последовательность SEQ ID №4, при этом в родительском штамме предварительно инактивируют ген kstD.
Следующим предметом настоящего изобретения является способ биотрансформации фитостерина в стероидные продукты, содержащие кислородную функцию при С-22, отличающийся тем, что биотрансформацию проводят клетками бактерии штаммов ВКМ Ac-2846D, ВКМ Ac-2847D.
Другим предметом настоящего изобретения является способ селективной биотрансформации фитостерина в 24-норхол-4-ен-3,22-дион, в котором биотрансформацию проводят клетками бактерий в присутствии гидроксипропилированного β-циклодектрина.
Следующим предметом настоящего изобретения является способ выделения и очистки 24-норхол-4-ен-3,22-диона и 20-гидроксиметил-прегн-4-ен-3-она из культуральной жидкости, включающий отделение бактериальных клеток, экстракцию стероидных продуктов биотрансформации из надосадочной жидкости органическим растворителем. При этом органический экстракт, содержащий продукты биотрансформации, отмывают водой, осуществляют ступенчатую кристаллизацию и перекристаллизацию 24-норхол-4-ен-3,22-диона из того же органического растворителя, Далее содержащийся в маточных растворах 20-гидроксиметил-прегн-4-ен-3-он, селективно отделяют посредством преципитации в виде нерастворимого аддукта с хлоридом кальция от 24-норхол-4-ен-3,22-диона.
Перечень фигур
Фиг. 1. Структуры соединений: 24-норхол-4-ен-3,22-дион (формула I); 20-гидроксиметил-прегн-4-ен-3-он (формула II); общая формула стеринов, используемых для биотрансформации, где: R=Н - холестерин, R=СН3 - кампестерин, R=С2Н5 - β-ситостерин, R=C2H5, Δ22 - стигмастерин (формула III); андрост-4-ен-3,17-дион - (формула IV); андроста-1,4-диен-3,17-дион (формула V); 20-гидроксиметил-прегна-1,4-диен-3-он (формула VI), дегидроаналог 20-гидроксиметил-прегн-4-ен-3-она; 24-норхола-1,4-диен-3,22-дион (формула VII), дегидроаналог 24-норхол-4-ен-3,22-диона.
Фиг. 2. Анализ методом ПЦР клонов, полученных после электропорации клеток Mycolicibacterium neoaurum ВКМ Ac-1815D плазмидой pEX-ΔfadA5-Km. Стрелками указано положение фрагментов ДНК, содержащих аллель дикого типа (1340 п.о.) и мутантный аллель (2400 п.о.) гена. Дорожки: М - маркеры длин фрагментов ДНК (Евроген, Россия); 1 - ампликон, полученный на матрице тотальной ДНК штамма дикого типа; 2 - 4 - ампликоны, полученные на лизатах клеток меродиплоидов; 5 - ампликон, полученный на лизате мутантного штамма М. neoaurum ВКМ Ac-2846D.
Фиг. 3. Анализ методом ПЦР клонов, полученных после электропорации клеток Mycolicibacterium neoaurum NRRL B-3805ΔkstD плазмидой pEX-ΔfadA5-Km. Стрелками указано положение фрагментов ДНК, содержащих аллель дикого типа (1340 п.о.) и мутантный аллель (2400 п.о.) гена. Дорожки: М - маркеры длин фрагментов ДНК (Евроген, Россия); 1 - 2 - ампликоны, полученный на матрице тотальной ДНК штамма дикого типа; 3 - ампликон, полученный на лизате мутантного штамма М. neoaurum ВКМ AC-2847D.
Фиг. 4. Профиль ВЭЖХ продуктов биотрансформации фитостерина штаммом Mycolicibacterium neoaurum ВКМ Ac-2846D. I - Соединение I; II - соединение II; IV - соединение IV; V - соединение V; VI - соединение VI; VII - соединение VII.
Фиг. 5. Профиль ВЭЖХ продуктов биотрансформации фитостерина штаммом Mycolicibacterium neoaurum ВКМ Ac-2847D. I - Соединение I; II - соединение II; IV - соединение IV.
Фиг. 6. Профиль ВЭЖХ продуктов биотрансформации фитостерина родительским штаммом Mycolicibacterium neoaurum NRRL В-3805 ΔkstD. II - соединение II; IV - соединение IV.
Фиг. 7. Профиль ВЭЖХ продуктов биотрансформации фитостерина штаммом Mycolicibacterium neoaurum ВКМ Ac-2847D в присутствии СМЦД. I - Соединение I; II -соединение II; IV - соединение IV.
Фиг. 8. Профиль ВЭЖХ продуктов биотрансформации фитостерина штаммом Mycolicibacterium neoaurum ВКМ Ac-2847D в присутствии СГПЦД. I - Соединение I; II - соединение II; IV - соединение IV.
Описание изобретения
Изобретение относится к новым рекомбинантным штаммам-продуцентам и к способам получения соединений I (24-норхол-4-ен-3,22-дион; синонимы 20-(1)-оксоэтил-прегн-4-ен-3-он, 20-(1)-оксоэтил-3-оксо-прегн-4-ен) и II (20-гидроксиметил-прегн-4-ен-3-он; синонимы 23,24-биснорхол-4-ен-22-ол-3-он, 22-гидрокси-23,24-биснорхол-4-ен-3-он) в процессе микробиологической трансформации стеринов с общей формулой III, и может быть использовано в фармацевтической промышленности для производства прекурсоров стероидных медицинских препаратов.
Получение рекомбинантных штаммов и способов биотрансформаци фитостерина в стероидные продукты, содержащие кислородную функцию при С-22 достигается за счет:
- инактивации ключевого гена стероидного катаболизма fadA5 путем введения направленной мутации в геном штаммов Mycolicibacterium, способных к окислительной деградации боковой цепи стеринов, преимущественно М. neoaurum, преимущественно М. neoaurum ВКМ Ac-2847D и родственных штаммов, содержащих в геномной ДНК нуклеотидную последовательность, гомологичную последовательности SEQ ID №1 (с уровнем гомологии 100-80%), что обеспечивает ее замещение на нуклеотидную последовательность SEQ ID №4 или гомологичную ей (с уровнем гомологии 100-80%) и содержащую дополнительно вставку репортерного гена, преимущественно гена антибиотикорезистентности; соответствующей селекции мутантных клонов;
- для генерации означенной мутации фрагмент бактериальной хромосомы родительского штамма, содержащий открытую рамку считывания (ОРС) fadA5 с фланкирующими ее последовательностями бактериального генома амплифицируют и клонируют в нереплицируемом в клетках микобактерий векторе, гидролизуют эндонуклеазой рестрикции, два сайта которой расположены только в кодирующей последовательности гена, лигируют гидролизат в условиях образования кольцевых молекул, трансформируют лигазной смесью клетки Е. coli, осуществляют селекцию плазмидосодержащих клонов на наличие делеции; маркируют делецию в кодирующей последовательности гена встраиванием различных антибиотикоустойчивых кассет, вводят сконструированную плазмиду в компетентные клетки микобактерий электропорацией; осуществляют отбор мутантных клонов, возникающих в результате гомологичной рекомбинации; подтверждают наличие введенной мутации;
- применение рекомбинантных штаммов-продуцентов для аэробной биотрансформации животных и растительных стеринов, преимущественно таллового или соевого фитостерина, проводят в специально подобранных условиях, которые могут включать присутствие в составе среды биотрансформации агентов, увеличивающих глубину и/или селективность конверсии субстрата, в том числе, замещенных водорастворимых циклодекстринов, преимущественно метилированного для получения продуктов I и II, или, преимущественно гидроксипропилированного для получения продукта I;
- отделения надосадочной жидкости и экстракции из нее стероидов известными способами, такими как твердофазная экстракция на обращенной фазе или экстракция несмешивающимся с водой органическим растворителем, преимущественно этилацетатом или 4-метил-пентан-2-оном;
- выделения и очистки продуктов I и II из органического экстракта, включающих концентрирование, серию отмывок от полярных примесей, серию кристаллизаций и перекристаллизаций из того же растворителя, который был использован для экстракции, с промежуточным селективным отделением продукта II посредством преципитации из этилацетатного раствора в виде нерастворимого аддукта с хлоридом кальция; - отмывку сорбированных продуктов I и II на обращенной фазе, их селективную ступенчатую элюцию с обращенной фазы, концентрирование элюата и перекристаллизацию.
Характеристика рекомбинантных штаммов-продуцентов.
Известно, что различные виды и штаммы микобактерий могут иметь один или несколько гомологичных генов kstD, экспрессия которых обеспечивает существенно различающиеся уровни активности 1,2-дегидрирования 3-кетостероидов. Так у штамма М. neoaurum АТСС 25795 было идентифицировано три гена kstD, причем инактивация только kstD1 сохраняла у мутанта способность к продукции стероидных 1,2-дегидроаналогов на уровне 18-20%, а инактивация всех трех гомологов - на уровне 1-2% (мольный выход) [27]. Тем не менее, в геноме штамма Mycobacterium sp. VKM Ac-1817D, обладающего низкой активностью 1,2-дегидрирования 3-кетостероидов было выявлено 5 гомологов kstD, только один из которых увеличивал экспрессию в присутствии стеринов [28]. Преимуществом предлагаемого способа является то, что у штаммов М. neoaurum VKM Ac-1815D, VKM Ac-1816D и близкородственного М. neoaurum NRRL В-3805 идентифицирован единственный ген kstD [29], что делает их преимущественным объектом для генной инженерии с целью получения 1,2-насыщенных аналогов стероидных продуктов биотрансформации стеринов
Рекомбинантный штамм Mycolicibacterium neoaurum ВКМ Ac-2846D получен методами генной инженерии из штамма Mycolicibacterium neoaurum ВКМ Ac-1815D (synonym Mycobacterium sp. ВКМ Ас-1815Д), полученным и описанным Доновой М.В. с соавт. [10]. Идентификация родительского штамма Mycolicibacterium neoaurum ВКМ Ас-1815D была проведена на основании анализа полных геномных последовательностей, а именно, показателей средней идентичности нуклеотидов (ANI) и цифровой ДНК-ДНК гибридизации (dDDH). Сборка генома штамма помещена в базы данных DDBJ/ENA/GenBank под номером СР006936.2 [3].
Колонии поверхностной культуры М. neoaurum ВКМ Ac-2846D, выращенной в течение 10 суток имеют следующие морфологические признаки: преимущественно гладкие колонии (S-типа); при многократном пассировании возможна диссоциация на два типа колоний - S- и R- (шероховатые). Колонии S-типа - желто-оранжевого цвета с возвышающейся центральной частью и прозрачной уплощенной периферической зоной; контур колонии ровный; поверхность гладкая, глянцевая, блестящая. Колонии R-типа -желто-оранжевого цвета, уплощенные с незначительно возвышающимся центром, края неравномерно извилистые, поверхность колонии полусухая и гранулированная. При выращивании в погруженной культуре может наблюдаться образование клеточных конгломератов различного размера и конфигурации.
Микроморфология: на ранних сроках роста в погруженных культурах штамм представлен палочковидными или гантелеобразными клетками размером (0,2-0,3)×(6-8) мкм с апикальными включениями, или укороченными палочками (0,2×0,3) мкм кокковидной или каплевидной формы с гомогенной цитоплазмой. Деление клеток осуществляется путем встраивания перегородки, мицелиальный рост и ветвление не наблюдаются.
М. neoaurum ВКМ Ac-2846D получают введением маркированной направленной делеции в ключевой ген стероидного катаболизма fadA5. Для мутагенеза в электрокомпетентные клетки родительского штамма вводят методом электропорации специально сконструированные суицидные плазмиды, несущие мутантный аллель целевого гена с фланкирующими последовательностями, гомологичными участкам бактериального генома, осуществляют селекцию мутантных клонов, возникших в результате гомологичной рекомбинации. Генотип мутантного штамма подтверждают методом ПЦР-амплификации.
Рекомбинантный штамм Mycolicibacterium neoaurum ВКМ Ac-2847D получен методами генной инженерии из штамма Mycolicibacterium neoaurum NRRL В-3805 (synonym Mycobacterium sp. NRRL В-3805, CECT3018; DSM 2967; NCIMB 11678), полученным и описанным Маршеком с соавт [1]. Идентификация родительского штамма Mycolicibacterium neoaurum NRRL В-3805 была проведена на основании анализа полных геномных последовательностей, а именно, показателей средней идентичности нуклеотидов (ANI) и цифровой ДНК-ДНК гибридизации (dDDH). Сборка генома штамма помещена в базы данных DDBJ/ENA/GenBank под номером СР011022.1 [4].
Колонии поверхностной культуры М. neoaurum ВКМ Ac-2847D, выращенной в течение 10 суток имеют следующие морфологические признаки: Макроморфология колоний: При росте на агаризованной питательной среде штамм образует преимущественно гладкие колонии (S-типа). При многократном пассировании возможна диссоциация на два типа колоний - S- и R-(шероховатые). Колонии S-типа - бледно-желтого цвета с возвышающейся центральной частью и прозрачной уплощенной периферической зоной. Контур колонии ровный. Поверхность гладкая, глянцевая, блестящая. Колонии R-типа - бледно-желтого цвета, уплощенные с незначительно возвышающимся центром, края неравномерно извилистые, поверхность колонии полусухая и гранулированная. При выращивании в погруженной культуре может наблюдаться образование вязких каплевидных клеточных конгломератов.
Микроморфология: На ранних сроках роста в погруженных культурах штамм представлен палочковидными или гантелеобразными клетками размером (0,2-0,3)×(6-8) мкм с апикальными включениями, или укороченными палочками (0,2×0,3) мкм кокковидной или каплевидной формы с гомогенной цитоплазмой. Деление клеток осуществляется путем встраивания перегородки, мицелиальный рост и ветвление не наблюдаются.
M. neoaurum ВКМ Ac-2847D получают введением комбинации направленных делеций в ключевые гены стероидного катаболизма - немаркированной в ген kstD известным способом [30] и маркированной в ключевой ген стероидного катаболизма fadA5. Для мутагенеза в электрокомпетентные клетки родительского штамма вводят методом электропорации специально сконструированные суицидные плазмиды, несущие мутантный аллель целевого гена с фланкирующими последовательностями геномной ДНК. Осуществляют селекцию мутантных клонов, возникших в результате гомологичной рекомбинации, и подтверждают их генотип методом ПЦР-амплификации.
Анализ продуктов биотрансформации проводят методом высокоэффективной жидкостной хроматографии на колонке 4,6 мм × 250 мм с обращенной фазой С18, 5 мкм, снабженной предколонкой (3,9 мм × 20 мм) с той же фазой, с детекцией по абсорбции УФ при 240 нм, с градиентной элюцией пиков водным ацетонитрилом в присутствии постоянной концентрации уксусной кислоты 0,01% (объем/объем), при 50 С° и скорости протока 1 мл/мин. Используют следующий профиль элюции (указано содержание ацетонитрила в элюенте): 0-5 мин., 60%; 5-15 мин., линейный градиент до 84%; 15-20 мин., линейный градиент до 99,99%; 20-21 мин., 99,99%; 21-26 мин. линейный градиент до 60%. При этом времена удержания составляют 11 мин. для II и 14,3 мин. для I. Идентификацию продуктов биотрансформации проводят методами масс-спектрометрии высокого разрешения с ионизацией электроспреем и протонной магнито-резонансной спектроскопии в ДМСО-d6. Характеристика сигналов инструментальных методов анализа приведена в Таблице 1.
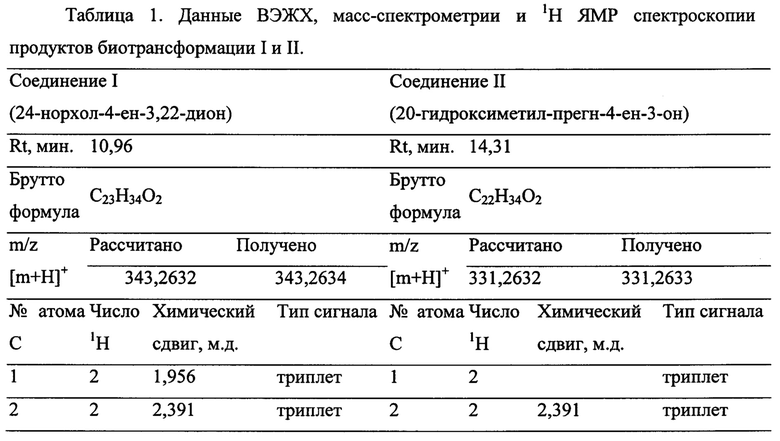
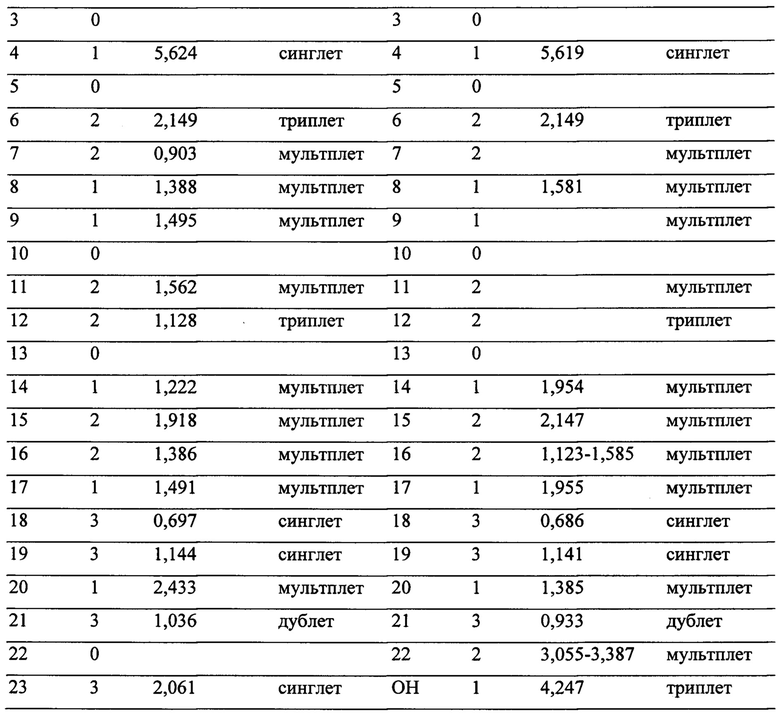
Возможность реализации заявляемого изобретения иллюстрируется, но не ограничена, примерами конкретного выполнения. Пример 1.
Рекомбинантный штамм-продуцент Mycolicibacterium получают, осуществляя нокаут ключевого гена стероидного катаболизма fadA5 введением направленной маркированной делеции. В качестве родительского штамма используют Mycolicibacterium neoaurum ВКМ Ac-1815D, содержащий ген fadA5. Фрагмент бактериальной хромосомы родительского штамма, содержащий ОРС fadA5 с фланкирующими ее последовательностями бактериального генома длиной 2580 п.о. (SEQ ID №1) амплифицируют методом ПЦР с использованием специфических праймеров (SEQ ID №2 и SEQ ID №3). Полученный фрагмент ДНК клонируют в векторе рЕХ18Тс [31] или другом нереплицируемом в клетках микобактерий векторе. Для получения делеции в ОРС fadA5 рекомбинантную плазмиду гидролизуют эндонуклеазой рестрикции SmaI (фирмы Thermo Fisher Scientific, согласно инструкции производителя [https://www.thermofisher.com/order/catalog/product/ER0661]), два сайта которой расположены только в кодирующей последовательности гена, с последующим лигированием в условиях образования кольцевых молекул. Полученной лигазной смесью трансформируют клетки Е. coli DH5α (Novagen, США) и осуществляют селекцию плазмидосодержащих клонов. Полученные трансформанты анализируют на наличие делеции (SEQ ID №4) методом ПЦР. Делецию в кодирующей последовательности гена маркируют встраиванием KmR-кассеты, кодирующей аминогликозид 3'-фосфотрансферазу, из плазмиды pUC4K [32, 33].
Сконструированную плазмиду pEX-ΔfadA5-Km вводят в электрокомпетентные клетки микобактерий электропорацией. Для приготовления компетентных клеток штамм микобактерий выращивают в 5 мл питательной среды MYC в 50-мл пробирках на орбитальном шейкере-инкубаторе при встряхивании с частотой 200 об/мин и эксцентриситетом 50 мм, в течение 48 часов. Среда MYC содержит (г/л): K2HPO4×3Н2О - 0,5; KH2PO4 - 0,5; (NH4)2HPO4 - 1,5; MgSO4×7H2O - 0,2; FeSO4×7H2O - 0,005; ZnSO4×7H2O - 0,002; глицерин - 10; дрожжевой экстракт сухой (тип Difco) - 10; с исходным значением рН 7,0-7,2. Затем 1 мл полученной культуры переносят в 50 мл среды MYC-EC, представляющую собой среду MYC, дополненную (г/л): глицином - 15 и Твином 80-15, и выращивают до оптической плотности 0,8-1,0. Культуру охлаждают в ледяной бане в течение 30 мин и центрифугируют при 5000×g в течение 20 мин при 4°С. Осадок клеток промывают дважды 25 мл охлажденной деионизованной воды, один раз 10% раствором глицерина в деионизованной воде, суспендируют в 1 мл того же раствора, распределяют по 100-200 мкл в стерильные микроцентрифужные пробирки и хранят при -70°С. Для электропорации используют 1-5 мкг ДНК, растворенной в деионизованной воде. ДНК (в объеме не более 5 мкл) добавляют к 100 мкл электрокомпетентных клеток, инкубируют в ледяной бане в течение 5 минут и переносят в предварительно охлажденные 0,2 см кюветы (фирмы "Bio-Rad", США) для электропорации. Электропорацию проводят на приборе Gene Pulser фирмы "Bio-Rad" (США) при напряженности электрического поля 2,5 кВ. Клетки подвергают электрическому импульсу дважды. К электропорированным клеткам добавляют 2 мл среды питательной среды, инкубируют 7-8 часов с аэрацией при 28°С и высевают на селективные среды с отбором меродиплоидных (фенотип KmRTcRSucS) или мутантных клонов (фенотип KmRTcSSucR), возникающих в результате гомологичной рекомбинации. Наличие мутации подтверждают методом ПЦР с использованием специфических праймеров (SEQ ID №5 и SEQ ID №6) (Фиг. 2) и/или секвенированием соответствующего фрагмента ДНК. В результате получают мутантный рекомбинантный штамм Mycolicibacterium neoaurum ВКМ Ac-2846D у которого отсутствует активность β-кетоацил-КоА тиолазы FadA5.
Пример 2.
Рекомбинантный штамм-продуцент Mycolicibacterium получают аналогично Примеру 1, но с использованием в качестве родительского штамма Mycolicibacterium neoaurum NRRL В-3805 с предварительно инактивированным геном kstD (М. neoaurum NRRL B-3805ΔkstD). В результате получают мутантный рекомбинантный штамм М. neoaurum ВКМ Ac-2847D, у которого отсутствуют активности ферментов 3-кетостероид-1-дегидрогеназы KstD и β-кетоацил-КоА тиолазы FadA5. Наличие мутации подтверждают методом ПЦР с использованием специфических праймеров (SEQ ID №5 и SEQ ID №6) (Фиг. 3) и/или секвенированием соответствующего фрагмента ДНК.
Пример 3.
В качестве биокатализатора используют активную культуру М. neoaurum ВКМ Ас-2846D, полученную как указано в Примере 1. Инокулят активной культуры выращивают в две стадии. Весь рост со скошенного агара из одной 20-мл пробирки суспендируют в 50 мл стерильной ростовой питательной среды MYC, описанной в Примере 1; культивируют при 30°С, аэробно, в колбах-качалках, на орбитальном шейкере-инкубаторе при встряхивании с частотой 200 об/мин и эксцентриситетом 50 мм, в течение 24 часов. Получают инокулят первой стадии.
Инокулят первой стадии вносят в количестве 10% (объем/объем) в 100 мл стерильной ростовой среды и культивируют в тех же условиях. Получают инокулят второй стадии.
Инокулят второй стадии используют для инокулирования стерильной среды биоконверсии. Для этого вносят 10 мл инокулята второй стадии в 90 мл готовой стерильной среды биоконверсии. Для приготовления среды биоконверсии, в колбах-качалках составляют 90 мл суспензии с рН 7,0-7,2, содержащей (г/л): K2HPO4×3Н2О - 5,56; KH2PO4 - 1,11; (NH4)2SO4 - 3,33; карбамид - 0,56; глицерин - 5,56; MgSO4×7H2O - 0,22; FeSO4×7H2O - 0,011; ZnSO4×7H2O - 0,0022; Твин (полисорбат) 80-0,11; фитостерин - 5,56. Готовую среду биоконверсии автоклавируют в колбах при 110°С в течение 30 минут и охлаждают; объем испарившейся жидкости в колбах определяют весовым методом и доводят до 90 мл добавлением необходимого количества стерильной дистиллированной воды. После инокулирования исходная нагрузка субстрата биоконверсии составляет 5 г/л.
Биоконверсию проводят в тех же условиях, что и приготовление, инокулята, в течение 144 часов. Каждые 24 часа отбирают пробы среды биоконверсии объемом 200 и 500 мкл. Каждые 24 часа объем испарившейся жидкости в колбах компенсируют добавлением необходимого количества стерильной дистиллированной воды.
Пробы разводят 1:10-1:50 с использованием 50% водного ацетонитрила и анализируют содержание продуктов биоконверсии методом обращеннофазной ВЭЖХ. По окончании процесса биоконверсии остаточный объем среды биоконверсии измеряют и учитывают при расчете выхода продуктов.
Получают биоконверсионную смесь, содержащую стероидные продукты, преимущественно соединения I, II и их 1,2-дегидроаналоги: 24-норхол-1,4-диен-3,22-дион (соединение VII), 20-гидроксиметил-прегна-1,4-диен-3-он (соединение VI) (Фиг. 4). Выход основных продуктов биоконверсии составляет (мг/л): I - 329, II - 146, VII - 91 и VI - 24. Также в среде присутствуют минорные С19-стероидные продукты (мг/л) - андрост-4-ен-3,17-дион (соединение IV) - 39 и андроста-1,4-диен-3,17-дион (соединение V) - 11.
Выходы соединений I и II, выраженные в мольных процентах от внесенного субстрата биоконверсии составляют приблизительно 8% и 3,7%, соответственно. Родительский штамм в тех же условиях трансформирует фитостерин преимущественно в соединение IV, не образует соединения I, и образует 65 мг/л соединения II.
Пример 4.
Получение инокулята, процедуры биоконверсии и анализа осуществляют по Примеру 3, но в качестве биокатализатора используют активную культуру М. neoaurum ВКМ Ac-2847D, полученную как указано в Примере 2.
Выход основных продуктов биоконверсии (мг/л) составляет: соединение I - 297, соединение II - 157, соединение IV - 54, при этом их 1,2-дегидроаналоги (соединения VII, VI, V, соответственно) отсутствуют (Фиг. 5). Выходы соединений I и II, выраженные в мольных процентах от внесенного субстрата биоконверсии составляют приблизительно 7,6% и 4%, соответственно. Родительский штамм в тех же условиях трансформирует фитостерин преимущественно в соединение IV, не образует соединения I, и образует 49 мг/л соединения II (Фиг. 6).
Пример 5.
Получение инокулята, процедуры биоконверсии и анализа осуществляют по Примеру 4, но в среду биоконверсии дополнительно вводят СМЦД со средней степенью замещения 1,6-1,9 до конечной концентрации 31,6 г/л; значение рН среды биоконверсии поддерживают в диапазоне 7,0-7,2, для чего каждые 12 часов корректируют рН 2н раствором KOH до значения 7,2-7,4, каждые 24 часа объем испарившейся жидкости в колбах компенсируют добавлением необходимого количества стерильной дистиллированной воды за вычетом объема внесенного титранта, а биоконверсию осуществляют в течение 216 часов.
Выход основных продуктов биоконверсии (г/л) составляет: соединение I - 1,37, соединение II - 1,12, соединение IV - 0,186, при этом их 1,2-дегидроаналоги (соединения VII, VI, V, соответственно) отсутствуют. Выходы соединений I и II, выраженные в мольных процентах от внесенного субстрата биоконверсии составляют приблизительно 33,2% и 9,3%, соответственно. Родительский штамм в тех же условиях трансформирует фитостерин преимущественно в соединение VI, не образует соединения I, и образует 0,827 г/л соединения II.
Пример 6.
Получение инокулята, процедуры биоконверсии и анализа осуществляют по Примеру 5, но исходную нагрузку субстрата биоконверсии увеличивают до 10 г/л, а концентрацию СМЦД увеличивают до 53,7 г/л; значение рН среды биоконверсии поддерживают в диапазоне 7,0-7,2, для чего каждые 12 часов корректируют рН 2н раствором KOH до значения 7,2-7,4, каждые 24 часа объем испарившейся жидкости в колбах компенсируют добавлением необходимого количества стерильной дистиллированной воды за вычетом объема внесенного титранта, а биоконверсию осуществляют в течение 288 часов.
Выход основных продуктов биоконверсии (г/л) составляет: соединение I - 3,76, соединение II - 2,39; выход побочного продукта биоконверсии IV - 0,51 г/л, при этом 1,2-дегидроаналоги указанных продуктов (соединения VII, VI, V, соответственно) отсутствуют (Фиг. 7). Выходы соединений I и II, выраженные в мольных процентах от внесенного субстрата биоконверсии, составляют приблизительно 45,6% и 30,1%, соответственно.
Пример 7.
Получение инокулята, процедуры биоконверсии и анализа осуществляют по Примеру 6, но вместо СМЦД в среду биоконверсии вводят СГПЦД в концентрации 59 г/л. Выход основных продуктов биоконверсии (г/л) составляет: соединение I - 4,29, соединение II - 1,69; выход побочного продукта биоконверсии IV - 0,12 г/л, при этом 1,2-дегидроаналоги указанных продуктов (соединения VII, VI, V, соответственно) отсутствуют (Фиг. 8). Выходы соединений I и II, выраженные в мольных процентах от внесенного субстрата биоконверсии составляют приблизительно 52,0% и 21,2%, соответственно.
Пример 8.
Получение инокулята, процедуры биоконверсии и анализа осуществляют по Примеру 6, но биотрансформацию осуществляют в трех независимых повторах, в 10 колбах каждый повтор, в идентичных условиях. Полученную культуральную жидкость из 10 колб центрифугируют при 5,4-7,2 тыс. × g в течение 60-30 минут. Надосадочную жидкость декантируют в экстракционный реактор (приблизительно 950 мл). Супернатант титруют при энергичном перемешивании 1н HCl до рН 2,5-3,0. Стероиды экстрагируют из супернатанта последовательно 3 порциями этилацетата 0,6:1 (объем/объем) каждая. Остаточное количество соединений I и II в водной фазе после экстракции составляет менее 0,2-0,4%. Органический экстракт концентрируют под вакуумом при 40-50°С до 10% от исходного объема (170-190 мл), трехкратно отмывают равными объемами дистиллированной воды от гидрофильных компонентов, осушают безводным сульфатом натрия, фильтруют и упаривают фильтрат под вакуумом при 50°С до 90-100 мл. Концентрат охлаждают и осуществляют кристаллизацию продукта при 4°С. После высушивания получают 4,1-4,4 г желтоватых кристаллов, содержащих 70-74% продукта I и 16-18% продукта II, которые дважды перекристаллизовывают из минимальных объемов этилацетата. Получают 1,9-2,1 г бесцветных кристаллов, содержащие 94-95% продукта соединения I. Водные фазы объединяют и концентрируют под вакуумом для повторного использования содержащегося в них СМЦД.
Все маточные растворы объединяют, концентрируют под вакуумом при 50°С до 90-100 мл осушают безводным сульфатом натрия, фильтруют и осуществляют последовательную двукратную преципитацию первичных стероидных спиртов титрованием горячим раствором хлорида кальция в изопропаноле. Осадок отделяют фильтрованием, промывают этилацетатом. Аморфный белый аддукт соединения II с CaCl2 гидролизуют нагреванием водной суспензии при 100°С. Далее осадок промывают дистиллированной водой и высушивают при 80°С. Получают 2,01-2,10 г бесцветного кристаллического продукта II с чистотой более 90%. Полученные кристаллы перекристаллизовывают из минимального количества изопропанола и получают 1,68-1,84 г продукта II с чистотой 94-95%.
Маточный раствор, полученный после преципитации, двукратно отмывают равными объемами дистиллированной воды, осушают безводным сульфатом натрия, фильтруют и упаривают фильтрат под вакуумом при 50°С до начала кристаллизации. 90-100 мл. Получают кристаллы соединения I с чистотой 85-90%. Полученные кристаллы перекристаллизовывают из минимального количества этилацетата и получают добавочную порцию продукта I (0,64-0,72 г) с чистотой 94-95%.
Суммарно получают 2,65-2,82 г соединения I и 1,68-1,84 г соединения II с чистотой 94-95%. Эффективность предложенного способа выделения и очистки составляет более 98% на стадии отделения бактериальных клеток, более 99% на стадии экстракции и более 70% по выходу целевых продуктов I и II от их содержания в среде биоконверсии.
Пример 9.
Получение инокулята, процедуры биоконверсии, анализа и получения надосадочной жидкости осуществляют по Примеру 7. К полученной надосадочной жидкости прибавляют 11,1% (объем/объем) ацетонитрила, 400 мкл трифторуксусной кислоты, перемешивают и центрифугируют при 7,2 тыс. × g в течение 15 минут.Надосадочную жидкость декантируют и пропускают через патрон для твердофазной экстракции, содержащий 20 г сорбента с обращенной фазой C18 со средним размером частиц 10 мкм, затем обращенную фазу в патроне промывают 80 мл 10%-ного водного раствора ацетонитрила и отсасывают элюент при пониженном давлении до прекращения тока. Жидкие фазы объединяют для отгонки ацетонитрила и утилизации.
Полярные примеси элюируют 20 мл 90%-ного водного раствора ацетонитрила и отсасывают элюент при пониженном давлении до прекращения тока (элюат 1). Затем таким же образом, последовательно производят элюцию порцией ацетонитрила 40 мл (получают элюат 2) и порцией смеси ацетонитрила и изопропилового спирта 1:1 (объем/объем) объемом 20 мл с получением элюата 3. Элюат 2 содержит соединения I и II в соотношении приблизительно 19-20:1; элюат 3 содержит соединения II и I в соотношении приблизительно 12-15:1. Элюаты 2 и 3 раздельно упаривают под вакуумом, остатки перерастворяют в минимальных количествах кипящего этанола (соотношение объема растворителя, выраженного в мл к массе высушенного остатка, выраженного в граммах, 7:1 для элюата 2 и 5:1 для элюата 1) и кристаллизуют при температуре -18°С в течение 10-12 часов. Получают 310-335 мг продукта I и 100-120 мг продукта II с чистотой 95-97% и 90-95%, соответственно (приведены данные по трем независимым повторам).
Промышленная применимость.
Соединения со структурой I и II могут быть использованы в фармацевтической промышленности как ценные прекурсоры в синтезах стероидных лекарственных субстанций, в том числе, но не исключительно, кортикостероидов, прогестагенов и производных витамина D3. Использованные для генной инженерии родительские штаммы проявили высокую стабильность активности окисления боковой цепи стеринов, что подтверждается их исследованиями в течение десятилетий. Промышленная применимость предложенного способа иллюстрируется примером 8. Показана возможность масштабирования биопроцесса, что обеспечивается стабильностью целевой активности рекомбинантного штамма в независимых повторах эксперимента и его устойчивостью к антибиотику, что облегчает поддержание культуры и снижает риск массовой контаминации среды биоконверсии. Также, на стадиях выделения и очистки целевых продуктов использована комбинация масштабируемых операций: отделения осадка, эффективной экстракции продуктов органическим растворителем из единственной (водной) фазы, концентрирования органической фазы при пониженном давлении, фильтрации, преципитации, перекристаллизации из единственного растворителя. В качестве органического растворителя экстракции стероидов из супернатанта может быть использован альтернативный несмешивающийся с водой органический растворитель, такой как 4-метил-пентанон и т.п. Эффективность отдельных стадий, особенно стадий финальной очистки продуктов может быть существенно повышена при масштабировании предложенного способа за счет снижения технических потерь продуктов.
Источники информации:
1. Marsheck W.J., Kraychy S., Muir R.D. / Appl. Microbiol. V. 23 P. 72-77. 1972.
2. Andor A., Jekkel A., Hopwood D.A., Jeanplong F.,  Kurucz I., Ambrus G. / Appl. Environ. Microbiol. V. 72 P. 6554-6559. 2006.
Kurucz I., Ambrus G. / Appl. Environ. Microbiol. V. 72 P. 6554-6559. 2006.
3. Shtratnikova V., Bragin E., Dovbnya D., Pekov Yu., Schelkunov N., Strizhov N., Ivashina Т., Ashapkin V., Donova M. / Genome Announc. V. 2 P. 1-2. 2014.
4. Rodriguez-Garcia A., Fernandez-Alegre E., Morales A., Sola-Landa A., Lorraine J., Macdonald S., Dovbnya D., Smith M.C.M., Donova M., Barreiro C. / J. Biotechnol. V. 224 P. 64-65. 2016.
5. Xu LQ, Liu YJ, Yao K, Liu HH, Tao XY, Wang FQ, Wei DZ / Sci. Rep. V. 6 P. 21928. 2016.
6. Mancilla R.A., Pavez-Diaz R., Amoroso A. / Methods Mol. Biol. V. 1645 P. 159-165. 2017.
7.  Martinez I.,
Martinez I.,  Felpeto-Santero C, Garcia J.L.,
Felpeto-Santero C, Garcia J.L.,  / Methods Mol. Biol. V. 1645 P. 211-225. 2017.
/ Methods Mol. Biol. V. 1645 P. 211-225. 2017.
8. Chen D., Wang Zh., Ge M., Jin Y., Ye W. / CN Patent 05014845, 2005
9. Hesselink P.G.M., Vliet S.V., Vries H.О. / Enzyme. Microb. Technol. V. 11 P. 398-404. 1989.
10. Донова M.B., Довбня Д.В., Калиниченко A.H. и др. / Патент РФ 2079258, 1997.
11. Суровцев В.В., Десяткин В.Г., Довбня Д.В. и др. / Патент РФ 2512076, 2014.
12. L. Zhang М., Wang Y., Ma Y., Luo J. / Appl. Biochem. Biotechnol. V. 159 P. 642-654. 2009.
13. Imada Y., Takahashi K. / Eur Patent 0001622, 1978.
14. Wovcha M.G., Antosz F.J., Beaton J.M., Garcia A.B., Kominek L.A. / US Patent 4214051, 1980.
15. Wang Y., Li X., Feng J., Wu Q., Zhu D., Ma Y. / CN Patent 106854630, 2017.
16. Jiu J., Marsheck W.J. / US Patent 3994933, 1976.
17. Neuland P., Ponsold K., Schubert G., Wunderwald M. / East German patent 142054. 1980.
18.  Ambrus G. / Tetrahedron Lett. V. 31 P. 3475-3476. 1990.
Ambrus G. / Tetrahedron Lett. V. 31 P. 3475-3476. 1990.
19.  Ambrus G. / Tetrahedron Lett. V. 33 P. 5265-5266, 1992.
Ambrus G. / Tetrahedron Lett. V. 33 P. 5265-5266, 1992.
20. Gavagnin M., Ungur N., Mollo E., Templado J., Cimino G. / Eur. J. Org. Chem. P. 1500-1504. 2002.
21. Cole W., Julian P.L. / J. Am. Chem. Soc. V. 67 P. 1369-1375. 1945.
22. Schwarz V., Pihera P., Protiva J., Mickova R. / Collect. Czech. Chem. Commun. V. 49 P. 2713-2719. 1984.
23. Protiva J., Schwarz V., Pihera P. / Czech Patent CS235660, 1986.
24. Imada Y., K. Takahashi / Japan Patent 56120698,1981.
25. Weber A., Muller R., Kurzidim J. / US Patent 4057541. 1976.
26. Nesbitt N.M., Yang X., Fontan P., Kolesnikova I., Smith I., Sampson N.S., Dubnau E. / Infect. Immun. V78. P. 275-282. 2010.
27. Xiong L., Liu H., Xu L., Sun W.-J., Wang F.-Q., Wei D.-Z. / Microb. Cell Fact. V. 16:89. 2017.
28. Bragin E.Yu., Shtratnikova V.Yu., Schelkunov M.I., Dovbnya D.V., Donova M.V. / BMC Biotechnol. V. 19:39. 2019.
29. Bragin E.Yu., Shtratnikova V.Yu., Dovbnya D.V., Schelkunov M.I., Pekov Yu.A., Malakho S.G., Egorova O.V., Ivashina T.V., Sokolov S.L., Ashapkin V.V., Donova M.V. / J. Steroid Biochem. Mol. Biol. V. 138 P. 41-53. 2013.
30. Loraine J.K., Smith M.C.M. / Methods Mol. Biol. V. 1645 P. 93-108. 2017.
31. Vieira J., Messing J. / Gene V. 19 P. 259-268. 1982.
32. Hoang T.T., Karkhoff-Schweizer R.R., Kutchma A.J., Schweizer H.P. / Gene V. 212 P. 77-86. 1998.
33. Oka A., Sugisaki H, Takanami M. / J. Mol. Biol. V. 147 P. 217-226. 1981.
--->
Список последовательностей
<110> ООО «Фарминс»
<120> Рекомбинантные микобактериальные штаммы-продуценты и их использование
для получения 22-функционализированных стероидов.
<160> 6
<210> 1
<211> 2609
<212> DNA
<213> Mycolicibacterium neoaurum VKM Ac-1815D
<400> 1
cttcatggcg taggtgatga gctcgaagga ggacatcgcc ggatcgacat cggcgtactc 60
ggggtcctcg cccgcagtca tctcattgga ccagcggaag atcttgtccc ggtcgtcctg 120
cggcacaccg agcagttcgg cgatggcctg cagcggcagt tcgcaggaca cctgctcgac 180
gaagtcgccc gaaccggctg ccgccgcggt ttcggcgatc ttgcgggcac gggcccgcaa 240
ctcgtcttcg agccgtccga tggcgcgcgg ggtgaacccg cgcgagatga tcttgcgcaa 300
ccgggtgtgc tgcggcgcgt ccatgttgag caggacggcc ttctgcagat cgatggcgtc 360
gcgggtcatc tcctgcggcc agaccgggat ggcgccgtcg ggtgagctgc cgaagatgtc 420
gtttcgcttc gagacctctt tgacgtcggc atgcttggtg acgatccagt agcccttgtc 480
gccgaagccc ccggtccctt ccggcacgtc cacccagtgg acgggctcgg cgcggcgaat 540
ctccgccaac tcctccacgg gcaggcgttc gaggttcaga ctggcgtcca gcgggtcgaa 600
gcccttgggc aggttggggc tgggcatgca gagatctcct tgctcaaatc gggtcatgtc 660
accggccacc tcgggtgccg agacaattcc ttctagtacc actcgtgaac cattgaaaca 720
tgccttcacc gcagataaaa ggcgcggcgg catcctcgct tgtcagagta atgaaacgtt 780
tctagcctga caagcatggg taatcctgtc atcgtcgaag ccacccgcag ccccatcggc 840
aagcgcaacg gctggctgtc cgggctgcat gccaccgaac tcttgggcgc cgtgcagaag 900
gcggtcgtcg agaaggccgg gatcgacgcc ggcgatgtcg aacagctcat cggcggctgc 960
gtcacccagt acggcgagca gtccaacaac atcacccggg tcgggtggct gaccgcggga 1020
ttgcccgagc acgtgggtgc caccaccatc gactgccagt gcggcagcgc ccagcaggcc 1080
aaccatctga tcgcgggtct gatcgccacc ggtgcgatcg acatcggcat cgcgtgcggt 1140
atcgaggcga tgagccgagt aggcctcggc gccaatgccg gccccgatcg cggtctcatc 1200
cgcgcatcgt catgggacat cgacatgccc aatcagttcg aggccgccga gcggattgcc 1260
aagcgccgcg ggatcacccg ggccgacctg gacgcgttcg ggctcgcctc gcaggccaag 1320
gccaagcagg cctgggccga gggtcgcttc gatcgggaga tctcacccat ctcggcgccc 1380
gtgctcgacg agaacaagcg tccgaccgac gaatgggcgc tcgtgacccg cgaccagggc 1440
ctgcgcgaca ccacggcgga gggtttggcc gcgctgaagc cggtgatgga aggtgccatg 1500
cacaccgcgg gaacctcctc acagatctcc gatggcgcgg cggcggtgct gtggatggac 1560
agcgatgtgg ccaaggccca cggcctcacg ccgcgcgccc ggatcgtcgc gcaggccaat 1620
gtcggcgccg agacctacta ccacctcgac ggcccggtgc agtcgaccgc caaggtgctg 1680
gagaaggccg ggatgaagat gggcgatatc gacctcgtcg agatcaacga ggctttcgcc 1740
tccgtggtgc tgtcctgggc gcaggtgcac ggggcggaca tggacaaggt caacgtcaac 1800
ggcggcgcca tcgcgctggg gcaccccgtc ggctccaccg gcgcccggtt gatcaccacc 1860
gcgctgcacg agttggaacg caccggcaag agcaccgcgc tcatcacgat gtgcgccggt 1920
ggcgcgctga gcacgggcac catcatcgaa aggatctgag accgcatggc cgtctcggac 1980
gccgaacgga tcgcggcggc gcagtcctat atcgacgcgc tgtcgaccca tcgcgcggat 2040
gccgtcccat ttcatccgga ttgcatccgc atcgagatgg ggctcaagac cgggcggtcg 2100
ggagatcacc tgcggcgcag cctgaacaac ggtccgcagt tcaaggtcat cgaaaagacc 2160
acgccaccgg agttcaccgt cgacggggac cacatccgtg ctcgtttcga cgtgctgacc 2220
aagcctcggc tgttcggcag gcgcgtgtgc tcccatgtcg acgagacgtt tctgatcccc 2280
gcccacgatc cccggatcca ccacatccgg gcgtcgctca agccgttcat cagccgttag 2340
ggtttcggca tgcccacacc acccaagcct ctgagcccca aacagatcga aggcctcaac 2400
tccaaggcgg tcggcaccgg catcaaatgg atgtcgcgtg ccaatacctg gctgttcaag 2460
aagtccggcg gcaagctcgg caacaaattc ctgcgtggcg ccgaggtagg catcctgacc 2520
accaccggcc gcaagtccgg ggagccacgg gacagtccgc tgctgttcct gcaggagggc 2580
aggcgcatcg tgttggtggc ctcccaagg 2609
<210> 2
<211> 26
<212> DNA
<213> Artificial Sequence
<400> 2
ttaggtacca caaagcacca ctgcgc 26
<210> 3
<211> 24
<212> DNA
<213> Artificial Sequence
<400> 3
ttcgagctcc agatcttctg tccg 24
<210> 4
<211> 2330
<212> DNA
<213> Artificial Sequence
<400> 4
cttcatggcg taggtgatga gctcgaagga ggacatcgcc ggatcgacat cggcgtactc 60
ggggtcctcg cccgcagtca tctcattgga ccagcggaag atcttgtccc ggtcgtcctg 120
cggcacaccg agcagttcgg cgatggcctg cagcggcagt tcgcaggaca cctgctcgac 180
gaagtcgccc gaaccggctg ccgccgcggt ttcggcgatc ttgcgggcac gggcccgcaa 240
ctcgtcttcg agccgtccga tggcgcgcgg ggtgaacccg cgcgagatga tcttgcgcaa 300
ccgggtgtgc tgcggcgcgt ccatgttgag caggacggcc ttctgcagat cgatggcgtc 360
gcgggtcatc tcctgcggcc agaccgggat ggcgccgtcg ggtgagctgc cgaagatgtc 420
gtttcgcttc gagacctctt tgacgtcggc atgcttggtg acgatccagt agcccttgtc 480
gccgaagccc ccggtccctt ccggcacgtc cacccagtgg acgggctcgg cgcggcgaat 540
ctccgccaac tcctccacgg gcaggcgttc gaggttcaga ctggcgtcca gcgggtcgaa 600
gcccttgggc aggttggggc tgggcatgca gagatctcct tgctcaaatc gggtcatgtc 660
accggccacc tcgggtgccg agacaattcc ttctagtacc actcgtgaac cattgaaaca 720
tgccttcacc gcagataaaa ggcgcggcgg catcctcgct tgtcagagta atgaaacgtt 780
tctagcctga caagcatggg taatcctgtc atcgtcgaag ccacccgcag ccccatcggc 840
aagcgcaacg gctggctgtc cgggctgcat gccaccgaac tcttgggcgc cgtgcagaag 900
gcggtcgtcg agaaggccgg gatcgacgcc ggcgatgtcg aacagctcat cggcggctgc 960
gtcacccagt acggcgagca gtccaacaac atcacccggg ccgacctgga cgcgttcggg 1020
ctcgcctcgc aggccaaggc caagcaggcc tgggccgagg gtcgcttcga tcgggagatc 1080
tcacccatct cggcgcccgt gctcgacgag aacaagcgtc cgaccgacga atgggcgctc 1140
gtgacccgcg accagggcct gcgcgacacc acggcggagg gtttggccgc gctgaagccg 1200
gtgatggaag gtgccatgca caccgcggga acctcctcac agatctccga tggcgcggcg 1260
gcggtgctgt ggatggacag cgatgtggcc aaggcccacg gcctcacgcc gcgcgcccgg 1320
atcgtcgcgc aggccaatgt cggcgccgag acctactacc acctcgacgg cccggtgcag 1380
tcgaccgcca aggtgctgga gaaggccggg atgaagatgg gcgatatcga cctcgtcgag 1440
atcaacgagg ctttcgcctc cgtggtgctg tcctgggcgc aggtgcacgg ggcggacatg 1500
gacaaggtca acgtcaacgg cggcgccatc gcgctggggc accccgtcgg ctccaccggc 1560
gcccggttga tcaccaccgc gctgcacgag ttggaacgca ccggcaagag caccgcgctc 1620
atcacgatgt gcgccggtgg cgcgctgagc acgggcacca tcatcgaaag gatctgagac 1680
cgcatggccg tctcggacgc cgaacggatc gcggcggcgc agtcctatat cgacgcgctg 1740
tcgacccatc gcgcggatgc cgtcccattt catccggatt gcatccgcat cgagatgggg 1800
ctcaagaccg ggcggtcggg agatcacctg cggcgcagcc tgaacaacgg tccgcagttc 1860
aaggtcatcg aaaagaccac gccaccggag ttcaccgtcg acggggacca catccgtgct 1920
cgtttcgacg tgctgaccaa gcctcggctg ttcggcaggc gcgtgtgctc ccatgtcgac 1980
gagacgtttc tgatccccgc ccacgatccc cggatccacc acatccgggc gtcgctcaag 2040
ccgttcatca gccgttaggg tttcggcatg cccacaccac ccaagcctct gagccccaaa 2100
cagatcgaag gcctcaactc caaggcggtc ggcaccggca tcaaatggat gtcgcgtgcc 2160
aatacctggc tgttcaagaa gtccggcggc aagctcggca acaaattcct gcgtggcgcc 2220
gaggtaggca tcctgaccac caccggccgc aagtccgggg agccacggga cagtccgctg 2280
ctgttcctgc aggagggcag gcgcatcgtg ttggtggcct cccaagg 2327
<210> 5
<211> 34
<212> DNA
<213> Artificial Sequence
<400> 5
ttatttcata tgcagagatc tccttgctca aatc 34
<210> 6
<211> 27
<212> DNA
<213> Artificial Sequence
<400> 6
ttaagcttgc ggtctcagat cctttcg 27
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| ШТАММ БАКТЕРИЙ MYCOBACTERIUM NEOAURUM И СПОСОБ ЕГО ИСПОЛЬЗОВАНИЯ ДЛЯ ПОЛУЧЕНИЯ АНДРОСТ-4-ЕН-3,17-ДИОНА ИЗ СТЕРИНОВ РАСТИТЕЛЬНОГО И ЖИВОТНОГО ПРОИСХОЖДЕНИЯ | 2001 |
|
RU2231553C2 |
| СПОСОБ ПОЛУЧЕНИЯ АНДРОСТА-1,4-ДИЕН-3,17-ДИОНА ИЗ СТЕРИНОВ РАСТИТЕЛЬНОГО И ЖИВОТНОГО ПРОИСХОЖДЕНИЯ | 2005 |
|
RU2297455C2 |
| СПОСОБ ПОЛУЧЕНИЯ АНДРОСТА-4,9(11)-ДИЕН-3,17-ДИОНА ИЗ ФИТОСТЕРИНА | 2012 |
|
RU2512076C1 |
| МИКРОБИОЛОГИЧЕСКИЙ СПОСОБ ПОЛУЧЕНИЯ 1,2-ДЕГИДРИРОВАННЫХ ПРОИЗВОДНЫХ Δ-3-КЕТОСТЕРОИДОВ РЯДА АНДРОСТАНА В ВОДНО-ОРГАНИЧЕСКИХ СРЕДАХ | 2010 |
|
RU2447154C1 |
| СПОСОБ КОНСТРУИРОВАНИЯ ГЕНЕТИЧЕСКИ МОДИФИЦИРОВАННОГО ШТАММА МИКРООРГАНИЗМА | 2000 |
|
RU2268935C2 |
| СПОСОБ ПОЛУЧЕНИЯ 11БЕТА, 17АЛЬФА, 21-ТРИГИДРОКСИ-16АЛЬФА-МЕТИЛ-9АЛЬФА-ФТОРПРЕГНА-1,4-ДИЕН-3,20-ДИОНА (ДЕКСАМЕТАЗОНА) ИЗ ФИТОСТЕРИНА | 2013 |
|
RU2532902C1 |
| БИОТЕХНОЛОГИЧЕСКАЯ ОПТИМИЗАЦИЯ МИКРООРГАНИЗМОВ | 2020 |
|
RU2832723C2 |
| ЦЕЛЬНОКЛЕТОЧНАЯ СИСТЕМА ДЛЯ БИОКАТАЛИЗА МОНООКСИГЕНАЗ ЦИТОХРОМА P450 | 2014 |
|
RU2684714C2 |
| ПОЛУЧЕНИЕ 1,4 ДИАМИНОБУТАНА | 2010 |
|
RU2577967C2 |
| СПОСОБ ПОЛУЧЕНИЯ 11БЕТА-ГИДРОКСИ-9БЕТА,10АЛЬФА-СТЕРОИДОВ С ИСПОЛЬЗОВАНИЕМ КЛЕТОК AMYCOLATOPSIS MEDITERRANEI | 2007 |
|
RU2426792C2 |





Группа изобретений относится к рекомбинантным штаммам Mycolicibacterium neoaurum, а также их применению для получения 22-функционализированных стероидов. Предложен рекомбинантный штамм Mycolicibacterium neoaurum ВКМ Ac-2846D, трансформирующий стерины в 24-норхол-4-ен-3,22-дион, 20-гидроксиметил-прегн-4-ен-3-он и соответствующие 1-дегидроаналоги. Также предложен рекомбинантный штамм Mycolicibacterium neoaurum ВКМ Ac-2847D, трансформирующий стерины в 24-норхол-4-ен-3,22-дион и 20-гидроксиметил-прегн-4-ен-3-он без примеси соответствующих 1-дегидроаналогов. Указанные штаммы получены введением маркированной направленной делеции в ген стероидной β-кетоацил-КоА-тиолазы fadA5 в соответствующих родительских штаммах. Указанные штаммы применяют для биотрансформации фитостерина в 24-норхол-4-ен-3,22-дион, 20-гидроксиметил-прегн-4-ен-3-он и их 1-дегидроаналоги. 6 н. и 4 з.п. ф-лы, 8 ил., 1 табл., 9 пр.
1. Рекомбинантный штамм Mycolicibacterium neoaurum ВКМ Ac-2846D, трансформирующий стерины в 24-норхол-4-ен-3,22-дион, 20-гидроксиметил-прегн-4-ен-3-он и соответствующие 1-дегидроаналоги и полученный введением маркированной направленной делеции в ген стероидной β-кетоацил-КоА-тиолазы fadA5, входящий в геномную ДНК родительского штамма Mycolicibacterium neoaurum ВКМ Ac-1815D, имеющий нуклеотидную последовательность SEQ ID №1, что обеспечивает возможность ее замещения на нуклеотидную последовательность SEQ ID №4.
2. Рекомбинантный штамм по п. 1, отличающийся тем, что уровень гомологии последовательности SEQ ID №1 составляет 100-80%.
3. Рекомбинантный штамм по п. 1, отличающийся тем, что уровень гомологии последовательности SEQ ID №4 составляет 100-80%.
4. Рекомбинантный штамм Mycolicibacterium neoaurum ВКМ Ac-2847D, трансформирующий стерины в 24-норхол-4-ен-3,22-дион и 20-гидроксиметил-прегн-4-ен-3-он без примеси соответствующих 1-дегидроаналогов и полученный введением направленной делеции в ген стероидной β-кетоацил-КоА-тиолазы fadA5, входящий в геномную ДНК родительского штамма Mycolicibacterium neoaurum NRRL В-3805 с нуклеотидной последовательностью SEQ ID №1, что обеспечивает возможность ее замещения на нуклеотидную последовательность SEQ ID №4, при этом в родительском штамме предварительно инактивируют ген kstD.
5. Рекомбинантный штамм по п. 4, отличающийся тем, что уровень гомологии последовательности SEQ ID №1 составляет 100-80%.
6. Рекомбинантный штамм по п. 4, отличающийся тем, что уровень гомологии последовательности SEQ ID №4 составляет 100-80%.
7. Применение штаммов по любому из пп. 1-3 для биотрансформации фитостерина в 24-норхол-4-ен-3,22-дион, 20-гидроксиметил-прегн-4-ен-3-он и их 1-дегидроаналоги.
8. Применение штаммов по любому из пп. 4-6 для биотрансформации фитостерина в 24-норхол-4-ен-3,22-дион и 20-гидроксиметил-прегн-4-ен-3-он.
9. Применение штамма по любому из пп. 4-6 для биотрансформации фитостерина преимущественно в 24-норхол-4-ен-3,22-дион, отличающийся тем, что в состав среды биотрансформации вводят статистически гидроксипропилированный β-циклодекстрин.
10. Способ выделения и очистки 24-норхол-4-ен-3,22-диона и 20-гидроксиметил-прегн-4-ен-3-она, получаемых по любому из пп. 8-9 с использованием бактериальных клеток по любому из пп. 4-6, включающий отделение бактериальных клеток от культуральной жидкости, экстракцию стероидных продуктов биотрансформации из надосадочной жидкости органическим растворителем, отличающийся тем, что органический экстракт, содержащий продукты биотрансформации, отмывают водой, осуществляют ступенчатую кристаллизацию и перекристаллизацию 24-норхол-4-ен-3,22-диона из того же органического растворителя, при этом содержащийся в маточных растворах 20-гидроксиметил-прегн-4-ен-3-он селективно отделяют посредством преципитации в виде нерастворимого аддукта с хлоридом кальция от 24-норхол-4-ен-3,22-диона.
| XU L.Q | |||
| ET AL | |||
| Прибор для равномерного смешения зерна и одновременного отбирания нескольких одинаковых по объему проб | 1921 |
|
SU23A1 |
| Sci Rep | |||
| Токарный резец | 1924 |
|
SU2016A1 |
| Токарный резец | 1924 |
|
SU2016A1 |
| CN 106854630 A, 16.06.2017 | |||
| СПОСОБ ПОЛУЧЕНИЯ ПОЛИАМИДОВ | 0 |
|
SU235660A1 |
| XIONG L.B | |||
| ET AL | |||
| Машина для добывания торфа и т.п. | 1922 |
|
SU22A1 |
Авторы
Даты
2022-03-18—Публикация
2019-12-10—Подача