Настоящее изобретение относится к проводимому при катализе палладием энантиоселективному способу получения производных γ-амино-α,β-ненасыщенных карбоновых кислот и промежуточных продуктов, а также производных γ-аминокислот.
Уровень техники
Рацемические варианты получения производных γ-амино-α,β-ненасыщенных карбоновых кислот и их α-замещенных аналогов с помощью катализируемого палладием аллильного аминирования описаны в публикации Tanikaga et al., J. Chem. Soc., Chem. Commun., p.386-387 (1987). В способе, описанном в публикации Tanikaga et al., используют субстраты, содержащие классические отщепляющиеся группы, такие как хлорацетаты и карбонаты, и получают рацемические продукты.
В публикации Mellegaard-Waetzig, et al., Synlett, p.2759-2762 (2005) описано аллильное замещение карбаматными отщепляющимися группами, в котором карбаматная отщепляющаяся группа также является источником амина. Однако до настоящего изобретения не была известна методика энантиоселективного катализируемого палладием аллильного аминирования производных α,β-ненасыщенных карбоновых кислот.
Краткое изложение сущности изобретения
Настоящее изобретение относится к способу катализируемого палладием энантиоселективного аллильного аминирования производных α,β-ненасыщенных карбоновых кислот. В одном объекте настоящего изобретения способ включает реакцию рацемической смеси производного карбоновой кислоты, описывающегося структурной формулой I:

с хиральным лигандом и палладиевым катализатором в присутствии нуклеофильного реагента с получением энантиомерно обогащенных производных α,β-ненасыщенных карбоновых кислот, описывающихся формулой II и III:


причем в формуле I, II и III R1 обозначает бензильную группу, н-бутильную группу или циклогексильную группу; R2 обозначает бензильную группу или водород; XR3 обозначает этоксигруппу, амидную группу или трет-бутоксигруппу. В формуле II NR1R2 также могут образовать фталимидный заместитель.
Другим объектом настоящего изобретения является катализируемого палладием энантиоселективного аллильного аминирования производных α,β-ненасыщенных карбоновых кислот, указанный способ включает реакцию рацемической смеси производного карбоновой кислоты, описывающегося формулой VI

с хиральным лигандом и палладиевым катализатором в присутствии нуклеофильного реагента с получением энантиомерно обогащенных производных α,β-ненасыщенных карбоновых кислот, описывающихся формулой VII и VIII:


причем в формуле VI и VII R2 обозначает алкильную группу и в формуле VIII R1 обозначает бензильную группу или ПМФ (ПМФ=4-метоксифенил). Предпочтительно, если R2 обозначает этильную или метильную группу.
Образовавшийся аллиламин и непрореагировавший карбамат можно разделить с получением чистых соединений.
В литературе описаны многочисленные методики восстановления двойной связи производных α,β-ненасыщенных карбоновых кислот. Поэтому продукты, предлагаемые в настоящем изобретении, можно легко превратить в соответствующие производные γ-аминокислот путем восстановления двойной связи.
Подробное описание изобретения
В контексте настоящего изобретения катализируемое палладием энантиоселективное аллильное аминирование производных α,β-ненасыщенных карбоновых кислот включает субстраты с карбаматными отщепляющимися группами, в которых карбаматная отщепляющаяся группа также является источником амина, приводит к увеличенному энантиомерному избытку продуктов, как показано на схеме I.
Таким образом, настоящее изобретение относится к энантиоселективному способу получения производных γ-амино-α,β-ненасыщенных карбоновых кислот и промежуточных продуктов, а также производных γ-аминокислот.
Схема 1

Примечательно, что непрореагировавшее исходное вещество характеризуется сходным энантиомерным избытком при степени превращения, доставляющей примерно 50%, что указывает на кинетическое оптическое расщепление. Эксперименты, которые были проведены при степени превращения >90% и с получением почти рацемических продуктов, подтверждают наличие кинетического оптического расщепления.
При разработке настоящего изобретения эксперименты по аллильному аминированию с использованием субстратов, содержащих классические отщепляющиеся группы, таких как хлорацетаты и карбонаты, привели к получению продуктов со средним энантиомерным избытком. В случае карбонатных отщепляющихся групп, как показано на схеме 2, наблюдается образование соответствующего карбамата в качестве побочного продукта. Карбаматный побочный продукт характеризуется наибольшим энантиомерными избытками в смеси продукт/побочный продукт/исходное вещество.
Схема 2

В контексте настоящего изобретения улучшенные энантиоселективности обеспечиваются при использовании карбаматов в качестве отщепляющихся групп, как показано на схеме 3 и в таблице 1. Энантиоселективности, приведенные в таблице 1, рассчитаны по отношениям содержаний отдельных энантиомеров в реакционных смесях (ВЭЖХ).
Схема 3

Наибольшие энантиоселективности обеспечиваются при использовании рац-6 в качестве субстрата и бензиламина или фталимида калия (KPhTh) в качестве нуклеофильного реагента. Эти нуклеофильные реагенты взаимодействуют намного быстрее, чем образовавшийся in situ дибензиламин, и в обоих случаях образуются лишь небольшие количества (<4%) замещенного дибензиламином побочного продукта 12 (схема 4, таблица 2).
Схема 4

(1,0)
9:1
эфир (50 мол.%)
Превращение карбаматов сильно зависит от состава палладиевого катализатора: при использовании [Pd(аллил)Cl]2 один из энантиомеров промежуточного карбамата предпочтительно превращается непосредственно в соответствующий аллиламин, а другой энантиомер остается в основном неизмененным. В этом случае карбаматный фрагмент одновременно выступает и в качестве отщепляющейся группы, и в качестве источника амина и получают смесь аллиламина и соответствующего, непрореагировавшего карбамата (схема 3). Однако с использованием [Pd2(dba)3]-CHCl3 в качестве источника палладия превращение карбаматов в амины не происходит. При использовании карбонатов в качестве отщепляющихся групп с этим источником катализатора и хиральным лигандом L1 наблюдается предпочтительное превращение одного энантиомера субстрата в соответствующий карбамат, а другой энантиомер субстрата остается в основном неизмененным (схема 5). Абсолютные конфигурации соединений 1 и 3 определены путем сопоставления с энантиомерно чистыми соединениями.
Схема 5

Эти результаты представляют собой первое катализируемое палладием энантиоселективное превращение аллилкарбоната в соответствующий аллилкарбамат.
Введение α-метильного заместителя снижает реакционную способность субстратов. Отщепляющиеся группы, такие как ацетаты, карбонаты и карбаматы, не вступают в реакцию. Искомый продукт замещения получают только при использовании более реакционноспособной фосфатной отщепляющейся группы (схема 6).
Схема 6

ПМФ: 4-Метоксифенил
В контексте настоящего изобретения энантиомерный избыток производных γ-амино-α,β-ненасыщенных карбоновых кислот и промежуточных продуктов обеспечивается с помощью реакции, представленной на схеме 3, и субстратов, приведенных в таблице 1.
Примеры субстратов, пригодных для практического осуществления способов, предлагаемых в настоящем изобретении, включают, например, рац-этил-(2E)-4-(бензиламинокарбонилокси)пент-2-еноат, рац-этил-(2E)-4-(бутиламинокарбонилокси)пент-2-еноат, рац-этил-(2E)-4-(циклогексиламинокарбонилокси)пент-2-еноат, рац-этил-(2Е)-4-(дибензиламинокарбонилокси)пент-2-еноат и рац-трет-бутил-(2E)-4-(бензиламинокарбонилокси)пент-2-еноат, приведенные в качестве субстратов 3-7 соответственно в столбце 1 таблицы 1. В качестве субстрата предпочтительно используют рац-6 (рац-этил-(2Е)-4-(дибензиламинокарбонилокси)пент-2-еноат).
Также в контексте настоящего изобретения энантиомерное обогащение производных γ-амино-α,β-ненасыщенных карбоновых кислот и промежуточных продуктов обеспечивается по реакции, представленной на схеме 6, и с использованием субстратов, приведенных в таблице 3, с учетом того, что субстратом, представленным на схеме 6, может быть любая альфа-алкилзамещенная карбоновая кислота. При использовании в настоящем описании алкил, если специально не указано иное, означает обладающий линейной или разветвленной цепью алкил, содержащий от 1 до 4 атомов углерода, такой как метил, этил, пропил, изопропил, бутил, изобутил, втор-бутил и трет-бутил. Предпочтительно, если алкильным заместителем является метил или этил.
"Энантиомерно обогащенное" означает производное карбоновой кислоты, которое всегда содержит от не менее примерно 40% до не менее примерно 96% одного энантиомера этого производного карбоновой кислоты. Например, энантиомерно обогащенный может означать, что один энантиомер конкретного производного составляет не менее примерно 40%, не менее примерно 43%, не менее примерно 45%, не менее примерно 48%, не менее примерно 50%, не менее примерно 65%, не менее примерно 70%, не менее примерно 72%, не менее примерно 74%, не менее примерно 76%, не менее примерно 80%, не менее примерно 82%, не менее примерно 84%, не менее примерно 85%, не менее примерно 89%, не менее примерно 90%, не менее примерно 91%, не менее примерно 93%, не менее примерно 95% или не менее примерно 96% в пересчете на энантиомеры производного карбоновой кислоты.
При использовании в настоящем изобретении термин "энантиоселективная" означает химическую реакцию, которая приводит к предпочтительному образованию одного энантиомера по сравнению с другим энантиомером, например, дает продукт, в котором искомый энантиомер содержится в количестве, составляющем от не менее примерно 40% до не менее примерно 96%. Например, энантиоселективная может означать реакцию, которая дает продукт, в котором искомый энантиомер содержится в количестве, составляющем не менее примерно 40%, не менее примерно 43%, не менее примерно 45%, не менее примерно 48%, не менее примерно 50%, не менее примерно 65%, не менее примерно 70%, не менее примерно 72%, не менее примерно 74%, не менее примерно 76%, не менее примерно 80%, не менее примерно 82%, не менее примерно 84%, не менее примерно 85%, не менее примерно 89%, не менее примерно 90%, не менее примерно 91%, не менее примерно 93%, не менее примерно 95% или не менее примерно 96%.
Примеры нуклеофильных реагентов, пригодных для практического осуществления способов, предлагаемых в настоящем изобретении, включают, например, бензиламин, н-бутиламин, циклогексиламин, дибензиламин и фталимид калия. В качестве нуклеофильного реагента предпочтительно используют бензиламин или фталимид калия. Предпочтительные нуклеофильные реагенты взаимодействуют намного быстрее с использованием рац-6, чем с использованием образовавшегося in situ дибензиламина и в обоих случаях образуются лишь небольшие количества (<4%) замещенного дибензиламином побочного продукта 12 (рац-этил-(2E)-N,N-дибензил-4-аминопент-2-еноата), как показано на схеме IV и в таблице II.
Примеры хиральных лигандов, пригодных для практического осуществления способов, предлагаемых в настоящем изобретении, включают любые хиральные лиганды, использующиеся в литературе для катализируемой палладием реакции аллильного замещения. В способах, предлагаемых в настоящем изобретении, предпочтительно используют хиральный лиганд L1, описывающийся структурной формулой:

или хиральный лиганд L2, описывающийся структурной формулой:

Примеры палладиевых катализаторов, которые можно использовать в контексте настоящего изобретения, включают, например, [Pd2(dba)3]·CHCl3. Предпочтительно палладиевым катализатором является [Pd(аллил)Cl]2. Например, при использовании [Pd(аллил)Cl]2 один энантиомер промежуточного карбамата предпочтительно превращается непосредственно в соответствующий аллиламин, тогда как другой энантиомер остается в основном неизмененным. В этом случае карбаматный фрагмент одновременно выступает и в качестве отщепляющейся группы, и в качестве источника амина и получают смесь аллиламина и соответствующего непрореагировавшего карбамата, как показано на схеме 3. Образовавшийся аллиламин и непрореагировавший карбамат легко разделяются с помощью хроматографии на силикагеле с получением чистых соединений.
Примеры диапазонов температуры, пригодных для практического осуществления способов, предлагаемых в настоящем изобретении, включают составляющие от примерно 25 до примерно 40°С. Предпочтительно, если температура реакции превращения 3 (рац-этил-(2Е)-4-(бензиламинокарбонилокси)пент-2-еноата) в 2 (рац-этил-(2Е)-N-бензил-4-аминопент-2-еноат) равна 25°С. Температура реакции превращения 4 (рац-этил-(2Е)-4-(бутиламинокарбонилокси)пент-2-еноата) в (рац-этил-(2E)-N-бутил-4-аминопент-2-еноат) предпочтительно равна 25°С. Предпочтительно, если температура реакции 5 (рац-этил-(2E)-4-(циклогексиламинокарбонилокси)пент-2-еноат)-с образованием 11 (рац-этил-(2E)-N-циклогексил-4-аминопент-2-еноата) равна 40°С. Реакцию 6 (рац-этил-(2E)-4-(дибензиламинокарбонилокси)пент-2-еноата) с образованием 12 (рац-этил-(2E)-N,N-дибензил-4-аминопент-2-еноата) предпочтительно проводят при 25°С. Предпочтительно, если температура реакции 7 (рац-трет-бутил-(2E)-4-(бензиламинокарбонилокси)пент-2-еноата) с образованием 13 (рац-трет-бутил-(2E)-N-бензил-4-аминопент-2-еноата) равна 25°С.
Ниже в качестве примера приведено неограничивающее описание.
ПРИМЕР 1
Общая методика синтеза субстратов, включая субстраты 3-5 и 7-9, приведенная на схеме III и в таблице I, включает растворение соответствующего спирта (например, (рац-этил-(2Е)-4-гидроксипент-2-еноата), соединение 21) и изоцианата в толуоле и перемешивания реакционной смеси при кипячении с обратным холодильником до полного превращения спирта. Затем реакционную смесь выпаривают при пониженном давлении при температуре около 40°С и дополнительно очищают, например, с помощью флэш-хроматографии или перекристаллизации.
ПРИМЕР 2
Общая методика синтеза продуктов рацемического аллильного аминирования, включая продукты рацемического аллильного аминирования 2 и 10-15, приведенные на схеме III и в таблице I, включает растворение [Pd2((dba)3]·CHCl3 и PPh3 в соотношении, составляющем примерно от 1:4 до 1:5, в дегазированном растворителе и перемешивание реакционной смеси при температуре реакции, указанной в таблице 1, в течение примерно 10-30 мин. Затем добавляют субстрат и амин и реакционную смесь перемешивают, пока исходное вещество полностью не подвергнется превращению. Затем реакционную смесь предпочтительно фильтруют через SiO2 с использованием tBuOMe и очищают с помощью хроматографии.
ПРИМЕР 3
Общая методика синтеза (R)-2, (R)-10-13 и соединений 14, 15, 18, 19 представлена на схеме III и в таблице 1.
В сосуд, такой как пробирка Шленка, помещают [Pd] (8 мол.%) и лиганд (12 мол.%), если не указано иное. Затем в приборе создают атмосферу инертного газа, такого как аргон (три цикла откачка/заполнение аргоном). Катализатор растворяют в CH2Cl2 (1,25 мл) при перемешивании (в течение не менее 10 мин). Затем микролитровым шприцем (Hamilton Gaslight, воздух удален) добавляют внутренний стандарт (аббревиатура: ВС, фенилгексан nHexPh ~ 15 мкл или дифениловый эфир Ph2O ~ 11 мкл) и субстрат (0,125 ммоля) и отбирают образец. При использовании бифенила (PhPh) в качестве ВС (~14 мг) и твердых или вязких субстратов их добавляют вместе с предварительным катализатором и лигандом. После добавления смеси амин/нуклеофильный реагент можно отбирать следующие образцы.
Приготовление образцов:
SP1: Образец реакционной смеси (20 мкл) фильтруют через SiO2 (0,1 г, кондиционирован с помощью 1 мл н-гексана) с использованием tВuОМе (1 мл). Для определения степени превращения фильтрат анализируют с помощью ВЭЖХ (высокоэффективная жидкостная хроматография) (LC). Для определения энантиомерного избытка растворитель выпаривают в токе n2 и смесь растворяют в элюенте для соответствующей методики ВЭЖХ (CLC).
SP2: Вариант SP1; SiO2 кондиционируют с помощью 25 мкл Et3N и 1 мл н-гексана.
SP3: Вариант SP1: Фильтрование с использованием ТГФ (тетрагидрофуран) (1 мл, нестабилизированный, пероксиды удаляют фильтрованием через Al2O3)
SP4: Вариант SP3: SiO2 кондиционируют с помощью 25 мкл Et3N и 1 мл н-гексан.
Методики ВЭЖХ:
Колонка: Supeico Hypersil MOS-2 3 мкм, 100×4,6 мм. Скорость потока: 1,5 мл/мин-1. Температура колонки: 40°С. Длина волны детектирования: 210 нм.
LC1: Элюенты: 0,01 М (NH4)2HPO4, MeCN; 30%→80% (16 мин), 80%→30% (1 мин), 30% (2 мин)
LC2: Элюенты: 0,01 М KH2PO4, MeCN; 30%→80% (16 мин), 80%→30% (1 мин), 30% (2 мин)
Времена удерживания t приведены в минутах. Времена удерживания для ВС в случае LC1 и LC2: t(PhPh)=8,6, t(Ph20)=8,7, t(nHexPh)=12,8
Методики разделения с помощью хиральной ВЭЖХ:
Ниже приведены составы элюентов в объемных отношениях. Отношения для элюирование в градиентном режиме указаны для органических растворителей. Времена удерживания t приведены в минутах.
CLC1: н-гексан:МеОН 97,5:2,5
CLC2: н-гексан:МеОН:iPrOH 99:0,5:0,5
CLC3: н-гексан:МеОН:iPrOH 98,75:0,75:0,5
CLC4: H-гексан:tPrOH:MeOH:Et2NH 93:5:2:0,01
CLC5: н-гексан:МеОН 99,5:0,5
CLC6: 30°С; Элюенты: значение pH 0,01 М раствора K2HPO4 доводят до 6,5 с помощью H3PO4, МеОН; 60%→84% (30 мин), 84% (5 мин), 84%→60% (5 мин), 60% (10 мин)
CLC7: 40°С; Элюенты: значение pH 0,01 М раствора K2HPO4 доводят до 6,5 с помощью Н3РO4, МеОН; 60%→88% (35 мин), 88% (10 мин), 88%→60% (5 мин), 60% (10 мин)
CLC1-5: Колонка: Chiralpak AD-H, 4,6×250 мм с форколонкой 4,6×10 мм. Скорость потока: 1,0 мл/мин. Температура колонки: 30°С. Длина волны детектирования: 210 нм.
CLC6/7: Колонка: Chiralpak AD-RH, 4,6×150 мм. Скорость потока: 0,5 мл/мин-1. Длина волны детектирования: 210 нм.
ПРИМЕР 4
Получение рац-этил-(2E)-4-(метоксикарбонилокси)пент-2-еноата (1)
Рац-этил-(2Е)-4-гидроксипент-2-еноат (21) (10,09 г, 70 ммолей), ДМАП (4-N,N-диметиламинопиридин) (1,71 г, 14 ммолей) и пиридин (17 мл, 210 ммолей) растворяют в ТГФ (400 мл). Раствор охлаждают до 1°С. Затем в течение 3 ч при перемешивании при 1°С по каплям добавляют метилхлорформиат (16,1 мл, 210 ммолей) в ТГФ (50 мл). Через 2 ч четырьмя порциями по каплям добавляют метилхлорформиат (199 мл, 2,50 моля) в ТГФ (150 мл). После добавления каждой порции реакционную смесь перемешивают в течение 5 ч при 1°С. Реакцию останавливают с помощью 10% HCl (0,5 л) и экстрагируют с помощью tBuOMe (1,5 и 0,5 л). Органические фазы промывают с помощью 10% HCl (0,5 л) насыщенным раствором NaHCO3 (0,3 л) и рассолом (2×0,2 л) последовательно. Объединенные органические фазы сушат над Na2SO4 и выпаривают при пониженном давлении. Остаток очищают с помощью флэш-хроматографии (tBuOMe:ракция гептана от 15:85 до 25:75) и получают 1 (рац-этил-(2Е)-4-(метоксикарбонилокси)пент-2-еноат) (8,64 г, 61%) в виде желтоватого масла.
Rf(tBuOMe: фракция гептана 40:60)=0,40.
1Н-ЯМР (300 МГц, CDCl3): δ 1,29 (t, 3Н, J=7,2 Гц), 1,43 (d, 3H, J=6,8 Гц), 3,80 (s, 3Н), 4,21 (q, 2H, J=7,0 Гц), 5,30-5,39 (m, 1H), 6,01 (dd, 1H, J=15,7, 1,6 Гц), 6,88 (dd, 1H, J=15,7, 5,2 Гц).
13С{1H}-ЯМР (100,6 МГц, CDCl3): δ 13,7, 19,2, 54,3, 60,0, 72,2, 120,7, 144,4, 153,9, 164,9.
ИК (инфракрасный спектр) (пленка): см-1 2985w, 1752s, 1723m, 1665w, 1266s, 979w.
MC-BP (масс-спектрометрия высокого разрешения): m/z [M+Na]+ рассчитано 225,0733, найдено 225,0734.
ПРИМЕР 5
Получение этил-(2Е,4S)-4-(метоксикарбонилокси)пент-2-еноата [(S)-1]
ДМАП (14,7 мг, 0,12 ммоля) и Et3N (0,5 мл, 3,6 ммоля) растворяют в пиридине (5 мл). Добавляют 3-(метоксикарбонил)-1H-бензотриазол-3-ий-1-олат [Р. G. M. Wuts, et al., Org. Lett., p.1483 (2003)] (1,74 г, 9,0 ммоля) и (S)-21 (рац-этил-(2E)-4-гидроксипент-2-еноат) (865 мг, 6,0 ммоля) и полученную суспензию перемешивают в течение 2,5 ч при комнатной температуре. Реакционную смесь выливают в Н2О (50 мл) и экстрагируют с помощью tBuOMe (150 и 50 мл). Органические фазы последовательно промывают с помощью 1 M HCl (50 мл), Н2О (25 мл), насыщенным раствором NaHCO3 (25 мл) и Н2О (25 мл). Объединенные органические фазы сушат над Na2SO4 и выпаривают при пониженном давлении при 40°С. Остаток очищают с помощью флэш-хроматографии (tBuOMe:фракция гептана от 20:80 до 30:70) и получают 1 (этил-(2E,4S)-4-(метоксикарбонилокси)пент-2-еноат) (0,97 г, 79%) в виде желтоватого масла. Rf(BuOMe:фракция гептана 30:70)=0,34.
ВЭЖХ: 98,4% ЭИ (энантиомерный избыток)-(CLC1, t(S)-1=8,2, t(R)-1=13,2). 
1Н-ЯМР и ВЭЖХ соответствуют данным для полностью охарактеризованного рацемического соединения.
ПРИМЕР 6
Получение рац-этил-(2E)-N-бензил-4-аминопент-2-еноата (2)
Реакцию 30 (рац-этил-(2E)-4-(хлорацетокси)пент-2-еноата) (983 мг, 4,0 ммоля) с BnNH2 (943 мг, 8,8 ммоля) и 6 мол.% [Pd] в толуоле (80 мл) проводят при 40°С по общей методике, описанной в примере 2. Флэш-хроматография (SiO2, инактивированный с помощью 1,1% Et3N, tBuOMe:фракция гептана от 20:80 до 30:70) дает 2 (рац-этил-(2E)-N-бензил-4-аминопент-2-еноат) (760 мг, 81%) в виде желтого масла. Rf(AcOEt:фракция гептана 30:70)=0,14.
1H-ЯМР (400 МГц, CDCl3): δ част./млн 1,22 (d, 3H, J=6,5 Гц), 1,30 (t, 3H, J=7,2 Гц), 1,48 (s br., 1H), 3,35-3,42 (m, 1H), 3,68 (d, 1H, J=13,1 Гц), 3,80 (d, 1H, J=13,3 Гц), 4,21 (q, 2H, J=7,1 Гц), 5,94 (dd, 1H, J=15,6, 1,0 Гц), 6,84 (dd, 1H, J=15,7, 7,4 Гц), 7,22-7,28 (m, 1 H), 7,30-7,32 (m, 4H).
13C{1H}-ЯМР (100,6 МГц, CDCl3): δ част./млн 14,3, 21,1, 51,5, 54,0, 60,4, 121,0, 127,0, 128,1, 128,5, 140,1, 151,7, 166,6.
ИК (пленка): см-1 3326w, 3063w, 3028w, 2978m, 2931w, 1717s, 1653m, 1604w, 1495w, 1454m, 1269m, 1179m, 1037m, 984m, 699m.
MC-BP: m/z [M+H]+ рассчитано 234,1489, найдено 234,1488.
ПРИМЕР 7
Получение этил-(2Е,4S)-N-бензил-4-аминопент-2-еноата [(S)-2] и этил-(2Е,4S)-N,N-дибензил-4-аминопент-2-еноата [(S)-12]
(S)-37 (Этил-(2E,4S)-4-аммонийпент-2-еноаттрифлат), полученный в примере 44, растворяют в CH2Cl2 (25 мл) и охлаждают до 0°С. При 0°С добавляют BnBr (891 мкл, 7,5 ммоля) и Cs2CO3 (4,89 г, 15,0 ммоля). Полученную суспензию перемешивают при 0°С в течение 14 ч и при комнатной температуре в течение 33 ч. Затем охлажденную реакционную смесь выливают в воду со льдом (25 мл) и экстрагируют с помощью CH2Cl2 (50 и 2×25 мл). Объединенные органические фазы промывают рассолом (25 мл), сушат над Na2SO4 и выпаривают при пониженном давлении при 30°С. Остаток трижды очищают с помощью флэш-хроматографии (CH2Cl2: фракция гептана 50:50,
МеОН:СН2С12:фракция гептана от 1:49,5:49,5 до 5:47,5:47,5, MeOH:CH2Cl2 от 0,25:99,75 до 2:98) и получают (S)-2 (этил-(2E,4,S)-N-бензил-4-аминопент-2-еноат) (378 мг, 32%) и (S)-12 (этил-(2E,4S)-N,N-дибензил-4-аминопент-2-еноат) (684 мг, 42%) в виде желтых масел.
Rf[(S)-2, МеОН: CH2Cl2:фракция гептана 10:45:45]=0,34
Rf[(S)-12, МеОН: CH2Cl2:фракция гептана 10:45:45]=0,69
(S)-2: ВЭЖХ CLC1: 82% ЭИ, t(S)-2=13,2, t(R)-2=8,7
(S)-12: ВЭЖХ CLC7: 78% ЭИ, t(S)-12=5,9, t(R)-12=4,7
(S)-12: 
1Н-ЯМР и ВЭЖХ обоих продуктов соответствуют данным для полностью охарактеризованных рацемических соединений.
ПРИМЕР 8
Получение рац-этил-(2Е)-4-(бензиламинокарбонилокси)пент-2-еноата (3)
Реакцию 21 (рац-этил-(2E)-4-гидроксипент-2-еноата) (1,44 г, 10 ммолей) с бензилизоцианатом (1,73 г, 13 ммолей) в толуоле (8 мл) проводят в соответствии с примером 1. Очистка с помощью флэш-хроматографии (AcOiPr:фракция гептана 25:75) дает 3 (рац-этил-(2Е)-4-(бензиламинокарбонилокси)пент-2-еноат) (2,49 г, 90%) в виде белого твердого вещества.
Rf(AcOiPr:фракция гептана 35:65)=0,26.
1Н-ЯМР (400 МГц, CDCl3): част./млн δ 1,29 (t, 3Н, J=7,2 Гц), 1,36 (d, 3H, J=6,8 Гц), 4,19 (q, 2 H, J=7,2 Гц), 4,32-4,41 (m, 2H), 5,00 (s br, 0,18H, поворотный изомер), 5,14 (s br, 0,87H), 5,42-5,47 (m, 1H), 5,86 (d br, 0,15H, J=15,8, поворотный изомер), 5,96 (d, 0,85H, J=15,8), 6,89 (dd, 1H, J=15,6, 4,8 Гц), 7,25-7,29 (m, 3H), 7,32-7,35 (m, 2H).
13C{1H}-ЯМР (100,6 МГц, CDCl3): δ част./млн 14,2, 19,9, 45,1, 60,5, 69,5, 120,7, 127,6, 128,6, 1,28,7, 138,3, 147,0, 155,5, 166,2.
ИК (пленка): см-1 3347m, 3032w, 2982w, 1718s, 1662m, 1455m, 1531m, 1258m, 1043m, 979w, 741w, 700m.
MC-BP: m/z [M+Na]+ рассчитано 300,1206, найдено 300,1206; [М+K]+ рассчитано 316,0946, найдено 316,0946.
ПРИМЕР 9
Получение этил-(2Е,4S)-4-(бензиламинокарбонилокси)пент-2-еноата [(S)-3]
Реакцию (S)-21 (этил-(2Е,4S)-4-гидроксипент-2-еноата) (1,44 г, 10 ммолей) с бензилизоцианатом (1,04 г, 7,8 ммоля) в толуоле (8 мл) проводят в соответствии с примером 1. Очистка с помощью флэш-хроматографии
(tBuOMe:фракция гептана 30:70) дает (S)-3 (этил-(2E,4S)-4-(бензиламинокарбонилокси)пент-2-еноат) (1,50 г, 90%) в виде белого твердого вещества.
Rf(BuOMe:фракция гептана 50:50)=0,37
ВЭЖХ: 98,5% ЭИ (CLC1, t(S)-3=90, t(R)-3=43)

1Н-ЯМР и ВЭЖХ соответствуют данным для полностью охарактеризованного рацемического соединения.
ПРИМЕР 10
Получение рац-этил-(2E)-4-(бутиламинокарбонилокси)пент-2-еноата (4)
Реакцию 21 (рац-этил-(2Е)-4-гидроксипент-2-еноата) (1,44 г, 10 ммолей) с н-бутилизоцианатом (1,46 мл, 13 ммолей) в толуоле (8 мл) проводят в соответствии с примером 1. Очистка с помощью флэш-хроматографии (AcOiPr:фракция гептана от 15:85 до 25:75) дает 4 (рац-этил-(2Е)-4-(бутиламинокарбонилокси)пент-2-еноат) (2,31 г, 95%) в виде желтого масла.
Rf(AcOiPr: фракция гептана 30:70)=0,26.
1Н-ЯМР (400 МГц, CDCl3): δ част./млн 0,93 (t, 3Н, J=7,3 Гц), 1,29 (t, 3H, J=7,2 Гц), 1,32-1,41 (m, 5H), 1,45-1,53 (m, 2H), 3,17-3,19 (m, 2H), 4,20 (q, 2H, J=7,3 Гц), 4,74 (s br, 1H), 5,35-5,48 (m, 1H), 5,95 (dd, 1H, J=15,7, 1,6 Гц), 6,89 (dd, 1Н, J=15,7, 4,6 Гц)
13С{1H}-ЯМР (100,6 МГц, CDCl3); δ част./млн 13,7, 14,2, 19,9, 20,0, 32,0, 40,8, 60,5, 69,1, 120,6, 147,2, 155,5, 166,2.
ИК (пленка): см-1 3352m, 2961m, 2935m, 1720s, 1662m, 1533m, 1267m, 1250m, 1184m, 978m.
MC-BP: m/z [M+Na]+ рассчитано 266,1363, найдено 266,1362; [М+K]+ рассчитано 282,1102, найдено 282,1102.
ПРИМЕР 11
Получение рац-этил-(2Е)-4-(циклогексиламинокарбонилокси)пент-2-еноата (5)
Реакцию 21 (рац-этил-(2E)-4-гидроксипент-2-еноата) (1,44 г, 10 ммолей) с циклогексилизоцианатом (2,53 мл, 20 ммолей) в толуоле (8 мл) проводят в соответствии с примером 1. Очистка с помощью флэш-хроматографии (AcOiPr:фракция гептана от 15:85 до 25:75) дает 5 (рац-этил-(2Е)-4-(циклогексиламинокарбонилокси)пент-2-еноат) (2,29 г, 85%) в виде желтоватого твердого вещества.
Rf(AcOiPr:фракция гептана 30:70)=0,30.
1Н-ЯМР (400 МГц, CDCl3): δ част./млн 1,09-1,40 (m, 5Н), 1,29 (t, 3H, J=7,2 Гц), 1,35 (d, J=6,8 Гц, 3H), 1,58-1,63 (m, 1H), 1,68-1,73 (m, 2H), 1,92-1,95 (m, 2H), 3,47-3,49 (m, 1H), 4,20 (q, 2H, J=7,1 Гц), 4,61 (s br, 1H), 5,39-5,41 (m, 1H), 5,95 (dd, 1H, J=15,7, 1,6 Гц), 6,89 (dd, 1H J=15,7, 4,6 Гц).
13С{1H}-ЯМР (100,6 МГц, CDCl3): δ част./млн 14,2, 20,0, 24,8, 25,5, 33,4, 49,9, 60,5, 69,0, 120,6, 147,3, 154,6, 166,3.
ИК (CH2Cl2): см-1 3436w, 2958w, 2937m, 2857w, 1716s, 1663m, 1508m, 1218m, 1186m, 1048m, 979m.
MC-BP: m/z [M+H]+ рассчитано 270,1700, найдено 270,1699; [M+Na]+ рассчитано 292,1519, найдено 292,1519.
ПРИМЕР 12
Получение рац-этил-(2Е)-4-(дибензиламинокарбонилокси)пент-2-еноата (6)
21 (Рац-этил-(2Е)-4-гидроксипент-2-еноата) (1,47 г, 10 ммолей), ди-(N-сукцинимидил)карбонат (4,04 г, 15 ммолей) и Et3N (4,2 мл, 30 ммолей) растворяют в MeCN (40 мл). Полученный раствор перемешивают при комнатной температуре в течение 5 ч. Затем Bn2NH (2,3 мл, 12 ммолей) в MeCN (5 мл) добавляют в течение 15 мин. После дополнительного перемешивания в течение 2,5 ч реакционную смесь выпаривают при пониженном давлении при 40°С. Остаток растворяют в смеси н-гексан: BuOMe 90:10 (4×25 мл) и раствор выпаривают при пониженном давлении при 40°С. Флэш-хроматография (BuOMe:фракция гептана 20:80) дает 6 (рац-этил-(2E)-4-(дибензиламинокарбонилокси)пент-2-еноат) (3,00 г, 82%) в виде бесцветного масла.
Rf(tBuOMe: фракция гептана 30:70)=0,32.
1Н-ЯМР (500 МГц, CDCl3): δ част./млн 1,29 (t, 3Н, J=7,1 Гц), 1,39 (d, 3H, J=6,7 Гц), 4,19 (q, 2H, J=7,2 Гц), 4,34-4,53 (m, 4H), 5,53-5,58 (m, 1H), 5,90 (dd, 1H, J=15,8, 1,3 Гц), 6,92 (dd, 1H, J=15,7, 4,7 Гц), 7,18-7,25 (m, 4H), 7,25-7,30 (m, 2H), 7,33-7,35 (m, 4 H).
13C{1H}-ЯМР (125,8 МГц, CDCl3): δ част./млн 14,2, 20,0, 49,0, 49,7, 60,5, 70,3, 120,6, 127,4, 127,5, 128,1, 128,6, 137,2, 146,9, 155,7, 166,2.
ИК (пленка): см-1 3088m, 3064m, 3031m, 2981m, 2933m, l701s, 1663m, 1605w, 1496w, 1454s, 1233s, 1181s, 1114s, 977m, 700m.
MC-BP: m/z [M+Na]+ рассчитано 390,1676, найдено 390,1672; [М+K]+ рассчитано 406,1415, найдено 406,1415; [М+Н]+ рассчитано 368,1856, найдено 368,1856.
ПРИМЕР 13
Получение рац-трет-бутил-(2Е)-4-(бензиламинокарбонилокси)пент-2-еноата (8)
Реакцию 23 (рац-трет-бутил-(2E)-4-гидроксипент-2-еноата) (1,03 г, 6,0 ммоля) с бензилизоцианатом (1,04 г, 7,8 ммоля) в толуоле (5 мл) проводят в соответствии с примером 1. Очистка с помощью флэш-хроматографии (AcOEt: фракция гептана 15:85) дает 8 (рац-трет-бутил-(2Е)-4-(бензиламинокарбонилокси)пент-2-еноат) (1,65 г, 90%) в виде желтого масла. Rf(AcOEt: фракция гептана 25:75)=0,29.
1Н-ЯМР (400 МГц, ДМСО-d6 (диметилсульфоксид)): δ част./млн 1,28 (d, 3H, J=6,5 Гц), 1,43 (s, 9H), 4,19 (d, 2H, J=6,0 Гц), 5,26-5,31 (m, 1H), 5,85 (dd, 1H, J=15,6, 1,5 Гц), 6,77 (dd, 1H, J=15,8, 4,5 Гц), 7,21-7,33 (m, 5H), 7,82 (t, 1H, J=6,0 Гц).
13С{1H}-ЯМР (100,6 МГц, ДМСО-d6): δ част./млн 19,6, 27,7, 43,7, 68,4, 80,0, 121,1, 126,7, 126,9, 128,2, 139,6, 147,2, 155,5, 164,7.
ИК (пленка): см-1 3345m, 3032w; 2980m, 1713m, 1661m, 1531m, 1456m, 1386m, 1256s, 1152s, 974m, 741m, 700m.
MC-BP: m/z [M+Na]+ рассчитано 328,1519, найдено 328,1519; [М+K]+ рассчитано 344,1259, найдено 344,1259.
ПРИМЕР 14
Получение рац-этил-(2Е)-4-(бензиламинокарбонилокси)пент-2-енамида (8)
Реакцию 25 (рац-этил-(2E)-4-гидроксипент-2-енамида) (591 мг, 4,0 ммоля) с бензилизоцианатом (789 мкл, 6,4 ммоля) в толуоле (3,5 мл) проводят в соответствии с примером 1. Очистка путем перекристаллизации из толуола дает 8 (рац-этил-(2Е)-4-(бензиламинокарбонилокси)пент-2-енамид) (637 мг, 57%) в виде сероватого твердого вещества.
mp=149-150°С.
1H-ЯМР (600 МГц, ДМСО-d6): δ част./млн 1,01 (t, 3Н, J=7,2 Гц), 1,18 (s br, 0,34H), 1,26 (d, 2,7Н, J=6,6), 3,09-3,14 (m, 2Н), 4,14-4,21 (m, 2Н), 5,24-5,28 (m, 1H), 5,98 (d, 1H, J=15,5), 6,56 (dd, 1H, J=15,5, 5,1 Гц), 7,21-7,24 (m, 3H), 7,29-7,32 (m, 2H), 7,41 (s br, 0,17H), 7,77-7,79 (m, 0,89H), 8,01 (s br, 0,12H), 8,08-8,10 (m, 0,89H).
13С{1H}-ЯМР (150,9 МГц, ДМСО-d6): δ част./млн 14,7, 20,0, 33,4, 43,8, 68,7, 123,7, 126,8, 127,0, 128,3, 139,7, 141,4, 155,7, 164,1.
ИК (пленка): см-1 3310s, 3088w, 3029w, 2971w, 2930w, 1686s, 1628s, 1534m, 1253m, 1047w, 966w, 753w, 697w.
MC-BP: m/z [M+Na]+ рассчитано 299,1366, найдено 299,1366; [М+K]+ рассчитано 315,1106, найдено 315,1105; [2М+Са]2+ рассчитано 296,1281, найдено 296,1281; [М+Н]+ рассчитано 277,1547, найдено 277,1546.
ПРИМЕР 15
Получение рац-диэтил-(2E)-4-(бензиламинокарбонилокси)пент-2-енамида (9)
Реакцию 27 (рац-диэтил-(2E)-4-гидроксипент-2-енамида) (847 мг, 5,0 ммоля) с бензилизоцианатом (801 мкл, 6,5 ммоля) в толуоле (4 мл) проводят в соответствии с примером 1. Очистка с помощью флэш-хроматографии (AcOEt: фракция гептана от 50:50 до 60:40) дает 9 (рац-диэтил-(2E)-4-(бензиламинокарбонилокси)пент-2-енамид) (1,40 г, 92%) в виде вязкого светло-желтого масла.
Rf(AcOEt: фракция гептана 60:40)=0,22.
1Н-ЯМР (600 МГц, ДМСО-d6): δ част./млн 1,01 (t, 3Н, J=7,0 Гц), 1,05 (t, 3H, J=7,1 Гц), 1,22 (s br, 0,3H), 1,28 (d, 2,7H, J=6,6 Гц), 3,19 (s br, 0,3H), 3,26-3,31 (m, 3H), 4,14-4,21 (m, 2H), 5,27-5,31 (m, 1H), 6,24 (d, 0,1H, J=15,2), 6,42 (d, 0,9H, J=15,1), 6,57 (s br, 0,1H), 6,62 (s br, 0,9H, J=15,2, 5,1 Гц), 7,21-7,24 (m, 3H), 7,29-7,31 (m, 2H), 7,45 (s br, 0,1H), 7,83 (t, 0,9H, J=6,1 Гц).
13С{1H}-ЯМР (150,9 МГц, ДМСО-d6): δ част./млн 13,1, 14,9, 20,1, 40,1, 41,5, 43,7,69,1, 120,0, 126,8, 126,9, 128,3, 139,7, 143,9, 155,7, 164,0.
ИК (пленка): см-1 3300m, 3064w, 3032w, 2978m, 2934m, 1720s, 1665s, 1613s, 1537m, 1454m, 1254s, 1043m, 974w, 745w, 700m.
MC-BP: m/z [M+Na]+ рассчитано 327,1679, найдено 327,1679; [М+Н]+ рассчитано 305,1860, найдено 305,1859.
ПРИМЕР 16
Получение рац-этил-(2Е)-N-бутил-4-аминопент-2-еноата (10)
Реакцию 31 (рац-этил-(2Е)-4-(диэтоксифосфинилокси)пент-2-еноата) (280 мг, 1,0 ммоля) с nBuNH2 (198 мкл, 2,0 ммоля) и 8 мол.% [Pd] в CH2Cl2 (10 мл) при комнатной температуре проводят в соответствии с примером 2. Флэш-хроматография (AcOEt: фракция гептана от 50:50 до 55:45) дает 10 (рац-этил-(2Е)-N-бутил-4-аминопент-2-еноат) (130 мг, 65%) в виде желтого масла.
Rf(кондиционирование с помощью NH3, AcOEt:фракция гептана от 60:40)=0,15.
1H-ЯМР (400 МГц, CDCl3): δ част./млн 0,91 (t, 3H, J=7,3 Гц), 1,22 (d, 3H, J=6,5 Гц), 1,29 (t, 3H, J=7,2 Гц), 1,32-1,40 (m, 2H), 1,41-1,52 (m, 2H), 2,47-2,62 (m, 2H), 3,31-3,40 (m, 1H), 4,20 (q, 2H, J=7,3 Гц), 5,90 (dd, 1H, J=15,8, 1,0 Гц), 6,80 (dd, 1H, J=15,8, 7,5 Гц).
13С{1H}-ЯМР (100,6 МГц, CDCl3): δ част./млн 14,0, 14,3, 20,5, 21,1, 32,3, 47,3, 54,9,60,4, 120,9, 151,8, 166,6.
ИК (пленка): см-1 3323w, 2961s, 2931s, 2873m, 1719s, 1655m, 1465m, 1269m, 1182m, 1037m, 984m.
MC-BP: m/z [M+H]+ рассчитано 200,1645, найдено 200,1644.
ПРИМЕР 17
Получение рац-этил-(2Е)-N-циклогексил-4-аминопент-2-еноата (11)
Реакцию 31 (рац-этил-(2E)-4-(диэтоксифосфинилокси)пент-2-еноата) (280 мг, 1,0 ммоля) с CyNH2 (228 мкл, 2,0 ммоля) и 5 мол.% [Pd] в CH2Cl2 (8 мл) при комнатной температуре проводят в соответствии с примером 2. Флэш-хроматография (SiO2, инактивированный с помощью 1,4% NH3, AcOEt: фракция гептана от 30:70) дает 11 (рац-этил-(2E)-N-циклогексил-4-аминопент-2-еноат) (169 мг, 75%) в виде желтого масла.
Rf(кондиционирование с помощью NH3, AcOEt: фракция гептана 50:50)=0,16.
1Н-ЯМР (400 МГц, CDCl3): δ част./млн 0,93-1,28 (m, 5Н), 1,18 (d, J=6,5 Гц, 3H), 1,30 (t, 3H, J=7,2 Гц), 1,58-1,61 (m, 1H), 1,69-1,79 (m, 3H), 1,88-1,91 (m, 1H), 2,39-2,46 (m, 1H), 3,49-3,55 (m, 1H), 4,20 (q, 2H, J=7,0 Гц), 5,88 (dd, 1H, J=15,7, 0,9 Гц), 6,79 (dd, 1H, J=15,6, 7,5 Гц).
13C{1H}-ЯМР (100,6 МГц, CDCl3): δ част./млн 14,2, 21,7, 24,9, 25,1, 26,1, 29,7, 33,3, 34,5, 51,2, 53,8, 60,3, 120,3, 152,7, 166,7.
ИК (пленка): см-1 3317w, 2977m, 2928s, 2854m, 1719s, 1653w, 1449m, 1268m, 1176m, 1038m, 981m.
MC-BP: m/z [M+H]+ рассчитано 226,1802, найдено 226,1801.
ПРИМЕР 18
Получение рац-этил-(2Е)-N,N-дибензил-4-аминопент-2-еноата (12)
Реакцию 30 (рац-этил-(2Е)-4-(хлорацетокси)пент-2-еноата) (221 мг, 1,0 ммоля) с Bn2NH (383 мкл, 2,0 ммоля) и 8 мол.% [Pd] в CH2Cl2 (10 мл) при комнатной температуре проводят в соответствии с примером 2. Флэш-хроматография (AcOEt:фракция гептана 5:95) дает 12 (рац-этил-(2Е)-N,N-дибензил-4-аминопент-2-еноат) (227 мг, 70%) в виде бесцветного масла.
Rf(AcOEt:фракция гептана 20:80)=0,47.
1Н-ЯМР (300 МГц, CDCl3): δ част./млн 1,23 (d, 3H, J=7,0 Гц), 1,31 (t, 3 H, J=7,1 Гц), 3,43-3,52 (m, 1H), 3,55-3,66 (m, 4H), 4,21 (q, 2H, J=7,2 Гц), 5,90 (dd, 1H, J=15,9, 1,6 Гц), 7,05 (dd, 1H, J=15,9, 5,9 Гц), 7,19-7,24 (m, 2H), 7,28-7,33 (m, 4H), 7,37-7,39 (m, 4H).
13C{1H}-ЯМР (100,6 МГц, CDCl3): δ част./млн 14,3, 14,5, 53,8, 60,4, 121,7, 126,7, 128,1, 128,3, 139,7, 150,0, 166,2.
ИК (пленка): см-1 3063w, 3028w, 2975m, 2930w, 2804w, 1719s, 1651w, 1598w, 1493s, 1453m, 1269m, 1183s, 1030m, 983w, 699m.
MC-BP: m/z [M-H]+ рассчитано 3247,1958 найдено 324,71958 [M+Na]+ рассчитано 346,1778, найдено 346,1778.
ПРИМЕР 19
Получение рац-трет-бутил-(2Е)-N-бензил-4-аминопент-2-еноата (13)
Реакцию 23 (рац-трет-бутил-(2E)-4-гидроксипент-2-еноата) (192 мг, 0,75 ммоля) с BnNH2 (164 мкл, 1,5 ммоля) и 8 мол.% [Pd] в CH2Cl2 (7,5 мл) при комнатной температуре проводят в соответствии с примером 2. Флэш-хроматография (AcOEt: фракция гептана 25:75) дает 13 (рац-трет-бутил-(2Е)-N-бензил-4-аминопент-2-еноат) (157 мг, 80%) в виде желтого масла.
Rf(AcOEt: фракция гептана 30:70)=0,16.
1Н-ЯМР (400 МГц, CDCl3): δ част./млн 1,22 (d, 3Н, J=6,5 Гц), 1,49 (s, 9H), 3,34-3,41 (m, 1Н), 3,69 (d, 1H, J=13,0 Гц), 3,81 (d, 1H, J=13,0 Гц), 5,85 (dd, 1H, J=15,6, 1,0 Гц), 6,74 (dd, 1H, J=15,7, 7,4 Гц), 7,22-7,33 (m, 5H).
13С{1H}-ЯМР (100,6 МГц, CDCl3): δ част./млн 21,2, 28,2, 51,5, 54,0, 80,4, 122,8, 127,0, 128,1, 128,5, 140,1, 150,3, 165,9.
ИК (пленка): см-1 3323w, 3004w, 2977w, 1712s, 1653w, 1605w, 1495w, 1454m, 1368w, 1257m, 1153s, 982m, 736m, 699m.
MC-BP: m/z [M+H]+ рассчитано 262,1802, найдено 262,1801.
ПРИМЕР 20
Получение рац-этил-(2Е)-N-бензил-4-аминопент-2-енамид (14)
Реакцию 33 (рац-этил-(2Е)-4-(хлорацетокси)пент-2-енамида) (179 мг, 0,80 ммоля) с BnNH2 (92 мкл, 1,05 ммоля) и 4 мол.% [Pd] в CH2Cl2 (4 мл) при комнатной температуре проводят в соответствии с примером 2. Реакционную смесь обрабатывают посредством кислотной и щелочной экстракции (HCl/NaOH/CH2Cl2). Препаративная ТСХ (тонкослойная хроматография) (концентрированный раствор NH3:MeOH:iPrOH:CH2Cl2 0,5:5:10:84,5 и iPrOH:CH2Cl2 15:85) дает 14 (рац-этил-(2Е)-N-бензил-4-аминопент-2-енамид) (98,8 мг, 53%) в виде желтого масла.
Rf(концентрированный раствор NH3:MeOH:iPrOH:CH2Cl2 0,5:5:10:84,5)=0,44.
1H-ЯМР (400 МГц. ДМСО-d6): δ част./млн 1,02 (t, 3Н, J=7,2 Гц), 1,10 (d, 3Н, J=6,5 Гц), 3,07-3,22 (m, 5H), 3,54 (d, 1H, J=13,5 Гц), 3,66 (d, 1H, J=13,8 Гц), 5,93 (dd, 1H, J=15,6, 0,8 Гц), 6,46 (dd, 1H, J=15,4, 7,4 Гц), 7,18-7,22 (m, 1H), 7,27-7,33 (m, 4H), 7,94 (t, 1H, J=5,3 Гц).
13C{1H}-ЯМР (100,6 МГц, ДМСО-d6): δ част./млн 14,7, 21,0, 33,3, 50,3, 53,1, 123,6, 126,4, 127,8, 128,0, 140,8, 145,7, 164,6.
ИК (пленка): см-1 3296s, 3087w, 2963m, 2927w, 1672m, 1632s, 1557s, 1497w, 1453m, 987m, 734m, 696m.
MC-BP: m/z [М+Н]+ рассчитано 233,1648, найдено 233,1648; [M+Na]+ рассчитано 255,1468, найдено 255,1467.
ПРИМЕР 21
Получение рац-диэтил-(2E)-N-бензил-4-аминопент-2-енамида (15)
Реакцию 34 (рац-диэтил-(2Е)-4-(хлорацетокси)пент-2-енамида) (190 мг, 0,75 ммоля) с BnNH2 (123 мкл, 1,125 ммоля) и 4 мол.% [Pd] в CH2Cl2 (5 мл) при комнатной температуре проводят в соответствии с примером 2. Реакционную смесь обрабатывают посредством экстракции (CH2Cl2). Флэш-хроматография (MeCN/BuOMe от 5:95 до 7,5:92,5) и препаративная ТСХ (iPrOH/BuOMe 15:85) дают 15 (рац-диэтил-(2E)-N-бензил-4-аминопент-2-енамид) (142 мг, 73%) в виде желтого масла. Rf(iPrOH:iBuOMe 15:85)=0,26.
1H-ЯМР (400 МГц, ДМСО-d6): δ част./млн 1,03 (t, 3Н, J=6,9 Гц), 1,08 (t, 3H, J=7,1 Гц), 1,11 (d, 3H, J=6,5 Гц), 3,23-3,68 (m, 5H), 3,56 (d, 1H, J=13,8 Гц), 3,67 (d, 1H, J=13,8 Гц), 6,36 (dd, 1H, J=15,1, 0,8 Гц), 6,53 (dd, 1H, J=15,1, 7,3 Гц), 7,17-7,22 (m, 1H), 7,26-7,33 (m, 4H).
13С{1H}-ЯМР (100,6 МГц, ДМСО-d6): δ част./млн 13,1, 14,9, 21,1, 39,9, 41,4, 50,4, 53,4, 120,1, 126,4, 127,8, 128,0, 140,9, 148,2, 164,5.
ИК (пленка): см-1 3302w, 3027w, 2973m, 2932m, 1658s, 1615s, 1482m, 1452m, 1432m, 980w, 738m, 700m.
MC-BP: m/z [M+H]+ рассчитано 261,1961, найдено 261,1960; [M+Na]+ рассчитано 283,1781, найдено 283,1780.
ПРИМЕР 22
Получение рац-этил-(2E)-4-фталимидопент-2-еноата (16)
Реакцию (рац-этил-(2E)-4-(метоксикарбонилокси)пент-2-енстата)-(104 мг, 0,50 ммоля) с фталимидом (147 мг, 1,0 ммоля), Cs2CO3 (40,7 мг, 0,125 ммоля) и 5 мол.% [Pd] в CH2Cl2 (10 мл) при комнатной температуре проводят в соответствии с примером 2. Флэш-хроматография (АсОЕ1:фракция гептана 25:75) дает 16 (рац-этил-(2Е)-4-фталимидопент-2-еноат) (124 мг, 90%) в виде желтоватого твердого вещества.
Rf(AcOEt: фракция гептана 35:65)=0,26.
1H-ЯМР (400 МГц, CDCl3): δ част./млн 1,28 (t, 3Н, J=7,1 Гц), 1,66 (d, 3H, J=7,2 Гц), 4,18 (q, 2H, J=7,1 Гц), 5,06-5,10 (m, 1H), 5,92 (dd, 1H, J=15,7, 1,6 Гц), 7,13 (dd, 1H, J=15,7, 5,8 Гц), 7,70-7,74 (m, 2H), 7,81-7,86 (m, 2H).
13С{1H}-ЯМР (125,8 МГц, CDCl3): δ част./млн 14,2, 17,6. 46,8, 60,6, 122,3, 123,3, 131,8, 134,1, 145,4, 165,9, 167,6.
ИК (пленка): см-1 2983w, 2939w, 1777m, 1713s, 1659w, 1386s, 1270m, 1193m, 1030m, 979m, 720m.
MC-BP: m/z [M+H]+ рассчитано 296,0893, найдено 296,0891.
ПРИМЕР 23
Получение рац-этил-(2E)-4-(диэтоксифосфинилокси)-2-метилпент-2-еноата (17)
29 (Рац-этил-(2E)-4-гидрокси-2-метилпент-2-еноат) (0,99 г, 6,0 ммоля) растворяют в пиридине (1,6 мл) и охлаждают до 0°С. При перемешивании в течение 20 мин при <3°С добавляют диэтилхлорфосфат (1,1 мл, 7,5 ммоля). После 4,5 ч дополнительного перемешивания при 0°С реакцию последовательно останавливают с помощью 1 M H2SO4 (100 мл) и экстрагируют с помощью BuOMe (300 мл). Органическую фазу промывают рассолом (50 мл), насыщенным раствором NaHCO3 (50 мл) и рассолом (50 мл). Органическую фазу сушат над Na2SO4 и выпаривают при пониженном давлении при 40°С. Остаток очищают с помощью флэш-хроматографии (AcOiPr: фракция гептана от 50:50 до 60:40) и получают 17 (рац-этил-(2Е)-4-(диэтоксифосфинилокси)-2-метилпент-2-еноат) (1,56 г, 88%) в виде желтоватого масла.
Rf(iAcOiPr:фракция-гептана 70:30)=0,16.
1H-ЯМР (400 МГц, CDCl3): δ част./млн 1,30 (t, 3H, J=7,2 Гц), 1,31 (dt, 3H, J=7,1, 1,0 Гц), 1,34 (dt, 3H, J=7,1, 1,0 Гц), 1,43 (d, 3H, J=6,3 Гц), 1,90 (d, 3H, J=1,3 Гц), 4,04-4,13 (m, 4H), 4,21 (q, 2H, J=7,0 Гц), 5,22-5,30 (m, 1H), 6,69 (dq, 1H, J=8,6, 1,3 Гц, ROESY CHN↔≡CCH3.
13C{1H}-ЯМР (100,6 МГц, CDCl3): δ част./млн 12,8, 14,2, 16,05, 16,12, 21,6 (d, J=5 Гц), 60,9, 63,69/63, 71/63, 75/63,77 (2×d), 71,6 (d, J=5 Гц), 129,2, 139,8 (d, J=5 Гц), 167,5
31Р-ЯМР (162,0 МГц, CDCl3): δ -1,12.
ИК (пленка): см-1 2985m, 2935w, 1717s, 1659w, 1447m, 1259s, 1158m, 1036s
МС-ВР: m/z [М+Na]+ рассчитано 317,1125, найдено 317,1124; [М+K]+ рассчитано 333,0864, найдено 333,0864.
ПРИМЕР 24
Получение рац-этил-(2Е)-N-бензил-4-амино-2-метилпент-2-еноата (18)
Реакцию 17 (рац-этил-(2Е)-4-(диэтоксифосфинилокси)-2-метилпент-2-еноата) (188 мг, 0,60 ммоля) с BnNH2 (131 мкл, 1,2 ммоля) и 5 мол.% [Pd] проводят в CH2Cl2 (3,5 мл) при комнатной температуре. ЖХСД (жидкостная хроматография среднего давления) (SiO2, инактивированный с помощью NH3, АсОЕ1:фракция гептана 20:80) и препаративная ТСХ (кондиционирование с помощью NH3, AcOEt:фракция гептана 50:50) дают 18 (рац-этил-(2E)-N-бензил-4-амино-2-метилпент-2-еноат) (98,7 мг, 67%) в виде желтого масла.
Rf(18, кондиционирование с помощью NH3, AcOEt:фракция гептана 20:80)=0,18.
1H-ЯМР (500 МГц, ДМСО-d6): δ част./млн 1,08 (d, 3Н, J=6,4 Гц), 1,22 (t, 3H, J=7,1 Гц), 1,70 (d, 3H, J=1,1 Гц), 2,47 (s br, 1H), 3,45 (dq, 1H, J=9,2, 6,6 Гц), 3,52 (d, 1H, J=13,8 Гц), 3,63 (d, 1H, J=13,1 Гц), 4,12 (q, 2H, J=7,2 Гц), 6,50 (dd, 1H, J=9,3, 1,2 Гц), 7,20-7,22 (m, 1H), 7,29-7,30 (m, 4H); ROESY CNH↔≡CCH3.
13С{1H}-ЯМР (125,8 МГц, ДМСО-d6): δ част./млн 12,4, 14.2, 20,5, 50,0, 50,7, 60,2, 126,5, 126,7, 127,8, 128,0, 140,9, 146,5, 167,2.
ИК (пленка): см-1 3319w, 3063w, 3028w, 2978m, 1710s, 1650w, 1605w, 1495w, 1454m, 1249m, 1140m, 749m, 700m.
МС-ВР: m/z [M+H]+ рассчитано 248,1645, найдено 248,1645; [M+Na]+ рассчитано 270,1465, найдено 270,1465.
ПРИМЕР 25
Получение рац-этил-(2E)-N-(4-метоксифенил)-4-амино-2-метилпент-2-еноата (19)
Реакцию 17 (рац-этил-(2E)-4-(диэтоксифосфинилокси)-2-метилпент-2-еноата) (188 мг, 0,60 ммоля) с п-анизидином (148 мг, 1,2 ммоля) и 5 мол.% [Pd] в CH2Cl2 (3,5 мл) проводят при комнатной температуре. Флэш-хроматография (AcOiPr:фракция гептана от 15:85 до 20:80) дает 19 (рац-этил-(2Е)-N-(4-метоксифенил)-4-амино-2-метилпент-2-еноат) (144 мг, 91) в виде желтого масла.
Rf(AcOiPr:фракция гептана 40:60)=0,37.
1H-ЯМР (400 МГц, CDCl3): δ част./млн 1,27 (t, 3Н, J=7,0 Гц), 1,31 (d, 3H, J=6,5 Гц), 1,95 (d, 3Н, J=1,3 Гц), 3,73 (s, 3H), 4,11-4,23 (m, 3H), 6,50-6,53 (m, 2H), 6,60 (dq, 1H, J=8,7, 1,4 Гц), 6,73-6,77 (m, 2H); ROESY: С4Н↔H3CC.
13С{1H}-ЯМР (100,6 МГц, CDCl3): δ част./млн 12,7, 14,2, 20,8, 48,7, 55,8, 60,7, 114,9, 115,0, 127,9, 141,3, 146,0, 152,5, 167,8.
ИК (пленка): см-1 3381w, 2980m, 2833w, 1707s, 1649m, 1515s, 1246s, 1235s, 1140s, 1037s, 819m.
MC-BP: m/z [M+H]+ рассчитано 264,1594, найдено 264,1593; [M+Na]+ рассчитано 286,1414 найдено 286,1413.
ПРИМЕР 26
Получение рац-этил-4-гидроксипент-2-иноата (20)
2,2,6,6-Тетраметилпиперидин (74,16 г, 0,525 моля) растворяют в ТГФ (600 мл) и охлаждают до -45°С. Добавляют nBuLi (0,022 моль/г в гексане, 228,3 г, 0,500 моля) и дают нагреться до -10°С. Реакционную смесь охлаждают до -70°С. Затем в течение 25 мин при ≤-66°С по каплям добавляют этилпропиолат (49,05 г, 0,500 моля). После дополнительного перемешивания в течение 70 мин при -72°С в течение 30 мин при ≤-67°С по каплям добавляют ацетальдегид (23,35 г, 0,530 моля) в холодном ТГФ (30 мл). После перемешивания при -72°С в течение 1 ч реакцию останавливают с помощью 2 M HCl (700 мл) и экстрагируют с помощью tBuOMe (650 и 400 мл). Органические фазы последовательно промывают насыщенным раствором NaHCO3 (200 мл) и рассолом (3×125 мл). Объединенные органические фазы сушат над Na2SO4 и выпаривают при пониженном давлении при 40°С. Фильтрование через SiO2 (150 г) с использованием смеси tBuOMe:фракция гептана (0,5 л) и BuOMe (0,2 л) дает неочищенный 20 (рац-этил-4-гидроксипент-2-иноат) (67,44 г, 90%, ВЭЖХ: площадь пика ~90%) в виде коричневого масла. Неочищенный продукт используют на следующей стадии без дополнительной очистки. Исследование с помощью 1Н-ЯМР- и ГХ приводит к таким же результатам, что и при аналогичном синтезе 20 (рац-этил-4-гидроксипент-2-иноата) с использованием диизопропиламида лития в качестве основания.
1Н-ЯМР (400 МГц, CDCl3): δ 1,32 (t, 3H, J=7,1 Гц), 1,53 (d, 3H, J=6,7 Гц), 2,36 (d, 1H, J=4,6 Гц), 4,24 (q, 2H, J=7,1 Гц), 4,61-4,67 (m, 1H).
13С{1H}-ЯМР (100,6 МГц, CDCl3): δ 14,2, 23,4, 58,0, 62,2, 75,9, 88,4, 153,2
ИК (пленка): см-1 3408m, 2987m, 2245m, 1713s, 1449w, 1249s, 1061s.
ГХ-МС-ЭУ (газовая хроматография - масс-спектрометрия с ионизацией электронным ударом): m/z 43 (100) [МеС=O]+ 53 (93), 71 (68), 81 (32), 97 (91) [M-OEt]+, 127 (26) [M-Me]+.
ПРИМЕР 27
Получение рац-этил-(2E)-4-гидроксипент-2-еноата
(21) NaAlH2[O(CH2)2OMe]2 (68,6 мас./мас.%, 82,2 г, 0,270 моля) растворяют в ТГФ (750 мл) и охлаждают до -70°С. В течение 1,25 ч при ≤-65°С по каплям добавляют 20 (рац-этил-4-гидроксипент-2-иноат) (неочищенный, ВЭЖХ: площадь пика ~ 90, 21,33 г, 0,135 моля) в ТГФ (500 мл). После перемешивания в течение 2 ч при ≤-68°С реакцию останавливают с помощью 2 M HCl (540 мл). Затем добавляют воду (250 мл) и смесь экстрагируют с помощью BuOMe (1,5 и 1 л). Органические фазы последовательно промывают насыщенным раствором NaHCO2 (250 мл) и рассолом (2×100 мл). Объединенные органические фазы сушат над Na2SO4 и выпаривают при пониженном давлении при 40°С. Остаток очищают с помощью флэш-хроматографии (AcOEt: фракция гептана от 20:80 до 40:60) и получают 21 (рац-этил-(2Е)-4-гидроксипент-2-еноат) (15,56 г, 80%) в виде желтого масла.
Rf(AcOEt: фракция гептана 40:60)=0,19.
1Н-ЯМР (400 МГц, CDCl3): δ 1,30 (t, 3Н, J=7,1 Гц), 1,34 (d, 3H, J=6,6 Гц), 2,08 (d, 1H, J=4,0 Гц), 4,19 (q, 2H, J=7,1 Гц), 4,48 (s br, 1H), 6,01 (dd, 1H, J=15,6, 1,7 Гц), 6,94 (dd, 1H, J=15,6, 4,7 Гц).
13С{1H}-ЯМР (100,6 МГц, CDCl3): δ 14,4, 22,9, 60,5, 67,2, 119,4, 150,6, 166,3
ИК (пленка): см-1 3430m, 2981m, 1719s, 1704s, 1657m, 1450w, 1304s, 1273s, 1046s, 980m.
ГХ-МС-ЭУ: m/z 43 (73) [MeC=O]+, 55 (42), 73 (76) [CO2Et]+, 83 (17), 101 (100) [M-OEt]+, 129 (12) [M-Me]+, 145 (5) [M+H]+.
ПРИМЕР 28
Получение этил-(2Е,4S)-4-гидроксипент-2-еноата [(S)-21]
AlCl3 (5,33 г, 40 ммолей) суспендируют в CH2Cl2 (65 мл) и охлаждают до - 20°С. Добавляют (S)-35 (этил-(2Е,4S)-4-(бензилокси)пент-2-еноат) (4,78 г, 20 ммолей) в м-ксилоле (20 мл) и полученный желтый раствор перемешивают в течение 1,5 ч при -20°С. Затем реакционную смесь выливают в смесь воды со льдом (100 мл) и экстрагируют с помощью tBuOMe (500 и 200 мл).
Органическую фазу промывают рассолом (2×50 мл). Объединенные органические фазы сушат над Na2SO4 и выпаривают при пониженном давлении при 40°С. Остаток очищают с помощью флэш-хроматографии (AcOEt: фракция гептана 30:70) и получают (S)-21 (этил-(2Е,4S)-4-гидроксипент-2-еноат) (2,65 г, 92%) в виде желтоватого масла.
Rf(AcOEt:фракция гептана 35:65)=0,16
ВЭЖХ: 98,5% ЭИ (CLC1, t(S)-этил-(2E,4S)-гидроксипент-2-еноат=22, t(R)-этил-(2E,4S)-4-гидроксипент-2-еноат=20).

1Н-ЯМР и ВЭЖХ соответствуют данным для полностью охарактеризованного рацемического соединения.
ПРИМЕР 29
Получен рац-трет-бутил-4-гидроксипент-2-иноат-(22)
По методике, использованной для синтеза 20 (рац-этил-4-гидроксипент-2-иноат), неочищенный 22 (рац-трет-бутил-4-гидроксипент-2-иноат) (5,77 г, 90%, ВЭЖХ: площадь пика ~ 94%) получают из трет-бутилпропиолата (4,60 г, 36,1 ммоля) и ацетальдегида (2,39 г, 39,7 ммоля) в виде коричневого масла.
Неочищенный продукт используют без дополнительной очистки.
Для проведения анализа часть вещества очищают с помощью флэш-хроматографии (iPrOH:фракция гептана 7,5:92,5).
Rf(iPrOH:фракция гептана 7,5:92,5)=0,17.
1Н-ЯМР (300 МГц, CDCl3): δ част./млн 1,50-1,51 (m, 12Н), 2,03 (d, 1H, J=5,7 Гц), 4,62 (dq, 1H, J=6,7, 5,7 Гц).
13С{1H}-ЯМР (125,8 МГц, CDCl3): δ част./млн 22,9, 27,5, 57,6, 76,6, 83,4, 85,7, 152,1.
ИК (пленка): см-1 3400m, 2984m, 2232m, 1709s, 1396m, 1277s, 1259s, 1159s.
ГХ-МС-ЭУ: m/z 57 (50) [M-tBu]+ 97 (100) [M-OEt]+.
ПРИМЕР 30
Получение рац-трет-бутил-(2E)-4-гидроксипент-2-еноата (23)
По методике, использованной для синтеза 21 (рац-этил-(2Е)-4-гидроксипент-2-еноата), 23 (рац-трет-бутил-(2Е)-4-гидроксипент-2-еноат) (3,85 г, 80%) получают из 22 (рац-трет-бутил-4-гидроксипент-2-иноата) (неочищенный, ВЭЖХ: площадь пика ~ 94%, 5,01 г, 28,0 ммоля) после очистки с помощью флэш-хроматографии (AcOEt: фракция гептана 15:85) в виде светло-желтого масла.
Rf(AcOEt: фракция гептана 30:70)=0,20.
1H-ЯМР (400 МГц, CDCl3): δ част./млн 1,34 (d, 3H, J=6,6 Гц), 1,49 (s, 9H), 1,89 (d, 1H, J=4,5 Гц), 4,42-4,49 (m, 1H), 5,92 (dd, 1H, J=15,6, 1,6 Гц), 6,84 (dd, 1H, J=15,6, 4,9 Гц).
13С{1H}-ЯМР (100,6 МГц, CDCl3): δ част./млн 22,9, 28,5, 67,3, 80,5, 121,3, 149,5, 165,6
ИК (пленка): см-1 3429w, 297Ss, l714s, 1697s, 1656m, 1457m, 1369s, 1311s, 1155s, 977m
MC-BP: m/z [M+Na]+ рассчитано 195,0992, найдено 195,0992.
ПРИМЕР 31
Получение этил-(2Е)-4-оксопент-2-енамида (24)
(2E)-4-Оксопент-2-еновую кислоту (9,41 г, 80 ммолей) и EtNH2 (2 М в ТГФ, 40 мл, 80 ммолей) растворяют в CH2Cl2 (250 мл). Раствор охлаждают до 0°С. Затем добавляют ДМАП (1,47 г, 12 ммолей) и EDCI (1-(3-диметиламинопропил)-3-этилкарбодииимидгидрохлорид) (15,34 г, 80 ммолей). Полученную суспензию перемешивают в течение 17 ч при 0°С. Затем реакционную смесь выливают в 2 М HCl (100 мл) и экстрагируют с помощью CH2Cl2 (2×1 л). Органические фазы последовательно промывают с помощью 2 М HCl (50 мл), насыщенным раствором NaHCO3 (50 мл) и рассолом (100 мл). Объединенные органические фазы сушат над Na2SO4 и выпаривают при пониженном давлении при 40°С. Получают 24 (этил-(2Е)-4-оксопент-2-енамид) (5,74 г, 51%) в виде коричневого твердого вещества.
mp=69-70°С.
1Н-ЯМР (400 МГц, ДМСО-d3): δ част./млн 1,05 (t, 3Н, J=7,3 Гц), 2,28 (s, 3H), 3,17 (qd, 2H, J=7,2, 5,8 Гц), 6,72 (d, 1H, J=15,8), 6,81 (d, 1H, J=15,8), 8,46 (s br, 1H).
13С{1H}-ЯМР (100,6 МГц, CDCl3): δ част./млн 14,4, 28,0, 33,8, 135,4, 135,5, 163,2, 198,2
ИК (пленка): см-1 3313m, 2985w, 1697w, 16435, 16295, 15465, 987w. MC-BP: m/z [М+Н]+ рассчитано 142,0863, найдено 142,0863; [M+Na]+ рассчитано 164,0682, найдено 164,0683.
ПРИМЕР 32
Получение рац-этил-(2E)-4-гидроксипент-2-енамид (25)
24 (этил-(2Е)-4-оксопент-2-енамид) (5,18 г, 36,7 ммоля) растворяют в МеОН (6 мл) и Н2О (54 мл) и охлаждают до 0°С. К полученному раствору порциями в течение 15 мин добавляют NaBH4 (426 мг, 11,3 ммоля). После 30 мин дополнительного перемешивания при 0°С реакционную смесь подкисляют с помощью 2 М HCl (1,15 мл) и экстрагируют с помощью AcOiPr (2×1 л). Органические фазы промывают рассолом (2×25 мл). Объединенные органические фазы сушат над Na2SО4 и выпаривают при пониженном давлении при 40°С. Остаток очищают с помощью флэш-хроматографии (МеОН:CH2Cl от 5:95 до 7,5:92,5) и получают 25 (рац-этил-(2E)-4-гидроксипент-2-енамид) (4,60 г, 88%) в виде вязкого коричневого масла.
Rf(MeOH:CH2Cl2 20:80)=0,55
1H-ЯМР (400 МГц, ДМСО-d3): δ част./млн 1,01 (t, 3Н, J=7,2 Гц), 1,13 (d, 3H, J=6,5 Гц), 3,07-3,14 (m, 2H), 4,20-4,28 (m, 1H), 4,93 (d, 1H, J=4,8 Гц), 5,97 (dd, 1H, J=15,4, 1,6 Гц), 6,57 (d, 1H, J=15,3, 4,5 Гц), 7,94 (s br, 1H).
13С{1H}-ЯМР (100,6 МГц, CDCl3): δ част./млн 14,7, 23,1, 33,3, 65,3, 121,9, 146,4, 164,7
ИК (пленка): см-1 3292s, 2976m, 2935m, 1671s, 1621s, 1556s, 1068m, 978m.
MC-BP: m/z [M+H]+ рассчитано 144,1019, найдено 144,1018; [M+Na]+ рассчитано 166,0839, найдено 166,0837.
ПРИМЕР 33
Получение диэтил-(2E)-4-оксопент-2-енамида (26)
(2E)-4-Оксопент-2-еновую кислоту (7,06 г, 60 ммолей) и EtaN (8,7 мл, 63 ммоля) растворяют в CH2Cl2 (150 мл). Раствор охлаждают до 0°С. Затем при ≤4°С в течение 10 мин по каплям добавляют iBuOCOCl (8,8 мл, 67 ммолей) в CH2Cl2 (10 мл). Полученную суспензию перемешивают в течение 25 мин при 0°С. В течение 10 мин при ≤4°С по каплям добавляют Et2NH (7,5 мл, 72 ммоля) в CH2Cl2 (5 мл). После перемешивания в течение 1,5 ч при 0°С дополнительно добавляют Et2NH (73,8 мл, 36 ммолей) и перемешивание продолжают в течение 3 ч. Затем реакционную смесь выливают в 2 M HCl (100 мл) и экстрагируют с помощью ТБМЭ (трет-бутилметиловый эфир) (750 мл и 2×250 мл). Органические фазы последовательно промывают с помощью 2 M HCl (100 мл), насыщенным раствором NaHCO3 (100 и 50 мл) и рассолом (2×50 мл). Объединенные органические фазы сушат над Na2SO4 и выпаривают при пониженном давлении при 40°C. Остаток очищают с помощью флэш хроматографии (AcOEt:фракция гептана от 50:50 до 60:40) и получают 26 (диэтил-(2Е)-4-оксопент-2-енамид) (7,16 г, 71%) в виде бледно-оранжевого масла.
Rf(AcOEt:фракция гептана 60:40)=0,18
1H-ЯМР (400 МГц, CDCl3): δ част./млн 1,18 (t, 3H, J=7,2 Гц), 1,23 (t, 3H, J=7,3 Гц), 2,35 (s, 3H), 3,42 (q, 2 H, J=7,3 Гц), 3,47 (q, 2H, J=7,0 Гц), 7,07 (d, 1H, J=15,3 Гц), 7,17 (d, 1H, J=15,3 Гц).
13С{1H}-ЯМР (100,6 МГц, CDCl3): δ част./млн 13,0, 15,0, 29,4, 41,0, 42,5, 131,6, 137,1, 164,3, 197,6.
ИК (пленка): см-1 2978m, 2936w, 1645s, 1615s, 977m.
MC-BP: m/z [M+H]+ рассчитано 170,1176, найдено 170,1175; [M+Na]+ рассчитано 192,0995, найдено 192,0994; [2М+Са]2+ рассчитано 189,0910, найдено 189,0910.
ПРИМЕР 34
Получение рац-диэтил-(2Е)-4-гидроксипент-2-енамида (27)
26 (Диэтил-(2E)-4-оксопент-2-енамид) (5,92 г, 35 ммолей) растворяют в МеОН (14 мл) и Н2О (56 мл) и охлаждают до 0°С. К полученному раствору порциями в течение 5 мин добавляют NaBH4 (0,50 г, 13,1 ммоля). После 15 мин дополнительного перемешивания при 0°С реакционную смесь подкисляют с помощью 2 М HCl (30 мл) и экстрагируют с помощью AcOEt (11 и 2×0,75 л). Органические фазы последовательно промывают с помощью Н2О (100 мл), насыщенным раствором NаНСО3 (100 мл) и рассолом (100 мл). Объединенные органические фазы сушат над Na2SO4 и выпаривают при пониженном давлении при 40°С. Получают 27 (рац-диэтил-(2E)-4-гидроксипент-2-енамид) (5,66 г, 94%) в виде бледно-желтого масла.
1H-ЯМР (400 МГц, CDCl3): δ част./млн 1,15 (t, 3H, J=7,2 Гц), 1,20 [t, 3H, J=7,2 Гц), 1,33 (d, 3H, J=6,5 Гц), 2,84 (s br, 1H), 3,39 (q, 2H, J=7 Гц), 3,43 (q, 2H, J=7 Гц), 4,46-4,51 (m, 1H), 6,42 (dd, 1H, J=15,1, 1,8 Гц), 6,89 (d, 1H, J=15,2, 4,6 Гц).
13С{1H}-ЯМР (100,6 МГц, CDCl3): δ част./млн 13,0, 14,8, 23,0, 40,1, 42,2, 67,3, 118,5, 148,5, 165,8.
ИК (пленка): см-1 3390s, 2975s, 2934m, 1661s 1605s, 1462s, 1450s, 1436s, 1075m, 976m.
МС-ВР: m/2 [М+Н]+ рассчитано 172,1332, найдено 172,1332 [М±H]+ рассчитано 194,1152, найдено 194,1151; [М+K]+ рассчитано 210,0891, найдено 210,0890.
ПРИМЕР 35
Получение этил-(2.Е)-2-метил-4-оксопент-2-еноата (28)
Этил-2-(трифенилфосфоранилиден)пропаноат (74,40 г, 0,193 моля) и активированный MnO2 (190,7 г, 1,93 моля) растворяют/суспендируют в CH2Cl2 (1 л), при перемешивании и охлаждении добавляют гидроксиацетон (10,6 г, 0,135 моля). Реакционную смесь перемешивают в течение 1,5 ч при комнатной температуре, затем фильтруют через целлюлозу (75 г). Целлюлозу промывают с помощью EtaO (1 л) и фильтрат концентрируют при 300 мбар и 40°С. Добавляют н-пентан (250 мл) и полученную суспензию фильтруют. Выпаривание при 200 мбар и 40°С дает желтое масло (24,74 г), содержащее 28 (этил-(2Е)-2-метил-4-оксопент-2-еноат) (57%, E:Z=97:3), которое используют без дополнительной очистки. Для проведения анализа часть неочищенного продукт очищают с помощью флэш-хроматографии (AcOiPr:фракция гептана от 8:92 до 50:50).
Rf(AcOiPr: фракция гептана 30:70)=0,38.
1Н-ЯМР (300 МГц, CDCl2): δ част./млн 1,33 (t, 3Н, J=7,2 Гц), 2,22 (d, 3H, J=1,5 Гц), 2,32 (s, 3H), 4,26 (q, 2H, J=7,2 Гц), 7,08 (d, 1H, J=1,5 Гц).
13C{1H}-ЯМР (100,6 МГц, CDCl3): δ част./млн 14,4, 14,5, 32,2, 61,7, 132,1, 140,6, 167,3, 199,0.
ИК (пленка): см-1 2985m, 1720s, 1695s, 1623m, 1256s, 1124s, 1029s.
MC-BP: m/z [M+Na]+ рассчитано 179,0679, найдено 179,0679.
ПРИМЕР 36
Получение рац-этил-(2Е)-4-гидрокси-2-метилпент-2-еноата (29)
28 (Этил-(2Е)-2-метил-4-оксопент-2-еноат) (ВЭЖХ: площадь пика ~ 84%, 16,73 г, 90 ммолей) растворяют в МеОН (500 мл) и охлаждают до 0°С. К полученному раствору порциями в течение 30 мин добавляют NaBH4 (1,04 г, 27,5 ммоля). После 3 ч дополнительного перемешивания при 0°С значение pH доводят до 5 с помощью 2 М HCl (12 мл). Реакционную смесь концентрируют при пониженном давлении при комнатной температуре. Добавляют H2O (100 мл). После подкисления с помощью 2 М HCl до pH 1 проводят экстракцию с помощью BuOMe (1 и 0,5 л). Органические фазы последовательно промывают с помощью Н2О (100 мл) и рассолом (2×100 мл). Объединенные органические фазы сушат над Na2SO4 и выпаривают при пониженном давлении при 40°С. Остаток очищают с помощью флэш-хроматографии (AcOiPr: фракция гептана от 20:80 до 40:60) и получают 29 (рац-этил-(2Е)-4-гидрокси-2-метилпент-2-еноат) (11,26 г, 79%) в виде желтоватого масла.
Rf(AcOEt:фракция гептана 25:75)=0,14.
1H-ЯМР (300 МГц, CDCl3): δ част./млн 1,30 (t, 3Н, J=7 Гц), 1,32 (d, 3H, J=6,4 Гц), 1,75 (s, 1H), 1,87 (d, 3H, J=1,5 Гц), 4,20 (q, 2H, J=7,0 Гц), 4,68 (dq, 1H, J=8,3, 6,4 Гц), 6,68 (dq, 1H, J=8,3, 1,4 Гц).
13С{1H}-ЯМР (100,6 МГц, CDCl3): δ част./млн 12,7, 14,3, 22,7, 60,8, 64,8, 127,5, 143,6, 167,6.
ИК (пленка): см-1 3424m, 2987m, 1714s, 1653m, 1249s, 1063s.
MC-BP: m/z [M+Na]+ рассчитано 181,0835, найдено 181,0835; [М-Н]- рассчитано 157,0870, найдено 157,0870.
ПРИМЕР 37
Получение рац-этил-(2Е)-4-(хлорацетокси)пент-2-еноата (30)
21 (Рац-этил-(2Е)-4-гидроксипент-2-еноат) (неочищенный, ВЭЖХ: площадь пика ~ 94%, 9,20 г, 60 ммолей), пиридин (9,7 мл, 0,12 моля) и ДМАП (1,47 г, 12 ммолей) растворяют в ТГФ (300 мл) и охлаждают до 0°С. При перемешивании при ≤2°С в течение 10 мин по каплям добавляют хлорацетилхлорид (9,6 мл, 0,12 моля) в ТГФ (60 мл). Реакционную смесь перемешивают 40 мин при 0°С. Затем полученную суспензию выливают в Н2О (250 мл) и экстрагируют с помощью nBuOMe (1 л). Органическую фазу последовательно промывают насыщенным раствором NaHCO3 (100 мл), 1 М HCl (100 мл), Н2О (3×100 мл) и рассолом (100 мл). Органическую фазу сушат над Na2SO4 и выпаривают при пониженном давлении при 40°С. Остаток очищают с помощью ВЭЖХ
(tBuOMe: фракция гексана 5:95) и получают 30 (рац-этил-(2Е)-4-(хлорацетокси)цент-2-еноат)-(9,78 г, 74-%) в виде желтоватого масла.
Rf(tBuOMe:CH2O2 5:95)=0,47
1Н-ЯМР (400 МГц, CDCl3): δ 1,31 (t, 3H, J=7,1 Гц), 1,34 (d, 3H, J=6,6 Гц). 4,09 (s, 2H), 4,21 (q, 2H, J=7,1 Гц), 5,53-5,59 (m, 1H), 5,99 (dd, 1H, J=15,7, 1,6 Гц), 6,85 (dd, 1H, J=15,7, 5,2 Гц).
13C{1H}-ЯМР (100,6 МГц, CDCl3): δ 14,4, 19,7, 41,0, 60,8, 70,9, 121,6, 144,6, 165,5, 166,0.
ИК (пленка): см-1 2985w, 1760m, 1721s, 1664w, 1449w, 1307s, 1277s, 1184s, 1042m, 967w
MC-BP: m/z [M+Na]+рассчитано 243,0395, найдено 243,0393.
ПРИМЕР 38
Получение рац-этил-(2Е)-4-(диэтоксифосфинилокси)пент-2-еноата (31)
21 (Рац-этил-(2E)-4-гидроксипент-2-еноат) (2,16 г, 15 ммолей) растворяют в пиридин (4 мл) и охлаждают до 0°С. При перемешивании в течение 20 мин добавляют диэтилхлорфосфат (2,7 мл, 18,75 ммоля). После 6 ч дополнительного перемешивания при 0°С реакцию останавливают с помощью 1 М H2SO4 (100 мл) и экстрагируют с помощью BuOMe (300 мл). Органическую фазу последовательно промывают рассолом (50 мл), насыщенным раствором NaHCO3 (50 мл) и рассолом (50 мл). Органическую фазу сушат над Na2SO4 и выпаривают при пониженном давлении при 40°С. Остаток очищают с помощью флэш-хроматографии (AcOiPr: фракция гептана от 50:50 до 60:40) и получают 31 (рац-этил-(2Е)-4-(диэтоксифосфинилокси)пент-2-еноат) (3,65 г, 87%) в виде желтоватого масла.
Rf(AcOEt: фракция гептана 65:35)=0,20.
1Н-ЯМР (400 МГц, CDCl3): δ част./млн 1,30 (t, 3Н, J=7,2 Гц), 1,28-1,36 (m, 6H), 1,47 (d, 3H, J=6,5 Гц), 4,08-4,16 (m, 4H), 4,21 (q, 2H, J=7,1 Гц), 5,04-5,12 (m, 1H), 6,05 (dd, 1H, J=15,7, 1,6 Гц), 6,89 (ddd, 1H, J=15,7, 5,0, 1,1 Гц).
13С{1H}-ЯМР (100,6МГц, CDCl3): δ част./млн 14,2, 16,08/16,09/16,14/16,16 (2×d), 21,6 (d, 7=3 Гц), 60,6, 63,84/63,89/63,90/63,95 (2×d), 73,2 (d, J=3 Гц), 121,2, 146,3 (d, J=3 Гц), 166,0.
31Р-ЯМР (162,0 МГц, CDCl3): δ -1,22.
ИК (пленка): см-1 2985s. 2937m, 1721s, 1665m, 1447m, 1270s, 1182m, 1034s.
MC-BP: m/z [M+Na]+ рассчитано 303,0968, найдено 303,0968.
ПРИМЕР 39
Получение рац-трет-бутил-(2E)-4-(хлорацетокси)пент-2-еноата (32)
23 (Рац-трет-бутил-(2Е)-4-гидроксипент-2-еноат) (517 мг, 3,0 ммоля), пиридин (0,73 мл, 9 ммолей) и ДМАП (73,3 мг, 0,60 ммоля) растворяют в толуоле (18 мл) и охлаждают до 0°С. При перемешивании при ≤4°С в течение 15 мин по каплям добавляют хлорацетилхлорид (0,48 мл, 6,0 моля) в ТГФ (2 мл). Реакционную смесь перемешивают 45 мин при 0°С. Затем полученную суспензию выливают в H2O (50 мл) и экстрагируют с помощью tBuOMe (150 и 75 мл). Органические фазы последовательно промывают с помощью 1 М HCl (25 мл), Н2О (15 мл) и рассолом (2×15 мл). Объединенные органические фазы сушат над Na2SO4 и выпаривают при пониженном давлении при 40°С.
Остаток очищают с помощью флэш-хроматографии (tBuOMe:фракция гептана 20:80) и получают 32 (рац-трет-бутил-(2E)-4-(хлорацетокси)пент-2-еноат) (680 мг, 91%) в виде желтоватого масла.
Rf(BuOMe: фракция гептана 25:75)=0,38.
1H-ЯМР (400 МГц, CDCl3): δ част./млн 1,41 (d, 3Н, J=6,8 Гц), 1,49 (s, 9H), 4,09 (s, 2H), 5,52-5,58 (m, 1H), 5,92 (dd, 1H, J=15,8, 1,5 Гц), 6,75 (dd, 1H, J=15,6, 5,3 Гц).
13С{1H}-ЯМР (100,6 МГц, CDCl3): δ част./млн 19,6, 28,1, 40,9, 71,1, 81,0, 123,7, 143,7, 165,1, 166,4.
ИК (пленка): см-1 2981m, 1761m, 1715s, 1662m, 1369m, 1305s, 1155s, 973m.
MC-BP: m/z [M+Na]+ рассчитано 271,0708, найдено 271,0707; [M+NH4]+ рассчитано 266,1154, найдено 266,1154; [М+K]+ рассчитано 287,0447, найдено 287,0447.
ПРИМЕР 40
Получение рац-этил-(2E)-4-(хлорацетокси)пент-2-енамида (33)
25 (Рац-этил-(2Е)-4-гидроксипент-2-енамид] (886 мг, 6,0 ммоля), пиридин (969 мкл, 12 ммолей) и ДМАП (147 мг, 1,2 ммоля) растворяют в толуоле (30 мл) и ТГФ (10 мл) и охлаждают до 0°С. При перемешивании при 5: 2°С в течение 15 мин по каплям добавляют хлорацетилхлорид (954 мкл, 12 молей) в толуоле (4 мл). Реакционную смесь перемешивают в течение 2,5 ч при 0°С. Затем полученную суспензию выливают в 2 М HCl (25 мл) и экстрагируют с помощью tBuOMe (250 и 150 мл). Органические фазы последовательно промывают с помощью 2 М HCl (25 мл), насыщенным раствором NaHCO3 (15 мл) и рассолом (25 мл). Объединенные органические фазы сушат над Na2SO4 и выпаривают при пониженном давлении при 40°С и получают 33 (рац-этил-(2Е)-4-(хлорацетокси)пент-2-енамид) (1,26 г, 95%) в виде бежевого твердого вещества.
mp=85,9-87,1°С.
1H-ЯМР (400 МГц, ДМСО-d6): δ част./млн 1,02 (t, 3Н, J=7,3 Гц), 1,31 (d, 3H, J=6,8 Гц), 3,12 (qd, 2H, J=7,2, 5,5 Гц), 4,41 (s, 2H), 5,41-5,48 (m, 1H), 6,03 (dd, 1H, J=15,4, 1,4 Гц), 6,55 (dd, 1H, J=15,6, 5,3 Гц), 8,06 (t, 1H, J=4,9 Гц).
13С{1H}-ЯМР (100,6 МГц, ДМСО-d6): δ част./млн 14,6, 19,4, 33,4, 41,1, 70,8, 124,6, 139,5, 163,8, 166,5.
ИК (пленка): см-1 3291m, 2979m, 2935w, 1749s, 1678m, 1624s, 1566m, 1189m, 1178m, 1042m, 977m.
MC-BP: m/z [M+Na]+ рассчитано 242,0554, найдено 242,0553; [М+Н]+ рассчитано 220,0735, найдено 220,0734; [М-Н+Са]+ рассчитано 258,0204, найдено 258,0205.
ПРИМЕР 41
Получение рац-диэтил-(2Е)-4-(хлорацетокси)пент-2-енамида (34)
27 (Рац-диэтил-(2E)-4-гидроксипент-2-енамид) (1,05 г, 6,0 ммоля), пиридин (969 мкл, 12 ммолей) и ДМАП (147 мг, 0,60 ммоля) растворяют в толуоле (30 мл; и ТГФ (10 мл) и охлаждают до 0°С. При перемешивании при ≤2°С в течение 15 мин по каплям добавляют хлорацетилхлорид (954 мкл, 12 молей) в толуоле (4 мл). Реакционную смесь перемешивают в течение 2,5 ч при 0°С. Затем полученную суспензию выливают в Н2О (50 мл) и экстрагируют с помощью BuOMe (150 и 75 мл). Органические фазы последовательно промывают с помощью 1 М HCl (50 мл), Н2О (50 мл), насыщенным раствором KaHCO3 (50 мл; и рассолом (50 мл). Объединенные органические фазы сушат над Na2SO4 и выпаривают при пониженном давлении при 40°С. Остаток фильтруют с использованием tBuOMe (50 мл) и tBuOMe:AcOEt 50:50 (300 мл) через SiOz (15 г) и получают 34 (рац-диэтил-(2Е)-4-(хлорацетокси)пент-2-енамид) (1,46 г, 98% в виде желтого масла.
1Н-ЯМР (400 МГц, ДМСО-d6): δ част./млн 1,02 (t, 3H, J=7,0 Гц), 1,08 (t, 3H, J=7,2 Гц), 1,34 (d, 3H, J=6,5 Гц), 3,30 (q, 2H, J=7,2 Гц), 3,36 (q, 2H, J=7,1 Гц), 4,39 (d, 1H, J=15,1 Гц), 4,47 (d, 1H, J=15,0 Гц), 5,49 (dqd, 1H, J=11,9, 6,5, 1,1 Гц), 6,50 (dd, 1H, J=15,2, 1,1 Гц), 6,89 (dd, 1H, J=15,3, 5,3 Гц).
13С{1H}-ЯМР (100,6 МГц, ДМСО-d6): δ част./млн 13,0, 14,9, 19,6, 40,1, 41,2, 41,5, 71.1, 121,4, 141,8, 163,8, 166,5.
ИК (пленка): см-1 2980m, 2936m, 1755s, 1667s, 1620s, 1449m, 1434m, 1279m, 1186m, 1041m, 960w.
MC-BP: m/z [M+Na]+ рассчитано 270,0867, найдено 270,0867; [М+Н]+ рассчитано 248,1048, найдено 248,1047.
ПРИМЕР 42
Получение этил-(2Е,4S)-4-(бензилокси)пент-2-еноата [(S)-35]
KOH (0,26 г, 4,63 ммоля) растворяют в EtOH (50 мл). Раствор охлаждают до 0°С, затем добавляют метил-(2E,4S)-4-(бензилокси)пент-2-еноат (5,20 г, 23,6 ммоля, продается фирмой Acros). Реакционную смесь перемешивают в течение 1,5 ч при 0°С и выливают в смесь воды со льдом (100 мл). Водную фазу экстрагируют с помощью tBuOMe (500 мл). Органическую фазу промывают с помощью H2O (2×50 мл) и рассолом (50 мл) и сушат над Na2SO4. Органическую фазу выпаривают при пониженном давлении при 40°С и всю процедуру повторяют до завершения превращения. Получают (S)-35 (этил-(2Е,4S)-4-(бензилокси)пент-2-еноат) (5,26 г, 95%) в виде желтого масла и его используют без дополнительной очистки.

ПРИМЕР 43
Получение этил-(2Е,4S)-4-[(трет-бутоксикарбонил)амино]пент-2-еноата
[(S)-36] [Reetz, et al., J. Chem. Soc., Chem. Commun., p.1605 (1995)]
(S)-Boc-аланин (1,73 г 10,0 ммоля продается фирмой Bachem) растворяют в CH2Cl2 (40 мл) и охлаждают до ~10°С. Затем добавляют (этоксикарбонилметилен)трифенилфосфоран (3,51 г, 10,0 ммоля) и реакционной смеси дают нагреться до комнатной температуры. Полученный желтый раствор перемешивают при комнатной температуре в течение 2 ч и выпаривают при пониженном давлении при 40°С. Остаток суспендируют в н-гексан (75 мл) и выдерживают в течение ночи при 5°С. Твердое вещество удаляют фильтрованием и фильтрат выпаривают при пониженном давлении при 40°С. Фильтрование остатка через SiO2 (30 г) с использованием смеси BuOMe:н-гексан 50:50 (200 мл) и выпаривание растворителя при пониженном давлении при 40°С дает (S)-35 (этил-(2Е,4S)-4-[(трет-бутоксикарбонил)амино]пент-2-еноат) (2,25 г, 93%) в виде бесцветного масла.
Rf(BuOMe:н-гексан 50:50)=0,40.

(1991)]: 
1Н-ЯМР (400 МГц, CDCl3): δ 1,27 (d, J=6,8 Гц, 3Н,), 1,29 (t, 3H, J=7,0 Гц), 1,45 (s, 9H), 4,19 (q, 2H, J=7,0 Гц), 4,40 (s br, 1H), 4,51 (s br, 1H), 5,90 (dd, 1H, J=15,8, 1,8 Гц), 6,87 (dd, 1H, J=15,7, 4,9 Гц).
13С{1H}-ЯМР (100,6 МГц, CDCl3): δ 14,2, 20,4, 28,4, 47,1, 60,5, 79,8, 120,2, 149,4, 154,9, 166,4.
ПРИМЕР 44
Получение трифлата этил-(2Е,4S)-4-аммонийпент-2-еноата [(S)-37] [W. V. Murray, P. K. Mishra, I. J. Turchi, D. Sawicka, A. Maden, S. Sun, Tetrahedron 2003, 59, 8955]
(S)-36 (Этил-(2Е,4S)-4-[(трет-бутоксикарбонил)аминопент-2-еноат) (1,22 г, 5,00 ммоля) растворяют в CH2Cl2 (11,5 мл) и охлаждают до 0°С. В течение 2 мин добавляют ТФК (трифторуксусная кислота) (11,5 мл, 150 ммолей) и реакционной смеси дают нагреться до комнатной температуры. Реакционную смесь перемешивают в течение 30 мин при комнатной температуре и растворитель выпаривают при пониженном давлении при 40°С. Остаток растворяют в CHCl3 (10 мл) и повторно выпаривают (6×). Получают (S)-37 (трифлат этил-(2E,4S)-4-аммонийпент-2-еноата) в виде желтого масла и используют без дополнительной очистки.
1H-ЯМР (400 МГц, ДМСО-d6) δ 1,21 (t, 3H, J=7,2 Гц), 1,31 (d, J=6,8 Гц , 3H), 4,04 (s br 1H) 4,14 (q, 2H J=0,7 Гц,) 6,08 (dd, 1H, J=15,9 1,4 Гц) 6,83 (dd, 1H J=15,8, 6,0 Гц), 8,26 (s br, 3H).
13C{1H}-ЯМР (100,6 МГц, ДМСО-d6): δ 14,0, 18,1, 46,8, 60,3, 116,3, 122,6, 144,8, 158,4, 165,0.
ПРИМЕР 45
Схема III, таблица I
(Общая методика синтеза (R)-2, (R)-10-13 и соединений 14, 15, 18, 19 приведена в примере 3)
Реакция 3 (рац-этил-(2Е)-4-(бензиламинокарбонилокси)пент-2-еноата) с получением (R)-2 (этил-(2Е,4R)-N-бензил-4-аминопент-2-еноата): PhPh используют без обработки. Образцы готовят в соответствии с SP1 и анализируют по методике ВЭЖХ LC1 (t2=5,5, t3=5,9) и CLC1 (tглавный, (R)-2=8,7, tвторостепенный,(R)-2=8,7, tвторостепенный,(S)-2=13,2 t второстепенный,(R)-3=43, tглавный,(S)-3=90).
Реакция 4 (рац-этил-(2E)-4-(бутиламинокарбонилокси)пент-2-еноата) с получением 10 (этил(2E)-N-бутил-4-аминопент-2-еноата): BC=nHexPh, SP2, LC1 (t10=4,1, t4=6,0), CLC6 (tвторостепенный,10=13,1, tглавный,10=17,5, tглавный4=20, tвторостепенный,4=29).
Реакция 5 (рац-этил-(2E)-4-(циклогексиламинокарбонилокси)пент-2-еноата) с получением 11 (этил-(2E)-N-циклoгeкcил-4-aминoпeнт-2-eнoaтa): BC=Ph2O, SP2, LC1 (t11=5,0, t5=7,4), CLC7 (tвторостепенный,11=16,0, tглавный,11=19,7, tглaвный,5=22, tвторостепенный,5=32,).
Реакция 6 (рац-этил-(2E)-4-(дибензиламинокарбонилокси)пент-2-еноата) с получением (R)-12 (этил-(2E,41S)-N,N-дибензил-4-аминопент-2-еноата): BC=PhPh, SP1, LC1 (t6=11,2, t12=13,4), CLC2 (tглавный.(R)-12=12=4,7, tвторостепенный,(S)-12=5,9, tвторостепенный,6=33, tглавный,6=0).
Реакция 7 (рац-трет-бутил-(2Е)-4-(бензиламинокарбонилокси)пент-2-еноата) с получением 13 (трет-бутил-(2E)-N-бензил-4-аминопент-2-еноата): BC=nHexPh, SP1, LC2 (t13=4,2, t7=8,5), CLC1 (tглавный,13=5,2, tвтоpocтeпeнный,13=5,9, tвторостепенный,7=2, tглавный,7=46).
Реакция 8 (рац-этил-(2Е)-4-(бензиламинокарбонилокси)пент-2-енамида) с получением 14 (этил-(2E)-N-бензи-4-аминопент-2-енамида): используют 4 мол.% [Pd] и 6 мол.% лиганда. BC=PhPh, SP3. LC1 (t14=2,1, t8=2,7), CLC4 (tвторостепенный,14=12,8, tглавный,14=14,1, tвтopocтeпeнный,8=40, tглавный,8=92).
Реакция 9 (рац-диэтил-(2Е)-4-(бензиламинокарбонилокси)пент-2-енамида) с получением (диэтил-(2E)-N-бензил-4-аминопент-2-енамида): BC=PhPh, SP3, LC1 (t9=4,3, t15=3,9), CLC4 (tвторостепенный,15=11,4 tглавный,15=12,6.
ПРИМЕР 46
Схема IV, таблица II
Реакция 6 с получением 2:
BC=PhPh, SP1, LC1 (t2=5,5, t6=11.2, t12=13,4), CLC3 (tглавный,(R)-2=10,5, tвторостепенный,(S)-2=12,1, tвторостепенный,6=22, tглавный,6=23)
Реакция 6 с получением 16:
В пробирку Шленка помещают [Pd(аллил)Cl]2 (1,8 мг, 5 мкмолей), L1 (10,4 mg, 15 мкмолей), PhPh (14 мг) и фталимид калия (23,2 мг, 125 мкмолей) и создают атмосферу инертного газа аргона (три цикла откачка/заполнение аргоном). Катализатор растворяют в CH2Cl2 (0,7 мл) при перемешивании (в течение не менее 10 мин). Добавляют 6 (45,9 мг, 125 мкмолей) и Н2O (0,1 мл) и отбирают образец. Затем добавляют раствор 18-краун-6-эфира (16,5 мг, 62,5 мкмоля) в CH2Cl2 (0,2 мл) и реакционную смесь перемешивают при КТ в течение 24 ч.
SP1, LC1 (t16=5,7, t6=11,2, t12=13,4), CLC3 (tвторостепенный,16=59, tглавный,16=75, tвторостепенный,6=22, tглавный,6=23).
ПРИМЕР 47
Этил-(2E,4R)-N-бензил-4-аминопент-2-еноат [(R)-2] и этил-(2E,4S)-4-(бензиламинокарбонилокси)пент-2-еноат [(S)-3]
В пробирку Шленка помещают [Pd(аллил)Cl]2 (22,0 мг, 60 мкмолей), хиральный лиганд L1 (124,3 мг, 0,18 ммоля) и рац-3 (424,5 мг, 1,5 ммоля). После образования атмосферы инертного газа аргона (три цикла откачка/заполнение аргоном) смесь растворяют в CH2Cl2 (15 мл) при КТ. бензиламин (33 мкл, 0,30 ммоля) и перемешивание продолжают в течение 1 ч при КТ. ВЭЖХ указывает на степень превращения, равную 61%. Реакцию останавливают с помощью 1 М HCl (10 мл) и экстрагируют с помощью и tBuОМе (75 и 50 мл). Органические фазы промывают с помощью 1 М HCl (2×10 мл), насыщенным раствором NaHCO3 (10 мл) и рассолом (10 мл). Объединенные органические фазы сушат над Na2SO4 и выпаривают при пониженном давлении при 40°С. Остаток очищают с помощью флэш-хроматографии (AcOiPr:фракция гептана от 25:75 до 35:65) и получают (S)-3 (112,1 мг, 27%) в виде желтоватого масла. К объединенным экстрактам в HCl добавляют концентрированный раствор NaOH (4 мл). Полученный водный раствор экстрагируют с помощью CH2Cl2 (2×50 мл). Объединенные органические фазы промывают рассолом (20 мл), сушат над Na2SO4 и выпаривают при пониженном давлении при 40°С. Остаток очищают с помощью флэш-хроматографии (AcOEt: фракция гептана 30:70) и получают (R)-2 (148,2 мг, 42%) в виде желтого масла.
Rf[2, AcOEt:фракция гептана 40:60]=0,16
Rf[3, AcOiPr:фракция гептана 50:50]=0,43
(R)-264% ЭИ (ВЭЖХ, методика CLC1, tвторостепенный,2=13,2 tглавный,2=8,7)
(S)-3>95% ЭИ (ВЭЖХ, методика CLC1, tвторостепенный,3=43, tглавный,3=90)
1Н-ЯМР, 13С-ЯМР и ВЭЖХ выделенного субстрата и продукта соответствуют полностью охарактеризованному- рацемическому соединениями.
ПРИМЕР 48
Этил-(2Е,4S)-4-(дибензиламинокарбонилокси)пент-2-еноат ((S)-6) и этил-(2Е,4R)-4-фталимидопент-2-еноат [(R)-16]
В пробирку Шленка помещают [Рd(аллил)С1]2 (29,3 мг, 80 мкмолей), хиральный лиганд L1 (165,8 мг, 0,24 ммоля), 18-краун-6-эфир (264,3 мг, 1,0 ммоля), рац-6 (742,3 мг, 2,0 ммоля) и фталимид калия (370,4 мг, 2 ммоля). После образования атмосферы инертного газа аргона (три цикла откачка/заполнение аргоном) смесь растворяют/суспендируют в CH2Cl2 (14,4 мл) при КТ. Добавляют H2O (1,6 мл) и перемешивание при КТ продолжают в течение 2,25 ч. Затем реакционную смесь выливают в Н2O (40 мл) и экстрагируют с помощью tBuОМе (400 мл). Органическую фазу промывают с помощью 15% Nа2СО3 (40 мл) H2O (40 мл), 1 M HCl (3×40 мл) и paccoлoм (40-мл). Opгaничecкyю фaзу сушат над Na2SO4 и выпаривают при пониженном давлении при 40°С. Остаток очищают с помощью флэш-хроматографии (AcOEt:фракция гептана 15:85) и препаративная ВЭЖХ (Nucleosil 5 С18 АВ, H2O:MeCN от 60:40 до 20:80). Получают (S)-6 (234,3 мг, 32%) в виде желтоватого масла и получают (R)-16 (200,7 мг, 37%) в виде белого твердого вещества. Степень превращения = 55%,
определена по данным 1Н-ЯМР неочищенной смеси субстрат-продукт.
Rf[6, AcOiPr:фракция гептана 40:60]=0,49
Rf[16, AcOiPr:фракция гептана 40:60]=0,37
(S)-6: 94% ЭИ (ВЭЖХ, методика CLC3, tвторостепенный,6=22,1 tглавный,6=23);
[α]D 20=+41,8 (с=1,010, CHCl3)
(R)-16: 89% ЭИ(ВЭЖХ, методика CLC3, tвторостепенный,16=59, tглавный,16=75) [α]D 20=+5,9 (с=1,001, CHCl3).
Отнесение абсолютных конфигураций проведено при допущении о механизме, аналогичном механизму реакций превращения 3 в 2 и 12 в 2. Данные 1Н-ЯМР, 13С-ЯМР и ВЭЖХ изолированного субстрата и продукта соответствуют полностью охарактеризованному рацемическому соединению.
| название | год | авторы | номер документа |
|---|---|---|---|
| Композиции для лечения заболевания почек и/или печени | 2016 |
|
RU2712624C2 |
| Аналоги сплицеостатина | 2013 |
|
RU2618523C2 |
| 3,6-ДИАМИНОПИРИДАЗИН-3-ИЛЬНЫЕ ПРОИЗВОДНЫЕ, СОДЕРЖАЩИЕ ИХ ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ПРОАПОПТОТИЧЕСКИХ СРЕДСТВ | 2020 |
|
RU2830186C2 |
| ПРОИЗВОДНОЕ ТРАНС-2-ДЕЦЕНОВОЙ КИСЛОТЫ И СОДЕРЖАЩЕЕ ЕГО ФАРМАЦЕВТИЧЕСКОЕ СРЕДСТВО | 2011 |
|
RU2584163C2 |
| СЕРОСОДЕРЖАЩИЕ ПРОИЗВОДНЫЕ РЕЗОРЦИНА, СПОСОБ ИХ ПОЛУЧЕНИЯ И КОСМЕТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2010 |
|
RU2539589C2 |
| ПРОИЗВОДНЫЕ ПИПЕРИДИНОВ | 2011 |
|
RU2554353C2 |
| ИНГИБИТОРЫ АРГИНАЗЫ И ИХ ТЕРАПЕВТИЧЕСКИЕ ПРИМЕНЕНИЯ | 2011 |
|
RU2586219C2 |
| ПРОИЗВОДНЫЕ 3β-АЛКЕНИЛПЕНАМА И ИХ ФАРМАЦЕВТИЧЕСКИ СОВМЕСТИМЫЕ СОЛИ | 1994 |
|
RU2139290C1 |
| МОДУЛЯТОРЫ ИНТЕГРИРОВАННОГО СИГНАЛЬНОГО ПУТИ СТРЕССА | 2017 |
|
RU2769327C2 |
| ПРОИЗВОДНЫЕ N2-(2-ФЕНИЛ)-ПИРИДО[3,4-d]ПИРИМИДИН-2,8-ДИАМИНА И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ MPS1 ИНГИБИТОРА | 2015 |
|
RU2693460C2 |
Изобретение относится к способу энантиоселективного аллильного аминирования производных α,β-ненасыщенных карбоновых кислот с получением энантиомерно обогащенных производных, описываемых формулами II, III, VII и VIII. Способ осуществляют путем взаимодействия рацемической смеси производного карбоновой кислоты с хиральным лигандом на катализаторе [Pd(аллил)Cl]2 в присутствии нуклеофильного реагента, выбранного из фталимида калия или амина формулы R1R2NH, где R1 представляет собой бензильную, н-бутильную или циклогексильную группу, R2 представляет собой водород или бензильную группу. Технический результат - энантиоселективное катализируемое палладием аллильное аминирование производных α,β-ненасыщенных карбоновых кислот с получением продуктов с увеличенным энантиомерным избытком. 2 н. и 8 з.п. ф-лы, 6 ил., 3 табл., 48 пр.

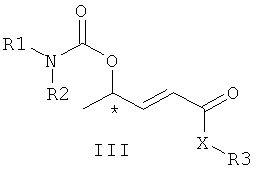

1. Способ катализируемого палладием энантиоселективного аллильного аминирования производных α,β-ненасыщенных карбоновых кислот, указанный способ включает реакцию рацемической смеси производного карбоновой кислоты, описываемого структурной формулой I:

с хиральным лигандом и палладиевым катализатором в присутствии нуклеофильного реагента, представляющего собой фталимид калия, или в котором нуклеофил имеет формулу R1R2NH, где R1 выбран из группы, состоящей из бензильной, н-бутильной и циклогексильной групп, R2 выбран из группы, состоящей из бензильной группы и водорода, с получением энантиомерно обогащенных производных α,β-ненасыщенных карбоновых кислот, описываемых формулами II и III:

причем в формулах I, II и III R1 обозначает бензильную, н-бутильную или циклогексильную группу; R2 обозначает бензильную группу или водород; XR3 обозначает этоксигруппу, аминогруппу или трет-бутоксигруппу; или формулы I и III являются такими, как указано выше, и в формуле II NR1R2 обозначает фталимидильный заместитель.
2. Способ по п.1, в котором указанным палладиевым катализатором является [Рd(аллил)С1]2.
3. Способ по п.1, в котором хиральный лиганд описывается структурной формулой IV:

4. Способ по п.1, в котором хиральный лиганд описывается структурной формулой V:

5. Способ по п.1, дополнительно включающий восстановление двойной связи производных α,β-ненасыщенных карбоновых кислот, описываемых формулами II и III, с получением соответствующих производных γ-аминокислоты.
6. Способ катализируемого палладием энантиоселективного аллильного аминирования производных α,β-ненасыщенных карбоновых кислот, указанный способ включает реакцию рацемической смеси производного карбоновой кислоты, описываемого формулой VI

с хиральным лигандом и палладиевым катализатором в присутствии нуклеофильного реагента, представляющего собой фталимид калия, или в котором нуклеофил имеет формулу R1R2NH, где R1 выбран из группы, состоящей из бензильной, н-бутильной и циклогексильной групп, причем R2 выбран из группы, состоящей из бензильной группы и водорода, с получением энантиомерно обогащенных производных α,β-ненасыщенных карбоновых кислот, описываемых формулами VII и VIII:

причем в формуле VIII R1 обозначает бензильную или 4-метоксифенильную группу.
7. Способ по п.6, в котором указанным палладиевым катализатором является [Pd(аллил)С1]2.
8. Способ по п.6, в котором хиральный лиганд описывается структурной формулой IV:

9. Способ по п.6, в котором хиральный лиганд описывается структурной формулой V:
 .
.
10. Способ по п.6, дополнительно включающий восстановление двойной связи производных α,β-ненасыщенных карбоновых кислот, описываемых формулами VII и VIII, с получением соответствующих производных γ-аминокислоты.
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| MURRAY W | |||
| V | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
Авторы
Даты
2014-04-10—Публикация
2009-11-16—Подача