Изобретение относится к производным пенама, в частности оно относится к производным 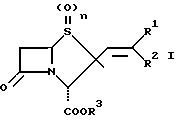 алкенилпенама общей формулы
алкенилпенама общей формулы
γ-
где один из R1 и R2 обозначает -COR4 -CN, -CH2R5, галоген, -CH=CHR6 либо Q, а другой обозначает водород либо низший алкил или оба вместе обозначают β- лактамовое кольцо,
R3 обозначает водород, низший алкил, арилалкил, аллил либо отщепляемый in vivo радикал,
R4 обозначает водород, низший алкил, низший алкокси, бензилокси, амино, низший алкиламино либо (низший алкил) (низший алкокси) амино.
R5 обозначает гидроксильную группу, -OCONHR7, -OCONH2 или пяти- либо шестизвенное, содержащее N, S и/или О гетероароматическое, связанное через атом азота кольцо,
R6 обозначает -CN либо -CHO,
R7 обозначает -COCH2Cl,
Q обозначает пяти- либо шестизвенное, содержащее N, S и/или О гетероароматическое кольцо и
n = 0, 1 либо 2,
а также к фармацевтически совместимым солям этих соединений.
Указанные соединения являются новыми и отличаются ценными в терапевтическом отношении свойствами. Прежде всего они обладают ярко выраженным подавляющим β- лактамазу действием и являются тем самым полезным средством для профилактики и борьбы против образующих β- лактамазу возбудителей болезней, применяемым в сочетании с  лактамовыми антибиотиками, как пенициллины и цефалоспорины.
лактамовыми антибиотиками, как пенициллины и цефалоспорины.
Кроме того, названные соединения обладают собственной антибактериальной активностью по отношению к отдельным штаммам бактерий, как, например, Acinetobacter spp.
Выражение "низший алкил", употребленное само по себе или в каком-либо другом сочетании, как "низший алкокси" или "низший алкиламино", обозначает линейные либо разветвленные насыщенные углеводородные радикалы с числом атомов углерода максимум 7, предпочтительно 1-4, как метил, этил, изопропил или трет-бутил.
Понятие "арилалкил" включает в себя бензил, бензгидрил, п-метоксибензил или п-нитробензил.
Понятие "галоген" включает в себя фтор, хлор, бром или иод.
Понятие "пяти- либо шестизвенное, содержащее N, S и/или О гетероароматическое кольцо" обозначает предпочтительно 2-пиридил, 1- метилпиридин-2-илио, 1,3- тиазол-2-ил, 1,2,4-оксадиазол-3-ил и т.п.
Отщепляемый in vivo радикал представляет собой предназначенный для орального введения радикал, содержащий предпочтительно сложноэфирную группу, как, например, -CH2OOCC(CH3)3,
β
или CH(CH3)OCO-CH3.
Объектом настоящего изобретения являются производные 3β-алкенилпенама приведенной выше общей формулы I и их фармацевтически совместимые соли как таковые и в качестве фармацевтически активных веществ, получение этих соединений, далее, лекарственные средства, содержащие одно из соединений общей формулы I или его фармацевтически совместимую соль и при определенных условиях дополнительно 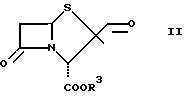 -лактамовый антибиотик, получение указанных лекарственных средств, а также применение соединений общей формулы I и их фармацевтически совместимых солей для борьбы и предупреждения болезней, прежде всего бактериальных инфекций, и для изготовления соответствующих лекарственных средств.
-лактамовый антибиотик, получение указанных лекарственных средств, а также применение соединений общей формулы I и их фармацевтически совместимых солей для борьбы и предупреждения болезней, прежде всего бактериальных инфекций, и для изготовления соответствующих лекарственных средств.
Соединения общей формулы
β
где R3 имеет указанное выше значение, представляют собой важные промежуточные продукты, используемые для получения соединений общей формулы I.
Предпочтительными являются соединения формулы I, где один из R1 и R2 обозначает -COR4, -CN либо -CH2R5, а другой обозначает водород либо низший алкил, R3 обозначает водород, низший алкил, арилалкил, аллил либо отщепляемый in vivo радикал, R4 обозначает водород, низший алкил, низший алкокси, бензилокси, амино либо низший алкиламино, R5 обозначает гидроксильную группу либо -OCONH2 и n = 0, 1 либо 2.
Особенно предпочтительны соединения общей формулы I, где R1 обозначает -CN, галоген либо -COR4, R5 обозначает водород и R4 обозначает метил, низший алкокси, бензилокси либо амино.
Предпочтительны соединения, где n обозначает 0 либо 2.
Предпочтительны также соединения формулы I, в которой R3 обозначает водород либо бензгидрил.
К предпочтительным соединениям относятся, например, следующие:
бензгидриловый эфир (E/Z)-(2S, 3S,5R)-3-(2-цианоэтенил)-3-метил-7- оксо-4-тиа-1-азабицикло[3.2.0]гептан-2- карбоновой кислоты,
бензгидриловый эфир (E)-(2S, 3S, 5R)-3-(2- цианоэтенил)-3-метил-4,4,7- триоксо-4-тиа-1- азабицикло[3.2.0]гептан-2-карбоновой кислоты,
бензгидриловый эфир (Z)-(2S, 3S, 5R)-3-(2-цианоэтенил)-3-метил-4,4,7- триоксо-4-тиа-1- азабицикло[3.2.0]гептан-2-карбоновой кислоты,
натриевая соль (Е)- (2S,3S,5R)-3-(2-цианоэтенил)-3-метил-4,4,7-триоксо-4-тиа-1- азабицикло[3.2.0]гептан-2-карбоновой кислоты,
натриевая соль (Z)- (2S,3S,5R)-3-(2-цианоэтенил)-3-метил-4,4,7-триоксо-4-тиа-1- азабицикло[3.2.0]гептан-2-карбоновой кислоты,
натриевая соль (Z)- (2S,3S,5R)-3-(2-хлорвинил)-3-метил-4,4,7-триоксо-4-тиа-1- азабицикло[3.2.0]гептан-2-карбоновой кислоты,
натриевая соль (E)-(2S, 3S,5R)-3-метил-3-(3-оксобут-1-енил)-4,4,7-триоксо-4-тиа- 1-азабицикло[3.2.0]гептан-2-карбоновой кислоты.
К особенно предпочтительным соединениям относятся далее:
бензгидриловый эфир (E/Z)-(2S, 3S,5R)-3-(2-карбамоилвинил)-3-метил-7-оксо-4-тиа- 1-азабицикло[3.2.0]гептан-2-карбоновой кислоты,
бензгидриловый эфир (Е)-(2S,3S,5R)-3-(2-карбамоилвинил)-3-метил-4,4,7-триоксо-4- тиа-1-азабицикло[3.2.0]гептан-2-карбоновой кислоты,
бензгидриловый эфир (Z)-(2S,3S,5R)-3-(2-карбамоилвинил)-3-метил-4,4,7- триоксо-4-тиа-1-азабицикло[3.2.0]гептан-2-карбоновой кислоты,
натриевая соль (Е)-(2S,3S,5R)-3-(2-карбамоилвинил)-3-метил- 4,4,7-триоксо-4-тиа-1-азабицикло[3.2.0]гептан-2-карбоновой кислоты,
натриевая соль (Z)-(2S,3S,5R)-3-(2-карбамоилвинил)- 3-метил-4,4,7-триоксо-4-тиа-1-азабицикло[3.2.0]гептан-2- карбоновой кислоты,
бензгидриловый эфир (E)-(2S,3S,5R)-3-(2- этоксикарбонилвинил)-3-метил-7-оксо-4-тиа-1- азабицикло[3.2.0]гептан-2-карбоновой кислоты,
бензгидриловый эфир (E)-(2S,3S,5R)-3-(2-этоксикарбонилвинил)-3-метил-4,4,7- триоксо-4-тиа-1-азабицикло[3.2.0]гептан-2-карбоновой кислоты,
натриевая соль (E)-(2S, 3S, 5R)-3-(2-этоксикарбонилвинил)-3-метил- 4,4,7-триоксо-4-тиа-1-азабицикло[3.2.0]гептан-2-карбоновой кислоты,
бензгидриловый эфир (Е)-(2S, 3S,5R)-3-(2- бензилоксикарбонилвинил)-3-метил-7-оксо-4-тиа-1- азабицикло[3.2.0]гептан-2-карбоновой кислоты,
бензгидриловый эфир (Е)-(2S,3S,5R)-3-(2-бензилоксикарбонилвинил)-3-метил-4,4,7- триоксо-4-тиа-1-азабицикло[3.2.0]гептан-2-карбоновой кислоты,
натриевая соль (Е)-(2S,3S,5R)-3-(2-бензилоксикарбонилвинил)-3- метил-4,4,7-триоксо-4-тиа-1-азабицикло[3.2.0]гептан-2-карбоновой кислоты.
Производные 3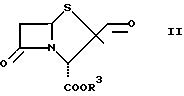 -алкенилпенама общей формулы I и их фармацевтически совместимые соли могут быть получены согласно изобретению следующим путем:
-алкенилпенама общей формулы I и их фармацевтически совместимые соли могут быть получены согласно изобретению следующим путем:
а) соединение общей формулы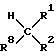
где R3 имеет указанное выше значение, подвергают обменной реакции с соединением общей формулы
P⊕
где R1 и R2 имеют указанные выше значения, а R8 обозначает 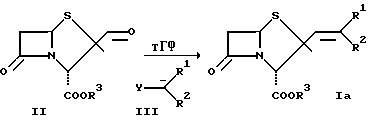 (арил)3, PO(Oалкил)2, Si(алкил)3 либо галоген, в присутствии активирующего агента или
(арил)3, PO(Oалкил)2, Si(алкил)3 либо галоген, в присутствии активирующего агента или
б) соединение общей формулы I, где n обозначает 0, окисляют или
в) соединение общей формулы I, где R3 имеет значения, отличные от водорода, переводят в соответствующую свободную кислоту и
г) при необходимости кислое соединение формулы I переводят в фармацевтически приемлемую соль.
Два известных метода, с помощью которых осуществляют вариант а) способа, представлены на схеме 1 (реакция Виттига, соответственно реакция Хорнера).
Схема 1
P⊕
Заместители R1, R2 и R3 соответствуют указанным выше значениям.
Альдегид формулы II путем прямой обменной реакции с алкилиден- трифенилфосфораном (III; Y обозначает 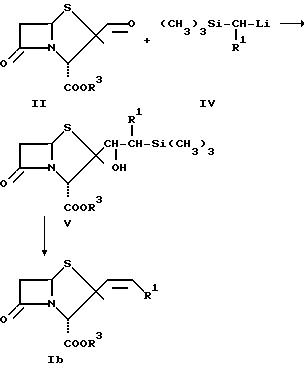 (арил)3, реакция Виттига), соответственно с алкилфосфонатом (III; Y обозначает (алкилО)2PO, реакция Хорнера) в присутствии активирующего агента, например основания, такого, как триэтиламин, метилат натрия, литийдиизопропиламин или DBU (1,5- диазабицикло[4.3.0]нон-5-ен), превращают в алкенилзамещенные пенамы формулы Ia. В качестве растворителей пригодны, например, тетрагидрофуран, толуол, дихлорметан, ацетонитрил либо бензол. Температуру реакции в зависимости от применяемого растворителя можно варьировать в пределах от -30oC до 80oC.
(арил)3, реакция Виттига), соответственно с алкилфосфонатом (III; Y обозначает (алкилО)2PO, реакция Хорнера) в присутствии активирующего агента, например основания, такого, как триэтиламин, метилат натрия, литийдиизопропиламин или DBU (1,5- диазабицикло[4.3.0]нон-5-ен), превращают в алкенилзамещенные пенамы формулы Ia. В качестве растворителей пригодны, например, тетрагидрофуран, толуол, дихлорметан, ацетонитрил либо бензол. Температуру реакции в зависимости от применяемого растворителя можно варьировать в пределах от -30oC до 80oC.
В некоторых случаях соединения формулы I могут быть получены путем реакции между соответственно замещенными галогенидами трифенилфосфония в присутствии окиси 1,2-бутилена в качестве основания и растворителя. Предпочтительная температура реакции лежит при этом в диапазоне от 50 до 70oC. Таким путем получают соединения формулы I, где n = 0.
Другими возможностями для осуществления варианта а) способа являются олефинирование по методу Петерсона, а также синтез с помощью реакции Реформатского. При олефинировании по методу Петерсона литиевые соли тетраалкилсиланов взаимодействуют с соединениями формулы II. На схеме 2 представлено взаимодействие с соответственно замещенным производным литийтриметилсилилметила формулы IV, причем R1 и R3 имеют указанные выше значения.
Схема 2
3β-
Производные α-алкенилпенама формулы Ib образуются из соединений формулы V в результате спонтанной дегидратации. Таким путем получают соединения формулы I, где n = 0 и R2 представляет собой водород. При осуществлении синтеза с помощью реакции Реформатского соединения формулы II конденсируют, как это представлено на схеме 3, с цинкорганическими производными сложных β-галогенэфиров с получением соответствующих сложных  гидроксиэфиров формулы VI. Путем отщепления воды образуются соединения формулы I, где n = 0, R1 обозначает COR4, где R4 обозначает низший алкил и R2 представляет собой водород.
гидроксиэфиров формулы VI. Путем отщепления воды образуются соединения формулы I, где n = 0, R1 обозначает COR4, где R4 обозначает низший алкил и R2 представляет собой водород.
Схема 3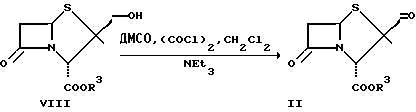
R3 имеет указанное выше значение.
Окисление сульфидной группы до сульфоксидной либо сульфоновой группы осуществляют с помощью известных методов. Особенно пригодной для такой цели является проводимая в двухфазной системе реакция между соединениями общей формулы I, где n = 0, и четырехокисью рутения либо водным раствором перманганата калия, а также раствором перекиси водорода.
Для получения сульфонов пенама могут использоваться также другие окислительные реагенты, как Na2WO4, или надкислота. В качестве растворителя особенно пригоден дихлорметан.
Соединение общей формулы I, где n = 0, целесообразно растворять в дихлорметане и добавлять в водную суспензию из метапериодата натрия, карбоната натрия и четырехокиси рутения. После окончания реакции органическую фазу отделяют, очищают и сушат.
Образование при окислении сульфоксида или же сульфона зависит от характера и/или количества окислителя.
Перевод соединения формулы I, где R3 имеет значения, отличные от водорода, в свободную кислоту и перевод свободной кислоты в фармацевтически приемлемую соль может осуществляться с помощью известных методов, при определенных условиях в течение одного единственного цикла.
Сложноэфирные группы, например, бензил, п-нитробензил, бензгидрил, п- метоксибензил или аллил, могут отщепляться следующим образом:
Бензил и п-нитробензил путем гидрирования с помощью палладия на угле при температуре в диапазоне от 0oC до 80oC в органическом растворителе, таком, как этилацетат, метанол либо вода, или путем гидролиза в присутствии сульфида натрия в диапазоне от 0oC до комнатной температуры в растворителе, таком, как, например, диметилформамид (ДМФ). Аллил - путем катализированного палладием (О) трансаллилирования в присутствии натриевой либо калиевой соли 2- этилкапроновой кислоты; бензгидрил - с помощью м-крезола при температуре порядка 50oC в течение 4-5 часов.
Применяемые в качестве исходных веществ соединения общей формулы II можно получать аналогично одному из описанных в Tetrahedron 43, N 5, стр. 1003-1012 (1987) способов из соответствующих спиртов.
Схема 4
β-
При этом R3 имеет указанное выше значение.
Большое преимущество дает проведение обменной реакции с оксалил-хлоридом в дихлорметане, причем целесообразно реакцию проводить следующим образом: дихлорметан и окислитель охлаждают до приблизительно - 60oC, обрабатывают диметилсульфоксидом (ДМСО) и соединением формулы VIII и после примерно 3-часовой реакции и добавки триэтиламина охлаждающую баню удаляют. Полученный таким путем альдегид формулы II может очищаться по обычной методике.
Аналогичным образом получают соединения общей формулы II окислением пиридинхлорхроматом (ПХХ), реагентом Десса-Мартина, MnO2 и др.
Как уже упоминалось выше, предлагаемые согласно изобретению соединения общей формулы I и их фармацевтически совместимые соли с основаниями обладают ярко выраженной подавляющей β- лактамазу активностью по отношению к β- лактамазам из различных штаммов бактерий. Эти ценные с терапевтической точки зрения свойства могут, как поясняется ниже, определяться in vitro на выделенных β- лактамазах.
А. Выделение β- лактамаз
Различные β- лактамазы могут быть выделены из пенициллино-, соответственно цефалоспориноустойчивых штаммов бактерий, таких как Klebsiella pneumoniae NCTC 418, Proteus vulgaris 1028, Bacillus licheniformis 749/C, Escherichia coli SN01 и Citrobacter freundii 1203. Для этого соответствующие штаммы культивируют в Tryptic Soy Broth (Difco) (питательный отвар на основе продуктов распада сои) и затем собирают путем центрифугирования в последующей экспоненциальной фазе роста (в случае необходимости в питательную среду к концу экспоненциальной фазы добавляют 50-100 мг/л ампициллина для индуцирования β- лактамазы). Полученную таким путем бактериальную массу обрабатывают 20 мМ трис-HCl-буфером (pH 7,0); в условиях охлаждения клетки вскрывают с помощью French Press. Затем центрифугируют (20000 об./мин) в течение 20-30 мин и получают прозрачный сырой экстракт. Очистку протеинов проводят по методу Cartwright, S. J. & Walley, S.G. [Biochem. J. 221, 505-512 (1980)] и, для В. licheniformis, по методу Ellerby, L.M. et al. [Biochemistry 29, 5797-5806 (1990)].
Б. Определение активности β- лактамазы
Определение активности выделенных β- лактамаз может проводиться по методу O'- Callaghan, C.H. et al. [Antimicr. Ag. Chemother 1, 283-288 (1972)] с помощью хромогенного цефалоспорина Nitrocefin (87/312 Glaxo). Требуемый опытный состав содержит на 1 мл воды: 50 мМ фосфатного буфера (pH 7,0), 0,1 мМ Nitrocefin и достаточное количество фермента Δ лактамазы) для получения β- А/мин порядка 0,1. Расщепление субстрата, сопровождаемое с изменением цвета, осуществляют при 37oC и его количество определяют при 482 нм с помощью спектрофотометра.
В. Определение подавляющего β- лактамазу действия соединений общей формулы I
Описанное выше расщепление хромогенного субстрата с помощью β- лактамаз (опыт Б) может подавляться добавками соединений общей формулы I (ингибиторы). Так как было выявлено, что ингибиторы необратимо инактивируют β- лактамазу в ходе реакции, зависящей от времени, по мере надобности эту реакцию (расщепление субстрата) начинают после прединкубационного периода β- лактамазы, осуществляемого с помощью ингибитора в течение 15 мин, путем добавления субстрата. Величиной измерения сродства испытуемого ингибитора с β- лактамазой, представляющей собой величину измерения эффективности ингибитора, служит такая концентрация, при которой расщепление субстрата (Nitrocefin), происходящее в описанных выше условиях проведения эксперимента (опыт Б) при отсутствии ингибитора, подавляется на 50% (IC50 в нМ). Для определения IC50 были проведены 4-6 опытов, в которых применяли различные концентрации ингибитора. Определение IC50 осуществляли графическим путем.
Полученные в описанном выше эксперименте (опыт В) результаты представлены в нижеследующих таблицах 1-3.
Испытания соединения из примера 5в (натриевой соли (Z)- (2S,3S,5R)-3-(2-цианоэтенил)-3-метил-4,4,7-триоксо-4-тиа-1- азабицикло[3.2.0] гептан-2-карбоновой кислоты) на крысах (2 раза в день, 300 мг/кг, в/в) показало, что оно хорошо переносится и не затрагивает такие важные органы, как печень и почки.
Соединения по изобретению могут находить применение в качестве лекарственных средств, например, в виде фармацевтических препаратов, содержащих эти продукты либо их соли в смеси с пригодным для парэнтерального или энтерального введения фармацевтическим, органическим либо неорганическим инертным наполнителем, таким как, например, вода, желатин, гумми-арабик, молочный сахар, крахмал, стеарат магния, тальк, растительные масла, полиалкиленгликоли, вазелины и т.д. Фармацевтические препараты могут изготавливаться в твердом виде, например, в виде таблеток, драже, суппозиториев, капсул, либо в жидком виде, например, в виде растворов, суспензий или эмульсий. При необходимости их стерилизуют и/или они содержат вспомогательные вещества, такие как консерванты, стабилизаторы, смачивающие агенты, эмульгаторы, соли для изменения осмотического давления, анестезирующие средства или буферы. Соединения формулы I и их соли предназначены предпочтительно для парэнтерального введения и изготавливаются для этой цели преимущественно в виде лиофилизатов либо сухих порошков, пригодных для растворения с помощью обычных агентов, как вода или изотонический раствор хлорида натрия.
Как уже упоминалось выше, соединения общей формулы I и их фармацевтически совместимые соли могут применяться согласно изобретению для борьбы, соответственно предупреждения болезней, прежде всего для борьбы с образующими β- лактамазу возбудителями болезней, в сочетании с β- лактамовыми антибиотиками, т.е. с такими антибиотиками, которые содержат β- лактамовое кольцо, например, пенициллины, такие как пиперациллин, мезлоциллин, азлоциллин, апалциллин, бензилпенициллин, феноксиметилпенициллин, карбенициллин, метициллин, пропициллин, тикарциллин, ампициллин, амоксициллин либо мециллинам, и цефалоспорины, такие как цефтриаксон, цефтазидим, цефетамет, цефетамет-пивоксил, цефотаксим, цефменоксим, цефтизоксим, цефуроксим, цефалоридин, цефалотин, цефазолин, цефалексин, цефокситин, цефацетрил, цефамандол, цефапирин, цефрадин, цефалоглицин, цефпиром либо цефепим, а также пенемы и карбапенемы, такие как имипенем или меропенем. При этом соединения общей формулы I или их фармацевтически совместимые соли с основаниями могут назначаться до, одновременно или же после приема β- лактамовых антибиотиков. Если соединения по изобретению назначают одновременно с каким- либо β- лактамовым антибиотиком, то это может осуществляться в виде используемой в тех же целях комбинации обоих ингредиентов или же в виде комбинированного фармацевтического препарата, содержащего соединение общей формулы I либо его фармацевтически совместимую соль с основанием и β- лактамовый антибиотик. Комбинированные фармацевтические препараты такого типа также являются предметом настоящего изобретения.
Дозировку соединений общей формулы I и их фармацевтически совместимых солей с основаниями можно варьировать в широких пределах, естественно, с учетом в каждом отдельном случае индивидуальных особенностей пациента, равно как и особенностей образующих β- лактамазу возбудителей болезни, с которыми ведется борьба. В принципе суточную дозу можно выбирать в пределах от приблизительно 0,1 до приблизительно 2,0 г. Соотношение ингибитора β- лактамазы (соединение формулы I либо его фармацевтически совместимая соль с основанием) и β- лактамового антибиотика также может варьироваться в широких пределах, но в каждом отдельном случае должны учитываться индивидуальные особенности пациента. Как правило, это соотношение выбирают в пределах от приблизительно 1:20 до приблизительно 1:1.
Способ получения лекарственных средств на основе соединений формулы I или их фармацевтически совместимых солей состоит в том, что из одного или нескольких соединений общей формулы I либо их фармацевтически совместимых солей и при определенных условиях одного или нескольких ценных в терапевтическом отношении веществ изготавливают препараты в галеновой форме. Необходимо еще раз назвать упоминавшиеся выше комбинированные фармацевтические препараты, на основе соединений изобретения. Это относится прежде всего к комбинированным фармацевтическим препаратам, содержащим соединение общей формулы I либо его фармацевтически совместимую соль и β- лактамовый антибиотик, например, пенициллин, такой как пиперациллин, мезлоциллин, азлоциллин, апалциллин, бензилпенициллин, феноксиметилпенициллин, карбенициллин, метициллин, пропициллин, тикарциллин, ампициллин, амоксициллин либо мециллинам, или же цефалоспорин, такой как цефтриаксон, цефтазидим, цефетамет, цефетамет-пивоксил, цефотаксим, цефметоксим, цефтизоксим, цефуроксим, цефалоридин, цефалотин, цефазолин, цефалексин, цефокситин, цефацетрил, цефамандол, цефапирин, цефрадин, цефалоглицин, цефпиром, цефепим, а также пенемы и карбапенемы, такие как имипенем либо меропенем. Комбинированные препараты такого типа предназначены для борьбы с вырабатывающими β- лактамазу возбудителями болезней.
Ниже изобретение подробнее поясняется на примерах, которые никоим образом не ограничивают его объем.
Пример 1
Бензгидриловый эфир (2S,3R,5R)-3-фopмил-3-метил-7-оксо-4-тиа-1- азабицикло[3.2.0] гептан-2-карбоновой кислоты
100 мл дихлорметана обрабатывают в атмосфере аргона 0,84 мл (9,60 ммолей) оксалилхлорида и охлаждают до -60oC. Затем по каплям добавляют сначала 0,73 мл (10,25 ммолей) ДМСО, а потом 2,50 г (6,52 ммолей) бензгидрилового эфира (2S, 3S,5R)-3-гидроксиметил-3-метил-7-оксо-4- тиа-1-азабицикло[3.2.0] гептан-2-карбоновой кислоты, растворенных в 100 мл дихлорметана. Смесь перемешивают при той же температуре в течение 3 ч, после чего добавляют 3,2 мл (23,0 ммоля) триэтиламина. Затем охлаждающую баню удаляют и смеси дают нагреться до комнатной температуры. Оранжевый раствор сливают в 1000 мл 0,2H соляной кислоты и водную фазу еще дважды экстрагируют с помощью дихлорметана. Органические фазы промывают водой и насыщенным водным раствором хлорида натрия, сушат над сульфатом натрия, фильтруют и концентрируют в ротационном испарителе. Полученный таким путем продукт (2,50 г, 100%) можно без последующей очистки перерабатывать дальше или кристаллизовать из простого диэтилового эфира.
Выход: 2,00 г (80%) белого кристаллического порошка; Т.пл. 111,8-112,8oC
ИК (KBr): 2720, 1788, 1743, 1718 см-1
МС: (M-CH2CO) 339
1H-ЯМР (250 МГц, CDCl3): δ [част./млн] =1,26 (s, 3H), 3,06 (dd, 1H, J= 16,2 Гц, 2 Гц, 6-H), 3,54 (dd, 1H, J=16,2 Гц, 4 Гц, 6-H), 5,34 (s, 1H, 2-H), 5,42 (dd, 1H, J=2 Гц, 4 Гц, 5-H), 6,95 (s, 1H, CHPh2), 7,30-7,38 (m, 10H, Ph), 9,20 (s, 1H).
Пример 2
а) Бензгидриловый эфир (E)-(2S,3S,5R)-3-(2-этоксикарбонилвинил)-3-метил-7-оксо-4-тиа- 1-азабицикло[3.2.0]гептан-2-карбоновой кислоты
500 мг (1,30 ммоля) бензгидрилового эфира (2S,3R,5R)-3-формил-3-метил-7-оксо-4-тиа-1- азабицикло[3.2.0] гептан-2-карбоновой кислоты растворяют в среде аргона в 20 мл ТГФ и обрабатывают 500 мг (1,40 ммоля) этоксикарбонилметилентрифенилфосфорана. Желтый раствор перемешивают в течение 75 мин при 50oC, после чего концентрируют. Образовавшийся остаток хроматографируют на силикагеле (размер зерен 0,040-0,063 мм) с помощью этилацетата/гексана 9:16 в качестве элюента.
Выход: 520 мг (88%) смолы желто-оранжевого цвета
ИК (пленка): 1783, 1747, 1717, 1650 см-1
MC: (M-CONH) 406, (M-CHPh2) 284
1H-ЯМР (250 МГц, CDCl3): δ [част./млн] =1,31 (t, 3H, J=7 Гц), 1,34 (s, 3H), 3,13 (dd, 1H, J=2 Гц, 16 Гц, 6-H), 3,57 (dd, 1H, J=4 Гц, 16 Гц, 6-H), 4,22 (q, 2H, J=7 Гц), 4,78 (s, 1H, 2-H), 5,30 (dd, 1H, J=4,2 Гц, 5-H), 5,97 (d, 1H, J= 15 Гц, =CH), 6,94 (s, 1H, CHPh2), 7,07 (d, 1H, J=15 Гц, =CH), 7,30-7,38 (m, 10 H, Ph).
б) бензгидриловый эфир (Е)-(2S,3S,5R)-3-(2-этоксикарбонилвинил)-3- метил-4,4,7-триоксо-4-тиа-1-азабицикло[3.2.0]гептан-2-карбоновой кислоты
250 мг (0,55 ммоля) бензгидрилового эфира (Е)-(2S,3S,5R)- 3-(2-этоксикарбонилвинил)-3-метил-7-оксо-4-тиа-1-азабицикло [3.2.0] гептан-2-карбоновой кислоты растворяют в 10 мл дихлорметана и обрабатывают 6,5 мл этилацетата. В желтый раствор по каплям добавляют 260 мг (1,66 ммоля) перманганата калия в 25 мл воды. После добавления перманганата калия перемешивают еще в течение 30 мин, после чего реакционную смесь коричневого цвета обрабатывают 30%-ным раствором перекиси водорода до тех пор, пока не образуется бесцветная двухфазная смесь. Фазы разделяют в делительной воронке и водную фазу экстрагируют еще дважды с помощью дихлорметана. Органическую фазу промывают водой, насыщенным раствором гидрокарбоната натрия, а также насыщенным раствором хлорида натрия, затем сушат над сульфатом натрия, фильтруют и концентрируют. Оставшееся масло хроматографируют на силикагеле (размер зерен 0,040-0,063 мм) этилацетатом/гексаном 9:16 в качестве элюента.
Выход: 170 мг (60%) бесцветного пенистого вещества
ИК (KBr): 1802, 1757, 1721, 1653, 1331, 960 см-1
MC: (M-H) 482,4
1H-ЯМР (250 МГц, CDCl2: δ [част./млн] = 1,26 (s, 3H), 1,35 (t, 3H, J=7 Гц), 3,44-3,59 (псевдо-m, 2H, 6-H), 4,29 (q, 2H, J=7 Гц), 4,60 (dd, 1H, J=4 Гц, 2 Гц, 5-H), 4,61 (s, 1H, 2-H), 5,99 (d, 1H, J=16 Гц, =CH), 6,94 (s, 1H, CHPh2), 7,07 (d, 1H, J=16 Гц, =CH), 7,23-7,40 (m, 10H, Ph).
в) Натриевая соль (E)- (2S,3S,5R)-3-(2-этоксикарбонилвинил)-3-метил-4,4,7-триоксо-4-тиа- 1-азабицикло[3.2.0]гептан-2-карбоновой кислоты
170 мг (0,35 ммоля) бензгидрилового эфира (E)-(2S,3S,5R)-3-(2- этоксикарбонилвинил)- 3-метил-4,4,7-тиоксо-4-тиа-1-азабицикло[3.2.0] гептан-2- карбоновой кислоты растворяют в атмосфере аргона в 3 мл м-крезола и перемешивают в течение 4,5 ч при 50oC. Затем обрабатывают 12,5 мл изобутилметилкетона и желто-оранжевый раствор трижды экстрагируют соответственно 3 мл насыщенного водного раствора гидрокарбоната натрия. Водную фазу дважды промывают соответственно 5 мл изобутилметилкетона, фильтруют через складчатый фильтр и затем с помощью концентрированной соляной кислоты устанавливают pH 1. После этого экстрагируют этилацетатом, органическую фазу промывают насыщенным водным раствором хлорида натрия, сушат над сульфатом натрия, фильтруют и концентрируют в ротационном испарителе. Оставшуюся желтую смолу растворяют в 0,5 мл этилацетата и обрабатывают 108 мкл натриевой соли 2- этилкарбоновой кислоты (2H раствор в этилацетате). Затем концентрируют, остаток обрабатывают 1,5 мл воды и экстрагируют один раз с помощью н-гексана. После этого водную фазу хроматографируют через полимерный гидрофобный гель водой в качестве элюента. Содержащие продукт фракции соединяют и лиофилизуют.
Выход: 60 мг (50%) бесцветного лиофилизата
ИК (KBr): 1782, 1715, 1627, 1396, 1192 см-1
MC: (M-Na)- 316,1
1H-ЯМР (250 МГц, D2O): δ [част./млн] = 1,31 (t, 3H, 7 Гц), 1,66 (s, 3H), 3,46 (dd, 1H, J=16 Гц, 2 Гц, 6-H), 3,71 (dd, 1H, J=16 Гц, 4 Гц, 6-H), 4,28 (q, 2H, J=7 Гц), 4,62 (s, 1H, 2-H), 5,15 (dd, 1H, J=2 Гц, 4 Гц, 5-H), 6,35 (d, 1H, J=16 Гц, =CH), 7,10 (d, 1H, J=16 Гц, =CH).
Пример 3
а) Бензгидриловый эфир (Е)-(2S,3S,5R)-3-(2-метоксикарбонилвинил)- 3- метил-7-оксо-4-тиа-1-азабицикло [3.2.0] гептан-2-карбоновой кислоты
Аналогично примеру 2 200 мг (0,52 ммоля) бензгидрилового эфира (2S,3R, 5R)-3-формил-3-метил-7-оксо-4-тиа-1- азабицикло[3.2.0] гептан-2-карбоновой кислоты путем обменной реакции с 193 мг (0,58 ммоля) метоксикарбонилметилентрифенилфосфорана переводят в бензгидриловый эфир (E)-(2S,3S,5R)-3-(2-метоксикарбонилвинил)-3-метил-7-оксо-4- тиа-1-азабицикло[3.2.0]гептан-2-карбоновой кислоты.
Выход: 209 мг (91%) бесцветного пенистого вещества
ИК (пленка): 1782, 1745, 1724, 1651 см-1
MC: (M+NH4 +) 455,3
Пример 4
а) Бензгидриловый эфир (E)-(2S,3S,5R)-3-(2-бензилоксикарбонилвинил)-3-метил-7-оксо-4- тиа-1-азабицикло[3.2.0]гептан-2-карбоновой кислоты
763 мг (2,0 ммоля) бензгидрилового эфира (2S,3R,5R)-3-формил-3-метил-7-оксо- 4-тиа-1-азабицикло[3.2.0] гептан-2-карбоновой кислоты растворяют в атмосфере аргона в 15 мл ТГФ, после чего обрабатывают 821 мг (2,0 ммоля) бензилоксикарбонилметилентрифенилфосфорана и оранжевый раствор перемешивают в течение 2 ч при 50oC. Затем дают раствору остыть до комнатной температуры, удаляют растворитель с помощью ротационного испарителя и полученное красно-коричневое масло хроматографируют на силикагеле (размер зерен 0,040-0,063 мм) этилацетат/гексаном 9:16 в качестве элюента.
Выход: 800 мг (78%) пенистого вещества оранжевого цвета
ИК (пленка): 1782, 1746, 1721, 1649, 985 см-1
МС: (М+H)+ 514,3
1H-ЯМР (250 МГц, CDCl3): δ [част./млн] = 1,33 (s, 3H), 3,11 (dd, 1H, J= 16 Гц, 1,6 Гц, 6-H), 3,56 (dd, 1H, J=16 Гц, 4,2 Гц, 6-H), 4,78 (s, 1H, 2-H), 5,20 (s, 2H), 5,36 (dd, 1H, J=1,6 Гц, 4,2 Гц, 5-H), 6,01 (d, 1H, 15 Гц, = CH), 6,93 (s, 1H, CHPh2), 7,12 (d, 1H, J=15 Гц, =CH), 7,30-7,43 (m, 15 H, Ph).
6) Бензгидриловый эфир (E)-(2S, 3S,5R)-3-(2-бензилоксикарбонилвинил)- 3-метил-4,4,7-триоксо-4-тиа-1-азабицикло[3.2.0]гептан-2- карбоновой кислоты
Аналогично примеру 2 окисляют 800 мг (1,56 ммоля) бензгидрилового эфира (E)-(2S, 3S, 5R)-3-(2- бензилоксикарбонилвинил)-3-метил-7-оксо-4-тиа-1-азабицикло [3.2.0] гептан-2-карбоновой кислоты
Выход: 255 мг (30%) бесцветного пенистого вещества
ИК (KBr): 1802, 1757, 1723, 1650, 1332 см-1
MC: (M-H)- 544,2
1H-ЯМР (250 МГц, CDCl3): δ [част./млн] = 1,25 (s, 3H), 3,47 (dd, 1H, J= 16 Гц, 2 Гц, 6-H), 3,55 (dd, 1H, J=16 Гц, 4 Гц, 6-H), 4,66 (dd, 1H, J=2 Гц, 4 Гц, 5-H), 4,81 (s, 1H, 2-H), 5,26 (s, 2H), 6,02 (d, 1H, J=16 Гц, =CH), 6,93 (s, 1H, CHPh2), 7,22 (d, 1H, J=16 Гц, =CH), 7,13-7,14 (m, 15 H, Ph).
в) Натриевая соль (E)-(2S,3S,5R)-3- (2-бензилоксикарбонилвинил)-3-метил-4,4,7-триоксо-4-тиа-1- азабицикло [3.2.0] гептан-2-карбоновой кислоты
Аналогично примеру 2в) 250 мг (0,46 ммоля) бензгидрилового эфира (Е)-(2S, 3S, 5R)-3- (2-бензилоксикарбонилвинил)-3-метил-4,4,7-триоксо-4-тиа-1- азабицикло[3.2.0] гептан-2-карбоновой кислоты подвергают удалению защитной группы и переводят в натриевую соль.
Выход: 54 мг (30%) лиофилизата бежевого цвета
ИК (KBr): 1781, 1719, 1626, 1322, 1189, 979 см-1
МС: (M-H)- 378,2
1H-ЯМР (250 МГц, D2O): δ [част./млн] = 1,65 (s, 3H), 3,45 (dd, 1H, J=17 Гц, 2 Гц, 6-H), 3,71 (dd, 1H, J=17 Гц, 4 Гц, 6-H), 4,63 (s, 1H, 2-H), 5,14 (dd, 1H, J=4 Гц, 2 Гц, 5-H), 5,29 (s, 2H), 6,42 (d, 1H, J=16 Гц, =CH), 7,13 (d, 1H, 16 Гц, =CH), 7,42-7,55 (m, 5H, Ph).
Пример 5
а) Бензгидриловый эфир (E/Z)-(2S,3S,5R)-3-(2-цианоэтенил)- 3-метил- 7-оксо-4-тиа-1-азабицикло[3.2.0]гептан-2-карбоновой кислоты
Метод А:
К 946 мг (3,14 ммоля) цианометилентрифенилфосфорана добавляют в атмосфере аргона 1,0 г (2,62 ммоля) бензгидрилового эфира (2S,3R,5R)-3- формил-3-метил-7- оксо-4-тиа-1-азабицикло[3.2.0]гептан-2-карбоновой кислоты и 30 мл толуола. Коричневую суспензию перемешивают в течение 1 ч, концентрируют и очищают посредством хроматографии на силикагеле (размер зерен 0,040-0,063 мм) с помощью этилацетата/н-гексана 3:1 в качестве элюента.
Выход: 1 г (94%) смеси изомеров, E/Z 3:1
Спектроскопические характеристики смеси:
ИК (пленка): 2224, 1781, 1744 см-1
МС: (M+Na+) 427,2
H-ЯМР (250 МГц, CDCl3) (изомер E): δ [част./млн] = 1,32 (s, 3H), 3,13 (dd, 1H, J= 16 Гц, 1,6 Гц, 6-H), 3,63 (dd, 1H, J=16 Гц, 4,4 Гц, 6-H), 4,74 (s, 1H, 2-H), 5,41 (dd, 1H, J=4,4 Гц, 1,6 Гц, 5-H), 5,54 (d, 1H, J=15 Гц, = CH), 6,82 (d, 1H, J=15 Гц, =CH), 6,95 (s, 1H, CHPh2), 7,30-7,44 (m, 10 H, Ph).
1H-ЯМР (250 МГц, CdCl3) (изомер Z): δ [част./млн] = 1,61 (s, 3H), 3,18 (dd, 1H, J= 16 Гц, 1,5 Гц, 6-H), 3,64 (dd, 1H, J=16 Гц, 4,6 Гц, 6-H), 4,86 (s, 1H, 2-H), 5,41 (d, 1H, J=12 Гц, =CH), 5,44 (dd, 1H, J=l,5 Гц, 4,6 Гц, 5-H).
Метод Б:
Суспензию 2,88 г (9,56 ммолей) цианометилентрифенилфосфорана в 24 мл раствора перхлората лития (0,4 М в ацетонитриле) охлаждают в атмосфере аргона до -20oC. Затем по каплям добавляют раствор 3,32 г (8,70 ммолей) бензгидрилового эфира (2S, 3R, 5R)-3- формил-3-метил-7-оксо-4-тиа-1-азабицикло[3.2.0]гептан-2- карбоновой кислоты в 30 мл ацетонитрила, продолжают перемешивать в течение 4 ч при той же температуре, после чего удаляют растворитель с помощью ротационного испарителя. Остаток растворяют в 100 мл этилацетата, экстрагируют путем встряхивания трижды с помощью воды и один раз с помощью насыщенного раствора хлорида натрия, сушат над сульфатом магния, фильтруют и концентрируют. Оставшееся масло очищают на силикагеле (размер зерен 0,040-0,063 мм) метиленхлоридом в качестве элюента.
Выход: 3,34 г (94%) смеси изомеров, E/Z 1:4
б) Бензгидриловый эфир (E, Z)-(2S,3S,5R)-3-(2-цианоэтенил)-3- метил-4,4,7-триоксо-4-тиа-1-азабицикло[3.2.0]гептан-2- карбоновой кислоты
Бензгидриловый эфир (E/Z)-(2S,3S,5R)-3-(2-цианоэтенил)-3- метил-4,4,7-триоксо-4-тиа-1-азабицикло[3.2.0] гептан-2-карбоновой кислоты получают аналогично тому, как это описано в примере 2, а именно, путем окисления 1,02 г (2,51 ммоля) бензгидрилового эфира (E/Z)-(2S,3S,5R)-3-(2-цианоэтенил)-3-метил-7-оксо-4-тиа-1- азабицикло[3.2.0] гептан-2-карбоновой кислоты. Оба изомера при этом могут разделяться посредством хроматографии на силикагеле (размер зерен 0,040-0,063 мм) с помощью этилацетата/н-гексана 9:16 в качестве элюента.
В качестве первого компонента элюируют изомер Z.
Выход: Z: 76 мг (7%) бесцветного масла
Е: 253 мг (23%) бесцветного пенистого вещества
Спектроскопические характеристики изомера Е:
МС: (M+NH4)+ 454,2
ИК (KBr): 2228, 1802, 1758, 1334, 1192, 990 см-1
1H-ЯМР (250 МГц, CDCl3): δ [част./млн] = 1,24 (s, 3H), 3,50 (dd, 1H, J= 16 Гц, 2,2 Гц, 6-H), 3,60 (dd, 1H, J=16 Гц, 4 Гц, 6-H), 4,65 (dd, 1H, J=2 Гц, 4 Гц, 5-H), 4,75 (s, 1H, 2-H), 5,37 (d, 1H, J=16 Гц, =CH), 6,85 (d, 1H, J=16 Гц, =CH), 6,98 (s, 1H, CHPh2), 7,25-7,45 (m, 10H, Ph).
Спектроскопические характеристики изомера Z:
МС: (M-H)- 435,3
ИК (KBr): 2220, 1801, 1757, 1333, 1190 см-1
1H-ЯМР (250 МГц, CDCl3): δ [част./млн] = 1,67 (s, 3H), 3,48 (dd, 1H, J= 16 Гц, 2,4 Гц, 6-H), 3,64 (dd, 1H, J=16 Гц, 4,6 Гц, 6-H), 4,72 (dd, 1H, J= 2,4 Гц, 4,6 Гц, 5-H), 4,85 (s, 1H, 3-H), 5,90 (d, 1H, J=12 Гц, =CH), 6,41 (d, 1H, J=12 Гц, =CH), 6,97 (s, 1H, CHPh2), 7,26-7,44 (m, 10 H, Ph).
в) Натриевая соль (E)-(2S,3S,5R)-3-(2- цианоэтенил)-3-метил-4,4,7-триоксо-4-тиа-1- азабицикло[3.2.0]гептан-2-карбоновой кислоты
Аналогично примеру 2в) 215 мг (0,5 ммоля) бензгидрилового эфира (E)-(2S, 3S, 5R)-3-(2-цианоэтенил)-3-метил-4,4,7-триоксо-4- тиа-1-азабицикло[3.2.0] гептан-2-карбоновой кислоты подвергают удалению защитной группы и переводят в натриевую соль.
Выход: 110 мг (82%) белого лиофилизата
ИК (KBr): 2240, 1782, 1629, 1397, 1141 см-1
MC: (M-Na)- 269,0
1H-ЯМР (250 МГц, CDCl3): δ [част./млн] = 1,64 (s, 3H), 3,47 (dd, 1H, J= 16 Гц, 2 Гц, 6-H), 3,72 (dd, 1H, J=16 Гц, 4 Гц, 6-H), 4,62 (s, 1H, 2-H), 5,15 10 (dd, 1H, J=2 Гц, 4 Гц, 5-H), 6,07 (d, 1H, J=16 Гц, =CH), 7,08 (d, 1H, J=16 Гц, =CH).
Натриевая соль (Z)- (2S,3S,5R)-3-(2-цианоэтенил)-3-метил-4,4,7-триоксо-4-тиа-1- азабицикло[3.2.0]гептан-2-карбоновой кислоты
95 мг (0,2 ммоля) бензгидрилового эфира (Z)-(2S,3S,5R)-3-(2-цианоэтенил)-3-метил- 4,4,7-триоксо-4-тиа-1-азабицикло[3.2.0] гептан-2-карбоновой кислоты растворяют в 3 мл м-крезола и перемешивают в течение 45 мин при 50oC. Реакционную смесь обрабатывают 10 мл изобутилметилкетона и 120 мкл натриевой соли 2-этилкапроновой кислоты (2H в этилацетате, 1,1 экв.). Затем экстрагируют дважды соответственно 3 мл воды, соединенные органические фазы промывают 10 мл изобутилметилкетона и лиофилизуют. Полученный желтый лиофилизат растворяют в 1,3 мл воды и хроматографируют через полимерный гидрофобный гель.
Выход: 50 мг (80%) бесцветного лиофилизата
ИК (KBr): 2222, 1782, 1626, 1395, 1323, 1141 см-1
1H-ЯМР (250 МГц, D2O): δ [част./млн] = 1,94 (s, 3H), 3,47 (dd, 1H, J=16 Гц, 1,6 Гц, 6-H), 3,73 (dd, 1H, J=16 Гц, 4,4 Гц, 6-H), 4,80 (s, 1H, 2-H), 5,19 (dd, 1H, J=l,6 Гц, 4,4 Гц, 5-H), 6,15 (d, 1H, J=12 Гц, =CH), 6,68 (d, 1H, J=12 Гц, =CH).
Пример 6
а) Бензгидриловый эфир (E/Z)-(2S,3S,5R)-3-(2-карбамоилвинил)-3- метил-7-оксо-4-тиа-1-азабицикло[3.2.0]гептан-2-карбоновой кислоты
2,60 г (6,86 ммолей) бензгидрилового эфира (2S,3R,5R)-3- формил-3-метил-7-оксо-4-тиа-1-азабицикло[3.2.0]гептан-2-карбоновой кислоты и 2,15 г (6,86 ммолей) карбамоилметилентрифенилфосфорана суспендируют в атмосфере аргона в 60 мл ТГФ и перемешивают в течение 45 мин при 50oC. Для отделения от нерастворимых компонентов фильтруют на нутче и фильтрат концентрируют с помощью ротационного испарителя. Коричневое масло хроматографируют на силикагеле (размер зерен 0,040-0,063 мм) с помощью этилацетата/н-гексана 1:1 в качестве элюента и разделяют оба изомера. При этом изомер Z элюируют перед изомером E, оба вместе можно получать из CH2Cl2/н-гексана в виде кристаллических твердых веществ.
Изомер Z:
Выход: 217 мг (7,5%) бесцветного твердого вещества
ИК (KBr): 3441, 1777, 1743, 1678, 986 см-1
MC: (M-CHPh2) 255
Тпл: 188-189oC
1H-ЯМР (250 МГц, CDCl3): δ [част./млн] = 1,58 (s, 3H), 3,11 (dd, 1H, J= 16 Гц, 1,60 Гц, 6-H), 3,57 (dd, 1H, J=16 Гц, 4,40 Гц, 6-H), 5,23 (s, 1H, 2-H), 5,36 (dd, 1H, J=4,40 Гц, 1,60 Гц, 5-H), 5,58 (псевдо-d, 2H, NH2), 5,75 (d, 1H, J= 12 Гц, = CH), 6,24 (d, 1H, J=12 Гц, =CH), 6,92 (s, 1H, CHPh2, 7,29-7,43 (m, 10H, Ph).
Изомер Е:
Выход: 347 мг (12%) кристаллического твердого вещества
ИК (KBr): 3444, 1775, 1728, 1671 см-1
MC: (M+H)+ 423,4
Т.пл.: 142oC (разложение)
1H-ЯМР (250 МГц, CDCl3): δ = 1,36 (s, 3H), 3,11 (dd, 1H, J=16 Гц, 2,0 Гц, 6-H), 3,56 (dd, 1H, J=16 Гц, 4,2 Гц, 6-H), 4,83 (s, 1H, 2-H), 5,37 (dd, 1H, J=2,0 Гц, 4,2 Гц, 5-H), 5,55 (s, шир., 2H, NH2), 5,97 (d, 1H, J=15 Гц, = CH), 6,94 (s, 1H, CHPh2), 6,95 (d, 1H, J=15 Гц, =CH), 7,28-7,40 (m, 10H, Ph).
б) Бензгидриловый эфир (Z)-(2S, 3S, 5R)-3-(2-карбамоилвинил)-3-метил- 4,4,7-триоксо-4-тиа-1-азабицикло[3.2.0]гептан-2- карбоновой кислоты
Аналогично примеру 2 окисляют 370 мг (0,875 ммоля) бензгидрилового эфира (Z)-(2S, 3S, 5R)-3-(2-карбамоилвинил)-3-метил- 7-оксо-4-тиа-l-aзaбицикло[3.2.0] гептан-2-карбоновой кислоты. В качестве растворителя используют смесь из этилацетата и н-гексана в соотношении 1:1.
Выход: 225 мг (57%) бесцветного пенистого вещества
ИК (KBr): 1799, 1750, 1678, 1326, 1188, 1140 см-1
MC: (M+H)+ 455,2
1H-ЯМР (250 МГц, CDCl3): δ [част./млн] = 1,5 (s, 3H), 3,45 (dd, 1H, J=16 Гц, 2 Гц, 6-H), 3,56 (dd, 1H, J=16 Гц, 4 Гц, 6-H), 4,67 (dd, 1H, J=4 Гц, 2 Гц, 5-H), 5,28 (s, 1H, 2-H), 5,63 (s, шир., 1H, NH2, 5,84 (d, 1H, J=13 Гц, = CH), 6,69 (s, шир. , 1H, NH2), 6,39 (d, 1H, J=13 Гц, =CH), 6,93 (s, 1H, CHPh2), 7,29-7,41 (m, 10H, Ph).
Бензгидриловый эфир (E)-(2S, 3S, 5R)-3-(2- карбамоилвинил)-3-метил-4,4,7-триоксо-4-тиа-1- азабицикло[3.2.0]гептан-2-карбоновой кислоты
0,64 г (1,51 ммолей) бензгидрилового эфира (E)-(2S,3R,5R)-3-(2-карбамоилвинил) -3-метил-7-оксо-4-тиа-1-азабицикло[3.2.0] гептан-2-карбоновой кислоты растворяют в 30 мл метиленхлорида и охлаждают до 0oC. Затем по каплям добавляют 1,86 г (7,55 ммолей) мета-хлорпербензойной кислоты (содержание: 70-75%, 5 экв.) в 30 мл метиленхлорида, после введения добавки охлаждающую баню удаляют и перемешивают в течение 6 ч при комнатной температуре. Реакционную смесь с помощью раствора сульфита натрия (3%-ный в насыщенном водном растворе бикарбоната натрия) экстрагируют путем встряхивания и промывают насыщенным водным раствором хлорида натрия, после чего сушат над сульфатом магния, фильтруют, удаляют растворитель с помощью ротационного испарителя и остаток перекристаллизовывают с помощью метиленхлорида/н-гексана.
Выход: 210 мг (30%) бесцветного твердого вещества
ИК (KBr): 1799, 1756, 1686, 1329, 1143, 1191 см-1
MC: (M+H)+ 455,3
Тпл: 186-188oC
1H-ЯМР (250 МГц, CDCl3): δ [част./млн] = 1,30 (s, 3H), 3,47 (dd, 1H, J= 16 Гц, 3,0 Гц, 6-H), 3,61 (dd, 1H, J=16 Гц, 4,4 Гц, 6-H), 4,67 (dd, 1H, J= 3,0 Гц, 4,4 Гц, 5-H), 4,82 (s, 1H, 2-H), 5,53 (s, шир., 2H, NH2), 6,03 (d, 1H, J= 16 Гц, =CH), 6,98 (d, 1H, J=16 Гц, =CH), 6,94 (s, 1H, CHPh2), 7,26-7,40 (m, 10H, Ph).
в) Натриевая соль (Z)- (2S,3S,5R)-3-(2-карбамоилвинил)-3-метил-4,4,7-триоксо-4-тиа-1- азабицикло[3.2.0]гептан-2-карбоновой кислоты
Аналогично примеру 2 135 мг (0,30 ммоля) бензгидрилового эфира (Z)-(2S, 3S, 5R)-3-(2- карбамоилвинил)-3-метил-4,4,7-триоксо-4-тиа-1-азабицикло [3.2.0] гептан-2-карбоновой кислоты подвергают удалению защитной группы и переводят в натриевую соль.
Выход: 67 мг (70%) бесцветного лиофилизата
ИК (KBr): 3434, 1781, 1668, 1626, 1397, 1317, 1139 см-1
MC: (M-Na)- 287,2
1H-ЯМР (250 МГц, D2O): δ [част./млн]= 17,6 (s, 3H), 3,44 (dd, 1H, J=16 Гц, 1,2 Гц, 6-H), 3,69 (s, 1H, J=16 Гц, 4 Гц, 6-H), 4,68 (s, 1H, 2-H), 5,10 (dd, 1H, J=4 Гц, 1,2 Гц, 5-H), 5,94 (d, 1H, J=13 Гц, =CH), 6,53 (d, 1H, J=13 Гц, =CH).
Натриевая соль (E)-(2S,3S,5R)-3-(2- карбамоилвинил)-3-метил-4,4,7-триоксо-4-тиа-1- азабицикло[3.2.0]гептан-2-карбоновой кислоты
Аналогично примеру 2в) 350 мг (0,78 ммоля) бензгидрилового эфира (E)-(2S, 3S, 5R)-3- (2-карбамоилвинил)-3-метил-4,4,7-триоксо-4-тиа-1-азабицикло [3.2.0] гептан-2-карбоновой кислоты подвергают удалению защитной группы и переводят в натриевую соль.
Выход: 190 мг (80%)
ИК (KBr): 1782, 1684, 1622, 1398, 1318, 1140 см-1
MC: (M-Na)- 287,1
1H-ЯМР (250 МГц, D2O): δ [част./млн] =1,66 (s, 3H), 3,46 (dd, 1H, J=17 Гц, 1,4 Гц, 6-H), 3,71 (dd, 1H, J=17 Гц, 4,0 Гц, 6-H), 4,62 (s, 1H, 2-H), 5,14 (dd, J=1,4 Гц, 4,0 Гц, 5-H), 6,46 (d, 1H, J=16 Гц, =CH), 6,88 (d, 1H, J=16 Гц, =CH).
Пример 7
а) Бензгидриловый эфир (E)-(2S,3S,5R)-3-(2- этоксикарбонилпропенил)-3-метил-7-оксо-4-тиа-1- азабицикло[3.2.0]гептан-2-карбоновой кислоты
286 мг (0,75 ммоля) бензгидрилового эфира (2S,3R,5R)-3-формил-3-метил-7-оксо-4-тиа- 1-азабицикло[3.2.0] гептан-2-карбоновой кислоты растворяют в атмосфере аргона в 12 мл ТГФ и обрабатывают 271 мг (0,75 ммоля) (1-этоксикарбонилэтилиден)трифенилфосфорана. Желтый раствор перемешивают в течение 6 ч при 70oC, после чего концентрируют. Образовавшийся остаток хроматографируют на силикагеле (размер зерен 0,040-0,063 мм) с помощью этилацетата/гексана 9:16 в качестве растворителя.
Выход: 157 мг (45%) твердого вещества бледно-желтого цвета
ИК (пленка): 1788, 1754, 1704, 1542 см-1
MC: (M+NH4 +) 483,4
1H-ЯМР (400 МГц, CDCl3): δ [част./млн] =1,32 (t, 3H, J=7,1 Гц), 1,38 (s, 3H), 2,03 (d, 3H, J=1,5 Гц), 3,05 (dd, 1H, J=1,8 Гц, 16 Гц, 6-H), 3,57 (dd, 1H, J= 4,3 Гц, 16 Гц, 6-H), 4,23 (q, 2H, J=7,l Гц), 4,89 (s, 1H, 2-H), 5,29 (dd, 1H, J=4,3, 1,8 Гц, 5-H), 6,94 (s, 1H, CHPh2), 7,20 (d, 1H, J=l,5 Гц, = CH), 7,30-7,36 (m, 10 H, Ph).
Пример 8
а) Бензгидриловый эфир (E/Z)-(2S,3S,5R)-3-(2- хлорвинил)-3-метил-7-оксо-4-тиа-1-азабицикло[3.2.0]гептан-2- карбоновой кислоты
Суспензию 1,37 г (4,40 ммоля) хлорметилентрифенилфосфорана в 25 мл простого диэтилового эфира охлаждают до 0oC и обрабатывают 1,60 г (4,20 ммоля) бензгидрилового эфира (2S, 3R, 5R)-3-формил-3-метил-7-оксо-4-тиа- 1-азабицикло[3.2.0]гептан-2-карбоновой кислоты. Охлаждающую баню удаляют и перемешивают еще в течение 3 ч при комнатной температуре. Оранжевую суспензию фильтруют и затем концентрируют. Образовавшийся остаток хроматографируют на силикагеле (размер зерен 0,040-0,063 мм) с помощью этилацетата/гексана 1:2 в качестве элюента.
Выход: 1,20 г (69%) желтой смеси изомеров, E/Z 7:9
Спектроскопические характеристики смеси:
ИК (пленка): 1782, 1747, 1590, 1496, 1251 см-1
MC: (M+NH4 +) 413
б) Бензгидриловый эфир (E/Z)- (2S, 3S, 5R)-3-(2-хлорвинил)-3-метил-4,4,7-триоксо-4-тиа-1- азабицикло[3.2.0]гептан-2-карбоновой кислоты
В атмосфере аргона растворяют 2,98 г (14,05 ммолей) метапериодата натрия в 30 мл воды и охлаждают до 0oC. Затем обрабатывают сначала 0,93 г (11,17 ммолей) бикарбоната натрия и после этого 45 мл ацетонитрила и 60 мл метиленхлорида. В двухфазную смесь добавляют сначала 9 мг (0,070 ммоля) двуокиси рутения, а затем раствор 1,20 г (2,90 ммоля) бензгидрилового эфира (Е/Z)-(2S, 3S, 5R)-3-(2-хлорвинил)-3- метил-7-оксо-4-тиа-1-азабицикло[3.2.0] гептан-2-карбоновой кислоты. Охлаждающую баню удаляют и реакционную смесь перемешивают до полного окончания обменной реакции (контроль посредством тонкослойной хроматографии). Затем обрабатывают 2 г активированного угля и 20 мл насыщенного раствора хлорида натрия, продолжают перемешивать в течение 5 мин и реакционную смесь фильтруют на нутче через дикалит. Фазы разделяют в делительной воронке, водную фазу дважды экстрагируют с помощью метиленхлорида и соединенные органические экстракты промывают водой и насыщенным раствором хлорида натрия. Затем сушат над смесью сульфата магния и отбеливающей земли, фильтруют и концентрируют методом ротирования. Полученное масло хроматографируют на силикагеле (размер зерен 0,040-0,063 мм) с помощью этилацетата/н-гексана 1:2, при этом оба изомера разделяют. В качестве первого компонента элюируют изомер Z.
Выход: Z: 495 мг (38%) бесцветного пенистого вещества
Е: 385 мг (30%) бесцветного пенистого вещества
Спектроскопические характеристики изомера Е:
MC: (M+NH4)+ 463,4
ИК (KBr): 1800, 1756, 1612, 1331, 1143, 700 см-1
Спектроскопические характеристики изомера Z:
MC: (M+NH4)+ 463,4
ИК (KBr): 1800, 1755, 1630, 1330, 1143, 700 см-1
в) Натриевая соль (E)-(2S,3S,5R)-3-(2-хлорвинил)-3- метил-4,4,7-триоксо-4-тиа-1-азабицикло[3.2.0]гептан-2-карбоновой кислоты
385 мг (0,86 ммоля) бензгидрилового эфира (E)-(2S,3S,5R)-3- (2-хлорвинил)-3-метил-4,4,7-триоксо-4-тиа-1- азабицикло[3.2.0] гептан-2-карбоновой кислоты растворяют в атмосфере аргона в 2,3 мл м-крезола и перемешивают в течение 4 ч при 50oC. Затем разбавляют 15 мл изобутилметилкетона, обрабатывают 0,50 мл натриевой соли 2-этилкапроновой кислоты (2H раствор в этилацетате) и трижды экстрагируют 8 мл воды. Соединенные водные фазы повторно промывают 10 мл изобутилметилкетона, лиофилизуют и полученный лиофилизат хроматографируют через полимерный гидрофобный гель с помощью воды в качестве элюента.
Выход: 57 мг (32%)
МС: (M-Na)- 278,2
ИК (KBr): 1780, 1626, 1564, 1417, 1329, 1145 см-1
Натриевая соль (Z)-(2S,3S,5R)-3-(2-хлорвинил)-3-метил-4,4,7- триоксо-4-тиа-1-азабицикло [3.2.0] гептан-2-карбоновой кислоты
Аналогично примеру 8в) 400 мг (0,90 ммоля) бензгидрилового эфира (Z)-(2S, 3S,5R)-3-(2- хлорвинил)-3-метил-4,4,7-триоксо-4-тиа-1-азабицикло[3.2.0] гептан-2-карбоновой кислоты подвергают удалению защитной группы и переводят в натриевую соль.
Выход: 176 мг (65%) бесцветного лиофилизата
МС: (M-Na)- 278,2
ИК (KBr): 1779, 1626, 1398, 1321, 1142 см-1
Элементный анализ: C9H9ClNO5SNa (301,676)
вычислено: C 35,83; H 3,01; N 4,64;
найдено#): C, 35,72; H 3,04; N 4,65;
#) безводный рассч. с 5,53% воды
Пример 9
а) Бензгидриловый эфир (E)-(2S, 3S,5R)-3-метил-7-оксо-3-(3-оксобут-1- енил)-4-тиа-1-азабицикло[3.2.0]гептан-2-карбоновой кислоты
381 мг (1,00 ммоль) бензгидрилового эфира (2S,3R,5R)-3-формил-3- метил-7-оксо-4-тиа-1-азабицикло [3.2.0] гептан-2-карбоновой кислоты растворяют в атмосфере аргона в 12 мл ТГФ и обрабатывают 350 мг (1,10 ммоля) ацетилметилентрифенилфосфорана. Смесь перемешивают в течение 6 дней при 50oC, после чего концентрируют. Образовавшийся остаток хроматографируют на силикагеле (размер зерен 0,040-0,063 мм) с помощью этилацетата/метиленхлорида 95:5 в качестве элюента.
Выход: 221 мг (52%) белой смолы
ИК (пленка): 1782, 1681, 1627, 1319, 1141, 980 см-1
MC: (M-Na)- 286,1
б) Бензгидриловый эфир (E)- (2S,3S,5R)-3-метил-3-(3-оксобут-l-енил)-4,4,7-триоксо-4-тиа-1- азабицикло[3.2.0]гептан-2-карбоновой кислоты
Аналогично примеру 8 окисляют 221 мг (0,49 ммоля) бензгидрилового эфира (E)-(2S, 3S, 5R)- 3-метил-7-оксо-3-(3-оксобут-1-енил)-4-тиа-1-азабицикло[3.2.0] гептан-2-карбоновой кислоты. Затем хроматографируют один раз на силикагеле (размер зерен 0,040-0,063 мм) с помощью этилацетата/н-гексана 9: 16 в качестве элюента и кристаллизуют из метиленхлорида/н-гексана.
Выход: 95 мг (40%) бесцветных кристаллов
MC: (M+NH4)+ 471,2
ИК (KBr): 1798, 1760, 1682, 1627, 1330, 1193, 1142, 976 см-1
Тпл: 183-184oC
в) Натриевая соль (E)- (2S,3S,5R)-3-метил-3-(3-оксобут-1-енил)-4,4,7-триоксо-4-тиа-1- азабицикло[3.2.0]гептан-2-карбоновой кислоты
Аналогично примеру 8в) 250 мг (0,55 ммоля) бензгидрилового эфира (Е)-(2S, 3S, 5R)-3- метил-3-(3-оксобут-1-енил)-4,4,7-триоксо-4-тиа-1-азабицикло [3.2.0] гептан-2-карбоновой кислоты подвергают удалению защитной группы и переводят в натриевую соль.
Выход: 47 мг (27%) бесцветного лиофилизата
MC: (M-Na)- 286,1
ИК (KBr): 1782, 1681, 1627, 1394, 1319, 1141, 980 см-1
Пример 10
а) Бензгидриловый эфир (E)-(2S,3S,5R)-3-(2-формилвинил)-3-метил-7-оксо-4-тиа-1-азабицикло [3.2.0] гептан-2-карбоновой кислоты
3,81 г (10,0 ммолей) бензгидрилового эфира (2S,3R,5R)-3-формил-3-метил-7-оксо-4-тиа-1- азабицикло [3.2.0] гептан-2-карбоновой кислоты растворяют в атмосфере аргона в 40 мл метиленхлорида и обрабатывают 3,34 г (11,0 ммолей) формилметилентрифенилфосфорана. Желтый раствор перемешивают в течение 3 дней при комнатной температуре, после чего концентрируют. Образовавшийся остаток хроматографируют на силикагеле (размер зерен 0,040-0,063 мм) с помощью трет.- бутилметилового эфира/н-гексана 2:3 в качестве элюента.
Выход: 528 мг (13%) бесцветной смолы
ИК (пленка): 2738, 1781, 1744, 1717, 1690, 1496, 1178, 986 см-1
MC: (M+MH4)+ 425,6
Пример 11
а) Бензгидриловый эфир (E)-(2S,3S,5R)-3-метил-3-[2-(1,2,4-оксадиазол- 3-ил)-винил]-7-оксо-4-тиа-1-азабицикло [3.2.0] гептан-2-карбоновой кислоты
1,14 г (3,0 ммоля) бензгидрилового эфира (2S,3R,5R)-3- формил-3-метил-7-оксо-4-тиа-1-азабицикло[3.2.0] гептан-2-карбоновой кислоты растворяют в 15 мл окиси 1,2-бутилена, обрабатывают 1,38 г (3,6 ммоля) хлорида (1,2,4-оксадиазол-3-ил)метилтрифенилфосфония и нагревают в течение 10 ч с обратным холодильником. Затем фильтруют, концентрируют методом ротации и остаток в виде коричневого масла хроматографируют на силикагеле (размер зерен 0,040-0,063 мм) с помощью метиленхлорида в качестве элюента.
Выход: 280 мг (21%) бесцветных кристаллов
MC: (M+NH4)+ 465,3
ИК (KBr): 1792, 1753, 1658, 1492, 1200, 991 см-1
б) Бензгидриловый эфир (E)-(2S,3S,5R)-3-метил-3-[2-(1,2,4-оксадиазол- 3-ил)-винил] -4,4,7-триоксо-4-тиа-1-азабицикло[3.2.0] гептан-2- карбоновой кислоты
Аналогично примеру 8 окисляют 280 мг (0,63 ммоля) бензгидрилового эфира (E)-(2S, 3S, 5R)-3-метил-3-[2-(1,2,4- оксадиазол-3-ил)-винил]-7-оксо-4-тиа-1-азабицикло[3.2.0]гептан-2- карбоновой кислоты. Затем хроматографируют один раз на силикагеле (размер зерен 0,040-0,063 мм) с помощью этилацетата/н-гексана 9:16 в качестве элюента и кристаллизуют из метиленхлорида/н-гексана.
Выход: 95 мг (40%) бесцветных кристаллов
MC:(M-H)- 478,3
ИК (KBr): 1805, 1758, 1650, 1334, 1196 см-1
Тпл: 157oC
Элементный анализ: C24H21N3O6S (479,507)
вычислено: C 60,12; H 4,41; N 8,76;
найдено; C 59,94; H 4,26; N 8,55.
в) (E)-(2S, 3S,5R)-3-метил-3-[2-(1,2,4-оксадиазол-3-ил)- винил]-4,4,7-триоксо-4-тиа-1-азабицикло[3.2.0]гептан-2- карбоновая кислота
355 мг (0,74 ммоля) бензгидрилового эфира (E)- (2S,3S,5R)-3-метил-3-[2-(1,2,4-оксадиазол-3-ил)-винил] -4,4,7- триоксо-4-тиа-1-азабицикло[3.2.0] гептан-2-карбоновой кислоты растворяют в 3 мл м-крезола и перемешивают в течение 4 ч при 50oC. В светло-коричневый раствор добавляют 20 мл н-гексана, выпавшие кристаллы фильтруют на нутче и промывают н-гексаном. Сырой кристаллизат перекристаллизовывают из этилацетата/н-гексана.
Выход: 170 г (73%) бесцветных кристаллов
МС: (М-H)- 312,2
ИК (KBr): 2900 (шир.), 1811, 1714, 1660, 1331, 1194, 980 см-1
Тпл.: 161oC (разложение)
Элементный анализ: C11H11N3O6S (313,284)
вычислено: C 42,17; H 3,54; N 13,41;
найдено: C 42,41; H 3,64; N 13,18,
г) Натриевая соль (E)-(2S,3S,5R)-3-метил-3-[2-(1,2,4-оксадиазол-3-ил)-винил] -4,4,7-триоксо-4-тиа-1-азабицикло [3.2.0] гептан-2-карбоновой кислоты
В прозрачный раствор 23 мг (0,27 ммоля) гидрокарбоната натрия в 10 мл воды добавляют за один прием 85 мг (0,27 ммоля) (E)-(2S,3S,5R)-3-метил-3-[2-(1,2,4-оксадиазол-3-ил)-винил] -4,4,7-триоксо-4-тиа-1-азабицикло[3.2.0] гептан-2-карбоновой кислоты, перемешивают в течение примерно 10 мин, фильтруют и лиофилизуют.
Выход: 90 мг (91%) бесцветного лиофилизата
МС: (M-Na)- 312,2
ИК (KBr): 1787, 1627, 1395, 1321, 1192, 970 см-1
Элементный анализ: C11H10N3O6SNa (335,266)
вычислено: C 39,41; H 3,01; N 12,53;
найдено #): C 39,86; H 3,04; N 12,51;
#) безводный рассч. с 5,82% воды.
Пример 12
а) Бензгидриловый эфир (Е) и (Z)- (2S,3S,5R)-3-метил-3-(2-тиазол-2-ил-винил)-7-оксо-4-тиа-1- азабицикло[3.2.0]гептан-2-карбоновой кислоты
1,14 г (3,0 ммоля) бензгидрилового эфира (2S,3R,5R)-3-формил-3-метил-7-оксо-4-тиа-1- азабицикло[3.2.0]гептан-2-карбоновой кислоты растворяют в 50 мл окиси 1,2-бутилена, обрабатывают 1,53 г (3,86 ммоля) хлорида (тиазол-2-ил)метилтрифенилфосфония и нагревают в течение 40 ч с обратным холодильником. Затем фильтруют, концентрируют методом ротации и полученный коричневый фильтрат хроматографируют на силикагеле (размер зерен 0,040-0,063 мм) с помощью метиленхлорида/этилацетата 95:5 в качестве элюента. При этом оба изомера разделяют, в качестве первого компонента элюируют изомер Z.
Изомер Z:
Выход: 240 мг (17%) желтого масла
ИК (пленка): 1778, 1743, 1493, 1197, 986 см-1
МС: (М+H)+ 463,5
Изомер Е:
Выход: 855 мг (62%) желтой смолы
ИК (KBr): 1779, 1746, 1492, 1292, 988 см-1
МС: (М+H)+ 463,5
б) Бензгидриловый эфир (E)-(2S,3S,5R)-3-метил- 4,4,7-триоксо-3-(2-тиазол-2-илвинил)-4-тиа-1-азабицикло[3.2.0] гептан-2-карбоновой кислоты
Аналогично примеру 8 окисляют 200 мг (0,43 ммоля) бензгидрилового эфира (E)-(2S, 3S, 5R)-3-метил-3-(2- тиазол-2-илвинил)-7-оксо-4-тиа-1-азабицикло[3.2.0] гептан-2- карбоновой кислоты. Затем хроматографируют на силикагеле (размер зерен 0,040-0,063 мм) с помощью метиленхлорида/этилацетата 95:5 в качестве элюента.
Выход: 72 мг (33%) бесцветного пенистого вещества
МС: (М+H)+ 495,4
ИК (KBr): 1799, 1756, 1329, 1192, 1142, 963 см-1
в) Бензгидриловый эфир (Z)-(2S,3S,5R)-3-метил-4,4,7-триоксо-3-(2- тиазол-2-илвинил)-4-тиа-1-азабицикло[3.2.0]гептан-2-карбоновой кислоты
Аналогично примеру 8 окисляют 210 мг (0,45 ммоля) бензгидрилового эфира (Z)-(2S, 3S, 5R)-3-метил-4,4,7-триоксо-3- (2-тиазол-2-илвинил)-4-тиа-1-азабицикло[3.2.0]гептан-2-карбоновой кислоты. Затем хроматографируют на силикагеле (размер зерен 0,040-0,063 мм) с помощью метиленхлорида/этилацетата 95:5 в качестве элюента.
Выход: 72 мг (33%) бесцветного пенистого вещества
МС: (М+H)+ 495,4
ИК (KBr): 1793, 1754, 1490, 1328, 1184, 1142, 963 см-1
(E)-(2S, 3S, 5R)-3-метил-4,4,7-триоксо-3-(2-тиазол-2- илвинил)-4-тиа-1-азабицикло [3.2.0] гептан-2-карбоновая кислота
Аналогично примеру 11в) 200 мг (0,40 ммоля) бензгидрилового эфира (Е)-(2S, 3S, 5R)-3-метил-3-(2-тиазол-2-илвинил)-4,4,7-триоксо-4-тиа- 1-азабицикло[3.2.0]гептан-2-карбоновой кислоты подвергают удалению защитной группы.
Выход: 53 мг (40%) бесцветных кристаллов
МС: (М+H)+ 329,4
ИК (KBr): 2800 (шир.), 1791, 1740, 1634, 1321, 1142, 965 см-1
Натриевая соль (E)-(2S,3S,5R)-3- метил-4,4,7-триоксо-3-(2-тиазол-2-илвинил)-4-тиа-1-азабицикло [3.2.0]гептан-2-карбоновой кислоты
Аналогично примеру 11 53 мг (0,16 ммоля) (E)- (2S,3S,5R)-3-метил-4,4,7-триоксо-3-(2-тиазол-2-илвинил)-4-тиа-1- азабицикло[3.2.0] гептан-2-карбоновой кислоты переводят в соответствующую натриевую соль.
Выход: 55 мг (98%) бесцветного лиофилизата
ИК (KBr): 1778, 1627, 1392, 1318, 1192, 1141, 955 см-1
Элементный анализ: C12H11N2O5S2Na (350,339)
вычислено: C 41,14; H 3,16; N 8,00;
найдено #): C 40,73; H 3,51; N 7,92.
#) безводный рассч. с 5,9% воды
Натриевая соль (Z)- (2S,3S,5R)-3-метил-4,4,7-триоксо-3-(2-тиазол-2-илвинил)-4-тиа-1- азабицикло[3.2.0]гептан-2-карбоновой кислоты
Аналогично примеру 8 160 мг (0,32 ммоля) бензгидрилового эфира (Z)-(2S, 3S, 5R)-3-метил-4,4,7-триоксо-3-(2-тиазол-2- илвинил)-4-тиа-1-азабицикло[3.2.0] гептан-2-карбоновой кислоты переводят в соответствующую натриевую соль.
Выход: 60 мг (57%) бесцветного лиофилизата
ИК (KBr): 1781, 1623, 1398, 1320, 1193, 1140, 950 см-1
1H-ЯМР (250 МГц, CDCl3): δ [част./млн] = 1,52 (s, 3H), 3,42 (dd, 1H, J= 16 Гц, 1,2 Гц, 6-H), 3,58 (dd, 1H, J=16 Гц, 4,1 Гц, 6-H), 5,04 (dd, 1H, J= 1,2 Гц, 4,1 Гц, 5-H), 5,19 (s, 1H, 2-H), 6,06 (d, 1H, J=12,5 Гц, =CH), 7,14 (d, 1H, J=12,5 Гц, =CH), 7,75 (ABSystem, 2H, J=3,5 Гц, тиазол-H).
Пример 13
а) Бензгидриловый эфир (E)-(2S, 3S,5R)-3-метил-3-(2-пиридин-2- ил-винил)-7-оксо-4-тиа-1-азабицикло [3.2.0] гептан-2-карбоновой кислоты
Суспензию 353 мг (1,0 ммоль) (2- пиколил)метилентрифенилфосфорана и 381 мг (1,00 ммоль) бензгидрилового эфира (2S,3R,5R)-3-формил-3-метил-7- оксо-4-тиа-1- азабицикло [3.2.0] гептан-2-карбоновой кислоты в 10 мл простого диэтилового эфира перемешивают в атмосфере аргона в течение 2 ч при комнатной температуре. Затем обрабатывают 10 мл метиленхлорида, отфильтровывают от нерастворимых компонентов и концентрируют. Образовавшийся остаток хроматографируют на силикагеле (размер зерен 0,040-0,063 мм) с помощью метиленхлорида/этилацетата 95:5 в качестве элюента.
Выход: 128 мг (28%) бесцветного пенистого вещества
МС: (M•) 456
ИК (KBr): 1779, 1747, 1634, 1291, 988 см-1
б) Бензгидриловый эфир (E)- (2S,3S,5R)-3-метил-3-(2-пиридин-2-ил-винил)-4,4,7-триоксо-4-тиа- 1-азабицикло [3.2.0] гептан-2-карбоновой кислоты
Аналогично примеру 8 окисляют 196 мг (0,43 ммоля) бензгидрилового эфира (Е)- (2S,3S,5R)-3-метил 3-(2-пиридин-2-илвинил)-7-оксо-4-тиа-1 - азабицикло [3.2.0] гептан-2-карбоновой кислоты. Затем хроматографируют на силикагеле (размер зерен 0,040-0,063 мм) с помощью метиленхлорида/этилацетата 95:5 в качестве элюента.
Выход: 130 мг (62%) бесцветного пенистого вещества
МС: (М+H)+ 489,4
ИК (KBr): 1799, 1756, 1580, 1490, 1327, 1184, 1141, 969 см-1
в) (E)- (2S, 3S, 5R)-3-метил-3-(2-пиридин-2-илвинил)-4,4,7-триоксо-4-тиа-1- азабицикло [3.2.0] гептан-2-карбоновая кислота
Аналогично примеру 10 из 200 мг (0,41 ммоля) бензгидрилового эфира (E)-(2S, 3S, 5R)-3- метил-3-(2-пиридин-2-илвинил)-4,4,7-триоксо-4-тиа-1- азабицикло[3.2.0]гептан-2-карбоновой кислоты получают кислоту.
Выход: 85 мг (65%) кристаллического порошка светло-бежевого цвета
МС: (М+H)+ 323,3
ИК (KBr): 2700 (шир.), 1790, 1720, 1621, 1318, 1140, 978 см-1
Натриевая соль (E)-(2S,3S,5R)-3-метил-3-(2-пиридин- 2-илвинил)-4,4,7-триоксо-4-тиа-1-азабицикло[3.2.0]гептан-2- карбоновой кислоты
Аналогично примеру 10 83 мг (0,17 ммоля) (E)- (2S,3S,5R)-3-метил-3-(2-пиридин-2-илвинил)-4,4,7-триоксо-4-тиа- 1-азабицикло [3.2.0] гептан-2-карбоновой кислоты переводят в соответствующую натриевую соль.
Выход: 89 мг (100%) бесцветного лиофилизата
ИК (KBr): 1784, 1629, 1587, 1478, 1396, 1320, 1187, 1141, 980 см-1
Элементный анализ: C14H13N2O5SNa (344,317)
вычислено: C 48,84; H 3,81; N 8,14;
найдено#): C 49,18; H 4,23; N 8,17.
#) безводный рассч. с 6,86% воды
Пример 14
а) Бензгидриловый эфир (E)-(2S,3S,5R)-3-[2-(N-метокси N-метил- карбамоил)-винил] -3-метил-7-оксо-4-тиа-1-азабицикло[3.2.0] гептан- 2-карбоновой кислоты
Оранжевый раствор 1,14 г (3,0 ммоля) бензгидрилового эфира (2S,3R,5R)-3-формил-3-метил-7-оксо-4-тиа-1- азабицикло [3.2.0] гептан-2-карбоновой кислоты и 1,14 г (3,15 ммоля) (N-метокси-N-метиламинокарбонилметилен)- трифенилфосфорана перемешивают в атмосфере аргона в течение 3 дней при комнатной температуре. Затем с помощью ротационного испарителя удаляют растворитель и хроматографируют на силикагеле (размер зерен 0,040-0,063 мм) с помощью этилацетата/н-гексана 1:1 в качестве элюента.
Выход: 1,12 г (80%) бесцветного пенистого вещества
МС: (М+H)+ 467,4
ИК (KBr): 1781, 1744, 1662, 1629, 995 см-1
б) Бензгидриловый эфир (E)-(2S,3S,5R)-3-[2-(N-метокси-N-метил- карбамоил)-винил] -3-метил-4,4,7-триоксо-4-тиа-1- азабицикло[3.2.0]гептан-2-карбоновой кислоты
0,69 г (1,48 ммоля) бензгидрилового эфира (E)-(2S,3S,5R)-3-[2-(N-метокси-N-метилкарбамоил)-винил] -3-метил-7-оксо-4-тиа-1- азабицикло[3.2.0] гептан-2-карбоновой кислоты окисляют аналогично тому, как это описано в примере 8. Затем хроматографируют на силикагеле (размер зерен 0,040-0,063 мм) с помощью этилацетата/н- гексана 3:2 в качестве элюента.
Выход: 405 мг (55%) бесцветного пенистого вещества
МС: (М+H)+ 499,4
ИК (KBr): 1807, 1753, 1662, 1624, 1318, 1140, 1000 см-1
в) Натриевая соль (E)-(2S,3S,5R)-3-[2- (N-метокси-N-метилкарбамоил)-винил] -3-метил-4,4,7-триоксо-4-тиа- 1-азабицикло[3.2.0]гептан-2-карбоновой кислоты
Аналогично примеру 8, из 200 мг (0,40 ммоля) бензгидрилового эфира (E)-(2S, 3S, 5R)-3- [2-(N-метокси-N-метилкарбамоил)-винил] -3-метил-4,4,7- триоксо-4-тиа-1-азабицикло[3.2.0]гептан-2-карбоновой кислоты получают указанную натриевую соль.
Выход: 95 мг (67%) бесцветного лиофилизата
МС: (М+H)+ 355,3
ИК (KBr): 1785, 1650, 1626, 1390, 1322, 1191, 1141, 980 см-1
Элементный анализ: C12H15N2O7SNa (354,309)
вычислено; C 40,68; H 4,27; N 7,91;
найдено#): C 40,37; H 4,35; N 7,84;
#) безводный рассч. с 2,74% воды
Пример 15
(E)-(2S, 3S, 5R)-3-метил-3-[2-(1-метилпиридин-2-илио)-винил] -4,4,7-триоксо-4-тиа-1-азабицикло[3.2.0]гептан-2-карбоновая кислота
150 мг (0,31 ммоля) бензгидрилового эфира (E)-(2S,3S,5R)- 3-метил-3-(2-пиридин-2-илвинил)-4,4,7-триоксо-4-тиа-1-аза- бицикло[3.2.0] гептан-2-карбоновой кислоты растворяют в 3 мл метиленхлорида, охлаждают до 0oC и обрабатывают 56 мкл (0,51 ммоля) метилового эфира трифторметилсульфокислоты. Затем удаляют охлаждающую баню и перемешивают при комнатной температуре в течение 2 дней. Растворитель удаляют с помощью ротационного испарителя и остаток сушат в высоком вакууме. Полученный таким путем продукт (200 мг, 100%) без последующей очистки перерабатывают дальше. Коричневую смолу растворяют в 2 мл м-крезола и перемешивают в течение 2 ч при 50oC. Затем обрабатывают 10 мл изобутилметилкетона и 5 мл воды, после чего экстрагируют путем встряхивания, фазы разделяют и органическую фазу еще дважды экстрагируют 5 мл воды. Водные фазы дважды промывают соответственно 10 мл изобутилметилкетона, фильтруют и лиофилизуют. Желтоватый лиофилизат хроматографируют над полимерным гидрофобным гелем с помощью воды в качестве элюента.
Выход: 105 мг (72%) лиофилизата оранжевого цвета
ИК (KBr): 1778, 1627, 1377, 1185, 970 см-1
МС: (М+) 337,4
Пример 16
а) Бензгидриловый эфир (1E, 3E)- (2S,3S,5R)-3-(4-формилбута-1,3-диенил)-3-метил-7-оксо-4-тиа-1- азабицикло[3.2.0]гептан-2-карбоновой кислоты
Бензгидриловый эфир (1E,3E)-(2S,3S,5R)-3-(4-формилбута-1,3-диенил)-3-метил-7-оксо-4- тиа-1-азабицикло[3.2.0]гептан-2-карбоновой кислоты получают аналогично тому, как это описано в примере 10, из 3,81 г (10,0 ммолей) бензгидрилового эфира (2S,3R,5R)-3-формил-3-метил-7-оксо- 4-тиа-1-азабицикло [3.2.0] гептан-2-карбоновой кислоты и 4,55 г (15,0 ммолей) формилметилентрифенилфосфорана. Хроматографию осуществляют на силикагеле (размер зерен 0,040-0,063 мм) с помощью метиленхлорида/этилацетата 98:2 в качестве элюента.
Выход: 347 мг (8%) смолы желтоватого цвета
МС: (M+NH4)+ 451,4
ИК (KBr): 1779, 1745, 1680, 1637, 1201, 988 см-1
Пример 17
а) Бензгидриловый эфир (1E, 3E) и (1E,3E)-(2S,3S,5R)-3-(4-цианобута- 1,3-диенил)-3-метил-7-оксо-4-тиа-1-азабицикло[3.2.0] гептан-2- карбоновой кислоты
Бензгидриловый эфир (1E,3E) и (1E,3Z)-(2S,3S,5R)- 3-(4-цианобута-1,3-диенил)-3-метил-7-оксо-4-тиа-1- азабицикло[3.2.0]гептан-2-карбоновой кислоты получают аналогично примеру 4, метод Б, из 815 мг (2,14 ммоля) бензгидрилового эфира (1E, 3E)-(2S, 3S, 5R)-3-формил-3-метил-7-оксо-4-тиа-1- азабицикло[3.2.0] гептан-2-карбоновой кислоты и 678 мг (2,25 ммол) цианометилентрифенилфосфорана. Образовавшееся масло очищают на силикагале (размер зерен 0,040-0,063 мм) с помощью этилацетата/н- гексана 1:2 в качестве элюента.
Выход: 820 мг (89%) смеси изомеров, E/Z 2:3
Спектроскопические характеристики смеси:
ИК (пленка): 2215, 1780, 1745, 1202, 989 см-1
МС: (M+NH4 +) 448,5
б) Бензгидриловый эфир (1E, 3E) и (1E,3Z)-(2S,3S,5R)-3-(4-цианобута-1,3-диенил)-3-метил-4,4,7-триоксо- 4-тиа-1-азабицикло[3.2.0] гептан-2- карбоновой кислоты
Аналогично примеру 8 окисляют 770 мг (1,79 ммоля) бензгидрилового эфира (1E, 3E) и (1E,3Z)-(2S,3S,5R)-3-(4-цианобута- 1,3-диенил)-3-метил-7-оксо-4-тиа-1-азабицикло[3.2.0]гептан-2- карбоновой кислоты. Оба изомера можно разделить посредством хроматографии на силикагеле (размер зерен 0,040-0,063 мм) с помощью этилацетата/н-гексана 9:16 в качестве элюента. В качестве первого компонента элюируют изомер Z.
Выход: Z: 430 мг (52%) бесцветного масла
Е: 280 мг (34%) бесцветного пенистого вещества
Спектроскопические характеристики изомера Е:
МС: (M+NH4)+ 480,5
ИК (KBr): 2219, 1800, 1756, 1329, 1191, 994 см-1
Спектроскопические характеристики изомера Z:
МС: (M+NH4)+ 480,5
ИК (KBr): 2210, 1800, 1756, 1330, 1192, 993 см-1
в) Натриевая соль (1E,3E)-(2S,3S,5R)-3-(4-цианобута-1,3-диенил)-3- метил-4,4,7- триоксо-4-тиа-1-азабиацикло[3.2.0]гептан-2-карбоновой кислоты
Аналогично примеру 8 250 мг (0,54 ммоля) бензгидрилового эфира (1E, 3E)-(2S, 3S, 5R)-3-(4-цианобута-1,3-диенил)-3-метил-4,4,7- триоксо-4-тиа-1-азабицикло[3.2.0] гептан-2-карбоновой кислоты подвергают удалению защитной группы и превращению в натриевую соль.
Выход: 55 мг (41%) лиофилизата желтоватого цвета
ИК (KBr): 2221, 1781, 1631, 1397, 1319, 1139, 992 см-1
MC: (M+Na)+ 341,2
Натриевая соль (1E,3Z)-(2S,3S,5R)-3-(4-цианобута-1,3- диенил)-3-метил-4,4,7-триоксо-4-тиа-1-азабицикло[3.2.0]гептан-2- карбоновой кислоты
Аналогично примеру 8 230 мг (0,49 ммоля) бензгидрилового эфира (1Е, 3Е)-(2S, 3S, 5R)-3-(4-цианобута-1,3-диенил)-3-метил- 4,4,7-триоксо-4-тиа-1-азабицикло[3.2.0] гептан-2-карбоновой кислоты подвергают удалению защитной группы и превращению в натриевую соль.
Выход: 84 мг (58%) лиофилизата желтоватого цвета
ИК (KBr): 2219, 1780, 1625, 1396, 1316, 1138, 951 см-1
МС: (M+H)+ 319,3
Элементный анализ: C12H11N2O5SNa (318,279)
вычислено: C 45,28; H 3,48; N 8,80;
найдено#): C 45,29; H 3,63; N 8,82;
#) безводный рассч. с 6,93% воды.
Пример 18
а) Бензгидриловый эфир (E/Z)-(2S,3S,5R)-3-метил-7-оксо-3-[2- оксо-1-(2,2,2-трифторэтил)-пирролидин-3-илиденметил] -4- тиа-1-азабицикло[3.2.0]гептан-2-карбоновой кислоты
Согласно примеру 12 762 мг (2,0 ммоля) бензгидрилового эфира (2S,3R, 5R)-3-формил-3-метил-7-оксо-4-тиа-1-азабицикло[3.2.0] гептан-2- карбоновой кислоты подвергают обменной реакции с 1,02 г (2,0 ммоля) бромида рацемического [2-оксо-1-(2,2,2-трифторэтил)-3- пирролидинил]-трифенилфосфония. После этого хроматографируют на силикагеле (размер зерен 0,040-0,063 мм) с помощью этилацетата/н-гексана 9:16 в качестве элюента.
Выход: 763 мг (71%) смеси изомеров, E/Z 5:1
Спектроскопические характеристики смеси:
ИК (пленка): 1782, 1748, 1702, 1664, 1158 см-1
MC: (M-CPh2) 363
б) Бензгидриловый эфир (Е) и (Z)-(2S, 3S, 5R)-3-метил-3-[2-оксо-1-(2,2,2-трифторэтил)- пирролидин-3-илиденметил] -4,4,7-триоксо-4-тиа-1- азабицикло[3.2.0]гептан-2-карбоновой кислоты
Аналогично примеру 8 окисляют 763 мг (1,42 ммоля) бензгидрилового эфира (E/Z)- (2S,3S,5R)-3-метил-7-оксо-3-[2-оксо-1-(2,2,2-трифторэтил)- пирролидин-3-илиденметил] -4-тиа-1-азабицикло [3.2.0] гептан-2- карбоновой кислоты. При этом оба изомера можно разделить посредством хроматографии на силикагеле (размер зерен 0,040-0,063 мм) с помощью этилацетата/н-гексана 1:2 в качестве элюента.
Выход: Е: 192 мг (24%) бесцветного пенистого вещества
Z: 32 мг (4%) бесцветного пенистого вещества
Спектроскопические характеристики изомера Е:
MC: (M+NH4)+ 580,4
ИК (KBr): 1801, 1759, 1706, 1667, 1329, 1144 см-1
Спектроскопические характеристики изомера Z:
MC: (M+NH4)+ 580,4
ИК (KBr): 1798, 1755, 1694, 1327, 1142 см-1
в) (Е)-(2S,3S,5R)-3-метил-3-[2-оксо-1-(2,2,2- трифторэтил)-пирролидин-3-илиденметил] -4,4,7-триоксо-4-тиа-1- азабицикло[3.2.0]гептан-2-карбоновой кислоты
Аналогично примеру 11 192 мг (0,34 ммоля) бензгидрилового эфира (Е)-(2S, 3S, 5R)-3- метил-3-[2-оксо-1-(2,2,2-трифторэтил)-пирролидин-3- илиденметил] -4,4,7-триоксо-4-тиа-1-азабицикло[3.2.0] гептан-2-карбоновой кислоты подвергают удалению защитной группы.
Выход: 78 мг (59%) бесцветного кристаллического порошка
MC: (M+NH4)+ 414,4
ИК (KBr): 2800 (шир.), 1790, 1729, 1674, 1646, 1321, 1166 см-1
Натриевая соль (E)-(2S, 3S, 5R)-3-метил-3-[2-оксо-1- (2,2,2-трифторэтил)-пирролидин-3-илиденметил] -4,4,7-триоксо- 4-тиа-1-азабицикло[3.2.0] гептан-2-карбоновой кислоты
Аналогично примеру 11 50 мг (0,13 ммоля) (E)-(2S,3S,5R)-3-метил-3-[2-оксо-1- (2,2,2-трифторзтил)-пирролидин-3-илиденметил] -4,4,7- триоксо-4-тиа-1-азабицикло[3.2.0] гептан-2-карбоновой кислоты превращают в соответствующую натриевую соль.
Выход: 52 мг (98%) бесцветного лиофилизата
ИК (KBr): 1780, 1699, 1628, 1478, 1396, 1323, 1140 см-1
Элементный анализ: C14H14N2O6F3SNa (418,318)
вычислено: C 40,20; H 3,37; N 6,70;
найдено#): C 39,80; H 3,28; N 6,62;
#) безводный рассч. с 7,24% воды
Пример 19
а) Бензгидриловый эфир (E/Z)-(2S,3S,5R)-3-(1-циклопропил-2-оксо- пирролидин-3-илиденметил)-3-метил-7-оксо-4-тиа-1-азабицикло [3.2.0] гептан-2-карбоновой кислоты
Аналогично примеру 18 381 мг (1,0 ммоль) бензгидрилового эфира (2S,3R, 5R)-3-формил-3-метил-7- оксо-4-тиа-1-азабицикло[3.2.0] гептан-2-карбоновой кислоты подвергают обменной реакции с 495 мг (1,1 ммоля) бромида рацемического [1-циклопропил-2-оксо-3-пирролидинил] - трифенилфосфония. После этого хроматографируют на силикагеле (размер зерен 0,040-0,063 мм) с помощью этилацетата/н-гексана 9:16 в качестве элюента.
Выход: 362 мг (74%) смеси изомеров, E/Z 5:1.
Спектроскопические характеристики смеси:
ИК (пленка): 1780, 1750, 1692, 1661, 1195, 1118 см-1
МС: (М+H)+ 489,4
Пример 20
а) Бензгидриловый эфир (E)-(2S,3S,5R)-3-(3- гидроксипропен-1-ил)-3-метил-7-оксо-4-тиа-1- азабицикло[3.2.0]гептан-2-карбоновой кислоты
5,80 г (14,2 ммолей) бензгидрилового эфира (Е)-(2S,3S,5R)-3- (2-формилвинил)-3-метил-7-оксо-4-тиа-1-азабицикло [3.2.0]гептан-2- карбоновой кислоты растворяют в атмосфере аргона в 240 мл толуола и охлаждают до 0oC. Затем добавляют по каплям 14,2 мл (21,3 ммолей) 20%-ного раствора гидрида диизобутилалюминия (в толуоле), после чего охлаждающую баню удаляют. Перемешивание продолжают при комнатной температуре в течение 6 ч, затем реакционную смесь выливают в 150 мл насыщенного раствора хлорида аммония и трижды экстрагируют соответственно порциями по 200 мл метиленхлорида. Соединенные органические экстракты промывают один раз 300 мл воды и насыщенным раствором хлорида натрия, сушат над сульфатом магния, фильтруют и с помощью ротационного испарителя отделяют от растворителя. Полученное желтое масло хроматографируют на силикагеле (размер зерен 0,040-0,063 мм) с помощью этилацетата/н-гексана 9: 16 в качестве элюента.
Выход: 1,90 г (32%) бесцветной смолы
ИК (пленка): 3480 (шир.), 1778, 1750, 1202, 1080, 988 см-1
MC: (M+NH4)+ 427,6
в) Натриевая соль (E)-(2S,3S,5R)- 3-(3-гидроксипропен-1-ил)-3-метил-4,4,7-триоксо-4-тиа-1- азабицикло[3.2.0]гептан-2-карбоновой кислоты
Аналогично примеру 8 500 мг (0,95 ммоля) бензгидрилового эфира (E)-(2S, 3S, 5R)-3-метил- 4,4,7-триоксо-3-[3-[(R)- и (S)-тетрагидро-пиран-2-илокси]- пропенил] -4-тиа-1-азабицикло[3.2.0] гептан-2-карбоновой кислоты подвергают удалению защитной группы и превращению в натриевую соль.
Выход: 165 мг (62%) бесцветного лиофилизата
MC: (M-Na)- 274,3
ИК (KBr): 3428, 1780, 1622, 1398, 1311, 1192, 1139, 1082 см-1
Элементный анализ: C10H12NO6SNa (297,257)
вычислено: C 40,41; H 4,07; N 4,71;
найдено#): C 40,44; H 4,48; N 4,79;
#) безводный рассч. с 8,73% воды
Бензгидриловый эфир (E)- (2S,3S,5R)-3-метил-7-оксо-3-[3-[(R)- и (S)-тетрагидропиран-2- илокси] -пропенил] -4-тиа-1-азабицикло[3.2.0] гептан-2-карбоновой кислоты
620 мг (1,50 ммоля) бензгидрилового эфира (Е)-(2S,3S,5R)- 3-(3-гидроксипропенил)-3-метил-7-оксо-4-тиа-1- азабицикло[3.2.0] гептан-2-карбоновой кислоты растворяют в 30 мл метиленхлорида и обрабатывают 4,5 мг (0,024 ммоля) моногидрата п- толуолсульфокислоты. Затем добавляют 0,25 мл (2,70 ммоля) 3,4- дигидро-2H-пирана и продолжают перемешивать в течение 1 ч. После этого с помощью ротационного испарителя удаляют растворитель и хроматографируют на силикагале (размер зерен 0,040-0,063 мм) с помощью этилацетата/н-гексана 9:16 в качестве элюента.
Выход: 700 мг (93%) бесцветного масла, смесь диастереомеров (1:1)
ИК (пленка): 3031, 1782, 1749, 1257, 1134, 967 см-1
MC: (M+NH4)+ 511,6
Бензгидриловый эфир (E)-(2S,3S,5R)-3-метил-4,4,7-триоксо-3-[3- [(R)- и (S)-тетрагидропиран-2-илокси] -пропенил] -4-тиа-1- азабицикло[3.2.0]гептан-2-карбоновой кислоты
Аналогично примеру 8 окисляют 585 мг (1,18 ммолей) бензгидрилового эфира (E)- (2S, 3S,5R)-3-метил-7-оксо-3-[3-[(R)- и (S)-тетрагидропиран-2- илокси] -пропенил] -4-тиа-1-азабицикло[3.2.0]гептан-2-карбоновой кислоты. Затем проводят хроматографию на силикагеле (размер зерен 0,040-0,063 мм) с помощью этилацетата/н-гексана 9:16 в качестве элюента.
Выход: 525 мг (84%) бесцветного пенистого вещества, смесь диастереомеров (1:1).
ИК (KBr): 1800, 1756, 1327, 1189, 1141, 969 см-1
MC: (M+NH4)+ 543,5
Пример 21
а) Бензгидриловый эфир (E)- (2S,3S,5R)-3-[3-(2-хлорацетиламинокарбонилокси)-пропенил] -3- метил-7-оксо-4-тиа-1-азабицикло[3.2.0] гептан-2-карбоновой кислоты
300 мг (0,73 ммоля) бензгидрилового эфира (E)-(2S,3S,5R)-3- (3-гидроксипропенил)-3-метил-7-оксо-4-тиа-1- азабицикло[3.2.0] гептан-2-карбоновой кислоты растворяют в атмосфере аргона в 10 мл тетрагидрофурана и обрабатывают 90 мкл (1,05 ммоля) хлорацетилизоцианата. Затем продолжают перемешивать в течение 3 ч, концентрируют методом ротации и хроматографируют на силикагеле (размер зерен 0,040-0,063 мм) с помощью этилацетата/ н-гексана 9:16 в качестве элюента.
Выход: 300 мг (77%) бесцветного пенистого вещества
ИК (KBr): 3300 (шир.), 1779, 1753, 1730, 1495, 1203 см-1
MC: (M+NH4)+ 546,4
б) Бензгидриловый эфир (E)-(2S,3S,5R)- 3-[3-(2-хлорацетиламинокарбонилокси)-пропенил] -3-метил-4,4,7- триоксо-4-тиа-1-азабицикло[3.2.0]гептан-2-карбоновой кислоты
Аналогично примеру 8 окисляют 295 мг (0,57 ммоля) бензгидрилового эфира (Е)-(2S,3S,5R)-3-[3-(2-хлорацетиламинокарбонилокси)- пропенил]-3-метил-7-оксо-4-тиа-1-азабицикло[3.2.0] гептан-2- карбоновой кислоты. Затем хроматографируют на силикагеле (размер зерен 0,040-0,063 мм) с помощью этилацетата/н-гексана 9:16 в качестве элюента.
Выход: 216 мг (68%) бесцветного пенистого вещества
ИК (KBr): 3413 (шир.), 1798, 1758, 1730, 1705, 1326, 1198, 991 см-1
MC: (M+NH4)+ 578,4
в) Натриевая соль (E)- (2S,3S,5R)-3-[3-(2-хлорацетиламинокарбонилокси)-пропенил] -3- метил-4,4,7-триоксо-4-тиа-1-азабицикло [3.2.0] гептан-2-карбоновой кислоты
195 мг (0,35 ммоля) бензгидрилового эфира (E)-(2S,3S,5R)- 3-[3-(2-хлорацетиламинокарбонилокси)-пропенил] -3-метил- 4,4,7-триоксо-4-тиа-1-азабицикло[3.2.0] гептан-2-карбоновой кислоты обрабатывают аналогично примеру 8 и переводят в соответствующую натриевую соль.
Выход: 60 мг (49%) бесцветного лиофилизата
MC: (M-COCH2Cl-Na)- 317,3
ИК (KBr): 3435, 1781, 1721, 1622, 1533, 1396, 1314, 1192, 1139 см-1
1H-ЯМР (250 МГц, D2O): δ [част./млн] = 1,61 (s, 3H), 3,42 (dd, 1H, J=16 Гц, 1,6 Гц, 6-H), 3,69 (dd, 1H, J=16 Гц, 6-H), 4,43 (s, 2H, CH2Cl), 4,49 (s, 1H, 2-H), 4,84 (d, 2H, J=4,4 Гц, CH2O), 5,08 (dd, J=l,6 Гц, 4,0 Гц, 5-H), 6,08 (d(шир.), 1H, J=16 Гц, =CH), 6,22 (dt, 1H, J=16 Гц, 4,4 Гц, =CH).
Пример 22
Бензгидриловый эфир (Е)-(2S,3S,5R)-3-(карбамоилоксипропенил)-3- метил-4,4,7- триоксо-4-тиа-1-азабицикло[3.2.0]гептан-2-карбоновой кислоты
450 мг (0,80 ммоля) бензгидрилового эфира (E)-(2S,3S,5R)-3-[3-(2- хлорацетиламинокарбонилокси)-пропенил] -3-метил-4,4,7- триоксо-4-тиа-1-азабицикло[3.2.0]гептан-2-карбоновой кислоты растворяют в атмосфере аргона в 5 мл тетрагидрофурана и обрабатывают 1,7 мл метанола. В этот раствор добавляют 135 мг (1,61 ммоля) гидрокарбоната натрия в 2,8 мл воды. После завершения реакции (контроль посредством тонкослойной хроматографии) смесь растворителей удаляют с помощью ротационного испарителя, оставшееся желтое масло растворяют в 15 мл этилацетата и 15 мл насыщенного раствора хлорида натрия, экстрагируют путем встряхивания и разделяют фазы. Водную фазу экстрагируют еще дважды соответственно 15 мл этилацетата и соединенные органические экстракты один раз промывают 15 мл насыщенного раствора хлорида натрия. Затем сушат над сульфатом магния, концентрируют с помощью ротационного испарителя и оставшееся масло хроматографируют на силикагеле (размер зерен 0,040-0,063 мм) с помощью этилацетата/н-гексана 2:1 в качестве элюента.
Выход: 200 мг (78%) бесцветного пенистого вещества
ИК (KBr): 3481, 1799, 1749, 1731, 1601, 1329, 1191, 996 см-1
MC: (M+NH4)+ 484
в) Натриевая соль (E)-(2S, 3S,5R)-3- (карбамоилоксипропенил)-3-метил- 4,4,7-триоксо-4-тиа-1-азабицикло [3.2.0] гептан-2-карбоновой кислоты
190 мг (0,60 ммоля) бензгидрилового эфира (Е)-(2S,3S,5R)-3-(карбамоилоксипропенил)-3- метил-4,4,7-триоксо-4-тиа-1-азабицикло[3.2.0] гептан-2- карбоновой кислоты получают аналогично примеру 8.
Выход: 82 мг (62%) бесцветного лиофилизата
1H-ЯМР (250 МГц, D2O): δ [част./млн] = 1,61 (s, 3H), 3,42 (dd, 1H, J=16 Гц, 1,6 Гц, 6-H), 3,69 (dd, 1H, J=17 Гц, 4 Гц, 6-H), 4,48 (s, 1H, 2-H), 4,70 (d, 2H, J=4,6 Гц, CH2), 5,08 (dd, 1H, J=4 Гц, 1,6 Гц, 5-H), 5,97 (d, 1H, J= 16 Гц, =CH), 6,19 (dt, 1H, J=16 Гц, 4,6 Гц, =CH).
Пример 23
а) Трифторметансульфонат (2S,3S,5R)-1- [3-(2- бензгидрилоксикарбонил-3-метил-7-оксо-4-тиа-1-азабицикло [3.2.0] гептан-3-ил)-аллил]-пиридиния
410 мг (1,0 ммоль) бензгидрилового эфира (E)-(2S,3S,5R)-3-(3-гидрокси-пропенил)-3-метил-7-оксо-4-тиа- 1-азабицикло[3.2.0] гептан-2-карбоновой кислоты растворяют в 6 мл метиленхлорида, охлаждают до -40oC и обрабатывают 250 мкл (1,5 ммоля) ангидрида трифторметансульфокислоты. Через 5 мин добавляют 200 мкл (2,50 ммоля) пиридина, перемешивают еще в течение 1 ч при той же температуре и затем удаляют охлаждающую баню. При комнатной температуре с помощью ротационного испарителя удаляют растворитель, реакционную смесь растворяют в 20 мл метиленхлорида и дважды промывают соответственно порциями по 10 мл насыщенного раствора хлорида натрия. После этого сушат над сульфатом магния, фильтруют и концентрируют с помощью ротационного испарителя. Оставшуюся смолу красного цвета без последующей очистки окисляют.
Выход: 600 мг (97%) красной смолы
МС: (М+) 471,6
ИК (KBr): 1777, 1743, 1630, 1160, 987 см-1
б) Трифторметансульфонат (2S,3S,5R)-1- [3-(2-бензгидрилоксикарбонил-3-метил-4,4,7-триоксо-4-тиа-1- азабицикло [3.2.0] гептан-3-ил)-аллил] -пиридиния
Аналогично примеру 8 окисляют 600 мг (0,97 ммоля) трифторметансульфоната (2S, 3S, 5R)-1-[3-(2-бензгидрилоксикарбонил-3-метил-7-оксо-4-тиа-l- азабицикло[3.2.0]гептан-3-ил)-аллил]-пиридиния.
Выход: 440 мг (70%) зеленой смолы
МС: (М+) 503,3
ИК (KBr): 1797, 1753, 1632, 1167 см-1
(E)-(2S, 3S, 5R)-3-метил-4,4,7-триоксо-3-(3-пиридин-1- илиопропенил)-4-тиа-1-азабицикло[3.2.0]гептан-2-карбоксилат
Раствор 440 мг (0,67 ммоля) трифторметансульфоната (2S,3S,5R)-1- [3-(2-бензгидрилоксикарбонил-3-метил-4,4,7-триоксо-4-тиа-1-азабицикло[3.2.0] гептан-3-ил)-аллил]-пиридиния перемешивают в 3 мл м- крезола в течение 1,5 ч при 50oC. Затем разбавляют при комнатной температуре 10 мл изобутилметилкетона и трижды экстрагируют соответственно 8 мл воды. Соединенные водные экстракты еще дважды промывают соответственно 10 мл изобутилметилкетона, фильтруют через бумажный фильтр и лиофилизуют. Затем коричневый лиофилизат хроматографируют через полимерный гидрофобный гель с помощью воды в качестве элюента.
Выход: 125 мг (55%) лиофилизата бежевого цвета
ИК (KBr): 1780, 1625, 1485, 1372, 1312, 980 см-1
MC: M+H+ 337,4
Пример 24
5-Метил-2-оксо-[1,3]диоксол-4-илметиловый эфир(Z)- (2S,3S,5R)-3-(2-цианоэтенил)-3-метил-4,4,7-триоксо-4-тиа-1- азабицикло[3.2.0]гептан-2-карбоновой кислоты.
(Z)-(2S, 3S, 5R)-3-(2- цианоэтенил)-3-метил-4,4,7-триоксо-4-тиа-1- азабицикло[3.2.0]гептан-2-карбоновую кислоту (1,0 г, 3,70 ммол) растворяют в 10 мл N,N-диметилформамида и по каплям прибавляют 0,47 мл (3,70 ммол) 1,1,3,3-тетраметилгуанидина. Через 30 мин раствор охлаждают до 2oC с помощью бани со льдом и к этому раствору прибавляют 1,07 г (5,55 ммол) 4-бромметил-5-метил-[1,3]- диоксол-2-она. Раствор перемешивают до завершения реакции (ТСХ). Реакционную смесь выливают в смесь этилацетат/вода (1:1 об/об) и экстрагируют. Водную фазу вновь экстрагируют этилацетатом и объединенные органические экстракты промывают водой и рассолом и сушат над MgSO4. Полученное масло подвергают мгновенной хроматографии на силикагеле (Мерк, 0,040-0,063 мм) этилацетат/ н-гексаном (1:1 об./об.) и фракцию, содержащую целевой продукт, отбирают и упаривают. Полученное масло кристаллизуют из н-гексана и высушивают в вакууме.
Выход: 579 мг (41,1%), твердое бесцветное вещество
MC (ISP): 400,3 (M+NH4 +)
ИК (KBr): 1794, 1759 см-1
Элементный анализ: C15H14N2O8S (382,35):
Вычислено*: C 47,37; H 3,87; N 7,08; S 8,11.
Hайдено: C 47,12; H 3,81; N 6,95; S 7,96.
*) Рассчитано на 1 моль C15H14N2O8S 0,29% воды и 0,1486 мол C4H8O2 (этилацетат).
По аналогии с примером 24 получены следующие производные:
Пример 25
2,2-Диметилпропионилоксиметиловый эфир (Z)-(2S, 3S, 5R)-3-(2-цианоэтенил)-3-метил-4,4,7-триоксо-4- тиа-1-азабицикло[3.2.0] гептан-2-карбоновой кислоты.
Из 1,0 г (3,70 ммол) (Z)-(2S,3S,5R)-3-(2-цианоэтенил)-3-метил-4,4,7- триоксо-4-тиа-1-азабицикло[3.2.0] гептан-2-карбоновой кислоты, 0,47 мл (3,70 ммол) 1,1,3,3-тетраметилгуанидина и 1,34 г (5,54 ммол) иодметилпивалоата в 10 мл N,N-диметилформамида.
Элюент для мгновенной хроматографии - дихлорметан
Выход: 347 мг (24,4%), твердое бесцветное вещество
MC (ISP): 402,4 (M+NH4 +)
ИК (KBr): 1796, 1777, 1751 см-1
Элементный анализ: C16H20N2O7S (384,408)
Вычислено: C 49,99; H 5,24; N 7,29; S 8,34.
Hайдено: C 49,99; H 5,18; N 7,28; S 8,28.
Пример 26
Смесь (R)- и (S)-1-(2,2-диметилпропионилокси)этиловых эфиров (Z)-(2S,3S, 5R)-3-(2-цианоэтенил)-3-метил-4,4,7-триоксо-4- тиа-1-азабицикло [3.2.0] гептан-2-карбоновой кислоты.
Из 0,40 г (1,48 ммол) (Z)-(2S,3S,5R)-2-(2-цианоэтенил)-3-мeтил-4,4,7- триоксо-4-тиа-1-азабицикло [3.2.0] гептан-2-карбоновой кислоты, 0,19 мл (1,48 ммол) 1,1,3,3-тетраметилгуанидина и 0,37 г (1,77 ммол) (RS)-1-бромэтилового эфира 2,2-диметилпропионовой кислоты в 4 мл N,N-диметилформамида. Элюент для мгновенной хроматографии этилацетат/н-гексан (2:3 об./об.).
Выход: 322 мг (54,7%), палево-желтый порошок
МС (ISP): 416,1 (M+NH4 +)
ИК (KBr): 1804, 1773, 1744 см-1
Элементный анализ: C17H22N2O7S (398,435)
Вычислено*: C 51,70; H 5,72; N 6,93; S 7,93.
Найдено: C 51,70; H 5,72; N 6,80; S 7,98.
*) Рассчитано на 1 моль C17H22N2O7S и 0,0656 моль C6H14 (н-гексан).
Пример 27
Смесь (R)- и (S)-1-ацетоксиэтиловых эфиров (Z)- (2S,3S,5R)-3-(2-цианоэтенил)-3-метил-4,4,7-триоксо-4-тиа-1-азабицикло [3.2.0] гептан-2-карбоновой кислоты.
Из 0,40 г (1,48 ммол) (Z)-(2S,3S,5R)-3-(2-цианоэтенила)-3-метил-4,4,7-триоксо-4- тиа-1-азабицикло [3.2.0] гептан-2-карбоновой кислоты, 0,19 мл (1,48 ммол) 1,1,3,3-тетраметилгуанидина и 0,30 г (1,78 ммол) (RS)-1-бромэтилового эфира уксусной кислоты в 4 мл N,N-диметилформамида.
Элюент для мгновенной хроматографии этилацетат/н-гексан (1:1 об./об.).
Выход: 236 мг (44,8%), желтый порошок
МС (ISP): 374,1 (M+NH4 +)
ИК (KBr): 1804, 1770 см-1
Элементный анализ: C14H16N2O7S (356,349)
Вычислено*: C 47,41; H 4,67; N 7,62; S 8,72.
Hайдено: C 47,16; H 4,62; N 7,44; S 8,64.
*) Рассчитано на 1 моль C14H16N2O7S и 0,1276 моль C4H8O2 (этилацетат).
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ ЦЕФАЛОСПОРИНА И ФАРМАЦЕВТИЧЕСКИЙ ПРЕПАРАТ | 1994 |
|
RU2130939C1 |
| β-ЛАКТАМЫ | 1995 |
|
RU2143435C1 |
| ПРОИЗВОДНЫЕ ЦИКЛОГЕКСАНА ИЛИ ТЕТРАГИДРОПИРАНА, ИЛИ ИХ ФАРМАЦЕВТИЧЕСКИ ПРИЕМЛЕМЫЕ СОЛИ, ИЛИ ГИДРАТЫ, ИЛИ СОЛЬВАТЫ ЭТИХ СОЕДИНЕНИЙ, ИЛИ ИХ СОЛЕЙ, ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ ДЛЯ ИХ ПОЛУЧЕНИЯ И ФУНГИЦИДНОЕ СРЕДСТВО | 1992 |
|
RU2084439C1 |
| Способ получения производных цефалоспорина, заместитель которых имеет в положении 3 азотсодержащий гетероцикл, или их фармацевтически совместимых солей с щелочными металлами | 1989 |
|
SU1787159A3 |
| ФАРМАЦЕВТИЧЕСКИЙ ПРЕПАРАТ | 1994 |
|
RU2146522C1 |
| ТРИЦИКЛИЧЕСКИЕ ПРОИЗВОДНЫЕ ПИРАЗОЛА | 1995 |
|
RU2152388C1 |
| КОНДЕНСИРОВАННОЕ ЗАМЕЩЕННОЕ ПРОИЗВОДНОЕ АМИНОПИРРОЛИДИНА | 2007 |
|
RU2443698C2 |
| ПРОИЗВОДНЫЕ 2-ПИПЕРИДОНА В КАЧЕСТВЕ АГОНИСТОВ ПРОСТАГЛАНДИНА | 2004 |
|
RU2311409C2 |
| КОМБИНИРОВАННОЕ ЛЕЧЕНИЕ АГОНИСТОМ ТОЛЛ-ПОДОБНОГО РЕЦЕПТОРА (TLR7) И ИНГИБИТОРОМ СБОРКИ КАПСИДА ВИРУСА ГЕПАТИТА В | 2016 |
|
RU2718917C2 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 1-АЦИЛ-4-ФЕНИЛСУЛЬФОНИЛПРОЛИНАМИДА И НОВЫЕ ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ | 2012 |
|
RU2615997C2 |
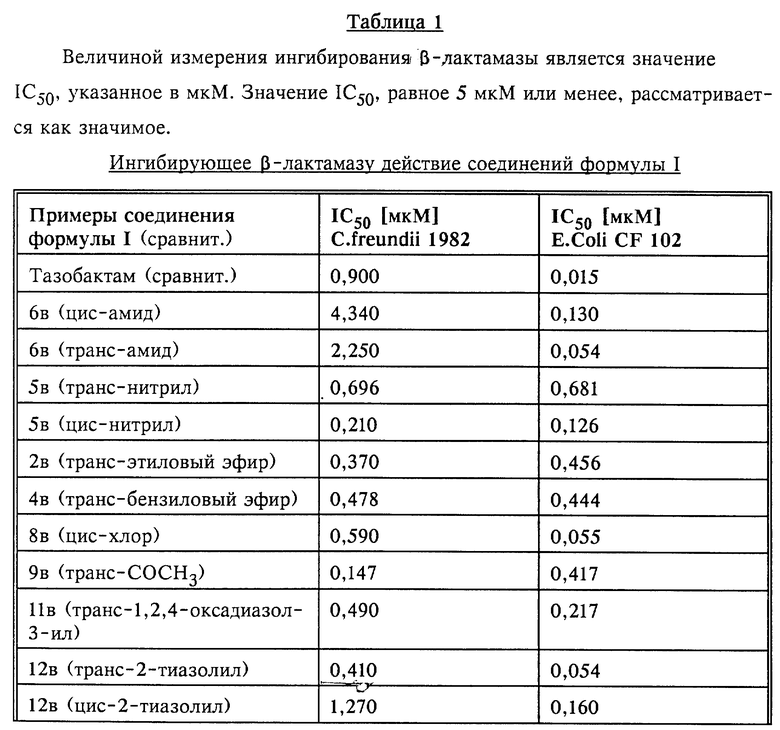
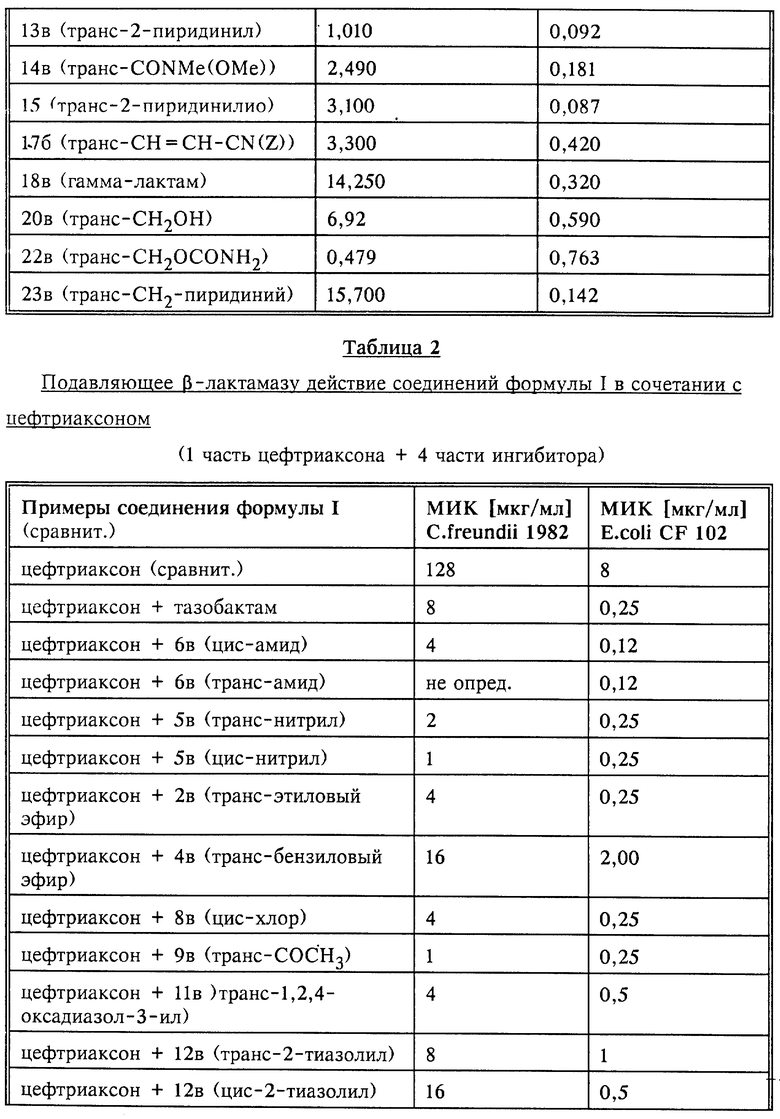
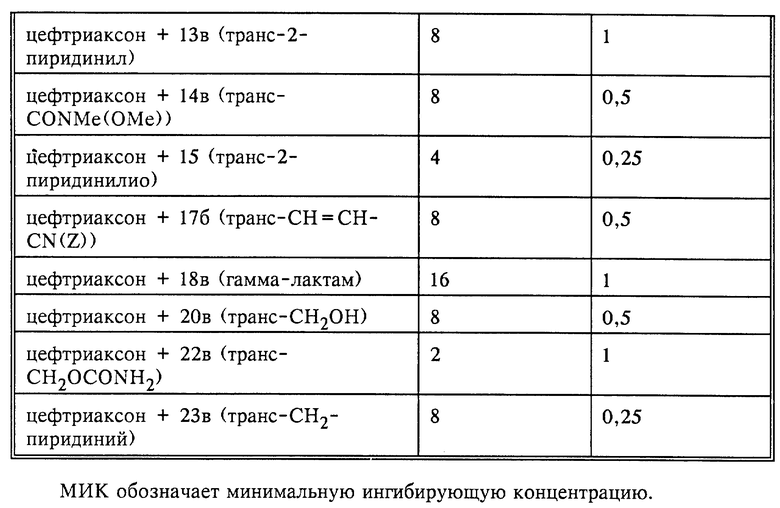
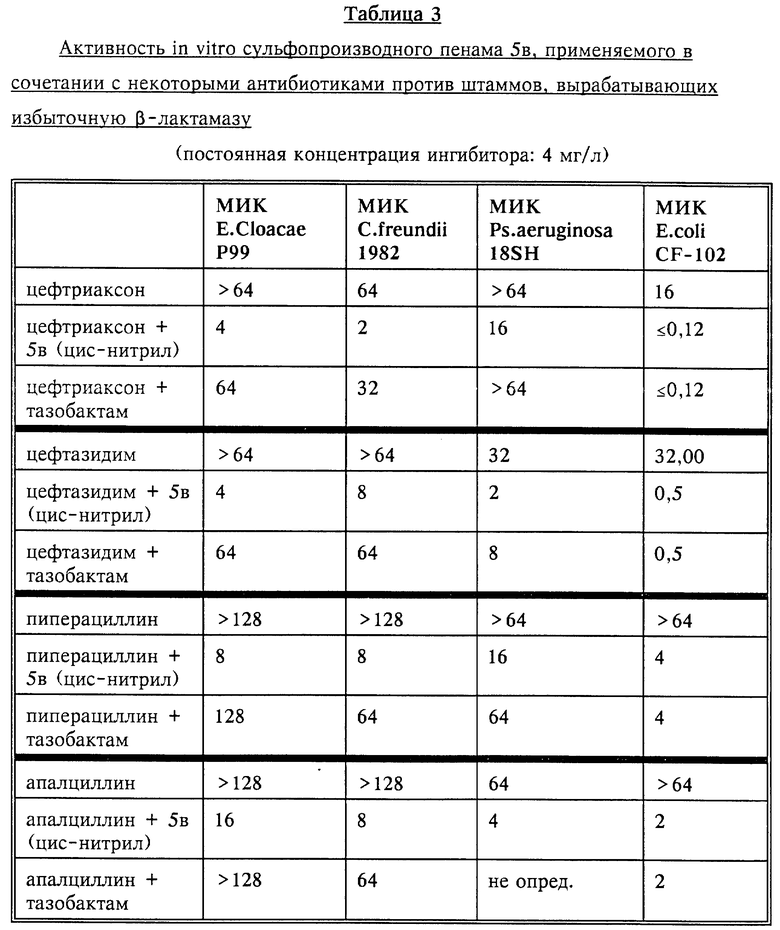
Изобретение относится к новым производным 3β-алкенилпенама общей формулы I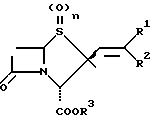
где один из R1 и R2 обозначает -СОR4, -СN , -СН2R5, галоген, -СН = СНR6 либо Q, а другой - водород и либо низший алкил или оба вместе обозначают γ-лактамовое кольцо; R3 - водород, низший алкил, арилалкил, аллил либо отщепляемый in vivo радикал; R4 - водород, низший алкил, низший алкокси, бензилокси, амино, низший алкиламино либо низший алкил-низший алкоксиамино, R5 - гидроксильная группа, -ОСОNНR7, -ОСОNН2 или пяти- либо шестизвенное, содержащее N, S и/или O гетероароматическое, связанное через атом азота кольцо; R6- -СN либо -СНО; R7 - -СОСН2 Сl; Q - пяти- либо шестизвенное, содержащее N, S и/или O гетероароматическое кольцо, и n = 0, 1 либо 2, а также к фармацевтически совместимым солям этих соединений. Эти соединения обладают подавляющим β-лактамазу действием. При определенных условиях они могут применяться вместе с β-лактамовым антибиотиком для профилактики и борьбы с образующими β-лактамазу возбудителями болезней. 14 з.п.ф-лы, 3 табл.
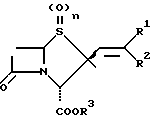
где один из R1 и R2 обозначает -СOR4, -CN, -CH2R5, галоген, -CH=CHR6 либо Q, а другой - водород либо низший алкил или оба вместе обозначают γ-лактамовое кольцо;
R3 - водород, низший алкил, арилалкил, аллил, либо отщепляемый in vivo радикал;
R4 - водород, низший алкил, низший алкокси, бензилокси, амино, низший алкиламино либо низш.алкилнизш. алкоксиамино;
R5 гидроксильная группа, -OCONHR7, -OCONH2 или пяти- либо шестизвенное, содержащее N, S и/или О гетероароматическое связанное атомом азота кольцо;
R6 - CN либо -CHO;
R7 - COCH2Cl;
Q - пяти- либо шестизвенное содержащее N, S и/или O гетероароматическое кольцо;
n = 0, 1 либо 2,
а также фармацевтически совместимые соли этих соединений.
бензгидриловый эфир (E/Z)-(2S, 3S, 5R)-3-(2-карбамоилвинил)-3-метил-7-оксо-4-тиа-1-азабицикло[3.2.0]гептан-2-карбоновой кислоты;
бензгидриловый эфир (Е)-(2S, 3S, 5R)-3-(2-карбамоилвинил)-3-метил-4,4,7-триоксо-4-тиа-1-азацицикло[3.2.0]гептан-2-карбоновой кислоты;
бензгидриловый эфир (Z )-(2S, 3S, 5R)-3-(2-карбамоилвинил)-3-метил-4,4,7-триоксо-4-тиа-1-азабицикло[3.2.0]гептан-2-карбоновой кислоты;
натриевую соль (Е)-(2S, 3S, 5R)-3-(2-карбамоилвинил)-3-метил-4,4,7-триоксо-4-тиа-1-азабицикло[3.2.0]гептан-2-карбоновой кислоты;
натриевую соль (Z )-(2S, 3S, 5R)-3-(2-карбамоилвинил)-3-метил-4,4,7-триоксо-4-тиа-1-азабицикло[3.2.0.]гептан-2-карбоновой кислоты;
бензгидриловый эфир (Е)-(2S, 3S, 5R)-3-(2-этоксикарбонилвинил)--3-метил-7-оксо-4-тиа-1-азабицикло[3.2.0]гептан-2-карбоновой кислоты;
бензгидриловый эфир (Е)-(2S, 3S, 5R)-3-(2-этоксикарбонилвинил)-3-метил-4,4,7-триоксо-4-тиа-1-азабицикло[3.2.0]гептан-2-карбоновой кислоты;
натриевую соль (Е)-(2S, 3S, 5R)-3-(2-этоксикарбонилвинил)-3-метил-4,4,7-триоксо-4-тиа-1-азабицикло[3.2.0]гептан-2-карбоновой кислоты;
бензгидриловый эфир (Е)-(2S, 3S, 5R)-3-(2-бензилоксикарбонилвинил)-3-метил-7-оксо-4-тиа-1-азабицикло[3.2.0]гептан-2-карбоновой кислоты;
бензгидриловый эфир (Е)-(2S, 3S, 5R)-3-(2-бензилоксикарбонилвинил)-3-метил-4,4,7-триоксо-4-тиа-1-азабицикло[3.2.0]гептан-2-карбоновой кислоты;
натриевую соль (Е)-(2S, 3S, 5R)-3-(2-бензилоксикарбонилвинил)-3-метил-4,4,7-триоксо-4-тиа-1-азабицикло[3.2.0]гептан-2-карбоновой кислоты.
Приоритет по пунктам и признакам:
24.08.93 по п.1: Производные 3β-алкенилпенама формулы I, где один из R1 и R2 обозначает -COR4, -CH2R5, а другой - водород либо низший алкил; R3 - водород, низший алкил, арилалкил, аллил, либо отщепляемый in vivo радикал; R4 - водород, низший алкил, низший алкокси, бензилокси, амино, низший алкиламино; R5 обозначает гидрокси или -OCONH2; n = 0, 1 или 2; пп.2-10, 12-15. - по п.1:
31.05.94 Производные 3β-алкенилпенама формулы I, где один из R1 и R2 обозначает галоген, -CH=CHR6 либо Q или оба вместе обозначают γ- лактамовое кольцо; R4 - низш. алкилнизш. алкоксиамино; R5 - -OCONHR7 или пяти- либо шестизвенное, содержащее N, S и/или O гетероароматическое связанное атомом азота кольцо; R6 - -CN либо -CHO; R7 - -COCH2Cl; Q - пяти- либо шестизвенное содержащее N, S и/или O гетероароматическое кольцо; п.11.
| Способ получения азотнокислого эфира N-/2-оксиэтил/ никотинамида или его солей | 1978 |
|
SU942593A3 |
| СТАНОК ДЛЯ ПРАВКИ ИЗДЕЛИЙ, ИМЕЮЩИХ ФОРМУ ТЕЛВРАЩЕНИЯ | 0 |
|
SU272016A1 |
| 0 |
|
SU236074A1 |
Авторы
Даты
1999-10-10—Публикация
1994-08-23—Подача