Область техники, к которой относится изобретение
Настоящее изобретение относится к способу получения химического продукта путем использования культуры микроорганизмов или культуры клеток. Конкретнее, настоящее изобретение относится к способу получения химического продукта и аппарату для ферментации, в котором при проведении культивирования, жидкость, содержащая продукт ферментации (химический продукт), полученный культивированием, эффективно фильтруется из культуральной жидкости, содержащей микроорганизмы или культуральные клетки, через сепарационную мембрану для сбора продукта ферментации с тем, чтобы желательный химический продукт мог быть получен с высокой эффективностью.
Предшествующий уровень техники
Способ получения материала, относящийся к культуре микроорганизмов или культуре клеток, главным образом классифицируется на (1) способ периодического культивирования и способ культивирования с подпиткой, а также (2) способ непрерывной ферментации.
Указанный выше способ периодического культивирования и способ культивирования с подпиткой (1) имеют преимущества, при которых культивирование может быть осуществлено с использованием всего лишь простого оборудования и за короткий период времени, и без существенного ущерба, вызываемого бактериальным загрязнением. По этой причине, указанные способы обычно применялись в качестве способа получения веществ с использованием микроорганизмов или культуральных клеток. Однако в этих способах, поскольку концентрация продукта ферментации в культуральной жидкости с течением времени становится выше, то продуктивность и выход снижаются, например, увеличением осмотического давления или ингибированием ферментации вследствие самого продукта. По этим причинам, данные способы культивирования затрудняют поддержание продуктивности и выхода продукта ферментации на высоком уровне стабильности в течение длительного времени.
С другой стороны, способ непрерывной ферментации указанного выше способа (2) отличается тем, что путем исключения накопления в высокой концентрации продукта ферментации в ферментационном сборнике, продуктивность и выход могут поддерживаться на высоком уровне в течение длительного периода времени.
Например, способ непрерывной ферментации был описан в отношении ферментации L-глутаминовой кислоты (см. патентный документ 1) и L-лизина (см. непатентный документ 1). Однако, хотя в этих примерах материалы, такие как питательные вещества, непрерывно подаются в культуральную жидкость, также всасывается культуральная жидкость, содержащая микроорганизмы или культуральные клетки, что приводит к тому, что микроорганизмы или культуральные клетки в культуральной жидкости разбавляются; поэтому улучшение его продуктивности ограничено.
По этой причине, в качестве способа непрерывной ферментации, был предложен способ, в котором микроорганизмы или культуральные клетки фильтруются через сепарационную мембрану, и, хотя продукт ферментации собирается из полученной фильтрацией жидкости, фильтруемые микроорганизмы или культуральные клетки удерживаются в ферментационном резервуаре или стекают обратно в него для поддержания концентрации микроорганизмов или клеток в культуральной жидкости на высоком уровне.
Например, была предложена методика, при которой непрерывная ферментация проводится с использованием аппарата для непрерывной ферментации с сепарационной мембраной (см. патентный документ 2). В этом предложении используется аппарат непрерывной ферментации, обеспеченный резервуаром для культивирования микроорганизмов или культуральных клеток в культуральной жидкости с тем, чтобы различные химические продукты могли быть получены с более высокой скоростью продукции, по сравнению со способом периодического культивирования и со способом культивирования с подпиткой.
Считается, что в аппарате для непрерывной ферментации с использованием мембранной сепарации, повышение скорости потока культуральной жидкости внутри резервуара мембранной сепарации, ведет к меньшему засорению мембраны; в результате этого, может быть увеличена скорость продукции вследствие увеличения количества жидкости, фильтруемой через сепарационную мембрану.
Однако в патентном документе 2, поскольку не может осуществляться раздельное регулирование количества жидкости, переносимой из ферментационного резервуара, и количественного потока в резервуар мембранной сепарации, количество текущей культуральной жидкости, подаваемой в резервуар мембранной сепарации, зависит от количества культуральной жидкости, текущей из ферментационного резервуара. Поэтому, при попытке изменения скорости потока культуральной жидкости внутри резервуара мембранной сепарации, требуется изменение количества жидкости, переносимой из ферментационного резервуара, что приводит к изменению состояния смешивания жидкости внутри ферментационного резервуара для вызова серьезных изменений условий культивирования. Кроме того, в случае, когда давление внутри резервуара мембранной сепарации повышалось вследствие засорения мембраны или увеличения концентрации микроорганизмов или культуральных клеток с течением времени и тому подобных причин, предпочтительно снижение количества текущей культуральной жидкости, подаваемой в резервуар мембранной сепарации для оптимизации самой мембранной сепарации. Однако, когда изменяется количество текущей культуральной жидкости, подаваемой в резервуар мембранной сепарации, в значительной степени изменяются условия культивирования в ферментационном резервуаре. По этой причине, нельзя легко изменить количество текущей культуральной жидкости, подаваемой в резервуар мембранной сепарации. Кроме того, в случае, когда количество культуральной жидкости, переносимое из ферментационного резервуара, снижено для оптимальной регуляции давления внутри резервуара мембранной сепарации, то скорость потока культуральной жидкости внутри трубопровода переноса жидкости снижается, и микроорганизмы или культуральные клетки осаждаются внутри трубопровода переноса жидкости, и возникает проблема снижения производительности. Напротив, когда давление внутри резервуара мембранной сепарации слишком высокое, то микроорганизмы в культуральной жидкости, переносимой наружу из резервуара мембранной сепарации, могут быть повреждены вследствие колебания давления.
Документы предшествующего уровня техники
Патентные документы
Патентный документ 1: JP-A No. 10-150996
Патентный документ 2: Международная Публикация № 07/097260
Описание
Непатентные документы
Непатентный документ 1: Toshihiko Hirao et al., Appl. Microbiol. Biotechnol. 32, 269-273 (1989)
Краткое описание сущности изобретения
Проблемы, решаемые изобретением
В связи с указанными выше обстоятельствами целью настоящего изобретения является предоставление способа получения химического продукта, который может регулировать скорость потока культуральной жидкости внутри резервуара мембранной сепарации без влияния на условия культивирования в ферментационном резервуаре, а также подавлять осаждение микроорганизмов или культуральных клеток с тем, чтобы повысить продуктивность химического продукта, а также предоставление аппарата для ферментации, с помощью которого желательно применение такого способа.
Средства для решения проблем
Авторы настоящего изобретения провели обширные исследования на аппарате для непрерывной ферментации с использованием мембранной сепарации для повышения скорости продукции и стабилизации ферментационной культуры, и в результате этого обнаружили, что путем применения следующих конструкций с (1) по (14), возможно требуемое поддержание условий культивирования (времени удерживания культуральной жидкости и т.д.) при регулировании скорости потока культуральной жидкости внутри резервуара мембранной сепарации и, следовательно, для эффективного получения химического продукта, и было создано настоящее изобретение.
(1) Способ получения химического продукта, включающий стадии: культивирования микроорганизмов или культуры клеток в ферментационном резервуаре; переноса культуральной жидкости из ферментационного резервуара в резервуар мембранной сепарации с тем, чтобы профильтровать культуральную жидкость через сепарационную мембрану; и сбора продукта ферментации из полученной фильтрацией жидкости в виде химического продукта при обратном стоке не фильтрованной культуральной жидкости с тем, чтобы объединиться с культуральной жидкостью на находящейся выше по потоку стороне резервуара мембранной сепарации, где одна часть культуральной жидкости, приносимая из ферментационного резервуара, направляется в обход резервуара мембранной сепарации, в зависимости от давления на стороне притока культуральной жидкости в резервуар мембранной сепарации.
(2) Способ получения химического продукта по указанному выше пункту (1), в котором количество культуральной жидкости, текущей в обход резервуара мембранной сепарации, регулируется установкой датчика давления на стороне притока культуральной жидкости резервуара мембранной сепарации на 1 МПа (10,19716 кгс/см2) или менее.
(3) Способ получения химического продукта по указанным выше пунктам (1) или (2), в котором одна часть не фильтрованной культуральной жидкости стекает обратно для объединения с культуральной жидкостью в ферментационном резервуаре, тогда как остальная часть не фильтрованной культуральной жидкости стекает обратно для объединения с культуральной жидкостью, находящейся между ферментационным резервуаром и резервуаром мембранной сепарации.
(4) Способ получения химического продукта по указанному выше пункту (3), в котором каждое из количества фильтрованной культуральной жидкости, стекающей обратно для объединения с культуральной жидкостью, находящейся между ферментационным резервуаром и резервуаром мембранной сепарации, и количества текущей не фильтрованной культуральной жидкости, стекающей обратно для объединения с культуральной жидкостью в ферментационном резервуаре, регулируется независимо.
(5) Способ получения химического продукта по указанным выше пунктам (3) или (4), в котором устанавливается отношение количества текущей не фильтрованной культуральной жидкости, стекающей обратно для объединения с культуральной жидкостью в ферментационном резервуаре, к количеству текущей не фильтрованной культуральной жидкости, стекающей обратно для объединения с культуральной жидкостью, находящейся между ферментационным резервуаром и резервуаром мембранной сепарации, равное 1 или менее.
(6) Способ получения химического продукта по любому из указанных выше пунктов с (1) по (5), в котором устанавливается каждая из величин линейной скорости культуральной жидкости, переносимой из ферментационного резервуара в резервуар мембранной сепарации, линейной скорости не фильтрованной культуральной жидкости, которая обратно стекает из резервуара мембранной сепарации для объединения с культуральной жидкостью на находящейся выше по потоку стороне резервуара мембранной сепарации, и линейной скорости культуральной жидкости, которая направляется в обход резервуара мембранной сепарации, равная 2,5 см/сек или более.
(7) Способ получения химического продукта по любому из указанных выше пунктов с (1) по (6), в котором количество культуральной жидкости, текущей в резервуар мембранной сепарации, и/или количество полученной фильтрацией жидкости, текущей из резервуара мембранной сепарации, регулируются так, чтобы процентная доля извлечения количества полученной фильтрацией жидкости из резервуара мембранной сепарации от количества культуральной жидкости, текущей в резервуар мембранной сепарации, была установлена на 10,0% или менее.
(8) Способ получения химического продукта по любому из указанных выше пунктов с (1) по (7), в котором отношение объема культуральной жидкости в ферментационном резервуаре к объему культуральной жидкости в резервуаре мембранной сепарации устанавливается в диапазоне от 4 или более до 100 или менее.
(9) Аппарат для непрерывной ферментации, включающий: ферментационный резервуар для культивирования микроорганизмов или культуры клеток; резервуар мембранной сепарации, имеющий сепарационную мембрану, используемую для сбора продукта ферментации, полученного в культуральной жидкости из ферментационного резервуара; трубопровод циркуляции, который соединяет ферментационный резервуар с резервуаром мембранной сепарации с тем, чтобы перемещать культуральную жидкость в резервуар мембранной сепарации и обеспечивать обратный сток не фильтрованной культуральной жидкости, которая не была профильтрована через сепарационную мембрану, для объединения с культуральной жидкостью на находящейся выше по потоку стороне резервуара мембранной сепарации; и средство для переноса культуральной жидкости, установленное в трубопровод циркуляции, причем данная конструкция, кроме того, включает обводной трубопровод для резервуара мембранной сепарации; средство регистрации давления на стороне притока культуральной жидкости резервуара мембранной сепарации; и средство регуляции количественного потока, установленное в обводной трубопровод.
(10) Аппарат для непрерывной ферментации по указанному выше пункту (9), в котором средство регуляции количественного потока срабатывает в ответ на результат выявления средством регистрации.
(11) Аппарат для непрерывной ферментации по указанному выше пункту (9) или (10), кроме того, включающий средство регистрации линейной скорости для трубопровода циркуляции с тем, чтобы средство регуляции количественного потока и/или средство для переноса культуральной жидкости срабатывали в ответ на результат выявления средством регистрации линейной скорости.
(12) Аппарат для непрерывной ферментации по любому из указанных выше пунктов с (9) по (11), в котором резервуар мембранной сепарации установлен в контур циркуляции, имеющий средство переноса жидкости, отличное от средства переноса культуральной жидкости, которое независимо от ферментационного резервуара.
(13) Аппарат для непрерывной ферментации по любому из указанных выше пунктов с (9) по (12), в котором трубопровод циркуляции имеет отверстие в положении, которое погружено в культуральную жидкость, содержащуюся в ферментационном резервуаре.
(14) Аппарат для непрерывной ферментации по любому из указанных выше пунктов с (9) по (13), в котором отношение объема ферментационного резервуара к объему резервуара мембранной сепарации установлено в диапазоне от 4 или более до 100 или менее.
Эффекты изобретения
В соответствии с настоящим изобретением, одна часть культуральной жидкости, переносимой из ферментационного резервуара, может направляться в обход резервуара мембранной сепарации, в зависимости от давления на стороне притока культуральной жидкости резервуара мембранной сепарации, то есть, количество текущей культуральной жидкости, подаваемой в резервуар мембранной сепарации, и количество текущей культуральной жидкости, переносимой из ферментационного резервуара, может регулироваться независимо. В результате, возможно предотвращение засорения мембраны соответствующим изменением скорости потока культуральной жидкости внутри резервуара мембранной сепарации без изменения условий культивирования, и, следовательно, повышение качества фильтрации жидкости и повышение скорости продукции. Даже если с течением времени происходит засорение мембраны или увеличивается концентрация микроорганизмов или культуральных клеток, вызывая повышение давления внутри резервуара мембранной сепарации, то возможен перенос культуральной жидкости в резервуар мембранной сепарации без вызова по существу никакого изменения условий культивирования в ферментационном резервуаре, а также возможна регуляция протекающего количества культуральной жидкости, подаваемого в резервуар мембранной сепарации, и давления, оказываемого в резервуаре мембранной сепарации при одновременном поддержании скорости потока, которая навряд ли вызывает осаждение микроорганизмов или культуральных клеток в трубопроводе циркуляции, используемом для обратного стока не отфильтрованной культуральной жидкости, которая не была отфильтрована сепарационной мембраной, и, как следствие, становится возможным предотвращение повреждений резервуара мембранной сепарации, а также предотвращение разрушений микроорганизмов и культуральных клеток в культуральной жидкости вследствие колебаний давления. Кроме того, даже после возникновения отказа внутри резервуара мембранной сепарации, можно полностью остановить подачу культуральной жидкости в резервуар мембранной сепарации и устранить неполадки внутри резервуара мембранной сепарации или заменить или переключить резервуары мембранной сепарации без прерывания ферментации.
Кроме того, в настоящем изобретении путем регулирования процентной доли извлечения фильтрованной жидкости в резервуаре мембранной сепарации до 10% или менее, причем одна часть культуральной жидкости, переносимой из ферментационного резервуара может направляться в обход резервуара мембранной сепарации, в зависимости от давления на стороне притока культуральной жидкости резервуара мембранной сепарации. Становится возможным дополнительное предотвращение засорения мембраны и продление времени непрерывной ферментации.
Как описано выше, в соответствии с настоящим изобретением, может быть одновременно улучшена продуктивность и связанный с сахаром выход продукта ферментации, полученного непрерывной ферментацией (то есть, желательного продукта) и путем дополнительного регулирования процентной доли извлечения в резервуаре мембранной сепарации до 10% или менее, время непрерывной ферментации также может продлеваться.
Краткое описание чертежей
Фиг. 1 представляет собой схематический вид, который объясняет один вариант осуществления аппарата для непрерывной ферментации в соответствии с настоящим изобретением.
Фиг. 2 представляет собой схематический вид, который объясняет другой вариант осуществления аппарата для непрерывной ферментации в соответствии с настоящим изобретением.
Фиг. 3 представляет собой схематический вид с пространственным разделением деталей, который объясняет один вариант осуществления элемента в виде сепарационной мембраны, используемой в настоящем изобретении.
Фиг. 4 представляет собой схематический вид в перспективе другого варианта осуществления элемента в виде сепарационной мембраны, используемой в настоящем изобретении.
Фиг. 5 представляет собой чертеж, который иллюстрирует физическую карту дрожжевого вектора экспрессии pTRS11, использованного в эталонном примере.
Фиг. 6 представляет собой график, который показывает линейную скорость потока культуральной жидкости внутри трубопровода циркуляции и количество бактерий, осажденных внутри трубопровода, полученные в примере 2.
Фиг. 7 представляет собой схематический вид, который объясняет еще один вариант осуществления аппарата для непрерывной ферментации в соответствии с настоящим изобретением.
Фиг. 8 представляет собой схематический вид, который объясняет еще один вариант осуществления аппарата для непрерывной ферментации в соответствии с настоящим изобретением.
Фиг. 9 представляет собой схематический вид, который объясняет тип аппарата для непрерывной ферментации, использованного в сравнительных примерах.
Фиг. 10 представляет собой чертеж, который показывает концентрацию молочной кислоты и мутность суспензии дрожжей, полученную в примере 1.
Фиг. 11 представляет собой чертеж, который показывает концентрацию молочной кислоты и мутность суспензии дрожжей, полученную в сравнительном примере 1.
Фиг. 12 представляет собой чертеж, который показывает давление культуральной жидкости на стороне притока резервуара мембранной сепарации, полученное в сравнительном примере 1.
Фиг. 13 представляет собой схематический вид, который объясняет тип аппарата для непрерывной ферментации, использованного в сравнительном примере.
Фиг. 14 представляет собой схематический вид, который объясняет еще один вариант осуществления аппарата для непрерывной ферментации в соответствии с настоящим изобретением.
Фиг. 15 представляет собой схематический вид, который объясняет тип аппарата для непрерывной ферментации, использованного в сравнительных примерах.
Фиг. 16 представляет собой схематический вид, который объясняет другой вариант осуществления аппарата для непрерывной ферментации в соответствии с настоящим изобретением.
Фиг. 17 представляет собой чертеж, который показывает переход различий трансмембранного давления, полученный в примерах 6-9.
Фиг. 18 представляет собой чертеж, который показывает концентрацию кадаверина и мутность суспензии коринеформных бактерий, полученные в примере 10.
Фиг. 19 представляет собой чертеж, который показывает концентрацию кадаверина и мутность суспензии коринеформных бактерий, полученные в сравнительном примере 5.
Фиг. 20 представляет собой чертеж, который показывает давление культуральной жидкости на стороне притока резервуара мембранной сепарации, полученное в сравнительном примере 5.
Фиг. 21 представляет собой чертеж, который показывает концентрацию L-лизина и мутность суспензии коринеформных бактерий, полученные в примере 11.
Фиг. 22 представляет собой чертеж, который показывает концентрацию L-лизина и мутность суспензии коринеформных бактерий, полученные в сравнительном примере 6.
Фиг. 23 представляет собой чертеж, который показывает давление культуральной жидкости на стороне притока резервуара мембранной сепарации, полученное в сравнительном примере 6.
Лучший способ осуществления изобретения
Способ по настоящему изобретению относится к способу получения химического продукта, при котором микроорганизмы или клетки культуры культивируются в ферментационном резервуаре, и культуральная жидкость непрерывно переносится из ферментационного резервуара в резервуар мембранной сепарации для фильтрации через сепарационную мембрану с тем, чтобы продукт ферментации собирался из фильтрованной жидкости в виде химического продукта, в то время как не подвергнутая фильтрации культуральная жидкость стекает обратно для объединения с культуральной жидкостью на находящейся выше по потоку стороне резервуара мембранной сепарации, и при этом одна часть культуральной жидкости, переносимой из ферментационного резервуара, может направляться в обход резервуара мембранной сепарации в ответ на давление на стороне притока культуральной жидкости резервуара мембранной сепарации.
Изобретение осуществляется с помощью аппарата для ферментации, например, показанного на фиг. 1. Фиг. 1 представляет собой схематический вид, который показывает аппарат для ферментации в соответствии с одним вариантом осуществления настоящего изобретения.
Аппарат для ферментации, например, показанный на фиг. 1, состоит из ферментационного резервуара 1, в котором культивируются микроорганизмы или клетки культуры, и резервуара мембранной сепарации 2, снабженного сепарационной мембраной 3, используемой для фильтрации культуральной жидкости. Резервуар мембранной сепарации 2 установлен снаружи резервуара для реакции ферментации и соединен с ферментационным резервуаром 1 через трубопровод переноса жидкости 17 и трубопровод переноса жидкости 15 (трубопровод циркуляции).
Ферментационный резервуар 1 имеет функцию непрерывного культивирования микроорганизмов или клеток культуры, и резервуар может использоваться в таком качестве, пока трубопровод циркуляции может быть соединен с резервуаром; таким образом, может использоваться сосуд ферментера или тому подобный сосуд ферментера, который обычно использовался для культивирования микроорганизмов или клеток культуры.
Ферментационный резервуар 1, который соединен с насосом подачи среды 6, обеспечен мешалкой 7 с тем, чтобы осадок загружался в ферментационный резервуар 1 насосом подачи среды 6, и, при необходимости, позволяет мешалке 7 перемешивать культуральную жидкость внутри ферментационного резервуара 1. Кроме того, устройство подачи газа 8 также соединено с ним с тем, чтобы при необходимости требуемый газ подавался устройством подачи газа 8. В данной конструкции, для извлечения и обеспечения рециркуляции подаваемого газа и подачи снова газа устройством подачи газа 8, например, трубопровод предпочтительно расположен между свободным пространством над продуктом в ферментационном резервуаре 1 и устройством подачи газа 8 с тем, чтобы путем направления подаваемого газа в следующем порядке: свободное пространство, трубопровод и устройство подачи газа 8, могло проводиться извлечение и рециркуляция.
Кроме того, устройство сенсора-регулятора pH 9 и насос подачи раствора для регулировки pH 10, при необходимости, присоединены к ферментационному резервуару 1 с тем, чтобы регулировать pH культуральной жидкости. Конечно, для регулирования pH культуральной жидкости путем подачи и кислоты, и щелочи в культуру, предпочтительно используется множество насосов подачи раствора, регулирующего pH. Кроме того, при необходимости, регулятор температуры 11 также присоединен к нему с тем, чтобы регулировать температуру культуральной жидкости для получения химического продукта с высокой продуктивностью. Кроме того, в качестве регулировок физико-химических состояний культуральной жидкости измерительными и регулирующими устройствами были проиллюстрированы pH и температура; однако при необходимости, регулирующие процессы могут проводиться в отношении растворенного кислорода и ORP (окислительно-восстановительного потенциала), и концентрация микроорганизмов в культуральной жидкости могут быть, кроме того, измерены анализатором, таким как трубопроводный химический сенсор, с тем, чтобы на основании полученного индекса, могли регулироваться физико-химические условия. Кроме того, путем использования в качестве индексов измеренных в физико-химической среде культуральной жидкости величин, полученных измерительными и регулирующими устройствами, по требованию, может регулироваться количество загрузки среды и ее скорость.
Сепарационная мембрана 3 может быть установлена внутри резервуара мембранной сепарации 2, и, таким же образом, как и в отношении ферментационного резервуара 1, форма и тому подобные параметры резервуара мембранной сепарации 2, не ограничиваются, пока трубопровод циркуляции может быть присоединен к нему. В качестве сепарационной мембраны 3, независимо от используемых неорганических и органических материалов, могут использоваться любые сепарационные мембраны, пока только микроорганизмы или клетки культуры могут отфильтровываться от культуральной жидкости, содержащей микроорганизмы или клетки культуры; однако предпочтительно используется пористая мембрана, выполняющая целесообразную функцию сепарации и проникновения, в соответствии со свойствами перерабатываемой жидкости и видам применения жидкости, которые будут описаны ниже, и мембрана предпочтительно обладает устойчивостью к стерилизации (например, при 120°С в течение 30 минут). Кроме того, сепарационная мембрана 3 соединена с насосом 4 с тем, чтобы создать трансмембранную разность давления между стороной сепарационной мембраны, с которой находится необработанная жидкость, и стороной, в которую она должна проникнуть.
Резервуары мембранной сепарации 2 и ферментационный резервуар 1 предпочтительно сконструированы так, чтобы иметь объемы для установки отношения объема культуральной жидкости в ферментационном резервуаре к объему культуральной жидкости в резервуаре мембранной сепарации равным 4 или более до 100 или менее. То есть, путем учета того, что, в целом, в резервуарах содержится культуральная жидкость, имеющая примерно 80% объема каждого из резервуара мембранной сепарации 2 и ферментационного резервуара 1, резервуары желательно сконструированы так, чтобы установить отношение объема ферментационного резервуара к объему резервуара мембранной сепарации, равное 4 или более до 100 или менее. При такой конструкции становится возможным изготовление компактного аппарата, а также удлинение времени удерживания культуральной жидкости в ферментационном резервуаре с тем, чтобы могли быть достигнуты соответствующие условия культивирования, снижены затраты на электрическое питание, повышена скорость получения химического продукта и могло быть достигнуто легкое управление приведением аппарата в действие.
Обводной трубопровод 26, который соединен с резервуаром мембранной сепарации на стороне вытекания из него культуральной жидкости, путем обхода резервуара сепарационной мембраны со стороны притока культуральной жидкости резервуара мембранной сепарации 2, вставлен в трубопровод циркуляции (трубопровод переноса жидкости 17 и трубопровод переноса жидкости 15) так, чтобы без подачи одной части культуральной жидкости, переносимой из ферментационного резервуара 1 в резервуар мембранной сепарации 2, часть культуральной жидкости могла быть объединена с не фильтрованной культуральной жидкостью в трубопроводе переноса жидкости 15, путем обхода резервуара мембранной сепарации 2. Кроме того, в настоящем варианте осуществления, один конец обводного трубопровода 26 соединен с трубопроводом переноса жидкости 17, причем другой конец соединен с трубопроводом переноса жидкости 15; однако в другой конструкции, обводной трубопровод 26 соединен с ферментационным резервуаром 1, путем обхода резервуара мембранной сепарации 2, со стороны притока культуральной жидкости резервуара мембранной сепарации 2, или соединен с частью между ферментационным резервуаром 1 и стороной притока культуральной жидкости резервуара мембранной сепарации 2. То есть, один конец (со стороны выше по потоку) линии обхода 26 может быть соединен с трубопроводом переноса жидкости 17, причем другой конец (со стороны ниже по потоку) соединен с ферментационным резервуаром 1 с тем, чтобы обеспечить непосредственный обратный сток в ферментационный резервуар 1 одной части культуральной жидкости, которая обошла резервуар мембранной сепарации 2. Альтернативно, указанные два конца обводного трубопровода 26 могут быть соединены с трубопроводом переноса жидкости 17 с тем, чтобы обеспечить возможность непосредственного объединения одной части культуральной жидкости, которая обошла резервуар мембранной сепарации 2, с культуральной жидкостью в трубопроводе переноса жидкости 17, подаваемой из ферментационного резервуара 1.
Средство регуляции количества текущей жидкости 25 установлено в обводной трубопровод 26 резервуара мембранной сепарации 2. Текущее количество культуральной жидкости, подаваемой в резервуар мембранной сепарации 2, может регулироваться указанным средством регуляции количества текущей жидкости. Средство регуляции количества текущей жидкости может представлять собой или клапан, или насос, и, с точки зрения затрат, предпочтительно используется клапан. В случае, когда клапан выбран в качестве средства регуляции количества текущей жидкости, количество культуральной жидкости, подаваемой в резервуар мембранной сепарации 2, может быть снижено путем открытия клапана. Напротив, путем закрытия клапана, всей культуральной жидкости, текущей через трубопровод переноса жидкости 17, предоставляется возможность течь в резервуар мембранной сепарации 2. Хотя конструкция клапана конкретно не ограничивается, предпочтительно используется мембранный клапан или дроссельный клапан, потому что после паровой стерилизации, культуральная жидкость или тому подобная вряд ли остается ввиду структуры клапана.
Кроме того, в случае, когда в качестве средства регуляции количества текущей жидкости 25 выбран насос, то процесс переноса жидкости может осуществляться так, чтобы обеспечить возможность потока культуральной жидкости в том же направлении, что и культуральной жидкости, текущей через резервуар мембранной сепарации 2, с тем, чтобы путем увеличения количества переноса жидкости насосом, могло быть уменьшено количество культуральной жидкости, подаваемой в резервуар мембранной сепарации 2, в то же время, напротив, путем остановки переноса жидкости насосом, вся культуральная жидкость, текущая через трубопровод переноса жидкости 17, направляется в резервуар мембранной сепарации 2.
Количество текущей культуральной жидкости, подаваемой в резервуар мембранной сепарации 2, в основном регулируется, в зависимости от давления на стороне притока культуральной жидкости резервуара мембранной сепарации. По этой причине, манометр 29 установлен в аппарате, как показано на фиг. 1. Давление на стороне притока культуральной жидкости резервуара мембранной сепарации измеряется манометром 29, и в случае, когда измеренная величина выше, чем желательная величина, то активируется средство регуляции количества текущей жидкости 25 с тем, чтобы одна часть культуральной жидкости, переносимая из ферментационного резервуара 1, могла обойти резервуар мембранной сепарации 2 и циркулировать.
Кроме того, в трубопровод циркуляции установлен насос 5, который регулирует протекающее количество культуральной жидкости, переносимой из ферментационного резервуара. Насос может быть установлен в трубопровод переноса жидкости 17 или трубопровод переноса жидкости 15 (обратный путь в ферментационный резервуар), и может быть также установлен в оба трубопровода. Хотя система, форма и материал для элементов насосов, контактирующих с жидкостью, конкретно не ограничиваются, в трубопроводе циркуляции предпочтительно используются такие насосы, которые устойчивы к паровой стерилизации.
На фиг. 6 показано соотношение между линейной скоростью культуральной жидкости в трубопроводе циркуляции и количеством осажденных дрожжевых штаммов, обладающих способностью продуцировать молочную кислоту, и на основании этого, обнаружено, что в случае, когда линейная скорость культуральной жидкости в трубопроводе циркуляции (трубопровод переноса жидкости 17 и трубопровод переноса жидкости 15) составляет 2,5 см/с или более, то культуральная жидкость может циркулировать без возможного осаждения бактерий внутри трубопровода. Поэтому, путем выявления линейной скорости потока культуральной жидкости внутри трубопровода переноса жидкости 17, переносимой из ферментационного резервуара, и/или не фильтрованной культуральной жидкости внутри трубопровода переноса жидкости 15, предпочтительно выбирается такой режим работы средства регуляции количества текущей жидкости 25 и насоса 5, чтобы установить линейную скорость на уровень 2,5 см/с или более. Кроме того, по той же причине, устанавливается линейная скорость культуральной жидкости в обводном трубопроводе 26, предпочтительно равная 2,5 см/с или более.
Кроме того, в случае, когда, как описано ранее, одна часть культуральной жидкости, которая обошла резервуар мембранной сепарации, объединяется с культуральной жидкостью в ферментационном резервуаре или с культуральной жидкостью, переносимой из ферментационного резервуара в резервуар мембранной сепарации, путем выявления линейной скорости культуральной жидкости, переносимой из ферментационного резервуара, то режим работы средства регуляции количества текущей жидкости 25 и насоса 5 выбирается так, чтобы установить линейную скорость на уровень 2,5 см/с или более. Кроме того, как будет описано позднее, в случае, когда не фильтрованная культуральная жидкость из трубопровода переноса жидкости 15 стекает обратно для объединения с культуральной жидкостью в ферментационном резервуаре, в то же время, стекая назад с тем, чтобы непосредственно объединяться с одной частью культуральной жидкости трубопровода переноса жидкости 17, то предпочтительно в каждом из двух трубопроводов устанавливается линейная скорость культуральной жидкости, равная 2,5 см/с или более. То есть, в настоящем изобретении, каждая из линейной скорости культуральной жидкости, переносимой из ферментационного резервуара в резервуар мембранной сепарации, линейной скорости не фильтрованной культуральной жидкости, стекающей обратно из резервуара мембранной сепарации, для объединения с культуральной жидкостью на стороне, находящейся выше по потоку от резервуара мембранной сепарации, и линейной скорости культуральной жидкости, направляемой в обход резервуара мембранной сепарации, предпочтительно устанавливается на уровень 2,5 см/с или более.
Кроме того, в аппарате, показанном на фиг. 1, для регулирования потока через сепарационную мембрану 3 и количества культуральной жидкости внутри ферментационного резервуара, датчик уровня 12 устанавливается в ферментационном резервуаре 1. Путем выявления количества культуральной жидкости в ферментационном резервуаре датчиком уровня 12, можно регулировать насос 6 подачи среды. Для регулирования потока, может регулироваться количество полученной фильтрацией жидкости. Хотя способ регулирования количества полученной фильтрацией жидкости конкретно не ограничивается, например, может быть установлено устройство, регулирующее разность давления уровня жидкости, которое изменяет протекающее количество полученной фильтрацией жидкости путем регулирования разности давления уровня жидкости, или протекающее количество полученной фильтрацией жидкости может изменяться приводом насоса путем использования источника энергии или электропитания. Кроме того, аппарат для ферментации, применяемый для получения химического продукта по настоящему изобретению, предпочтительно снабжен трубопроводом подачи пара для стерилизации аппарата для ферментации 1, резервуара мембранной сепарации 2 и трубопроводов переноса жидкости 15 и 17.
Среди различных видов насосов, которые могут использоваться в настоящем изобретении, можно указать, например, такие насосы, как центробежный насос, трубный насос и диафрагменный насос, а предпочтительно, такие насосы, в которых количество циркулирующей жидкости и количество полученной фильтрацией жидкости, полученной через сепарационную мембрану, может быть рассчитано на основании установок производительности насоса; а конкретнее, желательно использование диафрагменного насоса и трубного насоса.
В способе получения химического продукта путем использования аппарата для ферментации, имеющего указанную выше конструкцию, культивирование проводится, например, следующим образом. Другими словами, микроорганизмы или клетки культуры непрерывно культивируются в резервуаре для ферментации 1, и культуральная жидкость подается в резервуар мембранной сепарации 2 из ферментационного резервуара 1 через трубопровод переноса жидкости 17 насосом 5 внутри трубопровода циркуляции, и путем вызова разности давления между стороной необработанной жидкости и стороной полученной фильтрацией жидкости сепарационной мембраны 3 насосом 4 или тому подобным устройством, культуральная жидкость фильтруется с тем, чтобы можно было собрать фильтрованную жидкость, содержащую молочную кислоту или тому подобную (химический продукт), который представляет собой продукт ферментации микроорганизмами, или культуру клеток. С другой стороны, не фильтрованная культуральная жидкость стекает обратно в ферментационный резервуар 1 через трубопровод переноса жидкости 15. При этом, производительность насоса 5 устанавливается на такую скорость (например, линейную скорость 2,5 см/с или более, как описано выше), чтобы предотвратить осаждение микроорганизмов или клеток культуры в трубопроводе переноса жидкости 17 и трубопроводе переноса жидкости 15.
Однако в этом случае, когда непрерывно проводятся культивирование и мембранная сепарация, ввиду увеличения вязкости культуральной жидкости и засорения сепарационной мембраны, а также засорения канала потока вследствие осаждения микроорганизмов или культуральных клеток внутри резервуара мембранной сепарации, давление внутри резервуара мембранной сепарации увеличивается. Когда давление внутри резервуара мембранной сепарации увеличивается, то увеличиваются повреждения резервуара мембранной сепарации и нагрузки, прилагаемые к микроорганизмам и культуральным клеткам. Поэтому, давление внутри резервуара мембранной сепарации предпочтительно устанавливается на 1 МПа или менее. С другой стороны, для подавления увеличения давления внутри резервуара мембранной сепарации, когда уменьшается количество культуральной жидкости, переносимой из ферментационного резервуара 1 насосом 5, условия культивирования внутри ферментационного резервуара в значительной степени изменяются, вызывая осаждение микроорганизмов и культуральных клеток внутри трубопровода циркуляции, что приводит к уменьшению эффективности продукции.
Поэтому, в настоящем изобретении одна часть культуральной жидкости, переносимой из ферментационного резервуара 1, может направляться в обход резервуара мембранной сепарации 2 и обратно стекать в ответ на повышение давления культуральной жидкости на стороне притока жидкости резервуара мембранной сепарации 2. Предпочтительнее, количество культуральной жидкости, текущей в обход резервуара мембранной сепарации 2, регулируется так, чтобы установить давление культуральной жидкости на стороне притока жидкости резервуара мембранной сепарации на 1 МПа или менее. При этом, пока нет других определений, давление, указанное в данном случае, относится к манометрическому давлению.
Колебания давления внутри резервуара мембранной сепарации могут измеряться манометром 29, установленным на стороне подачи культуральной жидкости, и на основании результатов измерения, количество текущей культуральной жидкости, направляемой в обход резервуара мембранной сепарации, регулируется с тем, чтобы можно было контролировать увеличение давления внутри резервуара мембранной сепарации.
В результате, путем предотвращения осаждения микроорганизмов и культуральных клеток внутри трубопровода циркуляции, можно устойчивым образом проводить культивирование. Кроме того, поскольку можно уменьшить повреждения резервуара мембранной сепарации и повышенную нагрузку, прилагаемую к микроорганизмам или культуральным клеткам, то возможно достижение высокого выхода и высокой производительности.
Другими словами, по сравнению с обычной операцией серийной ферментации, скорость получения продукта ферментации может быть увеличена так, что достигается очень эффективная ферментационная продукция, причем продукт ферментации эффективно извлекается. Скорость продукции в непрерывной культуре может быть рассчитана следующим уравнением (1):
Уравнение 1

Кроме того, скорость ферментационной продукции в серийной культуре определяется делением количества продукта (г) во время, когда был израсходован весь материал, источник углерода, на время (ч), требуемое для потребления источника углерода, и количество культуральной жидкости в это время (L).
Аппарат, показанный на фиг. 1, может быть предпочтительно изменен, например, следующим образом. То есть, например, как показано на фиг. 2, средство регуляции количества протекающей жидкости 25 может быть предпочтительно сконструировано для работы в ответ на результаты измерений манометром 29. Кроме того, двухпозиционный клапан 27 резервуара мембранной сепарации может быть предпочтительно помещен в трубопровод переноса жидкости 17 на стороне, находящейся ниже по потоку от точки присоединения к обводному трубопроводу 26, в положение на находящейся выше по потоку стороне от резервуара мембранной сепарации 2, или двухпозиционный клапан 28 резервуара мембранной сепарации может быть предпочтительно помещен в трубопровод переноса жидкости 15 на стороне, находящейся выше по потоку от точки присоединения к обводному трубопроводу 26, в положение на находящейся ниже по потоку стороне от резервуара мембранной сепарации 2. В случае, когда установлены двухпозиционный клапан 27 резервуара мембранной сепарации и/или двухпозиционный клапан 28 резервуара мембранной сепарации, то вся культуральная жидкость, протекающая через трубопровод переноса жидкости 17, может по требованию направляться в обводной трубопровод 26. При такой конструкции, даже после возникновения отказа внутри резервуара мембранной сепарации вследствие засорения сепарационной мембраны и засорения канала потока, вызванного осажденными микроорганизмами или культуральными клетками внутри резервуара мембранной сепарации, культуральная жидкость, подаваемая в резервуар мембранной сепарации, может быть полностью остановлена для того, чтобы можно было произвести устранение причины отказа внутри резервуара мембранной сепарации и обмен жидкости.
Кроме того, как показано на фиг. 7, не фильтрованная культуральная жидкость из трубопровода переноса жидкости 15 предпочтительно стекает обратно для объединения с культуральной жидкостью внутри ферментационного резервуара, и также предпочтительно стекает обратно для непосредственного объединения с одной частью культуральной жидкости в трубопроводе переноса жидкости 17. При этом насос 5, который регулирует скорость потока и протекающее количество не фильтрованной культуральной жидкости, стекающей обратно для объединения с культуральной жидкостью внутри ферментационного резервуара, а также регулирует скорость потока и протекающее количество культуральной жидкости, переносимой из ферментационного резервуара, помещен на находящейся ниже по потоку стороне ближе к ферментационному резервуару точке ответвления 14B в трубопроводе переноса жидкости 15; и, в отличие от этого, насос 16 также помещается на находящейся ниже по потоку стороне точки соединения 14А в трубопроводе переноса жидкости 17. При данной конструкции, контуры циркуляции, которые не зависимы от ферментационного резервуара 1, образованы с находящейся ниже по потоку стороной от точки соединения 14А в трубопроводе переноса жидкости 17 и резервуаром мембранной сепарации 2, а также с находящейся выше по потоку стороной от точки ответвления 14В в трубопроводе переноса жидкости 15. И каждый из насосов 16 и 5 может регулировать скорость потока и протекающее количество жидкости в контуре циркуляции, образованном с находящейся ниже по потоку стороной от точки соединения 14А в трубопроводе переноса жидкости 17 и резервуаром мембранной сепарации 2, а также с находящейся выше по потоку стороной от точки ответвления 14В в трубопроводе переноса жидкости 15, и скорость потока и протекающее количество в контуре циркуляции, образованном с находящейся ниже по потоку стороной от точки соединения 14В в трубопроводе переноса жидкости 15 и ферментационным резервуаром 1, а также с находящейся выше по потоку стороной от точки соединения 14А в трубопроводе переноса жидкости 17, в каждом независимом способе. По этой причине, даже когда скорость потока культуральной жидкости внутри контура циркуляции увеличивается регулированием насоса 16, то есть, даже когда линейная скорость (линейная скорость потока) культуральной жидкости, протекающей по поверхности сепарационной мембраны 3 внутри резервуара мембранной сепарации, увеличивается, то скорость потока на находящейся ниже по потоку стороне от точки ответвления 14В в трубопроводе переноса жидкости 15 может поддерживаться на постоянном уровне насосом 5 с тем, чтобы скорость культуральной жидкости, возвращающейся в ферментационный резервуар 1, поддерживалась на постоянном уровне. То есть, поскольку можно улучшить регулирование скорости потока культуральной жидкости внутри резервуара мембранной сепарации при поддержании на постоянном уровне условий культивирования внутри ферментационного резервуара, то можно поддерживать желательные условия культивирования в ферментационном резервуаре, в то время как жидкость переносится со скоростью, которая предотвращает осаждение микроорганизмов или культуральных клеток, и, следовательно, проводить устойчивое культивирование с поддержанием высокого выхода и высокой производительности.
Кроме того, когда повышается скорость не фильтрованной культуральной жидкости для возврата в ферментационный резервуар 1 культуральной жидкости, то возникает тенденция вызова турбулентности в потоке жидкости, что приводит к воздействию на коэффициент переноса кислорода kLa; поэтому, путем поддержания постоянства скорости жидкости, возвращающейся в ферментационный резервуар 1 культуральной жидкости, можно стабилизировать эффективность ферментации.
В настоящем изобретении, для увеличения скорости потока, протекающего по поверхности сепарационной мембраны 3 внутри резервуара мембранной сепарации и, соответственно, для увеличения скорости продукции, при поддержании должной эффективности культивирования, и в то же время увеличении извлекаемого количества полученной фильтрованной жидкости, то есть, продукта ферментации, протекающее количество или скорость потока не фильтрованной культуральной жидкости, стекающей обратно, для объединения с культуральной жидкостью в ферментационном резервуаре (то есть, текущее количество или скорость потока на находящейся ниже по потоку стороне от точки ответвления 14В в трубопроводе переноса жидкости 15), α предпочтительно устанавливается на уровень, меньший чем протекающее количество жидкости или скорость потока не фильтрованной культуральной жидкости, стекающей обратно, для объединения с культуральной жидкостью между ферментационным резервуаром и резервуаром мембранной сепарации (то есть, текущее количество или скорость потока на находящейся ниже по потоку стороне от точки ответвления 14А в трубопроводе переноса жидкости 17) β, и отношение указанных α/β предпочтительно устанавливается на 1 или менее.
Кроме того, как показано на фиг. 14, трубопровод переноса жидкости 15, используемый для обратного стока не фильтрованной культуральной жидкости для объединения с культуральной жидкостью внутри ферментационного резервуара, предпочтительно сконструирован с отверстием в положении, которое погружено в культуральную жидкость, находящуюся в ферментационном резервуаре 1. Путем обеспечения возможности открытия одного из концов трубопровода переноса жидкости 15 в этом положении, обеспечивается возможность сведения к минимуму колебаний коэффициента переноса кислорода kLa внутри ферментационного резервуара 1 от желательной установленной величины с тем, чтобы скорость снижения коэффициента от установленной величины могла подавляться в пределах 30% установленной величины.
Как показано на фиг. 8, множество резервуаров мембранной сепарации 2 предпочтительно соединены параллельно друг с другом. При такой конструкции, даже после возникновения отказа внутри одного из резервуаров мембранной сепарации, могут включаться другие резервуары мембранной сепарации и должным образом использоваться с тем, чтобы культивирование могло продолжаться без прекращения фильтрации внутри резервуара мембранной сепарации. Кроме того, в случае, когда резервуары мембранной сепарации соединены параллельно друг с другом, путем соединения трубопровода подачи пара с соответствующими резервуарами мембранной сепарации, стерилизация может проводиться в каждом из резервуаров мембранной сепарации отдельно.
В настоящем изобретении, для увеличения выхода продукта ферментации, засорение сепарационной мембраны предпочтительно предотвращается, и непрерывное культивирование предпочтительно устойчиво поддерживается в течение длительного времени. В этих целях, процентная доля извлечения, которая представляет собой скорость протекающего количества полученной фильтрацией жидкости, полученной из сепарационной мембраны 3, относительно протекающего количества культуральной жидкости, переносимой в резервуар мембранной сепарации (далее иногда просто именуемая «процентной долей извлечения») предпочтительно регулируется на уровне 10,0% или менее.
Процентная доля извлечения относится к отношению количества полученной фильтрацией жидкости после прохождения через сепарационную мембрану 3 к количеству культуральной жидкости (количеству циркулирующей жидкости), которое было перенесено в резервуар мембранной сепарации в единицу времени, и рассчитывается следующим (уравнением 2). В случае, когда множество резервуаров мембранной сепарации соединены друг с другом, процентная доля извлечения рассчитывается по количеству полученной фильтрацией жидкости и количеству циркулирующей жидкости в каждом из резервуаров мембранной сепарации. Кроме того, количество полученной фильтрацией жидкости может быть замещено областью сепарационной мембраны, используемой в резервуарах мембранной сепарации, и потоком, который может регулироваться приводом с тем, чтобы (уравнение 2) могло быть превращено в следующее (уравнение 3).
Уравнение 2

Уравнение 3

Для регулирования процентной доли извлечения, можно регулировать количество культуральной жидкости для потока в резервуар мембранной сепарации и/или количество полученной фильтрацией жидкости после прохождения через сепарационную мембрану. То есть, предпочтительно регулируются один или более факторов, выбранных из количества циркулирующей жидкости, потока и количества полученной фильтрацией жидкости. Для регулирования количества циркулирующей жидкости, предпочтительно регулируются уровни производительности насосов 5 и 16, расположенные на находящейся выше по потоку стороне от резервуара мембранной сепарации, как описано ранее. В качестве способа регулирования потока или количества полученной фильтрацией жидкости, предпочтительно проводится регулировка производительности насоса 4.
Поэтому, в аппарате, показанном на фиг. 1, например, расходомеры установлены в трубопровод переноса жидкости 17 и трубопровод дренирования полученной фильтрацией жидкости после прохождения через сепарационную мембрану 3, и путем регулярного мониторинга количества циркулирующей жидкости и количества полученной фильтрацией жидкости, процентная доля извлечения рассчитывается по (уравнению 2) с тем, чтобы предпочтительно приводились в действие насосы 4 и 5 при таком регулировании уровней их производительности, чтобы процентная доля извлечения была установлена на 10,0% или менее.
В качестве способа регулирования потока или количества полученной фильтрацией жидкости, в дополнение к регулировкам производительности насоса 4, могут быть предложены регулировки разности давления уровня жидкости, отсоса жидкостью, газом и т.д., или повышением давления в резервуаре мембранной сепарации.
Путем использования любого из указанных способов, например, могут проводиться операции привода для регулирования только потока, причем количество циркулирующей жидкости поддерживается на постоянном уровне. Кроме того, может также проводиться операция привода для регулировки количества циркулирующей жидкости, причем поток поддерживается на постоянном уровне.
Процентная доля извлечения предпочтительно регулируется так, чтобы быть установленной на уровень 5,0% или менее. С точки зрения повышения эффективности энергии, процентная доля извлечения устанавливается на сколько возможно высокий уровень. Поэтому, нижний предел процентной доли извлечения предпочтительно устанавливается, по меньшей мере, на уровень 0,01% или более.
Затем, в следующем описании будет обсуждаться поток. Поток можно рассчитать по следующему (уравнению 4).
Уравнение 4

Ясно, что может быть установлена желательная площадь мембраны, используемой в аппарате. Объем (м3/день) количества фильтрованной жидкости предпочтительно получают измерением объема количества фильтрованной жидкости за один день; однако объем фильтрованной жидкости за один день может быть схематически рассчитан измерением объема количества фильтрованной жидкости в течение примерно одного часа. В настоящем изобретении, поток предпочтительно установлен на 0,500 м/день или менее, предпочтительнее, в диапазоне от 0,050 м/день или более до 0,400 м/день или менее. В случае, когда поток превышает 0,500 м/день, то иногда становится трудно поддерживать непрерывную культуру регулированием процентной доли извлечения. Кроме того, в случае, когда поток меньше чем 0,050 м/день, это значит, что площадь сепарационной мембраны слишком велика, что затрудняет запуск в промышленное применение с экономической точки зрения.
Далее в следующем описании будет обсужден один пример получения химического продукта, осуществляемого применением аппарата, показанного на фиг. 1.
Сначала микроорганизм и необработанный материал культуры (среда) хранятся в ферментационном резервуаре 1, и путем добавления в него по требованию нейтрализатора, pH внутренней среды ферментационного резервуара 1 поддерживается в диапазоне от 4 до 8, причем ее температура поддерживается в диапазоне от 20 до 50°С. При такой конструкции, проводится культивирование микроорганизма, и во время культивирования, получают желательные продукты ферментации (химические продукты), такие как спирт, органическая кислота, аминокислота, нуклеиновая кислота и тому подобные. Во время этого процесса, поскольку культивирование проводится непрерывно для получения желательного продукта ферментации, среда, содержащая питательные вещества, используемые для культивирования, непрерывно или периодически подается в ферментационный резервуар 1 через насос подачи среды 6.
Кроме того, одновременно с культурой, культуральная жидкость внутри ферментационного резервуара 1 непрерывно циркулирует между ферментационным резервуаром 1 и резервуаром мембранной сепарации 2 для установки линейной скорости потока внутри трубопровода циркуляции на 2,4 см/с или более насосом 5. В резервуаре мембранной сепарации 2, культуральная жидкость фильтруется и разделяется на не фильтрованную культуральную жидкость, содержащую микроорганизмы, и фильтрованную жидкость, содержащую продукты ферментации, путем использования сепарационной мембраны. В результате, полученная фильтрацией жидкость, содержащая продукты ферментации, может извлекаться из системы аппарата, и дальнейшим концентрированием, перегонкой и кристаллизацией полученной фильтрацией жидкости, может быть получен продукт ферментации, имеющий повышенную чистоту. С другой стороны, не фильтрованная культуральная жидкость, содержащая микроорганизмы или культуральные клетки, которые были отфильтрованы и отделены, удерживается внутри ферментационного резервуара 1 с тем, чтобы концентрация микроорганизмов в ферментационном резервуаре могла поддерживаться на высоком уровне, и могло проводиться культивирование с высокой продуктивностью химического продукта.
При этом, линейная скорость потока внутри трубопровода циркуляции может быть рассчитана по (текущему количеству в единицу времени)/(площадь поперечного сечения трубопровода). Альтернативно, цифровой датчик скорости потока Кориолиса или тому подобные устройства могут быть соединены с трубопроводом с тем, чтобы проводить измерения. Путем регистрации выходного сигнала такого цифрового расходомера, может регулироваться насос 5, средство регуляции количества протекающей жидкости 25 и тому подобные.
Концентрация микроорганизмов или культуральных клеток в культуральной жидкости в ферментационном резервуаре 1 предпочтительно поддерживается в пределах высокого уровня, но так, чтобы не вызвать состояние, неприемлемое для роста микроорганизмов или культуральных клеток, приводящее к их более высокой смертности; таким образом, обеспечиваются условия для получения более эффективной продуктивности. Например, путем поддержания концентрации на уровне 5 г/л или более в сухой массе, возможно получение желательной эффективности продукции.
Для поддержания данной соответствующей концентрации, при необходимости, микроорганизмы или культуральные клетки предпочтительно отсасываются из ферментационного резервуара. Когда концентрация микроорганизмов или культуральных клеток внутри ферментационного резервуара становится слишком высокой, то легко вызывается тенденция к засорению сепарационной мембраны. Путем отсасывания микроорганизмов или культуральных клеток и поддержанием концентрации на соответствующем уровне, можно избежать засорения сепарационной мембраны. Кроме того, поскольку эффективность получения химического продукта имеет тенденцию изменяться под воздействием концентрации микроорганизмов или культуральных клеток в ферментационном резервуаре, то реализация продуктивности может поддерживаться в пределах фиксированного диапазона путем удаления микроорганизмов или культуральных клеток отсасыванием при использовании реализуемой продуктивности в качестве показателя.
Подача культивируемого необработанного материала и отсасывание культуральной жидкости (переносы культуральной жидкости в резервуар мембранной сепарации) могут проводиться с соответствующей точки времени. То есть, точки времени начала подачи необработанного культивируемого материала и отсасывания культуральной жидкости необязательно устанавливаются совпадающими друг с другом. Более того, подача необработанного культивируемого материала и отсасывание культуральной жидкости могут проводиться непрерывно или периодически.
Кроме того, при необходимости, количество культуральной жидкости внутри ферментационного резервуара может предпочтительно регулироваться использованием датчика уровня 12. Регулировки количества культуральной жидкости внутри ферментационного резервуара могут также проводиться не измерением уровня культуральной жидкости в ферментационном резервуаре, а измерением массы культуральной жидкости.
В настоящем изобретении, число ферментационных аппаратов конкретно не ограничено, пока может быть получен химический продукт и пока выращиваются микроорганизмы или культуральные клетки. В целом, операция непрерывного культивирования предпочтительно проводится в одном ферментационном резервуаре с точки зрения управления культивированием; однако по причинам, таким как небольшая емкость ферментационного резервуара, может использоваться множество ферментационных резервуаров. В таком случае, даже при проведении непрерывного культивирования при множестве ферментационных резервуаров, соединенных параллельно друг с другом или последовательно друг с другом путем использования трубопроводов, итоговый продукт может быть получен с высокой продуктивностью.
В настоящем изобретении, культуральная жидкость относится к жидкости, полученной в результате роста микроорганизмов или культуральных клеток в культуральном сырьевом материале, а культуральный сырьевой материал относится к питательному составу или тому подобному, который может ускорить рост микроорганизмов или культуральных клеток и обеспечивает возможность получения химического продукта или тому подобного, который представляет собой целевой продукт, получение которого желательно. Композиция культурального сырьевого материала может по требованию изменяться в зависимости от композиции культурального сырьевого материала в исходной культуре с тем, чтобы повысить продуктивность целевого химического продукта.
Что касается микроорганизмов или культуральных клеток, используемых в настоящем изобретении, их примеры включают дрожжи, такие как хлебные дрожжи, часто используемые в промышленном масштабе, бактерии, такие как Escherichia coli и коринеформные бактерии, нитевидные грибы, Actinomyces, клетки животных и клетки насекомых. В частности, предпочтительно используются эукариотические организмы, такие как дрожжи, которые легко вызывают разрушение клеток вследствие внутренней разности давления отделенного ядра, и среди них предпочтительнее используются дрожжи. Используемые микроорганизмы и культуральные клетки могут быть отделены и изолированы из естественной среды или могут представлять собой те, основные свойства которых частично модифицированы мутацией или генной рекомбинацией. Среди этих микроорганизмов и культуральных клеток, предпочтительно выбираются и используются те, которые способны обеспечить высокий уровень продукции целевого химического продукта. В настоящем изобретении, культура микроорганизмов иногда именуется «ферментацией» или «ферментационной культурой».
В качестве сырьевого культурального материала, может использоваться любой материал, пока он ускоряет рост микроорганизмов или культуральных клеток, и может желательно продуцировать целевой химический продукт. Конкретные примеры сырьевого культурального материала включают: источник углерода, источник азота, неорганическую соль и общую жидкую среду, которая в зависимости от потребности содержит органические питательные вещества в следовых количествах, такие как аминокислоты и витамины.
В качестве источника углерода могут использоваться сахариды, такие как глюкоза, сахароза, фруктоза, галактоза и лактоза, крахмальные засахаривающие жидкости, содержащие указанные сахариды, сладкая картофельная патока, патока сахарной свеклы и сок сахарного тростника; кроме того, могут использоваться органические кислоты, такие как уксусная кислота, спирты, такие как этанол и глицерин.
В качестве источника азота могут использоваться газообразный аммиак, аммиачная вода, соли аммония, мочевина, нитраты и другие органические источники азота, вспомогательные материалы, такие как жмыхи, жидкость гидролизации соевых бобов, растворители казеина, другие аминокислоты, витамины, жидкость для замачивания кукурузы, дрожжи или дрожжевые экстракты, мясные экстракты, пептиды, такие как пептон, и различные культивированные бактерии и их гидролизаты.
В качестве неорганических солей, возможно использование фосфата, соли магния, соли кальция, соли железа, соли марганца и так далее. Когда микроорганизмы нуждаются в определенных питательных веществах для их роста, то могут добавляться соответствующие питательные пищевые продукты в качестве аутентичного препарата или натуральный продукт, содержащий его. Также по требованию может использоваться агент против пенообразования.
В настоящем изобретении, концентрация сахарида в культуральной жидкости предпочтительно поддерживается на уровне 5 г/л или менее. Причиной, почему желательно поддержание концентрации сахарида на уровне 5 г/л или менее, является уменьшение до минимума количества сахаридов, которые вымываются вследствие отсасывания культуральной жидкости.
В целом, культивирование микроорганизмов или культивирование клеток проводится в диапазоне pH от 4 до 8 при температуре от 20 до 50°С. pH культуральной жидкости может доводиться до заданной величины в пределах указанного выше диапазона использованием материалов, таких как неорганическая кислота или органическая кислота, щелочной материал, мочевина, карбонат кальция и газообразный аммиак. Кроме того, если необходимо повысить скорость подачи кислорода, то могут использоваться средства для удерживания концентрации кислорода на уровне 21% или более добавлением кислорода к воздуху для повышения давления внутри резервуара для реакции ферментации с целью увеличения скорости перемешивания и для увеличения количества тяги.
В настоящем изобретении, после того как концентрация микроорганизмов или культуральных клеток была увеличена проведением периодического культивирования или культивирования с подпиткой на начальной стадии культивирования, может быть начато непрерывное культивирование; или могут высеваться бактерии, имеющие высокую концентрацию, и непрерывное культивирование может проводиться после начала культивирования.
Поскольку химические продукты (продукты ферментации), получаемые по настоящему изобретению, конкретно не ограничены, при условии что они представляют собой вещества, которые продуцируются микроорганизмами или культуральными клетками в культуральной жидкости, то они могут быть по требованию выбраны, в зависимости от микроорганизмов или культуральных клеток. Определенные их примеры включают вещества, такие как спирт, органическая кислота, аминокислота, нуклеиновая кислота и тому подобные, которые массово продуцируются в ферментационной промышленности. Примеры спирта включают: этанол, 1,3-пропандиол, 1,4-бутандиол и глицерин; примеры органических кислот включают: уксусную кислоту, молочную кислоту, пировиноградную кислоту, янтарную кислоту, яблочную кислоту, итаконовую кислоту и лимонную кислоту, а примеры нуклеиновых кислот включают: нуклеозиды, такие как инозин и гуанозин, нуклеотиды, такие как инозиновая кислота и гуаниловая кислота, или диаминовые соединения, такие как кадаверин. Кроме того, настоящее изобретение может применяться при получении веществ, таких как ферменты, антибиотики и рекомбинантные белки.
В следующем описании будут обсуждены микроорганизмы или культуральные клетки, используемые для получения желательного химического продукта, хотя иллюстрируются определенные химические продукты.
В качестве микроорганизмов или культуральных клеток, которые могут использоваться при получении молочной кислоты по настоящему изобретению, хотя они конкретно не ограничены, могут желательно использоваться молочнокислые бактерии. Указанная здесь молочнокислая бактерия определяется в настоящем описании как прокариотический микроорганизм, который продуцирует 50% или более молочной кислоты в связанном с сахаром выходе к потребленной глюкозе. Примеры желательных молочнокислых бактерий включают любые из рода Lactobacillus, Pediococcus, Tetragenococcus, Carnobacterium, Vagococcus, Leuconostoc, Oenococcus, Atopobium, Streptococcus, Enterococcus, Lactococcus и Bacillus. Среди них, путем выбора молочнокислой бактерии, которая имеет высокий связанный с сахаром выход молочной кислоты по требованию, может желательно проводиться получение молочной кислоты.
Кроме того, в качестве молочных кислот могут быть выбраны те молочнокислые бактерии, которые имеют высокий связанный с сахаром выход L-молочной кислоты. L-молочная кислота представляет собой один вид оптических изомеров молочной кислоты, и она отчетливо отличается от D-молочной кислоты, образующей к ней энантиомер. Примеры молочнокислых бактерий, имеющих высокий связанный с сахаром выход L-молочной кислоты включают:
и т.д., и выбор может быть сделан среди них с тем, чтобы использовать для получения L-молочной кислоты.
В качестве микроорганизмов или культуральных клеток, используемых для получения D-молочной кислоты, могут использоваться, например, 
В случае, когда L-молочная кислота или D-молочная кислота продуцируется с использованием настоящего изобретения, то могут использоваться микроорганизмы или культуральные клетки, которым искусственно придана способность продуцировать молочную кислоту, или в которых такая активность усилена. В качестве способа придания микроорганизмам или культуральным клеткам способности продуцировать молочную кислоту, может использоваться известный способ путем использования мутации, вызванной лекарственным средством; однако предпочтительно используется рекомбинантный микроорганизм. В качестве рекомбинантного микроорганизма, предпочтительно используются те рекомбинантные микроорганизмы, которым придана или усилена способность продуцировать L-молочную кислоту или D-молочную кислоту, введением в них гена дегидрогеназы L-молочной кислоты (далее иногда именуемой L-LDH) или введением в них гена дегидрогеназы D-молочной кислоты (далее иногда именуемой D-LDH).
В качестве хозяина указанного выше рекомбинантного микроорганизма предпочтительнее используются Escherichia coli, которые представляют собой прокариотические клетки, молочнокислые бактерии и дрожжи, которые являются эукариотическими, и, в частности, предпочтительнее используются дрожжи. Среди дрожжей, предпочтительно используются те, которые относятся к роду Saccharomyces, а предпочтительнее, могут использоваться Saccharomyces cerevisiae.
Поскольку L-LDH или D-LDH конкретно не ограничиваются, то желательно использование тех, которые имеют дегидрогеназу L-молочной кислоты или дегидрогеназу D-молочной кислоты, представляющую собой белок, имеющий такую активацию, чтобы превратить никотинамид-аденин-динуклеотид восстановленного типа (NADH) в никотинамид-аденин-динуклеотид окисленного типа (NAD+), и L-молочной кислоты или D-молочной кислоты, кодированной в нее. Среди них, в качестве L-LDH, может желательно использоваться L-LDH, полученная у человека, или L-LDH, полученная у лягушки. Среди L-LDH, полученных у лягушки, желательно используются L-LDH, полученные у лягушек, относящихся к суринамской жабе (Pipidase), а среди них, более желательно использование L-LDH, полученных из Xenopus laevis. Кроме того, в качестве D-LDH, желательно используется ген, полученный из Lactobacillus plantarum или Pediococcus acidilactici или Bacillus laevolacticus, А предпочтительнее, используется ген, полученный из Bacillus laevolacticus.
Ген типа генетического полиморфизма и ген типа мутагенеза, вызванного индукцией мутации, включены в L-LDH или D-LDH, используемые в настоящем изобретении. Ген типа генетического полиморфизма относится к тем генам, в которых одна часть основной последовательности гена изменена ввиду естественной мутации гена. Кроме того, индукция мутации относится к процессу, при котором в гене искусственно индуцируется мутация. Индукция мутации осуществляется использованием способа, при котором используется набор (Mutan-K, выпускаемый компанией TAKARA BIO Inc.) введения сайт-направленной мутации, или способа, при котором используется набор (BD Diversify PCR Random Mutagenesis, выпускаемый компанией (CLONOTECH Inc.)) для индукции случайной мутации. Кроме того, в качестве L-LDH или D-LDH, используемых в настоящем изобретении, может использоваться даже та, которая имеет дефицит или вставку в одной части основной последовательности, пока она кодирует белок, имеющий активность L-лактат-дегидрогеназы или активность D-лактат дегидрогеназы.
После получения L-молочной кислоты, может проводиться отделение и очистка L-молочной кислоты, содержащейся в фильтрованной жидкости после прохождения через сепарационную мембрану 3, путем комбинирования общеизвестных способов концентрации, перегонки, кристаллизации и т.д. Например, предлагаются следующие способы: способ, при котором после установки рН жидкости, фильтрованной через сепарационную мембрану 3, на 1 или менее, полученная жидкость экстрагируется использованием простого диэтилового эфира, этилацетата и т.д., или способ, при котором после абсорбции на ионообменную смолу и промывания, проводится ее элюирование; способ, при котором после взаимодействия со спиртом в присутствии кислотного катализатора, полученный сложный эфир отгоняется, и способ, при котором культуральная жидкость кристаллизуется и осаждается в виде соли кальция или соли лития. Предпочтительно, предлагается способ, при котором концентрированная L-молочная кислота, полученная выпариванием влаги из фильтрованной жидкости после прохождения через сепарационную мембрану 3 подвергается перегонке. В этом случае, после перегонки предпочтительно проводится дистилляция, в то время как подается вода с тем, чтобы поддерживать постоянную концентрацию влаги в жидкости источника дистилляции. После дистилляции водного раствора L-молочной кислоты полученная жидкость концентрируется нагреванием и выпариванием из нее влаги с тем, чтобы можно было получить очищенную L-молочную кислоту, имеющую целевую концентрацию. В случае, когда в качестве дистиллята получается водный раствор L-молочной кислоты, имеющий компонент с низкой точкой кипения, то предпочтительно, компонент с низкой точкой кипения удаляется способом концентрации L-молочной кислоты. После операции перегонки дистиллят подвергается удалению примеси использованием ионообменной смолы, активированного угля, хроматографического разделения или тому подобных способов с тем, чтобы была получена L-молочная кислота, имеющая более высокую чистоту.
После получения D-молочной кислоты, таким же образом может проводиться отделение и очистка D-молочной кислоты, содержащейся в полученной фильтрацией жидкости после прохождения через сепарационную мембрану 3, путем комбинирования общеизвестных способов концентрации, перегонки, кристаллизации и т.д. Например, предлагаются следующие способы: способ, при котором после установки рН жидкости, фильтрованной через сепарационную мембрану 3 на 1 или менее, полученная жидкость экстрагируется использованием простого диэтилового эфира, этилацетата и т.д., или способ, при котором после абсорбции на ионообменную смолу и промывания, проводится ее элюирование; способ, при котором после взаимодействия со спиртом в присутствии кислотного катализатора, полученный сложный эфир отгоняется, и способ, при котором культуральная жидкость кристаллизуется и осаждается в виде соли кальция или соли лития. Предпочтительно, предлагается способ, при котором концентрированная D-молочная кислота, полученная выпариванием влаги из жидкости, фильтрованной через сепарационную мембрану 3, подвергается перегонке. В этом случае, после перегонки предпочтительно проводится дистилляция, в то время как подается вода с тем, чтобы поддерживать постоянную концентрацию влаги в жидкости источника дистилляции. После элюирования водного раствора D-молочной кислоты, полученная жидкость концентрируется нагреванием и выпариванием из нее влаги с тем, чтобы можно было получить очищенную D-молочную кислоту, имеющую целевую концентрацию. В случае, когда в качестве дистиллята получается водный раствор D-молочной кислоты, имеющий компонент с низкой точкой кипения (такой как этанол и уксусная кислота), то предпочтительно, компонент с низкой точкой кипения удаляется способом концентрации D-молочной кислоты. После операции перегонки, дистиллят подвергается удалению примеси использованием ионообменной смолы, активированного угля, хроматографического разделения или тому подобных способов с тем, чтобы была получена D-молочная кислота, имеющая более высокую чистоту.
В качестве микроорганизмов или культуральных клеток, используемых после получения этанола по настоящему изобретению, могут предпочтительно использоваться, например, дрожжи, относящиеся к любому из родов Saccharomyces, Kluyveromyces и Schizosaccharomyces, хотя они конкретно не ограничиваются. Среди них, могут использоваться Saccharomyces cerevisiae, Kluyveromyces lactis и Schizosaccharomyces pombe. Кроме того, также могут желательно использоваться бактерии, которые относятся к роду Lactobacillus и роду Zymomonas. Среди них, желательно могут использоваться Lactobacillus brevis или Zymomonas mobilis.
Микроорганизмы или культуральные клетки, которые могут использоваться для получения этанола, могут представлять собой микроорганизмы или культуральные клетки, у которых искусственно улучшена способность продукции этанола. Конкретнее, могут использоваться те микроорганизмы или культуральные клетки, которые имеют одну натуральную часть, частично модифицированную мутацией или генной рекомбинацией. Одним примером микроорганизмов или культуральных клеток, которые имеют одну модифицированную натуральную часть, являются дрожжи, в которых ген глюкоамилазы плесневого гриба, который относится к роду Rhizopus, комбинируется так, чтобы приобрести способность утилизировать сырьевой крахмал (микроорганизм. 3:555-564 (1987)).
Для отделения и очистки этанола, содержащегося в жидкости, полученной фильтрованной через сепарационную мембрану 3, желательно использование, например, способа очистки с применением NF (нано-фильтрационной) мембраны или RO мембраны (мембраны для системы обратного осмоса) или сепарационной мембраны, выполненной из цеолита.
В качестве микроорганизмов или культуральных клеток, используемых после получения пировиноградной кислоты по настоящему изобретению, желательно использование бактерий, относящихся к любому из родов Pseudomonas, Corynebacterium, Escherichia и Acinetobacter, хотя они конкретно не ограничиваются. Более желательно также использование бактерий Pseudomonas fluorescens, Pseudomonas aeruginosa, Escherichia coli и т.д.
В качестве микроорганизмов или культуральных клеток, которые могут использоваться для получения пировиноградной кислоты, могут использоваться микроорганизмы или культуральные клетки, у которых искусственно улучшена продукция пировиноградной кислоты, или те, основные свойства которых частично модифицированы мутацией или генной рекомбинацией. Например, могут желательно использоваться те бактерии, у которых ген АТФазы, непосредственно связанный с продукцией АТФ окислительным фосфорилированием, подвергнут мутации или удален. Кроме того, желательно использование плесневых грибов, дрожжей и т.д. Например, могут использоваться те плесневые грибы или дрожжи, которые относятся к любому из родов Saccharomyces, Toluropusis, Candida и Schizophyllum. Предпочтительнее, пировиноградная кислота может продуцироваться путем использования плесневых грибов или дрожжей Saccharomyces cerevisiae, Saccharomyces copsis, Candida glabrata, Candida lipolytica, Toluropusis glabrata, Schizophyllum commune и т.д.
Отделение и очистка пировиноградной кислоты в жидкости, фильтрованной через сепарационную мембрану 3, может проводиться способом, при котором используется анионообменная колонка. Например, желателен способ очистки, в котором используется ионообменник в виде слабой соли, описанный в документе JP-A No. 6-345683.
В качестве микроорганизмов или культуральных клеток, используемых после получении янтарной кислоты по настоящему изобретению, могут желательно использоваться, например, бактерии, относящиеся к роду Anaerobiospirillum и роду Actinobacillus. В частности, предлагается также использование Anaerobiospirillum succiniproducens, описанный в патенте США № 5143833, и Actinobacillus succinogenes, описанный James B. Mckinlay et al. (Applied Microbiol. Biotechnol., 71, 6651-6656 (2005)). Кроме того, могут использоваться коринеформные бактерии, относящиеся к роду Corynebacterium, Brevibacterium и Escherichia coli и т.д. В качестве коринеформных бактерий, желательно использование Corynebacterium glutamicum, Brevibacterium flavum, Brevibacterium lactofermentum и т.д.
В качестве микроорганизмов или культуральных клеток, которые могут использоваться для получения янтарной кислоты, могут использоваться микроорганизмы или культуральные клетки, у которых искусственно улучшена продукция этанола. Конкретнее, например, может использоваться микроорганизм, имеющий улучшенную способность продукции янтарной кислоты, достигнутую путем генной рекомбинации, и при его использовании может быть повышена продуктивность янтарной кислоты. В качестве такого микроорганизма, может использоваться, например, Brevibacterium flavum MJ233AB-41 (конфиденциальный номер: FERM BP-1498), имеющая дефицит лактат-дегидрогеназы, описанная в документе JP-A No. 2005-27533, Corynebacterium glutamicum, описанная в указанном выше непатентном документе 1, и штамм AFP11 Escherichia coli, который представляет собой штамм с дефицитом пируват-формиат-лиазы и лактат-дегидрогеназы, раскрытый в описании патента США № 5770435.
Сепарация и очистка янтарной кислоты, содержащейся в жидкости, фильтрованной через сепарационную мембрану 3, может проводиться обычным способом очистки янтарной кислоты. Например, желательно использование способа очистки, при котором способ электродиализа для смягчения воды и вакуумной концентрации и кристаллизации комбинируются друг с другом, как описано в документе JP-A No. 2005-333886.
В качестве микроорганизма или культуральных клеток, которые могут использоваться для получения итаконовой кислоты, могут, в частности, желательно, но без конкретного ограничения, использоваться плесневые грибы или дрожжи. Предпочтительнее, предлагается использование способа получения итаконовой кислоты путем использования плесневых грибов, относящихся к роду Aspergillus или Ustilago, или дрожжей, относящихся к роду Candida или Rhodotorula. Среди них, для продукции итаконовой кислоты желательно использование плесневых грибов, таких как Aspergillus terreus, Aspergillus itaconicus, Ustilago maydis, Ustilago cynodontis и Ustilago rabenhostina или Candia Antarctica.
Сепарация и очистка итаконовой кислоты, содержащейся в жидкости, фильтрованной через сепарационную мембрану 3, предпочтительно проводится с использованием ультрафильтрации и электродиализа. Например, может быть предложена ультрафильтрация, которая описана в документе JP-B No. 50958, или способ очистки электродиализом, при котором используется мембрана из катионообменной смолы солевого типа.
В качестве микроорганизмов или культуральных клеток, используемых после получения 1,3-пропандиола по настоящему изобретению, могут использоваться, например, без ограничения бактерии, относящиеся к роду Klebsiella, Clostridium и Lactobacillus, которые обладают активностью синтеза 1,3-пропандиола из глицерина.
После получения 1,3-пропандиола из глицерина, микроорганизм предпочтительно включает (а) по меньшей мере, один ген, который кодирует полипептид, имеющий активность глицерол-гидратазы; (b) по меньшей мере, один ген, который кодирует фактор, реактивирующий глицерол-гидратазу, и (с) по меньшей мере, один ген, который кодирует активность неспецифического катализатора для превращения 3-гидроксипропиональдегида в 1,3-пропандиол.
Предпочтительнее, используется рекомбинантный микроорганизм, способный продуцировать 1,3-пропандиол из глюкозы. В качестве хозяина рекомбинантного микроорганизма, предпочтительно используются рекомбинантные микроорганизмы, выбранные из группы, состоящей из: рода Klebsiella, рода Clostridium, рода Lactobacillus, рода Cytrobacter, рода Enterobacter, рода Aerobaqcter, рода Aspergillus, рода Saccharomyces, рода Schizosaccharomyces, рода Zygosaccharomyces, рода Pichia, рода Kluyveromyces, рода Candida, рода Hansenula, рода Debaryomyces, рода Mucor, рода Torulopsis, рода Methylobacter, рода Salmonella, рода Bacillus, рода Aerobacter, рода Streptomyces, рода Eschericia и рода Pseudomonas, а предпочтительнее используется Eschericia coli.
Рекомбинантный микроорганизм, способный продуцировать 1,3-пропандиол из глюкозы, предпочтительно получается в виде рекомбинантного микроорганизма, содержащего (а) по меньшей мере, один ген, который кодирует полипептид, имеющий активность глицерол-3-фосфат-дегидрогеназы; и (b) по меньшей мере, один ген, который кодирует полипептид, обладающий активностью глицерол-3-фосфатазы. Конкретнее, рекомбинантный микроорганизм предпочтительно включает ген, в котором фактор, реактивирующий глицерол-дегидратазу, кодируется orfX и orfZ, выделенными из регулона. Кроме того, рекомбинантный микроорганизм предпочтительно получен в виде рекомбинантного микроорганизма, который имеет дефицит активности глицерол-киназы и/или активности глицерол-дегидрогеназы и/или активности триозофосфат-изомеразы.
Сепарация и очистка 1,3-пропандиола, содержащегося в жидкости, фильтрованной через сепарационную мембрану 3, может проводиться концентрацией и кристаллизацией. Например, желательно используется способ очистки с использованием вакуумной концентрации и кристаллизации, как показано в документе JP-A No. 35785.
В качестве микроорганизмов или культуральных клеток, используемых после получения кадаверина по настоящему изобретению, предпочтительно используются, хотя и без конкретного ограничения, в качестве определенного примера те микроорганизмы, в которых усилена ферментативная активность лизин-декарбоксилазы и/или антипортера лизина-кадаверина, которыми обладает микроорганизм. Желательнее, предлагается применение рекомбинантного микроорганизма, в который вставлен ген, кодирующий лизин-декарбоксилазу и/или антипортер лизина-кадаверина. Наиболее желательно, предлагается применение рекомбинантного микроорганизма, в который вставлен один или два или более видов генов, кодирующих лизин-декарбоксилазу.
После получения кадаверина путем использования рекомбинантного микроорганизма, в качестве хозяина предпочтительно используется рекомбинантный микроорганизм, имеющий Eschericia coli или коринеформные бактерии. Предпочтительнее, используются коринеформные бактерии, которые имеют активность лизин-декарбоксилазы, а также имеют, по меньшей мере, одно из свойств: ауксотрофии к гомосерину и устойчивости к S-(2-аминоэтил)-L-цистеину. Среди коринеформных бактерий, предпочтительнее используются те, которые выбраны из рода Corynebacterium или рода Brevibacterium, а наиболее предпочтительно используется Corynebacterium glutamicum. Кроме того, микроорганизм предпочтительно имеет дефицит активности гомосерин-дегидрогеназы, и дефицит активности гомосерин-дегидрогеназы предпочтительно вызван генерацией мутации вследствие вставки гена.
Сепарация и очистка кадаверина, содержащегося в жидкости, фильтрованной через сепарационную мембрану 3, может проводиться комбинированием известных способов, таких как концентрация, перегонка и кристаллизация. Например, предпочтительно может использоваться способ очистки с использованием кристаллизации, как показано в документе JP-A No 2004-222569. В настоящем изобретении, получаются различные полимерные материалы, в зависимости от используемых кислот после непрерывной ферментации, и в случае использования полимерного материала, когда требуется высокая чистота, предпочтительно используется способ очистки с использованием кристаллизации. Когда рН культуральной жидкости поддерживается использованием хлористоводородной кислоты, то дигидрохлорид кадаверина может быть извлечен кристаллизацией фильтрованной жидкости. Конкретнее, предлагается использование способа, в котором, после непрерывной ферментации, рН культуральной жидкости поддерживается дикарбоновой кислотой с тем, чтобы был извлечен дикарбоксилат кадаверина. При этом, карбоновая кислота предпочтительно получается в виде алифатической и/или ароматической карбоновой кислоты, имеющей лишь две карбоновые группы в качестве функциональной группы, и предпочтительнее используется любая из кислот, выбранных из группы, состоящей из: адипиновой кислоты, себациновой кислоты, 1,12-додекандикарбоновой кислоты, янтарной кислоты, изофталевой кислоты и терефталевой кислоты.
Поскольку микроорганизмы или культуральные клетки, используемые после получения нуклеиновой кислоты по настоящему изобретению, конкретно не ограничиваются, то могут использоваться микроорганизмы или культуральные клетки, имеющие высокую продуктивную способность нуклеиновой кислоты, выделенные из натурального источника, или прокариотические микроорганизмы, чья продуктивная способность искусственно усилена. Конкретнее, могут использоваться те микроорганизмы или культуральные клетки, основные свойства которых частично модифицированы мутацией или генной рекомбинацией.
В следующем описании будет обсуждаться модификация части основных свойств. Для эффективного получения нуклеиновой кислоты необходимо синтезировать нуклеиновую кислоту, подлежащую сохранению, а также экскретировать полученную нуклеиновую кислоту наружу клетки. По этой причине, путем модификации основных свойств микроорганизмов или культуральных клеток, то есть, увеличением количества фермента, связанного с путем биосинтеза нуклеиновой кислоты, снижением активности фермента, связанного с путем разрушения нуклеиновой кислоты или модификацией белка, связанного с экскрецией нуклеиновой кислоты наружу клетки или композиции клеточной мембраны, могут быть получены микроорганизмы или культуральные клетки, которые эффективно продуцируют нуклеиновую кислоту.
Конкретнее, после получения инозина, предпочтительно конструируются микроорганизмы и культуральные клетки, не имеющие активности аденилосукцинат-синтетазы, или имеющие лишь слабую ее активность. Кроме того, они также конструируются без активности дегидрогеназы инозиновой кислоты или лишь со слабой ее активностью. Кроме того, они также конструируются без активности нуклеозидазы или лишь со слабой ее активностью. После получения гуанозина микроорганизмы и культуральные клетки желательно конструируются без активности аденилосукцинат-синтетазы или лишь со слабой ее активностью. Кроме того, они также конструируются без активности гуанилат-редуктазы или лишь со слабой ее активностью. Кроме того, они также желательно конструируются без активности нукелеозидазы или лишь со слабой ее активностью. Кроме того, они желательно конструируются без активности нуклеотидазы или лишь со слабой ее активностью. После получения уридина желательно конструируются микроорганизмы и культуральные клетки, не имеющие активности уридин-фосфорилазы или лишь со слабой ее активностью. После получения цитидина они желательно конструируются без активности цитидин-деаминазы или лишь со слабой ее активностью. А также без активности гомосерин-дегидрогеназы или лишь со слабой ее активностью.
В качестве микроорганизмов или культуральных клеток, используемых после получения нуклеиновой кислоты по настоящему изобретению, предпочтительно могут использоваться коринеформные бактерии или Bacillus subtilis. Например, после получения инозина в качестве коринеформных бактерий используются бактерии, относящиеся к роду Corynebacterium. Среди представителей рода Corynebacterium, предпочтительно используется Corynebacterium glutamicum, Corynebacterium ammoniagenes, Corynebacterium guanofaciens или Corynebacterium petrophilium. Кроме того, в качестве Bacillus subtilis, предлагаются бактерии, относящиеся к роду Bacillus, и среди них, предпочтительно используются Bacillus subtilis, Bacillus liqueniformis и Bacillus pumilus. Кроме того, после получения гуанозина, в качестве коринеформных бактерий используются бактерии, относящиеся к роду Corynebacterium, и среди них, предпочтительно используется Corynebacterium glutamicum; в качестве Bacillus subtilis, предлагаются бактерии, относящиеся к роду Bacillus, и среди них, предпочтительно используются Bacillus subtilis, Bacillus liqueniformis и Bacillus pumilus. Кроме того, после гуанозина, в качестве коринеформных бактерий используются бактерии, относящиеся к роду Corynebacterium, и среди них предпочтительно используется Corynebacterium glutamicum. После получения уридина или цитидина среди Bacillus subtilis предпочтительно используются бактерии, относящиеся к роду Bacillus, и среди них предпочтительно используется Bacillus subtilis.
Сепарация и очистка нуклеиновой кислоты, содержащейся в жидкости, фильтрованной через сепарационную мембрану 3, может проводиться комбинированием известных способов, таких как способ переработки с использованием ионообменной смолы, способ кристаллизации концентрационным охлаждением, способ мембранной сепарации и тому подобные. Для удаления примесей очистка может проводиться путем использования известного способа адсорбции активированным углем и способа рекомбинации.
После получения аминокислоты по настоящему изобретению предпочтительные примеры соответствующей аминокислоты включают: L-треонин, L-лизин, L-глутаминовую кислоту, L-триптофан,
L-изолейцин, L-глутамин, L-аргинин, L-аланин, L-гистидин,
L-пролин, L-фенилаланин, L-аспарагиновую кислоту, L-тирозин, метионин, серин, валин и лейцин.
Например, после получения L-треонина, в качестве микроорганизмов или культуральных клеток, могут использоваться бактерии, относящиеся к роду Escherichia, роду Providencia, Corynebacterium, Brevibacterium или Serratia. Среди них, в частности, примеры предпочтительных бактерий включают: Escherichia coli, Providencia rettgeri, Corynebacterium glutamicum, Brevibacterium flavum, Brevibacterium lactofermentum и Serratia marcescens.
В качестве микроорганизмов или культуральных клеток, используемых после получения L-лизина или L-глутаминовой кислоты, предпочтительно могут использоваться Corynebacterium glutamicum, Brevibacterium flavum или Brevibacterium lactofermentum.
В качестве микроорганизмов или культуральных клеток, используемых после получения L-триптофана, предпочтительно могут использоваться Corynebacterium glutamicum, Brevibacterium flavum, Brevibacterium lactofermentum, Bacillus subtilis, Bacillus amyloliquefaciens и Escherichia coli.
В качестве микроорганизмов или культуральных клеток, используемых после получения L-изолейцина, предпочтительно могут использоваться Corynebacterium glutamicum, Brevibacterium flavum, Brevibacterium lactofermentum или Serratia marcescens.
В качестве микроорганизмов или культуральных клеток, используемых после получения L-глутамина, предпочтительно могут использоваться Corynebacterium glutamicum, Brevibacterium flavum, Brevibacterium lactofermentum или Flavobacterium rigense.
В качестве микроорганизмов или культуральных клеток, используемых после получения L-аргинина, предпочтительно могут использоваться Corynebacterium glutamicum, Brevibacterium flavum, Serratia marcescens, Escherichia coli или Bacillus subtilis.
В качестве микроорганизмов или культуральных клеток, используемых после получения L-аланина, предпочтительно могут использоваться Brevibacterium flavum или Arthrobacter oxydans.
В качестве микроорганизмов или культуральных клеток, используемых после получения L-гистидина, предпочтительно могут использоваться Corynebacterium glutamicum, Brevibacterium flavum, Brevibacterium ammoniagenes, Serratia marcescens, Escherichia coli, Bacillus subtilis или Streptomyces coelicolor.
В качестве микроорганизмов или культуральных клеток, используемых после получения L-пролина, предпочтительно могут использоваться Corynebacterium glutamicum, Kurthia catenaforma, Serratia marcescens или Escherichia coli.
В качестве микроорганизмов или культуральных клеток, используемых после получения L-фенилаланина или L-тирозина, предпочтительно могут использоваться Corynebacterium glutamicum, Brevibacterium flavum, Brevibacterium lactofermentum или Escherichia coli.
В качестве микроорганизмов или культуральных клеток, используемых после получения L-аспарагиновой кислоты, предпочтительно могут использоваться Brevibacterium flavum, Bacillus megatherium, Escherichia coli или Pseudomonas fluorescens.
В качестве микроорганизмов или культуральных клеток, используемых после получения метионина, предпочтительно может использоваться Corynebacterium glutamicum.
В качестве микроорганизмов или культуральных клеток, используемых после получения серина, предпочтительно могут использоваться Corynebacterium glutamicum, Brevibacterium flavum, Brevibacterium lactofermentum или Arthrobacter oxydans.
В качестве микроорганизмов или культуральных клеток, используемых после получения валина, предпочтительно могут использоваться Brevibacterium lactofermentum, Serratia marcescens или Klebsiella pneumoniae.
В качестве микроорганизмов или культуральных клеток, используемых после получения лейцина, предпочтительно могут использоваться Corynebacterium glutamicum, Brevibacterium lactofermentum или Serratia marcescens.
В качестве микроорганизмов или культуральных клеток, используемых после получения описанных выше аминокислот, могут использоваться те, которые изначально имеют высокую способность продуцировать аминокислоты, могут быть выделены из натуральных источников, или микроорганизмы или культуральные клетки, полученные искусственным усилением продуктивной способности приведенных выше в качестве примеров микроорганизмов или культуральных клеток. Кроме того, могут использоваться те микроорганизмы или культуральные клетки, основные свойства которых частично модифицированы мутацией или генной рекомбинацией.
В качестве примеров микроорганизмов или культуральных клеток, основные свойства которых частично модифицированы, могут быть приведены Providencia rettgeri, у которой улучшена способность продуцировать L-треонин, описанная в документе JP-A No. 2-219582, и Corynebacterium glutamicum, у которой улучшена способность продуцировать L-аланин, описанная в заявке на патент Японии № 3-500486.
В следующем описании будет обсуждена пористая мембрана, которая предпочтительно используется в качестве сепарационной мембраны в настоящем изобретении.
В качестве пористой мембраны может использоваться пористая мембрана, в которой в качестве материала используется неорганический материал, такой как керамика, или органический материал, такой как смола, и предпочтительно используется пористая сепарационная мембрана, содержащая слой пористой смолы. Эта пористая мембрана имеет структуру, в которой слой пористой смолы, служащий в качестве сепарационного функционального слоя, образован на поверхности пористого материала основания. Пористый материал основания используется для поддержки слоя пористой смолы с тем, чтобы придать прочность сепарационной мембране. Слой пористой смолы может проникать или не проникать в пористый материал основания; однако с точки зрения прочности, предпочтительно используется мембрана, имеющая слой пористой смолы, проникающий в пористый материал основания.
Материал для пористого материала основания получают в виде органического материала и/или неорганического материала, и среди них предпочтительно используется органическое волокно. Предпочтительные пористые материалы основания составлены из ткани, не плетеной ткани или тому подобной ткани, сформированной использованием органических волокон, таких как волокна целлюлозы, волокна триацетата целлюлозы, полиэфирные волокна, полипропиленовые волокна и полиэтиленовые волокна. Среди них, предпочтительно используется не плетеная ткань, которая легко регулируется по ее плотности и может легко изготавливаться.
Слой пористой смолы функционирует в качестве сепарационного функционального слоя, как описано выше, и для этого слоя предпочтительно используется мембрана из органического полимера. Примеры материала для мембраны из органического полимера включают: смолу на основе полиэтилена, смолу на основе полипропилена, смолу на основе поливинилхлорида, смолу на основе поливинилидена, смолу на основе полисульфона, смолу на основе полиэфира, смолу на основе полиакрилонитрила, смолу на основе полиолефина, смолу на основе целлюлозы и смолу на основе триацетата целлюлозы. Мембрана из органического полимера может быть образована смесью, составленной главным образом из указанных смол. В этом случае, основной компонент относится к компоненту, который содержится в количестве 50% масс. или более, предпочтительно, 60% масс. или более. Среди них в качестве материала мембраны, образующего слой пористой смолы, предпочтительно используется смола на основе поливинилхлорида, смола на основе поливинилиденфторида, смола на основе полисульфона, смола на основе полиэфирсульфона, смола на основе полиакрилнитрила или смола на основе полиолефина, которая легко формируется в пленку использованием раствора, и превосходит по физической долговечности и химической устойчивости, и предпочтительнее используется смола на основе поливинилиденфторида, или смола на основе полиолефина, а наиболее предпочтительно, используется смола на основе поливинилиденфторида или смола, состоящая главным образом из него.
В качестве смолы на основе поливинилиденфторида, предпочтительно используется гомополимер винилиденфторида, и может также предпочтительно использоваться сополимер мономера на основе винила, сополимеризируемый с винилиденфторидом. Примеры мономера на основе винила, сополимеризируемого с винилиденфторидом, включают: тетрафторэтилен, гексафторпропилен и фторид-трихлорид этилена. Кроме того, в качестве смолы на основе полиолефина, предлагаются полиэтилен, полипропилен, хлорированный полиэтилен и хлорированный полипропилен, и предпочтительно используется хлорированный полиэтилен.
В следующем описании в виде примера будут обсуждаться общие характеристики способа образования пористой мембраны.
Во-первых, в отношении пористой мембраны, в следующем описании будут обсуждаться общие характеристики способа образования плоской мембраны. Плоская мембрана получается способами, при которых после образования на поверхности пористого материала основы пленки покрытия из образующего пленку основного раствора, содержащего смолу и растворитель, которые образуют слой пористой смолы (причем пористый материал основы импрегнирован образующим пленку основным раствором), только поверхность на стороне пленочного покрытия пористого материала основы выполнена для обеспечения ее контакта с содержащей осадитель баней с целью отверждения, с тем, чтобы обеспечить отверждение смолы для образования слоя пористой смолы на поверхности пористого материала основы. При этом средняя толщина пористого материала основы, которая выбирается, в зависимости от ее назначения, предпочтительно устанавливается в диапазоне от 50 мкм или более до 3000 мкм или менее, и средняя толщина пористого материала основы предпочтительнее устанавливается в диапазоне от 20 мкм или более до 5000 мкм или менее, наиболее предпочтительно, в диапазоне от 50 мкм или более до 2000 мкм или менее.
Затем, в следующем описании будут обсуждаться общие черты способа образования половолоконной мембраны. Половолоконная мембрана образуется способами, в которых образующий пленку основной раствор, состоящий из смолы и растворителя, которые образуют слой пористой смолы, подается из трубопровода наружу из наконечника двухтрубчатого типа, причем жидкость для образования полой части подается наружу из трубопровода внутри наконечника двухтрубчатого типа, и она охлаждается и отверждается в охлаждающей бане. При этом, внутренний диаметр полых волокон предпочтительно устанавливается в диапазоне от 200 мкм или более до 5000 мкм или менее, и толщина слоя пористой смолы предпочтительно устанавливается в диапазоне от 20 мкм или более до 2000 мкм или менее. Кроме того, имеющая трубчатую форму текстильная или трикотажная ткань, образованная органическими волокнами или неорганическими волокнами, может содержаться внутри полых волокон.
Полученная таким образом наружная поверхность половолоконной мембраны может быть покрыта (ламинирована) еще одним слоем пористой смолы. Такое наслоение слоя пористой смолы может проводиться с тем, чтобы модифицировать характеристики половолоконной мембраны, такие как гидрофильная характеристика, гидрофобная характеристика, диаметр ее пор или тому подобные, в желательные характеристики.
Слой пористой смолы, наслаиваемый на поверхность, может быть образован посредством способов, при которых основной раствор, образованный растворением смолы в растворителе, приводится в контакт с отверждающей баней, содержащей осадитель, для отверждения смолы. В качестве материала для наслаиваемой смолы, предпочтительно используется, например, такой же материал, как материал слоя пористой смолы. Кроме того, без конкретного ограничения, способ наслоения может осуществляться погружением половолоконной мембраны в основной раствор, или может проводиться нанесением основного раствора на поверхность половолоконной мембраны, и после наслоения, одна часть основного раствора может соскабливаться или сдуваться с использованием пневматического ножа с тем, чтобы можно было регулировать наслаиваемое количество.
Пористая мембрана, используемая в настоящем изобретении, предпочтительно сконструирована со средним диаметром пор в диапазоне от 0,01 мкм или более до 1 мкм или менее. Когда средний диаметр пор находится в диапазоне от 0,01 мкм или более до 1 мкм или менее, навряд ли происходит засорение вследствие микроорганизмов, используемых для ферментации, так что фильтрация может непрерывно поддерживаться в течение длительного времени. Кроме того, когда средний диаметр пор пористой мембраны находится в диапазоне от 0,01 мкм или более до 1 мкм или менее, можно обеспечить высокую скорость выталкивания, что может предотвратить утечку микроорганизмов или культуральных клеток, или может в течение длительного времени поддерживать свойство высокого проникновения воды.
В случае, когда диаметр пор близок к размеру микроорганизмов или культуральных клеток, то, поскольку они могут непосредственно забивать поры, то предпочтительно устанавливается средний диаметр пор пористой мембраны 1 мкм или менее. Кроме того, средний диаметр пор пористой мембраны предпочтительно устанавливается так, чтобы их размер был не слишком большим, по сравнению с размером микроорганизмов или культуральных клеток с тем, чтобы предотвратить возникновение таких проблем как утечка микроорганизмов или культуральных клеток, то есть снижение скорости выталкивания. По этой причине, в случае, когда среди микроорганизмов или культуральных клеток используются дрожжи, бактерии или тому подобные, размеры которых малы, то предпочтительно устанавливается диаметр пор 0,4 мкм или менее, предпочтительнее, 0,2 мкм или менее. Микроорганизмы или культуральные клетки могут иметь тенденцию к образованию вещества, отличного от целевого химического продукта, например, белков, полисахаридов или тому подобных, которые легко агрегируются, или может иметь место тенденция к образованию фрагментов клеток вследствие гибели микроорганизмов или культуральных клеток в культуральной жидкости. Во избежание засорения пористой мембраны, вызванного этими веществами, предпочтительнее устанавливается средний диаметр пор 0,1 мкм или менее.
На основании описанных выше фактов, предпочтительно устанавливается средний диаметр пор 0,4 мкм или менее, предпочтительнее, 0,2 мкм или менее, наиболее предпочтительно, 0,1 мкм или менее.
Напротив, в случае, когда средний диаметр пор слишком мал, снижается свойство пропускания воды, что вызывает недостаточно эффективный процесс продвижения фильтруемой жидкости, даже когда мембрана не засорена, и поэтому предпочтительно устанавливается средний диаметр пор пористой мембраны по настоящему изобретению, равный 0,01 мкм или более. Предпочтительнее, устанавливается средний диаметр пор, равный 0,02 мкм или более, наиболее предпочтительно, 0,04 мкм или более.
В этом случае, средний диаметр пор может быть получен способами измерения, при которых под контролем сканирующего электронного микроскопа при увеличении в 10000 раз, измеряются и усредняются все диаметры пор, наблюдаемых в пределах диапазона 9,2 мкм × 10,4 мкм. В случае, когда поры не образуют правильный круг, то устройство обработки изображения или ему подобное находит круг, имеющий такую же площадь (эквивалентный круг), как площадь, которую имеет каждая пора, и диаметр эквивалентного круга определяется как диаметр поры.
Сепарационная мембрана, используемая в настоящем изобретении, улучшается по мере того как стандартное отклонение σ диаметров пор делается меньше, то есть, она улучшается по мере сужения распределения размеров диаметров пор. Распределение размеров диаметров пор предпочтительно сужается так, что предпочтительно устанавливается стандартное отклонение, равное 0,1 мкм или менее. Когда стандартное отклонение диаметров пор делается меньше, то есть, когда размеры диаметров пор делаются более однородными, можно получить фильтрованную жидкость, имеющую однородные характеристики, а также содействовать приводному управлению аппаратом.
Стандартное отклонение σ диаметров пор рассчитывается следующим (уравнением 5), в котором, при допуске, что число пор, наблюдаемых в пределах диапазона 9,2 мкм × 10,4 мкм, равно N, предполагается, что измеренные таким образом соответствующие диаметры равны Xk и предполагается, что средняя величина диаметров пор равна X(ave).
Уравнение 5
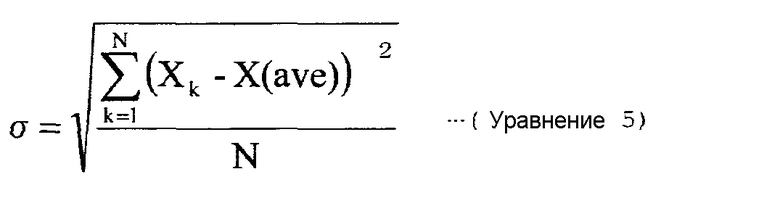
В сепарационной мембране, используемой в настоящем изобретении, проницаемость культуральной жидкости, содержащей химический продукт, образует один из критических факторов, и коэффициент проницаемости чистой воды сепарационной мембраны перед использованием может применяться в качестве показателя проницаемости. В настоящем изобретении, предпочтительно устанавливается коэффициент проницаемости сепарационной мембраны для чистой воды, равный 1×10-10 м3/м2·с·Па или более при расчете с использованием очищенной воды, имеющей температуру 25°С, полученной после прохождения через мембраны обратного осмоса. Причем количество проникающей воды измеряется при высоте напора 1 м. Кроме того, для получения достаточного количества фильтрованной жидкости при практическом использовании, предпочтительно устанавливается коэффициент проницаемости сепарационной мембраны для чистой воды в диапазоне от 2×10-9 м3/м2·с·Па или более до 6×10-7 м3/м2·с·Па или менее, предпочтительнее, от 2×10-9 м3/м2·с·Па или более до 2×10-7 м3/м2·с·Па или менее.
Шероховатость поверхности сепарационной мембраны, используемой в настоящем изобретении, составляет фактор, который влияет на засорение сепарационной мембраны. Для снижения коэффициента отслоения и сопротивления сепарационной мембраны с тем, чтобы получить химический продукт при более низкой трансмембранной разности давления, предпочтительно устанавливается шероховатость сепарационной мембраны, равная 0,1 мкм или менее. Для стабильного получения химического продукта подавлением засорения, шероховатость поверхности предпочтительно делается насколько возможно маленькой.
Кроме того, шероховатость поверхности мембраны составляет один из факторов, который обеспечивает возможность легкого отслаивания микроорганизмов или культуральных клеток, прилипших к поверхности сепарационной мембраны, под воздействием промывания поверхности потоком жидкости от перемешивающего или циркуляционного насоса. С этих точек зрения также, шероховатость поверхности сепарационной мембраны делается насколько возможно маленькой, и предпочтительнее устанавливается на уровне 0,1 мкм или менее. В случае, когда шероховатость поверхности составляет 0,1 мкм или менее, то микроорганизмы или культуральные клетки, прилипшие к мембране, можно легко отслоить.
Кроме того, путем установки шероховатости поверхности пористой мембраны на 0,1 мкм или менее, можно уменьшить силу сдвига, оказываемую на поверхность мембраны при фильтрации микроорганизмов или культуральных клеток, что приводит к подавлению повреждений микроорганизмов или культуральных клеток. В результате, засорение сепарационной мембраны может подавляться с тем, чтобы в течение длительного времени мог проводиться стабильный процесс фильтрации.
В этом случае, шероховатость поверхности мембраны относится к средней величине микроскопических выступов на поверхности мембраны в направлении, перпендикулярном направлению поверхности мембраны, и, как описано ниже, она может быть измерена использованием атомно-силового микроскопа (AFM).
- Устройство: атомно-силовой микроскоп (Nanoscope IIIa, выпускаемый компанией Digital Instruments Co., Ltd)
- Условия: датчик SiN Cantilever (выпускаемый компанией Digital Instruments Co., Ltd)
: Режим сканирования: Контактный режим (измерение в воздухе)
Режим погружения в воду (измерение в воде)
: Диапазон сканирования 10 мкм, 25 мкм в прямоугольной зоне (измерение в воздухе)
5 мкм, 10 мкм в прямоугольной зоне (измерение в воде)
: Разрешение сканирования 512×512
- Получение образца: после измерения, образец мембраны погружали в этанол при нормальной температуре на 15 минут, и после погружения в RO воду на 24 часа для промывания, полученный образец сушили на воздухе и использовали. RO вода относится к воде, профильтрованной с использованием мембраны обратного осмоса (RO мембрана), которая представляет собой один тип фильтрационной мембраны, используемой для удаления из воды таких примесей как ионы и соли. Размер пор RO мембраны составляет примерно 2 нм или менее.
Шероховатость поверхности мембраны drough рассчитывается следующим (уравнением 6), на основании высоты в направлении Z-оси каждой из точек, измеренной AFM.
Уравнение 6
drough: Шероховатость поверхности (мкм)
Zn: Высота в направлении Z-оси (мкм)
Z^ Средняя высота в диапазоне сканирования (мкм)
N: Число измеренных образцов
Указанная выше сепарационная мембрана может быть по желанию спрофилирована в желательную форму в соответствии с формой резервуара мембранной сепарации и может использоваться. Например, в случае сепарационной мембраны плоского типа, путем ее комбинирования с опорным элементом, полученным отдельно, может быть получен элемент сепарационной мембраны, показанный на фиг. 3. Кроме того, в отношении половолоконной мембраны, путем связывания и герметизации полой части использованием элемента, выполненного из смолы или тому подобного материала, может быть получен элемент сепарационной мембраны, показанный на фиг. 4. В настоящем изобретении, с точки зрения того, что преимущественно производится установка площади мембраны на объем, предпочтительно используется половолоконная мембрана.
Со ссылкой на чертежи, в следующем описании будут обсуждаться общие черты элемента в виде сепарационной мембраны.
Фиг. 3 представляет собой схематический вид в перспективе, который объясняет один вариант осуществления элемента в виде сепарационной мембраны, в котором используется сепарационная мембрана плоского типа. Как показано на фиг. 3, элемент сепарационной мембраны имеет структуру, в которой на обеих поверхностях поддерживающей планки 18, имеющей жесткость, в указанном порядке размещены элемент водовода 19 и сепарационная мембрана 20. Поддерживающая планка 18 имеет вогнутый отдел 21 на каждой из обеих поверхностей. Сепарационная мембрана 20 фильтрует культуральную жидкость. Водовод 19 используется для пропускания фильтрующейся жидкости через сепарационную мембрану 20 для эффективного потока на поддерживающую планку 18. Содержащая химический продукт фильтрующаяся жидкость, текущая на поддерживающую планку 18, может проходить через вогнутый отдел 21 поддерживающей планки и отбираться из аппарата для непрерывной ферментации через трубопровод сбора жидкости 22, служащий в качестве средства слива. В этом случае, может использоваться способ, в котором используется разность давления уровня воды, насос и фильтрация отсасыванием с использованием жидкости, газа или тому подобной среды, или способ повышения давления внутри аппаратной системы или тому подобный способ может использоваться в качестве движущей силы для забора фильтрованной жидкости.
Кроме того, в случае, когда необходимо увеличение площади мембраны с тем, чтобы она соответствовала ферментационному резервуару, эти элементы сепарационной мембраны могут наслаиваться для увеличения площади мембраны.
Фиг. 4 представляет собой схематический вид в перспективе, показывающий элемент сепарационной мембраны половолоконного типа, который главным образом состоит из поддерживающей планки 18, сепарационной мембраны 20 половолоконного типа, верхнего смоляного герметизирующего слоя 23 и нижнего смоляного герметизирующего слоя 24. Сепарационные мембраны 20, которые сформированы в пучок, связаны и фиксированы к поддерживающей планке 18 верхним смоляным герметизирующим слоем 23 и нижним смоляным герметизирующим слоем 24. Полая часть каждой сепарационной мембраны 20 половолоконного типа герметизируется нижним смоляным герметизирующим слоем 24, связанным и фиксированным к ней с тем, чтобы предотвращалась утечка культуральной жидкости. Напротив, полая часть каждой сепарационной мембраны 20 половолоконного типа не герметизируется верхним смоляным герметизирующим слоем 23, причем полая часть может сообщаться с трубопроводом сбора жидкости 22. Этот элемент сепарационной мембраны может быть установлен в аппарат для непрерывной ферментации использованием поддерживающей планки 18. Фильтрованная жидкость, прошедшая через сепарационную мембрану 20, может проходить через полую часть половолоконной мембраны и отводиться из аппарата для непрерывной ферментации через трубопровод сбора жидкости 22. В качестве движущей силы для забора фильтрованной жидкости может использоваться способ, в котором используется разность давления уровня воды, насос и фильтрация отсасыванием с использованием жидкости, газа или тому подобной среды, или способ повышения давления внутри аппаратной системы или тому подобный.
Резервуар мембранной сепарации 2, обеспеченный сепарационными мембранами, желательно подвергается стерилизации паром под высоким давлением, и при этом можно избежать загрязнения резервуара различными бактериями. Стерилизация паром под высоким давлением по настоящему изобретению относится к способу, с помощью которого микроорганизмы или культуральные клетки, которые присутствуют в резервуаре, стерилизуются нагреванием и повышением давления в резервуаре мембранной сепарации с использованием пара. В качестве условий нагревания и повышения давления, предпочтительно повышать давление и нагревать резервуар, например, при 121,1°С при давлении пара, равном 1 атмосферному давлению, в течение 20 минут или более. Поэтому, резервуар мембранной сепарации 12 аппарата для непрерывной ферментации, сепарационные мембраны, помещенные в резервуар мембранной сепарации 12, и составляющие элемент детали предпочтительно получаются в виде элементов, которые устойчивы к операциям стерилизации паром под высоким давлением в указанных условиях. Таким образом, может стерилизоваться внутренняя структура ферментационного резервуара, включая элемент сепарационной мембраны. Когда поддерживается стерилизуемое состояние внутренней структуры ферментационного резервуара, можно избежать риска загрязнения нежелательными микроорганизмами при непрерывной ферментации, и, следовательно, стабильным образом проводить непрерывную ферментацию.
Сепарационная мембрана и элементы, такие как поддерживающая планка, которые составляют элемент сепарационной мембраны, предпочтительно выполнены устойчивыми к условиям, например, температуры 121,1°С при давлении пара, равном 1 атмосферному давлению, в течение 20 минут или более, которые являются условиями операций стерилизации паром под высоким давлением, и пока эти условия выполняются, виды сепарационной мембраны и составных элементов мембраны конкретно не ограничиваются. В качестве материала для сепарационной мембраны, обладающего такой устойчивостью, могут использоваться указанные выше материалы для пористой мембраны. Кроме того, в качестве составных элементов для поддерживающей планки или тому подобных элементов, могут быть предпочтительно выбраны и использоваться, например, металл, такой как нержавеющая сталь и алюминий, или смолы, такие как смола на основе полиамида, смола на основе фтора, смола на основе поликарбоната, смола на основе полиацеталя, смола на основе полибутилентерефталата, PVDF (поливинилиденфторид), смола на основе модифицированного эфира полифенилена и смолы на основе полисульфона.
Примеры
В следующем описании настоящее изобретение будет детально обсуждено со ссылкой на примеры и сравнительные примеры.
Конкретнее, примеры 1-9 и сравнительные примеры 1-4 объясняют непрерывное получение химического продукта, которое проводится с использованием аппарата для непрерывной ферментации, показанного на любой из фиг. 2, 7, 9 и 13-16, на которых L-молочная кислота была выбрана в качестве химического продукта, дрожжи (эталонный пример 1), способные продуцировать L-молочную кислоту, использовали в качестве микроорганизма или культуральных клеток, и пористая мембрана (плоская мембрана: эталонный пример 2) была выбрана в качестве сепарационной мембраны.
Кроме того, пример 10 и сравнительный пример 5 объясняют непрерывное получение химического продукта, которое проводится с использованием аппарата для непрерывной ферментации, показанного на фиг. 2, в котором кадаверин (1,5-пентадиамин) был выбран в качестве химического продукта, микроорганизм, способный продуцировать кадаверин, использовали в качестве микроорганизма или культуральных клеток, и пористая мембрана (плоская мембрана: эталонный пример 2) была выбрана в качестве сепарационной мембраны.
Кроме того, пример 11 и сравнительный пример 6 объясняют непрерывное получение химического продукта, которое проводится с использованием аппарата для непрерывной ферментации, показанного на фиг. 2, в котором L-лизин был выбран в качестве химического продукта, микроорганизм, способный продуцировать L-лизин, использовали в качестве микроорганизма или культуральных клеток, и пористая мембрана (плоская мембрана: эталонный пример 2) была выбрана в качестве сепарационной мембраны.
В каждом из указанных примеров, двухпозиционный клапан использовали в качестве средства регуляции количества протекающей культуральной жидкости 25 с тем, чтобы регулировать количество протекающей культуральной жидкости и давление культуральной жидкости, текущей в резервуар мембранной сепарации.
Однако эти примеры используются для объяснения некоторых типов настоящего изобретения, и настоящее изобретение не ограничивается этими примерами.
Эталонный пример 1. Получение штамма дрожжей (штамма SU014), способного продуцировать молочную кислоту
В настоящем примере дрожжи, в которые ген L-ldh, полученный из Xenopus Laevis, имеющий основную последовательность, показанную в SEQ ID NO: 1, был введен ниже по ходу транскрипции промотера PDC1, использовали в качестве дрожжей, способных продуцировать молочную кислоту. Клонирование гена L-ldh, полученного из Xenopus Laevis, проводили с использованием способа PCR (полимеразной цепной реакции). При PCR, в качестве амплификационной системы использовали фагемидную ДНК, полученную в соответствии с прилагаемым протоколом библиотеки почечной кДНК Xenopus Laevis (выпускаемую STRATAGENE Corporation).
При реакции амплификации PCR, использовали полимеразу KOD-Plus (выпускаемую Toyobo Co., Ltd.), а также использовали прилагаемый реакционный буфер, dNTPmix (смесь дезоксинуклеозидтрифосфатов) и тому подобные. Фагемидную ДНК, доведенную в соответствии с прилагаемым протоколом, описанным выше, загружали в реакционную систему, в количестве 50 мкл для установки концентрации 50 нг/образец, в нее загружали праймер для установки концентрации 50 пкмоль/образец, а также в нее загружали KOD-Plus полимеразу для установки ее концентрации 1 единица/образец. После термической денатурации реакционного раствора амплификатором PCR iCycler (выпускаемым Bio-Rad Laboratories, Inc.) при температуре 94°С в течение 5 мнут, полученный раствор подвергали 30 циклам термической денатурации при 94°С в течение 30 секунд, отжигу праймера при 55°С в течение 30 секунд и удлинению комплементарной нити при 68°С в течение 1 минуты, и затем охлаждали до температуры 4°С. Кроме того, реакцию проводили так, чтобы праймер амплификации гена (SEQ ID NOs: 2 и 3), последовательность распознавания SalI и последовательность распознавания NotI были соответственно добавлены на 5-концевой стороне и 3-концевой стороне.
Амплифицированный PCR фрагмент очищали, и после того как его концы фосфорилировали Т4 полинуклеотид-киназой (выпускаемой компанией Takara Bio Inc.), полученный фрагмент лигировали вектором pUC118 (который разрезали рестрикционным ферментом HincII, причем отрезанную поверхность подвергали обработке дифосфорилированием). Лигирование проводили использованием набора для лигирования ДНК DNA Ligation Kit Ver. 2 (выпускаемого компанией Takara Bio Inc.). Раствор для лигирования трансформировали в компетентные клетки DH5α Escherichia coli (выпускаемые компанией Takara Bio Inc.), и их рассеивали на чашки с агаром LB, содержащие 50 мкг/мл антибиотика ампициллина, и культивировали в течение ночи. Из выращенной таким образом колонии собирали плазмидную ДНК с использованием препаративного мини-набора и расщепляли рестрикционными ферментами SalI и NotI с тем, чтобы была выбрана плазмида, в которую был вставлен ген ldh, полученный из Xenopus Laevis. Ряд этих операций проводили в соответствии с прилагаемым протоколом.
Вектор pUC118, в который был вставлен ген L-ldh, полученный из Xenopus Laevis, был расщеплен рестрикционными ферментами SalI и NotI с тем, чтобы фрагмент ДНК был отделен электрофорезом в 1% агарозном геле, и фрагмент, содержащий ген L-ldh из Xenopus Laevis, очищали использованием обычного способа. Фрагмент, содержащий ген L-ldh, лигировали XhoI/NotI расщепленной частью вектора экспрессии pTRS11, показанного на фиг. 5, и путем использования того же способа, который описан выше, собирали плазмидную ДНК и расщепляли рестрикционными ферментами SalI и NotI с тем, чтобы была выбрана плазмида, в которую был вставлен ген ldh, полученный из Xenopus Laevis. Далее, образованный таким образом вектор экспрессии, с которым комбинировался ген ldh из Xenopus Laevis, именуется pTRS102.
Путем использования pTRS102 в качестве амплификационной системы, PCR фрагмент, содержащий 1,3 тысячи пар оснований (т.п.о.), включающий ген ldh из Xenopus Laevis и терминаторную последовательность TDH3, был амплифицирован PCR, в которой олигонуклеотид (SEQ ID NOs: 4 и 5) использовали в качестве набора праймеров. В этом случае, последовательность, показанная в SEQ ID NO: 4, была сконструирована так, чтобы могла быть добавлена последовательность, соответствующая 60 тысячам пар оснований, выше по ходу транскрипции от стартового кодона гена PDC1.
Затем, путем использования плазмиды pRS424 в качестве амплификационной системы, PCR фрагмент, содержащий 1,2 т.п.о., включающий ген TRP1, который служит в качестве селекционного маркера дрожжей, амплифицировали PCR, при которой олигонуклеотид (SEQ ID NOs: 6 и 7) и использовали в качестве набора праймеров. В этом случае, последовательность, показанная в SEQ ID NO: 7, была сконструирована так, чтобы могла быть добавлена последовательность, соответствующая 60 т.п.о., ниже по ходу транскрипции от терминирующего кодона гена PDC1.
Соответствующие фрагменты ДНК были отделены электрофорезом на 1% агарозном геле и очищены использованием обычного способа. Полученную таким образом смесь фрагмента, содержащего 1,3 т.п.о., и фрагмента, содержащего 1,2 т.п.о., использовали в качестве амплификационной системы; PCR фрагмент, содержащий примерно 2,5 т.п.о., в котором ген L-1dh из Xenopus Laevis, в 5-конец и 3-конец которого выше и ниже по ходу транскрипции были добавлены соответствующие последовательности, содержащие 60 т.п.о. гена PDC1, терминатор TDH3 и ген TRP1 были соединены друг с другом, был амплифицирован способом PCR, при котором олигонуклеотид (SEQ ID Ns: 4 и 7) использовали в качестве набора праймеров.
PCR фрагмент отделяли электрофорезом на 1% агарозном геле. После очистки обычном способом, полученный фрагмент трансформировали в штамм NBRC10505 дрожжей Sacсharomyces и культивировали на не содержащей триптофан среде с тем, чтобы был выбран трансформированный штамм, в который ген L-1dh из Xenopus Laevis был введен ниже по ходу транскрипции промотера гена PDC1 на хромосоме.
Было подтверждено, что полученный таким образом трансформированный штамм представляет собой дрожжи, в которых ген L-1dh Xenopus Laevis был введен ниже по ходу транскрипции промотера гена PDC1 на хромосоме следующим образом. Во-первых, геномную ДНК трансформированного штамма получали использованием набора экстракции гена ДНК «Gentorukun» (зарегистрированная торговая марка) (выпускаемый компанией Takara Bio Inc.), и было подтверждено, что путем использования этой геномной ДНК в качестве амплификационной системы, амплифицированный фрагмент ДНК, содержащей 2,8 т.п.о., был получен PCR, в которой олигонуклеотид (SEQ ID NO: 8 и 9) использовали в качестве праймера. Кроме того, в не трансформированном штамме амплифицированный фрагмент ДНК, содержащей 2,1 т.п.о., был получен указанной выше PCR. В следующем описании, трансформированный штамм, в котором ген L-1dh из Xenopus Laevis введен ниже по ходу транскрипции промотера гена PDC1 на хромосоме, именуется штаммом B2. Последовательности на находящейся выше по ходу транскрипции и ниже по ходу транскрипции стороне гена PDC1 могут быть получены по базе данных генома Saccharomyces Genome Database ().
Затем штамм SW015 дрожжей, в котором ген pdc1 замещен маркером TRP1, при гене pdc5, имеющем термочувствительную мутацию, описанный в заявке на Международный патент WO2007/097260, был объединен со штаммом B2, полученным, как описано выше, так что была получена диплоидная клетка. Диплоидная клетка была сформирована в аск на среде образования аска. Аск рассекали микроманипулятором для получения моноплоидных клеток, и исследовали ауксотропию каждой моноплоидной клетки. Среди приобретенных моноплоидных клеток, были выбраны штаммы, имеющие ген 1dh из Xenopus Laevis, вставленный в локус гена pdc1, причем ген pdc5 был подвергнут термочувствительной мутации (неспособности роста при 34ºС). Полученный таким образом штамм дрожжей был определен как штамм SU014.
Кроме того, для определения, обладает ли штамм SU014 способностью продуцировать молочную кислоту, проводили измерения способом ВЭЖХ в следующих условиях для подтверждения, задерживается ли какое-либо количество молочной кислоты в надосадочной жидкости культуральной среды, в которой трансформированные клетки культивировали в среде SWC (METHODS IN YEAST GENETICS 2000 EDITION, CSHL PRESS).
Колонка: Shim-Pack SPR-H (выпускаемая Shimadzu Corporation)
Подвижная фаза: п-толуолсульфоновая кислота 5 мМ (скорость потока: 0,8 мл/мин)
Реакционный раствор: п-толуолсульфоновая кислота 5 мМ, бис/трис 20 мМ, 0,1 мМ EDTA·2Na (скорость потока: 0,8 мл/мин)
Способ выявления: Электрическая проводимость
Температура: 45°С
Кроме того, измерения оптической чистоты L-молочной кислоты проводили методом ВЭЖХ в следующих условиях:
Колонка: TSK-gel Enantio LI (выпускаемая Tosoh Corporation)
Подвижная фаза: Водный раствор сульфата меди 1 мМ
Скорость потока: 1,0 мл/мин
Способ выявления: УФ 254 нм
Температура: 30°С
Кроме того, рассчитывали оптическую чистоту L-молочной кислоты следующим уравнением:
Оптическая чистота (%)=100×(L-D)/(L+D)
В этом случае, L представляет концентрацию L-молочной кислоты, и D представляет концентрацию D-молочной кислоты.
В результате анализа ВЭЖХ, была выявлена L-молочная кислота, и количество D-молочной кислоты было на пределе выявления или менее. На основании описанных выше исследований, было подтверждено, что указанный штамм SU014 обладал способностью продуцировать L-молочную кислоту.
Эталонный пример 2. Получение пористой плоской мембраны
Поливинилиденфторидную (PVDF) смолу, используемую в качестве смолы, и N,N-диметилацетамид (DMAc), используемый в качестве растворителя, тщательно перемешивали при температуре 90°С для получения следующего основного раствора:
- PVDF: 13,0% масс.
- DMAc: 87,0% масс.
После того как указанный выше основной раствор охлаждали до температуры 25°С, его наносили на не плетеную ткань (пористый материал основы), выполненную из полиэфирных волокон, имеющих плотность 0,48/см3, и толщину 220 мкм, которая была предварительно фиксирована на стеклянной пластине, и затем немедленно погружали в отверждающую баню, имеющую следующую композицию при температуре 25°С на 5 минут для получения пористой мембраны со слоем пористой смолы, образованным на пористом материале основы.
- Вода: 30,0% масс.
- DMAc: 70,0% масс.
После отслоения пористой мембраны от стеклянной пластины, полученную мембрану погружали в горячую воду при температуре 80°С три раза для вымывания DMAc, посредством этого получая сепарационную мембрану (пористую мембрану). Поверхность слоя пористой смолы в пределах диапазона 9,2 мкм × 10,4 мкм рассматривали под сканирующим электронным микроскопом при увеличении в 10000 раз; средняя величина диаметров всех наблюдавшихся пор составила 0,1 мкм. Затем, оценивали коэффициент фильтрации чистой воды сепарационной мембраны для получения величины 50×10-9 м3/м2·с·Па. Измерения количества фильтрованной чистой воды проводили путем использования чистой воды при температуре 25°С, полученной из мембраны обратного осмоса, при высоте напора 1 м. Кроме того, стандартное отклонение диаметров пор составило 0,035 мкм, а шероховатость поверхности мембраны составила 0,06 мкм.
Пример 1
Путем использования штамма SU014, полученного в эталонном примере 1, проводили непрерывную ферментацию с помощью аппарата для непрерывной ферментации, показанного на фиг. 2, для получения L-молочной кислоты. В этом случае, в качестве культуральной среды, использовали сахарную культуральную среду (60 г/л Yutosei (торговое название, выпускаемая Muso Co., Ltd.), 1,5 г/л сульфата аммония). Эту необработанную сахарную культуральную среду подвергали обработке паровой стерилизацией под высоким давлением (2 атмосферы) при температуре 121°С в течение 15 минут и использовали. В качестве элемента в виде сепарационной мембраны, использовали формованное изделие, составленное из нержавеющей стали и полисульфоновой смолы, и пористую плоскую мембрану, полученную в эталонном примере 2, использовали в качестве сепарационной мембраны. В качестве насоса 5 внутри трубопровода переноса жидкости 17, использовали насос диафрагменного типа “APLS-20” (выпускаемый TACMINA Corporation), а в качестве насоса 4, используемого для отсоса фильтрованной жидкости из резервуара мембранной сепарации, использовали перистальтический насос. В экспериментах были установлены следующие рабочие условия:
Емкость ферментационного резервуара: 20 л
Используемая сепарационная мембрана: фильтрационная мембрана из PVDF (полученная в эталонном примере 2)
Емкость резервуара мембранной сепарации: 5 л
Эффективная площадь фильтрации элемента в виде сепарационной мембраны: 4000 см2
Установка температуры: 32°С
Количественная характеристика тяги в ферментационном резервуаре: воздух 1 л/мин
Скорость перемешивания содержимого ферментационного резервуара: 100 об/мин
Установка рН: рН 5 устанавливали использованием 8N гидроксида кальция
Скорость подачи среды: регулируется с возможностью изменения датчиком уровня 12 внутри ферментационного резервуара
Стерилизация: стерилизация сжатым паром при 121°С при 0,2 МПа в течение 20 минут всех компонентов - резервуара мембранной сепарации, ферментационного резервуара и используемой среды
Количество жидкости, протекающей через насос 4: 3 л/ч
Максимальный внутренний диаметр трубопроводов переноса жидкости 15, 17: 50 мм
Производительность насоса 5: 5 л/мин
Линейная скорость в трубопроводах переноса жидкости 15, 17: 4,2 см/с
Поток: 0,180 м/день
Процентная доля извлечения: не регулируется (1% или менее)
В качестве предварительной культуры, штамм SU014 подвергали встряхиванию в культуре в течение ночи (первоначально проводили первичное предварительное культивирование) на 5 мл сырьевой сахарной среды в пробирке. Полученную таким образом культуральную жидкость инокулировали в 100 мл сырьевой сахарной среды и подвергали культивированию со встряхиванием в 500-мл колбе Sakaguchi при 30°С в течение 24 часов (перед этим проводили предварительное культивирование). Полученную культуральную жидкость инокулировали в 1000 мл свежей сырьевой сахарной среды и подвергали культивированию со встряхиванием в 3000-мл колбе Sakaguchi при 30°С в течение 24 часов (перед этим проводили предварительное культивирование).
Эту предварительную культуру инокулировали в сырьевую сахарную среду с общим объемом 20 л в ферментационном резервуаре 1 и внутрь резервуара мембранной сепарации, и содержимое внутри ферментационного резервуара перемешивали прилагаемой к нему мешалкой, и устанавливали желаемое количество продувающего воздуха, температуру и рН, и после 50 часов культивирования, насос 4 включали для того, чтобы отсосать фильтрованную жидкость, содержащую L-молочную кислоту. При этом, давление культивируемой жидкости, втекающей в резервуар мембранной сепарации 2, измеряли один раз в день, и средство регуляции количества текущей жидкости 25 (двухпозиционный клапан), присоединенное к обводному трубопроводу, манометр, устанавливали на 0,1 МПа.
После 250 часов культивирования, измеряли мутность суспензии дрожжей в ферментационном резервуаре, концентрацию молочной кислоты в качестве продукта в фильтрованной жидкости и концентрацию сахара, а также рассчитывали выход молочной кислоты на потребленное количество сахара. Полученные результаты показаны на фиг. 10 и в таблице 1. Кроме того, концентрацию молочной кислоты измеряли способом, показанным в эталонном примере 1. Мутность суспензии дрожжей измеряли фотометром на основании поглощения света при 600 нм. Кроме того, выход молочной кислоты на потребленное количество сахара относится к отношению массы полученной молочной кислоты к массе потребленного сахара, и рассчитывается по следующему уравнению 7.
Уравнение 7

Концентрацию сахара измеряли способом ВЭЖХ в следующих условиях:
Колонка: Luna NH2 250×4,6 мм (выпускаемая Phenomenex Co., Ltd.)
Подвижная фаза: 0,6 мл/мин
Способ выявления: RI (дифференциальный рефрактометр)
Реакция: 4
Полярность: +
Температура: 30°С
Сравнительный пример 1
Непрерывную ферментацию проводили таким же образом как в примере 1, за исключением того, что использовали аппарат для непрерывной ферментации, показанный на фиг. 9, и измеряли мутность суспензии дрожжей и концентрацию молочной кислоты в качестве продукта. Аппарат, показанный на фиг. 9, имел такую же конструкцию, как конструкция аппарата, показанного на фиг. 2, за исключением того, что в него не были установлены: обводной трубопровод 26, средство регуляции количества текущей жидкости 25 и запорные клапаны резервуара мембранной сепарации 27 и 28.
Результаты показаны на фиг. 11 и в таблице 1. Кроме того, измеряли давление культуральной жидкости, подаваемой в резервуар мембранной сепарации, во время непрерывной ферментации, и результаты показаны на фиг. 12.
В сравнительном примере 1, поскольку не производили регулирование давления культуральной жидкости, подаваемой в резервуар мембранной сепарации, во время непрерывной ферментации давление колебалось и достигало 1 МПа или более через 250 часов с начала ферментации, как показано на фиг. 12. Кроме того, и мутность суспензии дрожжей, и концентрация получаемой молочной кислоты были ниже, чем указанные параметры примера 1, и выход молочной кислоты на потребленное количество сахара после 250 часов непрерывной ферментации составил 63%.
Как описано выше, путем регулирования потока культуральной жидкости в резервуар мембранной сепарации с помощью обводного трубопровода 26 и средства регуляции количества текущей жидкости 25, были подтверждены неожиданные эффекты, такие как высокая концентрация ферментации дрожжей, повышение концентрации молочной кислоты (химического продукта) и увеличение выхода молочной кислоты на потребленное количество сахара.
Пример 2
Путем использования аппарата непрерывной ферментации и культуральной жидкости после ферментации по примеру 1, жидкость пропускали в течение 2 часов через насосы с тем, чтобы измерить количества бактерий, которые в виде осадка накопились внутри трубопроводов, при каждой линейной скорости потока в трубопроводах циркуляции, установленной на 0,5, 1,5 и 2,5 см/сек. Результаты измерений показаны на фиг. 6. На основании этого, можно сказать, что путем установки величины линейной скорости культуральной жидкости внутри трубопроводов циркуляции 2,5 см/сек или более, можно обеспечить возможность циркуляции культуральной жидкости, не вызывая осаждения бактерий внутри трубопроводов.
Пример 3
Непрерывную ферментацию проводили таким же образом, как в примере 1, за исключением того, что производительность насоса 5 изменяли до 10 л/мин. После 100 часов культивирования, а также после 250 часов культивирования, измеряли мутность суспензии дрожжей, концентрацию молочной кислоты в качестве продукта в фильтрационной жидкости и концентрацию сахара в ферментационном резервуаре, а также рассчитывали выход молочной кислоты на потребленное количество сахара. Результаты показаны в таблице 1.
В случае, показанном в примере 3, концентрация молочной кислоты и выход молочной кислоты на потребленное количество сахара были несколько снижены, по сравнению с указанными показателями в примере 1. Это, возможно, было связано с изменением состояния смешивания жидкостей в ферментационном резервуаре вследствие увеличения количества циркулирующей жидкости в потоке (насос 5).
Сравнительный пример 2
Непрерывную ферментацию проводили таким же образом как в примере 3, за исключением того, что использовали аппарат непрерывной ферментации, показанный на фиг. 9.
Поскольку в сравнительном примере 2, давление культуральной жидкости, подаваемой в резервуар мембранной сепарации, не регулировалось, то давление внутри резервуара мембранной сепарации увеличивалось во время непрерывной ферментации, и через 70 часов после начала ферментации, оно достигало 1 МПа или более. При дальнейшей работе системы, начиналась утечка культуральной жидкости из резервуара мембранной сепарации, приводя к отказу системы при дальнейшем продолжении непрерывной ферментации.
По результатам примера 3 и сравнительного примера 2, было установлено, что обводной трубопровод 26 не вызвал бы отказа при непрерывной ферментации, а путем регулирования потока культуральной жидкости, поступающей в резервуар мембранной сепарации использованием средства регуляции количества протекающей жидкости 25, присоединенного к обводному трубопроводу 26, может быть получен эффект стабильного осуществления непрерывной ферментации.
Пример 4
Непрерывную ферментацию проводили таким же образом как в примере 3, за исключением того, что использовали аппарат непрерывной ферментации, показанный на фиг. 7, производительность насоса 5 устанавливали на 5 л/мин, а производительность насоса 16 устанавливали на 10 л/мин.
После 100 часов культивирования, а также после 250 часов культивирования, измеряли мутность суспензии дрожжей, концентрацию молочной кислоты в качестве продукта в фильтрационной жидкости и концентрацию сахара в ферментационном резервуаре, а также рассчитывали выход молочной кислоты на потребленное количество сахара. Результаты показаны в таблице 1.
В результате, даже когда в примере 1 количество циркулирующей протекающей жидкости увеличивали таким же образом как в примере 3 насосом 16 путем регулирования количества потока жидкости, возвращаемой в ферментационный резервуар насосом 16, появлялась возможность получения такой же концентрации молочной кислоты, мутности дрожжей и выхода молочной кислоты на потребленное количество сахара, как в примере 1, перед изменением количества циркулирующей жидкости.
Сравнительный пример 3
Непрерывную ферментацию проводили таким же образом как в примере 4, за исключением того, что использовали аппарат непрерывной ферментации, показанный на фиг. 13. В этом случае, аппарат, показанный на фиг. 13, имел такую же конструкцию, как конструкция аппарата, показанного на фиг. 7, за исключением того, что в него не были установлены: обводной трубопровод 26, средство регуляции количества текущей жидкости 25 и запорные клапаны резервуара мембранной сепарации 27 и 28.
Поскольку в сравнительном примере 3, давление культуральной жидкости, подаваемой в резервуар мембранной сепарации, не регулировалось, то давление увеличивалось во время непрерывной ферментации, и через 70 часов после начала ферментации, оно достигало 1 МПа или более. При дальнейшей работе системы, начиналась утечка культуральной жидкости из резервуара мембранной сепарации, приводя к отказу системы при дальнейшем продолжении непрерывной ферментации.
Пример 5
Непрерывную ферментацию проводили таким же образом как в примере 3, за исключением того, что использовали аппарат непрерывной ферментации, показанный на фиг. 14. Аппарат, показанный на фиг. 14, имел такую же конструкцию, как конструкция аппарата, показанного на фиг. 2, за исключением того, что трубопровод переноса жидкости 15 мог открываться в положении погружения в культуральную жидкость, содержащуюся в ферментационном резервуаре 1.
После 100 часов культивирования, а также после 250 часов культивирования, измеряли мутность суспензии дрожжей, концентрацию молочной кислоты в качестве продукта в фильтрационной жидкости и концентрацию сахара в ферментационном резервуаре, а также рассчитывали выход молочной кислоты на потребленное количество сахара. Результаты показаны в таблице 1.
В результате, даже когда в примере 1 количество циркулирующей текущей жидкости увеличивали таким же образом как в примере 3 насосом 5 путем формирования положения возврата не фильтрованной культуральной жидкости в положении погружения в культуральную жидкость в ферментационном резервуаре, то появлялась возможность получения такой же концентрации молочной кислоты, мутности дрожжей и выхода молочной кислоты на потребленное количество сахара, как в примере 1, перед изменением количества циркулирующей жидкости.
Сравнительный пример 4
Непрерывную ферментацию проводили таким же образом как в примере 5, за исключением того, что использовали аппарат непрерывной ферментации, показанный на фиг. 15. В этом случае, аппарат, показанный на фиг. 15, имел такую же конструкцию, как конструкция аппарата, показанного на фиг. 14, за исключением того, что в него не были установлены: обводной трубопровод 26, средство регуляции количества текущей жидкости 25 и запорные клапаны резервуара мембранной сепарации 27 и 28.
Поскольку в сравнительном примере 4, давление культуральной жидкости, подаваемой в резервуар мембранной сепарации, не регулировалось, то давление увеличивалось во время непрерывной ферментации, и через 70 часов после начала ферментации, оно достигало 1 МПа или более. При дальнейшей работе системы, начиналась утечка культуральной жидкости из резервуара мембранной сепарации, приводя к отказу системы при дальнейшем продолжении непрерывной ферментации.
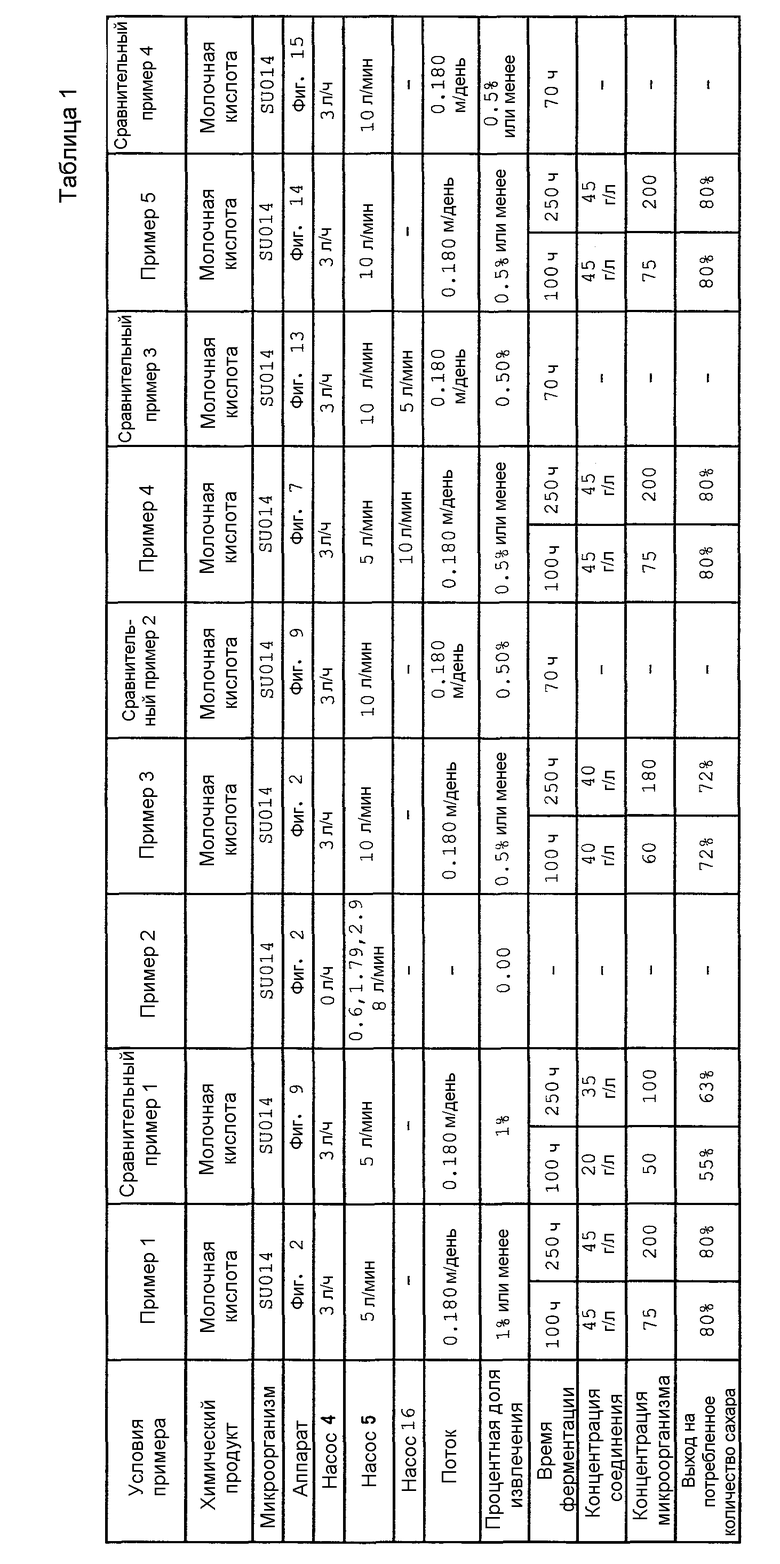
Пример 6
Непрерывную ферментацию проводили таким же образом как в примере 1, за исключением того, что использовали аппарат непрерывной ферментации, показанный на фиг. 16, непрерывную ферментацию проводили при регулировании количества фильтрованной жидкости, отбираемой насосом 4, с тем, чтобы установить процентную долю извлечения, рассчитанную по определяемой расходомером 30 величине, на уровень 1,5%, и что даже после 200 часов проводилась непрерывная ферментация. Аппарат, показанный на фиг. 16, имел такую же конструкцию как конструкция аппарата, показанного на фиг. 2, за исключением того, что в него был установлен расходомер 30. Одновременно в динамике во времени измеряли трансмембранную разность давления, оказываемого на сепарационную мембрану 3, и оценивали время блокирования мембраны вследствие резкого увеличения трансмембранной разности давления.
Изменение трансмембранной разности давления показано на фиг. 17. Более чем через 1000 часов от начала работы, трансмембранная разность давления удерживалась в стабильном состоянии, и во время работы при постоянном процентном извлечении 1,5%, стабильная продукция L-молочной кислоты обеспечивалась непрерывной ферментацией в течение длительного времени. После завершения непрерывной ферментации, измеряли и рассчитывали мутность суспензии дрожжей в ферментационном резервуаре, концентрацию молочной кислоты в качестве продукта в фильтрационной жидкости, концентрацию сахара и выход молочной кислоты на потребленное количество сахара, и эти результаты показаны в таблице 2.
Пример 7
Непрерывную ферментацию проводили таким же образом как в примере 6, за исключением того, что была установлена процентная доля извлечения 3,0%.
Изменение трансмембранной разности давления показано на фиг. 17. Более чем через 800 часов от начала работы, трансмембранная разность давления удерживалась в стабильном состоянии, и даже при процентном извлечении 3,0%, стабильная продукция L-молочной кислоты обеспечивалась непрерывной ферментацией в течение длительного времени. После завершения непрерывной ферментации, измеряли и рассчитывали мутность суспензии дрожжей в ферментационном резервуаре, концентрацию молочной кислоты в качестве продукта в фильтрационной жидкости, концентрацию сахара и выход молочной кислоты на потребленное количество сахара, и эти результаты показаны в таблице 2.
Пример 8
Непрерывную ферментацию проводили таким же образом как в примере 6, за исключением того, что была установлена процентная доля извлечения 9,9%.
Изменение трансмембранной разности давления показано на фиг. 17. Более чем через 550 часов от начала работы, трансмембранная разность давления удерживалась в стабильном состоянии, и даже при работе с процентным извлечением 9,9%, стабильная продукция L-молочной кислоты обеспечивалась непрерывной ферментацией в течение длительного времени. После завершения непрерывной ферментации, измеряли и рассчитывали мутность суспензии дрожжей в ферментационном резервуаре, концентрацию молочной кислоты в качестве продукта в фильтрационной жидкости, концентрацию сахара и выход молочной кислоты на потребленное количество сахара, и эти результаты показаны в таблице 2.
Пример 9
Непрерывную ферментацию проводили таким же образом как в примере 6, за исключением того, что была установлена процентная доля извлечения 12,0%.
Изменение трансмембранной разности давления показано на фиг. 17. Через 100 часов от начала работы, трансмембранная разность давления резко возрастала и вызывала блок пор мембраны. После завершения непрерывной ферментации, измеряли и рассчитывали мутность суспензии дрожжей в ферментационном резервуаре, концентрацию молочной кислоты в качестве продукта в фильтрационной жидкости, концентрацию сахара и выход молочной кислоты на потребленное количество сахара, и эти результаты показаны в таблице 2. После 100 часов непрерывной ферментации, концентрация молочной кислоты в ферментационном резервуаре составила 45 г/л. Кроме того, мутность суспензии дрожжей, OD600, увеличилась до 100, и выход молочной кислоты на единицу массы сахара составил 80%.
Однако поскольку проведение фильтрации было затруднено, трудно непрерывно получать L-молочную кислоту непрерывной ферментацией в течение периода времени, превышающего 100 часов.
На основании результатов примеров 6-9, путем проведения непрерывной ферментации при процентной доле извлечения, установленной на 10% или менее, были подтверждены неожиданные выраженные эффекты, такие как осуществление непрерывной ферментации в течение длительного периода времени (500 часов или более).
кислота
кислота
кислота
ганизм
тический
соединения
Пример 10
Путем использования штамма TR-CAD1 Corynebacterium glutamicum, описанного в документе JP-A No. 2004-222569, непрерывную ферментацию проводили аппаратом для непрерывной ферментации, показанным на фиг. 2, для получения кадаверина. В качестве култьтуральной среды, использовали среду для получения кадаверина, имеющую композицию, показанную в таблице 3. Эту среду для получения кадаверина подвергали стерилизационной обработке паром под высоким давлением (2 атм) при 121°С в течение 15 минут и затем использовали. В качестве элемента в виде сепарационной мембраны, использовали формованное изделие, составленное из нержавеющей стали и полисульфоновой смолы, и пористую плоскую мембрану, полученную в эталонном примере 2, использовали в качестве сепарационной мембраны. Кроме того, в качестве насоса 5 внутри трубопровода переноса жидкости 17, использовали насос диафрагменного типа “APLS-20” (выпускаемый TACMINA Corporation), а в качестве насоса 4, используемого для отсоса фильтрованной жидкости из резервуара мембранной сепарации, использовали перистальтический насос.
Кроме того, условия в экспериментах были следующие:
Емкость ферментационного резервуара: 20 л
Используемая сепарационная мембрана: фильтрационная мембрана из PVDF (полученная в эталонном примере 2)
Емкость резервуара мембранной сепарации: 5 л
Эффективная площадь фильтрации элемента в виде сепарационной мембраны: 4000 см2
Установка температуры: 30°С
Количественная характеристика тяги в ферментационном резервуаре: воздух 3 л/мин
Скорость перемешивания содержимого ферментационного резервуара: 100 об/мин
Установка рН: рН 7,0 устанавливали использованием 3M HCl и 3М аммиачной водой
Скорость подачи среды: регулируется с возможностью изменения датчиком уровня внутри ферментационного резервуара
Стерилизация: стерилизация сжатым паром при 121°С при 0,2 МПа в течение 20 минут всех компонентов - резервуара мембранной сепарации, ферментационного резервуара и используемой среды
Количество жидкости, протекающей через насос 4: 3 л/ч
Максимальный внутренний диаметр трубопроводов переноса жидкости 15, 17: 50 мм
Производительность насоса 5: 5 л/мин
Линейная скорость в трубопроводах переноса жидкости 15, 17: 4,2 см/с
Поток: 0,180 м/день
Процентная доля извлечения: не регулируется (1% или менее)
В качестве предварительной культуры, штамм TR-CAD1 подвергали встряхиванию в культуре в течение ночи (первоначально проводили первичное предварительное культивирование) на среде для получения кадаверина, к которой добавляли 5 мл канамицина (25 мкг/мл) в пробирке. Полученную таким образом культуральную жидкость инокулировали в 50 мл среды для получения кадаверина, к которой добавляли свежий канамицин (25 мкг/мл), и подвергали культивированию со встряхиванием в 500-мл колбе Sakaguchi при 30°С в течение 24 часов в условиях амплитуды 30 см. при 180 об/мин (перед этим проводили предварительное культивирование). Полученную культуральную жидкость инокулировали в 1000 мл свежей среды для получения кадаверина и подвергали культивированию со встряхиванием в 3000-мл колбе Sakaguchi при 30ºС в течение 24 часов (прекультура). Эту прекультуру инокулировали в среду для получения кадаверина с общим объемом 20 л в ферментационном резервуаре 1 и внутрь резервуара мембранной сепарации, и содержимое внутри ферментационного резервуара перемешивали прилагаемой к нему мешалкой, и устанавливали желаемое количество продувающего воздуха, температуру и рН, и после 50 часов культивирования, насос 4 включали для того, чтобы отсосать фильтрованную жидкость, содержащую кадаверин.
При этом, давление культуральной жидкости, текущей в резервуар мембранной сепарации 2, измеряли один раз в день, и средство регуляции количества текущей жидкости 25 (двухпозиционный клапан), прикрепленное к обводному трубопроводу 26, регулировали так, чтобы датчик давления был установлен на 0,1 МПа.
После 250 часов культивирования, измеряли мутность суспензии дрожжей в ферментационном резервуаре, концентрацию кадаверина в качестве продукта в фильтрованной жидкости и концентрацию сахара, а также рассчитывали выход кадаверина на потребленное количество сахара. Эти результаты показаны на фиг. 18 и в таблице 4. Концентрация кадаверина составила 3,5 г/л. Кроме того, мутность суспензии Corynebacterium измеряли фотометром на основании поглощения света при 600 нм. Кроме того, выход кадаверина на потребленное количество сахара составил 3%.
Концентрацию кадаверина измеряли следующим способом:
Способ анализа концентрации кадаверина ВЭЖХ
- Используемая колонка: CAPCELL PAK C18 (выпускаемая Shiseiso Co., Ltd.)
- Подвижная фаза: 0,1% (масс./масс.) водный раствор фосфорной кислоты:ацетонитрил = 4,5:5,5
- Выявление: УФ 360 нм
- Предварительная обработка образца: К анализируемому образцу (25 мкл) добавляли 25 мкл 1,4-диаминобутана (0,03 М), служившего в качестве вещества внутреннего стандарта, 150 мкл гидроацетата натрия (0,075 М) и раствор в этаноле 2,4-динитрофторбензола (0,2 М) и смешивали друг с другом, и смесь держали при 37°С в течение одного часа.
После растворения реакционного раствора (50 мкл) в 1 мл ацетонитрила, полученный раствор центрифугировали при 10000 об/мин в течение 5 минут, и его надосадочную жидкость (10 мкл) затем подвергали анализу ВЭЖХ.
Сравнительный пример 5
Непрерывную ферментацию проводили таким же образом как в примере 10, за исключением того, что использовали аппарат, показанный на фиг. 9. Измеряли мутность суспензии Corynebacterium и концентрацию кадаверина в качестве полученного продукта. В этом случае, аппарат, показанный на фиг. 9, имел такую же конструкцию как конструкция аппарата, показанного на фиг. 2, за исключением того, что в нем не были установлены обводной трубопровод 26, средство регуляции количества текущей жидкости 25 и запорные клапаны 27 и 28 резервуара мембранной сепарации.
Результаты показаны на фиг. 19 и в таблице 4. Кроме того, измеряли давление культуральной жидкости, подаваемой в резервуар мембранной сепарации, во время непрерывной ферментации, и результаты показаны на фиг. 20.
Поскольку в сравнительном примере 5, давление культуральной жидкости, подаваемой в резервуар мембранной сепарации, не регулировалось, то во время непрерывной ферментации давление увеличивалось, и через 225 часов после начала ферментации, оно достигало 1 МПа или более, как показано на фиг. 20. Кроме того, и мутность суспензии Corynebacterium, и концентрация кадаверина стали ниже, чем эти показатели в примере 10. Выход кадаверина на потребленное количество сахара составил 1,0%.
Как описано выше, путем регулирования потока культуральной жидкости в резервуар мембранной сепарации обводным трубопроводом 26 и связанным с ним средством регуляции количества протекающей жидкости 25, были подтверждены неожиданные эффекты, такие как ферментация высокой концентрации Corynebacterium, повышение концентрации кадаверина (химического продукта) и увеличение выхода кадаверина на потребленное количество сахара.
Пример 11
Путем использования штамма дельта-HOM Corynebacterium glutamicum, описанного в документе JP-A No. 2008-212138, непрерывную ферментацию проводили аппаратом для непрерывной ферментации, показанным на фиг. 2, с тем, чтобы получить L-лизин. В качестве культуральной среды использовали среду для получения L-лизина, имеющую состав, показанный в таблице 5. Эту среду для получения L-лизина подвергали обработке паровой стерилизацией под высоким давлением (2 атм) при 121°С в течение 15 минут и затем использовали. В качестве элемента в виде сепарационной мембраны использовали формованное изделие, составленное из нержавеющей стали и полисульфоновой смолы, а в качестве сепарационной мембраны, использовали пористую плоскую мембрану, полученную в эталонном примере 2. Кроме того, в качестве насоса 5 внутри трубопровода переноса жидкости 17 использовали насос диафрагменного типа “APLS-20” (выпускаемый TACMINA Corporation), а в качестве насоса 4, используемого для отсоса фильтрованной жидкости из резервуара мембранной сепарации, использовали перистальтический насос.
Кроме того, ниже представлены условия, использованные в примерах:
Емкость ферментационного резервуара: 20 л
Используемая сепарационная мембрана: фильтрационная мембрана из PVDF (полученная в эталонном примере 2)
Емкость резервуара мембранной сепарации: 5 л
Эффективная площадь фильтрации элемента в виде сепарационной мембраны: 4000 см2
Установка температуры: 30°С
Количественная характеристика тяги в ферментационном резервуаре: воздух 5 л/мин
Скорость перемешивания содержимого ферментационного резервуара: 300 об/мин
Установка рН: рН 7,3 устанавливали использованием 3M HCl и 3M аммиачной воды
Скорость подачи среды: регулируется с возможностью изменения датчиком уровня внутри ферментационного резервуара
Стерилизация: стерилизация сжатым паром при 121°С при 0,2 МПа в течение 20 минут всех компонентов - резервуара мембранной сепарации, ферментационного резервуара и используемой среды
Количество жидкости, протекающей через насос 4: 3 л/ч
Максимальный внутренний диаметр трубопроводов переноса жидкости 15, 17: 50 мм
Производительность насоса 5: 5 л/мин
Линейная скорость в трубопроводах переноса жидкости 15, 17: 4,2 см/с
Поток: 0,180 м/день
Процентная доля извлечения: не регулируется (1% или менее)
В качестве прекультуры, штамм дельта-HOM подвергали встряхиванию в культуре в течение ночи (первоначально проводили первичное предварительное культивирование) на 5 мл среды BY (0,5% дрожжевой экстракт, 0,7% мясной экстракт, 1% гептон, 0,3% хлорид натрия) в пробирке. Полученную таким образом культуральную жидкость инокулировали в 50 мл среды для получения L-лизина и подвергали культивированию со встряхиванием в 500-мл колбе Sakaguchi при 30°С в течение 24 часов в условиях амплитуды 30 см при 180 об/мин (перед этим проводили предварительное культивирование). Полученную культуральную жидкость инокулировали в 1000 мл свежей среды для получения L-лизина и подвергали культивированию со встряхиванием в 3000-мл колбе Sakaguchi при 30°С в течение 24 часов (прекультура). Эту прекультуру инокулировали в среду для получения L-лизина с общим объемом 20 л в ферментационном резервуаре 1 и внутрь резервуара мембранной сепарации, и содержимое внутри ферментационного резервуара перемешивали прилагаемой к нему мешалкой, и устанавливали желаемое количество продувающего воздуха, температуру и рН, и после 50 часов культивирования, насос 4 включали для того, чтобы отсосать фильтрованную жидкость, содержащую L-лизин.
При этом, давление культивируемой жидкости, втекающей в резервуар мембранной сепарации 2, измеряли один раз в день, и средство регуляции количества текущей жидкости 25 (двухпозиционный клапан), присоединенное к обводному трубопроводу (манометр), устанавливали на 0,1 МПа.
После 250 часов культивирования, измеряли мутность суспензии Corynеbacterium в ферментационном резервуаре, концентрацию L-лизина в качестве продукта в фильтрованной жидкости и концентрацию сахара, а также рассчитывали выход L-лизина на потребленное количество сахара. Полученные результаты показаны на фиг. 21 и в таблице 6. Концентрация L-лизина составила 6,0 г/л. Кроме того, мутность суспензии Corynеbacterium измеряли фотометром на основании поглощения света при 600 нм. Кроме того, выход L-лизина на количество использованного сахара составил 5,5%%. Концентрацию L-лизина измеряли с использованием такого же способа измерения как при измерении концентрации кадаверина.
Сравнительный пример 6
Непрерывную ферментацию проводили таким же образом как в примере 11, за исключением того, что использовали аппарат, показанный на фиг. 9. Измеряли мутность суспензии Corynеbacterium и концентрацию L-лизина в качестве продукта. В этом случае, аппарат, показанный на фиг. 9, имел такую же конструкцию, как конструкция аппарата, показанного на фиг. 2, за исключением того, что в него не были установлены: обводной трубопровод 26, средство регуляции количества текущей жидкости 25 и запорные клапаны резервуара мембранной сепарации 27 и 28.
Результаты показаны на фиг. 22 и в таблице 6. Кроме того, измеряли давление культуральной жидкости, подаваемой в резервуар мембранной сепарации, во время непрерывной ферментации, и результаты показаны на фиг. 23.
Поскольку в сравнительном примере 6, давление культуральной жидкости, подаваемой в резервуар мембранной сепарации, не регулировалось, то давление во время непрерывной ферментации колебалось, и через 225 часов после начала ферментации, оно достигало 1 МПа или более, как показано на фиг. 23. Кроме того, и мутность суспензии Corynebacterium, и концентрация L-лизина стали ниже, чем эти показатели в примере 11. Выход L-лизина на потребленное количество сахара составил 1,1%.
Как описано выше, путем регулирования потока культуральной жидкости в резервуар мембранной сепарации обводным трубопроводом 26 и связанным с ним средством регуляции количества текущей жидкости 25, были подтверждены неожиданные эффекты, такие как ферментация высокой концентрации Corynebacterium, повышение концентрации L-лизина (химического продукта) и увеличение выхода L-лизина на потребленное количество сахара.
Промышленная применимость
Настоящее изобретение может применяться для получения различных получаемых ферментацией микроорганизмов химических продуктов, таких как спирты, органические кислоты, аминокислоты, нуклеиновые кислоты, ферменты, антибиотики и рекомбинантные белки.
Объяснение обозначающих цифр
1. Ферментационный резервуар
2, 2'. Резервуар мембранной сепарации
3, 3'. Сепарационная мембрана
4. Фильтрационный насос
5. Насос
6. Насос подачи среды
7. Вал перемешивания
8. Трубопровод подачи газа
9. Датчик рН
10. Насос подачи нейтрализатора
11. Регулятор температуры
12. Датчик уровня
13. Узел открытия для подачи атмосферного давления
14А. Точка соединения
14В. Точка ответвления
15. Трубопровод переноса жидкости (возврата не фильтрованной жидкости в ферментационный резервуар)
16. Насос
17. Трубопровод переноса
18. Поддерживающая планка
19. Элемент водовода
20. Сепарационная мембрана
21. Вогнутый отдел
22. Трубопровод сбора жидкости
23. Верхний смоляной герметизирующий слой
24. Нижний смоляной герметизирующий слой
25. Средство регуляции количества текущей жидкости
26. Обводной трубопровод
27, 27'. Двухпозиционный клапан открытия/закрытия резервуара мембранной сепарации (сторона культуральной жидкости)
28, 28'. Двухпозиционный клапан открытия/закрытия резервуара мембранной сепарации (сторона нефильтрованной культуральной жидкости)
29. Манометр
30. Расходомер.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ МОЛОЧНОЙ КИСЛОТЫ, СПОСОБ ПОЛУЧЕНИЯ ЛАКТИДА И СПОСОБЫ ПОЛУЧЕНИЯ ПОЛИМОЛОЧНОЙ КИСЛОТЫ | 2009 |
|
RU2574783C2 |
| СПОСОБ ПОЛУЧЕНИЯ ХИМИЧЕСКОГО ВЕЩЕСТВА | 2013 |
|
RU2595387C2 |
| КОМПОЗИЦИЯ МОЛОЧНОЙ КИСЛОТЫ И ЕЕ ПРИМЕНЕНИЕ | 2009 |
|
RU2650802C1 |
| СПОСОБ ПОЛУЧЕНИЯ САХАРНОГО РАСТВОРА | 2009 |
|
RU2516792C2 |
| СПОСОБ ПОЛУЧЕНИЯ ХИМИЧЕСКОГО ВЕЩЕСТВА | 2013 |
|
RU2595388C2 |
| СПОСОБ ПОЛУЧЕНИЯ ХИМИЧЕСКОГО ВЕЩЕСТВА | 2013 |
|
RU2595386C2 |
| ПОЛИПЕПТИД, ОБЛАДАЮЩИЙ АКТИВНОСТЬЮ D-ЛАКТАТДЕГИДРОГЕНАЗЫ, ПОЛИНУКЛЕОТИД, КОДИРУЮЩИЙ ЭТОТ ПОЛИПЕПТИД, И СПОСОБ ПОЛУЧЕНИЯ D-МОЛОЧНОЙ КИСЛОТЫ | 2010 |
|
RU2553563C2 |
| БИОТЕХНОЛОГИЧЕСКИЙ СПОСОБ ПОЛУЧЕНИЯ МОЛОЧНОЙ КИСЛОТЫ | 2016 |
|
RU2661792C2 |
| СОДЕРЖАЩАЯ ЛИЗИН ДОБАВКА К КОРМАМ ДЛЯ ЖИВОТНЫХ И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2000 |
|
RU2271120C2 |
| Микроорганизм для продуцирования диамина и способ получения диамина с его использованием | 2015 |
|
RU2672323C2 |
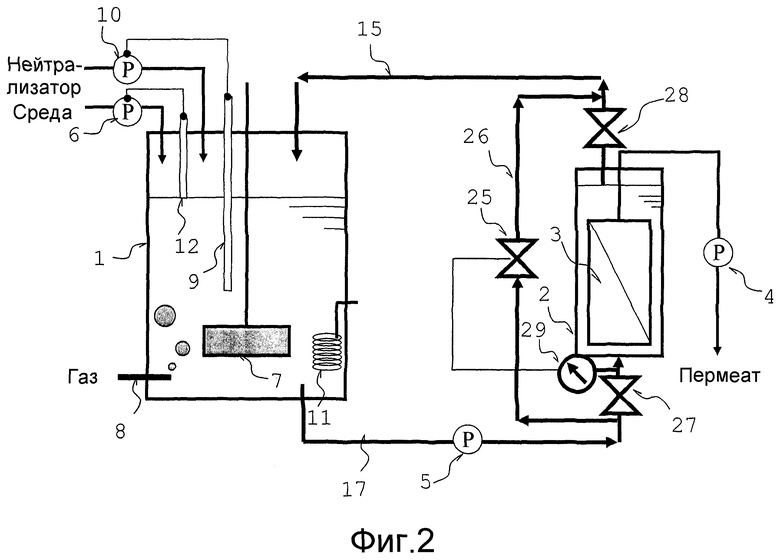
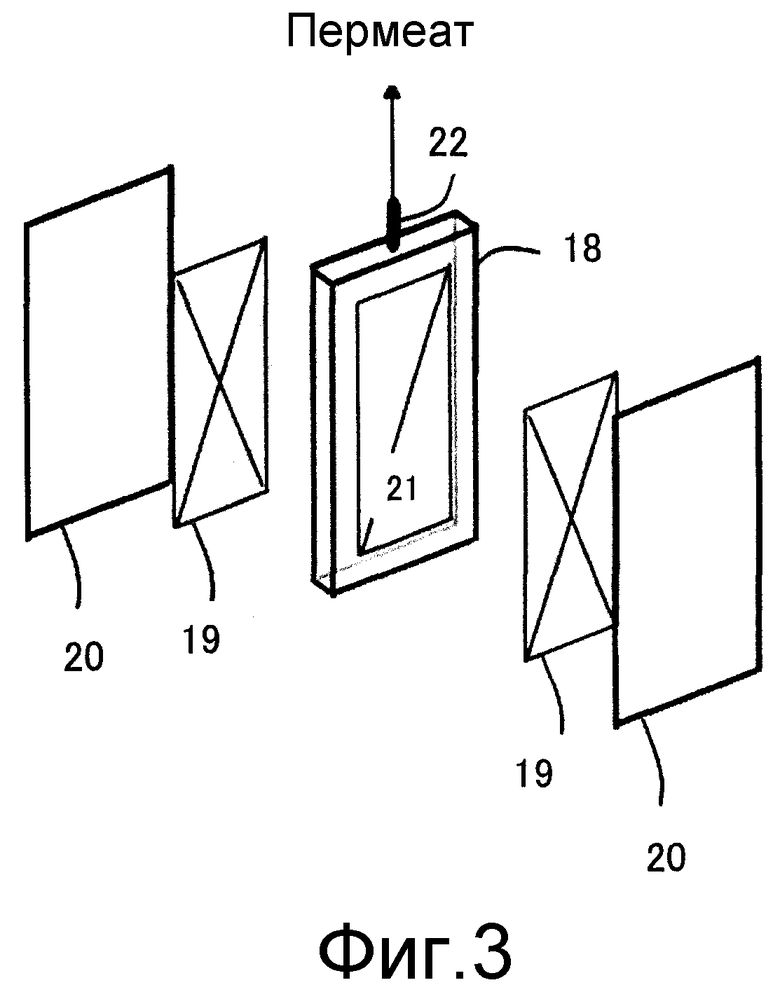
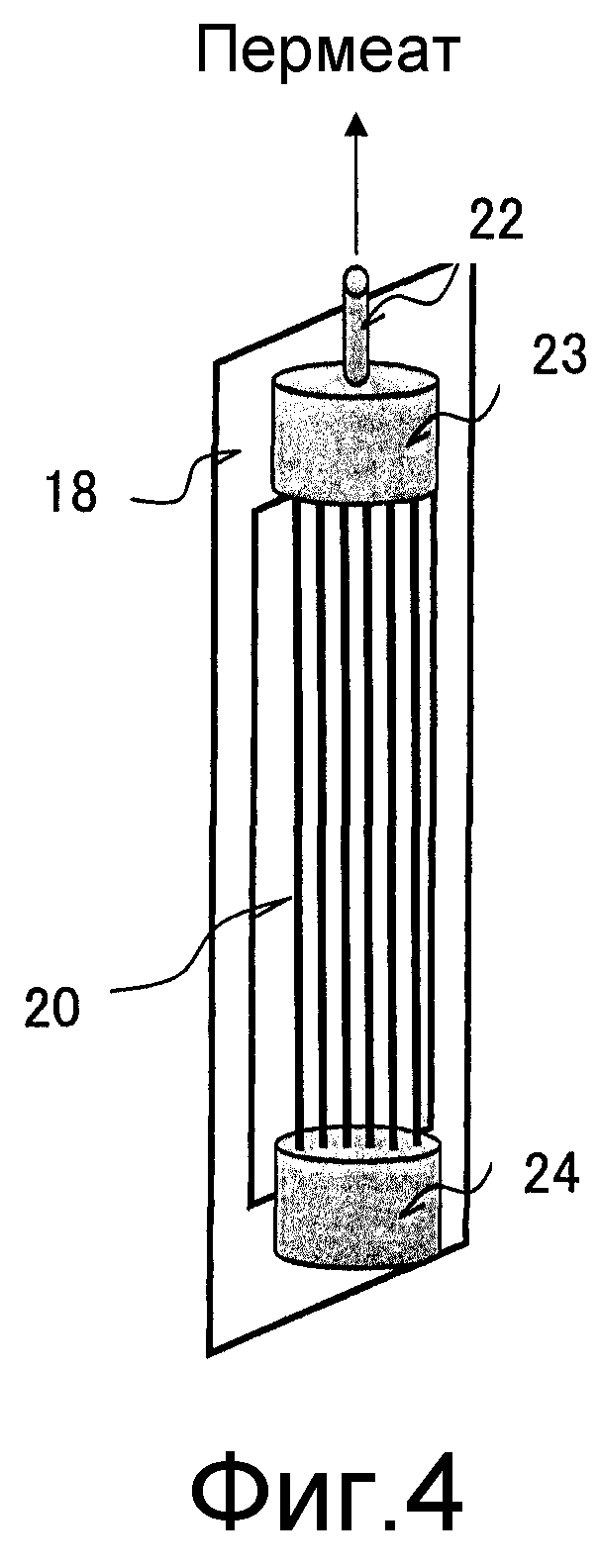
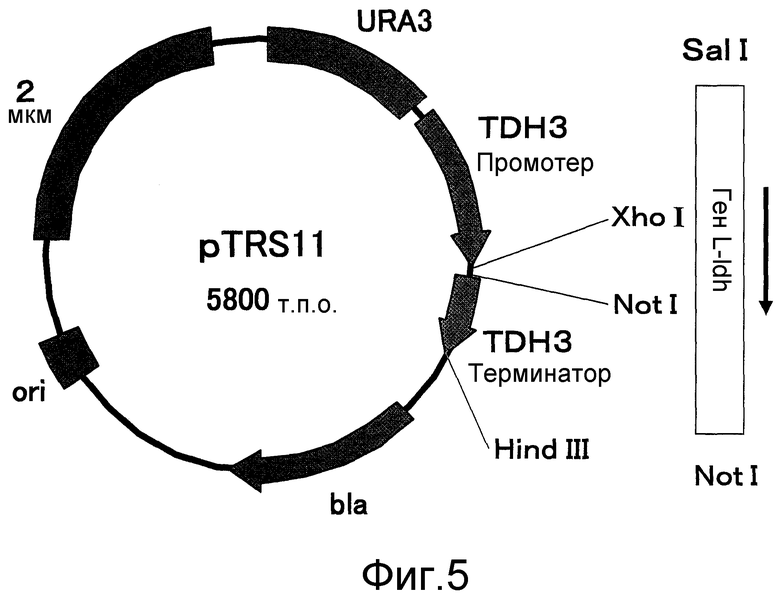
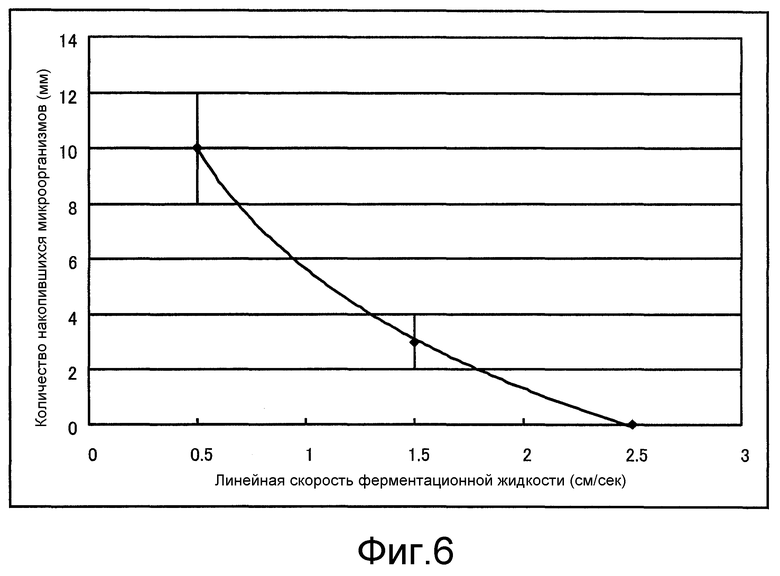
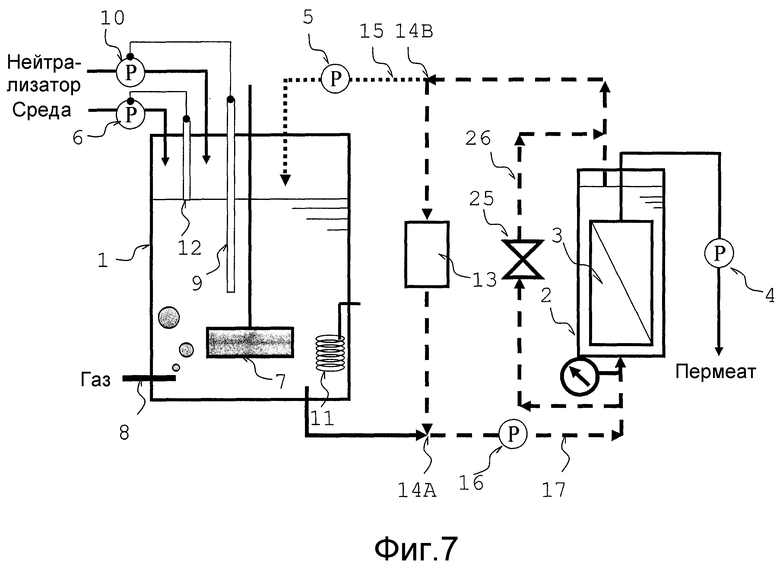
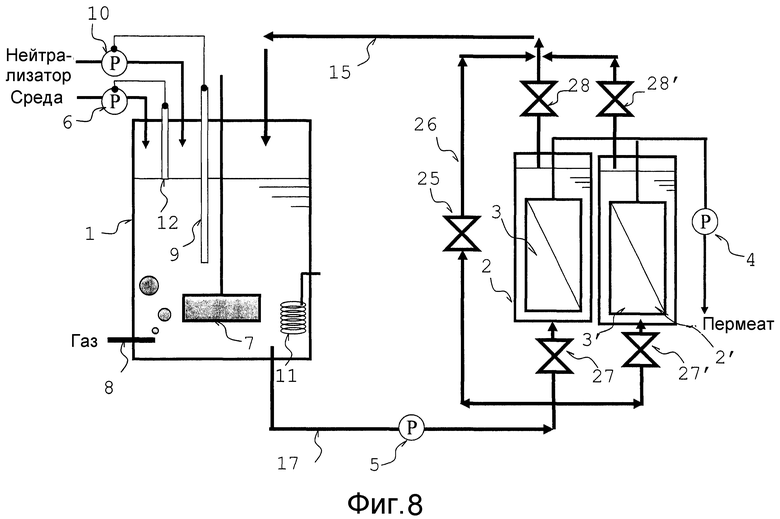
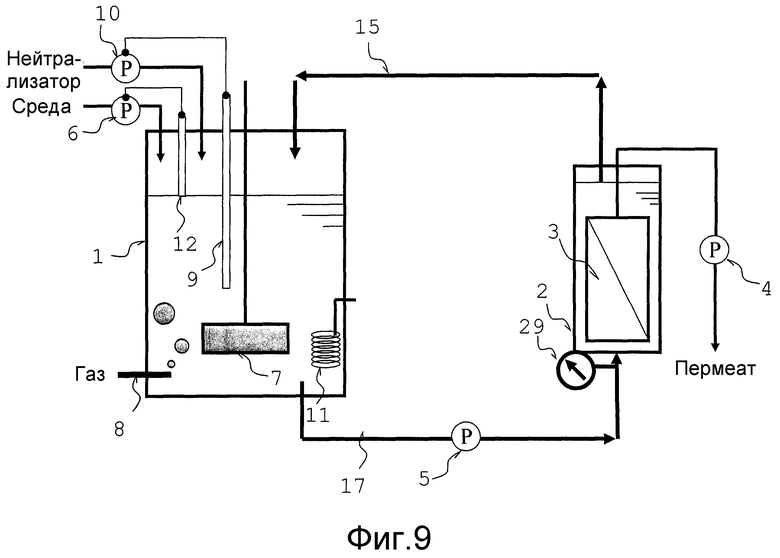
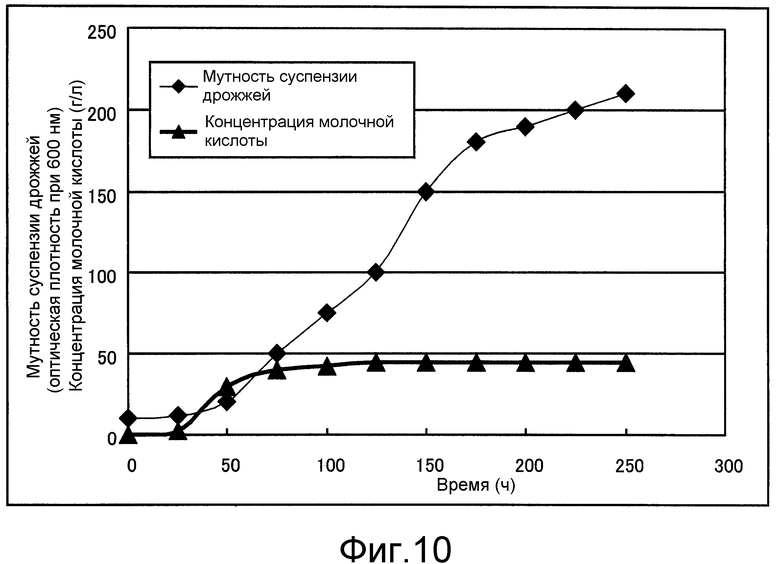
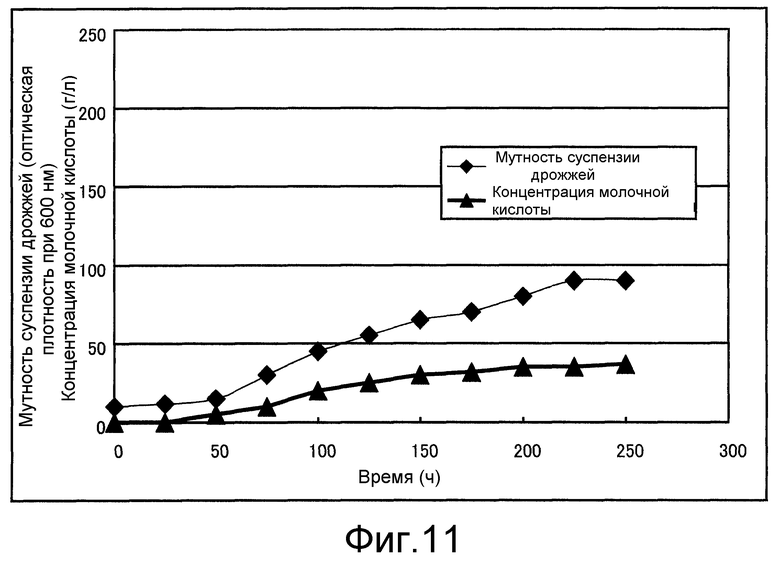
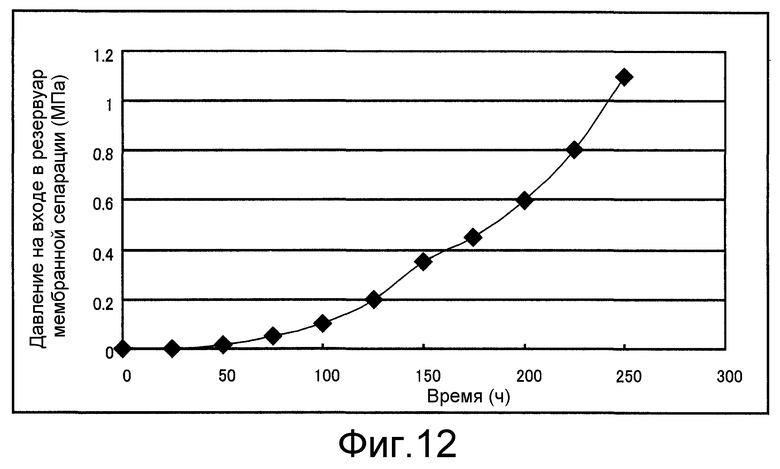
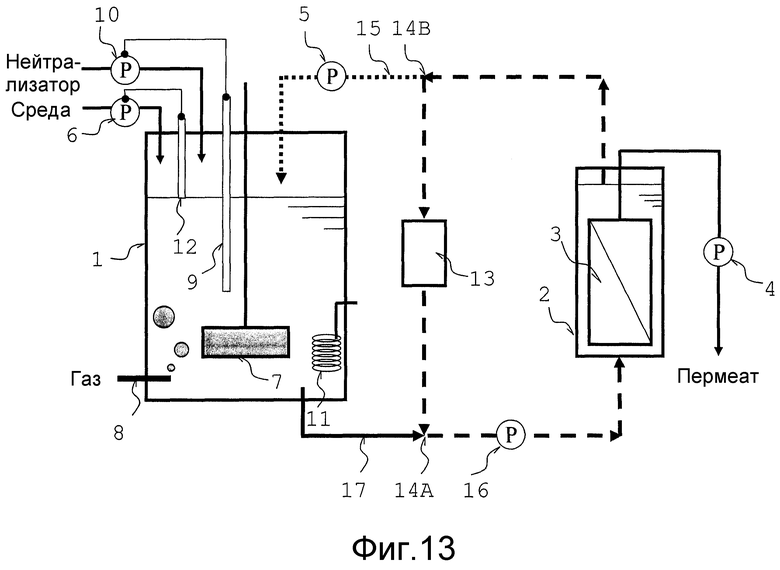
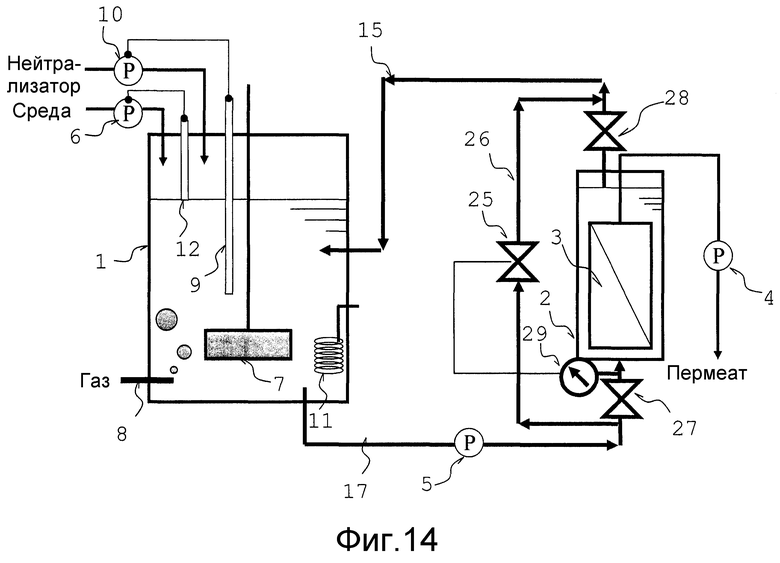
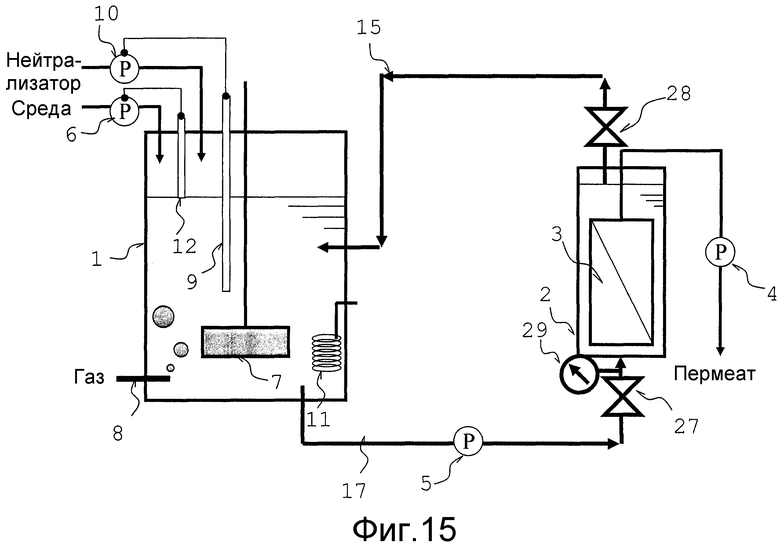
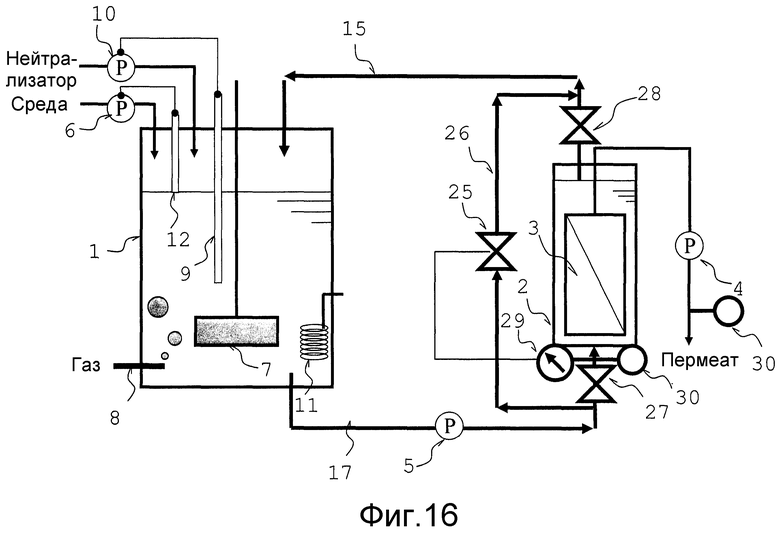
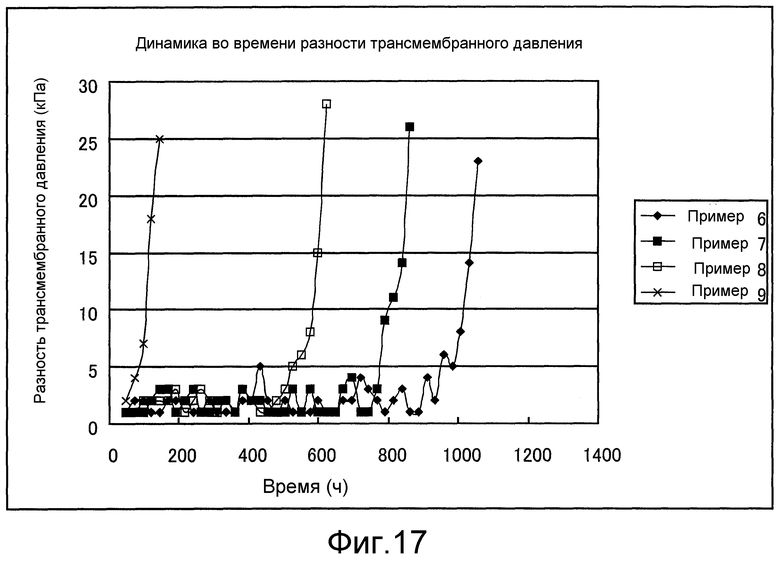
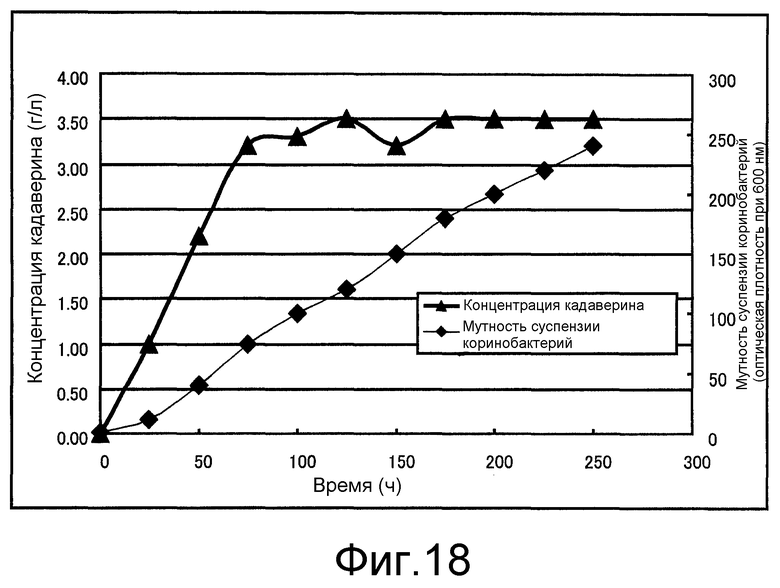
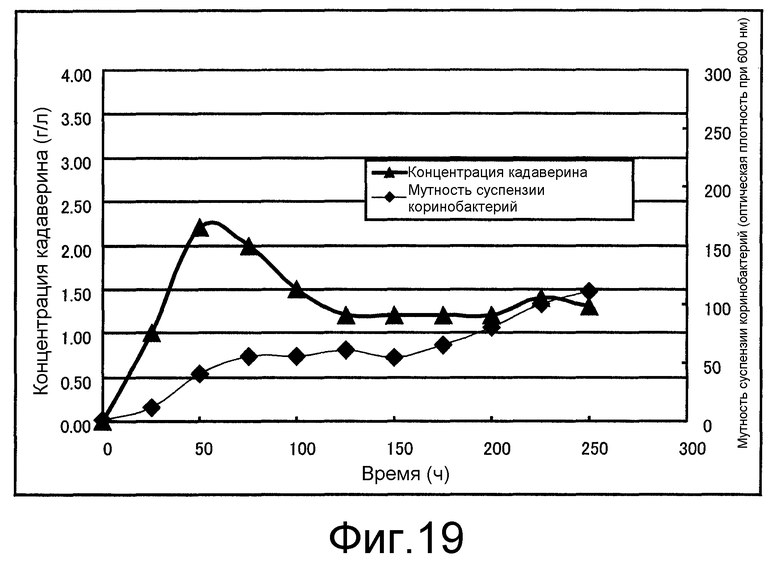
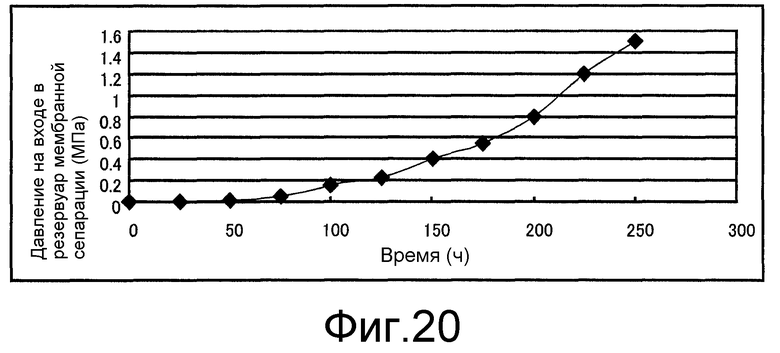
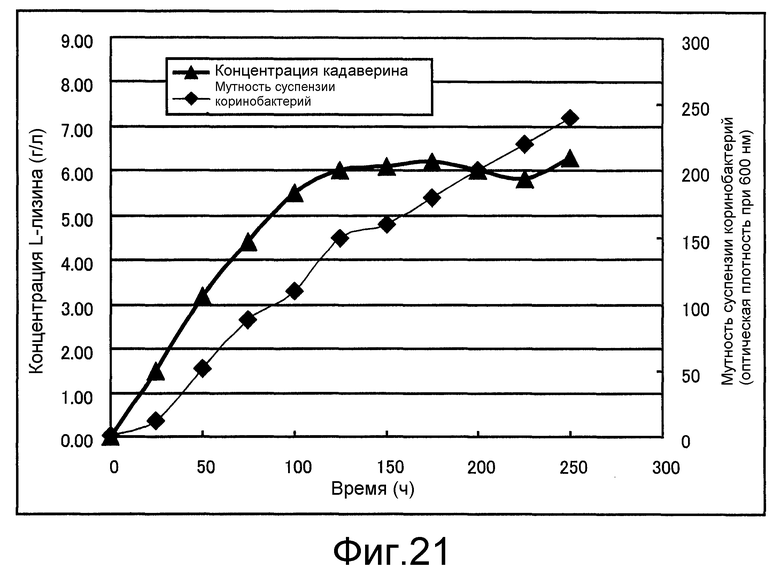
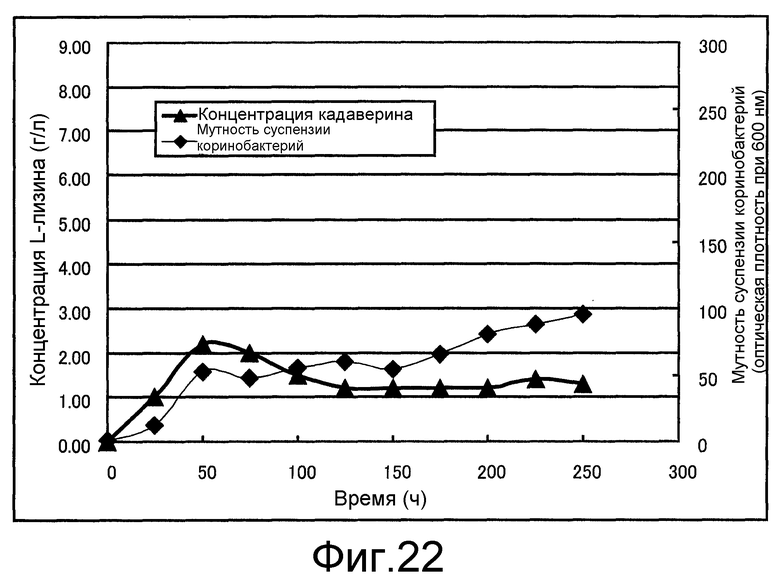
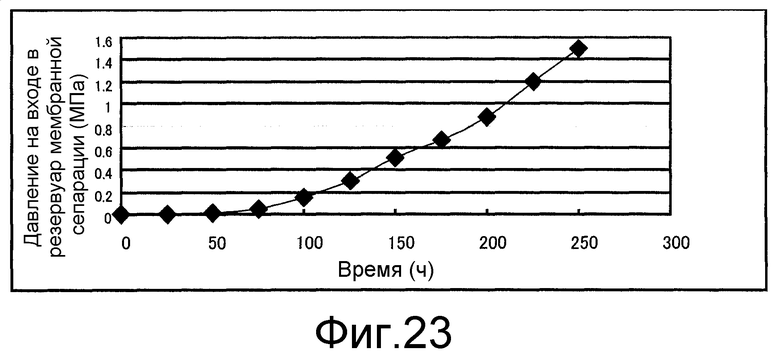
Группа изобретений относится к биотехнологии. Предложена группа изобретений: способ получения химического продукта и аппарат для получения химического продукта указанным способом. Культивируют микроорганизмы или культуральные клетки в ферментационном резервуаре. Переносят культуральную жидкость из ферментационного резервуара в резервуар мембранной сепарации для фильтрации культуральной жидкости через сепарационную мембрану. Собирают продукт ферментации из полученной после фильтрации жидкости в качестве химического продукта. Обеспечивают обратный сток нефильтрованной культуральной жидкости в ферментационный резервуар для объединения с культуральной жидкостью, не прошедшей через резервуар мембранной сепарации. Одна часть культуральной жидкости направляется в обвод резервуара мембранной сепарации обратно в ферментационный резервуар. При этом объём потока культуральной жидкости регулируют таким образом, что манометрическое давление культуральной жидкости со стороны выхода потока в резервуар мембранной сепарации составляет 1 МПа или менее. Аппарат включает в себя ферментационный резервуар, резервуар мембранной сепарации, трубопровод циркуляции, соединяющий ферментационный резервуар с резервуаром мембранной сепарации, средство для переноса культуральной жидкости, установленное в трубопровод циркуляции, обводной трубопровод для резервуара мембранной сепарации, средство регистрации давления потока со стороны входа потока в резервуар мембранной сепарации, средство регуляции объёма потока, установленное в обводной трубопровод. Изобретения обеспечивают повышение выхода конечного продукта. 2 н. и 11 з.п. ф-лы, 23 ил., 6 табл., 11 пр.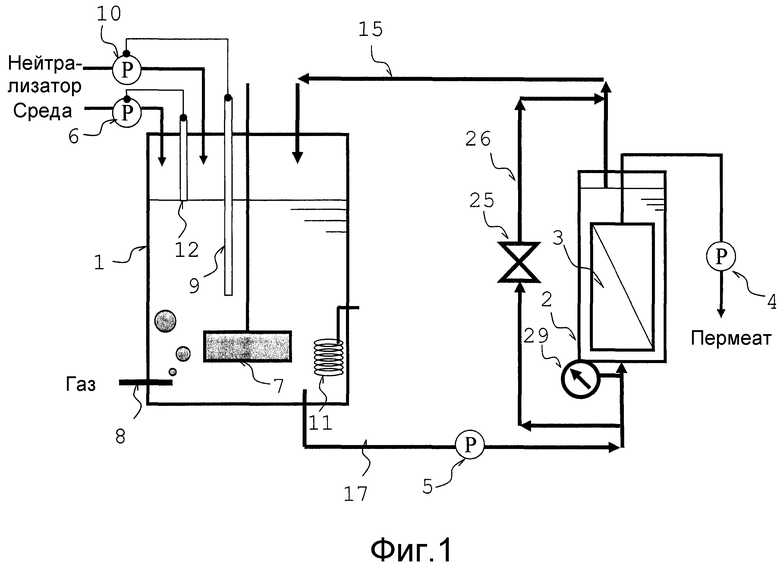
1. Способ получения химического продукта, включающий стадии: культивирования микроорганизмов или культуры клеток в ферментационном резервуаре; переноса культуральной жидкости из ферментационного резервуара в резервуар мембранной сепарации с тем, чтобы профильтровать культуральную жидкость через сепарационную мембрану; и сбора продукта ферментации из полученной после фильтрации жидкости в виде химического продукта с обеспечением обратного стока нефильтрованной культуральной жидкости в ферментационный резервуар для объединения с культуральной жидкостью, не прошедшей через резервуар мембранной сепарации, где одна часть культуральной жидкости, которая включает микроорганизмы или культуры клеток, направляется в обвод резервуара мембранной сепарации обратно в ферментационный резервуар, где объем потока культуральной жидкости, направленной в обвод резервуара мембранной сепарации, регулируется таким образом, что манометрическое давление культуральной жидкости со стороны входа потока в резервуар мембранной сепарации составляет 1 МПа или менее.
2. Способ получения химического продукта по п.1, в котором одна часть нефильтрованной культуральной жидкости стекает обратно для объединения с культуральной жидкостью в ферментационном резервуаре, тогда как остальная часть нефильтрованной культуральной жидкости стекает обратно для объединения с культуральной жидкостью, находящейся между ферментационным резервуаром и резервуаром мембранной сепарации.
3. Способ получения химического продукта по п.2, в котором каждое из количеств текущей нефильтрованной культуральной жидкости, стекающей обратно для объединения с культуральной жидкостью, находящейся между ферментационным резервуаром и резервуаром мембранной сепарации, и количества текущей нефильтрованной культуральной жидкости, стекающей обратно для объединения с культуральной жидкостью в ферментационном резервуаре, регулируется независимо.
4. Способ получения химического продукта по п.2, в котором устанавливается отношение количества текущей нефильтрованной культуральной жидкости, стекающей обратно для объединения с культуральной жидкостью в ферментационном резервуаре, к количеству текущей нефильтрованной культуральной жидкости, стекающей обратно для объединения с культуральной жидкостью, находящейся между ферментационным резервуаром и резервуаром мембранной сепарации, равное 1 или менее.
5. Способ получения химического продукта по п.1, в котором устанавливается каждая из величин линейной скорости культуральной жидкости, переносимой из ферментационного резервуара в резервуар мембранной сепарации, линейной скорости нефильтрованной культуральной жидкости, которая обратно стекает из резервуара мембранной сепарации для объединения с культуральной жидкостью на находящейся выше по потоку стороне резервуара мембранной сепарации, и линейной скорости культуральной жидкости, которая направляется в обвод резервуара мембранной сепарации, равная 2,5 см/сек или более.
6. Способ получения химического продукта по п.1, в котором
количество культуральной жидкости, текущей в резервуар мембранной сепарации, и/или количество полученной после фильтрации жидкости, текущей из резервуара мембранной сепарации, регулируются так, чтобы процентная доля извлечения количества полученной фильтрацией жидкости из резервуара мембранной сепарации от количества культуральной жидкости, текущей в резервуар мембранной сепарации, была установлена на 10,0% или менее.
7. Способ получения химического продукта по п.1, в котором отношение объема культуральной жидкости в ферментационном резервуаре к объему культуральной жидкости в резервуаре мембранной сепарации устанавливается в диапазоне от 4 до 100.
8. Аппарат для получения химического продукта по п.1, включающий: ферментационный резервуар для культивирования микроорганизмов или культуры клеток; резервуар мембранной сепарации, имеющий сепарационную мембрану, используемую для сбора продукта ферментации, полученного в культуральной жидкости из ферментационного резервуара; трубопровод циркуляции, который соединяет ферментационный резервуар с резервуаром мембранной сепарации с тем, чтобы перемещать культуральную жидкость, которая включает микроорганизмы или культуры клеток, в резервуар мембранной сепарации, и обеспечивает обратный сток нефильтрованной культуральной жидкости, которая не была профильтрована сепарационной мембраной, для объединения с культуральной жидкостью, не прошедшей через резервуар мембранной сепарации; и средство для переноса культуральной жидкости, установленное в трубопровод циркуляции, причем данная конструкция дополнительно включает обводной трубопровод для резервуара мембранной сепарации; средство регистрации давления потока культуральной жидкости со стороны входа потока в резервуар мембранной сепарации; и средство регуляции объема потока, установленное в обводной трубопровода.
9. Аппарат по п.8, в котором средство регуляции объема потока культуральной жидкости срабатывает в ответ на результат выявления средством регистрации давления культуральной жидкости со стороны входа потока в резервуар мембранной сепарации.
10. Аппарат по п.8 или 9, дополнительно включающий средство регистрации линейной скорости для трубопровода циркуляции с тем, чтобы средство регуляции объема потока и/или средство для переноса культуральной жидкости срабатывали в ответ на результат выявления средством регистрации линейной скорости потока.
11. Аппарат по п.8 или 9, в котором резервуар мембранной сепарации установлен в контур циркуляции, имеющий средство переноса жидкости, отличное от средства переноса культуральной жидкости, которое независимо от ферментационного резервуара.
12. Аппарат по п.8 или 9, в котором трубопровод циркуляции имеет отверстие в положении, которое погружено в культуральную жидкость, содержащуюся в ферментационном резервуаре.
13. Аппарат по п.8 или 9, в котором отношение объема ферментационного резервуара к объему резервуара мембранной сепарации установлено в диапазоне от 4 до 100.
| УДАРНО-СПУСКОВОЙ МЕХАНИЗМ ДЛЯ ОХОТНИЧЬЕ-СПОРТИВНОГО ОРУЖИЯ | 0 |
|
SU363854A1 |
| WO2007120449 A1, 25.10.2007 | |||
| WO2007097260 A1, 30.08.2007 | |||
| РЕАКТОР ДЛЯ ХИМИЧЕСКИХ ПРОДУКТОВ | 1996 |
|
RU2123380C1 |
| Аппарат для получения и переработки химических продуктов | 1970 |
|
SU440021A1 |
Авторы
Даты
2014-04-20—Публикация
2009-09-16—Подача