Область техники, к которой относится изобретение
Изобретение относится к применению 1,2-производных полиненасыщенных жирных кислот в качестве лекарственных препаратов, предпочтительно для лечения заболеваний, этиология которых основана на изменениях липидов клеточных мембран, таких как: изменения уровня, состава или структуры данных липидов и белков, которые взаимодействуют с ними; а также для лечения заболеваний, при которых регуляция состава липидов и структуры мембран, а также белков, взаимодействующих с ними, с обратным развитием патологического состояния.
Таким образом, настоящее изобретение в силу широкого ряда применений, вероятно, в основном относится к области медицины и фармацевтики.
Уровень техники
Клеточные мембраны являются структурами, которые определяют организацию клеток и органелл, которые они содержат. Большинство биологических процессов протекают в мембранах или около них. Липиды играют не только структурную роль, но также регулируют активность важных процессов. Кроме того, регуляция липидного состава мембран также оказывает влияние на локализацию или функцию важных белков, принимающих участие в регуляции физиологии клеток, таких как G-белки или PKC (Escribá et al., 1995, 1997; Yang et al., 2005; Martinez et al., 2005). Результаты данных и других исследований демонстрируют значение липидов в регуляции важных функций клеток. В сущности, многие заболевания человека, такие как рак, сердечно-сосудистое заболевание, нейродегенеративное заболевание, ожирение, метаболические расстройства, воспалительные процессы и заболевания, инфекционные заболевания или аутоиммунные заболевания, среди прочего связаны с изменениями в содержании или составе липидов в биологических мембранах, о чем дополнительно свидетельствуют положительные эффекты лечения жирными кислотами, которые можно использовать для обратного развития данных заболеваний, в дополнении к соединениям по настоящему изобретению, которые регулируют состав и структуру мембранных липидов (Escribá, 2006).
Липиды, потребляемые с пищей, регулируют липидный состав клеточных мембран (Alemany et al., 2007). Кроме того, различные физиологические и патологические ситуации могут вызывать изменения в липидах клеточных мембран (Buda et al., 1994; Escribá, 2006). В качестве примера ситуации, приводящей к физиологическим изменениям в мембранных липидах, можно упомянуть рыб, живущих в реках с изменчивой температурой, у которых липиды подвергаются существенным изменениям (изменениям в количестве и типах мембранных липидов), когда температура опускается с 20°С (летом) до 4°С (зимой) (Buda et al., 1994). Данные изменения позволяют рыбам поддерживать функции в клетках различной природы. Примерами патологических процессов, которые могут оказывать влияние на липидный состав, являются неврологические расстройства или вызванные лекарственными препаратами заболевания (Rapoport, 2008). Следовательно, можно прийти к заключению, что липиды мембран могут определять правильную активность многочисленных механизмов передачи сигналов в клетках.
Изменения в составе мембранных липидов оказывают влияние на передачу сигналов в клетках и могут привести к развитию заболевания или, напротив, его обратному развитию (Escribá, 2006). Результаты различных исследований, проведенных в течение прошедших нескольких лет, показывают, что мембранные липиды играют более важную роль, чем это считалось ранее (Escribá et al., 2008). Классический взгляд на клеточную мембрану отводит липидам чисто структурную роль такую, как основа для мембранных белков, которые, как полагается, являются единственными функциональными элементами мембраны. Плазматическая мембрана должна играть еще одну дополнительную роль, заключающуюся в недопущении проникновения воды, ионов и других молекул из окружающей среды в клетки. Однако мембраны обладают другими важными функциями, которые касаются поддержания здоровья, развития болезни и заживления. Поскольку организм болен, когда больны его клетки, то изменения в мембранных липидах приводят к изменениям в клетках, и последние могут привести к развитию заболевания. Аналогично терапевтические, нутрицевтические или косметические вмешательства, направленные на регуляцию уровня мембранных липидов, могут предупредить и отменить (излечить) патологические процессы. Дополнительно, результаты многочисленных исследований указывают, что потребление насыщенных или транс-мононасыщенных жиров оказывает отрицательное влияние на состояние здоровья. В дополнении к неврологическим заболеваниям, описанным выше, сосудистые заболевания, рак и другие также непосредственно связаны с мембранными липидами (Stender and Dyerberg, 2004). Отрицательное влияние на здоровье выражается в развитии данных и других типов заболеваний, которые включают метаболические заболевания, воспаление, нейродегенерацию и т.д.
Клеточные мембраны представляют собой избирательный барьер, через который клетка получает метаболиты и информацию от других клеток и из внеклеточной среды, которая ее окружает. Однако мембраны выполняют в клетках другие очень важные функции. С другой стороны, они служат в качестве носителя для белков, принимающих участие в получении или инициации сигналов, которые контролируют важные органические функции. Данные сигналы, действие которых опосредуется многими гормонами, нейромедиаторами, цитокинами, ростовыми факторами и т.д., активируют мембранные белки (рецепторы), проводящие полученный сигнал в клетку через другие белки (периферические мембранные белки), некоторые из которых располагаются в мембране. Поскольку (1) данные системы функционируют в качестве каскадов усиления и (2) мембранные липиды могут регулировать локализацию и активность данных периферических белков, то липидный состав мембран может оказывать большое влияние на физиологию клеток. В частности, взаимодействие некоторых периферических белков, таких как G-белки, протеинкиназа С, белок Ras и т.д., с клеточной мембраной зависит от ее липидного состава (Vogler et al., 2004; Vogler et al., 2008). Кроме того, на липидный состав клеточных мембран оказывают влияние тип и количество липидов в пище (Escribá et al., 2003). Фактически нутрицевтические или фармацевтические вмешательства могут регулировать липидный состав мембран, что, в свою очередь, может обеспечить контроль взаимодействия (и, следовательно, активность) важных белков передачи сигналов в клетке (Yang et al., 2005).
На основании того факта, что мембранные липиды способны контролировать передачу сигналов в клетке, также можно предположить, что они способны регулировать физиологический статус клеток и, следовательно, общее состояние здоровья. Действительно описаны как отрицательные, так и положительные эффекты липидов на здоровье (Escribá et al., 2006; Escribá et al., 2008). Результаты предварительных опытов показали, что 2-гидроксиолеиновая кислота, мононенасыщенная жирная кислота, способна давать ход обратному развитию некоторых патологических процессов, таких как избыточная масса, гипертензия или рак (Alemany et al., 2004; Martinez et al., 2005; Vogler et al., 2008).
Часто развитие сердечно-сосудистых заболеваний связывают с избыточной пролиферацией клеток, составляющих ткани сердца и сосудов. Данная гиперпролиферация приводит к сердечно-сосудистым отложениям во внутреннем просвете сосудов и полостях органов сердечно-сосудистой системы, приводя к развитию ряда заболеваний, таких как гипертензия, атеросклероз, ишемия, аневризмы, внезапный приступ, инфаркт миокарда, стенокардия, инсульт (цереброваскулярные события) и т.д. (Schwartz et al., 1986). Фактически было высказано предположение, что разработка лекарственных препаратов, которые предупреждают клеточную пролиферацию, будет хорошей альтернативной для предупреждения или лечения сердечно-сосудистого заболевания (Jackson and Schwartz, 1992).
Причиной ожирения является измененный баланс между приемом пищи и расходом энергии частично за счет изменений в механизмах, регулирующих данные процессы. С другой стороны, данное состояние характеризуется гиперплазией (увеличением числа клеток) или гипертрофией (увеличенным размером) жировых клеток, адипоцитов. Результаты многочисленных опытов показали, что жирные кислоты, свободные или в составе других молекул, могут оказывать влияние на ряд параметров, связанных с энергетическим гомеостазом, среди прочего, таких как масса жировой ткани в теле, обмен липидов, термогенезис и потребление пищи (Vogler et al., 2008). В данном смысле модификация жирных кислот может служить стратегией для регуляции энергетического гомеостаза, т.е. баланса между приемом пищи и расходом энергии и, следовательно, связанных процессов, таких как аппетит или масса тела.
Нейродегенеративные процессы приводят к развитию ряда заболеваний с различными клиническими проявлениями, но с общей характеристикой, заключающейся в том, что их причиной является дегенерация или дисфункция клеток центральной и/или периферической системы. Некоторые такие нейродегенеративные процессы включают существенное снижение когнитивной функции у пациентов или изменения их двигательной активности. Нейродегенеративные, неврологические и нейропсихические расстройства имеют общую основу: дегенерацию нейронов или изменение их компонентов, таких как липиды (например, миелин) или мембранные белки (например, адренергические, серотонинергические рецепторы и т.д.). Такие заболевания центральной нервной системы включают, среди прочего, болезнь Альцгеймера, болезнь Паркинсона, рассеянный склероз, амиотрофический латеральный склероз, склероз гиппокампа и другие типы эпилепсии, фокальный склероз, адренолейкодистрофию и другие лейкодистрофии, васкулярную деменцию, старческую деменцию, головные боли, включая мигрень, травму центральной нервной системы, расстройства сна, головокружение, боль, инсульт (цереброваскулярные события), депрессию, беспокойство или зависимости. Кроме того, некоторые неврологические и нейродегенеративные заболевания могут привести к развитию таких процессов, которые заканчиваются слепотой, проблемами со слухом, нарушением ориентации, сменой настроения и т.д.
Примером хорошо известного нейродегенеративного расстройства является болезнь Альцгеймера, которая характеризуется образованием старческих бляшек, состоящих из фрагментов мембранных белков (например, β-амилоидного пептида), образующихся в результате неправильного процессинга пептидов, с последующим накоплением с наружной стороны клеток, и образованием нейрофибриллярных клубков тау-белка. Данный процесс связан с изменениями в метаболизме холестерина и последующим изменением уровня некоторых мембранных липидов, таких как холестерин и докозагексаноевая кислота (Sagin and Sozmen, 2008; Rapoport, 2008). Кроме того, некоторые нейродегенеративные заболевания, такие как болезнь Паркинсона, болезнь Альцгеймера, старческая деменция (или деменция с тельцами Леви), связаны с патологическим накоплением фибриллярных агрегатов белка α-синуклеина, которое приводит к значительному изменению метаболизма триглицеридов в клетках (Coles et al., 2001). В сущности, развитие данных и других нейродегенеративных заболеваний связано с изменениями в сывороточных или клеточных липидах, таких как холестерин, триглицериды, сфингомиелин, фосфатидилэтаноламин и т.д. На основании этого можно вновь предположить, что липиды играют ключевую роль в правильной активности нейронов, нервов, головного мозга, мозжечка и спинного мозга, что является логичным с учетом высокого содержания липидов в центральной нервной системе. Молекулы по данному изобретению обладают большой или очень большой потенциальной способностью для обратного развития многих процессов, ассоциированных с неврологическими, нейродегенеративными или нейропсихическими расстройствами.
Кроме того, к таким заболеваниям относятся различные типы склероза и другие нейродегенеративные расстройства, связанные с «демиелинизацией», общим последствием которой является потеря липидов в оболочке аксонов нейронов с последующими изменениями в процессе проведения электрических сигналов. Миелин представляет жировой слой, который окружает аксоны многих нейронов и который образован рядом спиральных складок плазматической мембраны глиальных клеток (клеток Шванна). Следовательно, ясно, что липиды играют важную роль в развитии нейродегенеративных заболеваний. Кроме того, было установлено, что немодифицированные природные PUFA обладают незначительным защитным действием в отношении развития нейродегенеративных процессов (Lane and Farlow, 2005). Фактически наиболее важным липидом в центральной нервной системе является докозагексаноевая кислота, природная PUFA, и чье содержание изменяется при многих нейродегенеративных процессах.
Метаболические заболевания образуют группу заболеваний, для которых характерно накопление или, напротив, дефицит некоторых молекул. Типичным примером является накопление глюкозы, холестерина и/или триглицеридов выше нормального уровня. Повышенное содержание глюкозы, холестерина и/или триглицеридов как на системном уровне (например, повышенные концентрации в плазме крови), так и на клеточном уровне (например, в клеточных мембранах), связано с изменениями в передаче сигналов в клетке, приводящими к дисфункции на различных уровнях, и обычно возникающими за счет ошибок в активности некоторых ферментов или неадекватной регуляции таких белков. Среди наиболее важных метаболических заболеваний находятся гиперхолестеролемия (высокий уровень холестерина) и гипертриглицеридемия (высокий уровень триглицеридов). Данные заболевания имеют высокие показатели частоты развития, заболеваемости и смертности, и их лечение является необходимостью первого порядка. Другие важные метаболические заболевания включают диабет и резистентность к инсулину, характеризующиеся проблемами с регуляцией содержания глюкозы. Данные метаболические заболевания являются причиной развития других болезней, таких как рак, гипертензия, ожирение, атеросклероз и т.д. Недавно было установлено еще одно заболевание, тесно связанное с метаболическими нарушениями, описанными выше, и которое может представлять новый тип метаболопатии per se, - это метаболический синдром.
Различными исследователями была описана защитная роль некоторых полиненасыщенных жирных кислот (PUFA) в отношении некоторых заболеваний. Например, PUFA замедляют развитие рака и оказывают положительное действие против развития сердечно-сосудистого заболевания, нейродегенеративных заболеваний, метаболических расстройств, ожирения, воспаления и т.д. (Trombetta et al., 2007; Jung et al., 2008; Florent et al., 2006). Данные побудительные причины указывают на важную роль липидов (PUFA) в этиологии различных заболеваний и их лечении. Однако фармакологическая активность данных соединений (PUFA) проявляется в течение небольшого периода времени за счет быстрого метаболизма и короткого периода полураспада в крови. Следовательно, представляется необходимым разработать PUFA с медленным метаболизмом, что приведет к повышенному нахождению в клеточной мембране по сравнению с PUFA, используемыми до настоящего времени, и облегчит взаимодействие периферических белков в передаче сигналов в клетке. Молекулы по данному изобретению являются синтетическими производными PUFA, обладают более медленным метаболизмом, а также выраженным и существенно более высоким терапевтическим действием по сравнению с природными PUFA.
Основываясь на наличии взаимосвязи между структурными и функциональными изменениями липидов, расположенными в клеточной мембране, с развитием различных заболеваний разной типологии, но с этиологией, унитарно связанной со структурными и/или функциональными изменениями липидов в мембранах клеток, таких как рак, сердечно-сосудистое заболевание, ожирение, воспаление, нейродегенеративные и метаболические заболевания, настоящее изобретение относится к применению новых синтетических полиненасыщенных жирных кислот, способных решать технические проблемы, характерные для известных жирных кислот, указанные выше, и, следовательно, они являются пригодными для эффективного лечения данных заболеваний.
Описание изобретения
Сущность изобретения
Данное изобретение относится к 1,2-производным полиненасыщенных жирных кислот (далее по тексту: D-PUFA) для применения в лечении распространенных заболеваний, этиология которых связана со структурными и/или функциональными изменениями липидов в мембранах клеток или белков, взаимодействующих с ними, в частности, выбранных: из рака, сосудистых заболеваний, нейродегенеративных и неврологических расстройств, метаболических заболеваний, воспалительных заболеваний, ожирения и избыточной массы тела. D-PUFA обладают низкой скоростью метаболизма по сравнению с природными полиненасыщенными жирными кислотами (далее по тексту: PUFA), поскольку присутствие атомов, отличных от водорода (Н) в 1 и/или 2 атомах углерода, блокирует его деградацию через β-окисление. Это вызывает существенные изменения в составе мембран, регулируя взаимодействие периферических белков в передаче сигналов в клетках. Это может привести, например, к различиям в упаковке поверхности мембраны, модулируя связывание периферических белков, которые принимают участие в распространении клеточных сигналов. Таким образом, молекулы D-PUFA, которые являются предметом данного изобретения, обладают более высокой активностью по сравнению с PUFA, демонстрируя значительно более высокий фармакологический эффект для лечения указанных заболеваний.
Как указывалось выше, заболевания, которые поддаются лечению молекулами D-PUFA по изобретению, имеют одинаковую этиологию, связанную со структурными и/или функциональными (или любой иной природы) изменениями липидов в мембранах клеток, или белков, которые взаимодействуют с ними.
Последующие заболевания приводятся в качестве примера:
- рак: рак печени, рак молочной железы, лейкемия, рак головного мозга, рак легких и т.д.;
- сосудистые заболевания: атеросклероз, ишемия, аневризмы, внезапный приступ, кардиомиопатия, ангиогенез, сердечно-сосудистая гиперплазия, гипертензия, инфаркт миокарда, стенокардия, инсульт (цереброваскулярные события) и т.д.;
- ожирение, избыточная масса, контроль аппетита и целлюлит;
- метаболические заболевания: гиперхолестеролемия, гипертриглицеридемия, диабет, резистентность к инсулину и т.д.;
- нейродегенеративные заболевания, неврологические и нейропсихические расстройства: болезнь Альцгеймера, васкулярная деменция, синдром Зеллвегера, болезнь Паркинсона, рассеянный склероз, амиотрофический боковой склероз, склероз гиппокампа и другие типы эпилепсии, фокальный склероз, адренолейкодистрофия и другие типы лейкодистрофии, васкулярная деменция, старческая деменция, деменция с тельцами Леви, множественная системная атрофия, прионовое заболевание, головные боли, включая мигрень, повреждение центральной нервной системы, расстройства сна, головокружение, боль, инсульт (цереброваскулярные события), депрессия, беспокойство, зависимости, проблемы с памятью, обучением или когнитивной функцией и общие заболевания, при которых требуется остановка нейродегенерации или нейрорегенерация, которые индуцируются лечением соединениями по изобретению;
- воспалительные заболевания, включая воспаление, сердечно-сосудистое воспаление, вызванное опухолью воспаление, воспаление ревматоидного происхождения, воспаление инфекционного происхождения, респираторное воспаление, острое и хроническое воспаление, гипералгезия воспалительной природы, отек, воспаление в результате травмы или ожогов и т.д.
Производные D-PUFA по настоящему изобретению имеют следующую формулу (I):
COOR 1 -CHR 2 -(CH 2 ) a -(CH=CH-CH 2 ) b -(CH 2 ) c -CH 3
(I)
где a, b и с могут иметь независимые значения от 0 до 7, и R1 и R2 могут представлять ион, атом или группу атомов с молекулярной массой, которая независимо не превышает 200 Da.
В предпочтительной структуре по изобретению a, b и с могут иметь независимые значения от 0 до 7, R1 является Н и R2 представляет ОН.
В еще одной предпочтительной структуре по изобретению a, b и с могут иметь независимые значения от 0 до 7, R1 является Na, R2 представляет ОН.
В еще одной предпочтительной структуре по изобретению a и с могут иметь независимые значения от 0 до 7, b может иметь независимые значения от 2 до 7, R1 и R2 могут представлять ион, атом или группу атомов, молекулярная масса которых независимо равна или ниже 200 Da.
Введение жирных кислот по изобретению можно проводить любыми способами, например энтерально (внутрибрюшинно), перорально, ректально, местно, ингаляцией или с помощью внутривенной, внутримышечной или подкожной инъекции. Кроме того, можно вводить соединение формулы, приведенной выше, или любое его фармацевтически приемлемое производное, такое как сложные эфиры, простые эфиры, алкилпроизводное, ацилпроизводное, фосфат, сульфат, этилпроизводное, метилпроизводное, пропилпроизводное, соли, комплексы и т.д.
Кроме того, жирные кислоты по изобретению можно вводить самостоятельно или формулировать в фармацевтические или нутрицевтические композиции, в которых их объединяют друг с другом и/или с наполнителями, такими как связующие вещества, заполнители, разрыхлители, смазывающие вещества, оболочки, подсластители, вкусовые вещества, красители, переносчики и т.д. и комбинации всех приведенных веществ. Также жирные кислоты по изобретению могут представлять часть фармацевтических или нутрицевтических композиций в комбинации с другими активными ингредиентами.
Для целей настоящего изобретения термин «нутрицевтическое соединение» определяется как соединение, которое регулярно потребляют во время еды, и оно функционирует для предупреждения заболеваний, в данном случае заболеваний с этиологией, связанной с изменениями липидов клеточных мембран.
Для целей настоящего изобретения термин «терапевтически эффективное количество» представляет количество, которое дает ход обратному развитию или предупреждает заболевание без проявления побочных эффектов.
Краткое описание чертежей
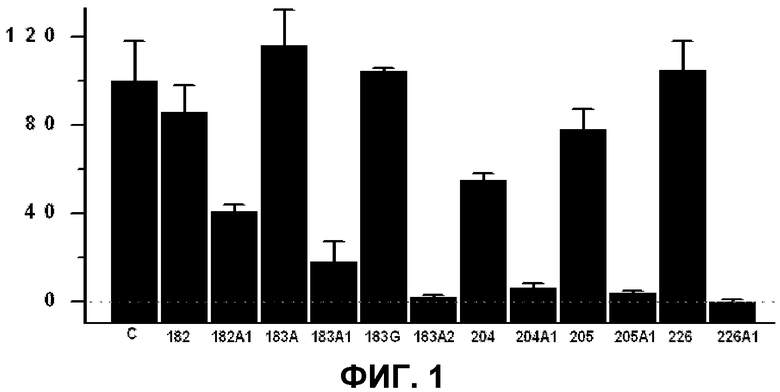
Фиг.1. Влияние соединений, приведенных в таблице 1, на рост опухолевых клеток. На оси Y представлено число жизнеспособных клеток (% от контроля) в зависимости от использованного соединения (ось Х). Клетки карциномы легких человека (А549) культивировали в среде RPMI-1640 с 10% сыворотки в течение 48 ч в отсутствии (контроль) или в присутствии 250 мкМ соединений по изобретению. На графике указано число жизнеспособных клеток (среднее значение и стандартная ошибка среднего в трех опытах). Пунктирная линия представляет общую элиминацию клеток (0% жизнеспособности).
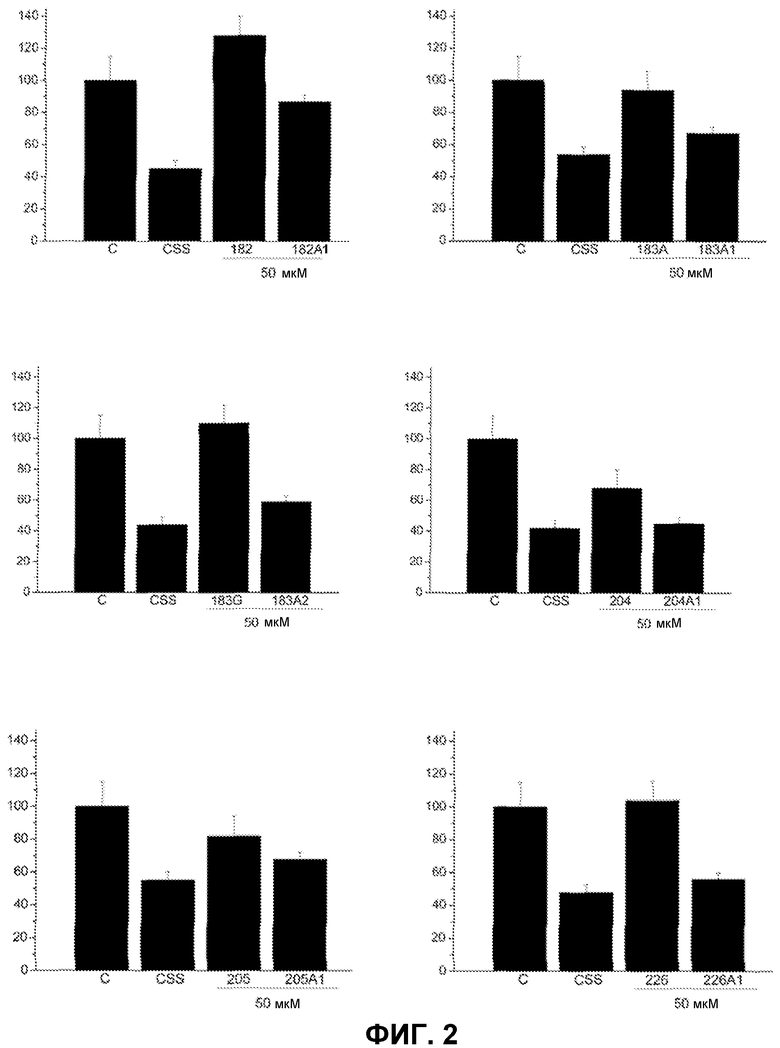
Фиг.2. Влияние некоторых молекул PUFA и D-PUFA по настоящему изобретению на пролиферацию сосудистых клеток А10. На оси Y представлено число клеток (% от контроля) в зависимости от использованного соединения (ось X). Клетки культивировали в полной среде (контроль, С), неполной среде без добавок (CSS) или полной среде в присутствии PUFA (182, 183А, 183G, 204, 205 и 226) или D-PUFA (182А1, 183А1, 183А2, 204А1, 205А1 и 226А1). Снижение пролиферации, но по-прежнему выше значений для среды CSS, указывает, что данные молекулы обладают способностью регулировать аномальную пролиферацию сердечно-сосудистых клеток, не будучи токсичными.
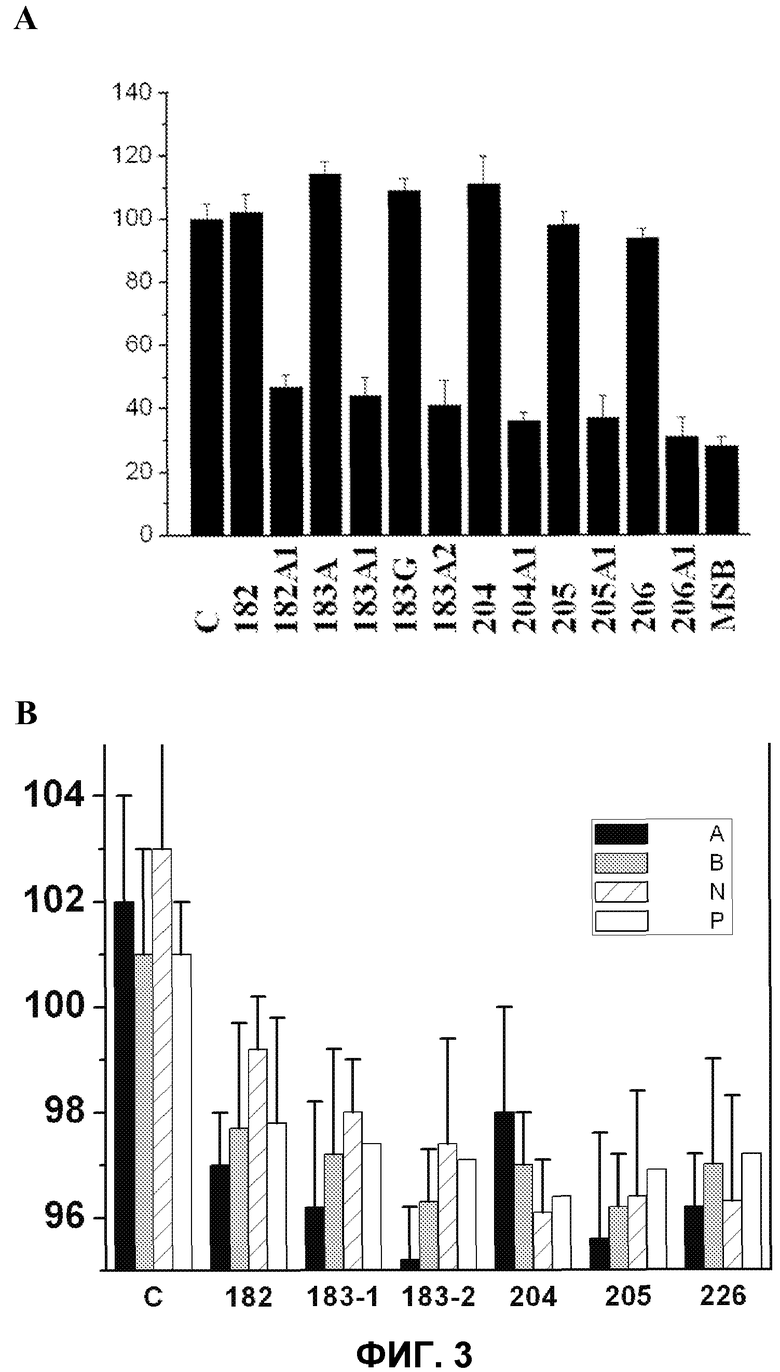
Фиг.3.
А. Пролиферация адипоцитов, культивированных в отсутствии (контроль, С) или в присутствии различных D-PUFA и PUFA. На оси Y указано число клеток (% от контроля) в зависимости от использованной жирной кислоты (ось X). В качестве непролиферативного контроля использовали среду с дефицитом сыворотки (среду с низким процентным содержанием сыворотки, MSB).
В. На оси Y указана масса тела (% от необработанного контроля) и на горизонтальной оси указаны соединения, использованные для обработки опытных животных. На оси Х слева направо вначале указана обработка растворителем (С) и затем обработка несколькими соединениями по изобретению. Крыс SHR обрабатывали в течение одного месяца каждым из 24 соединений, приведенных на фигуре, в дозе 200 мг/кг. Каждая опытная группа состояла из шести животных, и в каждой серии опытов использовали группу, обработанную носителем (водой), результаты сравнивали с массой тела животных, не подвергшихся какой-либо обработке. Буквы A, B, N и P указывают комбинацию радикалов R1 и R2, приведенных в таблице 3.
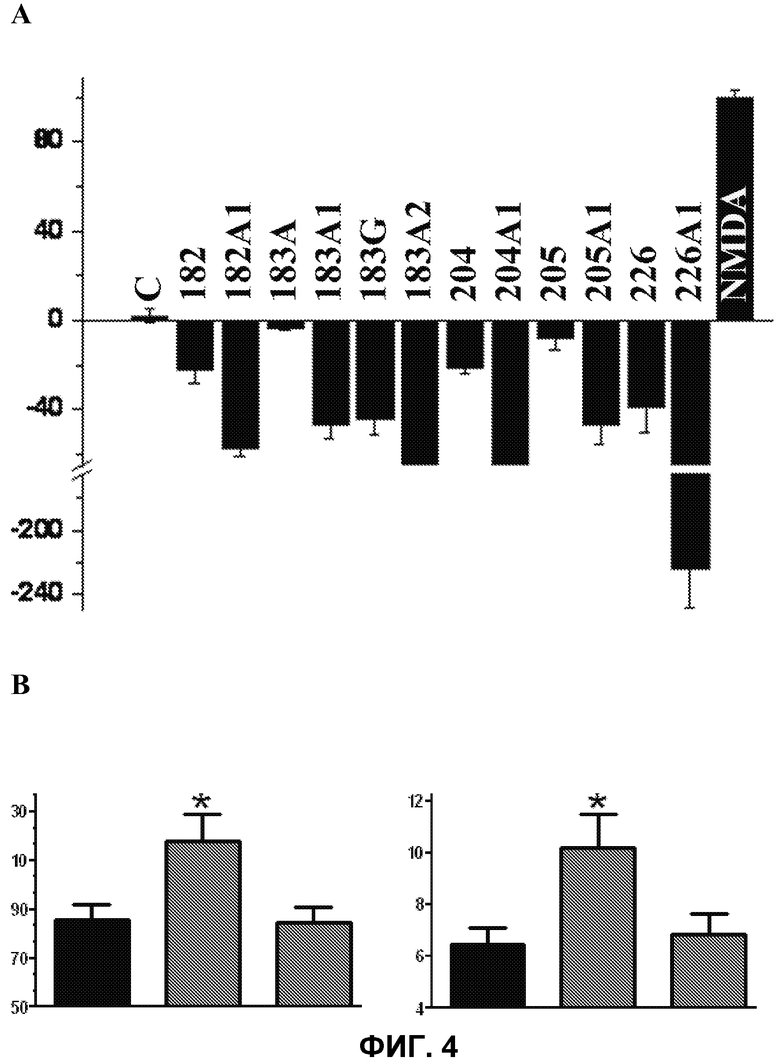
Фиг.4.
А. Гибель клеток Р19, культивированных в отсутствии внешних факторов (контроль, С: 0% гибель нейронов) и в присутствии NMDA (100% гибель нейронов). На вертикальной оси указана гибель нейронов (% от контроля) в зависимости от использованной жирной кислоты (ось Х). Присутствие PUFA индуцировало незначительное увеличение выживаемости клеток Р19 в присутствии NMDA. D-PUFA индуцировали достоверное повышение показателей выживаемости клеток, более 200% в случае соединения 226А1. Поскольку количество клеток в культурах обработанных клеток было выше по сравнению с контролем, то можно утверждать, что данные соединения не только предупреждают гибель нейронов, индуцированную NMDA (антинейродегенеративное действие), но также являются соединениями с нейрорегенеративными агентами.
В. Влияние D-226B1 PUFA в улучшении обучения в радиальном лабиринте на модели болезни Альцгеймера на животных. На оси Y на левой фигуре указано время, потраченное для полного обучения, и на вертикальной оси Y на правой фигуре указано общее количество ошибок, сделанных при выполнении запрограммированного обучения (среднее значение±стандартная ошибка среднего) (время пробега). На обеих фигурах слева направо на оси Х приведены результаты испытаний на здоровых мышах (контроль) (первая колонка), на мышах с индуцированной болезнью Альцгеймера и обработанных водой, использованной в качестве растворителя (вторая колонка) или на мышах, обработанных соединением 226В1 (третья колонка). Животные с болезнью Альцгеймера ориентировались дольше и делали больше ошибок по сравнению со здоровыми мышами, при этом различия были статистически достоверными (*, Р<0,05). В противоположность мыши, страдающие болезнью Альцгеймера, которые были обработаны соединением 226B1, не показали существенного отличия от здоровых животных статистически значимым образом.
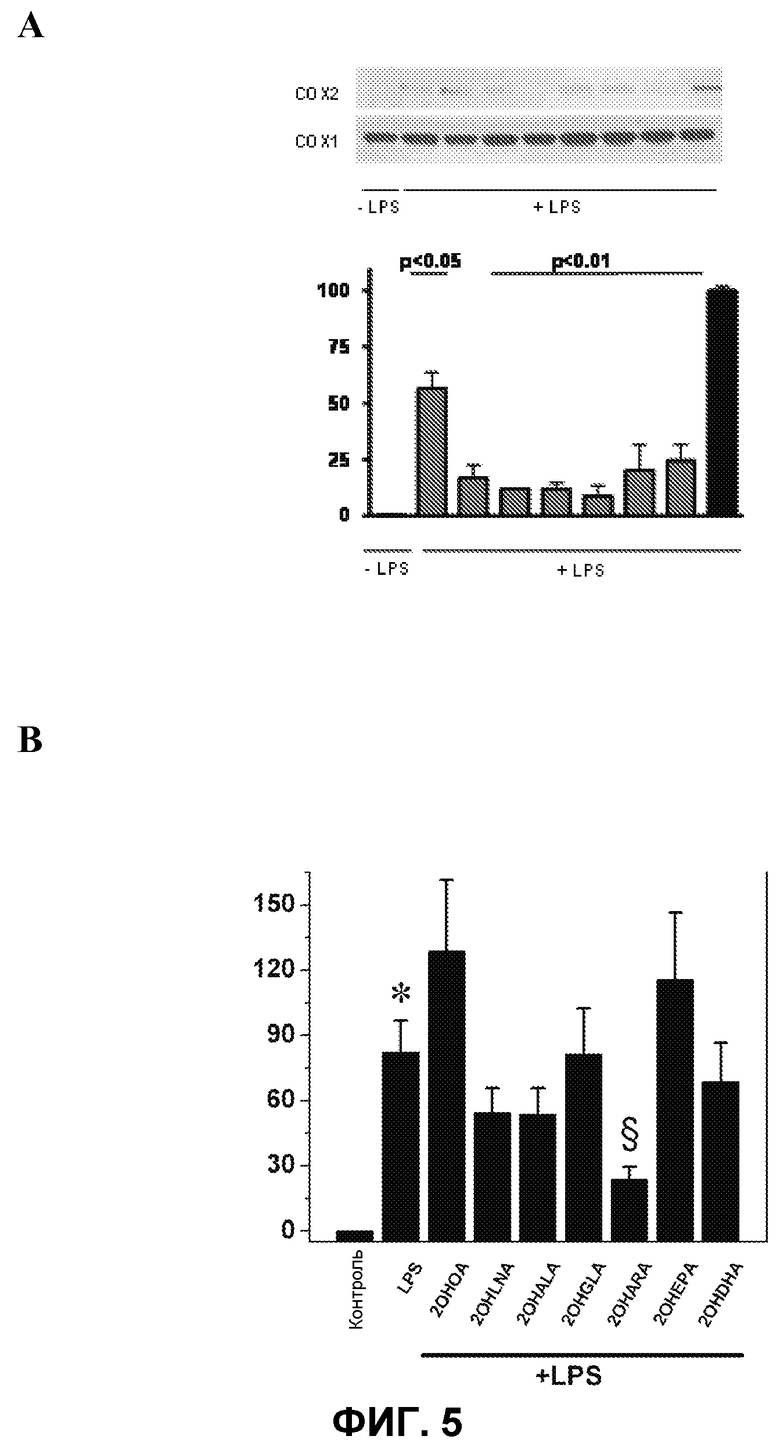
Фиг.5.
А. На верхней панели представлен иммуноблот, показывающий ингибирование экспрессии провоспалительного белка СОХ-2, ранее индуцированной бактериальным липополисахаридом (LPS) (C +, 100%) в человеческих макрофагах, происходящих из моноцитов U937, под действием различных D-PUFA по настоящему изобретению. На нижней панели показано взаимодействие СОХ-2/СОХ-1 в виде % от контроля (ось Y) для следующих соединений (ось Х): ООА (2-гидроксиолеиновая кислота), OLA (182A1), OALA (183A1), OGLA (183A2), OARA (204A1), OEPA (205A1), ODHA (226A1).
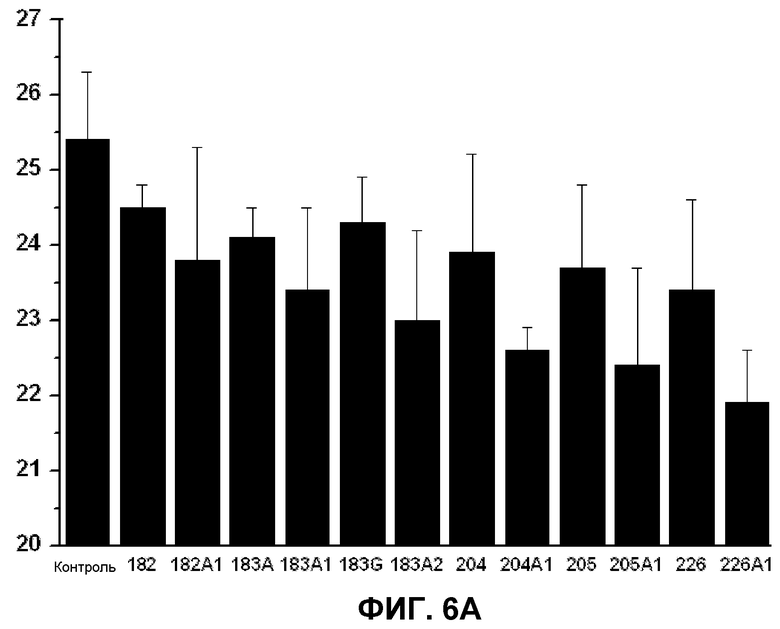
В. Показана противовоспалительная эффективность различных производных D-PUFA по настоящему изобретению на модели воспаления на животных. Было показано ингибирующее действие на концентрацию TNFα (пг/мл), индуцированного у мышей LPS (ось Y), для различных соединений по изобретению (ось Х). Снижение уровня данного фактора непосредственно связано с противовоспалительным лечением. Соединения аналогичны соединениям, приведенным на левой панели.
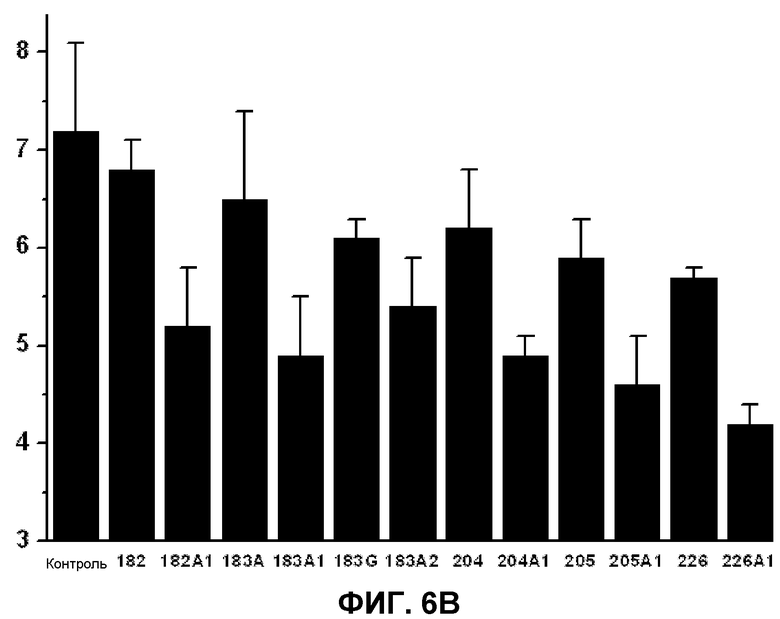
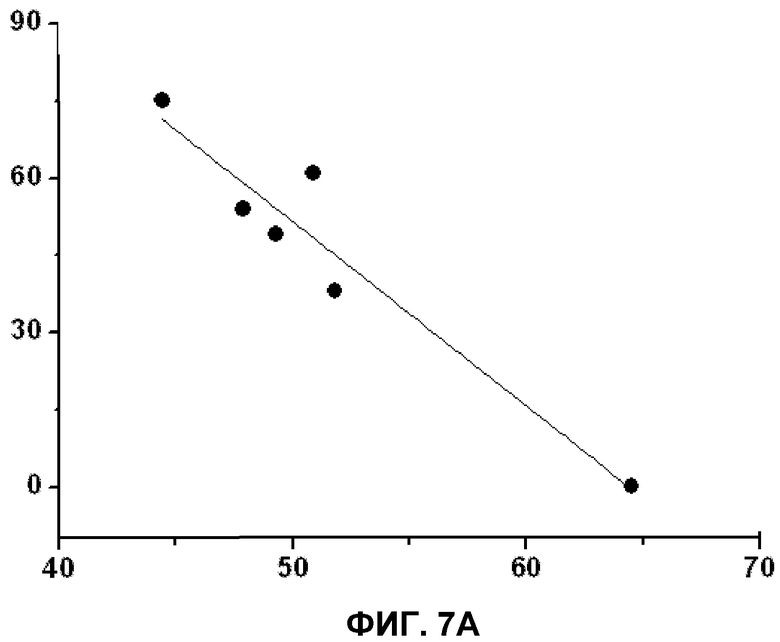
Фиг.6. Содержание холестерина (А) и общее содержание триглицеридов (В) в клетках 3Т3-L1. На вертикальной оси указана концентрация холестерина (А) или триглицеридов (В) (% от общих липидов) в зависимости от использованной жирной кислоты (ось X). Приведенные значения представляют среднее значение±стандартная ошибка среднего для холестерина и триглицеридов по сравнению с общими липидами в клеточных мембранах по данным спектрофотометрического метода (холестерин) или тонкослойной хроматографии с последующим анализом газовой хроматографией (триглицериды). Графики показывают установленные значения в клетках, культивированных в отсутствии (контроль) или в присутствии D-PUFA или PUFA, приведенных выше.
Фиг.7.
А. Взаимосвязь между структурой мембраны и клеточными эффектами, вызванными D-PUFA. На оси ординат приведены клеточные эффекты (% от контроля) в сравнении с температурой фазового перехода HII (ось Х). Определяли среднее значение эффекта для каждой молекулы D-PUFA (средний эффект каждого липида на моделях всех исследуемых заболеваний и число двойных связей) и строили график зависимости от температуры фазового перехода. Снижение температуры фазового перехода HII указывало на более значительную индукцию нарушения целостности мембран, что приводило к возникновению «якорных» сайтов в мембране для периферических белков и к лучшей регуляции передачи сигналов в клетке и, следовательно, более эффективному контролю некоторых заболеваний.
В. Взаимосвязь между терапевтической эффективностью PUFA (незакрашенные кружки) и D-PUFA (закрашенные кружки). Каждая точка представляет среднее значение эффекта, наблюдаемого для всех исследованных заболеваний (ось Y: изменение в % по отношению к контрольному значению) в зависимости от числа двойных связей, присутствующих в молекуле (горизонтальная ось). В обоих случаях корреляция носила статистический значимый характер (Р<0,05). Наблюдали, что терапевтический эффект зависел от числа двойных связей в молекуле, что, в свою очередь, связано со способностью регулировать структуру мембран. В данном смысле наличие радикала при 1 и 2 атомах углерода, находящихся в D-PUFA, но отсутствующих в PUFA, важно для усиления терапевтического эффекта данных молекул.
Полученные результаты свидетельствуют о том, что эффекты липидов, входящих в объем данного изобретения, имеют общую основу. Данные корреляции (со значениями r2, равными 0,77 и 0,90 для D-PUFA и Р<0,05 в обоих случаях) четко указывают, что структура используемых липидов, является основой для их действия и что оно опосредуется через регуляцию структуры мембран, базирующейся на взаимосвязи структура-функция для каждого липида. В действительности имеется ряд исследовательских работ, в которых заболевания человека ассоциируют с изменениями, описанными выше, в содержании PUFA, демонстрируя важную роль липидов в физиологии клеток.
Подробное описание изобретения
Широкий спектр терапевтических применений молекул D-PUFA по настоящему изобретению предполагает, что молекулы D-PUFA придают мембранам специфические структурные свойства, которые обеспечивают правильный процессинг активности, осуществляемой в данных мембранах и через данные мембраны. Другими словами, причиной многих аномалий, являющихся причиной различных заболеваний, являются существенные изменения в содержании некоторых важных для функции клеток липидов и/или белков, взаимодействующих с мембранами и/или связанными с продукцией липидов. Данные патологические изменения, которые могут привести к развитию различных заболеваний, можно предупредить или дать ход их обратному развитию с помощью синтетических жирных кислот, описанных в данном изобретении, которые можно эффективно использовать для лечения или предупреждения любых заболеваний, этиология которых связана с изменениями в составе, структуре или любыми другими изменениями липидов в биологических мембранах, или с нарушением регуляции передачи сигналов в клетке, возникших в результате изменений данных липидов в биологических мембранах. Кроме того, липиды, входящие в объем данного изобретения, также можно использовать в качестве лекарственных препаратов, в том случае, когда заболевание развивается в результате другого изменения, при условии, что модуляция свойств и/или функций мембраны способна отменить патологический процесс.
Для данного исследования терапевтических эффектов жирных кислот по настоящему изобретению использовали культивированные клеточные линии и модели различных заболеваний на животных и исследовали активность D-PUFA и PUFA в лечении различных заболеваний.
Структура молекул по изобретению приведена в таблицах 1, 2 и 3. С учетом формулы (I) соединения по настоящему изобретению предпочтительно представляют комбинации значений a, b и с, приведенных в таблице 1.
Кроме того, в изобретении соединения обозначаются трехзначным числом с последующим символом Х1 или Х2. Цифра 1 означает все использованные D-PUFA, за исключением серий, основанных на С18:3 ω-6 (γ-линолевая кислота), которые обозначены цифрой 2. Первые две цифры данного номера означают количество атомов углерода в молекуле. Третья цифра данного номера представляет количество двойных связей. Буква Х замещается буквами от А до W (таблица 3), данные буквы от А до W обозначают конкретную комбинацию радикалов R1 и R2 в формуле (I).
Таким образом, особо предпочтительное соединение по данному изобретению обозначено сокращениями: 182Х1, 183Х1, 183Х2, 204Х1, 205Х1, 226Х1, и их следует расшифровывать согласно приведенным выше указаниям.
В таблице 2 приведены структуры некоторых молекул D-PUFA по изобретению и PUFA, из которых они получены. Как можно заметить, в таблице приводятся некоторые соединения по изобретению с различными комбинациями значений a, b и с, и в которых радикалы R1 и R2 отмечены буквой А, что означает, как описано выше, что R1 представляет Н, и R2 является ОН (см. таблицу 3).
В таблице 3 приведены различные комбинации радикалов R1 и R2, которые можно комбинировать со значениями a, b и с, приведенными в таблице 1.
R2
Примеры
Пример 1. Общий процент PUFA в мембранах клеток, обработанных D-PUFA и PUFA
Молекулы синтетических D-PUFA являются гидрофобными молекулами, и, следовательно, клетки, подвергшиеся воздействию данных D-PUFA, имеют высокое содержание данных жирных кислот на их поверхности.
В таблице 4 показан общий процент PUFA в мембранах клеток 3Т3, обработанных 100 мкМ данных жирных кислот в течение 48 ч. Для постановки данных опытов мембраны экстрагировали и общую фракцию жирных кислот подвергали гидролизу в щелочной среде. Метанольные производные данных жирных кислот определяли газовой хроматографией. Приведенные данные представляют средние значения четырех независимых определений массы PUFA, деленное на общее количество жирных кислот и выраженное в процентах. Также показана стандартная ошибка среднего. В культурах клеток 3Т3, инкубированных в присутствии данных жирных кислот, обнаруживали более высокие концентрации PUFA (включая D-PUFA) и более низкие концентрации насыщенных жирных кислот.
Контроль соответствует культуре без добавления природных или синтетических жирных кислот. В клетках в их природной форме PUFA находятся в мембранах, но присутствие в среде молекул D-PUFA по изобретению приводит к повышению содержания PUFA в клеточной мембране. Следовательно, на основании данных результатов можно предположить, что нутрицевтические или фармацевтические композиции данных соединений по настоящему изобретению могут эффективно регулировать состав клеточных мембран.
Пример 2. Переход L (ламеллярной фазы)-в-H II (гексагональную фазу) в клеточных мембранах из DEPE (диэлаидоилфосфатидилэтаноламина)
В таблицах 5 и 6 показана температура перехода (ламеллярной фазы)-в-HII (гексагональную фазу) на модели DEPE мембран. Температуру фазового перехода определяли дифференциальной сканирующей калориметрией. Во всех случаях соотношение DEPE:D-PUFA составляло 10:1 (моль:моль). Переход ламеллярная фаза-гексагональная фаза представляет собой важный параметр, отражающий соответствующие свойства клеточных мембран к передаче сигналов. Способность образовывать фазы HII, которая тем выше, чем ниже температура перехода указывает, что давление поверхности мембран ниже, означая, что полярные головки фосфолипидов образуют менее плотную или компактную сеть по сравнению с сетью, образованной ламеллярными структурами (Escribá et al., 2008). Когда это происходит, то некоторые периферические мембранные белки (такие как G-белки, протеикиназа С или белок Ras) легче связываются с мембраной, в то время как другие имеют более слабое взаимодействие (например, Gα-белок); таким образом, изменения в температуре фазового перехода являются важными для регуляции клеточных функций, связанных со здоровьем или лечением человека (Escribá et al., 1995; Vogler et al., 2004; Escribá, 2006).
Контрольные значения соответствуют модельным мембранам в отсутствии жирных кислот. Снижение температуры фазового перехода HII, наблюдаемое при использовании D-PUFA по изобретению, указывает на повышенную индукцию нарушения целостности мембран с обеспечением «якорных» сайтов в мембране для периферических белков, что приводит к лучшей регуляции передачи сигналов в клетке и, следовательно, более высокой эффективности в контроле некоторых заболеваний.
Таким образом, в таблице 5 показана температура фазового перехода TH (гексагональная-ламеллярная фазы в HII) в мембранах из DEPE (4 мМ) в присутствии или отсутствии 200 мкМ различных соединений по настоящему изобретению серии А.
В таблице 6 приведена температура перехода ламеллярной фазы-в-гексагональную фазу в мембранах DEPE в присутствии D-PUFA из нескольких серий.
Пример 3. Связывание Gi 1 -белка (тримера) с модельной клеточной мембраной
Регуляция липидного состава мембран приводила к изменениям в мембранной структуре по данным дифференциальной сканирующей калориметрии, что вызывало изменения в локализации G-белков в модельных клеточных мембранах, как показано в таблице 7. Общий результат выражается в регуляции передачи сигналов, приводящей к обратному развитию различных патологических процессов, как будет показано ниже. В таблице 7 показано связывание гетеротримерного Gi1-белка с модельными мембранами из фосфатидилхолина:фосфатидилэтаноламина (6:4, моль:моль) по данным анализа центрифугированием с последующим иммуноблоттингом, визуализацией хемилюминесценцией и количественным определением визуализирующим анализом. Для данных опытов использовали 2 мМ фосфолипида и 0,1 мкМ различных D-PUFA, приведенных в таблице 7. Контролем служил образец модельных мембран без жирных кислот.
Результаты этих исследований свидетельствуют о том, что индуцированная модификация структурных и функциональных свойств мембраны приводила к увеличению числа ненасыщенных связей. Присутствие ненасыщенных связей и изменения в 1 и 2 атомах углерода снижали скорость метаболизма PUFA. Данный факт в отношении конкретного воздействия данных липидов на структуру мембран указывает, что действие на аномальные клетки имеет общую природу.
Фактически имела место тесная корреляция между фармакологическим действием и эффектом, который они оказывали на липидную структуру мембран.
Пример 4. Применение производных 1,2-PUFA для лечения рака
Рак является заболеванием, для которого характерна неконтролируемая пролиферация трансформированных клеток. Как уже указывалось выше, в дополнении к определенным генетическим изменениям рак характеризуется измененным содержанием мембранных липидов, что может оказывать влияние на передачу сигналов в клетке. В данном смысле природные PUFA проявляли некоторую эффективность в отношении роста раковых клеток человека (А549) в концентрациях, использованных для данного исследования, хотя, с учетом их быстрого метаболизма, вряд ли можно было бы достичь более высокой эффективности в организме (фиг.1). Однако D-PUFA проявляли выраженную и достоверно более высокую эффективность по сравнению с немодифицированными в 1 и 2 атомах углерода молекулами (фиг.1 и таблица 8) в одинаковых концентрациях. Данные результаты указывают, что изменения в природных полиненасыщенных жирных кислотах приводят к появлению молекул с сильным противоопухолевым действием и значительно более высоким действием по сравнению с природными PUFA и, следовательно, они обладают высокой применимостью в лечении и профилактике онкологических заболеваний при применении фармацевтических и нутрицевтических подходов у людей и животных.
Для опытов, результаты которых приведены на фиг.1, использовали культивированные клетки немелкоклеточной карциномы легких человека (А549) в среде RPMI 1640 с добавлением 10% фетальной бычьей сыворотки и антибиотиков при 37°С и в атмосфере с 5% СО2. Клетки поддерживали в культуре в течение 48 ч в присутствии или в отсутствии D-PUFA и PUFA, приведенных в таблице 2, в концентрации 250 мкМ. После обработки подсчитывали количество клеток и исследовали механизм противоопухолевой активности соединений с использованием проточной цитометрии. На фиг.1 показан процент выживаемости клеток (приняв его за 100% по отношению к необработанным опухолевым клеткам). Данные значения представляют средние значения трех независимых опытов.
В отдельной серии опытов соединения, приведенные в таблице 3, использовали против различных типов опухолей, перечисленных в таблицах 8А, 8В и 8С. Данные показывают противоопухолевую эффективность соединений по данному изобретению в отношении роста клеток злокачественной опухоли молочной железы, головного мозга (глиомы) и легких. Данные по эффективности выражены в виде значений IC50 (значения концентрации соединений в мкМ, приводящей к 50% гибели опухолевых клеток) через 72 ч инкубации. Другие экспериментальные условия были идентичны условиям, описанным в предыдущем разделе.
Полученные результаты четко указывают на то, что все D-PUFA проявляли высокую эффективность против роста опухолей. В целом можно отметить, что серии соединений А и В показывали наилучшие результаты, и исходя из этого, тестировали эффективность данных серий против лейкемии и рака печени (таблицы 9 и 10). Также можно утверждать, что соединения серий 204 и 226, т.е. пронумерованные D-PUFA с парными номерами ненасыщенных связей, больше по размеру и являются наиболее эффективными. Данные результаты указывают, что фармакологическая активность соединений по настоящему изобретению подчиняется зависимости структура-функция, что также подтверждает тезис об общем механизме действия, связанном со структурой каждого соединения, и, следовательно, единстве изобретения в данном разделе.
В таблице 8А приведены данные эффективности соединений по изобретению в отношении роста клеток злокачественной опухоли молочной железы MDA-MB-231, выраженной в значениях IC50 в микромолях.
Субсерии молекул
В таблице 8В приведены данные эффективности соединений по изобретению в отношении клеток злокачественной опухоли головного мозга (глиомы) U118, выраженной в значениях IC50 в микромолях.
Субсерии молекул
В таблице 8С приведены данные эффективности соединений по изобретению в отношении клеток карциномы легких А549, выраженной в значениях IC50 в микромолях.
Субсерии молекул
В таблице 9 приведены данные эффективности соединений по изобретению в отношении клеток лейкемии человека (клеток Jurkat), выраженной в значениях IC50 в микромолях через 72 ч.
Субсерии молекул
В таблице 10 приведены данные эффективности соединений по изобретению в отношении клеток карциномы печени (клетки HepG2), выраженной в значениях IC50 в микромолях через 72 ч.
Все эти результаты указывают, что D-PUFA являются пригодными для предупреждения и лечения рака, будучи включенными в нутрицевтические и фармацевтические композиции, у людей и животных. Также установлено, что эффективность D-PUFA коррелирует с повышенным числом двойных связей и что наличие изменений в 1 и 2 атомах углерода важно для проявления противоопухолевой активности липидов при лечении. Поскольку данные соединения обладают противоопухолевым действием против разных опухолевых клеток, можно утверждать, что они являются молекулами с широким спектром противоопухолевого действия и могут широко применяться при любом виде онкологического заболевания.
Пример 5. Применение производных 1,2-PUFA для лечения сердечно-сосудистых заболеваний
В целях исследования пригодности D-PUFA для лечения сердечно-сосудистых заболеваний использовали несколько экспериментальных подходов. Вначале, оценивали эффективность соединений по изобретению в культуре клеток аорты (клеточная линия А-10). Данные клетки поддерживали в культуре с полной средой (среда С с добавлением 10% фетальной бычьей сыворотки и PDGF) и неполной средой (среда CSS с добавлением 1% фетальной бычьей сыворотки без PDGF). Культивирование проводили в течение 72 ч аналогично тому, как описано в предыдущем разделе. После данного периода инкубации подсчитывали число клеток с использованием проточной цитометрии.
В неполной среде (среда CSS без добавления контрольного PDGF) клетки имели характер пролиферации, аналогичный наблюдаемому в здоровом организме. Характер пролиферации, имеющей место в полной среде, будет аналогичным ситуации, которая имеет место в больном организме. Присутствие D-PUFA приводило к значительному снижению пролиферации нормальных клеток аорты (А-10) в полной культуральной среде без пролиферативных агентов, находящихся в фетальной сыворотке, входящей в состав культуральной среды. В присутствии пролиферативных агентов (цитокинов, ростовых факторов и т.д.) количество клеток А10 было аналогичным количеству в неполной среде (CSS) с внесением D-PUFA по настоящему изобретению (фиг.2). В противоположность, PUFA проявляли незначительную антипролиферативную эффективность или она отсутствовала вовсе, показывая, что изменения, внесенные в молекулы данных жирных кислот, существенно повышали их фармакологическое действие в лечении сердечно-сосудистых заболеваний, таких как гипертензия, атеросклероз, ишемия, кардиомиопатии, аневризмы, внезапный приступ, ангиогенез, сердечная гиперплазия, инфаркт миокарда, стенокардия, инсульт (цереброваскулярные события) и т.д.
Действие на данной клеточной линии нельзя рассматривать в качестве токсического эффекта по двум причинам: (1) в полной среде D-PUFA никогда не индуцировали снижение пролиферации клеток ниже уровня, характерного для клеток, инкубированных в неполной среде; (2) в клетках аорты (А10), обработанных D-PUFA, отсутствовали признаки молекулярного или клеточного некроза, апоптоза или клеточной гибели другого типа. Поскольку пролиферация сосудистых клеток является компонентом развития многих сердечно-сосудистых заболеваний, D-PUFA являются пригодными для предупреждения и лечения данных заболеваний посредством нутрицевтических и фармацевтических подходов у людей и животных.
В отдельной серии опытов крысиные кардиомиоциты выделяли и культивировали в условиях in vitro в течение 24 ч, после чего определяли ряд параметров. Вначале определяли число, длину и ширину клеток в культуре. Наблюдали, что все соединения серий А и В (182-226) были способны увеличивать число клеток, выживших в культуре (в пределах от 12 до 33%), а также их длину и ширину (в пределах от 18 до 42%). Кроме того, данные соединения снижали высвобождение лактатдегидрогеназы (ЛДГ) в ответ на аноксию (снижение в пределах 9-68% для всех соединений серий А и В). Данные результаты указывают, что молекулы D-PUFA по настоящему изобретению обладают защитным действием для клеток сердца и сосудов и повышают их эластичность, что можно использовать для предупреждения и лечения сердечно-сосудистых заболеваний различных видов, таких как гипертензия, атеросклероз, ишемия, кардиомиопатия, аневризмы, внезапный приступ, ангиогенез, сердечная гиперплазия, инфаркт миокарда, стенокардия, инсульт (цереброваскулярные события), патологическое кровообращение и т.д.
В отдельной серии опытов исследовали влияние молекул D-PUFA по настоящему изобретению на кровяное давление у крыс SHR. У этих животных определяли кровяное давление и концентрацию аполипопротеина AI (apoA-I). Для данных опытов крыс со спонтанной гипертензией (SHR) обрабатывали в течение 30 суток носителем (водой) или соединениями по изобретению (в дозе 200 мг/кг/сутки, перорально). В конце данного периода определяли кровяное давление и концентрацию аполипопротеина AI в сыворотке крови. Результаты свидетельствовали о наличии у соединений по настоящему изобретению способности снижать кровяное давление и индуцировать экспрессию apoA-I, указывая на то, что данные молекулы являются пригодными для лечения гипертензии и атеросклероза (таблица 11). В данных опытах использовали неинвазивные методы для определения кровяного давления (метод с манжеткой на хвост) и оценку экспрессии гена apoA-I (ОТ-ПЦР), описанные в литературе (Teres et al., 2008). Применимость молекул по настоящему изобретению для лечения сердечно-сосудистых заболеваний подтверждается их способностью снижать концентрацию холестерина и триглицеридов в сыворотке крови (см. ниже).
В таблице 11 приведены данные кровяного давления (в мм рт.ст.) и концентрации apoA-I (%) у крыс SHR. Средние значения для крыс SHR до лечения составляли соответственно 214 мм рт.ст. и 100%.
Пример 6. Применение производных 1,2-PUFA для лечения ожирения
На фиг.3А показано, каким образом PUFA (природные и синтетические соединения) способны подавлять гиперплазию и гипертрофию жировых клеток. Для этого опыта использовали адипоциты 3T3-L1. Данный эффект уже известен и был описан ранее для немодифицированных PUFA (Hill et al., 1993). Однако D-PUFA обладают повышенной способностью ингибировать пролиферацию жировых клеток (фиг.3А). Наблюдаемый эффект в любом случае не является токсическим, поскольку ингибирование роста жировых клеток не приводило к снижению пролиферации клеток ниже уровня для клеток, культивированных в неполной среде (с 1% сыворотки). Использованные клеточные культуральные среды и условия были аналогичны описанным выше.
Полученные результаты показывают, что D-PUFA обладают высокой потенциальной способностью ингибировать рост жировых клеток и, следовательно, пригодны для предупреждения и лечения ожирения и других процессов, связанных с накоплением адипоцитов в организме (например, целлюлита), или изменения аппетита при использовании нутрицевтических или фармацевтических композиций у животных и людей. Вновь наблюдаемый эффект показывал корреляцию с числом двойных связей в использованных молекулах и наличием модификаций в 1 и 2 атомах углерода в липидной молекуле.
Кроме того, несколько соединений по настоящему изобретению использовали для изучения их влияния на массу тела крыс (фиг.3В). В этом отношении у крыс со спонтанной гипертензией (SHR), обработанных соединениями 182-226 (серии А, В, N и Р), наблюдали снижение массы тела через 1 месяц обработки в дозе 200 мг/кг (снижение на 3,2 и 6,9%), частично вызванное уменьшением приема корма и частично подавлением пролиферации жировых клеток (у необработанных животных, которым скармливали такое же количество корма, масса тела снижалась не так заметно, как у обработанных крыс). Результаты опытов свидетельствуют о том, что данные соединения можно использовать для контроля массы тела (развития ожирения и избыточной массы тела), контроля аппетита и регуляции жира тела (целлюлита).
Пример 7. Применение производных 1,2-PUFA для лечения нейродегенеративных заболеваний
В данных опытах использовали различные модели нейродегенерации. Вначале исследовали клетки Р19, когда дифференцировку нейронов индуцировали транс-ретиноевой кислотой. Для этого клетки Р19 инкубировали в минимальной эссенциальной среде (α-МЕМ) с добавлением 10% фетальной бычьей сыворотки и 2 мкМ транс-ретиноевой кислоты при 37°С в атмосфере с 5% СО2. Клетки инкубировали в присутствии или отсутствии нескольких D-PUFA или PUFA в различных концентрациях в течение 24 ч. Нейротоксичность индуцировали 1 мкМ NMDA. Затем подсчитывали количество клеток под оптическим микроскопом после окрашивания трипановым синим. Результаты данных опытов показывали, что PUFA обладают защитным действием в отношении дегенерации нейронов, хотя, эффект, опосредуемый D-PUFA, был значительно выше (фиг.4А и таблица 12). Из данных фигуры и таблицы становится очевидным, что молекулы D-PUFA по настоящему изобретению защищают нейроны от гибели, поскольку они ингибируют индуцированную NMDA гибель нейронов, таким образом, данные соединения могут быть пригодными для предупреждения и лечения нейродегенеративных заболеваний, таких как болезнь Альцгеймера, склероз, болезнь Паркинсона, лейкодистрофия и т.д. Также было показано, что количество клеток в обработанных культурах выше по сравнению с культурами без добавления агентов, вызывающих нейродегенерацию. В частности, отсутствие гибели клеток указывает, что количество клеток Р19 было выше по сравнению с контролем. Следовательно, производные D-PUFA по настоящему изобретению можно использовать для стимуляции нейрорегенеративных процессов, которые имеют место после травм (несчастных случаев) или воздействия токсинов.
В таблице 12 показано защитное действие для нейронов от гибели на клетках Р19: ингибирование гибели нейронов (клеток Р19) с помощью D-PUFA по настоящему изобретению после обработки NMDA (последний вызывает 100% гибель). Гибель контрольных клеток без воздействия NMDA отсутствовала (0% гибель). Все процентные значения ниже 100%, что указывает на защиту нейронов от гибели. Отрицательные значения указывают, что в дополнении к защите нейронов от гибели имеется определенная пролиферация нейронов. Кроме того, соединения по настоящему изобретению снижали концентрацию α-синуклеина (таблица 13), белка, связанного с нейродегенеративными процессами, такими как болезнь Паркинсона, болезнь Альцгеймера, деменция с тельцами Леви, множественная системная атрофия, прионовые заболевания и т.д. Следовательно, молекулы по настоящему изобретению можно использовать для предупреждения и лечения нейродегенеративных, нейрорегенеративных, неврологических и нейропсихических процессов.
В таблице 13 показана экспрессия α-синуклеина в культивированных нейронах (клетках Р19). С (контроль) представляет процент α-синуклеина в необработанных клетках (100%).
Для тестирования эффективности соединений по настоящему изобретению в индукции нейрорегенерации или подавлении нейродегенерации использовали модель болезни Альцгеймера на животных. На данной модели у мышей развивается нейродегенерация, поскольку они экспрессируют ряд мутантных белков, приводящих к повреждению головного мозга (мыши Alzh). В качестве контрольных животных использовали мышей В6. Животных обеих групп в течение 3 месяцев обрабатывали носителем (водой) или различными D-PUFA (в дозе 20 мг/кг ежедневно перорально), пока они не достигали 3-месячного возраста. Для определения улучшения когнитивной функции после обработки испытуемыми соединениями оценивали поведение животных в радиальном лабиринте. Животных содержали на ограниченном рационе для возбуждения аппетита. В симметричном радиальном лабиринте с 8 отсеками делали визуальные отметки для облегчения ориентации у животных и в четыре отсека помещали корм (15 мг таблетки). Определяли время для каждого животного, необходимое для полного обучения, и число ошибок с использованием камеры, подсоединенной к компьютеру. В данном смысле животные с болезнью Альцгеймера имели показатели примерно на 50% выше по сравнению со здоровыми животными, то есть как по времени, необходимом для обучения, так и по числу сделанных ошибок (фиг.4В). В противоположность мыши с болезнью Альцгеймера, обработанные 226В1 (Alzh+LP226), показывали параметры поведенческих реакций, сходные с контрольными животными, которые были достоверно ниже (P<0,05) по сравнению с животными, обработанными носителем (Alzh). В опыте также тестировали эффективность соединений 183В1, 205А1, 205В1, 226А1, 226В1, 226V1, и результаты этих оценочных опытов показывали улучшение обучения у животных с болезнью Альцгеймера (время соответственно 98, 92, 93, 86 и 89 сек). С другой стороны, также интересно отметить, что эти же соединения (183В1, 205А1, 205В1, 226А1, 226V1) приводили к снижению времени, необходимого для завершения обучения у контрольных мышей (здоровые мыши В6) соответственно 8, 11, 12, 18, 16 и 14 сек. Следовательно, можно прийти к заключению, что данные соединения обладают высокой активностью не только в отношении нейродегенерации, но и нейрорегенерации. Среди нейродегенеративных процессов, которые можно предупреждать и лечить с помощью молекул D-PUFA по настоящему изобретению, находятся болезнь Альцгеймера, болезнь Паркинсона, синдром Зеллвегера, рассеянный склероз, амиотрофический латеральный склероз, склероз гиппокампа и другие типы эпилепсии, фокальный склероз, адренолейкодистрофия и другие лейкодистрофии, васкулярная деменция, старческая деменция, деменция с тельцами Леви, множественная системная атрофия, прионовые заболевания и т.д. Кроме того, нейрорегенеративную активность, судя по эффекту на мышах с болезнью Альцгеймера и здоровых мышах В6, можно использовать для лечения других патологических процессов, при которых имеет место потеря нейронов, например, в результате несчастного случая, хирургической операции, травмы различной природы или действия токсинов. Молекулы D-PUFA по настоящему изобретению также можно использовать для предупреждения или лечения различных неврологических и/или нейропсихических расстройств, таких как головные боли, включая мигрень, повреждение центральной нервной системы, расстройства сна, головокружение, боль, инсульт (цереброваскулярные события), депрессия, беспокойство, аддикции, проблемы с памятью, обучением или когнитивной функцией, и для улучшения памяти и когнитивной функции у людей.
Пример 8. Применение производных 1,2-PUFA для лечения воспалительных заболеваний
Циклооксигеназа (СОХ) является ферментом, который связывается с мембраной, захватывая из нее некоторые липиды, и катализирует их превращение в молекулы, обладающие воспалительной активностью. Связывание данного фермента с мембранными липидами частично зависит от структуры мембранных липидов. Повышенная активность изоформ СОХ1 и СОХ2 связана с этиопатологией ряда воспалительных заболеваний через ингибирование метаболизма арахидоновой кислоты с образованием провоспалительных липидных медиаторов. Производные D-PUFA по настоящему изобретению воспроизводят серию клеточных сигналов, которые изменяют метаболизм арахидоновой кислоты и в результате этого ингибируют активность и экспрессию СОХ в моноцитах в культуре (таблица 14 и фиг.5). Также D-PUFA по настоящему изобретению ингибировали продукцию провоспалительных цитокинов (TNF-α) в условиях in vivo (таблица 15 и фиг.5). Для данной цели мышей C57BL6/J обрабатывали различными производными (в дозе 200 мг/кг перорально) после индукции воспалительной реакции внутрибрюшинным введением 20 мкг бактериального липополисахарида (LPS). Результаты опытов четко указывают на эффективность D-PUFA по настоящему изобретению в предупреждении или отмене воспалительных процессов и патологий.
В таблице 14 приведены данные по экспрессии СОХ-2 в культуре моноцитов. Ингибирование экспрессии СОХ-2 в моноцитах. Ингибирование в процентах (по сравнению с положительным контролем в присутствии LPS, 100%) белка СОХ-2 (экспрессия) различными производными жирных кислот.
В таблице 15 приведены данные синтеза TNF-α (%) у мышей: процент TNF-α в сыворотке крови после внутрибрюшинного введения LPS (в дозе 20 мкг) у мышей C57BL6/J (100%).
Данные результаты показывают, что молекулы по настоящему изобретению могут быть пригодными для предупреждения или лечения воспалительных заболеваний, включая воспаление, воспаление в сердечно-сосудистой системе, воспаление, вызванное опухолями, воспаление ревматоидной природы, воспаление, вызванное инфекцией, респираторное воспаление, острое и хроническое воспаление, гипералгезию воспалительной природы, отек, воспаление в результате травмы или ожогов и т.д.
Пример 9. Применение производных 1,2-PUFA для лечения метаболических заболеваний
Липиды являются ключевыми молекулами в поддержании метаболических функций. Обработка PUFA приводила к некоторому незначительному снижению концентрации холестерина и триглицеридов в клетках 3T3-L1. Однако обработка D-PUFA приводила к выраженному и достоверному снижению уровня холестерина и триглицеридов в этих клетках. В данных опытах указанные выше клетки инкубировали в среде RPMI 1640 в присутствии 10% фетальной бычьей сыворотки при 37°С в атмосфере 5% СО2 и в присутствии или отсутствии 150 мкМ различных PUFA или D-PUFA. Клетки инкубировали в течение 24 ч и затем экстрагировали липиды и определяли концентрацию холестерина и триглицеридов, следуя методам, описанным ранее (Folch et al., 1951).
В отдельной серии опытов крыс SHR обрабатывали различными соединениями по настоящему изобретению (в дозе 200 мг/кг ежедневно в течение 28 суток, перорально) и определяли концентрацию холестерина, триглицеридов и глюкозы в сыворотке крови с использованием колориметрических методов. Наблюдали, что данные соединения вызывали достоверное (и во многих случаях выраженное) снижение уровня данных метаболитов (таблица 16).
Результаты, приведенные на фиг.6 и в таблице 16, четко демонстрируют, что D-PUFA можно использовать в качестве лекарственных препаратов для лечения или предупреждения метаболических заболеваний, таких как гиперхолестеролемия, гипертриглицеридемия, диабет и резистентность к инсулину у людей и животных с использованием фармацевтических и нутрицевтических композиций. Одновременное высокое содержание холестерина и триглицеридов, высокая концентрация глюкозы вместе с сердечно-сосудистыми изменениями и/или изменениями массы тела приводят к развитию «метаболического синдрома», частота распространения которого начинает возрастать в западных странах. Соединения по настоящему изобретению обладают высоким терапевтическим потенциалом для лечения метаболического синдрома.
В таблице 16 приведены данные о содержании холестерина, триглицеридов и глюкозы у крыс SHR. В таблице приведены: уровень холестерина (верхние цифры), триглицеридов (средние цифры) и глюкозы (нижние цифры) в сыворотке крови крыс SHR, обработанных молекулами, описанными выше (в дозе 200 мг/кг ежедневно, перорально, в течение 28 суток). Значения выражены в виде процентов, и показатели у необработанных (контрольных) крыс всегда принимали за 100%.
Пример 10. Структурная основа терапевтических эффектов 1,2-производных PUFA
Результаты многочисленных исследований показали, что прием липидов или обработка ими приводит к изменениям в липидном составе клеточных мембран. Кроме того, состав оказывает непосредственное влияние на липидную структуру мембран, что, в свою очередь, регулирует передачу сигналов и связано с развитием многих заболеваний. На фиг.7 показана корреляция между изменениями в структуре мембран, вызванными различными D-PUFA (по данным определения температуры фазового перехода HII), и клеточными эффектами, наблюдаемыми в данном исследовании. Для этой цели авторы определяли средний эффект каждого из D-PUFA (среднее значение для каждого липида при всех изучаемых заболеваниях по отношению к числу двойных связей) и строили график зависимости от температуры фазового перехода. Снижение температуры фазового перехода HII указывает на высокую индукцию нарушения целостности мембран, создавая «якорные» сайты для белков периферических мембран, что приводит к лучшей регуляции передачи сигналов и, следовательно, более эффективному контролю некоторых заболеваний. До определенной степени на основании того факта, что сложные организмы могут метаболизировать лекарственные препараты и что некоторые дополнительные механизмы могут функционировать при некоторых типах (подтипах) заболеваний, можно предположить, что некоторые молекулы с меньшим количеством двойных связей могут обладать более высокой фармакологической активностью. Однако в целом оказалось, что терапевтическое действие зависит от числа двойных связей в молекуле, что само по себе связано со способностью регулировать структуру мембран. В данном смысле наличие радикалов в 1 и/или 2 атомах углерода в производных D-PUFA по настоящему изобретению, но не в природных PUFA, важно для повышения терапевтического действия данных молекул.
Полученные результаты свидетельствуют о том, что эффекты липидов, входящих в объем данного изобретения, имеют общую основу. Данные корреляции (со значениями r2, равными 0,77 и 0,90 для D-PUFA и P<0,05 в обоих случаях) четко указывают, что структура используемых липидов является основой для их действия и что оно проявляется через регуляцию структуры мембраны, вызванной наличием зависимости структура-функция для каждого липида.
Таким образом, настоящее изобретение в первом аспекте относится к соединениям формулы (I) или их фармацевтически приемлемым производным, в которой a, b и с независимо могут иметь значения от 0 до 7, R1 и R2 могут независимо представлять ион, атом или группу атомов с молекулярной массой, не превышающей 200 Da, для применения в лечении заболеваний, возникших на основе структурных изменений и/или функциональных характеристик липидов клеточной мембраны, выбранных из рака, сосудистых заболеваний, воспаления, метаболических заболеваний, ожирения, нейродегенеративных заболеваний и неврологических расстройств.
Второй аспект настоящего изобретения относится к применению, по меньшей мере, одного соединения формулы (I) или его фармацевтически приемлемых производных, в которой a, b и с независимо могут иметь значения от 0 до 7, R1 и R2 могут независимо представлять ион, атом или группу атомов с молекулярной массой, не превышающей 200 Da, для получения фармацевтической и/или нутрицевтической композиции для лечения заболеваний, возникших на основе структурных и/или функциональных изменений липидов в клеточных мембранах, выбранных из рака, сосудистых заболеваний, воспаления, метаболических заболеваний, ожирения, нейродегенеративных заболеваний и неврологических расстройств.
Последний аспект настоящего изобретения относится к способу терапевтического лечения заболеваний у людей и животных, этиология которых связана со структурными и/или функциональными изменениями липидов, расположенных в клеточных мембранах, выбранных из рака, сосудистого заболевания, воспаления, метаболических заболеваний, ожирения, нейродегенеративных и неврологических расстройств, который включает введение пациенту терапевтически эффективного количества, по меньшей мере, одного соединения формулы (I) или его фармацевтически приемлемых солей или производных, в которой a, b и с могут иметь независимые значения от 0 до 7, R1 и R2 могут независимо представлять ион, атом или группу атомов с молекулярной массой, не превышающей 200 Da.
Литература
• Alemany et al. 2004. Hypertension, 43, 249.
• Alemany et al. 2007. Biochim Biophys Acta, 1768, 964.
• Buda et al. 1994. Proc Natl Acad Sci USA., 91, 8234.
• Coles et al. 2001. J Biol Chem., 277, 6344.
• Escriba et al. 1995. Proc Natl Acad Sci USA., 92, 7595.
• Escriba et al. 1997. Proc. Natl. Acad. Sci USA., 94, 11375.
• Escriba et al 2003. Hypertension, 41, 176.
• Escriba 2006. Trends Mol Med., 12, 34.
• Escriba et al. 2008. J Cell Mol Med., 12, 829.
• Florent et al. 2006. J Neurochem., 96, 385.
• Folchetal. 1951. J Biol Chem, 191, 83.
• Jackson y Shwartz 1992. Hypertension, 20, 713.
• Jung et al. 2008. Am J Clin Nutr 87, 2003S.
• Lane y Farlow 2005. J Lipid Res., 46, 949.
• Martinez et al. 2005. Mol Pharmacol, 67, 531.
• Rapoport 2008. Postraglandins Leukot. Essent. Fatty Acids 79, 153-156.
• Sagin y Sozmen 2008. J Lipid Res., 46, 949.
• Schwartz et al. 1986. Circ Res. 58, 427.
• Stender y Dyerberg 2004. Ann Nutr Metab., 48, 61.
• Teres et al., 2008. Proc. Natl. Acad. Sci. USA, 105, 13811.
• Trombetta et al. 2007. Chem Biol Interact., 165, 239.
• Vogler et al 2004. J. Biol. Chem., 279, 36540.
• Vogler et al 2008. Biochim Biophys Acta., 1778, 1640.
• Yang et al. 2005. Mol Pharmacol, 68, 210.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ СИНТЕЗА ГИДРОКСИТРИГЛИЦЕРИДОВ И ИХ ПРИМЕНЕНИЕ ДЛЯ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ | 2015 |
|
RU2679443C2 |
| АЛЬФА-ПРОИЗВОДНЫЕ ЦИС-МОНОНЕНАСЫЩЕННЫХ ЖИРНЫХ КИСЛОТ, ПРЕДНАЗНАЧЕННЫЕ ДЛЯ ПРИМЕНЕНИЯ В КАЧЕСТВЕ ЛЕКАРСТВЕННОГО СРЕДСТВА | 2009 |
|
RU2531353C2 |
| ЭНАНТИОМЕРЫ 2-ГИДРОКСИПРОИЗВОДНЫХ ЖИРНЫХ КИСЛОТ | 2012 |
|
RU2687967C2 |
| СОЕДИНЕНИЯ ПЛАЗМАЛОГЕНОВ, СОДЕРЖАЩИЕ ИХ ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ И СПОСОБЫ ЛЕЧЕНИЯ ВОЗРАСТНЫХ ЗАБОЛЕВАНИЙ | 2009 |
|
RU2546108C2 |
| ЭНАНТИОМЕРЫ 2-ГИДРОКСИПРОИЗВОДНЫХ ЖИРНЫХ КИСЛОТ | 2012 |
|
RU2637937C2 |
| ПРИМЕНЕНИЕ ГИДРОКСИОЛЕИНОВОЙ КИСЛОТЫ И РОДСТВЕННЫХ СОЕДИНЕНИЙ ПРИ ПРОИЗВОДСТВЕ ЛЕКАРСТВЕННЫХ СРЕДСТВ | 2002 |
|
RU2310445C2 |
| ПРОЛЕКАРСТВА НЕСТЕРОИДНЫХ ПРОТИВОВОСПАЛИТЕЛЬНЫХ СРЕДСТВ (NSAIA) C ОЧЕНЬ ВЫСОКОЙ СКОРОСТЬЮ ПРОНИКНОВЕНИЯ ЧЕРЕЗ КОЖУ И МЕМБРАНЫ И НОВЫЕ МЕДИЦИНСКИЕ ПРИМЕНЕНИЯ УКАЗАННЫХ ПРОЛЕКАРСТВ | 2007 |
|
RU2509076C2 |
| АНАЛОГИ АЗАЦИТИДИНА И ИХ ПРИМЕНЕНИЕ | 2008 |
|
RU2488591C2 |
| МОРФОЛИНО-ЗАМЕЩЕННЫЕ ПРОИЗВОДНЫЕ МОЧЕВИНЫ ИЛИ КАРБАМАТА В КАЧЕСТВЕ ИНГИБИТОРОВ MTOR | 2012 |
|
RU2616619C2 |
| АНАЛОГИ АЗАЦИТИДИНА И ИХ ПРИМЕНЕНИЕ | 2008 |
|
RU2487883C2 |

Изобретение относится к средству для лечения или предупреждения заболевания, возникшего на основе структурных и/или функциональных, и/или композиционных изменений липидов в клеточных мембранах, выбранного из рака, сосудистых заболеваний, воспалительных заболеваний, метаболических заболеваний, ожирения и избыточной массы тела, неврологических или нейродегенеративных расстройств, которое представляет собой соединение формулы (I) или его фармацевтически приемлемые соли и производные, выбранные из сложных эфиров, простых эфиров, алкила, ацила, фосфата, сульфата, этила, метила или пропила: в которой а и с могут иметь независимые значения от 0 до 7; b может иметь независимые значения от 2 до 7, где R1 выбран из следующих радикалов: Н, Na, К, СН3О, СН3-CH2O и ОРО(О-СН2-СН3)2, и R2 выбран из следующих радикалов: ОН, ОСН3, O-СН3СООН, СН3, Cl, СН2ОН, ОРО(O-СН2-СН3)2, NOH, F, НСОО и N(ОСН2СН3)2. Также изобретение относится к применению соединения формулы (I) и фармацевтической композиции его содержащей. Средства на основании указанного соединения являются более эффективными, чем средства предшествующего уровня техники. 3 н. и 9 з.п. ф-лы, 7 ил., 16 табл., 10 пр.
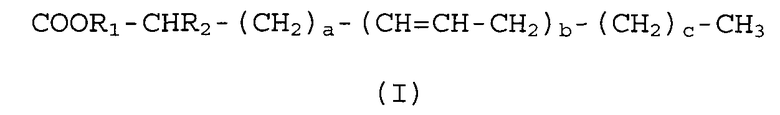
1. Средство для лечения или предупреждения заболевания, возникшего на основе структурных, и/или функциональных, и/или композиционных изменений липидов в клеточных мембранах, выбранного из рака, сосудистых заболеваний, воспалительных заболеваний, метаболических заболеваний, ожирения и избыточной массы тела, неврологических или нейродегенеративных расстройств, которое представляет собой соединение формулы (I) или его фармацевтически приемлемые соли и производные, выбранные из сложных эфиров, простых эфиров, алкила, ацила, фосфата, сульфата, этила, метила или пропила:
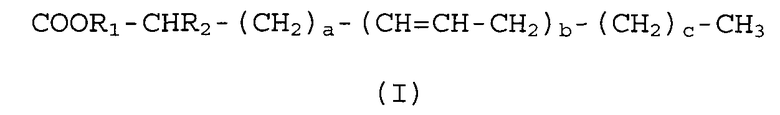
в которой а и с могут иметь независимые значения от 0 до 7, b может иметь независимые значения от 2 до 7, где R1 выбран из следующих радикалов: Н, Na, К, СН3О, СН3-CH2O и ОРО(О-СН2-СН3)2, и R2 выбран из следующих радикалов: ОН, ОСН3, O-СН3СООН, СН3, Cl, СН2ОН, ОРО(O-СН2-СН3)2, NOH, F, НСОО и N(ОСН2СН3)2.
2. Средство по п.1, отличающееся тем, что оно содержит одну из следующих шести комбинаций значений а, b и с: а=6, b=2 и с=3; а=6, b=3 и с=0; а=3, b=3 и с=3; а=2, b=4 и с=3; а=2, b=5 и с=0 и а=2, b=6 и с=0.
3. Средство по п.2, отличающееся тем, что когда R1 представляет Н, то R2 выбран из: ОН, ОСН3 или СН2ОН; когда R1 представляет Na, то R2 выбран из: ОН или СН3; когда R1 представляет К, то R2 является ОН; когда R1 представляет СН3О, то R2 выбран из: ОН, ОСН3, O-СН3СООН, СН3 или НСОО; когда R1 представляет СН3-CH2O, то R2 выбран из: ОН, ОСН3, O-СН3СООН, СН3, Cl, СН2ОН, ОРО(O-СН2-СН3)2, NOH, F, НСОО и N(ОСН2СН3)2; и когда R1 представляет ОРО(O-СН2-СН3)2, то R2 является ОН.
4. Средство по п.3, отличающееся тем, что R1 представляет Н, и R2 является ОН.
5. Применение, по меньшей мере, одного соединения формулы (I), определенного в п.1 или его солей, или фармацевтически приемлемых производных, выбранных из сложных эфиров, простых эфиров, алкила, ацила, фосфата, сульфата, этила, метила или пропила, где а и с могут иметь независимые значения от 0 до 7, b может иметь независимые значения от 2 до 7, где R1 выбран из следующих радикалов: Н, Na, К, СН3О, СН3-CH2O и ОРО(O-СН2-СН3)2, и R2 выбран из следующих радикалов: ОН, ОСН3, O-СН3СООН, СН3, Cl, CH2OH, ОРО(O-СН2-СН3)2. NOH, F, НСОО и N(ОСН2СН3)2, для приготовления фармацевтической и/или нутрицевтической композиции для лечения или предупреждения заболевания, возникшего на основе структурных, и/или функциональных, и/или композиционных изменений липидов в клеточных мембранах, выбранного из рака, сосудистых заболеваний, воспалительных заболеваний, метаболических заболеваний, ожирения и избыточной массы тела, нейродегенеративных или неврологических расстройств.
6. Применение по п.5, в котором соединение формулы (I) отличается тем, что оно содержит одну из следующих шести комбинаций значений а, b и с: а=6, b=2 и с=3; а=6, b=3 и с=0; а=3, b=3 и с=3; а=2, b=4 и с=3; а=2, b=5 и с=0 и а=2, b=6 и с=0.
7. Применение по п.6, отличающееся тем, что когда R1 представляет Н, то R2 выбран из: ОН, ОСН3 или CH2OH; когда R1 представляет Na, то R2 выбран из: ОН или СН3; когда R1 представляет К, то R2 является ОН; когда R1 представляет СН3О, то R2 выбран из: ОН, ОСН3, O-СН3СООН, СН3 или НСОО; когда R1 представляет СН3-СН2О, то R2 выбран из: ОН, ОСН3, O-СН3СООН, СН3, Cl, CH2OH, ОРО(O-СН2-СН3)2, NOH, F, НСОО или N(ОСН2СН3)2; и когда R1 представляет ОРО(O-СН2-СН3)2, то R2 является ОН.
8. Применение по п.7, отличающееся тем, что R1 представляет Н, и R2 является ОН.
9. Фармацевтическая или нутрицевтическая композиция для лечения или предупреждения заболевания, возникшего на основе структурных, и/или функциональных, и/или композиционных изменений липидов в клеточных мембранах, выбранного из рака, сосудистых заболеваний, воспалительных заболеваний, метаболических заболеваний, ожирения и избыточной массы тела, неврологических или нейродегенеративных расстройств, содержащая, по меньшей мере, одно соединение формулы (I) определенное в п.1 или его соли, или фармацевтически приемлемые производные, выбранные из сложных эфиров, простых эфиров, алкила, ацила, фосфата, сульфата, этила, метила или пропила, в которой а и с могут иметь независимые значения от 0 до 7, b может иметь независимые значения от 2 до 7, где R1 выбран из следующих радикалов: Н, Na, К, СН3О, СН3-CH2O и ОРО (O-СН2-СН3)2, и R2 выбран из следующих радикалов: ОН, ОСН3, O-СН3СООН, СН3, Cl, СН2ОН, ОРО(O-СН2-СН3)2, NOH, F, НСОО и N(OCH2CH3)2.
10. Композиция по п.9, в которой соединение формулы (I) отличается тем, что оно содержит одну из следующих шести комбинаций значений a, b и с: а=6, b=2 и с=3; а=6, b=3 и с=0; а=3, b=3 и с=3; а=2, b=4 и с=3; а=2, b=5 и с=0 и а=2, b=6 и с=0.
11. Композиция по п.10, отличающаяся тем, что когда R1 представляет Н, то R2 выбран из: ОН, ОСН3 или CH2OH; когда R1 представляет Na, то R2 выбран из: ОН или СН3; когда R1 представляет К, то R2 является ОН; когда R1 представляет СН3О, то R2 выбран из: ОН, ОСН3, O-СН3СООН, СН3 или НСОО; когда R1 представляет СН3-СН2О, то R2 выбран из: ОН, ОСН3, O-СН3СООН, СН3, Cl, CH2OH, ОРО(O-СН2-СН3)2, NOH, F, НСОО или N(ОСН2СН3)2; и когда R1 представляет ОРО (О-СН2-СН3)2, то R2 является ОН.
12. Композиция по п.11, отличающаяся тем, что R1 представляет Н, и R2 является ОН.
| ПРИМЕНЕНИЕ ГИДРОКСИОЛЕИНОВОЙ КИСЛОТЫ И РОДСТВЕННЫХ СОЕДИНЕНИЙ ПРИ ПРОИЗВОДСТВЕ ЛЕКАРСТВЕННЫХ СРЕДСТВ | 2002 |
|
RU2310445C2 |
| WO 2003084305 A2, 16.10.2003 | |||
| WO 2002064807 A2, 22.08.2002 | |||
| M.B | |||
| BOHANNON and R | |||
| Способ использования делительного аппарата ровничных (чесальных) машин, предназначенных для мериносовой шерсти, с целью переработки на них грубых шерстей | 1921 |
|
SU18A1 |
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
| Походная разборная печь для варки пищи и печения хлеба | 1920 |
|
SU11A1 |
| WO 2007058523 A1, 24.05.2007 | |||
Авторы
Даты
2014-04-27—Публикация
2010-03-15—Подача