Область техники, к которой относится изобретение
Настоящее изобретение относится к синтезу и применению новых химических соединений, обладающих полезными биохимическими, физиохимическими и клиническими свойствами. В частности, обеспечены серии производных 1-алкил, 2-ацилглицерина, которые могут применяться для лечения или предупреждения заболевания. Изобретение также относится к фармацевтическим композициям и наборам, содержащим такие соединения.
Уровень техники
Известно, что вероятность возникновения многих различных заболеваний человека, таких как рак, деменция или пониженное когнитивное функционирование увеличивается с возрастом. С эпидемиологической и статистической точки зрения данные заболевания часто выглядят очень похожими. Однако с клинической точки зрения каждое из раковых заболеваний, деменций и уменьшенного когнитивного функционирования сильно отличаются. В настоящее время большим фактором риска для этих заболеваний является возраст субъекта. Более того, установлено, что большинство раковых заболеваний, деменций и уменьшенное когнитивное функционирование имеют продолжительную продромальную фазу (5-15 лет), во время которой заболевание присутствует, но протекает субклинически. Сообщалось о возрастном повышении уровня холестерина в мембранах1-3 и повышенном содержании холестерина в мембранах митохондрий4-6. Данные повышения уровня холестерина в мембране приводят к понижению текучести мембран2, понижению функции ионных каналов6-8, понижению активностям некоторых мембраносвязанных ферментов, таких как 5'-нуклеотидаза9 и α-секретаза10, и изменению диффузионных свойств сигнальных молекул, таких как оксид азота11.
Субъекты, страдающие от повышенного уровня холестерина в мембране, демонстрируют увеличенную распространенность нейродегенеративных заболеваний (например, Альцгеймера, Паркинсона, рассеянного склероза и возрастной макулярной дегенерации), когнитивных нарушений, деменций, рака (например, предстательной железы, легких, молочной железы, яичников и почек), остеопороза, биполярного расстройства и сосудистых заболеваний (атеросклероза, гиперхолестеринемии).
В отношении специфических заболеваний, холестерин накапливается в мембранных структурах головного мозга пациентов с болезнью Альцгеймера в зависимости от тяжести заболевания12-14. При этом было показано, что понижение уровня холестерина в мембранах уменьшает активности бета- и гамма-секретаз, блокируя патологический процессинг бета-амилоида15-16. На молекулярном уровне холестерин связывается с трансмембранным доменом белка-предшественника бета-амилоида (АРР), активируя миграцию АРР в богатые холестерином домены мембраны с высоким содержанием бета- и гамма-секретаз, что приводит к продукции бета-амилоида17. Изменения синаптических мембран, происходящие в результате повышенного уровня холестерина, также могут быть важным фактором в использовании фосфолипидов мембран для поддержки холинергической нейротрансмиссии (концепция аутоканнибализма)18. Было предложено раннее назначение статинов для снижения заболеваемости или задержки начала болезни Альцгеймера и Паркинсона19. Накопление холестерина также наблюдается в друзах, ассоциированных с возрастной макулярной дегенерацией20. Уровень холестерина в мембране также является повышенным при раке21 и была выдвинута гипотеза о том, что повышение уровня холестерина в мембранах митохондрий является дефектом, приводящим к эффекту Варбурга, который ассоциирован с большинством раковых клеток22. Эффект Варбурга является определяющим признаком раковых клеток, поскольку, в отличие от нормальных клеток, которые практически полностью зависят от дыхания для энергии, раковые клетки для энергии могут использовать как дыхание, так и гликолиз.
Дополнительно к сложным негативным эффектам накопления холестерина на мембраны, существует также повышенное образование оксистерола23. Данные оксистеролы являются цитотоксическими (апоптоз и некроз), провоспалительными, истощают глутатион GSH и индуцируют фосфолипидоз23-26. Заболевания, в которые могут быть вовлечены данные токсические оксистеролы, включают нейродегенерацию (нейрональную и демиелинизирующую), остеопороз, возрастную макулярную дегенерацию и сердечно-сосудистые заболевания, в частности атеросклероз23.
Современные клинические терапии для снижения уровня холестерина в основном заключаются в ингибировании синтеза холестерина статинами или блокировании абсорбции холестерина из желудочно-кишечного тракта эзетимибом. По мнению авторов изобретения, в настоящее время не существует лекарственных средств, предназначенных для мобилизации миграции холестерина из мембран.
РАСКРЫТИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к соединениям и способам лечения возрастных заболеваний, ассоциированных с патологическими уровнями холестерина в мембране. Описанные соединения включают новые предшественники плазмалогенов, которые уменьшают уровни свободного холестерина в мембране и усиливают этерификацию холестерина для транспорта из клеточных мембран. Данные соединения, следовательно, являются полезными для снижения уровней холестерина в мембране у субъектов, страдающих от повышенных уровней холестерина в мембране. Соединения могут также применяться для лечения или предупреждения заболеваний, ассоциированных с повышенным содержанием холестерина в мембране, таких как нейродегенеративные заболевания (включающие, но без ограничения, болезнь Альцгеймера, болезнь Паркинсона, рассеянный склероз и возрастную макулярную дегенерацию), когнитивные нарушения, деменцию, рак (включающий, но без ограничения, рак предстательной железы, легких, молочной железы, яичника и почки), остеопороз, биполярное нарушения и сосудистые заболевания (включающие, но без ограничения, атеросклероз и гиперхолестеролемию). Кроме того, данные соединения являются эффективными для лечения нарушений, возникающих в результате аномальной экспрессии генов транспортных белков холестерина, таких как аполипопротеин Е.
Данные предшественники плазмалогенов содержат глицериновый остов с алкильным или алкенильным липидным замещением в sn-1-положении или ацильным липидным замещением в sn-2-положении. Полярный заместитель обеспечен в sn-3-положении для улучшения фармацевтических свойств (например, для улучшения стабильности и/или биодоступности, или для составления в виде соли).
Без привязки к теории, полагают, что в определенных вариантах заместитель в sn-3-положении расщепляется липазами, и полученные 1-алкил, 2-ацил глицерин или 1-алкенил, 2-ацил глицерин затем превращаются в плазмалогены в эндоплазматическом ретикулуме, тем самым обходя пероксисомальный компартмент, который может демонстрировать пониженную функцию при старении.
Соответственно, в отношении композиции обеспечены соединения формулы I:

в которой:
R1 и R2 могут быть одинаковыми или разными; и представляют собой алкильную или алкенильную углеводородную цепь, выбранную из Таблицы 1 или 2;
R3 представляет собой группу, выбранную из жирных кислот, карнитина, ацетил-D/L-карнитина, тиокарнитина, ацетил-D/L-тиокарнитина, креатина, норкарнитина, фосфохолина, липоевой кислоты, дигидролипоевой кислоты, фосфоэтаноламина, фосфосерина, N-ацетилцистеина, замещенных или незамещенных аминокислот и групп, имеющих структуры, показанные ниже в Таблице 3.

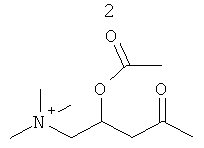

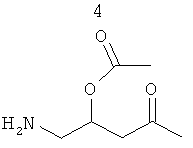
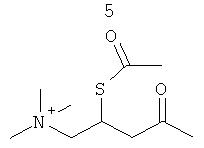
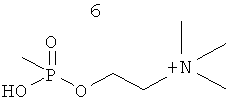

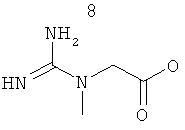
R4 и R5 являются одинаковыми или разными, и могут представлять собой водород или низший алкил, например, метил или этил;
R6 представляет собой водород или низший алкил, например, метил или этил; и
R7 и R8 являются одинаковыми или разными, и могут представлять собой водород или низший алкил, например, метил или этил,
и также включая рацематы или изолированные стереоизомеры и их фармацевтически приемлемые соли или сложные эфиры.
Другой аспект данного изобретения направлен на фармацевтические композиции, включающие фармацевтически приемлемый носитель и соединение, как описано выше.
В одном варианте настоящего изобретения R2 может представлять собой боковую цепь докозагексаеноевой кислоты (DHA) или СН3СН2(СН=СНСН2)6СН2-.
В другом варианте соединение может представлять собой 2-ацетокси-4-(2-((4Z,7Z,10Z,13Z,16Z,19Z)-докоза-4,7,10,13,16,19-гексаеноилокси)-3-(гексадецилокси)пропокси)-N,N,N-триметил-4-оксобутан-1-аминий.
В других вариантах соединение может представлять собой (4Z,7Z,10Z,13Z,16Z,19Z)-1-(5-((R)-1,2-дитиолан-3-ил)пентаноилокси)-3-(гексадецилокси)пропан-2-ил докоза-4,7,10,13,16,19-гексаеноат:

или (4Z,7Z,10Z,13Z,16Z,19Z)-1-(2-ацетамидо-3-меркаптопропаноилокси)-3-(гексадецилокси)пропан-2-ил докоза-4,7,10,13,16,19-гексаеноат:

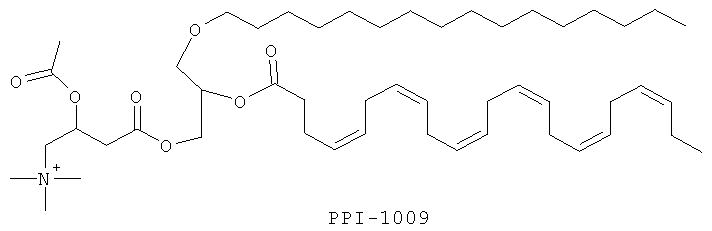
Изобретение также включает фармацевтические композиции, содержащие PPI-1009, PPI-1011, PPI-1014 или их комбинации.
Без привязки к теории, полагают, что определенные варианты соединений, описанных здесь, повышают уровни плазмалогенов, гидролиз ацетил-L-карнитин в sn-3-положении, и могут участвовать в возможных молекулярных механизмах, которые включают: (1) ацетилирование функциональных -NH2 и -ОН-групп в аминокислотах и N-концевых аминокислотах в пептидах и белках, что приводит к изменению их структуры, динамики, функции и обмена; и/или (ii) функционирование в качестве молекулярного шаперона для более крупных молекул, что приводит к изменению в структуре, молекулярной динамике и функции более крупных молекул.
Карнитин является важным в бета-окислении жирных кислот, и ацетильная группа может использоваться для поддержания уровней ацетил-СоА. Действия ацетил-L-карнитина (ALCAR) включают модуляцию: (i) мозговой энергии и метаболизма фосфолипидов; (ii) клеточных макромолекул, включающих нейротрофический фактор и гормоны; (iii) морфологии синапсов; и (iv) синаптической трансмиссии множественных нейротрансмиттеров.
Согласно еще одному аспекту настоящего изобретения, обеспечен способ лечения или предупреждения возрастных заболеваний, опосредованных дефицитом плазмалогенов, включающий введение пациенту, нуждающемуся в этом, эффективного количества соединения или композиции, как описано выше.
В еще другом аспекте настоящего изобретения обеспечен способ лечения возрастных заболеваний, ассоциированных с повышенным уровнем холестерина в мембране, повышенным уровнем амилоида и пониженными уровнями плазмалогенов, включающий введение пациенту, нуждающемуся в этом, эффективного количества соединения или композиции, как описано выше.
Изобретение также относится к способу приготовления соединения согласно структуре формулы II:
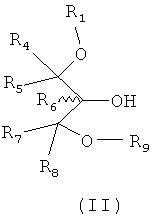
где R1 и от R4 до R8 являются такими, как описано выше, и R9 является блокирующей группой, и включает рацематы или изолированные стереоизомеры, и фармацевтически приемлемые соли или их эфиры.
Способ включает взаимодействие соединения формулы III:
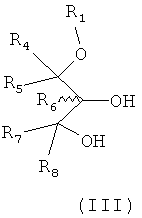
в пригодном растворителе с нуклеофильным катализатором, основанием и блокирующим агентом в условиях, пригодных для образования указанного соединения формулы II и факультативной очистки полученного соединения.
В определенных неограничивающих вариантах в качестве блокирующего агента может быть использован силан, например, трет-бутилдиметилсилил галогенид, который затем вызывает образование R9, являющийся трет-бутилдиметилсилильной группой.
В других неограничивающих вариантах нуклеофильным катализатором может являться DMAP, основанием может являться триэтиламин и растворитель может содержать диметилфармамид (DMF) и CH2Cl2.
Без желания быть ограниченными, в определенных вариантах предпочтительно готовить раствор, включающий соединение формулы III, нуклеофильный катализатор и основание в соответствующем растворителе при температуре от 0°С до 5°С перед добавлением блокирующего агента, с последующим добавлением блокирующего агента и дальнейшим проведением реакции при температуре примерно от 15 до 25°С, например, при 20°С. Предпочтительно, чтобы реакция проходила до полного завершения в течение вплоть до 20 часов.
Также обеспечено промежуточное соединение согласно структуре формулы II:

где R1 и от R4 до R9 являются такими, как описано выше, включая рацематы или изолированные стереоизомеры, и фармацевтически приемлемые соли или их эфиры.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Данные и другие признаки изобретения станут более очевидными из следующего описания, в котором сделано обращение на прилагающиеся чертежи, в которых:
ФИГУРА 1 показывает общую экспериментальную методику приготовления PPI-1009: 2-ацетокси-4-(2-((4Z,7Z,10Z,13Z,16Z,19Z)-докоза-4,7,10,13,16,19-гексаеноилокси)-3-(гексадецилокси)пропокси)-N,N,N-триметил-4-оксобутан-1-аминия согласно варианту настоящего изобретения.
ФИГУРА 2 показывает, что пониженные уровни общих DHA плазмалогенов в N-Rel клетках относительно контрольных клеток СНО являются восстановленными зависимым от концентрации образом с помощью PPI-1005 (R1=16:0; R2=DHA; R3=ОН), 72 ч инкубирования, *р<0/05 в зависимости от носителя (нос).
ФИГУРА 3 показывает (А) период внедрения PPI-1009 (10 мкМ) в плазмалогены и отсутствие эффекта на клеточных уровнях химилового спирта или связанного алкенил-ацил-глицерина (В) N-Rel клеток (0, 6, 12, 24, 48 и 72 ч). Содержание в клетках плазмалогенов и докозагексаеновой кислоты (DHA) подсчитывали методом ЖХ-МС/МС, тогда как химиловый спирт подсчитывали методом GC-MS.
ФИГУРА 4 показывает (А) зависимое от концентрации увеличение (72 ч) DHA плазмалогенов в клетках СНО с помощью PPI-1005 и PPI-1009. Несмотря на то что химиловый спирт повышал DHA-плазмалогены в клетках N-Rel, эффекта в СНО клетках не было (В). Содержание плазмалогенов в клетках подсчитывали методом ЖХ-МС и выражали относительно контролей СНО или контролей N-Rel.
ФИГУРА 5 показывает отклик концентрации на уменьшение холестерина в мембранах в клетках N-Rel через 48 часов инкубации с 16:0 (sn-1 алкил/DHA(sn-2 ацил) глицерином (PLM-05). Следует учесть, что уровни холестерина являются значительно повышенными (р<0.05) в клетках NRel относительно клеток СНО, и при 20 мкМ (PLM-05) уровни свободного холестерина в мембране понижаются и уровни эфиров холестерина в мембране повышаются (р<0.05).
ФИГУРА 6 показывает структурно-специфическое и зависимое от концентрации внедрение (72 ч) в связанный плазмалоген (R1=16:0, R2=22:6, R3 = фосфоэтаноламин) N-Rel клеток с помощью PPI-1005 (А; 1 или 5 мкМ) и PPI-1009 (В; 0.5, 1, 2, 3&10 мкМ). Заместители жирной кислоты в sn-2-положении также подвергали деацилированию и реацилированию для формирования связанных плазмалогенов с 20:4, 18:3, 18:2 и 18:1 в sn-2-положении. Содержание плазмалогенов в клетках подсчитывали методом ЖХ-МС/МС и нормализовали относительно клеток N-Rel, обработанных носителем.
ФИГУРА 7 показывает, что уровень холестерина в мембране повышается в мутантных клетках N-Rel относительно контрольных клеток СНО. Уровень холестерина в мембране в клетках N-Rel является пониженным (р<0.05) через 48 ч инкубации (20 мкМ) с предшественниками плазмалогенов, содержащими пальмитиновую (16:0) или стеариновую (18:0) кислоту в sn-1-положении в комбинации с ненасыщенными жирными кислотами, в частности DHA, в sn-2-положении. При 20 мкМ свободная DHA была неэффективной для изменения уровней холестерина в мембране. В противоположность активности аналогов с алкильной связью в sn-1-положении, диацильный аналог (16:0*:DHA глицерин) был неактивным. PPI-1009 (16:0/DHA/ALCAR) вызвал самое сильное уменьшение свободного холестерина и наращивание этерифицированного холестерина. V, носитель.
ФИГУРА 8 показывает уменьшение (р<0.04) холестерина в мембране в клетках НЕК293 через 48 ч инкубации с 20 мкМ 16:0 (sn-1 алкил)/ВНА(sn-2 ацил) глицерином, 18:0/DHA глицерином или 16:0/18:3 глицерином. При 20 мкМ 16:0/18:1 глицерин, 16:0/18:2 глицерин, 16:0/20:4 глицерин и свободная DHA были неэффективными для изменения уровней свободного холестерина в мембране. В отличие от активности аналогов с алкильной связью в sn-1-положении, диацильный аналог (16:0*:DHA глицерин) был неактивным.
ФИГУРА 9 показывает отклик концентрации на уменьшение холестерина в мембране в НЕК293 клетках через 48 ч инкубации с 16:0(sn-l алкил)/DHA (sn-2 ацил)/ацетил-L-картинин (sn-3 ацил)глицерином (PPI-1009).
ФИГУРА 10 показывает, что PPI-1005 (5а, 20 мкМ) уменьшает базальную и стимулированную холестерином (25.8 мкМ) секрецию Aβ42 клетками НЕК293, (А). PPI-1009 (PLM09, 10 мкМ) действовал аналогично (В).
ФИГУРА 11 иллюстрирует эффект PPI-1011 на плазмалогены в плазме кроликов. PPI-1011 был внедрен в этаноламин-плазмалогены (PlsEtn) и фосфатидилэтаноламины (PtdEtn) плазмы через 1, 3, 6 и 12 часов после орального введения дозы 200 мг/кг в желатиновой капсуле. Также наблюдали высвобождение DHA (свободной 22:6) из sn-2 посредством деацилаз. Группы включали от 3 до 5 кроликов.
ФИГУРА 12 показывает график включения предшественника плазмалогенов PPI-1011 в циркулирующие Pls 16:0/22:6, DHA, Pls 18:0/22:6 и Ptd 16:0/22:6 во времени. Включение PPI-1011 в этаноламин-плазмалогены (Pls) и фосфатидилэтаноламины (Ptd) плазмы измеряли через 1, 3, 6, 12, 18, 24 и 48 часов после орального введения дозы 200 мг/кг в желатиновой капсуле. Также наблюдали высвобождение DHA из sn-2 посредством деацилаз. Группы включали от 3 до 5 кроликов, за исключением 12 часовой отметки, которая включала 7 кроликов из 2 отдельных экспериментов.
ФИГУРА 13 иллюстрирует дозо-зависимое включение PPI-1011 в плазмалогены и фосфатидилэтаноламины плазмы. Включение PPI-1011 в этаноламин-плазмалогены (Pls) и фосфатидилэтаноламины (Ptd) плазмы измеряли через 6 часов после орального введения доз в 10, 75, 200, 500 и 1000 мг/кг в желатиновой капсуле. Также наблюдали высвобождение DHA из sn-2 посредством деацилаз. Группы включали от 3 до 5 кроликов.
ФИГУРА 14 показывает увеличение плазмалогенов и DHA в тканях под действием PPI-1011 в почке кроликов. Включение PPI-1011 в этаноламин-плазмалогены (PlsEtn) и фосфатидилэтаноламины (PtdEtn) почки измеряли через 1, 3, 6 и 12 часов после орального введения дозы в 200 мг/кг в желатиновой капсуле. Также наблюдали высвобождение DHA (свободной 22:6) из sn-2 посредством деацилаз. Группы включали от 3 до 5 кроликов.
ФИГУРА 15 показывает время увеличение плазмалогенов и DHA в ткани во времени под действием PPI-1011 в почках кроликов. Включение PPI-1011 в этаноламин-плазмалогены (16:0/22:6) почки измеряли через 1, 3, 6, 12, 18, 24 и 48 часов после орального введения дозы в 200 мг/кг в желатиновой капсуле. Группы включали от 3 до 5 кроликов.
ФИГУРА 16 показывает время увеличение плазмалогенов и DHA в ткани во времени под действием PPI-1011 в печени кроликов. Включение PPI-1011 в этаноламин-плазмалогены (16:0/22:6) печени измеряли через 12, 18, 24 и 48 часов после орального введения дозы в 200 мг/кг в желатиновой капсуле. Группы включали от 3 до 5 кроликов.
ФИГУРА 17 показывает структурно-специфическое и зависимое от концентрации включение PPI-1014 в этаноламин-плазмалогены (PlsEtn) и фосфатидилэтаноламины (PtdEtn) N-Rel клеток через 72 часа (5, 10 и 20 мкМ). Содержание плазмалогенов в клетках подсчитывали методом ЖХ-МС/МС и нормализовали относительно клеток N-Rel, обработанных носителем. Группы состояли из трех 10 см планшетов.
ФИГУРА 18 показывает (А) эффекты повышения концентрации PPI-1005 на мембранные резидентные белки в нагруженных холестерином клетках НЕК293, (В) эффекты PPI-1005 на мембранные резидентные белки в клетках НЕК293 дикого типа, и (С) эффекты правастатина на мембранные резидентные белки ADAM10 и SOAT1. β-актин использовали в качестве контроля нагрузки.
ОСУЩЕСТВЛЕНИЕ ИЗОБРЕТЕНИЯ
Описаны соединения согласно структуре формулы I:

где:
R1 и R2 являются одинаковыми или разными, и выбраны из алкильной или алкенильной углеводородной цепи, выбранной из группы, состоящей из: СН3(СН2)3-, СН3(СН2)5-, СН3(СН2)7-, СН3(СН2)9-, СН3(СН2)11-, СН3(СН2)13-, СН3(СН2)15-, СН3(СН2)17-, СН3(СН2)19-, СН3(СН2)21-, СН3(СН2)23-, СН3(СН2)3СН=СН(СН2)7-, СН3(СН2)5СН=СН(СН2)7-, СН3(СН2)7СН=СН(СН2)7-, СН3(CH2)4CH-CHCH2CH=CH(CH2)7-, СН3СН2СН-СНСН2СН=СНСН2СН-СН(СН2)7-, СН3СН2(СН=СН)-, СН3(СН2)3(СН=СН)-, СН3(СН2)5(СН=СН)-, СН3(СН2)7(СН=СН)-, СН3(СН2)9(СН=СН)-, СН3(СН2)11(СН=СН)-, СН3(СН2)13(СН=СН)-, СН3(СН2)15(СН=СН)-, СН3(СН2)17(СН=СН)-, СН3(СН2)19(СН=СН)-, СН3(СН2)21(СН-СН)-, СН3(СН2)3СН=СН(СН2)5(СН-СН)-, СН3(СН2)5СН=СН(СН2)5(СН-СН)-, CH3(CH2)7CH=CH(CH2)5(CH=CH)-, СН3(СН2)4СН=СНСН2СН=СН(СН2)5(СН=СН), CH3CH2CH=CHCH2CH=CHCH2CH=CH(CH2)5(CH-CH)-, CH3(CH2)3CH=CH(CH2)7-, CH3(CH2)5CH=CH(CH2)7-, СН3(СН2)7СН=СН(СН2)7-, CH3(CH2)4(CH=CHCH2)2(CH2)6-, СН3СН2(СН=СНСН2)3(СН2)6-, СН3(СН2)4(СН=СНСН2)4(СН2)2-, СН3СН2(СН=СНСН2)5(СН2)2-, СН3(СН2)7СН-СН(СН2)11 и СН3СН2(СН=СНСН2)6СН2-:
R3 представляет собой группу, выбранную из жирных кислот, карнитина, ацетил-D/L-карнитина, тиокарнитина, ацетил-D/L-тиокарнитина, креатина, норкарнитина, фосфохолина, липоевой кислоты, дигидролипоевой кислоты, фосфоэтаноламина, фосфосерина, N-ацетилцистеина, замещенных или незамещенных аминокислот и групп, имеющих структуры, показанные ниже:








R4 и R5 являются независимо водородом или низшим алкилом;
R6 представляет собой водород или низший алкил; и
R7 и R8 независимо являются водородом или низшим алкилом, и включают рацематы или изолированные стереоизомеры и фармацевтически приемлемые соли или их эфиры.
Такие соединения являются эффективными для лечения или предупреждения возрастных заболеваний, ассоциированных с повышенным уровнем холестерина в мембране, повышенным уровнем амилоида или пониженными уровнями плазмалогена.
Такие соединения также являются эффективными для лечения или предупреждения возрастных заболеваний, опосредованных дефицитом плазмалогенов.
Такие соединения могут также применяться для лечения нейродегенеративных заболеваний (включающих, но без ограничения, болезнь Альцгеймера, болезнь Паркинсона и возрастную макулярную дегенерацию), когнитивного нарушения, деменции, рака (включающего, но без ограничения, рак предстательной железы, легких, молочной железы, яичников и почек), остеопороза, биполярного нарушения и сосудистых заболеваний (включающих, но без ограничения, атеросклероз и гиперхолестеролемию).
В целях настоящего изобретения, гидрокси-группы в положениях sn-1, sn-2 и sn-3 глицеринового остова соединений формулы I названы с использованием общепризнанной номенклатуры плазмалогенов, т.е. атом кислорода глицерина, присоединенный к карбонильной группе -С=O(ацетил), -С (образует эфирную связь) и -Р (фосфорил) обозначен в формуле I.
В определенных неограничивающих вариантах, соединения, как описано здесь, могут содержать один или более хиральных центров. Обычно, такие соединения могут быть приготовлены в виде рацемической смеси. При желании, однако, такие соединения могут быть приготовлены или изолированы в виде чистых стереоизомеров, т.е. в виде индивидуальных энантиомеров или диастереомеров, или в качестве обогащенных стереоизомерами смесей. Все такие стереоизомеры (и обогащенные смеси) соединений формулы I включены в объем данного изобретения. Чистые стереоизомеры (или обогащенные смеси) могут быть приготовлены с использованием, например, оптически активных исходных материалов или стереоселективных реагентов, хорошо известных в данной области. Или же, рацемические смеси таких соединений могут быть разделены с использованием, например, хиральной колоночной хроматографии, хиральных оптически расщепляющих агентов и подобных.
Определения:
При описании алкил/ацил жирных кислот (Таблица 1, Таблица 2) и биологически активных соединений (Таблица 3), фармацевтических композиций и способов данного изобретения, следующие термины имеют следующие значения, если не указано иное.
«Жирные кислоты» представляют собой алифатические монокарбоновые кислоты, извлеченные или содержащиеся в этерифицированной форме в животных или растительных жирах, маслах или воске. Натуральные жирные кислоты обычно имеют цепь, состоящую из 4-28 атомов углерода (обычно неразветвленную и даже пронумерованную), которая может быть насыщенной или ненасыщенной. Такие кислоты известны как ациклические алифатические карбоновые кислоты.
В рамках значения насыщенных жирных кислот, термин «насыщенный» относится к атомам углерода (за исключением исходной карбоксильной [-СООН] группы), содержащим столько атомов водорода, насколько это возможно. Другими словами, конечный омега (ω) содержит 3 атома водорода (СН3-) и атом углерода в цепи содержит 2 атома водорода.
Ненасыщенные жирные кислоты (включающие, но не ограничивающиеся примерами, описанными в Таблице 2) имеют форму, аналогичную насыщенным жирным кислотам, за исключением того, что одна или более алкенильных функциональных групп присутствует вдоль цепи, причем каждый алкен имеет замещение простой связи -СН2-СН2- в цепи на двойную связь -СН=СН- (т.е. атом углерода соединен двойной связью с другим атомом углерода). Такие кислоты называются как CIS/TRANS и C:D, где С обозначает число атомов углерода, и D обозначает двойную связь.
«Незамещенные и замещенные аминокислоты» относятся к факультативно замещенному фрагменту аминокислоты, содержащему аминогруппу, группу карбоновой кислоты и вариабельную боковую цепь, при этом боковая цепь может включать общие боковые цепи аминокислоты, т.е. такие, которые используются при формировании белков или др., хорошо известных в данной области. Формирующие белки аминокислотные остатки являются особенно предпочтительными и включают аланин, аргинин, аспарагин, аспарагиновую кислоту, цистеин, глутамин, глутаминовую кислоту, глицин, гистидин, изолейцин, лейцин, лизин, метионин, фенилаланин, пролин, серии, треонин, триптофан, тирозин и валин. Также возможны заместители аминокислотных остатков, включающие заместители с функциональными группами, включающими, но без ограничения, низшие алкилы, ацетат, фосфат, липиды и карбогидраты.
Термин «низший алкил» относится к циклическому моновалентному алкильному радикалу с разветвленной или прямой цепью, содержащему от одного до семи атомов углерода (C1-C7) и в определенных неограничивающих вариантах от одного до четырех атомов углерода (C1-C4). Данный термин, кроме того, представлен такими радикалами, как метил, этил, н-пропил, изо-пропил, н-бутил, трет-бутил, изо-бутил (или 2-метилпропил), циклопропилметил, изо -амил, н-амил, гексил и гептил. Низшие алкильные группы также могут быть незамещенными или замещенными, при этом конкретным примером замещенного алкила является 1,1-диметилгептил.
«Гидроксил» относится к -ОН.
«Фармацевтически приемлемая соль» относится к любой соли соединения данного изобретения, которая сохраняет свои биологические свойства и которая не является биологически или иначе нежелательной. Такие соли могут быть получены из разных органических и неорганических противоионов, хорошо известных в данной области, и включают, например, натрий, калий, кальций, магний, аммоний, тетраалкиламмоний и подобные; и когда молекула содержит щелочные функциональные группы, соли органических или неорганических кислот, такие как гидрохлорид, гидробромид, тартрат, мезилат, ацетат, малеат, оксалат и подобные. Термин «фармацевтически приемлемый катион» относится к фармацевтически приемлемому катионному противоиону кислой функциональной группы. Примерами таких катионов являются катионы натрия, калия, кальция, магния, аммония, тетраалкиламмония и подобные.
«Фармацевтически приемлемый эфир» относится к обычно используемому этерифицированному соединению Формулы I, содержащему карбоксильную группу, при этом эфир сохраняет биологическую эффективность и свойства соединений Формулы I, и расщепляется in vivo (в организме) на соответствующую активную карбоновую кислоту. Информация, касающаяся эфиров и использования эфиров для доставки фармацевтических соединений, имеется в Design of Products. Bundgaard H ed. (Elsevier 1985). Также смотри H.Ansel et al., Pharmaceutical Dosage Forms and Drug Delivery Systems (6th Ed. 1995) на стр.108-109; Krogsgaard-Larsen, et al. Textbook of Drug Design and Development (2d Ed. 1996) на стр.152-191.
«Фармацевтический агент» или «препарат» относится к химическому соединению или композиции, способной вызывать требуемый терапевтический или профилактический эффект при соответствующем введении субъекту.
Термин «эффективное количество» означает такое количество препарата или фармацевтического агента, которое будет вызывать биологический или медицинский отклик тканей, системы, животного или человека, которое определяется, например, исследователем или клиницистом. Более того, термин «терапевтически эффективное количество» означает любое количество, которое, по сравнению с соответствующим субъектом, который не получал такого количества, приводит к улучшению лечения, облегчению, предупреждению или ослаблению заболевания, нарушения или побочного действия, или уменьшению скорости развития заболевания или нарушения. Термин также включает, в пределах его объема, количества, эффективные для усиления нормальной физиологической функции.
Все химические соединения включают оба (+) и (-) стереоизомера, а также один из (+) или (-) стереоизомеров.
Другие указанные здесь химические термины используются в соответствии с традиционным использованием в данной области, как показано в The McGraw-Hill Dictionary of Chemical Terms (1985) и The Condensed Chemical Dictionary (1981).
Соединения, описанные здесь, которые включают предшественников плазмалогенов, извлеченных из глицеринового остова с замещением в sn-1 и sn-2-положении жирными кислотами, и в sn-3-положении жирными кислотами или эндогенными метаболическими промежуточными соединениями, могут быть приготовлены из легкодоступных исходных материалов с использованием следующих общих способов и методик, показанных на Фигуре 1. Предпочтительно, чтобы при заданных типичных или предпочтительных условиях процесса (т.е. температура реакции, время, молярные соотношения реагентов, растворители, давление и т.д.), также можно было использовать другие условия, если не указано иное. Оптимальные условия реакции могут различаться в зависимости от конкретных используемых реагентов или растворителя, но такие условия могут быть определены опытным в данной области специалистом с помощью обычных методов оптимизации.
К тому же, опытным в данной области специалистам будет очевидно, что обычно используемые защитные группы могут потребоваться для защиты определенных функциональных групп от нежелательных реакций. Выбор пригодных защитных групп для конкретных функциональных групп, а также приемлемых условий для защиты и снятия защиты хорошо известны в данной области. Например, многочисленные защитные группы, а также их введение и удаление описаны в T.W.Greene and G.M.Wuts, Protecting Groups in Organic Synthesis, Second Edition, Wiley, New York, 1991 и в указанных здесь ссылках.
В предпочтительном способе синтеза, описанные здесь соединения, содержащие замещения глицерина в sn-1 и sn-2-положениях жирными кислотами, и в sn-3-положении жирными кислотами или эндогенными метаболическими промежуточными соединениями, как описано здесь, приготовлены с помощью протекции/депротекции гидроксильных групп глицеринового остова пригодными защитными группами с последующим O-алкилированием и O-ацилированием соединения; например PPI-1009, PPI-1011 и PPI-1014.
При использовании в качестве фармацевтических препаратов, соединения, как описано здесь, обычно вводятся в форме фармацевтической композиции. Такие композиции могут быть приготовлены с использованием методик, хорошо известных в фармацевтической области, и включают, по меньшей мере, одно активное соединение.
В целом, соединения данного изобретения вводятся в фармацевтически эффективном количестве. Количество фактически вводимого соединения обычно определяется терапевтом с учетом соответствующих обстоятельств, включающих состояние, подлежащее лечению, выбранный режим введения, конкретное вводимое соединение, возраст, вес, индивидуальные особенности пациента, тяжесть симптомов и подобные.
Соединения и композиции, описанные здесь, могут вводиться субъекту, предпочтительно млекопитающему, более предпочтительно человеку, для лечения и/или предупреждения заболевания любым приемлемым способом, включающим, например, оральный, местный, ректальный, трансдермальный, подкожный, внутривенный, внутримышечный, интраназальный, и подобные. В зависимости от предполагаемого способа доставки, соединения данного изобретения предпочтительно составлены для оральных, местных или инъецируемых композиций.
Фармацевтические композиции для орального введения могут быть в виде жидких растворов, суспензий или порошков. В целом, однако, такие композиции представлены в виде однократной лекарственной формы для способствования точному дозированию. Термин «однократная лекарственная форма» относится к физически дискретным единицам, пригодным для использования в качестве однократных доз для человеческих субъектов и других млекопитающих, причем каждая единица содержит заранее определенное количество активного материала, рассчитанное для произведения желаемого терапевтического эффекта, в комбинации с пригодным фармацевтически приемлемым вспомогательным веществом. Однократные лекарственные формы включают заранее заполненные, заранее отмеренные ампулы или шприцы с жидкими композициями или пилюли, таблетки, капсулы или подобные в случае твердых композиций.
Жидкие формы, пригодные для орального введения, могут включать пригодные водные и неводные носители с буферами, суспендирующие и диспергирующие агенты, красители, ароматизаторы и подобные. Твердые формы могут включать, например, любой из следующих ингредиентов или соединений аналогичной природы: связующее, такое как микрокристаллическая целлюлоза, трагант или желатин; вспомогательные вещества, такие как крахмал или лактоза, дезинтегрирующие агенты, такие как альгиновая кислота, примогель или кукурузный крахмал; лубриканты, такие как стеарат магния; глидант, такой как коллоидный диоксид кремния; подсластители, такие как сахароза или сахарин; или ароматизаторы, такие как мята перечная, метилсалицилат или апельсиновый ароматизатор.
Композиции для местного применения обычно составлены в виде мази или крема, которые содержат активный(е) ингредиент(ы) в количестве, которое изменяется примерно от 0,01 до 20% по массе, предпочтительно примерно от 0,1 до 10% по массе, и более предпочтительно примерно от 0,5 до 15% по массе. При составлении в виде мази, активные ингредиенты обычно объединены с парафиновым или смешивающимся с водой масляным основанием. Или же, активные ингредиенты могут быть составлены в виде крема, например, с водно-масляным основанием. Такие местные составы хорошо известны в данной области, и в целом включают дополнительные ингредиенты для усиления проникновения в кожу, или стабильности активных ингредиентов или состава. Все такие известные составы для местного применения и ингредиенты включены в объем данного изобретения.
Соединения настоящего изобретения также могут вводиться с помощью устройства для трансдермального введения. Таким образом, местное введение может быть выполнено с использованием пластыря, пористого или резервуарного мембранного типа или ряда твердых матриц.
Инъекционные композиции обычно основаны на инъекционном стерильном солевом растворе или фосфатно-буферном солевом растворе, или других инъекционных носителях, известных в данной области. Как сообщалось ранее, алкильное нитронное соединение в таких композициях является обычно второстепенным компонентом, часто составляющим примерно от 0,05 до 10% по массе с остатком, являющимся инъекционным носителем и т.п.
Описанные выше компоненты для оральных, местных или инъекционных композиций приведены лишь для примера. Другие материалы, а также способы обработки и т.п. представлены далее в Части 8 Remington's Pharmaceutical Sciences, 18th edition, 1990, Mack Publishing Company, Easton, Pennsylvania, 18042, которая включена здесь посредством отсылки.
Соединения настоящего изобретения также могут вводиться в виде форм с замедленным высвобождением или с помощью систем доставки лекарственных препаратов с замедленным высвобождением. Описание представительных материалов с замедленным высвобождением можно найти в материалах, включенных в Remington's Pharmaceutical Sciences.
Фармацевтические композиции данного изобретения могут быть составлены в виде таблеток, капсул, жидкости, инъекционного состава или в виде мази. Настоящее изобретение, однако, не ограничивается следующими фармацевтическими композициями. Например, без желания быть ограниченным каким-либо образом, соединение формулы I может быть растворено в забуференной стерильным физиологическим раствором инъекционной водной среде до соответствующей концентрации, составляющей примерно 5 мг/мл.
Изобретение также включает наборы, которые могут упростить введение фармацевтически активного агента животным. Типовой набор изобретения содержит единичную лекарственную форму фармацевтической композиции согласно изобретению. В одном варианте единичная лекарственная форма представляет собой контейнер (такой как колба, мешок, пробирку, шприц или т.п.), которые предпочтительно являются стерильными, содержащими фармацевтическую композицию изобретения. Набор может, кроме того, содержать наклейку или напечатанную инструкцию по использованию фармацевтически активного агента для лечения или предупреждения заболевания. В другом варианте набор содержит единичную лекарственную форму фармацевтической композиции изобретения и пипетку, шприц или другой аппликатор для введения фармацевтической композиции. Обычно, компоненты набора, например, единичная лекарственная форма и инструкции, содержатся внутри пригодного упаковочного материала.
Показано, что биодоступные предшественники плазмалогенов с замещением докозагексаеновой кислотой (22:6) в sn-2-положении понижали уровни холестерина в мембране. Напротив, стеариновая кислота (18:0), олеиновая кислота (18:1), линоевая кислота (18:2), арахидоновая кислота (20:4) или линоленоевая кислота (18:3) в sn-2-положении были значительно менее активными, и свободная DHA была неактивной. Замещение жирной кислотой в sn-1-положении показало необходимость алкенильной связи, причем ацильная связь полностью устраняла понижающую холестерин активность. Алкенильная связь может быть генерирована в эндоплазматическом ретикулуме из алкильного предшественника (например, PPI-1009); однако синтезированная алкенильная форма может быть также потенциальной терапевтической молекулой. Фармацевтические свойства данных целевых предшественников плазмалогенов также могут быть улучшены добавлением полярного заместителя в sn-3-положение. Данное замещение обеспечивает улучшенные фармацевтические свойства, включающие: 1) стабилизацию sn-2 замещения от миграции в sn-327-28; ii) способность к генерации фармацевтически приемлемой соли для улучшения состава и растворения препарата, и абсорбции; и iii) способность sn-3 заместителей быть легко удаляемыми липазами29 таким образом, что предшественник может превращаться в соответствующий эндогенный плазмалоген.
Таким образом, введение соединений настоящего изобретения в биологические системы млекопитающего приводит к увеличению клеточной концентрации специфических sn-2 замещенных этаноламин-плазмалогенов, независимо от способности системы к синтезу эфиров липидов. Повышенные уровни данных специфических sn-2 замещенных групп способствуют понижению уровней холестерина в мембране и понижению секреции амилоида, делая данные соединения эффективными для лечения или предупреждения возрастных заболеваний, ассоциированных с повышенным уровнем холестерина в мембране, повышенным уровнем амилоида и пониженными уровнями плазмалогенов.
Без привязки к теории полагают, что описанные здесь соединения могут быть получены, минуя пероксисомальный путь биосинтеза липида с простой эфирной связью, обеспечивая восстановление уровней плазмалогенов у субъектов с дефицитом плазмалогенов, а также доставку фармацевтически эффективных специфических понижающих холестерин плазмалогенов. Таким образом, данные молекулы могут быть использованы для лечения или предупреждения заболеваний, ассоциированных с пониженными уровнями плазмалогенов, повышенными уровнями холестерина в мембране или повышенными уровнями амилоида. Полагают, что данные факторы могут быть причиной многих заболеваний человека, таких как нейродегенерация (включая, но без ограничения, болезнь Альцгеймера, болезнь Паркинсона и возрастную макулярную дегенерацию), когнитивное нарушение, деменция, рак (включающий, но без ограничения, рак предстательной железы, легких, молочной железы, яичников и почки), остеопороз, биполярное нарушение и сосудистые заболевания (включающие, но без ограничения, атеросклероз и геперхолестеролемию). Таким образом, настоящее изобретение относится к лечению данных заболеваний с использованием описанных предшественников плазмалогенов. Кроме того, данные производные являются эффективными при лечении нарушений, возникших в результате аномальной экспрессии генов транспортных белков холестерина, таких как аполипопротеин Е.
Также показано, что введение 1-алкил-2-алкил глицеринов приводит к стереоселективному повышению PlsEtn уровней как в PlsEtn нормальных, так и в PlsEtn дефицитных системах. Эти данные также впервые демонстрируют, что 1-алкил, 2-ацил глицерины понижают уровни холестерина в мембране и уровни амилоида, и что данные эффекты требуют специфических замещений жирными кислотами в sn-2-положении.
Авторы изобретения также показали, что:
1) эфирная связь в sn-1-положении является стабильной и, кроме того, процессирована десатуразой (эндоплазматический ретикулум) для генерации главной алкенильной связи в sn-1-положении, характеризующей плазмалогены, но подобная десатурация возникает после добавления фосфоэтаноламина с помощью CDP-этаноламин трансферазы (эндоплазматический ретикулум);
2) заряженное замещение в sn-3-положении стабилизирует замещение жирной кислоты в sn-2-положении от миграции27-28 в sn-3;
3) заряженное замещение в sn-3-положении легко расщепляется клеточными липазами и обеспечивает образование свободной гидроксильной группы для добавления фосфоэтаноламина с помощью CDP-этаноламин трансферазы (эндоплазматический ретикул);
4) замещенная жирная кислота в sn-2-положении может подвергаться деацилированию и реацилированию другими жирными кислотами в клетках;
5) DHA замещение в sn-2-положении является оптимальным для понижения холестерина в мембране, и
6) заряженное замещение в sn-3-положении улучшает фармацевтические свойства (стабильность, биодоступность и приготовление в виде соли) новых представленных предшественников плазмалогенов.
Соединения настоящего изобретения эффективно превращаются в соединения PlsEtn в клетках с поврежденной способностью к биосинтезу плазмалогенов, и в клетках с неповрежденной способностью к биосинтезу плазмалогенов. Данные результаты противоречат результатам, имеющимся в данной области, в отношении других предшественников плазмалогенов. 1-алкил, 2-гидрокси глицерины (химиловый, батиловый, селахиловый спирты) показали, что могут повышать уровни PlsEtn в PlsEtn дефицитных системах до контрольных уровней, но не выше контрольных уровней, как в PlsEtn дефицитных системах, так в PlsEtn достаточных системах. Таким образом, соединения настоящего изобретения могут быть эффективными для предупреждения возрастных заболеваний, опосредованных дефицитом плазмалогенов, но повышать уровни PlsEtn выше контрольных уровней как в PlsEtn дефицитных системах, так и PlsEtn достаточных системах.
Как обсуждалось выше, описанные здесь соединения являются пригодными для использования в разных системах доставки лекарственных средств; однако, без желания быть ограниченными, соединения являются особенно эффективными при оральной доставке в капсуле или таблетке. Предполагается, что в таких вариантах максимальная общая доза не превышает 2 г/день для человеческого пациента весом 40 или 80 кг.
В последующих примерах следующие сокращения имеют следующие значения. Сокращения, не определенные ниже, имеют в общепринятое значение.
bd = широкий дуплет
bs = широкий синглет
d = дуплет
dd = диплет дуплетов
dec = разложенный
dH2O = дистиллированная вода
ELISA = метод твердофазного иммуноферментного анализа
EtOAc = этилацетат
EtOH = этанол
g = граммы
h = часы
Hz = герцы
ip = интраперитонеально
L = литры
m = мультиплет
min = минуты
М = молярный
МеОН = метанол
mg = миллиграммы
MHz = мегагерцы
ml = миллилитры
mmol = миллимоли
m.р. = точка плавления
N = нормальный
ро = per os, орально
q = квартет
quint. = квинтет
s = синглет
t = триплет
THF = тетрагидрофуран
tlc = тонкослойная хроматография
µg = микрограмм
µL = микролитр
UV = ультрафиолет
В приведенных ниже примерах все температуры представлены в градусах Цельсия, если не указано иное. Последующие примеры синтеза и биологические примеры представлены для иллюстрации данного изобретения и не рассматриваются как ограничивающие объем данного изобретения.
ПРИМЕРЫ
ПРИМЕР 1: Химический синтез
PPI-1009: 2-ацетокси-4-(2-((4Z,7Z,10Z,13Z,16Z,19Z)-докоза-4,7,10,13,16,19-гексаеноилокси)-3-(гексадецилокси)пропокси)-N,N,N-триметил-4-оксобутан-1-аминий готовили в соответствии со следующей общей экспериментальной методикой.
Стадия - 1
При 0°С в раствор немеченого PPI-1001 (50 г, 158 ммоль) в сухом DMF (20 мл) добавляли имидазол (21,5 г, 316 ммоль), полученную смесь перемешивали в течение 10 мин. По каплям добавляли раствор TBDMS-Cl (26,2 г, 174 ммоль) в DMF (50 мл) и полученный раствор перемешивали при комнатной температуре в течение 4 ч. Реакционную смесь разбавляли водой (50 мл), экстрагировали EtOAc (2×250 мл). Органический слой промывали ледяной водой (2×100 мл), солевым раствором (50 мл), высушивали (Na2SO4) и выпаривали для получения сырого соединения 4, которое очищали колоночной хроматографией (нейтральная окись алюминия, EtOAc - петролейный эфир (0,5:9,5) для получения соединения 3 (45 г, 66%). Rf=0.65 (EtOAc - петролейный эфир (1-9)).
Стадия - 2
При 0°С в раствор соединения 3 (75 г, 174 ммоль) в DMF (750 мл) порциями добавляли NaH (60% дисперсию в масле, 5 г, 209 ммоль), перемешивали в течение 30 мин, по каплям добавляли бензилбромид (44.8 г, 262 ммоль) в течение 1 ч, оставляли до установления комнатной температуры и перемешивали в течение ночи до полного расходования соединения 3, что подтверждали с помощью ТСХ. Реакционную смесь охлаждали до 0°С, добавляли метанол (5 мл), ледяную воду (50 мл), экстрагировали Et2O (2×250 мл), органический слой промывали водой (2×50 мл), солевым раствором (50 мл), высушивали (Na2SO4) и выпаривали для получения сырого соединения 4 (90 г) в виде желтого масла (Rf=0.7; EtOAc - петролейный эфир [5-95]), которое использовали на следующей стадии без дальнейшей очистки.
Стадия - 3
При -15°С в раствор соединения 4 (1,7 г, 3,26 ммоль) в сухом THF (15 мл) добавляли раствор TBAF (1.7 г, 6,53 ммоль) в сухом THF (5 мл) и реакционную смесь оставляли нагреваться до комнатной температуры и перемешивали в течение ночи до полного расходования соединения 4, что подтверждали с помощью ТСХ. Реакционную смесь осаждали водой (10 мл), экстрагировали EtOAc (2×50 мл), органический слой промывали солевым раствором (20 мл), высушивали (Na2SO4) и выпаривали для получения сырого соединения 6, которое очищали флэш колоночной хроматографией (100-200 меш силикагель, EtOAc - петролейный эфир (3:7)) для получения соединения 5 (850 мг, 65%) в виде светло-желтого масла. Rf=0.54 (EtOAc - петролейный эфир (3:7).
Стадия - 4
При 0°С в раствор соединения 7 (8 г, 39 ммоль) в сухом CH2Cl2 (50 мл) - DMF (3 капли) добавляли оксалилхлорид (4,2 мл, 40 ммоль), и полученную смесь медленно нагревали до комнатной температуры и перемешивали в течение 5 ч. Избыточное количество оксалилхлорида выпаривали, остаток растворяли в толуоле и растворитель выпаривали для получения соединения 6. Раствор соединения 6 в сухом CH2Cl2 (25 мл) добавляли по каплям в раствор соединения 5 (11 г, 20 ммоль) в сухом CH2Cl2 (50 мл) и полученный раствор продували аргоном до полного расходования соединения 5, что подтверждали ТСХ. Реакционную смесь концентрировали для получения сырого соединения 8 (14 г), которое использовали на следующей стадии без дальнейшей очистки. Rf=0.45 (МеОН-CHCl3 (1:4)).
Стадия - 5
Раствор соединения 8 (14 г сырой) в EtOH (50 мл) гидрогенизировали над 10% Pd/C при 40 psi до полного расходования соединения 8, что подтверждали с помощью ТСХ. Реакционную смесь фильтровали и выпаривали для получения сырого соединения 9, которое очищали колоночной хроматографией на нейтральной окиси алюминия для получения соединения 9 (6 г, 6 г, 61% за две стадии) в виде светло-коричневого масла. Rf=0.25 (МеОН-CHCl3 (2:3)).
Стадия - 6
При 0°С в раствор соединения 9 (8,2 мг, 16 ммоль) в THF (150 мл) добавляли каталитическое количество DMAP (1,9 г, 20 ммоль), пиридин (7,6 мл, 90 ммоль) и перемешивали при комнатной температуре в течение часа. В этот раствор по каплям добавляли раствор DHA-Cl (приготовленный путем добавления раствора оксалилхлорида (2,5 мл, 28 ммоль) в сухом CH2Cl2 при 0°С в DHA-кислоту (7,7 г, 20 ммоль), выпариванием избыточного количества оксалилхлорида для получения DHA-Cl) в CH2Cl2 (50 мл) при 0°С и перемешивали в течение 0,5 ч. Реакционную смесь медленно нагревали до комнатной температуры и перемешивали в течение 24 ч. Реакционную смесь разбавляли водой (50 мл), экстрагировали EtOAc (2×200 мл), промывали солевым раствором (50 мл), высушивали (Na2SO4) и выпаривали для получения сырого продукта, который очищали колоночной хроматографией (нейтральная окись алюминия, МеОН-CHCl3 (5:95)) для получения PPI-1009 (1.2 г, ~10%, HPLC чистота 97% вместе с 1,7 г примесей) в виде светло-коричневого полутвердого вещества. Rf=0.45 (МеОН-CHCl3 (15:85)).
ПРИМЕР 2: Биологическое тестирование
Клетки яичников китайского хомячка (линия СНО), N-Rel30 (мутантная клеточная линия СНО с дефицитом пероксисомального фермента дигидроксиацетонфосфат ацилтрансферазы) и клетки эмбриональной почки человека (НЕК293) выращивали в чашках 10 см2 в среде DMEM/Ham's F12 (1:1), содержащей 10% FBS. Клетки инкубировали с предшественниками плазмалогенов, растворенными в этаноле (конечная концентрация этанола 0.1%), и собирали для анализа плазмалогенов с помощью ЖХ-МС/МС31, и холестерин и эфир холестерина анализировали с использованием коммерческого колориметрического набора (BioVision#K613).
1-алкил, 2-ацил глицерины с пальмитиновой кислотой (16:0) в sn-1-положении, DHA в sn-2-положении, и ОН или ацетил-L-карнитин в sn-3-положении, PPI-1005 или PPI-1009 соответственно, были эффективно превращены в соединения PlsEtn в клетках с поврежденной способностью плазмалогена к биосинтезу (N-Rel, Фигуры 2, 3А) и в клетках с неповрежденной способностью плазмалогена к биосинтезу (СНО, Фигура 4А). Эти результаты противоречат научным данным в отношении других предшественников плазмалогенов. Было показано, что 1-алкил, 2-гидрокси глицерины (химиловый, батиловый, селахиловый спирты) повышают уровни PlsEtn в PlsEtn дефицитных системах до контрольных уровней, но не выше контрольных уровней как в PlsEtn дефицитных, так и в PlsEtn достаточных системах (Фигура 4В). К тому же, биопревращение 1-алкила, 2-ацил глицеринов, описанных в этом изобретении, не привело к повышению уровней химилового спирта или 1-алкенил, 2-ацил глицеринов (Фигура 3В), что указывает на то, что ни химиловый спирт, ни 1-алкенил, 2-ацил глицерины не являются промежуточными соединениями в путях биотрансформации описанных молекул в PlsEtn.
Соединение PPI-005 описано в находящейся на рассмотрении заявке РСТ/СА2007/001472 и показано ниже:

Обработка клеток 1-алкил, 2-ацил глицеринами с пальмитиновой кислотой (16:0) в sn-1-положении, DHA в sn-2-положении, и ОН или ацетил-L-карнитином в sn-3-положении приводила к структурно-специфическому обогащению PlsEtn DHA в sn-2-положении (Фигура 6). Это является первым описанием структурно-специфического обогащения PlsEtn.
PPI-1009 является предшественником плазмалогенов с улучшенными фармацевтическими свойствами. Данная молекула существует при комнатной температуре в виде соли и представляет собой первый предшественник плазмалогенов на немасляной основе, о котором когда-либо сообщалось.
Биологические системы с уже существующей недостаточностью синтеза плазмалогенов и, следовательно, низкими уровнями плазмалогенов (N-Rel по сравнению с СНО) (Фигура 1) имеют повышенные уровни холестерина в мембране (Фигура 5). Повышение DHA-PlsEtn до 80% контрольных значений с помощью PPI-1005 (Фигура 2) привела к значительному уменьшению холестерина в мембране (Фигура 5).
Было открыто, что понижающее холестерин действие повышенных уровней PlsEtn зависит от sn-2 заместителя (Фигуры 7 и 8). Наблюдалось, что только полиненасыщенные жирные кислоты (DHA, 18:3) имеют понижающую холестерин активность в НЕК293 клетках, в то время как насыщенные, моно- и диненасыщенные жирные кислоты не имеют эффекта. Только восстановление DHA-PlsEtn уровней приводит к сильному снижению повышенных уровней холестерина в мембране, наблюдаемых в N-Rel клетках как результат пониженных уровней плазмалогена (Фигура 7). Эти результаты указывают на то, что полиненасыщенные жирные кислоты, содержащие PlsEtn, селективно вовлечены в гомеостаз холестерина в мембране. Также было показано, что PPI-1009 уменьшает уровни холестерина в мембране зависимым от концентрации образом в NRel (Фигура 7) и НЕК293 клетках (Фигура 9). Данные результаты указывают на то, что понижающее холестерин действие повышенных уровней PlsEtn требует введения предшественника плазмалогенов, способного эффективно повышать уровни PlsEtn со специфическими sn-2 заместителями.
Обработка НЕК293 клеток PPI-1005 или PPI-1009 приводила к пониженным уровням обоих, АВ-40 и АВ-42, в нормальных клетках и нагруженных холестерином клетках (Фигура 10). Эти результаты, кроме того, иллюстрируют функциональную полезность предшественников плазмалогенов, заключающуюся в их способности позитивно модулировать функцию мембранного белка. В этом отношении известно, что пониженные уровни холестерина в мембране негативно модулируют продукцию амилоидного пептида15. Дополнительно к уменьшению холестерина в мембране в НЕК293 клетках, наблюдалось, что PPI-1005 и PPI-1009 также понижают секрецию амилоидных пептидов (Фигура 10).
Структурно-специфическое и зависимое от концентрации внедрение PPI-1014 в этаноламин-плазмалогены (PlsEtn) и фосфатидилэтаноламины (PtdEtn) N-Rel клеток также наблюдали через 72 часа с использованием концентраций в 5, 10 и 20 мкМ PPI-1014 (Фигура 17).
ПРИМЕР 3: Приготовление PPI-1011

Схема синтеза:
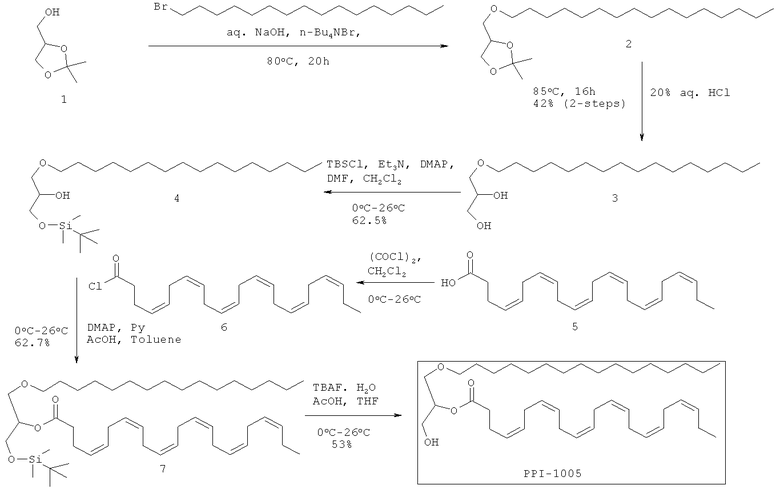
Схема синтеза для PPI-1011
Стадия реакции:
Краткая методика: Раствор соединения 1 (2,0 кг, 15,15 моль) в 10% растворе NaOH (10,0 л) перемешивали при 80°С в течение 1 ч, добавляли ТВАВ (992,0 г, 3,03 моль) и перемешивали в течение 15 мин. Медленно добавляли цетилбромид (5,5 кг, 18,18 моль) и реакционную смесь перемешивали при 80°С в течение 20 ч. (Развитие реакции контролировали путем разбавления небольших аликвот водой, экстрагирования этилацетатом, нанесением на аналитическую силикагелевую ТСХ-пластинку (30% этилацетата в петролейном эфире) и визуализацией соответствующих пятен с использованием Мо окрашивания и раствора KMnO4). Ниже приведены RfS компонентов смеси: соединение 1 (0.1), соединение 2 (0.7).
Выделение и очистка: Реакционную смесь охлаждали до комнатной температуры, экстрагировали CH2Cl2 (3×3,0 л). Объединенный CH2Cl2 слой промывали раствором NaHCO3 (1,0 л), водой (2×2,0 л), солевым раствором (1,0 л), высушивали над безводным Na2SO4 и концентрировали для получения сырого соединения 2 (2,9 кг, сырой) в виде бледно- желтой жидкости, которую использовали на следующей стадии.
Стадия реакции:

Краткая методика: Раствор соединения 2 (2,9 кг, 81,23 моль) в 20% водн. HCl (14,5 л) перемешивали при 85°С в течение 16 ч. (Развитие реакции контролировали путем разбавления небольших аликвот водой, экстрагирования этилацетатом, нанесения на аналитические силикагелевые ТСХ-пластинки (40% этилацетата в петролейном эфире) и визуализации пятен с использованием Мо окрашивания). Далее приведены RfS компонентов смеси: соединение 2 (0.8), соединение 3 (0.2).
Выделение и очистка: Реакционную смесь охлаждали до комнатной температуры, экстрагировали CH2Cl2 (3×4,0 л). Объединенный органический слой промывали раствором NaHCO3 (1,0 л), водой (2×2,0 л), солевым раствором (1,0 л), высушивали над безводным Na2SO4 и концентрировали для получения сырого соединения, которое растирали с 5% этилацетатом в петролейном эфире (2×1,0 л), после чего высушивали для получения соединения 3 (2,0 кг, 42% из 2 стадий) в виде грязно-белого твердого вещества.
Стадия реакции:

Краткая методика: В охлажденный раствор соединения 3 (1,0 кг, 3,16 моль) в DMF (640.0 мл) и CH2Cl2 (400 мл) при 0°С добавляли DMAP (38,6 г, 0,32 моль) с последующим триэтиламином (735,0 г, 7,27 моль). После добавления реакционную смесь перемешивали при 0°С в течение 30 мин и добавляли TBSCI (572,0 г, 3,79 моль) равными порциями (3 порции) в течение 1 ч, после чего реакционную смесь перемешивали в течение 20 ч при комнатной температуре. (Ход реакции контролировали путем осаждения небольших аликвот водой, экстрагирования CH2Cl2, нанесения на аналитические силикагелевые ТСХ-пластинки (20% этилацетата в петролейном эфире), и визуализации пятен с использованием Мо окрашивания и KMnO4). Далее приведены RfS компонентов смеси: соединение 3 (0,15), соединение 4 (0.7).
Выделение и очистка: Реакционную смесь разбавляли CH2Cl2 (2,0 л), промывали водой (3×3,0 л), солевым раствором (1,0 л), высушивали над безводным Na2SO4 и концентрировали. Полученное сырое соединение очищали колоночной хроматографией (силикагель 100-200 меш) с использованием 5% этилацетата в петролейном эфире в качестве элюента для получения соединения 4 (850 г, 90%) в виде бледно-желтого масла.
Стадия реакции:

Краткая методика: В охлажденный раствор соединения 5 (160,0 г, 0,487 моль), DMF (1,0 мл) в CH2Cl2 (500 мл) при 0°С медленно добавляли оксалилхлорид (105,0 г, 0,828 моль) в течение 30 мин. После добавления реакционную смесь перемешивали при 26°С в течение 4 ч. (Ход реакции контролировали путем осаждения небольших аликвот МеОН, нанесения на аналитические силикагелевые ТСХ-пластинки (10% этилацетата в петролейном эфире) и визуализации пятен с помощью раствора KMnO4). Далее приведены RfS компонентов смеси: соединение 5 (0,3), соединение 6 (0,8).
Выделение и очистка: Реакционную смесь концентрировали в атмосфере N2 для получения сырого соединения 6 (175 г, сырой).
Стадия реакции:

Краткая методика: В охлажденный раствор соединения 4 (150,0 г, 0,348 моль) в толуоле (1,25 л) при 0°С добавляли пиридин (110,0 г, 1,39 моль) с последующим DMAP (122,2 г, 0,348 моль) и перемешивали в течение 10 мин. Добавляли раствор сырого соединения 6 (175,0 г, 0,504 моль) в толуоле (250,0 мл) в течение 15 мин. После добавления реакционную смесь перемешивали при комнатной температуре в течение 20 ч. (Ход реакции контролировали путем осаждения небольших аликвот водой, экстрагирования EtOAc, нанесения на аналитические силикагелевые ТСХ-пластинки (5% этилацетата в петролейном эфире) и визуализации пятен с использованием раствора KMnO4). Далее приведены RfS компонентов смеси: соединение 4 (0.2), соединение 7 (0.5).
Выделение и очистка: Реакционную смесь разбавляли этилацетатом (3,0 л), промывали водой (1,0 л), 0,05 N HCl (500,0 мл), водой (2×1,0 л), солевым раствором (500,0 мл), высушивали над безводным Na2SO4 и концентрировали для получения сырого соединения 7, которое очищали колоночной хроматографией (силикагель 100-200 меш) с использованием 2% этилацетата в петролейном эфире в качестве элюента для получения соединения 7 (162 г, 62,7%) в виде бледно-желтого масла.
Стадия реакции:

Краткая методика: В охлажденный раствор соединения 7 (160,0 г, 216,21 ммоль) в THF (10,0 мл) и уксусной кислоте (52,0 г) при 0°С добавляли TBAF (226,0 г, 864,86 ммоль) равными частями в течение 30 мин. После добавления реакционную смесь перемешивали при комнатной температуре в течение 6 ч. (Ход реакции контролировали нанесением на аналитические силикагелевые ТСХ-пластинки (20% этилацетата в петролейном эфире) и визуализации пятен с использованием Мо окрашивания и раствора KMnO4). Далее приведены RfS компонентов смеси: соединения 7 (0,9), соединения PPI-1005 (0,4).
Выделение и очистка: Реакционную смесь разбавляли этилацетатом (3,0 л), промывали водой (2×2,0 л), солевым раствором (500,0 мл), высушивали над безводным Na2SO4 и концентрировали для получения сырого соединения, которое очищали колоночной хроматографией (силикагель 100-200 меш) с использованием 7% этилацетата в петролейном эфире в качестве элюента для получения соединения PPI-1005 (72 г, 53%) в виде бледно-желтого масла.
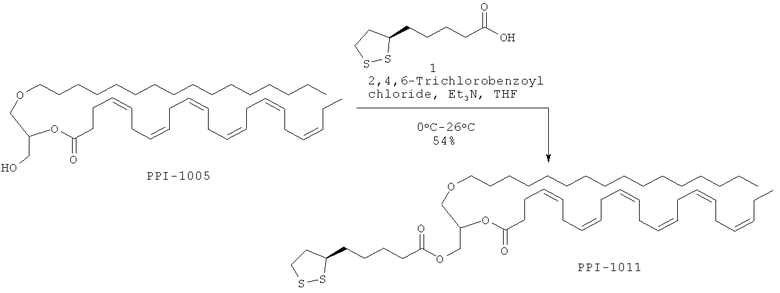
Стадия реакции:

Краткая методика: В охлажденный раствор α-липоевой кислоты 1 (12,0 г, 58.25 ммоль) в THF (500,0 мл) при 0°С медленно в течение 10 мин добавляли триэтиламин (8,1 мл, 58,25 ммоль) с последующим 2,4,6-трихлорбензоилхлоридом (14,2 г, 58,25 ммоль). После добавления реакционную смесь оставляли нагреваться до комнатной температуры и перемешивали в течение 18 ч. (Ход реакции контролировали нанесением на аналитические силикагелевые ТСХ-пластинки (20% EtOAc в петролейном эфире) и визуализацией пятен с использованием 254 нм УФ света и окрашивания по Hanessian). Далее приведены RfS компонентов смеси: соединения 1 (0,2), промежуточное соединение (0,6).
Реакционную смесь отфильтровывали, твердую фазу промывали THF (25,0 мл), объединенный фильтрат концентрировали с использованием пониженного давления в атмосфере N2 для получения сырого ангидрида, который растворяли в бензоле (500,0 мл), охлаждали до 0°С, добавляли DMAP (7,1 г, 58,25 ммоль) и перемешивали в течение 10 мин. В реакционную смесь при 0°С медленно добавляли раствор PPI-1005 (40,1 г, 64,07 ммоль) в бензоле (100,0 мл). После добавления реакционную смесь оставляли нагреваться до комнатной температуры и перемешивали в течение 24 ч. (Ход реакции контролировали осаждением небольших аликвот Н2О, экстрагированием этилацетатом, нанесением на аналитические силикагелевые ТСХ-пластинки (15% THF в петролейном эфире) и визуализацией пятен с использованием 254 нм УФ света и окрашивания по Hanessian). Далее приведены Rfs компонентов смеси: PPI-1005 (0.3), PPI-1011 (0.5).
Выделение и очистка: Реакционную смесь разбавляли этилацетатом (2000 мл), промывали насыщенным раствором NaHCO3 (1×400 мл), 0.05N HCl (1×400 мл), водой (1×400 мл), высушивали над безводным Na2SO4 и концентрировали для получения сырого соединения, которое очищали колоночной хроматографией (нейтральный силикагель 100-200 меш) с использованием от 2.5 до 5% THF в петролейном эфире в качестве элюента.
Указанное соединение PPI-1011 (28,0 г, 54%) получали в виде бледно-коричневого масла.
ПРИМЕР 4: Альтернативный способ приготовления PPI-1009

Схема синтеза:

Стадия реакции
Методика: Раствор соединения 1 (2,0 кг, 15,15 моль, Alfa Aesar) в 10% растворе NaOH (10,0 л) перемешивали при 80°С в течение 1 ч, добавляли ТВАВ (992,0 г, 3,03 моль, Rajdhani scientific) и перемешивали в течение 15 мин. Медленно добавляли цетилбромид (5,5 кг, 18,18 моль, Alfa Aesar) и реакционную смесь перемешивали при 80°С в течение 20 ч. (Ход реакции контролировали разбавлением небольших аликвот водой, экстрагированием этилацетатом, нанесением на аналитические силикагелевые ТСХ-пластинки (30% этилацетата в петролейном эфире) и визуализацией соответствующих пятен с использованием Мо окрашивания и раствора KMnO4). Далее приведены RfS компонентов смеси: соединение 1 (0,1), соединение 2 (0,7). Реакционную смесь охлаждали до комнатной температуры, экстрагировали CH2Cl2 (3×3,0 л). Объединенный слой CH2Cl2 промывали раствором NaHCO3 (1,0 л), водой (2×2,0 л), солевым раствором (1,0 л), высушивали над безводным Na2SO4 и концентрировали для получения неочищенного соединения 2 (2,9 кг, неочищенное) в виде бледно-желтой жидкости, которую использовали на следующей стадии.
Стадия реакции:

Методика: Раствор соединения 2 (2,9 кг, 81,23 моль) в 20% водн. HCl (14,5 л) перемешивали при 85°С в течение 16 ч. (Развитие реакции контролировали разбавлением маленьких аликвот водой, экстрагированием этилацетатом, нанесением на аналитическую силикагелевую ТСХ-пластинку (40% этилацетата в петролейном эфире) и визуализацией пятен с помощью Мо окрашивания). Далее приведены RfS компонентов смеси: соединение 2 (0.,8), соединение 3 (0,2). Реакционную смесь охлаждали до комнатной температуры, экстрагировали CH2Cl2 (3×4,0 л). Объединенный органический слой промывали раствором NaHCO3 (1,0 л), водой (2×2,0 л), солевым раствором (1,0 л), высушивали над безводным Na2SO4 и концентрировали для получения сырого соединения, которое растирали с 5% этилацетатом в петролейном эфире (2×1,0 л) и высушивали для получения соединения 3 (2,0 кг, 42% из 2 стадий) в виде грязно-белого твердого вещества.
Стадия реакции:
Методика: В охлажденный раствор соединения 3 (1,0 кг, 3,16 моль) в DMF (640,0 мл) и CH2Cl2 (400,0 мл) при 0°С добавляли DMAP (38,6 г, 0,32 моль) с последующим триэтиламином (735,0 г, 7,27 моль, Rankem). После добавления реакционную смесь перемешивали при 0°С в течение 30 мин и добавляли TBSCI (572,0 г, 3,79 моль, Fluoro chem., 3,0 кг) равными порциями (3 порции) в течение 1 ч, и реакционную смесь перемешивали в течение 20 ч при комнатной температуре. (Ход реакции контролировали осаждением небольших аликвот водой, экстрагированием CH2Cl2, нанесением на аналитическую силикагелевую ТСХ-пластинку (20% этилацетата в петролейном эфире) и визуализацией пятен с помощью Мо окрашивания и KMnO4). Далее приведены RfS компонентов смеси: соединение 3 (0,15), соединение 4 (0,7). Реакционную смесь разбавляли CH2Cl2 (2,0 л), промывали водой (3×3,0 л), солевым раствором (1,0 л), высушивали над безводным Na2SO4 и концентрировали. Полученное сырое соединение очищали колоночной хроматографией (силикагель 100-200 меш) с использованием 5% этилацетата в петролейном эфире в качестве элюента для получения соединения 4 (850,0 г, 90%) в виде бледно-желтого масла.
Стадия реакции:
Методика: В охлажденный раствор соединения 4 (734 г, 1,706 моль) в DMF (2,5 л) при 0°С добавляли 60% NaH (204,0 г, 5,12 моль) порциями в течение 30 мин. После добавления реакционную смесь перемешивали при 0°С еще в течение 30 ч и добавляли бензилбромид (438,0 г, 2,56 моль, S.D fine chemicals) по каплям в течение 1 ч. Реакционную смесь оставляли нагреваться до комнатной температуры и перемешивали в течение 20 ч. (Ход реакции контролировали осаждением небольших аликвот водой, экстрагированием EtOAc, нанесением на аналитическую силикагелевую ТСХ-пластинку (5% этилацетата в петролейном эфире) и визуализацией пятен с помощью Мо окрашивания и KMnO4). Далее приведены Кд компонентов смеси: соединение 4 (0,2), соединение 5 (0,5). Реакционную смесь осаждали метанолом (250 мл), холодной водой (1500 мл) и экстрагировали этилацетатом (2×2,0 л). Объединенный слой этилацетата промывали водой (3×1,0 л), солевым раствором (1,0 л), высушивали над безводным Na2SO4 и концентрировали. Полученное сырое соединение 5 (887 г) использовали на следующей стадии без дальнейшей очистки.
Стадия реакции:

Методика: В холодный раствор сырого соединения 5 (887,0 г, 1,702 моль) в THF (2,0 л) при 0°С медленно добавляли раствор TBAF (1,3 кг, 5,107 моль, Chemrich fine chemicals) в THF (1,0 л) в течение 1 ч. После добавления реакционную смесь перемешивали при комнатной температуре в течение 16 ч. (Ход реакции контролировали осаждением небольших аликвот водой, экстрагированием EtOAc, нанесением на аналитическую силикагелевую ТСХ-пластинку (30% этилацетата в петролейном эфире) и визуализацией пятен с помощью Мо окрашивания и KMnO4). Далее приведены RfS компонентов смеси: соединение 5 (0,9), соединение 6 (0,3). Реакционную смесь разбавляли этилацетатом (2,5 л), промывали водой (2×1,0 л), солевым раствором (1,0 л), высушивали над безводным Na2SO4 и концентрировали для получения сырого соединения, которое очищали колоночной хроматографией (силикагель 100-200 меш) с использованием 7% этилацетата в петролейном эфире в качестве элюента для получения соединения 6 (330 г, 48% из 2 стадий) в виде бледно-желтого масла.
Стадия реакции:

Методика: В холодный раствор N-ацетилкарнитена 8 (239,0 г, 1,177 моль, Molecula life Science) в CH2Cl2 (500,0 мл) и DMF (5,0 л) при 0°С медленно добавляли оксалилхлорид (179,4 г, 1,412 моль) в течение 30 мин и перемешивали при комнатной температуре в течение 4 ч. Растворитель из реакционной смеси удаляли дистилляцией при пониженном давлении и определяли следовые количества оксалилхлорида путем кодистилляции с CH2Cl2. Полученное сырое соединение 9 (250 г) растворяли в CH2Cl2 (500,0 мл) и медленно добавляли в холодный раствор соединения 6 (334,0 г, 0,823 моль) в CH2Cl2 (500,0 мл) при 0°С при пропускании пузырьков N2. После добавления реакционную смесь перемешивали в течение 20 ч при непрерывном пропускании пузырьков N2 при комнатной температуре. (Ход реакции контролировали осаждением небольших аликвот водой, экстрагированием CH2Cl2, нанесением на аналитическую силикагелевую ТСХ-пластинку (25% МеОН в хлороформе) и визуализацией пятен с помощью Мо окрашивания и KMnO4). Далее приведены RfS компонентов смеси: соединение 6 (0,8), соединение 10 (0,3). Реакционную смесь разбавляли CH2Cl2 (2,0 л), промывали солевым раствором (250 мл), высушивали над безводным Na2SO4 и концентрировали для получения сырого соединения, которое очищали колоночной хроматографией (силикагель 100-200 меш) с использованием 5% МеОН в хлороформе в качестве элюента для получения соединения 10 (153,0 г, 31,5%) в виде бледно-желтого масла.
Стадия реакции:
Краткая методика: В суспензиию 10% Pd/C (40,0 г, 25 масс.%, AlfaAesar) в этаноле (1,2 л) добавляли соединение 10 (150,0 г, 0,298 моль) и гидрогенизировали (Н2, давление 40 psi) при комнатной температуре в течение 20 ч. (Ход реакции контролировали нанесением на аналитическую силикагелевую ТСХ-пластинку (25% МеОН в хлороформе) и визуализацией пятен с помощью Мо окрашивания и раствора Ninhydrin). Далее приведены RfS компонентов смеси: соединение 10 (0,4), соединение 11 (0,2). Реакционную смесь отфильтровывали через слой целлита, промывали кек этанолом (2×200 мл), объединенный фильтрат концентрировали для получения сырого соединения, очищали колоночной хроматографией (силикагель 100-200 меш) с использованием 10% метанола в хлороформе в качестве элюента для получения соединения 11 (75,0 г, 60%) в виде бледно-желтого масла.
Стадия реакции:

Краткая методика: В охлажденный раствор соединения 5 (48,0 г, 0,146 моль, Nu-Chek-Prep Inc), DMF (1,0 мл) в CH2Cl2 (300,0 мл) при 0°С медленно добавляли оксалилхлорид (22,3 г, 0,175 моль, Molecula Lifesciences) в течение 30 мин. После добавления реакционную смесь перемешивали при 26°С в течение 4 ч. (Ход реакции контролировали осаждением небольших аликвот МеОН, нанесением на аналитическую силикагелевую ТСХ-тастинку (10% этилацетата в петролейном эфире) и визуализацией пятен с помощью раствора KMnO4). Далее приведены RfS компонентов смеси: соединение 12 (0,3), соединение 13 (0,8). Реакционную смесь концентрировали в атмосфере N2 для получения сырого соединения 6 (57 г, сырой).
Стадия реакции.

Краткая методика: В охлажденный раствор соединения 11 (50,0 г, 0,102 моль) в THF (1,0 л) при 0°С добавляли пиридин (32,3 г, 0,409 моль) с последующим DMAP (12,5 г, 0,102 моль) и перемешивали в течение 10 мин. Добавляли раствор сырого соединения 13 (57,0 г, 0,163 моль) в толуоле (1,0 мл) в течение 15 мин. После добавления реакционную смесь перемешивали при комнатной температуре в течение 20 ч. (Ход реакции контролировали осаждением небольших аликвот водой, экстрагированием EtOAc, нанесением на аналитическую силикагелевую ТСХ - пластинку (20% метанола в хлороформе) и визуализацией пятен с помощью Мо окрашивания и раствора Нингидрина). Далее приведены RfS компонентов смеси: соединение 11 (0,2) и PPI-1009 (0,5). Реакционную смесь разбавляли этилацетатом (2,0 л), промывали 0,5N HCl (250 мл), солевым раствором (250,0 мл), высушивали над безводным Na2SO4 и концентрировали для получения сырого соединения, которое очищали колоночной хроматографией (силикагель 100-200 меш) с использованием 20% метанола в хлороформе в качестве элюента для получения соединения PPI-1009 (27 г, 33,3%) в виде бледно-желтого масла.
ПРИМЕР 5: Приготовление PPI-1014
Целевая молекула
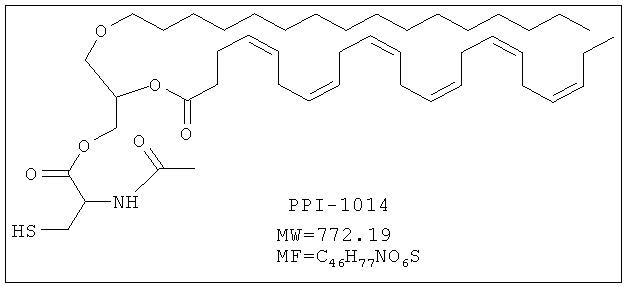
Схема синтеза:

Стадия реакции:
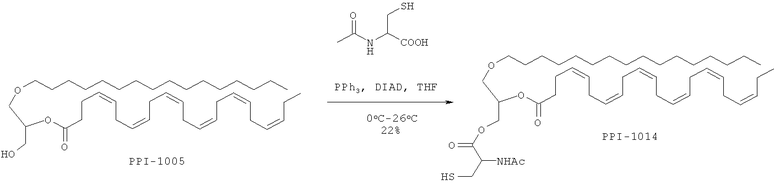
Время реакции: 17 ч. Температура реакции: от 0°С до 26°С. Краткая методика: В охлажденный раствор PPI-1005 (12,0 г, 19,16 ммоль) в THF (600 мл) добавляли трифенилфосфен (7,7 г, 28,75 ммоль) и перемешивали при 0°С в течение 10 мин с последующим медленным добавлением DIEAD (5,8 г, 28,75 ммоль). После перемешивания при 0°С в течение 30 мин в реакционную смесь добавляли N-ацетилцистин (4,6 г, 28,75 ммоль) и оставляли перемешиваться при комнатной температуре в течение 16 ч. (Ход реакции контролировали экстрагированием этилацетатом, нанесением на аналитическую силикагелевую ТСХ-пластинку (30% этилацетата в петролейном эфире) и визуализацией пятен с помощью Мо окрашивания). Далее приведены RfS компонентов смеси: PPI-1005 (0,8) и PPI-1014 (0,4).
Выделение и очистка: Реакционную смесь разбавляли водой (75 мл) и экстрагировали этилацетатом (3×200 мл). Объединенный слой этилацетата промывали солевым раствором (50 мл), высушивали над безводным Na2SO4 и концентрировали для получения сырого соединения, которое очищали колоночной хроматографией (100-200 меш силикагель) с использованием от 0 до 13% этилацетата в петролейном эфире в качестве элюента.
Указанное соединение PPI-1014 (3,2 г, 22%) получали в виде бледно-желтого масла, проявляющего следующие свойства. 1Н ЯМР (300 МГц, CDCl3): δ 6.35 (bs, 1H), 5.39-5.22 (m, 13H), 4.92-4.88 (m, 1H), 4.55-4.22 (m, 3Н), 3.55-3.41 (m, 5H), 3.02-2.97 (m, 2H), 2.85-2.77 (m, 10Н), 2.40 (s, 5H), 2.11-2.04 (m, 5H), 1.57-1.52 (m, 2H), 1.36-1.25 (m, 30Н), 0.97 (t, J=7.66 Гц; 3Н), 0.88 (t, J=6.63 Гц; 3Н). Mass (M+H): 772.3, ВЖЭХ чистота ~93.68%.
ПРИМЕР 6: Исследования на животных
Самцам новозеландских кроликов (1,8-2,5 кг) орально вводили PPI-1011, чистый в твердых желатиновых капсулах (размер 3). За время курса исследования крысам вводили дозы в 200 мг/кг PPI-1011 и животных умерщвляли сверхдозой эутенола через 1, 3, 6, 12, 18, 24 и 48 ч. Кровь собирали с помощью пункции сердца и плазму замораживали при -70°С для дальнейших анализов. Почки и печень также собирали и хранили при -70°С для дальнейших анализов. Данные исследования выполняли в виде 2 экспериментов с частично совпадающими группами через 12 ч (Эксперимент 1: 1, 3, 6 и 12 ч; Эксперимент 2: 12, 18, 24 и 48 ч). Контрольные образцы собирали в каждый момент времени. Плазмалогены и липиды экстрагировали и анализировали методом ЖХ-МС/МС, как сообщалось ранее (Goodenowe et al., 2007).
Как видно на Фигуре 11, с использованием оральной дозы в 200 мг/кг предшественник плазмалогенов PPI-1011 включался в циркулирующие плазмалогены. Также наблюдали деацилирование в sn-2-положении, высвобождающее докозагексаеновую кислоту (DHA). Самое большое включение было в 16:0/22:6, 18:0/22:6 и 18:1/22:6 этаноламин-плазмалогены и фосфатидилэтаноламины. Не наблюдалось изменений в фосфатидилэтаноламине сравнения 16:0/18:0.
Дальнейшее изучение временной динамики включения (Фигура 12) показало, что максимум включения было через 12 часов, и что этот уровень внедрения сохранялся в течение оставшегося периода наблюдения (48 ч). Это служило аргументом в пользу фосфатидилэтаноламинов и этаноламин-плазмалогенов. Напротив, уровни циркулирующей DHA достигали максимума через 6 часов и падали до менее стабильного состояния к 18 часов.
Изучения дозо-зависимого включения (Фигура 13) PPI-1011 в плазмалогены и фосфатидилэтаноламины плазмы показало, что новый стабильный уровень в этих циркулирующих фосфолипидах достигался дозозависимым образом от 10 до 200 мг/кг. Однако дальнейшее повышение дозы не повышало уровни стабильного состояния плазмалогенов и фосфатидилэтаноламинов выше уровней, полученных при 200 мг/кг. Напротив, самые высокие стабильные уровни циркулирующей DHA были получены при 500 мг/кг и больше не повышались при дозе 1000 мг/кг.
Увеличение плазмалогенов и DHA в тканях также наблюдали в тканях почек (Фигуры 4 и 5) и печени (Фигуры 6).
Данные разультаты указывают на то, что PPI-1011 является орально биодоступным у кроликов и превращается в DHA-содержащие этаноламин-плазмалогены и фосфатидилэтаноламины с помощью реакций деацилирования/реацилирования. К тому же, результаты предполагают, что эндогенные метаболические системы могут ограничивать максимальное повышение, которое может быть повышено фармакологически.
ПРИМЕР 7: Модулирование in vitro избыточного количества мембранного белка предшественниками плазмалогенов
Следующие исследования показали эффективность предшественника плазмалогенов (1-алкил-2-ацил глицерина) в изменении избыточного количества мембранных резидентных белков. Клеточные эффекты действия соединения показаны на клетках дикого типа, а также в условиях искусственно повышенного содержания холестерина в мембранах.
В клетках дикого типа увеличение содержания модулирующего белок-предшественник амилоида (АРР) фермента ADAM10, и этерифицирующего холестерин белка SOAT1 наблюдали при увеличении концентрации предшественника плазмалогенов. Аналогичные эффекты наблюдали в холестерин-нагруженных моделях. К тому же, другой участвующий в процессинге АРР фермент, ВАСЕ1, показал уменьшение избыточного количества только в нагруженных холестерином клетках. Без привязки к теории, эти данные поддерживают способ уменьшения отложений амилоида в контексте болезни Альцгеймера и одновременно повторное уравновешивание содержания холестерина в мембране в системе, предлагая тем самым возможные преимущества в лечении заболеваний, таких как атеросклероз и гиперхолестеролемия, дополнительно к болезни Альцгеймера.
АРР главным образом процессируется традиционным путем, включающим последовательное расщепление γ-секретазами (кодированы генами 1/2 пресенилина) и α-секретазой (кодируемой ADAM 10). Этот непаталогический процессинг АРР приводит к образованию нейротрофического пептида (sAPPα), который проявляет защиту против токсичности глутамата и гипоглицемии (Araki et al., 1991; Mattson et al., 1993; Postina et al., 2004; Fahrenholz, 2007). Альтернативный путь процессинга АРР проявляется в болезни Альцгеймера, когда АРР расщепляется γ- и β-секретазами в богатых холестерином липидных рафтах. Этот «нетрадиционный» путь приводит к формированию Аβ пептидов длиной 38-43 аминокислотных остатков, которые имеют тенденцию к агрегации в бляшки во внеклеточном матриксе, что является признаком AD (Selkoe, 2002; Walsh et al., 2002; Selkoe, 2003; Meyer-Luehmann et al., 2008). В то время как ранне-семейная AD объясняется генетическими повреждениями в АРР или процессирующих АРР ферментах (PSEN1/2, ВАСЕ, ADAM), первопричина спорадической поздней AD (переключение непатогенного процессинга АРР на патогенный) остается неясной.
Особое значение гомеостаза холестерина в этиологии AD было исследовано у человека (Corder et al., 1993; Saunders et al., 1993; Blacker et al., 1997; Hofman et al., 1997) и на животных моделях (Joyce et al., 2002; Singaraja et al., 2002; Van Eck al., 2006; Wahrle et al., 2008). Было показано, что изменение содержания холестерина в цитоплазматической мембране влияет на функцию мембранных резидентных белков (Scanlon et al., 2001; Lange et al., 2004). Повышенное содержание холестерина в структурах головного мозга было показано у субъектов с AD (Mori et al., 2001), в то время как кролики, которых питали обогащенной холестерином диетой, показали развитие бляшек в головном мозге (Ghribi et al., 2006). In vitro данные показали, что клетки с дефицитом плазмалогенов содержат повышенное количество свободного холестерина в мембране, однако было показано, что у человека дефицит плазмалогенов в сыворотке согласуется с ухудшением когнитивных функций (Goodenowe et al., 2007). На основании данных наблюдений была изучена взаимосвязь между холестерином и плазмалогенами, а также определение воздействия их баланса на патологические проявления AD, измеренные в условиях секретируемого Аβ.
Предложенный механизм действия: Сдвиг в процессинге АРР посредством модулирования мембранных липидов
Клетки эмбриональной почки человека (НЕК293) экспрессируют АРР и для прцессинга АРР требуется механизм связывания с мембраной, делая ее хорошей моделью для изучения процессинга АРР. Настоящее in vitro исследование противоречит предыдущим исследованиям, в которых модулирование мембранной текучести посредством нагрузки холестерина и/или добавления предшественника плазмалогена изменяло внутриклеточное содержание Aβ42. Нагрузка НЕК293 клеток холестерином повышает количество свободного холестерина на 17% (по сравнению с Контролем) в клетках через 48 часов периода инкубации. Это повышение сопровождается параллельным и значительным повышением (р<0.05) содержания Аβ42 в кондиционируемой среде по сравнению с контролем. Увеличение амилоида на 65% в первую очередь происходит благодаря повышению на 22% концентрации β-секретазы (Фигура 18А, линия 2); базальные уровни АРР остаются без изменения при нагрузке холестерином. Обработка нагруженных холестерином НЕК293 клеток предшественником плазмалогенов PPI-1005 значительно уменьшает количество свободного холестерина в клеточной мембране (р<0.05). Содержание Аβ42 в кондиционированной среде падает на 70% ниже нагруженных холестерином уровней при концентрации 20 мкМ (р=0.0001), в то время как содержание sAPPα в кондиционированной среде является увеличенным. Воздействие на процессинг АРР происходит не благодаря изменению экспрессии АРР, а скорее благодаря сдвигу в пути процессинга АРР из-за изменения избыточного количества ферментов, процессирующих АРР. Несмотря на то что β-секретаза была восстановлена до нормальных уровней при концентрации 20 мкМ PPI-1005, 73%-ное увеличение sAPPα видов было обнаружено в кондиционированной среде. Данное повышение объяснялось 63%-ным повышением ADAM10 (Фигура 18А, полоса 3), фермента, ответственного за формирование sAPPα.
Изменение холестеринового профиля клеток после добавления плазмалогена может объясняться тем, что SOAT1, фермент, ответственный за этерификацию свободного холестерина, увеличивается примерно на 25% (по сравнению с условиями нагруженного холестерина) при повышении концентрации плазмалогена (Фигура 18А, полоса 5).
Отдельно эффекты PPI-1005 были изучены на клетках НЕК293 дикого типа, не нагруженных холестерином. Фигура 18В показывает зависимое от концентрации повышение избыточного количества ADAM10 (35%) и SOAT1 (50%). Изменений в содержании ВАСЕ1 или АРР не наблюдалось. Хотя, когда НЕК293 клетки были истощенными холестерином с помощью ингибирования HMGCoA редуктазы правастатином, уровни ADAM10 и SOAT1 оставались постоянными (Фигура 18С). В то время как обработка плазмалогеном и правастатином значительно понижала фракцию свободного холестерина в клетках, только обработка плазмалогеном изменяла уровни ADAM10 и SOAT1 в клетке. Это указывает на то, что влияние на избыточное количество ADAM10 и SOAT1 в большей степени оказывают содержащиеся в мембране плазмалогены, чем содержащийся в мембране холестерин.
Таким образом, избыточное количество мембранных резидентных белков может быть изменено in vitro путем моделирования содержания плазмалогена в клетках, которое достигается обработкой клеток предшественниками плазмалогенов, как описано здесь.
Материалы и способы
Нагрузка холестерином
Клетки НЕК293, выращенные в DMEM, 10% FBS при 37°С, 5% СО2 засевали за день до обработки. На следующий день клеточные мембраны нагружали экзогенным холестерином при концентрации 10 мкг/мл среды с использованием метил-β-циклодекстрина в качестве носителя для доставки холестерина, как описано (Rong et al., 2003).
Анализ холестерина
Клетки обрабатывали предшественником плазмалогена PPI-1005 или этанолом в качестве контроля. Клетки собирали через 48 часов с использованием коктейля Versene: TryPLe Express, отмывали PBS. Липиды экстрагировали содержащим хлороформ 1% Triton Х-100. Органическую фракцию восстанавливали и высушивали в потоке азота. Высушенные липиды ресуспендировали в холестериновом реакционном буфере (Biovision, Mountain View, CA) и общие свободные и верифицированные фракции холестерина подсчитывали с использованием набора для подсчета холестерина (Biovision, Mountain View, CA) согласно рекомендациям производителя. Холестерин сначала рассчитывали как мкг/миллион клеток и определяли в виде процента контрольных условий для каждого эксперимента.
Анализ амилоида
НЕК293 клетки нагружали экзогенным холестерином, как описано, и обрабатывали PPI-1005 или этанолом в качестве контроля. Кондиционированную среду из обработанных клеток собирали по окончании 48 часового периода инкубации. Для анализа содержания Аβ1-42, кондиционированную среду обогащали с использованием центрифужного ультрафильтра Amicon (Millipore, Billerica, MA) перед загрузкой в микропланшеты. ELISA проводили согласно рекомендациям производителя (Covance Labs, Princeton, NJ). Реакции останавливали через 25 минут после добавления субстрата и абсорбцию считывали при 495 нм. Эксперимент проводили три раза. Значения рассчитывали как мкг/мл кондиционированной среды и нормализовали до количества Аβ, обнаруженного в кондиционированной среде из необработанных, нагруженных холестерином контрольных НЕК293 клеток.
Иммуноблоттинг и иммунопреципитация
Клетки НЕК293 обрабатывали, как описано в анализе амилоида. Гранулы клеток отмывали в PBS и лизировали в RIPA буфере, содержащем ингибирующий протеазу коктейль (Sigma, St. Louis, MI). Белок в клеточном лизате подсчитывали с помощью Bio-Rad Protein Assay (Bio-Rad, Hercules, CA). Следующие антитела использовали для вестерн-блот анализов: АРР (Calbiochem, Darmstadt, Germany), BACE1 и ADAM10 (Millipore, Temecula, CA), sAPPα (IBL, Gunma, Japan), SOAT1 (Santa Cruz Biotechnology Inc., CA) и β-актин (Sigma, St. Louis, MI). Иммуноосаждение проводили для установления sAPPα в кондиционированной среде. Вкратце, антитело к sAPPα добавляли в кондиционированную среду и инкубировали в течение 16 часов при 4°С. Иммуноосаждение проводили инкубацией с белок A/G-агарозными шариками в течение 6 часов при 4°С. Шарики промывали PBS и элюированные белки детектировали при помощи иммуноблоттинга с помощью анти-sAPPα антитела. Интенсивности полос рассчитывали с помощью Image Processing и Analysis in Java (ImageJ) программного обеспечения (National Instituyes of Health, Bethesda, MD).
Статистический анализ
Статистический анализ данных выполняли с помощью Microsoft™ Office Excel 2007 и тесты Даннета JMP version & Multiple применяли для анализа различий между обработанными и контрольными группами.
Опытным в данной области специалистам будет понятно, что много вариантов и модификаций может быть сделано, без отступления от объема изобретения, как определено в формуле.
Следующие ссылки, а также ссылки, представленные выше, включены здесь посредством отсылки.
Источники
1. Calderini G, Bonetti AC, Battistella A, Crews FT, Toffano G (1983) Biochemical changes of rat brain membranes with aging. Neurochem Res. 8:483-92.
2. Hashimoto M, Hossain S, Masumura S (1999) Effect of aging on plasma membrane fluidity of rat aortic endothelial cells. Exp Gerontol. 34:687-98.
3. Kessler AR, Kessler B, Yehuda S (1985) Changes in the cholesterol level, cholesterol-to-phospholipid mole ratio, and membrane lipid microviscosity in rat brain induced by age and a plant oil mixture. Biochem Pharmacol. 34:1120-1.
4. Lewin MB, Timiras PS (1984) Lipid changes with aging in cardiac mitochondrial membranes. Mech Ageing Dev. 24:343-51.
5. Modi HR, Katyare SS, Patel MA (2008) Ageing-induced alterations in lipid/phospholipid profiles of rat brain and liver mitochondria: implications for mitochondrial energy-linked functions. J Membr Biol. 221:51-60.
6. Wu CC, Su MJ, Chi JF, Wu MH, Lee YT (1997) Comparison of aging and hypercholesterolemic effects on the sodium inward currents in cardiac myocytes. Life Sci, 61:1539-51.
7. Guo J, Chi S, Xu H, Jin G, Qi Z (2008) Effects of cholesterol levels on the excitability of rat hippocampal neurons. Mol Membr Biol. 25:216-23.
8. Santiago J, Guzmàn GR, Rojas LV, Marti R, Asmar-Rovira GA, Santana LF, McNamee M, Lasalde-Dominicci JA (2001) Probing the effects of membrane cholesterol in the Torpedo californica acetylcholine receptor and the novel lipid-exposed mutation alpha C418W in Xenopus oocytes. J Biol Chem. 276:46523-32.
9. Hashimoto M, Hossain S, Tanabe Y, Shido O (2005) Effects of aging on the relation of adenyl purine release with plasma membrane fluidity of arterial endothelial cells. Prostoglandins Leukot. Essent. Fatty Acids. 73:475-83.
10. Xiu J, Nordberg A, Qi X, Guan ZZ (2006) Influence of cholesterol and lovastatin on alpha-form of secreted amyloid precursor protein and expression of alpha7 nicotinic receptor on astrocytes. Newochem Int. 49:459-65.
11. Miersch S, Espey MG, Chaube R, Akarca A, Tweten R, Ananvoranich S, Mutus В (2008) Plasma membrane cholesterol content affects nitric oxide diffusion dynamics and signaling. J Biol Chem. 283:18513-21.
12. Cultler RG, Kelly J, Stone K, Pedersen WA, Tammara A, Hatanpaa K, Troncoso JC, Mattson MP (2004) Involvement of oxidative stress-induced abnormalities in ceramide and cholesterol metabolism in brain aging and Alzheimer's disease. Proc Natl Acad Sci USA. 101:2070-5.
13. Corrigan FM, Horrobin DF, Skinner ER, Besson JA, Cooper MB (1998) Abnormal content of n-6 and n-3 long-chain unsaturated fatty acids in the phosphoglycerides and cholesterol esters of parahippocampal cortex from Alzheimer's disease patients and its relationship to acetyl CoA content. Int J Biochem Cell Biol. 30:197-207.
14. Distl R, Meske V, Ohm TG (2001) Tangle-bearing neurons contain more free cholesterol than adjacent tangle-free neurons. Acta Neuropathol. 101:547-54.
15. Grimm МО, Grimm HS, Tomic I, Beyreuther K, Hartmann T, Bergmann С (2008) Independent inhibition of Alzheimer disease beta- and gamma-secretase cleavage by lowered cholesterol levels. J Biol Chem. 283:11302-11.
16. Simons M, Keller P, De Strooper В, Beyreuther K, Dotti CG, Simons K (1998) Cholesterol depletion inhibits the generation of beta-amyloid in hippocampal neurons. Proc Nati Acad Sci USA. 95:6460-4.
17. Beel AJ, Mobley CK, Kim HJ, Tian F, Hadziselimovic A, Jap B, Prestegard JH, Sanders CR (2008) Structural studies of the transmembrane C-terminal domain of the amyloid precursor protein (APP): does APP function as a cholesterol sensor? Biochemistry. 47:9428-46.
18. Sigle JP, Zander J, Ehret A, Honegger J, Jackisch R, Feuerstein TJ (2003) High potassium-induced activation of choline-acetyltransferase in human neocortex: implications and species differences. Brain Res Bull. 60:255-62.
19. Wolozin В, Wang SW, Li NC, Lee A, Lee ТА, Kazis LE (2007) Simvastatin is associated with a reduced incidence of dementia and Parkinson's disease. BMC Med. 5:20.
20. Li CM, dark ME, Rudolf M, Curcio CA (2007) Distribution and composition of esterified and unesterified cholesterol in extra-macular drusen. Exp Eye Res. 85:192-201.
21. Hager MH, Solomon KR, Freeman MR (2006) The role of cholesterol in prostate cancer. Curr Opin Clin Nutr Metab Care; 9:379-85.
22. Campbell AM, Chan SH (2008) Mitochondrial membrane cholesterol, the voltage dependent anion channel (VDAC), and the Warburg effect. J Bioenerg Biomembr.
23. Vejux A, Malvitte L, Lizard G (2008) Side effects of oxysterols: cytotoxicity, oxidation, inflammation, and phospholipidosis. Braz J Med Biol Res. 41:545-56.
24. Streit WJ, Sparks DL (1997) Activation of microglia in the brains of humans with heart disease and hypercholesterolemic rabbits. J Mol Med. 75:130-8.
25. Diestel A, Aktas O, Hackel D, Hake I, Meier S, Raine CS, Nitsch R, Zipp F, Ullrich O (2003) Activation of microglial poly(ADP-ribose)-polymerase-l by cholesterol breakdown products during neuroinflammation: a link between demyelination and neuronal damage. J Exp Med. 198:1729-40.
26. Thirumangalakudi L, Prakasam A, Zhang R, Bimonte-Nelson H, Sambamurti K, Kindy MS, Bhat NR (2008) High cholesterol-induced neuroinflammation and amyloid precursor protein processing correlate with loss of working memory in mice. J Neurochem. 106:475-85.
27. Shin J, Thompson DH (2003) Direct synthesis of plasmenylcholine from allyl-substituted glycerols. J Org Chem. 68:6760-6.
28. Gupta CM, Radhakrishnan R, Khorana HG (1977) Glycerophospholipid synthesis: improved general method and new analogs containing photoactivable groups. Proc Natl Acad Sci USA. 74:4315-9.
29. Watt MJ, Steinberg GR (2008) Regulation and function of triacylglycerol lipases in cellular metabolism. Biochem J. 414:313-25.
30. Nagan N, Hajra AK, Larkins LK, Lazarow P, Purdue PE, Rizzo WB, Zoeller RA (1998) Isolation of a Chinese hamster fibroblast variant defective in dihydroxyacetonephosphate acyltransterase activity and plasmalogen biosynthesis: use of a novel two-step selection protocol. Biochem J. 332:273-9.
31. Goodenowe DB, Cook LL, Liu J, Lu Y, Jayasinghe DA, Ahiahonu PW, Heath D, Yamazaki Y, Flax J, Krenitsky KF, Sparks DL, Lerner A, Friedland RP, Kudo T, Kamino K, Morihara T, Takeda M, Wood PL (2007) Peripheral ethanolamine plasmalogen deficiency: a logical causative factor in Alzheimer's disease and dementia. J Lipid Res. 48:2485-98.
32. Araki W, Kitaguchi N, Tokushima Y, Ishii K, Aratake H, Shimohama S, Nakamura S and Kimura J (1991) Trophic effect of beta-amyloid precursor protein on cerebral cortical neurons in culture. Biochem Biophys Res Commun 181:265-271.
33. Blacker D, Haines JL, Rodes L, Terwedow H, Go RC, Harrell LE, Perry RT, Bassett SS, Chase G, Meyers D, Albert MS and Tanzi R (1997) ApoE-4 and age at onset of Alzheimer's disease: the NIMH genetics initiative. Neurology 48:139-147.
34. Corder EH, Saunders AM, Strittmatter WJ, Schmechel DE, Gaskell PC, Small GW, Roses AD, Haines JL and Pericak-Vance MA (1993) Gene dose of apolipoprotein E type 4 allele and the risk of Alzheimer's disease in late onset families. Science 261:921-923.
35. Fahrenholz F (2007) Alpha-secretase as a therapeutic target. Curr Alzheimer Res 4:412-417.
36. Ghribi O, Larsen В, Schrag M and Herman MM (2006) High cholesterol content in neurons increases BACE, beta-amyloid, and phosphorylated tau levels in rabbit hippocampus. Exp Neurol 200:460-467.
37. Hofman A, Ott A, Breteler MM, Bots ML, Slooter AJ, van Harskamp F, van Duijn CN, Van Broeckhoven С and Grobbee DE (1997) Atherosclerosis, apolipoprotein E, and prevalence of dementia and Alzheimer's disease in the Rotterdam Study. Lancet 349:151-154.
38. Joyce CW, Amar MJ, Lambert G, Vaisman BL, Paigen B, Najib-Fruchart J, Hoyt RF, Jr., Neufeld ED, Remaley AT, Fredrickson DS, Brewer HB, Jr. and Santamarina-Fojo S (2002) The ATP binding cassette transporter A1 (ABCA1) modulates the development of aortic atherosclerosis in C57BL/6 and apoE-knockout mice. Proc Natl Acad Sci USA 99:407-412.
39. Lange Y, Ye J and Steck TL (2004) How cholesterol homeostasis is regulated by plasma membrane cholesterol in excess of phospholipids. Proc Natl Acad Sci USA 101:11664-11667.
40. Mattson MP, Cheng В, Culwell AR, Esch FS, Lieberburg I and Rydel RE (1993) Evidence for excitoprotective and intraneuronal calcium-regulating roles for secreted forms of the beta-amyloid precursor protein. Neuron 10:243-254.
41. Meyer-Luehmann M, Spires-Jones TL, Prada C, Garcia-Alloza M, de Calignon A, Rozkalne A, Koenigsknecht-Talboo J, Holtzman DM, Bacskai BJ and Hyman ВТ (2008) Rapid appearance and local toxicity of amyloid-beta plaques in a mouse model of Alzheimer's disease. Nature 451:720-724.
42. Mori Т, Paris D, Town T, Rojiani AM, Sparks DL, Delledonne A, Crawford F, Abdullah LI, Humphrey JA, Dickson DW and Mullan MJ (2001) Cholesterol accumulates in senile plaques of Alzheimer disease patients and in transgenic APP(SW) mice. J Neuropathol Exp Neurol 60:778-785.
43. Postina R, Schroeder A, Dewachter I, Bohl J, Schmitt U, Kojro E, Prinzen C, Endres K, Hiemke C, Blessing M, Flamez P, Dequenne A, Godaux E, van Leuven F and Fahrenholz F (2004) A disintegrin-metalloproteinase prevents amyloid plaque formation and hippocampal defects in an Alzheimer disease mouse model. J Clin Invest 113:1456-1464.
44. Rong JX, Shapiro M, Trogan E and Fisher EA (2003) Transdifferentiation of mouse aortic smooth muscle cells to a macrophage-like state after cholesterol loading. Proc Natl Acad Sci USA 100:13531-13536.
45. Saunders AM, Strittmatter WJ, Schmechel D, George-Hyslop PH, Pericak-Vance MA, Joo SH, Rosi BL, Gusella JF, Crapper-MacLachlan DR, Alberts MJ and et al. (1993) Association of apolipoprotein E allele epsilon 4 with late-onset familial and sporadic Alzheimer's disease. Neurology 43:1467-1472.
46. Scanlon SM, Williams DC and Schloss P (2001) Membrane cholesterol modulates serotonin transporter activity. Biochemistry 40:10507-10513.
47. Selkoe DJ (2002) Alzheimer's disease is a synaptic failure. Science 298:789-791.
48. Selkoe DJ (2003) Folding proteins in fatal ways. Nature 426:900-904.
49. Singaraja RR, Fievet C, Castro G, James ER, Hennuyer N, Clee SM, Bissada N, Choy JC, Fruchart JC, McManus BM, Staels В and Hayden MR (2002) Increased ABCA1 activity protects against atherosclerosis. J Clin Invest 110:35-42.
50. Van Eck M, Singaraja RR, Ye D, Hildebrand RB, James ER, Hayden MR and Van Berkel TJ (2006) Macrophage ATP-binding cassette transporter A1 overexpression inhibits atherosclerotic lesion progression in low-density lipoprotein receptor knockout mice. Arterioscler Thromb Vasc Biol 26:929-934.
51. Wahrle SE, Jiang H, Parsadanian M, Kim J, Li A, Knoten A, Jain S, Hirsch-Reinshagen V, Wellington CL, Bales KR, Paul SM and Holtzman DM (2008) Overexpression of ABCA1 reduces amyloid deposition in the PDAPP mouse model of Alzheimer disease. J Clin Invest 118:671-682.
52. Walsh DM, Klyubin I, Fadeeva JV, Cullen WK, Anwyl R, Wolfe MS, Rowan MJ and Selkoe DJ (2002) Naturally secreted oligomers of amyloid beta protein potently inhibit hippocampal long-term potentiation in vivo. Nature 416:535-539.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ЗАМЕЩЕННЫХ 2,3,5,6-ТЕТРАОКСАБИЦИКЛО[2.2.1]ГЕПТАНОВ | 2012 |
|
RU2494102C1 |
| ТРИЦИКЛИЧЕСКИЕ ОРГАНИЧЕСКИЕ МОНОПЕРОКСИДЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2011 |
|
RU2466133C1 |
| ЭНАНТИОМЕРЫ 2-ГИДРОКСИПРОИЗВОДНЫХ ЖИРНЫХ КИСЛОТ | 2012 |
|
RU2687967C2 |
| ЭНАНТИОМЕРЫ 2-ГИДРОКСИПРОИЗВОДНЫХ ЖИРНЫХ КИСЛОТ | 2012 |
|
RU2637937C2 |
| СПОСОБ ПОЛУЧЕНИЯ АДАМАНТИЛАЛКИЛОВЫХ И АДАМАНТИЛОКСИАЛКИЛОВЫХ ЭФИРОВ ТОЗИЛОКСИМЕТИЛФОСФОНОВОЙ КИСЛОТЫ | 2009 |
|
RU2450012C2 |
| Новые производные CYP-эйкозаноидов | 2015 |
|
RU2730512C2 |
| ПРОИЗВОДНЫЕ [1,2,4]-ДИТИАЗОЛИ(ДИ)НА, ИНДУКТОРЫ ГЛУТАТИОН-S-ТРАНСФЕРАЗЫ И NADPH: ХИНОН-ОКСИДОРЕДУКТАЗЫ ДЛЯ ПРОФИЛАКТИКИ И ЛЕЧЕНИЯ НЕБЛАГОПРИЯТНЫХ СОСТОЯНИЙ, СВЯЗАННЫХ С ЦИТОТОКСИЧНОСТЬЮ В ЦЕЛОМ И АПОПТОЗОМ В ЧАСТНОСТИ | 2006 |
|
RU2397162C2 |
| ПРИМЕНЕНИЕ ПРОИЗВОДНЫХ ТИЕНОПИРИДОНА В КАЧЕСТВЕ АКТИВАТОРОВ АМФК И ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ, КОТОРЫЕ ИХ СОДЕРЖАТ | 2006 |
|
RU2416409C2 |
| ОКИСЛЕННЫЕ ЛИПИДЫ И ИХ ПРИМЕНЕНИЕ ДЛЯ ЛЕЧЕНИЯ ВОСПАЛИТЕЛЬНЫХ ЗАБОЛЕВАНИЙ И НАРУШЕНИЙ | 2009 |
|
RU2482854C2 |
| СПОСОБ ЛЕЧЕНИЯ РЕСПИРАТОРНЫХ ЗАБОЛЕВАНИЙ, ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И ЕЁ ПРИМЕНЕНИЕ | 2010 |
|
RU2539899C2 |
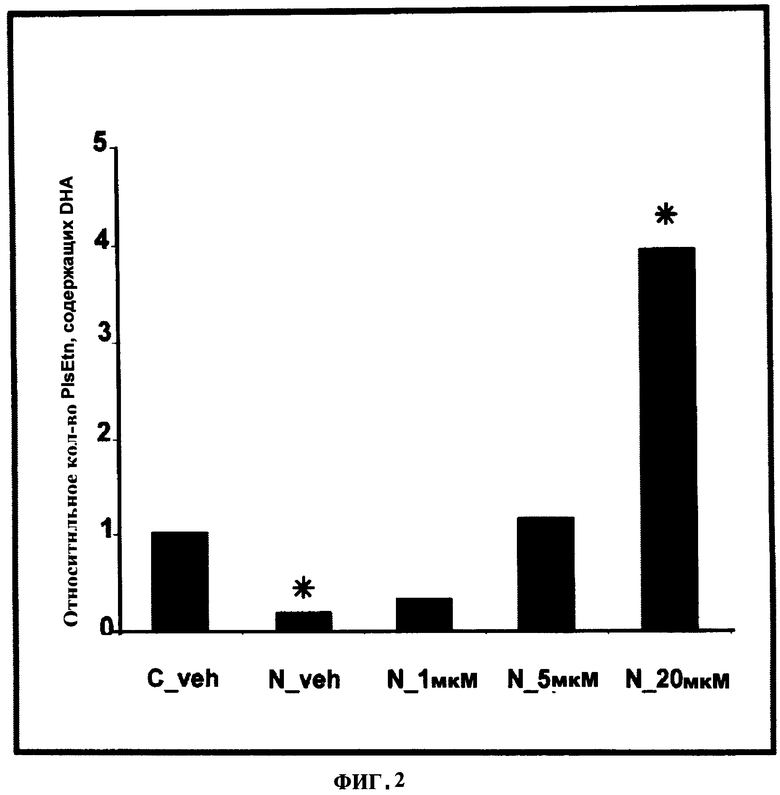



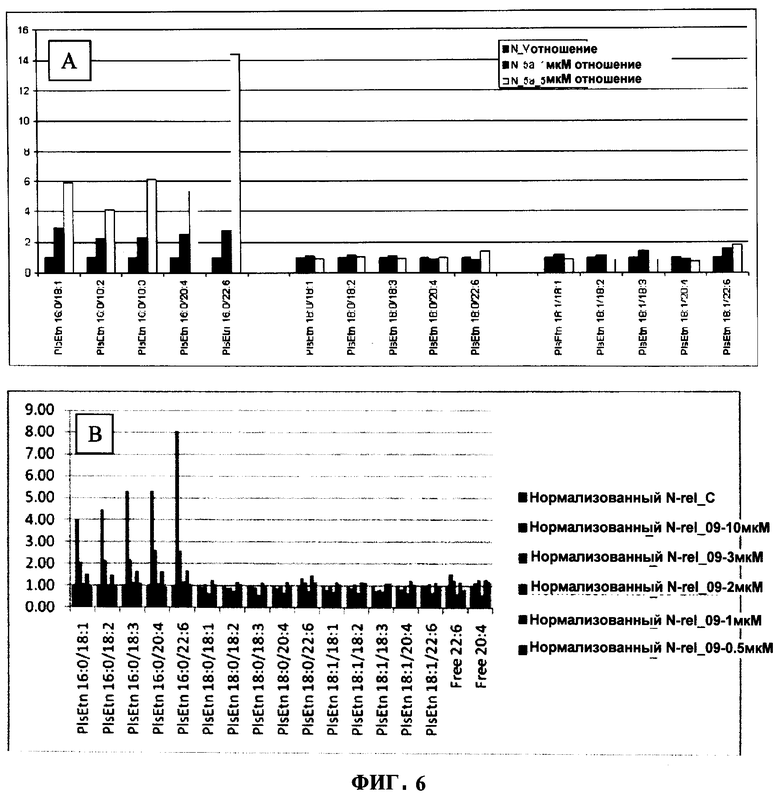



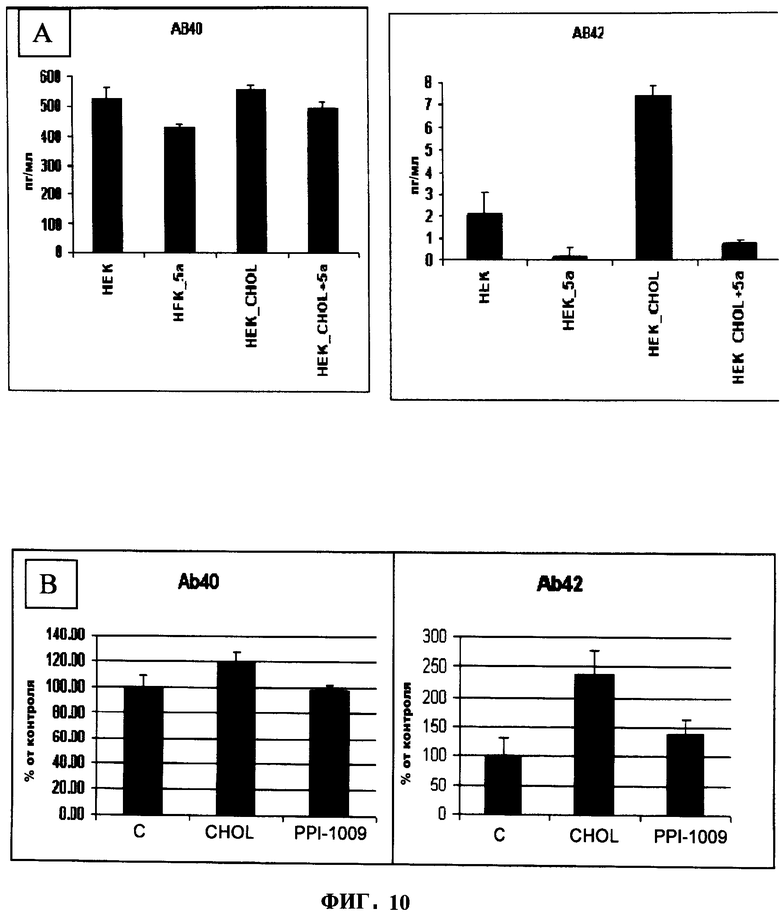

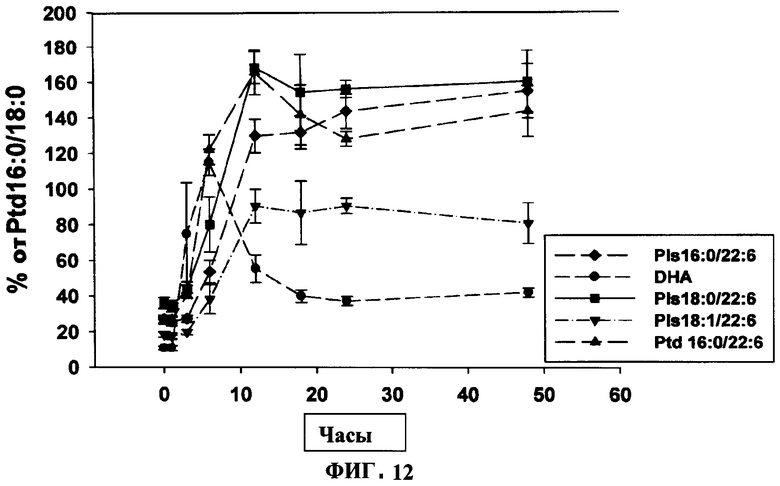

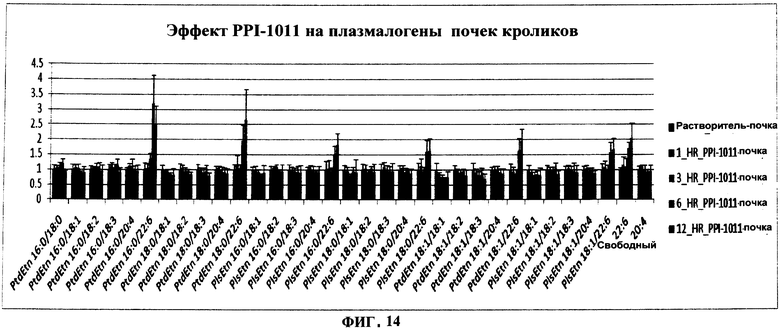

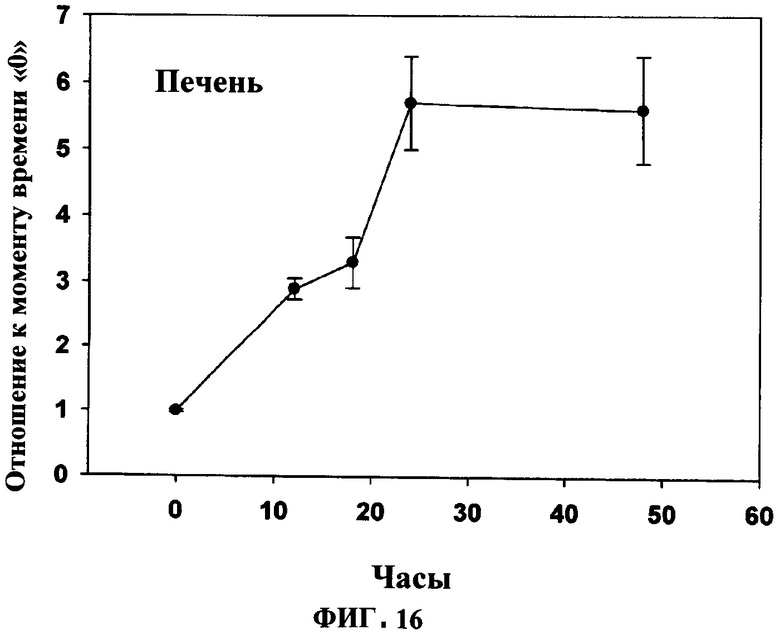

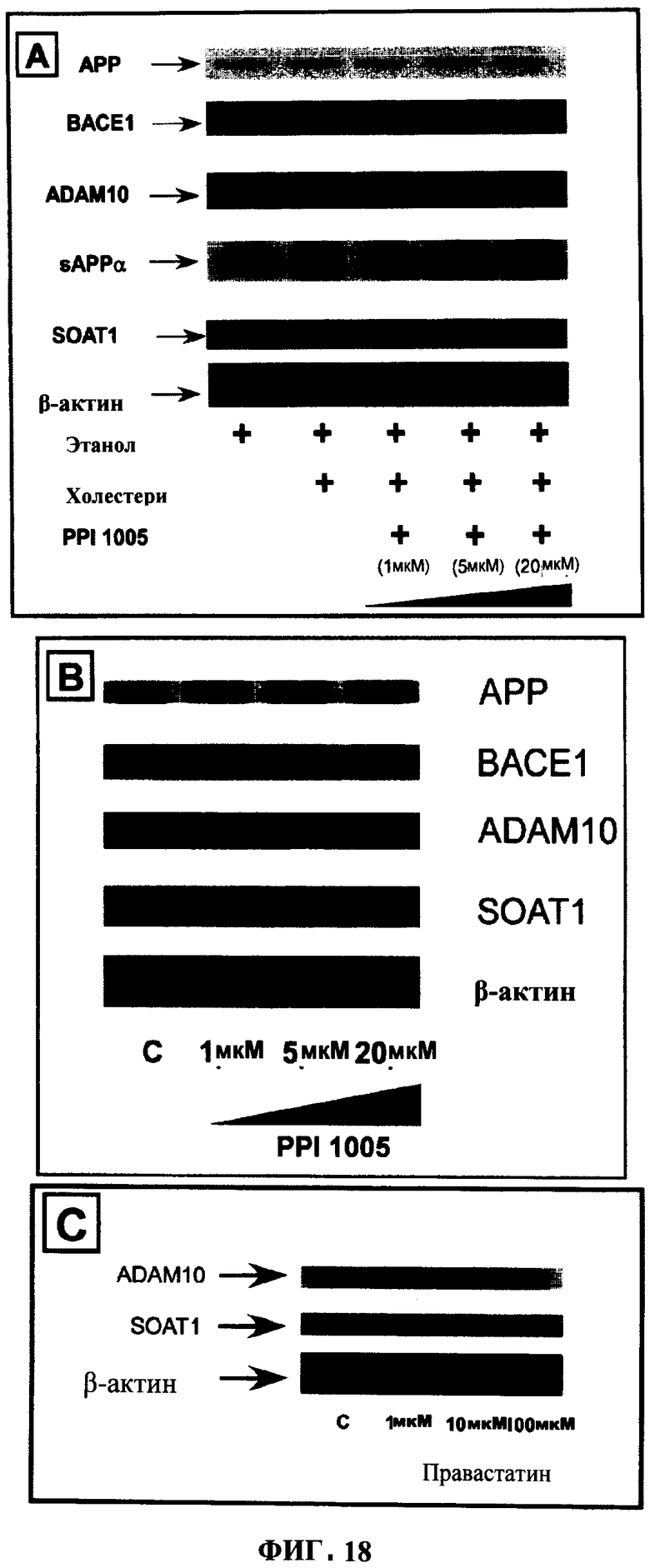
Изобретение относится к новым соединениям формулы I, в которой R1 и R2 являются одинаковыми или разными и выбраны из алкильной или алкенильной углеводородной цепи, значения группы R3, которая отщепляется липазой, определены в формуле изобретения. R4 и R5 являются независимо водородом или С1-С7алкилом; R6 представляет собой водород или С1-С7алкил; и R7 и R8 независимо являются водородом или С1-С7алкилом. Изобретение также относится к применению соединений формулы I, которые при введении в биологическую систему млекопитающего приводят к повышению клеточных концентраций специфических sn-2 замещенных этаноламин-плазмалогенов. Данные соединения могут применяться для лечения или предупреждения возрастных заболеваний, ассоциированных с повышенным уровнем холестерина в мембране, повышенным уровнем амилоида и пониженными уровнями плазмалогенов, таких как нейродегенерация, когнитивное нарушение, деменции, рак, остеопороз, биполярное нарушение и сосудистые заболевания.
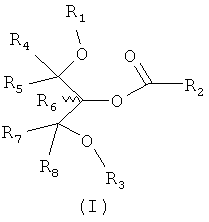
5 н. и 6 з.п. ф-лы, 18 ил., 7 пр.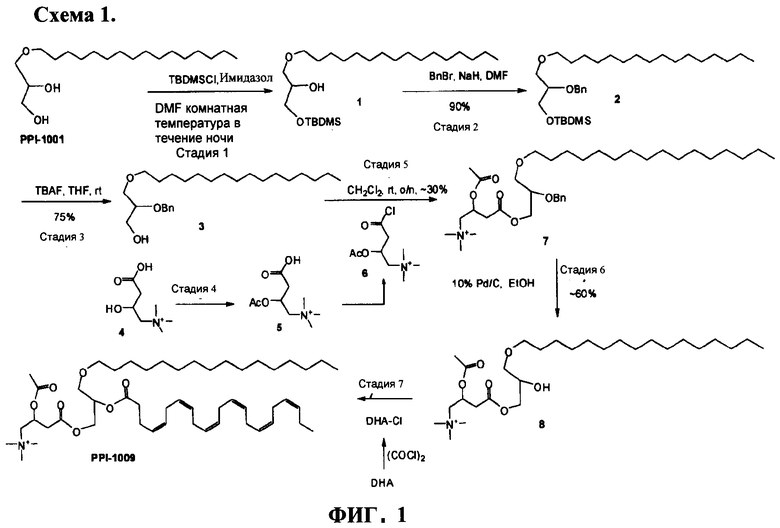
1. Соединение согласно структуре формулы I:

где:
R1 и R2 являются одинаковыми или разными, и выбраны из алкильной или алкенильной углеводородной цепи, выбранной из группы, состоящей из: СН3(СН2)3-, СН3(СН2)5-, СН3(СН2)7-, СН3(СН2)9-, СН3(СН2)11-, СН3(СН2)13-, СН3(СН2)15-, СН3(СН2)17-, СН3(СН2)19-, СН3(СН2)21-, СН3(СН2)23-, СН3(СН2)3СН=СН(СН2)7-, СН3(СН2)5СН=СН(СН2)7-, СН3(СН2)7СН=СН(СН2)7-, СН3(СН2)4СН=СНСН2СН=СН(СН2)7-, СН3СН2СН=СНСН2СН=СНСН2СН=СН(СН2)7-, СН3СН2(СН=СН)-, СН3(СН2)3(СН=СН)-, СН3(СН2)5(СН=СН)-, СН3(СН2)7(СН=СН)-, СН3(СН2)9(СН=СН)-, СН3(СН2)11(СН=СН)-, СН3(СН2)13(СН=СН)-, СН3(СН2)15(СН=СН)-, СН3(СН2)17(СН=СН)-, СН3(СН2)19(СН=СН)-, СН3(СН2)21(СН=СН)-, СН3(СН2)3СН=СН(СН2)5(СН=СН)-, СН3(СН2)5СН=СН(СН2)5(СН=СН)-, СН3(СН2)7СН=СН(СН2)5(СН=СН)-, СН3(СН2)4СН=СНСН2СН=СН(СН2)5(СН=СН), СН3СН2СН=СНСН2СН=СНСН2СН=СН(СН2)5(СН=СН)-, СН3(СН2)3СН=СН(СН2)7-, СН3(СН2)5СН=СН(СН2)7-, СН3(СН2)7СН=СН(СН2)7-, СН3(СН2)4(СН=СНСН2)2(СН2)6-, СН3СН2(СН=СНСН2)3(СН2)6-, СН3(СН2)4(СН=СНСН2)4(СН2)2-, СН3СН2(СН=СНСН2)5(СН2)2-, СН3(СН2)7СН=СН(СН2)11 и СН3СН2(СН=СНСН2)6СН2-;
R3 является группой, отщепляемой липазой от соединения согласно структуре формулы I, выбранной из группы, состоящей из карнитина, ацетил-D/L-карнитина, тиокарнитина, ацетил-D/L-тиокарнитина, креатина, норкарнитина, липоевой кислоты, дигидролипоевой кислоты, N-ацетилцистеина, замещенных или незамещенных аминокислотных групп, и групп, имеющих структуры, показанные ниже:


R4 и R5 являются независимо водородом или С1-С7алкилом;
R6 представляет собой водород или С1-С7алкил; и
R7 и R8 независимо являются водородом или С1-С7алкилом,
включая его фармацевтически приемлемые соли или сложные эфиры.
2. Соединение по п.1, в котором R2 представляет собой СН3СН2(СН=СНСН2)6СН2-, и которое предпочтительно выбрано из группы, состоящей из 2-ацетокси-4-(2-((4Z,7Z,10Z,13Z,16Z,19Z)-докоза-4,7,10,13,16,19-гексаеноилокси)-3-(гексадецилокси)пропокси)-N,N,N-триметил-4-оксобутан-1-аминия (PPI-1009),
(4Z,7Z,10Z,13Z,16Z,19Z)-1-(5-((R)-1,2-дитиолан-3-ил)пентаноилокси)-3-(гексадецилокси)пропан-2-илдокоза-4,7,10,13,16,19-гексаеноата (PPI-1011) и
(4Z,7Z,10Z,13Z,16Z,19Z)-1-(2-ацетамидо-3-меркаптопропаноилокси)-3-(гексадецилокси)пропан-2-илдокоза-4,7,10,13,16,19-гексаеноата (PPI-1014).
3. Фармацевтическая композиция для лечения или предупреждения возрастных заболеваний, опосредованных дефицитом плазмалогенов, содержащая фармацевтически приемлемый носитель и эффективное количество соединения по п.1 или 2.
4. Применение соединения по п.1 или 2 для лечения или предупреждения возрастного заболевания, ассоциированного с повышенным уровнем холестерина в мембране, повышенным уровнем амилоида или пониженным уровнем плазмалогенов.
5. Применение по п.4, в котором возрастное заболевание выбрано из группы, состоящей из: нейродегенеративного заболевания, когнитивного нарушения, деменции, рака и сосудистого заболевания.
6. Применение по п.5, в котором нейродегенеративное заболевание выбрано из группы, состоящей из: болезни Альцгеймера, болезни Паркинсона и возрастной макулярной дегенерации, рак выбран из группы, состоящей из: рака предстательной железы, легких, молочной железы, яичника и почки, и сосудистое заболевание выбрано из группы, состоящей из: атеросклероза и гиперхолестеринемии.
7. Применение соединения формулы I:

в котором
R3 является группой, отщепляемой липазой от соединения согласно структуре формулы I, выбранной из группы, состоящей из жирных кислот, карнитина, ацетил-D/L-карнитина, тиокарнитина, ацетил-D/L-тиокарнитина, креатина, норкарнитина, фосфохолина, липоевой кислоты, дигидролипоевой кислоты, фосфоэтаноламина, фосфосерина, N-ацетилцистеина, замещенных или незамещенных аминокислотных групп, и групп, имеющих структуры, показанные ниже:



и R1, R2 и от R4 до R8 являются такими, которые определены по п.1, включая его фармацевтически приемлемые соли или сложные эфиры, для лечения или предупреждения возрастных заболеваний, опосредованных дефицитом плазмалогенов путем повышения уровней PlsEtn выше контрольных уровней в PlsEtn дефицитных или PlsEtn достаточных системах, или заболеваний, возникших в результате патологической экспрессии генов транспортных белков холестерина.
8. Применение по п.7, где R2 представляет собой СН3СН2(СН=СНСН2)6СН2-, которое предпочтительно выбрано из группы, состоящей из 2-ацетокси-4-(2-((4Z,7Z,10Z,13Z,16Z,19Z)-докоза-4,7,10,13,16,19-гексаеноилокси)-3-(гексадецилокси)пропокси)-N,N,N-триметил-4-оксобутан-1-аминия (PPI-1009),
(4Z,7Z,10Z,13Z,16Z,19Z)-1-(5-((R)-1,2-дитиолан-3-ил)пентаноилокси)-3-(гексадецилокси)пропан-2-илдокоза-4,7,10,13,16,19-гексаеноата (PPI-1011) и
(4Z,7Z,10Z,13Z,16Z,19Z)-1-(2-ацетамидо-3-меркаптопропаноилокси)-3-(гексадецилокси)пропан-2-илдокоза-4,7,10,13,16,19-гексаеноата (PPI-1014).
9. Применение по п.7 или 8, в котором транспортным белком холестерина является аполипротеин Е.
10. Применение соединения формулы I:

для лечения или предупреждения нейродегенеративного заболевания, выбранного из группы, состоящей из: болезни Альцгеймера, болезни Паркинсона и возрастной макулярной дегенерации; сосудистого заболевания, выбранного из группы, состоящей из: атеросклероза и гиперхолестеринемии, где
R1 и R2 являются одинаковыми или разными, и выбраны из алкильной или алкенильной углеводородной цепи, выбранной из группы, состоящей из: СН3(СН2)3-, СН3(СН2)5-, СН3(СН2)7-, СН3(СН2)9-, СН3(СН2)11-, СН3(СН2)13-, СН3(СН2)15-, СН3(СН2)17-, СН3(СН2)19-, СН3(СН2)21-, СН3(СН2)23-, СН3(СН2)3СН=СН(СН2)7-, СН3(СН2)5СН=СН(СН2)7-, СН3(СН2)7СН=СН(СН2)7-, СН3(СН2)4СН=СНСН2СН=СН(СН2)7-, СН3СН2СН=СНСН2СН=СНСН2СН=СН(СН2)7-, СН3СН2(СН=СН)-, СН3(СН2)3(СН=СН)-, СН3(СН2)5(СН=СН)-, СН3(СН2)7(СН=СН)-, СН3(СН2)9(СН=СН)-, СН3(СН2)11(СН=СН)-, СН3(СН2)13(СН=СН)-, СН3(СН2)15(СН=СН)-, СН3(СН2)17(СН=СН)-, СН3(СН2)19(СН=СН)-, СН3(СН2)21(СН=СН)-, СН3(СН2)3СН=СН(СН2)5(СН=СН)-, СН3(СН2)5СН=СН(СН2)5(СН=СН)-, СН3(СН2)7СН=СН(СН2)5(СН=СН)-, СН3(СН2)4СН=СНСН2СН=СН(СН2)5(СН=СН)-, СН3СН2СН=СНСН2СН=СНСН2СН=СН(СН2)5(СН=СН)-, СН3(СН2)3СН=СН(СН2)7-, СН3(СН2)5СН=СН(СН2)7-, СН3(СН2)7СН=СН(СН2)7-, СН3(СН2)4(СН=СНСН2)2(СН2)6-, СН3СН2(СН=СНСН2)3(СН2)6-, СН3(СН2)4(СН=СНСН2)4(СН2)2-, СН3СН2(СН=СНСН2)5(СН2)2-, СН3(СН2)7СН=СН(СН2)11, и СН3СН2(СН=СНСН2)6СН2-;
R3 является группой, отщепляемой липазой от соединения согласно структуре формулы I, выбранной из группы, состоящей из жирных кислот, карнитина, ацетил-D/L-карнитина, тиокарнитина, ацетил-D/L-тиокарнитина, креатина, норкарнитина, фосфохолина, липоевой кислоты, дигидролипоевой кислоты, фосфоэтаноламина, фосфосерина, N-ацетилцистеина, замещенных или незамещенных аминокислотных групп, и групп, имеющих структуры, показанные ниже:



R4 и R5 являются независимо водородом или С1-С7алкилом;
R6 представляет собой водород или С1-С7алкил; и
R7 и R8 независимо являются водородом или С1-С7алкилом,
включая его фармацевтически приемлемые соли или сложные эфиры.
11. Применение по п.10, где R2 представляет собой СН3СН2(СН=СНСН2)6СН2-, при этом, предпочтительно, соединение, выбрано из группы, состоящей из 2-ацетокси-4-(2-((4Z,7Z,10Z,13Z,16Z,19Z)-докоза-4,7,10,13,16,19-гексаеноилокси)-3-(гексадецилокси)пропокси)-N,N,N-триметил-4-оксобутан-1-аминия (PPI-1009),
(4Z,7Z,10Z,13Z,16Z,19Z)-1-(5-((R)-1,2-дитиолан-3-ил)пентаноилокси)-3-(гексадецилокси)пропан-2-илдокоза-4,7,10,13,16,19-гексаеноата (PPI-1011) и
(4Z,7Z,10Z,13Z,16Z,19Z)-1-(2-ацетамидо-3-меркаптопропаноилокси)-3-(гексадецилокси)пропан-2-илдокоза-4,7,10,13,16,19-гексаеноата (PPI-1014).
| DATABASE CAS on STN, RN 18678-94-9, RN 892145-63-0, RN 186833-93-2, RN 186833-89-6, RN 125001-94-7, RN 123342-81-4, RN 123342-71-2, RN 117045-30-4, RN 117031-14-8, RN 117030-94-1, RN 117030-83-8, RN 116126-74-0, RN 116126-73-9, RN 116126-72-8, RN 116126-71-7, RN 116126-70-6, RN 116126-69-3, RN 115546-85-5, RN 115520-53-1, RN 115520-47-3, RN |
Авторы
Даты
2015-04-10—Публикация
2009-12-18—Подача