Изобретение относится к медицине, а именно к кардиохирургии, и может применяться для криоабляции миокарда со стороны эпикарда при лечении фибрилляции предсердий (ФП).
Фибрилляция предсердий связана с нарушением порядка распространения нервного возбуждения в миокарде предсердий, когда среди разветвленной системы нервных волокон образуются замкнутые пути рециркуляции (re-entry). Одним из направлений кардиохирургии является хирургическое лечение ФП, к которому прибегают, если исчерпываются возможности медикаментозной терапии.
Борьба с ФП принадлежит к ряду важнейших задач современной медицины. Данная патология встречается в общей популяции с частотой 0,4-1,0%, являясь одним из наиболее распространенных видов аритмий [1].
С фибрилляцией предсердий связана треть всех госпитализаций по поводу нарушений сердечного ритма [2].
Число людей, страдающих ФП, постоянно растет. Причины такого роста разнообразны: увеличение в обществе удельного веса людей пожилого возраста, улучшение диагностики ФП на амбулаторном этапе, повышение числа выживших после острого инфаркта миокарда и др. [3].
ФП относится к жизнеугрожающим осложнениям вследствие образования тромбов, которые приводят к развитию ишемического инсульта у больных ФП в пять раз чаще, чем среди лиц без ФП [4].
Результатом действия ФП на внутрисердечную гемодинамику является постепенная дилатация камер сердца с последующим снижением сократительной функции миокарда желудочков (аритмогенная кардиомиопатия) [5].
Помимо того что ФП укорачивает продолжительность жизни, она также негативно влияет на качество жизни [6].
С учетом сложности и важности проблемы по различным показаниям используются различные методы лечения ФП, такие как медикаментозное лечение, электрокардиостимуляция, трансвенозные катетерные радиочастотные абляции и, в том числе, хирургические методы [7].
Существующие методы лечения ФП направлены на разрушение множественных колец рециркуляции нервного возбуждения (re-entry), сформировавшихся в миокарде предсердий. При этом используют различные способы деструкции тканей: от механического рассечения до воздействия различными физическими средствами: ультразвуковым, радиочастотным, микроволновым, лазерным и криогенным. Они осуществляются, как правило, комбинированно с другими операциями на сердце в условиях искусственного кровообращения.
В современной кардиологии используют два основных метода хирургического лечения фибрилляции предсердий. В основе первого метода хирургического лечения лежит создание так называемого «коридора» из проводящих путей между первым водителем ритма - синусоатриальным узлом и водителем ритма второго уровня - атриовентрикулярным узлом. При этом клетки атриовентрикулярного узла изолируются от остальной части ткани предсердий, а это, в свою очередь, способствует созданию более регулярного ритма сердца.
Ко второму методу хирургического лечения фибрилляции предсердий можно отнести процедуру «лабиринт» (maze). В основе данного метода лежит нанесение линейных повреждений на миокард обоих предсердий во многих местах для профилактики возникновения устойчивых рециркуляционных волн re-entry.
Для прерывания патологического пути проведения нервного возбуждения используют различные методы: техника «разрез-шов», гипертермический (радиочастотное или ультразвуковое воздействие, лазер), гипотермический (криоабляция). Перспективность воздействия низких температур на миокард в лечении больных ФП обусловлена тем, что криоабляция со стороны эпикарда позволяет получить трансмуральное повреждение миокарда без проникновения в полости предсердий. Зона криодеструкции имеет, как правило, правильные и четко очерченные границы, что препятствует в дальнейшем формированию новых видов аритмий [8, 9].
Таким образом, среди хирургических инструментов для деструкции тканей важное место принадлежит криоинструментам, что обусловлено адекватностью криовоздействия по вышеуказанным показателям трансмурального воздействия и неаритмогенности.
В настоящее время существует ряд подходов в достижении охлаждения и криодеструкции целевых участков тканей и органов.
Наряду с шланговыми и наливными системами, в которых обеспечивается постоянное протекание хладагента через контактный инструмент для охлаждения миокарда (использование аргона, жидкого азота, углекислоты), особую роль в различных областях хирургии играют автономные инструменты с пористыми рабочими частями, в которых производится набор и постепенное испарение охлаждающего вещества. Известен, например, криохирургический аппликатор [10, 11], содержащий цилиндрический сердечник из пористого никелида титана, закрепленный на проволочном держателе, выполненном из никелида титана. Сердечник криоаппликатора представляет собой объем, образованный сообщающимися порами. Хладагент удерживается в порах силами поверхностного натяжения.
Известные типы криоаппликаторов преимущественно обеспечивают воздействие точечно (торцевой поверхностью) [10] или по площади (катком) [12]. Между тем, при формировании ограниченных маршрутов передачи нервного возбуждения по типу «коридор» или «лабиринт» требуется преимущественно создание не точечных и не площадных, а узких протяженных (криволинейных) областей криодеструкции.
В качестве наиболее близкого аналога выбран криохирургический аппликатор по патенту РФ №2221515 от 20.01.2004 «Устройство для хирургического лечения стеноза трахеи», авторы: Дамбаев Г.Ц., Соколович Е.Г., Гюнтер В.Э., Проскурин А.В., Фатюшин М.Ю., содержащий цилиндрический сердечник, из пористого никелида титана, аксиально закрепленный на проволочном держателе, выполненном из никелида титана. Держатель из никелида титана, в силу свойственной ему сверхэластичности, позволяет корректировать его изгиб соответственно условиям подведения к области воздействия, что несколько расширяет возможности позиционирования при внутриполостных операциях.
Недостатком устройства является его неадаптированность для проведения траекторией криодеструкции тканей миокарда в ходе хирургического лечения фибрилляции предсердий. В связи с этим недостатком применение известного устройства было бы сопряжено с большой длительностью процедуры, что нежелательно. Время процедуры, входящее в суммарное время нахождения под наркозом, должно быть минимальным, так как оно напрямую связано с уменьшением жизненного ресурса пациента.
Задачей изобретения является в обеспечение адаптации устройства к выполнению криодеструкции участков миокарда по целенаправленно задаваемым траекториям при лечении фибрилляции предсердий со стороны эпикарда, и, как следствие, сокращение времени процедуры, включаемого в суммарное время нахождения пациента под общим наркозом.
Поставленная задача решается тем, что в криохирургическом аппликаторе, содержащем цилиндрический сердечник из пористого никелида титана, аксиально закрепленный на проволочном держателе, выполненном из никелида титана, согласно изобретению сердечник выполнен с продольным выступом в виде гребня и вместе с ним плавно изогнут по длине на угол 20-30 градусов в плоскости, ортогональной радиальной ориентации гребня относительно радиуса окружности, частью которого является изогнутая длина сердечника. Удобство применения повышается тем, что держатель в области, примыкающей к сердечнику, дважды изогнут от оси радиуса окружности, частью которой является изогнутая длина сердечника, при этом первый изгиб выполнен на угол 100-130 градусов от приведенной оси радиуса окружности в направлении, продолжающем изгиб сердечника, а второй изгиб выполнен так, что продолжение прямолинейной дистальной части держателя проецируется на середину сердечника.
Связь отличительных признаков с достижением технического результата обусловлена следующим.
1. Выполнение сердечника с продольным выступом в виде гребня обеспечивает наличие выраженной узкой зоны для контакта с тканями эпикарда на выбранном протяженном участке.
2. Плавный изгиб сердечника вместе с гребнеобразным выступом обеспечивает кривизну узкого протяженного участка криодеструкции в соответствии с анатомической конфигурацией области воздействия.
3. Направление изгиба в плоскости, ортогональной радиальной ориентации гребня, обеспечивает удобство манипулирования в операционной зоне с возможностью визуального контроля.
4. Выбор угла изгиба сердечника с гребнем в пределах 20-30° проведен экспертно с учетом реальных характеристик кривизны протяженных участков криовоздействия.
5. Изгибы держателя обеспечивают удобство применения криоаппликатора. Изгиб в том же направлении, что и сердечник, придает всей конструкции плоские очертания с минимальным объемом, повышая удобство складирования, стерилизации, а также однозначность лежачего положения, важную для захвата в условиях ограниченного времени.
6. Наличие двойного изгиба держателя позволяет удерживать устройство в руке без риска прокручивания, а ориентация дистальной части в направлении середины сердечника позволяет органолептически прогнозировать положение сердечника при затрудненной визуализации.
7. Выбор угла первого изгиба держателя в пределах 100-130° проведен экспертно с учетом обеспечения выполнения второго изгиба над серединой сердечника. При этом выбор точки второго изгиба определяется интраоперационно, в соответствии с нужным наклоном сердечника относительно дистальной части держателя.
Таким образом, заявленные отличительные признаки в своей совокупности обеспечивают проведение криодеструкции тканей миокарда предсердий со стороны эпикарда адекватно их анатомическому строению и характеру процедуры, позволяя выполнить ее в минимальное время и с высокой точностью.
Изобретение поясняется фиг.1-3.
На фиг.1 схематически изображена конструкция криохирургического аппликатора:
1 - это цилиндрический сердечник;
2 - это проволочный держатель;
3 - это гребень сердечника;
4 - это первый изгиб 100-130 градусов;
5 - это второй изгиб 100-130 градусов;
А-А - поперечное сечение пористого сердечника.
На фиг.2 приведена фотография устройства. На фиг.3 фотография момента операции с криоаппликатором. Криохирургический эпикардиальный аппликатор (фиг.1) содержит выполненный из пористого никелида титана цилиндрический сердечник 1, аксиально закрепленный на проволочном держателе 2, выполненном из никелида титана. Отличие заявляемого криоаппликатора состоит в том, что сердечник выполнен с продольным выступом в виде гребня 3 и вместе с ним плавно изогнут по длине на угол 20-30 градусов в плоскости, ортогональной радиальной ориентации гребня относительно радиуса окружности, частью которого является изогнутая длина сердечника. Держатель 2 в области, примыкающей к сердечнику, дважды изогнут от оси радиуса окружности, частью которой является изогнутая длина сердечника, при этом первый изгиб 4 выполнен на угол 100-130 градусов от приведенной оси радиуса окружности в направлении, продолжающем изгиб сердечника, а второй изгиб 5 выполнен так, что продолжение прямолинейной дистальной части держателя проецируется на середину сердечника. На иллюстрации показаны варианты выполнения второго изгиба держателя, характеризуемые различным наклоном сердечника. Благодаря сверхэластичности материала держателя изгиб производится достаточно произвольно и без усилий.
Устройство применяют следующим образом (фиг.1). Заранее подвергнутое асептической обработке устройство используют во время основного этапа операции на кардиоплегированном сердце. За держатель 2 цилиндрический сердечник 1 погружают в хладагент (жидкий азот). Пористость материала обеспечивает наполнение его в течение 3-5 с, критерием наполнения является прекращение выделения пузырьков над поверхностью сердечника. После этого, манипулируя держателем 2, проводят криоабляцию целевых участков миокарда (процедура «лабиринт») со стороны эпикарда. Криовоздействие проводят гребнем сердечника 3, изгиб 4 которого обеспечивает контакт с поверхностью сердца на целенаправленно выбираемых фрагментах траектории «лабиринта». В то же время для уточнения траектории можно применять точечное воздействие торцом сердечника. При всех манипуляциях избегают случайных касаний тканей в связи с возможностью их примораживания, сопровождаемого механическим повреждением. Продолжительность криовоздействия определяется скоростью испарения хладагента из пор сердечника 1 и составляет 10-15 с. Зону промораживания контролируют визуально.
Для подтверждения работоспособности устройства и достижимости с его помощью технического результата проведено исследование заявляемого криоаппликатора, в 2 этапа: 1) экспериментальный, 2) клинический.
На первом этапе была изучена возможность выполнения абляции миокарда. Проведена серия экспериментов на 12 лабораторных крысах линии «Вистар», при помощи заявляемого аппликатора наносилось криовоздействие на верхушку левого желудочка в течение 15 секунд. Были выделены группы по срокам выведения из эксперимента: через 15 мин, через 10 дней, через 20 дней и через 30 дней, по 3 экспериментальных животных в каждой группе. Выполнено морфологическое исследование миокарда, подвергнутого воздействию. Толщина миокарда до воздействия составила 4,4±0,43 мм. После воздействия толщина миокарда в зоне воздействия составила 3,9±0,30 мм. Зона повреждения через 15 мин в среднем составила 2,8 мм, через 10 дней толщина грануляционной ткани составила 3 мм, через 10 дней - 3,1 мм. Через 30 дней отмечено появление рубцовой ткани толщиной до 3,5 мм, 0,4 мм неповрежденной ткани. Таким образом, установлено, что область криодеструкции проникает практически на всю толщину миокарда.
На втором этапе выполнена серия операций у больных пароксизмальной и постоянной формой фибрилляции предсердий. Количество больных составило 7 человек. Отмечено восстановление синусового ритма в послеоперационном периоде.
Клинический пример. Пациент С., 55 лет, находился на обследовании и лечении в кардиохирургическом отделении НИИ кардиологии СО РАМН с 10.01.2012 по 02.02.12 с диагнозом: Основной диагноз: ИБС, стенокардия, стенозирующий атеросклероз коронарных артерий. Пароксизмальная форма фибрилляции предсердий.
В соответствии с наличием у пациента основного заболевания 12.01.2012 было выполнено оперативное лечение: бимаммарокоронарное шунтирование: a. mammarla sinistrae секвенциальное шунтирование ветви тупого края, медианной артерии; a. mammaria dextrae шунтирование передней нисходящей артерии. Аортокоронарное аутовенозное шунтирование правой коронарной артерии. Эпикардиальная криоабляция предлагаемым устройством при помощи жидкого азота устьев легочных вен и ушка левого предсердия в условиях искусственного кровообращения и кардиоплегии раствором «Кустодиол» (фиг.3). Криовоздействие проводили гребнем сердечника, изгиб которого обеспечивал контакт с поверхностью сердца на целенаправленно выбираемых фрагментах траектории «лабиринта». При всех манипуляциях избегали случайных касаний тканей в связи с возможностью их примораживания, сопровождаемого механическим повреждением. Продолжительность криовоздействия составляла 15 с. Зону промораживания контролировали визуально. Отмечена относительная простота выполнения манипуляций. Непосредственно по окончании основного этапа операции и восстановлении сердечной деятельности был получен синусовый ритм, который сохранялся как в раннем, так и в позднем послеоперационном периоде. Послеоперационный период протекал без осложнений. Заживление послеоперационной раны первичным натяжением. Пациент выписан на 21-е сутки после операции с синусовым ритмом.
Заявленная конструкция криохирургического эпикардиального аппликатора, помимо лечения ФП, может быть рекомендована для применения на других органах с аналогичными анатомическими особенностями.
Список литературы
1. Go A.S., Hylek Е.М., Phillips K.A. et al. Prevalence of diagnosed atrial fibrillation in adults: national implications for rhythm management and stroke prevention: the Anticoagulation and Risk Factors in Atrial Fibrillation (ATRIA) Study // JAMA. - 2001. - Vol.285. - P. 2370-2375.
2. Feinberg W.M., Cornell E.S., Nightingale S.D., et al., for the Stroke Prevention in Atrial Fibrillation Investigators. Relationship between prothrombin activation fragment F1.2 and international normalized ratio in patients with atrial fibrillation. Stroke 1997; 28: 1101-6.
3. Freiberg J., Buch P., Scharling H. et al. Rising rates of hospital admissions for atrial fibrillation // Epidemiology. - 2003. - Vol.14. - P. 666-672.
4. Wolf P.A., Abbott R.D., Kannel W.B. Atrial fibrillation as an independent risk factor for stroke: the Framingham Study // Stroke. - 1991. - Vol.22. - P. 983-988.
5. Shinbane J.S., Wood M.A., Jensen D.N. et al. Tachycardia-induced cardiomyopathy: a review of animal models and clinical studies // J. Am. Coll. Cardiol. - 1997. - Vol.29. - P. 709-715.
6. Hamer M.E., Blumenthal J.A., Mc Carthy E.A. et al. Quality-of-life assesment in patients with paroxysmal atrial fibrillation or paroxysmal supraventricular tachycardia // Am. J. Cardiol. - 1994. - Vol.74. - P. 826-829.
7. Fuster V., Rydun L.E., Caimom D.S., et al. ACC/AHA/ESC 2006 guidelines for the management of patients with atrial fibrillation: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines and the European Society of Cardiology Committee for Practice Guidelines. J.Am. Coil. Cardiol. 2006; 48:el49-246.
8. Бокерия Л.А., Ревишвили А.Ш., Ольшанский M.C. Хирургическое лечение фибрилляции предсердий: опыт и перспективы развития. Грудная и сердечно-сосудистая хирургия. 1998; 1:7-14.
9. Nakajima Н., Kobayashi J., Bando С. et al. The effect of cryo-Maze procedure on early and intermediate term outcome in mitral valve disease: case matched study. Circulation 2002:106(12 Suppl I):I46-50.
10. Патент РФ №1616628 «Криогенный аппликатор».
11. Медицинские материалы и имплантаты с памятью формы / Гюнтер В.Э., Дамбаев Г.Ц. и др. Изд-во Томского университета, Томск. 1998, с.405.
12. Медицинские материалы и имплантаты с памятью формы: в 14 томах / под ред. В.Э.Гюнтера. т.9. Пористо-проницаемые криоаппликаторы из никелида титана в медицине. - Томск. Изд-во МИЦ. 2010. - С.100.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ КРИОДЕСТРУКЦИИ ОПУХОЛЕЙ НАДПОЧЕЧНИКОВ | 2011 |
|
RU2477625C1 |
| СПОСОБ ДОСТИЖЕНИЯ ТРАНСМУРАЛЬНОСТИ ПОВРЕЖДЕНИЯ МИОКАРДА ПРЕДСЕРДИЙ ПРИ ЛЕЧЕНИИ НАДЖЕЛУДОЧКОВЫХ АРИТМИЙ И УСТРОЙСТВО ДЛЯ ЕГО ОСУЩЕСТВЛЕНИЯ | 2008 |
|
RU2394522C2 |
| СПОСОБ БИАТРЕАЛЬНОЙ КРИОАБЛАЦИИ С ХИРУРГИЧЕСКОЙ ОККЛЮЗИЕЙ УШКА ЛЕВОГО ПРЕДСЕРДИЯ ПОЛНОСТЬЮ ТОРАКОСКОПИЧЕСКИМ МЕТОДОМ ПРИ ФИБРИЛЛЯЦИИ ПРЕДСЕРДИЙ | 2024 |
|
RU2826346C1 |
| УСТРОЙСТВО ДЛЯ ХИРУРГИЧЕСКОГО ЛЕЧЕНИЯ СТЕНОЗА ТРАХЕИ | 2001 |
|
RU2221515C2 |
| Способ моделирования устойчивой фибрилляции предсердий у животных (варианты) | 2021 |
|
RU2760087C1 |
| СПОСОБ ХИРУРГИЧЕСКОГО ЛЕЧЕНИЯ ФИБРИЛЛЯЦИИ ПРЕДСЕРДИЙ | 2015 |
|
RU2613445C1 |
| СПОСОБ РЕЗЕКЦИИ УШКА ЛЕВОГО ПРЕДСЕРДИЯ ПРИ КОРОНАРНОМ ШУНТИРОВАНИИ У БОЛЬНЫХ С ФИБРИЛЛЯЦИЕЙ ПРЕДСЕРДИЙ | 2019 |
|
RU2722882C1 |
| Способ фиксации зонда для хирургической абляции | 2020 |
|
RU2738134C1 |
| СПОСОБ ОБРАБОТКИ ПУНКЦИОННО-ДРЕНАЖНОГО КАНАЛА У БОЛЬНЫХ С ПАРАЗИТАРНЫМ ПОРАЖЕНИЕМ ПЕЧЕНИ ПОСЛЕ ДРЕНИРОВАНИЯ ПОЛОСТИ РАСПАДА | 2023 |
|
RU2811279C1 |
| Способ персонализации подхода к интервенционному лечению фибрилляции предсердий | 2022 |
|
RU2791135C1 |

Изобретение относится к медицине, а именно к кардиохирургии, и может применяться для криоабляции миокарда при лечении фибрилляции предсердий. Криохирургический эпикардиальный аппликатор содержит цилиндрический сердечник 1 из пористого никилида титана, аксиально закрепленный на проволочном держателе 2, выполненном из никилида титана. Сердечник 1 снабжен продольным выступом в виде гребня 3 и вместе с ним плавно изогнут по длине на угол 20-30 градусов в плоскости, ортогональной радиальной ориентации гребня, с возможностью обеспечить контакт с тканями эпикарда на протяженном участке криовоздействия. Технический результат состоит в обеспечении адаптации устройства для выполнения криодеструкции участков миокарда и сокращении времени процедуры, включаемого в суммарное время нахождения пациента под общим наркозом. 1 з.п. ф-лы, 3 ил.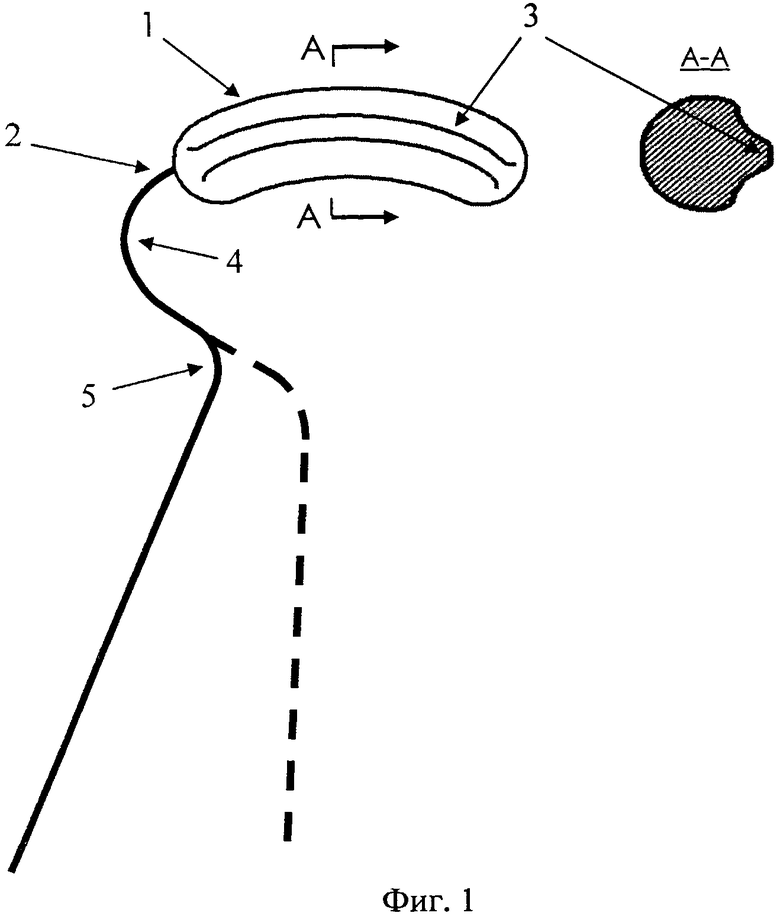
1. Криохирургический эпикардиальный аппликатор, содержащий цилиндрический сердечник из пористого никилида титана, аксиально закрепленный на проволочном держателе, выполненном из никилида титана, отличающийся тем, что сердечник снабжен продольным выступом в виде гребня и вместе с ним плавно изогнут по длине на угол 20-30 градусов в плоскости, ортогональной радиальной ориентации гребня, с возможностью обеспечить контакт с тканями эпикарда на протяженном участке криовоздействия.
2. Кардиохирургический эпикардиальный аппликатор по п.1, отличающийся тем, что держатель дважды изогнут в плоскости изгиба сердечника с возможностью обеспечить кривизну протяженного участка креодеструкции в соответствии с анатомической конфигурацией в области проведения процедуры, при этом первый изгиб выполнен на угол 100-130 градусов в направлении, продолжающем изгиб сердечника, а второй изгиб выполнен в дистальной части держателя в направлении середины сердечника.
| УСТРОЙСТВО ДЛЯ ХИРУРГИЧЕСКОГО ЛЕЧЕНИЯ СТЕНОЗА ТРАХЕИ | 2001 |
|
RU2221515C2 |
| Устройство для криохирургии | 1984 |
|
SU1344335A1 |
| Криоаппликатор с биоэлектрическим управлением | 1985 |
|
SU1426561A1 |
| СПОСОБ ПОЛУЧЕНИЯ ОБРАЩЕННОГО ЧЕРНО-БЕЛОГО ИЗОБРАЖЕНИЯ | 1990 |
|
SU1790304A1 |
| US 6652515 B1 , 25.11.2003 | |||
Авторы
Даты
2014-05-10—Публикация
2012-07-13—Подача